UNIVERSITE TOULOUSE III-PAUL SABATIER
École doctorale Biologie-Santé-Biotechnologie Année 2007
THESE
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE TOULOUSE III
Discipline : Sciences de la vie et de la santéFilière : Physiologie Cellulaire et Intégrée - Physiopathologie Spécialité : Cancérologie
Présentée et soutenue par
Marine GOFFINET
CONCEPTION et OBTENTION d’un
ANTICORPS SPECIFIQUE des FORMES
ACTIVEES des RHO GTPases
Directeurs de thèse : Dr Jean-Charles FAYE et Pr Gilles FAVRE
Dr Philippe FORT Rapporteur
Dr Grégoire PREVOST Rapporteur
Dr Evelyne BLOCH-GALLEGO Examinatrice
Pr Bertrand PERRET Examinateur
Dr Jean-Charles FAYE Directeur
Pr Gilles FAVRE Directeur
INSERM U563 -CPTP
Dept. Oncogenèse, Signalisation, Innovation Thérapeutique Équipe : Signalisation, GTPase Rho et cancers
Institut Claudius Regaud, 20-24, rue du Pont Saint Pierre 31052 Toulouse cedex
Je tiens à adresser mes remerciements aux membres du jury.
À Monsieur le Docteur Philippe Fort et Monsieur le Docteur Grégoire Prevost je vous exprime toute ma gratitude pour avoir accepté d’être rapporteurs de ce travail et pour avoir contribué à sa réalisation.
À Madame le Docteur Evelyne Bloch-Gallego, je vous remercie sincèrement de participer à l’examen de ma soutenance.
À Monsieur le Professeur Bertrand Perret, vous me connaissez depuis que je suis petite et avez suivi mes périples. Je suis très fière que vous ayez accepté de siéger à ce jury de soutenance.
À Monsieur le Docteur Jean-Charles Faye et Monsieur le Professeur Gilles Favre, je vous remercie d’avoir dirigé ma thèse, de m’avoir accueillie dans votre équipe et d’avoir accepté d’être membres du jury.
Je tiens aussi à remercier tous ceux qui ont participé à la réalisation de cette thèse, tous ceux qui m’ont soutenue et encouragée…
Ils sauront se reconnaître.
« Connaître, ce n’est pas démontrer ni expliquer.
C’EST ACCEDER à LA VISION.
Mais pour voir, il faut d’abord participer »
Antoine de Saint Exupery
TABLE des MATIERES
OBJECTIF 1
INTRODUCTION 5
GENERALITES SUR LES PROTEINES RHO 7
I.LA DESCRIPTION DE LA FAMILLE RHO 7
II.LA STRUCTURE DES PROTEINES RHO 7
III.LA LOCALISATION DES PROTEINES RHO 12
a) La GTPase RhoA 12
b) La GTPase RhoB 12
c) La GTPase RhoC 14
d) Les autres GTPases 14
IV.LES MODIFICATIONS POST-TRADUCTIONNELLES ET LES DOMAINES REGULATEURS DES
PROTEINES RHO 14
A.LA PRENYLATION 15
a) Définition 15
b) La prénylation et la localisation des Rho 15
c) L’importance de la prénylation 17
B.LA PALMITOYLATION 18
C.LES AUTRES DOMAINES 19
D.LA PHOSPHORYLATION 19
V.LE CYCLE D’ACTIVATION ET SA REGULATION 21
A.LE CYCLE D’ACTIVATION 21
B.LES PROTEINES REGULATRICES DU CYCLE 23
a) Les RhoGEFs 23
b) Les RhoGAPs 26
c) Les RhoGDIs 27
C.LES EFFECTEURS 29
D.LES REGULATIONS DU CYCLE D’ACTIVATION 31
a) Activation et adressage à la membrane 33
b) Désactivation et dissociation de la membrane 33
VI.LES FONCTIONS GENERALES DES PROTEINES RHO 34
A.LES RHO GTPASES, CYTOSQUELETTES ET FONCTIONS ASSOCIEES 34
a) les Rho GTPases et le cytosquelette d’actine 34
b) Les Rho GTPases et les microtubules 37
c) Les Rho GTPases et le trafic cellulaire 37
B.LES RHO GTPASES ET LA TRANSCRIPTION, LE CYCLE ET LA SURVIE CELLULAIRE ET LA REPONSE
AUX STRESS 38
IMPLICATION DES PROTEINES RHO 41
I.LES PROTEINES RHO ET L’ONCOGENESE 41
II.MUTATIONS DES PROTEINES RHO ET DES PROTEINES REGULATRICES 43
III.MODIFICATION DE L’EXPRESSION DES PROTEINES RHO ET DES PROTEINES REGULATRICES 45
A.EXPRESSION DES PROTEINES RHO DANS LES TISSUS TUMORAUX 45
a) Tumeurs du pancréas 45
b) Tumeurs du sein 45
d) Tumeurs du poumon 46
e) Tumeurs des testicules et des ovaires 47
B.EXPRESSION DES PROTEINES REGULATRICES DES PROTEINES RHO DANS LES TISSUS TUMORAUX 47 DESCRIPTIF DES OUTILS EXISTANTS POUR L’ETUDE DES PROTEINES RHO 49
I.MOYENS D’ETUDE DES FONCTIONS DES PROTEINES RHO DANS LES CELLULES 49 A.SUPPRESSION DE LA PRENYLATION DES PROTEINES RHO 49
B.MODIFICATION DE L’EXPRESSION DES PROTEINES RHO ET DE SES REGULATEURS 50
a) Transfection des différentes formes des Rho 50
Mutants avec différentes boîtes -CAAX 50
Dominants positifs 51
Mutants hyper-cyclants 51
Dominants négatifs 53
b) Transfection des régulateurs des Rho 53
c) Extinction de la protéine Rho ou de ses régulateurs par l’utilisation d’ARNs interférents 54 C.MODIFICATION DES VOIES DE SIGNALISATION IMPLIQUANT LES RHO DANS LES CELLULES 55
a) Modulation de l’activité des Rho 55
b) Stimulation des voies de signalisation 56
c) Interaction avec les voies de signalisation 57
II.MOYENS D’ETUDE DE LA LOCALISATION DES PROTEINES RHO DANS LES CELLULES 57
A.ANTICORPS 57
B.TRANSFECTION DE PLASMIDE « ETIQUETE » 58
C.TECHNIQUES ASSOCIEES 59
D.MARQUEURS DES COMPARTIMENTS CELLULAIRES 60
III.MOYENS D’ETUDE DE L’ACTIVATION DES PROTEINES RHO DANS LES CELLULES 61
A.QUANTIFICATION DES PROTEINES RHO ACTIVEES 61
B.LOCALISATION DES PROTEINES RHO ACTIVEES 62
C.ETUDE DE LA DYNAMIQUE DES PROTEINES RHO IN VIVO 63
a) La Méthode FLIP 63
b) Les sondes « Raichu » ou analyse par la technique du FRET 64
RESULTATS ET COMMENTAIRES 69
OBTENTION DE L’OUTIL 70
I.IMPORTANCE DE LA STRUCTURE TRIDIMENSIONNELLE DE LA CIBLE 70
A.CHOIX DE LA MUTATION 70
B.MUTAGENESE 71
C.PRODUCTION ET PURIFICATION DES PROTEINES RHO 71
II.SELECTION DE L’ANTICORPS PAR LA TECHNIQUE DU « PHAGE DISPLAY » 72
A.PRINCIPE DU PHAGE DISPLAY 74
B.SELECTION SUR GST-RHOBQ63L 79
a) Tours de sélection de I à V 79
b) Vérification du processus de sélection 81
c) Recherche des clones spécifiques par criblage et tests ELISA 84
d) Profil des clones sélectionnés 84
e) Alignement des séquences 86
III.SPECIFICITE DES CLONES SELECTIONNES SUR RHOAQ63L, RHOBQ63L, RHOCQ63L 88 IV.SPECIFICITE DE « L’ANTICORPS » VIS-A-VIS DE LA RECONNAISSANCE DES PROTEINES RHO
CHARGEES EN GDP ET GTP 90
A.CHARGEMENT DE LA PROTEINE GST-RHOA 91
a) Chargement de RhoA, B et C à partir de lysats frais 92
b) Chargement de Rac1 et Cdc42 à partir de lysat frais 95
c) Mesures par radioactivité de la liaison des nucléides GDP/GTP 95
PRODUCTION DE L’OUTIL 98
I.PRODUCTION DU SCFV C1 SOUS FORME SOLUBLE 98
A.OBTENTION DES SCFVS A PARTIR DU PERIPLASME 98
B.OBTENTION DES SCFVS APRES RENATURATION DES PROTEINES A PARTIR DE LA LYSE DES CORPS D’INCLUSION OU APRES RECUPERATION DE L’EXTRAIT TOTAL 99
II.DU SCFV C1 AU SCFV C1N1N2 : AMELIORATION FONCTIONNELLE 101 III.AMELIORATION DE L’OBTENTION DU SCFV C1N1N2 103
A.CHOIX DE LA SOUCHE DE BACTERIES 103
B.LES CONDITIONS DE PRODUCTION 104
a) Température 104
b) Cinétique 106
C.LES CONDITIONS DE PURIFICATION 106
a) Principe de la purification sur billes Ni-NTA 106
b) Adaptation du protocole à la purification du scFv C1N1N2 106
c) Résultats de l’enrichissement: 107
D.RESULTATS DES CONDITIONS DE CONSERVATION 110
IV.MESURE D’AFFINITE DU SCFV C1N1N2 110
UTILISATION DE L’OUTIL 115
I.« HIS PULL DOWN » AVEC LE SCFV C1N1N2 115
A.RECHERCHE DU TAMPON DE LYSE ADAPTE AU « HIS PULL DOWN » 115 B.« HIS PULL DOWN » D’EXTRAITS CELLULAIRES SUREXPRIMANT LES MUTANTS DES PROTEINES RHO
117 C.« HIS PULL DOWN » D’EXTRAITS PURIFIES CHARGES 118 D.« HIS PULL DOWN » D’EXTRAITS CELLULAIRES CHARGES 118 V.ÉTUDES DE MARQUAGE AVEC LE SCFV C1N1N2 DE CELLULES FIXEES 121
A.DETERMINATION DES CONDITIONS DE STIMULATION DES RHO 121
B.DETERMINATION DES CONDITIONS DE MARQUAGE 122
C.SPECIFICITE DU MARQUAGE ET VALIDATION PAR EPUISEMENT SUR DES BILLES CHARGEES 122
DISCUSSION 126
MATERIELS, METHODES ET OPTIMISATION DES TECHNIQUES 137
I.BANQUE, PLASMIDES, BACTERIES, ANTICORPS, NUCLEOTIDES, FACTEURS DE CROISSANCE 138
II.EXPERIENCES DE BIOLOGIE MOLECULAIRE 139
A.OBTENTION DES MUTANTS Q63L DES PROTEINES RHOA, RHOB ET RHOC 139 B.CONSTRUCTION DES PHAGEMIDES PHEN C1/A8 ET PHENC1N1N2 139 III.EXPERIENCES DE PRODUCTION ET PURIFICATION DES PROTEINES RECOMBINANTES 140
A.LES PROTEINES RHO GTPASES ET LES MUTANTS CORRESPONDANTS 140
a) Optimisation de la production 141
Test de différentes conditions de production 141 Cinétique de production du mutant Q63L 141
b) Optimisation de la purification 142
Extraction 142
B.LES SCFVS SOUS FORME SOLUBLE 143
a) La production et l’extraction 143
Protocole de production des scFvs et d’obtention du periplasme 143 Renaturation des scFvs à partir des corps d’inclusion 144
Obtention du lysat complet 144
b) La purification des scFvs 144
Sur billes Ni-NTA 144
Autres supports de purification testés 145
c) Le conditionnement 145
IV.SELECTION DE L’ANTICORPS PAR LA TECHNIQUE DU « PHAGE DISPLAY » 146 A.AMPLIFICATION DE LA BANQUE DE « PHAGE DISPLAY » 146
B.CONCENTRATION DE PHAGES 146
C.SELECTION ET ELUTION 147
D.AMPLIFICATION 147
E.IDENTIFICATION DE PHAGES MONOCLONAUX 147
V.IDENTIFICATION DES SCFV 148
A.RECHERCHE DES PROFILS SCFV 148
B.SEQUENÇAGE 148
C.ALIGNEMENTS 148
VI.TECHNIQUES POUR ETUDIER LES INTERACTIONS PROTEINES RHO ACTIVEES/SCFVS 148
A.L’ELISA 149
a) À partir de suspension de phages polyclonaux 149
b) À partir de suspension de phages monoclonaux 149
B.ANALYSES DE SPECIFICITE DE LIAISON PAR RESONANCE PLASMONIQUE DE SURFACE (SPR) 150 VII.LES CHARGEMENTS EN GDP ET GTPγS DES PROTEINES RHO 150 A.OPTIMISATION DU CHARGEMENT DES PROTEINES RHO PURIFIEES SUR BILLES DE GLUTATHION 150
B.OPTIMISATION DU CHARGEMENT DES PROTEINES RHO PURIFIEES DANS DES PUITS « GLUTATHION »
DE PLAQUE ELISA 151
C.ÉTUDES DE LIAISONS DES RADIONUCLEOTIDES GDP ET GTPGS 152
VIII.ÉTUDES DE L’ACTIVATION DES RHO GRACE A L’UTILISATION DU SCFV C1N1N2 152
A.CAPTATION IN VITRO DES PROTEINES RHO ACTIVEES 152
a) Tampons testés pour les expérimentations de précipitation 152
b) Chargement des échantillons pour « his pull down » 153
c) Réaction de « his pull down » 153
B.MARQUAGE PAR LE SCFV DES CELLULES ACTIVEES 154
BIBLIOGRAPHIE 155
LISTE des FIGURES
Figure 1 : Famille des protéines Rho humaines alignées avec les GTPases Ras 6
Figure 2 : Structure globale des protéines Rho GTPases 8
Figure 3: Structure de RhoAV14 lié au GTPγS 10
Figure 4: Alignement des séquences des 20 GTPases de la famille Rho et structures secondaires
de RhoA 11
Figure 5 : Modèle de la distribution des protéines RhoA, B et C et de leurs effecteurs dans les
cellules en migration 13
Figure 6: Modifications post-traductionnelles des protéines Rho GTPases à leur extrémité
COOH-terminal 16
Figure 7: Exemple de la régulation de la localisation membranaire des Rho 20
Figure 8 : Cycle d’activation des Rho GTPases 22
Figure 9 : Régulation du cycle des GTPases par l’action concertée des GEFs et des GAPs 24 Figure 10 : Exemple d’effecteurs des protéines Rho, Rac et Cdc42 30 Figure 11 : Translocation et intervention des GEFs, GAPs et GDI dans la régulation du cycle des
GTPases 32
Figure 12: Résumé des activités cellulaires qui impliquent les protéines Rho, Rac et Cdc42 35 Figure 13: Mutations associées au cancer des protéines Rho et de ses régulateurs 44 Figure 14: Acides aminés impliqués dans des régulations de l’activité des protéines RhoA, B et C
52 Figure 15: Représentation schématique d’une sonde intramoléculaire “Raichu” 65 Figure 16 : Vue schématique d’une particule de phage filamenteux M13 73 Figure 17 : Représentation schématique de la sélection d’anticorps à partir d’une banque de
phages 75
Figure 18: Représentation schématique du vecteur pHEN2 (Griffin 1. library) 77 Figure 19 : Vue schématique des particules de IgG, Fab et scFv 78
Figure 20 : Protocole suivi pour la sélection de phages spécifiques de la protéine RhoBQ63L 80 Figure 21 : Représentation schématique d’un ELISA sur puits de plaques ELISA 82 Figure 22: Les suspensions de phages obtenues à partir des tours de sélection IV et V se lient sur
la protéine RhoBQ63L 83
Figure 23: Les phages C1, A8, F7, F12, D11 et G5 se lient préférentiellement sur la protéine
RhoBQ63L 85
Figure 24: Analyses de séquence des scFvs C1, D11 et A8 spécifiques de RhoBQ63L 87 Figure 25: Les phages C1 et A8 sont spécifiques des formes activés (Q63L) des protéines RhoA,
B et C 89
Figure 26: Le phage C1 est spécifique de la protéine RhoA liée au GTP 93 Figure 27: Le phage C1 est spécifique des formes liées au GTP de RhoA, B et C 94 Figure 28: Le phage C1 ne se fixe pas sur les protéines Rac1 et Cdc42 associées au GTPgS 96 Figure 29: Du scFv C1 au scFv C1N1N2 : production et spécificité de liaison du scFv C1N1N2
sur RhoAQ63L 100
Figure 30: Représentation schématique de la construction du scFv C1N1N2 102 Figure 31: Les conditions de production du scFv C1N1N2 spécifique de RhoAQ63L : à 30°C et
pendant au moins 15h 105
Figure 32: Le scFv C1N1N2 est purifié sur des billes Ni-NTA et les élutions sont spécifiques de la
forme Q63L de RhoA 108
Figure 33: Injection des protéines RhoA-GDP (FC1), RhoA-GTPγS (FC2) et du C1N1N2 111 Figure 34: Le C1N1N2 se lie spécifiquement sur RhoA-GTPγS (FC2) vis-à-vis de RhoA-GDP
(FC1) 113
Figure 35: Test des tampons ne gênant pas la liaison du phage C1 sur la protéine RhoAQ63L 116 Figure 36: Le scFv C1N1N2 capte spécifiquement les protéines RhoA et RhoB chargées en
GTPγS 119
Figure 37: Le scFv C1N1N2 donne un signal spécifique sur les cellules activées et ne donne plus
de signal après épuisement sur RhoA-GTP 123
ABREVIATIONS
Amp : ampicilline ARNi : ARN interférent
CDR : Complementary Determining Regions CNF : facteur nécrosant cytotoxique
DO : Densité optique
EDTA : acide éthylène diamine tétraacétique EGF : facteur de croissance épidermoïde Fab : Fragment antigen-binding
FITC : Fluoresceine Iso Thio Cyanate
FRET : transfert d’énergie de fluorescence par résonance FTase : Farnésyl Transférase
FTI : inhibiteur de la farnésyl-transférase
GAP : GTP-ase Activating Protein = protéine activatrice des GTPases
GDI : Guanine nucleotide Dissociation Inhibitors=protéine inhibitrice de la dissociation du GDP
GDP : Guanosine DiPhosphate
GEF : Guanine nucleotide Exchange Factor = protéine d’échange du GDP en GTP GFP : Green Fluorescent Protein
GGTase : GéranylGéranyl Transférase Glu : glucose
GTP : Guanosine TriPhosphate
HRP : horse radish peroxidase ou peroxydase de raifort Ig : immunoglobuline
IPTG : isopropyl-β-D-thiogalactopyranoside kDa : kilo Dalton
LPA : acide lysophosphatidique
PAGE : polyacrylamide-gel pour électrophorèse PBS : phosphate-buffered saline
PCR : réaction de polymérase en chaîne
PDGF : facteur de croissance dérivé des plaquettes Raichu : Ras and interacting protein chimeric unit RBD : domaine de liaison aux Rho
SDS : sodium dodecyl sulfate
scFv : single-chain Fragment variable SPR : résonance plasmonique de surface SVF : sérum de veau fœtal
TMB : 3,3’,5,5’ tetramethylbenzidine
VH : domaine variable de la chaîne lourde de l’anticorps
VL : domaine variable de la chaîne légère de l’anticorps
WT : Wild-type = sauvage
Les protéines Rho (Ras-homologues) GTPases jouent un rôle central dans de nombreuses fonctions cellulaires. Certaines de ces fonctions sont impliquées dans des mécanismes de transformation maligne ou d’apparition de métastases (Vega and Ridley 2007). Ces Rho GTPases sont localisées aux membranes et peuvent être activées suite à la stimulation des récepteurs situés à la surface des cellules. Dans leur état activé, c’est-à-dire liées au GTP, elles interagissent avec des effecteurs et ainsi transmettent le signal. Les membres de la famille Rho GTPases sont des régulateurs clés de la ré-organisation de l’actine, de la motilité cellulaire, des mécanismes d’adhésion cellules-cellules et cellules-matrice extracellulaire (MEC) aussi bien que de la progression dans le cycle cellulaire, de l’expression génique et de l’apoptose. Chacune de ces fonctions est importante dans le développement et la progression du cancer. Les protéines Rho modifient aussi la sensibilité aux agents endommageant l’ADN, dont les médicaments antinéoplasiques et les radiations ionisantes. Ainsi la modulation des mécanismes induits par les Rho peut influencer l’efficacité des thérapeutiques et/ou les effets secondaires liés aux traitements anti-cancéreux classiques. Grâce à leurs fonctions pléïotropiques, les protéines Rho apparaissent comme des cibles prometteuses pour la lutte anti-cancéreuse.
Des expérimentations in vivo et in vitro utilisant des anticorps neutralisants, des protéines dominantes négatives, des toxines bactériennes, des oligonucléotides antisens ou des petits ARNs interférents ont montré que l’inhibition des protéines Rho et Ras a des effets négatifs sur la prolifération et/ou la survie cellulaire (Walker and Olson 2005). A partir de ces observations, les stratégies de thérapeutiques anti-cancéreuses s’orientent principalement autour de 2 axes : découverte de petites molécules inhibitrices des modifications post-traductionnelles des protéines Rho ou Ras ou de molécules inhibitrices des effecteurs stimulés par ces voies. Ainsi l’utilisation de FTI (inhibiteur de la prénylation) montre des effets anti-cancéreux encourageants mais, seulement dans un nombre limité de types de tumeurs (Walker and Olson 2005). Une autre stratégie est de cibler la biosynthèse en aval de la production des lipides isoprénoïdes. En effet, des essais cliniques étudient les effets anti-cancéreux des statines (inhibiteurs de l’HMG-CoA réductase) et des biphosphonates (inhibiteurs de la FarnésylPyroPhosphate synthase et/ou de la GéranylGéranylPyroPhosphate
synthase). Les biphosphonates présentent un potentiel thérapeutique intéressant sur les tumeurs osseuses en particulier sur la croissance tumorale, la résorption osseuse et les douleurs associées au cancer (Walker and Olson 2005). Je me suis consacrée dans un premier temps, à l’étude des effets de 2 amino-bisphosphonates : le pamidronate (Aredia™) et le zolédronate (Zometa™) sur des cellules de prostate. J’ai alors mis en évidence leurs capacités à bloquer la géranylgéranylation des protéines Rho et leurs effets anti-prolifératifs sur les cellules de prostate (Goffinet, Thoulouzan et al. 2006). L’inhibition de la prénylation des protéines Rho constitue donc une des cibles majeures pour une action anti-cancéreuse. Cette inhibition de la prénylation par les biphosphonates conduit à une activation des protéines Rac, Cdc42 et Rho dans des macrophages et des ostéoclastes (Dunford, Rogers et al. 2006). Les effets anti-cancéreux des biphosphonates pourraient être le résultat d’une activation inappropriée de certains effecteurs et/ou un effet de dominants négatifs des protéines non prénylées conduisant à la séquestration des effecteurs. Les études menées sur les biphosphonates ayant conduit à la publication d’un article dans BMC cancer (Goffinet, Thoulouzan et al. 2006) n’ont cependant pas été approfondies dans le laboratoire. C’est pourquoi, je ne décrirai dans cette thèse que les études menées à la suite de ce travail.
À la suite de ces travaux sur l’action des biphosphonates sur les protéines Rho conduisant à des effets sur leur activation, nous avons décidé de chercher un anticorps permettant d’étudier et localiser l’activation des Rho dans les cellules. En effet, les expressions des protéines Rho et de ses protéines régulatrices sont modifiées dans les tissus cancéreux par rapport aux tissus sains ; par exemple, les RhoGEFs (protéines activatrices des Rho) présentent des niveaux d’expression qui augmentent avec la gravité de la maladie. Etant donné que peu d’études n’ont pas encore lié l’état d’un tissu cancéreux à des modifications d’activité des Rho au sein de la cellule (Mira, Benard et al. 2000; Takami, Higashi et al. 2007), il nous semble important de posséder de nouveaux outils permettant de définir s’il existe un lien entre l’activité des protéines Rho et l’initiation ou le développement des cancers.
Alors que les protéines RhoB et RhoC ont été caractérisées en même temps que RhoA, ces protéines ont moins retenu l’attention à cause de leur homologie très forte avec RhoA et parce que des études de sur-expression
indiquent que comme RhoA, elles induisent des fibres de stress dans les cellules (Wheeler and Ridley 2004). Cependant bien qu’elles présentent une très forte homologie, ces trois protéines n’auraient pas les mêmes fonctions. Les protéines RhoA et RhoC auraient un rôle oncogénique alors que RhoB serait plutôt protecteur contre l’initiation du cancer. Les rôles de cette dernière intéressent depuis de nombreuses années l’équipe INSERM U563 du Pr Gilles Favre. Bien qu’il existe dans le commerce des anticorps spécifiques des protéines Rho, ces anticorps ne distinguent pas la forme active de la forme inactive de ces protéines. Dans le but de mieux appréhender l’activation de la protéine RhoB dans la cancérogènese, nous avons sélectionné un anticorps, par phage display, contre la forme active de celle-ci. L’anticorps que nous avons obtenu est spécifique de la forme active des trois protéines Rho (A, B et C). Ce résultat était attendu sachant que ces trois protéines Rho partagent 85% d’identité en acides aminés entre elles. L’utilisation des anticorps spécifiques de chacune des protéines Rho, en complément de cet anticorps dirigé contre leurs formes actives, nous permettra de cibler l’activation d’une des trois protéines Rho. Ainsi, grâce à ce nouvel outil nous pourrons affiner la compréhension de l’activité des protéines Rho dans le développement des cancers et dans la réponse des cellules aux traitements anti-cancéreux.
La famille des protéines Rho, leurs implications dans les cancers et les outils utilisés pour élucider leurs fonctions, leur régulation et leurs localisations cellulaires seront décrits dans la partie « introduction ». La sélection de l’anticorps par phage display, ses propriétés et les conditions suivies pour permettre sa production et sa purification seront présentées dans la partie « résultats et commentaires ». Puis seront exposées ses capacités spécifiques à capter les protéines Rho activées et à se fixer sur les protéines Rho de cellules HeLa stimulées.
Figure 1 : Famille des protéines Rho humaines alignées avec les GTPases Ras
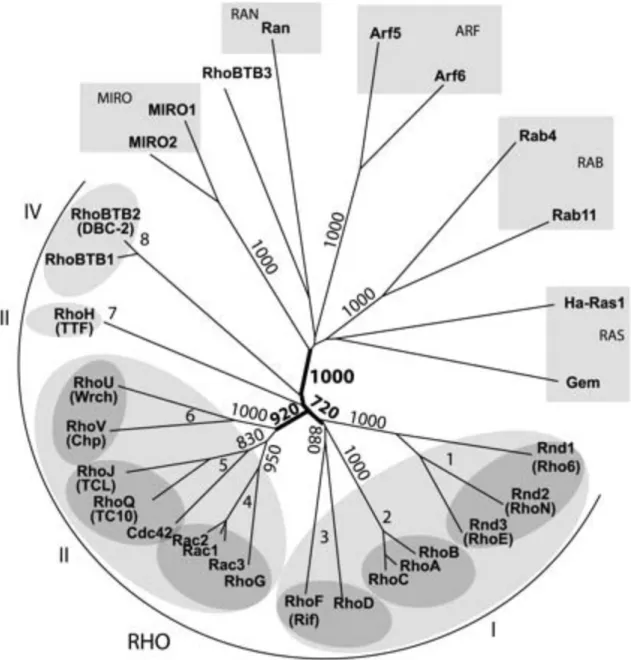
Les séquences des GTPases ont été alignées avec le « domaine Rho » (acides aminés 5-173) de Rac1. L’organisation de la famille Rho est représentée en 4 groupes numérotés de I à IV (ellipses gris clair) et 8 sous-familles (ellipses gris foncé). La topologie de l’arbre a été validée selon la méthode « bootstrap » permettant l’établissement de valeurs indiquées au niveau des nœuds. Les noms communs quand différents sont écrits entre parenthèse sous la nomenclature HUGO. Contrairement à la lecture des arbres phylogénètiques des Rho précèdemment proposée, l’interprétation de cet arbre démontre que les protéines MIRO appartiennent à une famille Ras distincte et que RhoBTB3 est une branche extérieure à la famille Rho.
Généralités sur les protéines Rho
I. La description de la famille Rho
Les protéines Rho appartiennent à la superfamille Ras des petites protéines de liaison du GTP, protéines G monomériques de faible masse moléculaire de 20 à 40 KDa. Ces protéines ont une expression ubiquitaire et sont retrouvées dans de nombreuses espèces animales allant de la levure à l’homme. Depuis l’identification de RhoA en 1985, environ 20 protéines, membres des Rho ont été identifiées dans le génome humain. Très récemment, une puissante étude a permis d’analyser strictement la phylogénie des Rho et a défini la présence de 8 sous-familles réparties dans 4 groupes : le groupe I contient les familles Rho(A-C), Rnd(1-3) et RhoD/RhoF ; le groupe II , les familles Rac/RhoG, Cdc42/RhoJ/RhoQ et RhoU/RhoV ; le groupe III, la protéine RhoH et le groupe IV les protéines RhoBTB1 et RhoBTB2. Les protéines RhoBTB3 et Miro (Miro-1 et Miro-2) ne font pas partie de la famille des Rho (Figure 1) (Boureux, Vignal et al. 2007).
En cyclant entre une forme inactive, protéines liées au GDP, et une forme active, protéines liées au GTP, les Rho GTPases jouent le rôle de commutateur moléculaire dans la transmission des signaux intracellulaires, contrôlant ainsi de nombreux processus biologiques. Elles sont surtout connues pour leur rôle majeur dans le réarrangement du cytosquelette d’actine. Par cette activité, elles sont impliquées dans de nombreux processus cellulaires incluant la régulation de la morphologie de la cellule, de la polarité et de l’adhésion cellulaires ou encore dans le trafic membranaire. De plus, il a été montré leur participation dans d’autres fonctions cellulaires comme le contrôle de la prolifération, du cycle cellulaire et des voies de l’apoptose/survie ainsi que la régulation de l’expression génique (Jaffe and Hall 2005).
II. La structure des protéines Rho
Les protéines Rho sont des protéines de petite taille (190 à 250 acides aminés) constituées essentiellement d’un domaine GTPase et de courtes
Figure 2 : Structure globale des protéines Rho GTPases
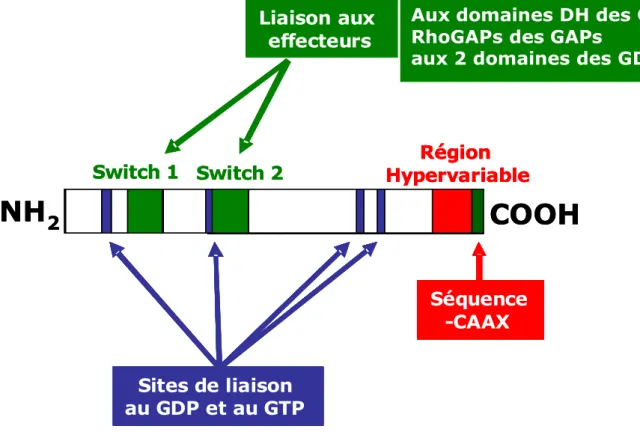
Les protéines Rho GTPases présentent des domaines communs entre elles. Les Switch 1 et
2 sont des domaines qui changent de structure tridimensionnelle en fonction de l’association
de la protéine Rho aux nucléotides GDP ou GTP (sites de liaisons) et permettent l’interaction avec les effecteurs et les protéines régulatrices GEFs, GAPs et GDIs. La région
hypervariable et la séquence –CAAX en position C-terminale représentent une zone très
variable entre les protéines Rho et sont en partie responsable de la localisation de la protéine dans les compartiments cellulaires.
COOH
Région
Hypervariable
Séquence
-CAAX
Liaison aux
effecteurs
Switch 1 Switch 2
NH
2
Sites de liaison
au GDP et au GTP
COOH
Région
Hypervariable
Séquence
-CAAX
Région
Hypervariable
Séquence
-CAAX
Liaison aux
effecteurs
Switch 1 Switch 2
NH
2
Sites de liaison
au GDP et au GTP
Sites de liaison
au GDP et au GTP
Aux domaines DH des GEFs RhoGAPs des GAPs
extensions N- et C-terminales. Elles partagent approximativement 30% d’identité en acides aminés avec la famille des protéines Ras et entre 40 et 95% d’identité entre elles (Wennerberg and Der 2004). La moitié N-terminale des Rho GTPases contient la majorité des acides aminés impliqués dans la liaison au GTP et dans son hydrolyse. Les domaines « switch 1 » et « switch 2 » subissent un changement de conformation important selon la nature du nucléotide lié à la protéine et jouent, en particulier, un rôle de liaison aux effecteurs (Wheeler and Ridley 2004) (Figure 2).
La structure tridimensionnelle des Rho GTPases s’organise en 6 feuillets β connectés entre eux principalement par des hélices α (Ihara, Muraguchi et al. 1998) (figure 3). L’insertion de 13 résidus (Asp124-Gln136), appelée « insert
loop » (A3’) localisée dans la boucle entre le 5ème feuillet β (B5) et la 4ème hélice
α (A4) compose la principale différence structurelle de la famille des protéines Rho par rapport à la famille Ras. L’alignement en acides aminés des 20 membres de la famille des protéines Rho et la localisation des structures secondaires de RhoA sont représentés sur la figure 4. Aucun effecteur interagissant spécifiquement avec l’ « insert loop » de RhoA, B ou C n’a été identifié, néanmoins certains effecteurs seraient spécifiques de cette sous-famille des Rho. D’autre part, la délétion de cet « insert loop » dans la protéine RhoA entraîne une diminution de sa stabilité et de son potentiel transformant (Wheeler and Ridley 2004).
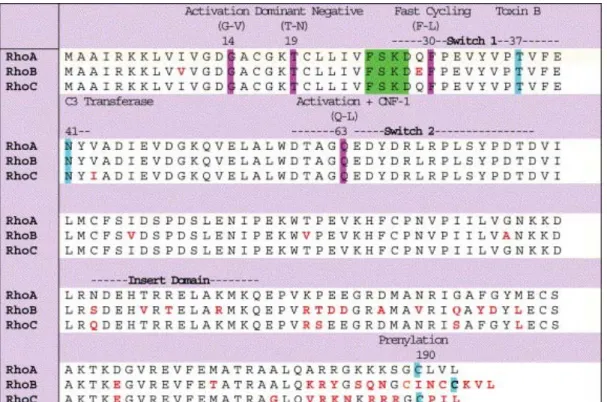
L’essentiel des différences de séquence primaire entre les protéines de la sous-famille Rho (85% d’identité en acides aminés) se trouve principalement dans la région C-terminale, appelée pour cette raison, région hypervariable. Les domaines de liaison au GTP et le switch 2 présentent, par contre, 100% d’homologie. De plus, les acides aminés essentiels pour la fonction catalytique sont conservés dans les trois protéines Rho(A, B et C) incluant Gly14, Thr19, Phe30 et Gln63. En dehors de ces domaines, quelques divergences sont observées entre RhoA, RhoB et RhoC notamment dans et autour du switch 1 suggérant des différences d’affinité pour les protéines régulatrices et les protéines cibles.
Figure 3: Structure de RhoAV14 lié au GTPγS
Représentation en ruban de RhoAV14 complexé avec le GTPγS (jaune) et Mg2+ (boule
grise) : Feuillets β (rouge), hélices α (vert), hélices 310 (bleu) et 3 molécules d’H20 (boules
roses : Wat). L’ « insert loop » est localisé au niveau de l’hélice A3’.
Figure 4: Alignement des séquences des 20 GTPases de la famille Rho et structures secondaires de RhoA
Résidus importants pour l’activité GTPasique (cyan), le domaine effecteur (rose), le domaine « insert » Rho (rouge) et les boîtes CAAX (jaune : géranylgéranyl ; bleu :farnésyl). Les séquences ont été alignées par ClustralW. Les séquences protéiques utilisées correspondent aux « accession numbers » suivants (de haut en bas) : NP_001655, NP_786886, NP_004031, NP_055393, NP_061907, NP_005431, NP_005159, NP_055285, NP_008839, NP_002863, NP_005043, NP_001656, NP_001782, NP_036381, NP_065714, NP_598378, NP_067028, NP_055651, NP_055993 et NP_004301. Les éléments de la structure secondaire de RhoA (sous forme liée au
GTP) sont indiqués au-dessus de l’alignement de séquences. Les hélices α (A1-A5) sont mentionnées en vert, les feuillets β (Β1−Β6) en rose et les hélices 10 (H1-H3) en bleu.
(D’après Wennerberg k., 2004, J. Cell Sciences et Ihara k., 1998, J. Biol Chem)
B6
A4 A5
B1 A1 B2
III.La localisation des protéines Rho
La localisation cellulaire très variée des Rho GTPases traduit la grande diversité des fonctions cellulaires auxquelles elles participent. Divers travaux ont montré que les GTPases Rho sont présentes dans le cytoplasme, à la membrane plasmique, à l’appareil de Golgi, aux endosomes précoces et tardifs et dans le noyau. Notre équipe se consacrant principalement à l’étude des trois protéines RhoA, B et C, nous présenterons principalement la localisation de celles-ci. Elles sont réparties au sein de la cellule et associées à différents effecteurs conduisant à des fonctions variées (figure 5).
a) La GTPase RhoA
La protéine RhoA est localisée majoritairement dans le cytosol et à un certain degré lié à la membrane plasmique (Robertson, Paterson et al. 1995). Quand elle est activée, la protéine RhoA serait plus précisément localisée dans les cavéoles des membranes plasmiques. Ces domaines se regroupent dans des régions, à la surface des cellules, riches en filaments d’actine (Michaely, Mineo et al. 1999). Elle pourrait être localisée aussi dans le noyau de certaines lignées et l’interaction avec ses protéines régulatrices telles que SmGDS modifierait cette localisation (Strassheim, Porter et al. 2000). Solski et son équipe montre une distribution de la protéine RhoA activée péri-nucléaire et au niveau de la membrane plasmique (Solski, Helms et al. 2002).
b) La GTPase RhoB
La protéine RhoB serait, elle, associée à la membrane des endosomes précoces et dans le compartiment pré-lysosomal mais pas au niveau des lysosomes matures. Une fraction minoritaire de la protéine RhoB serait présente au niveau de la membrane plasmique (Adamson, Paterson et al. 1992).
L’équipe de Michaelson montre que la protéine GFP-RhoB se localise préférentiellement à la membrane plasmique et faiblement au niveau de structures péri-nucléaires. A l’aide de co-marquage, ils identifient cette zone perinucléaire comme correspondante à des vésicules péri-golgiennes et de l’appareil de Golgi (Michaelson, Silletti et al. 2001).
Figure 5 : Modèle de la distribution des protéines RhoA, B et C et de leurs effecteurs dans les cellules en migration
mDia et Rock sont 2 effecteurs connus pour déstabiliser les microtubules et sont attendus à l’avant de la cellule. RhoA et Rock sont nécessaires pour la rétraction de la « queue » et le désassemblage des zones d’adhésions à l’arrière de la cellule. RhoB co-localise avec Prk1 au niveau des endosomes et retarde le trafic des récepteurs aux facteurs de croissance. La protéine RhoC a une localisation diffuse à travers le cytoplasme et est montrée pour interagir fortement avec Rock et Citron alors que son rôle dans les cellules en migration reste à définir.
c) La GTPase RhoC
La protéine RhoC est cytosolique et associée à la membrane plasmique et à des structures péri-nucléaires. Cependant les structures associées à la protéine n’ont pas pu être identifiées (Robertson, Paterson et al. 1995). La protéine RhoC est probablement comme RhoA associée aux cavéoles. En effet, il a été mis en évidence un lien entre la protéine RhoC et la caveolin-1 (protéine de structure majoritaire de ces domaines cavéoles) dans la régulation de la migration et l’invasion des cellules cancéreuses de pancréas (Lin, DiVito et al. 2005).
d) Les autres GTPases
Les protéines Rac1 et Rac2 sont localisées dans le cytosol et à la membrane plasmique. La protéine Rac1 comme RhoA est retrouvée préférentiellement dans les cavéoles de la membrane plasmique (Michaely, Mineo et al. 1999). Rac3, RhoG, Chp et Wrch sont localisées à la membrane plasmique et aux endomembranes (précisément pour RhoG aux endosomes et mitochondries). Cdc42 présente un marquage à la membrane plasmique et au niveau de l’appareil de Golgi. TC-10 et TCL sont localisées à la membrane plasmique et au niveau des endosomes (et au niveau perinucléaire pour TC-10). Les protéines Rnd1 et Rif sont localisées à la membrane plasmique alors que Rnd2 est retrouvé aux endosomes et dans le cytosol (Vega and Ridley 2007) et RhoD à la membrane plasmique et aux endosomes précoces (Ellis and Mellor 2000). Rnd3, quant à elle, est retrouvée dans le cytosol ainsi qu’au niveau des membranes intracellulaires, comme le réseau trans-golgien (Riento, Guasch et al. 2003). La localisation de RhoH n’est pas encore connue et les protéines RhoBTB 1 et 2 seraient localisées au niveau de vésicules (Vega and Ridley 2007).
IV. Les
modifications
post-traductionnelles
et
les
domaines régulateurs des protéines Rho
Pour permettre leurs localisations, leur régulation et leurs fonctions, la plupart des protéines Rho subissent une étape de prénylation, maturation post-traductionnelle, au niveau de leur partie C-terminale. Pour certaines Rho, une étape de palmitoylation et une régulation par des étapes de phosphorylation/déphosphorylation sont nécessaires à leurs activités.
A.
La prénylation
a) Définition
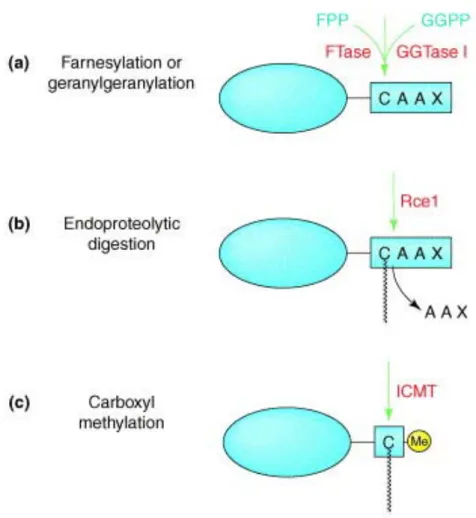
La prénylation est une modification post-traductionnelle qui consiste au greffage covalent d’un lipide isoprénique, lui-même issu du métabolisme du cholestérol, sur une cystéine au niveau d’une séquence consensus de l’extrémité C-terminale des protéines de la famille Rho appelée séquence « -CAAX » (où C est une cystéine, A, un acide aminé aliphatique et X, un acide aminé quelconque). La liaison thioéther entre la fonction thiol de la cystéine et le lipide est catalysée par la FTase (Farnésyl Transférase) pour la fixation d’un groupement farnésyl à 15 atomes de carbone ou par la GGTase I (Géranylgéranyl Transférase) pour la fixation d’un groupement géranylgéranyl à 20 atomes de carbone (figure 6). Cette première étape est suivie de la protéolyse des 3 derniers acides aminés (-AAX) par une endoprotéase (Rce1), puis de la carboxyméthylation de la fonction acide carboxylique de la cystéine par l’enzyme ICMT (Walker and Olson 2005).
La nature de l’isoprène transféré dépend généralement de la nature de l’acide aminé X. La Farnésyl-transférase réagit avec la séquence -CAAX lorsque X est par exemple une sérine ou une méthionine. Inversement quand X est une leucine, une isoleucine ou une phénylalanine, la protéine est géranylgéranylée. RhoA, RhoC, Rac1, Rac2 et Cdc42 possèdent des motifs CAAX reconnus par la GGTase I et sont géranylgéranylées. Rnd1, Rnd2, Rnd3, RhoD et TC10, elles, sont farnésylées. La protéine RhoB, quant à elle, possède une séquence C-terminale de prénylation –CKVL qui lui permet d'être farnésylée et géranylgéranylée (Baron, Fourcade et al. 2000).
b) La prénylation et la localisation des Rho
Des travaux du laboratoire ont démontré que la prénylation de la forme activée de RhoA est nécessaire pour sa localisation membranaire ainsi que pour sa liaison à la protéine régulatrice RhoGDI (Allal, Favre et al. 2000). Par contre, le mutant non activé même s’il est prénylé ne se localise pas à la membrane. Ceci démontre bien que la prénylation seule ne permet pas de déterminer la localisation de la forme active et celle non active de RhoA.
D’autres travaux suggèrent que la localisation de RhoB est dépendante du type de prénylation (Wherlock, Gampel et al. 2004). En effet, le traitement par
Figure 6: Modifications post-traductionnelles des protéines Rho GTPases à leur extrémité COOH-terminal
a) Addition d’un groupement à 15 carbones, le farnésyl par la FTase en utilisant le
farnésylpyrophosphate (FPP) comme donneur ou addition d’un groupement à 20 carbones, le géranylgéranyl par la GGTase I en utilisant le géranylgéranylpyrophosphate (GGPP) comme donneur. b) Digestion endoprotéolytique des 3 derniers acides aminés par l‘endopeptidase Rce1. c) Méthylation de la cystéine modifiée par la carboxy-méthyl-transférase (ICMT).
un FTI (Inhibiteur des Farnésyl-transférases) délocalise le pool de RhoB localisé à la membrane plasmique vers les endosomes, suggérant ainsi que la forme farnésylée de RhoB est préférentiellement localisée à la membrane plasmique et la forme géranylgéranylée majoritairement endosomale (Wherlock, Gampel et al. 2004). Par ailleurs, dans des cellules murines NIH-3T3, un mutant de RhoB exclusivement géranylgéranylable présente une localisation préférentiellement vésiculaire tandis que le mutant exclusivement farnésylable est localisé principalement au niveau de la membrane plasmique (Milia, Teyssier et al. 2005).
Le type de prényl, farnésyl ou géranylgéranyl, associé à la protéine semble en revanche ne pas modifier la localisation membranaire de Cdc42 et de Rac1 comme de RhoA, ni modifier leur liaison à la protéine RhoGDI (Allal, Favre et al. 2000).
c) L’importance de la prénylation
La prénylation des Rho, particulièrement nécessaire pour les interactions avec la membrane, est aussi essentielle pour leurs interactions avec les protéines régulatrices GEFs et GDI mais ne le serait pas pour leurs interactions avec les protéines GAPs (Hori, Kikuchi et al. 1991). Ces protéines régulatrices de l’activité des Rho seront décrites dans la partie traitant du cycle d’activation. Il est établi que la mutation du motif –CAAX des protéines Ras entraîne une absence de prénylation, empêche son association à la membrane plasmique et provoque la perte complète de l’activité oncogénique de Ras (Solski, Helms et al. 2002). Cette observation démontre l’importance de la prénylation dans l’activité oncogénique de ces familles de protéines. C’est pourquoi il a été développé une classe d’agents anti-cancéreux, les FTI (Farnésyl Transférase Inhibitors), à l’origine pour bloquer la fonction de la protéine oncogénique H-Ras. L’action de ces agents impliquerait une inhibition d’autres protéines, en particulier la farnésylation de RhoB. L’activité de RhoB, qui peut être farnésylée (F) ou géranylgéranylée (GG) serait liée au type de prényl. En effet, Prendergast et coll ont développé une théorie selon laquelle l’effet des FTI passerait par l’inhibition des fonctions de RhoB-F au profit d’un gain des fonctions médiées par RhoB-GG (Prendergast and Oliff 2000) suggérant ainsi que RhoB-F aurait un effet transformant et RhoB-GG, un effet anti-transformant. De plus, des études ont
montré que si le mutant de RhoB exclusivement géranylgéranylable et le mutant sauvage de RhoB sont capables de réverser le phénotype transformé des cellules NI3T3/Ras (fibroblastes murins NI3T3 transformés par l’oncogène H-RasL61) en revanche, le mutant de RhoB exclusivement farnésylable potentialise la transformation induite par H-Ras dans ces cellules (Mazieres, Tillement et al. 2005). Ces résultats confirment l’hypothèse selon laquelle la protéine RhoB aurait un rôle différent dans la transformation cellulaire selon la nature de sa prénylation. D’autre part, d’autres travaux ont montré que seule la forme RhoB-F augmente la survie des cellules NIH-3T3 après irradiation (Milia, Teyssier et al. 2005). Cependant quelque soit le type de prényl associé à la protéine RhoB, cette dernière montre des effets anti-tumoraux dans des modèles de greffes de tumeurs humaines dans des souris nude (Chen, Sun et al. 2000).
B.
La palmitoylation
Certaines protéines Rho telles que RhoB, Chp, Wrch, TCL et TC10 peuvent également être palmitoylées par une palmitoyltransférase sur une cystéine en amont de la cystéine prénylée (Hancock, Magee et al. 1989; Vega and Ridley 2007). RhoB est palmitoylé sur deux résidus cystéine (Cys189 et Cys192) en amont de la cystéine prénylée (Cys193). La palmitoylation de la cystéine 192, ainsi que la prénylation sur la cystéine 193 sont nécessaires pour les activités anti-tumorales et proapoptotiques de RhoB (Wang and Sebti 2005). L’importance de la palmitoylation de RhoB sur sa localisation a été montrée par l’équipe de Michaelson (Michaelson, Silletti et al. 2001). En utilisant un inhibiteur de la palmitoylation, le 2-bromopalmitate (2BP), ils observent une localisation incorrecte de RhoB au niveau de l’enveloppe nucléaire, du réticulum endoplasmique et une absence de sa localisation à la membrane plasmique. L’importrance de la palmitoylation est aussi mise en évidence avec la protéine Wrch. Celle-ci contient un motif carboxyl-terminal « -CAAX » unique (CCFV) qui permettrait l’incorporation d’un acide palmitique. En bloquant la palmitoylation de cette protéine, celle-ci perd sa capacité, dans des fibroblastes NIH-3T3, à s’associer aux membranes, sa localisation sub-cellulaire et ses fonctions transformantes (Berzat, Buss et al. 2005).
C.
Les autres domaines
Bien que ne subissant pas de modifications post-traductionnelles, des domaines de certaines protéines Rho sont impliqués dans la régulation de la localisation de la protéine. Les protéines Rac1, Rac2, Rac3, RhoA, RhoC, Cdc42, RhoE, RhoQ/TC10 présentent en amont du motif d’isoprénylation, un domaine
polybasique (séquence riche en arginine/lysine). Michaelson montre que la
partie hypervariable de la protéine Rac1 en fusion avec la GFP, suffit à localiser ce fragment de la protéine comme Rac1, principalement à la membrane plasmique. Cette équipe pose donc l’hypothèse selon laquelle la région hypervariable de cette protéine serait responsable de sa sub-localisation (figure 7C). Par contre le domaine hypervariable de RhoA ne permet pas à lui seul de localiser correctement cette protéine. En effet, le premier tiers du côté N-terminal de RhoA est nécessaire pour sa séquestration dans le cytosol probablement grâce à l’interaction avec des protéines régulatrices (les Rho-GDI) (Michaelson, Silletti et al. 2001).
D.
La phosphorylation
Si l’activité des petites protéines G est régulée de façon caractéristique par le cycle de liaison GDP/GTP (décrit dans le chapitre suivant), plusieurs études ont montré qu’elle pouvait parfois être aussi régulée par un autre mécanisme de régulation : le cycle de phosphorylation/déphosphorylation. En particulier, l’activité de la protéine RhoA semble être régulée par la phosphorylation de la sérine en position 188. En effet, la phosphorylation par les kinases PKA et PKG de la Ser188 augmente l’interaction de la protéine Rho avec la protéine régulatrice RhoGDI. Ainsi le RhoGDI peut extraire RhoA de la membrane et la séquestrer de façon non habituelle dans le cytosol (car encore liée au GTP), ce qui régule l’activité de cette protéine Rho. De même AKT phosphoryle Rac sur la serine 71, la kinase PKA phosphoryle Cdc42 sur la sérine en position 185 et ROCK1 phosphoryle RhoE sur la sérine 11. Ces étapes de phosphorylation semblent réguler positivement ou négativement leurs activités (Adamson, Paterson et al. 1992; Loirand, Guilluy et al. 2006).
Figure 7: Exemple de la régulation de la localisation membranaire des Rho
(A) Représentation schématique des éléments constituant les protéines Rho responsables de leur localisation. (B) Libération du complexe Rho-RhoGDI et adressage de la protéine Rho à des sites membranaires. (C) Le domaine polybasique retrouvé dans certaines protéines Rho fournit un signal secondaire qui dicte la localisation membranaire. Les composants de la membrane (marqués X ou Y) permettent la liaison spécifique de chaque type de protéine Rho (Rho1 et Rho2). Abréviations PM : membrane plasmique ; EM : membrane endosomique.
Ces modifications post-traductionnelles et ces domaines sont nécessaires à la localisation sub-cellulaire correcte de ces protéines Rho et en particulier leur ancrage dans les membranes et par conséquent sont essentiels pour leurs activités dans la transmission des signaux.
V. Le cycle d’activation et sa régulation
Comme les autres membres de la super famille Ras, les protéines Rho cyclent entre un état inactif lié au GDP et un état actif lié au GTP. La régulation de ce cycle est assurée par 3 familles de protéines, les GEFs (Guanine nucleotide Exchange Factors), les GAPs (GTPase-Activating Proteins) et les GDIs (Guanine nucleotide Dissociation Inhibitors) (Figure 8). Les GEFs stimulent l’échange du GDP en GTP, générant la forme active de la GTPase ce qui lui permet d’interagir avec ses effecteurs et de transmettre le signal dans la cellule. Les GAPs sont des activateurs de l’activité GTPasique intrinsèque des Rho et les GDI, des inhibiteurs de la dissociation du GDP de la protéine.
A.
Le cycle d’activation
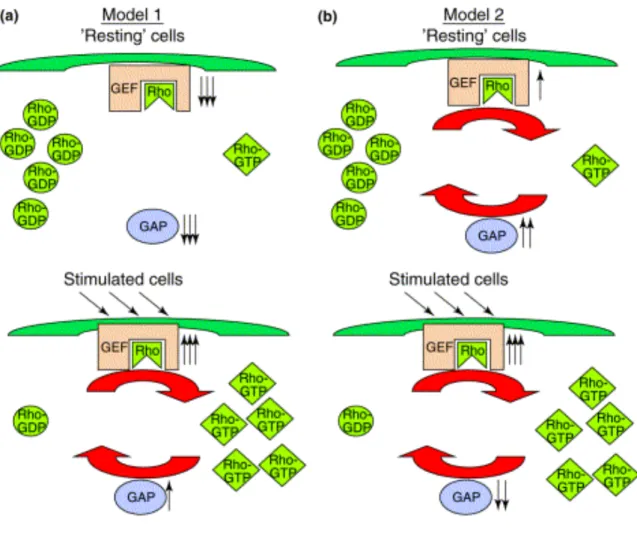
L’organisation des différentes protéines impliquées dans le cycle d’activation des Rho n’est pas complètement élucidée. D’un point de vue général, 2 hypothèses peuvent être posées (figure 9): dans la première version (a), les protéines GEFs activées par les stimuli permettraient d’échanger le GDP lié aux protéines Rho au repos par le GTP. Cette activation serait par la suite complétée par l’action des GAPs qui hydrolyseraient le GTP en GDP pour permettre le retour au repos des protéines Rho. L’autre hypothèse (b) présente l’idée que même dans des cellules au repos, les protéines Rho GTPases cycleraient constamment entre la liaison au GDP et au GTP grâce à l’activation combinée des GEFs et des GAPs. Dans ce modèle (b), l’activation de la cellule conduirait à une augmentation de la quantité des protéines Rho liées au GTP grâce à l’activation concommitante des GEFs et l’inhibition des GAPs (Symons and Settleman 2000).
Figure 8 : Cycle d’activation des Rho GTPases
Les protéines Rho sont inactives quand elles sont associées au GDP et actives quand associées au GTP. Le contrôle de ce mécanisme d’échange GDP-GTP est régulé par l’intervention des protéines GEFs, qui catalysent l’échange du GDP en GTP et des GAPs, qui augmentent le taux d’hydrolyse du GTP en GDP. Les protéines Rho interagissent avec de nombreux effecteurs pour transmettre l’activation de voies de signalisation. Les protéines RhoGDIs, non représentées ici, séquestrent dans le cytosol les protéines Rho et limitent leurs activations par les GEFs.
Les protéines RhoGDIs sont aussi impliquées dans ce cycle car ces protéines semblent capables de séquestrer grâce à une interaction avec leur groupement prényl, les protéines Rho et ainsi contrôler leur mobilité entre la membrane et le cytosol et limiter leur activation par les GEFs.
B.
Les protéines régulatrices du cycle
a) Les RhoGEFs
La première GEF des mammifères, Dbl, identifiée comme oncogène en 1985, catalyse l’échange de nucléotides de la protéine Cdc42 humaine. Il a été mis en évidence un domaine conservé, dénommé DH (Dbl homology), nécessaire pour l’activité GEF de la protéine (Schmidt and Hall 2002). Toutes les RhoGEFs, 69 membres répertoriés à ce jour chez les humains par homologie avec Dbl (Rossman, Der et al. 2005) contiennent un domaine DH responsable de leur activité biologique. A l’exception de 3 régions conservées (CR1-3) de chacune 10 à 30 acides aminés de long, les domaines DH partagent peu d’homologies entre eux et les GEFs spécifiques d’un substrat identique présentent souvent moins de 20% d’identité de séquences. Ce domaine DH participe à la formation de la poche d’interaction avec la GTPase. La GEF se lie à la forme liée au GDP de la protéine Rho et déstabilise le complexe GDP-GTPase pour former un intermédiaire réactionnel sans nucléotide. Grâce au rapport intracellulaire élevé GTP:GDP, le GDP libéré est remplacé par du GTP, conduisant à l’activation de la Rho GTPase. Presque toutes les GEFs possèdent un domaine C-terminal adjacent au DH, le domaine pleckstrin-homologue (PH). Plusieurs rôles ont été suggérés pour ce domaine. Premièrement, il pourrait intervenir directement avec le domaine DH pour agir sur son activité catalytique ou participer à la liaison à la protéine Rho. Deuxièmement, il permettrait la localisation membranaire de la GEF (Schmidt and Hall 2002) grâce à des liaisons avec des phospholipides ou à d’autres protéines (Garcia-Mata and Burridge 2007). En complément de ce module DH-PH, la plupart des GEFs contiennent des domaines fonctionnels comme les domaines SH2, SH3, Ser/Thr ou Tyr kinase, Ras-GEF, Rho-Gap, Ran-GEF, PDZ (domaines modulateurs d’interaction protéines-protéines). Ces domaines complémentaires sont probablement impliqués dans le couplage
Figure 9 : Régulation du cycle des GTPases par l’action concertée des GEFs et des GAPs
Modèle 1 : la conversion du GDP en GTP des protéines Rho est médiée par l’activation des GEFs puis la reconversion en GDP est ensuite médiée par les GAPs.
Modèle 2 : les GEFs et les GAPs agissent de façon simultanée pour créer un équilibre du cycle. Dans l’état au repos, la balance de leurs activités favorise la forme liée au GDP. La stimulation des cellules entraîne une modification de l’équilibre grâce à l’activation des GEFs de façon concomitante à l’inhibition des GAPs conduisant à une augmentation des formes liées au GTP.
de la GEF aux récepteurs en amont ou aux molécules de signalisation bien qu’il soit aussi possible qu’ils apportent des fonctions supplémentaires aux GEFs.
La notion de spécificité de ces GEFs vis-à-vis des différents membres de la famille des GTPases Rho reste encore assez floue. Certaines possèdent une activité très spécifique pour une seule GTPase, comme Trio DH2, Lbc, Lfc ou Lsc (pour Rho), Tiam-1, Sos1 et Sos2 (pour Rac) ou Fgd1 et Intersectin 1 (pour Cdc42). D’autres peuvent activer plusieurs types de GTPases Rho comme Vav1 (pour Cdc42, Rac et Rho), Dbl (pour Rho et Cdc42) ou Trio DH1 (pour Rac et RhoG). Certaines possèdent une plus grande spécificité in vivo. Par exemple, Tiam-1 peut activer Rho, Rac et Cdc42 in vitro, mais uniquement Rac in vivo (Schmidt and Hall 2002). La plupart des GEFs n’ont été testées que sur les GTPases Rho les plus étudiées, à savoir RhoA, Rac1 et Cdc42. Des spécificités particulières à l’intérieur d’une même sous-famille ne peuvent donc pas être exclues. Par exemple, XPLN possède une activité sur RhoA et RhoB mais pas sur RhoC, pourtant très homologue (Arthur, Ellerbroek et al. 2002).
Les protéines GEFs sont finement régulées et chaque membre possède probablement un mécanisme unique d’activation/desactivation. Néanmoins, il existe des principes généraux communs de régulation entre les différentes GEFs. L’activation des GEFs pourrait impliquer l’ouverture d’une boucle auto-inhibitrice sur la protéine grâce à des étapes de phosphorylation ou de liaisons à d’autres protéines mais ces mécanismes ne sont pas encore bien élucidés. Les étapes de phosphorylation ou de liaisons avec des protéines pourraient activer les GEFs sans impliquer de boucle auto-inhibitrice ou conduire à la réversion de l’activation. La sub-localisation des GEFs est très probablement un aspect clé de sa régulation et dans certains cas, l’activation des GEFs semble intimement liée à un mécanisme de relocalisation (Schmidt and Hall 2002).
D’autre part, une autre sous-famille de GEFs, ne possédant pas de domaines DH a été récemment décrite. Ces protéines à activité GEF sont appelées CZH pour « CDM and Zizimin homolgy » ou Dock180 mais ne sont pas encore très étudiées (Garcia-Mata and Burridge 2007).
Enfin, des réarrangements et des délétions sur les gènes des RhoGEFs ont été identifiés dans des troubles du développement ou neuro-dégénératifs ainsi que dans des cancers. De nombreuses GEFs dont Dbl, Lbc, Lfc, Lsc, Dbs/Ost, Vav, Net1, Ect2 et Tim ont été, à l’origine, isolées comme oncogènes dans des
tests in vitro de transformation de fibroblastes NIH-3T3 à partir de l’ADN de tumeurs humaines.
b) Les RhoGAPs
Le taux intrinsèque d’hydrolyse du GTP pour accélérer le retour à l’état inactif des protéines Rho est largement stimulé par les protéines RhoGAPs. La famille des RhoGAPs est définie par la présence dans la séquence primaire d’un domaine conservé « RhoGAP » responsable de leur activité ; celui-ci contient 150 acides aminés environ et partage 20% d’identité de séquence avec les autres membres de la famille. Il existe plus de 70 RhoGAPs codés dans le génome humain (Kandpal 2006).
Le domaine RhoGAP interagit avec les régions « switch 1 » et « switch 2 », et avec le domaine de liaison au GTP de la GTPase Rho (figure 2). Le résidu arginine conservé du domaine GAP vient se placer sur le site actif de la GTPase au contact du résidu glutamine présent dans le « switch 2 » qui est responsable du positionnement de la molécule d’eau permettant la catalyse hydrolytique. La stabilisation de ce résidu glutamine restreint la liberté de la molécule d’eau et réduit la barrière énergétique pour l’hydrolyse du GTP (Moon and Zheng 2003).
Ces RhoGAPs présentent en supplément du domaine RhoGAP des motifs fonctionnels, tels que SH2, SH3, DH, PH, des domaines de liaisons à l’actine, à la calmoduline, des domaines PDZ… Ces motifs participent à la régulation de l’activité de ces GAPs soit en permettant des mécanismes de phosphorylation par des protéines kinases comme Src avec p190RhoGAP, soit des interactions avec des phospholipides ou des protéines (Moon and Zheng 2003).
De la même façon que les RhoGEFs, le spectre d’activité de ces protéines est large in vitro. Certaines reconnaissent spécifiquement une protéine Rho: Myr5/Myr7 (pour RhoA) ou SrGAP1-3 (pour Cdc42) ; d’autres présentent plutôt des préférences comme p190 ou PARG1 qui agiraient de façon préférentielle sur RhoA puis sur Rac, Cdc42 (Moon and Zheng 2003).
Les RhoGAPs catalysent probablement des réactions enzymatiques autres que la stimulation de l’hydrolyse du GTP des Rho et parfois semblent faciliter la signalisation par les protéines Rho. En effet, certaines RhoGAPs possèdent des domaines RhoGEFs (DH-PH). Même si pour le moment, l’activité GEF de ces molécules n’est pas démontrée, des études portant sur une RacGAP de
Dictyostelium discoideum permettent de poser l’hypothèse que ce type de
protéine pourrait agir différemment sur différentes GTPases (Rac1, RhoE et Rab) impliquées dans des fonctions différentes pour coordonner un processus cellulaire (Knetsch, Schafers et al. 2001). Certaines RhoGAPs auraient un rôle potentiel de suppresseur de tumeur (décrit dans la partie suivante).
La sur-abondance des régulateurs RhoGAPs et RhoGEFs suggère que chacun d’entre eux doit jouer un rôle spécialisé dans la régulation de l’activité de chaque Rho GTPase et influencer leurs fonctions spécifiques. L’hypothèse avancée pour expliquer l’abondance de ces protéines, est qu’elles peuvent grâce à leurs sub-localisations et des interactions protéines-protéines coopérer dans la mise en place de connections entre les signaux d’activation en amont et les effecteurs en aval. En particulier, il a été identifié des interactions entre les GEFs et des protéines contenant des domaines PDZ. Ces protéines auraient la fonction de localiser la GEF et cibler l’activation d’une Rho en particulier (Garcia-Mata and Burridge 2007). Par exemple, récemment, il a été identifié une protéine, la caténine p0071, capable d’interagir avec RhoA et avec la RhoGEF Ect2. La formation de complexes multiprotéiques de cette sorte à un temps donné et dans un lieu précis de la cellule, serait impliquée dans le contrôle de la signalisation induite par les protéines Rho (Keil, Wolf et al. 2007).
c) Les RhoGDIs
À la différence des RhoGEFs et des RhoGAPs, il y a peu de RhoGDIs connus. Trois isoformes présentant une forte homologie de séquences ont été décrites à ce jour : RhoGDI-1(α) , RhoGDI-2 (aussi appelé LyGDI ou D4GDI) et RhoGDI-3(γ). RhoGDI-1 est le plus abondant chez les mammifères ; son expression est ubiquitaire. Il est capable de former des complexes cytosoliques avec la plupart des membres de la famille des Rho (Dransart, Olofsson et al. 2005). A l’inverse, RhoGDI-2 est retrouvé de façon prédominante dans les cellules hématopoïétiques où il semble avoir une plus étroite spécificité pour la sous-famille Rac1. Le 3ème membre, RhoGDI-3 est une protéine faiblement
exprimée qui interagit in vitro avec plusieurs Rho GTPases comme les autres RhoGDIs mais semble être spécifique de RhoG in vivo. Il diffère des autres RhoGDIs par une extension au niveau de la partie N-terminale responsable de sa
localisation unique au niveau de l’appareil de Golgi. Cette extension permet sa liaison directement ou grâce à un intermédiaire cytoplasmique à une protéine présente au niveau de l’appareil de Golgi (Dransart, Olofsson et al. 2005).
Les protéines RhoGDIs sont constituées de deux domaines fonctionnels : un domaine N-terminal flexible d’environ 70 acides aminés, responsable de l’inhibition de la dissociation du GDP (liaison au « switch 1 ») et un domaine C-terminal, composé d’environ 140 acides aminés impliqués dans la liaison à la GTPase (liaison au « switch 2 ») (figure 2). Ce dernier domaine adopte une structure ordonnée de type immunoglobuline, formant une poche hydrophobe dans laquelle se niche le lipide isoprènique de la GTPase lors de l’interaction. Les RhoGDIs masquent le groupe prényl des protéines Rho et permettent ainsi leur séquestration dans le cytosol.
Ces protéines RhoGDIs inhibent l’activité d’échange du GDP en GTP ainsi que l’activité GTPase intrinsèque des Rho ou stimulée par les GAPs (Fritz and Kaina 2006). Elles auraient aussi un rôle dans l’adressage de la protéine Rho au compartiment membranaire adapté. Une autre fonction des RhoGDI serait aussi de protéger la protéine Rac du clivage protéolytique (Zhang 2006).
La régulation des protéines RhoGDIs est importante pour leur contrôle de l’activité des Rho GTPases. Par exemple, la phosphorylation de RhoGDI par la protéine kinase C ou Pak1 diminue l’affinité du RhoGDI pour Rac1 (Bustelo, Sauzeau et al. 2007). De plus, Src en phosphorylant le RhoGDI entraîne une diminution de l’affinité de la protéine RhoGDI pour les Rho, ce qui probablement prolonge la période d’activation de la protéine Rho (DerMardirossian, Rocklin et al. 2006). D’autre part, l’interaction entre les RhoGDIs et les Rho GTPases peut être inhibée par la liaison des RhoGDIs aux membres de la famille ERM (ezrin-radixin-moesin) qui servent de liens entre les filaments d’actine et la membrane plasmique. La surexpression d’un fragment des protéines ERM est capable d’induire des fibres de stress de manière dépendante des Rho suggérant que la modulation de l’activité des protéines ERM doit contribuer à l’activation des Rho GTPases probablement en séquestrant les RhoGDIs (Symons and Settleman 2000).
Les protéines GEFs, GAPs et GDIs collaborent donc pour permettre la transmission des signaux en aval aux effecteurs.
C.
Les effecteurs
Une fois activées, ancrées et localisées dans leurs compartiments membranaires cibles, les protéines Rho interagissent avec les effecteurs pour entraîner les cascades de signalisation. La modification de la boucle intra-moléculaire d’auto-inhibition des effecteurs est le mécanisme le plus commun d’activation par les Rho GTPases. Cette modification permet l’exposition de domaines fonctionnels des effecteurs pour ses substrats (Bishop and Hall 2000).
A ce jour, plus de 70 effecteurs potentiels ont été identifiés (Bustelo, Sauzeau et al. 2007). D’un point de vue structural, il est établi que ces effecteurs utilisent certains acides aminées localisés dans les « switch 1 et 2 » des protéines Rho comme sites majeurs de reconnaissance (Bishop and Hall 2000) (figure 2). Cependant les acides aminés des effecteurs impliqués dans l’interaction avec chaque cible diffèrent. Un exemple d’effecteurs présentant des motifs différents RBD pour Rho Binding Domain sont classés dans un tableau sur la figure 10. Ainsi, les effecteurs PAK1 (p21 Activated Kinase), ACK (Activated Cdc42-associated tyrosine Kinase) et WASP (Wiskott-Aldrich-Syndrome Protein) contiennent un site consensus de liaison aux GTPases appelé CRIB (Cdc42/Rac-interactive binding) qui est présent dans la plupart mais pas toutes les protéines de liaisons aux protéines Rac et Cdc42. Alors que PAK1 se lie avec des affinités similaires à Rac et Cdc42, ACK et WASP sont relativement spécifique de Cdc42. Les effecteurs PRKs (aussi appelé PKNs), Rhoteckin et Rhophilin contiennent du côté N-terminal une région de liaison aux Rho (motif REM) d’environ 70 acides aminés. La structure de ce domaine est une « leucine zipper ». A l’opposé, les effecteurs ROCK1 et ROCK2 (ou ROKα et β) contiennent du côté C-terminal un RBD différent (motif RKH). Enfin, l’effecteur Citron contient un RBD localisé comme celui des ROCKs, mais qui ne présente aucune similarité avec les motifs REM ou RKH. Ces différents RBD des effecteurs sont listés par spécificité par rapport aux Rho, mais présentent des variations d’affinité entre chaque membre des Rho. Des études d’interaction suggèrent que, par exemple, ROCK et Citron ont une plus forte affinité pour RhoC comparée à RhoA et RhoB et que l’effecteur Rhophillin a une plus forte affinité pour RhoA comparée à RhoC et RhoB (Wheeler and Ridley 2004). La localisation de certains de ces effecteurs et des protéines Rho associées est représentée sur la figure 5.