Régulation des variants d’épissage du cotransporteur
rénal Na+-K+-Cl- de type 2 (NKCC2) : implication de la
voie des kinases with no lysine (WNK)
Thèse
Andrée-Anne Marcoux
Doctorat en médecine expérimentale
Philosophiæ doctor (Ph. D.)
Régulation des variants d’épissage du
cotransporteur rénal Na
-K
-Cl
de type 2
(NKCC2) : implication de la voie des kinases with
no lysine (WNK)
Thèse
Andrée-Anne Marcoux
Sous la direction de :
Résumé
L’hypertension artérielle affecte 40 % des Canadiens et Canadiennes âgés de 56 à 65 ans et correspond à un facteur de risque important pour le développement de maladies cardiovasculaires. Les causes de l’hypertension artérielle sont multifactorielles et le plus souvent difficiles à circonscrire. Elles incluent des facteurs génétiques, comme le dérèglement de certains systèmes de transport ionique dans le rein, et des facteurs environnementaux, comme l’ingestion excessive de sodium par la diète, l’abus d’alcool, la sédentarité, etc.
La réabsorption du sodium filtré par le rein est effectuée par des protéines de transport spécialisées. Parmi celles-ci, le cotransporteur Na-K-Cl de type 2 (NKCC2), exprimé uniquement dans l’anse ascendante large de Henle (AAH) du néphron, assure la réabsorption d’environ 20 % du sodium. Ce transporteur est inhibé par les diurétiques de l’anse qui sont utilisés en clinique pour traiter certaines formes d’hypertension. Un changement de l’activité de cette protéine, soit intrinsèque ou lié à celui de certaines enzymes qui agissent sur NKCC2, a aussi été associé à des désordres de la pression artérielle.
NKCC2 existe sous trois variants principaux qui sont produits par l’épissage alternatif de l’exon 4. Ces variants d’épissage, nommés NKCC2A, NKCC2B et NKCC2F, sont identiques les uns aux autres à l’exception du segment transmembranaire deux et de la boucle intracellulaire adjacente. Malgré tout, ils ont des caractéristiques, des localisations et des rôles différents le long de l’AAH.
NKCC2 est impliqué dans la régulation du volume cellulaire puisqu’il est activé en condition de stress hypertonique. Cette activation serait médiée (du moins en partie) par certains isoformes des kinases with no lysine (WNK) dont WNK1 et WNK3. Toutefois, l’effet de ces kinases sur chaque isoforme n’est pas connu et les mécanismes provoquant l’activation du cotransporteur en réponse au stress hypertonique sont peu définis. Une meilleure connaissance à ce sujet nous permettrait de mieux comprendre comment NKCC2 est régulé et de savoir de quelle manière il pourrait être modulé pour en contrôler l’activité dans un but thérapeutique éventuel.
Les objectifs de cette thèse étaient comme suit : 1) déterminer les mécanismes par lesquels les kinases WNK1 et WNK3 régulent chacun des variants de NKCC2 lors du stress hypertonique (chapitre 1) et 2) identifier les résidus de NKCC2 qui permettent la réponse au stress hypertonique et la régulation différentielle par les kinases WNK (chapitre 2). Le modèle des ovocytes de Xenopus laevis a été utilisé à cette fin.
Dans le chapitre 1, nous avons montré que le stress hypertonique produisait son effet en augmentant l’abondance de NKCC2A et NKCC2B à la surface cellulaire et que cet effet était mimé par WNK3, mais pas par WNK1. De plus, nous avons montré que WNK3 augmentait le recyclage à la membrane des transporteurs endocytés alors que le stress hypertonique ne produisait pas cette réponse. Enfin, NKCC2F s’est révélé peu sensible au stress hypertonique et à WNK3, suggérant que des résidus lui étant uniques dans l’exon 4 contribuaient à cette réponse différentielle.
Dans le chapitre 2, nous nous sommes intéressés aux rôles des résidus divergents entre les variants pour déterminer si l’exon 4 jouait un rôle dans les réponses observées. Par des études de mutagénèse dirigée, nous avons mis en évidence que les résidus en position 230 et 238 avaient un impact sur le trafic cellulaire de NKCC2. En outre, nous avons constaté que les résidus de NKCC2F à ces positions avaient pour effet de favoriser la rétention du transporteur à la membrane cellulaire.
En somme, l’ensemble de ces travaux permettent de mieux comprendre les mécanismes de régulation du cotransporteur NKCC2 par le stress hypertonique et par la voie des kinases WNK. À la partie variable de NKCC2, l’exon 4, nous avons identifié un nouveau rôle qui est de participer à la régulation du trafic cellulaire du transporteur. Grâce à cette connaissance, nous saurons désormais que des stratégies d’intervention pour contrôler l’activité de NKCC2 pourraient miser sur la modification du nombre de transporteurs au site d’expression.
Abstract
High blood pressure affects 40% of Canadians aged 56 to 65 and is a major risk factor for cardiovascular diseases. The causes of high blood pressure are multifactorial and are often difficult to circumscribe. They include genetic factors, such as abnormalities in the function of renal ion transporters, and environmental factors, such as excessive dietary sodium intake, alcohol abuse, sedentary lifestyle, etc.
In the kidney, the ultrafiltered NaCl load is reabsorbed by specialized ion transport systems. Of these systems, the Na-K-Cl cotransporter type 2 (NKCC2), is confined to the thick ascending loop of Henle (TALH) of the nephron where it reabsorbs approximatively 20% of the ultrafiltered NaCl load. This transporter is inhibited by loop diuretics that are used clinically to treat certain types of hypertension. A change in the activity of NKCC2, either intrinsic or secondary to the effect of regulatory enzymes, has also been associated with blood pressure disorders.
NKCC2 exists as three main variants that are produced through the alternative splicing of exon 4. These splice variants, named NKCC2A, NKCC2B, and NKCC2F, are identical to each other except for the residue composition of transmembrane segment 2 and the following connecting segment. Yet, they have different characteristics and roles along the TALH. NKCC2 is involved in cell volume regulation as it is activated by cell shrinkage. This activation is mediated (at least in part) by certain isoforms of the with no lysine (WNK) kinases including WNK1 and WNK3. However, the effect of these kinases on each of the splice variants is not known and the mechanisms that underlie the response to cell shrinkage are poorly defined. A better knowledge in these regards would allow us to better understand how NKCC2 is regulated and how it could be acted upon optimally towards maximal clinical benefits.
The objectives of this thesis were as follows: 1) to determine the mechanisms by which WNK1 and WNK3 regulate each of the NKCC2 variant under hypertonic stress (Chapter 1) and 2) to identify residues in NKCC2 that sustain the response to cell shrinkage and
differential regulation by the WNK kinases (chapter 2). The oocyte model of Xenopus laevis was used for this purpose.
In Chapter 1, we showed that cell shrinkage produced its effect by increasing the abundance of NKCC2A and NKCC2B at the cell surface and that this effect was mimicked by WNK3, but not by WNK1. In addition, we showed that WNK3 increased membrane recycling of endocytosed transporters while cell shrinkage failed to produce such a response. Finally, NKCC2F was found to be insensitive to cell shrinkage and WNK3, suggesting that specific residues that are unique to this variant in exon 4 contributed to this differential response. In Chapter 2, we looked at the roles of divergent residues between the variants to determine whether exon 4 played a role in the observed responses. Using mutagenic studies, we showed that residues at positions 230 and 238 played a major role in NKCC2 trafficking. In addition, we found that the residues of NKCC2F at these positions had the effect of promoting carrier retention at the cell membrane.
In sum, our findings have allowed us to better understand the mechanisms through which NKCC2 is regulated during cell shrinkage and by the WNK kinase-dependent pathway. Our findings have also allowed us to identify a new role for exon 4 in NKCC2 trafficking. With this gain of knowledge, we have found that strategies aimed at controlling the activity of NKCC2 could be based on altering the number of transporters at the cell surface.
Table des matières
Résumé ... ii
Abstract ... iv
Table des matières ... vi
Liste des figures ... ix
Liste des tableaux ... x
Liste des abréviations ... xi
Remerciements ... xiv
Avant-propos ... xvi
Introduction ... 1
1. Membrane cellulaire ... 1
2. Régulation du volume cellulaire ... 1
3. Transport membranaire ... 3
4. Le rein ... 4
5. La famille des cotransporteurs cation-chlore ... 5
5.1. Découverte du premier cotransporteur cation-chlore et des autres membres de cette famille ... 5 5.2. Structure ... 6 5.3. Fonction ... 7 5.4. Régulation ... 8 5.5. KCC ... 9 5.6. NCC ... 10 5.7. NKCC ... 10 5.8. NKCC1 ... 11 5.9. NKCC2 ... 13 5.9.1. Distribution ... 13 5.9.2. Structure ... 13 5.9.3. N-terminal ... 14 5.9.4. C-terminal ... 14 5.9.5. Variants d’épissage ... 14
5.9.6. Mouvement des ions ... 16
5.9.7. Fonctions ... 16
5.9.7.1. Réabsorption des ions et régulation acide-base ... 16
5.9.7.2. Rétrocontrôle tubuloglomérulaire ... 18 5.9.8. Régulation ... 19 5.9.8.1. Cl− intracellulaire ... 20 5.9.8.2. Volume cellulaire ... 21 5.9.8.3. Hormones ... 22 5.9.8.4. Kinases ... 23 5.9.9. Trafic du transporteur ... 23 5.9.10. Apport hydrique ... 24 5.10. Physiopathologies ... 24 5.10.1. Syndrome de Bartter ... 24 5.10.2. Hypertension artérielle ... 25 5.11. Inhibition ... 26
6. Les kinases with no lysine (WNK) ... 26
6.1. Structure ... 27
6.2. Fonction ... 28
6.3. Régulation ... 28
6.3.1. Régulation par la [Cl−]i ... 28
6.3.2. Régulation par la tonicité ... 29
6.3.3. Régulation croisée des kinases WNK ... 29
6.4. WNK1 ... 30 6.4.1. Expression ... 30 6.4.2. Effets fonctionnels ... 30 6.4.3. Modèles animaux ... 32 6.5. WNK2 ... 32 6.6. WNK3 ... 33 6.6.1. Expression ... 33
6.6.2. Interaction avec le cytosquelette ... 33
6.6.3. Effets fonctionnels ... 33 6.6.4. Modèles animaux ... 34 6.7. WNK4 ... 34 6.7.1. Expression ... 34 6.7.2. Effets fonctionnels ... 34 6.7.3. Modèles animaux ... 35
6.8. Pseudohypoaldostéronisme de type II (PHAII) ... 35
6.8.1. WNK1 ... 35 6.8.2. WNK4 ... 36 6.8.3. KLHL3 et CUL3 ... 36 7. SPAK/OSR1 ... 37 7.1. Régulation ... 37 7.2. Modèles animaux ... 37
8. Problématique, hypothèse et objectifs ... 38
Chapitre 1: Regulation of Na+-K+-Cl− cotransporter type 2 by the with no lysine kinase-dependent signaling pathway ... 39
2.1. Avant-propos ... 40 2.2. Résumé ... 41 2.3. Abstract ... 42 2.4. Introduction ... 43 2.5. Methods ... 45 2.6. Results ... 50 2.7. Discussion ... 55 2.8. References ... 58 2.9. Footnotes ... 63
2.10. Tables and figures ... 64
Chapitre 2: Endocytic recycling of Na+-K+-Cl− cotransporter type 2: importance of exon 4 ... 82
3.1 Avant-propos ... 83
3.2 Résumé ... 84
3.3 Abstract ... 85
3.5 Introduction ... 87 3.6 Experimental procedures ... 89 3.7 Results ... 94 3.8 Discussion ... 99 3.9 References ... 102 3.10 Additional information ... 107
3.11 Table and figure legends ... 108
Discussion générale ... 122
4.1. Régulation des variants de NKCC2 par le stress hypertonique ... 123
4.1.1. Effets sur l’influx en Rb+ ... 123
4.1.2. Effets sur la Vmax et le Km(Rb+) ... 124
4.1.3. Effet sur l’expression membranaire ... 124
4.2. Régulation des variants par les kinases WNK lors du stress hypertonique ... 125
4.2.1. Effet sur l’influx ... 126
4.2.2. Effets sur la Vmax et le Km(Rb+) ... 126
4.2.3. Effet sur l’expression membranaire ... 126
4.2.4. Endocytose ... 127
4.2.5. Recyclage endocytique ... 128
4.2.6. Différence dans l’action de WNK1 et WNK3 sur les CCC ... 129
4.3. Résidus de NKCC2 impliqués dans la régulation du transporteur ... 130
4.3.1. Résidus phosphoaccepteurs potentiels ... 130
4.3.2. Résidu 234 ... 130
4.3.3. Résidu 230 ... 131
4.3.4. Résidu 238 ... 131
4.3.5. Implications des voies dépendantes et indépendantes des clathrines dans l’endocytose de NKCC2... 132
4.4. Identification de résidus divergents conférant une différence dans la réponse à WNK3 et au stress hypertonique ... 132
4.5. Rôles physiologiques des variants de NKCC2 dans l’AAH ... 133
4.6. Forces et limites ... 133
4.6.1. Choix du modèle des ovocytes ... 133
4.6.2. Phosphorylation totale du transporteur ... 134
Conclusion ... 136
Perspectives de recherche ... 137
Liste des figures
Introduction
Figure 1.1 Perméabilité de la membrane cellulaire 2
Figure 1.2 Les types de transport membranaire 3
Figure 1.3 Le néphron 4
Figure 1.4 Modèle hydropathique d’un membre de la famille des CCC 6 Figure 1.5 Les CCC régulent le volume cellulaire suite à un stress osmotique 8 Figure 1.6 Alignement partiel des exons 4A, 4B et 4F de NKCC2 de lapin 15 Figure 1.7 NKCC2 dans l’anse ascendante large de Henle 17
Figure 1.8 Modèle d’activation de NKCC2 20
Figure 1.9 Domaines d’intérêt dans les kinases WNK1 et WNK3 27 Chapitre 1
Figure 2.1 Hydropathy plot model of NKCC2 and amino acid composition of exon 4 67 Figure 2.2 Effect of a change in cell volume on 85Rb+ transport by the NKCC2
variants 68
Figure 2.3 Effect of a change in cell volume on the ion-dependence of 85Rb+ influx
by the NKCC2 variants 69
Figure 2.4 Effect of a change in cell volume on cell surface expression of
biotinylated NKCC2 variants (BtNKCC2) 71
Figure 2.5 Effect of WNK1, WNK3 and WNK3kd expression on 85Rb+ transport
by the NKCC2 variants 72
Figure 2.6 Effect of WNK1 or WNK3 expression on the ion-dependence of 85Rb+
influx by the NKCC2 variants 74
Figure 2.7 Effect of WNK3 and WNK3kd expression on cell surface expression
of BtNKCC2 variants 75
Figure 2.8 Effect of cell shrinkage and WNK3 expression on NKCC2B endocytosis 77 Figure 2.9 Effect of cell shrinkage and WNK3 expression on NKCC2B recycling to
the cell surface 79
Figure S1 Effect of WNK1 and WNK3 expression on cell surface expression of
BtNKCC2 variants 81
Chapitre 2
Figure 3.1 Hydropathy model of NKCC2 and residue sequence of exon 4 111 Figure 3.2 Basal 85Rb+ transport by WT variants and by mutant variants harboring
a residue exchange at Pn 238 112
Figure 3.3 Dependence of BY238V activity on external [85Rb+] 113 Figure 3.4 Cell surface expression of AF238V and BY238V 114
Figure 3.5 Endocytosis of BY238V 115
Figure 3.6 Recycling of BY238V at the cell surface 117 Figure 3.7 Effect of WNK3 and cell shrinkage on AF238V and BY238V activity 118 Figure 3.8 Basal 85Rb+ transport by mutant variants harboring a residue exchange
at Pn 230 119
Figure 3.9 Dependence of FM230T activity on external [85Rb+] 120 Figure 3.10 Cell surface expression of BT230M and FM230T 121
Liste des tableaux
Introduction
Tableau 1.1 Effet des kinases WNK sur les CCC 30
Tableau 1.2 Effet des kinases WNK sur d’autres transporteurs 31 Chapitre 1
Tableau 2.1 Oligonucleotides used 64
Tableau 2.2 Solutions used 65
Tableau 2.3 Steps and conditions used to study NKCC2 trafficking 66 Chapitre 2
Tableau 3.1 Oligonucleotides used to introduce single point substitutions 108
Tableau 3.2 Solutions 109
Liste des abréviations
AAH Anse ascendante de Henle AMP Adénosine monophosphate AMPc AMP cyclique
AngII Angiotensine II
AP-1/2 «Adaptor protein complex 1/2» ARN Acide ribonucléique
ARNm ARN messager
ATP Adénosine triphosphate
Bp «Base pair»
Bt «Biotinylated» C-terminal Carboxyle-terminal
CCC Cotransporteur cation-Cl ou «cation-Cl cotransporter» CCC8 Cotransporteur cation-Clde type 8
CCC9 Cotransporteur cation-Cl de type 9
[Cl]i Concentration intracellulaire de Cl ou «intracellular Cl concentration» cDNA «Complementary DNA»
CLC-K «kidney-specific Cl channel» cRNA «Complementary RNA» CS «Connecting segment»
Ctl «Control»
CUL3 «Cullin3»
DMSO «Dimethyl sulfoxide» DNA «Deoxyribonucleic acid»
e Extracellulaire ou «extracellular» ou «external» ENaC Canal à Na+ épithélial ou «epithelial Na+ channel» ERK «Extracellular signal-regulated kinase»
EST «Expressed sequence tag»
FHHt Hypertension hyperkaliémique familiale ou «Familial hyperkalemia hypertension»
FRET «Fluorescence resonance energy transfert»
Fx «Fraction»
GMP Guanosine monophosphate GMPc GMP cyclique
HEK293 «Human embryonic kidney 293»
i Intracellulaire ou «intracellular» ou «internal» KCC Cotransporteur K+-Cl KCC1 Cotransporteur K+-Cl de type 1 KCC2 Cotransporteur K+-Cl de type 2 KCC3 Cotransporteur K+-Cl de type 3 KCC4 Cotransporteur K+-Cl de type 4 kDa kildaltons KLHL3 «Kelch-like protein 3»
Km Constante de Michaelis-Menten ou «Michaelis-Menten constant» M ou Mesna 2-mercaptoethanesulfonate
MAPK «Mitogen-activated protein kinase» MEK «MAPK/ERK kinase»
N-terminal Amino-terminal
NCC Cotransporteur Na+-Cl
NEDD4-2 «Neural precursor cell expressed developmentally down-regulated 4-like» NHE Échangeur Na+/H+
NKCC Cotransporteur Na+-K+-Cl ou «Na+-K+-Cl cotransporter»
NKCC1 Cotransporteur Na+-K+-Cl de type 1 ou «Na+-K+-Cl cotransporter type 1» NKCC2 Cotransporteur Na+-K+-Cl de type 2 ou «Na+-K+-Cl cotransporter type 2» NO «Nitrogen oxide»
OSR1 «Oxidative stress-response kinase 1» pb Paire de base
PCR «Polymerase chain reaction»
PHAII Pseudohypoaldostéronisme de type II PI «Protease inhibitor»
PKA Protéine kinase A PKC Protéine kinase C PKG Protéine kinase G PMSF «Phenylmethylsulfonyl»
Pn «Position»
PP1 Protéine phosphatase 1
PTH Hormone parathyroïdienne ou «parathyroid hormone» RE Réticulum endoplasmique
RNA «Ribonucleic acid»
ROMK Canal à K+ médullaire externe rénal
RT-PCR «Reverse transcription polymerase chain reaction» RTG Rétrocontrôle tubuloglomérulaire
RVD «Regulatory volume decrease» RVI «Regulatory volume increase»
SCAMP2 «Secretory carrier membrane protein 2» S.E. «Standard error»
SGK1 «Serum and glucocorticoid-induced kinase type 1» siRNA Petits ARN interférents
SLC «Solute carrier»
SNARE «Soluble N-ethylmaleimide-sensitive factor attachment protein factor» SPAK «Ste20/SPS1-related proline/alanine-rich kinase»
TAL ou TALH «Thick ascending limb of loop of Henle» THP «Tamm-Horsfall protein»
TM Domaine transmembranaire ou «transmembrane domain»
TOT Total
VAMP «Vesicle-associated membrane protein» Vmax Vitesse maximale ou «maximal velocity» WNK «With no lysine (K)»
WNK1 «With no lysine (K) type 1» WNK2 «With no lysine (K) type 2» WNK3 «With no lysine (K) type 3»
WNK3kd «Kinase-dead WNK3» WNK4 «With no lysine (K) type 4»
WT «Wild-type»
Remerciements
J’entamai mon doctorat avec une certaine fébrilité tout en étant consciente de l’exigence qu’une telle entreprise allait solliciter de moi. Ce ne fut pas une balade sur un long fleuve tranquille, car de nombreux défis se sont présentés sur mon chemin. Plusieurs personnes m’ont aidée à m’orienter, chacune d’elles étant une petite boussole indiquant le chemin à prendre pour arriver à bon port. Je suis très reconnaissante du soutient qu’elles m’ont apporté. Un chaleureux merci à mon directeur de recherche Paul Isenring. Tout ce chemin parcouru n’aurait pu être possible sans son appui constant, ses encouragements motivés, ses connaissances étendues et ses justes conseils. Je le remercie de m’avoir épaulée lors des épreuves qui ont parsemé mes recherches : sa grande écoute et son positivisme m’ont permis de continuer. Le développement de mon autonomie et de mes compétences en recherche a certainement été favorisé par la grande liberté qu’il m’octroyait dans la gestion de mes projets, tout en s’assurant de m’aiguiller lorsque nécessaire. Je suis reconnaissante de la confiance et de la considération qu’il m’a accordées tout au long de ces années.
Si je suis en mesure de terminer cette thèse, c’est également grâce à des collègues qui se sont succédé au fil des ans et pour qui j’ai une grande affection. Ceux-ci ont grandement contribué à l’atmosphère agréable au laboratoire où régnait une véritable cohésion. Un sincère merci à ma collègue et amie Rachelle Frenette-Cotton. Sa présence rassurante, ses opinions fondées que j’ai toujours considérées, son entrain contagieux et son souci du bien-être des gens qui l’entourent m’ont motivée quotidiennement. Bien des problèmes se sont dénoués grâce à son expertise. Merci à Samira Slimani pour nos discussions engagées, son enthousiasme absolu envers ce que je lui proposais, sa générosité sans borne et son grand don de soi. Je remercie aussi Micheline Noël pour sa disponibilité, son entraide et son rire communicatif. J’ai beaucoup appris grâce à elle et j’espère m’être imprégnée de sa rigueur scientifique sans faille. Merci également à Alexandre Garneau pour tous les bons moments que nous avons partagés et pour son entraide. Je tiens également à remercier Mariève Jacob-Wagner pour notre amitié sincère qui perdure et Laurence Tremblay pour son amabilité. Merci enfin à tous les autres collègues qui m’ont offert temps et expertise.
Merci à ma famille et amis : savoir qu’une porte m’est toujours ouverte est d’un grand réconfort. Merci à mes parents Yvette et Louis qui m’ont toujours témoigné leur fierté, qui ont su être présents et qui m’ont accompagnée de mille façons depuis tellement d’années. Merci à ma sœur Catherine pour m’avoir permis de m’échapper dans son univers et de m’énergiser au contact de mes neveux. Un merci spécial à Iskra, qui a été une inspiration par sa persévérance dans son parcours universitaire et professionnel et qui m’a toujours offert un soutien indéfectible, à Thérèse pour notre amitié que je chéris et nos escapades plein air revigorantes, à Emmanuelle dont le positivisme me rend toujours joyeuse et pour sa grande écoute active, et à Natacha qui enrichit ma vie et qui m’inspire à toujours me dépasser. Merci aussi à tous mes autres amis de faire partie de ma vie.
Je suis reconnaissante envers la Faculté de Médecine et la Société québécoise d’hypertension artérielle pour leur soutien financier vital qui est tombé juste à point dans mon parcours. Je remercie aussi les membres du personnel du centre de recherche qui font des pieds et des mains pour nous aider et ce, toujours avec le sourire !
Avant-propos
Durant mes études de maîtrise, que j’ai réalisées dans le même laboratoire, j’ai exploré l’effet de plusieurs kinases WNK sur les variants de NKCC2. Nous cherchions surtout alors à déterminer si les variants réagissaient de la même façon aux enzymes. Nous avions également produit quelques mutants chez lesquels des résidus divergents de l’exon 4 étaient intervertis entre les variants. Nous avions observé que la mutation Y238V insérée chez NKCC2B et WNK3 augmentaient tous deux l’expression de ce variant, mais ces expériences demeuraient au stade préliminaire. Bien que mon projet de doctorat ait pris forme suite à ces travaux, tous les résultats présentés dans cette thèse sont originaux et ont été produits durant mon parcours au doctorat.
Au début de mon doctorat, j’ai produit de nombreux mutants NKCC2 pour tenter d’identifier les résidus qui sous-tendaient la réponse de NKCC2 à l’activation par les kinases WNK. Durant ces expériences, j’ai aussi remarqué que certains variants de type sauvage étaient plus exprimés en réponse au stress hypertonique. C’est ainsi que j’ai aussi décidé d’investiguer l’effet du stress hypertonique sur les variants de type sauvage et d’évaluer la contribution de la cascade WNK-SPAK/OSR1 dans ce contexte.
Les études présentées dans cette thèse sont le fruit de cinq années de recherche. Ces travaux m’ont permis de réaliser deux articles en tant que première auteure qui feront l’objet des chapitres 1 et 2. Au chapitre 1, mes travaux sur la régulation des variants de NKCC2 par la voie WNK-SPAK/OSR1 en réponse à l’hypertonicité ont été publiés dans la revue American
Journal of Physiology-Cell Physiology le 27 mars 2019. Au chapitre 2, la caractérisation de
certains résidus ayant un effet sur le trafic cellulaire de NKCC2 a mené à une deuxième publication qui a été soumise à Journal of Physiology le 26 mars 2019.
En parallèle de mon sujet de doctorat, j’ai eu la chance de participer à d’autres projets stimulants, tels que des revues de littérature et des études basées sur des cas cliniques en plus d’avoir participé aux recherches de mes collègues. Comme les sujets de ces projets divergent du sujet principal de ma thèse, ils ne seront pas traités ici.
Parmi les publications auxquelles j’ai collaboré, trois correspondaient à des revues de littérature sur les cotransporteurs K-Cl et deux à des travaux originaux dans d’autres domaines que celui de la famille des cotransporteurs cation-chlore. L’une de celles-ci portait sur l’effet d’une mutation dans le gène INVS identifiée chez un patient du Dr Isenring. Ce manuscrit sera soumis pour publication dans les prochaines semaines. Ma contribution spécifique à ces articles est détaillée ci-dessous. La contribution des coauteurs des articles faisant l’objet des chapitres 1 et 2 sera aussi décrite en avant-propos.
Publications acceptées en tant que première auteure
Marcoux, A. A., Slimani, S., Tremblay, L. E., Frenette-Cotton, R., Garneau, A. P., & Isenring, P. (2019). Regulation of Na-K-Cl cotransporter type2 by the with no lysine kinase-dependent signaling pathway. Am J Physiol-Cell Physiol.
Ma contribution : Cet article fait l’objet du chapitre 1. J’ai réalisé la totalité des expériences, créé toutes les figures et participé de près à la rédaction et la révision du manuscrit.
Marcoux, A. A., Garneau, A. P., Frenette-Cotton, R., Slimani, S., Mac-Way, F., & Isenring, P. (2017). Molecular features and physiological roles of K(+)-Cl(-) cotransporter 4 (KCC4). Biochim Biophys Acta Gen Subj, 1861(12), 3154-3166.
doi:10.1016/j.bbagen.2017.09.007
Ma contribution: Dans cette revue de littérature sur KCC4, j’ai recueilli les données néssaires à l’élaboration de la figure 2, que j’ai également produite. J’ai également participé à la rédaction et la révision du manuscrit.
Marcoux, A. A., Garneau, A.P., Isenring, P. (2019). A "double hit" model of cystic kidney disease. To be published in: Kidney International April 19. KINT_1351.
Ma contribution : Cet article décrit un cas clinique de Dr Isenring. J’ai participé à la rédaction et la révision du manuscrit.
Manuscrit soumis en tant que première auteure
Marcoux, A. A., Slimani, S., Tremblay, L. E., Frenette-Cotton, R., Garneau, A. P., & Isenring, P. (2019). Endocytic recycling of Na-K-Cl cotransporter type 2: importance of exon 4. Soumis à Journal of Physiology le 26 mars 2019.
Ma contribution : Cet article fait l’objet du chapitre 2. J’ai généré tous les mutans, réalisé la totalité des expériences, créé toutes les figures et activement participé à la rédaction et la révision du manuscrit.
Manuscrit en préparation en tant que première auteure
Marcoux, A. A., Garneau, A.P., Fiola, M.-J., Rousseau-Gagnon, M., Isenring, P. (2019). Monoallelic mutations in nephronophtisis-associated genes: a cause of polycystic kidney disease in the elderly.
Ma contribution : Le sujet de ce manuscrit est la caractérisation d’une mutation pathogénique identifiée dans le gène INVS chez un patient souffrant des kystes rénaux. À partir d’un échantillon de sang du patient, j’ai isolé l’ARN, produit l’ADN complémentaire et amplifié par PCR la séquence d’intérêt. J’ai réalisé la totalité des expériences de cet article, créé la figure 4 et participé de près à la rédaction du manuscrit.
Publications en tant que coauteure
Garneau, A. P., Marcoux, A. A., Slimani, S., Tremblay, L. E., Frenette-Cotton, R., Mac-Way, F., & Isenring, P. (2019). Physiological roles and molecular mechanisms of K(+) -Cl(-) cotransport in the mammalian kidney and cardiovascular system: where are we? J Physiol. doi:10.1113/JP276807
Ma contribution: Dans cette revue de littérature sur le rôles des KCC dans le rein et le système cardiovasculaire, j’ai recueilli les données néssaires à la confection et la production du tableau 1. J’ai également participé à la rédaction du manuscrit ainsi qu’à la révision de l’épreuve finale.
Frenette-Cotton, R., Marcoux, A. A., Garneau, A. P., Noel, M., & Isenring, P. (2018). Phosphoregulation of K(+) -Cl(-) cotransporters during cell swelling: Novel insights. J Cell Physiol, 233(1), 396-408. doi:10.1002/jcp.25899
Ma contribution: Dans cet article, j’ai participé aux études d’expression de surface présentées à la figure 8 et à la révision du manuscrit.
Garneau, A. P., Marcoux, A. A., Frenette-Cotton, R., Mac-Way, F., Lavoie, J. L., & Isenring, P. (2017). Molecular insights into the normal operation, regulation, and multisystemic roles of K(+)-Cl(-) cotransporter 3 (KCC3). Am J Physiol Cell
Physiol, 313(5), C516-C532. doi:10.1152/ajpcell.00106.2017
Ma contribution: Dans cette revue de littérature sur KCC3, j’ai généré la figure 2 et j’ai révisé le manuscrit.
Introduction
L’hypertension artérielle est un facteur de risque majeur dans le développement de maladies cardiovasculaires. L’inhibition par certains diurétiques du cotransporteur Na-K-Cl de type 2 (NKCC2), une protéine retrouvée dans le rein, est un moyen utilisé en clinique pour diminuer le volume circulant et traiter certaines formes d’hypertension artérielle. NKCC2 est régulé par la famille de kinases with no lysine (WNK), mais les mécanismes moléculaires qui entraînent une modification du cotransport Na-K-Cl sont peu définis. De plus, NKCC2 existe sous la forme de trois variants d’épissage dont on ne connaît pas les rôles individuels parfaitement. Mon projet de doctorat porte ainsi sur la régulation de ce transporteur par la voie des kinases WNK et vise aussi à déterminer si les mécanismes en jeu affectent les variants de manière différente.
1. Membrane cellulaire
La membrane cellulaire, structure fondamentale de chaque cellule, est constituée d’une bicouche de lipides comprenant une tête hydrophile et une queue hydrophobe. Elle permet de singulariser les composants chimiques d’une cellule. L’entrée et le rejet contrôlés de substances par la cellule sont des mécanismes essentiels à sa régulation, à sa fonction et à sa survie. La membrane cellulaire permet aussi l’établissement de gradients ioniques. Par exemple, le milieu intracellulaire d’une cellule typique de mammifère est pauvre en sodium (Na) et riche en potassium (K). La perméabilité de la membrane cellulaire à différentes molécules est illustrée à la figure 1.1.
2. Régulation du volume cellulaire
Chaque type cellulaire a un volume qui lui est propre et qui est maintenu tout au long de son cycle de vie en ne permettant que de légères variations. La plupart des cellules des organismes terrestres ne sont pas soumises à des changements importants de l’osmolalité du milieu extracellulaire. Il y a des exceptions toutefois puisque certains types de cellules dans l’épithélium intestinal et rénal sont exposés à de tels changements à travers la diète et le mécanisme de la concentration urinaire.
Figure 1.1 Perméabilité de la membrane cellulaire. Les gaz et les petites molécules polaires non chargées diffusent au travers de la membrane facilement alors que les grosses molécules et les molécules chargées diffusent beaucoup plus difficilement. Pour ces cellules, des mécanismes de régulation permettant l’entrée ou la sortie d’eau se sont développés pour maintenir l’équilibre osmotique. La sortie d’eau d’une cellule gonflée en milieu hypotonique se nomme regulatory volume decrease (RVD) et l’entrée d’eau d’une cellule rétrécie par le milieu hypertonique est le regulatory volume increase (RVI) (216, 365). Le mouvement de l’eau est déterminé par le mouvement des solutés appelés osmolytes dont les principaux sont les ions Na+, K+ et Cl, les polyalcools, l’urée (pour certains types de cellules), la créatinine et les osmolytes organiques (70, 142, 283, 410). La rentrée ou sortie cellulaire d’osmolytes non-organiques permet de réguler le volume cellulaire rapidement, mais certains d’entre eux peuvent être dommageables pour le métabolisme de la cellule à plus long terme. Les osmolytes organiques, quant à eux, peuvent s’accumuler sans altérer les fonctions cellulaires et soutiennent la cellule soumise à un stress osmotique de plus longue durée.
Les petites molécules hydrophobes comme les gaz et les petites molécules polaires non chargées s’insèrent entre les lipides et traversent la bicouche par diffusion. Les plus grosses molécules, tels les glucides et les acides aminés, de même que les ions ne peuvent traverser la membrane sans être pris en charge par des protéines de transport.
3. Transport membranaire
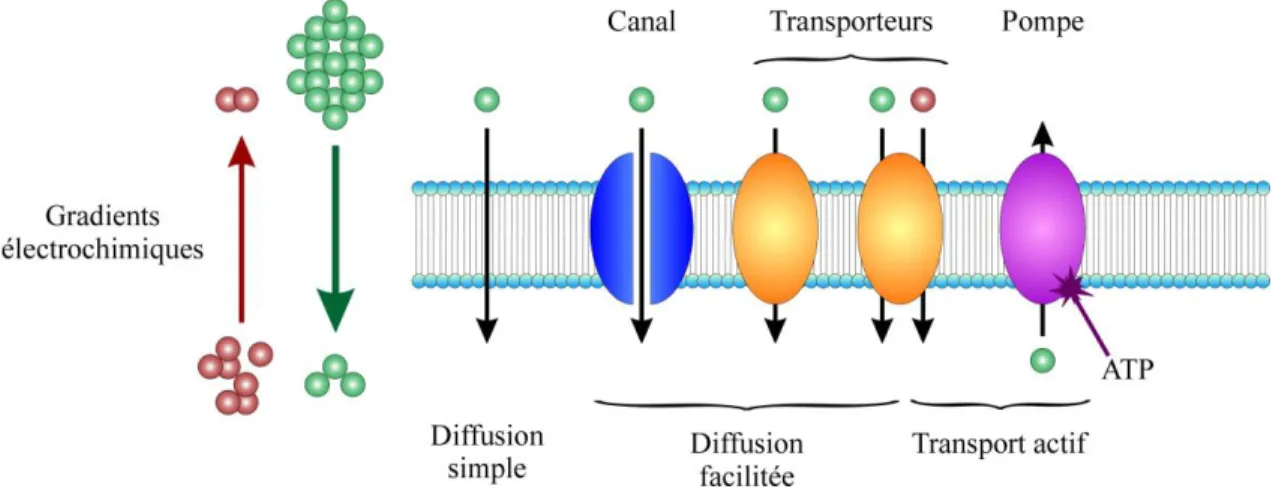
Comme illustré à la figure 1.1, certaines molécules peuvent traverser la bicouche lipidique par diffusion alors que d’autres ont besoin de protéines de transport spécialisées. Ces protéines de transport spécialisées existent sous trois formes : les canaux, les transporteurs en tant que tels et les pompes. Elles sont schématisées à la figure 1.2.
Figure 1.2. Les types de transport membranaire. Dans le cas du cotransporteur (ovale orange de droite), la molécule verte est transportée par diffusion facilitée et la molécule rouge par transport actif secondaire puisque le gradient électrochimique net de ces molécules est dicté par la molécule verte.
Le premier type, les canaux, permettent la diffusion facilitée en fonction du gradient électrochimique du substrat transporté. L’ouverture et la fermeture d’un canal sont déclenchées par des stimuli qui peuvent être électriques, chimiques ou mécaniques. Certains canaux peuvent être ouverts en permanence. Dans tout canal, il y a un pore dont le diamètre et les charges électrostatiques permettent de sélectionner un substrat précis et de le laisser passer rapidement à raison de 106 à 107 molécules par seconde.
Viennent ensuite les transporteurs en tant que tels qui utilisent également le gradient d’une molécule pour la faire voyager. N’ayant pas de pore apparent, le passage des molécules nécessite un changement conformationnel. La vitesse de transport est ainsi plus lente que dans un canal, soit environ 104 à 105 molécules par seconde. Parmi ce type de transporteurs, on retrouve la catégorie des cotransporteurs qui utilisent le gradient d’une ou de plusieurs molécules pour en transporter une autre contre son gradient. Ce type de mouvement contre gradient est aussi appelé transport actif secondaire.
Les pompes, elles, utilisent de l’ATP pour transporter toutes les molécules contre leur gradient électrochimique. Ce type de mouvement est aussi appelé transport actif primaire et permet de laisser passer environ 102 à 103 molécules par seconde.
4. Le rein
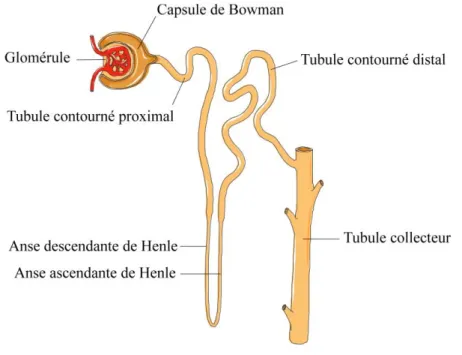
Le rein participe au maintien de l’équilibre osmotique et de la pression artérielle dans l’organisme puisqu’il régule la quantité d’eau et d’ions qui s’y retrouve. Le néphron, son unité fonctionnelle, est illustré à la figure 1.3. Il est constitué du corpuscule rénal qui comprend le glomérule entouré de la capsule de Bowman, et d’un long tubule multi-segmenté qui réabsorbe ou sécrète de petites molécules.
Figure 1.3. Le néphron. La filtration du sang s’effectue à la frontière du glomérule et de la capsule de Bowman. Le filtrat parcourt les différents segments du tubule où ses composantes sont réabsorbées. Adapté de Servier Medical Art.
Le sang est d’abord filtré de manière non sélective par les capillaires glomérulaires. Le produit de filtration, aussi appelé ultrafiltrat, est ensuite acheminé dans le tubule contourné proximal où une grande proportion des sels, des acides aminés et des glucides qui s’y retrouvent est réabsorbée. L’ultrafiltrat continue dans la partie descendante de l’anse de Henle où l’eau est réabsorbée sans les ions, ce qui établit un fort gradient osmotique dans la partie profonde du rein, nommée la médullaire. Dans la portion ascendante de l’anse de Henle, les ions sont ensuite réabsorbés sans eau, ce qui permet
de diluer les urines. À la fin de l’anse de Henle se retrouvent les cellules de la macula densa qui détectent la concentration de NaCl et en informent le glomérule de manière à ce que la filtration s’ajuste au flot tubulaire en aval (28, 214, 341). Ce processus se nomme le rétrocontrôle tubuloglomérulaire et sera décrit à la section 5.9.7.2. Le filtrat passe finalement dans le tubule contourné distal puis le tubule collecteur avant d’être acheminé dans le bassinet. Ces derniers segments sont sensibles à la vasopressine, une hormone qui permet la réabsorption d’eau.
5. La famille des cotransporteurs cation-chlore
Les transporteurs en tant que tels sont aujourd’hui nommés solute carrier (SLC). Chez les animaux, on en compte au moins 400 qui sont regroupés en plus de 50 familles (305). Les molécules transportées par ces protéines sont très variées et n’incluent pas que des ions, mais aussi des molécules organiques chargées et des gaz pour ne nommer que ceux-ci. Le cotransporteur NKCC2, celui qui est au centre de mes travaux, fait partie de la famille des cotransporteurs électroneutres cation-Cl, une famille qui est appelée SLC12A et qui comprend 9 membres. Parmi ceux-ci, plusieurs sont impliqués dans la régulation du volume circulant et influencent donc la pression artérielle.
5.1. Découverte du premier cotransporteur cation-chlore et des autres membres de cette famille
La séquence protéique du premier cotransporteur cation-Cl (CCC) a été identifiée durant les années quatre-vingt. Ce CCC correspondait au cotransporteur Na+-Cl (NCC; SLC12A3) qui a d’abord été cloné de la vessie de la plie rouge (Pseudopleuronectes americanus) puis du rein de rat (115, 116). Plus tard, c’est la séquence du cotransporteur Na+-K+-Cl de type 1 (NKCC1; SLC12A2) qui a été identifiée à partir de la glande rectale de requin (Squalus acanthias) (427) et le cotransporteur Na+-K+-Cl de type 2 à partir du rein de souris, de lapin et de rat (115, 173, 298).
La séquence protéique de deux autres CCC, les cotransporteurs K+-Cl (KCC1 et KCC2), a ensuite été identifiée durant les années quatre-vingt-dix chez le rat, l’humain et le lapin (125, 165, 300, 304). Quelques années plus tard, la séquence de deux autres KCC, KCC3
et KCC4, a été identifiée chez l’humain dans le tissu musculaire, le placenta, le rein et une banque de cellules endothéliales de veine ombilicale, et dans le rein de souris (161, 267, 317).
On sait aujourd’hui que la famille des CCC compte deux autres membres, CCC8 et CCC9, qui pourraient être impliqués non pas dans le transport d’ions, mais de polyamines et d’acides aminés (48, 74, 114). Toutefois, le rôle de ces CCC demeure incertain (154). 5.2. Structure
Selon des analyses d’hydrophobicité, tous les CCC transporteurs d’ions seraient composés de 12 segments transmembranaires (TM) et de segments carboxyle-terminal (C-terminal) et amino-terminal (N-terminal) intracellulaires (123, 124, 210, 300). Ce modèle est illustré à la figure 1.4. Plusieurs sites de phosphorylation ont été identifiés dans les segments C-terminal et N-terminal, supportant leur localisation intracellulaire (127, 230, 257, 327, 333, 409). Des sites de glycosylation ont aussi été identifiés aux sites prédits par des analyses in silico (168, 290, 292, 413).
Figure 1.4. Modèle hydropathique d’un membre de la famille des CCC. Modèle proposé par Biff Forbush (Université de Yale) pour NKCC2 selon l’analyse d’hydrophobicité de la séquence d’acides aminés (210). La bande grise correspond à la membrane cellulaire traversée par 12 segments transmembranaires. Les portions N-terminal et C-N-terminal sont dans le cytosol. Les sites de glycosylation sont représentés par des lignes en forme d’arbre sur la quatrième boucle extracellulaire.
Les TM putatifs sont bien conservés parmi les CCC : les NKCC et NCC partagent de 59 à 79 % d’homologie dans ces régions et les KCC de 72 à 80 % (114, 119, 174, 237, 359). Ces domaines sont notamment impliqués dans la translocation des ions et la liaison aux diurétiques (174, 175, 359). Les portions C-terminal sont assez bien conservées entre les CCC, mais les queues N-terminal le sont beaucoup moins (114). Ces autres domaines jouent plutôt un rôle dans la régulation de l’expression membranaire, dans l’adressage subcellulaire de la protéine et dans son assemblage (46, 209, 219, 333, 354, 355, 443, 450).
Les CCC fonctionnent probablement en homodimères. Les sites d’interaction se retrouvent non seulement dans les queues C-terminal, mais aussi dans les TM11 et 12 (40, 56, 57, 294, 354, 355). La structure des CCC n’a pas encore été déterminée par cristallographie. Cependant, une cristallographie de la partie C-terminal d’un ancêtre archéen des CCC a été obtenue (407).
5.3. Fonction
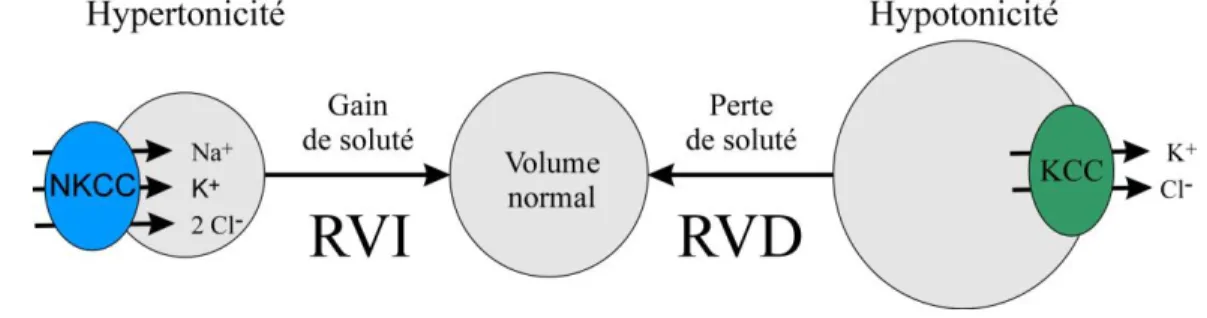
La plupart des membres de la famille des CCC permettent le mouvement vectoriel des électrolytes au travers des épithélia et assurent l’homéostasie du Cl− intracellulaire (Cl−i). Ils couplent tous obligatoirement le transport d’un cation, Na+ et/ou K+, avec un ou deux anions Cl−. Le transport est électroneutre puisque le même nombre de cation(s) et d’anion(s) est transporté. Ainsi, les CCC ne transfèrent pas de charges directement. Les NKCC et KCC répondent inversement aux changements de volume cellulaire et de la concentration de Cli ([Cl−]i). En effet, les NKCC sont activés par un rétrécissement du volume cellulaire et une diminution de la [Cl−]i – ils sont ainsi impliqués dans le RVI – alors que les KCC sont activés par un gonflement cellulaire et par une augmentation de la [Cl−]i – ils sont ainsi impliqués dans le RVD (6, 163). Ce processus, permettant la régulation du volume cellulaire et de la [Cl−]i en réponse à différentes conditions, est illustré à la figure 1.5.
Dans le rein, les CCC jouent un rôle essentiel dans la réabsorption des sels et, de cette façon, dans le maintien de la pression artérielle. De plus, les CCC permettent la régulation du pH puisque l’ammonium (NH4+) peut substituer l’ion K+ au site de liaison de tous les
KCC et les NKCC (32, 98, 119, 226, 415). Dans le cas de KCC4, par exemple, cette substitution permet la sécrétion de NH3 dans le tubule collecteur pour l’acidification distale (32).
Figure 1.5. Les CCC régulent le volume cellulaire suite à un stress osmotique. RVI,
regulatory volume increase; RVD, regulatory volume decrease.
5.4. Régulation
La régulation des CCC se fait entre autres par phosphorylation et déphosphorylation des extrémités. La phosphorylation active les N(K)CC alors qu’elle inhibe les KCC. Les kinases WNK, Ste20/SPS1-related proline/Alanine-rich kinase (SPAK) et oxidative
stress-response kinase 1 (OSR1) forment l’une des voies principales qui permettent cette
régulation. Leurs rôles seront décrits plus en détail à la section 6.2.
Plusieurs hormones circulantes influencent l’activité des CCC. Elles incluent l’angiotensine II (AngII) (51, 337, 338, 386), l’hormone parathyroïdienne (PTH) (169, 201), la vasopressine (129, 273, 302), l’aldostérone (1, 183, 198, 389), la norépinéphrine (268, 400), l’insuline (58, 369, 382), le glucagon et la calcitonine (19, 143). L’uromoduline, une glycoprotéine sécrétée exclusivement dans l’anse ascendante large de Henle, régule l’absorption des sels dans le néphron (272, 380). Il est possible que plusieurs de ces hormones exercent leurs effets en phosphorylant ou déphosphorylant les CCC. Les mécanismes en jeu demeurent toutefois largement inconnus.
Pour terminer, il a été montré que d’autres facteurs comme la température, le pH intracellulaire et la pression intracellulaire d’oxygène modulent l’activité de certains CCC (32, 197, 293, 444). Encore une fois, les mécanismes en jeu sont inconnus.
5.5. KCC
Les cotransporteurs K+-Cl− sont impliqués dans la régulation du volume cellulaire, de la concentration de K+ et de Cl− à l’intérieur et à l’extérieur de la cellule, de la réabsorption transépithéliale du NaCl et de la sécrétion rénale de NH3 (23, 96, 114, 138, 296, 418). Ils sont aussi exprimés dans nombre de tissus.
La stœchiométrie de transport proposée est 1K+ :1Cl−, mais il est possible que plusieurs sites de liaison soient présents (119, 181, 217, 237). En condition physiologique, les KCC se retrouvent du côté basolatéral des cellules polarisées et transportent les ions vers l’extérieur de la cellule (248). Ils sont activés par le gonflement cellulaire et la déphosphorylation de certains sites, et sont inhibés par une faible [Cl−]i (6, 106, 126, 144, 233, 250, 267, 327).
Le groupe des KCC comprend 4 isoformes, KCC1 à KCC4. Ces protéines ont été découvertes grâce au criblage de banques EST en se servant des séquences connues des NKCC. Elles sont très homologues les unes par rapport aux autres, mais remplissent néanmoins de rôles différents et ne retrouvent pas toutes dans les mêmes tissus.
KCC1 est largement distribué dans l’organisme et sa fonction principale est sans doute de réguler le volume cellulaire (125). Toutefois, il jouerait aussi un rôle dans le développement de l’anémie falciforme et la sécrétion de protons par les ostéoclastes (39, 191).
KCC2 se retrouve surtout dans le système nerveux central et est impliqué dans la réponse neuronale par son effet sur le gradient de Cl (172, 229, 300, 331). Il a été associé chez l’humain à certaines formes d’épilepsie et correspondrait à une cible d’intérêt pour le traitement de la douleur (88, 200).
KCC3 est exprimé dans plusieurs tissus dont le tubule proximal du rein où il pourrait faciliter la translocation du K+ et Cl− vers le sang (119, 161, 267, 317). Chez l’humain, KCC3 est responsable du syndrome d’Anderman, un désordre neurodégénératif héréditaire récessif (92, 170). Il jouerait lui aussi un rôle dans le développement de l’anémie falciforme (336).
KCC4 est exprimé de façon importante dans les muscles, le cerveau, les poumons, l’estomac, le cœur et le rein (237, 267). Une particularité de KCC4 est qu’il peut se retrouver du côté apical dans de rares tissus (107, 196). KCC4 jouerait un rôle important dans l’acidification rénale distale et pourrait être impliqué dans la sécrétion de protons par la cellule pariétale gastrique (35, 108, 247).
5.6. NCC
Le cotransporteur Na+-Cl− se retrouve dans le tubule contourné distal où il joue un rôle important dans la réabsorption des sels et la régulation de la pression artérielle. Il influence aussi indirectement la sécrétion de K+ et de H+ par le tubule collecteur et la sécrétion de Ca+2 par le tubule distal (115, 345, 391).
NCC est la cible des diurétiques thiazidiques utilisés pour traiter l’hypertension (72, 357). Des mutations perte de fonction causent le syndrome de Gitelman, une maladie autosomale récessive caractérisée par une hypokaliémie et une alcalose métabolique (357, 383, 387). Plusieurs modèles murins reproduisent le phénotype du syndrome (265, 345, 434).
NCC est aussi régulé par la cascade WNK-SPAK/OSR1. Des mutations retrouvées chez les gènes codant pour WNK1 et WNK4 ont été associées au pseudohypoaldostéronisme de type II (PHAII) par augmentation de l’activité de NCC. Cette maladie, image miroir du syndrome de Gitelman, est traitée par l’administration de diurétiques thiazidiques (137, 241). De manière intéressante, la mutation T60M, retrouvée chez certains des individus atteints, correspond à un site phosphorylé par SPAK/OSR1 (323).
La phosphorylation de quelques résidus augmenterait l’expression de NCC à la surface cellulaire (273, 333, 434, 435). En outre, la phosphorylation de T53, T58 et S71 exercerait cet effet via la diminution de l’endocytose par la voie des clathrines (333). Toutefois, ces observations n’ont pas été corroborées par certaines études (131, 290).
5.7. NKCC
Le groupe formé par les cotransporteurs Na+-K+-Cl comprend deux isoformes, NKCC1 et NKCC2. Dans les cellules polarisées, NKCC1 se retrouve du côté basolatéral alors que
NKCC2 est situé du côté apical. La distribution respective de ces isoformes sera discutée plus loin.
La stœchiométrie de transport par les NKCC serait de 1Na+-1K+-2Cl (147, 299). Toutefois, elle pourrait différer selon les espèces ou certaines conditions. Par exemple, un transport 2Na+-K+-3Cl a été observé chez l’axone de calamar et chez le globule rouge de furet (150, 237, 335).
Les NKCC sont activés par le rétrécissement cellulaire et une faible [Cl]i. Ils sont aussi régulés par la cascade WNK-SPAK/OSR1. Ce sujet sera aussi discuté plus en détail ci-dessous.
Les NKCC fonctionnent en monomères et en dimères grâce à des séquences d’interaction dans la queue C-terminal (40, 355, 364). Ils pourraient aussi former des hétérodimères avec plusieurs membres de la famille des KCC. Toutefois, la pertinence physiologique de ces structures n’a pas été encore démontrée.
Une caractéristique qui différencie les NKCC est leur habilité à transporter l’eau. En effet, NKCC1 transporte environ 460 molécules d’eau par cycle de transport alors qu’aucun mouvement d’eau n’est observé pour NKCC2 (447). Le modèle du Brownian pistol, proposé par Choe et al. (65) pour le cotransporteur sodium-glucose de type 1, pourrait expliquer cette différence. En somme, la voie de sortie des ions serait plus large chez NKCC2 que chez NKCC1 et en conséquence, les molécules d’eau accompagnant les ions glisseraient autour de ceux-ci plutôt que d’être poussés dans la pochette de translocation. 5.8. NKCC1
Le cotransporteur Na+-K+-Cl− de type I, NKCC1, est largement exprimé dans l’organisme où il est impliqué dans la régulation du volume cellulaire et de la [Cl−]i (148, 235, 427). De par sa localisation basolatérale dans plusieurs épithélia, il permet aussi la sécrétion de fluides par les bronches et les glandes salivaires, sudoripares, lacrymales et pancréatiques.
En engendrant l’accumulation de Cl−i, NKCC1 influence entre autres le potentiel de membrane, l’activation des canaux Ca2+ dépendants du voltage et plusieurs autres
systèmes de transport. Ce faisant, il est impliqué dans plusieurs fonctions telles la contraction des cellules musculaires lisses, modulant ainsi la résistance périphérique (286), l’odorat, la neurogénèse des neurones sensoriels olfactifs (149), le cancer (122, 146), l’ischémie et l’œdème cérébral (179, 180), la digestion (101, 245) et l’ouïe (86, 101, 289).
Il existe quelques variants d’épissage de NKCC1 (264, 320, 392). NKCC1A est le variant qui est le plus largement distribué et qui a été le plus étudié. NKCC1B, ne possédant pas l’exon 21, est exprimé majoritairement dans le cerveau et serait impliqué dans le développement de la schizophrénie (264).
Dans le rein, NKCC1 est exprimé de manière prépondérante au tubule colleteur sans qu’aucun rôle particulier dans la physiologie tubulaire ne lui soit attribué (225). Toutefois, il est exprimé dans l’artériole afférente rénale où il pourrait supprimer la sécrétion de rénine, tel que suggéré par des études sur des souris inactivées pour NKCC1 (NKCC1−/−) (53, 194). Lorsque soumises à une diète pauvre en sel, ces souris ont aussi une pression artérielle abaissée causée par la diminution du tonus vasculaire (199, 253). Des études de chimères dans lesquelles les portions C-terminal et N-terminal sont interchangées entre NKCC1 humain et de requin ont montré que le cœur formé par les segments transmembranaires est responsable du mouvement des ions (175). Des études de mutagénèse dirigée ont par la suite identifié que les TM2, 4 et 7 semblent impliqués et formeraient, du moins en partie, la pochette de translocation (176). Enfin, il est suggéré que la première boucle intracellulaire, le TM2 et la deuxième boucle extracellulaire contribuent à la sensibilité osmotique (112).
Dans la partie N-terminal, le résidu T189 correspond à un site de phosphorylation conservé et il est critique à l’activation de NKCC1 (76). Des analyses de transfert d’énergie entre molécules fluorescentes (FRET) ont montré que la phosphorylation de la portion N-terminal provoque un changement conformationnel qui modifie l’interaction entre ce segment, les TM10 et 12 et la queue C-terminal (257, 259, 301). Un site de liaison pour la phosphatase 1 (PP1) a aussi été identifié dans la queue N-terminal (75). Récemment, une mutation gain de fonction chez NKCC1 a été découverte chez un patient
atteint de schizophrénie (252). Une mutation perte de fonction a aussi été identifiée chez une patiente présentant un phénotype multiple et complexe. Cette mutation correspond à une délétion de 11 pb dans un allèle de NKCC1 et entraîne une protéine tronquée qui ne permet plus le maintien d’un gradient de Cl−
normal à la membrane plasmique des cellules musculaires lisses (87).
5.9. NKCC2
5.9.1. Distribution
Le cotransporteur Na+-K+-Cl− de type 2, NKCC2, est exprimé dans le rein à l’AAH de façon prépondérante (195, 278). Quelques études faites chez les rongeurs laissent entendre que NKCC2 pourrait se retrouver ailleurs dans l’organisme en faible quantité. Des études de RT-PCR, d’immunohistochimie et d’hybridation in situ ont en effet montré la présence de NKCC2 dans le sac endolymphatique de l’oreille interne (7, 8, 192) et dans les neurones de rat (205). NKCC2 pourrait aussi se retrouver chez la souris, selon des analyses de type western, de RT-PCR et d’immunohistochimie, dans les cellules β-pancréatiques (11, 12) et le colon (429, 430). D’autres investigations sont nécessaires pour confirmer la distribution de NKCC2 en dehors du rein et pour élucider son rôle dans ces tissus.
5.9.2. Structure
NKCC2 est codé par le gène SLC12A1 situé sur le chromosome 15 chez l’humain et comprend 26 exons (356). La protéine produite inclut de 1095 à 1099 acides aminés pour un poids moléculaire d’environ 121 kilodaltons (kDa) (115, 173, 298). Comme mentionné à la section 5.2 et illustré à la figure 1.4, NKCC2 est formé de 12 segments transmembranaires et de longs segments intracellulaires en N-terminal et C-terminal. Deux sites glycosylés se retrouvent sur la boucle extracellulaire située entre les TM7 et 8 (N442 et N452). Ils augmentent le poids moléculaire de la protéine à 160 kDa environ (173, 266, 298) et favorisent l’expression du transporteur à la membrane cellulaire (29, 292). Plusieurs sites consensus sont prédits pour les protéines kinases A (PKA), les protéines kinases C (PKC), les protéines kinases G (PKG) et les kinases de la famille des caséines entre autres (42, 111, 298).
5.9.3. N-terminal
La queue N-terminal comprend 170 acides aminés et contient les sites de phosphorylation essentiels impliqués dans la régulation de l’activité de la protéine. Bien que NKCC1 possède un site ciblé par la phosphatase PP1 dans ce segment de la protéine, il n’y en a aucun pour NKCC2. Cependant, une autre phosphatase, la calcineurine, semble impliquée dans la régulation de cet isoforme selon des études in vivo et in vitro (33, 36).
5.9.4. C-terminal
La section C-terminal est composée de 470 acides aminés et contient des résidus et des séquences importants pour la maturation, l’expulsion du réticulum endoplasmique (RE), la signalisation, l’assemblage homodimérique et la livraison à la surface de NKCC2. Par exemple, les motifs 1081LLV1083, 1038LL1039 et 1048LI1049, lesquels sont très conservés parmi les CCC, contrôlent le taux d’expulsion de la protéine du RE et sont impliqués dans sa glycosylation. Ils modulent donc l’expression de NKCC2 à la surface cellulaire (442, 443).
Beaucoup de mutations provoquant le syndrome de Bartter, qui sera décrit à la section 5.10.1, sont localisées dans la portion C-terminal, ce qui souligne l’importance de ce domaine protéique dans la fonction de NKCC2 (4, 313, 363, 388). Bien que plusieurs sites de phosphorylation y soient prédits, peu d’entre eux ont été confirmés expérimentalement à ce jour (143).
5.9.5. Variants d’épissage
Le clonage de NKCC2 a permis l’identification de variants d’épissage (173, 298, 388, 436). De fait, l’exon 4 existe sous trois formes (nommées 4A, 4B et 4F) qui peuvent être incluses dans la protéine de manière alternative pour générer les variants NKCC2A, NKCC2B et NKCC2F. Il encode la majeure partie du TM2 et une portion de la boucle intracellulaire suivante (CS2). Il est aussi composé de 32 acides aminés dont 13 ne sont pas conservés parmi les variants (voir figure 1.6). NKCC2 peut aussi être formé des exons 4A et 4F en tandem, mais ce variant ne transporte pas les ions (40, 111, 151, 436). Les variants NKCCA, NKCC2B et NKCC2F sont distribués de manière différentielle
dans l’AAH. Cette distribution se fait comme suit : NKCC2F se retrouve dans la couche interne de la médullaire externe, NKCC2A est exprimé majoritairement dans la couche externe de la médullaire externe et faiblement dans le cortex et NKCC2B se retrouve dans le cortex dans la région de la macula densa (173, 284, 285, 298, 436).
Figure 1.6. Alignement partiel des exons 4A, 4B et 4F de NKCC2 de lapin. L’exon 4 est formé de 32 acides aminés formant le deuxième segment transmembranaire (TM2) et une partie de la première boucle intracellulaire (CS2). Parmi ces résidus, 13 ne sont pas conservés. Les résidus entourés d’un rectangle sont conservés.
Comme les variants possèdent un segment transmembranaire unique et qu’ils sont compartimentés, il a été suggéré que les caractéristiques de transport de chacun d’eux sont adaptées à une réabsorption optimale du sel le long de l’anse (19, 55, 299). Selon des études dans les ovocytes de X. laevis, les variants ont en effet une affinité apparente pour les ions qui s’approche de la concentration tubulaire des substrats transportés (110, 128, 309). Par exemple, l’affinité pour le Cl− est faible chez NKCC2F (Km ~100-130
mM), elle est intermédiaire dans le cas de NKCC2A (Km ~30 mM) et elle est élevée chez NKCC2B (Km ~10-15 mM). Des études de mutagénèse ont permis de mieux cibler les
résidus conférents des différences d’affinités ioniques entre les variants. Il s’agit des résidus A219, T221, G224, T230, A234 et Y238 selon la séquence de NKCC2B du lapin (128). Parmi ceux-ci, T230 semble être le résidu le plus important pour la détermination de l’affinité pour le Cl−, suivi de A234 et Y238.
Peu de choses sont connues sur la régulation de l’épissage alternatif de NKCC2. Une hypothèse avancée est que les concentrations d’ions le long de l’anse joueraient un rôle. Une étude a montré que l’expression des isoformes est modulée par la diète en NaCl. Une restriction augmente l’expression de NKCC2B et diminue celle de NKCC2A sans toutefois modifier l’expression globale de NKCC2 (340). Comme l’apport alimentaire est corrélé inversement avec l’activation du système rénine-angiotensine et comme
l’AngII augmente l’ARNm de NKCC2 chez le rein de rat selon une étude (437), c’est à travers l’AngII que l’épissage alternatif serait régulé. Bien qu’intéressante, l’hypothèse supportant la régulation de l’épissage alternatif par les concentrations ioniques nécessite d’autres investigations.
5.9.6. Mouvement des ions
Le mécanisme de translocation des ions est peu connu, mais le modèle d’accès par alternance est le plus soutenu par la communauté scientifique. Selon ce modèle, le cotransporteur alterne entre deux conformations. Le transporteur vide (conformation 1) fait d’abord face à la lumière tubulaire et peut donc se lier aux ions. Le transporteur plein bascule ensuite ses sites de liaisons du côté cytosolique (conformation 2) pour relâcher les ions. Dans le cas de NKCC2, les quatre ions se lieraient dans un ordre précis à l’intérieur de la pochette soit Na+-Cl−-K+-Cl− et seraient relâchés dans le même ordre (234, 297).
Se basant sur la structure d’une superfamille de protéines à laquelle appartiennent les CCC et dont certains membres avaient été cristallisés (99, 117, 207, 348), l’équipe de Forbush (359) a généré un modèle tridimensionnel de NKCC1 humain. Les TM1, 3, 6, 8 et 10 ont alors été identifiés comme faisant partie de la voie de translocation qui se formerait par l’étroite interaction entre le résidu M382 du TM3 et le TM6. De plus, les résidus M382 et Y383, tous deux très conservés parmi les CCC et entre les espèces, participeraient également à la barrière extracellulaire. Toujours selon ce modèle, la première boucle intracellulaire formerait une barrière flexible contrôlant la sortie des ions dans le milieu intracellulaire. Le site de liaison du bumétanide se retrouverait quant à lui près de la partie intracellulaire de la pochette de translocation.
5.9.7. Fonctions
5.9.7.1. Réabsorption des ions et régulation acide-base
Le rein filtre 180 L de sang par jour et ce processus produit environ 1,5 L d’urine (54). La réabsorption des molécules utiles à l’organisme est prise en charge par plusieurs mécanismes de transport. Le NaCl est réabsorbé en majorité (de l’ordre de 60 à 70 %)
via le tubule proximal par les échangeurs Na+/H+ et Na+/glucose, en partie (20 à 30 %) via l’AAH et ensuite (5 à 10 %) via le tubule contourné distal. Le tubule collecteur finalise ensuite la fine réabsorption (54, 95, 251).
Dans l’AAH, illustrée à la figure 1.7, NKCC2 assure la réabsorption de 80 % du NaCl (54). Le gradient permettant aux ions Na+ et Cl− d’être réabsorbés est produit par la pompe Na+/K+ ATPase et le canal à Cl− CLCKα/β, tous deux situés du côté basolatéral, et par le recyclage du K+ dans la lumière par le canal à K+ médullaire externe rénal (ROMK) (139).
Figure 1.7. NKCC2 dans l’anse ascendante large de Henle. La pompe Na+/K+ ATPase et le canal à Cl− CLCKα/β situés du côté basolatéral produisent les gradients de Na+ et Cl favorables à l’activité de NKCC2. ROMK permet le recyclage du K+ dans la lumière pour alimenter le transport de NKCC2. Ce système collaboratif permet la réabsorption vectorielle de NaCl. Adapté de Nat Clin Prac Nephrol 2008, Nature Publishing Group. L’AAH qui comprend aussi un segment fin bouclé en amont de la partie large permet de générer un fort gradient corticomédullaire. En effet, et tel que mentionné à la section 4, l’eau est réabsorbée dans la portion descendante fine de cette anse sans les ions et ceux-ci sont réabsorbés dans la portion ascendante fine et large sans l’eau. Ce sont ces caractéristiques miroir qui sont responsables de la formation du gradient et donc,
l’activité de transport est assumée par NKCC2A et NKCC2F en grande partie. Ce sont aussi ces caractéristiques qui permettent au rein de réabsorber de l’eau au tubule collecteur dans les états d’anti-diurèse, tels que l’on peut rencontrer chez des individus qui traversent le désert.
La réabsorption effectuée par NKCC2A et NKCC2F permet également la réabsorption des cations minéraux divalents. En effet, le recyclage du K+ par ROMK, dépendant de la fonction de NKCC2, rend la lumière chargée positivement ce qui favorise le mouvement secondaire du Ca+2 et du Mg+2 vers le côté basolatéral de l’AAH (89, 316) et ce via les claudines paracellulaires (83, 368). L’importance du transport par les claudines est démontrée chez des patients ayant des mutations autosomales récessives dans les gènes les encodant (CLDN16 et CLDN19) puisque le phénotype observé en est un d’hypomagnésémie familiale avec une hypercalciurie et une néphrocalcinose (206, 254, 312). De fait, 60 % du Mg+2 et 25 % du Ca+2 seront réabsorbés par l’AAH.
L’AAH joue un autre rôle, celui de réguler l’équilibre acide-base, puisqu’il permet la réabsorption de l’anion HCO3− et des cations NH4+ et H+ (45, 120, 135, 136). Comme NKCC2 peut transporter le NH4+ au site de liaison du K+ (32, 34), ce cation tend à s’accumuler dans la médullaire et diffuse sous forme de NH3 gazeux jusque dans la lumière du tubule collecteur pour jouer le rôle de tampon.
5.9.7.2. Rétrocontrôle tubuloglomérulaire
Le taux de filtration glomérulaire (TFG) est finement régulé par les cellules formant la macula densa qui sont situées à l’extrémité de l’AAH juste avant le tubule contourné distal (190). Ce segment est contigu à l’appareil juxtaglomérulaire du glomérule, ce qui permet une signalisation paracrine. Les cellules épithéliales spécialisées de la macula densa détectent la quantité de Cl− dans le filtrat et en informent l’artériole afférente voisine. Si, par exemple, cette quantité est trop importante, le signal produit entraîne la vasoconstriction de l’artériole et de ce fait, diminue le TFG (215, 344). Ce mécanisme, nommé le rétrocontrôle tubuloglomérulaire (RTG) permet de limiter une perte de sels qui pourrait survenir lors d’un défaut de réabsorption tubulaire.




![Figure 1.8. Modèle d’activation de NKCC2. La diminution de la [Cl − ] i , le stress hypertonique et d’autres agonistes engendrent l’autophosphorylation des kinases WNK, la phosphorylation de SPAK/OSR1 puis de NKCC2](https://thumb-eu.123doks.com/thumbv2/123doknet/3184577.90926/39.918.325.629.177.505/modèle-activation-diminution-hypertonique-agonistes-engendrent-autophosphorylation-phosphorylation.webp)

