Impact de la dérivation biliopancréatique sur le
métabolisme osseux et son association avec les
changements hormonaux et l'homéostasie du glucose
Mémoire
Anne-Frédérique Turcotte
Maîtrise en sciences cliniques et biomédicales - avec mémoire
Maître ès sciences (M. Sc.)
Impact de la dérivation biliopancréatique sur
le métabolisme osseux et son association
avec les changements hormonaux et
l’homéostasie du glucose
Mémoire
Anne-Frédérique Turcotte
Sous la direction de :
Claudia Gagnon, directrice de recherche
Fabrice Mac-Way, codirecteur de recherche
Résumé
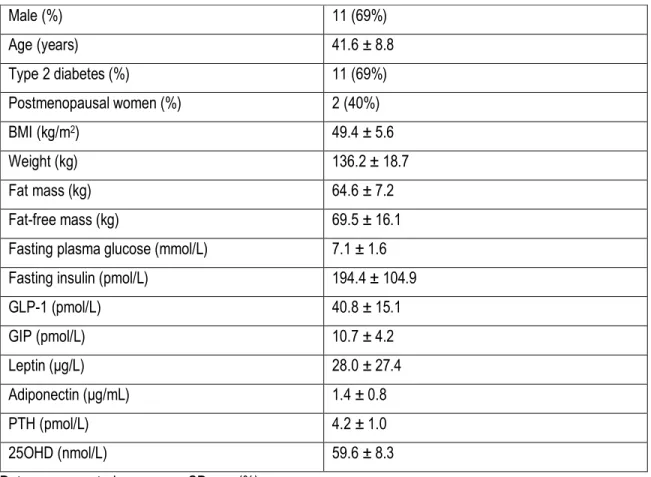
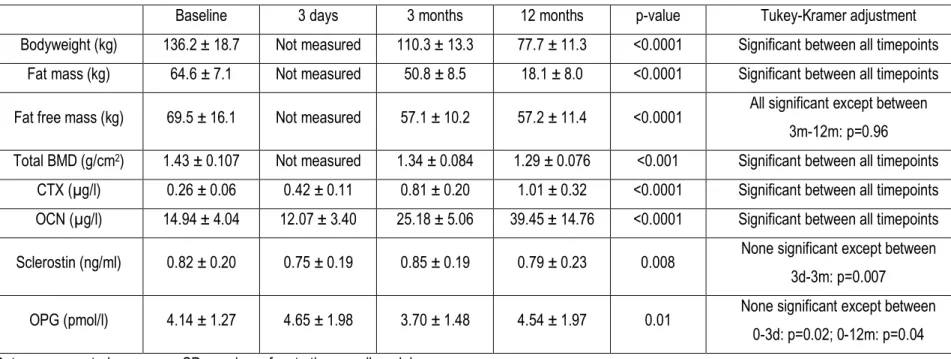
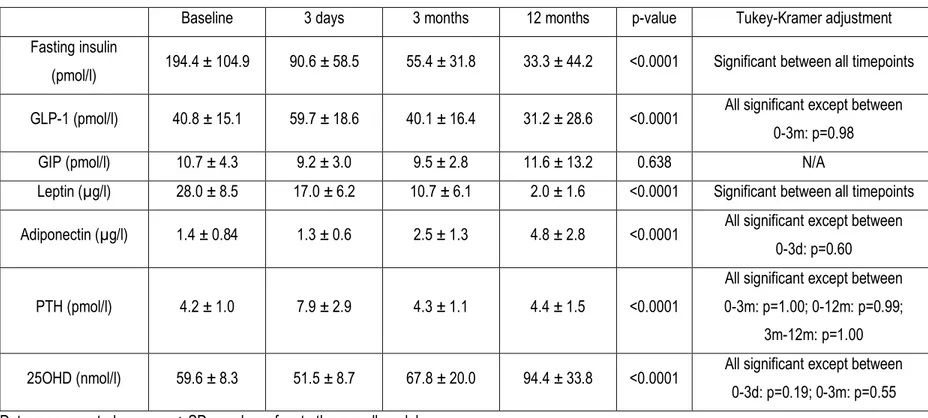
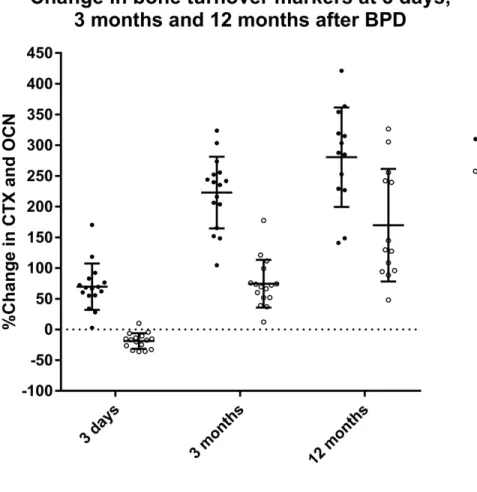
La chirurgie bariatrique gagne en popularité comme traitement de l’obésité sévère tant au Québec qu’au Canada. Alors que plus du tiers des patients opérés présente un diabète de type 2 avant la chirurgie, une méta-analyse a rapporté qu’une résolution du diabète était observée chez 80 % des patients après la gastrectomie en manchon et la dérivation gastrique en Y-de-Roux, et chez 95 % de ceux ayant subi une dérivation biliopancréatique (DBP). Cependant, bien que la chirurgie bariatrique soit associée à plusieurs bienfaits sur la santé, elle a récemment été associée à une augmentation du risque de fractures, en particulier après la dérivation gastrique en Y-de-Roux et la DBP. La mesure sanguine des marqueurs de la formation et de la résorption osseuse après la chirurgie bariatrique pourrait permettre de mieux comprendre la pathophysiologie de la fragilité osseuse. Par ailleurs, plusieurs mécanismes ont été proposés pour expliquer la résolution du diabète de type 2 après la chirurgie bariatrique. Alors que des études précliniques ont montré qu’une hormone dérivée de l’os, l’ostéocalcine décarboxylée (ucOCN), était impliquée dans le métabolisme du glucose, aucune étude n’a évalué si les changements d’ucOCN étaient associés à l’amélioration des indices de l’homéostasie du glucose observés après la chirurgie. Nos objectifs étaient donc d’évaluer les changements dans les marqueurs sanguins de la formation et de la résorption osseuse à court et moyen terme après la DBP, et d’explorer les associations entre les changements de ces marqueurs et les changements de la densité minérale osseuse (DMO) du corps entier et de certains facteurs hormonaux. De plus, nous voulions évaluer si les changements d’ucOCN étaient associés aux changements des indices de l’homéostasie du glucose après la DBP. En utilisant les données et les échantillons de plasma congelés d’une cohorte prospective récoltés à 3 jours, 3 mois et 12 mois après la DBP, nous avons démontré une augmentation rapide des marqueurs de la résorption osseuse dès la 3ème journée post-opératoire, et que cette augmentation s’amplifiait jusqu’à 1 an après la chirurgie, avec
une augmentation plus marquée des marqueurs de la résorption que de la formation osseuse. De plus, une diminution significative de l’ostéocalcine, un marqueur de la formation osseuse, a été observée à 3 jours après la DBP, suivie d’une augmentation jusqu’à 1 an. Par ailleurs, une association entre l’augmentation des marqueurs de la résorption osseuse et la diminution de la DMO totale, ainsi que quelques associations
significatives entre les changements de plusieurs marqueurs du remodelage osseux et ceux de certaines hormones après la DBP ont été trouvés. Enfin, nos résultats ont révélé une forte association, indépendante de la perte de poids, entre l’augmentation de l’ucOCN et l’amélioration de plusieurs indices de l’homéostasie du glucose après la DBP, suggérant un lien entre le métabolisme osseux et glucidique.
Abstract
Bariatric surgery is gaining in popularity as a treatment of severe obesity in Quebec and across Canada. While more than one third of patients have type 2 diabetes before bariatric surgery, a large meta-analysis reported type 2 diabetes resolution in 80% of patients after sleeve gastrectomy and Roux-in-Y gastric bypass, and in 95% of patients after biliopancreatic diversion (BPD). However, despite clear health benefits, recent evidence showed that bariatric procedures, especially Roux-in-Y gastric bypass and BPD, are associated with an increased risk of fracture. Assessment of circulating biochemical markers of bone formation and resorption after bariatric surgery could provide insight into the pathophysiology of bone fragility after surgery. Moreover, several mechanisms have been put forward to explain resolution of type 2 diabetes after bariatric surgery. While preclinical studies have reported that a bone-derived hormone, uncarboxylated osteocalcin (ucOCN), is involved in glucose metabolism, no study has evaluated whether changes in this hormone are associated with improvement in glucose homeostasis after bariatric surgery. Our study aimed at evaluating the early- and medium-term changes in bone remodeling markers after BPD, and whether these changes are associated with changes in whole-body (total) bone mineral density (BMD) and in hormonal factors. Furthermore, we assessed if changes in ucOCN are associated with changes in glucose homeostasis indices after BPD. We used data and frozen plasma samples from a one-year prospective cohort study where blood was drawn at 3 days, 3 months and 12 months after BPD. We showed that BPD is associated with an increase in the bone resorption marker C-telopeptide as early as 3 days after surgery, and that it continued to rise up to one year after surgery, with a greater increase in bone resorption over bone formation markers. Furthermore, a significant decrease in the bone formation marker osteocalcin was seen at 3 days after BPD, which was followed by an increase up to one year after surgery. Moreover, an inverse association between the change in bone resorption marker and the change in total BMD, as well as significant associations between the changes in several bone turnover markers and changes in hormonal factors after BPD were observed. Finally, there was a strong correlation between the increase in ucOCN and the improvement in several indices of glucose homeostasis after BPD, independent of weight loss, suggesting a link between bone and glucose metabolism.
Table des matières
Résumé ... ii
Abstract ... iv
Table des matières ... v
Liste des figures, tableaux, illustrations ... viii
Liste des abréviations, sigles, acronymes... ix
Remerciements ... x
Avant-propos ... xii
Introduction ...1
Chapitre 1. La santé osseuse ...4
1.1 Les déterminants d’un os solide ...4
1.2 Le remodelage osseux : un déterminant important de la solidité osseuse ...5
1.2.1 Facteurs modulant le remodelage osseux ...7
1.2.2 Marqueurs sanguins de la formation et de la résorption osseuse ...9
1.3 Évaluation de la densité minérale osseuse et du risque fracturaire ... 10
1.3.1 Le densitomètre à rayons X (DXA) ... 10
1.3.2 Autres modalités d’imagerie ... 11
Chapitre 2. La dérivation biliopancréatique ... 12
2.1 Les principaux types de chirurgie bariatrique ... 12
2.1.1 Historique et prévalence des divers types de chirurgies bariatriques ... 12
2.1.2 Critères d’admissibilité à la chirurgie bariatrique au Québec ... 13
2.1.3 Description des divers types de chirurgies bariatriques ... 14
Chapitre 3. La solidité osseuse et la chirurgie bariatrique... 16
3.1 La solidité osseuse et la chirurgie bariatrique ... 16
3.1.1 Risque fracturaire après la chirurgie bariatrique ... 16
3.1.2 Changements de la densité minérale osseuse et de la qualité osseuse après la chirurgie bariatrique ... 17
3.1.3 Changements du remodelage osseux après la chirurgie bariatrique ... 19
3.2 Mécanismes possiblement impliqués dans les changements du remodelage osseux et de la densité minérale osseuse après la chirurgie bariatrique ... 19
3.2.1 Décharge mécanique ... 19
3.2.3 Apports nutritionnels ... 20
3.2.4 Changements hormonaux ... 21
Chapitre 4. Les bénéfices de la dérivation biliopancréatique sur l’homéostasie du glucose ... 22
4.1 Chronologie des changements observés après la DBP sur l’homéostasie du glucose ... 22
4.2 Mécanismes potentiellement impliqués dans l’amélioration de l’homéostasie du glucose après la DBP 22 4.3 Communication inter-organe entre l’os et les organes impliqués dans l’homéostasie du glucose... 23
Chapitre 5. Hypothèses et objectifs ... 25
5.1 Hypothèses de l’étude ... 25
5.2 Objectifs de l’étude ... 25
Chapitre 6. Article : Impact de la dérivation biliopancréatique sur le métabolisme osseux et son association avec les changements hormonaux ... 26
6.1 Publication, présentations et prix... 26
6.2 Contribution des auteurs ... 27
6.3 Effects of Biliopancreatic Diversion on Bone Turnover Markers and Association with Hormonal Factors in Patients with Severe Obesity ... 28
6.3.1 Résumé ... 30
6.3.2 Abstract ... 31
6.3.3 Introduction ... 32
5.3.4 Materials and methods ... 32
6.3.5 Results... 34 6.3.6 Discussion ... 36 6.3.7 Conclusion ... 39 6.3.8 Bibliography ... 40 6.3.9 Tables ... 43 6.3.10 Figures ... 46
Chapitre 7. Article : Association entre les changements de l’ostéocalcine décarboxylée et de l’homéostasie du glucose après la dérivation biliopancréatique ... 47
7.1 Publication, présentations et prix... 47
7.2 Contribution des auteurs ... 48
7.3 Association Between Changes in Bioactive Osteocalcin, Bone Remodeling Markers and Glucose Homeostasis After Biliopancreatic Diversion ... 49
7.3.1 Résumé ... 51
7.3.2 Abstract ... 52
7.3.4 Materials and methods ... 54 7.3.5 Results... 56 7.3.6 Discussion ... 57 7.3.8 Bibliography ... 60 7.3.9 Tables ... 63 7.3.10 Figures ... 66 Chapitre 8. Conclusion ... 69
8.1 Résumé des résultats ... 69
8.2 Interprétation des résultats et comparaison avec les études publiées ... 70
8.3 Forces et limites de nos études ... 72
8.4 Perspectives ... 73
Bibliographie ... 75
Liste des figures, tableaux, illustrations
Figure 1 : Les phases du remodelage osseux.
Figure 2 : Prévalence mondiale des 4 principaux types de chirurgie bariatrique en 2017. Figure 3 : Volume de chirurgies bariatriques pratiquées au Canada de 2006 à 2016.
Figure 4 : Prévalence des divers types de chirurgies bariatriques réalisées au Québec en 2013-2014. Figure 5 : Principaux types de chirurgies bariatriques.
Figure 6 : Les diverses fonctions de l’ostéocalcine décarboxylée sur la sensibilité à l’insuline.
Figure 7 : Schéma intégrateur des associations observées entre les changements des marqueurs du
remodelage osseux et les changements de la densité minérale osseuse, de diverses hormones, et de l’homéostasie du glucose suite à la dérivation biliopancréatique.
Liste des abréviations, sigles, acronymes
IUCPQ : Institut universitaire de cardiologie et de pneumologie de Québec OMS : Organisation mondiale de la santé
UcOCN : Ostéocalcine décarboxylée ou uncarboxylated osteocalcin OCN : Ostéocalcine ou osteocalcin
DMO : Densité minérale osseuse BMD : Bone mineral density IMC : Indice de masse corporelle BMI : Body-mass index
FFM : Fat-free mass
RYGB : Dérivation gastrique en Y-de-Roux ou Roux-en-Y gastric bypass DBP : Dérivation biliopancréatique
BPD : Biliopancreatic diversion
RANK : Receptor Activating NF Kappa B
RANKL : Ligand du Receptor Activating NF Kappa B OPG : Ostéoprotégérine ou osteoprotegerin
PTH : Hormone parathyroïdienne CTX : C-terminal telopeptide
TRACP5b : Tartrate-resistant acid phosphatase 5b NTX : N-terminal telopeptide
P1NP : Propeptide N-terminal du procollagène de type 1 GLP-1 : Glucagon-like peptide-1
GIP : Glucose-dependent insulinotropic polypeptide PYY : Peptide YY
DXA : Dual-energy X-ray absorptiometry QCT : Quantitative computed tomography
pQCT : Peripheral quantitative computed tomography
HR-pQCT : High-resolution peripheral quantitative computed tomography 25OHD: 25-hydroxyvitamine D ou 25-hydroxyvitamin D
ELISA : Enzyme-linked immunosorbent assay HbA1c : Hémoglobine glyquée
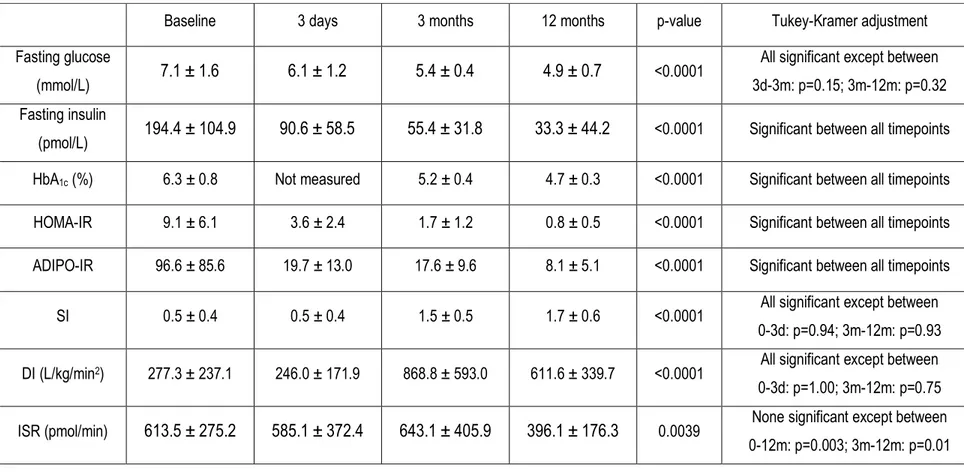
HOMA-IR : Homeostasic model assessment for insulin resistance ADIPO-IR : Indice de résistance à l’insuline du tissu adipeux DI : Indice de disposition ou disposition index
SI : Indice de sensibilité à l’insuline ou Insulin sensitivity index ISR : Indice de sécrétion d’insuline ou Insulin secretion rate
Remerciements
Je tiens d’abord à remercier profondément ma directrice de maîtrise, Claudia Gagnon, et mon co-directeur, Fabrice Mac-Way, sans qui je n’aurais pas pu y arriver. J’ai adoré les deux dernières années passées avec vous, et je vous remercie pour votre support et votre disponibilité tout au long de ma maîtrise. Merci de m’avoir fait connaître la recherche, de m’avoir soutenue dans mon apprentissage, mais surtout de m’avoir fait découvrir une passion. Je tiens également à vous remercier pour votre positivisme et votre enthousiasme, qui m’ont inspirée et m’ont permis de voir la recherche d’un autre œil. Claudia, tu m’as permis de développer mon autonomie et mon esprit critique, tu as su me guider et m’encourager à travers tous les obstacles que j’ai traversés. Je tiens aussi à te remercier pour ton expertise, ta rigueur, et la confiance que tu as démontrée en mes capacités. Fabrice, ton support a été, pour moi, très précieux. Tu m’as permis de découvrir et de développer mes habiletés en laboratoire, et tu m’as guidée et conseillée quant à mon parcours professionnel. Ton expérience et tes commentaires éclairés m’ont permis de pousser ma réflexion à un autre niveau.
Merci également à tous les coauteurs qui ont contribué de près ou de loin à l’écriture des deux articles. Merci pour votre support et votre expertise. Je tiens aussi à remercier tous mes collègues du CHUL, Sarah Chouinard-Castonguay, Anne-Sophie Morisset, Sarah O’Connor, Anne-Sophie Plante et Claudia Savard, avec qui j’ai su développer une belle complicité.
Merci à la Faculté de Médecine de l’Université Laval et à l’axe endocrinologie et néphrologie du Centre de recherche du CHU de Québec-Université Laval de m’avoir permis de réaliser ma maîtrise. Merci particulièrement à Diabète Québec, à la Fondation du CHU de Québec et au Réseau de recherche en santé cardiométabolique, diabète et obésité (CMDO), pour leur soutien financier tout au long de mes études.
Merci également à l’équipe du Dr André Carpentier du Centre de recherche du CHU de Sherbrooke, l’équipe du Dr André Tchernof du Centre de recherche de l’Institut Universitaire de Cardiologie et de Pneumologie de Québec et l’équipe de chirurgiens bariatriques de l’Institut Universitaire de Cardiologie et de Pneumologie de Québec pour l’accès aux données et à la biobanque de la cohorte bariatrique, me permettant de réaliser les 2 volets de mon projet de maîtrise.
Je tiens aussi à remercier le professeur Robin Daly, de l’Université Deakin, à Melbourne, en Australie, qui m’a accueilli lors d’un stage de 12 semaines afin de parfaire mes habiletés en imagerie osseuse et musculaire. Ce stage m’a permis de développer mon autonomie, mes compétences en statistiques, et d’acquérir de l’expérience dans une autre équipe de recherche. Ce stage a été extrêmement pertinent pour mon développement autant personnel que professionnel.
Finalement, merci à ma famille et à mes amis pour leur confiance dans tous les projets que j’entreprends. Merci pour vos encouragements, votre patience et votre support inestimable, qui m’ont permis d’atteindre mes objectifs. Un merci tout spécial pour votre compréhension et votre écoute lors des moments plus difficiles.
Avant-propos
Ce projet de recherche portant sur les impacts de la chirurgie de dérivation biliopancréatique sur les changements de marqueurs osseux a été élaboré par la Dre Claudia Gagnon, endocrinologue et clinicienne-chercheure au Centre de recherche du CHU de Québec-Université Laval et au Centre de recherche de l’Institut Universitaire de Cardiologie et de Pneumologie de Québec (IUCPQ)-Université Laval, et moi-même. Mon implication dans ce projet a débuté dès le début de ma maîtrise en Sciences cliniques et biomédicales à l’Université Laval, en septembre 2017. Nous avons eu la chance d’accéder aux données et aux échantillons de plasma congelé d’une étude de cohorte prospective d’un an, qui incluait des patients ayant subi une dérivation biliopancréatique à l’IUCPQ. L’objectif était de répondre à deux grandes questions. La première question (article 1) découlait d’une étude précédemment réalisée par la Dre Gagnon qui, en utilisant les bases de données de la Régie de l’assurance maladie du Québec (RAMQ), a démontré que le risque de fracture était augmenté après la chirurgie bariatrique de dérivation biliopancréatique. Ainsi, nous avons voulu mieux comprendre la pathophysiologie précoce de la fragilité osseuse après cette chirurgie, en étudiant les changements des marqueurs sanguins du remodelage osseux, et leur association avec les changements de la densité minérale osseuse et de différentes hormones gastro-intestinales et du tissu adipeux. Les résultats du premier article nous ont également mené à nous poser une deuxième question (article 2), où nous avons voulu étudier pour la première fois si l’amélioration de l’homéostasie du glucose observée après la dérivation biliopancréatique était associée à l’activation du remodelage osseux, en particulier à l’augmentation de l’ucOCN, une hormone dérivée de l’os qui régule l’homéostasie du glucose chez la souris. Pour tester cette question de recherche, nous avons bénéficié d’une collaboration avec le Dr Mathieu Ferron, chercheur à l’Institut de recherches cliniques de Montréal (IRCM), qui vient de développer le premier essai permettant de mesurer l’ucOCN chez l’humain. Ainsi, conjointement avec la Dre Gagnon, ma directrice de maîtrise, j’ai élaboré le protocole des deux volets de mon projet de maîtrise à l’automne 2017. J’ai ensuite réalisé une revue de la littérature, participé à la collecte de données et effectué les analyses statistiques sous la supervision de la Dre Gagnon. Les chapitres 6 et 7 présentent les articles « Effects of Biliopancreatic Diversion on Bone Turnover Markers and Association with
Hormonal Factors in Patients with Severe Obesity » publié dans le journal Obesity Surgery en mars 2019 et « Association Between Changes in Bioactive Osteocalcin, Bone Remodeling Markers and Glucose Homeostasis After Biliopancreatic Diversion » qui sera soumis au Journal of Clinical Endocrinology and Metabolism dans les
prochaines semaines, et dont je suis l’auteure principale. La rédaction de ces manuscrits a été supervisée par la Dre Claudia Gagnon, et ont été révisés par tous les co-auteurs soit Thomas Grenier-Larouche, Roth-Visal Ung, Mathieu Ferron, Julie Lacombe, David Simonyan, Anne-Marie Carreau, André C. Carpentier, Fabrice Mac-Way, Laëtitia Michou, André Tchernof, Denis Richard, Laurent Biertho, Stéfane Lebel et Simon Marceau.
Introduction
L’obésité se caractérise, selon l’Organisation mondiale de la santé (OMS), par une accumulation anormale ou excessive de graisse qui présente un risque pour la santé. Par ailleurs, l’obésité est l’un des problèmes de santé les plus répandus à l’échelle mondiale1. Le Canada n’a pas échappé à cette épidémie puisque le taux d’obésité
y est passé de 6,1 % en 1985 à 18,3 % en 20112. Au Canada, les coûts actuels associés à l’obésité sont estimés
à plus de 6 milliards de dollars annuellement3,4, et le bilan pourrait s’alourdir puisqu’en 2009-2011, 19,8 % des
enfants de 5 à 17 ans étaient en surpoids et 11,7 % étaient obèses5. L’obésité est un problème de santé
complexe et multifactoriel découlant de facteurs autant comportementaux et environnementaux que génétiques6. L’obésité est également associée à plusieurs comorbidités telles que le diabète de type 2,
l’hypertension artérielle, la dyslipidémie et l’apnée du sommeil7. Une autre comorbidité de l’obésité qui demeure
sous-estimée est l’atteinte osseuse. En effet, bien que l’obésité soit associée à une densité minérale osseuse (DMO) plus élevée8,9, les individus obèses ont une qualité osseuse altérée et seraient plus à risque de
fracture10,11. Par ailleurs, l’obésité coexiste fréquemment avec le diabète de type 2, qui peut contribuer à
exacerber la fragilité osseuse12,13.
Malheureusement, la modification des habitudes de vie par une diète hypocalorique associée ou non à la pratique quotidienne d’activité physique est rarement efficace pour maintenir une perte de poids à long terme14.
Par conséquent, la chirurgie bariatrique est actuellement le traitement le plus efficace pour engendrer une perte de poids suffisante et durable15. Le gain en popularité pour la chirurgie bariatrique au Canada est reflété par
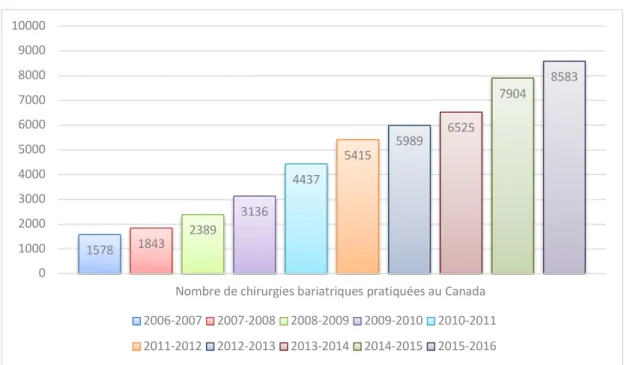
l’augmentation importante du volume de chirurgies réalisées, qui est passé d’environ 1 600 chirurgies en 2006-2007 à plus de 8 500 chirurgies en 2015-201616,17. La chirurgie permet d’améliorer, voire résoudre, les
comorbidités associées à l’obésité, et permet de réduire la mortalité7,18,19. En effet, elle est présentement le seul
traitement qui permet une rémission du diabète de type 220,21. Par ailleurs, suite à la publication d’études
démontrant la supériorité de la chirurgie bariatrique par rapport au traitement médical chez les patients ayant un diabète de type 2, la Fédération internationale du diabète propose depuis 2017 de considérer la chirurgie bariatrique chez les patients diabétiques de type 2 ayant une obésité modérée, soit un IMC supérieur ou égal à 30 kg/m2, pour qui le contrôle glycémique n’est pas optimal avec la médication22. Il est donc anticipé que le
nombre de patients atteints de diabète de type 2 ayant recours à la chirurgie bariatrique continuera de croître. Toutefois, malgré des bénéfices évidents sur la santé, les données démontrant que les chirurgies bariatriques, en particulier celles ayant une composante malabsorptive telles que la dérivation gastrique en Y-de-Roux (RYGB) et la dérivation biliopancréatique (DBP), ont un impact négatif sur la santé osseuse s’accumulent. En effet, elles occasionnent une augmentation des marqueurs sanguins du remodelage osseux, une diminution de la DMO, et une altération de la solidité et de la microarchitecture de l’os, résultant en une augmentation du
risque de fracture23-27. Plusieurs études ont montré un changement dans les marqueurs du remodelage osseux
à long terme après divers types de chirurgie bariatrique23,28, mais une seule étude a montré une augmentation
des marqueurs sanguins de la résorption osseuse tôt, soit 10 jours après la RYGB25. Ce nouvel élément est
important puisqu’il suggère que les changements osseux surviennent rapidement après la chirurgie bariatrique, même avant une perte de poids. Cependant, les mécanismes responsables des altérations du remodelage osseux sont encore incompris. Parmi ces facteurs, les changements dans la composition corporelle, les modifications hormonales, les changements métaboliques et les modifications anatomiques engendrées par la perte de poids et par la chirurgie elle-même sont vraisemblablement impliqués29-31. À ce jour, aucune étude n’a
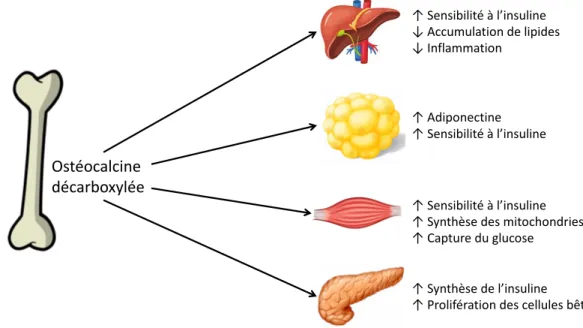
évalué les changements dans les marqueurs du remodelage osseux à court terme après la chirurgie de DBP, ni si ces changements sont associés à des changements hormonaux ou à l’amélioration de l’homéostasie du glucose. En effet, des études précliniques réalisées chez des souris ont révélé que l’os était un organe endocrine impliqué dans la régulation de l’homéostasie du glucose32-34. Ces études ont démontré une association entre le
remodelage osseux et l’homéostasie du glucose via une hormone sécrétée lors du processus de formation osseuse, l’ostéocalcine (OCN), qui devient métaboliquement active lors du processus de résorption osseuse (l’ostéocalcine décarboxylée – ucOCN).
Pour tenter de mieux comprendre la pathophysiologie de la fragilité osseuse après la chirurgie, nous avons utilisé les données et le plasma congelé d’une cohorte prospective d’une durée d’un an. L’étude originale avait pour but d’évaluer le changement du métabolisme des acides gras lors de la rémission du diabète de type 2 suite à la DBP. Les 16 individus inclus dans cette étude ont subi une DBP à l’IUCPQ entre 2012 et 2014 et étaient rencontrés avant la DBP, et à 3 jours, 3 mois et 12 mois après la chirurgie. Nous avons donc mesuré les marqueurs du remodelage osseux, l’ucOCN et diverses hormones dans les échantillons de plasma congelés de ces individus. L’objectif primaire de notre étude était d’évaluer les changements des marqueurs du remodelage osseux à court et à moyen terme après la DBP, et d’évaluer si ces changements étaient associés aux changements de la DMO et de certaines hormones (article 1). De plus, nous voulions déterminer le changement des concentrations sanguines d’ucOCN après la DBP et son association avec les changements des indices de l’homéostasie du glucose (article 2). Les résultats de cette étude permettront, d’une part, de déterminer l’impact précoce de la DBP sur le remodelage osseux et, d’autre part, d’étudier pour la première fois le lien entre les changements des niveaux d’une hormone dérivée de l’os (ucOCN) et l’homéostasie du glucose après la DBP. Ce mémoire présentera d’abord les déterminants d’un os solide, en discutant de la composition de l’os, du cycle de remodelage osseux et des méthodes d’évaluation de la DMO et de la qualité osseuse. Je poursuivrai en présentant les principaux types de chirurgies bariatriques actuellement pratiqués, puis décrirai plus en détail la DBP. Je présenterai ensuite les impacts de la chirurgie bariatrique sur la DMO, la qualité de l’os et le remodelage osseux, et les mécanismes potentiellement impliqués. Je poursuivrai en exposant les bénéfices de la DBP sur
l’homéostasie du glucose. J’enchainerai avec mes objectifs et hypothèses de recherche, pour ensuite insérer mes deux articles. Je terminerai par une discussion des résultats que nous avons obtenus et l’impact de ceux-ci sur le suivi des patients suite à la DBP.
Chapitre 1. La santé osseuse
1.1 Les déterminants d’un os solide
Composition de l’os
Le tissu osseux est un tissu conjonctif hautement spécialisé constitué d’un ensemble de cellules et d’une matrice osseuse. Cette matrice osseuse se compose d’une fraction minérale et d’une fraction organique. Plus spécifiquement, l’os est composé de 50-70 % de minéraux, 20-40 % de matrice organique, 5-10 % d’eau et 0-3 % de lipides35. Le contenu minéral osseux est principalement de l’hydroxyapatite, formé de calcium et de
phosphate, alors que la matrice organique est principalement constituée de fibres de collagène de type 1 et de glycoprotéines fibreuses et rigides36. Alors que le contenu minéral osseux fournit à l’os sa rigidité et sa
résistance, la matrice organique permet son élasticité et sa flexibilité.
L’os est un tissu dynamique en constant renouvellement qui a pour fonction de supporter les structures corporelles, protéger les organes internes et faciliter le mouvement. Il est également impliqué dans la formation de cellules sanguines et dans le métabolisme phosphocalcique, en plus de permettre une réserve de minéraux. Le tissu osseux comprend deux types de structures, l’os trabéculaire (ou spongieux) qui constitue 20 % du squelette et l’os cortical (ou compact) qui en compose 80 %. L’os trabéculaire est formé de travées et se retrouve à l’intérieur des vertèbres, du bassin, des os plats et des épiphyses des os longs. Il est riche en cellules adipeuses et en éléments sanguins, mais possède une faible résistance. L’os cortical correspond à la partie périphérique qui recouvre les os et constitue la diaphyse des os longs. C’est une partie dense, beaucoup plus dure et résistante.
Le tissu osseux comprend trois types de cellules, soit les ostéoclastes, les ostéoblastes et les ostéocytes. Les ostéoclastes proviennent des cellules myéloïdes différenciées en promonocytes, puis en pré-ostéoclastes. Les ostéoclastes sont responsables de la dégradation du tissu osseux, nécessaire à son renouvellement continu. Ils résorbent l’os sous l’effet d’enzymes lysosomiales, ce qui crée une lacune de résorption dans laquelle le nouveau tissu osseux sera formé. Les ostéoblastes trouvent leur origine dans la moelle osseuse, qui produit les cellules souches mésenchymateuses. Les ostéoblastes sont liés à la matrice osseuse et contribuent à la formation de nouveaux tissus osseux. Ils ont comme principale fonction de synthétiser la matrice osseuse et de participer à sa minéralisation. Lorsque les ostéoblastes achèvent leur fonction, certains s’incorporent dans le tissu osseux et deviennent des ostéocytes. Les ostéocytes ont pour fonction de transmettre diverses informations chimiques et mécaniques entre eux et avec les cellules de surface (ostéoblastes et cellules bordantes). Les ostéocytes exercent également un rôle de mécanorécepteur et synthétisent certaines molécules
en réponse à un stimulus mécanique, telle que la sclérostine, un puissant inhibiteur de la formation osseuse et activateur de la résorption osseuse37,38.
Masse osseuse et qualité osseuse
Cinquante (50 %) à 70 % de la solidité de l’os dépend de sa masse39, soit de la quantité de matrice osseuse
organique et minérale. La formation de l’hydroxyapatite et la maturation de la matrice organique sont régies par plusieurs enzymes et hormones telles que la phosphatase alcaline osseuse, l’ostéocalcine, l’ostéopontine et la
sialoprotéine osseuse40. Ces protéines régulent le remodelage osseux, la formation et l’arrangement spatial des
fibres collagéniques de la matrice, ainsi que le processus de minéralisation. Les autres déterminants d’un os solide se regroupent sous le concept général de qualité osseuse, qui se distingue de la masse osseuse. La qualité osseuse comprend à la fois la structure et la composition de l’os, soit la microarchitecture osseuse, la minéralisation, la composition de la matrice osseuse et du minéral osseux, la quantité et la proportion d’os cortical et d’os trabéculaire, les propriétés de la matrice organique, et la fonction des protéines impliquées dans le métabolisme osseux. La vitesse du remodelage osseux fait également partie du concept de qualité osseuse, et affecte la solidité d’un os. Alors qu’un faible taux de remodelage osseux mène à une accumulation de micro-fractures, ce qui fragilise l’os, un taux de remodelage élevé, souvent caractérisé par une résorption osseuse qui surpasse la formation, est également l’une des principales causes de la détérioration de la microarchitecture de
l’os et de la perte de masse osseuse35. Enfin, il est important de bien distinguer les concepts de masse osseuse
et de qualité osseuse, puisque ces deux concepts sont liés à la fragilité osseuse et, par conséquent, au risque de fracture.
Finalement, pour que les os soient solides, il est nécessaire d’avoir une quantité suffisante de calcium et de phosphate en circulation, afin d’assurer la disponibilité de substrat minéral pour maintenir l’homéostasie de l’os. Un remodelage osseux constant, où un équilibre entre la résorption et la formation osseuse est maintenu, permet aussi de préserver la santé et les fonctions du squelette. En somme, la solidité d’un os est dépendante de sa
masse, de sa géométrie, de sa composition, de sa microarchitecture et de ses propriétés matérielles35.
1.2 Le remodelage osseux : un déterminant important de la
solidité osseuse
Pour conserver sa solidité, un os doit constamment se renouveler. Le remodelage osseux est le processus par lequel un os se renouvèle en réponse à des forces mécaniques, des stress physiques ou des conséquences physiologiques. Le remodelage osseux accomplit trois principales fonctions : la régulation de l’équilibre minéral, l’adaptation à l’environnement physiologique et mécanique, et la réparation des dommages osseux. Le
remodelage osseux est le résultat d’une activité couplée entre les ostéoclastes, qui dégradent l’os, et les ostéoblastes, qui forment la nouvelle matrice osseuse qui sera ensuite minéralisée. La vitesse de renouvellement du tissu osseux diffère selon le type de structure. En effet, l’os trabéculaire se renouvèle plus rapidement que l’os cortical, puisque l’os trabéculaire contient un plus grand nombre d’unité cellulaire active41.
Cependant, un déséquilibre entre la résorption et la formation osseuse, aussi appelé découplage, peut mener à une détérioration de la structure et de la minéralisation osseuses, et par conséquent à une fragilité osseuse accrue.
Cycle du remodelage osseux
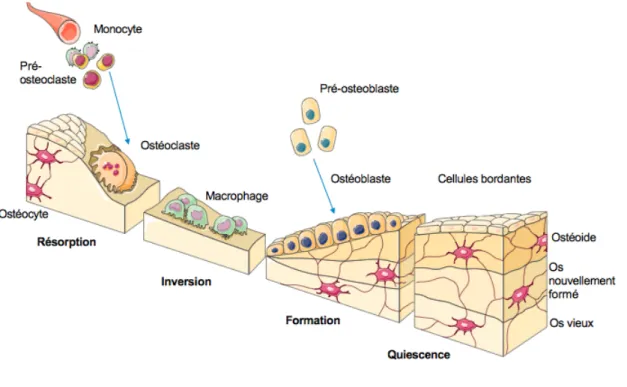
Le remodelage osseux comprend cinq phases distinctes : la phase d’activation, la phase de résorption, la phase d’inversion, la phase de formation et la phase de quiescence42 (Figure 1). Chez un jeune adulte en santé, un
cycle complet de remodelage dure environ 200 jours, où environ 3 semaines sont nécessaires pour compléter la phase de résorption, alors que 3 à 6 mois sont nécessaires pour compléter la phase de formation43,44. Le
cycle de remodelage est initié par un signal mécanique (dommage aux différentes structures, forces et tensions mécaniques, immobilisation d’un membre) ou endocrinien (parathormone, estrogènes, etc.). La phase d’activation est initiée par une activation des cellules bordantes qui recouvrent la surface osseuse et attirent par chimiotactisme les ostéoclastes. La phase de résorption s’ensuit par la différenciation des pré-ostéoclastes en pré-ostéoclastes matures grâce à un ligand, le RANKL. Les pré-ostéoclastes maintenant actifs adhèrent à la surface osseuse et dégradent le minéral osseux de la matrice organique pour former une lacune de résorption. La phase d’inversion permet de terminer la déminéralisation de la matrice en enlevant le collagène restant dans la lacune de résorption. Les macrophages responsables de la phase d’inversion produisent ensuite un signal qui permet la transition de la résorption à la formation osseuse en attirant les ostéoblastes dans la lacune. C’est pendant la phase de formation que les ostéoblastes apposent de la nouvelle matrice organique (principalement du collagène de type 1) dans la lacune précédemment formée. Cette matrice organique est ensuite minéralisée par l’incorporation d’hydroxyapatite. Le remodelage termine avec la phase de quiescence, où l’accumulation d’hydroxyapatite dans la matrice s’achève et confère à l’os sa résistance mécanique. C’est également pendant cette phase que certains ostéoblastes s’intègrent à la matrice pour devenir des ostéocytes.
Figure 1. Les phases du remodelage osseux.
Source : https://www.researchgate.net/figure/2-Representation-schematique-du-cycle-de-remodelage-osseux-courtoisie-banque-dimages_fig2_321862706
1.2.1 Facteurs modulant le remodelage osseux
Facteurs locaux qui régulent le remodelage osseux
Plusieurs facteurs endogènes et exogènes permettent de moduler l’activité des différentes cellules osseuses. Les principaux régulateurs sont les facteurs locaux, les facteurs hormonaux et les contraintes mécaniques. En premier lieu, les facteurs locaux qui contrôlent le remodelage osseux sont principalement produits directement par les cellules osseuses. Les facteurs RANK (Receptor Activating NF Kappa B), RANKL (RANK ligand) et l’ostéoprotégérine (OPG), appelés collectivement le système RANK/RANKL/OPG, est une voie importante de régulation du métabolisme osseux45. Ce système permet la communication entre les ostéoblastes et les
ostéoclastes, exerce un rôle majeur dans l’ostéoclastogenèse, et participe à la modulation des hormones et cytokines impliquées dans la résorption osseuse. RANKL est une cytokine impliquée dans la différenciation ostéoclastique, et exprimé dans plusieurs tissus et organes, dont l’ostéoblaste. Lorsque RANKL se lie à son récepteur RANK localisé à la surface des ostéoclastes, ceux-ci s’activent et peuvent exercer leur fonction de résorption. L’OPG est une glycoprotéine produite principalement par les ostéoblastes. L’OPG protège contre la résorption osseuse excessive en se liant à RANK, empêchant ainsi la liaison de RANK à son ligand, RANKL46.
Le ratio RANKL/OPG peut être utilisé pour mesurer l’activité ostéoclastique puisqu’un ratio élevé suggère une résorption osseuse augmentée.
Facteurs hormonaux qui régulent le remodelage osseux
En second lieu, les hormones directement impliquées dans le métabolisme osseux, soit la parathormone (PTH), la calcitonine et la vitamine D active (1,25-dihydroxyvitamine D), interviennent dans le maintien de l’homéostasie phosphocalcique en agissant sur l’intestin, l’os et le rein. La PTH est sécrétée par les glandes parathyroïdes, en réponse à une hypocalcémie. Elle stimule la résorption osseuse afin d’augmenter la concentration de calcium sérique, active la réabsorption du calcium dans les tubules rénaux et inhibe l’absorption rénale de phosphore47.
La PTH augmente aussi l’absorption intestinale de calcium et de phosphore indirectement via l’augmentation de la 1,25-dihydroxyvitamine D, puisqu’elle active l’enzyme 1-alpha hydroxylase qui convertit, dans le rein, la 25-hydroxyvitamine D en sa forme active, la 1,25-dihydroxyvitamine D48. La calcitonine est synthétisée par les
cellules C de la glande thyroïde et inhibe directement les ostéoclastes pour diminuer la résorption osseuse49. La
1,25-dihydroxyvitamine D augmente l’absorption intestinale de calcium et de phosphore et favorise la minéralisation de la matrice osseuse. Elle stimule également la résorption osseuse et exerce un rétrocontrôle négatif sur la sécrétion de PTH50.
Les hormones gastro-intestinales et pancréatiques, les hormones du tissu adipeux et les hormones sexuelles agissent également sur le métabolisme osseux. La ghréline, une hormone orexigène sécrétée par les cellules de l’estomac, stimule la prolifération des ostéoblastes et inhibe leur apoptose, ce qui favorise la formation osseuse51. Les incrétines telles que le Glucagon-like peptide-1 (GLP-1) et le Glucose-dependent insulinotropic polypeptide (GIP), qui sont libérées par les cellules intestinales Suite à un apport alimentaire, agissent en
stimulant la formation et en diminuant la résorption osseuse52,53. Plus spécifiquement, le GLP-1 stimule la
différenciation des cellules souches mésenchymateuses (qui donnent naissance aux ostéoblastes), augmente le nombre d’ostéoblastes actifs et augmente l’expression d’OPG (inhibiteur de la résorption). De plus, le GLP-1 ralentit la prolifération des ostéoclastes, résultant en une diminution de leur nombre. L’effet du peptide YY (PYY) sur le remodelage osseux n’est pas entièrement élucidé, mais les évidences suggèrent qu’une augmentation de la sécrétion de PYY suite à une prise alimentaire serait associée à une diminution de la masse osseuse25,54.
Finalement, l’insuline sécrétée par le pancréas suite à une augmentation de la glycémie agit également sur la formation osseuse en stimulant la prolifération et la différentiation des ostéoblastes55.
La leptine et l’adiponectine, deux hormones sécrétées par le tissu adipeux, exercent des effets opposés sur le remodelage osseux. La leptine entraîne une augmentation de l’activité ostéoblastique, alors que l’adiponectine module la voie RANKL/OPG, ce qui résulte en une augmentation de la résorption osseuse56,57. Finalement, les
oestrogènes et la testostérone influencent également le remodelage osseux par plusieurs mécanismes. Les oestrogènes augmentent l’activité ostéoblastique et inhibent l’activité ostéoclastique en induisant l’apoptose des ostéoclastes et en augmentant l’expression d’OPG58,59. La testostérone possède évidemment des effets
anaboliques puissants, mais son effet principal sur le remodelage osseux serait via son aromatisation en oestrogènes60. En effet, la testostérone est convertie en oestrogènes par l’enzyme aromatase, notamment dans
le tissus adipeux61.
Facteurs mécaniques qui régulent le remodelage osseux
En troisième lieu, les forces, les impacts et les stress mécaniques sont également impliqués dans le remodelage osseux. Les ostéocytes agissent comme mécanorécepteurs et perçoivent les changements de forces appliquées sur l’os62. Les ostéocytes peuvent ainsi traduire des signaux permettant d’activer ou d’inhiber le
remodelage. La présence d’une fracture influence le remodelage osseux par une diminution aiguë de la formation osseuse secondaire à la sécrétion de cortisol. Par la suite, la résorption et la formation augmentent jusqu’à plusieurs mois après la fracture, reflétant le processus de guérison de la fracture63. L’immobilisation se
traduit également par une augmentation de l’activité ostéoclastique. Ainsi, la charge mécanique est un stimulus nécessaire au maintien de la masse osseuse64. Lorsqu’un os n’est pas sollicité, il s’ensuit une diminution de la
formation osseuse et une augmentation de la résorption osseuse, tel qu’observé en contexte d’immobilisation ou d’alitement. Enfin, il est important de spécifier que la charge mécanique n’est pas seulement expliquée par le poids corporel. En effet, les impacts, les tensions et les stress mécaniques induits par une activité physique (course à pied, sauts, sports de raquettes, musculation, etc.) permettent aussi le maintien d’un bon remodelage osseux.
Autres facteurs et déterminants impliqués dans le remodelage osseux
Plusieurs autres facteurs peuvent également influencer le remodelage osseux. Le rythme circadien influence la résorption osseuse, celle-ci étant augmentée durant la nuit et diminuée pendant la journée65. De plus, l’apport
alimentaire et le jeûne engendrent aussi des variations dans l’activité ostéoclastique. En effet, la résorption osseuse est supprimée suite à un apport alimentaire, alors qu’elle est augmentée lors d’un jeûne (p. ex. pendant la nuit)66. Finalement, d’autres déterminants non modifiables influencent aussi le remodelage osseux.
L’avancement en âge et la prise de certains médicaments (thiazolidinediones (hypoglycémiants oraux) et corticostéroïdes) sont responsables d’un découplage du remodelage osseux, soit d’une diminution de la formation osseuse et une augmentation de la résorption osseuse67,68.
1.2.2 Marqueurs sanguins de la formation et de la résorption osseuse
Il est possible d’apprécier le taux du remodelage osseux en mesurant des marqueurs sanguins propres à la formation ou à la résorption osseuse. Ces marqueurs sont des produits des réactions, ou des facteurs impliqués dans l’une ou l’autre des phases, et nous indiquent l’activité cellulaire associée à la formation ou à la résorption osseuse. L’évaluation du remodelage osseux est utile afin de mieux comprendre la pathophysiologie de la
fragilité osseuse. Les changements spécifiques des marqueurs peuvent également être utilisés pour monitorer la réponse à certains traitements.
Marqueurs de la résorption osseuse
Les marqueurs de la résorption osseuse sont des molécules, des protéines ou des enzymes qui reflètent l’activité ostéoclastique. Le C-terminal télopeptide, ou CTX, est le marqueur le plus utilisé dans la littérature. Le CTX est libéré lors de la dégradation du collagène de type 1 par les ostéoclastes69. Un taux élevé de CTX révèle
donc une résorption osseuse augmentée. Le TRACP5b (tartrate-resistant acid phosphatase 5b) est une enzyme sécrétée par les ostéoclastes actifs et informe sur le nombre d’ostéoclastes70. Enfin, RANKL est également
utilisé pour révéler l’activité des ostéoclastes puisqu’il est le principal facteur qui stimule leur maturation. Le ratio RANKL/OPG indique, quant à lui, l’activité ostéoclastique71. Bien que moins utilisés de nos jours, le N-terminal
télopeptide (NTX), la pyridinoline et la deoxypyridinoline sont d’autres marqueurs de la résorption osseuse mesurés dans l’urine72.
Marqueurs de la formation osseuse
Comme pour les marqueurs de la résorption, les marqueurs de la formation osseuse nous informent sur l’activité des ostéoblastes. Le propeptide N-terminal du procollagène de type 1 (P1NP) est une glycoprotéine clivée lors de la synthèse du collagène de type 1 dans la matrice osseuse, reflétant ainsi la formation osseuse69.
L’ostéocalcine est une hormone peptidique sécrétée par les ostéoblastes matures qui favorise la fixation de l’hydroxyapatite à la substance fondamentale lors du processus de minéralisation72. Cette hormone se retrouve
sous plusieurs formes dans la circulation sanguine (forme intacte, décarboxylée, complètement décarboxylée et en fragments). Seule la forme intacte est utilisée pour mesurer l’activité ostéoblastique. La phosphatase alcaline osseuse est une enzyme également utilisée pour mesurer la formation osseuse. Cette glycoprotéine membranaire spécifique aux ostéoblastes intervient dans la formation du tissu ostéoïde et dans le processus de minéralisation, nous informant ainsi de l’activité ostéoblastique72.
1.3 Évaluation de la densité minérale osseuse et du risque
fracturaire
1.3.1 Le densitomètre à rayons X (DXA)
Le densitomètre à rayon X (DXA) est la méthode d’imagerie la plus couramment utilisée en clinique pour évaluer la DMO, estimer le risque de fracture et diagnostiquer l’ostéoporose73-75. La DMO correspond à la quantité de
minéral osseux, soit d’hydroxyapatite, en grammes par centimètre carré (g/cm2). La mesure de la DMO par DXA
est utilisée pour interpréter le score T, qui compare le résultat de DMO obtenu à la DMO moyenne de jeunes adultes du même sexe76. L’évaluation de la DMO se fait principalement au niveau de la hanche et de la colonne
lombaire, où le score T est utilisé pour diagnostiquer l’ostéoporose77. L’utilisation du DXA comme outil de
référence comporte des avantages et des inconvénients. Les principaux avantages incluent la faible dose de radiation imposée au patient, une mesure précise pour la majeure partie de la population, l’accès à des bases de données normatives, ainsi que la reproductibilité et la rapidité de l’examen78. L’évaluation de la DMO au
niveau du col fémoral par DXA peut aussi être utilisée pour estimer le risque de fracture avec l’outil FRAX, développé par l’OMS. Toutefois, l’utilisation et l’interprétation des résultats du DXA comportent certaines limites. Premièrement, le DXA évalue la DMO selon deux dimensions, diminuant la précision des mesures principalement chez les enfants79, et expliquant les différences observées selon le sexe et l’ethnie80. Une
seconde limite est que le DXA assume que les tissus mous sont de composition homogène. Cependant, les tissus mous se composent de tissus musculaires et adipeux81. Par ailleurs, une étude a voulu tester l’effet de la
présence de tissu adipeux sur les résultats de DMO obtenus par DXA. Pour ce faire, ils ont évalué la DMO avant et après une augmentation simulée de tissu adipeux chez 13 adultes, et autour d’un « fantôme de calibrage », un objet dont nous connaissons la densité et qui est utilisé en imagerie pour calibrer les appareils de mesure. Cette étude a démontré que l’augmentation du tissu adipeux surestimait la DMO mesurée par DXA82. À l’opposé,
une autre étude a démontré qu’une perte de poids importante pouvait également surestimer la perte de DMO mesurée par DXA, particulièrement au niveau de la hanche83. Pour toutes ces raisons, l’évaluation de la DMO
par DXA chez une population ayant une obésité sévère peut introduire des incertitudes quant à la précision de la mesure, et ainsi limiter l’interprétation des résultats. Enfin, le poids des individus peut également limiter l’utilisation du DXA, puisque l’appareil supporte un poids maximal pouvant aller jusqu’à 450 livres (204 kg), selon l’appareil.
1.3.2 Autres modalités d’imagerie
D’autres méthodes d’imagerie sont également utilisées afin d’évaluer la DMO et même la qualité osseuse. La tomographie quantitative (QCT; Quantitative computed tomography) permet d’obtenir une image de l’os en 3 dimensions, et permet également une analyse spécifique de la DMO volumétrique de l’os cortical et de l’os trabéculaire. La tomographie quantitative périphérique (pQCT; peripheral quantitative computed tomography) et la tomographie quantitative périphérique à haute résolution (HR-pQCT; High-resolution peripheral quantitative computed tomography) sont deux appareils d’imagerie permettant d’évaluer la DMO et la qualité de l’os aux sites osseux périphériques, soit au niveau du tibia et du radius. Le pQCT et le HR-pQCT nous informent de la géométrie osseuse, soit de l’épaisseur et de la porosité de l’os cortical, et de la structure de l’os trabéculaire84.
Cependant, le HR-pQCT permet une meilleure résolution de l’image, et fournit également plus d’informations sur la microarchitecture osseuse. Enfin, ces méthodes principalement utilisées dans le domaine de la recherche permettent une évaluation plus précise de la solidité osseuse.
Chapitre 2. La dérivation biliopancréatique
2.1 Les principaux types de chirurgie bariatrique
2.1.1 Historique et prévalence des divers types de chirurgies bariatriques
La chirurgie bariatrique a vu le jour au début des années 1950 pour traiter l’obésité sévère. Depuis ce temps, les interventions chirurgicales ont évolué afin d’augmenter les bienfaits et limiter les complications et les effets secondaires. Il existe plusieurs types de chirurgie bariatrique, qui sont basés sur la restriction alimentaire avec ou sans malabsorption des nutriments. Les deux grandes classes de chirurgie bariatrique, soit les chirurgies de type restrictive et les chirurgies de type mixte restrictive et malabsorptive seront présentées en détail dans la section 2.1.3 Description des divers types de chirurgie bariatrique. Étant le seul traitement efficace pour engendrer une perte de poids suffisante et durable, ainsi que pour améliorer voire résoudre les problèmes de santé associés à l’obésité, l’engouement entourant la chirurgie bariatrique ne cesse d’augmenter7,15. En 2017,
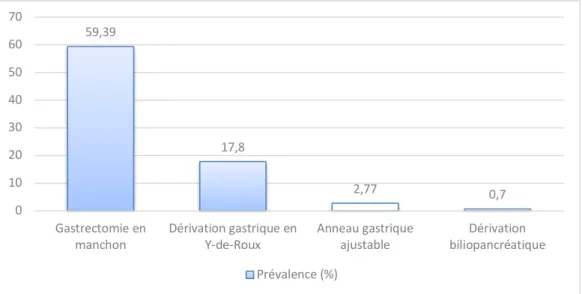
selon les données de l’« American Society for Metabolic and Bariatric Surgery (ASMBS) », 228 000 chirurgies bariatriques ont été réalisées à l’échelle mondiale, soit 70 000 de plus qu’en 2011. Selon ces mêmes données, les cinq types de chirurgie bariatrique les plus pratiqués sont la gastrectomie en manchon (59,39 %), la RYGB (17,80 %), l’anneau gastrique ajustable (2,77 %), et la DBP (0,70 %) (Figure 2). Au Canada, au courant de la dernière décennie, cette même tendance a été observée puisque le nombre de chirurgies pratiquées annuellement a plus que quintuplé entre 2006 et 2016 (Figure 3)16,17. De ce nombre, 80 % ont été réalisées au
Québec et en Ontario. La Figure 4 présente la répartition des divers types de chirurgies bariatriques pratiquées au Québec en 2013-2014. On remarque que la DBP est toujours offerte, faisant du Québec l’un des endroits dans le monde où cette chirurgie est la plus pratiquée85.
Figure 2. Prévalence mondiale des 4 principaux types de chirurgie bariatrique en 2017.
59,39 17,8 2,77 0,7 0 10 20 30 40 50 60 70 Gastrectomie en
manchon Dérivation gastrique enY-de-Roux Anneau gastriqueajustable biliopancréatiqueDérivation Prévalence (%)
Figure 3. Volume de chirurgies bariatriques pratiquées annuellement au Canada de 2006 à 2016.
Figure 4. Prévalence des divers types de chirurgies bariatriques réalisées au Québec en 2013-2014.
2.1.2 Critères d’admissibilité à la chirurgie bariatrique au Québec
Le critère d’admissibilité à la chirurgie bariatrique est d’avoir un indice de masse corporelle (IMC) supérieur ou égal à 40 kg/m2, ou supérieur ou égal à 35 kg/m2 pour les individus souffrant de comorbidités associées à
l’obésité14. Par ailleurs, comme énoncé précédemment, la chirurgie bariatrique est maintenant considérée pour
les individus ayant un IMC supérieur ou égal à 30 kg/m2 et qui souffrent d’un diabète de type 2, pour qui le
1578 1843 2389 3136 4437 5415 5989 6525 7904 8583 0 1000 2000 3000 4000 5000 6000 7000 8000 9000 10000
Nombre de chirurgies bariatriques pratiquées au Canada 2006-2007 2007-2008 2008-2009 2009-2010 2010-2011 2011-2012 2012-2013 2013-2014 2014-2015 2015-2016 50% 13% 26% 11% Gastrectomie en manchon Dérivation gastrique en Y-de-Roux
Anneau gastrique ajustable Dérivation biliopancréatique
contrôle glycémique n’est pas optimal avec la médication. Les individus désirant une chirurgie bariatrique doivent également être prêts à s’investir dans un suivi à long terme après la chirurgie. Ils doivent également s’engager à prendre des suppléments vitaminiques à vie et à adopter de saines habitudes de vie avant et après la chirurgie. Les contre-indications absolues à la chirurgie bariatrique comprennent la dépendance à l’alcool ou aux drogues, et la présence d’un trouble de santé mentale aigü ou instable. Les contre-indications relatives incluent une utilisation chronique de narcotiques et un âge de moins de 18 ans ou de plus de 60 ans. Comme toute intervention médicale, les individus doivent être en mesure de comprendre et d’accepter les risques, les bénéfices et les effets secondaires associés à la chirurgie.
2.1.3 Description des divers types de chirurgies bariatriques
La gastrectomie en manchon et l’anneau gastrique ajustable sont deux chirurgies purement restrictives, puisqu’aucune modification intestinale n’est réalisée. Pour la gastrectomie en manchon, les deux tiers de l’estomac sont retirés, ce qui limite la quantité de nourriture pouvant être consommée. L’anneau gastrique ajustable repose également sur le principe de restriction alimentaire. Cette chirurgie consiste à placer un anneau gastrique autour de la partie supérieure de l’estomac, ce qui diminue le volume de l’estomac et ralentit le passage des aliments vers l’intestin. La RYGB et la DBP sont deux chirurgies dites mixtes, puisqu’elles comprennent une composante restrictive et une composante malabsorptive, engendrant des changements métaboliques plus importants. Pour la RYGB, l’estomac est divisé en deux compartiments afin de former une petite poche gastrique reliée directement au jéjunum, soit la deuxième section de l’intestin grêle. L’autre compartiment est formé du reste de l’estomac et du début de l’intestin grêle, le duodénum. Les deux sections se rejoignent à 300 cm du gros intestin, formant ainsi l’anse commune où les nutriments sont absorbés. Enfin, pour la DBP, on procède d’abord à une gastrectomie en manchon, puis on dérive l’intestin grêle pour former une anse alimentaire et une anse biliopancréatique, dans lesquelles aucune absorption des nutriments n’est possible. Ces anses se rejoignent pour former l’anse commune, à environ 100 cm du gros intestin, allouant une absorption très limitée (Figure 5). Bien qu’elle soit la chirurgie bariatrique la moins pratiquée mondialement, la DBP demeure la plus efficace pour induire une perte de poids significative et durable, ainsi que pour la résolution des comorbidités en raison de son importante composante malabsorptive7,18. Sa faible prévalence est
principalement due à la complexité de la procédure et aux effets secondaires et indésirables possibles, tels que les carences en vitamines, minéraux et nutriments essentiels à la santé globale, et le risque de reflux gastrique, diarrhée, flatulence, ballonnement, etc.
Figure 5. Principaux types de chirurgies bariatriques.
Sources : https://www.chirurgiebariatrique.com/bande-gastrique.htm;http://iucpq.qc.ca/fr/soins-et-services/axes/obesite/programme-de-chirurgie-bariatrique/chirurgies-offertes GASTRECTOMIE VERTICALE FOIE VÉSICULE BILIAIRE PETIT INTESTIN (± 550 cm) PANCRÉAS PORTION ESTOMAC ENLEVÉE (≈2/3) PYLORE ŒSOPHAGE ESTOMAC CÔLON (GROS INTESTIN) DUODÉNUM
© Service audiovisuel IUCPQ, Qc
DÉRIVATION GASTRIQUE
FOIE VÉSICULE BILIAIRE
ANSE COMMUNE (tout le reste du petit intestin ± 300 cm) ANSE ALIMENTAIRE (100-150 cm) PANCRÉAS ESTOMAC PYLORE ŒSOPHAGE CÔLON (GROS INTESTIN) DUODÉNUM ANSE BILIOPANCRÉATIQUE (50-100 cm)
ANSE ALIMENTAIRE (aliments) ANSE BILIOPANCRÉATIQUE (bile + liquide pancréatique) ANSE COMMUNE (aliments + bile + liquide pancréatique) © Service audiovisuel IUCPQ, Qc
DÉRIVATION BILIOPANCRÉATIQUE FOIE VÉSICULE BILIAIRE ANSE ALIMENTAIRE (250 cm) ANSE COMMUNE (100 cm) ANSE BILIOPANCRÉATIQUE (± 300 cm) PANCRÉAS
ANSE ALIMENTAIRE (aliments) ANSE BILIOPANCRÉATIQUE (bile + liquide pancréatique) ANSE COMMUNE (aliments + bile + liquide pancréatique)
PORTION ESTOMAC ENLEVÉE (≈2/3) PYLORE ŒSOPHAGE CÔLON (GROS INTESTIN)
© Service audiovisuel IUCPQ, Qc ANNEAU GASTRIQUE AJUSTABLE
Chapitre 3. La solidité osseuse et la chirurgie
bariatrique
3.1 La solidité osseuse et la chirurgie bariatrique
Bien qu’elle comporte plusieurs bénéfices, la chirurgie bariatrique peut engendrer des conséquences délétères sur la solidité osseuse. Ces conséquences se traduisent par un risque de fracture accru, particulièrement démontré pour les chirurgies mixtes11,24,86-88. Cette section porte sur les changements qui surviennent après la
chirurgie bariatrique et qui peuvent avoir un impact sur la solidité des os, plus particulièrement sur les changements dans les marqueurs du remodelage osseux, de la DMO, et des diverses hormones qui pourraient être impliquées dans ces changements osseux. Les évidences scientifiques portent principalement sur la RYGB puisqu’elle était, jusqu’à tout récemment, la chirurgie la plus pratiquée mondialement.
3.1.1 Risque fracturaire après la chirurgie bariatrique
Une augmentation du risque de fracture variant selon le type de chirurgie bariatrique a été démontrée dans plusieurs études épidémiologiques11,24,86-88. À court terme, l’anneau gastrique ajustable ne semble pas être
associé à une augmentation du risque fracturaire11,88. À ce jour, les données sont insuffisantes pour conclure
sur le risque de fracture après la gastrectomie en manchon. D’un autre côté, les chirurgies mixtes sont associées à une augmentation du risque relatif de fracture variant entre 1,38 (intervalle de confiance à 95% : 1,23 – 1,55)11
et 1,47 (intervalle de confiance à 95% : 1,01 – 2,15)24 comparativement à des individus obèses, et entre 1,44
(intervalle de confiance à 95% : 1,29 – 1,59)11 et 2,3 (intervalle de confiance à 95% : 1,8 – 2,8)87
comparativement à des individus non-obèses. Une étude qui a été réalisée par notre groupe à l’aide des bases de données administratives de la RAMQ a démontré que seule la DBP était associée à un risque de fracture augmenté11. Cependant, ils n’ont pas été en mesure de déterminer si le risque de fracture était augmenté suite
à la RYGB et la gastrectomie en manchon comme le nombre de fractures n’était pas assez élevé pour la RYGB et la durée de suivi était trop courte pour la gastrectomie en manchon.
Après la chirurgie bariatrique, principalement la RYGB, on remarque que certains sites osseux sont plus susceptibles aux fractures, soit les sites typiques de fractures ostéoporotiques tels que le radius, l’humérus, la hanche, le col fémoral et la colonne lombaire11,86,87. Le risque accru engendré par les chirurgies bariatriques de
type mixte se manifesterait dans les 2 à 5 années suivant la chirurgie11,86-88. De plus, les sites fracturaires sont
également modifiés suite à la chirurgie, passant d’un patron affectant principalement les membres inférieurs distaux (cheville et tibia distal) dans une population avec obésité sévère, à un patron de fracture typique de l’ostéoporose (membres supérieurs, colonne lombaire, pelvis, hanche et fémur) après la chirurgie11. Somme
toute, les mécanismes responsables de ces changements demeurent incomplètement compris. L’augmentation du remodelage osseux, la diminution de la DMO et de la qualité osseuse contribuent tous possiblement à l’augmentation de la fragilité osseuse après la chirurgie bariatrique. Enfin, une étude a également démontré que le risque de chute était augmenté suite à la RYGB, ce qui pourrait contribuer au risque de fracture augmenté89.
3.1.2 Changements de la densité minérale osseuse et de la qualité osseuse après
la chirurgie bariatrique
Comparaison des outils de mesure de la densité minérale osseuse et de la qualité osseuse
La diminution de la DMO qui survient après la chirurgie bariatrique est sans contredit le résultat de plusieurs mécanismes qui ne sont pas encore tout à fait élucidés. Tel que discuté précédemment, l’outil de référence pour l’évaluation de la DMO est le DXA. En recherche, trois autres technologies sont également utilisées pour mesurer la DMO en 3 dimensions, augmentant ainsi la précision de la mesure. Le QCT, le pQCT et le HR-pQCT permettent d’obtenir des informations plus précises sur la solidité osseuse en nous renseignant sur la DMO, mais également sur la qualité de l’os. En contexte d’obésité, le QCT semble être un outil plus précis pour évaluer la DMO que le DXA, qui tend à surestimer la DMO à la hanche et à la colonne lombaire82. Pour les sites osseux
périphériques, la précision du HR-pQCT ne semble pas être affectée par l’obésité, dû à la dose de radiation supérieure qui accroît la précision de la mesure90,91.
Changement de la densité minérale osseuse par DXA après la chirurgie bariatrique
Plusieurs études ont mesuré les changements de la DMO suite aux divers types de chirurgie bariatrique, mais la RYGB reste le type de chirurgie le plus étudié. Une méta-analyse réalisée par Yu et al. a montré une diminution significative de la DMO au niveau de la hanche et de la colonne lombaire, mesurée par DXA ou QCT, un an après la RYGB28. Cependant, les résultats concernant la gastrectomie en manchon et l’anneau gastrique
ajustable sont contradictoires, ne permettant pas de statuer sur ces types de chirurgies. Néanmoins, on peut penser que l’anneau gastrique ajustable aurait un effet moindre sur la DMO, puisqu’elle engendre une perte de poids et des changements métaboliques moins importants. Pour ce qui est de la gastrectomie en manchon, d’autres évidences suggèrent qu’elle aurait un impact sur la DMO, mais qu’il serait inférieur à celui associé à la RYGB92-94. Enfin, la DBP serait le type de chirurgie qui engendrerait la diminution de la DMO la plus marquée,
dû à l’importante perte de poids, à la malabsorption intestinale et aux changements métaboliques associés.
Suite à la RYGB, une perte osseuse est observée au niveau des sites porteurs comme la hanche, le col fémoral et le tibia26,92,95, mais également au niveau du radius et des vertèbres lombaires26,27. Le degré de diminution de
la DMO diffère selon le site osseux. Le changement le plus marqué s’observe au niveau de la hanche, atteignant une diminution de la DMO de l’ordre de 6 % à 11 % à seulement un an après la RYGB26,92,93,96. Au niveau des
% à 1 an après la RYGB26,93. Aux sites osseux périphériques, soit au tibia et au radius, la diminution de la DMO
est plus variable, oscillant entre 4 % et 8 %, un à deux ans après la RYGB27,95,97. Au niveau de la hanche, le
changement de la DMO mesuré par QCT est généralement inférieur à celui mesuré par DXA26,92. Contrairement
à ce qui est observé à la hanche, la diminution observée à la colonne lombaire est généralement supérieure lorsque mesurée par QCT comparativement à la mesure par DXA96,97. Les discordances de DMO observées
selon les sites osseux entre le DXA et le QCT illustrent l’importance d’en tenir compte lors de l’interprétation des données. Ceci dit, toutes les études suggèrent une diminution rapide et significative de la DMO à tous les sites osseux après la RYGB, ce qui supporte l’implication d’un facteur systémique.
Comme la gastrectomie en manchon est une procédure plus récente, il y a moins de données sur la santé osseuse suite à ce type de chirurgie. Une méta-analyse récente a toutefois démontré une diminution significative de la DMO, mesurée par DXA, de 5 % au niveau de la hanche et du col fémoral alors que le changement à la colonne lombaire n’était pas significatif, 6 à 12 mois après cette chirurgie94. Notons cependant qu’une étude
incluse dans cette méta-analyse a également évalué le changement de DMO à l’aide du QCT et a montré une diminution significative de la DMO au niveau de la colonne lombaire, alors que les changements au niveau de la hanche et du col fémoral n’étaient pas significatifs92. Ces résultats contradictoires démontrent encore une
fois, tel que discuté précédemment, que le DXA et le QCT peuvent donner des résultats divergents dans cette population. Enfin, une seule étude a évalué le changement de DMO suite à la DBP. L’étude de Marceau et al. a montré que la DMO mesurée par DXA était, en moyenne, inchangée à 4 ans et à 10 ans après la DBP chez 33 individus98. Il est toutefois important de mentionner que les appareils et les technologies d’imagerie étaient
différents entre les mesures, ce qui a pu avoir une influence sur les changements observés. En effet, à l’entrée dans l’étude, la DMO était mesurée à l’aide d’un appareil d’absorptiométrie à double photon (Dual-photon
absorptiometry), alors que la DMO au terme du suivi était mesurée par DXA, rendant difficile la comparaison
des résultats.
Changements de la microarchitecture osseuse par HR-pQCT après la chirurgie bariatrique
La technologie par HR-pQCT permet d’évaluer avec précision différents déterminants de la qualité osseuse tels que la densité et l’épaisseur de l’os cortical et trabéculaire, la porosité corticale et la microarchitecture. Suite à la RYGB, il a été démontré que l’os cortical et trabéculaire subissaient des changements altérant leur structure et leur fonction26,27,95,99. En effet, la RYGB engendrerait une diminution de la densité et de l’épaisseur de l’os
cortical, une augmentation de la porosité corticale27, et une détérioration de la microarchitecture95,99. De plus,
l’aire de l’os trabéculaire tendrait à augmenter alors que le volume trabéculaire et le nombre de travées diminuraient26,27,95. Une étude a également montré que la détérioration de la microarchitecture osseuse persistait