© Michela Del Prete, 2019
Thérapie radionucléidique personnalisée des tumeurs
neuroendocrines
Thèse
Michela Del Prete
Doctorat en médecine expérimentale
Philosophiæ doctor (Ph. D.)
Thérapie radionucléidique personnalisée des
tumeurs neuroendocrines
Thèse
Michela Del Prete, MD
Sous la direction de :
Jean-Mathieu Beauregard, directeur de recherche
III
Résumé
Cette thèse de doctorat porte sur le traitement personnalisé des tumeurs
neuroendocrines (TNE) en utilisant la thérapie radiométabolique par 177Lu-octréotate.
Comme la plupart des TNE surexpriment des récepteurs de la somatostatine (RSST)s, les analogues de la somatostatine radiomarqués sont utilisés dans le diagnostic des TNE par imagerie moléculaire, ainsi que pour la radiothérapie interne en utilisant des radionucléides émetteurs bêta (PRRT : peptide receptor radionuclide therapy). Les protocoles actuels de la
PRRT impliquent l’administration de 4 cycles d’une activité fixe de 177Lu-octréotate (p. ex.
7,4 GBq), ce qui donne des doses de radiation absorbée très variables pour les organes critiques et les lésions tumorales. Les faibles taux de toxicité sérieuse rénale et
hématopoïétique (< 1 %) après traitement au 177Lu-octréotate suggèrent que la plupart des
patients reçoivent un traitement sous-optimal. La mise en place d’une personnalisation de l’activité administrée en fonction de la dosimétrie individualisée par imagerie moléculaire quantitative pourrait donc permettre de maximiser la réponse chez chaque patient, comparativement au régime empirique, et ce, en augmentant la dose tumorale absorbée sans dépasser les seuils de toxicité aux organes critiques. Les objectifs de cette thèse étaient donc, (i) de simuler un régime de PRRT personnalisée (P-PRRT) à partir d’une cohorte de patients atteints de TNE traités par PRRT empirique, (ii) de rapporter les premiers résultats dosimétriques, d’efficacité et de toxicité de notre essai prospectif de PRRT personnalisée (NCT02754297) et finalement (iii) d’évaluer l’exactitude et la reproductibilité interobservateurs des protocoles simplifiés de dosimétrie à deux temps (Jour 1 et 3) ou à un temps unique (Jour 3) basés sur la tomographie quantitative par émission de photon
(QSPECT : quantitative single-photon emission computed tomography) effectuée après
chaque administration de thérapie. Un autre objectif de la dernière étude était la mise à jour de notre protocole personnalisé de prescription de l’activité injectée (AI).
(i) Pour répondre au premier objectif, nous nous sommes basés sur une étude
rétrospective afin de concevoir un protocole personnalisé de PRRT basé sur les calculs dosimétriques. Par la suite, une simulation de ce protocole a été effectuée rétrospectivement chez des patients atteints de TNE traités par PRRT depuis 2012 à l’Hôpital de l’Hôtel-Dieu
IV
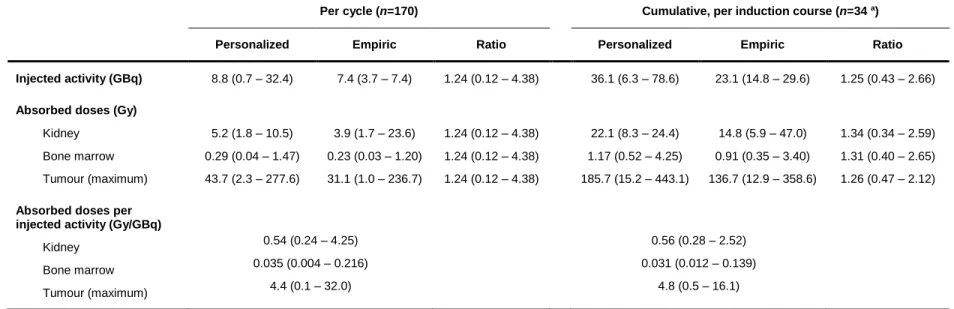
de Québec. Selon notre régime personnalisé de PRRT, la dose rénale absorbée par AI était prédite en fonction de la surface corporelle (SC) et le taux de filtration glomérulaire (TFG) pour le premier cycle de traitement, et par la dosimétrie rénale du cycle précédent (ou la moyenne de la dosimétrie rénale des deux derniers cycles) pour les cycles suivants. En normalisant la dose rénale absorbée administrée pendant les cycles d’induction, notre approche personnalisée a démontré une augmentation moyenne significative de 1,48 fois la dose cumulative maximale absorbée par la tumeur par rapport au régime empirique, augmentant potentiellement le bénéfice thérapeutique sans dépasser le seuil de toxicité rénale.
(ii) Sur la base de notre étude rétrospective, et en appliquant le protocole de PRRT
personnalisée développé aux patients atteints de TNE métastatique traités depuis avril 2016 à l’Hôpital de l’Hôtel-Dieu de Québec, nous avons rapporté les premiers résultats dosimétriques sur l’efficacité et la toxicité de notre essai prospectif de PRRT personnalisée. Notre approche personnalisée a démontré une augmentation significative de la dose tumorale absorbée médiane de 1,26 fois par rapport au régime de PRRT empirique simulé sans augmenter le taux de toxicité sérieuse des organes critiques liée au traitement. Le traitement personnalisé a donné un taux de réponse partielle ou mineure de 59 % avec une stabilité dans 33,3 % des cas. En particulier, la PRRT personnalisée a induit une réponse partielle ou mineure chez 84,6 % des patients atteints de TNE d’origine pancréatique (pTNE). Finalement, le profil de sécurité est similaire à celui du régime empirique alors qu’aucun patient n’a présenté d'insuffisance rénale sévère.
(iii) La dosimétrie, obtenue à l’aide de petits volumes d’intérêt pour l'échantillonnage
de concentration d’activité pour le rein, la moelle osseuse et la tumeur dominante, est basée sur trois temps (Jour 0, 1 et 3) selon la pratique courante. Toutefois, en raison de la complexité de cette procédure, des méthodes de dosimétrie plus pratiques mais robustes sont nécessaires pour une adoption clinique étendue. Nous avons démontré qu’un protocole simplifié de dosimétrie basé sur des images QSPECT à deux temps fournit des estimations de dose reproductibles et plus précises que les techniques basées sur un seul temps. Nous avons aussi observé une excellente reproductibilité interobservateurs, en particulier pour la dose rénale, en utilisant les deux méthodes les plus précises basées sur trois ou deux temps
V
avec des erreurs moyennes < 1 % et des écarts-types ≤ 5 %. Finalement, nous avons mis à jour notre protocole de P-PRRT : la dose rénale absorbée peut être normalisée en personnalisant l’AI en fonction du produit du TFG avec la SC pour le premier cycle et de la dosimétrie rénale précédente pour les cycles subséquents.
En conclusion, nous avons conçu et validé un protocole de personnalisation de la
PRRT au 177Lu-octréotate basé sur la dosimétrie, dans lequel la dose absorbée au rein est
contrôlée et normalisée. La personnalisation de la PRRT permet d’augmenter de façon significative la dose absorbée à la tumeur, et ainsi la probabilité d’obtenir une meilleure réponse thérapeutique, tout en limitant le risque de toxicité aux organes critiques. Nous proposons également un protocole de dosimétrie simplifiée, basé sur l'imagerie QSPECT en deux temps, en utilisant des petits volumes d’intérêt. Cette méthode donne des résultats de dosimétrie précis, notamment pour les reins et la tumeur, et une reproductibilité interobservateur élevée.
VI
Abstract
This doctoral thesis is focused on the personalized treatment of neuroendocrine
tumours (NET) using 177Lu-octreotate radiometabolic therapy. Since NETs overexpress
somatostatin receptors (SSRT)s, radiolabeled somatostatin analogues are used in the diagnosis of NETs by molecular imaging, and for internal radiotherapy using beta-emitting radionuclides (PRRT: peptide receptor radionuclide therapy). The existing protocols for
PRRT involve the administration of 4 cycles of a fixed activity of 177Lu-octreotate (i.e., 7.4
GBq), which gives highly variable absorbed radiation doses to critical organs and tumor
lesions. The low incidence of serious renal and hematopoietic toxicities (< 1 %) of 177
Lu-octreotate suggests that the majority of patients are undertreated. The personalization of the administered activity according to the individualized dosimetry obtained from quantitative molecular imaging could make possible to maximize the response in each patient, compared to the empirical regime, without exceeding the thresholds of toxicity to the critical organs. The objectives of this thesis were, therefore (i) to simulate a personalized PRRT (P-PRRT) regime in a cohort of patients with NET treated with empiric PRRT, (ii) to report the preliminary data on dosimetry, efficacy and safety from our prospective PRRT trial and (iii) to assess the accuracy and the inter-observer reproducibility of simplified two time points (Day 1 and 3) or one time point (Day 3) dosimetry protocols based on quantitative single-photon emission computed tomography (QSPECT) performed after each PRRT cycle. Another objective of the last study concerned the update of our P-PRRT protocol.
(i) We first reviewed retrospective data on patients with NETs treated with PRRT
since 2012 at l’Hôtel-Dieu de Québec hospital. According to our P-PRRT regimen, the renal absorbed dose per injected activity (IA) was predicted by the body surface (BSA) and the glomerular filtration rate (GFR) for the first induction cycle, and by the renal dosimetry of the previous cycle (or the average renal dosimetry of the last two cycles) for the following cycles. By normalizing the absorbed renal dose administered during the induction cycles, our personalized approach resulted in an average 1.48-fold increase in the maximum
VII
cumulative tumour absorbed dose compared with the empiric regimen, potentially increasing the therapeutic benefit without exceeding the threshold of renal toxicity.
(ii) Based on our retrospective study and applying our developed personalized PRRT
protocol to the patients with metastatic NET treated since April 2016 at l’Hotel-Dieu de Québec hospital, we reported the preliminary data on dosimetry, efficacy and safety from our prospective PRRT trial. Our personalized approach yielded a significant increase in the median absorbed tumor dose (1.26 fold) compared with the simulated empirical PRRT regimen, without increasing the rate of serious treatment-related toxicity for critical organs. The personalized treatment gave a partial or minor response rate of 59 % and stability in 33.3 % of cases. In particular, the personalized PRRT regime resulted in a partial or minor response in 84.6 % of patients with NET of pancreatic origin (pNET). Finally, the safety profile was similar to that of the empirical regimen whereas, no patient has had severe renal impairment.
(iii) According to the current practice, the dosimetry, obtained using small volumes of
interest activity for concentration sampling in the kidney, bone marrow and the dominant tumor, is based on three time points (day 0, 1 and 3). However, due to the complexity of this procedure, more practical yet robust dosimetry methods are required for extended clinical use. We have observed that a simplified dosimetry protocol based on two-time point QSPECT scanning on Day 1 and 3 after PRRT treatment provides reproducible and more accurate dose estimates than the techniques relying on a single time point for non-initial or all cycles. We also observed an excellent inter-observer reproducibility, in particular for the renal absorbed dose using the two most precise dosimetry methods based on three or two time points with mean relative errors < 1 % and standard deviations ≤ 5 %. In addition, we have updated our P-PRRT protocol. In particular, renal absorbed radiation dose over a four-cycle induction PRRT course can be standardized by personalizing IA based on the product of estimated GFR with BSA for the first cycle, and on prior renal dosimetry for the subsequent cycles.
In conclusion, we have designed and validated a personalized PRRT protocol with
VIII
and standardized. The personalization of PRRT can significantly increase the dose absorbed to the tumor, and thus the probability of obtaining a better therapeutic response, while limiting the risk of toxicity to critical organs. We also proposed a simplified dosimetry protocol, based on two time-points QSPECT scans, using small volumes of interest. This method gives accurate dosimetry results, especially for the kidneys and the tumors, and high interobserver reproducibility.
IX
Table des matières
RÉSUMÉ ... III ABSTRACT ... VI TABLE DES MATIÈRES ... IX LISTE DES TABLEAUX ... XI LISTE DES FIGURES ... XIII LISTE DES ABRÉVIATIONS ... XIV REMERCIEMENTS ... XVI AVANT-PROPOS ... XVII INTRODUCTION ... 1 TUMEURS NEUROENDOCRINES ... 1 INCIDENCE ET SURVIE ... 1 CLASSIFICATION ... 2 DIAGNOSTIC ... 7 TRAITEMENTS ... 14
ANALOGUES DE LA SOMATOSTATINE (ASST) RADIOMARQUÉS ... 20
PROTOCOLE DE THÉRAPIE RADIOMÉTABOLIQUE EMPIRIQUE ... 26
EFFICACITÉ ... 27
TOXICITÉ ... 29
PROBLEMATIQUE ... 29
OBJECTIFS ... 31
CHAPITRE 1 : PERSONALIZED 177LU-OCTREOTATE PEPTIDE RECEPTOR RADIONUCLIDE THERAPY OF NEUROENDOCRINE TUMOURS: A SIMULATION STUDY ... 33
RÉSUMÉ ... 34
ABSTRACT ... 36
INTRODUCTION ... 38
MATERIALS AND METHODS ... 39
RESULTS ... 48
DISCUSSION ... 59
ACKNOWLEDGEMENTS ... 63
X
CHAPITRE 2 : PERSONALIZED 177LU-OCTREOTATE PEPTIDE RECEPTOR RADIONUCLIDE THERAPY OF NEUROENDOCRINE TUMOURS: INITIAL RESULTS FROM THE P-PRRT
TRIAL ... 67
RESUME ... 68
ABSTRACT ... 70
INTRODUCTION ... 72
MATERIALS AND METHODS ... 73
RESULTS ... 79
DISCUSSION ... 98
REFERENCES ... 103
CHAPITRE 3 : ACCURACY AND REPRODUCIBILITY OF SIMPLIFIED QSPECT DOSIMETRY FOR PERSONALIZED 177LU-OCTREOTATE PRRT ... 106
RÉSUMÉ ... 107 ABSTRACT ... 109 BACKGROUND ... 111 METHODS ... 112 RESULTS ... 121 DISCUSSION ... 133 CONCLUSIONS ... 136 REFERENCES ... 140 DISCUSSION... 142
CONCEPTION ET SIMULATION D’UN RÉGIME DE PRRT PERSONNALISÉE ... 142
VALIDATION D’UN RÉGIME DE PRRT PERSONNALISÉE ... 144
EFFICACITÉ ... 145
TOXICITÉ ... 148
RELATION DOSE – EFFET ... 149
MÉTHODE OPTIMALE DE CALCUL DOSIMÉTRIQUE ... 150
VARIABILITÉ INTEROBSERVATEUR ... 152
CONCLUSION ... 152
BIBLIOGRAPHIE ... 154
ANNEXES ... 164
CHAPITRE 1:SUPPLEMENTAL FIGURES ... 164
XI
Liste des tableaux
Tableau 0 - 1 Principales tumeurs primitives et leur prévalence selon l’origine embryologique (Frilling et al.
2012). ... 3
Tableau 0 - 2 Nouvelle classification de l’organisation mondiale de la santé (oms) des TNE (Lloyd rv 2017) 4 Tableau 0 - 3 Caractéristiques anatomiques, cliniques et biochimiques des TNE (Mignon 2000; Kaltsas, Besser, and Grossman 2004). ... 9
Tableau 0 - 4 Affinite de liaison de la somatostatine et des asst avec les sous-types de RSST [traduit de (Baldelli et al. 2014)]. ... 16
Tableau 0 - 5 Caracteristiques physiques des radionucleides utilises dans la therapie radionucleidique des TNE (Teunissen et al. 2005) ... 23
Table 1 - 1 Patient characteristics ... 40
Table 1 - 2 Comparison of administered activity and absorbed doses between the empiric and personalized PRRT regimes ... 42
Table 1 - 3 Objective responses measured 3 months after the fourth induction cycle ... 52
Table 1 - 4 Biochemical and symptomatic responses determined 3 months after the fourth induction cycle . 52 Table 1 - 5 Toxicity ... 55
Table 2 - 1 Patient characteristics (n=52) ... 80
Table 2 - 2 Dosimetry of personalized PRRT and comparison with simulated empiric PRRT ... 82
Table 2 - 3 Response and survival (n=39) ... 88
Table 2 - 4 Best response per NET subgroup ... 90
Table 2 - 5 Per-cycle and per-patient acute and subacute side effects ... 92
Table 2 - 6 Per-cycle and per-patient haematological and biochemical toxicity ... 93
Table 3 - 1 Patient characteristics ... 113
Table 3 - 2 Tissue-specific effective half-lives derived from activity concentration at day 1 and day 3, and absorbed doses per injected activity for the 3TP reference method (n = 279) ... 121
Table 3 - 3 Per-cycle dosimetry estimates obtained with three, two- and one-time-point methods (n = 279) 123 Table 3 - 4 Per-cycle dosimetry estimates obtained with hybrid methods based on two time points for first cycle and one time point or no imaging at all for subsequent cycles (induction cycles only, n = 173) . 125 Table 3 - 5 Cumulative dosimetry estimates obtained in patients having completed three or four evaluable induction cycles (n = 65) ... 127 Table 3 - 6 Inter-observer variability of dosimetry estimates in 60 induction cycles received by 15 patients 129
XII
Table 3 - 7 Correlation between body size predictors, eGFR and the IA per renal absorbed dose (Gbq/Gy) at the first induction cycle (n=77) ... 132
Suppl. Table 2 - 1 Detailed renal dosimetry of patients who completed the induction course of personalized PRRT, with comparison to simulated empiric PRRT (n=34) ... 174 Suppl. Table 2 - 2 Detailed bone marrow dosimetry of patients who completed the induction course of
personalized PRRT, with comparison to simulated empiric PRRT (n=34) ... 176 Suppl. Table 2 - 3 Detailed maximum tumour dosimetry of patients who completed the induction course of
personalized PRRT, with comparison to simulated empiric PRRT (n=34) ... 177 Suppl. Table 2 - 4 Symptomatic and quality of life response according to the EORTC C30 and
XIII
Liste des figures
Fig. 0 - 1 ... 22 Fig. 0 - 2 ... 25 Fig. 0 - 3 ... 26 Fig. 1 - 1 ... 49 Fig. 1 - 2 ... 54 Fig. 1 - 3 ... 56 Fig. 1 - 4 ... 57 Fig. 1 - 5 ... 58 Fig. 2 - 1 ... 83 Fig. 2 - 2 ... 84 Fig. 2 - 3 ... 86 Fig. 2 - 4 ... 90 Fig. 2 - 5 ... 95 Fig. 2 - 6 ... 96 Fig. 2 - 7 ... 97 Fig. 3 - 1 ... 115 Fig. 3 - 2 ... 117 Fig. 3 - 3 ... 124 Fig. 3 - 4 ... 126 Fig. 3 - 5 ... 130 Fig. 3 - 6 ... 131 Suppl. Fig. 1 - 1 ... 164 Suppl. Fig. 1 - 2 ... 167 Suppl. Fig. 1 - 3 ... 171
XIV
Liste des abréviations
ACDF Activity concentration dose factor AI Activité injectée
ASST Analogues de la somatostatine BM Bone marrow
BSA Body surface area
CNE Carcinome neuroendocrinien
CTCAE Common toxicity criteria for adverse events Cg-A Chromogranine A
eGFR Estimated glomerular filtration rate GEP Gastro-entéro-pancréatique
5-HIAA 5-hydroxyindoleacetic acid 5-HT 5-hydroxytryptamine IA Injected activity
IRM Imagerie par résonance magnétique LBW Lean body weight
mTOR Mammalian target of rapamycin MR Minor response
NNE Néoplasie neuroendocrine NET Neuroendocrine tumor OS Overall survival PD Progressive disease
PET Positron emission tomography PFS Progression-free survival PCM Poids corporel maigre PR Partial response
PRRT Peptide receptor radionuclide therapy
P-PRRT Personalized peptide receptor radionuclide therapy
pTNE Tumeur neuroendocrine pancréatique
QSPECT/CT Quantitative single-photon emission computed tomography/computed
tomography
RECIST Response evaluation criteria in solid tumors RSST Récepteur de la somatostatine
SC Surface corporelle SG Survie globale SD Stable disease
SSP Survie sans progression SSTR Somatostatin receptor STZ Streptozotocine
SUV Standardized uptake value SWOG Southwest Oncology Group
TEP Tomographie par émission de positrons TFG Taux de filtration glomérulaire
XV TMZ Temozolomide
TNE Tumeur neuroendocrine VOI Volume of interest
XVI
Remerciements
Je souhaite en premier lieu remercier mon mari, Gaetano, avec lequel on a choisi de vivre cette expérience et qui m’a toujours soutenue et motivée tout au long de mon doctorat.
Je souhaite aussi remercier grandement mon directeur de recherche Dr Jean-Mathieu Beauregard qui m’a toujours guidée dans mon projet et m’a donné des précieux conseils, ainsi que mon codirecteur de recherche Philippe Després.
Je souhaite aussi remercier beaucoup le Dr François-Alexandre Buteau et le Dr Fréderic Arsenault qui m’ont donné toute l’aide et le soutien dont j’ai eu besoin et tous les techniciens et travailleurs du service de médecine nucléaire de l’Hôpital de l’Hôtel-Dieu de Québec.
Un grand merci à tous les amis avec lesquels j’ai eu la chance d’être en contact et qui ont été ma famille lorsque nous étions loin de notre pays. Cette expérience m’a permis de partager de connaissances, des valeurs et m’a donné l’opportunité de pouvoir échanger avec des personnes qui viennent de partout dans le monde.
XVII
Avant-propos
Les résultats de la présente thèse sont présentés sous forme d’insertion de trois articles de recherche originale.
1) Del Prete Michela, Buteau François-Alexandre, Beauregard Jean-Mathieu.
Personalized 177Lu-octreotate peptide receptor radionuclide therapy of
neuroendocrine tumours: a simulation study. Eur J Nucl Med Mol Imaging. 2017 Aug;44(9):1490-1500. Doi: 10.1007/s00259-017-3688-2. Epub 2017 Mar 31. Accepté et publié
2) Del Prete Michela, Buteau François-Alexandre, Arsenault Fréderic, Saighi Nassim, Bouchard Louis-Olivier, Alexis Beaulieu, Beauregard Jean-Mathieu. Personalized
177Lu-octreotate peptide receptor radionuclide therapy of neuroendocrine tumours:
initial results from the P-PRRT trial. Eur J Nucl Med Mol Imaging. 2018 Nov 30. doi: 10.1007/s00259-018-4209-7. [Epub ahead of print]. Accepté et publié
3) Del Prete Michela, Arsenault Fréderic, Saighi Nassim, Zhao Wei, Buteau François-Alexandre, Celler Anna, Beauregard Jean-Mathieu. Accuracy and reproducibility of
simplified QSPECT dosimetry for personalized 177Lu-octreotate PRRT. EJNMMI
Phys. 2018 Oct 15;5(1):25. doi: 10.1186/s40658-018-0224-9. Accepté et publié Le premier article est intégré dans le chapitre 2 de cette thèse. Il est inséré tel que publié en mars 2017 dans la revue scientifique European Journal of Nuclear Medicine and
Molecular Imaging. L’article a été rédigé par le Dr Michela Del Prete qui est la première
auteure. Dr Michela Del Prete a participé aussi à la conception de l’étude, la collecte et l’analyse des données. Dr Jean-Mathieu Beauregard, directeur du projet de la thèse, a participé à la conception de l’étude, la révision, la correction et la soumission de l’article pour sa publication. Les docteurs Jean-Mathieu Beauregard, François-Alexandre Buteau et Michela Del Prete ont contribué au traitement par thérapie radiométabolique de l’ensemble des patients évalués dans la publication.
XVIII
Le deuxième article est intégré dans le chapitre 3 de cette thèse. Il est inséré tel que publié en octobre 2018 dans la revue scientifique European Journal of Nuclear Medicine
and Molecular Imaging. L’article a été rédigé par le Dr Michela Del Prete qui est la
première auteure. Dr Michela Del Prete a participé aussi à la conception de l’étude, à la collecte et à l’analyse des données. Dr Jean-Mathieu Beauregard, directeur du projet de la thèse, a conçu l’étude, supervisé le projet, corrigé et soumis l’article pour publication. Dr Fréderic Arsenault a participé à l’évaluation de la réponse tumorale fonctionnelle, Dr Louis-Olivier Bouchard a contribué à l’évaluation de la réponse tumorale morphologique et Nassim Saighi a collaboré pour l’analyse des données sur la qualité de vie des patients. Les docteurs Jean-Mathieu Beauregard, François-Alexandre Buteau, Fréderic Arsenault, Alexis Beaulieu et Michela Del Prete ont contribué au traitement par thérapie radiométabolique de l’ensemble des patients évalués dans la publication.
Le troisième article est intégré dans le chapitre 4 de cette thèse. Il est inséré tel que publié en octobre 2018 dans la revue scientifique EJNMMI Physics. L’article a été rédigé par le Dr Michela Del Prete qui est la première auteure. Dr Michela Del Prete a participé aussi à la conception de l’étude, à la collecte et à l’analyse des données. Dr Jean-Mathieu Beauregard, directeur du projet de la thèse, a conçu l’étude, supervisé le projet, corrigé et soumis l’article pour de publication. Dr Fréderic Arsenault et Nassim Saighi ont contribué à l’élaboration des données sur la variabilité interobservateur et effectué des analyses dosimétriques. Le Professeur Anna Celler et Wei Zhao ont contribué à l’analyse et révision de l’article. Les docteurs Jean-Mathieu Beauregard, François-Alexandre Buteau, Fréderic Arsenault, Alexis Beaulieu et Michela Del Prete ont contribué au traitement par thérapie radiométabolique de l’ensemble des patients évalués dans la publication.
1
Introduction
Tumeurs neuroendocrines
Les tumeurs neuroendocrines (TNE) constituent un groupe de tumeurs hétérogènes qui proviennent des cellules entérochromaffines du système endocrinien diffus. Ce système comprend les cellules neuroendocrines des surrénales, des parathyroïdes, des îlots pancréatiques, de l’hypophyse, des cellules C de la thyroïde ainsi que des cellules neuroendocrines dispersées au niveau du tube digestif, du foie, des voies biliaires et du poumon (Leotlela et al. 2003).
Les cellules neuroendocrines sont capables de produire des amines et peptides (sérotonine, chromogranines, kinines) et expriment des marqueurs tissulaires généraux et spécifiques, tels que les récepteurs de la somatostatine (RSST).
Incidence et survie
Ces tumeurs sont rares, à croissance généralement lente avec une prévalence de 48 diagnostics sur 100 000 et une incidence annuelle de 6,98 diagnostics sur 100 000 (Modlin, Lye, and Kidd 2003; Hemminki and Li 2001; Yao et al. 2008; Dasari et al. 2017). On observe une tendance à la hausse de la prévalence qui peut être expliquée par l’amélioration des techniques d’imagerie endoscopique, radiologique et de médecine nucléaire, qui a augmenté le nombre des TNE diagnostiquées (Modlin et al. 2008). Environ 60 % des TNE proviennent du tractus gastro-entéro-pancréatique (GEP) tandis qu’environ 25 % proviennent du tractus broncho-pulmonaire (Lawrence et al. 2011; Frilling et al. 2012).
La survie à 5 ans est d’environ 60 %, et plus de 50 % des patients atteints de TNE peuvent être diagnostiqués d’une maladie métastatique, surtout au niveau du foie, qui est l’organe le plus touché par le développement métastatique. Certaines TNE se comportent comme des tumeurs malignes, progressant rapidement, avec risque de métastases et de rechutes après traitements. Certaines tumeurs démontrent une grande stabilité dans le temps, mais vont, par la suite, progresser rapidement, alors qu’autres progressent
2
rapidement dès le début. Ceci a pour conséquence un diagnostic tardif, au stade métastatique du développement où la chirurgie curative n’est plus envisageable (Modlin et al. 2008).
Classification
La classification des TNE, initialement classées comme tumeurs carcinoïdes, a subi plusieurs modifications depuis leur découverte en 1907 (Modlin, Shapiro, and Kidd 2004). En 1964, une première classification des TNE en fonction de leurs origines embryologique et anatomique a été adoptée (dérivée de l’intestin antérieur, moyen et postérieur) (Pearse 1969), mais c’est seulement à partir de 1995 que le terme « TNE » a été introduit pour designer toutes les tumeurs développées à partir du système endocrinien diffus (Capella et al. 1995).
Actuellement, les TNE peuvent être classées selon leur origine et leur siège, leur origine histologique et leur génétique, ou encore selon les secrétions hormonales qu’elles produisent.
Classification basée sur l’embryologie et l’organe
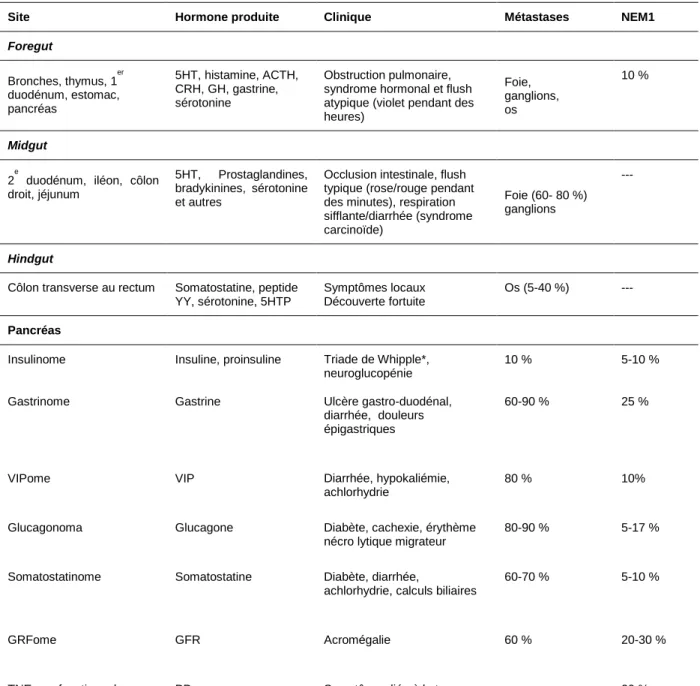
D’un point de vue embryologique, les tumeurs se développant à partir de l’intestin antérieur ou foregut sont des TNE du larynx, des bronches, du thymus, de l’œsophage, de l’estomac, du duodénum, du duodénum proximal et du pancréas. Les tumeurs se développant à partir de l’intestin moyen ou midgut sont des TNE du duodénum distale, jéjunales, iléales, appendiculaires et cæcales (colon droit). Les tumeurs se développant à partir de l’intestin postérieur ou hindgut sont des TNE du colon transverse et gauche, des TNE rectales ou pelviennes (Capella et al. 1995). En particulier, les TNE les plus fréquentes sont localisées aux poumons, à l’intestin grêle, à l’appendice, à l’estomac, au rectum et au pancréas (Dasari et al. 2017) (Tableau 1 – 1).
3
Tableau 0 - 1 Principales tumeurs primitives et leur prévalence selon l’origine embryologique (Frilling et al. 2012). Tumeurs neuroendocrines non digestives (39,5 %)
Larynx, Thymus, Bronches 69,1 %
Non classées 23,8 %
Tractus génito-urinaire féminin 4,5 %
Mammaire 1 %
Système urinaire 1 %
Prostate 0,6 %
Tumeurs neuroendocrines digestives (60,5 %)
Intestin grêle 30,8 % Rectum 26,3 % Colon 17,6 % Pancréas 12,1 % Appendice 5,7 % Autres 4,3 %
Classification basée sur l’histologie de la tumeur
Selon la nouvelle classification de l’Organisation mondiale de la santé (OMS), les TNE sont regroupées en tumeur neuroendocrine de grade 1 (G1 TNE), de grade 2 (G2 TNE), de grade 3a (G3 TNE) et carcinome neuroendocrine de grade 3b (G3 CNE). Le grade est basé sur le taux de prolifération mesuré par indice mitotique ou anticorps spécifiques pour le marqueur Ki-67 (Lloyd RV 2017) (Tableau 1 – 2). Il est également possible de distinguer les TNE selon les caractéristiques des cellules qui les composent en tumeurs bien différenciées (qui souvent sont sécrétantes) et en tumeurs peu différenciées. Le niveau de différentiation a un impact direct sur l’évolution tumorale et, par conséquent, sur le type de traitements à administrer.
4
Tableau 0 - 2 Nouvelle classification de l’Organisation mondiale de la santé (OMS) des TNE (Lloyd RV 2017)
Indice Ki-67 (%) Indice Mitotique
TNE G1 < 3 <2/10 HPF
TNE G2 3-20 2-20/10 HPF
TNE G3 >20 >20/10 HPF
CNE G3
(petites ou grandes cellules) >20 >20/10 HPF
MiNEN --- ---
NNE = tumeur neuroendocrine; CNE = carcinome neuroendocrine; HPF = High Power Field (champ haute puissance) MiNEN = Néoplasie neuroendocrinienne et non neuroendocrinienne mixte
Classification basée sur la génétique de la tumeur
La plupart des TNE sont sporadiques et environ 10 % du total des TNE sont d’origine génétique et peuvent être regroupées en syndromes héréditaires tels que la néoplasie endocrinienne multiple de type 1 (NEM1), la maladie de Von Hippel – Lindau (VHL), la sclérose tubéreuse de Bourneville et la neurofibromatose de type 1.
La NEM1, ou syndrome de Wermer, est un syndrome héréditaire à transmission autosomique dominante due à des mutations inactivant le gène suppresseur de tumeurs NEM1. Ce gène, situé sur le chromosome 11q13, code une protéine nucléaire de 610 acides aminés, la ménine, qui semble être impliquée dans la régulation de plusieurs fonctions cellulaires dont la réparation, la réplication de l’ADN et le mécanisme de transcription. Le NEM1 est caractérisé : (i) par la présence d’adénomes au niveau des glandes parathyroïdes chez 90 % des patients, de gastrinomes duodénaux (malins dans 40 % des cas) ou insulinomes pancréatiques (bénins dans 90 % des cas) et d’adénomes de l’antéhypophyse, (ii) par une pénétrance très élevée et (iii) par une atteinte équivalente entre les hommes et les femmes. La prévalence est d’environ 1 cas sur 30 000. D’autres lésions ont été décrites dans le NEM1, incluant des tumeurs au niveau des corticosurrénales, des carcinoïdes
5
bronchiques, du tube gastro-intestinal, du thymus, des lipomes, des angiofibromes et des collagénomes (Brandi et al. 2001).
La maladie de VHL est un syndrome néoplasique familial à transmission autosomique dominante, résultant de la mutation germinale du gène suppresseur de tumeur VHL. Ce gène est localisé sur le chromosome 3p25-26 et code pour une protéine impliquée dans la régulation du cycle cellulaire, la transcription et l’organisation du cytosquelette et qui va dégrader la sous-unité́ α des facteurs HIFs (Hypoxia-Inducible Factors). L’absence de cette protéine donne une production non contrôlée des facteurs de croissance qui vont favoriser le développement tumoral (Kaelin 2002). La maladie de VHL peut induire le développement d’hémangioblastomes de la rétine et du système nerveux central, des phéochromocytomes ou encore des tumeurs endocrines du pancréas.
La sclérose tubéreuse de Bourneville (Tuberous Sclerosis Complex, TSC) est un syndrome génétique à transmission autosomique dominante qui est dû à l’inactivation des gènes TSC1 (9q34) ou TSC2 (16p13.3), codant respectivement pour l’hamartine et la tubérine, qui forment un complexe inhibant indirectement la voie mTOR (mammalian target of rapamycin). L’absence d’une de ces protéines va donc entrainer une suractivation de la voie de signalisation mTOR. La prévalence est estimée à environ 1 cas sur 25 000. La maladie est caractérisée par des hamartomes au niveau de la peau, du cerveau, des reins, des poumons et du cœur, par des tumeurs du système nerveux telles que des tubers corticaux/sous-corticaux (des amas de cellules malformées (neurones et astrocytes) situés dans la matière grise du cerveau), des nodules sous-épendymaires et des astrocytomes sous-épendymaires à cellules géantes (pouvant causer une hydrocéphalie et une épilepsie) et des TNE du pancréas (pTNE) (Northrup et al. 1993).
La neurofibromatose de type 1 (NF1, ou maladie de Von Recklinghausen) est une maladie génétique neuro-cutanée à transmission autosomique dominante
6
due à la perte de fonction de la neurofibromine 1, une protéine codée par le gène NF1 sur le chromosome 17q11-2. Cette protéine est impliquée dans la régulation négative des protéines G et de la voie mTOR (Johannessen et al. 2005). L’incidence est estimée à 1 cas pour 2500. Les patients peuvent développer des lésions cutanées et/ou osseuses, des tumeurs du système nerveux incluant des phéochromocytomes ou des paragangliomes, ou encore des tumeurs endocrines duodénales ou pancréatiques.
Sécrétion hormonale
Les TNE peuvent être décrites comme fonctionnelles ou non fonctionnelles selon leur capacité à produire des hormones capables d’induire des syndromes hormonaux. Les tumeurs fonctionnelles sont souvent responsables de symptômes cliniques liés à une production tumorale de peptides ou d’amines pouvant être à l’origine de leur découverte et nécessitant un traitement antisécrétoire spécifique. Les hormones produites par les TNE sont le plus souvent la sérotonine, plus rarement l’insuline, la gastrine, le glucagon ou encore d’autres hormones. Le diagnostic des TNE est souvent difficile : dans 80 % des cas, ces tumeurs sont asymptomatiques (non fonctionnelles) et seulement dans 20 % des cas, elles produisent des substances hormonales capables d’évoquer des signes et symptômes du syndrome carcinoïde.
Le syndrome carcinoïde est caractérisé par un syndrome vasomoteur (flush cutané), de la diarrhée motrice (qui évolue en stéatorrhée dans 50 % des cas), des douleurs abdominales (souvent liées à l’obstruction tumorale ou à la fibrose mésentérique), une insuffisance tricuspidienne (liée aux dépôts de tissus fibreux sur les valves et l’endocarde) et plus rarement, une bronchoconstriction (Goichot et al. 2005). Le flush cutané est le symptôme le plus fréquent, qui se manifeste sous forme d’un érythème paroxystique vasomoteur de la face, du cou et de la partie antérieure du thorax. Il peut apparaitre spontanément, mais souvent est induit par une émotion, à la suite d’activité physique, après la consommation de certains aliments, médicaments ou la prise d’alcool. La diarrhée chronique est constituée de selles impérieuses et liquides, rarement dues à des problèmes de malabsorption.
7
Diagnostic
En raison de la grande variété et de la diversité des symptômes des TNE, le diagnostic est souvent difficile et parfois fait après plusieurs années. La découverte des TNE est souvent fortuite : par exemple, à l’occasion d’un examen d’imagerie, lors d’une intervention chirurgicale effectuée pour une autre maladie, ou lors d’une endoscopie et dans le cadre d’un syndrome de prédisposition génétique.
Dans le cas de suspicion de TNE, la localisation de la tumeur primitive par imagerie conventionnelle, la détermination de sa nature neuroendocrine selon les caractéristiques
anatomopathologiques, morphologiques et immunohistochimiques, ainsi que
l’établissement du risque évolutif de la maladie selon le grade histologique et sa dissémination demeurent les objectifs principaux afin d’instaurer un traitement adapté.
Manifestations cliniques
Les symptômes liés à la tumeur sont souvent non spécifiques. Dans le cas des TNE non fonctionnelles, les signes cliniques dépendent essentiellement du siège et du type de la tumeur. Par conséquent, le diagnostic peut être très difficile, car les signes peuvent être aussi présents dans d’autres maladies non endocriniennes. La maladie peut se manifester par des signes intestinaux tels qu’une occlusion ou des troubles du transit, des douleurs abdominales, du sang dans les selles, une masse abdominale, des signes d’infection respiratoire ou des saignements bronchiques, une perte de poids ou un manque d’appétit.
Dans le cas des TNE fonctionnelles, les symptômes les plus courants sont liés à l’hypersécrétion hormonale. Le syndrome carcinoïde est la manifestation clinique la plus fréquente des patients atteints de TNE bien différenciés métastatiques du duodénum distal, de l'iléum ou du cæcum. Les patients peuvent présenter des flushs cutanées, de la diarrhée, des douleurs abdominales ou des bronchospasmes dus à la sécrétion de substances vasoactives comme la sérotonine.
8
Rarement, les patients peuvent manifester une crise carcinoïde induite par anesthésie, chimiothérapie ou chimioembolisation, stress physique, palpation de la tumeur ou de ses métastases. Ces crises peuvent être prévenues par l’administration d’octréotide.
D’autres manifestations sont la cardiopathie carcinoïde qui nécessite une échocardiographie couplée au doppler pour le diagnostic et son suivi ou, encore, une fibrose péritonéale et rétro péritonéale responsables des douleurs abdominales et occlusion intestinale.
Plus rarement, les symptômes et signes sont liés à la production d’une hormone responsable d’un syndrome spécifique comme dans les cas du syndrome de Zollinger Ellison, caractérisé par l’hypersécrétion de gastrine causant des ulcères gastro-duodénaux. Le Tableau 1 – 3 rapporte les principales caractéristiques anatomiques, cliniques et biochimiques des TNE.
9
Tableau 0 - 3 Caractéristiques anatomiques, cliniques et biochimiques des TNE (Mignon 2000; Kaltsas, Besser, and Grossman 2004).
Site Hormone produite Clinique Métastases NEM1
Foregut Bronches, thymus, 1er duodénum, estomac, pancréas 5HT, histamine, ACTH, CRH, GH, gastrine, sérotonine Obstruction pulmonaire, syndrome hormonal et flush atypique (violet pendant des heures) Foie, ganglions, os 10 % Midgut 2 e
duodénum, iléon, côlon droit, jéjunum
5HT, Prostaglandines, bradykinines, sérotonine et autres
Occlusion intestinale, flush typique (rose/rouge pendant des minutes), respiration sifflante/diarrhée (syndrome carcinoïde) Foie (60- 80 %) ganglions --- Hindgut
Côlon transverse au rectum Somatostatine, peptide YY, sérotonine, 5HTP
Symptômes locaux Découverte fortuite
Os (5-40 %) ---
Pancréas
Insulinome Insuline, proinsuline Triade de Whipple*,
neuroglucopénie
10 % 5-10 %
Gastrinome Gastrine Ulcère gastro-duodénal,
diarrhée, douleurs épigastriques
60-90 % 25 %
VIPome VIP Diarrhée, hypokaliémie,
achlorhydrie
80 % 10%
Glucagonoma Glucagone Diabète, cachexie, érythème
nécro lytique migrateur
80-90 % 5-17 %
Somatostatinome Somatostatine Diabète, diarrhée,
achlorhydrie, calculs biliaires
60-70 % 5-10 %
GRFome GFR Acromégalie 60 % 20-30 %
TNE non fonctionnel PP Symptômes liée à la tumeur --- 20 %
5HT = 5 hydroxytryptamine, 5HTP = 5 hydroxytryptophan, VIP = vasoactive intestinal peptide, GFR = growth hormone-releasing factor, PP = polypeptide pancréatique. NEM1 = néoplasie endocrine multiple
* constatation simultanée de signes de neuroglucopénie et d’une glycémie basse, et sur la correction des symptômes lors de la normalisation de la glycémie.
10
Marqueurs tissulaires et sériques
Le diagnostic de la TNE est souvent confirmé par l’analyse anatomopathologique suite à une intervention chirurgicale ou d’une biopsie. Cette analyse permet de classer la tumeur, de préciser la différentiation tumorale et le pronostic et de démontrer la présence des marqueurs tumoraux tissulaires endocriniens spécifiques comme la chromogranine A (Cg-A), des marqueurs cytosoliques tels que la neuron-specific enolase (NSE) ou associés aux petites vésicules comme la glycoprotéine membranaire synaptophysine, ou encore des marqueurs membranaires tels que la molécule d’adhérence neural cell adhesion molecule (N-CAM).
La Cg-A est une glycoprotéine de 439 acides aminés. C’est le marqueur tissulaire et sérique le plus utilisé pour le diagnostic et le suivi des TNE, dans les formes non fonctionnelles, avancées et métastatiques (Campana et al. 2007; O'Toole et al. 2009). L’expression de la Cg-A est corrélée à la progression de la tumeur et à l’efficacité des traitements (Massironi et al. 2010). Toutefois, des niveaux de la Cg-A faussement élevés peuvent être dus à l’administration de médicaments comme les inhibiteurs de la pompe à protons ou les glucocorticoïdes, dans l’insuffisance rénale ou l’hypergastrinémie (Yang et al. 2015).
D’autres marqueurs peuvent être utilisés selon les signes et symptômes des patients dans le cas d’une suspicion d’une maladie fonctionnelle. Par exemple, dans le cas d’un syndrome carcinoïde d’une TNE de l’intestin grêle ou du côlon droit, les dosages de la sérotonine sérique (hydroxytryptamine, HT) ou de son catabolite urinaire, l'acide 5-hydroxyindoleacetic (5-HIAA), peuvent être également effectués (Kaltsas, Besser, and Grossman 2004) (Tableau 1 - 3). Néanmoins, il faut souligner qu’une TNE non fonctionnelle peut produire des hormones tels que la Cg-A ou le polypeptide pancréatique sans toutefois causer un syndrome clinique.
Imagerie conventionnelle
L’imagerie par tomodensitométrie (TDM) en triple-phase et par résonance
11
pour détecter la tumeur primaire et les métastases (Sundin et al. 2009). L’imagerie anatomique permet donc de localiser la tumeur, de définir son volume et son caractère invasif afin d’évaluer la faisabilité d’une résection chirurgicale de la tumeur.
L’imagerie morphologique permet de définir l’étendue de la dissémination de la maladie et de suivre l’évolution de celle-ci. L’examen TDM abdomino-pelvienne avec une phase artérielle tardive (30 sec) puis portale (70-90 sec) est utilisé pour permettre la visualisation pendant la phase artérielle de certaines TNE bien différenciées et très vascularisées. Elle permet la détection des lésions primitives qui sont typiquement hypodenses et qui deviennent hyperdenses après l’injection du produit de contraste à cause de l’hypervascularisation des TNE. L’examen TDM thoracique est demandé dans le cas où la tumeur est métastatique ou localement avancée ou dans le cas de tumeur primitive inconnue. La sensibilité et la spécificité de la TDM pour détecter les lésions de TNE sont respectivement de 61-93 % et de 71-100 % (Sundin et al. 2017).
L’IRM avec injection de gadolinium est plus sensible que la TDM surtout pour la détection des métastases cérébrales, hépatiques et osseuses (Sundin et al. 2017). La détection des petites pTNE (< 2 cm) hypervascularisées est aussi plus aisée par IRM (Manfredi et al. 2013). L’endoscopie permet d’explorer le tube digestif et l’arbre respiratoire ; l’échographie abdominale permet de rechercher d’éventuelles métastases hépatiques. Il a été montré que l’échographie abdominale, avec l’utilisation de produit de contraste, est plus sensible (82 %) dans le diagnostic et la caractérisation des lésions hépatiques par rapport à l’échographie abdominale classique (Mork et al. 2007). Toutefois, l’échographie est connue pour être « opérateur-dépendante », menant à une grande variation en ce qui concerne la sensibilité et la spécificité (Sundin et al. 2017). En outre, l’endoscopie associée à l’échographie (échoendoscopie) améliore la détection des TNE résécables de siège gastrique, duodénal et pancréatique ainsi que des TNE rectales.
Somatostatine
La somatostatine est un peptide de 14 acides aminés (prédominant dans le système nerveux central) ou 28 (prédominant au niveau gastro-intestinal) acides aminés découvert en 1973 (Brazeau et al. 1973). Elle est largement répandue dans le corps humain, en
12
particulier dans le système nerveux central et périphérique, dans les glandes endocrines, dans le système immunitaire et dans le tractus gastro-intestinal. Cette hormone inhibe la biosynthèse et l’excrétion des peptides exocrines et endocrines du système bilio-pancréatique et du tube digestif. En particulier, et pour ce qui concerne sa fonction endocrinienne, la somatostatine peut inhiber la sécrétion hypothalamo-hypophysaire de l’hormone de croissance, l’hormone thyréotrope, de la prolactine et de l’hormone corticotrope, ainsi que de l’insuline et du glucagon au niveau pancréatique (Lamberts 1988).
Récepteurs de la somatostatine
Dans les tissus, l’action de la somatostatine est contrôlée par des récepteurs membranaires, dont 5 sous-types ont été découverts (Patel et al. 1994). Ces récepteurs de la somatostatine (RSST) à 7 domaines transmembranaires appartiennent à la famille des
récepteurs couplés aux protéines G, inhibant l’adénosine monophosphate cyclique (AMPc).
Ces récepteurs sont exprimés dans plusieurs tissus humains comprenant le cerveau, l’hypophyse, le tractus gastro-intestinal, le pancréas, la thyroïde, la rate, les reins, les cellules immunitaires, les vaisseaux et le système nerveux périphérique (Reisine and Bell 1995; Csaba and Dournaud 2001). De plus, les RSST régulent l'action antiproliférative de la somatostatine en induisant la tyrosine phosphatase et en modulant les protéines kinases activées par les protéines mitogènes (MAP). Ces dernières protéines modulent également le flux de calcium et de potassium intracellulaire (Ferolla et al. 2008). Les RSST ont été identifiés in vitro dans un grand nombre de néoplasies. Une densité élevée de ces récepteurs se retrouve notamment dans les TNE gastro-entéro-pancréatiques, les carcinoïdes bronchopulmonaires, les adénomes hypophysaires, les phéochromocytomes, les paragangliomes, les neuroblastomes, les cancers thyroïdiens médullaires et les carcinomes pulmonaires à petites cellules (Reubi 1997). En particulier, le RSST de type 2 est exprimé par environ 90 % des TNE de l’intestin grêle et 80 % des pTNE (Papotti et al. 2002).
Imagerie fonctionnelle
Puisque les TNE surexpriment les RSST, notamment les types 2 et 5, qui sont les plus
In-13
octréotide, sont utilisés dans le diagnostic des TNE par imagerie moléculaire. L’111
In-octréotide est le couplage de l'In-octréotide, un octapeptide synthétique, caractérisé par une plus grande demi-vie biologique que celle de la somatostatine (1.7 heure vs 3 minutes) avec l’indium-111. Pour l’imagerie des TNE, il demeure le produit radiopharmaceutique le plus utilisé avec une sensibilité diagnostique variant entre 50 et 100 % (Shi et al. 1998).
La méta-iodobenzylguanidine marquée à l’123I ou 131I (123I-MIBG ou 131I-MIBG) est
un analogue d’un précurseur des amines, utilisée pour diagnostiquer, surveiller et traiter les patients présentant certains types de TNE comme les phéochromocytomes ou paragangliomes (Kaltsas et al. 2001). Pour la détection de la plupart des TNE, la
scintigraphie à l’111In-octreotide a une meilleure sensibilité par rapport à la scintigraphie au
MIBG, 76 % contre 50 %, alors que le couplage des 2 scintigraphies, 111In-octreotide et
MIBG, améliore la sensibilité de la détection des TNE digestives jusqu’à 95 % (Kaltsas et al. 2001).
L’expression des RSST cellulaires diminue avec l’augmentation de la prolifération cellulaire dans les TNE peu différenciés. Par conséquent, le degré de captation tumorale des ASST radiomarqués diminue également (Olsen et al. 2016). Dans ce cas, la tomographie d’émission par positrons (TEP) est préférable, car des lésions plus agressives sont plus
avides du [18F] (2)-fluoro-2-deoxy-D-glucose (FDG), un analogue du glucose (Pasquali et
al. 1998). La TEP-FDG permet la détection des processus hypermétaboliques, qui peuvent être aussi observé dans les processus inflammatoires comme par exemple les poussées de maladie de Crohn ou de rectocolite hémorragique, la sarcoïdose et les pathologies infectieuses récentes. Certains types histologiques de cancers fixent peu le FDG. C’est le cas des adénocarcinomes mucineux, de certains lymphomes de bas grades, des TNE bien
différenciées et des hépatocarcinomes bien différenciés. Un autre traceur marqué au 18F, la
fluoro-dihydroxyphénylalanine (18F-DOPA), peut être utilisé pour l’évaluation des TNE
digestives bien différenciées, mais est peu disponible. Dans l’investigation des TNE, la place de la TEP-FDG dépend du degré de différenciation de ces tumeurs. Les tumeurs bien différenciées à faible activité proliférative captent peu le FDG, mais sont bien mises en
évidence par la scintigraphie à l’111In-octréotide. La TEP-FDG est indiquée pour l’imagerie
14
mauvais pronostic. La TEP-FDG est donc utile pour déterminer le pronostic des TNE (Bahri et al. 2014). Récemment, l’examen TEP qui utilise des ASST marqués au gallium-68 a été introduit dans un nombre croissant de centres en raison de la plus grande précision diagnostique et de la faible dose de radiation pour le patient. Cet examen a l’avantage d’avoir une meilleure résolution d’image et une plus grande sensibilité dans le diagnostic
des TNE par rapport à la scintigraphie à l’111In-octreotide (Deppen, Liu, et al. 2016;
Deppen, Blume, et al. 2016). Cet examen est plus pratique pour le patient puisque l’imagerie peut être réalisée 60 minutes après l’injection, par rapport à l’imagerie
fonctionnelle classique qui est effectuée 24 heures après l’injection de 111In-otréotide
(Ambrosini et al. 2008; Sundin et al. 2017).
Récemment, des antagonistes des RSST radiomarqués se sont avérés préférables aux agonistes pour le ciblage in vivo des récepteurs peptidiques des tumeurs. En effet, cette nouvelle classe de peptides antagonistes est indépendante de l’état d’activation du RSST par phosphorylation de la protéine G. Par conséquent, ces antagonistes vont se fixer sur un plus grand nombre de sites de liaison à la surface des cellules tumorales, tandis que les peptides agonistes ne ciblent que les récepteurs activés (Ginj et al. 2006). Les composés théranostiques en cours d’études sont basés sur le peptide antagoniste JR11 qui se lie avec une grande affinité au RSST de type 2. Le composé de diagnostic OPS202 est couplé au chélateur NODAGA et peut être marqué avec le radionucléide gallium-68 (Fani et al. 2012). Enfin, le peptide thérapeutique OPS201 est lié à l’agent chélateur DOTA et peut être
marqué avec des isotopes tels que 90Y ou 177Lu pour la thérapie radionucléidique qui sera
décrite plus loin (Wild et al. 2014).
Traitements
Chirurgie
L’exérèse chirurgicale demeure le seul traitement curatif des TNE. En particulier, l’ensemble des TNE intestinales localisées ainsi que les petites TNE du pancréas non fonctionnelles nécessitent une résection chirurgicale radicale éventuellement associée à une lymphoadénectomie adéquate (Partelli et al. 2017). L’exérèse chirurgicale, si possible, permet l’ablation totale de la lésion primitive et des éventuelles métastases ganglionnaires
15
et hépatiques. Dans le cas des métastases hépatiques, une résection radicale est suggérée seulement pour des TNE bien ou modérément différenciées et en l’absence de maladie métastatique extra-abdominale (Partelli et al. 2017). Elle permet également, dans certains cas, de contrôler un syndrome tumoral non adéquatement contrôlé par le traitement médical. Dans ce cas, la chirurgie est cytoréductive et palliative, le principal objectif étant alors de maîtriser les symptômes causés par la tumeur avancée et à maintenir la qualité de vie du patient. Dans de nombreux cas, la chirurgie ne peut pas être réalisée, car les tumeurs sont souvent diagnostiquées à un stade métastatique.
Analogues de la somatostatine (ASST)
Parmi les traitements pour les patients atteints des TNE inopérables, les ASST jouent un rôle prédominant dans le soulagement des symptômes hormonaux (chez environ 60 % des patients). Les ASST agissent sur la sécrétion hormonale et sur la croissance tumorale avec des effets antiprolifératifs directs et indirects (Susini and Buscail 2006). Les effets antiprolifératifs directs sont : l’inhibition du cycle cellulaire, l’inhibition des effets des facteurs de croissance et l’augmentation de l’apoptose cellulaire, tandis que les effets antiprolifératifs indirects sont : l’inhibition de la libération de facteurs de transcription et d’hormones trophiques (hormone de croissance, somatomedine, insuline, gastrine, facteur de croissance épidermique), l’inhibition de l’angiogenèse (prolifération endothéliale, libération du facteur de croissance vasculaire endothélial (VEGF), activité des monocytes) et modulation du système immunitaire. Ces effets sont médiés par les RSST qui activent plusieurs médiateurs. En particulier, les phosphatases SHP-1 et SHP-2 inactivent par déphosphorylation respectivement PI3K et ERK1/2, induisant ainsi une inactivation des voies ERK/MAPK et AKT/mTOR. L’action des RSST sur ces voies métaboliques inhibe la synthèse protéique, le cycle cellulaire et ralentit le métabolisme cellulaire (Susini and Buscail 2006; Chalabi et al. 2014). En général, les ASST peuvent efficacement stabiliser la maladie de 8 à 16 mois (Rinke et al. 2009; Caplin, Pavel, and Ruszniewski 2014). Toutefois, les réponses objectives avec les ASST sont rares (Rinke et al. 2009; Eriksson and Oberg 1999).
16
Les ASST approuvés pour le traitement de première ligne pour les TNE sont l’octréotide (Bauer et al. 1982), prescrite sous forme d’injection sous-cutanée plusieurs fois par jour, à courte durée d’action, ou intramusculaire mensuelle, à action prolongée à la dose de 30 mg. Le lanréotide à action prolongée est administré par injection sous-cutanée mensuelle à la dose de 120 mg (Pavel et al. 2017). Ces deux ASST ont une plus haute affinité pour le RSST type 2 et une faible affinité pour le RSST de type 5 et 3. Les ASST sont généralement bien tolérés, mais peuvent donner des effets secondaires gastro-intestinaux (diarrhée, ballonnements, cholélithiase), une hyper- ou hypoglycémie ou une hypothyroïdie. L’octréotide est indiqué pour les TNE bien différenciées du midgut, tandis que le lanreotide trouve indication dans le TNE bien ou modérément différenciées du
midgut et du pancréas (Rinke et al. 2009; Caplin, Pavel, and Ruszniewski 2014).
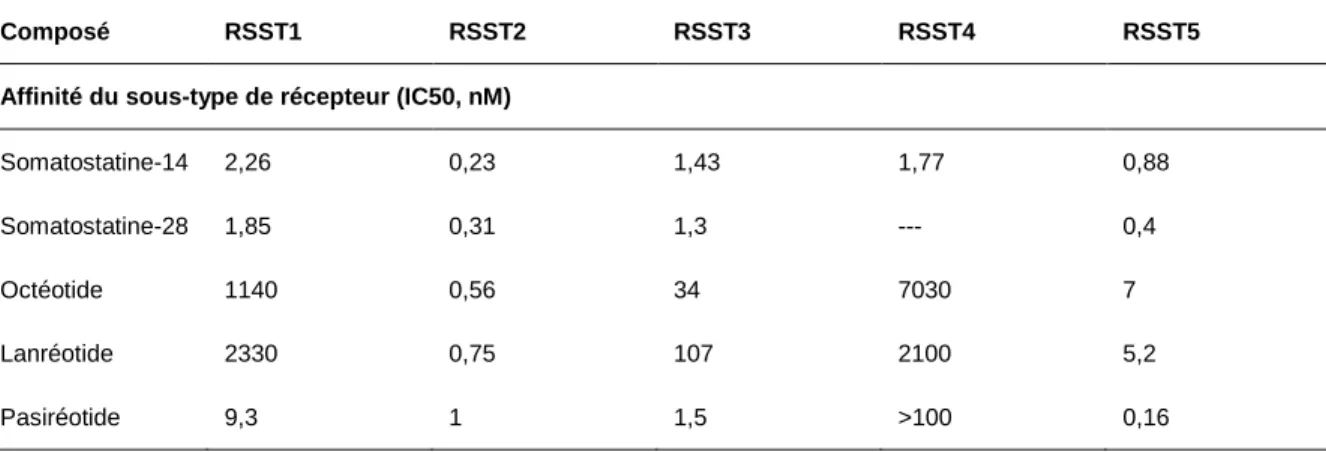
Un nouvel ASST qui n’est pas encore approuvé pour le traitement des TNE est le pasiréotide (SOM 230). Ce dernier pourrait être utilisé chez les patients en échappement à l’octréotide. Le pasiréotide est capable de se lier avec une haute affinité à l’ensemble des RSST. Son efficacité a été étudiée dans une étude de phase II et a permis d’obtenir un contrôle des symptômes chez 27 % des patients ainsi qu’une stabilisation de la maladie pendant 2 ans dans 57 % des cas (Kvols et al. 2012) (Tableau 1 – 4). Enfin, quelques études ont été réalisées pour évaluer l’efficacité du pasiréotide dans les TNE, seul ou en association avec d’autres médicaments tel que l’évérolimus, avec des résultats encourageants (Chan JA 2012; Wolin et al. 2015).
Tableau 0 - 4 Affinité de liaison de la somatostatine et des ASST avec les sous-types de RSST [traduit de (Baldelli et al. 2014)].
Composé RSST1 RSST2 RSST3 RSST4 RSST5
Affinité du sous-type de récepteur (IC50, nM)
Somatostatine-14 2,26 0,23 1,43 1,77 0,88
Somatostatine-28 1,85 0,31 1,3 --- 0,4
Octéotide 1140 0,56 34 7030 7
Lanréotide 2330 0,75 107 2100 5,2
17
Autres traitements antisécrétoires et antitumoraux
Un autre traitement agissant sur la sécrétion hormonale ainsi que sur la prolifération tumorale est l’Interféron- qui, à travers la voie de signalisation des protéines JAK-STAT, peut agir comme suppresseur des tumeurs (Zhou et al. 2001). En général, il est utilisé comme traitement complémentaire des ASST dans le syndrome carcinoïde réfractaire ou lorsque les ASST ne sont pas le choix préféré (par exemple, après un diagnostic négatif pour les RSST) ou encore si les ASST ne sont pas tolérés. Cependant, le traitement par Interféron- peut entraîner des effets toxiques sérieux nécessitant une interruption (Pavel et al. 2017).
D’autres traitements antisécrétoires sont également utilisés selon le type d’hormones produites, comme les inhibiteurs de la pompe à protons dans le gastrinome ou le diazoxide dans l’insulinome.
Thérapies ciblées
La rationnelle des thérapies ciblées est lié à la nature faiblement proliférative et hétérogène des TNE et à l’efficacité limitée associée à un taux de toxicité élevé des traitements de chimiothérapie. La majorité des molécules de thérapie ciblée visent les facteurs de croissance, leurs récepteurs ou la voie de signalisation sous-jacente aux récepteurs ciblés.
Plus récemment, des traitements ciblés comme les inhibiteurs de la tyrosine kinase (sunitinib) et de la voie signalétique mTOR (évérolimus) ont été approuvés pour les TNE bien ou modérément différenciées du pancréas. L’évérolimus a aussi été approuvé pour le traitement des TNE non fonctionnelles d’origine gastro-intestinale ou pulmonaire. L’évérolimus est administré à la dose quotidienne de 10 mg par voie orale. Ce traitement agit sur la voie PI3K/Akt/mTOR impliquée dans le mécanisme d’homéostasie cellulaire, qui est notamment dérégulée dans les cellules tumorales.
Le sunitinib, recommandé à la dose quotidienne de 37,5 mg par voie orale, est capable d’inhiber les récepteurs à activité tyrosine kinase VEGFR et c-KIT (entre autres) et
18
par conséquent, d’exercer une action antiangiogénique et antiproliférative sur les lésions hypervascularisées.
Chez des patients avec TNE, la survie médiane sans progression de maladie a été prolongée significativement à 11,4 mois pour le sunitinib et à 11,0 mois pour l’évérolimus comparativement au placebo (5.5 mois et 4.6 mois, respectivement) (Raymond et al. 2011; Yao et al. 2011). Le sunitinib et l’évérolimus ont démontré des faibles taux de réponse objective, chez 9,3 % et 5 % des patients, respectivement, ainsi qu’une stabilisation de la maladie chez 63 % et 73 % des patients, respectivement (Raymond et al. 2011; Yao et al. 2011). Néanmoins, les thérapies ciblées ont des effets secondaires plus fréquents et sérieux par rapport à la thérapie par ASST. Par exemple, les effets secondaires sérieux induits par le sunitinib sont la neutropénie (12 %), l’hypertension artérielle (10 %) et le syndrome main-pied (6 %) (Raymond et al. 2011). Les effets secondaires les plus fréquents rencontrés avec l’évérolimus sont la stomatite (64 %), des éruptions cutanées (49 %), la diarrhée (34 %), la fatigue (31 %) et des infections touchant principalement les voies respiratoires supérieures (23 %), tandis que les effets secondaires sérieux comprennent l’anémie (6 %) et l’hyperglycémie (5 %) (Yao et al. 2011).
Chimiothérapie
Plusieurs traitements de chimiothérapie peuvent être utilisés pour les TNE selon le degré de différenciation et le site tumoral (Strosberg et al. 2015). Cependant, la chimiothérapie demeure le traitement de première ligne surtout pour les TNE peu différenciées métastatiques, dont plusieurs formes n’expriment pas les RSST (Sorbye et al. 2014). Actuellement, la streptozotocine (STZ), seule ou en association avec le 5-fluorouracile (5-FU) ou la doxorubicine, est le traitement choisi pour les patients atteints de TNE du pancréas bien différenciée avec une charge tumorale élevée, avec ou sans symptômes associés, et avec une progression tumorale significative dans un délai de 6 à 12 mois (Moertel, Hanley, and Johnson 1980; Moertel et al. 1992). Cependant, l’utilisation de la doxorubicine est limitée en raison de la cardiotoxicité élevée. D’autres options thérapeutiques de deuxième ligne sont également possibles telles que le témozolomide
19
(TMZ), seul ou en association avec la capecitabine, la dacarbazine, l’oxaliplatine ou l’irinotécan (Garcia-Carbonero et al. 2017).
Dans les carcinomes neuroendocriniens de haut grade, la chimiothérapie à base de platine est généralement indiquée. L’association du cisplatine et de l’étoposide, ou des régimes thérapeutiques alternatifs substituant le carboplatine au cisplatine, ou l’irinotécan à l’étoposide, sont recommandés en première ligne. Étant donné que les taux de réponse de ces régimes thérapeutiques sont plus faibles chez les patients atteints de tumeurs avec un Ki-67 < 55 %, d'autres options thérapeutiques à base de TMZ ou d’irinotecan peuvent être utilisées chez ces patients (en particulier pour la TNE de grade 3 d’origine gastro-intestinale) (Garcia-Carbonero et al. 2017).
Thérapie des métastases hépatiques
La présence de métastases hépatiques est l’un des principaux facteurs pronostiques de la survie des patients atteints de TNE : le taux de survie des patients atteints de métastases hépatiques est plus faible que celui des patients sans atteinte hépatique (Panzuto et al. 2005). De plus, l’impact des métastases hépatiques sur la survie dépend du site de la tumeur primaire. Les tumeurs pancréatiques, par exemple, ont un taux de survie à 5 ans de 30 à 60 %, tandis que les tumeurs gastro-intestinales ont un taux de survie de 60 à 90 % (Steinmuller et al. 2008). La chirurgie ainsi que l’ablation par cryothérapie, alcoolisation ou radiofréquence sont généralement proposées aux patients présentant des métastases hépatiques bien différenciées provenant de TNE digestives quel que ce soit le site d’origine, avec absence d’insuffisance cardiaque droite, de métastases extra-abdominales et de carcinomatose péritonéale diffuse (Partelli et al. 2017). Néanmoins, chez les patients présentant des métastases hépatiques diffuses non résécables ou souffrant de troubles hormonaux potentiellement mortels et réfractaires au traitement médical, la transplantation hépatique peut constituer une option thérapeutique possible pour des candidats sélectionnés. En particulier, les patients de moins de 50 ans qui ne présentent pas de tumeur extrahépatique et dont la TNE a une faible expression du Ki-67 (< 10 %) sont ceux qui ont le plus de chances de bénéficier d’une transplantation hépatique (Steinmuller et al. 2008).
20
Parmi les options thérapeutiques locorégionales en radiologie interventionnelle, l’embolisation transartérielle ou la chimioembolisation des métastases hépatiques se sont révélées efficaces dans le soulagement des symptômes ainsi que pour réduire le volume des métastases hépatiques, surtout pour des lésions < 4 cm. L’embolisation de l’artère hépatique cause une ischémie au sein de la lésion hépatique à l’aide d’agents comme le cyanoacrylate ou l’alcool polyvinyle. Le traitement est indiqué pour les patients avec une tumeur non résécable, des symptômes liés à l’hypersécrétion hormonale et avec une progression rapide des métastases hépatiques. L’efficacité du traitement peut être améliorée en utilisant des agents chimiothérapeutiques comme la doxorubicine et la STZ, ce qui permet de concentrer jusqu’à vingt fois plus l’agent chimiothérapeutique par rapport à un traitement systémique. Néanmoins, la majorité des études scientifiques ne montre aucune amélioration significative au niveau de la survie des patients entre la chimioembolisation et l‘embolisation (Fiore et al. 2014). Ces traitements peuvent causer des syndromes post-embolisation (douleur, fièvre, vomissement), des abcès hépatiques, une insuffisance hépatique ou rénale, une crise carcinoïde ou encore des effusions pleurales et ulcérations gastroduodénales (Steinmuller et al. 2008).
Analogues de la somatostatine (ASST) radiomarqués
La radiothérapie est un traitement antitumoral ciblé qui consiste à exposer le patient à des rayonnements qui vont détruire les cellules cancéreuses. Les rayonnements abîment les cellules essentiellement au niveau de leur ADN. Les rayonnements ionisants provoquent des dommages aux bases de l’ADN, des cassures d’un seul brin ou double brin et aux liaisons croisées entre les protéines et l’ADN. Les cassures double brin sont les lésions les plus dommageables causées aux chromosomes par le rayonnement ionisant. Ces dommages surviennent par action directe ou indirecte. On parle d’action directe lorsque les rayonnements brisent l’un des deux ou les paires de base de l’ADN et d’action indirecte lorsque les dommages sont induits par des radicaux libres. Les radicaux libres sont des molécules extrêmement réactives qui peuvent former des composés comme le peroxyde d’hydrogène, qui peut induire divers changements structurels dans les cellules qui entraînent leur mort ou transforment leur fonction. La cellule a développé des mécanismes pour répondre à chaque type de dommage induit par les radiations comme la réparation par