HAL Id: tel-01405685
https://tel.archives-ouvertes.fr/tel-01405685v2
Submitted on 30 Oct 2017HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
lipidique du spermatozoïde sur l’étape de fusion des
gamètes chez le mammifère
Benjamin Ravaux
To cite this version:
Benjamin Ravaux. Influence du battement du flagelle et de la composition lipidique du spermatozoïde sur l’étape de fusion des gamètes chez le mammifère. Physique [physics]. Université Pierre et Marie Curie - Paris VI, 2016. Français. �NNT : 2016PA066597�. �tel-01405685v2�
Thèse de Doctorat en Physique
Influence du battement du flagelle et de la
composition lipidique du spermatozoïde sur
l’étape de fusion des gamètes chez le
mammifère
par
Benjamin Ravaux
sous la direction de
Christine Gourier
Thèse soutenue le 28 Octobre 2016
Martine Ben Amar Présidente
Guillaume Drin Rapporteur
Isabelle Tardieux Rapportrice
Eric Rubinstein Examinateur
David Tareste Examinateur
La fécondation est la rencontre de deux gamètes. Bien que centrale chez les espèces sexuées, la chronologie des mécanismes membranaires et moléculaires n’est pas établie de façon précise. Par ailleurs, la communauté scientifique bute toujours sur la question centrale : Comment le spermatozoïde fusionne-t-il avec l’ovule ? Ces 30 dernières années, les efforts ont surtout porté sur la détermination du ligand-récepteur responsable de la fusion des gamètes. Si des études récentes ont identifié trois protéines essentielles à la fusion : Izumo1 sur le spermatozoïde, Juno (son récepteur) et CD9 sur la membrane de l’ovocyte, elles montrent également que ces acteurs ne sont pas suffisants et que d’autres facteurs sont impliqués. Notre étude a eu pour but d’identifier et de caractériser des paramètres autres que protéiques impliqués dans la machinerie de fusion gamétique. Nous nous sommes focalisés sur la contribution des lipides spermatiques et sur celle du battement du flagelle lors de l’interaction du spermatozoïde avec l’ovocyte.
Pour cette étude, nous avons développé deux méthodes expérimentales originales, oppo-sées dans leurs approches mais parfaitement complémentaires. Avec la première, qualifiée de « Bottom-up », nous avons tenté d’identifier la machinerie spermatique minimale pour induire la fusion avec l’ovocyte. L’idée était de reconstituer pas à pas la membrane de la tête du spermatozoïde sous forme d’une membrane biomimétique composée d’abord des lipides spermatiques identifiés lors des analyses lipidiques des têtes spermatiques, puis en y incorporant la protéine Izumo1. Nous avons analysé les propriétés physico-chimiques des membranes obtenues à chacune de ces étapes et testé leur capacité fusogène en me-surant une énergie d’activation pour ces systèmes biomimétiques et en étudiant leurs interactions avec des ovocytes. Pour la seconde approche, appelée « Top-down », nous avons développé un outil microfluidique permettant de guider le spermatozoïde à un endroit prédéfini de l’ovocyte et de suivre la rencontre des gamètes avec le « meilleur » point de vue dans des conditions aussi physiologiques que possible. Nous avons ainsi découvert que contrairement à ce qu’on pensait du battement du flagelle, celui-ci ne sert pas seulement à amener le spermatozoïde jusqu’à l’ovocyte, mais il sert aussi à déclencher la fécondation après l’entrée en contact des gamètes, et encore... seulement s’il bat selon un mode bien précis que nous avons caractérisé. Les contraintes mécaniques générées par
sant au mélange des ADN des deux gamètes a été obtenu avec une résolution temporelle inégalée de l’ordre de la minute.
Ma thèse est le fruit d’un travail d’équipe et le résultat de multiples interactions. Je tiens donc à remercier tous ceux qui ont pu y contribuer de manière directe ou indirecte. Je suis reconnaissant envers Christine Gourier, de m’avoir offert la possibilité de travailler sur un sujet qui m’a passionné et pour la confiance qu’elle a bien voulue m’accorder. Je la remercie de m’avoir laissé explorer le sujet à ma manière, et aussi d’avoir relu et corrigé ce mémoire.
Ces 4 années m’ont permis d’apprendre beaucoup sur moi-même. Et si tout n’a pas toujours été facile, j’en arrive presque à oublier les moments difficiles pour ne garder que les meilleurs souvenirs. Toutefois, rien n’aurait été possible sans mes complices du second sous-sol et particulièrement Myriam Chalbi et Claire François-Martin, qui auront toujours une place particulière dans mon cœur. Je te remercie Myriam de m’avoir initié à ce monde mystérieux que peut être la biologie de la reproduction. Merci de m’avoir transmis tes connaissances précieuses avec pédagogie et patience. Je me souviendrai longtemps de ma première injection ou encore de la manière de manipuler avec grande précaution le BET. Je te remercie Claire de m’avoir épaulé, supporté, écouté, encouragé, aidé, soutenu. . . (la liste est longue), d’avoir été là pendant ces années presque tous les jours et à travers le monde. Je garde de très beaux souvenirs de tous ces moments passés ensemble. Un grand merci à mes deux autres comparses Isabelle Motta et Kevin Ho Wan, qui m’ont accompagné dans cette expérience scientifique, mais aussi en dehors du laboratoire. J’espère que nous continuerons encore longtemps nos sorties théâtres et concerts. J’espère aussi que tous nos projets se concrétiseront !
Je souhaite bon courage à Clémence Gruget pour la fin de sa thèse et à Sophie Favier qui prend la suite du projet « gamète ». J’espère avoir eu le temps de tout te transmettre avant de partir.
Merci Abdou Rachid Thiam, à qui l’aboutissement de ce travail doit beaucoup et dont j’admire les qualités scientifiques et humaines. Merci Nabil Garroum pour la richesse de nos discussions à propos de microfabrication et d’avoir mis tes connaissances au service de notre thématique. Merci Mariano Ostuni de m’avoir accompagné dans cette expérience
répétitions orales.
J’exprime également toute ma gratitude à Ahmed Ziyyat, pour les échanges que nous avons pu avoir. Je le remercie pour ses conseils et ses remarques qui m’ont été précieux et qui ont guidé une partie de mon projet afin de revenir toujours à l’essentiel : la biologie de la reproduction. Un grand merci à Jean-Philippe Wolf, toujours disponible pour discuter et qui m’a ouvert les portes de son service pour mieux cerner les enjeux sociétaux de nos recherches. Je remercie aussi Claude Boucheix et Eric Rubistein pour leurs judicieuses suggestions et Denis Clay pour son expertise en cytométrie. J’adresse un grand merci à tous nos collaborateurs : Bertrand Ducos, Isabelle Barbosa, Brigitte Lefèvre, Côme Ialy-radio, Virginie Barraud-Lange. Merci aussi à Christophe Auger et Guillaume Dabee d’avoir particulièrement bien pris soin de nos souris et à toute l’équipe de l’animalerie pour leur accueil.
Un grand merci également à l’administration, qui a été indispensable au bon déroulement de ma thèse. En tout premier, Nora Sadaoui, qui a toujours été là pour m’aider à résoudre mes petits tracas et ce, même si mes ordres de mission n’étaient pas souvent (même jamais) bien remplis. Je n’oublie pas non plus Annie Ribaudeau, Marie Gefflot, Fabienne Renia et Benoit Paulet. Merci également aux services techniques, en particulier Didier Courtiade et son équipe qui nous ont sauvé plus d’une fois.
Je remercie Sophie Cribier et Karim Dib de m’avoir fait confiance, chacun à un moment "charnière" de mon parcours. Ils me permettent sans aucun doute d’écrire ces lignes au-jourd’hui. Je remercie aussi Chantal Guihenneuc-Jouyaux et Emmanuel Curis de m’avoir offert la possibilité d’enseigner à leurs côtés à l’Université P5, et Julien Husson, qui m’a le premier montré l’intérêt de la physique en biologie.
J’adresse tous mes remerciements aux membres de mon jury, d’avoir pris le temps de juger mon travail, à Isabelle Tradieux venue assister à cette soutenance parisienne, et Guillaume Drin qui ont bien voulu être mes rapporteurs, ainsi qu’à Martine Ben Amar, David Tareste et Eric Rubinstein. Je remercie aussi tous les étudiants, qui ont fait un stage avec moi. Ils m’ont permis de clarifier mon sujet en essayant de le rendre le plus pédagogique possible. Merci à Eleonore Pronier, Aglae Balibar, Lou Collignon, Quentin Bureau, Nathan Line et Léa Ixéko-Davis.
Je remercie tous ceux qui m’ont soutenu pendant ces périodes de doutes et de joies : Cléa Benoliel, Willy Terrine, Rosalie Plantfèvre, Jian Wang Yong, Vladimir Adrien, Benjamin
Cadars, Pierre Soule, Lena Melkonyan, Monika Kamińska, Jerome Philippon, Léa Ixéko-Davis, Sathish Ramakrishnan, Matthieu Baillergeau et Sophie Damour.
Je termine par un tendre merci à ma famille, qui est venue m’écouter et à mes parents Nadine et Paul Ravaux, ainsi qu’à ma sœur Sabrina Ravaux. Je leur dois beaucoup et ce travail aussi.
List of Figures xi
List of Tables xv
I Biologie de la reproduction et Membrane lipidique 8
1 Gamètes et Fécondation 9
1.1 Caractérisation des gamètes . . . 9
1.1.1 L’ovule . . . 9
1.1.2 Le spermatozoïde . . . 11
1.1.3 Maturation des gamètes . . . 12
1.2 Fécondation . . . 13
1.2.1 La réaction acrosomique . . . 13
1.2.2 Adhésion et fusion du spermatozoïde à la membrane de l’ovocyte . 14 1.2.3 Internalisation du spermatozoïde et décondensation de son ADN . 15 2 Les acteurs protéiques de l’interaction gamétique 18 2.1 Modèle avant 2005 . . . 18
2.1.1 A Disintegrin And Metalloprotease protein . . . 19
2.1.2 Les Intégrines . . . 20
2.1.3 ADAM12/α6β1 . . . 20
2.2 Modèle après 2005 . . . 21
2.2.1 Les protéines de la SuperFamille des Immunoglobulines . . . 21
2.2.2 Les Glycosylphosphatidylinositol Anchored Proteins (GPI-AP) . . 23
2.3 Autres acteurs . . . 24
2.3.1 Les Tétraspanines . . . 24
2.3.2 Candidats potentiels . . . 25
3 Lipides, membranes et fusion 28 3.1 Les lipides à la base des membranes biologiques . . . 28
3.1.1 Classification des lipides . . . 28
3.1.2 Forme effective . . . 31
3.1.3 Transition de phase . . . 32
3.2 Membranes biologiques . . . 33 vi
3.2.1 Agencements lipidiques . . . 33
3.2.2 Dynamique membranaire . . . 34
3.2.3 Déformation des membranes . . . 37
3.3 Fusion membranaire . . . 39
3.3.1 Approche théorique . . . 39
3.3.2 Ouverture d’un pore de fusion . . . 39
3.3.3 Impact de certains paramètres sur la fusion . . . 42
3.3.3.1 Composition lipidique et courbure de la membrane . . . . 42
3.3.3.2 Conformation étendue des lipides . . . 43
3.3.3.3 La température . . . 44
3.3.3.4 Différences entre les cellules . . . 44
3.4 Conclusion et Objectifs . . . 44
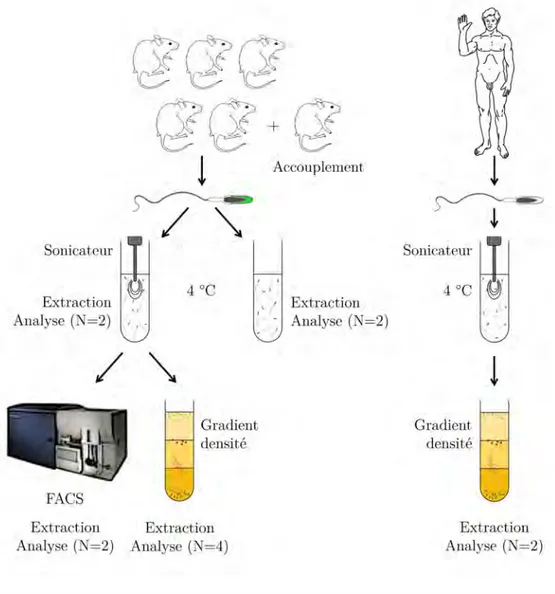
II Approche "Bottom-up", Système biomimétique 46 4 Les lipides spermatiques 48 4.1 De l’élevage des animaux à l’extraction lipidique . . . 49
4.1.1 Elevage des animaux . . . 49
4.1.2 Prélèvement des spermatozoïdes . . . 50
4.1.3 Capacitation et Réaction acrosomique . . . 50
4.1.4 Séparation têtes-flagelles . . . 51
4.1.5 Collecte des têtes spermatiques . . . 52
4.1.5.1 Méthode 1 : le gradient de densité . . . 52
4.1.5.2 Méthode 2 : cytométrie de flux . . . 54
4.1.6 Extractions lipidiques . . . 55
4.2 Spermatozoïdes humains . . . 55
4.3 Analyses lipidiques . . . 55
4.4 Résultats . . . 58
4.4.1 Influence du traitement sur la composition lipidique . . . 58
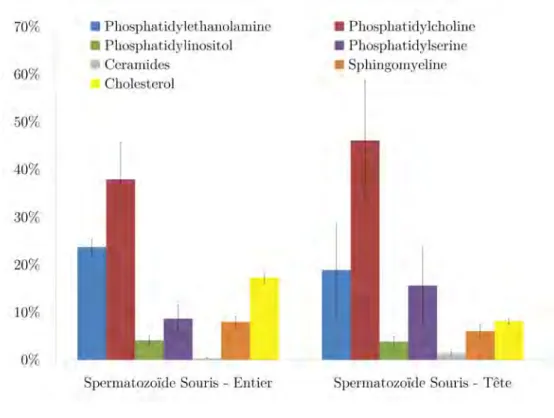
4.4.2 Étude comparée entre tête spermatique et spermatozoïde entier chez la souris . . . 59
4.4.3 Étude comparée entre tête spermatique et spermatozoïde entier chez l’humain . . . 61
4.4.4 Etude comparée avec d’autres types cellulaires . . . 62
4.4.4.1 Membrane plasmique du globule rouge . . . 62
4.4.4.2 Le neurone . . . 63
4.5 Conclusion . . . 65
5 Élaboration et caractérisation des membranes modèles de lipides sper-matiques 67 5.1 Composition des membranes modèles . . . 68
5.1.1 Membranes spermatiques : Lipides naturels . . . 68
5.1.2 Membranes spermatiques : Lipides synthétiques . . . 68
5.1.2.1 Critère 1 : espèces majoritaires . . . 68
5.1.2.2 Critère 2 : taille des chaines d’acides gras et nombre d’in-saturations . . . 69
5.2 Génération de membranes modèles . . . 75
5.2.0.1 SUV : Small Unilamellar Vesicles . . . 77
5.2.1 GUV : Giants Unilamellar Vesicles . . . 79
5.2.1.1 Electro-formation . . . 79
5.2.1.2 Choc osmotique . . . 79
5.3 Caractérisation des vésicules . . . 81
5.3.1 Petites Vésicules Unilamellaires . . . 81
5.3.2 Vésicules Unilamellaires Géantes . . . 82
5.3.2.1 Principe du FRAP . . . 82 5.3.2.2 Déroulement expérimental . . . 84 5.3.2.3 Coefficients de diffusion . . . 86 5.4 Interprétations . . . 86 5.4.1 Fluidité de la membrane . . . 86 5.4.2 Propriétés de la membrane . . . 87 5.5 Conclusion . . . 91
6 Capacités fusogènes des lipides de la membrane plasmique du sperma-tozoïde 92 6.1 Comment mettre en évidence de la fusion membranaire ? . . . 93
6.1.1 Principe du FRET . . . 93
6.1.2 Détection de la coalescence des membranes par mélange de lipides 94 6.2 Mesures par FRET des énergies d’activation de la réaction de fusion des liposomes en fonction de leur composition lipidique . . . 94
6.2.1 Energie d’activation : définition . . . 94
6.2.2 Comment obtenir l’énergie d’activation à partir des mesures de FRET ? . . . 96
6.2.3 Déroulement des expériences permettant d’évaluer les énergies d’ac-tivation de la réaction de fusion en fonction de la composition li-pidique . . . 97
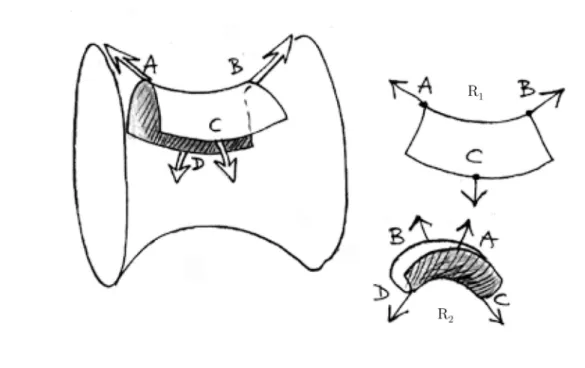
6.2.4 Fusion ou hémi-fusion ? . . . 103
6.3 Résultats des tests de fusion . . . 105
6.3.1 Energies d’activation des différentes réactions de fusion . . . 105
6.3.2 Les SUV de lipides spermatiques fusionnent-elles avec l’ovocyte ? . 107 6.3.2.1 Préparation des ovocytes de souris . . . 107
6.3.2.2 Déroulement de l’expérience . . . 108
6.3.2.3 Résultats des tests de fusion des liposomes avec des ovocytes109 6.3.2.4 Confirmation de l’expérience par le calcul . . . 110
6.4 Conclusion . . . 111
7 Lipides polyinsaturés et protéine Izumo1, machinerie minimale pour induire la fusion ? 113 7.1 Synthèse des protéines Izumo1 . . . 114
7.1.1 Production en cellules procaryotes . . . 114
7.1.2 Production en cellules eucaryotes . . . 115
7.2 Elaboration des protéoliposomes . . . 116
7.2.1 Protéo-SUV . . . 116
7.2.2 Protéo-GUV . . . 120
7.3 Organisation d’Izumo1 au sein des protéoliposomes . . . 120
7.3.1 Environnement lipidique d’Izumo1 . . . 120
7.3.2 Oligomérisation d’Izumo1 . . . 123
7.3.2.1 Photo-blanchiment par paliers . . . 123
7.3.2.2 Résultats d’oligomérisation d’Izumo1 . . . 126
7.4 Interactions protéoliposomes - ovocytes . . . 128
7.4.1 Tests de fusion des protéo-SUV Izumo1 avec des ovocytes . . . 130
7.4.1.1 Interactions entre protéo-GUV Izumo1 et ovocytes . . . . 131
7.4.1.2 Principe de la micromanipulation par micropipette . . . . 131
7.4.1.3 Résultats . . . 132
7.5 Interactions entre ovocytes et cellules somatiques transfectées avec Izumo1 et enrichies en phospholipides polyinsaturés . . . 135
7.6 Conclusion . . . 136
III Approche "Top-down", Système microfluidique 138 8 Le spermatozoïde doit battre le rythme 140 8.1 Principe de l’expérience . . . 141
8.2 Protocole expérimental de fécondation in vitro en cellule unique . . . 141
8.2.1 Préparation des gamètes . . . 141
8.2.2 Préparation des capillaires . . . 142
8.2.3 Déroulement de l’expérience de fécondation in vitro en cellule unique142 8.3 Résultats . . . 145
8.3.1 Taux de fécondation en FIV individuelle . . . 145
8.3.2 Corrélation entre mouvement de flagelle et fusion des gamètes . . . 146
8.3.3 Temps caractéristiques : du premier contact à la fusion . . . 149
8.4 Conclusion . . . 149
9 Fécondation in vitro contrôlée 151 9.1 Principe de la méthode . . . 152
9.1.1 Cahier des charges . . . 152
9.1.2 Description de la puce microfluidique . . . 153
9.1.3 Intérêt de la méthode . . . 153
9.2 Microfabrication de la puce microfluidique . . . 154
9.3 Réalisation d’une FIV individuelle dans la puce microfluidique . . . 159
9.3.1 Mise en place de l’expérience . . . 159
. . . 159
9.3.2 Validation du protocole de FIV individuelle dans la puce micro-fluidique . . . 160
9.4 Conclusion . . . 161
10 Séquence des évènements de la fécondation 162 10.1 Protocoles expérimentaux . . . 163
10.2.3 Enveloppement du spermatozoïde par l’ovocyte . . . 167
10.2.4 Bourgeonnement et détachement de vésicules membranaires. . . 167
10.2.5 Internalisation du spermatozoïde et dégradation de sa membrane . 169 10.2.6 Décondensation de l’ADN spermatique . . . 170
10.2.7 Description quantitative de l’internalisation du spermatozoïde et de la décondensation de son ADN . . . 170
10.3 Conclusion . . . 172
11 Dynamique de CD9 au fil de la fécondation 175 11.1 Principe de l’expérience . . . 176
11.2 Evolution de CD9 lors d’une fécondation . . . 177
11.2.1 Recrutement pré-fusionnel de CD9 dans la zone de contact . . . 177
11.2.2 Déplétion post-fusion de CD9 dans la zone de contact . . . 179
11.2.3 Cartographie spatiale et temporelle de CD9 et du Hoechst dans la zone de contact . . . 181
11.2.4 Relargage post-fusion de CD9 de la membrane de l’ovocyte . . . . 183
11.3 Influence des battements du flagelle sur l’organisation de CD9 . . . 186
11.4 Influence de Juno et Izumo1 dans l’évolution de CD9 . . . 189
11.5 Conclusion . . . 190 IV Annexes 196 A Proteines 197 A.1 ADAM12 . . . 197 A.2 α6β1 . . . 199 A.3 Izumo1/Juno . . . 201 A.4 CD9 . . . 202
B Tableaux des différentes analyses lipidiques 203
C Articles 213
1 Pourcentage de naissances issues d’une AMP en France entre 2007 et 2011. 3 2 Nombres de tentatives d’AMP et de naissances correspondantes en France
entre 2007 et 2011. . . 3
3 Répartition des différentes méthodes de Fécondation In Vitro utilisées pour l’année 2011 et leurs taux de succès en France. . . 4
4 Pourcentages de réussite d’une Procréation Médicalement Assistée en France. 5 1.1 Cumulus, zone pellucide et Ovocyte II . . . 10
1.2 Spermatozoïde de souris . . . 12
1.3 Schéma - Organes reproducteurs . . . 13
1.4 Réaction acrosomique . . . 14
1.5 Schéma - Fécondation . . . 15
1.6 Schéma - Adhésion et fusion . . . 16
1.7 Schéma - Internalisation du spermatozoïde . . . 16
1.8 Fécondation et émission du second globule polaire . . . 17
2.1 Oligomerisation d’Izumo1 . . . 23
2.2 Schéma - Protéines impliquées dans la fécondation . . . 26
3.1 Schéma - Phospholipide . . . 29
3.2 Schéma - Configurations des doubles liaisons . . . 29
3.3 Schéma - Sphingolipide . . . 31
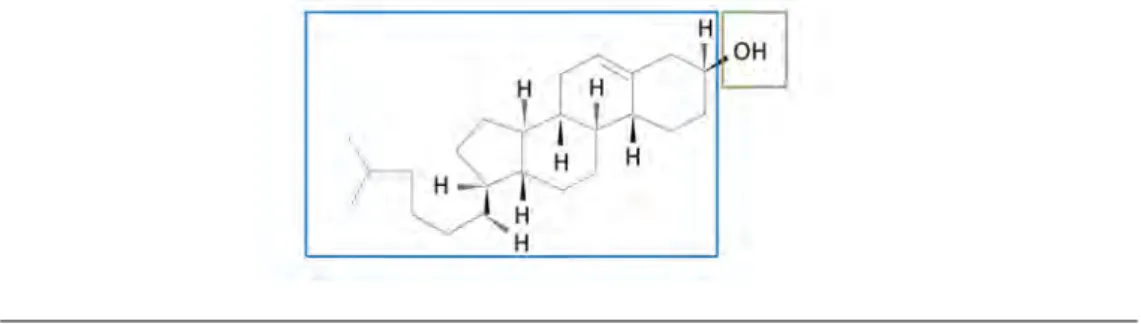
3.4 Schéma - Cholestérol . . . 31
3.5 Schéma - Forme effective d’un lipide . . . 32
3.6 Schéma - Différents types de phases lipidiques . . . 34
3.7 Schéma - Dynamique des lipides en membrane . . . 36
3.8 Schéma - Différents types de déformations appliquées à une membrane . . 37
3.9 Schéma - Représentation des rayons de courbures . . . 38
3.10 Schéma - Fusion membranaire . . . 40
3.11 Schéma - Étapes de la fusion . . . 41
3.12 Schéma - Lipides cylindriques en membrane . . . 42
3.13 Schéma - Polymorphisme lipidique . . . 43
3.14 Schéma - Conformation étendue . . . 43
4.1 Spermatozoïde Acrosine-EGFP . . . 52
4.2 Statistiques des spermatozoïdes avec et sans sonication . . . 53
4.3 Spermatozoïdes ACR-EGFP soniqués et triés . . . 54
4.4 Synthèse des différentes étapes de séparation têtes et flagelles . . . 56
4.5 Analyse espèces lipidiques - Spermatozoïde souris . . . 60 xi
4.9 Analyse espèces lipidiques - Globule rouge . . . 64
4.10 Analyse parties hydrophobes lipides - Globule rouge . . . 64
5.1 Spectre d’excitation et d’emission fluorophores . . . 77
5.2 Schéma - Différents types de liposomes et techniques de préparation . . . 78
5.3 Schéma - Electroformation et choc osmotique . . . 80
5.4 Vésicules formées par choc osmotique . . . 81
5.5 Profil de taille de liposomes par DLS . . . 82
5.6 Schéma - Technique FRAP . . . 83
5.7 Courbes caractéristique de FRAP . . . 85
5.8 Schéma - Deux états d’une chaine DHA d’une Phosphatidylcholine . . . . 87
5.9 Diagramme microdomaines : Phospholipides, Sphingolipides et Cholestérol 89 5.10 Vésicules avec microdomaines . . . 90
6.1 Schéma - Principe du FRET . . . 93
6.2 Schéma - Mise en évidence de l’échange de lipides . . . 95
6.3 Schéma - Diagramme Énergie . . . 95
6.4 Schéma - Premier cycle de fusion . . . 97
6.5 Schéma - Détermination de l’énergie d’activation de la réaction de fusion . 98 6.6 Évolution typique du signal de fluorescence du NDB . . . 100
6.7 Test de fusion : Membrane plasmique type contre membrane plasmique type101 6.8 Test de fusion : Membrane spermatique artificielle contre membrane plas-mique type . . . 101
6.9 Test de fusion : Membrane spermatique naturelle contre membrane plas-mique type . . . 102
6.10 Vitesse de fusion en fonction de la température . . . 103
6.11 Evolution fluorescence NBD après traitement dithionite . . . 104
6.12 Test de fusion après traitement dithionite . . . 105
6.13 Test fusion : Liposomes spermatiques avec Ovocyte . . . 110
7.1 Schéma - Synthèse protéoliposomes . . . 117
7.2 Analyse espèces lipidiques - Microsomes . . . 118
7.3 Analyse parties hydrophobes lipides - Microsomes . . . 118
7.4 Western Blot protéoliposomes . . . 119
7.5 Vésicules lipides spermatiques Izumo1-EGFP . . . 120
7.6 Protéo-GUV avec domaines et répartition Izumo1-EGFP . . . 122
7.7 Protéo-GUV avec domaines et répartition Izumo1-EGFP . . . 122
7.8 Schéma - Photo-blanchiment par paliers . . . 124
7.9 Schéma - Isolement des oligomères d’Izumo1 . . . 125
7.10 Schéma - TIRF . . . 125
7.11 Images de TIRF . . . 126
7.12 Statistiques de "step-bleaching" . . . 127
7.13 Microscopie électronique du contact entre K562-Izumo1 et ovocytes . . . . 129
7.14 Test fusion : Liposomes spermatiques + Izumo1 avec Ovocyte . . . 130
7.16 Contact protéo-GUV Izumo1 avec ovocyte - 2 minutes . . . 134
7.17 Contact protéo-GUV Izumo1 avec ovocyte - 5 minutes . . . 134
7.18 Contact K562-Izumo1 "traitées" avec ovocyte . . . 136
8.1 Sélection des spermatozoïdes dans la goutte . . . 143
8.2 Sélection des spermatozoïdes avec une micropipette . . . 144
8.3 Fécondation avec spermatozoïde unique et sélectionné . . . 145
8.4 Fécondation in vitro en cellule unique et en insémination . . . 146
8.5 Différents types de battements du flagelle du spermatozoïde sur la mem-brane de l’ovocyte . . . 148
8.6 Temps d’arrêt du flagelle et détection visuelle du Hoechst . . . 149
9.1 Schéma - Puce microfluidique . . . 155
9.2 Diagramme des points forts et des points faibles des différentes techniques de fabrication microfluidique . . . 156
9.3 Technique de moulage mise au point pour les expériences . . . 158
9.4 Ovocyte et spermatozoïde dans la puce microfluidique . . . 160
9.5 Fécondation guidée dans une puce microfluidique . . . 161
10.1 Vue de profil et de face de l’interaction gamétique . . . 164
10.2 Délimitation des régions d’intérêts dans la zone de contact et en dehors . . 165
10.3 Caractérisation du temps de fusion . . . 166
10.4 Internalisation d’un spermatozoïde par l’ovule . . . 168
10.5 Déformation de la membrane après fusion pour internaliser un spermatozoïde168 10.6 Image de microscopie électronique - Internalisation du spermatozoïde . . . 169
10.7 Bourgeonnement de la membrane de l’ovocyte . . . 169
10.8 Description quantitative de l’internalisation du spermatozoïde et de la décondensation de son ADN . . . 171
10.9 Schéma – Evolution de la tête du spermatozoïde et du devenir de son ADN174 11.1 Recrutement pré-fusionnel de CD9 dans la zone de contact . . . 177
11.2 Cinétique de CD9 dans la zone de contact . . . 178
11.3 Zone de contact en microscopie électronique . . . 178
11.4 Déplétion post-fusionnel de CD9 dans la zone de contact . . . 179
11.5 Marquage au PKH26 des ovocytes . . . 180
11.6 Cartographie spatiale et temporelle de CD9 et du Hoechst dans la zone de contact . . . 182
11.7 Relargage CD9-EGFP dans la puce microfluidique . . . 184
11.8 Fluorescence CD9-EGFP en membrane d’un ovocyte fécondé et dans la puce microfluidique . . . 185
11.9 Spermatozoïde du groupe 1 au contact de l’ovule . . . 187
11.10Spermatozoïde du groupe 2 au contact de l’ovule . . . 188
11.11Spermatozoïde du groupe 3 au contact de l’ovule avec une mauvaise dis-tribution des protéines . . . 188
11.12Synthèse - Cinétique de CD9 dans la zone de contact et sur la membrane de l’ovocyte . . . 191
A.1 Simulation numérique du repliement d’ADAM12 . . . 198
3.1 Températures de transition de la Phosphatidylcholine avec des chaines aliphatiques saturées . . . 33 3.2 Températures de transition de la Phosphatidylcholine avec des chaines
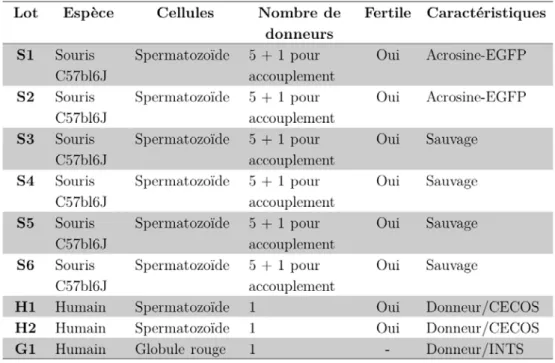
aliphatiques insaturées . . . 33 4.1 Récapitulatif des différents groupes en fonction de l’espèce, du type
cellu-laire et du nombre de donneurs . . . 57 5.1 Composition lipidique des espèces majoritaires de la membrane de la tête
du spermatozoïde de souris. . . 69 5.2 Composition lipidique des espèces majoritaires de la membrane de la tête
du spermatozoïde humain . . . 70 5.3 Composition lipidique des espèces majoritaires mimant la membrane
plas-mique de la tête du spermatozoïde de souris et humain . . . 71 5.4 Composition lipidique utilisée pour mimer la membrane plasmique de la
tête du spermatozoïde de souris et humain . . . 72 5.5 Récapitulatif des différentes concentrations obtenues en fonction des
dif-férentes espèces testées . . . 74 5.6 Composition lipidique des espèces majoritaires d’une membrane plasmique
de globule rouge . . . 75 5.7 Composition lipidique utilisée pour mimer une membrane plasmique de
globule rouge ou une membrane plasmique « type » . . . 76 5.8 Température de transition pour certains lipides présents dans la membrane
de la tête du spermatozoïde de souris . . . 76 5.9 Mesure des coefficients de diffusion de l’ATTO647-DOPE dans les
diffé-rents types de membranes testées à 37 °C . . . 86 6.1 Différentes compositions lipidiques testées dont les énergies d’activation
ont été mesurées (EA) . . . 98
6.2 Courbes d’ajustements exponentielles . . . 103 6.3 Récapitulatif des différentes compositions lipidiques testées et de leurs
énergies d’activation (EA) . . . 106
6.4 Compositions lipidiques mimant la tête du spermatozoïde . . . 107 6.5 Valeur du coefficient α représentatif du taux de fusion entre les liposomes
et l’ovule . . . 110 7.1 Valeur du coefficient α représentatif des taux de fusion entre les
protéo-liposomes et l’ovule . . . 131 8.1 Répartition des différents taux de fusion en fonction des groupes testés . . 148
11.1 Récapitulatif des différents mouvements enregistrés dans la puce
micro-fluidique et leurs conséquences . . . 187
A.1 Séquence d’acides aminés d’ADAM1 . . . 197
A.2 Séquence d’acides aminés d’ADAM2 . . . 198
A.3 Séquence d’acides aminés d’α6 . . . 199
A.4 Séquence d’acides aminés d’β1 . . . 200
A.5 Séquence d’acides aminés d’Izumo1 . . . 201
A.6 Séquence d’acides aminés de Juno . . . 201
A.7 Séquence d’acides aminés de CD9 . . . 202
B.1 Analyse des lipides de spermatozoïdes de souris entiers et non soniqués . . 204
B.2 Analyse des lipides de spermatozoïdes de souris soniqués . . . 205
B.3 Analyse des lipides des têtes de spermatozoïdes soniqués, récupérés par un gradient d’optiprep . . . 206
B.4 Analyse des lipides des têtes de spermatozoïdes soniqués séparées par FACS207 B.5 Synthèse des lipides de spermatozoïdes de souris entiers . . . 208
B.6 Synthèse des analyses de lipides des têtes de spermatozoïdes de souris soniquées et séparées par gradient d’optiprep . . . 209
B.7 Synthèse des analyses de lipides de spermatozoïdes humains entiers . . . . 210
B.8 Synthèse des analyses de lipides des têtes de spermatozoïdes humains so-niqués et séparés par gradient d’optiprep . . . 211
La médicalisation de la reproduction est un épisode majeur de la médecine occidentale du XXème siècle. Au cours des années 1920 et afin de reconstituer au plus vite une popu-lation éprouvée par la guerre, les médecins européens comme américains se sont efforcés de réduire la mortalité infantile et si possible maternelle. Toutefois, longtemps considéré comme une spécialité peu prestigieuse, les premiers résultats furent largement discu-tables. En effet, les praticiens hommes, en comparaison des sages-femmes de l’époque, manquaient cruellement de formations et de pratiques. Il fallut attendre le milieu des années 1940, pour enfin apprécier une différence notable du taux de survie avec ou sans encadrement médical [91]. Petit à petit, la compréhension plus fine des mécanismes biolo-giques à l’œuvre métamorphosa pour de bon les possibilités d’action du corps médical. Si bien qu’aux débuts des années 1960, les femmes ont pu enfin s’affranchir de leur fertilité naturelle grâce entre autre aux contraceptifs oraux. Le slogan « un enfant si je veux, quand je veux » devient une réalité en France dès 1967. Cependant, qu’en est-il des couples ne pouvant pas procréer ? Il fallut encore patienter jusqu’au mois de juillet 1978 pour assister à la naissance de Louise, premier bébé conçu in vitro, au Royal Oldham Hos-pital dans la banlieue de Manchester en Angleterre. L’équipe sous la direction de Robert G. Edwards – prix Nobel de médecine en 2010 – est parvenue à collecter et à inséminer un ovule sous microscope, avant de réimplanter l’œuf fécondé dans l’utérus de la future mère [42]. Rapidement, les sociétés civiles ont pris conscience du besoin d’établir un cadre juridique pour ces nouvelles techniques regroupées sous la notion d’Assistance Médicale à la Procréation (AMP). En France, ces pratiques sont d’ailleurs règlementées par les lois de bioéthiques de 1994, révisées en 2004 et 2011. Le législateur français a pris le parti de ne pas considérer ces méthodes comme un nouveau mode de reproduction accessible à tous, en fonction de ses envies. Il ne peut s’agir, selon lui, que d’une démarche théra-peutique répondant à un trouble physiologique avéré. Son choix a pour conséquence des conditions rigoureuses d’accès. Ainsi, un couple hétérosexuel doit pouvoir justifier d’une vie commune de plus de deux ans. Chaque partenaire est obligatoirement majeur, avec une limite d’âge de 43 ans pour la femme. De plus, l’infertilité, qui est définie comme «
l’absence de grossesse chez un couple ayant des rapports sexuels réguliers sans contracep-tion sur une période d’au moins 12 mois », aura été médicalement constatée. En retour, le traitement est pris en charge par l’assurance maladie dans la limite de quatre tentatives. En soi, la procréation n’est pas un acte vital pour l’individu, mais elle l’est pour la per-pétuation d’une espèce. Il s’agit du moment charnière entre deux générations. D’ailleurs, c’est certainement pourquoi la fécondité - nombre d’enfants par femme - est un des prin-cipaux indicateurs démographiques scrutés avec attention dans de nombreux pays depuis le début du siècle dernier [125]. Toutefois, le niveau relativement élevé de cet indice en France1 par rapport à ses voisins européens ne doit pas minimiser la prévalence de
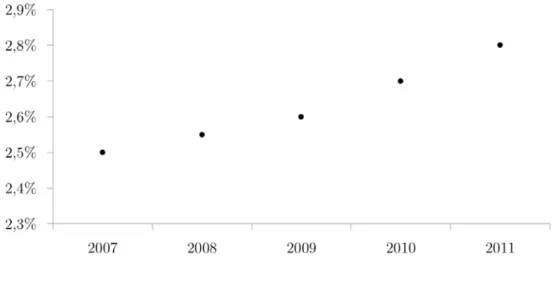
l’in-fertilité sur le territoire [36]. Le nombre de couples rencontrant une hypofertilité ou une stérilité y est probablement de l’ordre de 20 %. À titre de comparaison, ce taux se situe autour de 13 % en Italie, de 22 % en Allemagne, de 24 % au Danemark et culmine jusqu’à 32 % en Pologne [129]. Ces dernières années, nombreuses études épidémiologiques ont commencé à mettre en évidence l’impact de facteurs environnementaux sur les fonctions reproductives des êtres vivants. L’exposition à des composés chimiques type perturba-teurs endocriniens, l’alimentation ou encore le stress sont autant d’éléments potentiels responsables des observations faites entre 1976 et 2009 [74]. Les médecins constatent sans équivoque, chez des hommes en âge de procréer, une diminution de l’ordre de 30 % de la concentration en spermatozoïdes, ainsi qu’une réduction importante de leur motilité. En à peine trente ans, le nombre de cellules mobiles est passé de 64 % à moins de 44 % par éjaculat [23]. Cette baisse se retrouve dans toutes les populations testées, aussi bien en Amérique du Nord qu’en Europe et au Japon. Certains avancent l’hypothèse que de par sa complexité et sa grande fragilité, la reproduction humaine jouerait une fonction sen-tinelle. Les troubles de la fertilité n’étant ni plus ni moins qu’un des nombreux témoins de l’impact des transformations de notre environnement. En 2011 selon l’INSEE, 823 394 bébés sont nés en France, dont 2,8 % grâce à l’Assistance Médicale à la Procréation (AMP). Ce pourcentage en augmentation constante représente déjà à l’heure actuelle 1 enfant sur 35 (Figure 1). L’âge moyen de la première tentative de Fécondation In Vitro (FIV) est de 33 ans pour les femmes et de 36 ans pour les hommes.
Les méthodes sont différentes en fonction des causes d’infertilité. Elles se limitent dans certains cas à un simple coup de pouce. La cavité utérine de la future mère est directe-ment inséminée avec les gamètes du père, court-circuitant certaines pathologies du col de l’utérus. Cependant, les spermatozoïdes doivent être suffisamment mobiles pour atteindre l’ovule et nombreux2. Dans les cas plus sévères, la médecine s’affranchit cette fois-ci de
1. 2,1 enfants par femme en 2014 2. au moins 500 000
Figure 1: Pourcentage de naissances issues d’une AMP en France entre 2007 et 2011.
toutes les étapes naturelles de sélection. Sous microscope, le praticien micro-injecte di-rectement un spermatozoïde dans l’ovule3. Le transfert in utero de l’œuf fécondé aura
lieu après constat des premières divisions cellulaires4. Les embryons surnuméraires seront
congelés et utilisés pour un nouveau transfert en cas d’échec de la précédente tentative. Dans des situations extrêmes, comme la présence d’anomalies génétiques graves transmis-sibles à l’enfant ou pour pallier l’absence de gamètes, le couple s’orientera logiquement vers le don (Figure 2).
Figure 2: Nombres de tentatives d’AMP et de naissances correspondantes en France entre 2007 et 2011.
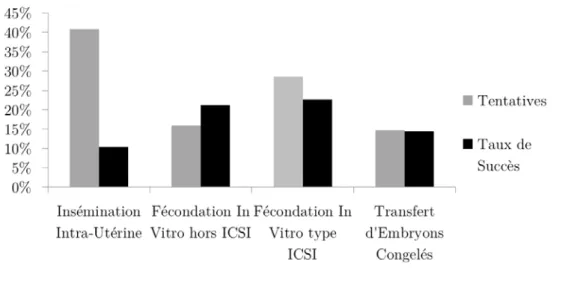
Le taux moyen de succès par tentative atteint actuellement 20 % grâce à l’amélioration du modus operandi [38]. Néanmoins, certaines techniques comme la micro-injection du
3. ICSI - Intra-Cytoplasmic Sperm Injection 4. stade 2/4 cellules
spermatozoïde directement dans l’ovule (ICSI) donnent de meilleurs résultats (Figure 3) [137].
Figure 3: Répartition des différentes méthodes de Fécondation In Vitro utilisées pour l’année 2011 et leurs taux de succès en France.
Le délai moyen pour réaliser son projet d’enfant grâce à l’Assistance Médicale à la Pro-création (AMP) est de cinq ans. Malheureusement, seuls 41 % des couples verront leurs démarches aboutir au bout d’un premier cycle de traitement. Et même s’il est tentant de vouloir multiplier les tentatives, un deuxième cycle n’augmentera les chances de succès que de 7 %. Ainsi, 52 % des couples se verront contraint de se tourner vers l’adoption ou renoncer à fonder une famille. Petite touche d’espoir, 11 % d’entre eux finiront tout de même par concevoir naturellement un bébé sans aucune explication scientifique (Figure 4) [111].
Les débats sociétaux autour de la biologie de la reproduction mettent souvent l’accent sur les aspects éthiques et juridiques, mais les interrogations médicales et scientifiques n’en sont pas moins tout aussi nombreuses. Par exemple malgré le recul des trente dernières années, la santé de l’enfant est toujours une source de questionnement [76]. En outre, le taux de réussite par tentative semble plafonner à 20 % malgré l’amélioration constante des techniques. Cette situation est probablement liée aux grandes parts d’ombres qui en-tourent encore la reproduction en apparence si simples que tout le monde pense connaître et pourtant si complexes et mystérieux. Quoiqu’il en soit les troubles de la fertilité et leurs incidences sur les sociétés humaines sont un problème majeur de santé publique et un enjeu économique substantiel pour l’avenir.
Figure 4: Pourcentages de réussite d’une Procréation Médicalement Assistée en France.
La fécondation résulte de la rencontre de deux cellules matures : le spermatozoïde et l’ovule. Ces deux cellules doivent se reconnaître, avant de pouvoir adhérer puis fusion-ner. Bien que déterminante dans la perpétuation de l’espèce, l’interaction gamétique et les mécanismes membranaires et moléculaires qui la sous-tendent restent une énigme. Au cours des dernières années, le développement de nouvelles méthodes expérimentales ont permis d’identifier un nombre conséquent d’acteurs moléculaires intervenant dans le processus de fécondation. Dans le but de trouver lesquels permettent aux deux gamètes de fusionner, chacun a fait l’objet de nombreuses études. Par exemple, grâce à la gé-nération d’organismes transgéniques, il a été possible d’éliminer ou d’implémenter leurs gènes, et donc de sonder un à un les effets engendrés par la présence ou l’absence de telle ou telle protéine. Au final, seulement trois d’entre elles se sont révélées essentielles : Izumo1 sur le spermatozoïde, Juno son récepteur sur l’ovule, et CD9 également situé sur la membrane de l’ovocyte. Ces résultats n’ont cependant pas permis d’élucider les mécanismes de fusion sous-jacents à l’interaction gamétique. Cela est peut-être dû au fait que les approches actuelles ont tendance à trop se focaliser sur la protéine en particulier, en oubliant l’environnement direct de celle-ci ou en négligeant sa cinétique et son mode d’action. Effectivement, il est envisageable que la fécondation nécessite une cascade de réactions et la complémentarité de plusieurs facteurs pour pouvoir aboutir à la fusion.
Dans cette étude, j’ai choisi d’approfondir cette hypothèse au travers de deux méthodes expérimentales originales et inédites dans le domaine de la fécondation. J’ai tout d’abord décidé de partir du niveau zéro de l’organisation cellulaire - une membrane purement lipidique - et de complexifier le système peu à peu, afin de reconstituer la membrane plasmique du spermatozoïde minimale permettant la fusion avec l’ovule. Dans un second temps, j’ai cherché à développer un outil qui faciliterait les observations d’une fécondation en temps réel, en offrant des conditions expérimentales les plus physiologiques possibles. Grâce à la microfluidique, j’ai donc conçu un système offrant le « meilleur » point de vue de la zone de contact entre les deux gamètes pendant tout le processus de fécondation et ce dès leur premier contact.
gamètes et les étapes clés de la fécondation telle qu’elle est définie dans le domaine de la biologie de la reproduction. Le deuxième chapitre fait le point sur les différents acteurs protéiques déjà identifiés et les deux modèles successifs qui ont été proposés au cours des 20 dernières années. Le troisième chapitre revient à l’essence même de ce qu’est la fusion à savoir la coalescence de deux bicouches lipidiques, en présentant les grandes familles de molécules à l’origine des membranes et une synthèse succincte de la fusion, afin de mieux introduire la seconde partie sur les membranes modèles. La deuxième partie présente le cheminement de l’étude visant à reconstituer la machinerie minimale du spermatozoïde lui permettant de fusionner. Dans un premier temps, nous avons identifié les lipides de la tête du spermatozoïde afin de recréer un système purement lipidique mimant la mem-brane plasmique de la cellule. J’ai ensuite caractérisé certaines des propriétés physiques de ces lipides, à commencer par l’énergie d’activation de leur fusion, pour évaluer leur pouvoir fusogène par rapport à d’autres membranes types. Enfin, j’ai incorporé Izumo1 dans ces membranes lipidiques pour vérifier si la proteine entourée du bon environne-ment lipidique, était capable d’initier la fusion avec l’ovule. La troisième partie expose le dernier volet de cette étude : tenter d’observer le plus précisément possible le processus de fécondation pour comprendre les mécanismes sous-jacents. Dans un premier temps, je présenterai les résultats portant sur un nouveau paramètre, qui s’est révélé indispensable dans l’établissement de la fusion et jusqu’à présent négligé, à savoir le mouvement du fla-gelle sur la membrane de l’ovocyte. J’expliciterai ensuite le processus de fabrication de la puce microfluidique nous ayant permis d’observer la zone de contact spermatozoïde-ovule avec une résolution spatiale et temporelle sans pareil. Nous présenterons alors comment nous avons établi une chronologie pour l’incorporation de l’ADN du spermatozoïde et, enfin, la cinétique complète de CD9 au cours de la fécondation.
Biologie de la reproduction et
Membrane lipidique
Gamètes et Fécondation
En un temps record, un œuf souvent pas plus grand qu’une tête d’épingle et plus léger qu’un millième de milligramme va édifier un être vivant façonné jusqu’à plusieurs milliers de milliards de cellules de natures très diverses. Ce nouvel individu est le résultat, chez les espèces sexuées, de la rencontre de deux gamètes, un spermatozoïde et un ovule. Ce sont des structures hautement spécialisées qui se distinguent du reste de l’organisme par leurs caractéristiques morphologiques, fonctionnelles et génétiques hors du commun. L’interaction gamétique fait toujours l’objet de nombreux travaux, mais les mécanismes mis en jeu pour leur fusion restent encore aujourd’hui très énigmatiques.
1.1
Caractérisation des gamètes
1.1.1 L’ovule
Chez la femme, la maturation ovocytaire s’installe à la puberté selon un rythme cy-clique jusqu’à l’épuisement d’un stock d’ovules initialement formés au stade embryon-naire. En effet, l’ovogénèse débute dès la vie intra-utérine. Au cours de cette période, une réserve de plusieurs millions de cellules immatures est constituée par vagues suc-cessives de mitoses. Elles sont rapidement isolées du reste du tissu ovarien au sein d’un follicule avec lequel elles établissent d’étroites connexions indispensables à leur déve-loppement futur [109]. Cette assise folliculaire prend le nom de cumulus oophorus au contact de l’ovocyte (Figure 1.1a), qui est alors mis en sommeil et la plupart d’entre eux seront éliminés par apoptose jusqu’à l’adolescence. Le début d’une activité hormo-nale hypothalamo-hypophysaire1 déclenchera la reprise du cycle cellulaire. Elle induira
chaque mois le recrutement d’une centaine de follicules, dont un seul parviendra jusqu’à
1. FSH-Hormone Folliculostimulante
maturité. Au cours de cette phase, une matrice extracellulaire semi-perméable se forme entre la cumulus et l’ovule. Cette barrière s’appelle la zone pellucide (Figure 1.1b). Elle sera impliquée plus tard dans une des étapes de sélection du spermatozoïde et le fu-tur blocage à la polyspermie. A ce stade, l’ovocyte accumule les produits de réserves lipidiques et protéiques. La quantité de produits de transcription maternelle (ARNm) explose. Cette étape de maturation s’achève par la génération de 2 cellules haploïdes2 de
taille inégale (Figure 1.1b). L’ovocyte élimine ainsi une partie de son matériel génétique sous la forme d’un premier globule polaire, en vue de la fécondation afin d’accueillir le futur ADN paternel. Cette étape clôt la première étape de méiose.
Figure 1.1: a) Ovule de souris entouré de son cumulus. Les liaisons entre cellules du cumulus seront dégradées grâce à la protéine PH-203 portée par la tête du
sper-matozoïde au moment de la fécondation et qui lui permet de disperser cette première protection. b) Ovule de souris débarrassé du cumulus. La zone pellucide bloque l’arrivée directe du spermatozoïde sur la membrane plasmique de l’ovocyte II. Cette deuxième barrière est composée essentiellement de glycoprotéines de type ZP1, ZP2, ZP3 chez les mammifères, auxquelles s’ajoute la ZP4 chez l’être humain [57, 64, 90]. L’interaction ligand/récepteur nécessaire au passage du spermatozoïde est spécifique à chaque es-pèce. C’est d’ailleurs cette barrière qui assure le blocage des fécondations inter-espèces comme par exemple le croisements humain/murin [24]. Sa solidification après féconda-tion de l’ovule, empêche la polyspermie. L’espace entre la zone pellucide et la membrane
plasmique de l’ovule s’appelle l’espace périvitellin.
Une seconde décharge hormonale4aboutit in fine à l’ovulation. La cellule que l’on appelle
dorénavant Ovocyte II est expulsée du follicule mur. Toujours protégé par son cumulus, l’ovule fécondable est libéré dans l’ampoule tubaire au niveau de la partie supérieure du tractus génital féminin (Figure 1.3b). Il y restera quelques jours. La reprise de son
2. 23 chromosomes à 2 n chromatides – 22 autosomes + 1 gonosome X à 2n ADN 4. LH- Hormone Lutéinisante
L’ovule mature apte à la reproduction est une structure rare et de grande taille. Il mesure plus ou moins 100 µm de diamètre chez l’être humain et environ 80 µm chez la souris. La membrane plasmique de l’ovocyte est recouverte d’excroissances appelées microvillosités, qui mesurent plusieurs centaines de nanomètres de long pour seulement quelques dizaines de nanomètres de large [121]. Ces microstructures sont absolument indispensables à la fécondation, même si la raison reste encore mal comprise. En effet chez mus musculus, la fusion du spermatozoïde est impossibles au niveau de la région amicrovillaire6. Cette zone légèrement bombée couvre jusqu’à 30 % de la surface de la
cellule et coïncide généralement avec la présence du fuseau mitotique.
1.1.2 Le spermatozoïde
Chez l’homme, la spermatogénèse débute réellement à la puberté. Elle est à l’origine de la métamorphose des spermatides en spermatozoïdes, en moins de 25 jours et suit un rythme quasi continu jusqu’à la mort. Au cours de la maturation testiculaire des cellules, la ségrégation du matériel génétique aboutit à la génération de deux populations de sper-matozoïdes distincts, l’un héritant du chromosome X et l’autre du chromosome Y. Une étape supplémentaire en sortie des testicules est indispensable à la fonctionnalité de la cellule. Cette période épididymaire octroie aux spermatozoïdes leurs motilités et la ca-pacité de s’arrimer à la zone pellucide de l’ovule. Pour terminer, les cellules sont stockées dans la queue de l’épididyme où elles survivront 3 semaines (Figure 1.3). L’éjaculation libèrera près de 150 millions de spermatozoïdes chez l’être humain et environ 10 millions chez la souris, en suspension dans le liquide séminal. Le spermatozoïde est donc une cel-lule produite en très grande quantité et qui est capable de « nager ». Il mesure environ 100 µm de long chez la souris. Il se décompose en trois parties principales. En partant de gauche à droite (Figure 1.2a), la première portion s’appelle le flagelle. Elle assure la mobilité du spermatozoïde. Le deuxième morceau ou pièce intermédiaire contient essen-tiellement le moteur moléculaire et les mitochondries. Ce compartiment relie le flagelle à la tête. Le dernier étage de la cellule, coiffé par une sorte de cape appelée l’acrosome, renferme le matériel génétique (Figure 1.2b). Bombée chez l’être humain, en forme de faucille chez la souris, la tête ne mesure que quelques micromètres de long. L’ADN y est compacté pour prendre le moins de place possible. Seule la tête du spermatozoïde
5. 23 chromosomes à 1 chromatide – 22 autosomes + 1 gonosome X à 1n ADN 6. zone naturellement dépourvue de microvillosités chez la souris
fusionnera avec l’ovule afin de lui transmettre un jeu de chromosomes complémentaire et assurer du même coup le brassage génétique.
Figure 1.2: a) Spermatozoïde de souris. La cellule comporte trois parties distinctes en partant de gauche à droite. Le flagelle sert de propulseur et confère à la cellule sa nage ondulante très particulière. La pièce intermédiaire, légèrement en surbrillance sur l’image, contient les réserves d’énergie. Pour finir la tête renferme le matériel génétique sous forme condensée. L’aspect en faucille est caractéristique des spermatozoïdes de souris. b) Sur la tête, trois zones se distinguent. La partie verte correspond à l’acrosome. Elle sera éliminée au cours de la maturation du spermatozoïde, démasquant ainsi une portion de membrane totalement nouvelle. Ce processus est indispensable pour réussir la fécondation. La partie rouge est baptisée cape post-équatoriale. Elle n’a pour le moment pas d’implication connue dans le processus de rencontre gamétique. En revanche, la zone comprise entre les deux éléments colorés s’appelle le segment équatorial. Il sera le lieu
privilégié de la fusion avec la membrane plasmique de l’ovule.
1.1.3 Maturation des gamètes
Les gamètes subissent au cours de leurs développements toute une série de modifi-cations. Au terme de la gamétogénèse, le spermatozoïde et l’ovule se distinguent des autres éléments de l’organisme par l’haploïdie de leur noyau, entrainant une redistribu-tion importante de leurs matériels génétiques. La recombinaison et la ségrégaredistribu-tion des chromosomes, qui a lieu au cours de la méiose, font de ces cellules, des entités abso-lument uniques. Tandis que le développement de l’ovule se produit entièrement dans l’ovaire, le spermatozoïde ne deviendra totalement fécondant qu’au passage des voies génitales féminines. Une de ces étapes - la capacitation - dure 5 heures dans l’espèce humaine, seulement 1 heure 30 chez la souris [53]. Elle est déclenchée par la dispersion du liquide séminal et le pH plus acide du vagin provoque alors une déstabilisation de la membrane plasmique du spermatozoïde. La cellule devient perméable à certains ions comme le calcium, ce qui module par ricochet la mobilité du spermatozoïde. Il devient « hyperactif » et « fléchant ». Les plus rapides atteindront les trompes de Fallope en à peine quelques dizaines de minutes.
Néanmoins, l’appareil reproducteur féminin est une formidable machine à trier. La ré-gulation y est très importante et élimine systématiquement toutes les cellules inaptes. Seuls quelques centaines atteindront finalement la périphérie de l’ovule.
Figure 1.3: a) Origine et maturation des gamètes chez l’homme. Étape 1, production des spermatozoïdes dans le testicule. Étape 2, maturation des cellules dans l’épididyme. Étape 3, libération des spermatozoïdes dans le canal déférant. b) Origine et maturation des gamètes chez la femme. Étape 1, maturation des ovules dans l’ovaire. Étape 2, libération de l’ovocyte fécondable et rencontre avec le spermatozoïde dans l’ampoule
tubaire. Étape 3, implantation de l’œuf fécondé dans la paroi utérine.
1.2
Fécondation
La procréation se caractérise par l’union d’un ovule avec un spermatozoïde et la généra-tion d’un œuf diploïde totipotent à l’origine d’un nouvel individu génétiquement unique. Ainsi, le terme « fécondation » regroupe l’ensemble des événements, qui aboutiront in fine à la fusion d’un gamète paternel avec le gamète maternel.
1.2.1 La réaction acrosomique
Les spermatozoïdes capacités parvenus jusqu’à l’ampoule tubaire au niveau des trompes sont en bonne position pour accomplir leur mission (Figure 1.3b). Toutefois l’ovocyte, au stade de méiose II et qui les attend, est encore protégé par la zone pellucide, elle-même entourée du cumulus. Dans un premier temps, les spermatozoïdes devront donc franchir cette matrice folliculaire. Grâce à l’activité enzymatique de certaines protéines présentes sur leurs têtes (PH-20), ils dégraderont la cohésion de cette première barrière et se fraieront un passage jusqu’à la zone pellucide. Le franchissement de la zone pellu-cide commencera par la formation d’un lien réversible avec un des ligands de ce nouvel obstacle7. Au même moment, une modulation des produits de sécrétion se produit dans
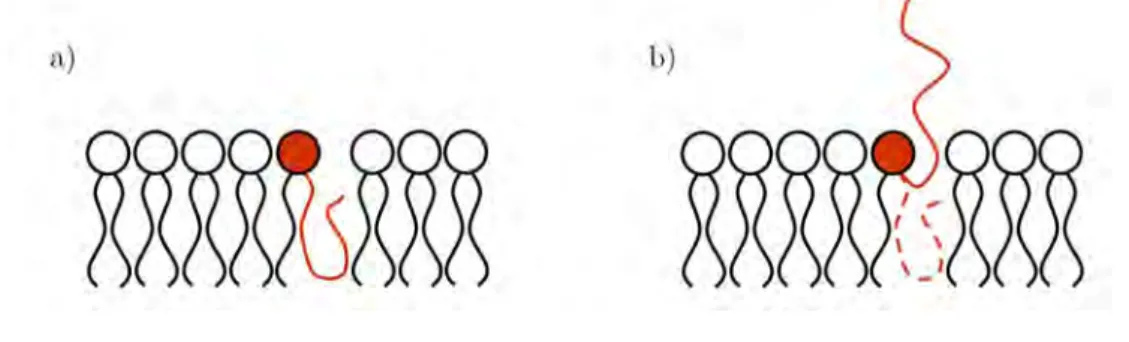
l’environnement immédiat du spermatozoïde [107,108]. Il se déclenche alors un phéno-mène de fenestration de la partie antérieure de sa tête – l’acrosome (Figure 1.4a2). Cette
étape, appelée « réaction acrosomique », expose une fraction de membrane jusqu’à pré-sent insoupçonnée (Figure 1.4a4). Certaines protéines, toute juste démasquées, serviront de nouveaux points d’attaches à la zone pellucide. Cet ancrage renforcé, couplé aux mou-vements actifs du flagelle permettront au spermatozoïde de s’infiltrer plus en profondeur jusqu’à atteindre l’espace périvitellin.
Figure 1.4: a) Les différentes étapes de la réaction acrosomique du spermatozoïde chez l’homme. Fenestration de l’acrosome (2) et démasquage de la membrane interne (3) de l’acrosome. b) Observation du processus sur la tête du spermatozoïde de souris.
Il existe encore un vif débat sur les facteurs déclenchant la réaction acrosomique. Une partie de la communauté considère que la perte de l’acrosome est provoquée avant tout par le contact avec la zone pellucide [57], alors que d’autres avancent l’hypothèse selon laquelle le milieu environnant contenant des hormones et certains ions secrétés par le cumulus, initieraient cette transformation [89]. Néanmoins dans tous les cas, il ne fait aucun doute que la réaction acrosomique est un mécanisme de maturation indispensable à la fécondation et qu’il est particulièrement conservé dans l’évolution. Cette modification de la partie acrosomale du spermatozoïde se retrouve chez des êtres sexués aussi éloignés des mammifères que les Échinides8.
1.2.2 Adhésion et fusion du spermatozoïde à la membrane de l’ovocyte
Un spermatozoïde, qui franchit la zone pellucide, évolue alors dans l’espace périvitellin et sonde la surface de l’ovule (Figure 1.5). En à peine quelques secondes, il adhère à la membrane plasmique de l’ovocyte via la partie antérieure de sa tête [161] (Figure
de son immobilisation complète en position tangentielle [161]. La fusion des deux cellules déclenche ensuite le relargage par l’ovule, de Calcium contenu dans les granules corticaux [145, 146] rendant ainsi la zone pellucide imperméable aux autres spermatozoïdes. La solidification de cette barrière bloquerait en grande partie la polyspermie.
Figure 1.5: Plusieurs spermatozoïdes évoluent dans l’environnement de l’ovocyte pro-tégé par sa zone pellucide. Un spermatozoïde, qui franchit l’espace périvitellin, va in-teragir avec la membrane de l’ovocyte pour en théorie fusionner. Si cette étape est un
succès, la zone pellucide se rigidifie pour bloquer la polyspermie.
1.2.3 Internalisation du spermatozoïde et décondensation de son ADN
Après la fusion, une partie du spermatozoïde, incluant au moins la tête et une fraction de la pièce intermédiaire est internalisée par l’ovocyte selon une dynamique « semblable » à la phagocytose. Le noyau spermatique est progressivement transféré dans le cytoplasme de l’ovocyte (Figure 1.7).
La fécondation achève ainsi la méiose avec l’émission d’un second globule polaire (Figure 1.8). La procréation rétablit de cette manière la diploïdie9 de l’œuf en réassortissant
deux séquences génétiques différentes issus des parents. La décondensation de l’ADN du spermatozoïde précède la formation de pronoyaux puis le début du développement
Figure 1.6: Adhésion et Fusion des gamètes. a) Une fois passé la zone pellucide et arrivé dans l’espace périvitellin de l’ovule, le spermatozoïde adhère à la membrane plasmique de l’ovule. b) Le spermatozoïde fusionne ensuite par son segment équatorial.
Le processus se déroule généralement en à peine quelques minutes.
Figure 1.7: Internalisation de la tête du spermatozoïde et début de décondensation de son ADN. Une vésicule se forme à la pointe de l’acrosome. Elle est composée à la fois de membrane de spermatozoïde et membrane ovocytaire. Elle sera dégradée bien
rapidement.
Figure 1.8: Fécondation réussie d’un spermatozoïde avec un ovule. Séparation de l’ADN de l’ovule le long du fuseau mitotique avec émission du second globule polaire. Sur le côté droit de l’ovule, le noyau d’ADN du spermatozoïde est déjà intégré au cytoplasme de la cellule. Une partie du flagelle est accolée à la membrane plasmique
Les acteurs protéiques de
l’interaction gamétique
La fécondation est caractérisée par l’union d’un gamète mâle et d’un gamète femelle. Une fois franchies toutes les étapes de sélection, le spermatozoïde doit encore adhérer à la membrane plasmique de l’ovule pour y fusionner en quelques minutes. Ces deux phases cruciales d’adhésion et de fusion impliquent de toute évidence des acteurs d’une très grande spécificité1 à l’efficacité remarquable. La question se pose dès lors de
l’exis-tence d’un complexe protéique capable d’aboutir à un tel résultat2. Alors qu’à la fin des
années 1990, le couple protéique ADAM12-α6β1 semblait fournir une réponse élégante aux mécanismes en jeu, de nouvelles techniques issues du génie génétique sont venues profondément rebattre les cartes du modèle établi. Finalement, les découvertes en 2005 d’Izumo1 [68] et de son récepteur Juno en 2014 [9] sur la membrane ovocytaire ont certes apporté un nouveau regard sur le processus, mais sans pour autant lever le voile sur l’étape de la fusion gamétique.
2.1
Modèle avant 2005
Le modèle d’avant 2005 décrivait traditionnellement le processus d’adhésion/fusion comme le fait de l’interaction d’une ADAM (A Disintegrin And Metalloprotease protein) sur la membrane du spermatozoïde avec une Intégrine sur l’ovocyte.
1. le spermatozoïde ne féconde pas d’autres types cellulaires connues que l’ovule 2. à l’image des SNAREs et de la fusion synaptique [106,131]
intervenir dans certains mécanismes d’adhésion extracellulaire et de signalisation intra-cellulaire [114]. Elle compte à l’heure actuelle plus d’une trentaine de membres, présents aussi bien chez les vertébrés que les invertébrés. Leurs structures ont été particulièrement conservées au cours de l’évolution [45]. Ce sont des protéines transmembranaires avec un large domaine extracellulaire se décomposant en cinq parties distinctes (Annexe A). L’ex-trémité N-terminal est chapeautée par un Prodomaine3 et une portion Metalloprotease4.
Tous deux ont été décrits comme servant aux transformations post-traductionnelles in-dispensables pour rendre la protéine active et seront progressivement éliminées au cours de la maturation de cette dernière. Suit la partie Disintegrine5 dévoilée après clivage
des deux éléments précédents. Elle possède une grande affinité pour une autre lignée de protéines : les Intégrines. La séquence peptidique se termine juste avant son entrée dans la membrane lipidique par un fragment de type EGF6 [160]. La partie extracellulaire
d’une ADAM est également très riche en cystéine7.
Une quinzaine d’entre elles s’expriment toute ou partie dans les tissus testiculaires [151]. Certaines sont même présentes plus spécifiquement sur la tête du spermatozoïde. La Fertiline (PH-30) est la première à avoir été identifiée chez la souris à la surface du sper-matozoïde. Elle comprend deux sous-unités - la Fertiline α (ADAM1) et la Fertiline β (ADAM2) – qui, même si elles peuvent rester monomérique [46], ont plutôt tendance à s’associer en homodimère ou en hétérodimère [12,48]. Au cours de la maturation du spermatozoïde, ADAM12 a été décrite comme se relocalisant dans la zone privilégiée de la fusion avec l’ovule, le segment équatorial [113,161]. De plus sur ADAM1, une sé-quence d’acides aminés particulière, située entre les domaines Disintegrin et EGF, révèle de fortes similitudes avec certains peptides fusogènes caractéristiques des virus. Ces at-tributs en ont fait pendant longtemps le candidat principal de la fusion gamétique. De surcroît, l’utilisation d’anticorps monoclonaux ciblant spécifiquement ADAM12, inhibe les fécondations in-vitro chez la souris, d’où le nom de « Fertiline » [113].
Depuis, plusieurs autres « A Disintegrin And Metalloprotease » protéines ont pu être mises en évidence, comme par exemple ADAM3 (Cyritestine) découverte sur le sper-matozoïde immature. Elle ne semble toutefois pas jouer un grand rôle dans l’étape de
3. Le Prodomaine fait office d’intermédiaire pour initier une interaction avec d’autres protéines dans le but par exemple de former des complexes
4. Fraction similaire à une classe d’enzymes du même nom liant un ion métallique Zinc 5. Peptides identifiés pour la première fois dans le venin de serpent
6. Epidermal Growth Factor - Séquence similaire un facteur de croissance qui stimule la prolifération et la différenciation cellulaire
7. Un des acides aminés essentiels à la synthèse des protéines. Il possède un atome de soufre indis-pensable à la formation d’un pont disulfure. Ce processus d’oxydation chimique entre deux cystéines contribue à la stabilité du repliement interne de la protéine ou peut aussi former un lien avec un autre partenaire
fusion puisque qu’elle est relarguée par la cellule au moment de sa réaction acrosomique. En revanche, ADAM24 (Testase 1) [168] exprimée chez l’homme et présente à la sur-face du spermatozoïde mature ou encore ADAM4 et 6 [58] pourraient être impliquées plus directement dans l’interaction avec l’ovule sans pour autant plus de détails pour le moment.
2.1.2 Les Intégrines
Les Intégrines sont des récepteurs typiques de l’adhésion cellulaire, Calcium dépendants et transmembranaires [15, 41]. Elles forment des hétérodimères constitués d’une sous-unité α et d’une sous-sous-unité β8 (Annexe A). A l’heure actuelle, vingt-quatre combinaisons
αβ différentes ont été identifiées [15], dont six d’entre elles interagissent avec au moins huit ADAM distinctes. Leurs activations par la fixation de cations divalents du type Calcium déclenchent un changement de conformation, démasquant le site de liaison porté par la sous-unité α [4].
La première des Intégrines importantes identifiées dans la fécondation fut α6β1 [1]. Elle s’exprime uniformément à la surface de la zone microvillaire de l’ovocyte mature et reconnait en trans la Fertiline β (ADAM2) portée par le spermatozoïde [120]. L’utilisation d’anticorps monoclonaux spécifique d’α6β1 inhibe d’ailleurs fortement la fécondation [1]. Le criblage de la membrane de l’ovule révéla par la suite la présence de plusieurs autres sous-unités commune à la souris et à l’humain comme αvβ3 et α5β1 [22,149,169], toutes deux récepteurs respectifs de la Vitronectine [19] et de la Fibronectine [122] constituant de la matrice extracellulaire du spermatozoïde. La sous-unité β des Intégrines a aussi la particularité de se lier en C-terminal à l’Actine du cytosquelette par le biais d’acteurs intracytoplasmiques (Paxiline, Vinculine, Taline).
2.1.3 ADAM12/α6β1
Les modèles décrivant l’interaction gamétique ont longtemps considéré que le couple ADAM12/α6β1 était clé dans le processus de fécondation (Figure 2.2). Il était indéniable que certaines caractéristiques des Fertilines et de leurs récepteurs pouvaient leurs confé-rer un rôle privilégié dans le processus de fusion gamétique. Ces suppositions étaient d’ailleurs renforcées par l’utilisation d’anticorps monoclonaux ciblant spécifiquement ces protéines et inhibant fortement l’interaction entre le spermatozoïde et l’ovule. Pour au-tant, l’émergence de nouvelles techniques issues du génie génétique est venue tout re-mettre en question. Les protéines considérées jusqu’à présent comme essentielles sont se
révélés plus ou moins fertiles. En réalité, les spermatozoïdes semblent plutôt affectées par des défauts de migration dans l’appareil génital féminin ou par des problèmes d’adhé-sion que par des ennuis de fud’adhé-sion [30, 102, 128]. Ainsi, le véritable rôle des Intégrines et de leurs ligands pourraient se situer plutôt dans la conversion de signaux mécaniques en messages biochimiques [31]. Soumises à des contraintes physiques, ces protéines ser-viraient de relais entre l’intérieur et l’extérieur de la cellule [16, 66]. Dans l’ovule, la partie cytoplasmique de la sous-unité β liée au cytosquelette pourrait redistribuer les contraintes en différents endroits de l’œuf déclenchant une cascade de signalisation [54]. Toutefois, même si ce modèle semble fortement remis en question pour expliquer l’étape de fusion gamétique, les interprétations directes sont néanmoins délicates. Effectivement, le mode d’action redondant des Intégrines serait susceptible de compenser la perte d’une d’entre elles. Par ailleurs, α6β1 a aussi été identifiée sur la tête du spermatozoïde. Ce qui, en cas d’échange de fragments de membrane entre les deux gamètes, pourrait restaurer la surface de l’ovule « KO » [7]. Pour conclure, l’éventualité de découvrir incidemment de nouvelles intégrines n’est pas impossible, à l’instar de la sous-unité α9 dernière en date [153].
2.2
Modèle après 2005
Un changement majeur est intervenu en 2005, quand une équipe japonaise est parvenue à identifier, pour la première fois, une protéine de la SuperFamille des Immunoglobulines absolument vitale pour l’interaction gamétique. Puis la découverte en 2014, soit presque dix ans plus tard, de son récepteur sur la membrane de l’ovule est venue confirmer ce résultat.
2.2.1 Les protéines de la SuperFamille des Immunoglobulines
Le premier véritable acteur spermatique identifié comme essentiel à la fécondation est issu de la SuperFamille des Immunoglobulines (Ig SF). Ce groupe de protéines déjà connu pour être impliqué dans de nombreux processus d’adhésion cellule-cellule [21], compte à l’heure actuelle plus de 765 membres chez l’homme [55], 140 chez la mouche ou encore 64 chez le vers [21]. Ils ont tous en commun un ou plusieurs domaines de type Immunoglobuline issus d’un même gène ancestral (Annexe A).
Mise en évidence en 2005 par une équipe japonaise chez Mus Musculus, Izumo19 est
à ce jour la seule protéine transmembranaire identifiée sur la membrane du spermato-zoïde, comme indispensable à l’étape de fusion avec l’ovule [68] (Figure 2.2). Elle est présente à la fois chez la souris et chez l’homme [60]. Izumo1 se relocalise après la réac-tion acrosomique du bord de l’acrosome au segment équatorial [124] (Figure 1.2), sous l’action éventuelle d’une sérine kinase spécifique du testicule - TSSK6 [136]. Le domaine extracellulaire est formé du segment Izumo suivi d’un unique domaine Immunoglobuline stabilisé par un seul pont disulfure. Cette liaison spécifique a fait penser un temps à un état intermédiaire, où le clivage de ce lien rendrait possible la fusion avec la cellule hôte grâce au changement de conformation, qui en résulterait. La protéine existe sous quatre états homotypiques différents notés simplement Izumo1, 2, 3 et 4 [44].
La génération de souris Izumo1 « KO » n’affecte que les mâles. Ce sont les seuls à être stériles in-vivo malgré un comportement sexuel « normal ». De plus au microscope, les spermatozoïdes passent tous les critères de sélection. La mobilité est bonne, la morpho-logie est normale et la réaction acrosomique a bien lieu. Néanmoins in-vitro, les résultats sont identiques, aucune fécondation n’a lieu. Les gamètes vont s’accumuler dans l’espace périvitellin, adhérer à la membrane de l’ovule sans jamais fusionner.
Izumo1 est également capable de former des complexes en s’oligomérisant avec lui-même. La dimérisation a lieu par la partie N-terminal sans impliquer le motif Immunoglobu-line (Figure 2.1). Puis les tétramères, quant à eux, se forment en C-terminal via leurs queues cytosoliques[44]. Cette association d’Izumo1 un peu particulière suggère une po-tentielle coopération de la molécule avec elle-même afin de renforcer le lien d’adhésion entre le spermatozoïde et l’ovule, même si la dimérisation en C-terminal ne semble pas indispensable pour la fusion [165]. Izumo1 subit aussi toute une série de modifications post-traductionnelles. Par exemple, elle possède un site unique de glycosylation extracel-lulaire. Cette petite transformation pourrait ainsi protéger Izumo1 d’une dégradation prématurée au cours de la maturation des gamètes dans l’épididyme [69].
Son repliement structurel, son oligomérisation et le défaut de fécondation chez les ani-maux « KO » ont laissé croire un temps qu’Izumo1 serait la clé de l’interaction gamé-tique. Pourtant malgré son rôle essentiel, l’ovule s’est révélé incapable de fusionner avec des cellules transfectées exprimant Izumo1 sur leurs membranes plasmiques. L’adhésion puissante induite par la protéine est sans aucun doute indispensable, mais pas suffisante [24].
9. Izumo est une province du Japon, berceau de la religion Shinto où se trouve l’un des plus anciens et importants sanctuaires : Izumo-taisha. Ce temple est dédié au kami Okuninushi-no-mikoto investigateur du En-musubi - les liens qui rassemblent - comme l’amour, l’amitié ou la natalité