1
Évaluation quantitative
de l’exposition à la
radiation en
cardiologie
interventionnelle
Approche transradiale et
facteurs techniques
Guillaume Plourde
Évaluation quantitative de l’exposition à la radiation
en cardiologie interventionnelle :
Approche transradiale et facteurs techniques
Thèse
Guillaume Plourde
Doctorat en médecine expérimentale
Philosophiæ Doctor (Ph. D.)
Québec, Canada
2
Évaluation quantitative de l’exposition à la radiation
en cardiologie interventionnelle :
Approche transradiale et facteurs techniques
Thèse
Guillaume Plourde
Sous la direction de :
3
iii
Résumé
La maladie coronarienne athérosclérotique constitue la principale cause de mortalité au monde. Les interventions coronariennes percutanées occupent une place de choix parmi les modalités diagnostiques et thérapeutiques offertes aux patients et nécessitent à ces fins l’utilisation de rayons X. Or, les effets délétères résultant d’une exposition aux rayons X comptent parmi les risques auxquels sont exposés les patients et le personnel médical lors d’une intervention coronarienne percutanée. Dans le but de minimiser ces risques, il convient de s’intéresser à l’identification, puis à l’optimisation des facteurs influençant l’exposition à la radiation. Parmi ceux-ci, un accès vasculaire via l’artère radiale a été associé de façon inconstante à une exposition accrue, bien qu’il soit de plus en plus adopté à l’échelle mondiale. D’autres facteurs ont également été décrits, mais il n’existe pas à ce jour de classification pratique axée sur les facteurs modifiables par l’hémodynamicien au chevet du patient. Cette thèse avait donc pour objectif l’identification de facteurs techniques modifiables influençant l’exposition à la radiation des patients en cardiologie interventionnelle ainsi que la formulation de recommandations cliniques visant leur optimisation dans une perspective de réduction des risques. Quatre volets indépendants et complémentaires, correspondant à autant d’études publiées dans des journaux scientifiques avec comité de pairs, ont été entrepris à l’Institut universitaire de cardiologie et de pneumologie de Québec afin d’étudier l’influence de la séquence d’intervention, du nombre et du type de cathéters, de la cadence d’images et de la voie d’accès artérielle sur l’exposition à la radiation. Le temps de fluoroscopie et le produit dose-surface ont été utilisés comme principales mesures de l’exposition à la radiation. Les résultats obtenus suggèrent que la séquence d’intervention n’influence pas l’exposition des patients à la radiation, mais que l’usage de cathéters spécifiques et d’une cadence d’images en fluoroscopie à 7,5 images par seconde sont associés à une réduction de l’exposition des patients. La voie d’accès transradiale est quant à elle associée à une légère hausse de l’exposition à la radiation comparativement à la voie transfémorale, mais les répercussions cliniques de ce surplus semblent peu significatives pour le patient. En conclusion, l’optimisation de facteurs techniques modifiables permet de réduire l’exposition à la radiation des patients en cardiologie interventionnelle et réitère l’importance de l’adoption de bonnes pratiques de radioprotection.
iv
Abstract
Coronary artery disease is the leading cause of mortality throughout the world. Percutaneous coronary interventions are increasingly used as diagnostic and therapeutic tools applied to patient care. The use of X-rays is mandatory to perform these procedures. The side effects of radiation exposure are amongst the risks to which patients undergoing a percutaneous coronary intervention are exposed. In order to minimize these risks, one must identify and optimize factors influencing radiation exposure. Amongst them, the radial vascular access site has been inconsistently associated with an increased exposure, even if it is increasingly adopted worldwide as the primary access site. Other factors have also been identified, yet a clinical classification based on their optimization potential by the physician at patient’s bedside remains to be described. The aims of this thesis were identification of technical factors that could be modified at patient’s bedside and formulation of clinical recommendations influencing patient’s radiation exposure. Four independent and complementary projects have been proposed targeting revascularization strategy, catheters number and type, fluoroscopy acquisition rate and vascular access site as potential factors influencing radiation exposure. All studies were lead at Institut universitaire de cardiologie et de pneumologie de Québec. Fluoroscopy time and dose-area product were used as surrogate indicators of radiation exposure. Our results imply that the revascularization strategy did not influence radiation exposure, but that the use of a multiple catheters approach and a 7.5 images per second low-rate fluoroscopy were associated with a reduction of patient’s radiation exposure. Transradial access was associated with a modest increase in radiation exposure when compared with transfemoral access, but the clinical significance of this small increase is uncertain and unlikely to outweigh the clinical benefits of transradial access. In conclusion, identification of technical factors associated with a reduction in radiation exposure enables the formulation of clinical recommendations aiming at risk minimization for the patient and encourages good radiation protection practices.
v
Table des matières
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... ix
Liste des figures ... x
Abréviations ... xii
Remerciements ... xiv
Avant-propos ... xvii
1. Introduction ... 1
1.1 Note historique ... 1
1.2 Maladie coronarienne athérosclérotique et interventions coronariennes percutanées .. 2
1.2.1 Pertinence de l’utilisation des rayons X en hémodynamie ... 6
1.2.2 Impact des interventions coronariennes percutanées sur l’exposition médicale à la radiation ... 6
1.2.3 Autres modalités diagnostiques ... 10
1.3 Mémorandum sur la physique des radiations et leurs interactions avec le vivant ... 13
1.3.1 Génération des rayons X et acquisition de l’image radiologique ... 13
1.3.2 Nature du rayonnement et mesure de l’exposition à la radiation ... 20
1.3.3 Interaction de la radiation avec la matière organique ... 24
1.4 Risques inhérents à l’utilisation des rayons X en hémodynamie ... 28
1.4.1 Effets stochastiques ... 28
1.4.2 Effets déterministes ou réactions tissulaires ... 33
1.4.2.1 Remise en question de l’effet de seuil pour le développement d’effets déterministes: l’exemple des cataractes ... 34
1.5 Radioprotection ... 38
1.5.1 Principes directeurs de la Commission internationale de radioprotection : justification, optimisation de la protection et application de contraintes de doses 38 1.5.2 Niveaux de référence diagnostiques et doses limites ... 39
1.6 Facteurs influençant l’exposition à la radiation en hémodynamie ... 42
1.6.1 Facteurs liés à la lésion ... 42
1.6.1.1 Type de procédure : diagnostique ou interventionnelle ... 42
1.6.1.2 Complexité procédurale ... 43
1.6.2 Facteurs liés au patient ... 43
1.6.2.1 Morphologie et composition corporelle ... 43
1.6.2.2 Anatomie et particularités de l’artère radiale ... 44
vi
R/Users/Guillaume/Desktop/page 7.pdf 1.6.3.1 Paramètres d’exposition à la radiation ... 47
1.6.3.2 Choix du site d’accès vasculaire et impact sur l’exposition à la radiation ... 53
1.6.3.2.1 L’approche transradiale : une alternative d’origine québécoise ... 53
1.6.3.2.2 Comparaison de l’approche transradiale à l’approche transfémorale ... 55
1.6.3.2.3 Exposition à la radiation en fonction du site d’accès vasculaire ... 61
2. Problématique, objectifs et approche expérimentale ... 64
3. Influence de la séquence d’intervention sur l’exposition à la radiation ... 68
3.1 Note sur le texte ... 68
3.2 Résumé ... 70 3.3 Abstract ... 71 3.4 Introduction ... 72 3.5 Methods ... 72 3.6 Results ... 74 3.7 Discussion ... 75
4. Influence du nombre et du type de cathéters sur l’exposition à la radiation lors de coronarographies diagnostiques ... 82
4.1 Note sur le texte ... 82
4.2 Résumé ... 84
4.3 Abstract ... 85
4.4 Introduction ... 86
4.4.1 Single- versus multi-catheters approach ... 86
4.5 Materials and methods ... 87
4.5.1 Study population and data collection ... 87
4.5.2 Procedural technique and materials ... 87
4.5.3 Outcomes ... 87
4.5.4 X-Rays delivery and radiation measuring systems ... 88
4.5.5 Statistical analysis ... 88 4.6 Results ... 89 4.7 Discussion ... 90 4.8 Limitations ... 92 4.9 Conclusion ... 93 4.10 Acknowledgment ... 93 4.11 Disclosures ... 93
5. Efficacité d’une faible cadence d’images en fluoroscopie à réduire l’exposition à la radiation ... 99
5.1 Note sur le texte ... 99
5.2 Résumé ... 101
5.3 Abstract ... 102
vii
Abstract 5.5 Methods ... 104 iv
5.5.1 Study design and cohort ... 104
5.5.2 Randomization ... 104
5.5.3 Cardiac catheterization and PCI ... 104
5.5.4 Radiation protection ... 105
5.5.5 Radiation measurements ... 105
5.5.6 Primary and secondary endpoints ... 106
5.5.7 Statistical analysis and sample size ... 106
5.6 Results ... 107
5.7 Discussion ... 108
5.7.1 Study limitations ... 110
5.8 Conclusions ... 110
5.9 Acknowledgements ... 111
6. Influence du site d’accès vasculaire sur l’exposition à la radiation ... 119
6.1 Note sur le texte ... 119
6.2 Résumé ... 121
6.3 Abstract ... 123
6.4 Introduction ... 125
6.5 Methods ... 126
6.5.1 Search strategy and selection criteria ... 126
6.5.2 Data extraction ... 127
6.5.3 Outcomes ... 127
6.5.4 Statistical analysis ... 128
6.5.5 Role of the funding source ... 129
6.6 Results ... 129
6.7 Discussion ... 131
6.8 Declaration of interests ... 134
6.9 Acknowledgments ... 134
7. Synthèse et perspectives ... 145
7.1 Les facteurs techniques : des déterminants majeurs de l’optimisation de l’exposition145 7.1.1 Séquence d’intervention ... 145
7.1.2 Nombre et type de cathéters ... 146
7.1.3 Cadence d’acquisition des images ... 147
7.1.4 Voie d’accès artérielle ... 149
7.2 Importance de l’expérience de l’hémodynamicien dans le contexte de l’approche transradiale ... 152
7.2.1 Seuils de compétence et maintien de l’expérience ... 154
7.3 Conscientisation à l’égard de l’exposition à la radiation ... 157
viii
Table des matières ... v
Liste des tableaux ix Liste des figures x Abréviations xii Remerciements xiv Avant-propos xvii 1. Introduction ... 1
1.1 Note historique ... 1
1.2 Maladie coronarienne athérosclérotique et interventions coronariennes percutanées .. 2
1.2.1 Pertinence de l’utilisation des rayons X en hémodynamie ... 6
1.2.2 Impact des interventions coronariennes percutanées sur l’exposition médicale à la radiation ... 6
1.2.3 Autres modalités diagnostiques ... 10
1.3 Mémorandum sur la physique des radiations et leurs interactions avec le vivant ... 13
1.3.1 Génération des rayons X et acquisition de l’image radiologique ... 13
1.3.2 Nature du rayonnement et mesure de l’exposition à la radiation ... 20
1.3.3 Interaction de la radiation avec la matière organique ... 24
1.4 Risques inhérents à l’utilisation des rayons X en hémodynamie ... 28
1.4.1 Effets stochastiques ... 28
1.4.2 Effets déterministes ou réactions tissulaires ... 33
1.4.2.1 Remise en question de l’effet de seuil pour le développement d’effets déterministes: l’exemple des cataractes ... 34
1.5 Radioprotection ... 38
1.5.1 Principes directeurs de la Commission internationale de radioprotection : justification, optimisation de la protection et application de contraintes de doses 38 1.5.2 Niveaux de référence diagnostiques et doses limites ... 39
1.6 Facteurs influençant l’exposition à la radiation en hémodynamie ... 42
1.6.1 Facteurs liés à la lésion ... 42
1.6.1.1 Type de procédure : diagnostique ou interventionnelle ... 42
1.6.1.2 Complexité procédurale ... 43
1.6.2 Facteurs liés au patient ... 43
1.6.2.1 Morphologie et composition corporelle ... 43
1.6.2.2 Anatomie et particularités de l’artère radiale ... 44
1.6.3 Facteurs liés à l’hémodynamicien ... 47
7.4 Propos conclusifs ... 162
Glossaire de termes utilisés en radiologie ... 164
Annexe A : Dosimétrie de l’exposition à la radiation du personnel médical ... 166
Annexe B : Matériel complémentaire à l’article présenté au Chapitre 6 ... 170
ix
Liste des tableaux
Tableau 1.1 Classification de l’Institut national du cancer américain des réactions
tissulaires selon la dose absorbée et le temps de latence ... 37
Tableau 1.2 Utilisation de la voie d’accès transradiale lors d’angioplasties dans différents pays ... 54
Table 3.1 Baseline characteristics ... 79
Table 3.2 Procedural characteristics ... 80
Table 3.3 Radiation measurements by number of catheters used ... 81
Table 4.1 Baseline characteristics ... 97
Table 4.2 Radiation parameters per catheter type ... 98
Table 5.1 7.5 versus 15 FPS – Baseline characteristics ... 116
Table 5.2 7.5 versus 15 FPS – Procedural characteristics ... 117
Table 5.3 Radiation measurements and endpoints stratified by procedural type 118 Table 6.1 Description of 24 randomised controlled trials included in the meta-analysis ... 140
Table 6.2 Baseline and procedural characteristics of the trials ... 142
Table 6.3 Operator radiation exposure per procedure ... 144
Tableau 7.1 Seuils d’expérience avec l’approche radiale suggérés par différentes études à répartition aléatoire ... 156
Tableau 7.2 Terminologie à utiliser pour communiquer le risque attribuable à une exposition à la radiation ... 159
Tableau A-1 Doses efficaces limites annuelles des travailleurs exposés à la radiation pour différentes parties du corps ... 169
Table B-1 Description of included observational studies ... 173
Table B-2 Baseline and procedural characteristics of included observational studies ... 184
Table B-3 Cochrane collaboration tool of risk of bias assessment ... 194
Table B-4 Newcastle-Ottawa score for assessment of methodological quality of observational studies ... 195
Table B-5 PRISMA research checklist ... 197
Table B-6 “One study removed” sensitivity analysis for randomized controlled trials reporting fluoroscopy time in a DCA setting ... 199
Table B-7 “One study removed” sensitivity analysis for randomized controlled trials reporting fluoroscopy time in a PCI setting ... 200
Table B-8 “One study removed” sensitivity analysis for randomized controlled trials reporting kerma-area product in a DCA setting ... 201
Table B-9 “One study removed” sensitivity analysis for randomized controlled trials reporting kerma-area product in a PCI setting ... 202
x
Liste des figures
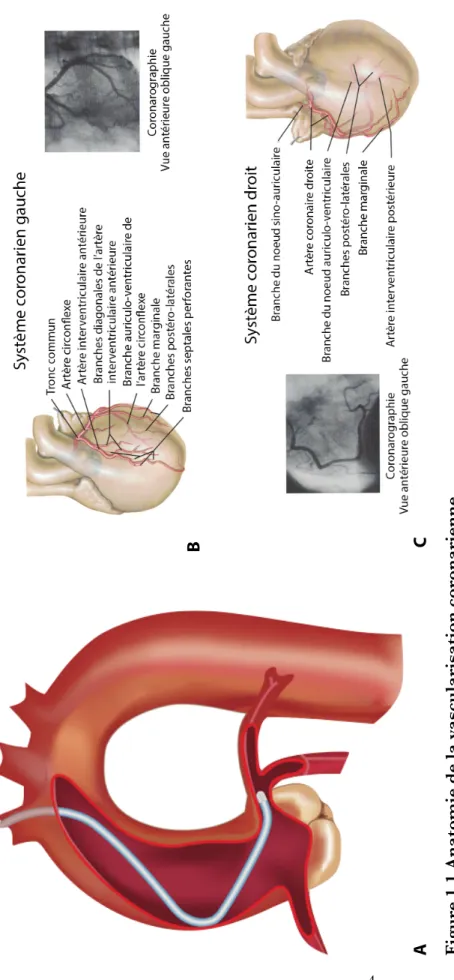
Figure 1.1 Anatomie de la vascularisation coronarienne ... 4
Figure 1.2 Évolution de la maladie coronarienne athérosclérotique ... 5
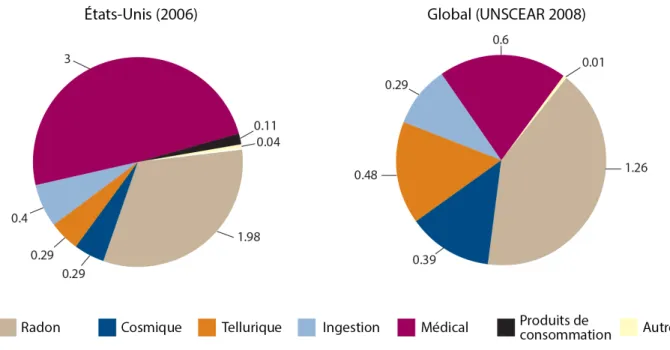
Figure 1.3 Estimation de la contribution de différentes sources à l’exposition publique à la radiation ... 8
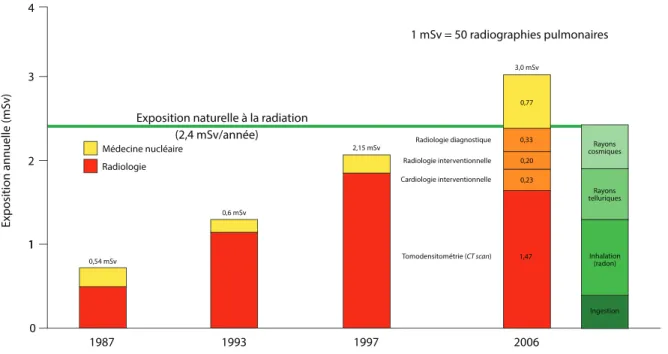
Figure 1.4 Estimation de l’évolution dans le temps de l’exposition médicale à la radiation et comparaison avec l’exposition environnementale mondiale à la radiation ... 9
Figure 1.5 Comparaison des doses efficaces moyennes des principales modalités d’imagerie cardiovasculaire ... 12
Figure 1.6 Appareil radiologique et tube radiogène ... 16
Figure 1.7 Génération des rayons X et filtration du faisceau ... 17
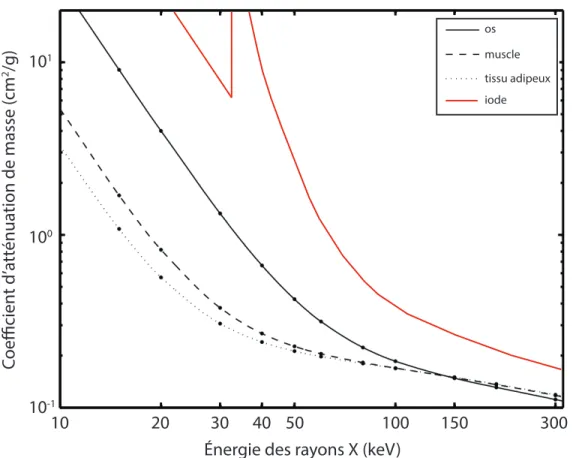
Figure 1.8 Coefficient d’atténuation de masse de l’iode et de tissus humains ... 18
Figure 1.9 Atténuation tissulaire et modulation du contraste de l’image radiologique ... 19
Figure 1.10 Installation d’un laboratoire d’hémodynamie ... 22
Figure 1.11 Isodoses diffusées à partir d’un appareil radiologique ... 23
Figure 1.12 Principaux effets moléculaires et cellulaires de l’exposition à la radiation ionisante ... 26
Figure 1.13 Modèles de probabilité de survenue d’effets stochastiques attribuable à une exposition à la radiation en fonction de la dose ... 32
Figure 1.14 Lésions cutanées induites par une exposition répétée à la radiation ... 36
Figure 1.15 Niveaux de référence diagnostiques pour le produit dose-surface d’une procédure coronarienne percutanée diagnostique ou thérapeutique .... 41
Figure 1.16 Anomalies anatomiques vasculaires rencontrées lors d’un accès transradial ... 46
Figure 1.17 Cadences d’images utilisées en hémodynamie ... 50
Figure 1.18 Exposition à la radiation du patient et du personnel médical lors d’une coronarographie sélective gauche ... 51
Figure 1.19 Mise à jour de la méta-analyse de l’étude RIVAL ... 60
Figure 1.20 Courbe d’apprentissage et évolution du produit dose-surface suite à l’introduction de l’approche radiale ... 63
Figure 3.1 DTB times after immediate PCI and angiography first followed by PCI ... 77
Figure 3.2 Survival curves up to 5 years ... 78
Figure 4.1 Types of catheters according to approach ... 94
Figure 4.2 Fluoroscopy time and kerma-area product by catheter approach ... 95
Figure 4.3 Local reference levels for DCA compared to diagnostic reference levels from international institutions ... 96
xi
Figure 5.1 Radiation protection equipment and EPD ... 112
Figure 5.2 Study flowchart ... 113
Figure 5.3 Effect of 7.5 FPS on operator radiation dose ... 114
Figure 5.4 Effect of 7.5 FPS on Patient DAP ... 115
Figure 6.1 Study selection ... 135
Figure 6.2 Fluoroscopy time in PCI by operator experience ... 136
Figure 6.3 Forest plot of fluoroscopy time in diagnostic coronary angiograms and PCI ... 137
Figure 6.4 Meta-regression analysis of effects of time on radiation exposure ... 138
Figure 6.5 Forest plot of kerma-area product for diagnostic coronary angiograms and PCI ... 139
Figure 7.1 Mise à jour de la méta-régression avec les données de l’étude REVERE ... 151
Figure 7.2 Évolution des doses de radiation générées selon l’expérience des hémodynamiciens et le site d’accès vasculaire ... 153
Figure 7.3 Comparaison du risque de cancer supplémentaire attribuable à l’exposition à la radiation selon différents examens radiologiques ... 160
Figure B-1 Funnel plot of randomized controlled trials reporting fluoroscopy time (A) and kerma-area product (B) ... 204
Figure B-2 Forest plot of kerma-area product for DCA and PCI in included observational studies ... 205
Figure B-3 Forest plot of fluoroscopy time for DCA and PCI in included observational studies ... 206
Figure B-4 Forest plot of fluoroscopy time by radial access ... 207
xii
Abréviations
ACC American College of Cardiology
ACCF American College of Cardiology Foundation
ADN Acide désoxyribonucléique
AHA American Heart Association
BEIR Comité du Conseil national de recherche américain chargé de l’étude des effets biologiques de l’exposition à la radiation (Biological Effects of
Ionizing Radiation)
CABG Pontage aorto-coronarien (Coronary artery bypass grafting) DAP Produit dose-surface (Dose-area product)
DCA Coronarographie diagnostique (Diagnostic coronary angiogram)
DDREF Facteur d’efficacité de dose et de débit de dose (Dose and dose-rate
effectiveness factor)
DMP Différence de moyennes pondérée
DTB Door-to-balloon time
FDA Food and Drug Administration
IAEA Agence internationale de l’énergie atomique (International Atomic Energy
Agency)
IC 95% Intervalle de confiance à 95%
ICRP Commission internationale de radioprotection (International Commission on
Radioprotection)
IRM Imagerie par résonance magnétique
IUCPQ Institut universitaire de cardiologie et de pneumologie de Québec LNT Modèle linéaire sans effet de seuil (Linear-no-threshold)
MACE Major adverse cardiovascular events
MATRIX Minimizing Adverse Haemorrhagic Events by Transradial Access Site and Systematic Implementation of angioX (Lancet 2015;385(9986) :2465-76)
NACE Net adverse clinical events
NCI Institut national du cancer américain (National Cancer Institute) NRD Niveaux de référence diagnostiques
xiii
OMS Organisation mondiale de la santé PAB Temps « porte au ballonnet »
PCI Angioplastie coronarienne percutanée (Percutaneous coronary intervention) REVERE Randomized Evaluation of Vascular Entry Site and Radiation Exposure (JACC
Cardiovascular Interventions 2015;8(9) :1189-96)
RIFLE-STEACS Radial Versus Femoral Randomized Investigation in ST-Elevation Acute Coronary Syndrome (JACC 2012;60(24) :2481-9)
RIVAL Radial vs Femoral access for coronary intervention (Lancet 2011;377(9775) :1409-20)
RR Risque relatif
RTI Rapport des taux d’incidence (risk ratio)
SCA Syndrome coronarien aigu
SCAI Society for Cardiac Angiography and Interventions
SCC Société canadienne de cardiologie
STEMI Infarctus du myocarde avec élévation du segment ST (ST-segment elevation
myocardial infarction)
STEMI-RADIAL ST-Elevation Myocardial Infarction Treated by Radial or Femoral Approach
(JACC 2014;63(10) :964-72)
UNSCEAR Comité scientifique des Nations Unies pour l’étude des rayonnements ionisants (United Nations Scientific Committee on the Effects of Atomic Radiation)
xiv
Remerciements
Mes premières pensées vont à mon directeur de recherche, le Dr Olivier F. Bertrand. Il y a bientôt cinq ans, j’adressais un courriel à tous les chercheurs en cardiologie de l’IUCPQ leur manifestant mon intérêt à m’impliquer dans un projet de recherche. Je n’obtins qu’une seule réponse; le courriel du Dr Bertrand m’invitait à le rencontrer et se terminait par « et pourquoi pas un papier ensemble… » Pour le jeune étudiant que j’étais, ces quelques mots constituaient une opportunité sans précédent, l’étincelle d’allumage à ce que le Dr Bertrand aime appeler le « feu sacré de la recherche ». Après toutes ces années, je demeure admiratif devant son envergure intellectuelle, la profondeur de son analyse, la créativité de son esprit. Parmi les choses qu’il m’aura apprises, je retiens particulièrement la ténacité et la détermination face à l’adversité; success is going from failure to failure without loss of enthusiasm, dirait Churchill.
Or, remercier le Dr Bertrand ne peut se faire sans souligner l’apport de son plus proche collaborateur, le Dr Olivier Costerousse. Son esprit analytique et son sens de l’observation méthodique en font un critique redoutable, dont les précieux commentaires ont éclairé les zones d’ombres qui parsemaient mes travaux.
Merci à mes collègues (devenus amis!) fellows de l’équipe de recherche, à qui je dois beaucoup et dont la réalisation d’une grande partie de mes travaux revient directement : Tigani, Jimmy, Frédéric, Yoann. Merci particulièrement pour votre patience envers l’étudiant impétueux et impatient que j’étais. Merci également aux infirmières de recherche, à Michèle Jadin, à Jean Arsenault, au Dr Jean-Pierre Després, au Dr Éric Larose et au Dr Yves Lacasse pour m’avoir supporté activement dans mon parcours.
Je profite de l’occasion pour remercier sincèrement les membres du jury d’évaluation de ma thèse : Dr Gérald Barbeau, cardiologue hémodynamicien considéré comme l’un des « pères fondateurs » de l’approche transradiale; Dr Paul Poirier, cardiologue et chercheur de renommée mondiale; Dr Rodrigo Bagur, cardiologue hémodynamicien et chercheur que j’ai eu le plaisir de côtoyer alors qu’il complétait ses études doctorales.
xv
Je suis également reconnaissant envers le Centre de recherche de l’IUCPQ, la Faculté de médecine de l’Université Laval, la Fondation de l’Université Laval, le Fonds de recherche du Québec - Santé ainsi que les Instituts de recherche en santé du Canada pour leur soutien financier ininterrompu tout au long de mon cheminement aux études supérieures.
Sur un plan plus personnel, j’éprouve un bonheur quotidien à être entouré, écouté, aimé et guidé par des personnes exceptionnelles. Merci à mes nombreux amis; votre amitié est un phare dans mes moments de doute. Merci à Louis de me comprendre si bien. Merci à Martin, Goran, Marc-Étienne et Marie-Claire, Yann, Marc-Antoine, Timothé, Pascale, Olivier, Élisabeth et Mathieu, Véronique et Martin, Judith, Alexandre. Je chéris précieusement le bonheur que j’ai à partager notre amitié. Merci à tous les professeurs qui ont jalonné mon parcours d’étudiant et qui ont su attiser les braises de ma curiosité et contribué à structurer mon esprit. Merci plus particulièrement à Jean-Marc, Kevin et Louise pour votre présence signifiante et votre amitié fidèle.
Merci à mes parents, deux éducateurs, de m’avoir inculqué l’inestimable valeur de l’éducation. Merci de m’avoir transmis le sens de la famille, le goût du travail bien fait, le respect des autres et la rigueur. Merci à mon frère Étienne, à mes beaux-parents Pierre et Hélène, à mes grands-parents, à Jean-Luc et Louise ainsi qu’au reste de ma famille, notamment pour votre compréhension face aux exigences de mon horaire de travail.
Enfin, merci à ma conjointe Anne de partager la route avec moi et de m’accepter tel que je suis; merci pour ton intelligence, ta complicité, tes attentions. Tu m’es tellement complémentaire que je ne saurais plus vivre sans toi.
Guillaume Plourde Val-Morin, Novembre 2016
xvi
Toute la mer monte d’une pierre qu’on y jette. Blaise Pascal (1623-1662)
Qui serait assez insensé pour mourir sans avoir fait au moins le tour de sa prison? Vous le voyez, frère Henri, je suis vraiment un pèlerin. La route est longue, mais je suis jeune.
- Le monde est grand, dit Henri-Maximilien. - Le monde est grand, dit gravement Zénon. Plaise à Celui qui Est peut-être de dilater le cœur humain à la mesure de toute la vie.
xvii
Avant-propos
La présente thèse intitulée « Évaluation quantitative de l’exposition à la radiation en cardiologie interventionnelle : approche transradiale et facteurs techniques » est présentée à la Faculté des études supérieures de l’Université Laval sous la forme d’une insertion d’articles.
Le chapitre 3 reproduit l’intégral de l’article intitulé « Effect on door-to-balloon time of immediate transradial percutaneous coronary intervention on culprit lesion in ST-elevation myocardial infarction compared to diagnostic angiography followed by primary percutaneous coronary intervention » par Guillaume Plourde, Eltigani Abdelaal, Yoann Bataille, Jimmy MacHaalany, Jean-Pierre Déry, Ugo Déry, Éric Larose, Robert De Larochellière, Onil Gleeton, Gérald Barbeau, Louis Roy, Olivier Costerousse et Olivier F. Bertrand. Cet article est publié dans la revue The American Journal of Cardiology (2013; 111 : 836-840. http://dx.doi.org/10.1016/j.amjcard.2012.11.059). Olivier F. Bertrand, Olivier Costerousse et moi-même avons conçu le projet de recherche, assuré la coordination des collaborateurs, choisi, puis exécuté les analyses statistiques, interprété les résultats, rédigé le manuscrit initial et assuré la révision des versions ultérieures. Nous avions la responsabilité finale de la soumission pour publication. Eltigani Abdelaal a contribué au choix des analyses statistiques, à l’interprétation des résultats, à la préparation du manuscrit et à la révision des versions ultérieures. Yoann Bataille a contribué à l’élaboration de la base de données. Jimmy MacHaalany, Jean-Pierre Déry, Ugo Déry, Éric Larose, Robert De Larochellière, Onil Gleeton, Gérald Barbeau et Louis Roy ont contribué à l’interprétation des résultats et à la révision du manuscrit. Quelques modifications ont été apportées au texte original afin de mieux l’intégrer à l’ensemble de la thèse.
Le chapitre 4 reproduit l’intégral de l’article intitulé « Comparison of radiation exposure during transradial diagnostic coronary angiography with single- or multi-catheters approach » par Guillaume Plourde, Eltigani Abdelaal, Jimmy MacHaalany, Goran Rimac, Yann Poirier, Jean Arsenault, Olivier Costerousse et Olivier F. Bertrand. Cet article est publié dans la revue
Catheterization and Cardiovascular Interventions (2016; Epub ahead of print. doi : 10.1002/ccd.26851).
xviii
assuré la coordination des collaborateurs, choisi, puis exécuté les analyses statistiques, interprété les résultats, rédigé le manuscrit initial et assuré la révision des versions ultérieures. Nous avions la responsabilité finale de la soumission pour publication. Eltigani Abdelaal a contribué au choix des analyses statistiques, à l’interprétation des résultats, à la préparation du manuscrit et à la révision des versions ultérieures. Jimmy MacHaalany, Goran Rimac, Yann Poirier et Jean Arsenault ont contribué à l’interprétation des résultats et à la révision du manuscrit. Quelques modifications ont été apportées au texte original afin de mieux l’intégrer à l’ensemble de la thèse.
Le chapitre 5 reproduit l’intégral de l’article intitulé « Effectiveness of low rate fluoroscopy at reducing operator and patient radiation dose during transradial coronary angiography and interventions » par Eltigani Abdelaal, Guillaume Plourde, Jimmy MacHaalany, Jean Arsenault, Goran Rimac, Jean-Pierre Déry, Gérald Barbeau, Éric Larose, Robert De Larochellière, Can M. Nguyen, Ricardo Allende, Henrique Ribeiro, Olivier Costerousse, Rosaire Mongrain et Olivier F. Bertrand. Cet article est publié dans la revue Journal of the
American College of Cardiology : Cardiovascular Interventions (2014; 7 : 567-574. http://dx.doi.org/10.1016/j.jcin.2014.02.005). Eltigani Abdelaal, Olivier F. Bertrand et Olivier Costerousse ont conçu le projet de recherche, assuré la coordination des collaborateurs, choisi, puis exécuté les analyses statistiques, interprété les résultats, rédigé le manuscrit initial et assuré la révision des versions ultérieures. Ils avaient la responsabilité finale de la soumission pour publication. J’ai contribué au choix des analyses statistiques, à l’interprétation des résultats, à la préparation du manuscrit et des figures ainsi qu’à la révision des versions ultérieures. Jimmy MacHaalany, Jean Arsenault, Goran Rimac, Jean-Pierre Déry, Gérald Barbeau, Éric Larose, Robert De Larochellière, Can M. Nguyen, Ricardo Allende, Henrique Ribeiro et Rosaire Mongrain ont contribué à l’interprétation des résultats et à la révision du manuscrit. Quelques modifications ont été apportées au texte original afin de mieux l’intégrer à l’ensemble de la thèse.
Le chapitre 6 reproduit l’intégral de l’article intitulé « Radiation exposure in relation to arterial access site used for diagnostic coronary angiography and percutaneous coronary intervention: a systematic review and meta-analysis » par Guillaume Plourde, Samir B. Pancholy, Jim
xix
Nolan, Sripal Bangalore, Sunil V. Rao, Imdad Ahmed, Tejas Patel, Johannes B. Dahm et Olivier F. Bertrand. Cet article est publié dans la revue The Lancet (2015; 386 : 2192-203. http://dx.doi.org/10.1016/S0140-6736(15)00305-0). Samir B. Pancholy, Olivier F. Bertrand et moi-même avons conçu le projet de recherche, assuré la coordination des collaborateurs, sélectionné les études, choisi, puis exécuté les analyses statistiques, interprété les résultats, rédigé le manuscrit et assuré la révision des versions ultérieures. Nous avions la responsabilité finale de la soumission pour publication. Jim Nolan a contribué au choix des analyses statistiques, à l’interprétation des résultats, à la préparation du manuscrit et à la révision des versions ultérieures. Sripal Bangalore a contribué au choix des analyses statistiques, à l’interprétation des résultats et à la préparation du manuscrit. Sunil V. Rao, Imdad Ahmed, Tejas Patel et Johannes B. Dahm ont contribué à l’interprétation des résultats et à la révision du manuscrit. Quelques modifications ont été apportées au texte original afin de mieux l’intégrer à l’ensemble de la thèse.
Tout au long du texte, les termes en italique entre parenthèses sont en anglais, à moins d’avis contraire.
1
1. Introduction
1.1 Note historique
La découverte des rayons X par Wilhelm Röntgen (1895) a été suivie par une expansion technologique de laquelle ont rapidement émergé plusieurs applications médicales. Très tôt, la communauté médicale s’est aperçue du potentiel de ces rayons, qui permettaient de visualiser l’intérieur du corps de façon non invasive et indolore pour le patient. La cardiologie, alors jeune spécialité médicale en émergence, n’échappa pas à cet enthousiasme et intégra les rayons X à son arsenal diagnostique.
Le Dr Werner Forssmann fit la première utilisation des rayons X chez l’humain à des fins diagnostiques en cardiologie (1929) en installant un cathéter dans l’une de ses veines antécubitales et en immortalisant son exploit sur une radiographie. L’image obtenue, loin de posséder la précision des films d’aujourd’hui, permit néanmoins d’objectiver un cathétérisme cardiaque in vivo minimalement invasif, n’ayant pas nécessité d’exploration thoracique chirurgicale. Suite à cette première expérience, les Drs André F. Cournand (1941) et Dickinson W. Richards (1945) ont travaillé à raffiner le cathétérisme cardiaque intra-artériel à visée diagnostique. Les Drs Forssmann, Cournand et Richards se sont d’ailleurs vu décerner le prix Nobel de physiologie ou médecine (1956) pour leurs travaux.
Ce n’est cependant qu’en 1953 que le Dr Sven Ivar Seldinger mit au point la technique de ponction percutanée permettant le cathétérisme cardiaque rétrograde; cela a ouvert la voie aux Drs Howard J. Ricketts et Herbert L. Adams (1962) ainsi qu’au Dr Melvin Judkins (1967), qui ont réalisé les premières coronarographies diagnostiques sélectives par voie transfémorale avec des cathéters préformés. Enfin, le Dr Andreas Grüntzig a pratiqué la première angioplastie avec dilatation par ballonnet (1977). Cette avancée ouvrait la porte à la vaste discipline qu’est aujourd’hui la cardiologie interventionnelle.
2
1.2 Maladie coronarienne athérosclérotique et interventions coronariennes
percutanées
Le cœur est un organe musculaire composé de quatre cavités servant à pomper le sang dans l’organisme. Un système vasculaire dit coronarien (lat. corona,-ae; couronne) émerge de la racine aortique et assure l’apport sanguin du muscle cardiaque (Figure 1.1). Ce réseau, à l’instar du reste de la vascularisation artérielle périphérique, n’est pas exempt de développer une maladie vasculaire athérosclérotique, c’est-à-dire une combinaison de sclérose vasculaire et de formation de plaques athéromateuses (Figure 1.2). C’est le développement, la déstabilisation, puis la rupture de ces plaques qui sont à l’origine de la maladie coronarienne, dont le spectre des manifestations cliniques s’étend de l’angine de poitrine à l’infarctus aigu du myocarde.
On estime actuellement que la maladie coronarienne affecte 16,5 millions d’individus de plus de 20 ans aux États-Unis, soit une prévalence de 6,9% de la population (1). Globalement, on estime que le nombre de décès attribuables à la maladie coronarienne a augmenté de 16,6% entre 2005 et 2015; en 2015, la maladie cardiovasculaire représentait toujours la première cause de mortalité au monde (1, 2). Aux États-Unis, la prévalence de la maladie coronarienne serait cependant en régression depuis le début des années 2000, reflétant un changement des habitudes de vie, de meilleurs soins préventifs ainsi qu’une amélioration de la prise en charge médicale (1, 3, 4).
Sommairement, deux types de procédures ont cours au laboratoire d’hémodynamie pour diagnostiquer, puis traiter la maladie coronarienne. Les procédures diagnostiques, ou coronarographies (diagnostic coronary angiogram, DCA), permettent de visualiser le réseau vasculaire coronarien via l’insertion d’un cathéter intra-artériel dans l’un des deux ostia coronaires (Figure 1.1). Un fluide de contraste iodé est par la suite injecté localement via le cathéter, ce qui opacifie les ramifications vasculaires en aval de ce dernier. Dans la majorité des cas, une injection de contraste dans l’ostium coronaire gauche permet de visualiser le tronc commun, l’artère interventriculaire antérieure, l’artère circonflexe ainsi que leurs branches. Une injection dans l’ostium coronaire droit permet quant à elle de visualiser l’artère coronaire
3
droite ainsi que l’artère interventriculaire postérieure, lorsque le système droit est dit « dominant » (85% des cas) (5). Lorsqu’il est « non dominant », l’artère interventriculaire postérieure provient soit de l’anastomose de l’artère coronaire droite et de l’artère circonflexe (5%), soit de l’artère circonflexe seule (10%). Elle peut alors être visualisée par une injection de liquide de contraste dans l’ostium coronaire gauche.
L’angioplastie coronarienne percutanée (percutaneous coronary intervention, PCI) correspond au deuxième type de procédure pendant laquelle l’hémodynamicien procède à un remodelage de la lumière vasculaire coronarienne afin de lever l’obstruction identifiée préalablement et de rétablir le flot sanguin. Pour ce faire, il peut entre autres utiliser un ballonnet, avec lequel il dilate la lésion, ou un tuteur (stent) qui redistribue la plaque et maintient la paroi vasculaire ouverte à long terme. Avec les années, l’angioplastie est devenue une procédure de choix dans le traitement de la maladie coronarienne avancée (6).
Aux États-Unis, on estime que plus d’un million de coronarographies diagnostiques et plus de 490 000 angioplasties sont réalisées annuellement (1). Un encadrement de l’accès à ces soins spécialisés combiné à la diminution de la prévalence de la maladie coronarienne symptomatique ont résulté en une diminution marquée du nombre de procédures par année (1, 7). À titre comparatif, on comptait près d’un million d’angioplasties réalisées en 2006 aux États-Unis (4, 8). Au Canada, on estimait en 2014 un taux normalisé selon l’âge de 204 angioplasties par 100 000 individus (IC 95% 202 - 206/100 000), soit environ 60 000 à 70 000 procédures par année au pays (9-11).
4
Figure 1.1 Anatomie de la vascularisation coronarienne (12) (13) B A C F igu re 1. 1 An at om ie de la v asc u larisat ion c oron arie n n e Re pr és en ta tion de la c an ul at ion de l’os tium c or on air e ga uc he a u niv ea u de la c ros se a or tique à pa rt ir d’un a bor d va sc ul air e ra dia l dr oit (A ). Re pr és en ta tion du cœur e n pos ition a na tom ique e t de sc ript ion de la v as cul ar is at ion a rt ér ie lle du sy st èm e cor on ar ie n ga uc he (B ) e t dr oit (C ). Le s im ag es e n te in te s de g ris s on t obt en ue s lor s d’un e cor on ar og ra ph ie e n pos ition a nt ér ie ur e obl ique g auc he e t pe rm et te nt de c or ré le r l’a na tom ie t hé or ique à l ’a na tom ie obs er vé e ch ez l e pa tie nt . Pour obt en ir l ’im ag e en ( B ), l’os tium c or on air e ga uc he a é té ca nul é, t el qu’e n ( A ); pour l’im ag e e n ( C ), l ’os tium c or on air e dr oit a é té c an ul é. (A ) t ir é de (12 ). (B ) e t ( C ) a da pt és de (13 ).
5
Figure 1.2 Évolution de la maladie coronarienne athérosclérotique
La maladie coronarienne athérosclérotique est une combinaison de sclérose vasculaire et de formation de plaques athéromateuses. Au cours de sa progression, la maladie devient symptomatique lorsque la diminution de la lumière vasculaire cause un déséquilibre entre la demande myocardique en oxygène et la capacité du vaisseau à répondre à cette demande. Coupes transversales adaptées de (13).
6
1.2.1 Pertinence de l’utilisation des rayons X en hémodynamie
L’utilisation des rayons X est nécessaire en hémodynamie puisque ceux-ci permettent de visualiser la lumière des vaisseaux coronariens et d’y intervenir au cours de la même procédure. Suite à l’injection de produit de contraste, un appareil radiologique génère des images (cf. section 1.3.1 pour une discussion plus approfondie à ce sujet), et c’est la somme de celles-ci qui reproduit un film continu permettant à l’hémodynamicien d’évaluer in vivo et de façon minimalement invasive la présence de sténoses, de calcifications ou d’anomalies du lit vasculaire.
1.2.2 Impact des interventions coronariennes percutanées sur l’exposition médicale à la radiation
L’exposition individuelle à la radiation découle d’une grande variété de sources environnementales ou attribuables à l’activité humaine : inhalation de radon, exposition aux rayons telluriques et cosmiques, ingestion d’aliments radioactifs, utilisation de certains produits de consommation ainsi qu’exposition attribuable au secteur médical (examens diagnostiques et traitements) (15).
Selon un rapport du Comité scientifique des Nations Unies pour l’étude des rayonnements ionisants (UNSCEAR) publié en 2008, on estimait que le radon et les rayons cosmiques étaient responsables de près de la moitié de l’exposition individuelle annuelle moyenne au niveau mondial, soit 1,65 mSv/année (15). L’exposition médicale arrivait quant à elle au deuxième rang des sources individuelles et était estimée à 0,6 mSv/année en 2008, soit une dose équivalente à celle générée par 30 radiographies pulmonaires (Figure 1.3). Ces estimés constituent une moyenne mondiale pondérée selon les données provenant de plusieurs pays. En effet, l’exposition individuelle à la radiation varie significativement selon la géographie et le niveau de développement socioéconomique d’une région. À des fins de comparaison, l’UNSCEAR utilise depuis 1988 quatre niveaux de soins de santé basés sur le nombre de médecins par tranche de population (niveau I : ≤ 1 médecin pour 1000 individus; niveau II : 1 :1000-2999; niveau III : 1 :3000-10 000; niveau IV : < 1 :10 000) pour classifier les pays, une
7
mesure qui est corrélée à l’utilisation médicale de la radiation (16). En 2008, celle-ci était 65 fois plus importante dans les pays de niveau 1 (24% de la population mondiale) que dans les pays de niveaux III-IV (27%) (15). À titre d’exemple, l’exposition médicale à la radiation représentait à elle seule près de 50% de l’exposition individuelle aux États-Unis (niveau de soins de santé I) en 2006, soit une exposition de 3,0 mSv/année équivalente à 150 radiographies pulmonaires ou cinq fois l’exposition médicale individuelle par année au niveau mondial (Figure 1.3).
Globalement, on considère que l’exposition médicale à la radiation per capita a sextuplé depuis les années 1980 (17). Selon Picano et al., l’année 2006 constituerait le point tournant où l’exposition médicale à la radiation a pour la première fois dépassé l’exposition attribuable aux sources environnementales (radon, rayons cosmiques, etc.) (Figure 1.4) (18). On estimait en 2006 que l’imagerie diagnostique cardiovasculaire (rayons X et γ) était responsable de 40% de l’exposition médicale à la radiation aux États-Unis, excluant la radiothérapie (17-19). Plus spécifiquement, entre 6,5% et 8,0% de l’exposition médicale à la radiation aux États-Unis seraient directement attribuables au secteur de l’hémodynamie. Cette dose collective, lorsque redistribuée sur l’ensemble de la population (américaine, dans le cas présent, estimée à 300 millions d’individus pour fins de calculs), représente une dose moyenne individuelle de 0,15 mSv équivalente à la radiation générée par environ 8 radiographies pulmonaires (17, 18, 20, 21). Cette exposition individuelle peut sembler négligeable. Or, dans les faits, seuls environ 0,5% à 1,0% de la population ont recours aux services de cardiologie interventionnelle. Ce sont donc ces individus qui se partagent l’ensemble de la dose collective, ce qui représente une exposition non négligeable équivalente à plusieurs fois l’exposition environnementale annuelle.
Bref, la contribution directe significative de la cardiologie interventionnelle à l’exposition médicale globale s’explique par la prévalence de la maladie coronarienne dans la population, par une amélioration de l’accès aux services spécialisés d’hémodynamie et par les doses de radiation relativement importantes générées par chaque procédure.
8
Figure 1.3 Estimation de la contribution de différentes sources à l’exposition publique à la radiation
Les diagrammes représentent une estimation de la contribution des principales sources d’exposition à la radiation aux États-Unis (diagramme de gauche, 2006) et au niveau mondial (diagramme de droite, 2008). Le radon, le rayonnement cosmique et tellurique ainsi que le rayonnement secondaire à l’ingestion d’aliments représentent les sources environnementales. L’exposition médicale et celle attribuable aux produits de consommation découlent quant à elles de l’activité humaine. Les chiffres représentent un estimé des doses moyennes individuelles générées par les différentes sources d’exposition annuellement, en mSv.
UNSCEAR : United Nations Scientific Committee on the Effects of Atomic Radiation Adapté de (15).
9
Figure 1.4 Estimation de l’évolution dans le temps de l’exposition médicale à la radiation et comparaison avec l’exposition environnementale mondiale à la radiation
Ce diagramme à bandes représente la dose efficace moyenne annuelle par individu, exprimée en mSv, en fonction du temps et du pays. La fraction jaune des bandes représente l’exposition attribuable à la médecine nucléaire (rayons γ), tandis que les fractions rouges représentent l’exposition attribuable à la radiologie (rayons X). La colonne en vert représente l’exposition environnementale à la radiation, estimée à 2,4 mSv/année. Il s’agit d’une estimation moyenne, puisque certains endroits au monde ont une exposition environnementale annuelle allant jusqu’à 10 mSv (22). En 2006, aux États-Unis, le secteur de la cardiologie interventionnelle était responsable d’une exposition individuelle estimée à 0,23 mSv/année, ce qui correspond à l’exposition générée par environ 10 radiographies pulmonaires.
Les données proviennent des États-Unis (1987, 1993, 2006) et de l’Allemagne (1997). Adapté de (20).
10 1.2.3 Autres modalités diagnostiques
En plus de la fluoroscopie conventionnelle utilisant les rayons X, il existe d’autres modalités d’imagerie permettant de diagnostiquer la présence de maladie coronarienne ou encore d’en évaluer les répercussions fonctionnelles (23, 24).
Ainsi, la tomodensitométrie (computed tomography scan) et l’imagerie par résonance magnétique (IRM) permettent de visualiser de façon non invasive le système vasculaire coronarien. La tomodensitométrie produit des images précises avec une grande vitesse d’acquisition, mais expose le patient aux effets néfastes de la radiation, générant des doses efficaces moyennes de 15 à 20 mSv par examen (Figure 1.5). L’IRM comporte certains avantages par rapport à la tomodensitométrie, notamment l’absence d’utilisation de produit de contraste pour certains appareils d’IRM et l’absence d’exposition à la radiation (25). Cependant, ni la tomodensitométrie, ni l’IRM ne permettent d’intervenir sur les lésions mises en évidence, contrairement au cathétérisme cardiaque utilisant la fluoroscopie.
Il est également possible de dépister la présence de maladie coronarienne de façon indirecte en évaluant les répercussions fonctionnelles de celle-ci. On utilise généralement l’échographie cardiaque et la scintigraphie de perfusion myocardique à cet effet. L’échographie a l’avantage de n’exposer le patient à aucune radiation et permet de mettre en évidence des anomalies régionales de la contractilité myocardique : selon la paroi myocardique affectée, il est possible de présumer l’atteinte d’une ou de plusieurs artères coronaires. Cependant, ces anomalies de contractilité ne sont pas spécifiques à la maladie coronarienne et peuvent résulter de différentes étiologies non coronariennes. De plus, plusieurs patients sont peu échogènes (notamment en présence d’obésité), rendant l’interprétation diagnostique des images échographiques impossible. La scintigraphie de perfusion myocardique, quant à elle, nécessite l’injection d’un radiotraceur lié chimiquement à un radio-isotope (p.ex. 99mTc), puis une analyse en médecine
nucléaire afin de mesurer l’émission de rayons γ provenant de la désintégration du radio-isotope. Cette émission est proportionnelle à la perfusion myocardique. Une telle analyse demande du temps, est moins sensible et spécifique que la coronarographie et expose le patient à des doses importantes de radiation allant de 10 à 25 mSv par examen selon le protocole
11
utilisé (Figure 1.5) (24). Enfin, à l’instar des autres modalités d’imagerie susmentionnées, il n’est pas possible d’intervenir sur les lésions objectivées.
12
Figure 1.5 Comparaison des doses efficaces moyennes des principales modalités d’imagerie cardiovasculaire
Ce diagramme à bandes représente la dose efficace moyenne des principales modalités d’imagerie cardiovasculaire nécessitant l’utilisation de radiation ionisante. Les doses efficaces sont comparées au nombre d’années d’exposition naturelle équivalentes (moyenne annuelle estimée à 2,4 mSv/individu).
NH3 : ammoniaque, Rb : rubidium, Tc : technétium.
13
1.3 Mémorandum sur la physique des radiations et leurs interactions avec le
vivant
Les radiations électromagnétiques comprennent les ondes radio, les micro-ondes, la lumière visible, les rayons X et les rayons γ. Ces radiations sont classifiées selon leur longue d’onde, leur fréquence et leur énergie. Les rayons X et γ sont les plus énergétiques : un photon de rayons X contient de 5000 à 75 000 fois plus d’énergie qu’un photon de lumière visible (22). Cette énergie, lorsqu’elle dépasse 10 électrons-volts (eV), confère aux radiations électromagnétiques la possibilité d’ioniser les atomes qu’elles rencontrent (26). L’ionisation constitue la capacité d’un rayonnement à éjecter un électron de son orbite autour du noyau atomique. Ce seuil énergétique de 10 eV est atteint par les rayons X et γ, qui sont donc, au côté des particules α et β (rayonnement corpusculaire), des radiations ionisantes.
1.3.1 Génération des rayons X et acquisition de l’image radiologique
Les rayons X sont générés par un tube radiogène (aussi appelé fluoroscope) (Figure 1.6) situé sous le patient. Dans ce tube, un courant d’électrons (exprimé en milliampère, mA) est accéléré par une importante différence de potentiel (exprimée en kilovolt, kV) à partir d’une cathode et est dirigé vers une anode rotative de manière pulsatile. Ces électrons entrent alors en collision avec une cible composée d’un métal très dur (p.ex. tungstène) et perdent rapidement leur énergie cinétique, qui est émise sous la forme de chaleur (99%) et de photons (1%).
Deux types d’interactions entre les électrons incidents et les atomes du métal composant l’anode génèrent ces photons : le bremsstrahlung et la production de rayons X caractéristiques (Figure 1.7) (27).
La majorité des photons sont issus du phénomène de bremsstrahlung, qui signifie littéralement « radiation de freinage » en allemand (28). En passant près du noyau des atomes constituant l’anode, les électrons incidents subissent son attraction et perdent une grande quantité d’énergie cinétique, qui est émise sous la forme de photons. L’énergie des photons ainsi produits est égale à la perte d’énergie cinétique des électrons incidents en raison du principe de
14
conservation d’énergie. De plus, la quantité d’énergie perdue par un électron incident (et transférée à un photon) est inversement proportionnelle à la distance entre ce dernier et le noyau. Or, les électrons ne passent pas tous à la même distance du noyau; ils ne subissent donc pas son attraction avec la même force. C’est pourquoi le phénomène de bremsstrahlung produit un spectre de photons d’énergies différentes, donc la valeur maximale ne peut dépasser celle de la tension de crête (différence de potentiel électrique) appliquée sur le tube radiogène (kilovoltage
peak, kVp) (Figure 1.7).
Le deuxième type d’interaction constitue la production de rayons X caractéristiques, qui survient lorsqu’un électron incident entre en collision avec un électron d’une des orbitales d’un atome de l’anode. Lorsque ce dernier est éjecté de l’atome, sa place est comblée par un électron d’une orbitale d’énergie supérieure. En se rapprochant ainsi du noyau atomique, cet électron perd de l’énergie, qui est émise sous la forme de rayons X « caractéristiques » à chaque élément du tableau périodique.
Le faisceau de photons ainsi formé est alors filtré. Cette filtration permet de retirer du spectre les photons de basse énergie (généralement sous les 30 keV) (Figure 1.7). Sous ce seuil, les photons n’ont pas suffisamment d’énergie pour atteindre et traverser un patient de taille moyenne, ce qui signifie qu’ils ne participent pas à la formation de l’image radiologique. Ils contribuent toutefois à la dose du patient et c’est pourquoi on cherche à les retirer du spectre via la filtration. Cette dernière est effectuée par une mince couche d’aluminium ou de cuivre (deux métaux ayant des coefficients d’atténuation intéressants à de basses énergies) directement appliquée à la sortie du tube.
Une fois filtré, le faisceau de photons est dirigé vers le patient et le traverse en perdant de l’énergie par un phénomène nommé atténuation (22). L’atténuation différentielle, ou modulation, du faisceau de rayons X selon les structures rencontrées (os, muscle, tissu adipeux, etc.) est proportionnelle à leur coefficient d’atténuation de masse (Figure 1.8) et est nécessaire à la formation d’une image contrastée (Figure 1.9). L’énergie perdue via le phénomène d’atténuation est proportionnelle à quatre facteurs : la densité, l’épaisseur et le numéro atomique des éléments formant le tissu rencontré, ainsi que l’énergie du faisceau de rayons X
15
(22). Le degré d’atténuation varie donc selon la composition des tissus traversés. L’utilisation d’un produit de contraste exploite cette caractéristique physique des rayons X (28). Par exemple, un produit de contraste iodé (numéro atomique Z = 53) injecté dans les artères coronaires a un coefficient d’atténuation de masse plus élevé que les tissus environnants formés majoritairement de carbone (Z = 6) et accentue ainsi la différence naturelle entre les structures (Figure 1.8). Le squelette osseux, composé entre autres de calcium (Z = 20), a un coefficient d’atténuation de masse intermédiaire : il est plus élevé que les structures environnantes, mais moins que le contraste iodé.
Lorsque les rayons X pénètrent un patient, ils peuvent soit le traverser ou être absorbés par les tissus via le phénomène d’atténuation. Les rayons absorbés contribuent à la dose du patient, tandis que ceux qui le traversent sont captés par le détecteur ou diffusés. Lorsqu’ils sont captés, les rayons X sont convertis en signal électronique, puis acheminés à un ordinateur chargé de générer une image radiologique digitale. La qualité, le contraste et la définition de l’image obtenue sont interprétés instantanément par l’ordinateur et sont à la base d’une boucle de rétroaction automatique qui calibre les différents paramètres d’acquisition (voltage, ampérage, filtration, etc.) afin d’obtenir l’image la plus nette en exposant le patient à un minimum de radiation. Parmi les paramètres d’acquisition, le courant (mA) influence l’intensité des rayons (nombre de photons émis) et la définition de l’image, tandis que la tension (kVp) influence le pouvoir pénétrant des rayons et le contraste de l’image obtenue.
16
Figure 1.6 Appareil radiologique et tube radiogène
Appareil radiologique constitué d’un tube radiogène ou fluoroscope situé sous le patient. Un flux d’électrons est accéléré d’une cathode vers une anode rotative, où ils sont brusquement freinés. Près de 99% de leur énergie est diffusée en chaleur, le reste étant converti en photons (22). Ces derniers constituent le rayonnement X, qui est filtré à la sortie du tube radiogène afin d’éliminer les rayons inutiles à la génération de l’image diagnostique.
Adapté de la Figure 2.10 de (28).
17
A B
Figure 1.7 Génération des rayons X et filtration du faisceau
(A) Génération des rayons X par le phénomène de bremsstrahlung. En s’approchant d’un noyau atomique (cercle rouge) de charge positive, un électron e d’énergie E1 et de vitesse v1 est attiré
vers ce dernier. Cette attraction lui fait perdre de l’énergie cinétique et le fait dévier de sa trajectoire. Cette perte d’énergie correspond à la différence entre l’énergie initiale (E1) et
l’énergie finale (E2) de l’électron et est émise sous la forme de rayonnement X de fréquence f
selon la relation de Planck-Einstein, où h est la constante de Planck : E = h×f
(B) Spectre de rayons X générés par le phénomène de bremsstrahlung et rayons X caractéristiques. Les courbes représentent la distribution du nombre de photons (intensité du faisceau) en fonction de leur énergie, exprimée en kiloélectronvolt (keV). La zone ombragée correspond à la portion du spectre constituée de photons de faible énergie qui n’ont pas d’intérêt diagnostique mais qui contribuent à la dose du patient : c’est pourquoi on cherche à les retirer du spectre via la filtration du faisceau. La courbe A représente le spectre de photons sans filtration, dont une quantité importante se situe sous les 30 keV. La courbe B représente le spectre filtré par du cuivre, qui absorbe les photons de faible énergie. Cela réduit la dose à la peau, mais aussi le contraste. Diminuer l’énergie maximale des photons (courbe C) améliore le contraste, mais diminue l’intensité du faisceau. Augmenter le courant du tube augmente le nombre de photons et l’intensité du faisceau (courbe D). Le spectre représenté par la courbe D produit des images de même qualité que la courbe A, mais à des doses réduites pour le patient. Figures et légendes adaptées de (27) et de (22).
18
Figure 1.8 Coefficient d’atténuation de masse de l’iode et de tissus humains
Ce graphique représente les coefficients d’atténuation de masse de différents tissus humains et de l’iode, exprimés en cm2/g, en fonction de l’énergie des rayons X, exprimée en
kiloélectronvolt (keV). Pour une même énergie photonique, un tissu ayant un coefficient plus élevé (p.ex. os) absorbera davantage les rayons X que les tissus ayant un coefficient plus faible (p.ex. muscle ou tissu adipeux), ce qui permettra de générer une image contrastée. En effet, l’absorption différentielle du faisceau de rayons X par les différentes composantes d’un objet rend sa structure interne visible. L’utilisation de l’iode comme produit de contraste exploite cette propriété, son coefficient d’atténuation de masse étant plus élevé que les tissus humains avoisinants.
19
Figure 1.9 Atténuation tissulaire et modulation du contraste de l’image radiologique
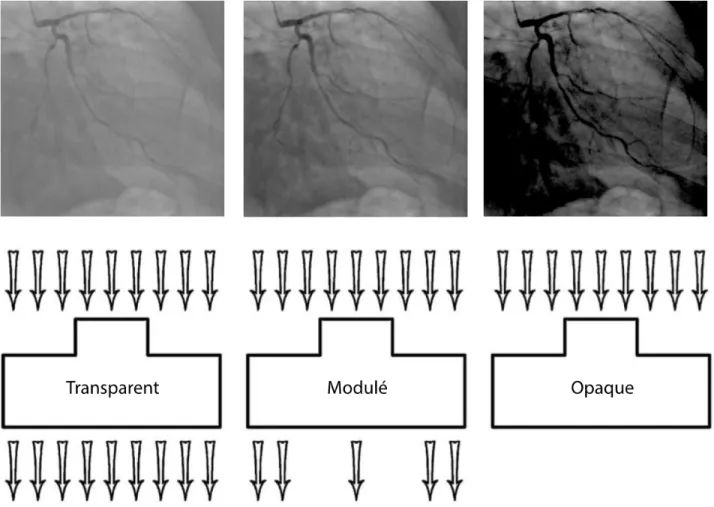
L’absorption différentielle du faisceau de rayons X par les différentes parties d’un objet rend sa structure interne visible sur l’image radiologique. Les photons constituant les rayons X sont représentés par des flèches. Dans l’exemple de gauche, les photons traversent l’objet sans être absorbés. Le faisceau de rayons X subit peu d’atténuation et l’image est transparente. L’exemple du centre illustre un objet où les photons sont absorbés de façon inégale par ses différents constituants. Il en résulte une image modulée ayant des propriétés diagnostiques. Dans l’exemple de droite, les photons sont presque tous absorbés par l’objet. Le faisceau de rayons X est fortement atténué de façon uniforme et l’image est opaque.
20
1.3.2 Nature du rayonnement et mesure de l’exposition à la radiation
L’exposition à la radiation dans un contexte médical touche à la fois les patients et le personnel médical. Le patient est directement exposé au faisceau de rayons X qui le traverse dans un axe postéro-antérieur à travers la table d’examen (Figure 1.10). L’exposition du patient résulte donc majoritairement du rayonnement primaire.
La majorité de l’exposition du personnel médical et une fraction moindre de l’exposition du patient résultent quant à elles du rayonnement secondaire. Ce dernier provient d’une exposition indirecte aux rayons via un phénomène physique nommé diffusion Compton (Compton scattering) (30). Par ce phénomène, les photons de haute énergie composant un faisceau de rayons X sont déviés de leur trajectoire initiale lorsqu’ils rencontrent un électron en adoptant un angle θ par rapport à celle-ci. En pratique, les rayons sont réfléchis sur la table et le patient, puis parviennent au personnel médical (Figures 1.10 et 1.11). On estime qu’entre 25% et 40% de la dose est ainsi réfléchie (backscatter factor) (31). La dose diffusée est proportionnelle à l’intensité du faisceau principal et au produit dose-surface, qui est un estimé de la dose totale du patient (28). En raison de principes physiques, l’énergie des rayons X diffusés diminue selon l’inverse du carré de la distance parcourue par ceux-ci (Figure 1.11). La dose du personnel médical est mesurée à l’aide de dosimètres individuels qui sont identifiés afin de permettre un suivi cumulatif personnalisé des doses. La Commission internationale sur la radioprotection (ICRP) recommande le port de deux dosimètres, soit un sur l’épaule gauche ou au niveau thyroïdien sur le collier cervical plombé, et un sous le tablier plombé au niveau thoracique (32). Au Canada, leur calibration et la collecte des données qu’ils contiennent sont régis par Santé Canada afin d’assurer que les doses limites annuelles de référence ne soient pas dépassées (33).
L’exposition à la radiation est estimée de façon directe ou indirecte à l’aide de différentes mesures (cf. Glossaire). Parmi les mesures directes de l’exposition à la radiation, le produit dose-surface (dose-area product, DAP; ou kerma-area product, KAP) est la principale mesure employée dans la littérature (34). Il s’agit d’une estimation globale de la dose de radiation absorbée par le patient. Elle a l’avantage d’être mesurée directement à la sortie du tube
21
radiogène, ce qui la rend facile à utiliser en pratique. Le DAP peut également être utilisé pour estimer le risque de cancer attribuable à une exposition aux rayons X (28, 35). Le kerma de l’air, quant à lui, estime la dose de rayonnement primaire et est équivalent à la somme de l’énergie cinétique des photons en un endroit précis, le point de référence interventionnel (interventional reference point, IRP). Ce dernier est situé par convention à 15 cm de l’organe étudié, ce qui correspond approximativement à la dose à la peau.
En plus des mesures directes de l’exposition à la radiation exposées ci-haut, il existe quelques mesures indirectes, dont le temps de fluoroscopie. Il s’agit du temps d’utilisation du mode fluoroscopique d’acquisition d’images. Certains auteurs estiment que le temps de fluoroscopie corrèle bien avec le produit dose-surface et la dose du patient (21, 36, 37), alors que d’autres prétendent le contraire (28, 38). Quoiqu’il en soit, le temps de fluoroscopie demeure la principale mesure indirecte de l’exposition à la radiation employée dans la littérature, entre autres parce qu’il est facile à obtenir. Or, on estime que le temps de fluoroscopie ne contribue qu’à environ 40% de la dose générée par une coronarographie et à environ 55% de la dose générée par une angioplastie, en moyenne (39). En effet, le reste de la dose provient de l’utilisation du mode cinéangiographique d’acquisition d’image (mode ciné). Si la fluoroscopie offre une résolution suffisante pour les phases d’approche d’une procédure, c’est en mode ciné que sont réalisées les acquisitions finales à haute résolution destinées à l’interprétation diagnostique et à l’archivage. Afin d’améliorer la précision et la définition du film radiologique, la dose par image, ou dose pulsée, est accrue de 10 à 15 fois en mode ciné comparativement au mode fluoroscopique, et ce indépendamment de la cadence d’images, qui demeure habituellement à 15 images par seconde (IPS). Ainsi, une seule image obtenue en mode ciné est équivalente à une seconde de fluoroscopie (cadence d’images fixée à 15 IPS); de façon analogue, une minute de ciné équivaut à 10 à 20 minutes de fluoroscopie (22, 28, 40).
Bref, le temps d’utilisation et le nombre d’images réalisées en mode ciné sont des mesures plus représentatives de l’exposition totale à la radiation; elles demeurent néanmoins peu employées dans la littérature comparativement au temps de fluoroscopie. Enfin, lorsque des mesures directes de l’exposition sont disponibles (p.ex. DAP), plusieurs auteurs recommandent leur utilisation par rapport aux mesures indirectes (21, 38).
22
Figure 1.10 Installation d’un laboratoire d’hémodynamie
Un patient est couché sur la table d’examen. L’appareil radiologique est déployé autour du patient. La source émettrice de rayons X (A) est située sous le patient et la majorité des rayons suivent un trajet plus ou moins parallèle à la flèche rouge jusqu’au récepteur (B). Le récepteur convertit les rayons X en signal digital qui constitue une image, puis la relaie jusqu’aux écrans. Un panneau amovible plombé (C) est disposé entre la source et le personnel médical dans le but de diminuer les risques attribuables à la diffusion des rayons X (flèche jaune). Or, certains rayons ne sont pas bloqués et sont réfléchis sur la table d’examen ou sur le patient (flèche verte) et contribuent à l’exposition du personnel médical (rayonnement secondaire). La distance D correspond à la distance foyer-peau, qu’on cherche à maximiser. La distance E correspond à la distance détecteur-patient, qui doit à l’inverse être la plus petite possible.