N° 2686
T
HESE DE DOCTORAT
Présentée par
:
M. Hugo Ronald RAMANANARIVO
Discipline : Chimie
Spécialité : Sciences des matériaux, Physico-chimie des nanomatériaux
« Elaboration par éco-design des nanomatériaux: Cas de l’oxyde
de cérium et de l’oxyde de zirconium »
Soutenue le : 15/11/2013
Devant le jury:
Président :
M. El Mokhtar ESSASSI Professeur à la Faculté des Sciences, Agdal de Rabat
Examinateurs:
M. Ahmed BOUHAOUSS Professeur à la Faculté des Sciences, Agdal de Rabat
M Abdelaziz. EL JAZOULI Professeur à la Faculté des Sciences Ben M’Sick, Casablanca M. Christophe LEN Professeur à l’Université de Technologie de Compiègne, France M. Abdelatif BARAKAT Docteur - Chargé de recherche à l’INRA-Montpellier, France Mme. Karima ABDELOUHDI Professeur - Chef de service au CNRST, Rabat
M. Aziz FIHRI Docteur - Chargé de Recherche à la Fondation MASCIR, Rabat M. Abderrahim SOLHY Docteur - Chef de Projet à la Fondation MASCIR, Rabat
Université Mohammed V–AGDAL
Faculté des Sciences
Dédicace
A mon frère RAMANANARIVO Asman Gerard Janvion, décédé le 09 Octobre 2013 à Vohipeno :
« Je sais que tu ne verras jamais cette dédicace mon très cher frère, mais je veux que tout le monde sache qu’à quel point tu étais un model d’amour et de devoir envers tes frères et tes sœurs. Je n’arriverais jamais à ce stade sans toi et tu étais toujours fier de mes exploits dans le passé mais tu n’as pas pu attendre cette fois-ci. Je remercie DIEU de m’avoir donné un frère comme toi »
A ma famille :
A ma Mère : RASOAMALALA Josephine
A mon Père : RAMANANARIVO Bernard
A mes deux Sœurs : RAMANANARIVO Venus et RAMANANARIVO Divine
A mes trois Frères : Dr RAMANANARIVO Hector Gonzales, RAMANANARIVO Giscard Benzer, RAMANANARIVO Michael Rodriguez ;
A mes Nieces et mes Neveux.
« Je vous adresse mes sincères remerciements pour votre amour, je n’oublierai jamais tout ce que vous avez fait pour moi »
« J’ai vu plus loin que les autres parce je me suis juché sur les epaules de géants »
Isaac NEWTON
Conseil d’un père à son fils :
-Tu défendras trois choses : L’honneur, le Foyer et la Patrie
-Tu estimeras trois choses : Le courage, La Reconnaissance et La Sincérité -Tu éviteras trois choses : La Paresse, La Honte et La Vanité
-Tu contrôleras trois choses : Le Caractère, La Conduite et Le Langage -Tu détesteras trois choses : Le Vol, L’Injustice et L’Ingratitude
-Tu combattras trois choses : Le Mensonge, La Méchanceté et La Lâcheté -Tu sauvegarderas trois choses : La Franchise, La Liberté et La Bravoure Parole sage
« The idea is to try to give all the information to help others to judge the value of your contribution; not just the information that leads to judgment in one particular direction or another»
Avant propos
Les travaux de cette thèse ont été réalisés dans le cadre de la convention liant l’Université Mohammed V-Agdal de Rabat et la Fondation MAScIR. Lesdits travaux ont été effectués sous la direction scientifique de Monsieur le Professeur El Mokhtar ESSASSI et Monsieur le Docteur Abderrahim SOLHY.
Je tiens à remercier Monsieur El Mokhtar ESSASSI, Professeur à l’université Mohammed V-Agdal de Rabat, pour avoir accepté de m’inscrire avec lui à la prestigieuse Université Mohamed V-Agdal. C’est aussi un grand honneur qu’il m’a fait en acceptant de présider le jury de cette thèse.
Je tiens à remercier vivement Docteur Abderrahim SOLHY, Project leader à la Fondation MAScIR non seulement pour avoir dirigé cette thèse, mais surtout pour son accompagnement, sa rigueur scientifique, sa disponibilité et l’attention dont il a fait preuve à mon égard tout au long de ces travaux.
Je remercie Monsieur Ahmed BOUHAOUS, Professeur à l’université Mohammed V-Agdal de Rabat, pour l’intérêt qu’il a porté à ce travail en acceptant de participer au jury en tant que rapporteur.
J’adresse également mes sincères remerciements à Monsieur Abdelaziz EL JAZOULI, Professeur à la Faculté des Sciences Ben M’Scik, Casablanca, pour le jugement du présent travail ainsi que sa participation au jury de cette thèse.
Je suis honoré que Monsieur Christophe LEN, Professeur à l’Université de Technologie de Compiègne en France ait accepté d’être membre du jury de ce travail. Qu’il trouve ici l’expression de ma respectueuse gratitude.
Je tiens à remercie également Dr. Abdelatif BARAKAT, chargé de recherche à l’INRA de Montpellier en France, d’abord pour les biopolymères qui nous a fourni constamment et pour sa participation au jury de cette thèse.
Je tiens à remercier infiniment Madame Karima ABDELOUAHDI, Professeur - responsable de la plateforme Matériaux UATRS-CNRST, qui a suivi de près le travail de cette thèse. Je la remercie pour tous ses conseils scientifiques, son aide à la réalisation de nombreuses analyses et leurs interprétations ainsi que pour toute sa patience et les encouragements durant la rédaction du manuscrit.
Que Monsieur Aziz FIHRI, Docteur - Chargé de recherche à la Fondation MASCIR, trouvent ici l’expression de ma gratitude pour l’honneur qu’il m’a fait de participer en tant qu’examinateurs dans la soutenance de ce mémoire de thèse.
J'adresse mes remerciements également à l’ensemble des chercheurs de l’équipe VARENA de la Fondation MASCIR, pour leur gentillesse, le partage des connaissances scientifiques, la collaboration, l’esprit d’équipe et la joie de vivre rayonnant tout au long de ce travail.
J’aimerais remercier mon compatriote et collègue M. Heriarivelo RISITE qui a partagé avec moi la peine et la joie de mes quatre années de thèse.
Je voudrais remercier vivement tous mes collègues thèsards et amis de la fondation MAScIR : Dr Walid Amer, Dr Meriem Bricha, Houda Maâti, Otmane Amadine, Younes Essamlali, Hicham Abououalid, Karim Daânoun, Nassima El miri, Younes Belmamouni, Youness Brahmi, Amal Maadane, Khadija El Maalam, Meriem Benali, Saïf Ur-Rehman, Tarik Ajjammouri, Amine Bensaih, Yassine Mouhib, Yassine Redouany, Hind Grirat et Mounia Karim et Hamid Essabir.
Je remercie ensuite l’ensemble du staff technique et administratif de la Fondation MAScIR. Spécialement, je tiens à témoigner toute ma reconnaissance et mon respect aux ingénieurs et les techniciens de la plateforme pour leur engagement et leur aide afin de réaliser mes travaux de thèse.
Enfin, je ne saurais terminer cette liste sans adresser un remerciement particulier à ceux qui m’ont soutenu dans l’ombre, mes parents, mes soeurs et mes frères, sans qui ce travail n’aurait jamais pu voir le jour. Je leur dédie ce travail en témoignage de ma profonde reconnaissance pour toute la patience et les sacrifices qu’ils ont consentis pour moi et dont je leur serai à jamais redevable. D’avoir porté ce travail à terme représente pour moi aujourd’hui la plus belle des récompenses. Que tous ceux qui m’ont aidé de près ou de loin dans l’élaboration de ce travail trouvent ici l’expression de ma sincère gratitude.
Liste des abbreviations
ATG Analyse thermogravimétrique
DRX Diffraction des rayons X
MEB Microscope électronique à balayage
EDAX Analyse semi-qualitative par spectrométrie à
dispersion d'énergie
HR Haute Résolution
MET Microscopie Electronique en Transmission
IR-TF Infrarouge à Transformé de Fourier
BET Théorie Brunauer, Emett et Teller
BJH Méthode Barrett, Joyner et Halenda
XPS Spectroscopie de Photoelectron-X
UIPAC International Union of Pure and Applied
Chemistry nm Nanométre µm Micromètre P/P0 Pression Relative CMC Carboxymethylcellulose Alg Alginate CO2SCC CO2 Superctitique
MCM@Ce Xérogels et aérogels à base de
carboxymethylcellulose et le cérium
Alg@Zr Xérogels et aérogels à base d’alginate et le
zirconium
CeO2 Oxyde de Cérium
ZrO2 Oxyde de Zirconium
t-ZrO2 ZrO2 de phase tétragonal
m-ZrO2 ZrO2 de phase monoclinique
JCPDS Joint Committee on Powder Diffraction
SOMMAIRE
INTRODUCTION GENERALE ... 1
CHAPITRE I :ETAT DE L’ART SUR LES OXYDES DE CERIUM ET ZIRCONIUM NANO-STRUCTURES... 7
Introduction... 7
I- Etat de l’art sur l’oxyde de cérium nanostructuré ... 7
I-1. Les techniques de synthèse de CeO2... 8
1.1. Sol-gel ... 8
I-1.2. Précipitation... 9
I-1.3 Synthèse hydrothermale et solvothermale ... 11
I-1.4 Synthèse assistée par micro-onde ... 12
I-1.5 Microémulsions ... 13
I-1.6 Nouvelles techniques ... 15
I-2. Caractérisation de CeO2... 16
I-2.1. Phase cristalline ... 16
I-2.2. Défauts de structure et lacunes ... 18
I-2.3. Morphologies et textures ... 20
I-2.3.1. Morphologies ... 20
I-2.3.2. Textures ... 21
I-3. Propriétés et applications... 23
I-3-1 Propriétés des oxydes de cérium ... 23
I-3-2 Applications potentielles ... 24
I-3.2.1 Filtres UV ... 24
I-3.2.2 Dispositif de Capteurs... 24
I-3.2. 3. Catalyse ... 25
I-3.4 Autres propriétés et applications intéressantes ... 26
II- Etat de l’art sur l’oxyde de zirconium nanostructuré... 27
II-1. Les techniques de synthèse de ZrO2... 27
II-1.1. Sol-gel ... 27
II-1.2. Précipitation ... 29
II-1.3. Synthèse solvothermale ... 30
II-1.4. Synthèse assistée par micro-onde ... 32
II-1.5. Microémulsions... 33
II-1.6. Autres techniques ... 33
II-2. Caractérisation de ZrO2... 34
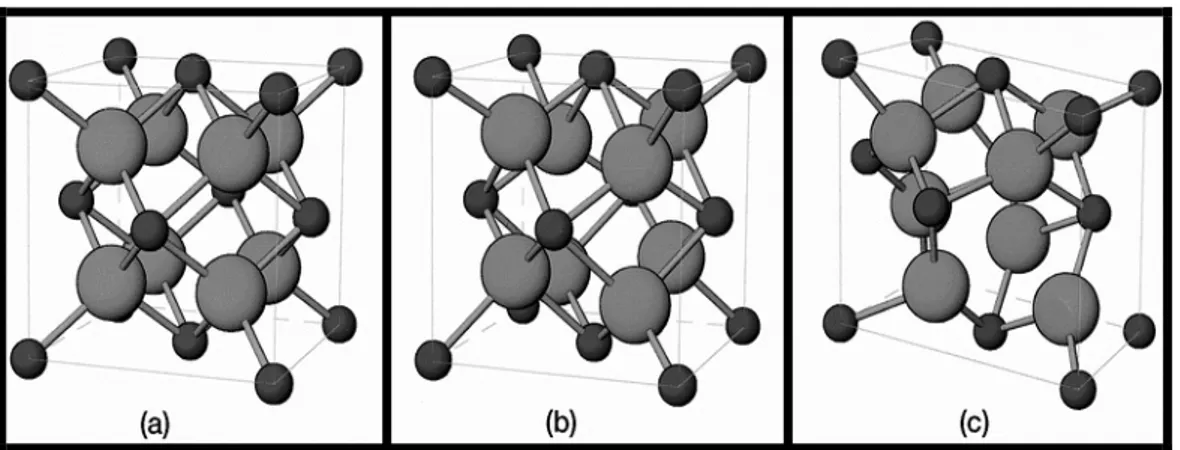
II-2.1. Structure cristalline ... 34
II-2.1. 1. Structure tétragonale... 35
II-2.1. 2. Structure monoclinique... 35
II-2.1. 3. Structure Cubique... 36
II-2.1. 4. Calcul de pourcentage de phase tétragonale et monoclinique... 37
II-2.1. 5. Transformation et stabilisation des phases... 38
II-2.2. Morphologie et texture ... 39
II-2.2.1. Morphologie ... 39
II-2.2.2. Texture ... 40
II-3. Propriétés et applications ... 41
II-3.1 Propriétés ... 41
II-3.1.1 Acidité et basicité ... 41
II-3.1.2 Propriété optique : luminescence... 42
II-3.1.3 Fonctionnalisation de l’oxyde de zirconium... 42
II-3.1.4. Autres propriétés ... 43
II-3.2 Applications potentielles ... 43
II-3.2 .1 Catalyse hétérogène... 43
II-3.2 .2 Support de catalyseurs ... 44
II-3.2 .3 Capteurs... 45
II-3.2 .4 Autres ... 45
III- Etat de l’art sur les biopolymères : Carboxyméthylcellulose et Alginate ... 46
III -2. Carboxyméthylcellulose ... 46
III -2.1. Structure... 46
III -2-2 Propriétés... 48
III -2-3 Application potentielles ... 49
III -3 Alginate ... 50
III -3-1 Structure ... 50
III -3-2 Propriétés... 51
III -3-3 Applications potentielles... 54
Conclusions ... 54
CHAPITRE II :ELABORATION PAR ECO-DESIGN DE LA MOUSSE D’OXYDE DE CERIUM VIA LA GELIFICATION DE CARBOXYMETHYLCELLULOSE... 56
Introduction... 56
I- Préparation de la mousse de CeO2 via la gélification de carboxymethylcellulose... 56
I-1. Préparation de l’oxyde de cérium ... 56
I-1.1. Protocole expérimental ... 56
I-1.2. Gélification du carboxymethylcellulose par le cation Ce4+... 57
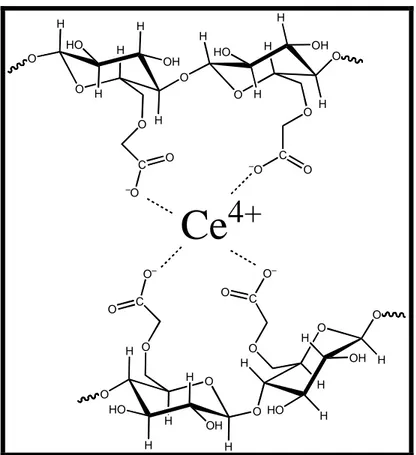
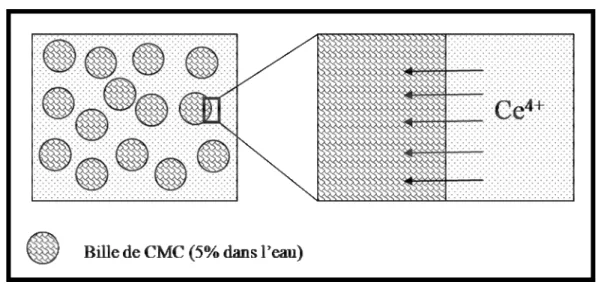
I-1.2.1 Mécanisme de la gélification ... 57
I-1-2-2 Effet de la concentration du gélifiant sur le processus de gélification... 58
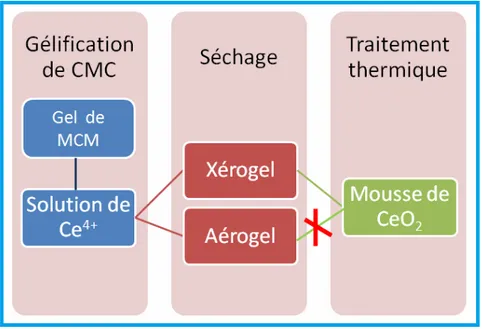
I-1-3 Gel de carboxyméthylcellulose-Ce : hydrogel, xérogel et aérogel ... 60
I-1.3.1 Hydrogel ... 60
I-1.3.2 Xérogel ... 61
I-1.3.3 Aérogel ... 63
I-1.4. Traitement thermique des gels ... 64
I-1.5. Schéma de principe de fabrication de la mousse d’oxyde de cérium ... 65
II- Résultats et Caractérisation physico-chimique des échantillons de CeO2... 66
II-1. Analyse par spectroscopie d’absorption d’infrarouge à transformé de Fourier ... 66
II-2. Analyse thermogravimétrique ... 68
II-3. Analyse par diffraction des rayons X ... 69
II-4. Analyse morphologique par microscope électronique à balayage... 76
II-4.1. Analyse du Xérogel ... 77
II-4.2 Analyse de l’aérogel ... 78
II-4.3. Analyse des mousses d’oxyde de cérium ... 78
II-4.3.1. Effet de la concentration de Ce4+ sur les échantillons calcinés à 500°C ... 78
II-4.3.2. Effet de la température de calcination sur la texture des échantillons préparés à 0,1 M de Ce4+ et séchés à température ambiante ... 82
II-4.4. Analyse de l’oxyde de cérium préparé par la calcination à 500 °C des échantillons CMC@Ce_x (x = 0,1 ; 0,2 ; 0,3) ... 84
II-5. Analyse par microscope électronique en transmission ... 85
II-5.1. Analyse de la mousse d’oxyde de cérium... 85
II-5.1.1. Effet de la concentration du précurseur de Ce4+ sur la morphologie de la mousse : ... 85
II-5.1.2. Effet de la température de calcination sur la morphologie des échantillons M_CeO2_0,1 ... 87
II-5.2. Analyse de l’oxyde de cérium préparé par calcination de l’aérogel à 500 °C ... 89
II-5.2.1. Effet de la concentration du précurseur de Ce4+ sur la morphologie... 89
II-6. Analyse structurale par la microscopie électronique en transmission haute résolution ... 90
II-7. Analyse semi-quantitative l’EDAX... 92
II-8. Analyse structurale par la diffraction électronique... 93
II-9. Caractérisation par spectroscopie de photoélectrons-X (XPS) ... 94
II-10. Caractérisation par spectroscopie UV-Visible... 98
II-11. Etude de la texture... 101
II-11.1. Surfaces spécifiques ... 101
II-11.2. Isotherme d’adsorption et de désorption d’azote ... 102
II-11.3. La courbe BJH (Barret-Joyner-Halenda) ... 103
III- Synthèse et discussions... 104
III-1. Mécanisme de la formation de la mousse ... 104
III-2. Stabilité thermique de la mousse : hypothèse de maturation d’Oswald ... 109
CHAPITRE III :ELABORATION PAR ECO-DESIGN ET CARACTERISATION DE L’OXYDE DE ZIRCONIUM
NANOSTRUCTURE CRISTALLOGRAPHIQUEMENT PUR... 112
Introduction... 112
I- Elaboration par éco-design de ZrO2 via la gélification de l’alginate ... 112
I-1. Protocole expérimental ... 112
I-.2 Gélification de l’alginate par le cation Zr4+... 113
I-2.1. Mécanisme de la gélification ... 113
I-2.2. Effet de la concentration d’agent réticulant sur le processus de gélification... 114
I-3. Hydrogel, xérogel : Alg@Zr... 115
I-3.1. Hydrogel ... 115
I-3.2. Xérogel ... 115
I-4. Traitement thermique des xérogels... 116
II - Caractérisation physico-chimique... 117
II-1. Analyse par spectroscopie d’absorption d’infrarouge à transformé de Fourier des xérogels ... 117
II-2. Analyse thermogravimétrique ... 119
II-3. Analyse par DRX ... 120
II-4. Analyse morphologique par le MEB... 123
III-4.1 Analyse des Xérogels... 123
III-.4.2. Analyse de poudre d’oxyde de zirconium ... 124
II-5. Analyse par le MET ... 125
II-6. Etude de la texture... 127
II-6.1 Surfaces spécifiques ... 127
II-6.2. Isotherme d’adsorption/désorption d’azote ... 128
II-6.3. Distribution poreuse estimée par le model BJH ... 129
III-Synthèse et discussions... 130
III-1. Selectivité de la phase tetragonale : Effet de taille... 130
III-2. Similarité de la strucutre tetragonal et cubique : détermination de la structure exacte des trois échantillons : ZrO2_0,1, ZrO2_0,2, et ZrO2_0,3 ... 131
Conclusion... 132
CHAPITRE IVSYNTHESE D’OXYDE DE ZIRCONIUM MESOPOREUX NANOSTRUCTURE VIA UN PROCEDE EN DUPLEX :SOL-GEL SUIVI D’UN TRAITEMENT SOLVO-HYDROTHERMAL ASSISTE PAR MICRO-ONDE... 133
Introduction... 133
I- Préparation de l’oxyde de zirconium mésoporeux nanostructuré ... 133
I-1. Protocole expérimental ... 133
I-2. Mécanisme général de la réaction... 135
II- Caractérisation physico-chimique des échantillons de l’oxyde de zirconium ... 136
II-1. Analyse par IR ... 136
II-2. Analyse thermogravimétrique ... 138
II-3. Analyse par DRX ... 139
II-4. Etude de la texture par adsorption/désorption d’azote... 142
II-4.1. Variation de la surface spécifique en fonction du ratio de solvants... 144
II-4.2. Variation du volume de pore en fonction du ratio de solvants ... 145
II-4.3. Effet de ratio de solvants sur la surface spécifique et le volume total de pore... 146
II-4.4. Courbes d’isotherme d’adsorption/désorption des échantillons non-calcinés... 148
II-4.5. Isotherme d’adsorption/désorption des échantillons calcinés ... 150
II-4.6. Distribution de tailles de pores ... 152
II-4.7. Diffractions des rayons-X à bas angle ... 153
II-5. Analyse par MET et diffraction électronique ... 153
II-6. Analyse par la microscopie électronique à haute résolution... 156
II-7. Analyse par XPS ... 157
Conclusion... 158
CHAPITRE V :PARTIE EXPERIMENTALE... 160
I- Réactifs et techniques d’analyses... 160
I-1. Réactifs... 160
II- Appareillages utilisés pour l’élaboration des matériaux Réactifs... 161
II-2. Centrifugeuse ... 161
III-Techniques d’analyses ... 161
III-1. Analyse par spectroscopie infrarouge à transformée de Fourrier en mode ATR (Attenuated Total Reflexion) ... 161
III-2. Diffraction des rayons-X ... 162
III-3. Analyse thermogravimétrique... 162
III-4. Microscope électronique à balayage ... 162
III-5. Microscope électronique en transmission et diffraction électronique ... 163
III-6. Microscope électronique en transmission à haute-résolution... 163
III-7. Spectroscopie UV-visible ... 164
III-8. Photoluminescence et absorbance... 164
III-9. Adsorption/désorption de l’azote ... 164
IV- Elaboration des matériaux ... 165
IV-1 Synthèse de la mousse d’oxyde de cérium ... 165
IV-2. Synthèse de l’oxyde de zirconium via la gélification d’alginate... 165
IV-3. Elaboration de l’oxyde de zirconium par un procédé en duplex assisté par microondes ... 166
CONCLUSION GENERALE ET PERSPECTIVES ... 167
INTRODUCTION GENERALE
Depuis le discours fondateur de Richard Feynman en 1959 qui s’intitule « There is plenty of room at the bottom » au California Institute of Technology (CALTECH) en passant par l’invention du premier microscope à effet tunnel par Gerd Bining et al. [1] puis le pessimisme d’Eric Drexler sur son roman « Engine of creation » [2] ainsi que la découverte d’autres variétés allotropiques du carbone, la nanotechnologie a pris beaucoup d’ampleur surtout après la décision de nombreux Gouvernements des pays industrialisés d’engager des financements pour la recherche en nanoscience et nanotechnologie [3]. Toutes les disciplines comme la physique, la chimie, les sciences de matériaux ainsi que la médecine convergent et adaptent leur savoir-faire pour mieux développer cette nouvelle niche économiquement porteuse [4].
D’une manière générale, la nanotechnologie diffère des autres technologies par l’échelle où nous manipulons la matière. A cette échelle, les matériaux se comportent différemment due à deux effets majeurs nommés : effet de taille et effet quantique [5]. Cependant, la recherche sur l’élaboration des nanostructures ne se limite pas seulement à l’obtention de particules de petite taille mais aussi à leur distribution et leur dispersion uniforme ainsi que le parfait contrôle de leur morphologie, leurs structures, et leur texture poreuse. Un contrôle typique de la nucléation et de la croissance de ces nanostructures confère à ces dernières des propriétés extraordinaires et ensuite une multitude d’applications dans des domaines de technologie de pointe.
L’obtention de nanostructures se fait donc par deux principales approches : « Bottom-Up » et/ou « Top-down » [6]. La première approche consiste à fabriquer des nanostructures par assemblage élément par élément ou molécule par molécule pour former la structure recherchée. Par contre la deuxième possibilité consiste à fragmenter les matériaux volumineux et massifs pour avoir de petites particules dont plusieurs méthodes ont été utilisées comme l’ultrason ou le broyage micromécanique. Néanmoins, la première manière de fabrication de nanostructures est la plus fructueuse et promettant, étant donné que cela permet de contrôler parfaitement la nucléation et la croissance, ce qui sera favorable pour avoir une distribution meilleure, une taille homogène, une morphologie et une porosité calibrées.
Le développement de plusieurs filières industrielles de cette ère exige une innovation permanente qui se base sur le concept « Technology push », lequel se profite des avancés scientifiques de la recherche académique. Ladite exigence du monde industriel pousse la recherche pour la conduite d’études sur des nouveaux matériaux nanostructurés. Parmi ceux-ci, les oxydes poreux nanostructurés qui forment une classe de matériaux potentiellement intéressants, particulièrement grâce à un large panel d’étonnantes propriétés physiques. Dans ce cadre, l’oxyde de cérium et l’oxyde de zirconium nanostructurés et mésoporeux sont des matériaux de choix aux propriétés physiques remarquables : catalytique, électrique, optique, thermique, etc. Certaines applications industrielles de ces oxydes commencent déjà à apparaître dans le domaine de traitement des gaz de moteurs diesel. Ils peuvent être utilisés aussi dans le domaine d’énergie (pile à combustible), et il pourrait aussi servir, dans le cas d’oxyde de zirconium, comme matériaux d’implants dentaires et prothèses dentaires. Autre aspect novateur dans ce genre de matériaux est de les préparer sous forme de mousse qui a l'avantage d’avoir une surface active élevée et une faible contre-pression. L’obtention des oxydes métalliques ou des métaux sous forme de mousse a commencé à être étudiée ces dernières années.
D’autre part, l’éco-design se présente comme une approche globale de conception qui consiste à réduire les impacts environnementaux. Ce concept peut être défini comme une solution durable qui implique de trouver un équilibre parfait entre les exigences écologiques dans le développement des produits. Il s’agit de prendre en compte l’ensemble des étapes du cycle de vie des matériaux, produits ou procédés, de leur fabrication à leur utilisation. C’est une démarche vaste qui exige une nouvelle façon de concevoir en intégrant les principes de la chimie verte et du développement durable. La communauté scientifique de la chimie des matériaux quant à elle, a intégré aussi ce concept dans son endogène afin d’élaborer des matériaux par bio-inspiration, par exemple, via l’utilisation des produits naturels comme agents structurants ou porogènes. Plusieurs produits naturels sont ainsi exploités comme les biopolymères, les polysaccharides, les protéines,… etc. En adoptant une démarche d’éco-design, les chimistes de matériaux et nanomatériaux peuvent ensuite élaborer des matériaux plus respectueux de l’environnement en préservant les objectifs de la chimie verte puisqu’ils essayent d’abandonner progressivement l’utilisation des agents issus de la pétrochimie. L’éco-design intègre, entre autre, les considérations de fonctionnalités et de performances des matériaux préparés en contrôlant leur nucléation et leur croissance.
Le procédé sol-gel est un procédé de minéralisation de matériaux à partir de précurseurs en solution (de préférence des composés organométalliques). Il permet de préparer des céramiques, des verres, des matériaux hybrides organique/inorganique, et des nanoparticules d’oxydes métalliques. C’est le procédé exemplaire pour l’élaboration de matériaux poreux. Il s’effectue dans des conditions dites de chimie douce, à des températures nettement plus basses que celles des voies classiques de synthèse. Sauf qu’il a certaines limites qui freinent l’élargissement de son transfert à l’échelle industrielle pour la production massive de produits à forte valeur ajoutée. Les principaux obstacles sont : i) le coût élevé des précurseurs à base d’alcoxydes, et ii) la maîtrise délicate du procédé et du temps de processus souvent très longs.
D’un autre côté, le procédé hydrothermal est une technique tout à fait mature pour la croissance de matériaux cristallins. Le procédé hydrothermal est le terme générique utilisé pour décrire une réaction entre un ou plusieurs précurseurs en présence d’eau, ou solvant organique, ou un mélange eau/solvant organique (eau : hydrothermal, solvant organique : solvothermal, mélange eau/solvant organique : solvohydrothermal), dans un milieu confiné à une température plus élevée que la température d’ébullition et avec la pression autogène supérieure que celle de la pression ambiante. Ceci pourrait rendre le milieu en conditions sous-critiques ou supercritiques, suivant la pression et la température. Ledit procédé permet à travers l’effet de condensation et de l’accroissement de la réactivité, en fonction de la valeur de pression et de température, la création de liaisons chimiques et la formation des germes conduisant à la synthèse de matériaux originaux. Notons que la pression élevée permet la mise en forme de matériaux sous forme de micro ou nano-cristallites de taille, de morphologie et de porosité contrôlées, puisqu’il servit à la modulation des interactions solide/solvant, en particulier la solubilité, et conduit ainsi à la maîtrise de processus : nucléation-croissance. Cette technique est utilisée souvent après la synthèse des matériaux avec les procédés habituels tels que : la co-précipitation ou sol-gel. Dans le cas de sol-gel, il est justement utilisé pour relever les problèmes rencontrés lors de la synthèse des matériaux par ce procédé surtout la durée qui peut aller à quelques jours.
L’élaboration des matériaux par le procédé hydrothermal assisté par micro-ondes « monomodes » constitue cependant une technique aisée qui donne lieu à des matériaux parfaitement cristallins avec un rendement accru et surtout homogène en matière de taille, de porosité et de morphologie. L’activation par micro-ondes dans la chimie des matériaux a
connu un regain d’intérêt vue les progrès atteignent. Ladite activation résulte de deux contributions : i) la première d’origine purement thermique résultant de l’agitation moléculaire causée par l’inversion des dipôles avec les alternances du champ électrique, et ii) la deuxième d’origine électrostatique résultant d’interactions de type dipôles-dipôles entre les molécules polaires et le champ électrique. Ce qui a donc un effet direct sur la cinétique par la diminution de l’énergie d’activation.
C’est dans ce contexte que rentrent les travaux de recherche menés dans le cadre de cette thèse de doctorat et qui s’inscrivent dans la stratégie scientifique de la Fondation MASCIR à développer le champ de la nanotechnologie. Plus particulièrement, ces travaux portent sur une approche d’élaboration des oxydes par éco-design basée sur l’utilisation des polysaccharides comme agents structurants. Dans cette logique, nous avons préparé la mousse d’oxyde de cérium et l’oxyde de zirconium cristallographiquement pur avec une porosité parfaitement calibrée, en utilisant, bien évidemment, le carboxyméthylcellulose et l’alginate entant qu’agents porogènes. D’autre part, nous avons développé une autre technique de synthèse d’oxyde de zirconium en exploitant les avantages à la fois des procédés : sol-gel, solvohydrothermal et l’activation par micro-ondes. Ce procédé duplex a permis d’avoir un oxyde mésoporeux et nanostructuré.
Le présent manuscrit visant à répondre à la problématique de développement des méthodes innovatrices d’élaboration de nanomatériaux mésoporeux est composé de cinq chapitres. Ce manuscrit débute ainsi par un chapitre bibliographique, dressant le contexte général de notre recherche, et puis illustrant les techniques de synthèse de l’oxyde de cérium ainsi que d’oxyde de zirconium et leurs principaux domaines d’utilisation. Nous présenterons ainsi les enjeux du contrôle de la porosité de susdits oxydes et la notion d’éco-design. Cela nous amènera à présenter les différents biopolymères utilisés comme agents porogènes et les démarches d’éco-design proposés dans la littérature. A la suite de ce chapitre introductif, nous présenterons dans le deuxième chapitre la mise au point d’un protocole expérimental visant l’élaboration de la mousse d’oxyde de cérium. Ce chapitre reporte également la caractérisation physico-chimique de la mousse obtenue. Dans le troisième chapitre, nous présenterons l’élaboration et la caractérisation de l’oxyde de zirconium obtenu par la méthode dite : gélification d’alginate. Dans le quatrième chapitre, un procédé de synthèse d’oxyde de zirconium par un procédé en duplex : sol-gel, solvohydrothermal et l’assistance par micro-ondes, sera présenté avec une caractérisation systématique. Dans le dernier chapitre nous
cette étude. Dans la conclusion, nous dressons un bilan des principaux résultats obtenus, ainsi que des perspectives qui permettraient d’approfondir cet étude dans le but d’élaborer d’autres nanomatériaux et envisager ensuite des éventuelles applications desdits nanomatériaux notamment dans le domaine de la catalyse ou la photo-catalyse.
Chapitre I : Etat de l’art sur les oxydes de cérium et
zirconium nano-structurés
Introduction
Le présent état de l’art a pour objet de rapporter l’état de la connaissance dans le domaine d’oxydes nanostructurés de zirconium et de cérium ainsi que de biopolymères d’alginate et de carboxymethylcellulose. Il est bien de noter que l’auteur de ce document n’insiste pas sur l’exhaustivité de cet état de l’art.
Les techniques de synthèse sont mises en exergue dans cet état de l’art pour les cas de l’oxyde de cérium et de zirconium car c’est le principal objet de cette thèse en plus des études de propriétés des matériaux et les applications pour mieux situer cette contribution vis-à-vis de la littérature. Quand aux alginate et carboxymethycellulose, les structures et les propriétés ainsi que les applications potentielles sont objets de synthèse bibliographique.
I- Etat de l’art sur l’oxyde de cérium nanostructuré
Selon la nomenclature de l’International Union of Pure and Applied Chemistry (IUPAC), les termes terres rares regroupent 17 éléments de la classification périodique des éléments, particulièrement les 15 éléments du groupe lanthanide plus le scandium et l’Yttrium. Parmi les éléments lus plus importants de la famille des terres rares, on trouve le cérium qu’est le plus abondant dont 66.5 ppm de la croute terrestre, soit supérieur au cuivre et l’étain. La configuration électronique du cérium est de : [Xe]4f26s2 et de deux valences dont la Ce(III) et le Ce(IV). Avec cette abondance, l’oxyde de cérium (CeO2) est un matériau d’importance
majeur du point de vue technologique due au large spectre d’applications. Plusieurs techniques de synthèse ont été rapportées pour la préparation de l’oxyde de cérium comme le sol-gel, la précipitation, la synthèse par voie hydrothermale/solvothermale, les microémulsions, la synthèse par chauffage par microonde ainsi que d’autres techniques attrayantes [7-12]. La structure de l’oxyde de cérium est de type fluorite et la présence des défauts dans la structure conjuguée à la présence de Ce3+ confère à l’oxyde de cérium des propriétés intéressantes [13-17]. La morphologie et la texture du materiau syntetisé sont des caracteristiques très importantes et pour le cas de l’oxyde de cérium, des morpholgies et
textures diverises ont été rapportées. Beaucoup de propriétés de l’oxyde de cerium découlent de ses textures et ses structures. Cependant, l’oxyde de cerium est largment utilisé dans plusieurs domaines notamment dans le domaine de la catalyse (support, catalyseur, photocatalyseur), en tant que dispositif pour barrière d’ultraviolet, comme capteur ainsi qu’autres applications potentielles [18-20].
I-1. Les techniques de synthèse de CeO2
1.1. Sol-gel
La réaction sol-gel est caractérisée par la conversion de précurseur en solution à un solide par polymérisation inorganique [21,22]. En général, le procédé sol-gel consiste aux étapes suivantes : i) préparation d’une solution homogène par dissolution des précurseurs, ii) conversion de cette solution homogène en sol par traitement avec des réactifs chimiques (en présence d’un catalyseur acide ou base), iii) formation et vieillissement d’un gel (qui n’est autre qu’un réseau infini), et enfin iv) traitement thermique. La première étape de la réaction sol-gel, susmentionnée, est la formation de polymère inorganique par hydrolyse et condensation, c'est-à-dire une transformation de précurseur en solide enchevêtré et fortement interconnecté.
La technique de synthèse par voie sol-gel est polyvalente pour préparer des matériaux solides cristallins sans recours à des techniques difficiles à mettre en œuvre et qui consomme beaucoup d’énergie. Les précurseurs peuvent être des sels métalliques (nitrate, chlorure, sulfate, acétate ainsi que acetylacetonate) ou des alcoxydes. Les précurseurs à base d’alcoxydes sont largement utilisés pour la synthèse par voie sol-gel, sauf que leurs disponibilités limitent leur utilisation afin de synthétiser le CeO2 [23]. En effet, pour la
réaction en phase aqueuse utilisant de sel de cérium (nitrate par exemple), le contrôle de la réaction s’avère compliquée et aussi les deux états d’oxydation III et IV du cérium sont quasi-coexistants [24].
Dans ce contexte, Ksapabutr et al. ont pu synthétiser l’oxyde de cérium par voie sol-gel [25]. Le précurseur utilisé était le glycolate de cérium qui a été préalablement préparé par mélange
chauffage à température d’ébullition de l’éthylène glycol sous atmosphère inerte. Cette technique est une manière de contourner les problèmes de disponibilité de précurseur à base d’alcoxyde de cérium.
Ansari et al. ont rapportés la synthèse de l’oxyde de cérium en utilisant de l’ammonium cérium (IV) nitrate comme précurseur [26]. Le passage par l’hydroxyde de cérium comme le précédent mode opératoire est nécessaire quand on utilise un précurseur à base de sel métallique qui est obtenue par réaction avec l’hydroxyde d’ammonium moins concentrée. L’acide nitrique relativement concentré a été ajouté à l’hydroxyde pour avoir une solution de pH qui est égal à 1 à une température de 60 °C. Le sol a été porté à une température de synthèse pour obtenir l’oxyde de cérium.
La synthèse par voie sol-gel de l’oxyde de cérium est très limité et loin d’être la meilleure méthode pour préparer dudit oxyde à moindre coût avec un parfaite contrôle : de morphologie, de texture et d’autres exigences pour des applications spécifiques. Par contre cette méthode est une solution alternative pour une possible application en tant que matériaux céramiques grâce à la stabilité de sol à base de l’hydroxyde de cérium.
I-1.2. Précipitation
La réaction de précipitation est largement utilisée en synthèse des matériaux solides surtout les oxydes métalliques et les oxydes mixtes. La flexibilité et la facilité de mise en œuvre de cette technique de synthèse la confèrent une place de choix en vue d’une production industrielle d’oxydes métalliques [27]. Ce processus implique la nucléation, la croissance, l’épaississement ainsi que l’agglomération. Parmi les étapes susmentionnées, la nucléation s’avère la plus importante qui permet la formation des petites particules. C’est le phénomène de maturation d’Ostwald (Ostwald ripening) qui prend place après la nucléation résultant l’apparition des grosses particules affectant sans doute la taille, la morphologie ainsi que les propriétés texturales du matériau synthétisé. Du point de vue réactionnel, le processus de précipitation peut être acide ou basique. Ainsi, H. Zou et al. [28] ont réussi à synthétiser l’oxyde de cérium en milieu acide par précipitation utilisant deux précurseurs ayant différents degrés d'oxydation. Ils ont ensuite proposé un mécanisme qui est présenté ci-après :
Ce4+ + nH2O [Ce(H2O)n]4+ Ce(H2O)n]4+ + mH2O [Ce(OH)m(H2O)n-m](4-m)+ + mH3O+ [Ce(OH)m(H2O)n-m](4-m)+ + H2O CeO2.nH2O + H3O+ 2) Cas de Ce(III) Ce3+ H2O2 + 2H+(aq) Ce4+ + 2H2O Ce4+ + nH2O [Ce(H2O)n]4+
[Ce(H2O)n]4+ + mOH- [Ce(OH)m(H2O)n-m](4-m)+ + mH2O
[Ce(OH)m(H2O)n-m](4-m)+ + OH- CeO2.nH2O
Dans le premier cas, Ce(NO3)4 est solvaté par les molécules d’eau avoisinantes pour donner
lieu à des espèces hydroxylés qui se décomposent en oxyde par le biais des ions H3O+
provenant de la dissociation de l’eau. Pour le deuxième cas, Ce(NO3)3 réagit avec le peroxyde
d’hydrogène et des molécules d’eau où l’oxydation et l’hydrolyse se produisent simultanément suivi de l’ajout d’agent précipitant qui n’est autre que l’hydroxyde d’ammonium. Les nanoparticules formées dans le deuxième cas ne sont pas sphérique ce qui montre la complexité du contrôle de la morphologie par cette technique. Hailstone et al. [29] ont utilisé une méthode presque similaire à celle susmentionnée en haut, sauf qu’ils ont ajouté un stabilisant organique à base de mélange d’acide ethylenediaminetétraacetique et d’acide lactique pour surmonter les obstacles de la technique de précipitation. Des nanoparticules mono-dispersées de 2 nm de taille ont été obtenues avec cette méthode.
Du et al. [30] ont adopté une méthode basée sur la précipitation en milieu fortement basique pour aboutir à l’obtention de nanotiges de cérium parfaitement orientées en contrôlant le ratio de précurseur et la concentration d’une base forte. Le Ce(NO3)3 était le précurseur de cérium
pendant cette expérience dont le système à reflux (100 °C) a été maintenu pendant 4 à 8 minutes. L’effet de changement de ratio molaire de Ce3+ et OH- était significatif, et qu’à partir de 1/2,5 (ratio Ce3+/OH-) favorise la formation de nanotiges.
Des nanoparticules d’oxyde de cérium de 2,3 nm de taille ont été préparées par Sreeremya et al. [31] en utilisant de l’ammonium comme agent précipitant en présence de nitrate de cérium, d’un mélange de glycol et d’eau à volume égal. Les surfaces de ces petites particules ont été passivées par des molécules d’acides oléiques permettant leur stabilisation et empêchant leur agglomération.
La technique de synthèse par précipitation est une méthode très simple pour la synthèse des oxydes métalliques massifs mais pour la synthèse d’oxyde nanostructuré les tâches se compliquent car des paramètres régissant la synthèse ne sont pas vraiment contrôlables pour synthétiser des morphologies et de tailles bien calibrées en témoignent les exemples ci-dessus. Les résultats sont presque aléatoires ou imprédictibles qui ne sont pas du tout promettant si nous avons un cahier de charge à respecter.
I-1.3 Synthèse hydrothermale et solvothermale
Dans une bombe ou un autoclave scellé, les solvants peuvent être portés à une température largement supérieure à leurs températures d’ébullition en générant de pression autogène par chauffage. Effectuant une synthèse chimique dans une telle condition se réfère à la technique solvothermale [32] et si le solvant n’est autre que de l’eau on l’appelle : synthèse hydrothermale [33-35]. Cette technique est largement utilisée pour synthétiser des matériaux solide cristallins, et depuis quelques décennies elle fait partie des techniques très efficaces en terme de contrôle de morphologie, de cristallinité des nanocristaux, et de leur taille [36,37].
Plusieurs paramètres régissent la synthèse solvothermale comme : la température, la nature du solvant et des précurseurs ainsi que la durée de la réaction. En général, elle nécessite une durée relativement longue par rapport aux autres techniques qui permet aussi d’achever la croissance cristalline et c’est pour cette raison que la plupart des oxydes préparés par ladite technique possèdent une bonne cristallinité. Des oxydes de cérium de différentes morphologies et de diverses tailles ont été préparés via cette technique.
Taniguchi et al. [38] ont réussi à contrôler la croissance des nanocubes d’oxyde de cérium de 8 nm d’arête par la synthèse hydrothermal en utilisant l’oléate de sodium et le nitrate de cérium (III). Tandis que des nanocubes de 5 nm ont été obtenus en changeant du cérium (III) en cérium (IV). L’hydroxyde d’ammonium a été ajouté dans le mélange formé par le
précurseur de cérium et l’oléate de sodium avant de sceller et mettre l’autoclave à une température de 200 °C pendant une durée qui varie de 1h à 30h sous pression autogène bien évidemment.
Cao et al. [39], quand à eux, ont utilisé l’urée à la place de l’ammonium sans recours à l’utilisation d’agent structurant comme le cas précédent. Des nanosphères creuses ont été obtenues et la réaction n’a duré que de 5 à 30 minutes sous irradiation microondes. De leur part, Yang et al. [40] ont pu obtenir aussi des nanosphères creuses formées par de nanoparticules octaédrales en utilisant le CeCl3 comme précurseur de cérium et le
polyvinylpirrolidone comme agent structurant dans des conditions hydrothermales. L’ajout de quelques millilitres de formamide et de peroxyde d’hydrogène était nécessaire pour favoriser cette réaction qui a durée 24h à 180 °C.
Zhang et al. [41] ont adopté la technique solvothermale comme technique de synthèse de l’oxyde de cérium en présence de soude/potasse. La température de la réaction a été maintenue à 180 °C sous un système de chauffage classique et pendant 24h. Des agrégats de nanoparticules possédant une propriété particulière ont été obtenus. Les nanoparticules synthétisées de différente taille (de 2,6 nm à 6,9 nm) absorbent la radiation ultraviolette de différente façon. Ce phénomène d’effet de taille sur les propriétés des nanoparticules fait partie des intérêts de la synthèse de tels nanomatériaux.
La technique de synthèse par voie hydrothermale ou solvothermale permet la synthèse des oxydes de cérium nanostructurés de différentes tailles et morphologies mais le problème majeur limitant l’utilisation de ladite technique est la mise en œuvre relativement difficile et la durée de la réaction qui est généralement très longue à moins qu’on chauffe par un four microondes.
I-1.4 Synthèse assistée par micro-onde
Les micro-ondes proviennent des radiations électromagnétiques de plage de fréquences 300 MHz à 300 GHz dont la fréquence usuelle est de 2,45 GHz. L’interaction microondes-matière est basée sur deux principaux mécanismes : interaction dipôle-dipôle et la conduction ionique. L’interaction dipôle-dipôle est spécifique pour les molécules dipolaires et cette polarité est un
tendent à se réorienter et se désorienter et osciller avec le changement d’orientation des champs électriques. La chaleur provient des frictions et des collisions des molécules dans le milieu. Cette technique a été largement utilisée en synthèse organique mais cette dernière décennie, les chimistes de matériaux n’ont pas tardé à l’adopter pour la synthèse de divers matériaux [42]. Les particularités du chauffage par microondes résident en faite : i) dans la réduction de la durée des réactions en quelques minutes, voire secondes, ii) dans l’homogénéisation de la température du chauffage dans le milieu réactionnel, et iii) dans l’absence d’inertie thermique. Ceci a permis à cette technique de prendre de l’importance comme technique post-synthèse couplée à d’autres méthodes de synthèse (précipitation, solvothermale, sol-gel…). L’oxyde de cérium a été ainsi synthétisé par cette technique [39].
Ainsi, Li et al. [43] ont synthétisé des nanotiges mésoporeuses d’oxyde de cérium présentant une bande gap de 2,74 eV en utilisant le nitrate de cérium (III) hexahydraté comme précurseur de cérium et l’urée comme agent hydrolysant. La durée de la réaction était de 30 minutes sous microondes à système ouvert. Godinho et al. [44] ont démontré l’influence du chauffage par microondes sur la croissance cristalline des nanoparticules d’oxyde de cérium synthétisées dont la synthèse s’est déroulée sous système fermé (hydrothermal) porté à 130 °C. L’ammonium a été ajouté dans le but de calibrer le pH à 10 avant de sceller le réacteur sur la solution préparée de nitrate de cérium (III) hexahydraté. En comparant avec des résultats obtenus avec le système de chauffage classique, ils ont pu observer que le chauffage microondes a influencé remarquablement la vitesse de croissance des nanotiges d’oxyde de cérium synthétisées et puis la durée de la réaction qui a été réduite à 30 minutes.
Natile et al. [45] ont fait une étude comparative de synthèse d’oxyde de cérium par chauffage à microondes et celle de synthèse basée sur le chauffage classique. Ils ont conclu que des nanoparticules de faible distribution de taille ont été obtenues par irradiation microondes avec une surface spécifique supérieure en comparant avec la technique classique (72 m2/g versus 48 m2/g). Notons que la réaction a duré 10 minutes sous irradiation à microondes. Les exemples mentionnés ci-dessus montrent la versatilité et l’importance de l’utilisation du chauffage microondes en synthèse de matériaux.
La microémulsion est un milieu liquide formé par un mélange stable d’eau et d’huile ou de solvant organique non miscible avec l’eau et en présence de tensioactifs [46-50]. Généralement, le milieu aqueux contient du sel ou autres espèces chimiques nécessaires pour la réaction. Ces dernières peuvent jouer plusieurs rôles dans l’émulsion comme l’augmentation de force ionique du milieu, la solubilisation de réactif et surtout le zêta-potentiel des micelles. Le milieu organique est composé généralement de solvant organique, de précurseurs (surtout des alcoxyde ou acetylacetonate) ou de molécules à très longue chaîne aliphatique [52-57].
Quand la concentration de tensioactif dépasse la concentration micellaire critique (CMC) dans l’eau, les micelles se forment par agrégation des molécules de tensioactif. Dans une micelle, la chaîne (aliphatique) carbonée de tensioactif est orientée vers l’intérieur de la micelle tandis que la tête hydrophile est en contact avec le milieu aqueux. Au-dessus de la CMC, les propriétés de micelles et du milieu changent comme la solubilité, la diffusion, la turbidité, et la conductivité, …etc. Cependant, la micelle inverse se forme dans un milieu non-aqueux où la tête hydrophile du surfactant se dirige vers l’intérieur de la micelle [58-60]. Dans le cas de la micelle inverse, la CMC n’est pas bien définie à cause du nombre d’agrégat de surfactant (pour former de micelle inverse) qui est relativement faible et que le milieu n’est pas sensible à la variation de la concentration du surfactant et/ou du mélange de surfactants. Ces micelles (inverse ou normale) sont utilisées comme de nanoréacteur pour la synthèse des matériaux dont l’élimination des surfactant après la réaction se fait juste par lavage avec de solvant approprié suivie d’un traitement thermique [61,62]. Cette technique de synthèse tellement polyvalente s’est apparue efficace pour la synthèse des matériaux poreux organisés et homogènes, de nanoparticules sphériques de faible distribution de taille ainsi que d’autres matériaux intéressants pour diverses applications.
Des oxydes de cérium de différentes caractéristiques ont été obtenus par cette technique. Ainsi, Zhou et al. [63] ont pu calibrer la morphologie, la taille ainsi que la texture des oxydes de cérium synthétisés via cette technique. L’oxyde de cérium nanostructuré, monodispersé, polycristallin et mésoporeux, a été obtenu par la modification des paramètres de synthèse dont le type de surfactant, la température ainsi que la durée de la réaction. Ce(OC8H17)4 a été
formation des nanoparticules monodispersées de taille moyenne de 2,23 nm. L’oxyde de cérium nanostructuré polycristallin et mésoporeux est préparé par l’utilisation de l’éthylène glycol ainsi que le mélange du P123 avec l’isopropanol.
Kuiry et al.[65] ont réussi à synthétiser des nanotiges d’oxyde de cérium par micelle inverse
en utilisant du nitrate de cérium (III) hexahydraté comme précurseur de cérium, de bis(2-ethylhexyl) sulfosuccinate de sodium (connu sous le nom de AOT) comme agent structurant, du toluène comme solvant ainsi que de peroxyde d’hydrogène comme agent oxydant. Le ratio en masse (en %) est de «1,78», «96,44» et «1,78» respectivement pour le AOT, le toluène ainsi que l’eau. Ces proportions de solvant et de surfactant provoquent une formation d’une micelle inverse où le cœur est formé par le milieu aqueux. Des nanotiges de 40 nm de diamètre et de 240 nm de longueur ont été obtenues.
Zhang et al. [66] ont synthétisé l’oxyde de cérium mésoporeux de faible distribution de taille centrée à 2,5 nm en utilisant des acides aminés (L-lysine, L-glycine, L-acide glutamique) comme agents structurants. En présence de ces acides aminés susmentionnés, la formation des nanotiges mésoporeuses est favorisée sauf dans le cas du L-acide glutamique qui favorise la formation des nanosphères d’oxyde de cérium. CeCl3.7H2O est le précurseur utilisé dans cette
étude et la synthèse a été réalisée dans un milieu aqueux.
Masui et al. [67] ont utilisé une micelle inverse pour synthétiser des nanoparticules ultrafines d’oxyde de cérium dont l’éther de 10-polyoxyethylene octaphenyl a été utilisé comme agent structurant et le cyclohexane comme solvant organique. La solution aqueuse a été obtenue par la dissolution de nitrate de cérium et de l’hydroxyde d’ammonium.
La technique de synthèse par microémulsion dite aussi dans quelques cas sol-gel permet d’obtenir des nanomatériaux de morphologie et de textures intéressantes mais le problème se pose souvent sur la séparation et le lavage du matériau synthétisé et l’utilisation du solvant en grande quantité ainsi que la conservation de la texture.
I-1.6 Nouvelles techniques
A part les techniques traditionnelles de synthèse d’oxyde de cérium, des nouvelles techniques de synthèses sont recensées ci-après :
1) Un simple procédé basé sur la biominéralisation a été développé par Okuda et al
.
[68]pour synthétiser des nanoparticules d’oxyde de cérium. L’apoferitine a été utilisée comme agent structurant dans cette étude. Les auteurs ont utilisé le CeCl3.7H2O comme précurseur decérium pour ce processus chimique dont la température réactionnelle est de 23 °C, tandis que la durée d’incubation était de 20 h. Des nanoparticules d’oxyde de cérium de 5 nm de diamètre moyen ont été obtenues.
2) Primo et al. [29] ont obtenu de nanoparticules d’oxyde de cérium par gélification de l’alginate en présence des ions tétravalents de cérium. L’aérogel composé de cérium et d’alginate a été préparé par séchage par CO2 supercritique. Ce dernier a été calciné pour
obtenir l’oxyde de cérium.
3) Li et al. [70] ont utilisé un liquide ionique à base de bromure de 1-hexadecyl-3-methylimidazolium comme agent structurant et solvant en même temps. Des agrégats de nanoparticules formant des sphères monodispersées ont été obtenues après traitement thermique à 100 °C.
4) Maensiri et al. [71] ont pu obtenir de nanoparticules d’oxyde de cérium en utilisant du blanc d’œuf (ovalbumine) comme agent structurant dans l’eau. Dans cette technique spécifique, l’acétate de cérium hydraté a été utilisé comme précurseur de cérium et la réaction s’est déroulée à température ambiante. Après un séchage et une calcination, l’oxyde de cérium a été obtenu après calcination.
5) Wilson et al. [72] ont développé une technique basée sur la pyrolyse des résines échangeuses d’ions afin d’obtenir des nanoparticles de taille homogène de 2 nm.
I-2. Caractérisation de CeO2
I-2.1. Phase cristalline
L’oxyde de cérium cristallise sous structure fluorine du groupe d’espace Fm3m dans toutes les plages de température (de température ambiante à la température de fusion). Cette dénomination vient du faite que la structure de l’oxyde de cérium est similaire à celle de
Standards) est de 34-0394 et la constante de maille « a » est de 0,543 nm [73]. La structure fluorine consiste à une structure cubique à face centrée de cations où les anions occupent les sites interstitiels octaédriques. Cela peut se présenter comme superposition d’une structure cubique à faces centrés de Ce4+ avec une constante de maille « a » ainsi qu’une simple maille cubique des anions de O2- de constante de maille a/2 pour un oxyde de cérium pur. Dans cette structure, chaque cation de cérium est lié à 8 proches voisins d’oxygène, tandis que chaque anion d’oxygène est lié à 4 proches voisins d’ion de cérium. Cette structure change quand on introduit des dopants dans des interstices qui vont créer de défauts [74].
Figure I-1 : structure cristalline d’oxyde de cérium stœchiométrique
Les raies de diffraction des plans atomiques (111), (200), (220) ainsi que (311) sont considérées comme l’empreinte digitale de l’oxyde de cérium dont le plus intense, généralement, est la raie de diffraction relative au plan (111). Dans des cas très rares [75], c’est la raie de diffraction relative au plan (220) qui est la plus intense et qui renseigne sur la non-stoechiometricité de l’oxyde. Des études insistent sur le fait que le plan (111) est le moins actif tandis que les autres plans comme (110) et (100) sont très actifs [77,78]. C’est très important de le savoir pour prédire l’activité catalytique, par exemple, de l’oxyde de cérium synthétisé. Parce que d’après Dang et al. [78] l’ordre d’énergie de surface des oxydes de cérium est ; γ (100) > γ (110) > γ (111). La structure cristalline de l’oxyde de cérium reste de la fluorite, pour le cas de l’oxyde de cérium non-stœchiométrique, mais les plans atomiques
Ce CeCe Ce4+4+4+4+ O OO O2222---- a a a a a/2
dominants et les activités de surfaces y afférentes dépendent de la technique de synthèse comme dans le cas susmentionné [75].
I-2.2. Défauts de structure et lacunes
L’oxyde de cérium stœchiométrique se présente soit sous forme de dioxyde CeO2 ou sous
forme sesquioxyde Ce2O3. Généralement ces deux structures coexistent avec un faible
pourcentage pour la dernière forme [79]. Cette dernière forme est moins stable car les ions Ce3+ ont tendance à s’oxyder pour donner Ce4+ et cela confère une propriété particulière de
l’oxyde de cérium [38]. En réalité, l’oxyde de cérium est non-stœchiométrique et il est souvent représenté sous forme de CeO2-δ où δ représente la vacance d’oxygène [80]. La
propriété de stockage d’oxygène de l’oxyde de cérium découle de la présence de ces vacances d’oxygène [81-83] dont plusieurs études théoriques qu’expérimentales ont été effectuées pour les évaluer et surtout les corréler en défauts-propriétés [73], [29]
La présence des vacances d’oxygène dans l’oxyde de cérium coïncide généralement avec la présence en taux non négligeable de Ce3+ surtout à la surface de nanoparticules [29]. L’un des avantages de réduction de la taille réside dans le fait du pourcentage élevé des atomes en surface par rapport aux matériaux massifs. En plus de cela, les éléments avoisinant la surface ont tendance à avoir une coordination moins élevée que ceux à l’intérieur. En effet, l’obtention des nanoparticules de taille plus petite favorise la présence de Ce3+ [73] donc une forte chance d’avoir des défauts d’oxygène dans le matériau. La co-existence de Ce4+/Ce3+ dans l’oxyde cérium fait partie des propriétés intrinsèques de l’oxyde de cérium et confère à ce matériau de nombreuses propriétés si on ne cite dans ce paragraphe que l’apparition des défauts d’oxygène.
La spectroscopie XPS est la meilleure technique utilisée pour déterminer le degré d’oxydation et le taux en Ce3+ et Ce4+. Les pics repérables à 917 et 899 eV sont caractéristiques à Ce4+ (Ce 3d5/2). Tandis que les pics à 903 et 885 eV sont affectés à Ce3+ (Ce 3d3/2) [84]. Les défauts
sont généralement crées en ajoutant des éléments à valence différente [85] ou en bombardant le matériau par des faisceaux d’ions légers comme le He3+ [86]. Le premier semble plus intéressant car la chimie colloïdale permet de contrôler la morphologie, la taille ainsi que le taux de dopage par des hétéro-éléments de valence différente. Plusieurs hétéro-éléments ont été insérés pour créer des défauts mais pas seulement pour augmenter l’activité catalytique du CeO2 mais améliorer d’autres propriétés comme la luminescence, l’absorption d’UV. Le
néodyme, praséodyme ainsi que d’autres éléments sont largement utilisés pour doper l’oxyde de cérium en vue de créer des défauts ainsi que de conférer une propriété luminescente
I-2.3. Morphologies et textures
I-2.3.1. Morphologies
L’un des défis dans le domaine de nanomatériaux pour des applications spécifiques est le contrôle de la morphologie des nanomatériaux synthétisés. Plusieurs techniques sont disponibles pour la préparation d’oxyde de cérium de morphologie bien déterminée (cf. I-1). Dans la connaissance actuelle, plusieurs variétés de morphologie et toutes les géométries possibles ont été obtenues par différentes techniques adoptées [89].
Figure I-3 Oxyde de cérium de différentes morphologies : (a) [39], (b) [38], (c) [90], (d) [91], (e) [92] et (f) [93]
La figure I-3 montre les différentes morphologies possibles de l’oxyde de cérium allant de la structure creuse jusqu’à la forme de fleur. Le contrôle de la morphologie pour le cas de l’oxyde de cérium est possible et suscite des recherches très avancées pour que la technique de synthèse soit reproductibles, de faible coup et exploitable industriellement et avec une faible consommation d’énergie. Pour tout ce qui est contrôle de morphologie de nanoparticules, la technique de synthèse par voie hydrothermale est la plus efficace. Les nanomatériaux de différentes morphologies présentés dans la figure I-3 ont été tous
200n 200n200n 200n m mm m
a
b
c
d
e
f
synthétisés par cette technique. Les paramètres de synthèse surtout la température, la durée de la réaction, ainsi que la pression confèrent à cette technique d’être la plus efficace en terme de contrôle de morphologie. La croissance cristalline nécessite une bonne calibration des paramètres thermodynamiques notamment la pression et la température et c’est pour cette raison que la voie hydrothermale se montre plus efficace pour le contrôle de distribution de taille et de morphologie. La technique par microémulsion quant à elle-même se présente efficace de point de vue morphologique. En effet, des différentes morphologies ont été synthétisées (I-1-5). Plusieurs publications scientifiques démontrent une corrélation entre la morphologie et la taille avec les propriétés du matériau. La revue de la littérature de Burda et al. [94] résume la relation propriété-morphologie des nanomatériaux (nanocristaux).
Le contrôle de la morphologie pendant la synthèse est presque familière pour les chimistes travaillant dans le domaine de synthèse de matériaux mais de grands problèmes se posent sur la stabilité de ces nanoparticules. Si les particules sont en suspension dans un solvant avec le stabilisant, l’application plus probable de ces nanoparticules reste dans ce milieu car tout traitement que ce soit physique (évaporation de solvant) ou chimique (changement de pH) peut altérer la stabilité de ces nanoparticules. Et au lieu d’avoir des particules individuelles de petite taille, nous aurons des agrégats de particules de taille plus importante.
I-2.3.2. Textures
Les problèmes rencontrés sur la dispersion et la stabilisation des nanoparticules individuelles de géométrie bien définie peuvent être contournés en contrôlant l’agrégation des particules et/ou en ajoutant des agents structurant de surfaces. Les résultats sont significatifs et parfois imprédictibles et les propositions de mécanisme se divergent dans certains cas [95,96]. Néanmoins, pour l’oxyde de cérium, des textures lamellaires [97], poreuses [98], ou mousseuses [99,100] ont été synthétisées.
Figure I-4 Images des différentes textures de l’oxyde de cérium : (a) texture lamellaire [97], (b), texture poreuse organisée [98], (c) texture mousseuse [99].
La texture des matériaux se détermine par leur surface spécifique et aussi leur distribution des tailles de pore. Plusieurs techniques ont été développées pour obtenir l’oxyde de cérium de surface spécifique importante, on cite notamment l’utilisation des tensioactifs [66], ou des agents structurants rigides comme le carbone, et la modification du traitement post-synthèse comme le séchage par CO2-supercritique [69,101]. L’oxyde de cérium d’une surface
spécifique de 144 m2/g a été préparé par Wang et al. en utilisant des microsphères de carbone comme agent structurant rigide [101]. Les problèmes qui se posent souvent sur la surface spécifique sont : i) la stabilité thermique, et ii) l’accessibilité au micropore. Même si on a réussi à avoir des matériaux de surface spécifique très élevée, les applications potentielles de ces matériaux requièrent un traitement thermique, alors que ledit traitement provoque l’effondrement de la porosité. De ce fait, la stabilité thermique de la texture et/ou de la structure de l’oxyde de cérium préparé s’avère décisive car certaines applications (cf. 1.3.2) nécessitent de température élevée.
L’accessibilité des surfaces intérieures des matériaux est aussi un problème courant surtout pour les matériaux microporeux (diamètre de pore inferieur à 2 nm selon la classification UIPAC [102] surtout pour une application relative à la réactivité de surface comme dans le cas de la catalyse hétérogène. De ce fait, la préparation d’oxyde de cérium de texture thermiquement stable est d’importance majeure en tenant compte des problèmes susmentionnés.
b
I-3. Propriétés et applications
I-3-1 Propriétés des oxydes de cérium
Les oxydes de cérium ont de multitude propriétés intéressantes qui les qualifient de matériaux très importants du point de vue technologique. Les propriétés structurales et les vacances d’oxygène sont déjà détaillées ci-dessus (cf. I-2-1 et I-2-2) or les propriétés d’oxyde de cérium sont plus large [103-116].
La couleur de l’oxyde de cérium stœchiométrique est de jaune pale qui est probablement venant du transfert de charge entre Ce (IV)-O (II) alors que l’oxyde de cérium non- stœchiométrique est bleu [117].
L’oxyde de cérium possède une propriété redox due à la coexistence de Ce3+ et Ce4+ qui jouent un rôle d’un couple redox [118]. Sicard et al. [119] ont démontré que le couple redox Ce3+/Ce4+ peux jouer un rôle de chasseur de radicaux (radical scavenger) dans une matrice où l’oxyde de cérium n’a été introduit qu’en petite proportion pour conférer à la matrice une nouvelle propriété.
L’effet de réduction de tailles fait partie des intérêts pour la préparation des nanomatériaux. Pour le cas de l’oxyde de cérium, la réduction de la taille permet de créer plus de vacances d’oxygène dans le matériau car plus la taille des particules est petite plus le pourcentage des atomes en surface augment, alors que les Ce3+ sont en majorité à la surface de particules [73].
L’oxyde de cérium a une propriété d’absorption de la radiation UV. Duan et al. [120] a avancé deux hypothèses pour expliquer le mécanisme de la forte absorption de la radiation UV par l’oxyde de cérium : i) l’excitation de la couche de valence de l’atome de cérium, et ii) l’indice de réfraction élevé. Pina et al. [
![Figure I-7 Représentation schématique des étapes de préparation de l'oxyde de zirconium par la méthode precipitation [185]](https://thumb-eu.123doks.com/thumbv2/123doknet/2193319.11716/41.892.117.788.393.572/figure-representation-schematique-etapes-preparation-zirconium-methode-precipitation.webp)
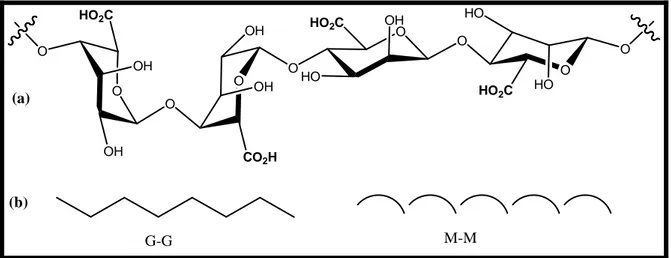
![Figure I-12 Schéma de principe de la gélification de l’alginate par des cations divalents et trivalents [311]](https://thumb-eu.123doks.com/thumbv2/123doknet/2193319.11716/63.892.115.783.483.706/figure-schema-principe-gelification-alginate-cations-divalents-trivalents.webp)
![Figure I-13 Schéma de principe des interactions possibles entre le cation Fe 2+ et la chaîne de l’alginate (monomère G) [314]](https://thumb-eu.123doks.com/thumbv2/123doknet/2193319.11716/64.892.110.782.106.292/figure-schema-principe-interactions-possibles-chaine-alginate-monomere.webp)