Transport du silicium par les aquaporines animales
Thèse
Gabriel Carpentier
Doctorat en médecine expérimentale
Philosophiae Doctor (Ph. D.)
Québec, Canada
© Gabriel Carpentier, 2015
iii
Résumé
Cette thèse de doctorat porte sur le transport du silicium (Si) par les aquaporines animales. Le Si est un élément abondant dans la nature où il joue des rôles impor-tants, chez les plantes notamment. Il jouerait également des rôles importants en physiologie animale en contribuant à l’intégrité osseuse, à la santé tégumentaire et au maintien du collagène. Bien que des transporteurs de Si soient déjà connus chez les diatomées et les plantes, aucun n’a encore été décrit chez l’animal. Tou-tefois, la compartimentalisation du Si au sein de l’organisme et son assimilation nutritionnelle suppose l’existence de tels transporteurs. En raison de l’homologie qu’elles partagent avec les transporteurs de Si chez les plantes, les aquaporines (AQPs) animales correspondent à des candidats pertinents. Dans ce contexte, les objectifs de la thèse étaient de déterminer si les AQPs sont perméables au Si et, le cas échéant, de caractériser le rôle physiologique du transport en Si par les AQPs et d’identifier des résidus qui permettent à ces canaux d’agir ainsi. Nos travaux ont permis de constater que les AQP3, AQP7, AQP9 et AQP10 humaines, connues sous le nom d’aquaglycéroporines (AQGPs), peuvent toutes agir comme des transporteurs de Si ou plus spécifiquement de l’acide orthosilicique qui permet à l’atome d’exister sous forme soluble. Le transport observé est de nature michae-lienne, sensible à la phlorétine (AQP7 et AQP9) mais insensible aux changements de pH et d’osmolalité extracellulaire. Aussi, la distribution tissulaire de ces trans-porteurs concorde avec celle du Si, et l’expression des AQP3, AQP7 AQP9 dans le petit intestin de la souris est augmentée avec une diète faible en Si. Par ailleurs, nous avons démontré que la région des AQPs connue sous le nom de filtre aroma-tique/Arginine joue un rôle important dans la sélectivité à l’OSA, et que les résidus L84 chez AQP1 et N208 chez AQP10 jouent un rôle dans la sélectivité à l’eau et au Si respectivement. Ces travaux ont mené à la première description de transpor-teurs de Si chez l’animal, et à une meilleure compréhension de la physiologie de l’atome chez les mammifères.
iv
Abstract
The subject of this Ph.D. thesis is the transport of silicon (Si) by animal aquaporins. Si is an abundant element in nature where it plays important roles, namely in plants. It also appears to play important physiological roles in animal physiology, by contributing to bone integrity, tegumentary health and collagen maintenance. Even though Si transporters have already been identified in diatoms and plants, none have been described in animals thus far. However, compartmentalization of Si throughout the mammalian body and nutritional assimilation suggest the existence of such transporters. Given the homology that they share with the Si transporters of plants, the mammalian aquaporins (AQPs) correspond to relevant candidates. In this context, the thesis’ objectives were, to determine whether AQPs are permea-ble to Si, and if so, to characterize the physiological role of Si transport by the AQP and to identify residues that allow these channels to act as such. Our work has al-lowed us to observe that human AQP3, AQP7, AQP9 and AQP10, also known as aquaglyceroporins (AQGPs), can all act as transporters for Si or more specifically for orthosilicic acid (OSA) that allow Si to be soluble in this form. The observed transport is michaelian in behavior, sensitive to phloretin (AQP7 and AQP9), but insensitive to changes in pH and extracellular osmolality. Also, tissular distribution of these carriers concords with that of Si, and expression of AQP3, AQP7 and AQP9 in the small intestine of mice is upregulated through a Si-poor diet. Other-wise, we have demonstrated that the region within the AQP that is knows as that aromatic/arginine filter (ar/R) plays an important role in OSA selectivity, and that residues L84 in AQP1 and N208 in AQP10 plays an important role in water perme-ability and Si permeperme-ability respectively. These results have led to the first descrip-tion of Si transporters in animals, and a better understanding of the role played by this atom in mammalian physiology.
v
Résumé de l’article inséré au chapitre 4
Chez les animaux, le silicium est un élément trace abondant et compartimenté qui assurerait d’importants rôles biologiques. Il serait vraisemblable que les concentra-tions de silicium dans les fluides corporels soient régulés par des transporteurs présents à la surface de divers types cellulaires. Cependant, et ce même s’ils ont d’ores et déjà été identifiés chez les plantes et les algues unicellulaires, aucun de ces transporteurs n’a été identifié chez un vertébré. Dans cet article, nous démon-trons pour la première fois que les aquaglycéroporines humaines, c’est-à-dire AQP3, AQP7, AQP9 et AQP10 peuvent agir comme transporteurs de silicium dans les oocytes de Xenopus laevis de même que dans les cellules HEK-293. EN parti-culier, AQP7, AQP9 et AQP10 exprimés de façon hétérologue sont capable d’induire une activité de transport du silicium robuste, saturable et sensible à la phlorétine, qui est comparable à celle observée chez low silicon rice 1 (lsi1), un transporteur de silicium végétal. De plus, nous avons démontré que les aquaglycé-roporines peuvent être des voies de perméabilité du silicium pertinentes chez la souris et chez l’homme en se basant sur 1) la cinétique de transport, 2) la pré-sence de silicium dans les tissus où celui-ci pourrait jouer un rôle clé et 3) les changements transcriptionnels observés suite à des variation de la quantité de slicium dans la diète. Dans son ensemble, nos données fournissent de nouvelles concernant les rôles biologiques potentiels du silicium chez l’animal et sur la régu-lation de sa distribution corporelle. Ces résultats devraient ouvrir de nouvelles ave-nues de recherche concernant le rôle physiologique véritable du silicium chez les vertébrés.
vi
Résumé de l’article inséré au chapitre 5
Nous avons récemment démontré que les aquaglycéroporines (AQGPs) pouvaient agir comme transporteurs efficaces d’acide orthosilicique (H4SiO4). Bien
qu’intéressante, cette découverte amène à se questionner à savoir si le H4SiO4 – la
forme transportable du Si – et l’eau utilisaient la même voie de passage au travers de la protéine, considérant les différences de taille entre les deux substrats. Le but de cette étude était d’identifier des résidus qui fournissaient aux AQGPs la capaci-té de faciliter la diffusion du Si. Pour ce faire, nous avons examiné les caraccapaci-téris- caractéris-tiques fonctionnelles de mutants dans lesquels des résidus étaient interchangés entre un canal perméable à l’eau mais imperméable au Si (AQP1) et un canal im-perméable à l’eau mais im-perméable au Si. Nos résultats indiquent que la composi-tion du filtre aromatique/arginine (Ar/R), connu pour inclure trois résidus importants pour le transport de l’eau, est également crucial à la sélectivité au Si ; le fait d’interchanger les résidus non-arginine de ce filtre ont mené à une augmentation d’un facteur 7 de la capacité de transport en Si d’AQP1 et d’une diminution d’un facteur 3 de la capacité de transport en Si d’AQP10, alors que le transport en eau et l’expression membranaire demeuraient inchangés. Nos résultats ont également permis d’observer que deux autres résidus jouent des rôles importants dans la sé-lectivité aux substrats : le fait d’interchanger un des résidus a eu un effet important sur la perméabilité à l’eau alors que l’interchangement de l’autre a profondément affecté la perméabilité au Si. Nous avons ainsi identifié les premiers résidus jouant un rôle clé dans le transport du Si par les AQGPs et avons découvert que la sélec-tivité au substrat est assurée par plusieurs points de contrôle à l’intérieur du pore.
vii
Table des Matières
Résumé ... iii
Abstract ... iv
Résumé de l’article inséré au chapitre 4 ... v
Résumé de l’article inséré au chapitre 5 ... vi
Table des Matières... vii
Liste des tableaux et figures ... ix
Liste des abréviations ... x
Remerciements ... xii Avant-Propos ...xiii 1 .. Introduction ... 1 1.1 Le Silicium ... 1 1.1.1 Généralités ... 1 1.1.2 Rôles physiologiques ... 1
1.1.2.1 Chez les diatomées ... 1
1.1.2.2 Chez les végétaux ... 4
1.1.2.3 Chez les animaux ... 5
1.1.2.3.1 Généralités ... 5
1.1.2.3.2 Silicium et santé osseuse ... 6
1.1.2.3.3 Silicium et greffe (verres bioactifs) ... 9
1.1.2.3.4 Silicium et santé mentale ... 11
1.1.2.3.5 Silicium et santé tégumentaire ... 13
1.2 Les transporteurs de Silicium ... 14
1.2.1 Découverte : Transporteurs de Si chez les diatomées ... 14
1.2.2 Transporteurs de Si chez les plantes ... 15
1.3 Les Aquaporines mammaliennes ... 17
1.3.1 Découverte ... 17
1.3.2 Caractéristiques ... 18
1.3.2.1 Généralités ... 18
1.3.3 Aquaporines « classiques », ou orthodoxes ... 23
viii 1.3.3.2 AQP1 ... 24 1.3.3.3 AQP2 ... 26 1.3.3.4 AQP4 ... 27 1.3.3.5 AQP5 ... 28 1.3.3.6 AQP6 ... 29 1.3.3.7 AQP8 ... 30 1.3.4 Aquaglycéroporines ... 31 1.3.4.1 AQP3 ... 31 1.3.4.2 AQP7 ... 32 1.3.4.3 AQP9 ... 34 1.3.4.4 AQP10 ... 34
1.3.5 Superaquaporines, ou aquaporines non-orthodoxes ... 35
1.3.5.1 AQP11 ... 35
1.3.5.2 AQP12 ... 36
1.3.6 Études structure-fonction chez les aquaporines ... 37
2 . Hypothèses, objectifs et aperçu de la thèse ... 40
2.1 Hypothèses et objectifs de recherche ... 40
2.2 Aperçu de la thèse ... 41
3 . Méthodes générales ... 42
3.1 Constructions AQP ... 42
3.2 Mutations ponctuelles ... 42
3.3 Constructions des chimères ... 43
3.4 Expression dans les oocytes de Xenopus laevis ... 44
3.5 Études fonctionnelles avec les oocytes ... 44
3.6 Études d’expression ... 45
4 . Aquaporins mediate silicon transport in mammals ... 47
5 . Identification of key residues involved in Si transport by the aquaglyceroporins71 6 . Discussion et conclusion ... 99
6.1 Discussion et critiques des travaux obtenus... 99
6.2 Limitations des études poursuivies jusqu’à maintenant. ... 102
ix
Liste des tableaux et figures
TABLE 4.1 ... 63 TABLE 4.2 ... 64 TABLE 4.3 ... 65 TABLE 5.1 ... 88 TABLE 5.2 ... 89 FIGURE 1.1 . ... 2 FIGURE 1.2 ... 7 FIGURE 1.3: ... 20 FIGURE 1.4 ... 21 FIGURE 1.5. ... 22 FIGURE 1.6 ... 37 FIGURE 1.7 ... 38 FIGURE 4.1 ... 66 FIGURE 4.2 ... 67 FIGURE 4.3 ... 68 FIGURE 4.4 ... 69 FIGURE 4.5 ... 70 FIGURE 5.1 ... 90 FIGURE 5.2 ... 91 FIGURE 5.3 ... 92 FIGURE 5.4 ... 93 FIGURE 5.5 ... 94 FIGURE 5.6 ... 95 FIGURE 5.7 ... 96 FIGURE 5.8 ... 97 FIGURE 5.9 ... 98
x
Liste des abréviations
203 Hg-PCMBS 203 Hg-p-chloromercuribenzene-sulfonate A.A. Acide Aminé
ALP Alkaline Phosphatase
AOS Acide Orthosilicique
AQGP Aquaglycéroporine AQP Aquaporine
AQPap Aquaporine adipose
ch-AOS Acide orthosilicique stabilisé à la choline CHIP28 « channel-like integral protein of 28kD » DMO
Densité Minérale Osseuse
HCA Apatite Hydroxycarbonate
KO « knock-out »
MA Maladie d’Alzheimer
MEC Matrice Extracellulaire NEM N-ethylmaleimide
NPA Asparagine-Proline-Arginine
RE Réticulum Endoplasmique
SIT1 « Silicon Transporter 1 » SSR « single sequence repeats »
xi
A mon père, pour m’avoir ouvert toute grandes les portes de la connaissance et pour m’avoir convaincu de ne jamais les refermer.
xii
Remerciements
Je tiens tout d’abord à remercier mon directeur de recherche, le docteur Paul Isenring, de m’avoir permis de poursuivre mes études graduées au sein de son laboratoire. Les huit dernières années furent fastes sur les plans scientifique et académique, d’abord et avant tout grâce à la confiance qu’il a su mettre en moi, aux précieux conseils prodigués et à la liberté intellectuelle accordée sans réserve.
Je veux ensuite remercier mes collègues du laboratoire, présents et pas-sés : Luc Caron, Micheline Noël, François Côté, Mariève Jacob-Wagner, Charles Simard, Marc Bergeron, Nikolas Daigle, Andréanne Marcoux, Alexandre Garneau, Michaël Simard et Rachelle Frenette-Cotton. De par leur expertise, générosité, attention et surtout amitié, ils ont été des éléments indissociables de la réussite de toutes ces années d’études. Je leur en suis toutes et tous éternellement recon-naissant. Ils me manqueront!
Merci également aux IRSC pour la généreuse bourse qui m’a soutenu pour la majeure partie de mes études de doctorat et m’a accordé le privilège de voyager afin de partager la science et d’élargir mes horizons, de même qu’au FCI pour avoir participé monétairement au bon fonctionnement de mon laboratoire d’accueil.
Je ne puis passer sous silence le rôle qu’a joué ma famille dans la réussite de mes études. Mathieu, Kathy, Marie et Andrée, vous êtes les piliers qui m’élèvent dans l’allégresse et me redressent dans la tourmente; vos encourage-ments et votre soutien sont inestimables. Les (animées) discussions autour de la table auxquelles vous m’avez invité à participer dès que j’ai su parler ont permis de développer chez moi un esprit critique et une soif de connaissance qui me sont aujourd’hui essentiels. Je vous aime inconditionnellement.
xiii
Avant-Propos
Les chapitres 4 et 5 de cette thèse sont des articles insérés. Le premier article s’intitule Aquaporins mediate silicon transport in mammals. Les autres auteurs de cet article sont Charles F. Simard, Rachelle Frenette-Cotton, Alexandre P. Gar-neau, Andrée-Anne Marcoux, Luc Caron, François Côté, Mariève Jacob-Wagner, Micheline Noël et Paul Isenring. En tant que premier coauteur avec M. Charles Simard, Mme Rachelle Frenette-Cotton et M. François Côté, j’ai produit environ 20-25% des résultats présentés dans cet article, en plus d’avoir participé à la produc-tion de certaines des construcproduc-tions utilisées et d’avoir contribué à l’analyse des résultats et la rédaction. Plus précisément, j’ai produit les résultats concernant les AQP3, 7, 9, et 10 de la figure 1A, les figures 2A, 2B et3A. Cet article a été publié dans PLoSone en août 2015.
Pour le second article, Identification of key residues involved in Si transport by the
aquaglyceroporins, je suis premier auteur ; Paul Isenring, Alexandre Garneau,
An-drée-Anne Marcoux et Micheline Noël agissent à titre de coauteur. J’ai réalisé la majeure des expériences, des figures et des nouvelles constructions utilisées et participé de façon importante à la rédaction de l’article. Cet article a été soumis à Open Biology en octobre 2015.
1
1 Introduction
1.1 Le Silicium1.1.1 Généralités
Le silicium (Si) est un métalloïde tétravalent portant le numéro atomique 14. Il est le second élément le plus abondant de la croûte terrestre (après l’oxygène), en constituant à lui seul près de 28% de la masse [1]. Il peut former, à l’instar du carbone, des interactions via ses quatre électrons de valence afin de former une grande diversité de composés sous conditions favorables. Il n’est ainsi que très rarement retrouvé sous sa forme élémentaire pure; il a plutôt tendance à former du dioxyde de silicium (SiO2). Toutefois, c’est dans un arrangement cristalloïde
d’atomes de Si et d’O, au lieu de molécules distinctes, que le SiO2 est retrouvé
dans la croûte terrestre. Ces arrangements peuvent prendre plusieurs formes, no-tamment le quartz, l’améthyste, l’opale et le jaspe. De même, divers silicates (composés avec un anion comprenant du silicium, le plus souvent [SiO4]4-)
abon-dent dans la nature. Biologiquement, la forme sous laquelle le Si est le plus sou-vent assimilé par les différents organismes est l’acide orthosilicique (AOS), Si(OH)4.
1.1.2 Rôles physiologiques 1.1.2.1 Chez les diatomées
Les diatomées (Bacillariophyta) sont un groupe d’algues photosynthétiques unicellulaires présentes dans la majorité des environnements aquatiques. Elles sont une des composantes principales du phytoplancton, et représenteraient à elles seules jusqu’à 40% de la production primaire marine [2]. Elles sont un
consti-2
tuant majeur de la chaîne alimentaire en tant que source alimentaire primaire de diverses formes de zooplancton. Il existe à ce jour plus de 200 genres de diato-mées répertoriés avec plus de 100 000 espèces [3-5]. Ces organismes sont parti-culièrement abondants dans les océans où ils se retrouvent majoritairement sous forme pélagique, mais aussi sous forme benthique, notamment en tant que bio-films à l’interface eau-sédiment. La principale caractéristique des diatomées est leur paroi cellulaire à base de silice [6], appelée frustule, au design nanométrique élaboré et complexe. Composée de deux parties (thèques) de tailles légèrement différentes (hypothèque et épithèque) s’emboîtant comme les deux éléments d’une boîte de pétri, cette « coquille » serait indispensable à la survie des microorga-nismes et leur conférerait divers avantages évolutifs.
Figure 1.1 : Image en microscopie électronique à balayage de frus-tules purifiés de Stephanopyxis turris à différentes magnifications.
3 La relation de dépendance dont font preuve les diatomées face au Si a été mise en évidence par l’étude d’Egge et Aknes en 1992. Ces chercheurs ont montré que dans des enceintes marines isolées, l’addition de Si de façon à maintenir sa concentration supérieure à 2 µm promouvait la dominance des diatomées sur les autres espèces, et ce indépendamment de la saison [8].
Plusieurs hypothèses ont été émises quant à l’utilité du frustule. Elles sont revues ici.
L'une des hypothèses est que le frustule serve de protection mécanique : l’enveloppe rigide siliceuse agirait comme une «armure » face aux agressions du zooplancton. En effet, il a été démontré que la rigidité extrême du frustule de cer-taines espèces telle le Fragilariopsis kerguelensis pouvait résister à des forces al-lant jusqu’à 7 N mm-2, soit équivalentes à 700 tonnes m-2 [9]. Il a aussi été
démon-tré que le contenu en Si de la paroi des diatomées était augmenté lorsque ces dernières étaient mises en contact avec un milieu de culture ayant préalablement contenu simultanément des diatomées et leur prédateur [10], suggérant ainsi une réponse concertée des microorganismes par le biais de facteurs sécrétés en ré-ponse au stress. Le frustule pourrait également agir en tamponnant le pH de la cellule, via la conversion enzymatique de bicarbonate en CO2 [11].
Il a aussi été avancé que le design complexe des thèques, avec leurs mul-tiples cavités et repliements, permettrait aux diatomées d’avoir un certain contrôle sur leur flottaison [12], et que, parallèlement, le taux de silification du frustule modi-fierait dynamiquement la vitesse de sédimentation [13]. Toujours concernant la structure nanométrique du frustule, il est possible que cette dernière soit ainsi faite de façon à affecter les paramètres hydrodynamiques et le mouvement brownien des particules dans l’environnement immédiat de la cellule, promouvant ainsi l’absorption de nutriments [14]. De manière intéressante, il a été démontré que la synthèse d’une paroi cellulaire à base de Si était d’environ 10 et 20 fois plus éner-gétiquement rentable que la synthèse de parois ligneuses ou polysaccharidiques, respectivement [15].
4
1.1.2.2 Chez les végétaux
Le Si est présent chez une foule de plantes terrestres dans des proportions hautement variables; sa masse représente de 0,1 à 10% du poids sec selon l’espèce. Il est qualifié d’élément bénéfique, en ce sens qu’il favorise la croissance de la plupart des plantes sans toutefois être indispensable à chacune d’elles. Dans le même ordre d’idée, et d’après les concepts d’essentialité d’Epstein et Bloom [16], le Si serait un élément « quasi-essentiel »; un apport incorrect de cet élément peut générer divers problèmes développementaux ou reproductifs.
Le Si est accumulé par la plante sous forme de Si(OH)4 via ses racines. Il
est par la suite distribué à l’ensemble de la plante et est déposé sous forme amorphe (SiO2 • nH2O) dans les parois cellulaires principalement. En s’associant
notamment avec la pectine et les polyphénols, le Si augmente la rigidité et la tur-gescence de la plante [17]. Cette résistance accrue se traduit par divers bénéfices non seulement directs, comme le fait que la structure plus solide de la plante faci-lite son ancrage au sol et sa croissance, mais aussi plus subtils. Entre autres, les feuilles rendues plus rigides ont moins tendance à s’affaisser et se retrouvent donc dans une position plus favorable pour recevoir la lumière [18].
Un autre des avantages indéniable de la silification des plantes est leur ré-sistance accrue aux agents pathogènes. Des études ont révélé ce phénomène pour les maladies d’origine fongique en particulier [19, 20]. Deux mécanismes hy-pothétiques ont été décrits concernant la nature de cette protection par le Si. Le premier est mécanique, en ce sens que la membrane cellulaire silifiée résiste mieux à la pénétration des champignons, ce qui prévient l’infection [21]. Le deu-xième concerne plutôt des propriétés biochimiques du Si qui pourraient induire cer-taines défenses naturelles de la plante comme la production d’enzymes telles que les chitinases, les peroxydases ou encore les polyphénoloxydases et de divers composés antimicrobiens tels les composés phénoliques, les composés phy-toalexines et d’autres éléments de réponse au stress [21-23]. Fait intéressant, ce deuxième système de défense est directement relié à la présence de Si dans
5 l’environnement de la plante et devient inefficace en son absence; ce serait donc la portion soluble du Si (Si(OH)4) et non sa portion amorphe et polymérisée qui serait
responsable de la réponse systémique pathogénique [24].
On confère aussi au Si des propriétés de résistance aux stress abiotiques. Par exemple, il a été démontré d’après des études effectuées avec le sorgho (Sorghum bicolor) qu’un cultivar présentant une concentration plus élevé en Si s’avérait également plus résistant à la sécheresse, ce qui s’expliquerait notamment par un taux de transpiration moins élevé [25]. Il a également été démontré que le Si amenuisait la toxicité de certains métaux lourds, particulièrement le manganèse (Mn) [26-29], le Cadmium (Cd) [30] et l’aluminium (Al) [31, 32]. Les mécanismes potentiels pour une telle protection pourraient être la formation d’un complexe entre le Si et le métal lourd [32] et/ou une perturbation des systèmes de transport de l’agent toxique causée par le Si [33]. Enfin, le Si augmenterait la tolérance à la salinité et permettrait la croissance dans un environnement de pression ionique élevée tel que révélé dans des études effectués chez le riz [34], le blé [35] et l’orge [36]. Cette tolérance pourrait s'expliquer par la capacité du Si à réduire la perméa-bilité des racines au sodium (Na).
1.1.2.3 Chez les animaux 1.1.2.3.1 Généralités
Chez l’animal, le Si est classifié comme élément trace; chez l’humain, on le retrouve à une concentration sérique moyenne de 50 µg/dL, ce qui est comparable à celle du fer, par exemple [37]. On le retrouve presque exclusivement sous forme de Si(OH)4 dans la circulation, et sa distribution est hautement compartimentée
dans les différents tissus. Ainsi, des études employant différents modèles animaux démontrent que les concentrations les plus élevées de Si sont atteintes dans des tissus conjonctifs tels que l’os, l’aorte, la trachée, le tendon et la peau. A titre
6
d’exemple, chez le rat, la concentration mesurée dans l’aorte est près de cinq fois supérieure à celle mesurée dans le foie [38].
Chez l’humain, le Si provient principalement de la diète; la plupart des popu-lations occidentales en ingèrent entre 25 et 50 mg par jour, ce qui correspond a environ deux fois l’apport quotidien en fer et en zinc [39-42]. Les sources nutrition-nelles principales de Si sont la bière [39, 41], les produits céréaliers (riz, orge, avoine, blé) [41, 43-45] et les légumes, plus spécifiquement certains types de fèves, les épinards et certaines herbes aromatiques [41, 43]. L’absorption est ma-joritairement effectuée par le tract gastro-intestinal, à raison de 40% de la quantité ingérée [39]. Il est à noter que la forme de Si dans l’aliment influence grandement son assimilation; ainsi, le Si(OH)4 présent librement dans la bière est beaucoup
plus facilement absorbé (>50%) [46] que les composés polymériques et phyto-litques contenus dans les bananes (<2%) [39].
La distribution compartimentée du Si et son assimilation nutritionnelle impor-tante laissent croire à un ou des rôles importants pour cet élément en biologie animale, mais aucun ne fait à ce jour consensus au sein de la communauté scienti-fique. Toutefois, une quantité d’évidences accumulée depuis maintenant une qua-rantaine d’années laisse supposer le bienfait, voire l’essentialité du Si pour l’organisme.
1.1.2.3.2 Silicium et santé osseuse
Les premières études d’intérêt portant sur le rôle du Si en physiologie ani-male remontent aux années 70. Deux équipes indépendantes avaient alors produit des études animales qui tendaient à démontrer le rôle du Si dans la croissance et le maintien des tissus squelettiques et conjonctifs.
La première avait comme sujets des rats; les chercheurs ont démontré qu'en supplémentant la diète des animaux de Si à raison de 50 mg/100g de nourri-ture, ils pouvaient augmenter la croissance de 33% par rapport à des contrôles.
7 Ces diètes semblaient également affecter positivement la forme du crâne et des incisives [47].
La deuxième étude avait comme sujets des poulets. Ces derniers, âgés de 24h, étaient nourris avec des suppléments de Si à raison de 100 ppm durant 23 jours ou étaient privés de Si. Ainsi, des taux de croissance bonifiés jusqu'à presque 50% ont étés observés chez les poussins supplémentés, tandis qu’une posture anormalement voutée, des organes atrophiés (crête et caroncule) et une pigmentation plus pâle (voir fig.1-2) l’ont été chez les poussins privés de Si [48]. Bien que ces résultats n’aient jamais été reproduits avec une telle ampleur, plu-sieurs travaux récents semblent confirmer les hypothèses avancées à l’époque par les auteurs [49-51]. Quoi qu’il en soit, ils sont les précurseurs d’un bon nombre d’études dont le but principal est de déterminer le rôle potentiel du Si en physiolo-gie osseuse. Certaines de ces études seront décrites plus en détail ci-après.
Figure 1.2: Photographie de poulets de 4 semaines sous diète enrichie en Si (gauche) et diète basale pauvre en Si (droite). Tiré de [52].
Deux études ont permis d'observer une corrélation positive entre la densité minérale osseuse (DMO) de hanches d’hommes et de femmes pré-ménopausées et la quantité de Si ingérée par la diète [53, 54]. Deux études additionnelles ayant comme sujet des femmes ostéoporotiques ont démontré que la supplémentation
8
en Si sous forme de monomethyl trisilanol pouvait augmenter d’une part la masse osseuse totale [55] et d’autre part la BMO du fémur et de l’épine dorsale [56]. D'autres études ont démontré des effets positifs de l'AOS ou de l'AOS stabilisé à la choline (ch-AOS).En outre, chez des patients ostéopéniques et ostéoporotiques, une corrélation possible a été observée entre la quantité d’AOS stabilisé à la cho-line (ch-AOS) administrée et l’apparition de marqueurs de formation osseuse (no-tamment PINP, un marqueur de la synthèse du collagène de type I) [57]. Un effet similaire a aussi été observé chez les rats ovarectomisés chez qui l’ingestion d’AOS ou de ch-AOS a diminué la perte osseuse et augmenté la DMO de façon générale [58-60].
L’étude animale la plus complète sur le sujet a été effectuée par un consor-tium international chez un nombre important de rats Sprague-Dawley. Elle con-firme la plupart des résultats mentionnés ci-dessus, sauf pour ceux observés dans les années 70, en plus de démontrer que la supplémentation en Si augmente la taille des os longs et de l’animal en général, que la concentration urinaire du Si est régulée et que l'apport de Si influence les plaques de croissance [61].
Des études faisant appel à des modèles cellulaires et/ou tissulaires ont éga-lement été mises de l’avant afin de démontrer le rôle du Si dans la formation seuse. Par exemple, des chercheurs ont démontré que la sécrétion de matrice os-seuse (polysaccharides et collagène) par des chondrocytes et des épiphyses de poulets cultivés dans un milieu enrichi en Si était augmentée et que l’activité de la prolyl hydroxylase, un enzyme qui est impliqué dans la synthèse du collagène, augmentait proportionnellement à la dose [62-65]. Ils ont aussi observé que l'addi-tion de Zéolite A (un aluminosilicate) à des ostéoblastes en culture stimule la proli-fération cellulaire, la production de phosphatase alcaline (PA), la synthèse de ma-trice extracellulaire et la synthèse d’ostéocalcine, alors que la supplémentation avec de l’AOS augmente la synthèse de collagène de type I et promeut la différen-tiation cellulaire. Fait intéressant, l’AOS augmente la quantité d’ARNm pour le col-lagène de type I, l’ALP et l’ostéocalcine, suggérant donc une régulation transcrip-tionnelle de certains gènes par le Si.
9 Malgré la quantité et la qualité des travaux disponibles le sujet, la nature de l’implication du Si dans la formation et la santé osseuse demeure élusive. Cepen-dant, les données cumulées à ce jour portent à croire que c'est le rôle que joue le Si dans la synthèse et le maintien du collagène qui lui confère son importance bio-logique. Notamment, il est démontré que des rats ayant eu une diète pauvre en Si cicatrisent moins bien que les contrôles [66]. Comme on retrouve le Si concentré et fortement lié à différentes composantes du tissu conjonctif (collagène, polyuro-nides, glycoaminoglycans) [67], il est probable qu'il joue aussi un rôle structurel.
1.1.2.3.3 Silicium et greffe (verres bioactifs)
Les rôles que l’on attribue au Si dans la formation et le maintien osseux sont difficilement mieux appréciés que dans le domaine des verres bioactifs. Inventés par le professeur Larry Hench en 1969 [68], ces composés polymériques à base de Si sont utilisés comme matrice régénératrice pour l’os dans une multitude de procédures médicales. En outre, ils permettent parfois d’éviter l’autogreffe os-seuse, une procédure souvent compliquée et incommodante pour le patient.
Les verres bioactifs doivent pouvoir lier fermement l’os afin d’assurer une bonne réparation et être biodégradables afin de préserver les propriétés initiales de l’os. Le premier composé d’intérêt mis au point par le Dr. Hench et son équipe contient, en ratio molaire, 46,1% de SiO2, 24,4% de Na2O, 26,9% de CaO et 2,6%
de P2O5 [69]. Baptisé Bioglass®45S5, ce composé, encore le plus utilisé en
cli-nique à ce jour, forme un lien si fort avec l’os qu’il est impossible de l’en détacher sans le casser. Plus d’un million de patients ont reçu une opération impliquant le Bioglass® sous une ou l’autre de ses formes depuis sa mise en marché [70].
La première utilisation clinique du Bioglass® remonte en fait à 1984. À l’époque, un patient ayant perdu l’ouïe suite à une infection a subi une chirurgie où ses osselets dégradés ont été remplacés par des prothèses en verre bioactif tail-lées sur mesure. Douze ans après la chirurgie, les résultats demeuraient très con-cluants [71]. Normalement, le métal ou le plastique était utilisé en guise de
pro-10
thèse, mais la formation de tissu fibreux autour des implants rendait souvent les résultats décevants après un certain temps. Des implants de Bioglass® furent éga-lement développées pour traiter d’autres conditions : ancrage pour des prothèses dentaires [72], corrections de fractures du plancher orbitaire [73], etc. Le verre bioactif a aussi été utilisé pour la guérison de bris osseux causés par des traumas et des tumorectomies. Dans de telles situations, où les os à réparer ne portent pas nécessairement de poids important, le Bioglass® (ou un autre composé similaire) est appliqué à l’instar d’une colle sous forme solide, granulée, gélifiée, en mousse ou en pâte au site voulu, par exemple à l’interface de deux segments espacés,. Il est également employé pour solidifier les os de la mâchoire, freiner la perte de dents [74], oblitérer des sinus crâniens [75], fusionner des vertèbres [76] et même pour des situations où un os de soutien est touché, comme dans le cas de frac-tures traumatiques du tibia [77]. Il est également utilisé dans certains dentifrices pour traiter l’hypersensibilité dentaire [78], et des études sont en cours afin de véri-fier son efficacité comme enduit pour recouvrir les parties métalliques de certaines prothèses [79, 80].
Il existe deux mécanismes par lesquels les verres bioactifs peuvent interve-nir positivement dans la régénération osseuse. Le premier concerne la formation d’une couche d’apatite hydroxycarbonate (HCA) à la surface du verre, et l’autre des produits de dissolution.
Pour ce qui est de la couche de HCA, celle-ci aurait pour effet de favoriser la liaison des fibres de collagène provenant de l’os à réparer et de faciliter la migra-tion des cellules ostéogéniques responsables de la formamigra-tion de la matrice os-seuse [81]. La formation de la couche de HCA est elle-même due à la dissolution du verre suite à son implantation et donc au changement de pH et de composition chimique dans son environnement immédiat [82].
Le second mécanisme implique justement ces produits de dissolution; non seulement constituent-ils une source abondante d’éléments nécessaires à la syn-thèse de matrice osseuse, mais ceux-ci ont également un effet stimulant sur les cellules ostéogéniques en favorisant leur croissance, leur différenciation et leur
11 production [83]. Par exemple, des études in vitro ont montré que des ostéoblastes humains mis en culture sur du verre bioactif produisent non seulement de la ma-trice extracellulaire (MEC), mais que cette dernière se transforme en nodules os-seux même en l’absence d’hormones ostéogéniques. Aussi, les produits de disso-lution stimulent la production de facteurs de croissance et de protéines de la MEC [84-86]. Par ailleurs, la culture d’ostéoblastes humains en présence de produits de dissolution amène une augmentation du niveau de calcium intracellulaire de même que la surexpression de sept familles de gènes, notamment IGF-II (« insulin-like growth factor type II ») qui est le facteur de croissance osseux le plus abondant [87-89].
Malgré le fait que ce soit les verres bioactifs qui offrent les meilleurs résul-tats en greffe osseuse à l’heure actuelle (hormis l’autogreffe), ces composés ne sont pas les plus utilisés, principalement à cause de considérations techniques et légales. Toutefois, les développements dans le domaine et l’apparition de nou-veaux composés hybrides [90] laissent présager un avenir florissant pour ces pro-duits. Quoi qu’il en soit, les avantages évidents que confèrent les verres bioactifs à base de Si à la régénération osseuse sont autant d’indications de l’importance po-tentielle de cet élément en physiologie animale.
1.1.2.3.4 Silicium et santé mentale
Comme mentionné précédemment, le Si protège la plante de certains mé-taux lourds. Des données montrent qu’il pourrait jouer un rôle similaire chez l’animal, plus spécifiquement avec l’Al.
D’abord, différentes études ont montré qu’il existerait un lien causal entre la quantité d’Al présente dans l’eau potable et le développement de la maladie d’Alzheimer (MA) [91-94], et que l’exposition occupationnelle à l’Al favoriserait le développement de troubles neurodégénératifs [95-97] . Chez des chats et des rats, la perfusion cérebelleuse d’Al favorise d’ailleurs la formation d’enchevêtrements
12
neurofibrillaires [98] et dans différents modèles in vivo et in vitro, l’Al favorise aussi la formation de plaques β-amyloïdes dans les neurones [99, 100].
Comme il existe une association chimique entre les formes de Si et d’Al re-trouvées à pH physiologique (AOS et Al(OH)4- ), des chercheurs ont tenté de savoir
si cette association pouvait être bénéfique chez l’animal comme chez la plante pour protéger contre l’accumulation de métaux lourds. Il s’avère ainsi que les sili-cates préviennent la toxicité de l’Al chez des poissons en milieu acide [101] et que la supplémentation orale en Si réduit l’absorption gastro-intestinale d’Al et en aug-mente l’excrétion urinaire chez l’humain [102, 103].
Face à ces évidences, certains groupes ont cherché à savoir s’il y avait ef-fectivement des corrélations entre les quantités de Si et d’Al présentes dans l’eau potable et l’incidence de problèmes neurologiques chez certaines populations. L’étude PAQUID, ayant pris place en France et réunissant 3777 patients âgés de 65 ans et plus, a permis de tirer plusieurs conclusions intéressantes sur le sujet. Ainsi, on a pu démontrer que la fonction cognitive des sujets était plus à risque dans des conditions où l’eau potable avait un faible pH, une concentration élevée en Al et une basse concentration de Si, alors qu’un effet protecteur était observé lorsque l’eau potable avait un haut pH et une concentration élevée en Si [104]. Une autre étude a montré que l’exposition à des concentrations élevées (> 0.1mg/L) d’Al dans l’eau augmente l’incidence de démences et que la quantité de Si pré-sente dans l’eau la diminue indépendamment de la concentration d’Al [105]. Ces tendances se sont d’ailleurs maintenues sur un suivi de 15 ans [106].
Diverses études animales ont également été effectuées afin de vérifier l’effet protecteur du Si face aux effets délétères de l’Al. Chez des rats soumis à des diètes variables en Si et Al, par exemple, il a été démontré qu’une faible quantité de Si favorisait l’accumulation d’Al dans différentes régions du cerveau, dont cer-taines sont reliées avec la MA, et qu’une quantité plus importante la prévenait [107]. Des effets similaires ont été observés dans d’autres tissus, soit le foie, l’os, la rate et le rein [108]. Parallèlement, des études ont montré que chez des souris auxquelles étaient administrées d’importantes doses d’Al, l’excrétion urinaire de
13 l’atome augmentait et son absorption digestive diminuait grâce à l’ingestion de bière commerciale; l’accumulation cérébrale était également atténuée [109, 110].
Encore ici, les mécanismes par lesquels le Si prévient la neurotoxicité de l’Al ne sont pas parfaitement définis. Bien qu’en théorie, l’AOS et l’Al(OH)4- s’associent
à pH 7.4, il n’est pas clairement démontré que cette réaction chimique puisse à elle seule expliquer le rôle protecteur du Si. Il s’agirait plutôt d’un système plus com-plexe, impliquant entre autres la réduction de l’absorption et l’augmentation de l’excrétion du métal lourd.
1.1.2.3.5 Silicium et santé tégumentaire
Comme le Si semble impliqué dans la formation et le maintien du collagène, il est logique de penser qu’il pourrait jouer un rôle dans d’autres structures que l’os. C’est dans cette optique que certains chercheurs ont voulu savoir si le Si participait à la physiologie tégumentaire, plus spécifiquement de la peau, des cheveux et des ongles, considérant que le Si s’accumule de manière importante dans ces tissus (1-10 ppm pour les ongles et les cheveux) [111, 112].
Une étude ayant comme sujet des femmes montrant des signes de photo-vieillissement a montré que l’administration de ch-AOS à raison de 10mg/jour sur une période de 20 semaines avait un effet positif sur la texture et l’élasticité de la peau, de même que sur la fragilité des ongles et des cheveux [113].
Le Lagon Bleu, près de Grindavik en Islande, est une source géothermale biotope dont l’eau et les boues sont supposément bénéfiques pour la santé cuta-née et le traitement de certains désordres tels que le psoriasis et la dermatite ato-pique [114, 115]. Des chercheurs ont voulu savoir si des extraits de boues riches en Si provenant du lagon, de même que des extraits provenant de deux types de diatomées s’y trouvant, avaient effectivement des vertus thérapeutiques. Ils ont démontré que ces extraits induisaient chez des kératinocytes humains l’expression d’involucrine, de loricrine, de transglutaminase-1 et de filaggrine qui sont des
mar-14
queurs de différentiation pour ce type cellulaire, contribuent à la formation de la barrière cutanée, et préviennent le développement de différentes dermatites [116]. Aussi, le traitement de peau humaine saine avec ces extraits amène une réponse génétique similaire à celle observée avec les cellules, en plus d’augmenter l’imperméabilité de la peau [117]. Une autre étude a évalué l’effet d’une supplé-mentation en ch-AOS de neuf mois chez des femmes aux cheveux fins, et a révélé qu’une telle intervention avait un effet positif sur l’élasticité et la résistance des cheveux [118].
1.2 Les transporteurs de Silicium
1.2.1 Découverte : Transporteurs de Si chez les diatomées
La première description d’un transporteur de Si a été faite par Hildebrand et
al. en 1997 [119]. Des travaux précédents sur les diatomées avaient déjà permis
de prévoir l’existence de tels systèmes de transport : les diatomées évoluant sou-vent dans des environnement où les concentrations de Si sont faibles (de l’ordre du µM) [120], elles maintiennent des réserves d’AOS non polymérisé [121] et ac-cumulent le Si selon des caractéristiques qui sont propres aux systèmes de trans-port facilité et qui varient selon le cycle cellulaire et la disponibilité du substrat [122].
À partir de clones d’ADNc précédemment identifiés comme étant régulés à la hausse par le Si chez Cynlindrotheca fusiformis [123], des chercheurs ont entre-pris de vérifier si ces clones étaient des transporteurs de Si. En exprimant le plus long d’entre eux (1662 pb) dans le système d’expression hétérologue de l’oocyte du Xenopus laevis, ils ont observé l’apparition d’un transport de Germanium 68 (68Ge) (un analogue du Si, utilisé comme traceur radioactif) affecté par la
concen-tration de Si dans le milieu, indiquant une compétitivité des deux ions pour le même site liaison. Ils ont aussi observé que l’activité de transport était dépendante
15 du sodium (Na) et était sensible au N-ethylmaleimide (NEM), un agent bloquant les groupements sulphydryls. Le transporteur a été baptisé SIT1 (« Silicon Transporter 1 »).
L’année suivante, la même équipe a fait état de la caractérisation de 5 autres transporteurs de Si (SIT2-6), toujours chez C. fusiformis [124]. Les six iso-formes comptent 12 segments transmembranaires (TM) putatifs fortement conser-vés (≥ 87%) et de longs segments C-terminaux hydrophiles plus variables (≤ 67%). Ils ont aussi des activités et expression variables. Des sondes spécifiques à chaque isoforme ont permis de repérer des homologues chez toutes les autres espèces de diatomées testées : Nitzschia spp., Navicula pelliculosa,
Phaeodacty-lum tricornutum, Thalassiosira weissflogii, Thalassiosira pseudonana (3 protéines)
[125], Synedra acus [126], Chaetoceros muelleri [127], Skeletonema costatum [128] de même que dans les algues chrysophytes Synura Petersenii et
Ochromo-nas ovalis [129].
1.2.2 Transporteurs de Si chez les plantes
Les premières études concernant les transporteurs de Si chez d’autres es-pèce que les diatomés ont été effectuées chez le riz d’Oryza sativa. Ma et al. ont d’abord recherché des plants mutants pauvres en Si et résistants au Ge. En effet, comme le Ge est analogue au Si, mais toxique pour la plante, il était logique de penser que l’absence de système de transport pour le Si protégerait la plante contre le Ge. Des analyses combinées de type SSR (« single sequence repeats ») et PCR ont ensuite permis d’identifier deux gènes mutés distincts, vraisemblable-ment impliqués dans le transport du Si. Les deux gènes sont maintenant connus en tant que OsLsi1 et 2 (« Low silicon 1 and 2 ») [130, 131]. Ils constituent à ce jour les transporteurs de Si les mieux caractérisés, tous organismes confondus, et sont des gènes de référence dans le domaine.
Le gène OsLsi1 code pour une protéine de 298 acides aminés (a.a.) faisant partie de la sous-famille des «NOD-26-like major intrinsic protein » (NIP) comprise
16
dans le groupe de protéines apparentées aux aquaporines (AQPs) végétales. Lsi1 utilise comme substrat l’AOS et est exprimé dans les racines des plantes, plus spécifiquement du côté basolatéral des cellules de l’exoderme et de l’endoderme. Son rôle premier est donc l’assimilation de l’AOS à partir du milieu afin de l’acheminer vers l’intérieur des cellules de l’exoderme, puis de l’aérenchyme vers l’intérieur des cellules de l’endoderme. La structure de la protéine comprend no-tamment six segments TM de même que deux motifs Asp-Pro-Ala (NPA), caracté-ristiques communes à pratiquement toutes les AQPs eucaryotes (voir section 3.2) [130, 132, 133]. Des homologues de OsLsi1 sont connus chez l’orge (HvLsi1) [134], le maïs (ZmLsi1) [135], la citrouille (CmLsi1) [136], le blé (TaLsi1) [137] et la prêle (EaLsi1) [138].
La protéine OsLsi2, contrairement à OsLsi1, est un effluxeur d’AOS. Elle est classée parmi les transporteurs d’anions putatifs, et sa structure ne présente pas d’homologie marquée avec OsLsi1, comptant en effet 472 a.a. et 11 TM présumés. OsLsi2 possède toutefois le même patron d’expression au sein de la plante, au détail près qu’il est exprimé du côté apical des cellules. Son activité est dépen-dante du gradient de protons et dans les racines du plant de riz, il agit de façon miroir avec OsLsi1, assurant le transport de l’AOS de l’intérieur de la cellule exo-dermique vers l’aérenchyme, et de la cellule endoexo-dermique vers la stèle, d’où il pourra être ensuite distribué à l’ensemble de la plante grâce au flot transpiratoire [131]. On retrouve chez le maïs (ZmLsi2) [139], l’orge (HvLsi2) [139] et la citrouille (CmLsi2-1 et 2)[140] des homologues de OsLsi2 remplissant essentiellement les mêmes rôles.
Plus récemment identifiée, la protéine OsLsi6 est quant à elle plus large-ment distribuée que les autres transporteurs de Si chez O. sativa. Outre la racine, on la retrouve également dans la gaine foliaire et dans le limbe, plus spécifique-ment dans les cellules parenchymateuses du xylème de même que dans les bour-geons axillaires. Sa structure est 77% homologue à celle de Lsi1 (il s’agit aussi d’un membre du sous-groupe des NIP), mais la protéine joue un rôle différent dans la distribution de l’AOS. Ainsi, alors qu’OsLsi1 et 2 sont responsables de
17 l’absorption et de l’acheminement vers la circulation, OsLsi6 permet plutôt de ré-absorber l’AOS du xylème de par son expression apicale et de le distribuer dans les feuilles [141]. Dans les bourgeons axillaires, le transporteur permettrait aussi le transfert d’AOS des larges faisceaux vasculaires provenant des racines aux fais-ceaux plus diffus se rendant aux panicules. À ce jour, on ne connait qu’un homo-logue chez l’orge (HvLsi6) [142], mais considérant la vaste quantité d’espèces de plantes dont les tiges et plantes sont silifiées, il est logique de penser que des pro-téines semblables puissent être retrouvées ailleurs dans le règne végétal.
1.3 Les Aquaporines mammaliennes
1.3.1 Découverte
La découverte de la première AQP est, encore à ce jour, teintée de contro-verse. Deux groupes de recherche s’en disputent la primauté aujourd’hui.
Officiellement, la caractérisation d’AQP1 a été faite par Peter Agre et al. en 1992 [143]. C’est en cherchant à identifier les antigènes Rhésus à partir de la membrane du globule rouge que ce groupe en serait venu par hasard [144] à la découverte d’une protéine de 28kD (alors baptisée CHIP28, « channel-like integral protein of 28kD »). Croyant d’abord à un produit de dégradation d’un des antigènes étudiés, les chercheurs ont vite constaté que la protéine en question n’était pas reconnue par un anticorps supposément spécifique et qu’elle était abondante dans une foule de tissus [145]. Plusieurs autres chercheurs soupçonnaient déjà l’existence d’un canal à eau, sans toutefois avoir réussi à l’identifier. D’après l’expression marquée de CHIP28 dans le néphron, l’hypothèse a été avancée qu’il pourrait s’agir de ce canal. Après l’isolation de l’ADNc correspondant, des épreuves fonctionnelles avec le système d’expression de Xenopus laevis ont con-firmé la fonction de la protéine [143]. Celle-ci a été rebaptisée AQP1 l’année sui-vante [146]. Ces travaux ont valu à Agre, conjointement avec Roderick McKinnon, le prix Nobel de chimie en 2003.
18
Gheorghe Benga affirme plutôt que c’est son équipe qui aurait pour la pre-mière fois identifié la protéine en 1986 [147, 148]. Ses intérêts de recherche con-cernaient le transport de l’eau dans les érythrocytes. C’est en effectuant des épreuves de marquage à l’aide du 203Hg-p-chloromercuribenzene-sulfonate (203
Hg-PCMBS), un inhibiteur réversible du transport de l’eau, que Benga aurait pour la première fois mis en évidence l’existence d’une protéine impliquée dans le trans-port de l’eau chez l’humain [147]. Des bandes diffuses de 35 à 60kD obtenues sur des gels d’autoradiographie après migration de membranes érythrocytaire mar-quées au 203Hg-PCMBS correspondent en fait à différents stades de glycosylation
de CHIP28 [148]. Ainsi, bien qu’il soit généralement convenu que la caractérisation de la première AQP ait effectivement été réalisée par Agre, la controverse réside dans le fait que ce dernier ne mentionne peu ou pas les travaux majeurs de Benga dans ses publications.
1.3.2 Caractéristiques 1.3.2.1 Généralités
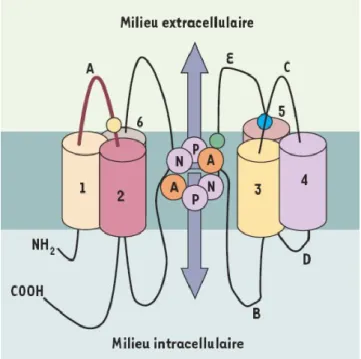
Treize aquaporines ont été identifiées chez l’humain. Elles se nomment AQP0 à AQP12 et partagent un certain nombre de caractéristiques communes.
Sur le plan structural, ce sont toutes des protéines membranaires de 28 à 30kD dans leur forme native, soit de 261 à 342 a.a. Elles possèdent 6 TM ayant tous une inclinaison d’environ 30° par rapport au plan de la membrane et reliés entre eux par 5 boucles (A à E). Leurs extrémités N- et C- terminales sont intracel-lulaires, et la séquence peptidique comprise entre le TM4 et l’extrémité C-terminale constitue en fait une répétition en tandem de la première partie [149, 150]. Les deux parties similaires, vraisemblablement issues de duplication génique, sont les hémipores 1 et 2 [151]. Ils se font face dans la membrane plasmique, et forment une structure tridimensionnelle rappelant un sablier. Les boucles entre les TM2 et 3 et les TM5 et 6 contiennent chacune un motif NPA. Dans la conformation tertiaire
19 d’une aquaporine, ces motifs imposent une constriction indispensable à la sélecti-vité du pore et l’exclusion des protons [152]. Ils sont conservés chez toutes les aquaporines humaines, exception faite des deux superaquaporines (AQP11 et AQP12) et d’AQP7.
Une autre structure, appelée filtre aromatique/Arginine (ar/R), est compo-sée de quatre a.a. : un premier (Phe dans la majorité des cas) est situé dans l’hélice 2, un autre, dans l’hélice 5 et les deux derniers (Gly et Arg sauf pour les superaquaporines), dans la boucle E. Cette structure impose une constriction plus étroite que la première, et sa composition variable serait en partie responsable de la capacité à transporter différents substrats. Elle contribuerait aussi à l’exclusion protonique de concert avec le filtre NPA [152-154]. Dans la membrane, les AQP s’associent pour former des homo-tétramères, ce qui serait indispensable pour le repliement, l’acheminement à la membrane et la stabilité des protéines. Néan-moins, chaque sous-unité est un canal entièrement fonctionnel [155].
Le mercure (Hg) est capable d’inhiber l’activité de transport d’eau de plu-sieurs AQPs [156]. Des études structurales d’AQP1 indiquent que la liaison du Hg avec la Cys189 entrainerait cette inhibition en menant à l’effondrement du pore [157]. La phlorétine, un composé phénolique traditionnellement utilisé pour bloquer l’absorption cellulaire de glucose, semble également inhiber l’activité de certaines AQPs mammaliennes [158, 159]. Le mécanisme de cette inhibition n’a toutefois pas été élucidé à ce jour.
20
Figure 1.3: Représentation schématique d’une aquaporine modèle. Les segments transmembranaires sont numérotés de 1 à 6, et les boucles intra- et extracellulaires sont identi-fiées par les lettres A à E. Modifié de [160]
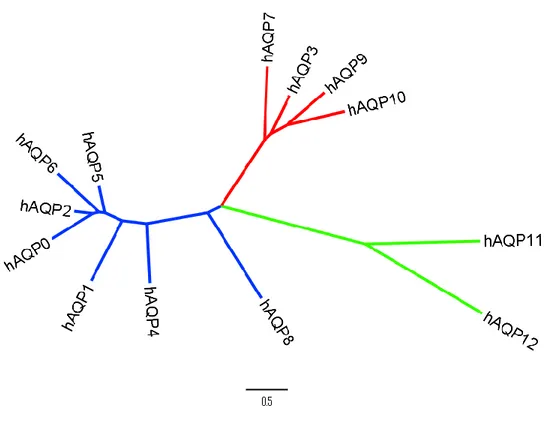
Malgré l’homologie structurale, les 13 aquaporines ont des propriétés fonc-tionnelles divergentes (voir figures 1-4 et 1-5) qui sont à la base de leur séparation en trois classes : les aquaporines dites « classiques » (ou orthodoxes) qui effec-tuent principalement le transport de l’eau, les aquaglycéroporines (AQGPs) qui transportent notamment le glycérol et d’autres solutés simples, et les supera-quaporines (ou asupera-quaporines non-orthodoxes) dont les rôles sont mal définis. Les différents membres de chacun de ces groupes seront abordés à la section sui-vante.
21 Figure 1.4: Arbre phylogénétique des différentes aquaporines humaines. Le groupe bleu re-présente les aquaporines classiques, le groupe rouge, les aquaglycéroporines et le groupe vert, les aquaporines non-orthodoxes. L’échelle est en distance génétique. Les séquences proviennent de UniProtKB [161]. Réalisé à l’aide du serveur DIVEIN [162] et du programme FigTree v.1.4.0 [163].
22
Figure 1.5 : Alignement des différentes aquaporines humaines. La coloration violette, selon son intensité, indique le degré de conservation d’un résidu. Les boîtes rouges encadrent les deux motifs NPA, et les flèches noires indiquent les résidus impliqués dans la formation du filtre ar/R. Les sé-quences proviennent de UniProtKB [161]. Réalisé avec le programme Unipro UGENE v.1.11.4 [164].
23 1.3.3 Aquaporines « classiques », ou orthodoxes
Tel que mentionné précédemment, les aquaporines « classiques » sont d’abord reconnues à leur capacité à transporter l’eau au travers des membranes. Elles sont impliquées notamment dans les phénomènes de sécrétion fluidique, d’osmose tissulaire, de migration cellulaire et de signalement neuronal [165]. Cer-taines d’entre elles sont également capables de transporter d’autres solutés. Les sous-sections suivantes sont consacrées à de brèves descriptions de chacune des différentes aquaporines « classiques ».
1.3.3.1 AQP0
Initialement connue sous le nom de MIP (« major intrinsic protein » ou « main intrinsic polypeptide » dépendant des auteurs), AQP0 est la toute première protéine de la famille à avoir été isolée. En effet, des études au courant des an-nées 70 l’avaient déjà identifiée comme étant la protéine membranaire la plus abondante du cristallin [166, 167]. Cependant, jusqu’à la caractérisation d’AQP1, son rôle en tant que transporteur d’eau n’avait pas été soupçonné. Ce n’est donc que beaucoup plus tard que, par homologie, MIP a été considérée comme faisant partie de la famille des aquaporines [146] et que son activité de transport de l’eau a été démontrée [168]. On lui a donc donné le nom AQP0 pour respecter l’ordre dans lequel les AQP ont été découvertes.
Sur le plan structural, AQP0 est une aquaporine classique conventionnelle avec un filtre ar/R identique à celui d’AQP1. L’homologie de séquence entre les deux protéines est cependant de seulement 43,5% [169]. Ceci ne semble toutefois pas affecter la capacité de transport de l’eau de la protéine, qui serait qualitative-ment comparable à celle d’AQP1, bien que quantitativequalitative-ment différente sur certains points [170].
AQP0 est exclusivement exprimé dans l’œil, dans la cornée et la rétine en plus du cristallin [171]. On lui attribue trois fonctions principales.
24
D’abord, il agit à titre de transporteur d’eau pour développer et maintenir la transparence du cristallin. À cet effet, des études ont démontré que l’expression d’AQP0 chez les souris en développement corrélait avec le degré de transparence [171], et que la disruption d’AQP0 menait à la formation de cataractes [172].
Ensuite, AQP0 agirait aussi comme molécule d’adhésion dans le cristallin et aurait ainsi des propriétés structurales. En outre, on sait que AQP0 est exprimée fortement dans les jonctions fines entre les fibres du cristallin [173] où elle subit une protéolyse de sa partie C-terminale [174]. D’après des analyses de microsco-pie électronique, cette forme écourtée de la protéine forme in vitro des structures cristallines à double couche semblables à celles dont sont constituées les jonctions fines entre les fibres. De telles structures ne se forment pas avec la protéine de pleine longueur. La protéolyse de la partie C-terminale aurait donc un effet positif sur les propriétés adhésives d’AQP0 [175, 176].
Enfin, la protéine semble non seulement assurer la cohésion des fibres entre-elles, mais elle agirait également en formant des liens avec d’autres molé-cules au sein même de la fibre. Citons parmi ses partenaires les connexines, cons-tituants majeurs des jonctions communicantes [177], la filensine et la phakinine, des éléments cytosquelettiques uniques au fibres du cristallin [178], de même que les cristallines, des protéines responsables des propriétés réfractrices du cristallin [178].
1.3.3.2 AQP1
AQP1 est l’archétype des aquaporines classiques chez les mammifères. Elle est la plus largement distribuée des AQPs, et possiblement celle ayant les rôles physiologiques les plus variés [156]. Elle est aussi la plus étudiée et la mieux caractérisée parmi les membres de la famille.
D’une longueur de 269 a.a., AQP1 respecte en tous points la structure dé-crite à la section 3.2.1. Un modèle hydropathique de la protéine est présenté à la
25 Figure 5-1A. Son filtre ar/R, de séquence F-G-G-R, est reproduit chez toutes les autres AQP orthodoxes, exception faite d’AQP8. C’est l’élucidation de sa structure tridimensionnelle par des études de cristallographie qui a permis d’apprécier l’assemblage tétramérique typique des AQPs et d’identifier plusieurs résidus-clés dans la sélectivité et la régulation du pore [152, 179]. La protéine existe sous forme glycosylée (Asn42, dans la boucle C); cette modification ne semble toutefois pas importante pour son activité [180].
AQP1 est un transporteur d’eau efficace. Lorsqu’injecté dans les oocytes de
Xenopus laevis, l’ARNc de AQP1 les rend 10 fois plus perméables à l’eau, un
phé-nomène qui est inhibé en présence de Hg [143]. Outre l’eau, AQP1 aurait aussi la capacité de transporter le CO2 et l’oxyde nitreux (NO) [181, 182].
Protéine majoritairement endothéliale, AQP1 est quasi-ubiquitaire. De fait, il est beaucoup plus simple de mentionner les tissus desquels elle est absente que l’inverse. Ainsi, chez l’humain, elle n’est pas exprimée dans l’ovaire, le tissu adi-peux du sein et les tubules séminifères. Par contre, les tissus où l’expression est la plus marquée sont le plexus choroïde, le cortex rénal, le pancréas et la vésicule biliaire [183].
De par sa distribution, AQP1 remplit une foule de rôles physiologiques. Parmi les plus importants, on peut mentionner la concentration de l’urine; AQP1 serait en effet responsable de 75% de la réabsorption de l’eau par le rein [184]. Dans le système nerveux central, elle participerait à la formation du liquide céré-bro-spinal [185] et dans le système nerveux périphérique, à la nociception [186]. AQP1 serait aussi importante pour l’œil en maintenant la transparence de la cor-née et la pression intraoculaire [187, 188]. Elle agit aussi dans la sécrétion et l’absorption de la bile par les cholangiocytes et les cellules épithéliales de la vési-cule biliaire [189, 190] et dans celles des liquides appartenant aux systèmes re-producteurs masculins et féminins [191] et à l’oreille interne [192].
Des rôles physiologiques indirects seraient également attribués à AQP1. comme d’influer sur la migration cellulaire et l’angiogénèse [193]. Pour le globule
26
rouge, de tels rôles correspondraient à la capacité de favoriser l’oscillation caracté-ristique de la membrane plasmique nécessaire au déplacement de la cellule dans les capillaires et de favoriser le déplacement rapide des molécules d’eau lors de l’accumulation d’autres solutés (Cl-,HCO3-, glucose) [194].
Les souris « knockout » (KO) pour AQP1 permettent d’appuyer les hypo-thèses concernant certains des rôles énumérés ci-avant. Ainsi, la souris AQP1-/- souffre de polyurie [184], a des problèmes de perception nerveuse périphérique [186], a une pression oculaire diminuée [195] et une angiogénèse tumorale défi-ciente [193]. De façon générale, toutefois, ces animaux ne sont pas incapacités de façon majeure. Tout porte à croire que l’organisme dispose donc de mécanismes compensateurs. Par ailleurs, il existe de rares cas où AQP1 n’est pas exprimé chez l’humain, mais les individus atteints ne présentent pas de phénotype majeur, si ce n’est une plus grande susceptibilité à la déshydratation provenant d’un défaut de concentration urinaire [196].
1.3.3.3 AQP2
Abondante dans le rein où elle est exprimée sur la membrane apicale des cellules principales du tubule collecteur, AQP2 est également retrouvée dans l’oreille interne et le système reproducteur masculin [197-199]. Partageant 42% d’homologie avec AQP1, elle possède la structure classique des AQPs ortho-doxes. Toutefois, la structure en sablier est un peu altérée par la contribution sup-plémentaire des boucles C et D à la formation du pore [200]. Sa fonction de trans-port d’eau est comparable à celle d’AQP1, et on ne lui connait pas d’autre substrat à ce jour [201]. À l’instar de plusieurs autres AQPs, AQP2 est aussi inhibée par le Hg.
La fonction principale d’AQP2 est la concentration de l’urine. Dans les tu-bules collecteurs, elle assure ainsi la réabsorption de l’eau sous l’effet de la vaso-pressine. C’est en réponse à une hyperosmolalité sérique ou à une baisse du
vo-27 lume circulant que cette hormone est relâchée par l’hypophyse et va agir sur le récepteur (V2R) à la membrane basale des cellules du tubule collecteur pour in-duire une translocation d’AQP2 des vésicules subapicales vers la membrane plasmique [202]. Des mutations dans le gène codant pour AQP2 chez l’homme et la souris mènent d’ailleurs à un diabète insipide néphrogénique [203].
Une autre fonction d’AQP2 pourrait être d’assurer l’homéostasie de l’endolymphe de l’oreille interne, son expression étant augmentée dans la maladie de Ménière [198, 204]. Sa présence dans différents organes du système reproduc-teur masculin laisse également présager une implication dans la maturation ou la capacitation du spermatozoïde [199].
1.3.3.4 AQP4
Bien qu’on l’ait retrouvé dans les muqueuses nasales, le tractus gastrointes-tinal, le rein, le muscle squelettique et une foule d’autre tissus, AQP4 est essentiel-lement une protéine du SNC [205-207]. Structurelessentiel-lement et fonctionnelessentiel-lement, AQP4 correspond au modèle classique d’une AQP orthodoxe. Fait intéressant, six variantes d’épissage différentes ont été identifiées dans le cerveau, dont trois sont fonctionnelles (M1, M23 et Mz). Ces trois variantes sont exprimées aux mêmes endroits, mais ont des perméabilités et des caractéristiques fonctionnelles légère-ment différentes, ce qui pourrait permettre une fine régulation du transport de l’eau dans les tissus du SNC. Les variantes qui n’agissent pas en tant que transporteurs d’eau semblent impliquées dans la localisation cellulaire et l’assemblage d’AQP4 en réseaux de tétramères [208, 209].De manière plus spécifique, mentionnons que la protéine est exprimée abondamment dans la membrane plasmique des astro-cytes, avec une concentration marquée aux extrémités des prolongements cyto-plasmiques, surtout lorsque ceux-ci se trouvent à proximité d’une synapse neuro-nal ou d’un capillaire [210].
28
Le rôle principal d’AQP4 est la régulation du volume cellulaire astrocytaire face aux variations osmolaires autant en situation normale qu’en réponse au trau-ma. Il a par exemple été démontré que d’importantes variations dans l’expression d’AQP4 surviennent en cas d’œdème cérébral ou de traumatisme crânien [211, 212]. AQP4 serait également impliquée dans d’autres mécanismes physiologiques du SNC, comme la migration et la cicatrisation astrocytaire [213], la formation tu-morale [214] et l’épilepsie [215].
Le comportement de souris AQP4-/- illustre l’importance de cette protéine
dans le fonctionnement. Par exemple, ces souris ont une accumulation d’eau intra-crânienne ralentie en cas d’œdème cytotoxique, mais accélérée dans le cas d’un œdème vasogénique ou d’un hydrocéphale [216-218]. De même, elles présentent une plus grande susceptibilité aux crises épileptiques, et sont sujettes à des dé-sordres auditifs, olfactifs et visuels [215, 219-221].
1.3.3.5 AQP5
L’AQP5 est souvent définie par son association avec les glandes exocrines, même si sa distribution n’y est pas restreinte. Elle est abondante dans les glandes salivaires, lacrymales et sudoripares, de même que dans l’épithélium respiratoire, la cochlée et la cornée [222-225]. Elle est retrouvée à la membrane plasmique, de façon asymétrique dans les cellules polarisées, avec une concentration beaucoup plus forte du côté apical [226]. Son activité de transport de l’eau est comparable à celle d’AQP1 [227] et on ne lui connait pas d’autres substrats. Sa structure est si-milaire à celles des autres AQP orthodoxes.
Dans les glandes salivaires, AQP4 assure le passage transépithélial de l’eau depuis la lumière de l’acinus et serait impliquée dans la salivation stimulée [228]. Dans les yeux, elle serait importante dans la production de larmes et l’hydratation de la cornée. [223, 229]. Elle contribuerait également à la sudation. [229]. Dans le système respiratoire, elle participerait au maintien du taux