Mécanismes cellulaires et moléculaires régulés par
SLITRK2 et SLITRK5 dans la formation des circuits
dopaminergiques du mésencéphale
Mémoire
Julien Charest
Maîtrise en neurobiologie
Maître ès sciences (M.Sc.)
Québec, Canada
© Julien Charest, 2016
Résumé
Les neurones dopaminergiques du mésencéphale (mDA) sont impliqués dans une variété de fonctions clefs du système nerveux central, incluant le mouvement volontaire, les processus affectifs, la récompense, l’attention, la mémoire de travail et l’apprentissage. La spécification des neurones mDA, de même que l’établissement des circuits dopaminergiques, sont finement régulés au cours du développement et requièrent l’activation spatiotemporelle complexe de facteurs de transcription et de leurs gènes cibles. La dégénérescence ou une perturbation de l’activité des neurones mDA peut mener au développement de troubles neurodégénératifs ou neuropsychiatriques graves, tels la maladie de Parkinson (PD), la schizophrénie (SCZ) et les troubles du spectre obsessif compulsif (OCD).
Les facteurs de transcriptions Lmx1a et Lmx1b sont des déterminants précoces de la destinée dopaminergique, essentiels à la différenciation et à la spécification des neurones mDA. Des polymorphismes de LMX1A/B ont précédemment été associés à la SCZ et aux troubles du spectre OCD. Parmi les gènes développementaux sous le contrôle transcriptionnel de Lmx1a/b, nous avons identifié deux membres de la famille Slit et Trk (Slitrk), Slitrk2 et Slitrk5, comme contrôlant la formation des synapses excitatrices et inhibitrices afférentes aux neurones mDA. Des mutations de SLITRK2 et
SLITRK5 furent également associées au développement de divers désordres neuropsychiatriques.
Nous présentons ici le rôle de Lmx1a/b dans la régulation de l’activité électrophysiologique des neurones mDA, par leur régulation transcriptionnelle de Slitrk2 et Slitrk5. En utilisant un modèle de culture primaire de neurones mDA, nous avons identifié un rôle de Slitrk2 et de Slitrk5 dans la régulation postsynaptique de la synaptogénèse excitatrice et inhibitrice, respectivement. La perturbation de l’activité électrique des neurones mDA résultant de la perte ou du gain de fonction de
Slitrk2/5 pourrait possiblement résulter en une perturbation de la libération de la dopamine aux noyaux
cibles des neurones mDA, menant ainsi au développement de comportements pathologiques associés aux troubles neuropsychiatriques humains.
Abstract
Mesodiencephalic dopaminergic (mDA) neurons regulate key functions of the mammalian central nervous system, including voluntary movement, affection, reward, attention, working memory and learning. The specification of mDA neurons and dopaminergic circuitry’s establishment are finely regulated during development and require specific and complex spatial and temporal activation of transcription factors and target genes. The degeneration of mDA pathways or their dysfunction can lead to severe neurodegenerative or neuropsychiatric disorders, including Parkinson’s disease (PD), schizophrenia (SCZ) and obsessive-compulsive disorder (OCD).
Lmx1a and Lmx1b transcription factors are early determinants of the dopaminergic fate, essential to mDA neurons differentiation and specification. Polymorphisms of LMX1A/B were previously linked to SCZ and OCD. Within the transcriptional targets of Lmx1a/b, we identified to members of the Slit and Trk (Slitrk) family, Slitrk2 and Slitrk5, controlling excitatory and inhibitory afferent synapses formation of mDA neurons. Mutations of SLITRK2 and SLITRK5 were also previously linked to various neuropsychiatric diseases.
We here present the role of Lmx1a/b in the regulation of the electrophysiological activity of mDA neurons, by their transcriptional regulation of Slitrk2 and Slitrk5. Using a mDA neurons’ primary cell culture paradigm, we identified a role of Slitrk2 and Slitrk5 in the post-synaptic regulation of excitatory and inhibitory synaptogenesis, respectively. The perturbation of mDA neurons’ electrophysiological activity, resulting from Slitrk2/5 loss or gain of function could lead to an alteration in dopamine release to mDA neurons target nuclei, and thus to the development of pathological behaviours associated with human neuropsychiatric diseases.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... xi
Liste des abréviations ... xiii
Remerciements ... xxi
Introduction ... 1
Introduction générale... 1
Circuits dopaminergiques du mésencéphale ... 3
Les noyaux dopaminergiques du mésencéphale ... 4
La dopamine ... 6
Formation des circuits dopaminergiques du mésencéphale ... 14
Mise en place précoce du mésencéphale ventral ... 15
Régulation transcriptionnelle de l’identité des progéniteurs neuronaux dopaminergiques... 17
Neurogénèse des neurones dopaminergiques du mésencéphale ... 18
Migration des neurones dopaminergiques du mésencéphale ... 20
Différenciation et survie des neurones dopaminergiques du mésencéphale ... 21
Croissance et guidage des axones dopaminergiques du mésencéphale ... 24
Synaptogénèse ... 26
Dysfonction dopaminergique et troubles neuropsychiatriques ... 32
La schizophrénie ... 32
Le trouble bipolaire ... 34
La dépression ... 35
Le trouble déficitaire de l’attention avec hyperactivité ... 36
La dépendance et l’abus de drogues ... 36
Le trouble obsessif compulsif ... 38
Le Syndrome Gilles de la Tourette... 39
La trichotillomanie ... 40
Les désordres du spectre autistique ... 41
La maladie de Parkinson ... 41
Les facteurs de transcription Lmx1a et Lmx1b ... 42
Lmx1a/b dans la formation des circuits dopaminergiques ... 44
Rôles de Lmx1a/b dans le maintien de l’homéostasie neuronale chez l’adulte ... 46
Implications de Lmx1a/b dans les troubles neurodéveloppementaux et maladies neurodégénératives ... 47
La famille de protéines Slitrk ... 48
Organisation génomique ... 49
Structure protéique ... 52
Fonctions des protéines Slitrks dans le système nerveux central ... 54
Protéines Slitrks et troubles neuropsychiatriques ... 56
Participation ... 61
Matériel et méthodes ... 63
Animaux ... 63
Souris DatCre/+Lmx1aF/FLmx1bF/F ... 63
Souris Pitx3-eGFP ... 63
Constructions d’ADN ... 64
Culture primaire de neurones mDA ... 64
Transfection transitoire ... 65
Analyse de PCR quantitative en temps réel ... 65
Immunofluorescence ... 66
Analyses de complexité dendritique ... 66
Analyses de densités de marqueurs synaptiques ... 67
Enregistrements électrophysiologiques ... 67
Analyses statistiques ... 68
Résultats ... 69
La perte d’expression de Lmx1a/b influence l’activité électrophysiologique et la morphologie des neurones mDA... 69
Lmx1a/b régulent l’expression de Slitrk2 et Slitrk5 dans les neurones mDA ... 70
La perte et le gain de fonction de Slitrk2 influencent l’arborisation dendritique des neurones mDA in vitro ... 71
La perte et le gain de fonction de Slitrk5 influencent l’arborisation dendritique des neurones mDA in vitro ... 73
Slitrk2 régule la formation des synapses excitatrices et l’activité électrophysiologique des neurones mDA in vitro ... 74
Slitrk5 régule la formation des synapses inhibitrices et l’activité électrophysiologique des neurones mDA in vitro ... 77
Discussion ... 81
Slitrk2 régule la formation des synapses excitatrices afférentes aux neurones mDA ... 81
Slitrk5 régule la formation des synapses inhibitrices afférentes aux neurones mDA ... 83
Lmx1a/b régulent l’expression de Slitrk2/5 et l’activité électrophysiologique des neurones mDA ... 84
Implication de Lmx1a/b et Slitrk2/5 dans le développement de troubles neuropsychiatriques ... 85
Conclusion et perspectives ... 89
Liste des tableaux
Tableau 1 Résumé des associations génétiques entre les gènes de la famille SLITRK et les
Liste des figures
Figure 1 Distribution des noyaux dopaminergiques dans le cerveau du rongeur en développement et
adulte………. 4
Figure 2 Origine des projections mésostriatales, mésolimbiques et mésocorticales chez le rat…… 5
Figure 3 Biosynthèse et dégradation de la dopamine………... 8
Figure 4 Métabolisme neuronal de la dopamine………. 9
Figure 5 Réseaux signalétiques régulés par les récepteurs dopaminergiques de classe D1…….... 11
Figure 6 Réseaux signalétiques régulés par les récepteurs dopaminergiques de classe D2……...12
Figure 7 Signalisation précoce et tardive des récepteurs dopaminergiques au cours de la neurotransmission lente……….. 14
Figure 8 Facteurs moléculaires impliqués dans le développement des neurones dopaminergiques du mésencéphale ventral………. 16
Figure 9 Expression génétique dans la lignée des neurones dopaminergiques………... 21
Figure 10 Schématisation des protéines présente dans la zone active présynaptique………. 27
Figure 11 Voies de signalisation impliquées dans la régulation de la synaptogénèse chez le vertébré ……… 28
Figure 12 Interactions moléculaires synaptiques impliquant neuroligin/neurexin……….. 29
Figure 13 Connectivité des neurones de la VTA associés au circuit de la récompense………. 33
Figure 14 La circuiterie cortico-striato-thalamo-corticale………. 39
Figure 15 Fonctions de Lmx1a et de Lmx1b dans les neurones dopaminergiques en développement et matures……….. 46
Figure 16 Expression de l’ARNm des membres de la famille Slitrk dans le cerveau en développement ……….... 50
Figure 17 Structure protéique de membres de la famille Slitrk……….. 53
Figure 18 La perte d’expression de Lmx1a/b dans les neurones mDA entraîne une diminution de la fréquence des mEPSCs……….. 69
Figure 19 La perte d’expression de Lmx1a/b entraîne une diminution de l’arborisation dendritique des neurones mDA………. 71
Figure 20 Lmx1a et Lmx1b régulent l’expression de Slitrk2 et Slitrk5 dans les neurones mDA……...72
Figure 21 La perte et le gain de fonction de Slitrk2 influencent l’arborisation dendritique des neurones mDA in vitro……….. 73
Figure 22 La perte et le gain de fonction de Slitrk5 influencent l’arborisation dendritique des neurones mDA in vitro……….. 74
Figure 23 Slitrk2 régule la formation des synapses excitatrices et l’activité électrophysiologique des neurones mDA in vitro……… 76
Figure 24 Slitrk5 régule la formation des synapses inhibitrices et l’activité électrophysiologique des neurones mDA in vitro……… 78
Liste des abréviations
βARR β-arrestin3’-UTR région 3’ non-traduite (3’ untranslated region)
5-HT sérotonine (5-hydroxytryptamine; 3-(2-aminoethyl)-1H-indol-5-ol)
A/P antéro-postérieur
AADC acide aminé aromatique décarboxylase (aromatic amino acid decarboxylase)
AC adénylyle cyclase
ACC cortex cingulaire antérieur (anterior cingular cortex)
AD adrénaline ((R)-4-(1-hydroxy-2-(methylamino)ethyl)benzene-1,2-diol) ADH alcool déshydrogénase
ADHD trouble déficitaire de l’attention avec hyperactivité (attention deficit hyperactivity disorder) ADNc ADN complémentaire
ALDH aldéhyde déshydrogénase
AM noyau antéromédian
AMPA α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid AMPc adénosine monophosphate cyclique
ASD désordre du spectre autistique (autistic spectrum disorder) BD trouble bipolaire (bipolar disorder)
BDNF brain-derived neurotrophic factor
BH4 tetrahydrobiopterine
bHLH motif de base hélice-boucle-hélice (basic helix-loop-helix)
CA catécholaminergique
CAM molécule d’adhésion cellulaire (cellular adhesion molecule)
Cck cholecystokinin
Cdkn cyclin-dependent kinase inhibitor
CM noyau centromédian
CNS système nerveux central (central nervous system) COMT catéchol o-méthyl transférase
CREB cAMP response element-binding protein CSTC cortico-striato-thalamo-cortical
Cxcr C-X-C motif chemokine receptor
Cyp2D cytochrome p450 2D
D/V dorso-ventral
DA dopamine (4-(2-aminoethyl)benzene-1,2-diol)
DAG diacylglycérol
DARPP-32 32-kDa dopamine and cAMP-regulated phosphoprotein
DAT dopamine transporter
DCC deleted in colorectal cancer
DKK1 dickkopf1
DIV jour in vitro (day in vitro) dLG noyau genouillé dorsolatéral
DLS septum dorsolatéral (dorsolateral septum) DOPAL 3,4-dihydroxyohenylacetaldehyde
DOPET 3,4-dihydrophenylethanol
DR récepteur dopaminergique (dopamine receptor) E jour embryonnaire (embryonic day)
EN engrailed
Eph ephrin
FP plaque du plancher (floor plate)
GABA acide γ-aminobutyrique (γ-aminobutyric acid; 4-aminobutanoic acid) GCL couche granulaire (granular cell layer)
GDP guanosine diphosphate
GIRK2 G-protein-regulated inward-rectifier potassium channel 2
GL couche glomérulaire (glomerular layer) GTP guanosine triphosphate
GTS syndrome Gilles de la Tourette (Gilles de la Tourette’s syndrome) GPCR récepteur couplé à une protéine G (G-protein coupled receptor)
GPe globus pallidus externe
GPi globus pallidus interne
GSK glycogen synthase kinase
GNDF glia cell derived neurotrophic factor
HVA acide homovanilique (homovanilic acid)
IP3 inositol triphosphate
IsO organisateur d’isthmus (isthmus organizer) IZ zone intermédiaire (intermediate zone)
L-DOPA L-dihydroxyphenylalanine
LAR-RPTP leukocyte common antigen-related receptor protein tyrosine phosphatase
LD noyau latérodorsal
LEFTY1 left-right determination factor 1
Lge éminence ganglionnaire latérale (lateral ganglionic eminence) Lhx LIM à homéodomaine (LIM homeobox)
LMX facteur de transcription LIM à homéodomaine (LIM Homebox Transcription Factor) LP noyau latéropostérieur
LRP low density lipoprotein receptor-related protein
LRR répétitions riches en leucine (leucine-rich repeat) LRRTM leucine-riche repeat transmembrane proteins
MA monoamine
MAO monoamine oxydase
MASH1 mouse achaete-schute homolog 1
MCL couche des cellules mitrales (mitral cell layer)
mDA dopaminergique du mésencéphale (mesodiencephalic dopaminergic)
mEPSC courants miniatures excitateurs post-synaptiques (miniature excitatory postsynaptic current) MFB fascicule médian télencéphalique (medial forebrain bundle)
Mge éminence ganglionnaire médiale (medial ganglionic eminence) miARN micro ARN
mIPSC courants miniatures inhibituers post-synaptiques (miniature inhibitory postsynaptic current) MPTP 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine
MSN neurones moyens épineux (medium spiny neurons) MZ zone du manteau (mantle zone)
NAD noradrénaline
Nb neuroblaste
NGF nerve growth factor
NMDA N-Methyl-D-aspartic acid ((2R)-2-(Methylamino)butanedioic acid)
NOG noggin
NP précurseur neuronal (neuronal precursor)
Ntn netrin
Nrlg neuroligin
OCD trouble obsessif compulsif (obsessive-compulsive disorder) OFC cortex orbitofrontal (orbitofrontal cortex)
ONL couche des nerfs olfactifs (olfactory nerve layer) OV ventricule olfactif (olfactory ventricule)
p prosomère
P jour postnatal (postnatal day)
PBS tampon phosphate salin (phosphate buffer saline) PD maladie de Parkison (Parkinson’s disease) PF noyau parafasciculaire
PFA paraformaldehyde
PFC cortex préfrontal (prefrontal cortex)
PKA protéine kinase A
PKC protéine kinase C
PLC phospholipase C
Po complexe postérieur
PP protein phosphatase
PSF polypyrimidine tract binding protein associated splicing factor
PSPC paraspeckle-associated paraspeckles component
PT noyau paraténial
PTP protein tyrosine phosphatase
PV noyau paraventriculaire (paraventricular nuclei)
RELN reelin
RG glie radiale (radial glia)
RRF aire rétrorubrale (retrorubral field) RM migration radiale (radial migration)
SCZ schizophrénie
SHH sonic hedgehog
SLITRK Slit et Trk (Slit and Trk)
SNc substance noire compacte (substantia nigra pars compacta) SNl substance noire latérale (substantia nigra lateralis)
SNP small nucleotide polymorphisms
SNr substance noire réticulée (substantia nigra pars reticulata)
SNRI inhibiteur de la recapture de la sérotonine et de la noradrénaline (serotonin and
noradrenaline reuptake inhibitor)
SSRI inhibiteur sélectif de la recapture de la sérotonine (selective serotonin reuptake inhibitor) STN noyau sous-thalamique (subthalamic nuclei)
SynCAM molécule d’adhésion cellulaire synaptique (synaptic cellular adhesion molecule) TG ganglion trigéminal (trigeminal ganglia)
TH tyrosine hydroxylase
TM migration tangentielle (tangential migration) TTM trichotillomanie
TTX tetrodotoxin
Trk tropomyosin-related kinase
VGAT vesicular GABA transporter
VGLUT vesicular glutamate transporter
VL noyau ventrolatéral
VM mésencéphale ventral (ventral mesencephalon)
VMH noyau hypothalamique ventromédian (ventromedian hypothalamic nuclei) VP noyau ventropostérieur
VTA aire tegmentale ventral (ventral tegmental area) VZ zone ventriculaire (ventricular zone)
Neuroscience is by far the most exciting
branch of science because the brain is the
most fascinating object in the universe. Every
human brain is different – the brain makes
each human unique and defines who he or
she is.
Remerciements
C’est avec émotions que se termine la première étape de mes études graduées, durant laquelle, en deux relativement très courtes années, j’aurai grandi, vieilli, maturé et appris plus que je ne l’aurais cru possible. La maîtrise fut pour moi beaucoup plus qu’un diplôme; ce fut ma première réelle opportunité d’accomplir quelque chose dépassant ma propre existence et de réaliser que rien n’est impossible avec beaucoup de volonté et de café. La maîtrise c’est apprendre que tout est loin d’être écrit dans les livres, apprendre à penser toujours plus grand, se péter la gueule et recommencer. Parce que la Science, c’est beau. La maîtrise c’est aussi accepter ses propres limites et les repousser, mais c’est aussi beaucoup plus que quelques affiches, un séminaire, un mémoire et des articles; c’est se façonner sa place dans l’Univers et aider à en démystifier les rouages, une protéine à la fois.
Et j’aurais très difficilement pu y arriver sans le soutien d’une équipe incroyablement soudée. Merci à HDB. Je n’ai pas vraiment de mots français en tête pour décrire à quel point tu es « super awesome ». Tu es plus qu’un modèle, et plus que concernant la Science. Quand tu auras enfin ton propre laboratoire, fais-moi signe. Les choses vont s’y passer, je n’en ai aucun doute, et je serais très triste de manquer ça. Merci à Guigui. Les Sholls nous auront rendus fous, ensemble, mais je crois qu’on s’en est relativement bien tiré. Avec quelques subtiles séquelles. Tu seras toujours le bienvenu chez moi pour des tapas et une 50 tablette. Merci à Audrey. Obrigado a Marcos. Sempre boa companhia, o laboratório e fora. Estou convencido de que vamos nos encontrar novamente. Merci à Cléo. Quand tu sors de ton repaire de physiciens, c’est toujours mémorable, surtout après quelques bières. Sois heureux! Merci Axelle. Tu es le seul soleil qui ne me brule pas les yeux le matin. Le monde à besoin de toi et de ta joie de vivre. Libère l’afro! Je te promets que j’irai te visiter en France un jour, si tu y retournes. Merci Charleen. Pas seulement pour avoir patché mes splendides cultures, semaine après semaine. Bonne fin de doctorat! Shukraan lk Sarah! Malheureusement, mon arabe tunisien n’est pas propice à un remerciement de mémoire, en grande partie par ta faute… Mais tu sais que tu seras toujours la bienvenue chez moi et que c’est loin d’être un au revoir. Nurakim qaribaan, fatat jamila. Merci Clathrine. Collègue, colocataire, amie. Il fallait le faire, s’endurer 24/7 et s’aimer encore. Il fallait aussi le faire, ramasser toutes les maudites étoiles de tous les maudits jeux de Mario Bros pour débloquer des niveaux bonis pas faisables, réfléchir au non-sens de la vie, et mettre nos cerveaux à off quand ça sentait trop le cramé. On aura pas mal tout fait ensemble… J’aurai toujours une bonne bouteille de scotch pour toi. Et… « We’ll always have Amsterdam ». Merci aussi aux nombreux stagiaires qui laissent leurs marques, même s’ils ne restent pas longtemps. Loris, Aurélie, Gaëlle, Camille, Jean-David, Alicia, Babujhi, Ophélie, Catherine, Franky Boy et Myriam. Merci. Vous nous aidez plus que vous ne le pensez. Et maintenant vous pouvez m’appeler « Maître » en toute légitimité.
Dans les bons et les moins bons moments, resteront toujours les vrais amis. Et en mon cours passage au CRIUSMQ, j’aurai appris à connaitre de nombreux jeunes scientifiques extraordinaires, avec lesquels je partagerai toujours quelque chose d’exceptionnel, peu importe leurs origines, peu importe s’ils se transforment en Hulk durant une partie de Munchkins, peu importe s’ils diluent leur whiskey, peu importe s’ils prétendent ne pas parler français quand on sait très bien qu’ils écoutent et comprennent tout… Parce que la Science, c’est loin d’être toujours facile. Et aussi parce que théoriquement l’alcool est une solution. Alors à Yanina, Louis, Kapil, Sarah, Melina, Tush, Charles-Étienne, Simon, Cédric, Isabel, Amalia, Damon, Terry, Alicja, Karen, Archana, Valérie et Arthur… Merci!, Thanks!, благодаря!, Dhanyavaad!, Ευχαριστώ!, ¡Gracias!, Vielen Dank!, Dzięki! et Shnorhakalut’yun!
Un merci tout spécial à Véronique. Premièrement, merci pour chaque jour où tu empêches le labo d’exploser. Merci aussi pour tout ce que tu fais pour tout le monde tout le temps. Merci surtout pour tout ce que tu fais pour tout le monde tout le temps sans que personne ne le sache. Tu es (littéralement) toujours là. Tout le temps. Tu sais tout, tu as une réponse pour tout. Tu gères tout. Tu es extraordinaire. Tu mérites plus qu’un mini paragraphe dans une section de remerciements dans un mémoire de maîtrise, mais je sais que tu me dirais de ne pas trop exagérer. Merci.
Et le meilleur pour la fin… Merci à Martin, mon père de Science, qui a cru en moi quand je n’étais qu’un tout petit stagiaire d’été en plein milieu de baccalauréat et qui a continué de croire en moi jusqu’à la fin de la maîtrise, et possiblement un peu après. Je n’en serais pas où j’en suis aujourd’hui dans la vie sans ton support, tes «AWÈYES! » et toutes les opportunités que tu m’as offertes. Partir du labo pour le Ph. D. n’a pas été une décision facile, mais travailler avec toi m’a donné la confiance nécessaire pour aller conquérir le monde. Merci pour tout.
Merci à tout le monde. On se reverra très surement bientôt, en congrès ou pas.
Chapitre 1
Introduction
Introduction générale
Le développement du cerveau humain, débutant par la neurulation de l’ectoderme embryonnaire, est un processus particulièrement complexe et ne se complétant qu’après 20 à 25 ans de maturation, à la fois physique et basée sur l’expérience (Jiang & Nardelli, 2015). La construction de cet organe hautement organisé nécessite la génération d’une grande variété de types cellulaires neuronaux et non neuronaux spécialisés, dans un nombre approprié, une localisation particulière et à un point précis du développement. De plus, la connexion appropriée entre les neurones, de même que la communication efficace entre les différentes populations neuronales, sont cruciales à l’accomplissement des fonctions cognitives.
Synthétisée par des populations neuronales hautement spécialisées distribuées dans le télencéphale, le diencéphale et le mésencéphale, la dopamine (DA) est l’un des neurotransmetteurs permettant le maintien des fonctions cognitives et motrices complexes du système nerveux central (CNS) chez les vertébrés. Initialement identifiée en tant que molécule intermédiaire dans la biosynthèse de l’adrénaline (AD) et de la noradrénaline (NAD), ce furent les travaux des docteurs Arvid Carlsson, Margit Lindqvist, Tor Magnusson et Bertil Waldeck à Lund et de Kathleen Montagu à Londres qui permirent de révéler le rôle indépendant de la DA en tant que neurotransmetteur à part entière du CNS (Carlsson, Lindqvist, & Magnusson, 1957; Carlsson, Lindqvist, Magnusson, & Waldbeck, 1958; Montagu, 1957). Quelques années plus tard, Annika Dahlström et Kjell Fuxe publièrent le premier rapport détaillé décrivant la distribution des neurones catécholaminergiques (CA) et sérotoninergiques (5-HT) dans le cerveau du rat (Dahlstroem & Fuxe, 1964). Identifiant initialement douze groupes de cellules CA distribués de la medulla oblongata à l’hypothalamus (alors désignés A1 à A12), cinq groupes additionnels, situés dans le diencéphale, le bulbe olfactif et la rétine (A13-A17), ainsi que trois groupes adrénergiques (C1-C3), se rajouteront par la suite à leur description (Björklund & Hökfelt, 1983). Les neurones dopaminergiques du mésencéphale (mDA) composent les noyaux A8, A9 et A10, formant respectivement l’aire rétrorubrale (RRF), la substantia nigra pars compacta (SNc) et l’aire tegmentale ventrale (VTA), dont l’implication clinique est particulièrement forte de par leurs fonctions régulatrices et modulatrices des comportements moteurs, sensorimoteurs et motivationnels. En effet, une atteinte à la survie ou au développement des neurones mDA peut être responsable d’un contrôle anormal du mouvement volontaire, et peut également mener au développement de troubles neuropsychiatriques sévères.
La formation des circuits dopaminergiques du mésencéphale au cours du développement embryonnaire est un processus complexe et finement régulé, nécessitant l’interaction entre facteurs de transcription et morphogènes, à chaque étape de spécification et prolifération des progéniteurs dopaminergiques, de même qu’au cours de la neurogénèse, différenciation et maturation des neurones mDA (Arenas, Denham, & Villaescusa, 2015). Parmi les premiers marqueurs de l’identité des précurseurs dopaminergiques, les facteurs de transcriptions LIM à homéodomaine Lmx1a et Lmx1b sont des régulateurs clefs de leur différenciation (Q. Deng et al., 2011; H. L. Doucet-Beaupré, M., 2013; Ono et al., 2007; C. H. Yan, Levesque, Claxton, Johnson, & Ang, 2011). L’étude d’un modèle murin double mutant conditionnel pour Lmx1a/b permit de démontrer la coopération fonctionnelle entre ces facteurs de transcription dans la régulation de la prolifération, spécification et différenciation des progéniteurs dopaminergiques (Q. Deng et al., 2011; C. H. Yan et al., 2011). La co-expression de Lmx1a/b persiste dans les neurones dopaminergiques matures et au cours de l’âge adulte. Leurs fonctions, indépendantes ou coopératives, au sein des neurones mDA matures et chez l’adulte demeurent cependant inconnues à ce jour (H. L. Doucet-Beaupré, M., 2013).
Parmi les cibles transcriptionnelles de Lmx1a et Lmx1b identifiées par l’équipe du Dr Martin Lévesque, deux membres de la famille de protéines Slit et Trk-like (Slitrk), Slitrk2 et Slitrk5, se trouvent différentiellement régulés par Lmx1a/b dans les neurones mDA (H. Doucet-Beaupré et al., In Revision). Les Slitrks représentent une famille de protéines à domaines à répétitions riches en leucine (LRR) structurellement similaire, ayant une forte expression à l’intérieur du système nerveux central (Aruga & Mikoshiba, 2003). Les membres de la famille Slitrk ont été impliqués dans une variété de processus neuronaux, incluant la croissance et l’arborisation dendritique, la synaptogénèse, de même que dans la survie neuronale (Proenca, Gao, Shmelkov, Rafii, & Lee, 2011). Chez la souris DatCre/+Lmx1aF/FLmx1bF/F, dont la double inactivation
conditionnelle de Lmx1a et Lmx1b est permise par l’action de la recombinase Cre, exprimée sous le contrôle du promoteur du transporteur dopaminergique (DAT), spécifique aux neurones dopaminergiques matures, une diminution de l’expression de Slitrk2 et une augmentation de l’expression de Slitrk5 fut observée au niveau du domaine des neurones mDA. Ceci témoigne de la régulation positive et de la répression de l’expression de
Slitrk2 et Slitrk5, respectivement, par l’activité transcriptionnelle de Lmx1a/b. Ce double mutant conditionnel
présente également un phénotype comportemental d’hyperactivité accompagné de mouvements stéréotypés, souvent associés aux désordres du spectre obsessif compulsif (OCD). De plus, des polymorphismes des gènes LMX1A et LMX1B, de même que des gènes SLITRK2 et SLITRK5, furent associés à plusieurs désordres neuropsychiatriques, incluant la schizophrénie (SCZ) et les troubles du spectre OCD. Plusieurs évidences pharmacologiques et tirées d’études en imagerie fonctionnelle supportent un rôle important de la DA, des neurones mDA et de leurs cibles dans la pathophysiologie de ces désordres psychiatriques.
Nous avons identifié un rôle de Lmx1a/b dans le maintien de l’équilibre de l’activité électrophysiologique des neurones mDA. Par leur fin contrôle de l’expression de Slitrk2 et de Slitrk5, Lmx1a/b régulent la mise en place des connexions synaptiques glutamatergiques et GABAergiques afférentes aux neurones mDA. Un débalancement de leur activité électrophysiologique peut ultimement être associé à une dérégulation de la libération de DA et à une perturbation fonctionnelle au niveau de leurs cibles striatales, corticales et limbiques, associées au développement de troubles neuropsychiatriques, notamment à la SCZ et aux troubles du spectre OCD. C’est dans cette optique que l’étude des rôles spécifiques de protéines synaptogéniques au cours du développement cérébral, et par le fait même l’étude des mécanismes par lesquels une altération de leur expression au cours de la formation des circuits neuronaux peut conduire à un débalancement de l’activité de réseaux neuronaux en entier, se révèle particulièrement intéressante. Dans son ensemble, cette étude permettra une meilleure compréhension des mécanismes développementaux normaux des circuits dopaminergiques du mésencéphale, de même que des mécanismes cellulaires et moléculaires pouvant conduire au développement de troubles neuropsychiatriques.
Circuits dopaminergiques du mésencéphale
Dans le système nerveux central adulte, 75% des neurones dopaminergiques du cerveau entier résident au niveau du mésencéphale ventral (VM), avec 400,000 – 600,000 neurones retrouvés dans le VM chez l’humain, et 20,000 – 30,000 chez la souris (Hegarty, Sullivan, & O'Keefe, 2013). Ces neurones produisent et relâchent la DA, et sont caractérisés par l’expression de la tyrosine hydroxylase (TH), l’enzyme limitant la vitesse de synthèse des CA. Les neurones mDA sont arrangés en trois noyaux distincts : la substantia nigra pars
compacta (SNc; aussi connu comme le groupe A9), l’aire tegmentale ventrale (VTA ou groupe A10) et l’aire
rétrorubrale (RRF; A8) (Björklund & Hökfelt, 1983; Dahlstroem & Fuxe, 1964). Ces neurones sont responsables de la régulation du mouvement volontaire, du comportement émotionnel, de la motivation naturelle, des processus liés à la récompense et des fonctions cognitives (Carlsson, 2001a; Chao & Nestler, 2004; Hornykiewicz, 1978). Au niveau de la périphérie, la DA joue un rôle important dans la régulation de l’olfaction, des processus rétiniens, des fonctions hormonales, rénales et cardiovasculaires, ainsi que pour la régulation du système immunitaire (Carlsson, 2001b; Iversen & Iversen, 2007; Missale, Nash, Robinson, Jaber, & Caron, 1998; Sibley, 1999; Snyder, Taylor, Coyle, & Meyerhoff, 1970). La formation des circuits dopaminergiques du mésencéphale est finement régulée au cours de développement embryonnaire et nécessite l’interaction complexe entre morphogènes et facteurs de transcriptions, permettant la prolifération, spécification et différenciation des progéniteurs dopaminergiques. Plusieurs évidences génétiques et
pharmacologiques supportent une association entre le développement de troubles neuropsychiatriques et une perturbation de la signalisation dopaminergique.
Les noyaux dopaminergiques du mésencéphale
On retrouve au niveau du mésencéphale 75% des neurones dopaminergiques du cerveau entier. Ceux-ci composent trois importants noyaux dopaminergiques, soit la RRF (A8), la SNc (A9) et la VTA (A10) (Figure 1). Les neurones de la SNc projettent vers la portion dorsale du striatum, formant ainsi les voies nigrostriées. Ces projections striatales sont requises pour le contrôle du mouvement volontaire et la perte des projections nigrostriées est la caractéristique pathologique principale de la maladie de Parkinson (PD), un désordre neurodégénératif caractérisé par un déficit important de la fonction motrice volontaire. Les neurones de la VTA et de la RRF innervent quant à eux la portion ventrale du striatum, le système limbique, ainsi que le cortex préfrontal, formant ainsi les voies mésolimbiques et mésocorticales, impliqués dans la régulation des processus émotifs et de la récompense. Une altération de la transmission mésocorticolimbique fut notamment associée à la SCZ, à la dépendance aux drogues, ainsi qu’à la dépression (Hegarty et al., 2013). Cependant, cette description classique des projections dopaminergiques est une simplification de la complexité des projections dopaminergiques des neurones mDA vers leurs cibles télencéphaliques. En effet, la SNc comporte non seulement des neurones projetant vers le striatum, mais également des neurones innervant les aires corticales et limbiques, alors que certains neurones de la VTA projettent également vers la portion ventrale du noyau caudé et du putamen (Figure 2) (Bjorklund & Dunnett, 2007). Les cellules de la RRF, formant une extension dorsale et caudale de la SNc, projettent à la fois vers les aires striatales, limbiques, et corticales (Bjorklund & Dunnett, 2007). Le système dopaminergique augmente en taille et en complexité chez les primates. Chez les rongeurs, le compte total de cellules positives pour la TH est d’environ 20 000 à 30 000
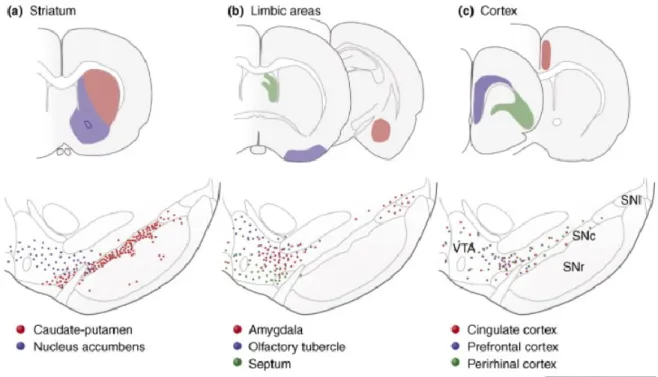
Figure 1 : Distribution des noyaux dopaminergiques dans le cerveau du rongeur en développement (a) et adulte (b). Les neurones dopaminergiques chez les mammifères sont localisés dans neuf noyaux distincts, distribués entre le mésencéphale et le bulbe olfactif, tel qu’illustré schématiquement en vue sagittale. Les principales projections dopaminergiques sont indiquées par les flèches. Abréviations : lge, éminence ganglionnaire latérale; Mge, éminence ganglionnaire médiale; p1-3, prosomères 1-3.
cellules chez la souris, pour 40 000 à 45 000 cellules chez le rat, 50% de ces cellules étant localisées au niveau de la SNc (Bjorklund & Dunnett, 2007). Ce nombre est augmenté chez les primates, retrouvant alors entre 160 000 et 320 000 neurones dopaminergiques chez le singe et entre 400 000 et 600 0000 neurones chez l’humain, plus de 70% de ces neurones étant localisés au niveau de la SNc (Bjorklund & Dunnett, 2007). Cette expansion de la SNc corrèle parfaitement avec l’expansion de son territoire d’innervation, particulièrement au niveau du néocortex qui se trouve plus densément innervé chez le primate. Chez le rongeur l’innervation dopaminergique corticale se limite aux aires du cortex frontal, cortex cingulaire et cortex entorhinal, alors que chez le primate, l’innervation dopaminergique couvre le manteau cortical en entier (Bjorklund & Dunnett, 2007; Lewis, Sesack, Levey, & Rosenberg, 1998).
En se basant sur leurs caractéristiques morphologiques et leur connectivité, il est possible de séparer les neurones mDA en un tiers dorsal et un tiers ventral (Bjorklund & Dunnett, 2007). La portion dorsale des neurones mDA inclus les cellules des fractions dorsales de la VTA et de la SNc, ainsi que les cellules de la RRF innervant le striatum ventral, les aires limbiques et corticales, de même que les compartiments matriciels du striatum dorsal (Bjorklund & Dunnett, 2007; Gerfen, Herkenham, & Thibault, 1987; Lynd-Balta & Haber, 1994). Ces cellules sont typiquement rondes ou fusiformes, positives pour la calbindin et expriment un niveau relativement faible du DAT. La fraction ventrale des neurones mDA représente les cellules des portions
Figure 2 : Origine des projections (a) mésostriatales, (b) mésolimbiques et (c) mésocorticales chez le rat. Les cellules localisées dans le tiers ventral de la SNc [points rouges en (a)] innervent, possiblement exclusivement, la portion sensorimotrice du caudé-putamen [aire rouge en (a)], alors que ses cellules du tiers dorsal comprennent des neurones projetant à la fois aux aires limbiques et corticales, tel qu’illustré en (b) et en (c). Abréviations : SNc, substantia nigra pars compacta; SNr, substantia nigra pars
reticulata; SNl, substantia nigra lateralis; VTA, aire tegmentale ventrale.
ventrales de la VTA et de la SNc, qui sont caractéristiquement de forme angulaire, négatives pour la calbindin, exprimant un fort niveau de DAT (Bjorklund & Dunnett, 2007). Ils sont également majoritairement positifs pour le canal potassique GIRK2 (G-protein-regulated inward-rectifier potassium channel 2). Ces neurones projettent vers le striatum où ils innervent les striosomes. Plusieurs de ces neurones possèdent également des dendrites projetant ventralement vers la substantia nigra pars reticulata (SNr) (Fallon & Moore, 1978; Gerfen et al., 1987). Les neurones mDA présentent donc une organisation riche et complexe, différant non seulement de par leurs morphologies, mais également par l’expression de plusieurs marqueurs moléculaires, ainsi que par leurs différents patrons de projections (Bjorklund & Dunnett, 2007).
Les premières études en immunofluorescence suggéraient trois systèmes ascendants de projections dopaminergiques à partir des noyaux dopaminergiques du mésencéphale, ayant des projections éparses au niveau de leurs cibles télencéphaliques, soit les voies nigrostriées, mésocorticales et mésolimbiques (Fallon & Moore, 1978; Lindvall & Bjorklund, 1974; Lindvall, Bjorklund, & Divac, 1977). Il fut depuis démontré que ces voies ascendantes sont bien anatomiquement et fonctionnellement distinctes. Cependant, leur origine au niveau du mésencéphale est plutôt complexe. Chez le rat et le singe, l’innervation striatale est dérivée non seulement des neurones de la SNc, mais également des neurones localisés dans la portion latérale de la VTA et RRF (Figure 2) (Bjorklund & Dunnett, 2007). En plus de leurs cibles striatales, les noyaux dopaminergiques du mésencéphale innervent plusieurs structures des ganglions de la base, incluant les segments internes et externes du globus pallidus, une portion du pallidum ventral, ainsi que les noyaux sous-thalamiques (STN) (Hassini, Francois, Yelnik, & Féger, 1997; Lindvall & Bjorklund, 1979; Y. Smith, Lavoie, Dumas, & Parent, 1989). Au niveau de la substance noire, il fut démontré que la DA peut être libérée par un plexus de terminaisons dendritiques qui origine du tiers ventral de la SNc et s’étendant largement dans la SNr (Bjorklund & Dunnett, 2007). Les neurones mDA sont donc en mesure de moduler l’activité des ganglions de la base, à la fois au niveau pallidal, sous-thalamique et de la substance noire elle-même.
La dopamine
La dopamine (4-(2-Aminoethyl)benzene-1,2-diol) est une molécule de la famille des CA, possédant plusieurs fonctions biologiques chez l’humain. Au niveau du cerveau, la DA fonctionne en tant que neurotransmetteur, exerçant son action sur de multiples circuits neuronaux par une modulation relativement lente de la neurotransmission glutamatergique et GABAergique rapide (Beaulieu & Gainetdinov, 2011). Produite et libérée par les neurones mDA, la DA active ses récepteurs et autorécepteurs, les récepteurs D1R à D5R, couplés à une protéine G. Des centaines de composés pharmacologiques actifs et drogues récréatives
interfèrent avec la fonction des récepteurs dopaminergiques, en augmentant ou bloquant l’action de la DA et sont présentement utilisés cliniquement pour le traitement d’une variété de désordres psychiatriques.
Métabolisme de la dopamine
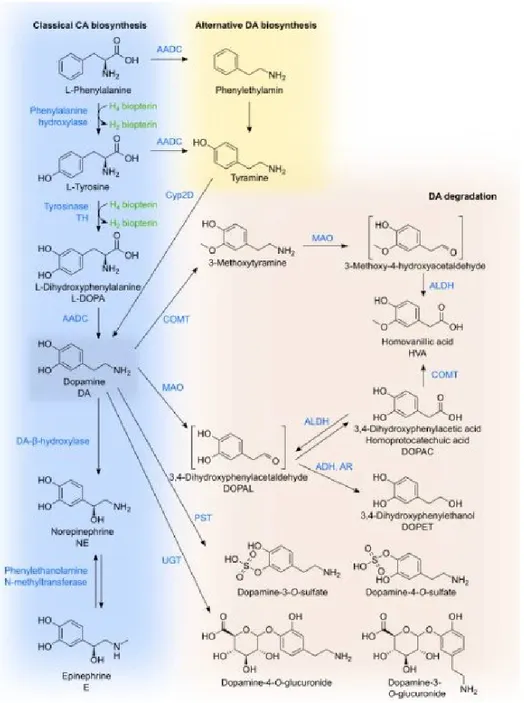
À l’intérieur du système nerveux central, la biosynthèse classique de la DA se produit en deux étapes, la première étant l’hydroxylation de la L-tyrosine sur sont anneau phénolique par la tyrosine hydroxylase, formant ainsi le L-Dihydroxyphenylalanine (L-DOPA) (Figure 3) (Meiser, Weindl, & Hiller, 2013). La TH est l’enzyme limitant la vitesse de synthèse de la DA, et son activité est fortement régulée et dépend directement de la tetrahydrobiopterine (BH4), un cofacteur synthétisé à partir du guanosine triphosphate (GTP) par la GTP cyclohydrolase. Le L-DOPA est par la suite décarboxylé en DA, par l’action de l’acide aminée aromatique décarboxylase (AADC) (Blascko, 1939). Une seconde voie de synthèse, dépendante du cytochrome P450 fut également découverte in vivo, chez le rat (Bromek, Haduch, Golembiowska, & Daniel, 2011). Suivant cette voie de biosynthèse, la décarboxylation de la tyrosine précède son hydroxylation, celle-ci étant en un premier temps convertie en tyramine, et par la suite hydroxylée par les protéines du Cyp2D. La contribution totale de cette voie dans la production de DA semble cependant être très limitée, mais pourrait se montrer importante en certaines conditions physiologiques (Bromek et al., 2011).
Au sein des neurones dopaminergiques, la DA est immédiatement séquestrée à l’intérieur de vésicules synaptiques par transport actif, via le transporteur vésiculaire monoaminergique 2 (VMAT2) (Chaudhry, Edwards, & Fonnum, 2008). Le pH légèrement acide de ces vésicules stabilise la DA et la protège contre l’oxydation, prévenant ainsi le stress oxydatif au niveau du cytosol (Miesenbock, De Angelis, & Rothman, 1998; Vergo, Johansen, Leist, & Lotharius, 2007). Suite à l’excitation des neurones dopaminergiques, la DA vésiculaire est libérée par exocytose à l’intérieur de la fente synaptique et interagit avec les récepteurs dopaminergiques postsynaptiques et autorécepteurs présynaptiques (Meiser et al., 2013). La DA est par la suite retirée de la fente synaptique pour être recyclée par les neurones dopaminergiques ou dégradée par les cellules gliales (Figure 4). La recapture de la DA par le DAT est suivie de sa séquestration vésiculaire par le VMAT2 (Eriksen, Jorgensen, & Gether, 2010). La DA pouvant s’accumuler dans le cytosol est dégradée en 3,4-dihydroxyohenylacetaldehyde (DOPAL) par l’action de la monoamine oxydase (MAO), présente sur la membrane mitochondriale externe, et par la suite réduite en 3,4-dihydrophenylethanol (DOPET) ou oxydée en acide 3,4-dihydroxyphenylacétique, par l’alcool déshydrogénase (ADH) ou l’aldéhyde déshydrogénase (ALDH), respectivement. En conditions normales, l’oxydation du DOPAL en acide carboxylique est favorisée (Eisenhofer, Kopin, & Goldstein, 2004). Les neurones de la SNc présentent de faibles niveaux de MAO, en comparaison aux autres types neuronaux et cellules gliales (Westlund, Denney, Rose, & Abell, 1988). La DA libérée à l’intérieur de la fente synaptique est également capturée par les cellules gliales pour sa dégradation. Suivant la déamination oxydative par la MOA, les cellules gliales, par l’action de la catéchol o-méthyl
transférase (COMT), converti l’acide 3,4-dihydroxyphenylacetic (DOPAC) en acide homovanilique (HVA), le principal produit de dégradation de la DA.
Figure 3 : Biosynthèse et dégradation de la dopamine. La voie principale de biosynthèse de la DA débute par la tyrosine, pouvant être hydroxylée pour former le L-dihydroxyphénylalanine (L-DOPA). La décarboxylation du L-DOPA par l’acide aminé aromatique décarboxylase (AADC) conduit alors à la production de dopamine (DA). La dégradation de la DA est effectuée par la catéchol-o-méthyl transférase (COMT), la monoamine oxydase (MAO), l’alcool déshydrogénase (ADH) et l’aldéhyde désydrogénase (ALDH), menant à la production d’acide 3,4-dihydroxyphenylacétique (DOPAC) et d’acide homovanilique (HVA). Abréviations : DA, dopamine; DOPA, dihydoxyphenyalanine; AADC, acide aminé aromatique décarboxylase; COMT, catéchol o-méthyl transférase; MAO, monoamine oxydase; ADH, alcool déshydrogénase; ALDH, aldéhyde déshydrogénase; DOPAC, acide dihydroxyphénylacetique; HVA, acide homovanilique.
Récepteurs dopaminergiques
La dopamine exerce ses actions physiologiques par l’activation de récepteurs à sept domaines transmembranaires couplés à des protéines G (GPCRs), divisés en deux classes sur la base de leurs propriétés structurales, pharmacologiques et biochimiques (Andersen et al., 1990; Beaulieu & Gainetdinov, 2011). Selon leur capacité à moduler l’activité de l’adénylyle cyclase (AC) et la production d’AMPc, les cinq différents récepteurs dopaminergiques (D1R à D5R) sont classés en tant que récepteurs dopaminergiques de classe D1 (D1R et D5R) et de classe D2 (D2R, D3R et D4R) (Beaulieu & Gainetdinov, 2011; Missale et al., 1998). Chaque membre des sous-types de récepteurs dopaminergiques partage une forte homologie au niveau de leurs domaines transmembranaires et possède des caractéristiques physiologiques distinctes. Les récepteurs dopaminergiques ont un patron d’expression étendu au niveau du système nerveux central et périphérique.
Figure 4 : Métabolisme neuronal de la dopamine. Dans les neurites des neurones dopaminergiques, la DA est synthétisée par l’action combinée de la TH et de l’AADC, et importée dans les vésicules synaptiques par la VMAT2. La DA extravésiculaire est dégradée par la MAO. Suite à l’excitation neuronale, la DA est relâchée dans la fente synaptique pour la transduction du signal. La signalisation dopaminergique se termine lors de la recapture de la DA et son recyclage par le neurone présynaptique, ou par son importation et dégradation par les cellules environnantes. Abréviations : DA, dopamine; DOPA, dihydoxyphenyalanine; AADC, acide aminé aromatique décarboxylase; COMT, catéchol o-méthyl transférase; MAO, monoamine oxydase; ADH, alcool déshydrogénase; ALDH, aldéhyde déshydrogénase; VMAT2, transporteur vésiculaire des monoamines 2.
Il est communément accepté que les récepteurs dopaminergiques de classe D1 stimulent la production d’AMPc via l’activation des protéines G de la famille Gαs/olf et de l’AC (Beaulieu & Gainetdinov, 2011). Ces récepteurs sont exclusivement postsynaptiques et retrouvés au niveau des différentes cibles dopaminergiques, dont les neurones moyens épineux (MSN) GABAergiques du striatum. Dans le cerveau, les D1R sont exprimés à forte densité dans les aires striatales, limbiques et corticales innervées par les neurones mDA, tels le noyau caudé et le putamen, le nucleus accumbens, la substantia nigra, le bulbe olfactif, l’amygdale et cortex frontal (Beaulieu & Gainetdinov, 2011). Ils sont également exprimés au niveau de l’hippocampe, du cervelet, et des aires thalamiques et hypothalamiques à plus faibles densités. Les D5R sont également exprimés à de faibles niveaux dans de multiples régions du cerveau, comprenant les neurones pyramidaux du cortex préfrontal, des cortex promoteur, cingulaire et entorhinal, de la substantia nigra, de l’hypothalamus, de l’hippocampe et du gyrus denté (Beaulieu & Gainetdinov, 2011). Un très faible niveau d’expression fut également observé dans les MSN du noyau caudé et du nucleus accumbens (Missale et al., 1998).
Les récepteurs dopaminergiques de classe D2 sont couplés aux membres de la famille Gαi/o de protéines G et induisent l’inhibition de l’AC (Beaulieu & Gainetdinov, 2011). Les récepteurs D2R et D3R sont exprimés à la fois postsynaptiquement au niveau des cibles dopaminergiques, et présynaptiquement sur les neurones mDA, servant ainsi la fonction d’autorécepteurs (Beaulieu & Gainetdinov, 2011; Sokoloff et al., 2006). Les niveaux les plus forts de D2R sont retrouvés au niveau du striatum, nucleus accumbens et tubercule olfactif (Beaulieu & Gainetdinov, 2011). Il est également significativement exprimé au niveau de la substantia nigra, de la VTA, de l’hypothalamus, des aires corticales, du septum, de l’amygdale et de l’hippocampe (Beaulieu & Gainetdinov, 2011; Missale et al., 1998). Le récepteur D3R a un patron de distribution plus limité, ses plus hauts niveaux d’expression étant observés au niveau des aires limbiques, tels la coquille du nucleus
accumbens, le tubercule olfactif et les ilots de Calleja (Missale et al., 1998; Sokoloff et al., 2006). Il est
également détectable à des niveaux significativement plus faibles dans le striatum, la SNc, la VTA, l’hippocampe, le septum, ainsi que dans les aires corticales (Beaulieu & Gainetdinov, 2011). Le récepteur D4R possède le plus faible niveau d’expression de tous les récepteurs dopaminergiques, avec une expression rapportée dans le cortex frontal, l’amygdale, l’hippocampe, l’hypothalamus, le globus pallidus, la SNr et dans le thalamus (Missale et al., 1998; Rondou, Haegeman, & Van Craenenbroeck, 2010).
Le développement de souris exprimant des protéines fluorescentes rapporteuses sous le contrôle des promoteurs des gènes D1R et D2R permit l’identification d’une ségrégation de ces récepteurs parmi les populations de MSNs du striatum et du nucleus accumbens (Shuen, Chen, Gloss, & Calakos, 2008; Valjent, Bertran-Gonzalez, Hervé, Fisone, & Girault, 2009). Il fut démontré que les MSNs peuvent être séparés en deux principaux sous-groupes, définis par leurs sites de projection et les protéines qu’ils expriment. En effet,
les MSNs projetant au globus pallidus médian et vers la SNr forment une voie striatonigrale directe, exprimant sélectivement le récepteur D1R, alors que les MSNs projetant au globus pallidus latéral et exprimant sélectivement le récepteur D2R forment une voie striatopallidale indirecte (Beaulieu & Gainetdinov, 2011; Shuen et al., 2008). Cette voie indirecte atteint également la SNr, via des relais synaptiques au niveau du
globus pallidus latéral et des noyaux sous-thalamiques. Signalisation dopaminergique
L’ensemble des récepteurs dopaminergiques appartient à la superfamille des GPCRs. Les récepteurs dopaminergiques présentent une forte similarité au niveau de leurs séquences en acides aminés et possèdent une structure commune de par leurs sept domaines transmembranaires. Chaque récepteur dopaminergique est également en mesure d’activer une protéine G hétérotrimérique afin d’induire ses mécanismes précoces de signalisation intracellulaire (Gingrich & Caron, 1993; Missale et al., 1998; Neve, Seamans, & Trantham-Davidson, 2004). Cependant, plusieurs évidences suggèrent que ces récepteurs permettent également une signalisation indépendante des protéines G, permettant une réponse tardive, progressive et prolongée à l’activation des récepteurs dopaminergiques (Beaulieu & Gainetdinov, 2011; Luttrell et al., 1999; Luttrell & Lefkowitz, 2002).
Les protéines G consistent en une association de trois sous-unités protéiques (α, β et γ) et leur classification dépend de la nature de la séquence de leur sous-unité α et de ses caractéristiques fonctionnelles (Pierce, Premont, & Lefkowitz, 2002). En absence de ligand agoniste, la sous-unité α, contenant le site de liaison de la
Figure 5 : Réseaux signalétiques régulés par les récepteurs dopaminergiques de classe D1. A) Régulation de la signalisation
Gαs/cAMP/PKA par les récepteurs dopaminergiques de classe D1. B) Régulation de la signalisation Gαq/PLC par les récepteurs
dopaminergiques de classe D1, ou par un hétérodimère D1R :D2R. Les flèches bleues indiquent une activation, les flèches rouges indiquent une inhibition et les flèches vertes indiquent l’amplification d’une fonction préalablement activée.
guanine, est liée au GDP et fortement associée au complexe βγ, formant ainsi le complexe trimérique inactif.
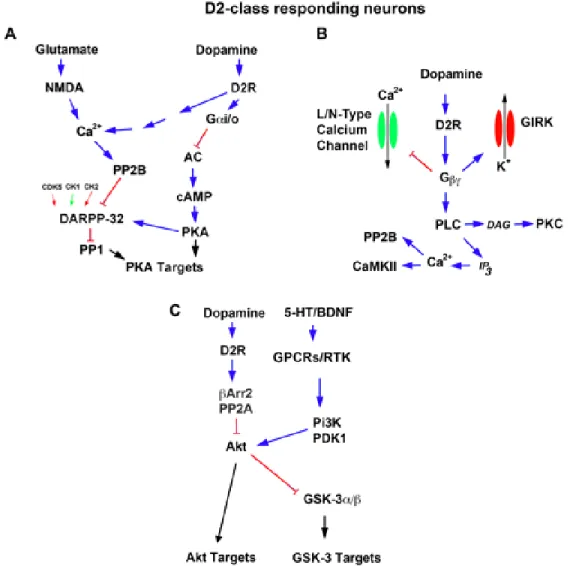
Lors de son activation par la liaison du ligand agoniste au récepteur, le GDP relâché est remplacé par le GTP, permettant ainsi la dissociation de la sous-unité α du complexe βγ et l’initiation de la transduction du signal. À la fois la sous-unité α et le complexe βγ permettent la transduction du signal, par l’activation d’un nombre relativement faible de systèmes effecteurs. La fonction des récepteurs dopaminergique est traditionnellement associée à la régulation de l’AMPc et à l’activité de la protéine kinase A (PKA), constituant la phase précoce de la signalisation dopaminergique. Dans le cas des récepteurs dopaminergiques, les récepteurs de type D1 (D1R et D5R) activent une protéine de type Gαs stimulant l’activité de l’AC (Figure 5), alors que les récepteurs de type D2 (D2R, D3R et D4R) activent une protéine de type Gαi inhibant la production d’AMPc (Figure 6)
Figure 6 : Réseaux signalétiques régulés par les récepteurs dopaminergiques de classe D2. A) Régulation de la signalisation Gαs/cAMP/PKA par les récepteurs dopaminergiques de classe D2. B) Régulation de la signalisation Gβγ par les récepteurs
dopaminergiques de classe D2. C) Régulation de la signalisation β-arrestin 2/Akt/GSK-3 par les récepteurs D2R et D3R. Les flèches bleues indiquent une activation, les flèches rouges indiquent une inhibition et les flèches vertes indiquent l’amplification d’une fonction préalablement activée.
(Beaulieu & Gainetdinov, 2011). Plusieurs substrats de la PKA, tels CREB, les récepteurs glutamatergiques AMPA et NMDA et certains canaux ioniques, sont affectés par la stimulation des récepteurs dopaminergiques (Greengard, 2001). Parmi les substrats de la PKA, la protéine DARPP-32 (32-kDa dopamine and
cAMP-regulated phosphoprotein) est l’une des plus étudiée en rapport à la neurotransmission dopaminergique
(Beaulieu & Gainetdinov, 2011). Exprimé par les MSNs, DARPP-32 agit comme intégrateur de la modulation de la signalisation intracellulaire en réponse à de l’action de multiples neurotransmetteurs, incluant la DA (Svenningsson et al., 2004). L’étude de la fonction de DARPP-32 in vivo et en tranches striatales permit de démontrer son rôle dans l’amplification de la signalisation PKA dépendante (Beaulieu & Gainetdinov, 2011). En addition à leurs effets directs sur la signalisation AMPc-dépendante, les récepteurs dopaminergiques de type D1 peuvent également être couplés à une protéine Gαq, permettant la régulation de l’activité de la phospholipase C (PLC) (Figure 6) (Beaulieu & Gainetdinov, 2011). L’activation de la PLC conduit à la production d’inositol triphosphate (IP3) et de diacylglycérol (DAG), résultant respectivement en une augmentation de la mobilisation du calcium intracellulaire et en l’activation de la protéine kinase C (PKC). Les récepteurs de classe D2 sont également en mesure d’influencer les niveaux intracellulaires de calcium par leur action sur les canaux ioniques, ou en amorçant la libération du calcium des réserves intracellulaires (Missale et al., 1998; Nishi, Snyder, & Greengard, 1997). Cette réponse serait médiée par l’action du complexe βγ qui, suite à l’activation du récepteur dopaminergique et le détachement de la sous- unité α de la protéine G dans les MSNs, permet l’activation de la PLC et l’augmentation de la concentration intracellulaire en calcium (Hernandez-Lopez et al., 2000). Le complexe βγ permet également la réduction de l’activité des canaux calciques de type L dans les MSNs, en plus de réguler l’activité des canaux calciques de type N dans les interneurones striataux (Z. Yan, Song, & Surmeier, 1997). Le complexe βγ serait de plus impliqué dans l’activation des canaux GIRKs, permettant un effet inhibiteur sur le neurone et pouvant potentiellement médier plusieurs fonctions dopaminergiques in vivo (Beaulieu & Gainetdinov, 2011; Kuzhikandathil, Yu, & Oxford, 1998; Lavine et al., 2002).
La transduction du signal suivant l’activation des récepteurs dopaminergique comprend également une composante tardive, permettant une réponse tonique à une augmentation de longue durée de la concentration extracellulaire en DA (Figure 7) (Beaulieu & Gainetdinov, 2011). Identifiée comme intermédiaire signalétique, la protéine β-arrestine 2 (βARR-2) est impliquée dans l’activation AMPc-indépendante d’AKT et GSK-3 par la DA (Figure 6) (Beaulieu & Gainetdinov, 2011; Beaulieu et al., 2005; Beaulieu et al., 2004). AKT est une sérine/thréonine kinase régulée par la signalisation médiée par le IP3, recrutée à la membrane suite à son activation (Jacinto et al., 2006). La régulation d’AKT fut également associée à l’action de l’insuline, de peptides reliés à l’insuline et à l’action de neurotrophines tel le NGF, BDNF et neurotrophin-3, exerçant leur fonction via un récepteur de type tyrosine kinase (Scheid & Woodgett, 2001). GSK-3α et GSK-3β sont deux sérine/thréonine kinases à forte homologie, initialement associées à la synthèse du glycogène en réponse à
l’insuline (Embi, Rylatt, & Cohen, 1980). Il fut démontré que AKT inhibait l’action de GSK-3α/β en réponse à de multiples hormones et facteurs de croissance, incluant l’insuline, l’insulin-like growth factor et le BDNF (Cross, Alessi, Cohen, Andjelkovich, & Hemmings, 1995; Frame & Cohen, 2001).
Formation des circuits dopaminergiques du mésencéphale
L’étude et la compréhension de la circuiterie moléculaire régulant la formation des circuits dopaminergiques du mésencéphale est particulièrement importante dans une optique de compréhension des mécanismes pouvant être altérés dans le développement de troubles neuropsychiatriques associés à un défaut de la transmission dopaminergique. Le développement des neurones mDA est un processus complexe, comprenant des évènements développementaux précoces, tels la mise en place précoce du mésencéphale ventral, la régulation transcriptionnelle de l’identité des progéniteurs dopaminergiques, la neurogénèse, migration et différenciation des neurones dopaminergiques, ainsi que les étapes tardives de croissance des neurites et de synaptogénèse. Des progrès significatifs définissant les étapes précoces de formation des circuits dopaminergiques ont eu lieu au cours des dernières années, et bien que moins bien comprises, de récentes études permirent d’identifier les signaux cellulaires et moléculaires essentiels à la connectivité des neurones mDA avec leurs différentes cibles. Cependant, on en sait encore très peu à propos des de la provenance des connexions afférentes innervant et régulant l’activité des neurones dopaminergiques du mésencéphale, de même qu’à propos des mécanismes cellulaires et moléculaires régulant cette connectivité.
Figure 7 : Signalisation précoce et tardive des récepteurs dopaminergiques au cours de la neurotransmission lente. Au cours de la phase précoce de la transduction du signal, la signalisation médiée par les protéines G induit un changement rapide et transitoire dans l’état de phosphorylation des cibles directes et indirectes de la PKA, tel DARPP-32 et CREB, rapidement antagonisé lors de l’inactivation de cette protéine G. Au cours de la phase de signalisation tardive, les récepteurs dopaminergiques stimulent la formation d’un complexe protéique formé de
β-arrestin2, PP2A et AKT, permettant une réponse prolongée et progressive à la stimulation dopaminergique.
Mise en place précoce du mésencéphale ventral
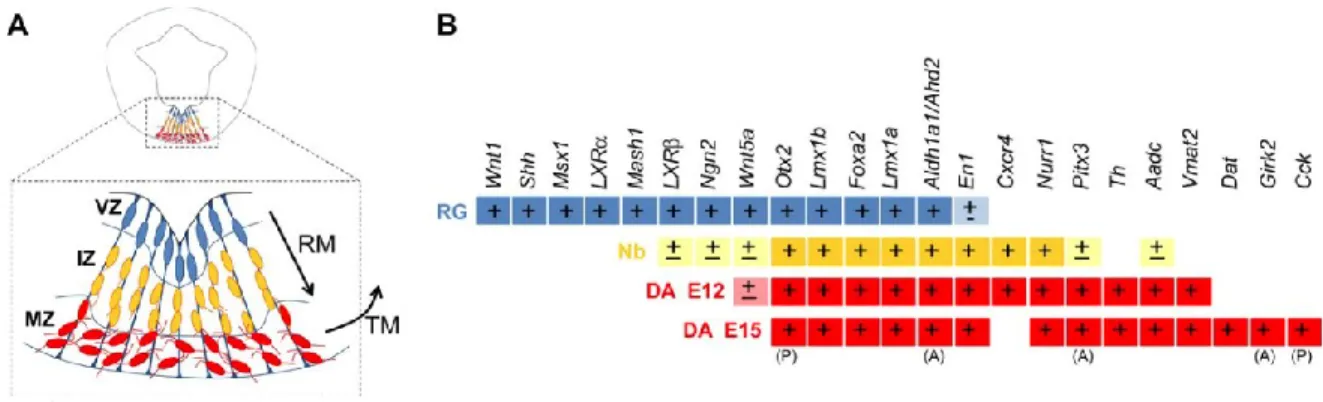
Les premières étapes clefs de la formation des circuits dopaminergique du mésencéphale sont les évènements primaires qui permettront de conduire à la mise en place du mésencéphale ventral. Au cours de la gastrulation, une migration cellulaire postéro-antérieure se produit alors que se forment le mésoderme, l’endoderme et l’ectoderme (Arenas et al., 2015). Du côté rostral de l’embryon, la sécrétion des du côté rostral de l’embryon, la sécrétion des inhibiteurs DKK1 (dickkopf1; inhibiteur de WNT), NOG (noggin; inhibiteur de BMP), de LEFTY1 (left-right determination factor 1; inhibiteur de NODAL) et CERBUS (inhibiteur de WNT, BMP et NODAL), suppriment les signaux postérieurs et permettent la mise en place de l’ectoderme neural, conduisant ainsi à la formation du tube neural antérieur (Takaoka, Yamamoto, & Hamada, 2007). L’ectoderme dorsal sera restreint à une destinée neuronale en réponse aux signaux provenant de l’organisateur de Spemann, donnant naissance à la plaque neurale (Harland, 2000; Hemmati-Brivanlou & Melton, 1997; Liu & Niswander, 2005). Celle-ci sera par la suite sous-divisée en domaines restreints, guidée par un gradient de différents morphogènes exprimés le long des axes antéropostérieur (A/P) et dorsoventral (D/V), tout en se refermant sur elle-même pour former le tube neural (Puelles, 2001; H. Simon, Hornbruch, & Lumsden, 1995; Ulloa & Briscoe, 2007). Alors que se poursuit la formation du tube neural se forment deux importants centres de signalisation: l’organisateur d’isthmus (IsO), définissant la frontière entre le mésencéphale et le rhombencéphale, ainsi que la plaque du plancher (FP) (Joyner, Liu, & Millet, 2000; Rhinn et al., 1998; Wassarman et al., 1997). Au cours des différents stades du développement, l’action combinée des facteurs de transcriptions et morphogènes provenant de ces centres de signalisation orchestreront de multiples fonctions, incluant la définition de l’identité régionale du VM, la spécification et prolifération des progéniteurs dopaminergiques, la neurogénèse des neurones mDA, ainsi que leur différentiation et survie (Arenas et al., 2015).
Un des évènements les plus précoces et les plus cruciaux du développement du tube neural est la formation de l’IsO débutant à E7.5, par l’expression coordonnée et la répression mutuelle des facteurs de transcriptions à homéodomaines Otx2 et Gbx2 (Figure 8) (Broccoli, Boncinelli, & Wurst, 1999; Millet et al., 1999; Wassarman et al., 1997). L’IsO est un centre unique de signalisation délimitant le mésencéphale du rhombencéphale, et nécessaire au développement de ces deux régions (Liu & Joyner, 2001a; Rhinn & Brand, 2001). Son positionnement exact à la frontière du mésencéphale et du rhombencéphale est directement dépendant de la répression mutuelle entre Otx2 et Gbx2 (Martinez-Barbera et al., 2001). Alors que Otx2 est exprimé par la portion antérieure du tube neural en développement, Gbx2 est exprimé plus postérieurement au niveau du rhombencéphale antérieur (Acampora, Avantaggiato, Tuorto, & Simeone, 1997; Matsuo, Kuratani, Kimura, Takeda, & Aizawa, 1995; Simeone, Acampora, Gulisano, Stornaiuolo, & Boncinelli, 1992; Wassarman et al., 1997). Bien que critique au positionnement adéquat de l’IsO, Otx2 et Gbx2 ne sont pas requis pour l’induction
des gènes exprimés par cet organiseur, mais seulement à la limitation de leur domaine d’expression (Brodski et al., 2003; Liu & Joyner, 2001b). Lorsque l’IsO est déplacé caudalement dû à une expression ectopique de
Otx2 dans le rhombencéphale, le nombre de neurones mDA se trouve augmenté (Brodski et al., 2003).
Similairement, lorsque sa position est déplacée rostralement par la suppression de Otx2 au niveau du mésencéphale, le nombre de neurones mDA se trouve diminué, démontrant ainsi l’importance de la position de l’IsO au développement normal des neurones dopaminergiques du mésencéphale ventral (Brodski et al., 2003).
Un second évènement majeur dans l’établissement du tube neural et de ses fonctions est la formation de la plaque du plancher, dépendante de la sécrétion de la protéine de signalisation sonic hedgehog (Shh). Initialement sécrété par le notochorde, Shh spécifie la portion la plus ventrale de la plaque neurale, la FP, par l’induction de l’expression de Foxa2 à E8 chez la souris (Ang et al., 1993; Sasaki, Hui, Nakafuku, & Kondoh, 1997). FoxA2 joue un rôle central dans la signalisation Shh et est requis à la fois dans le développement du notochorde et de la FP, en plus de la mise en place ventrale (Ang & Rossant, 1994; Weinstein et al., 1994). À E8.5, la FP commence elle-même à exprimer Shh et devient alors le second organisateur ventral du tube neural (Echelard et al., 1993; Ho & Scott, 2002; Hynes et al., 1995). Un gradient de Shh en provenance de la
Figure 8 : Facteurs moléculaires impliqués dans le développement des neurones dopaminergiques du mésencéphale ventral. La couleur de flèches indique l’effet de leur expression : violet, régulation positive; vert, boucle d’autorégulation; orange, régulation coopérative; noir, inhibition.