THESE
Pour l’obtention du grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
(Faculté des Sciences Fondamentales et Appliquées)
(Diplôme National – Arrêté du 7 août 2006)
Ecole Doctorale : Biosanté
Secteur de recherche : Aspects Moléculaires et Cellulaires de la Biologie
Présentée par
Hamid MOHA OU MAATI
****************************
Mise au point et validation d’un modèle cellulaire exprimant de façon stable le canal KCNQ1 / KCNE1. Implication du courant IKs dans les mécanismes pro-arythmiques
cardiaques.
****************************
Directeur de thèse : Pr. Patrick Bois****************************
Soutenue le 16 Décembre 2009
Devant la commission d’examen
JURY
René Rouet Professeur, Université de Caen Rapporteur Jean-Yves Le Guennec Professeur, Université de Montpellier Rapporteur Marc Borsotto Chargé de recherche CNRS, IPMC de Nice Examinateur Omar Benzakour Professeur, Université de Poitiers Examinateur Patrick Bois Professeur, Université de Poitiers Examinateur Joffrey Ducroq Chef de laboratoire, Physiostim, Lautrec Examinateur
Remerciements
Remerciements
Remerciements
Remerciements
Remerciements
Remerciements
Remerciements
Remerciements
Ce travail de thèse a été effectué en collaboration entre deux laboratoires : le laboratoire PhysioStim d’une part et le laboratoire de Physiologie et Physiopathologie des Canaux Ioniques (PPCI) d’autre part. PhysioStim est une société de biotechnologie spécialisée dans les études précliniques de pharmacologie de sécurité cardiovasculaire. Elle est dirigée par le Docteur Marie Le Grand. Le laboratoire PPCI est dirigé par le Docteur Christian Cognard, il fait partie de l’Institut de Physiologie et Biologie cellulaire (IPBC, UMR 6187, CNRS) du Pôle Biologie Santé de Poitiers. Cet Institut était sous la direction du Docteur Guy Raymond en début de ma thèse et il est actuellement dirigé par le Professeur Frédéric Becq.
Je souhaite remercier vivement le Docteur Marie Le Grand pour m’avoir accueilli au sein de PhysioStim, et d’avoir accepté la mise en place du contrat CIFFRE avec l’ANRT et le laboratoire PPCI, qui a permis la réalisation de ce travail de thèse. J’adresse mes remerciements au Docteur Guy Raymond et au Professeur Frédéric Becq pour leur accueil au sein de l’Institut de Physiologie et Biologie cellulaire. Mes remerciements s’adressent également au Docteur Christian Cognard pour son accueil dans son équipe de recherche (PPCI) de l’IPBC.
Ce travail de thèse a été effectué sous la direction du Professeur Patrick Bois. Je tiens à lui exprimer ma profonde gratitude pour tout l’investissement qu’il a apporté dans la mise place de ce projet. Je le remercie également pour la confiance qu’il me témoigne, pour sa patience, sa disponibilité et surtout pour l’encadrement et les connaissances scientifiques de qualité dont j’ai bénéficié tout au long de ma thèse et de mon parcours universitaire. Je souhaite aussi le remercier pour l’engagement et les recommandations dont il a fait preuve à mon égard durant mes démarches de recherche de stage postdoctoral.
Je remercie également le Docteur Joffrey Ducroq pour toutes les connaissances scientifiques et techniques qu’il a pu m’apporter au cours de son encadrement durant la période que j’ai passé chez PhysioStim. Je le remercie également pour la patience dont il a fait preuve, et pour sa bonne humeur et sa gentillesse qui m’ont permis d’évoluer dans un cadre agréable.
Je tiens également à témoigner ma gratitude à l’égard des Professeurs René Rouet et Jean-Yves Le Guennec pour avoir accepter de juger ce travail de thèse en tant que rapporteurs. Leurs remarques et leurs critiques seront pour moi une source d’enrichissement. J’adresse mes remerciements au Docteur Marc Borsotto qui a accepté de faire parti des membres du jury de cette thèse comme examinateur et de juger ainsi ce travail. Je le remercie surtout de la confiance qu’il me témoigne en acceptant ma candidature pour mon premier stage postdoctoral dans son équipe de recherche. Je tiens également à remercier le Professeur Omar Benzakour pour avoir accepter d’être le président du jury qui va juger ce travail de thèse.
Je souhaite également exprimer ma profonde reconnaissance envers le Professeur Jean-François Faivre, pour sa gentillesse, son soutien et sa disponibilité tout au long de mon travail de thèse. Je voudrais également le remercier pour les connaissances scientifiques, le goût pour la science et la recherche qu’il m’a transmis, mais aussi pour son investissement lors de la mise en place de ce projet de thèse. Enfin, je voudrais lui témoigner ma gratitude pour la confiance qu’il a eut à mon égard notamment au cours de mes démarches de recherche de stage postdoctoral.
Je souhaite exprimer ma gratitude envers le Docteur Bruno Le Grand pour sa disponibilité et pour les conseils scientifiques qu’il a pu apporter au cours de ce travail. Je tiens également à remercier le Docteur Jocelyn Bescond pour son soutien, sa disponibilité tout au long de ce travail de thèse. Mes remerciements s’adressent aussi au Docteur Bruno Constantin pour ses conseils scientifiques précieux pour l’amplification et l’extraction des plasmides, et pour son aide au cours des techniques de transfection. Je remercie le Docteur Anne Cantereau pour sa disponibilité et son aide sur le microscope confocal pour les expérimentations d’immunofluorescence. J’adresse mes remerciements au Docteur Jacques Barhanin qui nous a fourni les plasmides permettant la mise en place de notre modèle cellulaire. Je souhaite également remercier Jérôme Rivet pour sa gentillesse, sa disponibilité et son aide technique en microbiologie, qui a permis la réalisation de la première partie de ce travail.
Je remercie l’ensemble du personnel technique de l’équipe Physiologie et Physiopathologie des canaux ioniques, Christophe, Françoise, Chantal, Sandra, James, Lalasoa, Carole, Khadra, et Claudine pour leur gentillesse, leur disponibilité et leur aide précieuse durant ces années de thèse.
Je tiens à remercier l’ensemble des personnes de l’équipe PhysioStim Céline Salvetat, Myriam Caparros, Stéphanie Guilbot, Richard Printemps, Line Alayrac-Benazech, Laetitia Mercadieu, Brigitte Pradelles et Virginie Boutes pour l’accueil agréable qu’elles ont eu à mon égard lors de mon arrivée et tout au long de ma présence dans le laboratoire.
J’adresse également un grand merci à l’ensemble des membres de l équipe PPCI et plus particulièrement :
Au Docteur Aurélien Chatelier pour son soutien et ses conseils même si nous n’avons pas eu beaucoup de temps pour nous connaître. Au docteur Ludivine Mondin pour son soutien et sa gentillesse durant toutes ces années d’études communes. Je te souhaite plein de bonnes choses pour la suite, et surtout profite bien de ton séjour postdoctoral dans celle ville magnifique qu’est Bruxelles. A Jessica Sabourin pour son soutien durant toutes ces années universitaires. Je te souhaite également plein de réussite pour la suite de ton parcours. A Najate Benamer pour sa gentillesse, sa disponibilité. Merci également pour ton soutien durant les moments difficiles que j’ai pu traverser. J’ai été ravi de partager cette période de thèse avec toi, et j’espère que l’on aura un jour l’occasion de retravailler ensemble. Je te souhaite plein de choses extraordinaires pour la suite de ton parcours, et surtout profite bien de ton séjour à New-York. A Charlotte, Aurélie, et Rania pour leur bonne humeur qui m’a permis de décompresser un peu dans la période finale de rédaction de cette thèse. Je vous souhaite de réaliser une bonne thèse.
J’adresse également mes plus vifs remerciements au Docteur Mickael Derangeon pour son aide technique précieuse et pour son soutien. J’ai énormément apprécié d’avoir travaillé avec toi durant mon stage de Master 1 et durant ma thèse, et j’espère que cette occasion se représentera un jour. Je souhaiterais également remercier Sylvain Normand avec qui j’ai réalisé tout mon cursus universitaire. Merci pour ton soutien et pour tous ces bons moments passés ensemble durant cette période d’études. Je te souhaite le meilleur pour la suite de ton parcours, j’espère que l’on aura l’occasion de ce revoir.
Je souhaiterais adresser des remerciements plus particuliers à toute ma famille : Tout d’abord je souhaite dédier cette thèse à la mémoire de ma mère, qui a tant fait pour moi et sans qui ce travail de thèse n’aurais peut être pas vu le jour. Je dédie aussi ce travail de thèse à mon père qui à toujours cru en moi et pour son soutien permanent tout au long de mes années d’études.
Je remercie tout mes frères et sœurs qui de par leur soutien au quotidien ont contribués à la réalisation de ce travail.
J’adresse un grand merci à ma femme Candy, pour son soutien sans faille, et pour toutes ces années de sacrifices qui ont permis la réalisation de cette thèse. Je te remercie pour la confiance en moi que tu as eu, mais aussi d’avoir été présente à mes cotés dans cette longue aventure qu’est la thèse. Sans toi, ce travail n’aurait pas la même signification. J’adresse également un énorme merci à mes trois enfants, Ilias, Ouassim et Siham, qui font mon bonheur au quotidien, et en qui j’ai pu trouver tout le réconfort nécessaire pendant les périodes difficiles de toutes ces années d’études. Je vous dédie ce travail dont la réussite à en partie résidée dans la joie de vivre que vous m’apportez chaque jour passer à vos cotés.
Abréviation
Abréviation
Abréviation
Liste des abréviations
Liste des abréviations
Liste des abréviations
Liste des abréviations
A1 récepteur de type 1 à l’adénosine
ADN acide désoxyribonucléique
ADNc acide désoxyribonucléique complémentaire
ADP adénosine bispohsphate
AKAP Akinase anchoring protein
AMPc adénosine monophosphate cyclique
4-AP 4-aminopyridine
APD action potential duration
APDx% action potential duration at x percent of repolarization
ARN acide ribonucléique
AT2 récepteur à l’angiotensine de type 2
ATP adénosine triphosphate
AV atrio ventricular
b background
BET bromure d’éthidium
BKca grande conductance potassique calcium dépendante
BSA bovine serum albumine
BVR beat to beat variability
CaCl2 chlorure de calcium
CACNA1S, C, D et F gènes codant les isoformes cardiaques du canal calcique
de type L
Cav 1.1 à 1.4 isoformes cardiaques du canal calcique de type L
CACNC1G et H gènes codant les isoformes cardiaques du canal calcique de type T
Cav 3.1 et 3.2 isoformes cardiaques du canal calcique de type T
CNBD cyclic nucleotide binding domain
CFTR cystic fibrosis transmembrane regulator
CO2 dioxide de carbone
COS-7 cellules tumorales issues de fibroblastes de reins de singe
DADs delayed after depolarizations
DAG diacylglycérol
DEX dexrazoxane
DHP dihydropyridine
DHPR récepteur aux dihydropyridines
DIDS 4,4'-diiosothiocyanatostilbène-2,2'-disulfonat
DMSO diméthyle sulfoxyde
DOX doxorubicine
EADs early after depolarizations
ECG électrocardiogramme
HCN1-4 hyperpolarization-activated cyclic nucleotide-gated 1-4
HEK 293 human embryonic kidney 293
E4031 N-[4-[[1-[2-(6-Methyl-2-pyridinyl)ethyl]-4-piperidinyl] carbonyl]phenyl]methanesulfonamide dihydrochloride
Einv potentiel d’inversion
eNOS NO synthases
Er potentiel de repos
ETA récepteur à l’endothéline de type A
f funny
GAPDH glyceraldehyde-3-phosphate dehydrogenase
i current
Hz hertz
ICaT transient calcium current
ICaL long lasting calcium current
IC50 concentration efficace pour obtenir 50 % d’inhibition
ICH international committee of harmonisation
IClCa calcium activated chloride current
IClir inward rectifier chloride current
IClPKA A kinase protein activated chloride current
IClswell swelling activated chloride current
If funny current
IKca conductance potassique calcium dépendante intermédaire
IKr rapidly activating delayed rectifier potassium current
IKs slowly activating delayed rectifier potassium current
IKur ultrarapid delayed rectifier potassium current
INaL late sodium current
IP3 inositol triphosphate
Ist sustained inward current
Ito transient outward current
K potassique
KAch canal potassique activé par l’acétylcholine
KATP canal potassique sensible à l’ATP intracellulaire
KCNE1-5 potassium voltage-gated channel, Isk-related family, member 1-5
KCNH2 gène codant le canal potassique hERG
KCNJ2 gène codant le canal potassique Kir 2.1
KCNJ11 gène codant le canal potassique sensible à l’ATP intracellulaire
KCNQ1-5 potassium voltage-gated channel, KQT-like subfamily, member 1-5
KCOs potassium channel openers
KDa kilo Dalton
Kir canal potassique à rectification entrante
Kir 2.1 à 2.3 isoformes cardiaques du canal potassique à rectification entrante responsable du courant IK1
Kir 6.1, 6.2 isoformes cardiaques du canal potassique à rectification entrante responsable du courant IKATP
KOH hydroxyde de potassium
Kv canal potassique dépendant du voltage
LQT1-8 syndrome du QT long de type 1 à 8
LV left ventricle
MirP1 minK related protein 1
MinK minimum potassium
mL millilitre
mM millimolaire
MOX moxifloxacine
M méga ohm ohm Ms milliseconde Mm Hg millimètre de mercure mV millivolt nA nano ampère
Na/K ATPase pompe sodium/potassium
NaOH hydroxyde de sodium
NAV nœud atrio ventriculaireK+ : potassium
Nav 1.1-1.9 isoformes du canal sodique dépendant du voltage
NCX sodium calcium exchange
nm nanomètre
nM nanomolaire
RNMDA N-methyl-D-aspartate receptor
NO monoxyde d’azote NS nœud sinusal O2 dioxygène °C degrés Celsius pA pico ampère PA potentiel d’action
PBS phosphate buffer saline
PCR polymerase chain reaction
PDE4D3 isoforme D3 de la phosphodiestérase 4
PIP2 phosphatidylinositol 4,5-bisphosphate
PKA protéine kinase A
PKC protéine kinase C
pS pico siemens
RPM rotation par minute
RT-PCR reverse transcriptase polymerase chain reaction
Rv right ventricle
RVD regulatory volume decrease
RYR récepteur à la ryanodine
SA sino atrial
SCN5A gène codant le canal sodique cardiaque Nav 1.5
SDS sodium dodecyl sulfate
SIDS sudden infant death syndrome
SKca petite conductance potassique calcium dépendante
st sustained
SVF sérum de veau foetal
SUR 2A, 2B isoformes A et B du récepteur aux sulfonylurés
TASK twik-acid sensitive potassium channel
TdPs torsades de pointe
TEA tétraéthylamonium
THIK Tandem pore domain halotane inhibited potassium channel
Tp-e Tpeak-Tend interval
TRAAK TWIK1-related arachidonic acid-stimulated K+ channel
TREK twik-related potassium channel
TRIaD triangulation, reverse use dependance, instability and dispersion
TWIK tandem weak inward rectifier potassium channel
µg microgramme
µg/mL microgramme par millilitre
µg/µL microgramme par microlitre
µL microlitre
µm micromètre
µM micromolaire
XIP eXchange inhibitory peptide
V volt
v/v volume/volume
Historique
Abréviations et sommaire……….7
I- Le cœur... 17
A- Généralités ... 17
B- Activité des cellules cardiaques ... 18
a- Généralités... 18
b- Les cellules à activité automatique dominante ... 20
c- Les cellules à activité contractile dominante ... 22
d- L’électrocardiogramme (ECG) ... 23
II- Les courants ioniques cardiaques... 25
A- Le courant de pacemaker ou courant If... 25
B- Le courant sodique rapide ... 27
C- Les courants calciques... 31
a- Canaux calciques de type L... 31
b- Canaux calciques de type T ... 33
D- Les canaux chlorures... 34
a- Courant chlore IClCA... 35
b- Courant chlore IClswell... 36
c- Courant chlore IClPKA... 36
d- Courant chlore IClir... 36
E- Pompe et échangeur... 37
a- L’échangeur sodium/calcium (Na/Ca) ... 37
b- La pompe sodium potassium Na+/K+... 38
F- Les courants potassiques... 40
a- La famille Kir (Deux segments transmembranaires) ... 41
1- Le canal Kir 2.1 et le courant IK1 (figure H18) ... 42
2- Le canal sensible à l’ATP intracellulaire KATP... 43
3- Le canal activé par l’acétylcholine KACH... 44
b- La famille 2TM 2P « K2p » (Quatre segments transmembranaires) ... 45
c- La famille des canaux à six segments transmembranaires... 46
1- Le courant Ito (transient outward current, figure H21 A)... 47
2- Le courant IKur (ultra rapid rectifier potassium current, figure H21 B) ... 48
3- Les canaux potassiques activés par le calcium « KCa channels » ... 48
4- Les canaux potassiques hERG (courant IKr) ... 49
4.1- Structure des canaux hERG ... 49
4.2- Régulation du courant IKr... 51
4.3- Pharmacologie du courant IKr... 52
4.4- Implication physiopathologique du courant IKr... 53
5- Le canal KCNQ1/KCNE1 et le courant IKs... 53
5.1- Structure des canaux KCNQ1/KCNE1... 53
5.2- Association entre les membres KCNQ et KCNE ... 55
5.3- Le courant IKs cardiaque généré par l’association KCNQ1/KCNE1 ... 57
5.4- Régulation du courant IKs... 60
5.4.1- Régulation du courant IKs par le système nerveux... 60
5.4.2- Régulation du courant IKs par le Phosphatidyl-inositol 4,5-bisphosphate (PIP2) ... 61
5.4.3- Régulation du courant IKs par le monoxyde d’azote (NO)... 62
5.5- Réponse du courant IKs à l’étirement membranaire ... 63
5.7- Modulation pharmacologique du canal KCNQ1/KCNE1 ... 64
5.8- L’implication physiopathologique du courant IKs... 65
5.8.1- QT long de type 1 ... 65
5.8.2- Syndrome du QT court... 65
5.8.3- Les fibrillations auriculaires et ventriculaires... 66
5.8.4- La surdité et autres pathologies... 66
III- Les pathologies arythmiques du muscle cardiaque... 66
A- Les mécanismes à l’origine des arythmies... 67
a- Les modulations de la pente de dépolarisation diastolique... 67
b- Les blocs auriculo-ventriculaires ... 67
c- Les postdépolarisations précoces ... 68
d- Les postdépolarisations tardives ... 69
e- Les arythmies de réentrée... 69
B- Les arythmies ... 71
a- Les arythmies atriales... 71
1- Les troubles de la commande sinusale... 71
2- Les extrasystoles atriales... 72
3- Les tachycardies atriales ... 72
4- Les fibrillations auriculaires ... 72
b- Les arythmies ventriculaires ... 73
1- Les extrasystoles ventriculaires ... 73
2- Les tachycardies ventriculaires ... 73
3- Les fibrillations ventriculaires ... 76
IV- Le syndrome du QT long ... 76
A- Le syndrome du QT long congénital... 77
B- Le syndrome du QT long acquis ... 79
V - Concepts et paramètres proarythmiques... 80
A- La réserve de repolarisation ... 80 B- Le concept de TRIaD®... 82 a- La triangulation ... 82 b- La « reverse use-dependence » ... 83 c- L’instabilité ... 84 d- La dispersion... 85
VI- Position du problème... 87
A- Première partie ... 88
B- Seconde partie ... 89
C- Troisième partie... 89
Matériels et méthodes I- Matériels biologiques ... 92
II- Culture cellulaire ... 92
A- Les cellules HEK 293 ... 92
B- Conservation des cellules et mise en culture... 93
a- Conservation ... 93
b- Mise en culture et repiquage ... 93
III- Amplification et extraction plasmidique... 94
A- Amplification des plasmides... 94
B- Extraction des plasmides... 96
a- Préparation du gel d’agarose... 97
b- Dépôt des échantillons et migration... 98
c- Digestion des plasmides... 98
IV-Transfection des cellules HEK 293 ... 98
A- Transfection des cellules HEK 293 par la technique calcium/phosphate ... 98
B- Isolement des clones stables après transfection ... 99
V- Protocole de RT-PCR (Reverse Transcriptase-Polymerase Chain Reaction)... 100
A- Extraction des ARN totaux ... 101
B- Réaction de transcription inverse ... 102
C- Réaction de polymérisation en chaîne... 102
D- Séparation des produits de PCR sur un gel d’agarose ... 103
VI- Méthodes d’analyse des protéines ... 103
A- Analyse des protéines par Western Blot ... 104
a- Préparation des échantillons protéiques ... 104
b- Dosage des protéines... 104
c- Electrophorèse des protéines dans un gel d’acrylamide en conditions dénaturantes. 104 d- Electrotransfert des protéines sur membrane de nitrocellulose ... 106
e- Immunodétection des protéines d’intérêt ... 106
f- Anticorps utilisés pour le Western Blot... 107
B- Analyse des protéines par immunofluorescence indirecte ... 108
VII- Technique de patch clamp ... 109
A- Principe de la technique ... 110
a- Configuration cellule attachée... 111
b- Configuration cellule entière... 111
c- Configuration inside out... 112
d- Configuration outside out ... 112
e- Configuration patch perforé ... 112
B- Dispositif expérimental ... 113
C- Solutions utilisées pour le pacth clamp ... 115
D- Protocole de stimulation et méthode d’analyse... 115
VIII - Technique de cœur isolé perfusé ou Langendorff ... 117
A- Principe de la technique ... 117
B- Acquisition et analyse des paramètres ... 119
IX- Technique de microélectrode ... 120
A- Principe de la technique ... 120
X- Méthodes d’analyses statistiques... 122
Résultats I- Première partie : caractérisation de la lignée HEK 293 transfectée de façon stable avec les gènes KCNQ1 et KCNE1... 125
A- Caractérisation moléculaire... 125
a- Résultats de RT-PCR ... 126
b- Résultats de Western Blot... 127
c- Résultats de l’immunofluorescence indirecte ... 128
B- Caractérisation électrophysiologique ... 130
a- Approche électrophysiologique ... 130
b- Approche pharmacologique ... 131
II- Deuxième partie : protection du cœur par la dexrazoxane contre l’allongement de
l’intervalle QT induit par la doxorubicine... 136
A- Introduction... 136
B- Résultats ... 137
C- Discussion et conclusion ... 139
III- Troisième partie: La réduction de la réserve de repolarisation par activation du courant sodique persistant (INaL) associée à l’inhibition du courant IKs, induit une prolongation du potentiel d’action et de l’intervalle QT. Implication de la doxorubicine. ... 151
A- Introduction... 151
B- Résultats ... 152
C- Discussion et conclusion ... 155
Conclusions générales et perspectives Conclusions générales et perspectives ... 180
Références bibliographiques Références bibliographiques ... 186
Historique
Historique
Historique
Historique
HISTORIQUE
I- Le cœur
A- Généralités
Le cœur est l’organe qui permet la circulation du sang dans l’ensemble de l’organisme, assurant de cette manière un apport continu en nutriments, hormones et gaz respiratoires nécessaires à la fonction et à la survie des cellules. Cet organe fonctionne comme une pompe sous le contrôle d’une activité rythmique. Il est en réalité constitué de deux cœurs montés en série : un cœur droit assurant la circulation pulmonaire ou petite circulation, et un cœur gauche assurant la circulation systémique ou grande circulation. Ces deux circulations permettent la réoxygénation du sang dans les poumons, et l’approvisionnement en nutriments et dioxygène des cellules. Le sang circule en sens unique dans les cavités cardiaques grâce à la présence d’un système valvulaire. Ce système, composé de quatre valves, assure une séparation hermétique entre les oreillettes et les ventricules d’une part, et entre les ventricules et les deux circulations d’autre part. Les valves cardiaques atrio-ventriculaires sont reliées à des muscles papillaires qui sont enchâssés dans la couche de tissu qui tapisse l’intérieur des ventricules. Ces muscles sont impliqués dans le fonctionnement de l’appareil valvulaire. Le ventricule gauche possède une paroi musculaire beaucoup plus importante que celle du ventricule droit et des oreillettes. Ceci s’explique par le fait qu’il est relié à la circulation systémique dans laquelle le trajet parcouru par le sang est le plus long, nécessitant ainsi une force de contraction et donc une pression plus importante. Un appareil circulatoire ainsi que plusieurs réseaux capillaires associés au cœur permettent la circulation sanguine et les différents échanges entre les cellules et le sang. Pour son fonctionnement, comme le reste de l’organisme, le cœur nécessite un apport continu en nutriments et dioxygène. Cet apport est assuré par de nombreux vaisseaux qui irriguent l’ensemble du tissu cardiaque, c’est le réseau d’artères coronaires qui prend naissance à la base de l’aorte juste après la valve aortique, par deux artères principales gauche et droite.
Le cœur est composé de plusieurs types de tissus :
Un tissu musculaire qui va permettre la contraction cardiaque et le fonctionnement de
l’appareil valvulaire. Ce tissu est constitué de cellules contractiles riches en myofilaments, appelées cardiomyocytes. Elles ne représentent qu’un tiers environ du nombre total de cellules
qui constituent le cœur, mais 70% de sa masse totale. Le tissu musculaire s’organise en un véritable syncitium fonctionnel dans lequel les cellules sont rattachées entre elles par des disques intercalaires composés de desmosomes assurant la cohésion des cellules au cours de la contraction musculaire, et de jonctions communicantes, par lesquelles transitent des ions et des petites molécules. Un dysfonctionnement des cardiomyocytes peut entraîner une diminution de la force contractile du muscle cardiaque et/ou la genèse d’arythmies.
Un tissu fibreux qui est responsable de la cohésion tissulaire du myocarde. Il est
constitué de cellules appelées fibroblastes qui représentent les 2/3 du nombre total de cellules du cœur pour seulement 10% du volume cardiaque. Les fibroblastes sont responsables de la synthèse et du renouvellement de la matrice extracellulaire qui, en formant un réseau dynamique, permet la cohésion des cellules cardiaques entre elles. En conditions pathologiques, ils vont libérer de nombreux facteurs ayant des effets autocrines et paracrines. Ces facteurs modifient le fonctionnement des fibroblastes et des autres types cellulaires cardiaques. Ce dysfonctionnement conduit à une fibrose excessive par augmentation de la synthèse de la matrice extracellulaire et du nombre de fibroblastes, entraînant alors des modifications de la contractilité et de la conduction de l’influx électrique du myocarde. De plus, dans certaines conditions pathologiques, les fibroblastes peuvent se différencier en myofibroblastes.
Un tissu vasculaire qui constitue le réseau d’artères coronaires qui permet d’alimenter
le myocarde en dioxygène et nutriments dont il a besoin pour son fonctionnement. Ce tissu vasculaire est composé en majorité de cellules de type endothélial, musculaire lisse, et fibroblastique. De nombreuses pathologies cardiaques telle que l’infarctus du myocarde ont pour origine l’occlusion d’une des artères de ce réseau coronaire privant de cette manière le muscle cardiaque des éléments nécessaires à son fonctionnement.
B- Activité des cellules cardiaques
a- Généralités
Indépendamment du système nerveux central, le cœur est capable de battre de façon autonome. L’influx électrique spontané va se propager à l’ensemble des cellules excitables. La propagation électrique se manifeste sous la forme d’une onde électrique, le potentiel
d’action (PA) dont le décours est fonction de la nature du tissu cardiaque parcouru (figure H1). Cet influx électrique va être à l’origine du phénomène de couplage excitation-contraction.
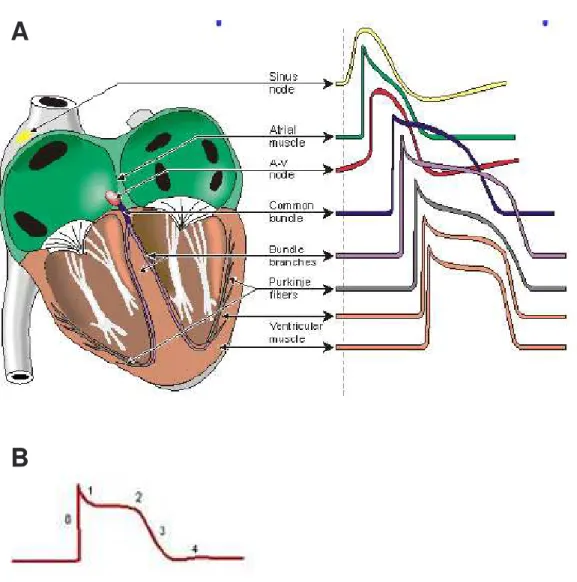
Figure H1 : représentation schématique des potentiels d’action enregistrés dans les différents tissus cardiaques (d’après
Nerbonne, 2000). A : potentiel d’action des différents tissus (Sinus node: nœud sinusal, AV node: nœud atrio ventriculaire, Tissus auriculaire et ventriculaire, Faisceau de His et fibres de Purkinje). B : représentation schématique d’un potentiel d’action ventriculaire et ses différentes phases (0 : dépolarisation rapide, 1 : courte repolarisation limitant la dépolarisation, 2 : phase plateau, 3 : repolarisation, 4 : potentiel de repos).
Une fois généré, l’influx va se propager avec un cheminement précis à l’ensemble du cœur, de cellule à cellule permettant de cette manière la contraction chronologique et synchronisée des cardiomyocytes, d’abord à l’étage auriculaire puis à l’étage ventriculaire. Ainsi, l’influx se propage depuis le nœud sinusal (NS) à travers les oreillettes, puis il converge vers le nœud auriculo-ventriculaire (NAV) faisant le lien entre les oreillettes et les
A
B
A
ventricules. A partir du NAV, il est amené à l’apex des ventricules par le faisceau de His, qui se sépare en deux branches droite et gauche. Chacune de ces branches se ramifie pour former un réseau de fibres très denses appelées fibres de Purkinje. Ces dernières vont s’insérer dans la couche interne des ventricules et transmettre alors l’influx électrique à l’ensemble des cardiomyocytes ventriculaires. La propagation de l’influx électrique à travers le myocarde, se fait grâce à la présence de canaux spécifiques permettant un couplage des cellules entres elles. Ces canaux appelés canaux jonctionnels ou encore jonctions communicantes sont constitués de connexines, et vont venir s’organiser en plaques jonctionnelles assurant ainsi une continuité électrique entre les cellules. Les canaux jonctionnels sont issus de deux hemi-canaux produits par chacune des cellules en contact. Un hémi-canal est composé de six connexines qui peuvent être identiques ou différentes, expliquant en autres les différences de vitesse de propagation observées selon le tissu cardiaque considéré.
La naissance de l’influx électrique et la propagation sont rendues possibles grâce à la présence de structures protéiques particulières au niveau des membranes de l’ensemble des cellules cardiaques. Ces structures protéiques ou canaux ioniques, vont permettre le transit des ions tels que les ions K+, Na+, Ca2+, Cl-, Mg2+ ou encore H+ au travers des membranes cellulaires. Le passage des ions d’un compartiment à un autre se fait, de manière sélective ou non, en fonction des propriétés intrinsèques de chacun des canaux ioniques. Ces propriétés vont être dépendantes de la structure même des canaux. De nombreux et divers mécanismes régulant l’ouverture et la fermeture des canaux ioniques ont été décrits. Parmi l’ensemble de ces mécanismes, peuvent être citées : la dépendance au potentiel de membrane, la sensibilité au pH ou au volume cellulaire, la régulation par un ligand, la régulation par des ions ou molécules intracellulaires (Ca2+, phosphorylation par les kinases, les nucléotides…), ou encore la régulation par couplage à différents récepteurs. Les canaux ioniques ont une expression cardiaque différentielle qui conduit à des propriétés électriques spécifiques à chaque compartiment cardiaque.
b- Les cellules à activité automatique dominante
Ce sont elles qui sont à l’origine de la capacité de contraction autonome du cœur. Elles sont localisées dans le nœud sinusal, le nœud auriculo-ventriculaire et le tissu de Purkinje. Elles ont la particularité de générer des potentiels instables (figure H2). Sur ces cellules de pacemaker naturel se développe spontanément une phase lente de dépolarisation diastolique. Cette phase dépolarise la membrane jusqu’au seuil de déclenchement d’un nouveau PA. La
fréquence de l’activité spontanée des cellules sinusales, par conséquent du rythme cardiaque, est soumise à une modulation via le système nerveux autonome par l’intermédiaire d’un certain nombre de neurotransmetteurs. L’acétylcholine libérée par le système parasympathique et la noradénaline libérée par le système sympathique vont respectivement diminuer et augmenter le rythme cardiaque. Ces agents régulateurs agissent sur la pente de dépolarisation diastolique à l’origine de l’activité électrique spontanée.
Figure H2 : représentation schématique des potentiels d’action des cellules automatiques (d’après Carmeliet et
Vereecke, 2000).
Le nœud sino-atrial possède une fréquence intrinsèque plus élevée que celle du nœud auriculo-ventriculaire et du faisceau de His, lui conférant ainsi son statut de pacemaker prédominant. Cependant, en conditions physiopathologiques, le nœud auriculo-ventriculaire et le faisceau de His peuvent prendre le relais et assurer cette fonction mais en générant des fréquences plus faibles. Les principaux courants ioniques impliqués dans la genèse et le décours des potentiels d’action des cellules à activité autorythmique, sont représentés sur la figure H2. La phase lente de dépolarisation diastolique est majoritairement due au courant If ou courant de pacemaker. L’activation de ce courant amène le potentiel de membrane
jusqu’au seuil d’activation des canaux calciques de type T. Ces deux composantes ioniques If et ICaT permettent d’atteindre le seuil d’activation du courant calcique de type L responsable de la phase de dépolarisation. La repolarisation membranaire est ensuite assurée par l’inactivation et la désactivation des courants entrants et par l’activation de certains courants potassiques, majoritairement Ikr. Cette repolarisation amène le potentiel de membrane au seuil d’activation du courant If qui sera à l’origine d’une nouvelle phase lente de dépolarisation diastolique.
.
c- Les cellules à activité contractile dominante
Figure H3 : représentation schématique des potentiels d’action des cellules contractiles (d’après Carmeliet et
Vereecke, 2000).
Les cellules auriculaires et ventriculaires sont responsables (entre autre) de la contraction du muscle cardiaque. L’influx électrique qui prend naissance dans les cellules autorythmiques va entraîner en se propageant, la dépolarisation des cellules contractiles, permettant ainsi l’entrée du calcium nécessaire à leur contraction (phénomène de couplage
excitation / contraction). La morphologie du potentiel d’action de ces cellules est différente de celle des cellules automatiques. Ceci résulte de l’expression différentielle des courants ioniques impliqués dans la genèse et le décours du PA. Cette variation d’expression des canaux ioniques et de morphologie des potentiels d’action est également observée entre les différents tissus contractiles, comme l’atrium et le ventricule (figure H3). Dans ces tissus, la phase de dépolarisation du potentiel d’action est principalement assurée par l’activation du courant sodique rapide. Cette dépolarisation est freinée par l’activation d’un courant Ito responsable de la repolarisation rapide et/ou transitoire du potentiel d’action représentée par l’encoche précédent la phase plateau. Cette dernière est la conséquence d’une entrée de calcium via les canaux calcique de type L et des propriétés de rectification entrante du courant IK1. Elle est suivie d’une phase de repolarisation principalement assurée par les courants IKr, IKs et /ou IKur .Comme l’indique la figure H3, la participation des différentes composantes potassiques est fonction du type cellulaire. Les courants de fond comme le courant IK1 vont permettre le maintien du potentiel de repos des cardiomyocytes.
d- L’électrocardiogramme (ECG)
L’activité électrique globale du cœur peut être enregistrée par réalisation d’un électrocardiogramme. Il s’agit d’un tracé enregistré par l’intermédiaire d’électrodes placées à la surface de l’organisme (figure H4). L’électrocardiogramme est une représentation graphique du potentiel électrique qui commande l’activité musculaire du cœur. En clinique, il représente un examen rapide, indolore et non invasif, permettant de surveiller l’appareil cardio-circulatoire pour la prévention ou le diagnostic des troubles du rythme cardiaque. Le premier électrocardiogramme humain a été montré en 1887 par Augustus D. Waller, suivi par la mise en évidence des différentes déflections ou ondes P, Q, R, S et T par Willhem Einthoven en 1895. Ce dernier montrera également en 1906 les premiers tracés d’électrocardiogrammes pathologiques.
Figure H4 : représentation schématique d’un signal électrocardiographique avec les différentes ondes et
intervalles constituant le complexe PQRST (www.davita-shop.co.uk/uploads/pics/ECG_hart.jpg).
Le signal électrocardiographique est constitué de la répétition d’un signal qui peut être découpé en différentes ondes et intervalles, correspondant chacun à un événement électrique spécifique au niveau du cœur. L’onde P correspond à la dépolarisation des cellules auriculaires et de ce fait à la contraction des oreillettes. L’espace PR correspond à la conduction auriculo-ventriculaire de l’influx électrique cardiaque. Le complexe d’onde QRS est le reflet de la dépolarisation des cellules ventriculaires, et représente par conséquent la contraction des ventricules. Le segment ST correspond au temps de la stimulation complète des ventricules. L’onde T représente la repolarisation des ventricules, et l’espace mesuré entre le début de l’onde Q et la fin de l’onde T (intervalle QT) reflète le temps global des phénomènes électriques ventriculaires. Il existe d’autres ondes qui peuvent apparaître sur le signal électrocardiographique, mais dans certains cas pathologiques (ondes absentes sur la figure H4). C’est le cas de l’onde U, qui suit l’onde T pouvant même fusionner avec cette dernière en cas d’intervalle QT prolongé. Elle correspond à une déflexion positive dont la signification reste encore discutée. Elle pourrait correspondre à la repolarisation des fibres de Purkinje ou représenter un facteur mécanique comme la relaxation ventriculaire. L'hypothèse la plus récente attribue la genèse de l'onde U à l’apparition de postdépolarisations précoces (EADs pour « Early After Depolarizations », voir chapitre III c) dans les cellules de Purkinje et les cellules mésocardiques (ou cellules M) qui constituent une couche de cellules situées dans le tiers sous-épicardique de la paroi ventriculaire (El Sherif et al., 1990 ; Cranfield et Aronson, 1991 ; Antzelevitch et Sicouri, 1994). Lorsque l’onde U est négative, certains
auteurs la définisse comme un critère d’ischémie myocardique (Gerson et al., 1979 ; Gerson et Mc Henry, 1980). L’ECG peut également présenter une onde J qui correspond à plusieurs types de pathologies comme l’hypotermie profonde, l’hypercalcémie ou encore le syndrome de Brugada (Osborn, 1953 ; Gussak et al., 1995 ; Yan et Antzelevitch, 1996 ; Ansari et Cook, 2003 ; Nishida et al., 2004). Certains troubles du rythme cardiaque vont entraîner des modifications caractéristiques du signal électrocardiographique, et seront facilement détectables au cours de l’électrocardiogramme.
II- Les courants ioniques cardiaques
A- Le courant de pacemaker ou courant I
fLe courant If (pour funny current) est un des mécanismes ioniques fondamental responsable de la phase lente de dépolarisation diastolique (Difrancesco, 1986). C’est un courant net entrant non spécifique, transporté par les ions sodium et potassium, qui s’active en fin de phase de repolarisation des potentiels d’action (Carmeliet et Vereecke, 2000). Son seuil d’activation est proche du potentiel maximum diastolique. Il est fortement impliqué dans la régulation nerveuse du rythme cardiaque.
Les canaux responsables du courant de pacemaker, ont été clonés récemment par Biel et al. (1999), Kaupp et Seifert (2001) et Ludwig et al. (1998, 1999). Ces auteurs ont identifié quatre gènes nommés HCN1 à 4 (Hyperpolarisation-activated cyclic Nucleotide-gated). Chacun d’eux code une structure protéique à six segments transmembranaires (6TM) (figure H5). Le segment 4, riche en acide aminés chargés positivement, constitue le senseur du canal sensible aux hyperpolarisations. Le pore du canal est formé par une boucle extracellulaire entre les segments 5 et 6. Sur la partie C-terminale de la protéine, est présent un site de liaison aux nucléotides cycliques (Renaudon et al., 1998) ayant une grande affinité pour l’AMPc. En se fixant sur son site, ce nucléotide cyclique module la probabilité d’ouverture du canal de pacemaker et donc le rythme cardiaque. Le courant If va être régulé positivement par la voie -adrénergique ( 1), et négativement par la voie cholinergique (M2). Ces deux voies entraînent une augmentation (voies 1 et 2 via Gs) ou une diminution (voie Ach via Gi) du taux d’AMPc intracellulaire (Difrancesco D, 1993 ; Difrancesco et al., 1994).
Figure H5 : modélisation de la structure d’un canal HCN, d’après (Biel, 2009). La portion C terminale montre
le site de liaison à l’AMPc. Deux sous-unités KCR1 et MirP1 pourraient réguler le canal.
Le profil d’expression de ces quatre gènes HCN est variable selon le tissu et l’espèce animale. Un canal fonctionnel est constitué de l’assemblage de quatre de ces structures protéiques, et cet assemblage peut être homo ou hétérotétramérique. Dans le cœur, l’isoforme HCN4 est la forme principalement exprimée dans le nœud sinusal et les fibres de Purkinje alors que HCN2 est l’isoforme majeure du tissu ventriculaire. L’expression de HCN4, dont la prédominance a été confirmée dans le nœud sinusal humain, serait donc corrélée à l’activité spontanée caractéristique des cellules cardiaques automatiques (Chandler et al. 2009).
En conditions pathologiques, If peut être présent sur l’oreillette et le ventricule (Thuringer et al., 1992 ; Porciatti et al., 1997 ; Fares et al., 1998) où il est responsable de la genèse d’arythmies, notamment au cours d’une libération accrue de catécholamines (Robinson et al., 1997). Le courant If a également été caractérisé dans les cardiomyocytes ventriculaires ; chez l’homme atteint d’insuffisance cardiaque et chez le rat hypertendu (rat SHR) (Cerbai et al., 1994, 1996, 2000).
Les ions césium, qui inhibent en grande partie If, ralentissent la phase de
dépolarisation diastolique sans toutefois supprimer l’activité rythmique des cellules nodales. Le même résultat est obtenu par des inhibiteurs plus spécifiques, tels que la zatébradine et l’ivabradine (S 16257) (Bois et al. 1996 ; 2007, pour revue).
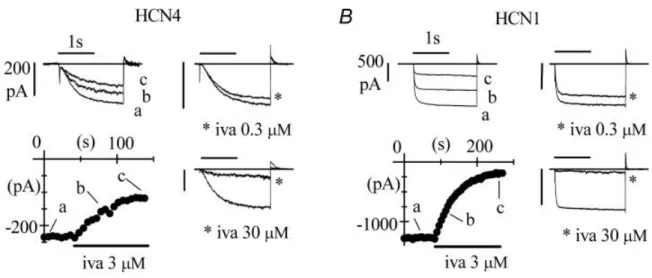
Figure H6 : exemple d’enregistrements du courant If à travers les isoformes humains HCN1 et 4 transfectés dans des cellules HEK 293, et de leurs différentes sensibilités à l’ivabradine (d’après Bucchi et al., 2006).
Cette dernière molécule bloque le courant If de façon « Use-dependent » (voir figure H6). En se fixant du côté interne du canal cette molécule va réduire la fréquence cardiaque et ainsi diminuer le travail du cœur et donc la consommation en oxygène du myocarde. Contrairement aux -bloquants cette molécule ne modifie pas la contraction cardiaque. L’ivabradine sous le nom de « Procoralan » est prescrite pour le traitement de l’angor stable chronique chez des patients ayant un rythme sinusal normal et qui présentent une intolérance aux -bloquants.
B- Le courant sodique rapide
Le courant sodique joue un rôle essentiel dans le déclenchement et le décours du
potentiel d’action des cardiomyocytes auriculaires et ventriculaires (Balser, 1999). Son activation induit une dépolarisation membranaire très rapide. Ses propriétés d’inactivation contrôlent partiellement la durée du potentiel d’action (Coraboeuf et al., 1979 ; Morad et Tung, 1982 ). Il est aussi impliqué dans la conduction de l’impulsion électrique cardiaque et conditionne la vitesse de propagation dans les tissus conducteurs (Abriel et Kaas, 2005, pour revue). Il est important de mentionner que ce canal est absent sur la membrane des cellules sinusales cardiaques au stade adulte.
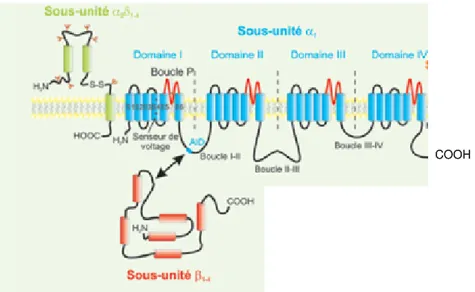
Cette « protéine canal » appartient à la grande famille des canaux sodiques « dépendant du voltage » qui comprend dix membres (Nav1.1-Nav1.9 et Nax). Un canal sodique est composé de plusieurs sous-unités. Une sous-unité glycosylée qui intègre le pore,
et plusieurs sous-unités de régulation (Balser, 1999 ; Goldin, 2001). Le canal sodique Nav1.5 se présente comme l’isoforme prédominante cardiaque. La sous-unité est codée par le gène SCN5A localisé sur le chromosome 3p21. Il comprend 28 exons. Cette sous-unité de poids moléculaire de 227 KDa est formée de quatre domaines membranaires (D1 à D4) comprenant chacun six segments transmembranaires S1 à S6 (Figure H7). La boucle "p" entre S5 et S6 des 4 domaines D borde le pore et le filtre de sélectivité au sodium. La boucle cytoplasmique entre les domaines D3 et D4 est impliquée dans le processus d’inactivation des canaux sodiques. Sur le cœur les canaux sodiques rapides dépendants du voltage sont principalement regroupés au niveau des disques intercalaires et des tubules T des myocytes (Dominguez et al., 2008 ; Remme et al., 2009).
Figure H7 : représentation schématique de la sous-unité cardiaque du canal sodique et des mutations décrites
et impliquées dans différentes pathologies (Balser, 1999).
Leur localisation et leur biosynthèse seraient sous la dépendance de l’ankyrine G dont la liaison serait localisée dans la boucle reliant les domaines D2 et D3 de la sous-unité (Lowe et al., 2008). Contrairement aux autres membres des canaux sodiques rapides, l’isoforme cardiaque est relativement résistant à la tétrodotoxine (TTX) (Diss et al., 2004). Ces canaux sont sensibles aux anti-arythmiques de classe I. Ces molécules sont prescrites dans certains cas d’arythmies auriculaires, jonctionnelles et ventriculaires.
Plusieurs mutations dans la séquence du gène SCN5A ont été décrites, et sont à l’origine de troubles du rythme plus ou moins sévères. Certaines de ces mutations sont responsables du syndrome de Brugada, une maladie autosomique dominante, caractérisée par des anomalies du segment ST au niveau des dérivations V1, V2 et V3 de l'électrocardiogramme, et associée à un risque élevé d'arythmies ventriculaires (Antzelevitch
et al., 2003) et de mort brutale. Dans ce syndrome, les mutations provoquent une perte de fonction de la sous-unité (Dumaine et al., 1999), à l’origine de la diminution de l’entrée de sodium. D’autres mutations du gène SCN5A sont soupçonnées d’être responsables de la mort subite du nourrisson (Hamilton RM, 2008) appelée SIDS (pour « sudden infant death syndrome ») bien que les origines de ce syndrome soient encore mal connues. D’autres mutations du gène SCN5A, sont à l’origine d’un troisième syndrome ; le QT long de type 3 (voir chapitre IV). Dans le cas du syndrome du QT long de type 3 ou de l’ischémie myocardique, l’inactivation du courant sodique est incomplète, provoquant de ce fait une surcharge sodique, elle-même favorisant une surcharge calcique intracellulaire responsable d’arythmies et de troubles contractiles. Cette inactivation incomplète est qualifiée de courant sodique persistant, soutenu ou lent (INaL). Une fraction de ces canaux sodiques partiellement inactivés est présente dans le myocarde physiologique, mais est fortement augmentée en conditions physiopathologiques (figure H8), entraînant ainsi la surcharge calcique des cellules via l’échange Na/Ca (Zaza et al., 2008).
Figure H8 : exemple de courants sodiques normaux et persistants, enregistrés par la technique de patch clamp
sur des cardiomyocytes ventriculaires humains et canins sains et pathologiques (d’après Undrovinas et al., 2008).
Dans ces conditions physiopathologiques, le courant sodique persistant provoque un allongement de l’intervalle QT de l’électrocardiogramme donc de la repolarisation cardiaque, par augmentation de la durée de la phase plateau du potentiel d’action. Ce phénomène est à l’origine de l’apparition de postdépolarisations précoces (EAD : « early afterdepolarisation »)
qui constituent un substrat pour certaines arythmies telles que les torsades de pointes (Dessertenne, 1966 ; Wu et al., 2004 ; Undrovinas et al., 2008 ; Zaza et al., 2008).
Expérimentalement, le courant sodique persistant peut être généré par un certain nombre d’outils pharmacologiques tels que les alcaloïdes comme la vératridine (Zong et al., 1992), les toxines peptidiques comme l’ATX-II (Romey et al., 1976 ; Wang et Wang, 2003), les pyréthroïdes (Spincer et al., 2001) et des petites molécules comme le DPI 201-106 et le BDF 9148 (Honerjager et al., 1982 ; Hoey et al., 1994 ; Yuill et al., 2000). Etant donné l’implication importante du courant sodique persistant dans ces situations pathologiques, ce dernier constitue une cible thérapeutique majeure. Il peut être inhibé de façon pharmacologique par la ranolazine (figure H9). Cette molécule utilisée pour le traitement de la crise d’Angor (Pepine et wolff, 1999), diminue d’une part le courant IKr (avec une IC50 de 11.5 µM) (Zygmunt et al., 2002) et d’autre part le courant INaL (avec une IC50 de 5-21 µM) (Zygmunt et al., 2002 ; Song et al., 2004). L’effet sur IKr génère un allongement du potentiel d’action mais sans effet de troubles du rythme de type EAD ou tachycardie ventriculaire. La réduction du courant INaL par la ranolazine réduit l’allongement du potentiel d’action et donc protège du risque potentiel arythmogène.
Figure H9 : potentiels d’actions monophasiques enregistrés sur le cœur de cobaye (d’après Wu et al.,
2004). A : enregistrement en condition contrôle et en présence de ranolazine 5µM. B : enregistrement en condition contrôle et en présence d ATX-II 20 nM seule puis associée à 5 µM de ranolazine.
Au cours des années 2000, un autre type de courant sodique a été caractérisé sur certaines préparations cardiaques. Ce courant appelé Ist (« pour sustained inward current ») est insensible à la TTX, mais est inhibé par les dihydropyridines (DHP) et activé par la voie -adrénergique (Mitsuiye et al., 2000).
C- Les courants calciques
Il existe une grande diversité de canaux calciques. Dans le cœur sont présents deux types principaux de canaux calciques, les canaux de type L (pour « long lasting ») et les canaux de type T (pour « transient ») avec pour chacun des propriétés électrophysiologiques et pharmacologiques différentes, ainsi qu’une distribution tissulaire variable. Ces canaux sont impliqués dans la contraction (type L) et l’automaticité cardiaque (type T).
a- Canaux calciques de type L
Le canal calcique cardiaque portant le courant ICaL (aussi appelé récepteur aux dihydropyridines, DHPr pour dihydropyridine receptor) a un seuil d’activation estimé à - 30 mV. Son inactivation (qui est dépendante du voltage, de la phosphorylation et du calcium intracellulaire) permet de limiter la durée du plateau du PA d’une part et de déclencher la phase de repolarisation d’autre part (Lipp et al., 1987 ; Hirano et al., 1992). Sa conductance unitaire est de l’ordre de 5 à 7 pS (Guia et al., 2001). Il est responsable de la phase de dépolarisation du PA sur les cellules sinusales et de la phase plateau sur les cardiomyocytes non automatiques. Ce courant régule l’inotropisme cardiaque. Il est modulé positivement par la voie -adrénergique qui par le biais de l’activation de la protéine kinase A (PKA) par l’AMPc, aboutit à sa phosphorylation (Curtis et Catterall, 1985).
Figure H10 : représentation schématique de la sous-unité d’un canal calcique de type L ; 2, , , sont les sous-unités régulatrices associées à (edk.admin.e-dition.fr/.../media_Dewaards_02.jpg).
Le canal est constitué de l’assemblage de quatre sous-unités ayant chacune une structure différente (figure H10). La sous unité 1 a comme la sous-unité des canaux
COOH COOH
sodiques, une structure organisée en quatre domaines (DI à IV) constitués chacun de six segments transmembranaires. Cette sous-unité qui intègre le pore du canal est associée à plusieurs sous-unités régulatrices. Il existe quatre isoformes différentes 1S, C, D et F codées respectivement par les gènes CACNA1S, C, D et F. Ces quatre sous-unités forment les canaux Cav 1.1, Cav 1.2, Cav 1.3 et Cav 1.4. L’isoforme 1C (Cav 1.2) est prédominante dans les cardiomyocytes. A cette structure , viennent s’associer trois autres sous-unités 2 , et . 2 est extracellulaire, et elle est liée à qui est membranaire par l’intermédiaire de ponts disulfures. est intracellulaire, et son association avec 1 se fait au niveau de la boucle intracellulaire présente entre DI et DII (Rousset et al., 2005).
Figure H11 : exemple de courants calciques enregistrés sur l’ovocyte de xénope transfecté (d’après Restituito
et al., 2001). A : courant calcique transitant à travers le canal constitué de l’association des sous-unités 1a- 2
avec 1 et son inactivation correspondante. B : courant calcique transitant à travers le canal constitué de
l’association des sous-unités 1a- 2 avec 2 et son inactivation correspondante.
L’association de 2 et de à 1 va augmenter le niveau d’expression de cette dernière et lui confère certaines propriétés électrophysiologiques comme l’inactivation dépendante du voltage et du calcium (Singer et al., 1991 ; Lacerda et al., 1991). Plusieurs isoformes de ont été identifiées, chacune étant capable de moduler les cinétiques d’activation, d’inactivation et la pharmacologie de 1 (Arikkath et Campbell, 2003). Une sous-unité a été identidiée dans les neurones et les muscles squelettiques. Des mutations du gène CACNA1C ont été identifiées et sont responsables du syndrome de Timothy (Splawski et al., 2005) dans lequel il a été décrit une perte partielle de l’inactivation du courant
entraînant alors une surcharge calcique intracellulaire responsable d’arythmies. Le courant qui transite à travers les canaux calciques de type L est également impliqués dans l’apparition des postdépolarisations précoces ou EADs (« Early AfterDepolarizations », voir chapitre III page 68).
Ce canal est la cible pharmacologique de molécules calciques (les agents anti-arythmiques de classe IV) classées en trois grandes familles : les dihydropyridines, les benzothiazépines et les phénylalkylamines. Les phénylalkylamines comme le vérapamil sont utilisées dans le traitement de l’hypertension, de l’angor stable et de certaines arythmies. Leur action consiste en une réduction de la propagation de l’influx électrique et une diminution de la capacité de contraction des cellules, cette dernière le rendant contre indiqué dans l’insuffisance cardiaque. Les dihydropyridines comme la nifédipine sont également prescrites dans l’hypertension artérielle et l’angor stable. Elles favorisent la vasodilatation des artères coronaires et périphériques. Le diltiazem est le chef de file des benzothiazépines qui constituent le troisième type d’anticalcique et qui présentent des effets intermédiaires à ceux des deux autres groupes.
b- Canaux calciques de type T
Le courant calcique de type T intervient au cours de la phase lente de dépolarisation diastolique sur les cellules sinusales, dans laquelle il permet au potentiel de membrane d’atteindre le seuil d’activation des canaux calciques de type L responsables de la phase de dépolarisation du PA (Hagiwara et al., 1988; Bois et Lenfant, 1991). La structure protéique de la sous-unité formant le canal calcique de type T à travers lequel transite le courant ICaT, est relativement proche de celle de 1 des canaux calciques de type L décrits précédemment (figure H12). Elle résulte de l’assemblage de quatre domaines DI à DIV composés chacun de six segments transmembranaires. Une grande boucle intracellulaire relie les domaines DI et DII. Cette boucle, constitue la principale différence structurale avec la sous-unité des canaux de type L. Deux isoformes ont été détectées dans les cardiomyocytes, 1G et 1H.
Ces deux sous-unités, qui sont les produits respectifs des gènes CACNC1G et H, forment les canaux de types Cav 3.1 et Cav 3.2. A la différence des canaux de type L, les canaux de type T ne sont pas soumis à une régulation par les sous-unités 2 et (Bers et Perez-Reyes, 1999) et ne sont pas modulés par une stimulation -adrénergique (Protas et
Robinson, 2000). De plus, ils sont activés pour des potentiels plus négatifs (de -70 mV à -50 mV) que ICaL, et leur inactivation est plus rapide (Nilius et al., 1985 ; Nargeot, 2000).
Figure H12 : Modélisation de la structure d’un canal calcique Cav 3.1, (Talavera K, Nilius B, 2006).
Contrairement aux canaux de type L, ils sont insensibles aux substances antiarythmiques de classe IV. Néanmoins, ils sont inhibés par la Kurtoxin (Chuang et al., 1998) ou par de faibles concentrations de nikel (10 µM), (Obajero-Paz et al., 2008).
D- Les canaux chlorures
Les canaux chlorures constituent une large famille de canaux ioniques de par leur structure, leurs propriétés biophysiques et leurs rôles physiologiques. Ils sont présents dans l’ensemble des tissus de l’organisme. D’une manière générale, ils participent à des phénomènes physiologiques tels que la régulation du volume cellulaire, le transport transépithélial, ou encore la régulation de l’excitabilité cellulaire (Jentsch et al., 2002). Dans le myocarde, plusieurs types de courants chlorures ont été identifiés (figure H13). Leur rôle physiologique est encore peu connu, mais leur implication dans des phénomènes pathologiques comme les troubles du rythme, l’ischémie ou encore le remodelage myocardique posthypertrophique, a été récemment proposée (Hume et al., 2000 ; Duan et al., 2005). Parmi ces courants chlorures cardiaques, se distinguent : ICLCA, ICLvol ou swell, ICLPKA, et
Figure H13 : représentation schématique des courants chlorures potentiellement présents dans les
cardiomyocytes (d’après Duan et al., 2005). ICLPKA : courant activé par la PKA : il serait porté par la protéine
CFTR. ICLCA: courant chlore activé par le calcium intracellulaire : il serait issu des canaux de type CLCA1 ou
Bestrophine. ICLir : courant chlore rectifiant entrant, porté probablement par les canaux de type ClC-2. ICLvol ou
swell: courant chlore activé par le gonflement cellulaire de support moléculaire non identifié.
a- Courant chlore IClCA
Il est activé par le calcium intracellulaire, présente une rectification sortante, une conductance unitaire faible (entre 1 et 3 pS), et il a été enregistré aussi bien dans les oreillettes que dans le ventricule (Jentsch TJ et al., 2002). Il a été décrit pour la première fois sur les myocytes auriculaires humains par Escande et al. en 1987. Dans les cellules du nœud atrio ventriculaire il participerait à la synchronisation des potentiels d’action (Verkerk et al., 2002). Bien que de nombreux candidats soient proposés, son identité moléculaire reste encore inconnue à ce jour. Il pourrait néanmoins s’agir des canaux membres des familles des bestrophines, des ClCA ou des TMEM16 (Duan, 2009). Sur le plan pharmacologique, les canaux chlorures « dépendants du calcium » sont inhibés par le DIDS et l’acide niflumique.
b- Courant chlore IClswell
Il s’agit d’un courant activé par le gonflement cellulaire, et il est présent sur tous les types cellulaires cardiaques (Jentsch et al., 2002). Il est impliqué dans la régulation du volume cellulaire suite à un choc hypotonique. Il présente une rectification sortante et une conductance unitaire de 30 à 70 pS (Vandenberg et al., 1997). Dans le cœur, un courant chlorure de type IClswell a été décrit sur les cellules auriculaires humaines (Demion et al., 2006) et sur le petit mammifère (Duan et al., 1997). Cette composante chlorure pourrait être associée à certains phénomènes pathologiques comme l’ischémie, l’insuffisance cardiaque ou la dilatation du tissu auriculaire (Kocic, 2005 ; Wang et Hill, 2006). De nombreuses études tentent d’élucider les mécanismes de régulation et l’identité moléculaire de cette composante anionique (Jentsch TJ et al., 2002). Les propriétés biophysiques de ce canal rappellent celles des canaux de type ClC-3 (Duan et al., 1997 ; 2001). Néanmoins, ces données sont controversées par d’autres travaux qui tendent à montrer que ClC-3 est absent sur le cœur (Weylandt et al., 2001).
c- Courant chlore IClPKA
Ce courant est stimulé par phosphorylation (via la protéine kinase A) et par hydrolyse de l’ATP intracellulaire. En condition [Cl-] isométrique sa courbe courant/potentiel est linéaire (Gadsby et al., 1995). Il possède une conductance unitaire de 8 pS. Cette conductance chlorure a été caractérisée sur les cellules auriculaires et ventriculaires chez plusieurs espèces (homme, chien, cobaye et lapin). Il est absent sur les cellules sinusales. Bien que ses propriétés électrophysiologiques et de régulation soient très proches de celles de la protéine Cystic Fibrosis Transmembrane conductance Regulator (CFTR), sa fonction dans le cœur reste encore controversée.
d- Courant chlore IClir
Le courant chlore rectifiant entrant a été identifié sur plusieurs préparations cardiaques, notamment sur les cardiomyocytes auriculaires et ventriculaires de souris et de cobaye (Duan et al., 2000). Sur ces préparations cardiaques, en condition isotonique, Duan et collaborateurs montrent que le courant est activé par des impulsions hyperpolarisantes, et qu’il est augmenté en condition hypotonique (Duan et al., 2000). La fonction de ce courant chlorure n’est pas encore éclaircie. Il pourrait jouer un rôle dans le maintien du potentiel de repos et le contrôle de l’homéostasie chlorure. Des travaux récents laissent penser que
l’identité moléculaire de ce courant anionique pourrait être celle du canal du type ClC-2 (Duan et al., 2005 ; Britton et al., 2005).
E- Pompe et échangeur
a- L’échangeur sodium/calcium (Na/Ca)
L’échangeur sodium/calcium est présent dans la membrane de toutes les cellules cardiaques, où il joue un rôle important dans la régulation de la concentration calcique intracellulaire, par conséquent, dans le phénomène du couplage excitation/contraction, ainsi que dans le contrôle de la durée du potentiel d’action cardiaque. Il représente le mécanisme principal d’extrusion du calcium depuis le milieu intracellulaire (Choi et al., 2000). Cet échangeur est également responsable des oscillations calciques induites pendant la phase lente de dépolarisation des cellules de pacemaker cardiaques. Au cours de son fonctionnement, l’échangeur sodium/calcium va permettre l’extrusion du calcium depuis l’intérieur de la cellule, en utilisant l’énergie du gradient sodique membranaire. La stœchiométrie de ce mécanisme est de 3 ions Na+ pour 1 ion Ca2+. Fujioka et al., (2000) proposent que cette dernière pourrait être de 4 Na+ pour 1 Ca2+. Elle serait fonction des concentrations sodique et calcique intracellulaires. Le potentiel d’inversion (Einv) de l’échangeur sur les cardiomyocytes est estimé entre -10 et -50 mV ; son fonctionnement va se faire dans le sens d’une entrée de sodium et d’une sortie de calcium pour les potentiels inférieurs au Einv et dans le sens inverse pour les potentiels supérieurs à Einv (Egan et al., 1989). En mode reverse, il est responsable de la contraction phasique myocardiaque. La régulation physiologique de l’échangeur est encore peu connue, cependant il semblerait qu’il soit sensible aux phosphorylations via les protéines kinases A et C (PKA et C).
L’isoforme humaine de l’échangeur est codée par le gène NCX1, localisé sur le locus p21-p23 du chromosome 2 (Kraev et al., 1996). C’est une protéine transmembranaire dont la première structure tridimensionnelle proposée se présente comme une protéine constituée de 11 segments avec l’extrémité N-terminale extracellulaire et la C-terminale intracellulaire. D’autres modélisations proposent 9 segments (Philipson et al., 2000) (figure H14).
Actuellement, peu d’agents actifs sont capables de bloquer cette protéine. Quelques molécules telles que le KB-R7943, le SEA0400 ou l’amiloride inhibent de façon non