EFFET D’UN SUPPLÉMENT D’HUILE DE LIN AVEC DIFFÉRENTS
NIVEAUX D’AMIDON DANS LA RATION SUR LE PROFIL EN
LACTONES ET LES PROPORTIONS DE DIFFÉRENTS
INTERMÉDIAIRES DU PROCESSUS DE BIOHYDROGÉNATION DE
L’ACIDE -LINOLÉNIQUE DANS LE LAIT CHEZ LA VACHE
Mémoire
LEA CADI SALIBA
Maîtrise en sciences animales
Maître ès sciences (M. Sc.)
Québec, Canada
Résumé
Vingt-quatre vaches ont été utilisées afin d’évaluer les effets du rapport fourrages:concentrés et de l’ajout d’huile de lin dans la ration sur les profils en acides gras et en lactones du lait. L’huile de lin a fait augmenter les concentrations de 18:3 cis-9, cis-12, cis-15 dans le gras du lait, et ces augmentations ont été plus importantes avec les rations riches en concentrés. L’huile a également fait augmenter les teneurs en 18:1 trans-13 et en 18:2 cis-9, trans-13, tandis que le 18:3 cis-9, trans-13, cis-15 n’a pas été détecté. La teneur en γ-12:0 a été plus élevée dans le lait avec la ration riche en concentrés et contenant de l’huile, mais aucun effet n’était apparent lorsque l’huile était ajoutée à la ration faible en concentrés. Finalement, la teneur en γ-12:1 a été plus élevée avec les rations riches en concentrés, tandis que la γ-12:2 n’a pas été détectée.
Table des matières
Résumé ... iii
Table des matières ... iii
Liste des tableaux ...vii
Liste des figures ... ix
Liste des abréviations et des sigles ... xi
Remerciements ... xiii
Avant-propos ... xvii
CHAPITRE 1: INTRODUCTION ... 1
CHAPITRE 2: REVUE DES TRAVAUX ANTÉRIEURS ... 5
2.1 Effet de l’alimentation de la vache sur la composition du lait ... 6
2.1.1 Effet de l’alimentation sur les constituants majeurs du lait et leur profil en acides gras... 6
2.2 Caractéristiques de l’acide -linolénique ... 8
2.2.1 Structure chimique et sources alimentaires ... 8
2.2.2 Bénéfices sur la santé humaine... 10
2.2.3 Biohydrogénation ruminale de l’acide
-linolénique ... 122.2.3.1 Effets des sources d’acide -linolénique sur les performances zootechniques chez la vache laitière ... 15
2.2.3.2 Effet de l’ajout de l’huile de lin sur le profil en acides gras ... 16
2.2.3.3 Interaction de l’acide -linolénique avec différents rapport fourrages : concentrés ... 17
2.3 Les lactones ... 19
2.3.1 Nature et composition ... 19
2.3.2 Voies de synthèse des lactones du lait ... 19
2.3.3 Propriétés sensorielles des lactones ... 22
2.3.3.1 Effet de l’alimentation des vaches laitières sur les qualités sensorielles des produits laitiers ... 24
2.3.4 Méthodes d’extraction et d’identification des lactones ... 26
2.3.4.1 Méthodes d’extraction ... 26
2.3.4.2 Méthodes d’identification ... 30
2.3.4.2.2 La chromatographie en phase gazeuse couplée à la spectrométrie de masse ... 33
2.4 Objectif et hypothèse de l’étude ... 35
2.5 Liste des ouvrages cités ... 36
CHAPITRE 3: EFFECT OF FEEDING LINSEED OIL IN DIETS DIFFERING IN FORAGE TO CONCENTRATE RATIO: 1. PRODUCTION PERFORMANCE AND MILK FAT CONTENT OF BIOHYDROGENATION INTERMEDIATES OF α-LINOLENIC ACID ... 47
3.1 Résumé ... 49
3.2 Abstract ... 50
3.3 Introduction ... 51
3.4 Materials and methods... 53
3.4.1 Animals and diets ... 53
3.4.2 Sampling, measurements and analyses... 55
3.4.3 Statistical analysis ... 57
3.5 Results ... 57
3.6 Discussion ... 67
3.7 Acknowledgements ... 71
3.8 References ... 72
CHAPITRE 4: EFFECT OF FEEDING LINSEED OIL IN DIETS DIFFERING IN FORAGE TO CONCENTRATE RATIO: 2. MILK LACTONE PROFILE ... 75
4.1 Résumé ... 77
4.2 Abstract ... 78
4.3 Introduction ... 79
4.4 Materials and methods... 81
4.4.1 Animals and diets ... 81
4.4.2 Sampling, measurements and analyses... 82
4.4.3 Sensory evaluation ... 83 4.4.4 Statistical analysis ... 84 4.5 Results ... 85 4.6 Discussion ... 87 4.7 Acknowledgements ... 93 4.8 References ... 94 CHAPITRE 5: CONCLUSION ... 97
Liste des tableaux
Tableau 2.1: Besoin en acides gras polyinsaturés pour un adulte consommant 2000 kcal/jour (en pourcentage des apports énergétiques) (Adapté de Legrand, 2010) .... 10 Tableau 2.2: Propriétés sensorielles des γ- et δ-lactones (Adapté de Dufossé et al. 1994 et
Bendall, 2001) ... 23 Tableau 2.3: Type de fibre utilisé en microextraction en phase solide (Adapté de Falcó &
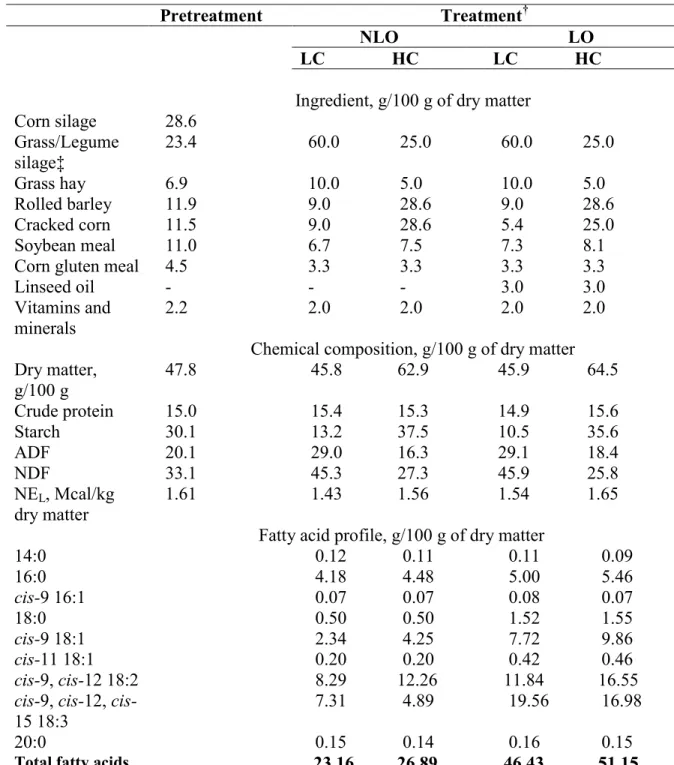
Mayo, 2007) ... 29 Table 3.1: Ingredients and chemical composition of experimental diets (g /100 g dry matter)
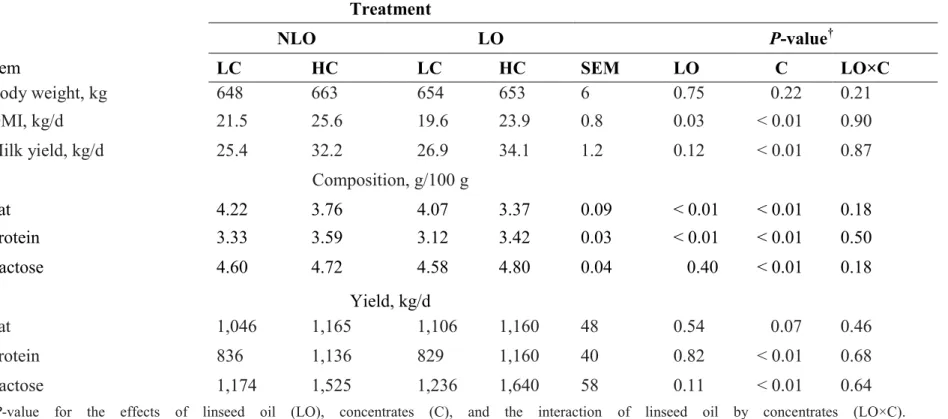
... 53 Table 3.2: Body weight, dry matter intake (DMI), milk yield, and milk composition in cows
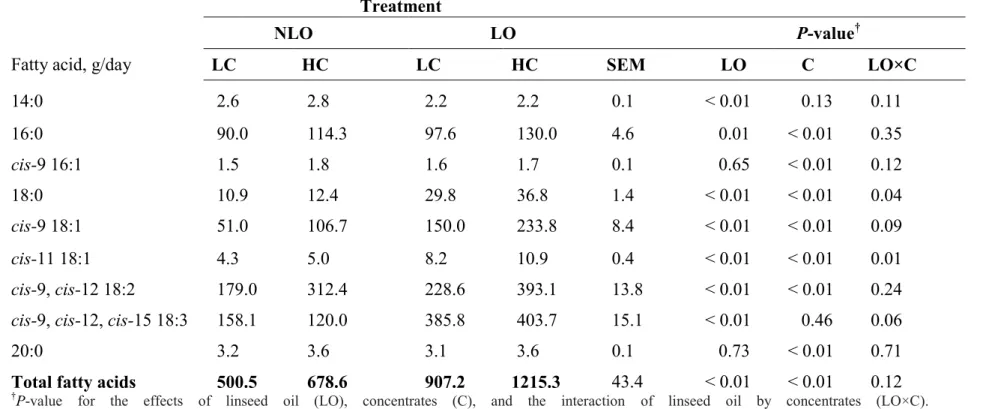
fed high (HC) or low (LC) concentrate diets without supplemental oil (NLO), or supplemented at 3% of dry matter with linseed oil (LO) ... 59 Table 3.3: Fatty acid intake in cows fed high (HC) or low (LC) concentrate diets without
supplemental oil (NLO), or supplemented at 3% of dry matter with linseed oil (LO) ... 60 Table 3.4: Milk fat composition in cows fed high (HC) or low (LC) concentrate diets
without supplemental oil (NLO), or supplemented at 3% of dry matter with linseed oil (LO) ... 62
Table 4.1: Milk lactone profile in cows fed low (LC) or high (HC) concentrate diets without supplemental oil (NLO), or supplemented with linseed oil (LO) . 86
Liste des figures
Figure 2.1: Conversion de l'acide -linolénique en acides gras polyinsaturés à longue chaîne (Adaptée de Williams, 2000) ... 9 Figure 2.2: Biohydrogénation ruminale et métabolisme endogène de l'acide α- linolénique (Adaptée de Destaillats et al. 2005) ... 14 Figure 2.3: Mécanisme de formation des lactones γ-12:0 et γ-12:1 pendant la lactation (Urbach, 1990) ... 21 Figure 4.1: Lactone profile of processed milk samples from cow fed low (LC) or high (HC) concentrate diets without supplemental oil (NLO), or supplemented with linseed oil (LO). Values represent the average of 3 replicates, with standard deviations shown as error bars ... 91 Figure 5.1: Devenir de l'acide linolénique chez la vache laitière ... 98 Figure 5.2: Sentiers de biohydrogénation de l'acide -linolénique et métabolisme mammaire des intermédiaires produits. Les flèches () indiquent les isomères pour lesquels une augmentation a été observée dans le lait des vaches ayant reçu de l'huile de lin dans leur alimentation (voir chapitre 3) ... 100 Figure 5.3: Voie suggérée de production de la lactone γ-12:0 à partir de l'acide -linolénique débutant par la biohydrogénation partielle de l'acide gras par les microorganismes du rumen et se poursuivant avec la lactonisation des intermédiaires monoénoïques (18:1) ... 101
Liste des abréviations et des sigles
ADF: acid detergent fiber (fibre au détergent acide) ADH: acide docosahexaénoïque
AEP: acide éicosapentaénoïque AG: acides gras
AGPI : acides gras polyinsaturés a.m.: before midday (avant-midi) cm: centimetre (centimètre) d: day (jour)
DMI: dry matter intake (matière sèche ingérée) eV: electron volt (électronvolt)
FA: fatty acid (acide gras)
F:C: rapport fourrages:concentrés g: gramme
h: hour
HC: high in concentrate (riche en concentré) i.d.: internal diameter (diamètre interne) kg: kilogramme
l : liter (litre)
LC: low in concentrate (pauvre en concentré) LO: linseed oil (huile de lin)
μg: microgram (microgramme) μl: microliter (microlitre) μm: micrometer
m: meter M: molar
Mcal: megacalorie (mégacalorie) min: minutes
ml: milliliter (millilitre) mm: millimeter (millimètre)
MS: mass spectrometry (spectromètre de masse) m/z : mass-to-charge ratio (rapport masse/charge) n: number of evaluator (nombre d’évaluateurs)
NDF: neutral detergent fiber (fibre au détergent neutre) NEL: net energy of lactation (énergie nette de lactation) NLO: without linseed oil (sans huile de lin)
Pd: probability distribution (distribution probable) p.m.: after midday (après-midi)
ppm: part per million (partie par million) RPM: rotation per minute (rotation par minute) s: second (seconde)
SPME: solid phase microextraction (microextraction en phase solide) v/v: volume-volume
α: alpha ß: beta δ: delta γ: gamma
Remerciements
Ces travaux ont été financés par le programme de Chaire Industrielle du Conseil de Recherches en Sciences Naturelles et en Génie du Canada (Ottawa, ON, Canada) avec la contribution des Producteurs laitiers du Canada (Ottawa, ON, Canada), de Novalait Inc. (Québec, QC, Canada), de Valacta (Ste-Anne-de-Bellevue, QC, Canada), de la Fédération des Producteurs de Lait du Québec (Longueuil, QC, Canada), et du Ministère de l'Agriculture, des Pêcheries et de l'Alimentation du Québec (Québec, QC, Canada). Les auteurs remercient également André Perreault et Philippe Cantin ainsi que le personnel administratif du Centre de Recherche en Sciences Animales de Deschambault (Québec, Canada) pour leur collaboration durant la phase expérimentale. Les auteurs sont également reconnaissants à Gabrielle St-Pierre et Micheline Gingras du département des Sciences animales de l’Université Laval pour leur aide dans les analyses de laboratoire.
Au Bienheureux
Estephan Nehmé
Avant-propos
C’est durant ma 4ème année d’Agronomie à l’Université Saint Esprit de Kaslik au Liban, que j’ai décidé de poursuivre mes études à l’étranger pour me spécialiser en production animale. Ainsi ai-je commencé ma recherche sur les universités proposant ce cursus et sur la possibilité d’obtenir une bourse. Lors de ma visite à l’UNESCO à Beyrouth, j’ai appris l'existence du PCBF (Programme Canadien des bourses de la Francophonie) et j’ai décidé de déposer une demande auprès de cet organisme. Deux mois plus tard, j’ai obtenu la bourse.
La direction de ce programme m’a mis en contact avec la direction du département des sciences animales à l’Université Laval. Ainsi, ai-je pris contact avec le Dr. Yvan Chouinard qui m’a proposé un sujet de Maîtrise sur l’effet d’un supplément d’huile de lin avec différents niveaux d’amidon dans la ration sur le profil en lactones et les proportions de différents intermédiaires du processus de biohydrogénation de l’acide α-linolénique dans le lait chez la vache. Malgré les distances, j’ai été immédiatement convaincue par ce sujet et par les propos du Dr. Chouinard, à qui je tiens à exprimer ma gratitude et mon plus profond respect. Dr Chouinard a fait preuve de confiance en ma personne et m'a fait intégrer son équipe de recherche. Je le remercie pour la qualité de son encadrement, la solide formation qu'il m'a donnée, et surtout pour sa disponibilité et ses nombreux et précieux conseils qui m’ont guidée tout au long de ce projet.
Durant ces années j’ai eu la chance de travailler avec une équipe magnifique, notamment avec ma co-directrice Dr. Rachel Gervais que je remercie pour son soutien tout au long de ces années, pour sa patience, son aide dans les analyses statistiques, dans l’intégration des chromatogrammes de même que dans la rédaction. Ce mémoire contient notamment deux articles qui ont été réalisés avec la collaboration de Dr. Rachel Gervais, Dr. Yvan Chouinard, Dr. Jean-Christophe Vuillemard, Yolaine Lebeuf et Jacinthe Fortin. Ces articles ont été publiés dans le Journal of Dairy Research sous les références suivantes:
Saliba L, Gervais R, Lebeuf Y & Chouinard PY 2014 Effect of feeding linseed oil in diets differing in forage to concentrate ratio: 1. Production performance and milk fat content of biohydrogenation intermediates of α-linolenic acid Journal of Dairy Research 81 82-90
Saliba L, Gervais R, Lebeuf Y, Vuillemard JC, Fortin J & Chouinard PY 2014 Effect of feeding linseed oil in diets differing in forage to concentrate ratio: 2. Milk lactone profile Journal of Dairy Research 81 91-97
Je remercie également Yolaine Lebeuf pour son aide lors des analyses de laboratoires. Je suis également très reconnaissante envers l'Université Laval, la Faculté des Sciences de l'agriculture et de l'alimentation, et en particulier le Département des Sciences animales pour les ressources humaines et matérielles mises à ma disposition. Merci à Juan Pablo Sarramone, Marie-Pier Villeneuve et Marie-Marie-Pier Dallaire.
Ce projet n’aurait pas pu voir le jour sans la contribution financière du PCBF. Ma profonde gratitude va vers le Canada, ce grand pays que j'ai appris à connaître et à aimer et que je respecte énormément. Le Canada est devenu et restera ma deuxième patrie. Et dans ce sens, je tiens à remercier également la communauté Libanaise de Québec, ma 2ème famille.
Finalement, les derniers, mais loin d'être les moindres, mes proches qui ont cru en moi et soutenue. Je tiens à mentionner les membres de ma famille: Georges, Antoinette, Miriana, Jennifer, Pierre, Georges, Cetrile, Kai et Luka; et aussi mes amis, surtout Nada et Zeina. Merci en particulier à mes parents d’avoir toujours été à mes côtés et d'avoir guidé mes pas tout au long des mes 28 ans. Ce document, c'est aussi le produit de leurs efforts.
Mon dernier remerciement s'adresse à celui qui, par son grand amour, m'apporte soutien et bonheur, Roy. Je suis très chanceuse d’avoir ce grand homme dans ma vie !
C’est avec le cœur rempli de fierté que je termine ce chapitre de ma vie. J'espère que le contenu de ce document sera un point, un mot, une phrase ... un chapitre dans la vie des autres.
CHAPITRE 1
Introduction
L’acide -linolénique (18:3 cis-9, cis-12, cis-15) est un acide gras essentiel (Legrand, 2010). Il a été identifié pour la première fois en Allemagne en 1887 à partir d’huile de lin, un an après la découverte de l’acide linoléique (Schmitt, 2010). Son caractère indispensable ne fut cependant établi que 40 ans plus tard à l'Université du Minnesota (Burr et Burr, 1929; 1930). À cette époque, une étude sur les rats a montré qu’un régime alimentaire dépourvu de gras induisait un retard de croissance, une chute de poils et une desquamation de la peau (Burr et Burr, 1930).
On estime aujourd’hui que 0,5 à 0,6 % de l’apport énergétique quotidien de l’homme doit être composé d’acide -linolénique afin d’éviter les symptômes de carence (FAO, 2010). Les graines et les huiles de certaines plantes (lin, chia, sacha inchi) sont reconnues pour leur richesse en acide -linolénique. Aussi, plusieurs études ont démontré l’efficacité de ces sources d’acide -linolénique à prévenir des maladies cardiovasculaires, des maladies artérielles périphériques, le cancer du sein, la polyarthrite rhumatoïde et les maladies coronariennes. (Simopoulos, 2002; Berbert et al. 2005; Harris et al. 2008; Maurer et al. 2012; Rodriguez-Leyva et al. 2013).
Étant donné les effets positifs des huiles riches en acide -linolénique, plusieurs chercheurs ont tenté d’enrichir le lait en cet acide gras polyinsaturé par la supplémentation des rations des vaches laitières (Donovan et al. 2000; Nelson et Martini, 2009). L’incorporation d’huile de lin, source d’acide -linolénique, dans la ration des vaches laitières permet de modifier le profil en acides gras du lait et ainsi de moduler sa qualité nutritionnelle (Brunschwig et al. 2010).
Cependant, après son ingestion par la vache, l’acide -linolénique est soumis au processus de biohydrogénation dans le rumen de l’animal. Selon les conditions de fermentation, différents intermédiaires sont générés par l’action des microorganismes. Si le sentier principal de biohydrogénation a déjà été identifié, plusieurs intermédiaires d’acides gras apparaissent dans le rumen des vaches et sont incorporés dans la matière grasse laitière. L’analyse de ces intermédiaires dans le lait peut donc nous permettre d’identifier les sentiers alternatifs de biohydrogénation.
Outre les effets reconnus aux acides gras polyinsaturés sur la santé du consommateur, de récentes études ont aussi démontré que l’augmentation des teneurs en ces acides gras dans la ration des animaux pouvait influencer le profil aromatique du lait.
Les principaux composés aromatiques dans le lait et les produits laitiers proviennent de deux sources: i) soit des protéines, de la matière grasse ou de composés dérivés du lactose lors du traitement thermique; ii) soit de la ration de base, du rumen et du métabolisme des tissus animaux durant la synthèse et la sécrétion du lait (Keen, 1998).
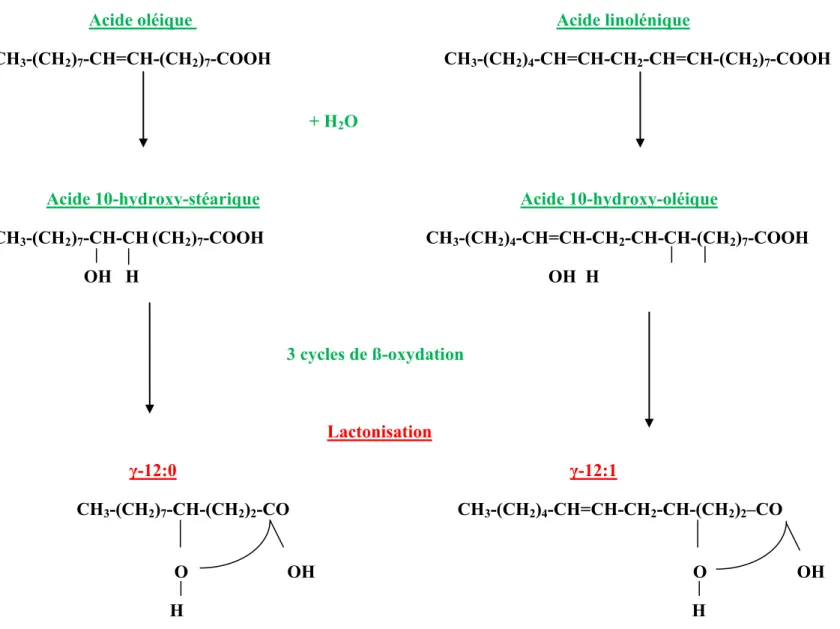
Parmi ces composés aromatiques, un des groupes les plus importants et qui contribuent grandement à la flaveur caractéristique du beurre est celui des lactones (Urbach, 1990). Dans ce groupe de composés aromatiques, deux séries sont plus abondantes dans les produits issus des ruminants, soit les gamma-lactones (γ -lactone à 4 atomes de carbone) et les delta-lactones (δ -lactones à 5 atomes de carbone) (Shahidi et al. 1986; Hettinga, 2005). L’acide oléique et l’acide linoléique sont les précurseurs respectifs de la γ-dodécalactone (γ-12:0) et de la γ-dodécaenolactone (γ-12:1) (Urbach, 1990).
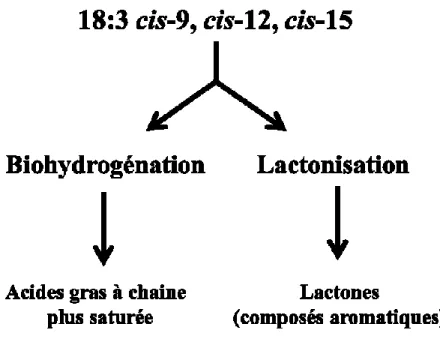
Plus précisément, chez la vache, la synthèse du γ-12:0 et du γ-12:1 est un processus en deux étapes où les acides gras insaturés dont la chaîne comporte 18 atomes de carbone sont d’abord hydratés en hydroxy-acides. Suite à l’absorption par la paroi intestinale de l’animal, ces molécules sont ensuite raccourcies par trois cycles de β-oxydation. En dernier
lieu, la molécule est cyclisée pour donner des γ-lactones (Joblin et Hudson, 1997). S’il était soumis à une série semblable de réactions, l’acide α-linolénique retrouvé dans la ration de la vache laitière pourrait potentiellement être le précurseur de la γ-dodec-cis-6,cis-9-dienolactone (γ-12:2), tel qu’il a été antérieurement observé lors de la lactonisation microbienne des acides gras de l’huile de lin (Kim, 2005).
D’autres facteurs alimentaires, outre la teneur en acides gras polyinsaturés de la ration, influencent les concentrations en lactones du lait chez la vache. À ce sujet, Urbach et Stark (1978) ont observé une augmentation des teneurs en γ-12:0 du lait lorsque des vaches laitières recevaient une ration totale mélangée contenant de l’avoine comme source d’amidon comparativement à des vaches recevant exclusivement un foin de luzerne. À la lumière de ces résultats, il est permis de croire que, chez la vache, des variations dans la teneur en amidon et en acides gras polyinsaturés de la ration pourraient influencer le profil
CHAPITRE 2
Revue des travaux antérieurs
2.1 Effet de l’alimentation de la vache sur la composition du lait
La composition des produits dérivés des animaux varie d'une espèce à l'autre, mais aussi à l'intérieur d'une même espèce, voire à l'intérieur des races d'espèces identiques. Cette variabilité dépend de plusieurs facteurs dont le stade de lactation, l'âge, la saison, la nutrition et plusieurs autres.
L’alimentation agit d’une façon marquée sur les produits dérivés des ruminants. Le lait et la viande des bovins contiennent des acides gras (AG) qui résultent de la transformation par la flore ruminale des AG polyinsaturés (AGPI) présents dans les rations.
2.1.1 Effet de l’alimentation sur les constituants majeurs du lait et leur profil en acides gras
L’ajout à la ration d’aliments concentrés et d’huile de lin augmente les proportions d’AG et d’amidon et, par le fait même, la densité énergétique des régimes alimentaires. En revanche, cet ajout diminue la digestibilité ruminale du contenu fibreux des fourrages (fibres aux détergents acide et neutre) (Ueda et al. 2003).
Sterk et al. (2011) ont montré qu’un passage d’un régime riche en fourrages (rapport fourrages:concentrés (F:C) 65:35) vers un régime riche en concentrés (F:C 35:65) augmente la prise alimentaire ainsi que la production laitière chez les vaches laitières. Or, il est reconnu que l’ingestion d’une ration riche en amidon induit une réduction marquée du taux butyreux chez les ruminants. Ce phénomène est connu sous le nom de syndrome dit du lait pauvre en matières grasses (Milk Fat Depression) et implique une interrelation entre les processus microbiens du rumen et le métabolisme tissulaire (Bauman et Griinari, 2003).
Une sous-alimentation provoque quant à elle une baisse de la production laitière en plus d’une chute du taux protéique du lait (Araba, 2006). Au contraire, une ration riche en énergie augmente le taux protéique (Araba, 2006). Il existe une corrélation positive entre le pourcentage d’amidon dans la ration et la concentration du lait en protéines (Sterk et al. 2011).
Les taux butyreux et protéique du lait sont influencés par la production des différents AG volatils dans le rumen. D’une part, l’acide acétique provient d’une fermentation adéquate de fourrage et induit une augmentation du taux butyreux. Au contraire, un excès de concentrés entraine une fermentation de type propionique favorable au taux protéique. Selon Gonthier et al. (2004), l’ajout de 12,5 % de graines de lin crues ou extrudées dans la ration est responsable d’une diminution de rapport acétate/propionate de 3,1 à 2,5. Ueda et al. (2003) ont mis en évidence qu'un supplément d’huile de lin à raison de 3 % de la matière sèche de la ration de vaches laitières n’a pas d’effet négatif important sur la digestion ruminale, à condition que la proportion de fourrages soit élevée (65:35 F:C). En revanche, l’ajout de 3 % d’huile à une ration riche en concentrés provoque une diminution du rapport acétate/propionate et de la quantité d’AG volatils produite.
Selon Lerch et al. (2012), le profil d’AG du lait peut être modulé par des facteurs intrinsèques (race, génotype, et stade de lactation) ou extrinsèques (alimentation principalement). L’alimentation joue un rôle très important sur le profil en AG du lait et son effet est rapide et réversible (Chilliard et al. 2000, Dewhurst et al. 2006). Le profil en AG
du lait est principalement relié à la composition en AG des fourrages et des concentrés consommés, ainsi qu’aux interactions entre les différents constituants de la ration.
2.2 Caractéristiques de l’acide -linolénique
2.2.1 Structure chimique et sources alimentaires
L’acide -linolénique est un AGPI dont la chaîne carbonée contient 18 atomes de carbone avec trois doubles liaisons de configuration cis. Par biotransformation dans l’organisme animal, l’acide -linolénique donne une quantité modérée d’Acide éicosapentaénoïque (AEP; 20:5 cis-5, cis-8, cis-11, cis-14, cis-17), qui a son tour est transformé, mais en des quantités plus faibles, en Acide docosapentaénoïque (ADP; 22:5 cis-7, cis-10, cis-13, cis-16, cis-19), puis en Acide docosahexaénoïque (ADH; 22:6 cis-4, cis-7, cis-10, cis-13, cis-16, cis-19) (Lecerf 2008) (Figure 2.1).
L’acide -linolénique est un AG essentiel qui compose les membranes thylacoïdales des feuilles vertes. Il constitue entre 55 et 65 % des AG de l’herbe et 17 % des AG du foin (Bauchart et al. 1985; Harfoot et Hazlewood 1988; Doreau et Poncet 2000). Certaines graines, et par la suite les huiles tirées de ces graines, sont riches en acide -linolénique et en particulier le colza, le soja et spécialement le lin, où il représente de 54 à 57 % des AG totaux (Palmquist et Jenkins 1980; Morand-Fehr et Tran 2001).
Acide Octadécatriénoïque (Acide -linolénique) 18:3 cis-9, cis-12, cis-15
↓ ∆6-désaturase Acide Octadécatétraénoïque 18:4 cis-6, cis-9, cis-12, cis-15
↓ Élongase
Acide Éicosatétraénoïque 20:4 cis-8, cis-11, cis-14, cis-17
↓ ∆5-désaturase Acide Éicosapentaénoïque
(AEP)
20:5 cis-5, cis-8, cis-11, cis-14, cis-17 ↓ Élongase
Acide Docosapentaénoïque (ADP)
22:5 cis-7, cis-10, cis-13, cis-16, cis-19 ↓ Élongase
Acide Tétracosapentaénoïque 24:5 cis-9, cis-12, cis-15, cis-18, cis-21
↓ ∆6-désaturase Acide Tétracosahexaénoïque
24:6 cis-6, cis-9, cis-12, cis-15, cis-18, cis-21 ↓ β-oxydation
Acide Docosahexaénoïque (ADH)
22:6 cis-4, cis-7, cis-10, cis-13, cis-16, cis-19
Figure 2.1: Conversion de l'acide -linolénique en acides gras
2.2.2 Bénéfices sur la santé humaine
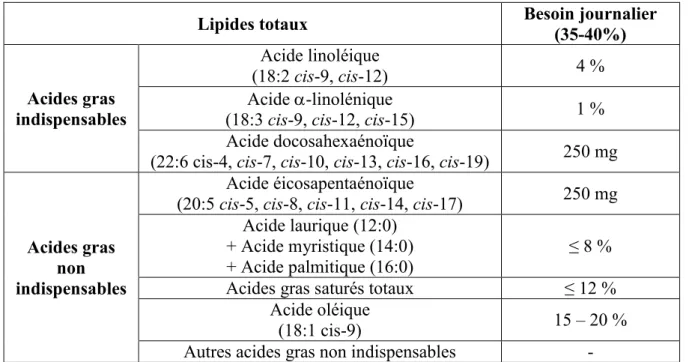
Les AG indispensables chez l’humain se limitent à trois: l’acide linoléique (18:2 cis-9, cis-12), l’acide -linolénique et un de ses dérivés, l’ADH (Legrand, 2010) (Tableau 2.1). Un déséquilibre entre les deux familles d’AGPI (les oméga-6 et les oméga-3) est préjudiciable à la synthèse et à la disponibilité des AEP et ADH et à leur incorporation dans les tissus. Ce déséquilibre pourrait accentuer des perturbations physiologiques et contribuer à l’apparition de pathologies telles que les affections neuropsychiatriques, les maladies cardiovasculaires, les pathologies inflammatoires, le diabète et l’obésité (Legrand, 2010).
La dose journalière bénéfique en acide -linolénique a été fixée à 2,0 g/j chez l’homme adulte et de 1,6 g/j chez la femme adulte (Agence française de sécurité sanitaire des aliments, 2003).
Tableau 2.1: Besoin en acides gras polyinsaturés pour un adulte consommant 2000
kcal/jour (en pourcentage des apports énergétiques) (Adapté de Legrand, 2010)
Lipides totaux Besoin journalier (35-40%)
Acides gras indispensables
Acide linoléique
(18:2 cis-9, cis-12) 4 %
Acide -linolénique
(18:3 cis-9, cis-12, cis-15) 1 %
Acide docosahexaénoïque
(22:6 cis-4, cis-7, cis-10, cis-13, cis-16, cis-19) 250 mg
Acides gras non indispensables
Acide éicosapentaénoïque
(20:5 cis-5, cis-8, cis-11, cis-14, cis-17) 250 mg Acide laurique (12:0)
+ Acide myristique (14:0)
+ Acide palmitique (16:0) ≤ 8 %
Acides gras saturés totaux ≤ 12 %
Acide oléique
(18:1 cis-9) 15 – 20 %
Selon Klein et al. (2000), il y a une relation inverse entre l’incidence du cancer et le profil des AG dans le tissu adipeux du sein. En effet, la concentration en acide -linolénique dans le tissu adipeux du sein est inversement proportionnelle à la présence de tumeurs cancéreuses. L’acide -linolénique est aussi capable de prévenir le développement du diabète induit chimiquement chez l’animal (Suresh et Das, 2003).
Certains isomères conjugués de l’acide -linolénique comme l’acide punicique (18:3 cis-9, trans-11, cis-13) sont présents naturellement dans les graines de certaines plantes (Pereira de Melo et al. 2014) et ont un effet important contre la leucémie (Suzuki et al, 2001) et contre le cancer du côlon (Kohno et al. 2004). Ces isomères sont toutefois différents de ceux présents dans le lait bovin tels que le 18:3 cis-9, trans-11, cis-15 et le 18:3 trans-9, trans-11, cis-15 (Kohno et al. 2004).
Plusieurs études ont montré les effets de l’acide α-linolénique dans la prévention des maladies cardiovasculaires. Les acides oméga-3 en général et l’AEP plus spécifiquement exercent un effet hypotriglycéridémiant quel que soit le niveau des triglycérides dans le sang (De Lorgeril et Salen, 2004). La consommation d’un breuvage laitier enrichi en AEP et ADH abaisse significativement les concentrations sanguines en cholestérol total et en cholestérol-LDL (lipoprotéines de faible densité), ayant ainsi un effet protecteur contre le risque de maladies cardiovasculaires (Baró et al. 2003). Presque la totalité des études sur la consommation d’aliments riches en AGPI oméga-3 tels que les poissons montrent une réduction des maladies cardiovasculaires, et coronariennes, et de la mortalité par cardiopathie ischémique (Lecerf, 2004). Cette réduction est beaucoup plus importante quand l’apport provient de l’acide -linolénique (Mozafarian et al. 2005) malgré son faible taux de conversion vers les AG oméga-3 à plus longue chaîne (Pawlosky et al. 2001).
D’autres études ont également montré une association entre l’apport d’AGPI oméga-3 (Albert et al. 1998, 2002) et des acides -linolénique (Albert et al. 2005) et la
diminution du risque de mort subite. Un effet antihypertenseur de l’acide -linolénique a aussi été documenté (Lecerf, 2008).
L’ADH présente quant à lui des propriétés antidépressives (Sublette et al. 2006) et a un rôle primordial dans le développement neuronal chez le fœtus et le nouveau-né (Williams, 2000). Certaines maladies neurodégénératives telles que le Parkinson et l’Alzheimer sont associées à une perte d’AGPI dans les membranes des cellules cérébrales. Ainsi un régime riche en AG oméga-3 sans excès d’AG oméga-6 pourrait retarder le développement de ces maladies (Youdim et al. 2000).
2.2.3 Biohydrogénation ruminale de l’acide -linolénique
Dans l’estomac des ruminants, les matières grasses des rations ingérées subissent deux processus majeurs: l’hydrolyse des lipides complexes aussi appelée lipolyse, et la biohydrogénation des AG insaturés. L’hydrolyse a pour effet de libérer les AG, principalement de leur lien avec le glycérol. Après cette réaction, les AG libérés et insaturés subissent une biohydrogénation conduisant à la saturation totale ou partielle de leur(s) double(s) liaison(s).
Dans des conditions normales, la biohydrogénation de l’acide -linolénique débute par une isomérisation de la double liaison cis-12 en double liaison trans-11. Cette première étape aboutit à la formation du 18:3 cis-9, trans-11, cis-15 (Kepler et Tove, 1967). S’ensuivent des étapes de réduction des doubles liaisons cis-9 puis cis-15 qui conduisent à la formation de l’acide vaccénique, le 18:1 trans-11. À son tour le 18:1 trans-11 subit une dernière réduction pour former l’acide stéarique, le 18:0. Les AG intermédiaires formés au cours du métabolisme ruminal sont absorbés et passent dans le sang puis dans le tissu mammaire où sous l’action de la ∆9-désaturase, le 18:1 trans-11 et le 18:0 sont transformés respectivement en 18:2 cis-9, trans-11 et 18:1 cis-9 (Griinari et al. 2000). Destaillats et al. (2005) ont également proposé un schéma alternatif de la biohydrogénation et du métabolisme endogène de l’acide -linolénique où la double liaison cis-12 est initialement
isomérisée en double liaison trans-13 pour donner le 18:3 cis-9, trans-13, cis-15 qui, à son tour, va être réduit pour donner le 18:2 cis-9, trans-13 ou le 18:2 trans-13, cis-15 (Figure 2.2).
Selon plusieurs essais, la biohydrogénation de l’acide α-linolénique est presque complète tandis que celle de l’acide linoléique est comprise entre 60 et 95% (Akraim et al. 2007). Malgré cette biohydrogénation intense qui a lieu normalement dans le réticulo-rumen, la teneur de la ration en AGPI a une certaine influence sur la composition en AGPI des lipides du plasma chez les vaches (Akraim et al. 2007). Cela peut être dû à une biohydrogénation ruminale incomplète, une partie des AGPI échappe à ce phénomène et serait absorbée par l’intestin. Ainsi, une ration riche en AGPI entraine une augmentation de la quantité de ces acides qui parviennent au niveau du duodénum et une augmentation de leur taux plasmatiques. Il en résulte un enrichissement des produits dérivés tels que le lait et la viande de tous les AG produits par ces voies métaboliques (Ledoux, 2006).
Acide α-linolénique 18:3 cis-9, cis-12, cis-15
18:3 cis-9, trans-11, cis-15 18:3 cis-9, trans-13, cis-15
18:2 trans-11, cis-15 18:2 cis-9, trans13 18:2 trans-13, cis-15
18:1 trans-11 18:1 trans-13 Biohydrogénation ruminale 18:0 18:1 trans-11 18:0 18:1 trans-13 Métabolisme endogène
18:2 cis-9, trans-11 18:1 cis-9 18:2 cis-9, trans-13
Figure 2.2: Biohydrogénation ruminale et métabolisme endogène de l'acide α-
linolénique (Adaptée de Destaillats et al. 2005) ∆9-Désaturase
Isomérisation
Réduction
Réduction Réduction
2.2.3.1 Effets des sources d’acide -linolénique sur les performances zootechniques chez la vache laitière
L’incorporation de lin dans les rations a un double objectif; diminuer la teneur en matières grasses (dans les marchés où le mode de paiement favorise la production d’un lait moins gras) et modifier la composition en AG dans le lait. Les supplémentations en graines et produits oléagineux ont aussi des effets importants sur les performances zootechniques des vaches laitières.
Selon Chilliard (1993), les graines et produits oléagineux peuvent diminuer l’ingestion due à une réduction de la digestibilité des nutriments dans le rumen spécialement lorsque cette supplémentation est sous forme d’huile avec un taux supérieur à 5 % de la matière sèche. Cette diminution d’ingestion peut affecter le poids vif de l’animal, notamment en début de lactation. Shingfield et al. (2010) ont montré que les AG, notamment les polyinsaturés, pourraient aussi avoir des effets post-absorptifs ce qui explique dans certains cas la diminution d’ingestion observée.
Plusieurs études ont montré des résultats contradictoires reliés aux effets de l’huile de lin sur la production laitière. Chilliard et Ferlay (2004) indiquent que l’apport de l’huile de lin augmente la production laitière tandis que Brunschwig et al. (2010) estiment que l’huile de lin n’a pas d’effet sur ce paramètre.
L’ajout du lin dans les rations réduit les émissions de méthane. Une réduction de 64 % a été observée en supplémentant l’huile de lin au taux de 5 % dans une ration à base d’ensilage de maïs (Martin et al. 2008). Avec de la graine de lin extrudée apportée au taux de 5, 10 et 15 % de la matière sèche, les réductions de production de méthane étaient proportionnelles aux quantités ajoutées, soit respectivement -10, -16 et -41 %. (Martin et al. 2009). Ces réductions semblent se maintenir après 18 mois de supplémentation continue en graines de lin extrudées (Martin et al. 2010).
Des résultats contradictoires concernant l’effet de l’huile de lin sur les performances reproductives ont été présentés: Petit et al. (2001; 2002) ont montré que l’ajout de graines de lin dans la ration réduit la sécrétion de prostaglandine F2α et augmente la taille du corps jaune et le taux de conception. La concentration en progestérone dans le sang a tendance à être plus élevée pour les vaches recevant des graines de lin notamment du jour 17 au jour 21 du cycle ovarien (Petit et Twagiramungu, 2006) ce qui peut améliorer la fertilité (Moris et Diskin, 2008).
Selon Lessard et al. (2003), la supplémentation d’AG de type oméga-3 contribue à améliorer la reproduction en diminuant la prolifération des cellules mononucléaires initiées lors de l’implantation des embryons chez les vaches laitières ce qui diminue la mortalité embryonnaire (Petit et Twagiramungu 2006). Cependant, l’ajout de lipides cristallisés (Carroll et al. 1990), de sels de calcium d’AGPI (Scott et al. 1995) ou de graines oléagineuses (Schingoethe et Casper, 1991) n’a pas eu d’effet sur les performances reproductives des vaches laitières et l’ajout de sels de calcium d’AGPI dans l’expérience réalisée par Sklan et al. (1994) a même diminué la fécondité des vaches.
2.2.3.2 Effet de l’ajout de l’huile de lin sur le profil en acides gras
L’ajout de lin dans les rations entraîne une baisse des AG courts et moyens, de 4 à 16 atomes de carbone, et une augmentation des AG longs à 18 atomes de carbone de la matière grasse du lait (Brunschwig et al. 2010). La teneur du lait en 18:0 est généralement aussi augmentée provenant de la biohydrogénation complète du 18:1 cis-9, de l’acide linoléique et de l’acide -linolénique. C’est le même cas pour le 18:1 cis-9 et le 18:2 cis-9, trans-11 provenant respectivement de l’action de la ∆9-désaturase mammaire sur le 18:0 et le 18:1 trans-11 (Glasser et al. 2008, Bernard et al. 2008).
Les AG oméga-6 et oméga-3 présents dans le lait proviennent uniquement des quantités ingérées puisqu’ils ne peuvent pas être synthétisés par les ruminants (Chilliard et al. 2007). Enfin, l’apport de l’acide -linolénique augmente les 18:1 (cis-15 et trans-13 à trans-16), les 18:2 (cis-9, trans-12; cis-9, trans-13 et trans-11, cis-15), et les acides linoléiques conjugués (cis-11, trans-13; cis-12, trans-14; trans-11, cis-13; trans-12, cis-14; trans-9, trans-11; trans11, trans-13 et trans-12, trans-14) (Chilliard et al. 2007). L’apport de lin permet aussi d’augmenter la teneur du lait en 18:3 cis-9, trans-11, cis-15 chez la vache laitière (Akraim et al. 2007, Rego et al. 2009).
2.2.3.3 Interaction de l’acide -linolénique avec différents rapport fourrages:concentrés
Plusieurs facteurs affectent le processus de biohydrogénation dont le pH ruminal, le type de fourrage, le pourcentage de concentrés ainsi que beaucoup d’autres facteurs. L’effet de ces facteurs est complexe car il dépend de la nature de l’AG, ainsi que des interactions de cet AG avec les autres composants de la ration.
Une étude effectuée par Loor et al. (2004) a montré que pour un même pH ruminal (6,38 ± 0,12), l’ajout d’huile de lin à des rations avec un rapport F:C faible (35:65) ou élevé (65:35) conduit à une diminution de la biohydrogénation des AGPI. Les acides gras de 4 atomes de carbones à 16 atomes de carbones, ainsi que les 18:0, 18:1 cis-9, 18:1 trans-11 et 18:2 cis-9, trans-11 ont augmenté de manière plus importante avec une ration pauvre en concentrés supplémentée en huile de lin tandis que le 18:1 trans-10 et l’acide -linolénique ont eu tendance à moins augmenter qu’avec une ration riche en concentrés (Loor et al. 2005). Ces résultats indiquent une déviation des voies de biohydrogénation vers le 18:1 trans-10 aux dépens du 18:1 trans-11 (Griinari et Bauman, 1999) dans le cas de supplémentations en oléagineux de rations riches en amidon (Chilliard et al. 2007, Shingfield et al. 2010).
Le type de fourrage peut aussi affecter le processus de biohydrogénation. Brunschwig et al. (2010) ont montré que le rapport trans10/trans11 des isomères du 18:1 augmente plus fortement avec un supplément de lin dans une ration à base d’ensilage de maïs qu’une ration à base de foin. Les teneurs du lait en acide linoléique, en acide -linolénique et en AG trans ont augmenté de manière plus importante lors d’un apport d’huile de lin dans un régime à base d’ensilage de maïs, en comparaison avec un régime à base d’ensilage d’herbe. Par contre, les augmentations des teneurs en 18:0 et en 18:1 cis-9 ont été plus marquées dans les matières grasses du lait dans le cas de l’ensilage d’herbe (Chilliard et al. 2007).
2.3 Les lactones
2.3.1 Nature et composition
Les lactones sont des molécules présentes dans une grande variété d’aliments et de boissons. Les γ- et δ-lactones sont les plus abondantes. Elles sont reconnues pour leur contribution à la saveur unique du beurre qui contient 26 lactones différentes dont 15 γ- lactones et 11 δ-lactones (Urbach, 1990; Dufossé et al. 1994). Elles sont présentes dans certains fruits comme l’abricot, la fraise, la papaye, la pêche, la mangue, la nectarine et le fruit de la passion (Dufossé et al.1994) ainsi que dans plusieurs boissons comme le thé, le café et le vin (Maga, 1976). Les lactones sont des esters particuliers contenant un cycle bi-oxygéné qui se synthétisent dans le rumen et les tissus des animaux (Dufossé et al. 1994; Walker et al. 1968; Joblin et Hudson, 1997).
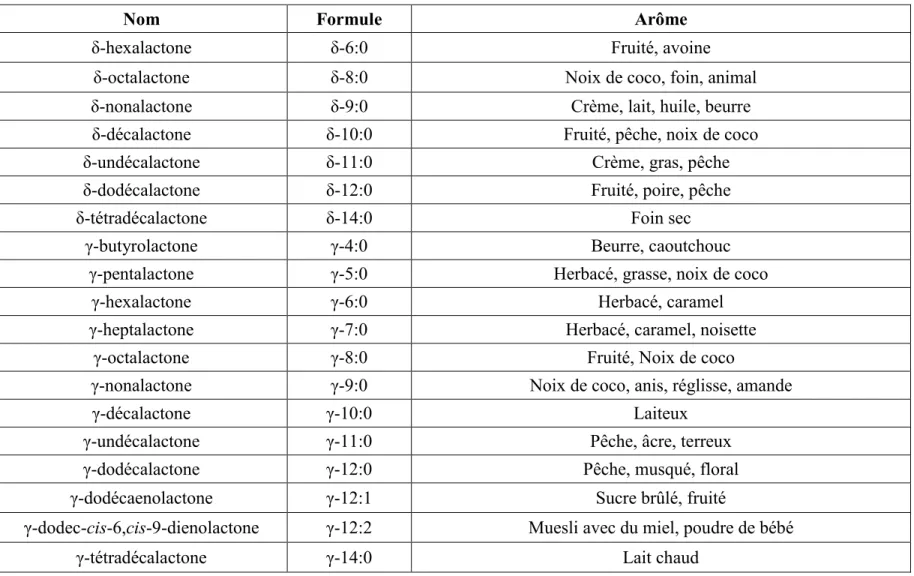
Selon la taille de leur hétérocycle, différentes formes de lactones ont été identifiées dans le lait bovin. Le nombre d’atomes de carbone pour les lactones volatiles est compris entre 4 (butyrolactone) et 12 (dodécalactone) (Dufossé et al. 1994). Les γ-lactones ont un pouvoir aromatisant plus élevé que les δ-lactones (Engel et al. 1988) et leur pourcentage dans les aliments s’élève à 63% contre seulement 23% pour les δ-lactones (Dufossé et al. 1994). Par contre ces dernières sont plus abondantes dans le lait bovin (Hettinga, 2005).
2.3.2 Voies de synthèse des lactones du lait
Les précurseurs des δ- et γ-lactones sont les AG hydroxylés et plus spécifiquement les 5- et 4-hydroxy acides respectivement (Singh et al. 2003). Ces AG hydroxylés peuvent avoir plusieurs origines: ils peuvent être présents sous forme de triglycérides dans le lait (Urbach et al. 1972), peuvent provenir du catabolisme normal des AG ou être générés à partir des AG insaturés par l'action des lipoxygénases ou des hydratases (Dufossé et al.
1994) et peuvent être libérés par hydrolyse lors du traitement thermique du lait (Dimick et al. 1969).
Selon Urbach et Stark (1978) « le potentiel lactone » est défini par la quantité de lactones libérées après chauffage de la matière grasse à 180°C en présence d’eau et absence d’air. Après ce traitement thermique, les acides hydroxylés estérifiés au glycérol seront hydrolysés pour donner les acides hydroxylés libres, qui à leur tour seront spontanément lactonisés (Mattick et al. 1959).
Les hydroxy-acides libres provenant des AG à longues chaines seront raccourcis par 3 cycles de ß-oxydation. Les acides hydroxylés en position 4 et 5 se cyclisent respectivement sous forme de γ- et δ-lactones (Joblin et Hudson, 1997).
Les acides oléique et linoléique sont les précurseurs des lactones γ-12:0 et γ-12:1, via la production des acides 10-hydroxy-stéarique et 10-hydroxy-oléique, respectivement (Urbach, 1990) (Figure 2.3).
Acide oléique Acide linolénique
CH3-(CH2)7-CH=CH-(CH2)7-COOH CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH
+ H2O
Acide 10-hydroxy-stéarique Acide 10-hydroxy-oléique
CH3-(CH2)7-CH-CH(CH2)7-COOH CH3-(CH2)4-CH=CH-CH2-CH-CH-(CH2)7-COOH OH H OH H 3 cycles de ß-oxydation Lactonisation γ-12:0 γ-12:1 CH3-(CH2)7-CH-(CH2)2-CO CH3-(CH2)4-CH=CH-CH2-CH-(CH2)2–CO O OH O OH H H
2.3.3 Propriétés sensorielles des lactones
Les lactones sont des contributrices importantes à la saveur et à l'arôme du lait et des produits laitiers. Elles se caractérisent généralement par une odeur à caractère fruité et de framboise (Urbach et Stark, 1978).
Selon Dufossé et al. (1994), les caractéristiques aromatiques des lactones sont influencées par de nombreux facteurs:
-La longueur de la chaîne latérale: l’allongement de la chaîne latérale est capable de modifier les propriétés organoleptiques des γ-lactones sans avoir une influence remarquable sur les δ-lactones. On passe d’un arome doux herbacé pour la γ-pentalactone (γ-5:0) à une odeur forte, fruitée, ou de pêche pour la γ-undécalactone (γ-11:0).
-La position de la double liaison: Nobuhara, en 1969, a étudié l’effet de la position de la double liaison sur les perceptions sensorielles des lactones synthétisées. La δ-lactone à 10 atomes de carbone sans double liaison était décrite par les attributs crémeux, doux, de noix de coco, de pêche ou de lait. À l’inverse, la δ-lactone à 10 atomes de carbone avec une double liaison en position 6 était qualifiée de rance.
-La présence de substituant sur le cycle ou sur la chaîne: La δ-nonalactone (δ-9:0) était décrite comme huileuse, de chèvre et chimique avec l’addition d’un groupement méthyle en position 3 contre les attributs de beurre, de lait et crémeux en absence de ce groupement.
-La chiralité: Elle joue un rôle dans l’intensité de l’odeur. Les formes R sont responsables d’odeurs plus intenses que leurs homologues de la forme S chez les δ et les γ-lactones.
Tableau 2.2: Propriétés sensorielles des γ- et δ-lactones (Adapté de Dufossé et al. 1994 et Bendall, 2001)
Nom Formule Arôme
δ-hexalactone δ-6:0 Fruité, avoine
δ-octalactone δ-8:0 Noix de coco, foin, animal
δ-nonalactone δ-9:0 Crème, lait, huile, beurre
δ-décalactone δ-10:0 Fruité, pêche, noix de coco
δ-undécalactone δ-11:0 Crème, gras, pêche
δ-dodécalactone δ-12:0 Fruité, poire, pêche
δ-tétradécalactone δ-14:0 Foin sec
γ-butyrolactone γ-4:0 Beurre, caoutchouc
γ-pentalactone γ-5:0 Herbacé, grasse, noix de coco
γ-hexalactone γ-6:0 Herbacé, caramel
γ-heptalactone γ-7:0 Herbacé, caramel, noisette
γ-octalactone γ-8:0 Fruité, Noix de coco
γ-nonalactone γ-9:0 Noix de coco, anis, réglisse, amande
γ-décalactone γ-10:0 Laiteux
γ-undécalactone γ-11:0 Pêche, âcre, terreux
γ-dodécalactone γ-12:0 Pêche, musqué, floral
γ-dodécaenolactone γ-12:1 Sucre brûlé, fruité
γ-dodec-cis-6,cis-9-dienolactone γ-12:2 Muesli avec du miel, poudre de bébé
Selon Siek et al. (1971), les seuils de perception « en bouche » des lactones sont plus bas dans l’eau que dans l’huile. En présence de matière grasse, les seuils olfactifs de perception sont considérablement augmentés (Guyot et al.1996). Les lactones à longue chaîne sont relativement hydrophobes, ainsi elles sont largement retenues par la matière grasse (Siek et al. 1971).
À poids moléculaire égal, les seuils de détection des γ-lactones sont plus bas que ceux des δ-lactones. Dans l’eau par exemple, les seuils de perception de la γ-octalactone (γ-8:0) et de la γ-décalactone (γ-10:0) sont respectivement 50 et 9 fois plus faibles que ceux de la δ-octalactone (δ-8:0) et de la δ-décalactone (δ-10:0). Finalement, les seuils olfactifs des γ-lactones s’élèvent avec le raccourcissement de la chaine latérale (Engel et al. 1988).
2.3.3.1 Effet de l’alimentation des vaches laitières sur les qualités sensorielles des produits laitiers
L’alimentation, tel qu’il a été mentionné précédemment, agit d’une façon marquée sur les composés majeurs du lait. Elle influe sur la composition chimique du lait, soit par le transfert direct des composés de la ration, soit par la modification du métabolisme des vaches (Urbach, 1990). Par exemple, des ensilages de mauvaise qualité ou divers produits végétaux (oignon, ail, crucifères) produisent des goûts indésirables dans les produits laitiers (Urbach, 1990).
Le pâturage joue également un rôle primordial sur la flaveur du lait. Les herbes broutées contiennent des marqueurs tels que les terpènes, les caroténoïdes et les polyphénols (Cornu et al. 2009) qui sont transférés dans les sécrétions lactées. En évaluant les qualités sensorielles, Dubroeucq et al. (2002) ont montré une différence significative entre le lait provenant de vaches mises au pâturage et le lait provenant de vaches alimentées d’une ration riche en concentrés. Dans le même ordre d’idée, Drake et al. (2005) ont signalé que le fromage Cheddar provenant de la Nouvelle-Zélande avait un goût herbeux en
comparaison à celui des États-Unis et de l’Irlande. Ils ont estimé que cette différence pouvait être due aux systèmes de pâturage utilisés en Nouvelle-Zélande.
La teneur totale en lactones de la matière grasse du lait comprenant principalement des δ-lactones est également influencée par la ration de base des vaches laitières. Dans une étude portant sur 276 animaux, le lait provenant des vaches au pâturage avait une teneur totale en lactones inférieure à celui provenant des vaches alimentées de ration conventionnelle à base de fourrages conservés et de grains (Dimick et Harner, 1968).
Urbach et Starck (1978) ont quant à eux effectué une étude approfondie sur les effets de différents régimes alimentaires sur les niveaux de lactones dans le lait. En ajoutant à la ration de l’huile de tournesol, le niveau des AGPI augmentait dans la matière grasse laitière. Le lait provenant des animaux nourris de ce régime a été caractérisé par une saveur sucrée et de framboise.
Bendall (2001) a comparé le profil aromatique de deux types de lait provenant de vaches laitières alimentées par différents types de régimes. Seule la γ-12:2 était présente dans le lait provenant des vaches alimentées par une ration totale mixte et absente chez les vaches au pâturage. Tous les autres composés étaient présents dans les deux types de lait avec différents niveaux de détection. Malgré cette similarité de composés volatils, il y avait une grande différence de flaveur entre les deux échantillons de lait. Bendall (2001) a suggéré que cette différence de flaveur était due à des concentrations différentes d’un ensemble commun de composés aromatiques plutôt qu’à un composé associé uniquement à un type de ration particulière.
Selon Urbach (1990), pour parvenir à augmenter le niveau de la γ-12:0 dans le lait, il faut une source d’amidon facilement disponible ainsi qu’une source d’AG précurseurs: de l’acide oléique pour la γ-12:0 et de l’acide linoléique pour la γ-12:1.
2.3.4 Méthodes d’extraction et d’identification des lactones
2.3.4.1 Méthodes d’extraction
Au fil des années, des équipes de recherche ont fait de grands efforts pour développer des méthodes fiables et efficaces pour extraire les composés volatils à partir de plusieurs types de substrats. Diverses méthodes d'extraction existent. Chacune de ces techniques a ses avantages et ses inconvénients.
Les composés volatils dans les produits laitiers sont distribués d’une façon très hétérogène et se trouvent à l’état de traces (Mariaca & Bosset, 1997). Afin de pouvoir détecter les changements des profils aromatiques, des méthodes d'analyse très sophistiquées sont appliquées en plus des tests sensoriels (Imhof & Bosset, 1994). D’un autre côté, il est très important que les techniques d’extraction utilisées ne créent ni n’introduisent de composés volatils contaminants (Marsili, 2000).
Plusieurs méthodes d’extractions des composés volatils des produits laitiers ont été développées telles que: la distillation à la vapeur (en anglais: steam distillation), l’extraction à l’aide d’un solvant (en anglais: solvent extraction), la distillation-extraction simultanée (en anglais: simultaneous distillation-extraction), l’évaporation de flaveurs assistée par solvant (en anglais: solvent-assisted flavor evaporation), l’analyse statique et dynamique d’espace de tête ou d’effluve (en anglais: headspace) et la microextraction en phase solide (en anglais: solid-phase microextraction).
Le choix d'une technique dépend de plusieurs facteurs, notamment du nombre d'échantillons à tester, du type de l’échantillon, des limites de détection souhaitées et de la précision requise (Marsili, 2000).
-La distillation à la vapeur est l’une des plus anciennes techniques utilisées pour séparer les composés volatils à partir de la matière non volatile. Malgré la rapidité et la simplicité de cette méthode, la température élevée appliquée durant la distillation peut conduire à la formation d’artefact (Reineccius, 2006).
-La méthode d’extraction à l’aide d’un solvant utilise le plus couramment l’éther di-éthylique bien qu’il ait été montré qu’il est moins efficace que d’autres solvants (Alewijn et al. 2003). Prosoki et al. (2007) ont montré que l’éther di-éthylique est capable de récupérer seulement 35 composés de la poudre de lactosérum comparativement à 37 et 42 composés récupérés en utilisant respectivement le formiate de méthyle et le chlorure de méthylène. Selon Alewijn et al. (2003), l’acétonitrile est capable de dissoudre la quasi-totalité des composés dérivés de lipides et ainsi est considéré comme un solvant de qualité pour l’extraction des composés volatils des fromages. Cependant, sa toxicité le rend dangereux à manipuler et à utiliser en chromatographie en phase gazeuse couplée à l’olfactométrie. Malgré ces résultats, l’éther di-éthylique est utilisé dans de nombreuses recherches concernant les saveurs des produits laitiers (Drake et al. 2010).
-La méthode de distillation et extraction simultanée de Nickerson et Likens (1966) permet, tel que son nom l’indique, une distillation et une extraction simultanées à l’aide d’un solvant (Chaintreau, 2001). Elle consiste à chauffer séparément le solvant et l’échantillon mélangé avec de l’eau. Les vapeurs obtenues se mélangent et se condensent ensuite selon leur densité (Mariaca et Bosset, 1997). La température élevée utilisée lors de l’extraction peut conduire à la formation d’artefacts (Majcher et Jelen, 2009). Pour éviter ce problème, Maignial et al. (1992) cité par Mariaca et Bosset (1997) ont proposé un système de travail sous une pression réduite et une basse température (20 à 40°C).
-La méthode d’analyse d’espace de tête est simple et rapide. Elle implique l’établissement d’un équilibre entre l’échantillon et la phase gazeuse, puis l’injection des molécules présentes dans l’espace de tête dans un chromatographe en phase gazeuse (Friedrich et Acree, 1998). Cette technique présente plusieurs avantages. Il est possible d’analyser des molécules de faible poids moléculaire sans la présence d'un solvant. Elle peut être aussi automatisée (Wampler, 2001). Cependant, elle est limitée par le niveau
chromatographie en phase gazeuse couplée à la spectrométrie de masse, ils doivent avoir une concentration égale ou supérieure à 10-5 g/L. Or la concentration des composés volatils dans un aliment varie entre 10-11 et 10-4 g/L. Par conséquent, seuls les produits abondants seront détectés (Friedrich et Acree, 1998).
- La méthode d’évaporation de flaveurs assistée par solvants permet l’extraction de composés volatils à partir de liquides (lait, bière, etc.) et de suspensions aqueuses d’aliments (pulpes de fruits etc.) ou de matrices très huileuses (Engel et al. 1999). Par comparaison avec d’autres techniques d’extraction, la méthode d’évaporation de flaveurs assistée par solvants peut donner des rendements plus élevés en substances volatiles et aromatiques polaires. Elle permet la quantification et la récupération de composés volatils polaires et labiles se trouvant sous forme de traces dans des échantillons complexes (Engel et al. 1999).
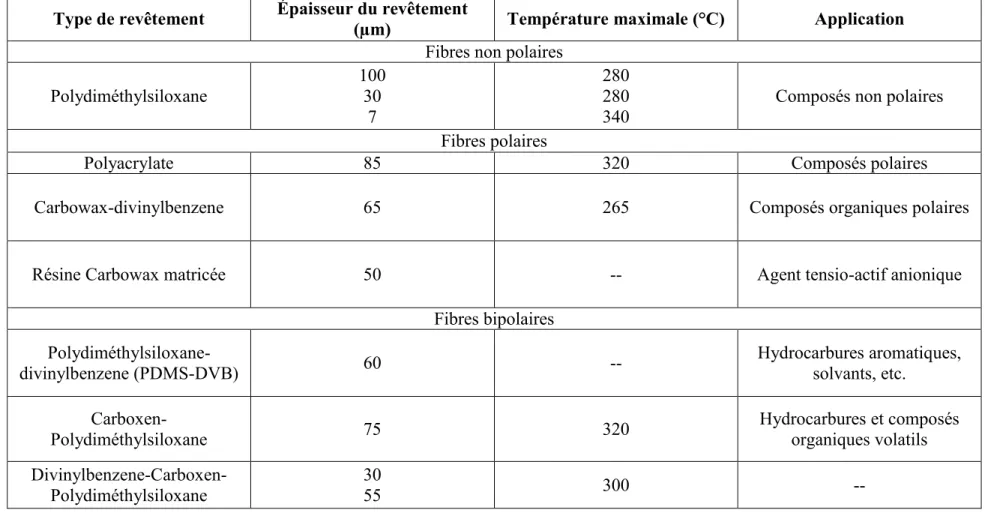
- La microextraction en phase solide a été développée par le professeur Janusz Pawliszyn de l’Université de Waterloo au début des années 90 comme méthode de préparation des échantillons pour l'analyse chromatographique sans utilisation de solvants (Arthur et Pawliszyn, 1990; Zhang et al. 1994). Le principe de cette technique consiste à exposer un échantillon (liquide ou gazeux) à une petite fibre de silice fondue recouverte d’une phase solide appropriée au produit à analyser (Quach et al. 1999). Si l’échantillon est formé de liquides complexes, la fibre sera exposée à l’espace de tête afin d’éviter son endommagement. Ainsi, elle adsorbera les composés d’intérêts dans la phase gazeuse située au-dessus de la matrice liquide ou solide (Lee et al. 2003).
Tel que montré au Tableau 2.3, plusieurs types de fibres existent selon les caractéristiques des composés à extraire. Elles différent par la nature de la phase polymérique qui les enveloppe (Falcó & Moya, 2007).
Tableau 2.3: Type de fibre utilisée en microextraction en phase solide (Adapté de Falcó & Moya, 2007)
Type de revêtement Épaisseur du revêtement (µm) Température maximale (°C) Application Fibres non polaires
Polydiméthylsiloxane 100 30 7 280 280
340 Composés non polaires
Fibres polaires
Polyacrylate 85 320 Composés polaires
Carbowax-divinylbenzene 65 265 Composés organiques polaires
Résine Carbowax matricée 50 -- Agent tensio-actif anionique
Fibres bipolaires Polydiméthylsiloxane- divinylbenzene (PDMS-DVB) 60 -- Hydrocarbures aromatiques, solvants, etc. Carboxen-Polydiméthylsiloxane 75 320 Hydrocarbures et composés organiques volatils Divinylbenzene-Carboxen- Polydiméthylsiloxane 30 55 300 --
Les composés volatils ainsi concentrés sur la fibre seront désorbés dans l’injecteur d’un chromatographe en phase gazeuse couplé à un détecteur spécifique. Une combinaison de la microextraction en phase solide et de la chromatographie en phase gazeuse couplée à la spectrométrie de masse a été utilisée pour caractériser la saveur du lait et du fromage (Chin et al. 1996; Marsili, 1999).
Selon Marsili (2000) et Marshall (2003), la méthode d’extraction par microextraction en phase solide présente plusieurs avantages qui soutiennent son utilisation:
- Elle permet d’analyser des échantillons de tailles variables;
- Ses limites de détection sont très basses;
- Elle peut être automatisée;
- Le temps de préparation de l’échantillon est court;
- Le matériel requis n’est pas coûteux;
- Sa précision par comparaison avec d’autres techniques d’échantillonnage est plus élevée;
- Elle ne requiert pas l’utilisation de solvant.
2.3.4.2 Méthodes d’identification
Plusieurs méthodes d'analyses ont été utilisées pour identifier les arômes des produits laitiers. La chromatographie en phase gazeuse couplée à l’olfactométrie et la chromatographie en phase gazeuse couplée à la spectrométrie de masse sont les plus couramment utilisées.
2.3.4.2.1 La chromatographie en phase gazeuse couplée à l’olfactométrie
La chromatographie en phase gazeuse couplée à l’olfactométrie est une méthode qui est utilisée pour détecter et caractériser les arômes obtenues par la séparation des composés volatils à l’aide d’un chromatographe en phase gazeuse (Friedrich et Acree, 1998).
Elle consiste à injecter l’échantillon à analyser dans un chromatographe en phase gazeuse muni d’un détecteur olfactomètre. Le renifleur ou la personne détectrice enregistrera par un mot ou groupe de mots ce qu’il sent du flux d’air humide à la sortie de l’olfactomètre (Friedrich et Acree, 1998). Pour de meilleurs résultats, les renifleurs recrutés doivent être entrainés par la détection de standards pour au moins une courte période (Friedrich et Acree, 1998).
La chromatographie en phase gazeuse couplée à l’olfactométrie peut être utilisée en tant que méthode uniquement descriptive mais peut également fournir des informations sur l'impact olfactif des constituants lorsqu'on suit une méthodologie adaptée (Van Ruth, 2001; Zellner et al. 2008). Ces méthodologies sont généralement divisées en quatre catégories: la méthode de dilution, la méthode de fréquence de détection, la méthode temps-intensité et la méthode d’intensité postérieure (Van Ruth, 2001; Zellner et al. 2008).
-La méthode de dilution: C’est la méthode la plus appliquée. Elle est basée sur des dilutions successives d'un extrait d'arôme jusqu'au point où l’odeur n’est plus perçue par les renifleurs (Zellner et al. 2008).
-La méthode de fréquence de détection: Le nombre des renifleurs capable de détecter l’odeur est utilisé comme une estimation de l’intensité de l’odeur (Van Ruth, 2001).
- La méthode temps-intensité: Elle est basée sur l'enregistrement immédiat de l'intensité perçue en même temps que l’élution de son pic chromatographique (Van Ruth, 2001; Zellner et al. 2008).
- La méthode d’intensité postérieure: Elle est basée sur la mesure de l’intensité de l’odeur d’un composé après l’élution de son pic chromatographique (Van Ruth, 2001).
Le choix de la méthode dépend des informations que l'on souhaite obtenir mais également des ressources, surtout humaines, dont le laboratoire dispose (Zellner et al. 2008). Certaines méthodologies nécessitent un panel d'évaluateurs de huit à douze personnes (la méthode de fréquence de détection) alors que pour d'autres (la méthode de dilution) deux peuvent suffire (Zellner et al. 2008).
La chromatographie en phase gazeuse couplée à l’olfactométrie a été utilisée dans l’analyse des produits laitiers depuis 1993 (Friedrich et Acree, 1998). Dans son étude, Bendall (2001) a utilisé cette méthode pour identifier la différence entre deux types de lait. Le panel, consistant de 4 femmes et 6 hommes, était capable de reconnaître 71 composés aromatiques dont 66 ont été identifiés. Bendall s’est basé sur la méthode de fréquence de détection nasale (en anglais: Nasal Impact Frequency) pour montrer la différence entre les deux types de lait.
L’utilisation de la chromatographie en phase gazeuse couplée à l’olfactométrie requiert beaucoup de concentration. L’élution rapide des composés aromatiques peut être problématique pour les renifleurs afin de trouver le mot qui décrit mieux l’odeur sentie (Naudé et al. 2009). Un panel formé de huit renifleurs ou plus peut causer des difficultés et des problèmes lors de l’analyse statistique des résultats obtenus (obtention d’un aromagramme) ainsi que dans les conditions de travail (Berdagué et al. 2007). Pour pallier à cet inconvénient, des olfactomètres avec ports multiples ont été développés. Ce système permet la distribution uniforme des composants volatils séparés par chromatographie à différent ports (Berdagué et al. 2007). Ainsi, les renifleurs pourront
détecter les substances éluées en une seule séparation chromatographique et dans des conditions identiques (même échantillon, même heure, mêmes conditions ambiantes, etc.), améliorant ainsi la qualité des données obtenues et rendant plus facile l’étude des échantillons frais et périssables (Berdagué et al. 2007).
Dans le but d’étudier les effets de l’alimentation, de la pasteurisation et de l’affinage sur le profil aromatique du fromage de type Cantal, Cornu et al. (2009) ont utilisé un olfactomètre à huit ports pour l’analyse des fromages provenant de huit traitements (pâturage ou concentrés × lait cru ou pasteurisé × 3 ou 6 mois d’affinage). Le panel était capable d’identifier 42 composés aromatiques et de détecter des différences significatives sur l’effet de l’alimentation et du traitement thermique sur le Cantal.
Parallèlement à ces développements dans l'instrumentation, un logiciel d'acquisition et de traitement du signal appelé AcquiSniff a été mis au point. Ce logiciel permet l'enregistrement complet de la perception sensorielle des renifleurs lors de l'analyse, le traitement immédiat du vocabulaire utilisé pour la description de l’odeur sentie, et l'exploitation synthétique de l'information fournie par le panel (vocabulaire, nombre de détections, intensité et durée de perception de l'odeur), ce qui facilite le traitement des données (Berdagué et al. 2007).
2.3.4.2.2 La chromatographie en phase gazeuse couplée à la spectrométrie de masse
La chromatographie en phase gazeuse couplée à la spectrométrie de masse permet la séparation et l’identification quantitative et qualitative des composés organiques volatils et semi-volatils dans des mélanges complexes (Hites, 1997).
Selon Akande (2012), la quantification peut être obtenue par l’utilisation d’un standard interne. Comme tous les autres composés inconnus sur le chromatogramme, les standards internes ont aussi leurs pics qui constituent la base des interprétations quantitatives. La concentration inconnue d’un composé peut être connue par l’application de la formule suivante:
Cc = Ai / Ac × Ci
Soit: Cc: Concentration du composé inconnu Ai: Aire du pic du standard interne Ac: Aire du pic du composé inconnu Ci: Concentration du standard interne
Une librairie spectrale sera utilisée pour identifier les composés chimiques dans le mélange inconnu de l’échantillon (Akande, 2012). Le spectre de masse d’un composé de l’échantillon est alors comparé aux spectres de masses de la librairie afin d’émettre une liste de composés possibles (y compris les noms, les formules et les structures moléculaires) avec la probabilité statistique de l’appariement (Akande, 2012).
La chromatographie en phase gazeuse couplée à la spectrométrie de masse a été largement utilisée dans l’analyse des arômes des produits laitiers (Imhof et Bosset, 1994; Verzera et al. 2004). La principale limite de cette technique est reliée à la complexité de détection des composés présents en faibles concentrations.
Pour être détectés en spectrométrie de masse, les composés volatils doivent être présents à des concentrations égales ou supérieures à 10-5 g/L. Or, la concentration de la plupart des composés volatils d’un produit alimentaire varie entre 10-11 et 10-4 g/L. Ainsi, seuls les composés volatils abondants seront détectés (Friedrich et Acree, 1998).