Syn
thèse
de
mé
tabo
l
i
tes
seconda
i
res
d
’
impo
r
tance
b
ioméd
ic
ina
le
;
Syn
thèse
to
ta
le
de
te
rpéno
ïdes
l
inéa
i
res
e
t
po
lycyc
l
iques
e
t
cons
t
ruc
t
ion
d
’hé
té
rocyc
les
oxygénés
asymé
t
r
iquemen
t
subs
t
i
tués
Thèse
V
incen
t
A
lbe
r
t
Doc
to
ra
t
en
ch
im
ie
Ph
i
losoph
iae
Doc
to
r
(Ph
.D
.
)
Québec
,
Canada
Résumé
Ces travaux concernent la synthèse totale de produit naturels d’importance biologique qui ont pu être effectués par le développement et l’application de méthodologies pour la construction d’hétérocycles oxygénés et azotés.
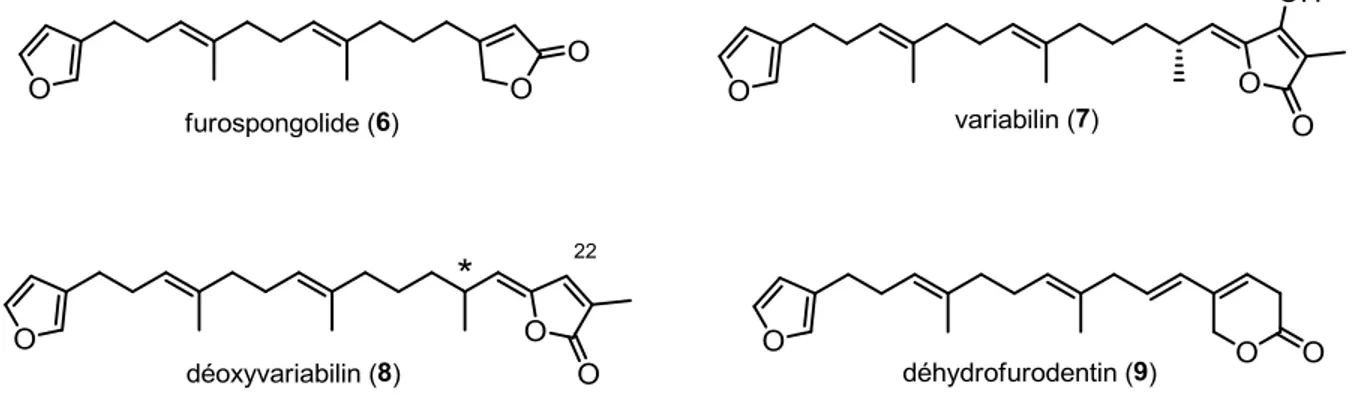
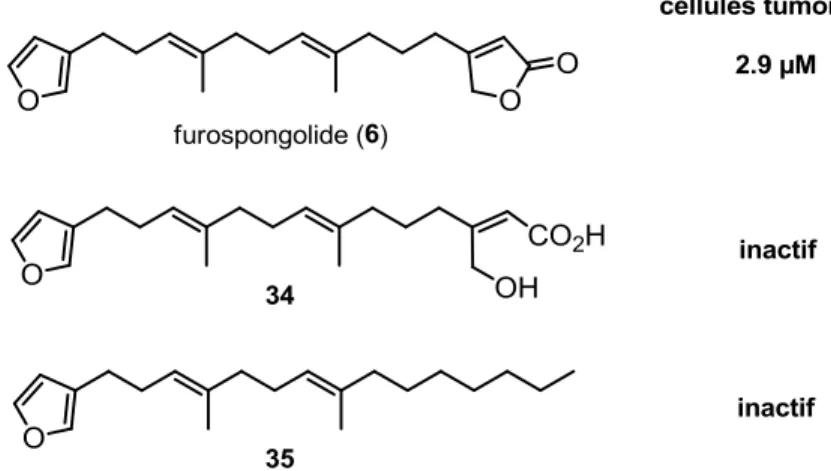
Premièrement, nos travaux sur la synthèse de métabolites secondaires appartenant à la famille des furanoterpénoïdes linéaires sont décrits. La première synthèse du furospongolide, un inhibiteur d’origine marine de HIF-1, a été accomplie en 8 étapes linéaires à partir de l’acétate de géranyle. Les étapes clés impliquées sont une réaction de couplage croisé sp3-sp3 de Schlosser ainsi qu’une alkynylation de Sonogashira du
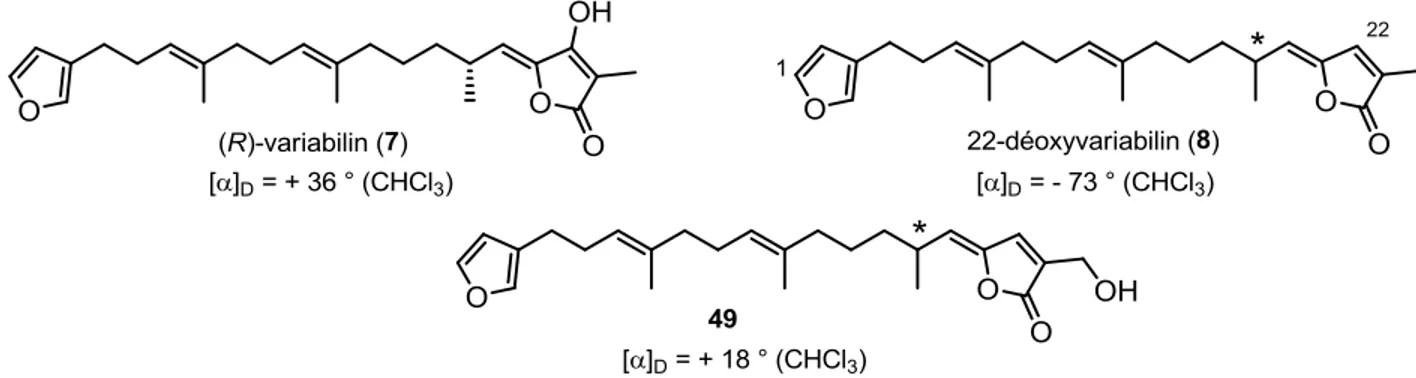
β-bromobuténolide. La première synthèse du furanosesterterpène antimicrobien 22-déoxyvariabilin ainsi que la détermination de sa configuration absolue sont également décrites. Les étapes clés consistent en l’emploi de réactions de couplages sp3-sp3
séquentielles de Schlosser ainsi que l’application de notre méthode pour l’installation du fragment (Z)-γ-ylidène-buténolide. Nos efforts sur les produits naturels apparentés variabilin et déhydrofurodentin soulignent le besoin de développer de nouvelles stratégies synthétiques.
Par la suite, deux synthèses divergentes de plusieurs dérivés de l’anhydride maléique isolés du champignon Antrodia camphorata sont démontrées. La première synthèse de l’antrocinnamomin D ainsi qu’une nouvelle synthèse des antrodins A et B ont été accomplies efficacement en 6-8 étapes. Les étapes clés incluent un couplage croisé sp2-sp3 catalysé au
fer de Fürstner-Kochi et l’oxyfonctionnalisation d’un 2-silyloxyfurane. De plus, une synthèse biomimétique simple et efficace des anhydrides maléiques et des maléimides d’Antrodia est présentée. L’étape clé consiste en une condensation de type Perkin effectuée dans des conditions exceptionnellement douces. Par ailleurs, le γ-hydroxy-β-sulfanylbuténolide naturel cépanolide ainsi qu’une série d’analogues ont été synthétisés régiosélectivement par la combinaison d’une oxyfonctionnalisation d’un 2-silyloxyfurane et d’une addition thia-Michael/élimination en tandem.
Finalement, une synthèse énantiosélective efficace de l’antrocin, provenant également d’Antrodia camphorata, est décrite. Notre stratégie synthétique impliquait l’utilisation du sclaréolide comme synthon chiral de départ et une fonctionnalisation C-H à distance par une
iv
sont représentés. Les transformations clés incluent la déconstruction séquentielle du sclaréolide par l’emploi d’une fragmentation de Grob et la fabrication du carbocycle à 9 membres par métathèse de fermeture de cycle.
Summary
This work concerns the total synthesis of natural products of biological importance which were achieved by the development and application of methodologies for the construction of oxygen and nitrogen containing heterocycles.
First, our work on the synthesis of structurally similar metabolites of the linear furanoterpenoids family is described. The first synthesis of the marine HIF-1 inhibitor furospongolide has been achieved in 8 linear steps from geranyl acetate. The key steps involved were a Schlosser sp3-sp3 cross-coupling reaction and a Sonogashira alkynylation of
β-bromobutenolide. The first synthesis of the antimicrobial furanosesterterpene 22-deoxyvariabilin and the determination of its absolute configuration are also described. Its assembly was carried out using sequential sp3-sp3 Schlosser cross-coupling reactions and
our methodology for the installation of the (Z)-γ-ylidenebutenolide moiety. Our efforts towards the synthesis of the closely related natural products, namely variabilin and dehydrofurodentin, underline the need for the development of new synthetic strategies.
Then, the divergent synthesis of many related maleic anhydride derivatives isolated from the rare fungus Antrodia camphorata are outlined. The first synthesis of antrocinnamomin D and a new synthesis of antrodins A and B have been achieved in 6-8 steps and high overall efficiency. Key steps include a Fürstner-Kochi iron-catalyzed sp2-sp3 cross-coupling and a
2-silyloxyfuran oxyfunctionalization. Moreover, a simple and efficient biomimetic synthesis of Antrodia maleimides and maleic anhydrides is described. The key step is a Perkin-type condensation performed under exceptionally mild conditions. Additionally, the naturally occurring γ-hydroxy-β-sulfanylbutenolide cepanolide and a range of new analogues were synthesized in a concise, regiospecific manner through the combined use of 2-silyloxyfuran oxyfunctionalization and tandem thio-Michael addition/elimination.
Finally, an efficient enantioselective synthesis of antrocin, another Antrodia camphorata metabolite, is described. Our synthetic strategy involved the use of sclareolide as a chiral synthon in conjunction with a remote C-H functionnalization using the Barton reaction. Furthermore, our recent progress towards the total synthesis of the amomaxins A and B is represented. Key transformations include the controlled deconstruction of sclareolide employing a Grob fragmentation strategy and a ring-closing metathesis to form the
Table des matières
Résumé ... iii
Summary ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des schémas ... xiii
Liste des figures ... xvii
Liste des abréviations ... xix
Remerciements ... xxiii
Épigraphe ... xxv
1
Chapitre 1 : Introduction générale ... 1
1.1
À la conquête des produits naturels ... 3
1.1.1 L’importance des produits naturels en médecine ... 3
1.1.2 Isolation et découvertes de nouveaux produits naturels... 5
1.2
Rôles fondamentaux de la synthèse totale moderne ... 8
1.2.1 Détermination et confirmation de structures ... 8
1.2.2 Un accès à des quantités de produits naturels et analogues ... 9
1.2.3 Une plateforme pour l’innovation ... 14
1.2.4 Les objectifs de cette thèse ... 20
1.3
Références ... 22
2
Chapitre 2 : Synthèse de furanoterpénoïdes linéaires .... 25
2.1
Les terpénoïdes linéaires ... 27
2.1.1 Introduction sur la biosynthèse des terpénoïdes ... 27
2.1.2 Une petite famille de furanoterpénoïdes ... 29
2.1.3 La problématique ... 29
2.2
Synthèse du néotorreyol ... 31
2.3
Synthèse du furospongolide et d’un analogue ... 36
2.3.1 Origine et activité biologique ... 36
2.3.2 Premières approches synthétiques ... 37
2.3.3 Synthèse totale du furospongolide ... 38
2.3.4 Synthèse d’un analogue ... 41
2.4
Synthèse du 22-déoxyvariabilin énantiomériquement pur .... 42
2.4.1 Origines et activités biologiques ... 42
2.4.2 Problématique ... 44
2.4.3 Première approche vers le (S)-22-déoxyvariabilin... 47
2.4.4 Approche de la méthode de Schlosser ... 49
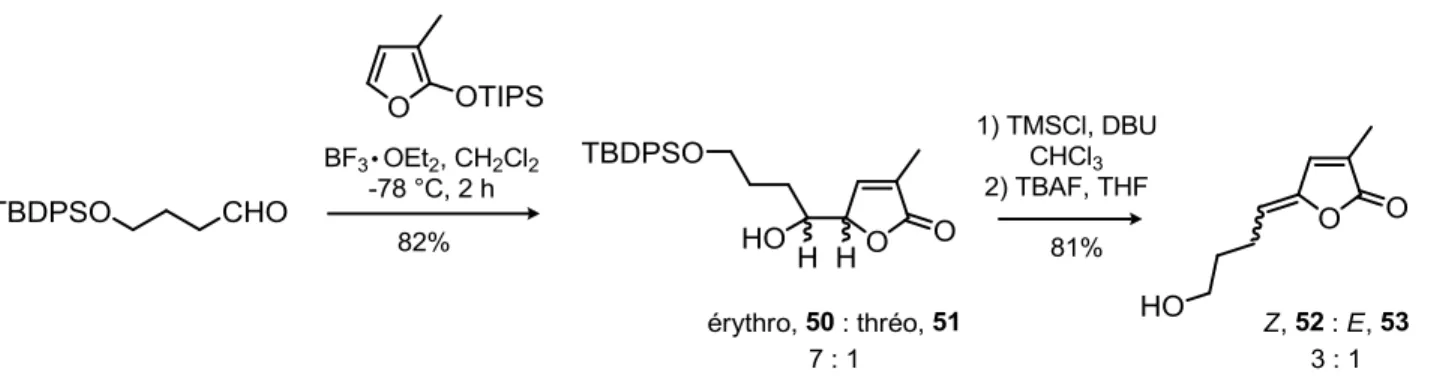
2.4.5 Synthèse du fragment chiral... 51
viii
2.5
Progrès vers la synthèse du déhydrofurodentin ... 62
2.6
Conclusion ... 65
2.7
Références ... 66
3
Chapitre
3 :
Synthèse
de
constituants
d’Antrodia
camphorata... 71
3.1
Les composés de la famille des antrodins ... 73
3.1.1 L’origine d’Antrodia camphorata ... 73
3.1.2 Composition chimique et activités biologiques ... 73
3.1.3 Synthèses précédentes rapportées des antrodins ... 75
3.1.4 Problématique ... 78
3.2
Synthèses de l’antrocinnamomin D et des antrodins ... 80
3.2.1 Stratégie de synthèse régiosélective ... 80
3.2.2 Synthèse unifiée de la famille des antrodins ... 82
3.2.3 Vers une synthèse plus efficace ... 85
3.2.4 Synthèse biomimétique des antrodins ... 88
3.3
Synthèse totale du cépanolide et analogues ... 92
3.3.1 Une cible idéale pour l’oxyfonctionnalisation régiosélective ... 92
3.3.2 La synthèse du cépanolide et de ses analogues ... 94
3.4
Conclusion ... 96
3.5
Références ... 96
4
Chapitre 4: Synthèse de terpénoïdes polycycliques ... 101
4.1
La famille des labdanes et leurs synthèses ... 103
4.1.1 Biosynthèse des labdanes ... 103
4.1.2 Stratégies de synthèse employées pour fabriquer des labdanes ... 104
4.1.3 Importance du sclaréolide en synthèse ... 106
4.2
Synthèse de l’antrocin ... 112
4.2.1 Origine et activités biologiques ... 112
4.2.2 Stratégie de synthèse... 115
4.2.3 Synthèse de l’albicanol ... 116
4.2.4 La réaction de Barton ... 122
4.2.5 Synthèse de l’antrocin ... 127
4.3
Vers la synthèse des amomaxins A et B ... 129
4.3.1 Les nonadrides et analogues ... 129
4.3.2 Analyse rétrosynthétique des amomaxins A et B ... 131
4.3.3 Synthèse de l’ottensidione ... 133
4.3.4 Vers la synthèse totale des amomaxins A et B ... 136
4.4
Conclusion ... 138
5
Chapitre 5 : Conclusion et perspectives ... 143
5.1
Accomplissements importants et perspectives futures ... 145
5.2
Conclusion générale ... 154
5.3
Références ... 155
6
Partie expérimentale ... 157
6.1
General Methods: ... 159
6.2
Chapitre 2: Synthèse de furanoterpénoïdes linéaires ... 160
Synthesis and characterization of key intermediates for the synthesis of furospongolide: ... 160
Synthesis and characterization of key intermediates for the synthesis of deoxyvariabilin: ... 169
Synthesis and characterization of compounds related to variabilin: ... 184
Synthesis and characterization of key intermediates for the synthesis of dehydrofurodentin: 187
6.3
Chapitre 3: Synthèse de constituants d’Antrodia camphorata191
Synthesis and characterization of key intermediates related to the antrodins: ... 191Synthesis and characterization of intermediate 152, cepanolide and analogues: ... 201
6.4
Chapitre 4: Synthèse de terpénoïdes polycycliques ... 206
Synthesis and characterization of key intermediates for the synthesis of antrocin: ... 206
Synthesis and characterization of key intermediates for the synthesis of ottensidione 11: .... 217
6.5
References ... 228
7
Annexe : ... 231
Liste des tableaux
Tableau 1 : Méthodologies explorées pour la synthèse des β-halobuténolides 83 et 84 ... 56 Tableau 2 : Tentatives pour convertir les β-halobuténolides 89 et 90 en acide tétronique . 60 Tableau 3 : Optimisation de la condensation de type Perkin ... 89 Tableau 4 : Synthèse d’analogues du cépanolide ... 95 Tableau 5 : Optimisation de la régiosélectivité de la déshydratation de l’alcool tertiaire ... 122
Liste des schémas
Schéma 1: Le taxol® et son précurseur hémisynthétique baccatin III ... 6
Schéma 2: Yondelis® et son précurseur hémisynthétique cyanosafracin B ... 7
Schéma 3: Procédé de fabrication à grande échelle de l'artémisinine ... 9
Schéma 4: Représentation des types de stratégies de synthèses courantes ... 11
Schéma 5: Synthèse divergente des amathaspiramides du groupe Fukuyama ... 11
Schéma 6: Système de diversification à 12 branches synthétiques de Stockman ... 13
Schéma 7: Diversification par voie hémisynthétique de Hergenrother ... 14
Schéma 8: Synthèse biomimétique de la progestérone par Johnson ... 19
Schéma 9 : Origine des précurseurs universels des terpénoïdes ... 27
Schéma 10 : Biosynthèse des terpénoïdes ... 28
Schéma 11 : Première synthèse énantiosélective du variabilin rapportée ... 30
Schéma 12 : Concept de la méthodologie de Grieco ... 31
Schéma 13 : Exemple d’un problème associé à la méthode de Grieco ... 31
Schéma 14 : Stratégie anticipée pour accéder aux furanoterpénoides ciblés ... 32
Schéma 15 : Méthodologie employée pour la synthèse du luffariellolide par notre groupe . 33 Schéma 16 : Méthodologie de Schlosser et travaux complémentaires de Bäckvall et coll. .. 34
Schéma 17 : Fonctionnalisation de l’acétate de géranyle ... 34
Schéma 18 : Synthèse du néotorreyol ... 35
Schéma 19 : Synthèse du β-vinylbuténolide par couplage de Suzuki-Miyaura ... 37
Schéma 20 : Premières approches étudiées pour la synthèse du furospongolide... 38
Schéma 21 : Méthodes pour fabriquer des β-alkynylbuténolides ... 39
Schéma 22 : Synthèse du furospongolide par une séquence de Sonogashira/hydrogénation ... 40
Schéma 23 : Hydrogénation partielle d’alkynylbuténolides ... 41
Schéma 24 : Tautomérie des γ-hydroxybuténolides ... 42
Schéma 25 : Synthèse du dérivé γ-hydroxybuténolide du furospongolide ... 42
Schéma 26 : Méthodes employées en synthèse de γ-alkylidène-buténolides ... 45
Schéma 27 : Exemple de synthèse non stéréosélective de Z-alkylidène-buténolides ... 46
Schéma 28 : Méthode de synthèse stéréosélective de (Z)-γ-alkylidène-buténolides non substitués en position β ... 47
Schéma 29 : Analyse rétrosynthétique du 22-déoxyvariabilin ... 47
Schéma 30 : Première approche vers le (S)-22-déoxyvariabilin ... 48
Schéma 31 : Tentatives d’optimisation de la sélectivité pour la substitution allylique ... 49
Schéma 32 : Routes existantes pour les synthons 67 et 68 ... 50
Schéma 33 : Hydrogénation asymétrique du α-méthylène-γ-butyrolactone rapportée ... 50
Schéma 34 : Synthèses énantiosélectives des composé (S)-70 et (S)-65 rapportées ... 51
Schéma 35 : Synthèse non optimisée de (R)-67 ... 52
Schéma 36 : Synthèse en un seul pot optimisée de (R)-67 ... 53
Schéma 37 : Transformation détaillée de 70 en 66 dans nos conditions ... 54
Schéma 38 : Synthèse de l’aldéhyde (R)-23 par couplage sp3-sp3 de Schlosser ... 55
Schéma 39 : Synthèse stéréosélective du fragment (Z)-γ-alkylidène-buténolide du 22-déoxyvariabilin ... 56
xiv
Schéma 41 : Étude sur un système modèle pour l’étape de déhalogénation ... 58
Schéma 42 : Synthèse stéréosélective du (R)-22-déoxyvariabilin ... 58
Schéma 43 : Évaluation de la sélectivité engendrée par le tétronate d’isopropyle ... 61
Schéma 44 : Synthèse de nouveaux dérivés silylés ... 62
Schéma 45 : Stratégie rétrosynthétique pour la synthèse du déhydrofurodentin ... 63
Schéma 46 : Première approche étudiée pour synthétiser le déhydrofurodentin ... 64
Schéma 47 : Seconde approche étudiée vers la synthèse du déhydrofurodentin ... 65
Schéma 48 : Synthèse d’Argade et coll. des antrodins ... 75
Schéma 49 : Synthèse de Stewart et coll. des antrodins et d’analogues ... 76
Schéma 50 : Synthèse de Lee et coll. des antrodins et des camphorata imides ... 77
Schéma 51 : Application de notre chimie «click» à la synthèse de l’antrodins A ... 78
Schéma 52 : Synthèse non régiosélective du microperfuranone rapportée par Clive et coll. ... 80
Schéma 53 : Étape clé de la synthèse du yangjinhualine A rapportée par Argade et coll. ... 80
Schéma 54 : Méthode d’oxyfonctionnalisation régiosélective des buténolides ... 81
Schéma 55 : Analyse rétrosynthétique de l’antrocinnamomin D et des composés apparentés ... 81
Schéma 56 : Synthèse du buténolide précurseur de l’antrocinnamomin D ... 83
Schéma 57 : Réaction d’auto-oxydation du rofecoxib rapportée ... 83
Schéma 58 : Première synthèse de l’antrocinammomin D et nouvelle synthèse de l’antrodin A et B ... 84
Schéma 59 : Biosynthèse des butyrolactones I et II ... 86
Schéma 60 : Biosynthèse proposée du microperfuranone ... 86
Schéma 61 : Biosynthèse proposée de l’antrodin A et de l’antrocinnamomin D ... 87
Schéma 62 : Application des conditions de Fields à la synthèse de l’antrodin A ... 88
Schéma 63 : Synthèses d’antrodins par une condensation de type Perkin ... 90
Schéma 64 : Synthèse de l’antrocinnamomin D par réduction biomimétique de l’antrodin A ... 91
Schéma 65 : Synthèse non régiosélective du cépanolide rapportée ... 93
Schéma 66 : Plan de synthèse du cépanolide ... 93
Schéma 67 : Synthèse totale régiosélective du cépanolide ... 94
Schéma 68 : Synthèse totale des déoxyspongiaquinol et déoxyspongiaquinone par voie biomimétique... 105
Schéma 69 : Procédé derrière la production de sclaréolide ... 106
Schéma 70 : Production de la fragrance Ambrox® à partir du sclaréolide ... 106
Schéma 71 : Exemples de produits naturels synthétisés à partir du sclaréolide ... 107
Schéma 72 : Synthèse totale de (+)-zerumin B rapportée ... 108
Schéma 73 : Synthèse totale du (-)-villosin rapportée ... 109
Schéma 74 : Synthèse totale de l’ottensinin rapportée ... 110
Schéma 75 : Synthèse du donneur de labdane borono-sclaréolide ... 111
Schéma 76 : Monoterpénoïdes synthétisés à partir du borono-sclaréolide ... 112
Schéma 77 : Synthèse racémique de l’antrocin rapportée par Luo et coll. ... 114
Schéma 78 : Synthèse brevetée de l’antrocin ... 115
Schéma 79 : Analyse rétrosynthétique initiale pour fabriquer l’antrocin ... 116
Schéma 80 : Première approche étudiée pour la synthèse de l’albicanol ... 117
Schéma 82 : Travaux rapportés sur la synthèse de drimanes ... 119
Schéma 83 : Seconde approche pour synthétiser l’albicanol ... 120
Schéma 84 : Exemple de déshydratation effectuée avec succès par le groupe de Vassilikogiannakis ... 121
Schéma 85 : Synthèse alternative de l’albicanol ... 121
Schéma 86 : Concept de la réaction de Barton ... 123
Schéma 87 : Fonctionnalisation de l’albicanol par la méthode de Barton ... 124
Schéma 88 : Structure et synthèse des produits secondaires observés ... 125
Schéma 89 : Séquence optimisée pour la fonctionnalisation à distance du carbone C15 de l’albicanol ... 126
Schéma 90 : Hydrolyse de l’oxime dans des conditions douces ... 127
Schéma 91 : Équilibre entre les épimères du marsamal B... 127
Schéma 92 : Synthèse efficace de l’antrocin ... 128
Schéma 93 : Analyse rétrosynthétique des amomaxins A et B ... 132
Schéma 94 : Déconstruction séquentielle et contrôlée du sclaréolide ... 133
Schéma 95 : Réaction d’hydroboration futile ... 134
Schéma 96 : Refonctionnalisation du fragment 210 synthétisé ... 135
Schéma 97 : Synthèse de l’ottensidione 11 par métathèse de fermeture de cycle ... 136
Schéma 98 : Séquence envisagée pour compléter la synthèse de l’amomaxin A ... 137
Schéma 99 : Méthode de Tanabe et coll. pour fabriquer des α-méthylbuténolides à partir de cétones ... 137
Schéma 100 : Séquence envisagée pour compléter la synthèse de l’amomaxin B ... 138
Schéma 101 : Furanoterpénoïdes linéaires ciblés par nos recherches ... 145
Schéma 102 : Synthèse totale du furospongolide ... 146
Schéma 103 : Synthèse totale du (R)-22-déoxyvariabilin ... 148
Schéma 104 : Concept de la métathèse de fermeture de cycle à relais... 149
Schéma 105 : Voies de synthèse envisageables vers le déhydrofurodentin ... 150
Schéma 106 : Deux voies de synthèse des antrodins développées... 151
Schéma 107 : Synthèse totale du cépanolide ... 151
Schéma 108 : Synthèse totale de l’antrocin ... 152
Schéma 109 : Transformations possibles pour accéder à des analogues intéressants de l’antrocin ... 153
Liste des figures
Figure 1: Exemples historiques de médecines dérivées de produits naturels ... 4
Figure 2: Évolution des corrections de la structure de l'UGA ... 8
Figure 3: Exemples de composés naturels les plus complexes synthétisés ... 15
Figure 4: Mesure quantitative de l'idéalité d'une synthèse ... 16
Figure 5: Pourcentage de rendement global en fonction du nombre d'étapes d’une synthèse ... 17
Figure 6: Développement de synthèses idéales selon Wender ... 18
Figure 7: Développement d'un analogue simplifié d'halochondrin B pour traiter le cancer du sein ... 18
Figure 8: Molécules ciblées dans le cadre de nos travaux de recherche ... 21
Figure 9 : Les furanoterpénoïdes ciblés ... 29
Figure 10 : Étude de relation structure-activité préliminaire du furospongolide ... 36
Figure 11 : Composés isolés de l’éponge Fasciospongia ... 44
Figure 12 : Comparaison des pouvoirs rotatoires et de la stéréochimie absolue du sotolon et du maple furanone ... 44
Figure 13 : Exemples d’autres composés possédant le fragment C18-C25 du 22-déoxyvariabilin ... 46
Figure 14 : Structure du déhydrofurodentin ... 62
Figure 15 : Une famille de métabolites du mycète Antrodia camphorata ... 74
Figure 16 : Les composés de la famille des antrodins ciblés ... 79
Figure 17 : Exemples de composés organosoufrés isolés de légumes du genre Allium ... 92
Figure 18 : Représentation de composés naturels biologiquement actifs de type labdane 104 Figure 19 : Structure rapportée et structure corrigée de l’ottensinin ... 110
Figure 20 : Structures des composés inhibiteurs des signaux métaboliques akt/mTOR antrocin et rapamycine ... 113
Figure 21 : Exemples de nonadrides naturels ... 130
Figure 22 : Composés isolés de la plante asiatique Amomum maximum Roxb. ... 130
Figure 23 : Structures de l’ottensidione 11 et de l’ottensinin ... 131
Figure 24 : Analogues intéressants synthétisés du furospongolide ... 146
Figure 25 : Quelques analogues du furospongolide accessibles par notre route synthétique ... 147
Figure 26 : Analogues hybrides intéressants du furospongolide ... 147
Liste des abréviations
Abréviationsα : pouvoir rotatoire Ac : acétyle
acac : acétylacétonate
ADN : acide désoxyribonucléique AIBN : azobisisobutyronitrile Akt : protéine kinase B Anal. : analyse élémentaire approx. : approximativement aq : aqueux
Ar : aryle
av. J.-C. : avant Jésus-Crist
9-BBN : 9-borabicyclo[3.3.1]nonane BINAP : 2,2’-bis(diphénylphosphino)-1,1’-binaphthyle Bn : Benzyle Boc : tert-butoxycarboxylate br : broad signal Bu/n-Bu: butyle i-Bu: isobutyle t-Bu : tert-butyle Bz : benzoyle
CAN : nitrate de cérium et d’ammonium cat. : quantité catalytique
COD : 1,5-cyclooctadiène
Cp : cyclopentadiène/cyclopentadiényle cPLA2 : phospholipases A2 cytosoliques
CSA : camphorsulfonic acid
m-CPBA : acide méta-chloroperbenzoïque Cy : cyclohexyle
δ : déplacement chimique
d : doublets (spectres RMN), days DADS : diallyle disulfure
DAS : diallyl sulfure
dba : dibenzylidèneacétone DBU : 1,8-diazabicyclo[5.4.0]undéc-7-ène DBP : peroxyde de benzoyle DCC : dicyclohexylcarbodiimide DCE : 1,2-dichloroéthane DCM : dichlorométhane
DEAD : diethyl azodicarboxylate DHP : dihydropyrane
xx
DMAP : 4-(diméthylamino)pyridine DMAPP : diméthylallyle diphosphate DMDO : diméthyldioxirane DME : 1,2-diméthoxyéthane DMF : diméthylformamide DMP : Dess-Martin périodinane DMS : sulfure de diméthyle DMSO : diméthylsulfoxyde
DOS : synthèse orientée sur la diversité dppf : 1,1’-Bis(diphenylphosphino)ferrocène dppp : 1,3-Bis(diphénylphosphino)propane dr : ratio diastéréoisomérique
DTS : synthèse totale divergente ee : excès énantiomérique
E1cB : élimination avec un intermédiaire carbanionique E2 : élimination concertée
EDC : 1-éthyl-3-(3-diméthylaminopropyl)carbodiimide équiv/equiv : nombre d’équivalents
ESI : electrospray ionisation Et : éthyle FPP : diphosphate de farnésyle g : gramme GFPP : diphosphate de farnésylgéranyle GGPP : diphosphate de géranylgéranyle GPP : diphosphate de géranyle
GSK-3B: glycogène synthase kinase 3 bêta GST : glutathion S-transférase
h : heure
HG : catalyseur de Hoveyda-Grubbs
HIF : facteur inductible par l’hypoxie (hypoxia inducible factor) HMDS : hexaméthyldisilazane
HMPA : hexaméthylphosphoramide
HRMS : spectroscopie de masse haute résolution Hz : hertz
IC50 : concentration inhibitrice médiane
IL-6 : interleukine 6 im : imidazole
IPP : isopentényl diphosphate
IPr : 1,3-bis(2,6-diisopropylphényl)imidazole-2-ylidène IR : spectroscopie infrarouge
J : constante de couplage (spectres RMN) JAK : Janus kinase
k : kilo
KAPA : 3-aminopropylamidure de potassium KIC : acide α-cétoisocaproïque
lit. : littérature
LiTMP : 2,2,6,6-tétraméthylpipéridide de lithium LLC : Lewis Lung carcinoma
m : multiplet (spectres RMN), milli M : molaire/masse molaire max : maximum Me : méthyle MHz : mégahertz min : minute mol : moles
mp : point de fusion (melting point) Ms : méthanesulfonyle (mésyle)
mTOR : cible de la rapamycine chez les mammifères m/z : rapport masse/charge
N : normal (normalité) NBS : N-bromosuccinimide
NF-κB : facteur nucléaire kappa B NIS : N-iodosuccinimide
nm : nanomètre
NMO : N-méthylmorpholine N-oxide NMP: N-méthyl-2-pyrrolidone
NMR: nuclear magnetic raisonance spectroscopy NO: oxide nitrique
PCC : chlorochromate de pyridinium
PG : groupement protecteur (protecting group) Ph : phényle
Phe : phénylalanine
PIDA : diacétate d’iodobenzène pin : pinacol/pinacolyle
ppm : partie par million Pr : propyle i-Pr : isopropyle PTFE : polytétrafluoroéthylène py : pyridine q : quadruplet (spectres RMN) QR : quinine réductase
RAR : acide rétinoïque
RCM : métathèse de fermeture de cycle ref. : référence
RMN : spectroscopie à résonance magnétique nucléaire RRCM : métathèse de fermeture de cycle à relais Rf : facteur de rétention (chromatographie) rt : température ambiante (room temperature) s : singulets (spectres RMN)
xxii
sPLA2 : phospholipases A2 sécrétés
STAT : signal transducers and activators of transcription t : triplet (spectres RMN)
TBAB : bromure de tétrabutylammonium TBAF : fluorure de tétrabutylammonium TBAI : iodure de tétrabutylammonium TBS : tert-butyldiméthylsilyle
TBDPS : tert-butyldiphénylsilyle
Tf : trifluorométhanesulfonyle (triflyle) TFA : acide trifluoroacétique
TFAA : anhydride trifluoroacétique TFEF : 2,2,2-trifluoroéthyle formate THF : tétrahydrofurane
THP : tétrahydropyranyle TIPS : triisopropylsilyle TMS : triméthylsilyle tol : tolyle, toluène
TOS : synthèse orienté vers la cible
TPAP : perruthénate de tétrapropylammonium TPP : tétraphénylporphyrine
Ts : para-toluènesulfonyle (tosyle) µ : micro
UV : ultra-violet
Remerciements
I would like to express my gratitude to my research supervisor Prof. John Boukouvalas who took me on an amazing journey for the past years. John, it was a pleasure to be part of your team and learn from you. Your ideas are brilliant and inspiring and your projects so stimulating. Your attention to details is flawless and together with your passion for organic chemistry, you have been a great influence on me.
I would also like to thank Prof. Peter McBreen and the members of his group for giving me the opportunity to participate in an interesting project as part of a collaboration between our two research groups.
Je remercie toutes les personnes que j’ai côtoyées pendant mes années d’études à l’Université Laval. J’ai trouvé la motivation de poursuivre grâce à beaucoup d’entre vous. J’aimerais ajouter une mention spéciale pour les étudiants de notre groupe de recherches qui ont eu un impact énorme sur la qualité de vie au laboratoire. Richard, Lucas and Nic, thank you for welcoming me in the group and make it feel like home. I am glad to have met you and wish you all the best. Charles, un gros merci pour les mêmes raisons et pour tes judicieux conseils autant en chimie que sur les bières ;) Tu es quelqu’un d’exceptionnel qui a tous les talents pour réussir. Ce fut un plaisir de te côtoyer toutes ces années. Raph, ta joie de vivre et ton sens de l’humour sont contagieux et tu as su nous divertir par tous les moyens. Keep it up, tu es un être extraordinaire et c’est le moindre qu’on puisse dire. Merci pour tes efforts constants et ton aide dans les projets. Rameshski!! I am very glad to have met you. You are an amazing individual and it was most interesting to learn to know you. I can only hope to meet with you again in the future and I wish you great success. Et Marc... Markovnikov, je ne sais pas par où commencer pour exprimer à quel point je me considère chanceux de t’avoir rencontré. Mis à part que tu as été un collègue de travail exceptionnel, tu es devenu pour moi un ami sincère avec qui j’ai pu partager toutes mes passions. Je te remercie pour tous les moments qu’on a partagés, que ce soit au labo ou à l’extérieur. Un merci à Doriane également pour l’avoir autorisé ;)
Je remercie énormément mes amis à l’extérieur de l’université qui ont su comprendre mes ambitions et qui m’ont supporté et encouragé à poursuivre. Merci d’avoir présent pour moi dans les moments les plus difficiles. La distance n’aura pas toujours été facile, mais elle ne
xxiv
Cette thèse n’aurait jamais vu le jour si ce n’était du support immense de tous les membres de ma famille durant ces années. Je remercie particulièrement de tout mon cœur ma mère (and Curt) pour sa présence, ses encouragements et ses sacrifices qui me permettent constamment d’accomplir mes rêves. Mes remerciements s’adressent également à mon père (et Nathalie et Zariéma) pour ses judicieux conseils et son support qui m’ont permis de me rendre où j’en suis. Je remercie ma chère soeur pour son attention constante et pour toute l’aide qu’elle m’apporte. Mes remerciements spéciaux à ma grand-mère également pour son énorme présence dans ma vie.
Épigraphe
"Strategy requires thought, tactics require observation."
- Max Euwe, Dutch chess Grandmaster
1 Chapitre 1 :
1.1 À la conquête des produits naturels
1.1.1 L’importance des produits naturels en médecine
Depuis les temps anciens, l’homme utilise les produits naturels pour se guérir de plusieurs pathologies. On peut retracer l’utilisation de plantes médicinales jusqu'à l’année 2900 av. J.-C.1, 2 La médecine traditionnelle est encore aujourd’hui essentielle dans les pays en
développement où 65-70% de la population mondiale n’a pas accès aux médecines modernes.3 L’utilisation d’extraits de plantes sous forme de thés ou de suppléments
alimentaires pour guérir des maladies est courante. Ce n’est pas étonnant, car les produits naturels sont dotés d’activités biologiques très diversifiées. Depuis des milliards d’années, les produits naturels évoluent avec les espèces qui les produisent pour être capables d’interagir avec les systèmes biologiques.4 Ces produits sont des métabolites secondaires
biosynthétisés par tous les organismes vivants et sont responsables de l'équilibre écologique entre l’organisme et son environnement. Ils engendrent des réponses biologiques bénéfiques pour l’organisme qui les produit et jouent un rôle crucial dans la survie de ce dernier. Ils interagissent entre autres au niveau de la régulation cellulaire, de la concurrence ou la cohabitation d’organismes, de la communication entre les organismes ainsi qu’au niveau de la défense chimique d’organismes contre la prédation et les pathogènes. En raison de ces caractéristiques, les produits naturels influencent grandement l’industrie pharmaceutique dans le développement de médicaments. Certaines activités intéressantes recherchées dans ces molécules sont des activités anticancéreuses, antivirales ainsi qu’antibactériennes qui pourraient s’avérer bénéfiques pour une utilisation chez l’homme.
Depuis ses débuts, l’industrie pharmaceutique s’inspire des produits naturels pour la commercialisation de médicaments. Les découvertes de la morphine, la pénicilline, la quinine, et le paclitaxel (Taxol®) sont de nombreux exemples historiques bien connus de
molécules naturelles qui ont démontré leurs vertus chez l’être humain.5, 6 Ces découvertes
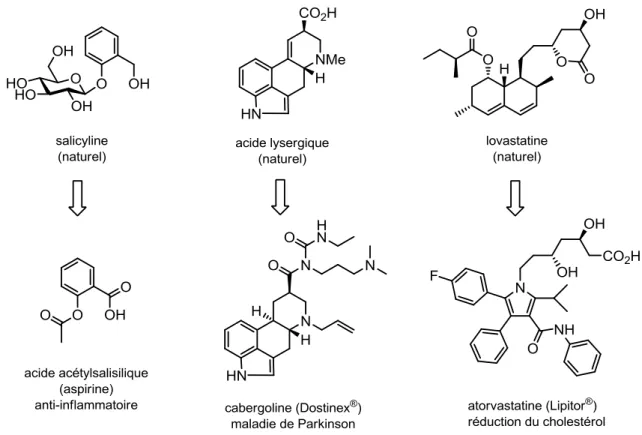
ont eu un grand impact sur la société et ont révolutionné la recherche pharmaceutique. Avec une maturation de la chimie de synthèse, la recherche et le développement de médicaments qui dérivent de produits naturels a conduit à la découverte de plusieurs traitements qui sont aujourd’hui indispensables telle que l’aspirine, la cabergoline (Dostinex®) et l’atorvastatine (Lipitor®) pour en nommer que quelques-uns (Figure 1).7
Parmi les 1135 médicaments approuvés entre 1981 et 2010, plus de la moitié sont des produits naturels ou des analogues qui en dérivent.1, 8
4
Dans les années 1990, l’industrie pharmaceutique s’était plutôt consacrée à des méthodes de chimie combinatoire pour construire des librairies de composés synthétiques et de criblage à haut débit dans l’optique d’accélérer la découverte de nouvelles molécules bioactives.1 Plusieurs compagnies avaient même complètement mis fin à leurs programmes
de recherches en produits naturels, car cette nouvelle approche semblait prometteuse. Malheureusement, la diversité moléculaire obtenue par la chimie combinatoire classique est toutefois limitée à des molécules simples telles que des peptides, des sulfonamides ou de simples molécules aromatiques.9 En conséquence, l’efficacité et la spécificité des molécules
de librairies combinatoires pour les sites actifs d’enzymes cibles ne sont point optimales et ces recherches ne sont pas aussi fructueuses qu’originalement promis.10 Il a été démontré
qu’une librairie de composés doit être plus diversifiée en matière de fonctionnalité, de structure tridimensionnelle et de stéréochimie pour favoriser la découverte de composés bioactifs.9 En d’autres termes, c’est de dire qu’il faut construire des molécules qui
ressemblent structurellement plus à des produits naturels afin d’explorer une plus vaste région de l’espace chimique.11 La raison réside dans le fait que lorsqu’on compare les petites
molécules synthétiques de bibliothèques combinatoires et les produits naturels, on trouve
que les produits naturels possèdent déjà les caractéristiques nécessaires recherchées dans une molécule pour avoir le potentiel de devenir un médicament. Elles sont stables in vivo, perméables aux membranes cellulaires, ont une meilleure biodisponibilité et ont la capacité d’interagir efficacement avec des enzymes grâce à leurs structures de complexités supérieures. La découverte de nouvelles molécules bioactives est essentielle à l’avancement des sciences biomédicinales et depuis quelques années, la chimie des produits naturels semble reprendre de l’importance dans ces recherches.12, 13 Tel qu’il sera discuté dans cette
thèse, la chimie de synthèse joue un rôle d’importance au cœur de ces recherches.
1.1.2 Isolation et découvertes de nouveaux produits naturels
Les organismes terrestres tels que les plantes, les mycètes et les microorganismes sont des sources de produits naturels exploités depuis bien des années.1, 3 Plus récemment,
l’exploration marine est devenue tout aussi importante pour l’isolation de produits naturels. La naissance de la plongée sous-marine dans les années 1970 a permis l’accès à un vaste univers encore peu connu.3, 14 On y retrouve des organismes qui produisent des métabolites
de structures très diversifiés qu’on ne retrouve pas ailleurs. En ce qui concerne les organismes terrestres, il est estimé que seulement 1% des bactéries et 5% des mycètes sont connus aujourd’hui.13, 15 Alors, qu’ils soient d’origines marines ou terrestres, les
organismes vivants représentent une importante source de diversité moléculaire et de nouveauté.
Guidés par des essais biologiques, l’isolation de nouveaux produits issus de sources naturelles qui manifestent des activités biologiques d’intérêt est le travail de plusieurs équipes de recherches.5 Les produits identifiés sont par la suite analysés, et leurs structures
sont élucidées. On trouve entre autres des composés des vastes familles des terpénoïdes et des polycétides qui sont riches en activités biologiques. Par contre, ces produits s’y retrouvent souvent qu’en faible concentration, ce qui limite la quantité isolable de produit. De faibles quantités suffisent pour permettre la détermination de structures et l’évaluation de certaines activités biologiques, mais davantage de matériel est requis pour l’étude approfondie de leurs profils biologiques et de leur potentiel thérapeutique. La culture de tels organismes à petite échelle pour l’isolation de produits naturels est à la base de la découverte de nouvelles molécules bioactives mais l’obtention de grandes quantités de produits par cette méthode serait destructible pour l’environnement et les fragiles
6
l’écorce de 3 arbres matures de 100 ans est requise pour isoler 1 g de produit (0.01-0.02% de l’espèce Taxus brevifolia) quand la demande annuelle est de 100-200 kg par année.2, 16
Le paclitaxel est plutôt obtenu par la transformation d’un analogue structurel (le baccatin III) isolable en plus grande quantité de la même espèce (0.2%) (Schéma 1). Faute d’une synthèse totale trop dispendieuse et peu pratique de cet anticancéreux, il faut compter sur la nature et sur une hémisynthèse pour s’en procurer. Des recherches sont en cours pour l’obtention de ce produit à partir de cultures artificielles de cellules de l’arbre ou de son fongus endophytique (Taxomyces adreanae), mais ne sont pas rentables actuellement.17
La culture artificielle d’organismes est une approche alternative pour l’obtention de produits naturels et est le sujet de bien des recherches. Par exemple, la plupart des polycétides commerciaux sont obtenus par fermentation et/ou hémisynthèse.18 Cette culture artificielle
est toutefois limitée à la culture de certains types d’espèces tels que certaines bactéries, mycètes ou plantes. La croissance d’éponges marines en conditions contrôlées est toujours un défi biotechnologique d’actualité.19 D’un autre côté, certains organismes ont une
croissance trop lente et produisent que de faibles quantités du métabolite désiré et ces facteurs limitent l’exploitation d’une culture artificielle à des fins commerciales. Ces aspects ont été mis en évidence par la compagnie ParmaMar qui avait lancé un programme d’aquaculture de l’éponge marine Ecteinascidia turbinata dans le but d’en isoler le trabectedin (Yondelis®) (Schéma 2), un médicament anticancéreux d’origine naturelle
d’importance.20 Cette approche était très coûteuse et c’est finalement une approche
hémisynthétique à partir du cyanosafracin B, un antibiotique obtenu par fermentation bactérienne, qui a permis ultimement la poursuite des études cliniques et la commercialisation de ce composé.
De plus, il est connu que dans des conditions de laboratoire, les organismes ne produisent pas tous les produits naturels encodés dans leurs génomes et les rendements des produits biosynthétiques varient extrêmement en fonction des conditions de culture.4 On peut
expliquer ce phénomène par le fait que l’environnement d’un organisme influence directement son expression génétique et qu’il est extrêmement difficile de répliquer l’environnement naturel d’un organisme en laboratoire. Grâce à la biotechnologie moderne, de nouvelles approches sont développées afin de permettre un meilleur contrôle sur la production de produits naturels dans le contexte d’une culture artificielle. Des recherches ambitieuses démontrent qu’il est possible d’activer la biosynthèse de métabolites par l’activation des gènes correspondants d’un organisme.21 Cette activation s’effectue par le
contrôle des marques épigénétiques qui dictent l’expression des gènes d’un organisme. De plus, cette approche permettrait potentiellement de découvrir de nouvelles structures de produits naturels qui se cacheraient dans l’ADN non exprimé de l’organisme en question. La biosynthèse hétérologue est également une approche explorée pour l’obtention de molécules complexes.22 Cette dernière consiste en l’incorporation de fragments d’ADN qui
contiennent des gènes codants pour la production d’une molécule d’intérêt dans un microorganisme cultivé afin de favoriser sa biosynthèse. Les modifications génétiques et épigénétiques d’organismes pour la production de métabolites sont des approches expérimentales d’importance en recherche pour la découverte de molécules, mais la production massive de médecines uniquement par ces techniques reste illusoire.
8
1.2 Rôles fondamentaux de la synthèse totale moderne
1.2.1 Détermination et confirmation de structures
Originellement, la synthèse totale ou partielle de produits naturels permettait aux chimistes de déterminer la structure des composés isolés de la nature lorsque les outils analytiques ne le permettaient pas. Depuis l’avènement des techniques d’analyse modernes telles que la diffraction des rayons X et la spectroscopie à résonance magnétique nucléaire, les analyses de structures sont bien plus précises et la lourde tâche qu’était la détermination de structure avant les années 1960 a été facilitée.23, 24 Malgré ces technologies
révolutionnaires, les analyses peuvent tout de même être incomplètes ou mal interprétées et conduire à des erreurs de structures qui sont encore à ce jour rapportées. On approxime que sur une période de 5 ans, 369 produits naturels sont mal assignés et mal représentés.25
Les erreurs de structures courantes concernent des erreurs de connectivité de liaisons, de stéréochimie d’alcènes, du nombre de carbone sur de longues chaînes aliphatiques (ou de masse moléculaire), de configuration absolue et de configuration relative de centres stéréogéniques.26 En guise d’exemple, la récente révision de la structure de l’acétate
d’uprolide G (UGA) par le groupe de Tong démontre bien la nécessité de la synthèse totale pour la détermination de structure encore aujourd’hui (Figure 2).27 Une première révision de
structure avait été effectuée en 2000 par une synthèse partielle du composé mais cette dernière n’était pas en mesure de prouver la correcte configuration stéréochimique.28
Seulement une synthèse totale énantiosélective a permis d’y parvenir. La synthèse totale d’un composé naturel demeure la meilleure méthode pour confirmer sa structure sans ambigüité et quelques revues de la littérature ont été publiées sur ce sujet, regroupant plusieurs exemples de révisions structurelles. 23, 25, 26
1.2.2 Un accès à des quantités de produits naturels et analogues
La synthèse et l’hémisynthèse de composés bioactifs et de produits naturels demeurent les approches les plus fiables pour subvenir aux besoins matériels de ces structures pour la conception et la production de médecines.29 Le succès de l’application d’une telle stratégie
dans la production du médicament anti-malaria artémisinine 1,30 qui a fait l’objet du prix
Nobel de médecine 2015, l’illustre bien (Schéma 3). Ce composé, initialement utilisé en médecine traditionnelle chinoise, est retrouvé dans la plante Artemisia annua dans une concentration de seulement 0.8% de sa masse sèche.29 La grande demande pour ce
composé en nécessitait un approvisionnement massif qui était difficilement atteignable par extraction de la plante.31 Les synthèses totales développées d’artémisinine ne permettaient
toutefois pas une production à grande échelle qui était rentable.32 Une voie de biosynthèse
hétérologue fut mise au point permettant la production de l’acide artémisinique 2, un précurseur important dans la synthèse d’artémisinine, à partir de la levure Saccharomyces cerevisae.31, 32 Des efforts synthétiques ont par la suite permis l’élégante transformation de
2 en artémisinine 1 par un procédé de seulement 3 étapes qui fourni 55% de rendement
global (Schéma 3).30 Aujourd’hui, l’artémisinine est produit à l’échelle de plus de 35 tonnes
par année et est devenue un médicament de nouvelle génération approuvée par le WHO (World Health Organization) pour traiter la malaria.29
10
Les produits naturels sont irréfutablement une source importante de structures nouvelles et bien que leurs activités soient intéressantes, ils ne sont pas toujours des candidats idéaux pour le développement d’un médicament. Ils peuvent par contre servir en tant que composés tête de série (lead compound) où l’optimisation des propriétés biologiques de tels composés est la base de l'élaboration d’un nouveau traitement. La synthèse d’analogues de produits naturels va permettre des études de relation structure-activité entre ces derniers et le composé parent ainsi que des études pharmacologiques afin de trouver un candidat plus prometteur en vue des études cliniques subséquentes. Il est impératif d’être capable d’obtenir des quantités suffisantes de produit pour ces études et lorsque la culture de produits naturels de l’environnement est limitée pour des raisons économiques, pratiques ou éthiques, leur synthèse chimique devient une solution de rechange viable pour fournir ces molécules. De plus, une fois établie, une voie de synthèse d’un produit naturel peut souvent être modifiée et adaptée afin de fabriquer des analogues. Cette approche synthétique demeure la plus efficace pour l’exploration moléculaire dans un contexte de recherche et développement de médicaments qui doit progresser à un rythme accéléré.
Une approche typique adoptée dans l'élaboration d’une voie de synthèse d’un composé en est une qui est dite orientée vers la cible (target-oriented synthesis ou TOS). Des séquences linéaires ou convergentes sont centrées sur l’obtention d’un seul produit d’intérêt (Schéma 4). Un aspect moderne de la synthèse totale est la mise au point d’une seule séquence synthétique pour permettre la synthèse de plusieurs composés ciblés. Cette approche diffère substantiellement des synthèses linéaires ou des synthèses convergentes, car la synthèse d’un intermédiaire commun servira à fabriquer différents analogues par différentes routes synthétiques. On parle de synthèses totales divergentes (diverted total synthesis ou DTS) lorsqu’on combine une approche convergente pour fabriquer l’intermédiaire commun et une approche divergente pour en fabriquer des analogues. En guise d’exemple, le groupe de Fukuyama a rapporté la synthèse des amathaspiramides par une voie de synthèse divergente (Schéma 5).33 Dans ce cas, le groupe a d’abord synthétisé l’amathaspiramide D
qui a servi d’intermédiaire pour la synthèse de tous les autres membres de cette même famille. D’autres exemples de synthèses divergentes qui ont permis de fabriquer plusieurs composés naturels ou d’analogues d’une même famille sont rassemblés dans des revues de la littérature.7, 34 Avec cette stratégie, il est possible d’étudier les propriétés biologiques
Schéma 5: Synthèse divergente des amathaspiramides du groupe Fukuyama33 Schéma 4: Représentation des types de stratégies de synthèses courantes34
12
En chimie pharmaceutique, ce concept est présentement pris en compte pour construire des librairies de molécules de structures plus complexes que celles obtenues avec la chimie combinatoire classique. La synthèse orientée sur la diversité (diversity-oriented synthesis ou DOS) est une approche qui découle de la synthèse divergente et qui vise à découvrir de nouvelles structures bioactives.35 L’idée derrière ce concept est d’avoir un haut taux de
divergence dès les premières étapes de synthèse afin de construire une grande quantité de composés très diversifiés et d’améliorer la qualité des librairies de composés pharmaceutiques. C’est dans cet ordre d’idée que le groupe de Stockman a démontré qu’à partir du dicétodienoate 3, différentes méthodologies pouvaient être appliquées pour fabriquer plusieurs substrats afin d’en évaluer les propriétés anticancéreuses (Schéma 6).36
Également, la dérivation de produits naturels complexes par une stratégie hémisynthétique pour concevoir des librairies de structures diversifiées en est un autre exemple d’importance. Certains composés polycycliques naturels sont facilement accessibles par des méthodes d’isolation et peuvent être source de diversité moléculaire lorsqu’on applique cette stratégie DOS. Des méthodologies complexes de distorsion de cycles ont permis de transformer des molécules telles que l’adrénostérone, l’acide gibbérellique et la quinine en de nouvelles molécules possédant des structures intéressantes (Schéma 7).37, 38 Il va de soi
que le développement de nouvelles réactions et de nouvelles méthodologies de synthèses servent de catalyseur dans l’épanouissement de ces recherches.
14
1.2.3 Une plateforme pour l’innovation
La chimie de synthèse sert également de plateforme pour découvrir de nouvelles réactions et concevoir des stratégies qui peuvent offrir des solutions à différents problèmes synthétiques. Comme mentionné précédemment, le développement de nouvelles méthodes de synthèse est ce qui alimente les recherches de nouvelles structures. Depuis l’époque des pionniers de la synthèse organique tels que Woodward puis Corey, la synthèse totale de produits naturels a permis une compréhension profonde de la chimie organique et une accélération de la découverte de réactions pour fournir une panoplie de méthodologies employées aujourd’hui.39 Avec la disponibilité de ces méthodes synthétiques, il a été
possible de construire d’énormes structures de complexités impressionnantes, et ce avec un excellent contrôle régiochimique et stéréochimique. On dit de la chimie de synthèse qu’elle a été poussée à ses limites avec la synthèse de molécules telles que la ciguatoxine7, 40 ou la
palytoxine (Figure 3).41, 42 La question n’est désormais plus si l’on est capable de synthétiser
une molécule ciblée, mais bien comment la synthétiser.
En effet, dans cette nouvelle ère de la chimie de synthèse, les objectifs visent non seulement l’obtention d’un produit naturel synthétique, mais d’en effectuer la synthèse avec ruse de manière efficace tout en respectant l’environnement. Il est également désirable d’éviter l’utilisation de réactifs toxiques tel que les métaux lourds qui pourraient contaminer (même à l’échèle de la ppm) un produit synthétisé. De plus, il est souhaitable que ces
16
clinique des composés synthétisés et leur commercialisation future.43 La construction d’une
molécule complexe de façon idéale représente un défi impressionnant dans ce contexte et l’innovation de nouvelles séquences réactionnelles permettra de réaliser ce rêve.
L’idée d’une «synthèse idéale» amenée par Hendrickson en 1975 est devenue une réalité qui impacte la pratique des chimistes de synthèse.42, 44 Les concepts d’économie d’atomes,45
d’économie d’étapes46 et d’économie de redox47 sont l’ultimatum de la synthèse organique
du 21e siècle.48 Ces critères définissent l’idéalité d’une synthèse et peuvent maintenant être
quantifiés par une équation qu’a postulée Baran (Figure 4).49
Figure 4: Mesure quantitative de l'idéalité d'une synthèse49
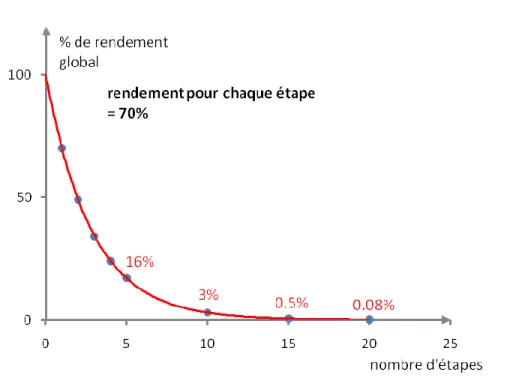
D’abord, le concept d’économie d’atomes est une approche de chimie verte qui vise à utiliser des méthodes dont la majorité des atomes des réactifs soit incorporés sur les produits de la réaction. De cette manière, moins de produits secondaires et de déchets sont générés. Par exemple, la réaction de Diels-Alder est une réaction 100% économique en atomes puisque tous les atomes présents sur les réactifs de départ se retrouvent sur le produit de la réaction. Ensuite, le nombre d’étapes d’une synthèse quant à lui, aura un impact majeur sur la quantité de matériel requise pour effectuer la synthèse et donc sur la quantité de déchets qui seront produits (solvants, réactifs et produits secondaires). Tel que souligné par Mulzer, le rendement d’une synthèse décroit exponentiellement avec le nombre d’étapes.50 Par exemple, en considérant un rendement de 70% pour chaque étape d’une
synthèse fictive, le rendement global de cette synthèse après 5 étapes serait de 16% et après 10 étapes, de 3% (Figure 5). Lorsque cette séquence dépasse les 20 étapes, le rendement global peut être aussi bas que 0.05% et cela signifie que 99.95% du produit de départ a été perdu en déchets.
La simplification d’une synthèse peut se faire en éliminant l’utilisation de groupements protecteurs et en employant des méthodes plus chimiosélectives pour les remplacer par exemple. Ce concept va de pair avec celui de l’économie de redox qui propose d’éliminer ou de diminuer le nombre de transformations de groupements fonctionnels qui ne contribuent pas à la construction du squelette de la molécule cible. Ces transformations impliquent souvent des réactions d’oxydation ou de réduction qui pourraient être évitées. Par exemple, l’obtention de la fonction aldéhyde à partir d’un ester est un exemple typique dans ce contexte. L’utilisation de DIBAL pour réduire un ester en aldéhyde est une réaction très capricieuse, à un point tel que cette méthode est généralement évitée.48 Son obtention par
la refonctionnalisation du groupement ester en d’autres groupements (alcool, amide de Weinreb, thioester) est plutôt préférée, ce qui augmente le nombre de réactions inutiles dans une synthèse. Davantage de méthodes synthétiques doivent être développées afin de régler de telles problématiques et améliorer l’efficacité et l’idéalité des synthèses.
La figure 6 que propose Wender vise à mettre en perspective l’idéalité et la praticité des synthèses.46 On peut comparer la complexité d’une molécule par rapport au nombre
d’étapes requises pour la construire. Une synthèse idéale vise l’obtention d’un composé
18
une solution envisageable lorsque la molécule d’intérêt est trop complexe pour être synthétisée de manière pratique.46c Par
exemple, la conception d’un analogue simplifié du produit naturel halichondrin B a mené à la commercialisation de l’anticancéreux eribulin mesylate (Halaven®),
une molécule entièrement synthétique emblématique des progrès de la chimie de synthèse (Figure 7).51, 52 Il est à noter que
cette molécule est une des seules molécules de la famille des polycétides qui est produite par une méthode alternative à la culture
bactérienne pour sa commercialisation.18 25 années d’efforts et d’acharnement en
laboratoire ont permis la synthèse économiquement rentable de ce composé qui requiert 62 étapes au total.53 L’eribulin mesylate, approuvé en 2010 pour le traitement des cancers
métastatiques du sein,51 possède une activité anticancéreuse qui dépasse largement (5 à 10
fois supérieure) celle du paclitaxel (Taxol®).54 D’un autre côté, lorsque la synthèse totale
d’un produit naturel est visée, cette cible ne peut pas être modifiée ce qui nous force à développer de meilleures routes synthétiques pour les obtenir de façon pratique, voire idéale. Le développement de nouvelles réactions est donc la seule solution possible dans ce contexte.
Figure 6: Développement de synthèses idéales selon
Wender46
Beaucoup de stratégies et de tactiques synthétiques employées aujourd’hui démontrent une efficacité exceptionnelle. Par exemple, une des stratégies les plus efficaces pour effectuer la synthèse d’une molécule naturelle est d’en considérer sa biogenèse et d’employer des réactions similaires.55 Les réactions biomimétiques visent à répliquer des réactions clés
observées dans la nature pour permettre d’atteindre un bon niveau de complexité en un minimum d’étapes. La cyclisation cationique d’isoprènoïdes pour former des structures stéroïdiennes est un excellent exemple de réaction observée dans la nature que l’on peut répliquer en laboratoire. La synthèse totale de la progestérone par voie biomimétique rapportée par Johnson et coll. en est un exemple de longue date (Schéma 8).56 Il a
démontré que 4 pouvait être cyclisé en une étape pour fournir la structure 5 qui fut transformée en progestérone. Il va sans dire que la nature a une longueur d’avance sur nous en ce qui concerne la synthèse de composés complexes après ses milliards d’années d’évolution. Il semble logique de s’en inspirer pour développer des séquences synthétiques plus efficaces.
Bien que des progrès technologiques aient été accomplis de ce côté, nous ne sommes pas encore à la hauteur de son efficacité. Pour y arriver, il faut continuer d’approfondir les connaissances en synthèse, diviser de nouvelles stratégies et optimiser les méthodes actuelles. Quelques domaines de recherche en vogue en synthèse incluent le
20
de méthodes asymétriques catalytiques et organocatalytiques.59 Ce type de travaux
permettra de raccourcir le nombre d’étapes des synthèses, de résoudre des problèmes synthétiques d’importance et par-dessus tout, d’améliorer l’efficacité de nos méthodes. Enfin, la synergie entre la chimie de synthèse moderne et la chimie médicinale permettra l’identification de nouvelles entités chimiques bioactives et ultimement le développement de nouvelles approches thérapeutiques pour guérir les pathologies d’aujourd’hui.
1.2.4 Les objectifs de cette thèse
Le but de nos travaux de recherche est de développer des séquences synthétiques concises pour la construction de produits naturels qui sont d’un intérêt pharmaceutique d’un point de vue de leurs activités biologiques. Un accent important est apporté sur l’économie d’étapes et sur l’utilisation de méthodes hautement chimio-, régio- et stéréosélectives pour atteindre une efficacité maximale. Les voies de synthèse développées permettent également la synthèse d’analogues potentiellement plus bénéfiques. Dans l’optique d’étudier les activités biologiques de ces molécules, les produits chiraux sont synthétisés énantiomériquement purs. Cet important aspect permet également la confirmation de structures ainsi que la détermination de la stéréochimie absolue de certains composés. De plus, l’utilisation du concept de synthèse divergente pour accéder à plusieurs composés naturels via un intermédiaire commun est également un thème récurrent dans nos recherches. Dans le but de développer davantage la chimie des hétérocycles oxygénés, un intérêt prédominant au sein du groupe Boukouvalas, nous nous sommes concentrés sur la synthèse de composés figurant la présence d’un ou plusieurs cycles oxygénés tels que les motifs furane et ses dérivés, furanone (buténolide), γ-hydroxybuténolide, anhydride maléique et γ-lactone. Ces travaux sont notre contribution à l’avancement de la chimie de synthèse et de la science en général.
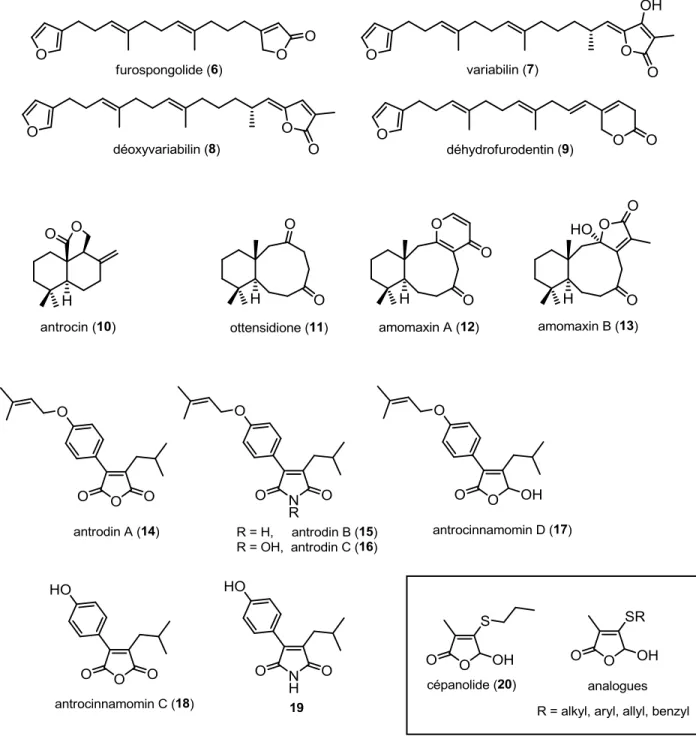
D’abord, nos champs d'intérêt se sont posés sur la synthèse de terpénoïdes bioactifs. De cette famille, les synthèses des furanoterpénoïdes linéaires 6 à 9, le drimane antrocin 10 et les analogues de nonadrides 11, 12 et 13 étaient visées (Figure 8). Par ailleurs, nous avons développé une synthèse biomimétique d’une famille de dérivés de l’anhydride maléique isolés de l’espèce fongique Antrodia camphorata représenté par les composés 14 à 19. Cette méthode divergente est ensuite complémentée par une voie de synthèse qui permet également l’accès au dérivé γ-hydroxybuténolide 17 de manière régiosélective. Pour démontrer davantage l’applicabilité de cette méthode régiosélective à un autre substrat, la
synthèse du cépanolide (20), un composé anticancéreux isolé de l’oignon vert, et d’analogues a été effectuée.
22
1.3 Références
1 David B., Wolfender J.-L., Dias D. A. Phytochem. Rev. 2015, 14, 299. 2 Dias D. A., Urban S., Roessner U. Metabolites 2012, 2, 303.
3 Cragg G. M., Newman D. J. Biochim. Biophys. Acta 2013, 1830, 3670.
4 Schmitt E. K., Moore C. M., Krastel P., Petersen F. Curr. Opin. Chem. Biol. 2011, 15, 497. 5 Baker D. D., Chu M., Oza U., Rajgarhia V. Nat. Prod. Rep. 2007, 24, 1225.
6 Lahlou M. J. Pharm. Pharmacol. 2013, 4, 17.
7 Wilson R. M., Danishefsky S. J. J. Org. Chem. 2006, 71, 8329. 8 Newman D. J., Cragg G. M. J. Nat. Prod. 2012, 75, 311.
9 Lovering F., Bikker J., Humblet C. J. Med. Chem. 2009, 52, 6752. 10 Rouhi A. M. Chem. Eng. News. 2003, 81, 77.
11 Rosén J., Gottfries J., Muresan S., Backlund A., Oprea T. I. J. Med Chem. 2009, 52, 1953.
12 Carter G. T. Nat. Prod. Rep. 2011, 28, 1783.
13 Harvey A. L., Edrada-Ebel RuA., Quinn R. J. Nat. Rev. Drig Disc. 2015, 14, 111. 14 Martins A., Vieira H., Gaspar H., Santos S. Mar. Drugs 2014, 12, 1066.
15 Gunatilaka A. A. L. J. Nat. Prod. 2006, 69, 509.
16 Dewick P. M. Medicinal Natural Products: A Biosynthetic Approach, 2nd ed.; John Wiley
and son: West Sussex, UK, 2002; p. 205.
17 Gangadevi V., Muthumary J. Biotechnol. Appl. Biochem. 2009, 52, 9.
18 Dechert-Schmitt A.-M. R., Schmitt D. C., Gao X., Itoh T., Krische M. J. Nat. Prod. Rep.
2014, 31, 504.
19 Hausmann R., Vitello M. P., Leitermann F., Syldatk C. J. Biotechnol. 2006, 125, 117. 20 Cuevas C., Francesch A. Nat. Prod. Rep. 2009, 26, 322.
21 Williams R. B., Henrikson J. C., Hoover A. R., Lee A. E., Cichewicz R. H. Org. Biomol. Chem. 2008, 6, 1895.
22 Zhang H., Boghigian B. A., Armando J. Pfeifer B. A. Nat. Prod. Rev. 2011, 28, 125. 23 Nicolaou K. C., Snyder S. A. Angew. Chem., Int. Ed. 2005, 44, 1012.
24 Molinski T. F. Org. Lett. 2014, 16, 3849.
25 Suyama T. L., Gerwick W. H., McPhail K. L. Bioorg. Med. Chem. 2011, 19, 6675. 26 Maier M. E. Nat. Prod. Rep. 2009, 26, 1105.
27 (a) Zhu L., Liu Y., Ma R., Tong R. Angew. Chem., Int. Ed. 2015, 54, 627; (b) Zhu L., Tong R. Synlett 2015, 26, 1643.
28 Rodríguez A. D., Soto J. J., Barnes C. L. J. Org. Chem. 2000, 65, 7700. 29 Bauer A., Brönstrup M. Nat. Prod. Rep. 2014, 31, 35.
30 Corsello M. A., Garg N. K. Nat. Prod. Rep. 2015, 32, 359.
31 (a) Paddon C. J., Westfall P. J., Pitera D. J., Benjamin K., Fisher K., McPhee D., Leavell M. D., Tai A., Main A., Eng D., Polichuk D. R., Teoh K. H., Reed D. W., Treynor T., Lenihan J., Fleck M., Bajad S., Dang G., Dengrove D., Diola D., Dorin G., Ellens K. W., Fickes S., Galazzo J., Gaucher S. P., Geistlinger T., Henry R., Hepp M., Horning T., Iqbal T., Jiang G., Kizer L., Lieu B., Melis B., Moss N., Regentin R., Secrest S., Tsuruta H., Vazquez R., Westblade L. F., Xu L., Yu M., Zhang Y., Zhao L., Lievense J., Covello P. S., Keasling J. D., Reiling K. K., Renninger N. S., Newman J. D. Nature 2013, 496, 528; (b) Vonwiller S. C., Warner J. A., Mann S. T., Haynes R. K. J. Am. Chem. Soc. 1995, 117, 11098; (c) Roth R. J., Acton N. J. Nat. Prod. 1989, 52, 1183.