MELANIE LABONTE-COTE
UTILISATION DU FOCUS HYDRODYNAMIQUE
POUR LA DÉTECTION DE PARTICULES PAR
MICROSCOPIE DE FLUORESCENCE
Mémoire présenté
à la Faculté des études supérieures de l'Université Laval dans le cadre du programme de maîtrise en chimie pour l'obtention du grade de Maître es Sciences (M. Sc.)
DEPARTEMENT D E CHIMIE FACULTÉ DES SCIENCES ET D E GÉNIE
UNIVERSITÉ LAVAL QUÉBEC
2010
Résumé
Avec l'essor de la microfabrication, il est désormais possible d'imaginer des appareils miniatures qui sont en mesure d'effectuer, à l'échelle microscopique, ce que réalisent les appareils actuels. Or, l'analyse chimique dans ces systèmes peut facilement s'avérer ardue car le volume d'analyte y est très restreint. Ces structures miniatures permettent en contrepartie de manipuler de petites particules, voire des molécules, presqu'individuellement. Il est par conséquent envisageable de pouvoir compter, localiser et identifier des nanoparticules fluorescentes qui seraient, par exemple, le véhicule de détection d'analytes d'intérêt comme de l'ADN dans un système d'analyse chimique microfluidique.
Les présents travaux se penchent sur l'analyse de particules fluorescentes confinées au centre d'un canal microfluidique par focus hydrodynamique. L'analyte s'écoule au centre du canal car il est bordé de chaque côté par un flot colinéaire. En ajustant les débits de cette gaine et du flot analyte, il est possible d'aligner les particules au centre du canal. Un système de détection de fluorescence par microscopie confocale modifiée permet de recueillir l'émission de photons et de compter le nombre de particules ayant traversé le volume de détection. De cette façon, on maximise la probabilité de détection car tout l'échantillon est passé au peigne fin.
Afin de faire de l'analyse quantitative de particules fluorescentes dans un échantillon, plusieurs paramètres ont été étudiés. Le choix de la configuration microfluidique, la construction du montage optique et la caractérisation de l'appareil ont permis d'analyser des nanoparticules fluorescentes de type « cœur-coquille » bien particulières. En effet, ces nanoparticules sont recouvertes d'une couche d'or pour tirer profit de l'exaltation de la fluorescence par l'effet plasmon. Les résultats présentés dans ce mémoire démontrent l'utilité du focus hydrodynamique pour l'analyse chimique et sont prometteurs pour étudier différents véhicules de détection.
Abstract
Nowadays, due to remarkable progress in micromachining, it is possible to imagine miniature devices that realize analysis at the microliter scale instead of the actual larger systems. These micro-devices allow us to manipulate very small particles almost individually with very high precision. However, analytical performances in these systems are limited with regards to the small amount of analyte available. Fluorescence could be used as a sensitive tool to maximize the chance of detecting particles of interest, which could for example be the vehicle for stained DNA.
The present work concerns the analysis of fluorescent particles that are confined at the center of a microfluidic channel through hydrodynamic focusing. An analyte flow runs down the channel and is edged on each side by a parallel sheath flow. By adjusting the different flow rates, one can control the width of the analyte flow in the output channel, and ultimately align small particles. A modified confocal microscope allows to record the fluorescence photons and to count the number of particles that have crossed the detection volume. By doing so, all sample is forced to cross the detection volume, thus increasing the detection probability. In order to perform quantitative analysis of fluorescent particles, several parameters were optimized. Several microfluidic configurations were evaluated. The optical set-up was put into place, characterized and calibrated. All those steps allowed the study of peculiar nanoparticles which take advantage of metal-enhanced fluorescence through a core-shell structure. The results presented here demonstrate the utility of hydrodynamic focusing for chemical analysis and are promising for the detection of analyte vehicles.
Avant-Propos
Je tiens d'abord à remercier le professeur Denis Boudreau d'avoir cru en moi et de m'avoir donné la chance de réaliser mes études graduées au sein de son groupe de recherche. Au cours de mon projet de maîtrise, j'ai pris goût aux discussions scientifiques inspirantes, aux défis novateurs et au dépassement de soi Et tout çà, grâce à toi Denis. Merci
Je tiens aussi à remercier tous les membres de l'équipe de recherche sans qui mon passage à l'Université Laval n'aurait pas été aussi agréable et formateur. Je remercie spécialement Sébastien Chapdelaine, Jean-François Gravel, Yoan Lechasseur ainsi que Jean-François Y. Gravel pour l'inspiration et le support lors de la conception du montage expérimental. Sans vous, j'y serais encore! Je veux aussi souligner la contribution de David Béliveau-Viel pour son savoir-faire avec le logiciel Labview. Je désire aussi remercier Karine Herreyre, Benoît Voisin et Ludovic Saiveng Live pour avoir été mes mentors lors de mes premiers pas au sein du groupe de recherche. J'aimerais aussi remercier tout particulièrement Maxime Rioux pour sa bonne humeur contagieuse, Luc Rainville pour sa touche d'humour, Mathieu Lessard Viger pour son attitude toujours réconfortante et Danny Brouard pour sa grande motivation. Je veux de plus souligner l'apport des autres membres du laboratoire, Ilya Veksler, Guillermo Bracamonte ainsi que les étudiants d'été qui ont apporté la joie de vivre avec eux à chaque matin.
J'aimerais mentionner la contribution d'Emmanuel Roy et de Teodor Veres, chercheurs à l'Institut des matériaux industriels. Je tiens aussi à souligner l'apport de Serge Valois à ma formation en sciences. Il est de plus essentiel de remercier les organismes subventionnaires qui m'ont permis de réaliser ce projet : FQRNT, CRSNG, FCI et RDDC.
En terminant, je désire remercier tout particulièrement mes proches pour leur support constant et leurs encouragements. Merci papa pour tout ce que tu m'as appris, maman pour tout ce que tu fais pour nous, Guillaume pour avoir formé mon caractère, Sophie pour ton écoute toujours fidèle ainsi qu'Alex, pour l'étincelle dans tes yeux.
A mon père pour sa sagesse, ses conseils et sa patience, ainsi qu'à ma famille pour son support inconditionnel.
Table des matières
Résumé ii Abstract iii Avant-Propos iv Table des matières vi Liste des tableaux viii Liste des figures ix
Liste des symboles et abréviations xi Chapitre 1: Mise en contexte 1 Chapitre 2: Principes théoriques 5
2.1 Initiation à l'écoulement microfluidique 5
2.1.1 Le nombre de Reynolds 5 2.1.2 L'équation de Navier-Stokes simplifiée 6
2.1.3 Le flot de Poiseuille 7 2.1.5 Le nombre de Péclet 9 2.2 Description du focus hydrodynamique 10
2.2.1 Largeur du focus hydrodynamique 11 2.2.2 Comportement du focus hydrodynamique en trois dimensions 14
2.2.3 Applications du focus hydrodynamique dans littérature scientifique 15
2.3 Amélioration de la probabilité de détection optique 18
2.3.1 Augmentation du signal analytique 20 2.3.2 Diminution du signal de fond 22 2.4 Utilisation de la microscopie confocale 24
2.4.1 Fonctionnement et avantages 25 2.4.2 Variante de la microscopie confocale : la prédivergence optique 26
Chapitre 3: Matériel et méthodes 29 3.1 Intégration du système fluidique 29
3.1.1 Propriétés des cartouches en thermoplastique élastomère 29
3.1.2 Propriétés des cartouches en borosilicate 32
3.1.3 Valve, pompes et seringues 34 3.2 Description du système de détection 36
3.2.1 Présentation du train optique 37 3.2.2 Interprétation du signal et traitement des données 40
3.3 Composition des particules fluorescentes 42
3.3.1 Fonctionnalisation de microparticules magnétiques 43
3.3.2 Synthèse de nanoparticules cœur-coquille 45
Chapitre 4: Résultats et discussion 48 4.1 Optimisation des paramètres expérimentaux 48
4.1.1 Choix de la configuration microfluidique optimale 48 4.1.2 Établissement de la plage de ratios utilisables pour le focus hydrodynamique 53
4.1.3 Ajustement de la prédivergence du système optique 55
4.1.4 Optimisation de la puissance d'excitation 56
4.2 Validation de la méthode 59 4.2.1 Caractérisation : seuil de détection, récupération et répétabilité 59
4.2.2 Pertinence de l'emploi du focus hydrodynamique 63 4.3 Potentiel de la méthode en regard de la détection de nanoparticules 66
Chapitre 5: Synthèse et conclusions 69
Bibliographie 71 Annexe 75
1. Plan de la monture de connexion des cartouches microfluidiques en TPE 75 2. Table de vitesse linéaire du liquide dans les canaux d'entrée des cartouches en TPE...
76 3. Table de vitesse linéaire du liquide dans le canal de sortie des cartouches en TPE.. 77
4. Table de vitesse linéaire du liquide dans les cartouches en borosilicate 78 5. Spectres de transmission des pièces optiques utilisées dans le montage de détection...
79
6. Algorithme Mathlab pour le traitement du signal analytique 82 7. Structure chimique du Lucifer Yellow-Cadavérine-Biotine 83
8. Spectre d'excitation/émission du Lucifer Yellow 83 9. Spectre d'excitation/émission des nanoparticules cœur-coquille (Si02+FITC@Au)...
84
10. Focus hydrodynamique dans la cartouche en TPE, angle de 60° 85 11. Focus hydrodynamique dans la cartouche en borosilicate de Micronit 86 12. Débits de gaine à utiliser selon le ratio et le débit analyte souhaités 87
Liste des tableaux
Tableau 3.1 : Description des microbilles magnétiques commerciales 43 Tableau 4.1 : Résumé des conditions expérimentales utilisées pour déterminer la pertinence du
Liste des figures
Figure 2.1 : Profil parabolique de la vitesse d'un liquide en mouvement dans un canal 7 Figure 2.2 : Détection optique de particules uniques par microscopie de fluorescence 8 Figure 2.3 : Formation d'un focus hydrodynamique dans une configuration en croix 10 Figure 2.4 : Variation de la largeur du focus selon le ratio des débits gaine/analyte [40] 12
Figure 2.5 : Comparaison d'un focus hydrodynamique à un circuit électrique 13 Figure 2.6 : Représentation CLSM de la vue en coupe du canal de sortie du focus
hydrodynamique; a) focus symétrique; b) focus non-symétrique (ratio 8 pour 1)
[38] 14 Figure 2.7 : Distribution du signal de fond et de la fluorescence selon le bruit [55] 19
Figure 2.8 : Diagramme dejablonski, transitions électroniques de la fluorescence 20 Figure 2.9 : Intensité Raman de l'eau relative à la fluorescence d'une molécule de rhodamine
6G pour divers volumes d'analyse [29] 24 Figure 2.10 : Principe de l'épifluorescence avec détection confocale 25
Figure 2.11 : Conception optique pour la détection de fluorescence; a) pour un faisceau
d'excitation collimaté; b) pour un faisceau d'excitation prédivergé 27 Figure 3.1 : Schéma des configurations microfluidiques des cartouches en TPE; a) angle de
jonction à 30°; b) angle de jonction à 60° 30 Figure 3.2 : Monture de connexion pour les cartouches microfluidiques en thermoplastique
élastomère; a) superposition des différents éléments; b) observation des canaux
sous un microscope du côté de la lamelle 32 Figure 3.3 : Cartouche microfluidique en borosilicate fabriquée par Micronit 33
Figure 3.4 : Stratégies de connexion pour les cartouches en borosilicate; a) monture en acier inoxydable; b) férule pour les tubes de Tefzek c) férule pour les capillaires de silice
fondue 33 Figure 3.5 : Schéma d'intégration des composantes du système fluidique 35
Figure 3.6 : Système de détection optique employé avec un faisceau d'excitation prédivergé... 39 Figure 3.7 : Signal de fluorescence typique relatif au déplacement par capillarité de particules de
Lucifer Yellow (2,8 pm de diamètre) dans le volume de détection, acquisition à 1 kHz; a) portrait d'ensemble du signal; b) agrandissement d'une partie du signal... 41 Figure 3.8 : Synthèse des nanoparticules cœur-coquille fluorescentes; a) formation du cœur en
silice dopée; b) création de la coquille d'or 46 Figure 4.1 : Étude de la largeur du focus hydrodynamique en fonction du débit de la gaine
image de microscopie de fluorescence; b) profil d'intensité de fluorescence dans la
tranche du canal 49 Figure 4.2 : Étude de la largeur du focus hydrodynamique en fonction du débit de la gaine
pour différents débits analyte 50 Figure 4.3 : Largeur du focus hydrodynamique en fonction du ratio des débits gaine et analyte
pour différentes configurations microfluidiques 52 Figure 4.4 : Établissement de la plage de ratios utilisable pour le focus hydrodynamique dans la
cartouche en borosilicate; a) ratio minimal (débit gaine 0,25 uL/min); b) ratio
maximal (débit analyte 1,00 uL/min) 54 Figure 4.5 : Effet de la prédivergence sur la localisation du point focal sur l'axe optique 55
Figure 4.6 : Diamètre de l'empreinte laser au plan de travail selon la prédivergence 56 Figure 4.7 : Optimisation de la puissance d'excitation du système de détection 58 Figure 4.8 : Signaux typiques obtenus lors d'analyses en focus hydrodynamique dans la
cartouche en borosilicate (acquisition 2 kHz, vitesse linéaire ~33 mm/s); a) signal
de fond, eau ultrapure; b) billes LY 1,0 um 60 Figure 4.9 : Distribution d'intensité de fluorescence de particules analysées en focus
hydrodynamique 61 Figure 4.10 : Augmentation du taux de détection de particules fluorescentes en fonction de la
focalisation du flot analyte 64 Figure 4.11 : Diminution de la distribution d'intensité de fluorescence selon la largeur du focus
hydrodynamique 65 Figure 4.12 : Analyse de nanoparticules fluorescentes en focus hydrodynamique; a) signal brut;
Liste des symboles et abréviations
ADN Acide désoxyribonucléiqueVIH Virus d'immunodéficience humaine colL Collaborateurs
cm2 Centimètre carré (10^ mètre carré)
PCR Polymerase Chain Reaction (Réaction en chaîne par polymerase) £L Femtolitre (1015 litre)
Re
Nombre de Reynolds v Vitesse linéaire/ Diamètre du canal de propagation P Densité du liquide
n
Viscosité dynamique cm Centimètre (10~2 mètre) s Seconde um Micromètre (10~6 mètre) kg Kilogramme (103 gramme) m3 Mètre cube P a s Pascal seconde P Pression Pe Nombre de Péclet D Coefficient de diffusionum2 Micromètre carré (1012 mètre carré)
min Minute
a Ratio des pressions gaine/analyte mm Millimètre (103 mètre)
R Résistance électrique
v,
Potentiel électriquey Facteur de géométrie microfluidique a Facteur de géométrie microfluidique
o.
Oie Largeur du canal de sortie
/? Facteur de géométrie microfluidique
CLSM Confocal Laser Scanning Microscopy (Microscopie confocale laser à balayage) 2D Deux dimensions
Degré d'angle r Rayon de courbure
co Largeur du canal microfluidique PQ Point quantique
C Degré Celsius
% v/v Pourcentage volumique
ab Bruit, écart-type sur le signal de fond
So Niveau électronique fondamental, état singulet Si Premier niveau électronique excité, état singulet 52 Deuxième niveau électronique excité, état singulet Ti État triplet
ns Nanoseconde (10"9 seconde)
Of Rendement quantique de fluorescence cm'1 Nombre d'onde
1RS Intensité de la diffusion Raman IF Intensité de fluorescence
nm Nanometre (10~9 mètre)
mL Millilitre (103 litre)
uL Microlitre (10~6 litre)
NA Numerical Aperture (Ouverture numérique) eps Comptes par seconde
mW/m2 Milliwatt par mètre carré (Irradiance)
ETR Écart-type relatif
TPE Thermoplastique élastomère
IMI Institut des matériaux industriels, (Boucherville, Québec) LL Later Lack (Type de connecteur à seringue)
PVC Polyvinyl Chloride (Chlorure de polyvinyle) " Pouce (2,54 centimètres)
uL/h Microlitre à l'heure
CCD Charge Coupled Device (Dispositif à couplage des charges) kHz Kilohertz (103 hertz)
mrad MiUliradian m Mètre
FWHM Full Width Half Maximum (Largeur à mi-hauteur) PMT Photomultiplier Tube (Tube photomultiplicateur) R6G Rhodamine 6G
uM Micromolaire (10~6 mole par litre)
mW Milliwatt (103 joule par seconde)
ms Milliseconde (103 seconde)
nL Nanolitre (10~9 litre)
mg Milligramme (10~3 gramme)
pmol Picomole (1012 mole)
Kj Constante de dissociation M Molaire (mole par litre) CV Coefficient de variation LY Lucifer Yellow
mM Millimolaire (103 mole par litre)
TEL Tris-HCL Tween 20, LiCl
APS 3-(Arninopropyl)triéthoxysilane FITC Fluorescéine isothiocyanate
TEOS Tétra-éthoxysilane
TEM Transmission Electronic Microscope (Microscope électronique à transmission) APTMS 3-(Ammopropyl)teimédioxysilane
THPC Chlorure de tétralds(hydroxyméthyI)phosphonium uM Micromolaire (10^ mole par litre)
mg Milligrarrune (103 gramme)
uL/min Microlitre à la minute us Microseconde (10"6 seconde)
Chapitre 1: Mise en contexte
Depuis le début des années 90, on retrouve de plus en plus l'expression anglophone « Lab On a Chip », ou « Laboratoire sur puce » en français, dans la littérature scientifique. Et pour cause! Ce créneau niultidisciplinaire rejoint autant l'analyse clinique et environnementale que le criblage pharmaceutique, en passant par la mécanique des fluides, la mise en œuvre des matériaux, la nanofabrication, la détection de traces, le séquençage de l'ADN et l'étude de cellules individuelles. L'engouement pour cette nouvelle science s'explique entre autres par la réussite de l'implantation d'un tel dispositif dans des milliers de foyers : le glucomètre. Il aide en effet chaque jour des milliers de personnes à gérer leur diabète de la maison. Cet appareil peu dispendieux tient dans le creux de la main. Il n'a besoin que d'une goutte de sang pour indiquer en moins de dix secondes le taux de sucre dans une matrice très complexe. La réponse est fiable et répétable, malgré le fait que l'opérateur ne soit pas expérimenté. De plus, l'appareil est indépendant au niveau électrique et peut être trimbalé n'importe où. Il limite également le recours aux experts : plus besoin de l'infirmière pour le prélèvement sanguin, plus besoin du biologiste pour séparer les différentes phases du sang et plus besoin du chimiste pour réaliser une longue et onéreuse analyse en chromatographic liquide haute performance.
Le glucomètre est certes une avancée technologique remarquable, mais les regards se tournent maintenant vers l'adaptation de ce concept vers d'autres types de détection biologique. Par exemple, un dispositif semblable pourrait un jour servir à diagnostiquer les cas de VIH ou de paludisme dans les régions isolées du globe. Pareillement, un tel appareil pourrait être utilisé pour des raisons de sécurité en ciblant directement à la sortie des avions les voyageurs porteurs de virus hautement contagieux. Dans un autre ordre d'idées, le médecin pourrait effectuer des tests bactériologiques directement dans son bureau, en présence du patient, plutôt que d'envoyer les prélèvements au laboratoire. Les avenues sont virtuellement inimitées et l'intérêt pour les laboratoires sur puce n'est donc pas près de s'essouffler.
L'explosion du champ provient surtout de l'essor de la microélectronique qui a poussé la miniaturisation de composants au début des années 90. Entre autres, l'amélioration de la photolithographie a permis de réaliser des systèmes très complexes avec une grande précision. L'avancement de la micro et de la nanofabrication a non seulement conduit à la diminution de
la taille des circuits électroniques, mais il a aussi ouvert la voie à la réduction de la taille des pièces optiques et mécaniques. Par exemple, il existe dans la littérature une multitude de concrétisations de laboratoires sur puce différentes de celle du glucomètre [1-10]. Ces appareils comprennent notamment des canaux microfluidiques, des micropompes, des thermocouples, des valves, des chambres de mélange et des électrodes qui sont ordonnés selon une géométrie particulière et qui gèrent l'arrivée des réactifs et les conditions de réaction. Non seulement l'intégration de toute ces technologies sur un même dispositif qui ne couvre que quelques centimètres carrés est compliquée, mais l'interfaçage avec le monde macroscopique l'est tout autant. Cependant, le jeu en vaut la chandelle, car les avantages des laboratoires sur puce sont nombreux dépendamment du domaine d'application.
Pour la synthèse de composés chimiques et de micro- et de nanomatériaux, les laboratoires sur puce sont notamment employés pour leur excellente capacité à contrôler le milieu réactionnel [11-16]. En effet, ils sont tout indiqués pour ce type d'application car le petit volume des réacteurs conduit à un excellent contrôle des conditions, tant stœchiométriques que thermiques, ce qui améliore les rendements. La synthèse en flasque traditionnelle ne régit pas aussi bien les concentrations locales de réactifs que la synthèse microfluidique et elle donne lieu à une plus grande dispersion de la taille des matériaux. Or, pour relier un effet de taille à une propriété physique du matériau, il va de soi qu'une bonne monodispersité est souhaitable. Le petit volume des réacteurs consomme aussi moins de solvants et moins de réactifs. Il y a donc une économie de coûts et une approche plus verte de la chimie. La caractérisation des produits peut aussi être directement intégrée au dispositif. Malgré tous ces avantages, la synthèse microfluidique ne crée toutefois qu'une infime quantité de matériau ou de composé chimique à la fois. Il faut donc s'armer de patience si on opte pour cette stratégie.
En biologie, les laboratoires sur puce sont surtout utilisés pour leur capacité d'automatisation des différentes étapes. Encore une fois, le petit volume des laboratoires sur puce est avantageux car la préparation de l'échantillon est grandement accélérée, la séparation des composants est très efficace et l'analyse est réalisée in situ. Le groupe de Pal et coll. ont su développer un dispositif qui accomplit le génotypage complet d'une souche d'influenza sur une superficie de 2,4 cm2 [17]. Leur dispositif comprend notamment un canal d'injection de
chaîne par polymerase (Polymerase Chain Reaction, PCR), une chambre de mélange isolée thermiquement du reste du dispositif ainsi qu'un canal d'électrophorèse qui effectue la séparation. Les bandes d'ADN sont ensuite détectées par fluorescence directement dans le canal électrophorétique. Le groupe de Mathies et colL ont aussi récemment développé des dispositifs intégrés de replication de l'ADN [18] et d'essais biomoléculaires automatisés [19]. D'autres groupes ont de plus utilisé les laboratoires sur puce pour effectuer de la détection multiplex d'ADN marqué [20], pour étudier sa mobilité [21] et pour mimer la communication neuronale [22].
Le volume restreint des laboratoires sur puces est certes profitable au niveau de l'automatisation, de la synthèse et de la séparation des espèces, mais la diminution des volumes entraîne son lot de complications au niveau analytique. En effet, la faible quantité d'analyte présente dans un canal microfluidique stimule le recours à des techniques d'analyse ultra-sensibles pour la caractérisation et la quantification in situ. La fluorescence devient alors un outil d'analyse intéressant. Non seulement cette technique ouvre la porte à la ségrégation sélective des chromophores basée sur leur spectre d'émission et d'excitation, mais elle démontre généralement une grande sensibilité. En effet, l'intensité du signal produit est directement proportionnelle à l'intensité de la source d'excitation. La sensibilité de la technique est même améliorée lorsque le volume de détection est réduit [23-26]. La fluorescence d'une molécule n'est aucunement dépendante du volume sondé. Or, 1 e signal de fond, généré notamment par les impuretés présentes dans l'échantillon, par la diffusion de Rayleigh et par la diffusion Raman, augmente proportionnellement au volume sondé. Ainsi, en ciiminuant le volume d'analyse, on tend à améliorer la puissance du signal analytique par rapport à la puissance du signal de fond. Du même coup, on augmente la probabilité de détection des fluorophores présents en faible quantité.
La diminution de la dimension des canaux microfluidiques est une bonne façon de réduire davantage le volume d'analyse. Néanmoins, des canaux trop étroits se bouchent fréquemment, l'analyte adsorbe facilement aux parois et la diffusion de ces dernières vient contaminer le signal de florescence [23]. Une autre approche pour diminuer le volume de détection consiste à employer la microscopie confocale, qui limite le volume sondé à quelques femtolitres (1015 L).
volume de détection lorsqu'on souhaite détecter efficacement l'ensemble des particules d'intérêt [27-29].
Pour palier à ces contraintes, une approche originale a été suggérée par un groupe de chercheurs à Los Alamos au milieu des années 80 [30-32]. Ce que Keller et coll. proposent est d'adapter le concept de cytomètre à flux, développé initialement pour la biologie, à la microfluidique. L'idée est de concentrer l'analyte au centre du canal d'analyse à l'aide de flots colinéaires, de part et d'autre du flot analyte. Ceux-ci viennent contreindre l'analyte à circuler uniquement au centre du canal. De cette façon, on évite d'avoir à construire des canaux nanofluidiques pour climinuer le volume d'analyse. On limite aussi la diffusion de la lumière par les parois qui peuvent désormais être éloignées de la zone d'intérêt et on oblige tout l'échantillon à traverser le volume de détection. Cette stratégie trouve le nom de focus hydrodynamique et en la couplant à la microscopie confocale, on améliore grandement la probabilité de détection d'espèces fluorescentes dans les systèmes microfluidiques.
Dans notre laboratoire, plusieurs personnes travaillent à développer de nouvelles nanosondes suprafluorescentes de type cœur-coquille. Nous croyons que la combinaison de l'analyse microfluidique en focus hydrodynamique et de la microscopie confocale de fluorescence induite par un laser nous permettra d'étudier les systèmes de nanoparticules multicouches développés à l'interne. Les objectifs du projet sont donc de cibler la configuration microfluidique optimale pour le focus hydrodynamique, de construire un montage confocal de détection optique en épifluorescence, de caractériser le système établi et de démontrer son potentiel pour l'étude de nanoparticules suprafluorescentes.
Chapitre 2: Principes théoriques
2.1 Initiation à l'écoulement microfluidique
La mécanique des fluides est une discipline large qui implique plusieurs phénomènes physiques. La compréhension de ces phénomènes, à l'aide de modèles mathématiques, permet de prédire le comportement des liquides et des gaz et d'en tirer parti. L'écoulement de fluides dans les conduites macroscopiques est bien documenté et plusieurs applications modernes en découlent, comme le déplacement de l'eau potable dans les canalisations municipales. Sous un autre angle, la compréhension du déplacement microfluidique est tout aussi essentielle. Par exemple, il peut s'avérer utile de connaître la façon dont le sang est acheminé aux cellules via les capillaires sanguins. À cette échelle, les phénomènes physiques ne sont pas régis par les mêmes forces et il est important de connaître les caractéristiques du régime microfluidique afin d'en saisir les enjeux.
2.1.1 Le nombre de Reynolds
Le nombre de Reynolds (Re) est un nombre sans dimension qui représente le ratio des forces d'inertie et des forces de viscosité pour un fluide soumis à des conditions bien établies [1, 33, 34]. Le nombre de Reynolds est défini comme :
Re = ^ (2.1)
où V est la vitesse linéaire du liquide, / est le diamètre du canal où se déplace le liquide, p e t t ] représentent respectivement la densité et la viscosité du liquide. Dans un système microfluidique typique, la vitesse linéaire est de l'ordre de 1 cm/s et le diamètre du canal mesure 100 pm ou moins. Par ailleurs, si l'eau est le liquide employé, la densité est d'environ 1 000 kg/m3 et la viscosité est de 103 Pa s. En remplaçant ces valeurs dans l'équation 2.1, on
obtient un nombre de Reynolds << 1. Dans ce régime, le flot est dit être dans un régime laminaire, c'est-à-dire que tout le liquide se déplace de façon concertée et qu'il n'y a aucune turbulence. En effet, la petite dimension du canal fait en sortes que la masse de liquide qui se déplace est faible et que l'inertie est minime par rapport à la force générée par la viscosité. Par
conséquent, les forces d'inertie peuvent être négligées. À titre comparatif, le mélange du lait dans le café est un régime macrofluidique dominé principalement par la turbulence et aura un Re > 2000.
2.1.2 L'équation de Navier-Stokes simplifiée
L'équation de base qui gouverne la dynamique des liquides incompressibles est l'équation de Navier-Stokes, équation 2.2 [33-35]. Cette formule mathématique plutôt ardue n'est en fait qu'une version modifiée de la Loi de Newton (F=ma) pour les liquides, où P est la pression appliquée.
f
+
(W)v
= - V P + 77V2v (2.2)Le terme de gauche évoque la masse par unité de volume (p) multipliée par l'accélération, soit le gradient de vitesse (v). Le terme de droite décrit quant à lui les forces par unité de volume attribuables aux gradients de pression (P) et de vitesse (v) selon la viscosité du liquide (r/). Comme énoncé à la section 2.1.1, en milieu microfluidique, l'inertie peut être négligée. Il est donc possible d'ignorer le terme de gauche de l'équation 2.2 et de réduire ainsi l'équation de Navier-Stokes à l'équation de Stokes :
V P = TJV2V (2.3)
Toute cette gymnastique mathématique ne sert en fait qu'à démontrer qu'à l'échelle microfluidique, la vitesse du liquide est uniquement fonction de sa viscosité et de la pression à laquelle il est soumis (équation 2.3). En éliminant la dérivée selon le temps, pour de faibles nombre de Reynolds, il est désormais possible de qualifier le mouvement du liquide de « symétrique » dans le temps [33]. C'est-à-dire que si la direction de la force appliquée est inversée, alors le mouvement du liquide sera complètement inversé lui aussi. Le liquide retrouvera la position qu'il avait quelques instants auparavant dans le canal, sans turbulence et sans mélange chaotique. Or, pour des liquides se déplaçant en régime turbulent, il est virtuellement impossible de retrouver l'état original. Cette caractéristique est unique aux
liquides soumis au régime laminaire et peut être exploitée dans la conception de systèmes microfluidiques.
2.1.3 Le flot de Poiseuille
L'écoulement laminaire d'un liquide dans un canal est connu sous le nom de flot de Poiseuille. Ce type de circulation de liquide est typique des systèmes actionnés par la pression plutôt que par l'écoulement électro-osmotique. Il est caractérisé par une vitesse maximale du liquide au centre du canal et une vitesse nulle aux abords des parois. Cette condition s'explique par le fait que le liquide sur les parois subit une force de friction opposée au flot. Autrement dit, la vitesse est maximale au centre et décroît radialement jusqu'à la paroi tel qu'illustré à la Figure 2.1 [36].
Figure 2.1 : Profil parabolique de la vitesse d'un liquide en mouvement dans un canal
Cette distribution radiale de la vitesse provoque la dispersion hydrodynamique d'un traceur lors de son déplacement tout au long du canal [1, 33, 34]. En effet, si un traceur est placé en tête du canal et que la pression est nulle, la seule dispersion que subira le traceur est la diffusion moléculaire. Toutefois, si la pression est augmentée soudainement et que le liquide commence à s'écouler dans le canal, les molécules du centre fileront vers la sortie alors que les molécules près des parois seront grandement ralenties. On assistera donc à une dilution de la concentration locale du traceur alors qu'il s'étalera dans le canal. Ce phénomène, connu aussi sous le nom de dispersion de Taylor, n'est évidemment pas souhaitable lors d'analyse dans des systèmes intégrés. On a par contre avantage à réduire la dimension des canaux, puisque la couche de molécules qui subit de la friction près des parois rejoint plus rapidement le centre du canal. Ainsi, on limite l'effet de la dispersion hydrodynamique et les molécules de traceur restent davantage regroupées.
Dans un autre registre, le flot de Poiseuille a des répercussions sur le déplacement de particules circulant dans un canal. Par exemple, des particules sphériques dans un canal où circule un liquide seront soumises à une force nette dans la direction du flot [35]. En effet, la surface de la particule subira la friction générée par la viscosité et par la pression du liquide l'entourant. Or, comme mentionné dans la section 2.1.1, les effets de l'inertie peuvent être négligés à bas nombre de Reynolds. Dans ce cas, la force nette appliquée sur un objet en mouvement dans un liquide est seulement fonction de sa taille et de la vitesse linéaire du liquide en amont de l'objet. Donc, plus le liquide se déplace rapidement dans le canal, plus il entraînera un déplacement rapide chez une particule pouvant y circuler. D'ailleurs, il n'y aura pas de traînée turbulente en aval de l'objet. Maintenant, à cause du flot de Poiseuille illustré à la Figure 2.1, une particule circulant au centre du canal se déplacera à plus haute vitesse qu'une particule aux abords des parois. La distribution de vitesse des particules se déplaçant dans un canal est donc très étendue.
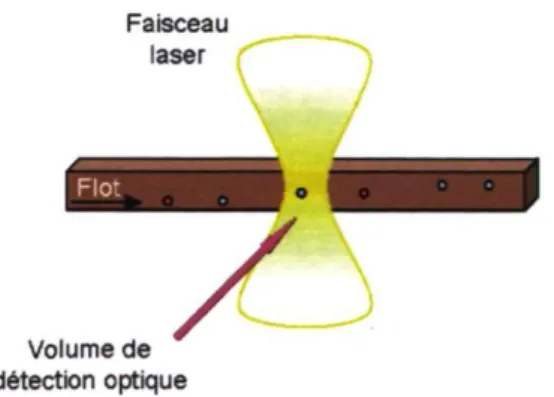
La vitesse des particules dans un canal microfluidique est importante à considérer lorsqu'on analyse une population de particules fluorescentes comme à la Figure 2.2 [37]. Avec cette approche, il est possible de compter les particules qui traversent une région d'intérêt, comme par exemple le volume éclairé par un faisceau laser orienté perpendiculairement au canal microfluidique. Les particules fluorescentes y sont alors excitées et émettent des photons en fonction de la signature spectrale qui leur est propre. L'émission est collectée en épifluorescence et en la filtrant, on peut déterminer la concentration de différentes espèces présentes dans un même échantillon.
Faisceau laser
Volume de détection optique
L'intensité de la fluorescence sera fonction du temps de résidence de l'analyte dans le parcours optique. Par exemple, une particule se déplaçant au centre du canal traversera le faisceau laser plus rapidement qu'une particule longeant une paroi La vitesse réduite de la particule longeant une paroi lui permettra de demeurer plu s longtemps dans le volume sondé et de su bir davantage de cycles d'excitation/émission. Durant cette période, il y aura donc plus de photons émis par cette particule et ils seront répartis sur une plus longue période de temps. En revanche, dans la configuration présentée à la Figure 2.2, le faisceau laser est focalisé. Comme il sera traité à la section 2.4.1, la densité de puissance est par conséquent plus grande au centre du canal où les billes circulent plus rapidement. Il est donc possible qu'une particule au centre soit éclairée plus efficacement et émette une fluorescence plus intense, sur une plus courte période de temps.
2.1.5 Le nombre de Péclet
Le nombre de Péclet (Pe) est une façon d'exprimer le ratio des mouvements attribuables à la convection par rapport à ceux provenant simplement de la diffusion [34, 38]. Le transport des particules ou des molécules via un mécanisme de diffusion est un processus beaucoup plus lent que le transport via convection du flot de Poiseuille. Ainsi, pour une longueur de canal donnée, une particule longeant une paroi dont l'entraînement par convection est réduit, aura davantage le loisir de diffuser qu'une particule qui se déplace au centre. Le nombre de Péclet est définit ci-dessous.
Pe = — (2.4)
D v
Dans cette relation, D est le coefficient de diffusion de l'espèce. Une autre façon d'interpréter cette relation est qu'à grande vitesse, une particule au centre parcourra une longue distance dans le canal avant de rejoindre la paroi par diffusion. Par exemple, une petite protéine (D — 40 um2/s) circulant dans un canal de 100 um à une vitesse de 100 um/s parcourra
linéairement 250 fois la largeur du canal avant de diffuser jusqu'à la paroi, soit 2,5 cm ou 4 min. Ainsi, pour un canal large et une haute vitesse linéaire, le nombre de Péclet sera très élevé, indiquant une forte dominance du mouvement de convection par rapport au mouvement de diffusion de la particule.
2.2 Description du focus hydrodynamique
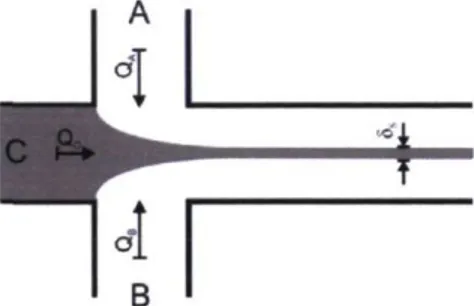
L'idée principale derrière le focus hydrodynamique est de forcer tout l'analyte à traverser le volume sondé pour faire de l'analyse dite « absolue ». Tout l'échantillon est interrogé et on peut ainsi définir le nombre exact de particules ou de molécules d'intérêt que contient l'échantillon, le tout par un processus non-destructif. Pour créer un focus hydrodynamique, il s'agit d'utiliser une configuration microfluidique dans laquelle les canaux forment une intersection d'au moins 3 entrées de liquides ainsi qu'une voie de sortie. Par exemple, dans une configuration en forme de croix, l'analyte s'écoule dans une des branches. En rejoignant l'intersection, le flot analyte est bordé par les deux branches adjacentes dans lesquelles s'écoule aussi un liquide. L'analyte est donc contraint à s'écouler au centre du canal de sortie. La Figure 2.3 schématise cette situation, où A et B représentent la « gaine » et C l'analyte [38].
A
1
m
4
B
Figure 2.3 : Formation d'un focus hydrodynamique dans une configuration en croix
À l'intersection, tout le liquide est dirigé dans le canal de sortie. Puisque tout ce liquide crée une augmentation de pression, il accélère dans la sortie jusqu'à ce que le flot de Poiseuille se soit complètement développé. Il est important de mentionner que pour obtenir un focus étroit et efficace, la superficie de la tranche du canal de sortie doit être inférieure à la somme des superficies des trois autres canaux qui s'y engagent. Aussi, le choix du liquide composant la gaine se fera selon l'application désirée. Dans la plupart des cas, la gaine est inerte, de viscosité similaire et ne réagit pas chimiquement avec l'analyte. Wu et coll. ont étudié l'effet de la différence de viscosité entre le flot analyte et la gaine [39]. Leurs résultats démontrent qu'il existe bel et bien une différence de vitesse dans le canal de sortie entre le flot analyte et la gaine lorsque ceux-ci n'ont pas la même viscosité (eau/glycérol). En effet, il existe à l'interface entre la gaine et le liquide une zone de cisaillement où un gradient de vitesse permet de passer d'une zone de haute viscosité (faible vitesse) à une zone de faible viscosité (haute vitesse).
2.2.1 Largeur du focus hydrodynamique
Il est intuitif de penser qu'en appliquant un plus fort débit, ou une plus forte pression, dans le canal analyte, celui-ci augmentera sa largeur dans le canal de sortie. De même, en appliquant une gaine plus forte, la largeur du flot analyte dans la voie de sortie sera diminuée. Or, la largeur du flot analyte dans le canal de sortie est indépendante du débit de l'analyte ou du débit de la gaine. C'est plutôt le ratio de ces pressions qui dictera la largeur du flot analyte [38, 40, 41]. Ce ratio est défini par le paramètre a et est décrit à l'équation 2.5. Pour obtenir un focus hydrodynamique stable, le ratio des pressions doit être maintenu à l'intérieur des balises ami, et ttmax- En effet, un grand ratio indique que la gaine est dominante par rapport à l'analyte. Dans ce cas, la largeur du flot analyte dans le canal de sortie est minimale. Par contre, si la gaine est trop forte par rapport à l'analyte, la gaine s'engagera dans le canal analyte et on assistera à une inversion complète de la direction du flot tel que décrit par l'équation de Stokes (2.3). Le ratio maximum que peut soutenir la configuration microfluidique se définit comme Omax- À l'inverse, dans le cas où le ratio a est faible, le flot analyte dans la voie de sortie sera plus large. Encore, si la pression de l'analyte est très grande par rapport à la pression de la gaine, l'analyte se propagera dans les branches de la gaine. Dans cette situation, la jcimite du système est définit comme cimin.
« = -£*=- (2.5)
analyte
a <a<a (2.6)
min "* *"* — '"max \ /
La largeur du flot analyte dans la sortie n'est donc pas régie par le débit de l'une ou l'autre des branches de l'intersection, mais plutôt par leur force relative l'une par rapport à l'autre. Certes, les débits des liquides influenceront la vitesse linéaire totale dans la sortie, mais pas le profil du focus. Par exemple, pour une même conception microfluidique, on peut obtenir une même largeur de focus à une vitesse totale de 10 mm/s ou de 100 mm/s, si le ratio des pressions demeure constant. De Mello et coll. ont fait une analyse approfondie du comportement du focus hydrodynamique et ont établi la relation entre la largeur analyte (um) et le ratio a des débits pour différents débits de la gaine [40]. Leurs résultats sont présentés à la Figure 2.4.
I
75 10 c ro <U ro . ♦ » T f ^ _ " » — Débit gaine: »"V
H • 7 ul/min* H
A 5 il/min Av*
▼ 3 ul/minV
♦ 1 ul/min2
, • ■ • Paramètres correspondants: i p = 0.61 <r = 0.18 I I I I I I r = 3.5 . . . t 0.01 0 1Ratioa(P Ine/Panal )
Figure 2.4 : Variation de la largeur du focus selon le ratio des débits gaine/analyte [40]
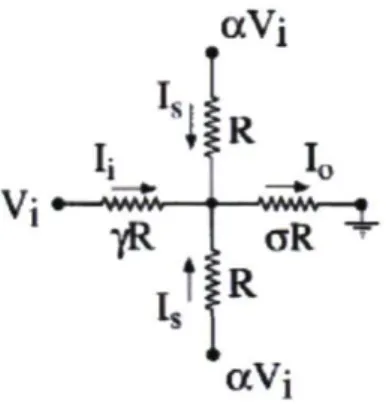
Comme on l'observe à la Figure 2.4, la largeur analyte diminue avec l'augmentation du ratio a, mais il est aussi important de mentionner que la relation n'est pas linéaire. Les résultats de cette étude rejoignent le point de vue présenté par Knight et coll. En effet, la largeur de l'analyte dans le canal de sortie est fonction du ratio des débits, mais elle est aussi intimement liée à la géométrie des canaux microfluidiques. Dans leur étude, Knight et coll. font une analogie intéressante en comparant le concept de focus hydrodynamique à un circuit électrique [41]. La relation entre la pression et le flot de liquide est l'analogue hydrodynamique de la Loi d'Ohm pour laquelle la résistance R peut être comparée à la restriction générée par la dimension des canaux. Dans cette approche, l'analyte est poussé par un voltage Vi et la gaine par un voltage aVj, où a est un facteur multiplicatif pour exprimer le ratio entre les différents potentiels. La mise à la terre se trouve au bout du canal de sortie. La résistance de la gaine, de l'analyte et de la sortie sont respectivement R, yR et aR. Les paramètres y et o ne reflètent en fait que la géométrie des canaux en indiquant la restriction selon leur largeur. Le débit est quant à lui associé au courant, I, circulant dans le circuit. La Figure 2.5 démontre la configuration électrique.
k
laVi
!Si Y j ■ VAVA \-R
Io
W * M r-oR
R
aVj
Figure 2.5 : Comparaison d'un focus hydrodynamique à un circuit électrique
Le ratio des potentiels, ou pressions, appliqués sur le système correspond à a comme dans l'équation 2.5. Les valeurs limitantes pour ce ratio, telles que décrites à l'équation 2.6, peuvent être établies à partir de la Loi d'Ohm et des « résistances » de chaque branche comme le démontre les équations 2.7 et 2.8.
cc^=tTl(a + Y) (2-7)
aw a= ( l + 2tj)l2c7 (2.8)
Lorsque les résultats présentés à la Figure 2.4 sont analysés avec une loi des moindres carrés, on peut établir la relation mathématique qui lie la géométrie microfluidique et le ratio des débits à la largeur du flot analyte dans le canal de sortie. Avec cette relation, il est possible de prédire le ratio de débit qu'il faudra employer pour obtenir une largeur analyte souhaitée, pour un système donné. Cette relation est présentée ci-dessous.
nl + 2 c 7 - 2 a a
a
>f=
(°cP—r-L 2.9)
1 + 2 0 7 a
Dans cette équation, a>f est la largeur du focus obtenu, coc représente la largeur du canal de
sortie et /?, y et a définissent les paramètres géométriques de la configuration microfluidique. Il est important de souligner que cette relation ne tient la route que pour les systèmes de focus hydrodynamique dont les canaux ont des tranches rectangulaires. Cette équation permet de guider le concepteur de systèmes dans la réalisation de configurations devant atteindre des
largeurs de focus préétablies. En augmentant y, soit la restriction du canal analyte, on peut diminuer la taille du focus créé. Aussi, en élargissant le canal de sortie, coc, on peut augmenter
la largeur du focus.
2.2.2 Comportement du focus hydrodynamique en trois dimensions
Malgré le fait que les canaux microfluidiques soient très minces, le profil de vitesse mérite d'être considéré en trois dimensions. Lorsque les deux flots de gaine interceptent le flot analyte, la pression locale augmente grandement et le liquide accélère vers la sortie. Néanmoins, si on observe le canal de sortie par le bout, on remarque que le flot central n'a pas la forme d'une bande rectangulaire, mais bien de deux « c » dos à dos. Domagalski et coll. ont pu capter des images de la tranche du canal de sortie en microscopie laser confocale à balayage (Confocal Laser Scanning Microscopy, CLSM) et elles sont présentées à la Figure 2.6 [38]. En a), le liquide s'écoule selon l'axe X. Le focus hydrodynamique est symétrique et on remarque un élargissement du focus en Z près des parois. Cet effet est attribuable à la diffusion qui se manifeste à basse vitesse linéaire. En effet, le flot possède deux régions distinctes : le centre dominé par la convection et les abords des parois dominés par une zone de diffusion où la vitesse est faible. Il y a donc une distribution locale du nombre de Péclet en fonction du profil de vitesse du liquide (voir section 2.1.5).
b)
P = = ^
Figure 2.6 : Représentation CLSM de la vue en coupe du canal de sortie du focus hydrodynamique; a) focus symétrique; b) focus non-symétrique (ratio 8 pour 1) [38]
De plus, il est important de comprendre qu'avant d'entrer dans l'intersection, les deux flots de gaine ont aussi chacun un profil de vitesse unique selon la description de Poiseuille. Si les débits de gaine ne sont pas égaux de chaque côté du flot analyte, comme en b) sur la Figure 2.6, on assistera non seulement à une décentralisation du focus, mais aussi à une courbure du flot central provoquée par la vitesse centrale du liquide qui pousse le plus fort.
Afin de limiter l'effet de la diffusion près des parois et de concentrer davantage les particules au centre du canal d'analyse, plusieurs auteurs se sont lancés dans la conception de systèmes pouvant réaliser un focus hydrodynamique en trois dimensions plutôt que deux, comme présenté jusqu'ici [42-45]. Dans la Figure 2.6, le focus est effectué dans l'axe Y. Le but de ces nouvelles conceptions est toujours de focaliser l'analyte en Y, mais d'ajouter aussi une focalisation en Z. Pour y arriver, les auteurs emploient généralement l'addition d'un canal placé orthogonalement au plan X-Y pour acculer le flot analyte sur la paroi opposée. Ce nouveau canal de gaine peut être placé en aval ou en amont du focus hydrodynamique 2D. Une autre stratégie fait usage de deux intersections de focus hydrodynamique placées à 90° l'une de l'autre. Il est aussi possible de combiner de façon séquentielle ces stratégies afin d'obtenir un focus optimal. Une approche qui mérite mention est celle employée par Mao et coll. [45], qui proposent une configuration microfluidique plutôt élégante. Le canal analyte où circulent les particules a une tranche rectangulaire de largeur co, mais se propage selon une courbe qui possède un très grand rayon de courbure, r. Avec cette géométrie, où r » c o , il y a développement d'un deuxième écoulement, le flot de Dean. En empruntant la courbe, les particules sont attirées vers l'extérieur du virage par la force centrifuge. Elles ont donc tendance à s'aligner au centre, sur la largeur du canal, plutôt que de demeurer dans une distribution aléatoire près du « plancher » et du « plafond ». Une fois ce premier alignement établi, l'intersection classique en croix permet de focaliser par le côté les particules dans l'autre axe.
2.2.3 Applications du focus hydrodynamique dans littérature scientifique
Dans la littérature scientifique, on retrouve certes beaucoup d'articles traitant de la physique des fluides impliqués dans le focus hydrodynamique. Or, on peut aussi dénicher quelques exemples d'applications originales qui mettent cette technique à l'avant plan. Certains l'utilisent
pour synthétiser avec précision des nanomatériaux inorganiques [46-50], alors que d'autres l'utilisent comme outil d'analyse en biologie [51-54].
a) Synthèse et caractérisation de nanomatériaux
Chan et colL ont développé une approche qui permet de synthétiser des nanocristaux de séléniure de cadmium (CdSe) de taille variable [46]. Leur configuration microfluidique utilise une jonction en croix dont le canal de sortie est modifié. Le canal analyte contient les précurseurs de Cd et de Se et la gaine est composée de polyéther perfluoré (PFPE). Une marche dans la sortie permet d'augmenter soudainement le volume du canal et de diminuer la vitesse linéaire du liquide. La compétition entre les forces de viscosité et la tension de surface permet alors de former des gouttes qui sont en fait des piscines réactionnelles pour la formation des nanocristaux. Un thermocouple placé à la sortie permet de chauffer les réactifs jusqu'à 300°C. Selon les ratios de débits employés, la taille des chambres réactionnelles et le temps de résidence dans la zone de chauffage varieront et influenceront la taille des cristaux. De plus, la température modulable agit aussi sur la dimension des matériaux formés. La taille des nanocristaux est évaluée in situ à partir du déplacement spectral du maximum d'émission de fluorescence. La gaine en PFPE a surtout été choisie pour sa viscosité élevée et pour son haut point d'ébuUition qui permet de chauffer le système à très haute température sans créer de surpression dans le réseau microfluidique.
Schabas et coll. ont quant à eux mis au point une méthode d'analyse de points quantiques (PQ) de sulfure de cadmium (CdS), qui sont plus volumineux que les nanocristaux présentés par Chan [47]. Dans leur approche, les auteurs tirent profit de la zone de cisaillement à l'interface de la gaine et du canal central pour créer l'auto-assemblage des PQ rendus hydrophobes par une monocouche de polystyrène (PS). En effet, le flot central contient du copolymère bloc polystyrène-polyacrylique (PS-PA) et des PQ qui sont maintenus en suspension dans du d^méthylformamide (DMF). La gaine contient aussi du DMF et des proportions variables d'eau. Lors de la jonction du focus hydrodynamique, il y a mélange des phases à l'interface des liquides, dans la zone de cisaillement. Lorsque la concentration en eau dans cette zone atteint 2 % massique, on assiste à la formation de micelles où les PQ hydrophobes sont entourés PS-PA. Ceci a pour effet d'augmenter la diffusion locale et le signal de fluorescence conséquent.
Aussi, les auteurs ont remarqué un gradient de miscibilité dépendant de la teneur en eau de la gaine. En effet, puisque les PQ sont hydrophobes, ils se concentrent au centre du canal de sortie lorsque la gaine possède une grande proportion d'eau.
Dans un autre ordre d'idées, le groupe de Nie et coll. ont su déployer une stratégie de synthèse de particules de polymère de type cœur-coquille qui pourraient, par exemple, servir d'agents encapsulant pour l'industrie du médicament [48, 49]. Dans cette approche, les auteurs exploitent l'amont de la croix de focus hydrodynamique pour mettre en œuvre leurs particules. Il s'agit de faire s'écouler trois flots co-linéaires dans le canal analyte avant qu'ils ne rencontrent la gaine. Le liquide au centre est une huile de silicone. Dans chaque côté, le liquide est une solution composée d'un photoinitiateur et de deux monomères, le tripropylène glycol diacrylate (TPGDA) et le ethylene glycol diméthacrylate (EGDMA). Tous ces liquides s'écoulent parallèlement avant d'être conscrits par la gaine aqueuse. Encore une fois, une augmentation soudaine du volume du canal de sortie permet de former des gouttelettes, dont le cœur est rempli d'huile de silicone et dont la coquille est une solution de polymère. Cette coquille est photopolymérisée plus loin dans le canal de sortie à l'aide d'une source lumineuse. Selon le régime de débits employés, il est même possible de réaliser des particules multi-cœurs.
b) Outil d'analyse biologique
Yang et coll. ont utilisé le focus hydrodynamique non pas dans une optique de synthèse, mais bien de comptage de particules d'intérêt biologique [51]. Plutôt que d'utiliser une cartouche microfluidique plane pour compter leurs particules, les auteurs ont décidé d'utiliser un canal qui est en fait un capillaire de forme carrée. Dans ce capillaire où circule la gaine, un autre capillaire, plus petit, est immergé et libère les particules. Cette configuration est similaire à celle employée dans les cytomètres commerciaux. Au lieu d'utiliser l'épifluorescence comme sur la Figure 2.2 pour collecter les photons émis, la détection s'effectue à 90°. Ainsi, il est possible de compter des bactéries E. coli ER2738 qui ont été marquées au préalable avec un fluorophore, le SYTOX. Les auteurs sont aussi en mesure de compter des nanoparticules d'oxyde de zinc (ZnO^ fluorescentes. En effet, ces particules sont dopées avec un excellent agent thérapeutique pour le traitement du cancer, le doxorubicin, qui démontre toutefois un effet cytotoxique sur les muscles cardiaques à haute concentration. Cet agent est utilisé car il
possède des propriétés de fluorescence compatibles avec le montage optique des auteurs. Cette application montre l'intérêt d'utiliser le focus hydrodynamique pour caractériser des véhicules de relargage ciblé de médicament.
Le groupe de Dittrich et coll. ont quant à eux appliqué le focus hydrodynamique à la séparation de cellules marquées [52]. Ils utilisent la partie étroite du focus pour aligner des cellules et déterminer à quel groupe chacune appartient selon son spectre d'émission. En aval de la jonction, un canal perpendiculaire au canal de sortie contient un liquide s'écoulant avec une force électro-osmotique. En jouant sur la polarité des électrodes qui induisent la circulation dans ce canal, on peut attirer les cellules, selon leur polarité, dans l'une au l'autre des voies de sortie proposées. La polarité des électrodes peut directement être associée au spectre de fluorescence. On assiste donc à une ségrégation efficace des cellules en temps réel.
En voulant imiter la microcirculation pour étudier les globules rouges, le groupe de Moehlenbrock et coll. a été capable de relier la déformation de ces cellules au relargage accru d'adénosine triphosphate (ATP) [53]. En effet, en augmentant la pression de la gaine sur le flot central de cellules, une déformation induite dans la structure des globules permet de libérer davantage d'ATP dans le canal de sortie. Pour mesurer la teneur en ATP, les auteurs ont utilisé la chiniiluminescence produite par la réaction avec la luciférine/luciférase qui est contenue dans la gaine.
2.3 Amélioration de la probabilité de détection optique
Comme mentionné précédemment, le défi de la détection de la fluorescence dans les laboratoires sur puce est la petite quantité d'analyte présente dans le volume sondé, c'est-à-dire la nécessité de déceler un faible niveau de fluorescence parmi un signal de fond relativement élevé. De plus, une embûche supplémentaire est rencontrée si les fluctuations sur le signal de fond, soit le bruit (a^, sont de grande amplitude. Il faut donc choisir judicieusement le seuil de détection qui permettra de discriminer un événement de fluorescence, comme le passage d'une particule dans le volume sondé, du signal de fond provenant de la matrice. La Figure 2.7, tirée de Barnes et colL, montre bien l'enjeu qui compromet la probabilité de détection dans le cas où le signal de fluorescence est faible [55].
Signal de fond — Bruit Seuil détection
Fluorescence
Intensité relative / o.
Figure 2.7 : Distribution du signal de fond et de la fluorescence selon le bruit [55]
Le bruit correspond à l'écart type sur le signal de fond et présente une distribution gaussienne de part et d'autre du signal moyen. Normalement, en fixant le seuil de détection à trois fois l'écart type (3 ab), plus de 99 % du signal de fond sera discriminé [56]. Par conséquent, un
signal ayant une intensité supérieure à ce seuil pourra fort probablement être attribué à de la fluorescence. Cependant, la probabilité de détecter à tort des événements de fluorescence est grande, comme le montre le chevauchement en vert foncé sur la Figure 2.7. En augmentant le seuil de détection à cinq ou six fois le bruit (5-6 O,,), on réduit certes la probabilité de reconnaître de faux positifs, mais on diminue du même coup la sensibilité de détection en élùninant arbitrairement des événements de fluorescence. La situation idéale est donc d'avoir une petite fluctuation du signal de fond et d'augmenter la différence d'intensité entre la fluorescence et le signal de fond.
Pour atteindre ces objectifs, il ne s'agit pas seulement d'augmenter le signal de fluorescence, car il est relativement facile d'établir les conditions optimales propres à un chromophore, notamment le choix de la source d'excitation et des filtres spectraux requis devant le détecteur. Il s'agit plutôt de diminuer le signal de fond afin d'obtenir un contraste suffisant. En effet, l'intensité de la fluorescence d'une molécule ou d'une particule est indépendante du volume sondé. Au contraire, le signal de fond provenant de la fluorescence des impuretés, de la diffusion de Rayleigh et de la diffusion de Raman augmente proportionnellement avec le
volume sondé. Par conséquent, on a avantage à réduire la taille du volume analysé pour améliorer le rapport du signal de l'analyte sur le signal de fond. Par ailleurs, le bruit ne peut être complètement éliminé car il provient notamment des fluctuations inévitables de la source et de l'électronique du détecteur, quoique, dans ce dernier cas, des modules de qualité qui limitent ces fluctuations sont disponibles sur le marché. Pour tenter de maximiser la probabilité de détection, plusieurs paramètres peuvent être optimisés.
2.3.1 Augmentation du signal analytique
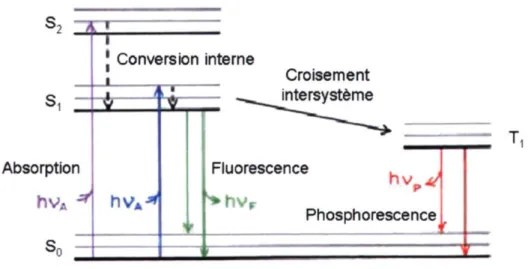
La Figure 2.8 présente le diagramme de Jablonski qui décrit les transitions électroniques typiques encourues pendant le processus de fluorescence [29]. Les électrons sont d'abord promus à l'état excité, Si ou 1S2, suite à l'absorption d'un ou de plusieurs photons. Par la suite, la désactivation de l'état excité peut se faire par voie radiative ou non-radiative. Dans le cas de la fluorescence, la désactivation de l'état excité se produit en premier lieu par la relaxation vibrationnelle du niveau excité. Les électrons qui auront été promus à l'état 1S2 subiront de plus de la conversion interne, un processus non-radiatif qui permet d'atteindre le niveau de plus basse énergie Si, d'où sera émise la fluorescence. La transition électronique vers le niveau So produira les photons de fluorescence. Cependant, ceux-ci sont de plus basse énergie que les photons absorbés au départ. Le résultat se traduit par un déplacement spectral de la longueur d'onde vers le rouge. Cet effet caractérise la fluorescence et est appelé déplacement de Stokes.
s2 ZK Absorption Conversion interne
hv*-**
Croisement intersystème Fluorescence Phosphorescence T,Une autre voie de désactivation radiative est le phénomène de la phosphorescence. Une fois à l'état Si, une molécule est susceptible de subir une inversion de spin qui la conduira à l'état triplet T\. Cette transition se nomme le croisement intersystème. Dans cette configuration, la molécule, en retournant à l'état fondamental, peut émettre des photons qui seront de plus basse énergie que la fluorescence. Cependant, puisque la transition vers So est une transition peu favorisée, le rendement de la phosphorescence est généralement plus faible que celui de la fluorescence.
Tous les photons absorbés ne donnent pas lieu à un phénomène radiatif. En effet, plusieurs causes peuvent inhiber l'émission de photons d'une molécule excitée. Le milieu dans lequel se trouve le fluorophore influence grandement l'intensité de la fluorescence. Par exemple, une collision avec une autre molécule, telle une molécule de solvant, peut conduire à un transfert d'énergie qui permettra à la molécule de retourner à l'état fondamental sans émission de lumière. La viscosité du milieu joue un rôle important. En limitant certains mouvements moléculaires, un solvant très visqueux peut par exemple prévenir l'extinction collisionnelle. La force ionique, le pH et la température influencent tout autant l'intensité de la fluorescence. Les réactions chimiques se produisant à l'état excité, les réarrangements moléculaires ainsi que la photodégradation sont aussi des processus qui peuvent inhiber la fluorescence.
Les paramètres qui font en sorte qu'une molécule est un bon fluorophore sont entre autre la facilité avec laquelle la molécule absorbe les photons incidents, soit l'efficacité d'absorption, et le taux de photons émis par rapport à ceux qui auront été absorbés, soit le rendement quantique, Of. Ce dernier est en quelque sorte l'indicateur du nombre de photons qui empruntent la voie de désactivation radiative. L'efficacité d'absorption et le rendement quantique sont deux caractéristiques propres à chaque structure moléculaire. Il est donc difficile de les modifier pour optimiser le signal de fluorescence. En revanche, il est possible de jouer sur le milieu d'analyse, sur les conditions spectrales et sur la puissance d'excitation. D'abord, la source lumineuse doit recouvrir adéquatement le spectre d'excitation du fluorophore. De plus, elle doit être suffisamment intense pour permettre à chaque fluorophore se trouvant à l'état So de monter aussitôt aux états excités. Cette condition s'appelle la saturation optique et elle est rencontrée lorsque le taux d'excitation est équivalent au taux de désactivation, radiative et non-radiative. Il faut cependant être vigilant avec l'intensité de
l'excitation. Une source très intense augmentera la probabilité de photodestruction car un fluorophore typique subit environ 105-106 cycles d'excitetion/émission avant de cesser
d'émettre [24, 57].
2.3.2 Diminution du signal de fond
Les impuretés présentes dans le volume de détection sont tout aussi susceptibles d'être excitées par la source lumineuse et d'émettre des photons. Une façon de réduire l'ampleur de ce problème est de filtrer l'excitation et l'émission en ciblant le maximum du spectre du fluorophore d'intérêt. Aussi, à cette échelle de détection, la propreté des solvants et des réactifs est primordiale. Une autre source de l'augmentation du signal de fond est la diffusion de Rayleigh. Cette sorte de diffusion est en fait provoquée par la source d'excitation qui est diffusée par l'échantillon dont certains photons peuvent atteindre le détecteur. Lorsque le déplacement de Stoke est suffisant, ces photons peuvent être en bonne partie discriminés du signal de fluorescence par un filtre spectral approprié. Néanmoins, aucun système n'est parfait et une partie de la lumière incidente finira toujours par atteindre le détecteur, ce qui implique qu'une augmentation de la puissance d'excitation, si elle peut augmenter l'intensité du signal de fluorescence, ne conduit pas nécessairement en une amélioration de la qualité des résultats. En effet, en augmentant la puissance de la source, davantage de photons seront diffusés et viendront s'ajouter au signal de fond total. Il y a donc un compromis à faire à cette étape. Cependant, en filtrant convenablement l'émission devant le détecteur, il est possible de réduire considérablement la quantité de photons attribuables à la diffusion de Rayleigh.
Une autre source de contamination du spectre de fluorescence est la diffusion Raman, dont le spectre interfère généralement avec l'émission du fluorophore. Contrairement à la diffusion de Rayleigh, la diffusion Raman, bien que provoquée elle aussi par la source d'excitation, est un phénomène inélastique car la fréquence de cette dernière n'est pas identique à celle de la lumière incidente. Par ailleurs, la fluorescence et la diffusion Raman donnent tous deux lieu à l'émission de photons de plus basse énergie que ceux de la source d'excitation. La différence entre les deux phénomènes est que la diffusion Raman se produit peu importe la fréquence de la lumière incidente alors que la fluorescence se produit seulement lorsque l'excitation lumineuse superpose le spectre d'absorption de la molécule. D'ailleurs, à l'image de la
fluorescence où le déplacement de Stokes est dicté par la nature de la molécule, la diffusion Raman maintient une séparation constante avec la fréquence d'excitation et cette séparation dépend aussi de la structure de la molécule.
Lors de la diffusion Raman, les photons incidents sont absorbés par la molécule. L'équilibre thermique fait en sorte que les molécules de l'état électronique So se trouvent à différents niveaux d'énergie vibrationnelle au sein de cet état. L'absorption de la lumière incidente se produit donc à partir de différents niveaux énergétiques. La molécule excitée se désactive ensuite par l'émission de photons. Ces photons redescendent vers le niveau électronique fondamental, mais à différents niveaux vibrationnels de l'état électronique fondamental II y a donc création d'une différence de fréquences entre la lumière incidente et celle émise. Si le niveau vibrationnel résultant est plus élevé en énergie que celui à partir duquel l'excitation a eu lieu au départ, la molécule gagne en énergie, mais les photons émis seront de plus basse énergie que les photons incidents. On assiste alors à un déplacement de Stokes vers les basses fréquences, tout comme la fluorescence. De plus, les nombreuses transitions permises donnent lieu à un spectre de plusieurs bandes. Il est à noter qu'on observe aussi un déplacement vers le bleu, appelé déplacement Anti-Stokes, dont l'intensité est négligeable et qui n'interfère pas avec la fluorescence. Le déplacement Raman est généralement exprimé en nombre d'onde (cm1) et
si on l'exprime en longueur d'onde (nm), elle variera en fonction de la fréquence d'excitation. Par exemple, l'eau, qui est un solvant couramment utilisé en analyse biologique, possède vin déplacement Stokes Raman maximum à - 3 380 cm"1 [58].
L'intensité de la diffusion Raman est souvent négligée en spectrofluorimétrie conventionnelle car elle correspond à 0,001 % de l'intensité de la source [56]. Or, dans le cas où l'on désire repérer une faible quantité d'analyte, la présence prédominante des molécules de solvant génère suffisamment de Raman pour concurrencer sérieusement l'intensité de la fluorescence. Ce phénomène est bien illustré à la Figure 2.9, où l'on compare l'intensité relative de la diffusion Raman de l'eau à l'intensité de fluorescence d'une molécule de rhockmine 6G (R6G) pour différents volumes d'analyse [29].
Une molécule R6G k - l c m — H IF = 1.0 1 R S5 10 V - l m l 10 Une molécule R6G
fi
H
4.6 microns
IPs 1.0
1RS"1 0
V-97M
Une molécule R6Gm
H
h-1 micron
I
F=1.0
I
R SM 0
V I fl
- 2Figure 2.9 : Intensité Raman de l'eau relative à la fluorescence d'une molécule de rhodamine 6G pour divers volumes d'analyse [29]
Dans un volume (V) de 1 mL, il y a environ 3,3 xlO22 molécules d'eau. L'intensité Raman (1RS)
d'une molécule d'eau est faible. Or, leur nombre fait en sorte qu'ensemble, elles produisent une intensité 1010 fois supérieure à l'intensité de fluorescence (IF) produite par une seule molécule
de rhodamine 6G. Les intensités 1^ et IF seront équivalentes pour un volume de 97 fL et pour
que la fluorescence d'une molécule soit 100 fois plus intense que le Raman de l'eau, il faut atteindre un volume de 1 fL, qui correspond au volume d'un cube de 1 um de côté. Il y a donc un avantage significatif à réduire le volume sondé pour diminuer la contribution de la diffusion Raman au signal de fond.
2.4 Utilisation de la microscopie confocale
De nos jours, un objectif de microscope performant est capable de focaliser la lumière sur une surface de moins d'un micron carré. Comme il vient d'en être question, cette particularité est très recherchée pour diminuer le volume d'analyse. Il faut remonter en 1976 pour trouver dans la littérature le premier usage de la microscopie pour la détection d'une faible quantité de fluorophore [59, 60]. Depuis, plusieurs en ont tiré profit [24, 29, 61].
2.4.1 Fonctionnement et avantages
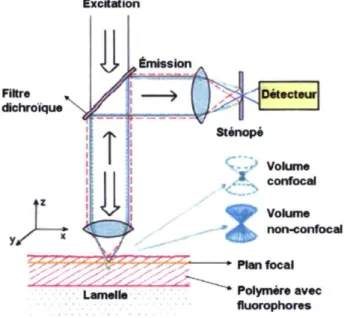
En microscopie, la collecte de l'émission en épifluorescence est couramment rencontrée. Le schéma de la Figure 2.10 en présente le concept [29]. Le faisceau d'excitation traverse le filtre dichroïque et est focalisé à l'aide de l'objectif de microscope sur l'échantillon. À cette étape, toute l'épaisseur de l'échantillon est excitée selon la forme des deux cônes inversés, comme le volume non-confocal décrit sur la Figure 2.10. L'émission de fluorescence est isotrope et une partie des photons revient dans l'objectif. Puisque le filtre dichroïque placé à 45° est conçu pour être transparent à basse longueur d'onde (excitation) et pour réfléchir les hautes longueurs d'onde (émission), les photons de fluorescence sont dirigés vers le détecteur. Cette configuration est typique de l'épifluorescence. Il est important de souligner qu'un objectif de microscope avec une grande ouverture numérique (NA) améliore l'efficacité de collecte des photons de fluorescence en récoltant la lumière provenant d'un plus grand angle [62].
Excitation Filtre dichroïque Volume , «-•c^ confocal Volume noto-confocal » Plan focal Polymère avec fluorophores
Figure 2.10 : Principe de l'épifluorescence avec détection confocale
Dans un montage confocal, les photons sont focalisés dans une ouverture de quelques microns de diamètre appelée sténopé, avant d'atteindre le détecteur. Cette ouverture a pour fonction de rejeter tous les photons qui ne proviennent pas du plan focal de l'objectif. En effet, dans la mesure où l'objet à mesurer au plan focal est entouré de solvant, les photons émis sous le plan focal seront en théorie focalisés derrière le sténopé tandis que ceux émis au-dessus du plan de
![Figure 2.1 : Profil parabolique de la vitesse d'un liquide en mouvement dans un canal Cette distribution radiale de la vitesse provoque la dispersion hydrodynamique d'un traceur lors de son déplacement tout au long du canal [1, 33, 34]](https://thumb-eu.123doks.com/thumbv2/123doknet/5579942.133896/20.898.275.670.436.590/figure-parabolique-mouvement-distribution-provoque-dispersion-hydrodynamique-déplacement.webp)
![Figure 2.4 : Variation de la largeur du focus selon le ratio des débits gaine/analyte [40]](https://thumb-eu.123doks.com/thumbv2/123doknet/5579942.133896/25.898.239.699.109.481/figure-variation-largeur-focus-ratio-débits-gaine-analyte.webp)
![Figure 2.6 : Représentation CLSM de la vue en coupe du canal de sortie du focus hydrodynamique; a) focus symétrique; b) focus non-symétrique (ratio 8 pour 1) [38]](https://thumb-eu.123doks.com/thumbv2/123doknet/5579942.133896/27.898.192.753.685.944/figure-représentation-clsm-coupe-sortie-hydrodynamique-symétrique-symétrique.webp)
![Figure 2.7 : Distribution du signal de fond et de la fluorescence selon le bruit [55]](https://thumb-eu.123doks.com/thumbv2/123doknet/5579942.133896/32.898.316.625.97.396/figure-distribution-signal-fond-fluorescence-bruit.webp)
![Figure 2.9 : Intensité Raman de l'eau relative à la fluorescence d'une molécule de rhodamine 6G pour divers volumes d'analyse [29]](https://thumb-eu.123doks.com/thumbv2/123doknet/5579942.133896/37.898.245.718.117.414/figure-intensité-relative-fluorescence-molécule-rhodamine-volumes-analyse.webp)