HAL Id: dumas-01245153
https://dumas.ccsd.cnrs.fr/dumas-01245153
Submitted on 16 Dec 2015HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Pathologie moléculaire des carcinomes anaplasiques
thyroïdiens : étude rétrospective à propos de 144 cas
Benjamin Bonhomme
To cite this version:
Benjamin Bonhomme. Pathologie moléculaire des carcinomes anaplasiques thyroïdiens : étude rétro-spective à propos de 144 cas. Médecine humaine et pathologie. 2015. �dumas-01245153�
Université de Bordeaux
U.F.R. DES SCIENCES MÉDICALES
Année 2015
N°3141
Thèse pour l’obtention du
DIPLÔME D’ÉTAT DE DOCTEUR EN MÉDECINE
présentée et soutenue publiquement
le 21 octobre 2015
par
Benjamin BONHOMME
né le 6 novembre 1986
à Cannes (Alpes-Maritimes)
TitrePATHOLOGIE MOLÉCULAIRE DES CARCINOMES ANAPLASIQUES THYROÏDIENS :
ÉTUDE RÉTROSPECTIVE À PROPOS DE 144 CAS
MOLECULAR PATHOLOGY OF ANAPLASTIC THYROID CARCINOMAS: A RETROSPECTIVE STUDY OF 144 CASES
Jury
Monsieur le Professeur Antoine DE MASCAREL Président du jury
Monsieur le Professeur Jean-Philippe MERLIO Rapporteur
Monsieur le Professeur Bogdan NICOLESCU-CATARGI Juge
Madame le Docteur Hélène TROUETTE Juge
Monsieur le Docteur Yann GODBERT Juge
TABLE DES MATIÈRES
LISTE DES ABRÉVIATIONS ... 6
LISTE DES FIGURES (TABLEAUX, GRAPHIQUES, IMAGES) ... 8
LISTE DES ANNEXES ... 10
RÉSUMÉ ... 11
I. GÉNÉRALITÉS ... 12
1. Rappels anatomique et histologique du corps thyroïde ... 12
A. Anatomie ... 12
B. Histologie ... 13
2. Épidémiologie des cancers thyroïdiens ... 13
3. Anatomie pathologique des tumeurs thyroïdiennes ... 15
II. INTRODUCTION-CARCINOME ANAPLASIQUE DE LA THYROÏDE ... 16
1. Définition (OMS 2004) ... 16
2. Épidémiologie ... 16
3. Facteurs de risque ... 16
4. Présentation clinique ... 17
5. Extension tumorale et classification TNM ... 17
6. Aspects macroscopiques ... 18 7. Aspects microscopiques ... 19 A. Aspect sarcomatoïde ... 20 B. Aspect épithélial ... 22 8. Cytologie ... 23 9. Immunohistochimie ... 23
10. Diagnostics différentiels en pathologie ... 24
11. Pathogenèse moléculaire des CAT ... 25
A. Voies de signalisation impliquées dans l’oncogenèse thyroïdienne ... 25
a. MAP-kinase ... 25
b. PI3K-AKT ... 26
c. NF-κB ... 27
d. WNT-β-caténine ... 27
e. Autres voies ... 28
B. Modèle de progression tumorale ... 28
C. Autres altérations moléculaires rencontrées dans les CAT ... 29
a. Gains, amplifications, délétions ... 29
b. Translocations ... 29
4
D. Un exemple de récepteur à activité tyrosine kinase : le point sur ALK ... 30
12. Evolution et pronostic ... 31
13. Principes généraux des thérapies conventionnelles ... 33
A. Place de la chirurgie ... 33
B. Place de la radiothérapie ... 34
C. Place de la chimiothérapie conventionnelle... 34
14. Intérêt des thérapies ciblées émergentes ... 34
III. INTÉRÊTS ET OBJECTIFS DE L’ÉTUDE ... 37
1ère partie : Prévalence et intérêt de la recherche des réarrangements de ALK dans les CAT ... 37
A. Contexte ... 37
B. Objectifs... 38
2ème partie : Étude par séquençage de nouvelle génération (NGS) de cibles thérapeutiques potentielles dans les CAT avec corrélations immunohistochimiques (IHC) ... 38
A. Contexte ... 38
B. Objectifs... 39
IV. MATÉRIELS ET MÉTHODES ... 40
1. Recueil des prélèvements ... 40
2. Classification histologique des échantillons ... 40
3. Construction des Tissue Microarrays (TMAs) ... 40
4. Immunohistochimie (IHC) ... 42
A. Aspects techniques ... 42
B. Interprétation des immunomarquages ... 42
5. Hybridation in situ par fluorescence (FISH) avec sondes encadrantes ALK... 44
6. Réaction en chaîne par polymérase après rétro-transcription (RT-PCR) ...45
7. Séquençage de nouvelle génération (NGS) ...45
8. Hybridation in situ par fluorescence (FISH) avec sondes encadrantes RET ... 49
V. RÉSULTATS ... 51
1. Population et échantillons ... 51
2. Histologie ... 51
1ère partie : Prévalence et intérêt de la recherche des réarrangements de ALK dans les CAT ... 52
A. Immunohistochimie (IHC) ... 52
B. FISH ALK ...54
C. RT-PCR ...56
2ème partie : Étude par séquençage de nouvelle génération (NGS) de cibles thérapeutiques potentielles dans les CAT avec corrélations immunohistochimiques (IHC) ...59
A. Immunohistochimie (IHC) ...59
B. Séquençage de nouvelle génération (NGS) ... 63
D. FISH RET ... 67
VI. DISCUSSION ... 68
1ère partie : Prévalence et intérêt de la recherche des réarrangements de ALK dans les CAT .... 68
2ème partie : Étude par séquençage de nouvelle génération (NGS) de cibles thérapeutiques potentielles dans les CAT avec corrélations immunohistochimiques (IHC) ... 70
A. Oncogenèse des CAT ... 71
a. Arguments morphologiques ... 71
b. Mutations de BRAF ... 71
c. Mutations de RAS ... 72
d. Filiation entre carcinomes bien différenciés et CAT ... 72
e. Voie PI3K-AKT ... 73
f. Altération de TP53 ... 74
g. Altération de PTEN ... 75
h. Altération conjointe de PTEN et de TP53 ... 75
i. Atteinte conjointe des voies MAP-kinase et PI3K-AKT ... 75
B. Émergence de nouveaux gènes ... 76
a. MET ... 76 b. ALK ... 76 c. APC ... 76 d. ERBB2 ... 77 e. RET... 77 f. SMAD4 ... 77 g. CDKN2A ... 78 h. ATM ... 78 C. Absence de mutation ... 79 D. Implications thérapeutiques ... 79 VII. CONCLUSION ... 81 VIII. OUVERTURE ... 83 BIBLIOGRAPHIE ... 86 ANNEXES ... 95 SERMENT D’HIPPOCRATE ... 124
6
LISTE DES ABRÉVIATIONS
- ACE : Antigène carcino-embryonnaire - ADN : Acide désoxyribonucléique
- AJCC : American joint committee on cancer (AJCC) - AKT : Protéine kinase B
- ALK : Anaplastic lymphoma kinase - AMM : Autorisation de mise sur le marché - APC : Adenomatous polyposis coli
- ARN : Acide ribonucléique
- ATM : Ataxia telangiectasia mutated kinase
- BCR-ABL : Breakpoint cluster region protein - Abelson murine leukemia viral oncogene - BRAF : V-raf murine sarcoma viral oncogene homolog B1
- CAT : Carcinome anaplasique thyroïdien - CBP : Carcinome broncho-pulmonaire
- CDKN2A : Cyclin-dependent kinase inhibitor 2A - CHU : Centre hospitalier universitaire
- CK haut pds moléculaire : Cytokératines de haut poids moléculaire - C-KIT : Récepteur du facteur de cellule souche
- CLCC : Centre de lutte contre le cancer - C-MET : Hepatocyte growth factor receptor
- COSMIC : Catalog of somatic mutations in cancer (catalogue des mutations somatiques des cancers)
- CTNNB1 : Catenin (cadherin-associated protein) bêta 1 - EBV : Virus Epstein-Barr
- EGFR : Epidermal growth factor receptor - EMA : Antigène épithélial de membrane
- EML4 : Echinoderm microtubule associated protein like 4 - ERBB2 : Erb-b2 receptor tyrosine kinase 2
- ERK : Extracellular signal-regulated kinases
- FFPE : Formalin-fixed paraffin embedded (fixation formolée et inclusion paraffine) - FISH : Fluorescence in situ hybridization (Hybridation in situ en fluorescence) - FRANCIM : Réseau France Cancer Incidence et Mortalité
- GDNF : Glial cell line-derived neurotrophic factor - Gy : Gray
- HES : Hématoxyline Eosine Safran - IHC : Immunohistochimie
- INCa : Institut National du Cancer
- Inserm : Institut national de la santé et de la recherche médicale - InVS : Institut de veille sanitaire
- MAP-kinase : Mitogen-activated protein kinase - MEK : Mitogen-activated protein kinase kinase - m-TOR : mechanistic target of rapamycin - NF-κB : Nuclear factor-kappa B
- NGS : “Next-generation sequencing” (séquençage de nouvelle génération) - OMS : Organisation mondiale de la santé (WHO : World health organization) - p53 : Protéine p53
- PAX8 : Paired box gene 8
- PCR : Polymerase chain reaction (réaction en chaîne par polymérase) - PDGF/R : Platelet-derived growth factor (receptor)
- PI3K: Phosphoinositide 3-kinase
- PIK3CA/B : Phosphatidylinositol-4,5-bisphosphate 3-kinase, sous-unité catalytique alpha/bêta - PPARγ : Peroxisome proliferator-activated receptor gamma
- PTC : gène/protéine RET “papillary thyroid carcinoma” - PTEN : Phosphatase and tensin homolog
- RAS : Rat sarcoma virus
- RASAL1 : RAS Protein Activator Like 1
- RECIST : Response Evaluation Criteria In Solid Tumor - RET : gène/protéine RET “rearranged during transfection” - RT : Radiothérapie
- RT-PCR : Reverse transcription polymerase chain reaction (réaction en chaîne par polymérase après rétro-transcription)
- SMAD4 : Similar to mad-mother against decapentaplegic
- SNP : Single nucleotidic polymorphism (polymorphisme nucléotidique) - STRN : Striatine
- TDM : Tomodensitométrie
- TGFβ : Transforming growth factor β - TMA : Tissue microarray
- TP53 : Gène TP53
- TSH : Thyroid-stimulating hormone (thyréostimuline ou thyréotropine) - TTF1 : Thyroid transcription factor 1
- TUTHYREF : Réseau des tumeurs thyroïdiennes réfractaires - VEGF/R : Vascular endothelial growth facteur (receptor) - WNT : accronyme de “wingless” et de “integration”
8
LISTE DES FIGURES (TABLEAUX, GRAPHIQUES, IMAGES)
- Figure 1 : Corps thyroïde et ses vaisseaux - Figure 2 : Histologie de la thyroïde
- Figure 3 : Principaux indicateurs du cancer thyroïdien en 2012
- Figure 4 : Incidence et mortalité du cancer thyroïdien par âge en 2012 pour la France - Figure 5 : Tendance chronologique du cancer thyroïdien pour la France
- Figure 6 : Classification OMS 2004 des tumeurs thyroïdiennes (traduite d’après l’OMS) - Figure 7 : Image tomodensitométrique (TDM) d’un CAT
- Figure 8 : Classification TNM du CAT (7ème édition, AJCC 2009)
- Figure 9 : Illustration de la classification TNM (7ème édition, AJCC 2009) - Figure 10 : Aspect macroscopique d’un CAT
- Figure 11 : Aspects microscopiques communs des CAT - Figure 12 : Aspects sarcomatoïdes des CAT
- Figure 13 : Aspects épithéliaux des CAT - Figure 14 : Aspect cytologique d’un CAT
- Figure 15 : Marqueurs immunohistochimiques utiles dans le diagnostic des CAT - Figure 16 : Tableau des principaux diagnostics différentiels des CAT en pathologie - Figure 17 : Voie MAP-kinase
- Figure 18 : Voie PI3K-AKT
- Figure 19 : Modèle de progression tumorale thyroïdien
- Figure 20 : Principaux gains et pertes chromosomiques dans les CAT rapportés dans la littérature - Figure 21 : Principaux gains en nombre de copies de gène dans les CAT rapportés dans la littérature - Figure 22 : Principaux mécanismes épigénétiques dans les CAT rapportés dans la littérature
- Figure 23 : Structure du récepteur ALK
- Figure 24 : Tableau des principaux facteurs pronostiques des CAT
- Figure 25 : Algorithme du traitement initial recommandé pour les patients présentant un CAT - Figure 26 : Principaux essais thérapeutiques ciblés sur les CAT dans la littérature à ce jour - Figure 27 : Cerclage des lames en 3 couleurs en fonction des différentes composantes - Figure 28 : Exemple de bloc et lame HES de TMA
- Figure 29 : Référence, prétraitement, dilution et temps d’incubation des anticorps utilisés - Figure 30 : Système de score utilisé dans le protocole AcSé pour l’immunomarquage ALK (D5F3) - Figure 31 : Système de score utilisé pour l’immunomarquage BRAF (VE1)
- Figure 32 : Système de score utilisé pour l’immunomarquage p53 (DO7) - Figure 33 : Système de score utilisé pour l’immunomarquage C-MET (SP44) - Figure 34 : Système de score utilisé pour l’immunomarquage PTEN (138G6) - Figure 35 : Sondes Vysis® LSI Break Apart (Abbott Molecular)
- Figure 36 : Schéma FISH ALK de 2 signaux de fusion (négatif) et d’un signal séparé (positif) - Figure 37 : Illustration d’un résultat positif en RT-PCR
- Figure 38 : Gènes cibles du cancer panel “Ion AmpliSeqTM Cancer Hotspot Panel v2” - Figure 39 : Appareil Ion Personal Genome Machine® (PGM™) System (Life Technologies) - Figure 40 : Illustration des étapes de séquençage selon la technologie PGM Ion Torrent - Figure 41 : Idéogramme du chromosome 10 indiquant la position des sondes encadrantes RET - Figure 42 : Schéma FISH RET de 2 signaux de fusion (normal) et d’un signal séparé (réarrangé)
9 - Figure 43 : Tableau des différentes composantes histologiques de la cohorte
- Figure 44 : Diagramme de répartition des différents sous-types histologiques des CAT de la cohorte
- Figure 45 : Tableau des résultats immunohistochimiques pour ALK (D5F3)
- Figure 46 : Résultats de l’immunohistochimie ALK (D5F3) pour les composantes anaplasiques - Figure 47 : Exemples de marquages immunohistochimiques ALK (D5F3)
- Figure 48 : Marquage immunohistochimique ALK (D5F3) sur le parenchyme thyroïdien normal - Figure 49 : Résultats FISH ALK sur composantes anaplasiques
- Figure 50 : Résultats du cas n°136 (cas anaplasique positif en FISH) - Figure 51 : Illustration du cas n°136 (HES, IHC, FISH)
- Figure 52 : Tableau de concordance entre IHC ALK (D5F3) et FISH break-apart ALK - Figure 53 : Photos de gel des résultats RT-PCR sur 1ère série
- Figure 54 : Photos de gel des résultats RT-PCR sur 2ème série - Figure 55 : Photos de gel des résultats RT-PCR sur 3ème série
- Figure 56 : Schéma des différents variants actuellement recensés du réarrangement du gène ALK avec ses différents partenaires
- Figure 57 : Résultats RT-PCR ALK-EML4 pour le cas 136A
- Figure 58 : Synthèse des résultats immunohistochimiques pour BRAF, C-MET, PTEN et p53 - Figure 59 : Résultats IHC pour BRAF
- Figure 60 : Résultats IHC pour p53 - Figure 61 : Résultats IHC pour C-MET - Figure 62 : Résultats IHC pour PTEN
- Figure 63 : Résultats des mutations gène par gène
- Figure 64 : Synthèse des résultats NGS cas par cas pour les cas analysables - Figure 65 : IHC BRAF (2+) du cas 26A (mutation N581S)
- Figure 66 : Performance de l’IHC dans l’identification des mutations - Figure 67 : Résultats FISH RET sur cas non mutés en NGS
- Figure 68 : Illustration de cas RET/PTC en HES et FISH
- Figure 69 : Extrait du tableau du programme « AcSé crizotinib » (janvier 2015) - Figure 70 : Immunohistochimie p16 pour le cas n°2A
- Figure 71 : Modèle de carcinogenèse à partir des cellules fœtales - Figure 72 : Cancer mature et immature
10
LISTE DES ANNEXES
- Annexe 1 : Fiche technique FISH ALK (Institut Bergonié) - Annexe 2 : Fiche technique RT-PCR (Institut Bergonié)
- Annexe 3 : Fiche technique extraction ADN FFPE (Institut Bergonié) - Annexe 4 : Fiche technique FISH RET (Institut Bergonié)
- Annexe 5 : Résultats détaillés cas par cas pour données cliniques, microscopiques et IHC - Annexe 6 : Résultats détaillés cas par cas pour FISH et immunohistochimie ALK
- Annexe 7 : Données techniques RT-PCR - Annexe 8 : Détails résultats NGS cas par cas
- Annexe 9 : Tableaux de corrélation entre IHC et statut mutationnel - Annexe 10 : Résultats détaillés cas par cas pour FISH RET
11
RÉSUMÉ
Titre : Pathologie moléculaire des carcinomes anaplasiques thyroïdiens : étude rétrospective à
propos de 144 cas
Introduction : Le carcinome anaplasique de la thyroïde (CAT) est une tumeur rare, de pronostic
sombre, dont les mécanismes moléculaires oncogéniques restent méconnus et les essais cliniques ciblés sans véritable succès. L’objectif de cette étude rétrospective est double : rapporter la prévalence de la translocation de ALK et décrire le profil mutationnel des CAT.
Matériel et methodes : 144 cas ont été collectés. L’analyse des réarrangements par FISH et les
études immunohistochimiques (IHC) ont été effectuées sur Tissue Micro-Array. La recherche de transcrits de fusion par RT-PCR a été effectuée pour les cas positifs en FISH ou IHC. L’étude mutationnelle a été réalisée par une technique de séquençage de nouvelle génération (NGS) ciblant un panel de 50 gènes.
Résultats : 90 cas (62,5%) étaient analysables en FISH. 1 cas (1,1%) présentait un réarrangement de
ALK avec un seuil limite (15%), une IHC et une RT-PCR négatives. 3 cas (2,1%) présentaient une positivité 2+ en IHC sans réarrangement FISH. 94 cas (65,3%) étaient analysables en NGS : 42,6% des cas présentaient une mutation de RAS, 13,8% de BRAF, 17% de la voie PI3K-AKT, 7,4% une altération conjointe des voies RAS et PI3K et 3,2% une co-mutation TP53/PTEN. La mutation de TP53 était la plus fréquente (57,5%). 18,1% des cas ne présentaient aucune mutation des voies MAP-kinase et PI3K-AKT mais des mutations isolées de ATM, CDKN2A, ERBB2, ALK, APC, RET, SMAD4, certaines non encore décrites dans la thyroïde. Enfin, 8,5% des cas ne présentaient ni mutation dans les gènes cibles ni réarrangement de RET/PTC en FISH.
Conclusion : Notre étude confirme que, dans les CAT, la prévalence des réarrangements de ALK est
faible et que le paysage mutationnel est hétérogène, mettant en jeu de nombreux gènes impliqués dans les processus de dédifférenciation thyréocytaire. Le rôle joué par ces mutations dans l’oncogenèse thyroïdienne, non établi à ce jour, peut expliquer la faible efficacité des thérapies ciblées.
Discipline : Anatomie et cytologie pathologiques
Mots-clés : thyroïde, carcinome anaplasique, ALK, mutations, séquençage de nouvelle génération, immunohistochimie, FISH, oncogenèse
12
I. GÉNÉRALITÉS
1. Rappels anatomique et histologique du corps thyroïde
A. Anatomie
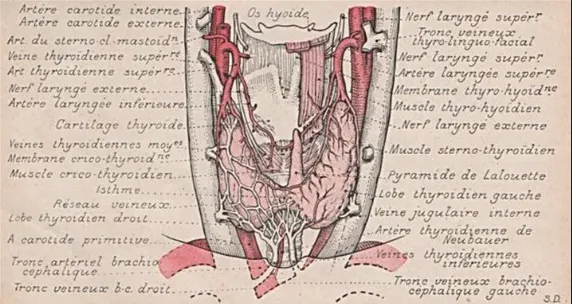
Figure 1 : Corps thyroïde et ses vaisseaux* *
(extrait de : L’anatomie en poche - V. Pauchet et S. Dupret - 1926)
Sur le plan embryologique, la glande thyroïde dérive d’un bourgeon de cellules endodermiques naissant près de la racine de la langue qui, en migrant, forme le tractus thyréoglosse. Par la suite, ce tractus s’atrophie et il ne persiste que la thyroïde, en position définitive. Parfois, le tractus thyréoglosse ne régresse pas totalement et quelques fragments peuvent persister sur la ligne médiane du cou, habituellement sous formes d’une traînée de cavités ou de kystes cervicaux (kystes du tractus thyréoglosse)1.
Sur le plan anatomique (figure 1), la glande thyroïde comporte deux lobes latéraux situés de part et d’autre du cartilage thyroïde, à la partie supérieure de la trachée, dans la région antérieure du cou. Ces lobes sont réunis près de leurs pôles inférieurs par un isthme situé en avant de la partie inférieure du larynx. Parfois, un petit lobe pyramidal (autrement appelé pyramide de Lalouette) se projette vers le haut à la partie moyenne de l’isthme. Chaque lobe latéral mesure en moyenne 5 cm de longueur, 3-4 cm de largeur et 2-3 cm d’épaisseur. Chez l’adulte, la thyroïde pèse physiologiquement 15 à 20 grammes ; elle est un peu plus grosse chez l’homme que chez la femme1.
13
B. Histologie
La thyroïde est entourée d’une fine capsule fibreuse émettant des septa qui pénètrent la glande et la divisent en lobules irréguliers. La partie glandulaire de la thyroïde est composée d’un épithélium constituant des unités sphériques tassées les unes contre les autres : les vésicules. Chaque vésicule (figure 2) est bordée d’une simple couche cellulaire spécialisée, qui repose sur une membrane basale et entoure une lumière remplie de colloïde thyroïdienne, matériel protéique homogène coloré en rose à l’hématoxyline-éosine-safran (HES) et riche en thyroglobuline.
Les cellules produisant la calcitonine (cellules C) sont dispersées entre les cellules bordant les vésicules thyroïdiennes (follicules), mais se regroupent parfois en petits îlots dans la paroi d’une vésicule ou en amas plus gros dans les espaces interstitiels séparant des vésicules adjacentes1.
Figure 2 : Histologie de la thyroïde (coloration HES)
2. Épidémiologie des cancers thyroïdiens
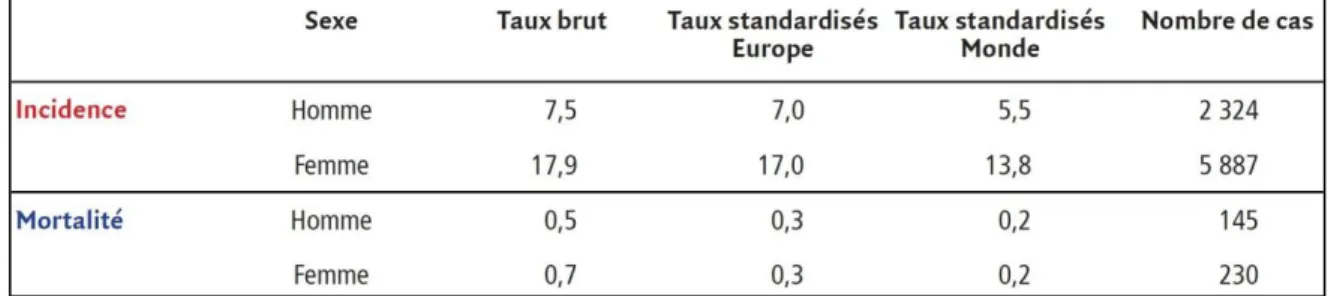
En France, avec 8211 nouveaux cas estimés en 2012 dont 72 % survenant chez la femme, le cancer de la thyroïde se situe au 11ème rang des causes de cancer. Les taux d’incidence standardisés sont de 5,5 chez l’homme et de 13,8 chez la femme, soit un rapport hommes/femmes de 0,40. Avec 375 décès, dont 61 % chez la femme, ce cancer se situe au 18ème rang des causes de décès par cancer. Les taux de mortalité standardisés sont de 0,2, aussi bien chez l’homme que chez la femme (figure 3).
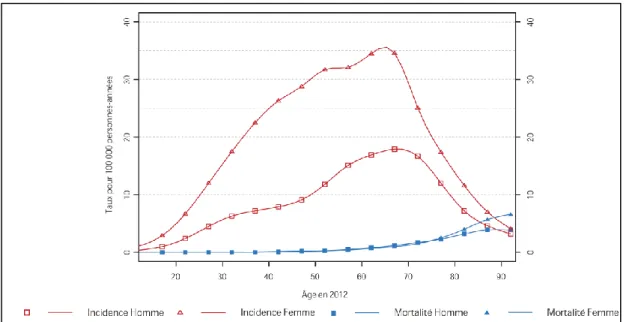
14 En 2012, le pic d’incidence est atteint chez les 60-69 ans, quel que soit le sexe. Les taux spécifiques de mortalité sont plus élevés aux grands âges (figure 4).
Figure 4 : Incidence et mortalité du cancer thyroïdien par âge en 2012 pour la France2
L’incidence du cancer de la thyroïde a fortement augmenté en France depuis 1980 (figure 5) ; cette augmentation se faisant aux dépens des carcinomes papillaires3. Si cette augmentation persiste chez les hommes, celle-ci semble s’atténuer chez les femmes au cours de la période récente. La différence d’évolution entre l’incidence et la mortalité s’explique par le fait qu’il existe d’importantes différences de survie selon le type histologique4.
3. Anatomie pathologique des tumeurs thyroïdiennes
La classification des tumeurs thyroïdiennes date de 2004 et est publiée par l’Organisation Mondiale de la Santé (OMS) dans « WHO Pathology and Genetics of Tumours of Endocrine Organs»5 (figure 6).
Figure 6 : Classification OMS 2004 des tumeurs thyroïdiennes (traduite d’après l’OMS5)
Les tumeurs bénignes (adénomes et tumeurs apparentées) sont fréquentes alors que les carcinomes, bien que relativement rares, représentent les tumeurs malignes les plus fréquentes du système endocrine. Parmi les tumeurs épithéliales, les carcinomes d’origine folliculaire (ou vésiculaire) surpassent largement en nombre les tumeurs provenant des cellules C. Les lymphomes primitivement thyroïdiens sont rares et les autres tumeurs non-épithéliales sont exceptionnelles5. La séparation traditionnelle des carcinomes thyroïdiens en grands groupes (papillaire, folliculaire ou vésiculaire, médullaire et anaplasique ou indifférencié), basée sur des données morphologiques et cliniques, est aujourd’hui supportée par les études moléculaires démontrant l’implication de gènes distincts dans ces différents groupes de tumeurs avec, cependant, quelques recoupements.
Au sein des tumeurs de souche folliculaire, on identifie d’une part les carcinomes dits « différenciés » (carcinome papillaire, carcinome vésiculaire bien et peu différencié) du carcinome indifférencié (carcinome anaplasique) ; ce dernier se distinguant par son caractère rapidement progressif et son évolution fatale foudroyante5.
La définition du carcinome vésiculaire peu différencié a quant à elle été précisée dans un article publié en 2007, postérieurement à la classification OMS par une équipe italienne (Turin)6.
16
II. INTRODUCTION-CARCINOME ANAPLASIQUE DE LA THYROÏDE
1. Définition (OMS 2004)
Le carcinome anaplasique de la thyroïde (CAT) ou carcinome indifférencié est une tumeur maligne agressive, d’origine folliculaire, qui, histologiquement, apparait comme partiellement ou totalement composée de cellules indifférenciées, mais qui présente cependant des aspects immunohistochimiques et ultra-structuraux en faveur d’une différenciation épithéliale5.
2. Épidémiologie
Les carcinomes thyroïdiens représentent environ 1% des nouvelles tumeurs malignes7. Les CAT sont rares voire exceptionnels, comptant pour 1 à 2 % des carcinomes thyroïdiens8. L’incidence estimée est de 1 à 2 cas par million d’habitants par an9. Cette dernière semble plus élevée en Europe (et dans les zones d’endémie goitreuse) par rapport aux États-Unis10.
Les CAT touchent une population âgée (pic d’incidence situé entre la sixième et la septième décennie) et présentent une prédominance féminine (sex-ratio F/H variant de 1,5/111 à 5/112). Dans une étude rétrospective allemande portant sur 5583 cas de CAT, 67% des patients avaient plus de 70 ans et la part des femmes atteignait 70% des cas13.
Une étude indienne montre une réduction de la proportion des CAT dans l’incidence totale des carcinomes thyroïdiens entre 1969 et 1993, passant de 8% à 4%14. D’autres études italiennes retrouvent cette même tendance avec un déclin de 4% à 1% entre 1985 et 200415,16. Cette diminution (incidence divisée par 8 en près de 35 ans) pourrait s’expliquer par l’amélioration des conditions de vie, la correction de la carence iodée, la performance des nouveaux outils diagnostiques (notamment immunohistochimiques permettant d’éliminer d’éventuels diagnostics différentiels) et la meilleure prise en charge des formes bien différenciées17,18.
3. Facteurs de risque
Plusieurs études rapportent une association entre antécédent de goitre et CAT à des fréquences comprises entre 10% et 25%13,19; l’incidence des CAT étant plus importante dans les zones de carence iodée. Une étude slovène retrouve d’ailleurs une diminution de l’incidence des CAT entre 1972-1997 et 1998-2008 du fait de l’augmentation de la teneur en iodure de potassium du sel de consommation20.
17 Les CAT peuvent se développer de novo ou, comme dans 18% à 71% des cas, apparaître secondairement chez des patients aux antécédents de carcinome thyroïdien différencié21–23.
Enfin, une large étude cas-témoins menée entre 1993 et 2005 comparant une cohorte de 126 patients atteints de CAT à une cohorte témoins de 252 patients identifie le faible niveau socio-économique (RR = 1,42 ; IC 95% = [1,09-1,86]), le groupe sanguin B (RR = 2,41 ; IC 95% = [1,03-5,66]) et l’existence d’un goitre (RR = 25-33 ; IC 95% = [5,66-126,65]) comme facteurs de risque de CAT.
4. Présentation clinique
La symptomatologie loco-régionale la plus fréquente est celle d’une masse cervicale de croissance rapide (77%) ou d’une masse ganglionnaire (54%) suivie par les signes secondaires à une compression locale : dysphagie (40%), dysphonie et raucité de la voix par paralysie des cordes vocales (40%), douleur cervicale (30%) et stridor / dyspnée (24%). La symptomatologie générale comporte anorexie, perte de poids, essoufflement.
Plus de 90% des patients présentent au diagnostic une maladie localement avancée ; 50% sont d’emblée métastatiques22 et 25% développent des métastases au cours de l’évolution de la maladie. Les localisations métastasiques les plus fréquentes sont pulmonaire (80%), osseuse (6-16%) et cérébrale (5-13%)24. Des métastases cardiaques ont également été décrites25.
Figure 7 : Image tomodensitométrique (TDM) d’un CAT
5. Extension tumorale et classification TNM
Dans la classification TNM (7ème édition, AJCC 2009), les CAT appartiennent, par définition, à la catégorie pT4 (stade IV), quelle que soit la taille tumorale.
18 stade IV A T4a tout N M0 T4a tumeur intra-thyroïdienne
stade IV B
T4b tout N M0 T4b extension extra-thyroïdienne IVB-a = atteinte tissus mous, larynx, trachée, œsophage, nerf laryngé récurrent IVB-b = atteinte fascia pré-vertébral, carotide ou vaisseaux médiastinaux stade IV C tout T tout N M1 (métastases à distance)
Figure 8 : Classification TNM du CAT (7ème édition, AJCC 2009)
Figure 9 : Illustration de la classification TNM (7ème édition, AJCC 2009)
6. Aspects macroscopiques
19 Les CAT sont généralement des tumeurs de grande taille (6 cm en moyenne), d’aspect charnu, blanchâtre, siège de remaniements hémorragiques et nécrotiques. Ils sont typiquement invasifs et infiltrent les tissus mous péri-thyroïdiens ainsi que les structures cervicales adjacentes (ganglions, larynx, pharynx, trachée et œsophage), ne laissant persister que peu de parenchyme thyroïdien normal5.
7. Aspects microscopiques
Les CAT sont caractérisés par une très grande hétérogénéité morphologique avec le plus souvent une association de plusieurs aspects microscopiques27,28. Cependant, ils présentent quelques caractéristiques communes :
Aspect infiltrant Hémorragie
20
Angiotropisme Mitoses (atypiques)
Figure 11 : Aspects microscopiques communs des CAT (coloration HES)
En pratique, les différents aspects rencontrés peuvent être regroupés en deux grandes catégories29 :
A. Aspect sarcomatoïde
Il est présent dans au moins 50% des cas28 :Cellules fusiformes C’est l’aspect le plus fréquemment rencontré.
Paucicellulaire Décrit en 1995, il pourrait s’agir d’une variante fusiforme avec cependant peu d’atypies. Elle toucherait des patients plus jeunes (et serait donc associée à une survie prolongée). Elle peut mimer une thyroïdite de Riedel30,31.
21 Cellules pléomorphes
Cette forme est caractérisée par un important pléomorphisme nucléaire28.
Cellules géantes (ostéoclastique-like) Les cellules géantes sont de nature réactionnelle et non tumorale32.
(encart IHC CD68/KP1+) Rhabdoïde
Ce sous-type rapporté de manière exceptionnelle est soit un sous-type à part entière soit un contingent hétérologue d’un autre sous-type sarcomatoïde33–35.
Angiomatoïde Ce sous-type est formé de cordons cellulaires mimant des vaisseaux sanguins avec des aspects pseudo-hémangiopéricytaires29.
Référence image29
22
B. Aspect épithélial
Les CAT épithélioïdes sont histologiquement moins hétérogènes que les CAT sarcomatoïdes. Ils sont caractérisés par la présence de cellules polygonales présentant des aspects épithéliaux évidents et dessinant des cordons ou des îlots cellulaires au sein d’un stroma desmoplasique29.
Malpighien
Il peut être plus ou moins kératinisant.
Malpighien fusiforme L’aspect est identique à celui observé dans les primitifs ORL et mammaire et doit donc faire éliminer la possibilité d’une métastase29.
Lymphoépithélial-like Exceptionnel, l’aspect est identique à celui rencontré au niveau du nasopharynx ou des autres sites. Il n’est pas lié à l’EBV36.
Référence image36
Figure 13 : Aspects épithéliaux des CAT (coloration HE/HES)
8. Cytologie
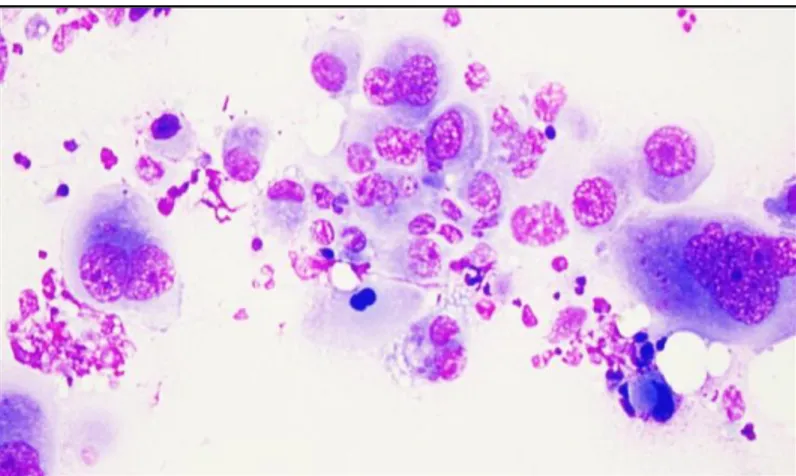
Le diagnostic cytologique par cytoponction est possible dans plus de 80% des cas. L’aspect classiquement rencontré est celui de cellules tumorales pléomorphes sur un fond nécrotique sale.
Figure 14 : Aspect cytologique d’un CAT (coloration May-Grünwald Giemsa)26
9. Immunohistochimie
Les progrès de l’immunohistochimie ont permis de rétablir des diagnostics en reclassant certaines tumeurs initialement diagnostiquées comme CAT en lymphome, carcinome médullaire, carcinome thyroïdien vésiculaire peu différencié. Ainsi le sous-type histologique de CAT à petites cellules, autrefois rapporté, a aujourd’hui disparu37.
Schématiquement, les CAT expriment les marqueurs de différenciation épithéliale29: - Cytokératine à large spectre : 40-100% des cas
- Vimentine : 100% des cas (si inflexion fusiforme)
- Antigène épithélial de membrane (EMA) : 30-50% des cas (si inflexion épithéliale) - p53 (protéine p53) : 70% des cas (si inflexion malpighienne)
En revanche, les marqueurs de différenciation thyroïdienne restent négatifs sauf le PAX829 : - Thyroglobuline : 0% des cas (sauf vésicules non tumorales piégées)
- TTF1 : 0% des cas (ou très faible) - Oncoprotéine RET/PTC : 0% des cas
- Calcitonine (de même que chromogranine A, synaptophysine, CD56) : 0% des cas - PAX8 : 0-79 % des cas (90-100% dans les formes à inflexion épithéliale)
24 Les principaux marqueurs immunohistochimiques utiles en pathologie thyroïdienne sont résumés dans le tableau ci-dessous :
ACE : antigène carcino-embryonnaire - CK haut pds moléculaire : cytokératines de haut poids moléculaire
Figure 15 : Marqueurs immunohistochimiques utiles dans le diagnostic des CAT8
10. Diagnostics différentiels en pathologie
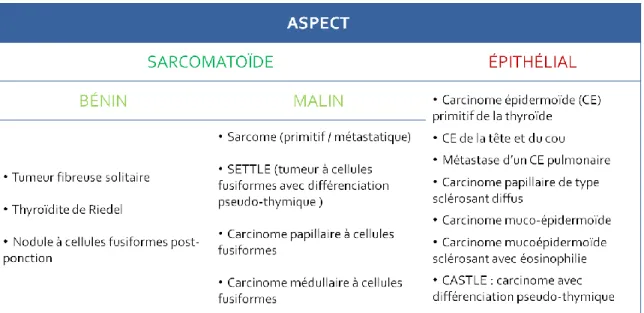
Les principaux diagnostics différentiels des CAT en pathologie sont à envisager en fonction de l’aspect microscopique prédominant (sarcomatoïde ou épithélial). Ils sont répertoriés dans le tableau ci-dessous29 :
11. Pathogenèse moléculaire des CAT
Les cancers thyroïdiens différenciés (papillaire et vésiculaire) tendent le plus souvent à ne présenter qu’un seul type d’altération génétique. À mesure du processus de dédifférenciation, le nombre d’anomalies génétiques s’accumulent et les CAT présentent généralement de multiples altérations génétiques38.
A. Voies de signalisation impliquées dans l’oncogenèse thyroïdienne
Beaucoup de microlésions de l’ADN (mutations ponctuelles) intéressent ces voies de signalisation.a. MAP-kinase
Figure 17 : Voie MAP-kinase (traduite d’après39)
La voie MAP-kinase (Mitogen-activated protein) joue un rôle fondamental dans la régulation de la prolifération cellulaire, la survie et la tumorigenèse humaine. L’implication et l’importance de cette voie sont bien établies dans l’oncogenèse thyroïdienne, en particulier dans les carcinomes papillaires40,41. En effet, dans ces derniers, la voie MAP-kinase est dérégulée par des mutations activatrices notamment de BRAF, des translocations de RET-PTC et, dans certains cas, par des mutations activatrices de ALK42. L’oncogenèse thyroïdienne dépendante de la voie MAP-kinase implique secondairement d’autres altérations moléculaires potentialisant et amplifiant l’activité oncogénique de cette voie, tels que des mécanismes d’hyper- ou hypo-méthylations géniques, une
26 régulation positive de diverses protéines oncogéniques comme les chimiokines, les facteurs de croissance de l’endothélium vasculaire (VEGF), le facteur nucléaire κB (NF-κB) et les métalloprotéases matricielles (MMPs). Ces dernières, constituant clé de la matrice extracellulaire du micro-environnement, possèdent un rôle maintenant établi dans la tumorigenèse à travers différents mécanismes induisant prolifération, croissance, migration et survie, de même que néo-angiogenèse, invasion et métastase.
b. PI3K-AKT
Figure 18 : Voie PI3K-AKT (traduite d’après39)
La voie PI3K-AKT (phosphoinositide 3-kinase - protéine kinase B) joue elle aussi un rôle fondamental dans la carcinogenèse thyroïdienne. Les premières preuves de son importance proviennent des découvertes faites dans le syndrome de Cowden (secondaire à des mutations de PTEN) associant adénomes et carcinomes thyroïdiens43. Le rôle fonctionnel de cette voie dans l’oncogenèse sporadique thyroïdienne est évoqué du fait de l’hyperexpression et de l’activation de AKT (AKT1 et 2 essentiellement) dans les carcinomes d’origine folliculaire, notamment les carcinomes vésiculaires44,45, ce qui explique la fréquence des mutations de AKT1 dans les métastases de carcinomes vésiculaires46. De plus, plusieurs études suggèrent que le caractère invasif et métastatique secondaire à une altération de la voie PI3K-AKT dans les carcinomes vésiculaires serait
27 lié à l’activation et à la localisation nucléaire de AKT144. L’inhibition de la prolifération des cellules cancéreuses thyroïdiennes présentant une altération de la voie PI3K-AKT laisse à penser que les cellules thyroïdiennes cancéreuses présentent une dépendance vis-à-vis de l’hyperactivation de cette voie de signalisation. Il existe par ailleurs des altérations secondaires, bien que plus limitées en terme de fréquence, mais jouant aussi un rôle dans la pathogénie des carcinomes vésiculaires notamment les altérations des voies β-caténine47,HIF1α48,49, FOXO350 et NF-κB.
c. NF-κB
La voie NF-κB intervient dans la réponse inflammatoire liée à l’oncogenèse51. Des études récentes montrent qu’elle contrôle les voies de signalisation et anti-apoptotique des cellules thyroïdiennes tumorales52,53. Elle est aussi impliquée dans la régulation positive de l’expression de plusieurs protéines oncogéniques par ailleurs aussi régulées par la voie MAP-kinase. De plus, RET-PTC, RAS et BRAF (voie MAP-kinase) peuvent aussi activer cette voie dans les cancers thyroïdiens. Par un mécanisme non encore élucidé, la mutation BRAF V600E est à l’origine d’une dégradation de IκB (et par conséquent une activation de NF-κB) indépendamment de MEK-ERK dans les cellules thyroïdiennes tumorales54. Le couplage de BRAF V600E à la voie NF-κB et à la voie MEK-ERK valide les découvertes sur l’inhibition simultanée des 2 voies (inhibiteurs de MEK et NF-κB) comme étant capable d’inhiber la prolifération des cellules tumorales thyroïdiennes présentant une mutation BRAF V600E55.
d. WNT-β-caténine
La voie WNT-β-caténine intervient dans la croissance et la prolifération cellulaires mais aussi dans la différenciation des cellules souches56. Dans les cancers thyroïdiens, l’activation de la voie WNT-β-caténine est souvent secondaire à des mutations de CTNNB1 (qui code pour la β-WNT-β-caténine), en particulier dans les carcinomes peu différenciés et les CAT57,58 semblant alors jouer un rôle dans l’agressivité des tumeurs thyroïdiennes59. Une activation paradoxale de cette voie peut survenir secondairement à l’activation de la voie PI3K-AKT dans les cancers thyroïdiens (notamment en cas de translocation de RET-PTC)60–62. De plus , CTNNB1 est un composant majeur du complexe de jonction et d’adhésion cellule-cellule E-cadhérine et son implication dans le phénomène de transition épithélio-mésenchymateux est démontrée63.
28
e. Autres voies
L’implication d’autres voies est aussi rapportée dans l’oncogenèse thyroïdienne : RASSF1-MST1-FOXO364, HIF1α48,65 et celle du récepteur à la TSH66,67.
B. Modèle de progression tumorale
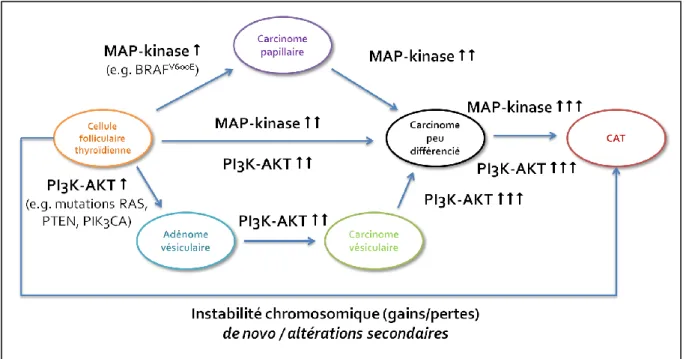
Figure 19 : Modèle de progression tumorale thyroïdien (d’après Xing39)
L’activation de la voie MAP-kinase est secondaire à des altérations génétiques (comme par exemple la mutation BRAF V600E). Les altérations de cette voie surviennent principalement dans les carcinomes papillaires. Parallèlement, l’activation de la voie PI3K-AKT par altération de PTEN ou de PIK3CA est le driver oncogénique privilégié des carcinomes vésiculaires. À mesure que les altérations génétiques s’accumulent, des altérations secondaires peuvent aussi se surajouter, facilitant la transformation des carcinomes vésiculaires et papillaires en carcinomes peu différenciés puis en CAT39. Bien que les altérations conjointes des deux voies soient retrouvées dans des études sur des CAT, suggérant une possible dédifférenciation d’un carcinome thyroïdien différencié, certaines anomalies moléculaires sont retrouvées uniquement dans les CAT comme des gains récurrents en 3q, 20q, de 3p13-14 et 11q13 ou des pertes en 7q, Xp ou de 5q11-3168,69. Caractérisés par une grande instabilité chromosomique peu retrouvée dans les formes différenciées, il est difficile de faire la part entre évènements oncogéniques conducteurs et évènements secondaires.
C. Autres altérations moléculaires rencontrées dans les CAT
a. Gains, amplifications, délétions
Les principales données de la littérature sur le sujet sont résumées dans les tableaux ci-dessous :
Année Nombre de
cas Résultats Réf.
1999 11
Gains 7p22-pter (31%), 8q22-qter (23%), 9q34-qter (23%)
Gènes impliqués dans ces régions : PDGFRα, MYC, ABL1, VAVZ (lien entre altération en nombre de ces gènes et agressivité des CAT non établis) 70 2000 21 Pertes alléliques en 1q (40%), 9p (58%), 11p (33%), 11q, (33%), 17p (44%), 17q (43%), 19p (36%), and 22q (38%) 71 2002 15 Gains 3p13-14 et 11q13 et perte 5q11-31
Gènes impliqués dans ces régions : Cycline D1, FOSL1
69
2004 7
Gains 20p, 20q et perte Xp (86%) et gains 3q, 5p (71%)
Gènes impliqués dans ces régions : PI3K, BCL6, SST (3q) et MMP9, MMP24, STK15 (3q)
68
Figure 20 : Principaux gains et pertes chromosomiques dans les CAT rapportés dans la littérature
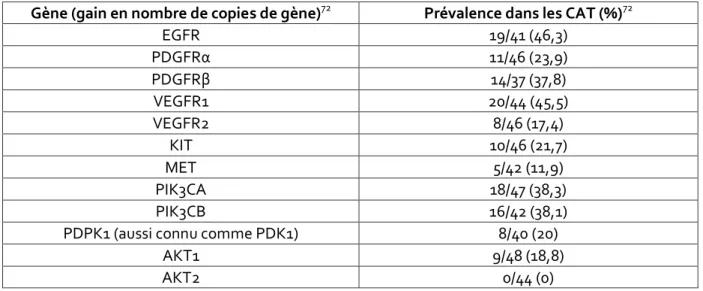
Gène (gain en nombre de copies de gène)72 Prévalence dans les CAT (%)72
EGFR 19/41 (46,3) PDGFRα 11/46 (23,9) PDGFRβ 14/37 (37,8) VEGFR1 20/44 (45,5) VEGFR2 8/46 (17,4) KIT 10/46 (21,7) MET 5/42 (11,9) PIK3CA 18/47 (38,3) PIK3CB 16/42 (38,1)
PDPK1 (aussi connu comme PDK1) 8/40 (20)
AKT1 9/48 (18,8)
AKT2 0/44 (0)
Figure 21 : Principaux gains en nombre de copies de gène dans les CAT rapportés dans la littérature
b. Translocations
Seule la translocation RET-PTC (connue dans les carcinomes papillaires) a été décrite dans les CAT sur 3 cas d’une série de 51 CAT. Ces derniers présentaient une composante de carcinome papillaire et par conséquent la présence de cette translocation comme étant propre à la composante anaplasique est difficile à affirmer72. Cette translocation aboutit à la genèse d’une oncoprotéine
30 chimérique responsable de l’activation des voies MAP-kinase et PI3K-AKT62,73. La translocation PAX8/PPARγ est décrite dans les formes différenciées mais n’est pas rapportée dans les CAT74.
c. Mécanismes épigénétiques
Quelques études portent sur ces mécanismes dans les CAT :
Année Nombre de
cas Résultats Réf.
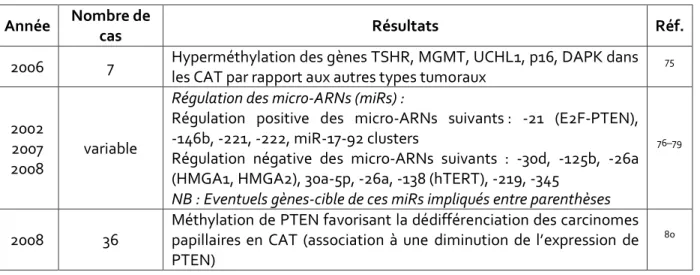
2006 7 Hyperméthylation des gènes TSHR, MGMT, UCHL1, p16, DAPK dans les CAT par rapport aux autres types tumoraux
75
2002 2007 2008
variable
Régulation des micro-ARNs (miRs) :
Régulation positive des micro-ARNs suivants : -21 (E2F-PTEN), -146b, -221, -222, miR-17-92 clusters
Régulation négative des micro-ARNs suivants : -30d, -125b, -26a (HMGA1, HMGA2), 30a-5p, -26a, -138 (hTERT), -219, -345
NB : Eventuels gènes-cible de ces miRs impliqués entre parenthèses
76–79
2008 36
Méthylation de PTEN favorisant la dédifférenciation des carcinomes papillaires en CAT (association à une diminution de l’expression de PTEN)
80
Figure 22 : Principaux mécanismes épigénétiques dans les CAT rapportés dans la littérature
D. Un exemple de récepteur à activité tyrosine kinase : le point sur ALK
Le gène ALK (Anaplastic Lymphoma Kinase), situé sur le chromosome 2, au niveau du locus 2p23, code pour un récepteur à activité tyrosine kinase. Il a été identifié pour la première fois à la fin des années 1980 dans les lymphomes anaplasiques à grandes cellules, en tant que partenaire de fusion de la nucléophosmine dans le cadre d’une translocation chromosomique t(2;5)81,82. Depuis, la description de tumeurs présentant des réarrangements de ALK (avec d’autres partenaires) n’a cessé de croître : lymphome B diffus à grandes cellules, plasmocytome extra-médullaire, tumeur myofibroblastique inflammatoire, carcinome broncho-pulmonaire non à petites cellules, neuroblastome,…83 Les premiers réarrangements du gène ALK dans la thyroïde ont été identifiés dans 10 / 19 cas (52,6%) de carcinomes papillaires thyroïdiens chez des adultes ayant survécu à la bombe atomique, démontrant ainsi son rôle majeur dans la carcinogenèse induite par les radiations dans la thyroïde84. L’équipe de Bergonié a d’ailleurs décrit un réarrangement de ALK dans un CAT développé sur un carcinome papillaire85 qui s’est avéré être un réarrangement entre ALK et le gène de la striatine STRN86.ALK est un récepteur à activité tyrosine kinase qui présente des similitudes avec les récepteurs de la sous-famille des récepteurs à insuline. Il joue un rôle important dans le développement cérébral et est physiologiquement abondamment exprimé dans le système nerveux central pendant
l’embryogenèse mais est cependant focalement exprimé chez l’adulte au niveau de l’intestin grêle, du testicule et du cerveau87. Les fonctions physiologiques de ce récepteur ne sont pas bien connues. Les translocations impliquant ALK sont le résultat de la fusion de la partie codant pour la portion intracytoplasmique du gène ALK et de la partie codant pour la portion N-terminale d’un gène partenaire (STRN ou EML4) avec formation d’une protéine chimérique fonctionnelle. La dimérisation des portions N-terminales de STRN ou de EML4 est essentielle dans le potentiel oncogénique de cette protéine de fusion car elle entraîne l’autophosphorylation et l’activation des domaines tyrosine kinase de la protéine chimérique provoquant ainsi une activation des voies de signalisation d’aval comme PI3K-AKT-mTOR, RAS-MEK-ERK et PLCγ-PIP2-IP3 ; ces voies contrôlant les processus cellulaires clés de la survie cellulaire, la migration cellulaire et le remodelage cellulaire88.
Figure 23 : Structure du récepteur ALK
Dans les carcinomes broncho-pulmonaires (CBP), les réarrangements de ALK intéressent 3,7% des carcinomes non à petites cellules et sont plus fréquents chez les non-fumeurs par rapport aux fumeurs (de l’odre de 9,7% versus 3,5%89). Le crizotinib représente aujourd’hui une thérapeutique ciblée standard dans les CBP non à petites cellules présentant une translocation de ALK. De plus, 50 à 60% des tumeurs myofibroblastiques inflammatoires présentent un réarrangement de ALK par FISH avec une bonne corrélation avec l’immunohistochimie90.
12. Evolution et pronostic
Le CAT est un carcinome d’une très grande malignité progressant rapidement tant sur le plan local qu’à distance. Il est d’ailleurs considéré comme le cancer le plus agressif de l’espèce humaine. La
32 survie moyenne à 5 ans est comprise entre 0 et 14% et la médiane de survie est évaluée entre 2,5 et 6 mois22,91–94.
Plusieurs études s’intéressent d’ailleurs aux facteurs pronostiques des CAT dont les principales sont résumées dans le tableau ci-dessous :
Année Pays Nombre de patients
Facteurs pronostiques statistiquement significatifs - (facteur péjoratif) / + (facteur protecteur) Réf.
2010 France 26 Âge > 75 ans(-) Atteinte ganglionnaire (-) Envahissement capsulaire (-) Sexe féminin (-) 95 2008 États-Unis 261 Maladie métastatique (-) Taille tumorale > 7 cm (-)
Chirurgie avec ou sans radiothérapie (-)
96
1999 Chine 28
Absence de localisation à distance au diagnostic (+) « Jeune » âge (+) Taille tumorale < 6 cm (+) 92 1997 États-Unis 251 Âge < 60 ans (+) Tumeur intra-thyroïdienne (+)
Utilisation combinée chirurgie et radiothérapie (+)
97
1995 États-Unis 21 Sexe féminin (+)
Taille tumorale < 6 cm (+)
98
1990 États-Unis 121 Absence de métastase (+) 27
Figure 24 : Tableau des principaux facteurs pronostiques des CAT
Les métastases à distance (pourcentage médian entre parenthèses) surviennent au niveau pulmonaire (37,2%), médiastinal (25%), hépatique (10,1%), rénal (5,3%), cardiaque et surrénalien (5,2%) ainsi que cérébral (4,4%)99.
Les causes de décès rapportées incluent les métastases à distance dans 51,5% des cas (12-68%), les complications locales dans 23,7% (5-37%) ou les deux dans 26,2% (25-51%)99.
Un indice pronostique93, développé à partir d’une série de 44 patients pris en charge entre 1976 et 1999 dans une même institution, est rapporté. Cet indice est une combinaison de 4 facteurs de risque :
1 Taille tumorale > 5 cm 3 Métastases à distance
Le taux de survie globale à 1 an de la série est de 16%. Les patients ayant un indice pronostique inférieur ou égal à 1 présentent un taux de survie à 6 mois égal à 62% contre 33% pour la série complète. Les patients avec un indice égal à 3 ou 4 décèdent dans les 6 et 3 mois, respectivement.
13. Principes généraux des thérapies conventionnelles
La stratégie de prise en charge des CAT dépend du stade (IV-A, IV-B, IV-C) de la maladie. Un traitement multimodal consistant en une chirurgie (si tumeur et patient opérables) combinée à une radio-chimiothérapie est généralement recommandé ; les soins palliatifs venant en appui dans la prise en charge des CAT.
Schématiquement, la prise en charge peut se résumer par l’algorithme suivant :
RT : radiothérapie externe (une radiothérapie par modulation d'intensité est recommandée) Chimio : chimiothérapie (conventionnelle ou thérapie ciblée)
Figure 25 : Algorithme du traitement initial recommandé pour les patients présentant un CAT
A. Place de la chirurgie
La chirurgie est la pierre angulaire du traitement et est le traitement de première intention pour les stades IV-A et les stades IV-B (dont l’extension extra-thyroïdienne permet tout de même une résection complète) ; l’objectif n’étant pas une chirurgie de réduction tumorale mais une chirurgie avec résection complète. Elle ne doit pas compromettre le fonctionnement anatomique des structures cervicales ; la cause la plus fréquente de décès étant secondaire à l’envahissement de structures vitales cervicales. Elle s’envisage donc dans un but curatif avec une thyroïdectomie totale et un curage ganglionnaire pour les stades IV-A, ou une résection monobloc en marges macroscopiquement saines pour les stades IV-B résécables ; soit en première intention soit après une radio-chimiothérapie néo-adjuvante si la tumeur est secondairement résécable. Enfin, elle peut s’envisager de manière palliative, dans un but de sauvetage et de libération des voies aériennes (trachéotomie ou chirurgie de décompression)8,100.
34
B. Place de la radiothérapie
Des études portant sur la radiothérapie dans les CAT montrent son intérêt dans la réduction de la morbidité et de la mortalité des complications loco-régionales. Elle doit être employée au regard de la résécabilité chirurgicale. L’irradiation hyper-fractionnée accélérée est utilisée dans les CAT de croissance rapide101. Elle est cependant pourvoyeuse d’une importante toxicité102,103. L’utilisation de la radiothérapie par modulation d'intensité est préférable104,105. La survie est statistiquement augmentée par l'utilisation de la radiothérapie dans 71 % des 18 études rapportées dans une revue de la littérature99. La dose optimale évaluée est de 40 Gy (gray). Les doses palliatives sont à adapter en fonction de l’état général et de l’extension de la maladie99.
C. Place de la chimiothérapie conventionnelle
Il semble exister une supériorité de l’association doxorubicine + cisplatine par rapport à l'utilisation de la doxorubicine seule. La survie à long terme est augmentée chez les patients de stade IV-A et IV-B traités par chimiothérapie conventionnelle cytotoxique combinée à une radiothérapie par modulation d'intensité99. Dans les stades métastatiques (IV-C), la chimiothérapie permet d'augmenter la survie chez les patients répondeurs et doit être envisagée chez les patients en bon état général souhaitant une approche thérapeutique agressive8.
14. Intérêt des thérapies ciblées émergentes
Du fait du caractère réfractaire des CAT aux thérapies conventionnelles (chimiothérapie, radiothérapie et iodothérapie [131I])106, de nouvelles approches et solutions thérapeutiques sont aujourd’hui nécessaires. Les patients à un stade avancé ou métastatique souhaitant une approche thérapeutique agressive doivent être encouragés à participer à des essais cliniques du fait de la rareté de ce sous-type histologique de carcinome thyroïdien ainsi que du fait du manque de données disponibles sur l'amélioration de la survie et de la qualité de vie sous thérapies systémiques ciblées8. Plusieurs essais de thérapies ciblées sont parus dans la littérature, même si la plupart d'entre eux intéressent de petites cohortes. Les essais sur lignées cellulaires sont encore plus nombreux et ne sont donc pas détaillés dans le tableau ci-après.
Molécule Résultats
sorafenib
Inhibiteur de tyrosine kinase par action sur le récepteur au facteur de croissance de l’endothélium vasculaire : VEGFR2 (vascular endothelial growth facteur receptor 2), le récepteur β au facteur de croissance plaquettaire : PDGFRβ (platelet-derived growth factor receptor)107 ;
Propriétés anti-angiogéniques107.
Essai de phase II : 1 patient atteint de CAT
Bénéfice clinique global de 77%, médiane de survie sans progression de 79 semaines et réduction moyenne de 70 % du taux de thyroglobuline sérique108. Mais progression sous traitement (arrêt après 4 jours du fait de complications)108 ; Essai de phase II multicentrique : 20 patients atteints de CAT
Réponse partielle chez 2 patients (10%) et stabilisation de la maladie pour 5 patients (25%). Durée de réponse pour les deux patients répondeurs : 10 et 27 mois. Survie sans progression médiane de 1,9 mois avec médiane et survie à un an respectivement de 3,9 mois et 20 %107.
sunitinib
Inhibiteur de multiples récepteurs à activité tyrosine kinase incluant les récepteurs du facteur de croissance endothélial vasculaire (VEGFR2, VEGFR1 et VEGFR3), les récepteurs du facteur de croissance plaquettaire (PDGFRα et PDGFRβ) ainsi que le facteur neurotrophe dérivé de la glie (GDNF)109.
Deux cas rapportés dans la littérature :
- Réduction tumorale spectaculaire d’un CAT secondaire survenu sur une cicatrice de thyroïdectomie pour carcinome thyroïdien différencié. Réponse tumorale au niveau cervical non corrélée à l’efficacité au niveau des métastases pulmonaires qui sont demeurées stables110;
- Réduction tumorale significative chez un patient traité par radiothérapie par modulation d'intensité complétée par l’association d’une chimiothérapie conventionnelle au sunitinib avec réponse complète et persistance de la réponse thérapeutique après 18 mois de suivi111.
pazopanib
Puissant inhibiteur de la tyrosine-kinase des récepteurs du facteur de croissance endothélial vasculaire (VEGFR2, VEGFR1 et VEGFR3), des récepteurs du facteur de croissance plaquettaire (PDGFRα et PDGFRβ) et du récepteur du facteur de cellule souche (c-KIT).
Essai de phase II :
Régressions temporaires notées chez certains patients et activité in vivo (pré-clinique) encourageante mais aucune réponse selon les critères RECIST. Survie sans progression médiane de 62 jours et médiane de survie globale à 111 jours. Association pazopanib + paclitaxel semble plus prometteuse112.
axitinib
Puissant inhibiteur des récepteurs à activité tyrosine kinase pour le facteur de croissance de l’endothélium vasculaire (VEGFR2, ainsi que VEGFR1 et VEGFR3). Essai de phase II : 60 patients dont 3 atteints de CAT
Réponse partielle pour 1 des 3 patients avec stabilisation de la maladie observée pour les 2 autres patients113.
36 vémurafénib
Puissant inhibiteur de l’oncogène BRAF.
Réponse spectaculaire décrite chez un homme de 51 ans présentant un CAT métastatique porteur d’une mutation BRAF V600E avec contingent différencié de type « papillaire » et réfractaire aux thérapies conventionnelles. Réponse thérapeutique spectaculaire avec amélioration clinique en seulement 6 jours et excellente réponse radiologique après 28 jours de traitement114.
imatinib
Inhibiteur de c-KIT, des récepteurs du facteur de croissance plaquettaire (PDGFR) et de l’activité tyrosine kinase de la protéine chimérique BCR-ABL.
Essai de phase II : 11 patients atteints de CAT (PDGFR+ en IHC)
Absence de réponse complète sur 8 patients suivis. Réponse partielle chez 2 patients et stabilité chez 4 patients. Survie sans progression à 6 mois à 36% et survie globale à 45%115.
erlotinib
Antagoniste de l’EGFR (Epidermal Growth Factor Receptor). Deux cas de réponses remarquables rapportés dans la littérature :
Une patiente de 65 ans d’origine japonaise atteinte d’un CAT avec mutation somatique L858R de l’exon 21 après 6 mois de traitement116 ;
Une patiente de 69 ans atteinte d’un carcinome oncocytaire récidivant avec foyers focaux anaplasiques présentant une positivité focale en IHC pour l’anticorps EGFR ainsi que 2 mutations ponctuelles silencieuses des exons 18 et 20117.
gefetinib
Antagoniste de l’EGFR (Epidermal Growth Factor Receptor). Essai de phase II : cohorte mixte dont 19% de CAT
Absence de réponse mais stabilisation de la maladie chez 12% des patients à 12 mois. Médiane de survie sans progression de 16 semaines pour les patients atteints de CAT118.
fobretabulin
Agent déstabilisant les microtubules.
Essai de phase II : 26 patients atteints de CAT
Stabilisation de la maladie chez 7 (26,9%) des 26 patients119.
III.
INTÉRÊTS ET OBJECTIFS DE L’ÉTUDE
Bien que les connaissances actuelles concernant la pathogénie moléculaire des CAT voient l'émergence de nombreux essais cliniques s'intéressant aux cibles pharmaceutiques existantes, les résultats, à ce jour, ne permettent pas d'amélioration significative du pronostic (malgré l’existence de quelques succès individuels) et les mécanismes moléculaires précis de l’oncogenèse et de la dédifférenciation des CAT demeurent toujours inconnus.
1
èrepartie : Prévalence et intérêt de la recherche des réarrangements de
ALK dans les CAT
A. Contexte
La publication récente par l’équipe de l’institut Bergonié d’une réponse thérapeutique spectaculaire sous crizotinib chez une patiente de 71 ans atteinte d’un CAT métastatique présentant un réarrangement de ALK détecté par FISH avec réponse > 90% des lésions pulmonaires (critères RECIST 1.1)85 a initié cette étude. Les premières altérations du gène ALK publiées dans les CAT correspondent à des mutations ponctuelles au niveau de l’exon 23 avec une prévalence de 11,11%, sans mutation par ailleurs dans les tissus normaux ou dans les lésions différenciées adjacents42. Les premiers réarrangements du gène ALK dans la thyroïde ont été identifiés par la suite dans environ 50% des cas (10/19) d’une série de carcinomes papillaires thyroïdiens chez des adultes ayant survécu à la bombe atomique. Ces résultats démontrent ainsi le rôle majeur de ALK dans la carcinogenèse thyroïdienne induite par les radiations120. Des partenaires de fusion de ce gène ont ensuite été identifiés : tout d’abord EML4 (Echinoderm Microtubule-associated protein-Like 4) dans un carcinome papillaire en l’absence de toute mutation NRAS, BRAF et de réarrangement de RET/PTC121 puis le gène de la striatine (STRN), nouveau partenaire récurrent de ALK dans les carcinomes thyroïdiens86. Ce dernier a été retrouvé comme partenaire de ALK dans 2 carcinomes papillaires parmi 45 cas de carcinomes thyroïdiens différenciés86. Une étude en suivant valide son existence sur une large étude retrouvant une prévalence pour cette translocation de 4 cas (1,6%) sur 256 carcinomes papillaires, 3 cas (9%) sur 35 carcinomes peu différenciés et 1 cas (4%) sur 24 CAT122. L’exemple de cette réponse spectaculaire85 et les données in vitro publiées122 démontrent que cette protéine de fusion confère une sensibilité aux inhibiteurs de ALK existants (crizotinib).
38
B. Objectifs
L’objet principal de cette première partie est de rapporter la prévalence du réarrangement de ALK par technique FISH dans une large série de CAT. La technique FISH (technique de référence) sera associée à une technique de pré-screening par immunohistochimie ALK (clone D5F3). Enfin, si l’échantillon présente une composante mieux différenciée (bien et/ou peu différenciée), les techniques FISH et immunohistochimique seront aussi appliquées à cette/ces composante(s).
Les intérêts poursuivis sont les suivants :
- permettre une meilleure connaissance de la prévalence de ce réarrangement dans ce carcinome thyroïdien rare ;
- étudier la corrélation entre technique immunohistochimique et technique FISH afin d’apprécier l’utilité d’un pré-screening par immunohistochimie ALK (clone D5F3).
Enfin, les cas positifs en FISH et, pour lesquels le matériel disponible (bloc de paraffine) reste suffisant, bénéficieront d’une recherche par RT-PCR du transcrit de fusion récemment décrit par l’équipe de l’institut Bergonié entre le gène ALK et le gène de la striatine (STRN) ainsi que les transcrits de fusion également décrits dans les carcinomes thyroïdiens (plus fréquents dans les CBP non à petites cellules) entre le gène ALK et le gène EML4.
2
èmepartie : Étude par séquençage de nouvelle génération (NGS) de cibles
thérapeutiques
potentielles
dans
les
CAT
avec
corrélations
immunohistochimiques (IHC)
A. Contexte
Au sein des mutations somatiques, on distingue les mutations conductrices (driving mutations), conférant aux cellules un potentiel de croissance et de survie, des mutations de passage (passenger mutations). Une mutation de passage peut parfois devenir une mutation conductrice et induire la récidive, sous l’effet, par exemple, d’une modification du micro-environnement tumoral secondaire à un traitement par chimiothérapie123. Cependant, un nombre limité de ces altérations génomiques sont actuellement cliniquement significatives. La récente compréhension de nouveaux mécanismes moléculaires de cancérogenèse permet l’identification de certaines mutations conductrices ou de biomarqueurs permettant une optimisation thérapeutique (thérapie ciblée). Avant l’apparition du NGS, chaque altération génomique nécessitait le
développement d’une méthode de détection spécifique124. L’analyse par NGS peut détecter un plus large panel d’altérations génomiques avec une haute sensibilité et une spécificité croissante125. Une mutation présente dans une minorité (< 10 %) de cellules de l’échantillon à analyser ne sera pas détectée par les techniques habituelles de séquençage124. Dans le cadre de la génétique somatique, des protocoles de séquençage ciblés sont désormais élaborés avec pour objectif d’analyser pour chaque type de cancer un panel de gènes en un seul séquençage.
B. Objectifs
Nous avons donc émis l’hypothèse que le NGS serait un outil approprié pour l’étude du profil génétique des tumeurs afin de :
- mieux caractériser le profil mutationnel et l’oncogenèse des CAT ;
- d’identifier de nouvelles mutations conductrices pour avancer dans la compréhension de l’oncogenèse des CAT ;
- de détecter de possibles altérations candidates aux thérapies ciblées chez les patients atteints de CAT.
Pour cela, nous avons appliqué la technique de NGS centrée sur les 50 gènes du cancer panel Ion AmpliSeqTM Cancer Hotspot Panel v2 (Ion Torrent, Life Technologies, Foster City, CA) sur 144 cas de CAT. Cette cohorte est la plus large série décrite à ce jour.
Nous avons couplé à cette étude génique une analyse immunohistochimique (p53, PTEN, C-MET, BRAF) ciblant les protéines fréquemment altérées dans les cancers ainsi que les protéines pouvant faire l’objet (comme ALK) d’une thérapeutique ciblée. Cette approche permet d’une part de tester la corrélation entre altération génique et niveau protéique pour BRAF, TP53 et PTEN mais permet aussi d’établir des liens possibles entre la présence de certaines mutations et les conséquences d’expression immunohistochimique notamment de PTEN et de p53.
Enfin, dans les cas analysables en NGS et pour lesquels aucune mutation n’est retrouvée, une analyse par FISH à la recherche d’un réarrangement du gène RET a été effectuée afin d’essayer d’associer à ces cas un substratum physiopathologique autre que mutationnel. En effet, des translocations RET/PTC (provoquant une activation constitutive de l’activité tyrosine kinase de RET) ont été décrites et sont maintenant bien connues dans les carcinomes thyroïdiens différenciés de type papillaire mais aussi dans les adénomes.
40
IV.
MATÉRIELS ET MÉTHODES
1. Recueil des prélèvements
Le matériel utilisé pour cette étude a été collecté de manière rétrospective grâce au réseau national pour la prise en charge des cancers réfractaires de la thyroïde (TUTHYREF). Cent quarante-quatre échantillons ont été collectés de manière rétrospective (période de 1973 à 2014) dans les 10 centres ayant participé au recueil : CHU de Bordeaux, Tours, Lille et Paris, CLCC de Bordeaux (Institut Bergonié), Clermont-Ferrand (Institut Jean Perrin), Caen (Institut François Baclesse), Paris (Institut Gustave Roussy) ainsi que 2 laboratoires libéraux : Valence (Drôme) et Pau (Pyrénées-Atlantiques). Tous les échantillons ont été fixés dans du formol tamponné à l’exception de 23 cas fixés en formol acétique et 3 cas fixés dans du Bouin « de Hollande ». Des Tissue Micro-Arrays (TMA) ont été réalisés pour 110 cas dont les cas non fixés en formol tamponné (TMA à part). Trente-quatre cas n’ont pas été intégrés aux TMAs du fait de l’exigüité du matériel communiqué ; les examens ont alors été réalisés sur coupe entière. L’ensemble des techniques de pathologie et de biologie moléculaire a été réalisé dans l’unité de pathologie moléculaire du département de biopathologie de l’institut Bergonié (CLCC de Bordeaux).
2. Classification histologique des échantillons
Les diagnostics positifs histologiques ont été portés par 2 pathologistes de manière indépendante selon les critères OMS5 (Benjamin Bonhomme - BB et Isabelle Soubeyran - IS). Le diagnostic des tumeurs peu différenciées a quant à lui été effectué selon l’algorithme de la classification de Turin6. Les tumeurs classées dans la catégorie anaplasique ont ensuite été rangées en sous-types histologiques comme décrits ci-dessus (cf. aspects microscopiques). Les tumeurs bien différenciées ont été classées en carcinome vésiculaire ou en carcinome papillaire.
3. Construction des Tissue Microarrays (TMAs)
La technique des tissue microarrays (TMAs) permet d’obtenir des profils d’expression protéiques par immunohistochimie de plusieurs tumeurs disposées au sein d’un même bloc de paraffine grâce à la technique de fabrication mise au point par Kononen et al. en 1998126,127. L’avantage de cette technique est de réduire le coût et le temps technique en diminuant en particulier la quantité d’anticorps utilisée, de diminuer la variabilité des techniques en traitant différentes tumeurs sur une même lame dans les mêmes conditions, et de pouvoir réaliser plusieurs coupes sériées successives,