L’UNIVERSITE MOHAMMED V-AGDAL
FACULTE DES SCIENCES
RABAT
N° d’ordre: 2589THESE DE DOCTORAT
Présentée parFadila Amraoui
Discipline: BiologieSpécialité: Virologie - Entomologie
Le moustique Culex pipiens, vecteur potentiel des
virus West Nile et fièvre de la vallée du Rift dans la
région du Maghreb
Soutenue le 10 juillet 2012Devant le jury composé de: Président:
Saaïd Amzazi, Professeur à la faculté des Sciences, Rabat
Examinateurs:
Youssef Bakri, Professeur à la faculté des Sciences, Rabat
Anna-Bella Failloux, Directeur du laboratoire Arbovirus et Insectes Vecteurs, Institut Pasteur, Paris, France M’hammed Sarih, Directeur du laboratoire Maladies Vectorielles, Institut Pasteur du Maroc
Avant propos
Cette thèse a été réalisée dans le cadre d’une collaboration entre le Laboratoire d’Immunologie et Biochimie à la Faculté des Sciences de Rabat, le Laboratoire des Arbovirus et Insectes Vecteurs à l’Institut Pasteur à Paris, France et le Laboratoire des Maladies Vectorielles à l’Institut Pasteur du Maroc.
Les travaux de cette thèse ont été effectués sous la direction de Mr M’hamed Tijane, Mme Anna-Bella Failloux et Mr M’hammed Sarih.
Je remercie vivement Mr M’hamed Tijane, Professeur à la Faculté des Sciences à Rabat et Directeur du Laboratoire Immunologie et Biochimie qui s’est toujours soucié de l’avancement de mes travaux tout au long de ces quatre années. Il a toujours fait preuve d’enthousiasme, de bonne humeur et d’encouragements qui m’ont remotivé dans les périodes difficiles.
Je remercie du fond du coeur Mme Anna-Bella Failloux, Chef du Laboratoire Arbovirus et Insectes Vecteurs à l’Institut Pasteur à Paris aussi bien pour son encadrement exemplaire et complet que pour m’avoir accompagné amicalement et fraternellement dans ce cheminement. Merci pour ses précieux conseils, ses encouragements ainsi que pour les corrections et les relectures de ce manuscrit. Son énergie, ses compétences et sa constante disponibilité m’ont beaucoup aidé pour mener à bien ce travail.
Je remercie chaleureusement Mr M’hammed Sarih, Responsable du Laboratoire des Maladies Vectorielles à l’Institut Pasteur du Maroc, de m’avoir fait confiance et proposé ce sujet alors même que je ne connaissais rien à l’entomologie. Merci pour son dynamisme, son soutien et ses conseils qui m’ont permis de mener à bien cette thèse.
Je remercie le Professeur Saaïd Amzazi, Doyen de la Faculté des Sciences de Rabat, d’avoir accepté de présider ce jury et de critiquer ce travail.
Mes remerciements vont aussi à Mr Youssef Bakri, Professeur à la Faculté des Sciences de Rabat d’avoir eu l’amabilité de lire et de juger ce travail.
Les travaux de cette thèse ont été financés par l’Institut Pasteur à Paris, dans le cadre d’un projet ACIP, sous la référence A-08-2009. Je profite de cette occasion pour remercier l’Institut Pasteur à Paris pour ce financement et aussi pour m’avoir accordé une bourse de stage durant une année au Laboratoire Arbovirus et Insectes Vecteurs.
Je remercie le Centre National de la Recherche Scientifique et Technique de m’avoir accordé une bourse d’excellence pendant 18 mois et ce dans le cadre du programme des bourses de recherche initié par le ministère de l'Éducation Nationale, de l'Enseignement Supérieur, de la Formation des Cadres et de la Recherche Scientifique.
J’adresse toute ma gratitude et reconnaissance à tous les collègues des Instituts Pasteur à Alger et à Tunis qui ont participé activement à ce projet ACIP notamment, Messieurs Ali Bouattour, Ghazi Krida, Zoubir Harrat et Said Boubidi.
Je remercie Mme Michèle Bouloy de m’avoir accueilli dans son unité de Génétique Moléculaire des Bunyavirus à l’Institut Pasteur à Paris.
Quoique je fasse, je ne peux remercier assez tous les membres du Laboratoire Arbovirus et Insectes Vecteurs: Marie Vazeille, Laurence Mousson, Karima Zouache, Jocelyne Alexandre et Camilo Arias Goeta. Merci pour ces qualités humaines et scientifiques. Merci à Louis Lambrechts, parti sans trop s’éloigner, pour ses précieux conseils.
Je remercie Melle Najma Boudebouch du Laboratoire des Maladies Vectorielles pour son aide et le temps qu’elle a consacré pour moi.
Je tiens à remercier Mme Chafika Faraj de l’Institut National d’Hygiène à Rabat et tous les membres de son équipe qui m’ont initié à l’entomologie.
Je remercie tout le personnel de santé publique qui a participé aux prospections des gîtes larvaires à Tanger, Marrakech, Mohammedia et Casablanca. Merci pour leur patience et aide ainsi que pour les récoltes abondantes de larves.
Je ne saurais jamais remercier ma famille et mes amis pour leur soutien permanent, leurs encouragements tout au long de mes études, sans lequel je ne serai jamais arrivée à ce stade de réussite. Comme vous êtes nombreux je ne peux nommer tout le monde, mais je sais que vous vous reconnaitrez.
Travaux scientifiques
Articles publiés:
Fadila Amraoui, Ghazi Krida, Ali Bouattour, Adel Rhim, Jabeur Daaboub, Zoubir Harrat, Said-Chawki Boubidi, Mhamed Tijane, Mhammed Sarih, Anna-Bella Failloux (2012). Culex pipiens, an experimental efficient vector of West Nile and Rift valley fever viruses in the Maghreb region. PLoS ONE 7(5): e36757. doi:10.1371/journal.pone.0036757
Fadila Amraoui, Mhamed Tijane, Mhammed Sarih, Anna-Bella Failloux (2012). Molecular evidence of Culex pipiens form molestus and hybrids pipiens/molestus in Morocco, North Africa. Parasites & Vectors 5: 83.
doi:10.1186/1756-3305-5-83
Communications:
Fadila Amraoui, Ali Bouattour, Ghazi Krida, Zoubir Harrat, Said Boubidi, Mhamed Tijane, Mhammed Sarih, Anna-Bella Failloux. Vector competence of Culex pipiens for West Nile and Rift Valley Fever viruses in the Maghreb region. 8-10 novembre 2011. Institut Pasteur International Network Meeting (Paris, France). Commented Poster.
Fadila Amraoui, Ali Bouattour, Ghazi Krida, Zoubir Harrat, Said Boubidi, Mhamed Tijane, Mhammed Sarih, Anna-Bella Failloux. Vector competence of Culex pipiens for West Nile and Rift Valley Fever viruses in the Maghreb region. 16-18 novembre 2011. Journées Départementales de Virologie de l’Institut Pasteur de Paris (Le Touquet, France). Communication affichée.
Résumé
Le virus West Nile (VWN) et le virus de la fièvre de la vallée du Rift (VFVR) sont deux virus à ARN, transmis essentiellement par des moustiques.
Le VWN (Flaviviridae, Flavivirus) est largement reparti dans le monde. Il est maintenu au sein d’un cycle enzootique faisant intervenir les oiseaux comme hôtes amplificateurs. L'infection de l'homme et des équidés est accidentelle et les deux hôtes sont considérés comme des culs de sacs épidémiologiques. Par ailleurs, le VFVR (Bunyaviridae, Phlebovirus) est présent en Afrique sub-saharienne, en Egypte et dans la péninsule arabique. Le cycle de transmission du VFVR est complexe, varie selon la région géographique et touchant essentiellement le bétail et l’homme.
Le moustique Culex pipiens, largement reparti en Afrique du Nord, a été incriminé dans la transmission de VWN et du VFVR dans d’autres régions du monde. Dans ce travail, les populations de Cx. pipiens récoltées au Maroc, en Algérie et en Tunisie ont été infectées avec le VWN et le VFVR avec un titre viral respectif de 107,8 et 108,5 unité formant plage/mL. Les taux d’infection disséminée (TID) et de transmission (TT) ont été évalués à j14 et j21 post-infection. Toutes les populations testées ont été capables de disséminer le VWN au-delà du tube digestif ainsi que libérer des particules virales au niveau de la salive. Les TID varient de 59.1% à 100% et les TT de 25% à 83.3 %. Pour le VFVR, 69,2% des populations testées développent une infection disséminée avec des TID variant de 6.2% à 38,1%, et 77,8% présentaient des salives infectieuses avec des TT allant de 10% à 47.1%.
Par ailleurs, l’analyse moléculaire basée sur la diversité génétique de la région flanquante du microsatellite CQ11 a montré que Cx pipiens existe au Maroc sous la forme pipiens, la forme molestus et des formes hybrides pipiens/molestus. Ces différentes formes sont morphologiquement semblables mais présentent des caractères bio-écologiques différents pouvant influencer la transmission vectorielle du VWN et du VFVR.
Cx. pipiens est bon vecteur en conditions expérimentales pour le VWN et dans une
moindre mesure, pour le VFVR. Cependant, les recherches doivent se poursuivre afin d’évaluer les compétences vectorielles respectives des différentes formes de Cx.
pipiens ainsi que leurs préférences trophiques pour mieux appréhender leur rôles
épidémiologiques. Ces données sont essentielles pour mesurer le risque d’introduction et d’installation de ces arboviroses dans le Maghreb, les pays du pourtour méditerranéen et également, en Europe.
Mots clés: Culex pipiens, virus West Nile, virus de la fièvre de la vallée du Rift,
Abstract
West Nile virus (WNV) and Rift Valley fever virus (RVFV) are two emerging arboviruses causing epidemics outside their natural range of distribution.
WNV (Flaviviridae, Flavivirus) is one of the most broadly distributed arboviruses in the world, being found on all continents. Recent outbreaks of WNV were recorded all over the Mediterranean region. WNV has been isolated from horses and birds in Algeria, Morocco and Tunisia, indicating an active circulation of the virus in this region. Emergences may occur when adequate vector and susceptible vertebrate host populations intersect under permissive climatic conditions. Moreover, RVFV (Bunyaviridae, Phlebovirus) is endemic to countries bordering the Maghreb region. Illegal importations of viremic livestocks along trade routes have been suspected to introduce the virus and initiate local viral transmission.
Culex pipiens is widely found in North Africa. This species has been incriminated in
the transmission of different arboviruses including WNV and RVFV. In this context, we define the importance of Cx. pipiens as vector of both viruses in the Maghreb region. For such, we experimentally infected field collected populations of Cx. pipiens from North Africa with WNV and RVFV at titers of 107,8and 108,5plaque forming units/mL. Disseminated infection and transmission rates were estimated 14-21 days following the exposure to the infectious blood-meal. We show that 14 days after exposure to WNV, all mosquito strains developed a high disseminated infection and were able to excrete infectious saliva. However, only 69.2% of mosquito strains developed a disseminated infection with RVFV Clone 13 strain, and among them, 77.8% were able to deliver virus through saliva. We showed that Cx. pipiens from the Maghreb are efficient experimental vectors to transmit WNV and to a lesser extent, RVFV.
Cx pipiens has two recognized forms ‘‘pipiens’’ and ‘‘molestus’’ which are
morphologically indistinguishable with distinct behaviors and physiologies that may influence their vectorial status. In this study, we prospected for these forms in Morocco by using diagnostic primers designed for the flanking region of microsatellite CQ11. We established the presence of both forms of Cx. pipiens and their hybrids in Morocco.
Our findings should be confronted to parameters describing mosquito ecology and biology. Thus, North Africa should be considered as a bridge region between the Sub-Saharan region where both viruses are endemic circulating within a selvatic cycle and the northern latitudes such as Europe for emergence of vector borne pathogens. Unintentional introductions of birds or animals may have set the stage for the emergence of WNV and RVFV in Europe.
Key words: Culex pipiens, West Nile virus, Rift valley fever virus, vector
Liste des abréviations
Ace2: Acetylcholine estérase 2 ADN: Acide désoxyribonucléique Ae: Aedes
AN: anautogène
ARN: Acide ribonucléique ARNi: ARN interférence ATP: Adénosine triphosphate AU: Autogène
BSA: Bovine serum albumin
C6/36: Cellules de moustique Aedes albopictus COI: Cytochrome oxydase I
Cs: Culiseta Cx: Culex
DC-SIGN: Dendritic Cell-Specific Intercellular adhesion molecule-3-Grabbing Non-integrin
dNTP: Désoxynucléotide triphosphate FITC: Isocyanate de fluorescéine FVR: Fièvre de la vallée de Rift FWN: Fièvre West Nile
Imd: Immune deficiency Jak: Janus kinase L: Leishmania min: Minute mL: Millilitre
NSs: Facteur de virulence P: Plamsodium
PBS: Phsphate buffer salt Ph: Phlebotomus
RE: Reticulum endoplasmique
STAT: Signal Transducer and Activator of Transcription SVF: Serum de veau foetal
UFP: Unité formant plage VUSU: virus Usutu
Vero: Cellules de reins de singe
VFVR: Virus de la fièvre de la vallée de Rift VWN: Virus West Nile
Liste des figures
Figure 1. Mortalité humaine dûe aux maladies vectorielles. Figure 2. Quelques arthropodes vecteurs existants au Maghreb Figure 3. Distribution géographique du virus West Nile
Figure 4. Schéma de la structure (a) et du génome (b) d’un Flavivirus Figure 5. Analyse phylogénétique du virus West Nile
Figure 6. Cycles de transmission du virus West Nile. Figure 7. Cycle de réplication des Flavivirus
Figure 8. Répartition de la fièvre de la vallée du Rift en Afrique, à Madagascar et dans la péninsule arabique chez l’animal et chez l’homme
Figure 9. Schéma de la structure et du génome du virus de la fièvre de la vallée du Rift
Figure 10. Analyse phylogénétique du virus de la fièvre de la vallée du Rift Figure 11. Cycles biologique du virus de la fièvre de la vallée du Rift
Figure 12. Schéma montrant le cheminement du virus dans le corps d’un moustique vecteur
Figure 13. La période d’incubation extrinsèque varie selon la température Figure 14. Cycle biologique de Culex pipiens
Figure 15. Shéma récapitulatif des réactions antivirales chez la drosophile Figure 16. Mécanisme de l’ARN interférence
Figure 17. Immunité antivirale innée et aquise chez l’homme
Figure 18. Sites de récolte de Cx. pipiens au Maroc, en Algérie et en Tunisie Figure 19. Exemples de gîte larvaire de Culex pipiens.
Figure 20. Matériel utilisé lors de l’élevage de Culex pipiens.
Figure 21. Infections expérimentales des moustiques en laboratoire P3
Figure 22. Femelle en cours de récupération de sa salive en utilisant la technique de salivation forcée
Figure 24. Taux de transmission et nombre moyen des particules virales présentes dans la salive de Cx pipiens “Tabarka” infecté oralement par le VWN (A) et le VFVR (B)
Figure 25. Taux d’infection disséminée (A), taux de transmission (B) et nombre moyen de particules virales par salive (C) pour les populations naturelles de
Culex pipiens, 14 jours après l’infection avec le virus West Nile
Figure 26. Taux d’infection disséminée, taux de transmission et nombre moyen de particules virales par salive de Culex pipiens, 14 (A, B, C) et 21 jours (D, E, F) après l’infection avec le virus de la fièvre de la vallée du Rift (souche avirulente Clone 13)
Figure 27. Profils des produits d’amplification du microsatellite CQ11 de Culex
Liste des tableaux
Tableau I. Les cas humains et équins recensés dans la région du Maghreb depuis l’emergence du virus West Nile en 1994
Tableau II. Principales épidemies de la fièvre de la vallée du Rift
Tableau III. Sensibilité des animaux au virus de la fièvre de la vallée du Rift
Tableau IV. Caractères éco-physiologiques des membres du complexe Cx. pipiens Tableau V. Marqueurs moléculaires utilisés pour identifier certains membres du
complexe Cx. pipiens
Tableau VI.Gîtes larvaires échantillonnés en 2010 en Algérie, au Maroc et en Tunisie Tableau VII. Gîtes larvaires échantillonnés dans différentes régions du Maroc durant
l’été 2010
Tableau VIII. Espèces de larves identifiées dans des gites larvaires riches en matières organiques
Tableau IX. Identification moléculaire des populations de Cx. pipiens provenant de Tanger, Casablanca/Mohammedia et Marrakech
Sommaire
Introduction et rappels bibliographiques ... 1
1. La situation des maladies vectorielles dans la région du Maghreb ... 2
1.1. Les maladies vectorielles ... 2
1.2. Les agents infectieux circulants au Maroc, en Algérie et en Tunisie ... 3
1.2.1. Les protozoaires... 4
1.2.2. Les bactéries ... 5
1.2.3. Les arbovirus ... 5
2. Le virus West Nile ... 8
2.1. Historique ... 8
2.2. La structure et le génome ... 9
2.3. Les lignages ... 10
2.4. Le cycle de transmission ... 12
2.5. Le cycle de réplication virale ... 13
2.6. Pathogénèse et vaccin ... 14
3. Le virus de la fièvre de la vallée du Rift ... 16
3.1. Historique ... 16
3.2. La structure et le génome ... 18
3.3. Le cycle de transmission ... 21
3.4. Le cycle de réplication virale ... 22
3.4. Pathogénèse et vaccin ... 23
4. Les vecteurs du VWN et VFVR ... 25
4.1. La transmission vectorielle et la notion de capacité vectorielle ... 25
4.2. Les vecteurs du VWN ... 27
4.3. Les vecteurs du VFVR ... 27
4.4. Le complexe Culex pipiens... 28
4.4.1. Position systématique ... 28
4.4.2. Bio-écologie ... 29
4.4.3. Les membres du complexe Cx. pipiens ... 30
5. L’immunité antivirale ... 34
5.1. Chez le moustique ... 34
5.1.2. La voie Imd ... 34 5.1.3. La voie Jak/STAT... 35 5.1.4. L’ARN interférence ... 35 5.2. Chez l’homme ... 36 6. Objectifs de la thèse ... 38 Matériels et méthodes ... 40
1. Sites de récolte des moustiques ... 41
2. Elevage des moustiques ... 42
3. Infections expérimentales avec les virus WN et FVR ... 44
3.1. Les populations de Culex pipiens ... 44
3.2. Les souches virales ... 45
3.3. Le repas sanguin infectieux ... 45
3.4. La salivation forcée ... 46
3.5. Le titrage des salives ... 47
3.6. L’immunofluorescence indirecte sur squashs de tête ... 47
4. Les analyses statistiques ... 49
5. Taxonomie moléculaire de Culex pipiens au Maroc ... 49
5.1. Populations de Cx. pipiens ... 49
5.2. Extraction de l’ADN génomique ... 50
5.3. Réaction PCR ... 50
Résultats et discussion ... 52
1. Compétence vectorielle de Culex pipiens vis-à-vis du virus West Nile et virus de la fièvre de la vallée du Rift ... 53
1.1. Résultats ... 53
1.1.1. Réceptivité au VWN ... 53
1.1.2. Réceptivité au VFVR ... 57
1.2. Discussion ... 60
Article 1: Culex pipiens, an experimental efficient vector of West Nile and Rift valley fever viruses in the Maghreb region ... 63
2.1. Résultats ... 72 2.2. Discussion ... 74 Article 2: Molecular evidence of Culex pipiens form molestus and hybrids
pipiens/molestus in Morocco, North Africa ... 76
Conclusions et perspectives ... 81
1
2
1. La situation des maladies vectorielles dans la région du Maghreb
1.1. Les maladies vectorielles
Les maladies vectorielles sont des maladies pour lesquelles l’agent infectieux (virus, bactérie, protozoaire ou helminthe) est transmis d’un individu infecté à un autre, principalement par l’intermédiaire d’un arthropode hématophage (insecte ou acarien) (Rodhain & Perez, 1985). Il s’agit d’une transmission biologique ou active car l’agent infectieux accomplit un cycle d’amplification ou de développement au préalable chez l’arthropode vecteur, à la différence d’une transmission mécanique ou passive qui se traduit par un simple transport de l’agent pathogène.
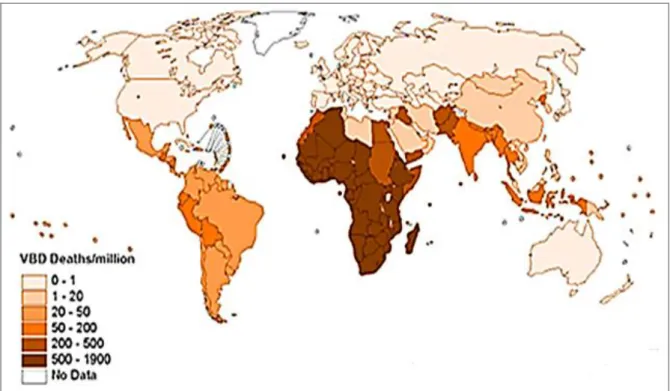
Les maladies vectorielles sont largement répandues en zone intertropicale, elles se rencontrent également en zone tempérée voire septentrionale mais restent relativement rares. Cependant, les maladies vectorielles peuvent générer de fortes mortalités et morbidités chez l’homme (Figure 1; WHO, 2004). A l’exception de certaines maladies humaines comme la dengue urbaine, la plupart des maladies à transmission vectorielle sont des zoonoses (touchent les animaux) où l'homme est le plus souvent un hôte accidentel. Ces maladies ont une importance sanitaire et socio-économique qui s’est accentuée avec les changements que subit le monde. En effet, les changements climatiques et anthropiques déclenchent l’émergence, la réémergence ou la recrudescence inattendue de certaines maladies vectorielles. C’était le cas de l’introduction du VWN (CDC, 1999) en Amérique du Nord, l'apparition du virus de l'encéphalite japonaise en Australie (Mackenzie, 1999) et l’émergence du virus Usutu (VUSU) en Europe centrale (Weissenböck et al., 2001).
3
Figure 1. Mortalité humaine dûe aux maladies vectorielles. La carte montre la mortalité attribuée
aux maladies à transmission vectorielle en fonction des pays (WHO, 2004).
1.2. Les agents infectieux circulants au Maroc, en Algérie et en Tunisie
Dans la région du Maghreb, plusieurs maladies vectorielles sont présentes et importantes sur le plan de la santé publique. Elles sont dûes à des virus, des bactéries ou des protozoaires et sont transmises par des arthropodes vecteurs, principalement des moustiques, des tiques, des phlébotomes, des moucherons (Culicoïdes), des poux ou des puces (Figure 2). La situation relative à ces maladies est abordée ci-dessous selon la nature de l’agent infectieux.
4
Figure 2. Quelques arthropodes vecteurs existants au Maghreb
(a) Moustique (Culicidae), (b) Tique dure (Ixodidae), (c) Tique molle (Argasidae), (d) Phlébotome (Psychodidae) (e) Culicoïdes (Ceratopogonidae), (f) Poux (Pediculidae), (g) Puce (Pulicidae).
1.2.1. Les protozoaires
Dans la région du Maghreb, le paludisme est causé par deux parasites du genre Plasmodium: P. falciparum et P. vivax. Toutes les espèces de Plasmodium sont transmises par les moustiques du genre Anopheles. La Tunisie et le Maroc ont été respectivement certifiés exempts de paludisme en 1979 et en 2010 (Weekly Epidemiological Record, 2010). Quant à l’Algérie, le paludisme y est endémique mais à faible taux de transmission et le pays est en phase d’élimination du parasite (World Malaria report, 2011). Cependant, la région du Maghreb reste vulnérable à la maladie en raison de la persistance de vecteurs et la coexistence d'un réservoir constitué par les cas importés de l’Afrique subsaharienne (Aoun et al., 2010), comme l’attestent les deux cas autochtones à P. falciparum répertoriés au Maroc (EpiSouth Weekly Epi Bulletin, 2010).
Quatre espèces de Leishmania circulent dans la région du Maghreb et sont responsables de leishmaniose cutanée et/ou viscérale: L. infantum (Harrat & Belkaid, 2003; Postigo,2010), L. major (Benikhlef et al., 2004; Chelbi et al., 2009; Rhajaoui, 2011), L. tropica (Guilvard et al., 1991; Kharfi et al., 2003; Mihoubi et al., 2008; Postigo, 2010) et L. killicki, (Rioux et al., 1986; Harrat et al., 2009). Les vecteurs d’importance les plus répandus sont Phlebotomus papatasi, Ph. sergenti et Ph.
5
D’autres protozoaires du genre Babesia et Theileria (Darghouth et al., 1996; El Haj et al., 2002; Bouattour et al., 2004) qui sont transmis par des tiques au bétail constituent une entrave majeure au développement de l’élevage dans la région et dans d’autres régions du monde (Morzaria, 1991).
1.2.2. Les bactéries
Les bactéries sont transmises essentiellement par des tiques, des poux ou des puces et appartiennent aux genres: Anaplasma (Verhulst et al., 1983), Ehrlichia (Sarih et al., 2005), Bartonella (Bitam et al., 2008; Boudebouch et al., 2011), Borrelia (Sarih et al., 2009; Bouattour et al., 2010) et Rickettsia (Sarih et al., 2008; Bitam et al., 2009). En 2003, Yersinia pestis, agent responsable de la peste qui est transmis à l’homme par l’intermédiaire de puces infectées, réapparait en Algérie (Bertherat et al., 2007) où elle continue à se manifester (Bitam et al., 2010).
1.2.3. Les arbovirus
Les virus qui sont transmis par des arthropodes hématophages sont qualifiés d’arbovirus (arthropod-borne virus). Les arbovirus appartiennent à cinq familles de virus: Togaviridae, Bunyaviridae, Flaviviridae, Rhabdoviridae et Reoviridae. Il en existe plus de 500 espèces dont une centaine peut être pathogène pour l’homme.
Dans le grand Maghreb, la fièvre catarrhale est une maladie virale affectant les ruminants domestiques et sauvages. Elle est due à un Orbivirus (Reoviridae) transmis par certaines espèces du genre Culicoides (moucherons hématophages). En 1956, la maladie fait son apparition en Afrique du Nord, précisément au Maroc (Placidi, 1957). Depuis, la maladie reste absente jusqu’à son apparition en Tunisie en 1999 (sérotype 2), en Algérie en 2000 (sérotype 2) et finalement, au Maroc en 2004 (sérotype 4). A partir de 2006, le sérotype 1 a été introduit dans la région du Maghreb et des foyers de la maladie continuent à être observés (2008, 2009, 2010, 2011) (ProMED-mail, 2011).
6
La fièvre West Nile a fait son apparition en Algérie en 1994 et était responsable de 20 cas dont 8 décès (Le Guenno et al., 1996). En 1997, une deuxième épidémie a été déclarée dans la région, en Tunisie, faisant 173 cas dont 8 décès (Triki et al., 2001). Au Maroc, c’est une épizootie qui a été rapportée en 1996 avec 42 équidés morts (El Harrak et al., 1997). Dès lors, le virus a sévi à plusieurs reprises au Maroc (2003, 2008 et 2010) et en Tunisie (2003, 2008 et 2011) laissant suggérer une circulation enzootique du virus (Tableau I; Schuffenecker et al., 2005; Garbouj et al., 2003; Figuerola et al., 2009; OIE 2010; ECDC 2011; Ben Hassine et al., 2011).
Tableau I. Les cas humains et équins recensés dans la région du Maghreb depuis l’emergence du virus West Nile en 1994
Pays Période Région Nombres de cas
Algérie 1994 (Aout-septembre) Timimoune 50 patients dont 20
cas cliniques (8
décès)
Maroc 1996 (Aout- octobre) Kenitra et Larache 94 équidés (42
morts) et 1 cas humain
2003 (Septembre) Kenitra 9 équidés
2010 (Août) Benslimane et
Mohammedia
16 équidés
Tunisie 1997 (Septembre
-décembre)
Sfax et Mahdia 173 cas humains (8
décès)
2003 (Juillet -octobre) Sfax, Mahdia, Monastir,
Sousse et Gabés
31 cas humains
2011 (Novembre) Province de Kebili 3 cas humains
En 1965, la peste équine africaine apparait au Maroc et s’étend rapidement en Algérie et en Tunisie (Rabah, 1966; Mornet et al., 1967; Sers, 1967; Laaberki, 1969).
7
Le virus réapparait au Maroc entre 1989 et 1991, avec une perte de 555 équins (Anonymous, 1992), le seul vecteur prouvé étant le moucheron Culicoides imicola.
La maladie épizootique hémorragique touche le bétail et le virus est transmis par des culicoïdes. En 2004 et 2006, une mortalité et une morbidité associées au virus ont été rapportées au Maroc et en Algérie (ProMED-mail, 2006).
Récemment, la fièvre à phlébotomes sicilienne a émergé en Algérie en 2008 (Izri et al., 2008). Le VUSU et le VFVR, ne se sont jamais manifestés dans la région du Maghreb. Cependant, des sérologies positives ont été mises en évidence dans leSud marocain (Figuerola et al., 2009; Ayari-Fakhfakh et al., 2011; El-Harrak et al., 2011).
8
2. Le virus West Nile
2.1. Historique
Le virus West Nile (VWN) ou virus du Nil occidental a été isolé pour la première fois en 1937 dans le district West Nile en Ouganda chez une femme souffrant d’une forte fièvre (Smithburn et al., 1940). Aujourd’hui, le virus est présent sur tous les continents à l’exception de l’Antarctique (Figure 3) faisant de lui le virus le plus répandu dans le monde (Kramer et al., 2008).
Figure 3. Distribution géographique du virus West Nile (en gris) (Mackenzie et al., 2004; Smith,
2007; Kilpatrick, 2011).
La première épidémie dûe au VWN a été rapportée en Israël (1951-1952; Bernkopf et al., 1953) où les premieres manifestations neurologiques sévères ont été rapportées en1957 et en 1962(Hayes, 1989). Le VWN a également sévi en France (1962; Joubert et al., 1970) et en Afrique du Sud (1974, 1986-1984; McIntosh et al., 1976; Jupp et al., 1986).
A partir de 1994, le VWN regagne de l’activité dans l’ancien monde et des premiers cas humains ont été rapportés en Algérie (Le Guenno et al., 1996). L’arbovirus révèle une pathogénicité plus importante et est à l’origine de plusieurs épisodes
9
épidémiques observés chez l’homme et/ou les chevaux. En 1996, une épidémie éclate à Bucarest (Roumanie) avec plus de 500 cas d'encéphalite dont 17 mortelles (Tsai et al., 1998). En 1999, 40 décès sont rapportés dans les villes de Volzskii et Volvograd, en Russie (Platonov et al., 2001) et en 2000, 8 décès rapportés en Israël (Weinberger et al., 2001). Une situation différente est observée au Maroc (1996), en Italie (1998) et en France (2000, 2003, 2004 et 2006) où le virus a touché essentiellement les chevaux (El Harrak et al., 1997; Cantile et al., 2000; Murgue et al., 2001b; Zeller et al., 2004; Durand et al., 2005).
En 1999, le VWN est introduit à New York (USA), 62 cas d'encéphalite humaine (7 décès), 20 cas équins (9 décès) ainsi qu’une grande mortalité aviaire ont été observés (Novello, 2000; Garmendia et al., 2001). Par la suite, le VWN va élargir son aire de distribution en atteignant l’ensemble des États-Unis ainsi qu’une grande partie du continent américain, du Canada (Pepperell et al., 2003) jusqu’en Argentine (Morales et al., 2006).
En 2011, 712 et 110 cas ont été déclarés respectivement aux USA et Canada (CDC, 2011; PHAC, 2011) et 303 cas sont recensés entre l’Europe et ses pays voisins (ECDC, 2011).
2.2. La structure et le génome
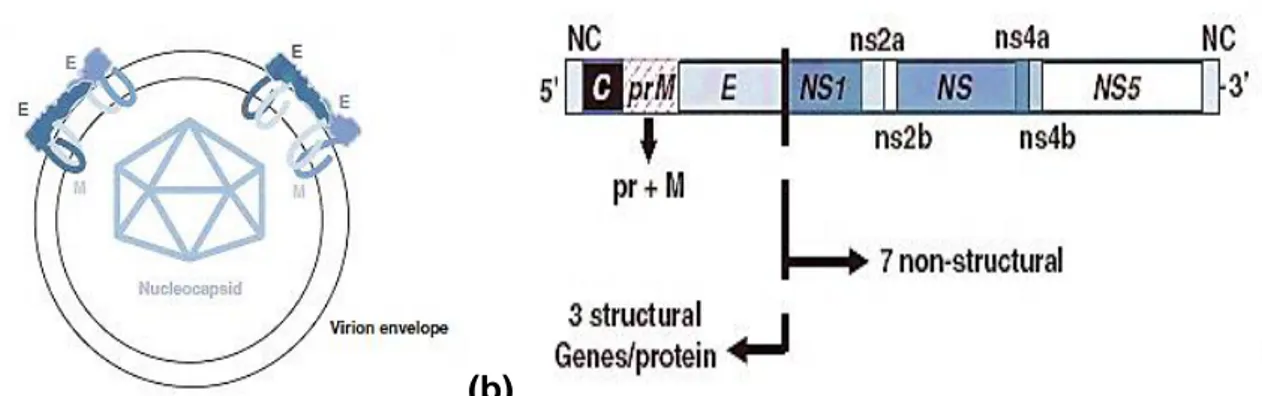
Le VWN est un Flavivirus de la famille des Flaviviridae. C’est un virus sphérique de 50 nm de diamètre. Le génome viral est un ARN simple brin de polarité positive, comportant un seul cadre ouvert de lecture d’environ 11 000 nucléotides. Cet ARN code une polyprotéine d’environ 3400 acides aminés dont les clivages co et post-traductionnels génèrent trois protéines structurales (protéines C de la capside, prM /M de la membrane et E de l’enveloppe) et sept protéines non structurales (NS1, NS2A, NS2B, NS3, NS4A, NS4B, NS5) nécessaires à la réplication virale et qui jouent des rôles importants dans la transcription virale, la traduction, la réplication, la maturation, et l'évasion immunitaire (Diamond et al., 2009). L’ARN viral est flanqué à ses deux extrémités de séquences non codantes (NC) nécessaires à l’initiation de la réplication et de la traduction (Figure 4).
10
L’ARN viral se lie aux protéines de la capside et le tout est entouré d’une enveloppe dans laquelle sont ancrées 180 copies des protéines M et E fortement glycosylées (Mukhopadhyay et al., 2003).
(a) (b)
Figure 4. Schéma de la structure (a) et du génome (b) d’un Flavivirus. Le virus est enveloppé et
son génome est un ARN simple brin de polarité positive codant pour 3 protéines structurales (Capside, Membrane et Enveloppe) et 7 protéines non structurales (Petersen &Roehrig, 2001).
2.3. Les lignages
Des analyses phylogénétiques basées sur l’analyse des séquences nucléotidiques d’un fragment de 255 pb du gène codant pour la glycoprotéine E, ont montré que les isolats du VWN de différentes régions géographiques sont classés en deux lignages majeures (1 et 2), présentant 25 à 30% de différences nucléotidiques (Berthet et al., 1997; Lanciotti et al., 2002) et plusieurs sous-clades ou clusters (Figure 5a; Berthet et al., 1997; Lanciotti et al., 1999; Savage et al., 1999; Scherret et al., 2001; Charrel et al., 2003).
Le lignage 1 regroupe des souches qui circulent en Afrique de l’Ouest, Moyen Orient, Europe de l’Est, Amérique du Nord et Australie. Le lignage 2 a une répartition géographique restreinte; il circule en Afrique sub-saharienne et Madagascar. Récemment, il a été retrouvé en Europe et plus précisement, en Hongrie, en Grèce et en Italie (Bakonyi et al., 2006; Bagnarelli et al., 2011; Papa et al., 2011).
D’autres souches du VWN ont été isolées et présentent des différences génétiques considérables par rapport aux deux lignages 1 et 2 (Figure 5b; Lvov et al., 2004); le lignage 3 inclût le virus Rabensburg isolé en République Tchèque en 1997 (Bakonyi
11
et al., 2005), le lignage 4 est représenté par une seule souche isolée en Russie (Caucase en 1998; Bakonyi et al., 2005) et le lignage 5 correspond à une souche isolée en Inde en 1980 (Bondre et al., 2007).
a b
12
2.4. Le cycle de transmission
Après la découverte du VWN, des premiers travaux ont été conduits en Egypte, en couplant les volets entomologiques, vétérinaires et humains et ont révélé l’implication des moustiques de genre Culex comme vecteurs principaux et des oiseaux comme principaux hôtes amplificateurs qui développent une virémie suffisante pour permettre l’infection des moustiques lors de la prise du repas de sang. Après une période d'incubation extrinsèque, le moustique peut infecter d’autres oiseaux. Ainsi, le virus est maintenu dans un cycle enzootique «oiseau-moustique-oiseau». Ces travaux ont montré également la présence d’infections «cul de sac» chez le cheval et l’homme qui sont incapables de développer une virémie suffisante pour permettre par la suite l’infection du moustique (Work et al., 1953, 1955; Hurlbut, 1956; Hurlbut et al., 1956; Taylor et al., 1956).
Le VWN a pu disséminer d’un pays à l’autre et d’un hémisphère à l’autre par l’intermédiaire des oiseaux migrateurs (Nir et al., 1967; Hannoun et al., 1969, 1972; Watson et al., 1972; Berthet et al., 1997). Dans le cas de l’introduction du virus de l’ancien vers le nouveau monde, il s’agit d’une introduction liée aux activités commerciales et non via la migration des oiseaux (Figure 6; Weaver & Barrett, 2004). D’autres cycles de transmission ont été décrits impliquant certains amphibiens ou reptiles comme hôtes amplificateurs (Kostyukov et al., 1985; Klenk et al., 2004).
Figure 6. Cycle de transmission du virus West Nile. Le VWN est maintenu au sein d’un cycle
13
2.5. Le cycle de réplication virale
La premiere étape du cycle viral est l’attachement virus sur la surface cellulaire qui implique une interaction entre la protéine d’enveloppe E et des récepteurs spécifiques de la surface cellulaire (Figure 7). Les récépteurs DC-SIGN, alphaVbeta3 integrin (Bogachek et al., 2010) et laminin-binding protein (Bogachek et al., 2008) ont été rapportés comme potentiel récepteurs. Un processus d’endocytose récepteur-dépendante conduit alors à l’internalisation de la particule virale dans une vésicule à clathrines (Chu & Ng, 2004). Une acidification de l’endosome s’opère entrainant un changement de conformation de la proteine E et induisant ainsi la fusion de l’enveloppe virale et de la membrane endosomale (Gollins & Porterfield, 1986). La nucléocapside est libérée dans le cytoplasme de la cellule hôte et l’ARN génomique est décapsidé. Ce dernier etant de polarité positive, fait office d’ARNm et est transcrit en une seule polyproteine. La maturation protéolytique de la polyprotéine virale, puis de ces produits de clivage, génère les trois protéines structurales et les sept protéines non-structurales.
Les protéines virales NS3 et l’ARN polymérase ARN-dépendante NS5 (Rice et al., 1986; Poch et al., 1989) s’associent probablement à des protéines cellulaires pour former un complexe de réplication réalisant la synthèse de brins d’ARN (-). Ceux-ci servent à leur tour de matrice pour la synthèse de brins d’ARN (+) destinés soit à être traduits, soit à être encapsidés dans les virions en cours de maturation. Les proteines de capside s’assemblent avec l’ARN viral pour former la nucléocapside. Les nucléocapsides nouvellement formées seraient ensuite internalisées dans la lumière du réticulum endoplasmique (RE) selon un processus de bourgeonnement. La membrane du RE, dans laquelle sont ancrées les protéines E et prM, formerait ainsi l’enveloppe des virions immatures. Ces derniers seraient ensuite transportés, dans des vésicules de sécrétion, vers l’appareil de Golgi. Dans le réseau trans-golgien, il a été démontré qu’une protéase cellulaire assure la maturation de l’enveloppe virale par le clivage de prM en M (Konishi & Mason, 1993). La libération des virions dans le milieu extracellulaire se ferait ensuite par exocytose au travers de la membrane plasmique (Mukhopadhyay et al., 2005).
14
Figure 7. Cycle de réplication des Flavivirus (Samuel, 2002).
2.6. Pathogénèse et vaccin
Après une piqure de moustique, le flavivirus infecte les kératinocytes (Lim et al., 2011) et les cellules dendritiques de Langerhans migrent aux ganglions lymphatiques où le virus se réplique (Ho et al., 2001; Libraty et al., 2001; Wu et al., 2001), dissémine par la suite via la circulation sanguine et infecte le rein et la rate, où une deuxième réplication a lieu. Selon le niveau de virémie, le virus peut traverser la barrière hémato-encéphalique, atteindre le cerveau et cause la méningo-encéphalite. La période d’incubation de l’arbovirus chez l’homme varie entre 2 et 14 jours. L’infection chez l’homme est souvent asymptomatique. Dans le cas contraire, elle se traduit par un syndrome pseudogrippal; fièvre, céphalées, myalgies, arthralgies, asthénie, éruption cutanée, pharyngite, manifestations digestives (nausées, vomissement, diarrhée, douleurs abdominales). Près de 1 % des personnes développant des signes cliniques présentent des formes graves avec des troubles neurologiques de type méningites aigues ou encéphalites (Gallian et al., 2005). Chez les équidés, l’infection varie de simple syndrome pseudo-grippal à une encéphalite mortelle. Les atteintes neurologiques touchent approximativement 10 % des chevaux infectés dont les signes cliniques sont les suivants: ataxie, contractions
15
musculaires, paralysie partielle, cécité apparente, mouvements d’appui de la tête, grincements de dents, désorientation, convulsions. L’affaiblissement, généralement localisé au niveau des membres postérieurs, est parfois suivi de paralysie.
L’infection chez les oiseaux est généralement asymptomatique à l’exception de certaines espèces telles que les oies et les corbeaux.L’atteinte neurologique se manifeste sous diverses formes allant d’une incapacité à se tenir debout à une paralysie des pattes et des ailes.
Le traitement des infections dûes au VWN est purement symptomatique et aucun traitement spécifique n’est disponible actuellement. L’utilisation de la ribavirine et l’interferon α est discutable. En effet, la ribavirine inhibe la multiplication des virus en s’incorporant en tant que nucléoside défectueux à la place des nucléosides corrects durant la réplication du virus.
Lorsque le virus pénètre dans la circulation sanguine, les leucocytes produisent l’interféron α qui active les cellules environnantes infectées et non infectées afin d’inhiber la synthèse protéique virale et d'autre part, de provoquer la décomposition de l'ARN viral. Au niveau des cellules de mammifères infectées par le VWN, la production d'interféron α est inhibée. Ainsi, le traitement par l'interféron permet de réactiver les cellules et par conséquent, les défenses immunitaires.
Il n’existe pas de vaccin humain. Cependant, le virus inactivé est utilisé comme vaccin aux USA pour prévenir l’infection chez le cheval ainsi que d’autres vaccins chimériques exprimant les protéines de la membrane et de l’enveloppe (DeFilette et al., 2012).
16
3. Le virus de la fièvre de la vallée du Rift
3.1. Historique
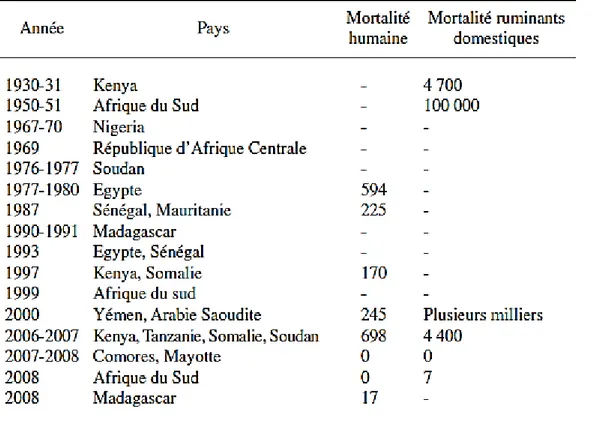
Le virus de la fièvre de la vallée du Rift (VFVR) a été isolé en 1930 lors d’une épizootie au Kenya qui a provoqué la mort de 3500 agneaux et 1200 brebis (Daubney et al., 1931). Pendant plusieurs années, le virus a continué à être responsable d’épizooties en Afrique de l’Est et du Sud. Ce n’est qu’en 1975, qu’une première épizootie-épidémie éclate en Afrique du Sud où l’infection humaine est associée pour la première fois à des symptômes de fièvre hémorragique et d’encéphalite (McIntosh et al., 1980).
Le VFVR atteint l’Egypte en 1977, touchant 200 000 personnes et faisant 598 décès (El-Akkad, 1978; Meegan, 1979). Depuis lors, des épidémies se sont succédées dans toute l’Afrique sub-saharienne; en Mauritanie en 1987 en provoquant 1264 cas dont 224 décès (Digoutte et al., 1989), à nouveau en Egypte en 1993 (Arthur et al., 1993) et en 1997 (Abd El-Rahim et al., 1999), au Kenya (Nord-Est) et en Somalie (Sud) en 1997-98 faisant 478 décès (Anonymous, 1998). En outre, le virus s'est étendu pour la première fois hors d'Afrique, gagnant l’Arabie Saoudite et le Yémen en 2000 (Ahmed, 2000) et faisant respectivement 884 cas humains dont 124 décès et 1087 cas humains dont 121 décès.
En 2006-2007, une vaste épidémie sévit en Afrique de l’Est: au Kenya (684 cas dont 155 décès), en Tanzanie (264 cas dont 109 décès), en Somalie (114 cas dont 51 décès) et au Soudan (601 cas dont 211 décès). En 2008, un foyer est notifié en Afrique du Sud ainsi qu’à Madagascar (17 morts et plus de 400 cas humains) (Tableau II).
17
Tableau II. Principales épidemies de la fièvre de la vallée du Rift (Cêtre-Sossah & Albina, 2009)
Aujourd’hui, la fièvre de la vallée de Rift est présente en Afrique, à Madagascar et dans la péninsule arabique. Cependant, dans certains pays africains, la maladie ne s’est jamais manifestée malgré les sérologies positives détectées dans le bétail (Figure 8).
18
Figure 8. Répartition de la fièvre de la vallée du Rift en Afrique, à Madagascar et dans la péninsule arabique chez l’animal et chez l’homme (Chevalier et al., 2008).
3.2. La structure et le génome
Le VFVR, un Phlebovirus de la famille des Bunyaviridae, est un virus enveloppé de 90 à 110 nm de diamètre. Le génome du VFVR est un ARN simple brin de polarité négative et tri-segmenté: Le segment L (Large) code pour la protéine L qui est une ARN polymérase ARN dépendante. Le segment M (Medium) code pour une polyprotéine qui génère les glycoprotéines Gn, Gc et NSm après clivage post-traductionnel. Le segment S est traduit de manière ambisens : dans le sens du génome, il code pour une protéine non structurale NSs, et dans le sens antigénomique, pour la protéine N (Figure 9).
Chaque ARN est associé à des protéines N et L et l’ensemble forme une ribonucléoprotéine. Les glycoprotéines Gn et Gc sont deux protéines de surface qui s’insèrent dans la membrane du virus, formant des spicules de 5 à 10 nm de longueur. Elles ont des propriétés hémagglutinantes et sont responsables de la fixation de la particule virale à la surface des cellules cibles, après reconnaissance de leurs récepteurs (encore inconnus). La protéine non structurale NSm n’est pas essentielle pour le déroulement du cycle viral (Won et al., 2006; Gerrard et al., 2007) et son rôle est encore inconnu (Bouloy & Weber, 2010) tandis que la protéine NSs
19
constitue le facteur de virulence. En effet, la proteine NSs forme des filaments dans le noyau de la cellule infectée et inhibe la transcription cellulaire.
Figure 9. Schéma de la structure et du génome du virus de la fièvre de la vallée du Rift. Le
VFVR possede un génome de polarité négative ou ambisens et tri-segmenté (Segments L, M et S) (Pépin et al., 2010).
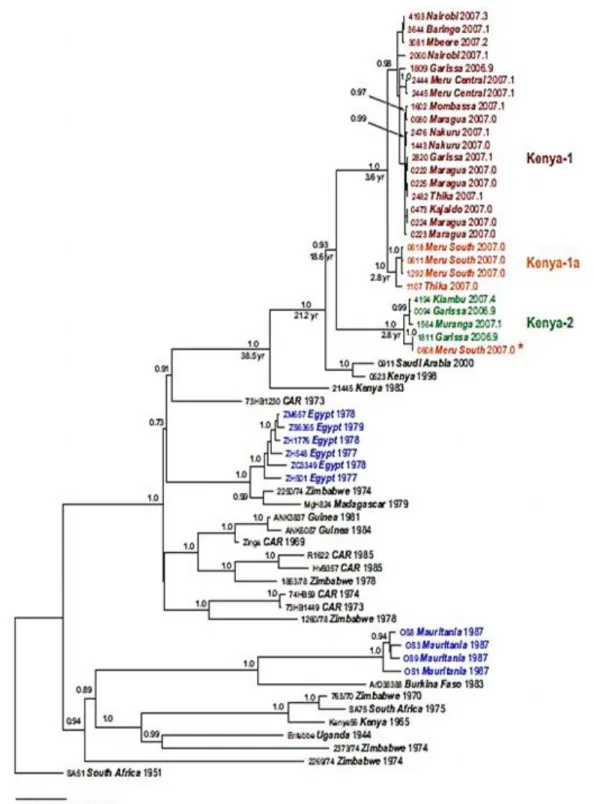
Les analyses phylogénétiques des séquences du segment M ont permis de définir trois lignées majeures: Afrique de l'Ouest, Afrique centrale-orientale et Egypte (Figure 10). Bien que la plupart des souches sont regroupées selon leur origine géographique, aucune corrélation entre le génotype viral et l'emplacement géographique n’a été observée (Bird et al., 2007).
20
21
3.3. Le cycle de transmission
Le cycle de la fièvre de la vallée de Rift fait intervenir des moustiques du genre
Aedes et/ou Culex. Les femelles infectées du genre Aedes sont capables de
transmettre le virus à leurs descendants (transmission verticale). Les œufs sont capables de résister à la dessiccation durant de longues périodes jusqu’à la saison des pluies suivantes. A la mise en eau, les œufs infectés éclosent et donnent des adultes infectés. Lors d’un repas sanguin, la femelle transmet par piqure le virus aux animaux sauvages ou domestiques. C’est le cycle enzootique. Les animaux infectés vont servir de source de contamination pour d’autres moustiques et vont être à l’origine d’épizootie et/ou d’épidémie.
Une autre possibilité serait que le virus soit conservé au sein d’un réservoir naturel. Certains rongeurs ont été proposés comme réservoir possible en Afrique du Sud (Pretorius et al., 1997). Le VFVR a été également isolé d’animaux sauvages et de moustiques en forêt tropicale suggérant un cycle selvatique (Sall, 1999).
Le virus est également transmis par aérosols à partir de liquides biologiques ou de tissus d’animaux contaminés. C’est dans cette situation que l’homme se contamine en plus d’une transmission par des moustiques. Cependant, l’homme reste généralement considéré comme un “cul-de-sac épidémiologique”, car la transmission interhumaine n’a jamais pu être observée (Figure 11).
22
Figure 11. Cycle biologique du virus de la fièvre de la vallée du Rift. Le maintien du virus se fait
dans des œufs d’Aedes et/ou dans des rongeurs ou des ruminants sauvages qui seraient le réservoir animal. Suite à de fortes pluies, la pullulation des moustiques infectés entrainerait la contamination des animaux d’élevage, c’est l’épizootie. Si cette derniere s’intensifie et se déplace en zone urbaine
par le déplacement du bétail contaminé, l’homme peut alors être touché, c’est l’épidémie.
3.4. Le cycle de réplication virale
Comme tous les virus à ARN négatif, le génome est transcrit et répliqué seulement quand les proteines N et L lui sont associées sous forme de ribonucleoproteines (RNPs). Les RNPs se présentent sous forme circulaire et possedent une structure pseudo-hélicoidale. A la différence des ARN génomiques et anti-génomiques, les ARNm viraux possèdent à leur extremité 5’ une sequence additionnelle d’ARN coiffée et methylée d’origine cellulaire aquise par capture de coiffe (cap-snatching).
Comme tous les Bunyavirus, le cycle a lieu dans le cytoplasme. Le virus bourgeonne au niveau des membranes de l’appareil de Golgi. Le site de bourgeonnement semble être determiné par les glycoprotéines Gn et Gc qui possèdent des signaux d’adressage aux membranes golgiennes (Gerrard & Nichol, 2002).
Les glycoproteines de l’enveloppe semblent médier l’entrée du virus dans les cellules à travers des récepteurs qui pour la plupart des Bunyavirus, restent à identifier
23
(Bouloy & Weber, 2010).Cependant, une étude récente a montré que DC-SIGN sert de récepteur pour les Phlebovirus (Lozach et al., 2011).
3.4. Pathogénèse et vaccin
Le virus se réplique au niveau du foie, la rate et souvent le cerveau. Suite à une période d’incubation de 3 à 7 jours, l’homme développe une forme bénigne pseudo-grippale avec une hyperthermie, des céphalées, des myalgies et des nausées. Une proportion de personnes infectées de 3% à 20% développe des complications: une atteinte oculaire, une méningo-encéphalite ou une hépatite associée à un syndrome hémorragique. Les lésions rétiniennes peuvent provoquer une baisse définitive de l’acuité visuelle voire la cécité. La méningo-encéphalite peut entraîner des lésions nerveuses irréversibles (Alrajhi et al., 2004). Ces deux formes sont rarement mortelles. A l’inverse, la fièvre hémorragique est fatale dans la moitié des cas et apparait 3 à 6 jours après le début de la maladie (Peters & Meegan, 1981).
Chez les animaux, la sensibilité à l’infection varie selon l’âge et l’espèce (Tableau III). L’infection est rarement mortelle pour les adultes, mais provoque des avortements chez les femelles en gestation et une mortalité importante chez les jeunes animaux (Easterday, 1965; Shimshony & Barzilai, 1983).
24
Tableau III. Sensibilité des animaux au virus de la fièvre de la vallée du Rift (Lefèvre, 1989)
Hautement sensibles Sensibles Modérément sensibles Faiblement sensibles (infection inapparente) Résistants Agneaux Chevreaux Chiots Chatons Souris Hamsters Veaux Moutons Bovins Chèvres Buffles Chameaux Chevaux Porcs Chiens Chats Cobayes Lapins Oiseaux Reptiles Amphibiens
Il n’existe aucun traitement spécifique pour la FVR. Chez l’homme, un traitement symptomatique est mis en place dans les cas sévères afin d’améliorer l’état général du patient. L’usage d’interférons (α et β) ou de ribavirine est discutable.
Les vaccins existants sont divisés en deux groupes: les souches vivantes et les souches inactivées. La souche neurotrope Smithburn (Smithburn, 1949) est une souche atténuée qui induit une immunité de longue durée après une seule inoculation mais provoque des avortements et/ou des malformations fœtales. Dans cette catégorie, on cite deux autres candidats, la souche MP12 (obtenue à partir de la souche ZH548 après 12 passages en présence de l’agent mutagène 5 fluoro-uracyl (Caplen et al., 1985) et la souche Clone 13 (souche naturellement atténuée). Un autre vaccin R566, est obtenu par réassortiments entre les deux souches Clone13 et MP12. Les vaccins inactivés ont l’avantage de ne pas présenter d’effets néfastes mais l’immunité induite est de courte durée et nécessite des rappels annuels. La souche virale est généralement inactivée à l’aide de dérivé de formol comme la souche RVFV TSI-GSD-200 (Ikegami & Makino, 2009; Pépin et al., 2010; Boshra et al., 2011).
25
4. Les vecteurs du VWN et VFVR
4.1. La transmission vectorielle et la notion de capacité vectorielle
En conditions naturelles, le vecteur s’infecte lors d’un repas sanguin sur un hôte vertébré en phase de virémie. Par la suite, le vecteur devient infectant et peut transmettre le virus à un hôte naïf. En conditions de laboratoire, on reproduit ce cycle soit en utilisant des animaux comme hôtes donneurs ou receveurs soit en utilisant des méthodes artificielles qui consistent en une infection orale du vecteur puis à une recherche du virus dans la salive. Ces deux techniques permettent d’évaluer l’aptitude d’un arthropode à s’infecter, amplifier et transmettre le virus, autrement dit, elles permettent d’évaluer la compétence vectorielle.
Quand un moustique ingère un repas sanguin contenant du virus (Figure 12, site A), ce dernier se retrouve dans la lumière de l’intestin moyen (Figure 12, site B). La prise du repas sanguin initie l’excrétion d’enzymes protéolytiques ainsi que la formation d’une membrane chitineuse nommée “la matrice péritrophique” (Figure 12, site C) qui entoure le bol alimentaire et protège l’épithélium intestinal des enzymes de la digestion. Pendant ce temps, le virus doit pénétrer dans les cellules intestinales (Figure 12, site D) avant que la membrane péritrophique ne devienne complètement imperméable sinon il sera piégé dans le bol alimentaire et détruit. Après une phase de réplication dans les cellules de l’épithélium intestinal, les virions sont libérés dans la cavité générale et disséminent dans les différents organes avec l’hémolymphe (Figure 12, site E). Ainsi, le virus infecte le corps gras, les tubes de Malpighi (Figure 12, site F), les ovaires (Figure 12, site G), la chaine nerveuse centrale et les glandes salivaires (Figure 12, site H). Une fois la barrière salivaire franchie, le virus se retrouve dans la salive qui est alors injectée lors d’une piqure de la femelle infectante. A savoir qu’une femelle infectée le restera toute sa vie.
Le temps nécessaire pour que le virus progresse dans un moustique, depuis son ingestion jusqu’à ce qu’il se retrouve dans la salive, est appelé la période d’incubation extrinsèque (PIE) qui est un paramètre sensible à la température. En effet, quand on augmente la température d’incubation, on diminue la PIE (Figure13). La compétence vectorielle dépend des interactions moustique-virus qui vont permettre ou empêcher le développement de l’agent infectieux dans le corps de l’arthropode. Elle dépend de facteurs intrinsèques essentiellement d’origine
26
génétique (Beerntsen et al., 2000). Quant à la capacité vectorielle, elle dépend des interactions moustique-virus-environnement et plus précisément, de la densité du vecteur, ses préférences trophiques, sa durée de vie, sa durée d’incubation extrinsèque pour l’agent infectieux…(Macdonald, 1957).
Figure 12. Schéma montrant le cheminement du virus dans le corps d’un moustique vecteur.
Aprés ingestion (A), le virus se retrouve dans le bol alimentaire et doit infecter les cellules intestinales (B, C et D) pour être libéré par la suite dans la cavité générale (E) et infecter les organes secondaires
(F, G) y compris les glandes salivaires (H) (modifié à partir de Beerntsen et al., 2000).
Figure 13. La période d’incubation extrinsèque varie selon la température. La période
d’incubation extrinsèque est la durée nécessaire pour qu’une femelle de moustique devienne infectante après un repas sanguin infecté. Cette période diminue en augmentant la température
27
4.2. Les vecteurs du VWN
Plus de 70 espèces de moustiques ont été trouvées naturellement infectées par le VWN, (Mononi et al., 2010). Cependant, elles ne sont pas toutes impliquées dans la transmission. En effet, une espèce naturellement infectée ne signifie pas automatiquement qu’elle soit vectrice. Elle a peut-être piqué un individu infecté et présentait du virus dans le repas de sang en cours de digestion.
Les espèces impliquées dans la transmission du VWN appartiennent essentiellement au genre Culex. En Afrique et au Moyen Orient, le principal vecteur est Cx.
univittatus associé à Cx. antennatus et Cx. pipiens en Égypte (Taylor et al.,1956), Cx. pipiens en Israël (Nir et al., 1972) et Culex theileri en Afrique du Sud (McIntosh et
al., 1967). En Europe et Russie, les principaux vecteurs sont Cx. pipiens et Cx.
modestus (Mouchet et al., 1970; Berezin, 1971; Savage et al., 1999) et en Asie, il
s’agit de Cx. tritaeniorhynchus, Cx. quinquefasciatus et Cx. vishnui (Pavri & Singh, 1965; Akhter et al., 1982). Aux États-Unis, les espèces qui jouent un rôle dans la transmission du VWN sont Cx. tarsalis, Cx. pipiens, Cx. restuans, Cx. salinarius et
Cx. erraticus au Nord (Andreadis et al., 2004; Lukacik et al.,2006; Gujral et al., 2007)
et au Sud, Cx. quinquefasciatusassocié à Cx. nigripalpus à l’Est et Cx. tarsalis à l’Ouest (Reisen et al., 2004; Hayes et al., 2005a). Cx. nigripalpus, Cx. bahamensis et
Cx. quinquefaciatus sont des vecteurs principaux du VWN en Amérique centrale et
aux Caraïbes (Lefrançois et al., 2006; Barrera et al., 2008).
4.3. Les vecteurs du VFVR
En Afrique de l’Est, les principales espèces qui ont été trouvées naturellement infectées appartiennent aux genres Aedes (Ae. cumminsii, Ae. circumluteolus, Ae.
mcintoshi) et Culex (Culex pipiens, Culex neavii, Cx. zombaensis et Culex antennatus), Mansonia africana, et Anopheles pharoensis (Hoogstraal et al., 1979;
Meegan et al., 1980; Linthicum et al., 1985; Meegan & Bailey, 1989; Logan et al., 1991).
En Afrique du Sud, le VFVR a été isolé d’Ae. circumluteolus, Ae. caballus, Ae. juppi,
28
En Afrique de l’Ouest, Ae. vexans arabiensis, Ae. ochraceus et Ae. dalzieli sont des vecteurs enzootiques du virus au Sénégal où une autre espèce, Ae. vexans joue un rôle primordial dans le maintien du virus et notamment, dans la région de Ferlo (Fontenille et al., 1998; Chevalier et al., 2004). L’espèce Cx. poicilipes a été incriminée dans l’épizootie-épidémie de 1998 en Mauritanie (Diallo et al., 2005). Cx.
quinquefacsiatus pourrait également jouer un rôle dans la transmission du VFVR
(Marrama et al., 2005).
Lors de l’épidémie du 1977 en Egypte, Culex pipiens fut la seule espèce trouvée naturellement infectée (Meegan et al., 1980).
En Arabie saoudite et au Yémen, deux espèces ont été trouvées naturellement infectés. Il s’agit de Ae. vexans arabiensis et Cx. tritaeniorhynchus tandis que Ae.
caspius et Cx. pipiens sont soupçonnées de jouer un rôle dans le cycle
épidémiologique du VFVR (Jupp et al., 2002; Miller et al., 2002).
4.4. Le complexe Culex pipiens
4.4.1. Position systématique
Les moustiques appartiennent à la classe des insectes, à l’ordre des diptères et à la famille des Culicidés. Les moustiques sont cosmopolites et sont groupés en deux sous-familles, Culicinae et Anophelinae. Au Maroc, 42 espèces sont référencées et issues des genres: Anopheles, Aedes, Coquillettidia, Culex, Culiseta,
Ochlerotatus, Orthopodomyia et Uranotaenia (Trari et al., 2002) dont l’espèce Culex pipiens. Sa classification est la suivante:
29 Règne : Animalia Embranchement : Arthropoda Sous-embranchement : Hexapoda Classe : Insecta Sous-classe : Pterygota Ordre : Diptera Sous-ordre : Nematocera Famille : Culicidae Sous-famille : Culicinae Genre : Culex
Espèce : Culex pipiens
4.4.2. Bio-écologie
La vie du moustique Cx. pipiens est composée de deux phases distinctes: une phase aquatique et une phase aérienne (Figure 14). Après l’accouplement, les femelles prendront un repas sanguin nécessaire à l’élaboration des œufs. Cependant, les femelles de Cx. pipiens peuvent produire une première ponte sans repas sanguin: elles sont dites autogènes. Elles utilisent les réserves accumulées durant leur stade larvaire. Les œufs sont pondus dans l’eau, claire en général, mais on les trouve également dans les eaux polluées, chargées en matières organiques qui permettront aux larves de se nourrir. Les œufs sont déposés en une nacelle qui flotte sur l’eau. L’éclosion se produit environ 24 h à 48 h après l’oviposition. Les larves ont un mode de vie exclusivement aquatique, d’une durée de 5 à 6 jours. Elles subiront 4 mues avant de se transformer en nymphe. La nymphe ne se nourrit plus et de profondes modifications anatomiques s’opèrent. Aprés 2 à 3 jours, l’adulte est complètement formé dans son enveloppe nymphale. Le tégument se dessèche au contact de l’air et il se forme une déchirure en T sur sa face dorsale sous l’effet de l’augmentation de la pression interne. L’imago se dégage progressivement en se
30
gonflant d’air pour s’envoler après un temps nécessaire au déplissage des ailes et des pattes par augmentation de la pression de l’hémolymphe.
Figure 14. Cycle biologique de Culex pipiens.
4.4.3. Les membres du complexe Cx.pipiens
Le complexe Culex pipiens regroupe plusieurs espèces: Cx. pipiens Linnaeus, 1758 avec ses deux formes; la forme pipiens et la forme molestus Forskll,1775, Cx.
quinquefasciatus Say, 1823, Cx. pallens Coquillett 1898, Cx. globocoxitus
Dobrotworsky 1953 et Cx. australicus Dobrotworsky et Drummond, 1953. D’autres espèces sont étroitement liées ou suggérées appartenir à ce complexe telles que,
Cx. vagans Wiedemann 1828, Cx. fatigans Wiedemann 1828, Cx. Pervigilans Von
Bergroth 1889 et Cx. torrentium Martini, 1925, (Vinogradova 2003; Smith & Fonseca, 2004). Les membres de ce complexe présentent des caractères morphologiques semblables avec des différences éco-physiologiques qui se traduisent par leur capacité à produire une première ponte sans prendre de repas sanguin (autogénie
versus anautogénie), à s’accoupler dans des espaces fermés (sténogamie versus
eurygamie), à entrer en diapause durant la période hivernale (hétérodyname versus homodyname) (Tableau IV).
31
Chaque membre appartenant au complexe Cx. pipiens a une répartition géographique caractéristique. En effet, Cx. pipiens L. est présent en Europe, au Nord et au Sud de l’Afrique, en Asie non tropicale et en régions tempérées de l’Amérique du Nord et du Sud (Harbach et al., 1985; Vinogradova, 2000; Vinogradova, 2003).
Cx. pipiens existe uniquement sous sa forme molestus au Japon, en Corée du Sud et
en Australie (Vinogradova, 2000). Cx. quinquefasciatus est présent en région tropicale, subtropicale de l’Afrique et des Amériques et en Sud-Est de l’Asie et de l’Australie (Fonseca et al., 2006). Cx. pallens est distribué à l'Est de l'Oural à travers l'Asie tempérée (Fonseca et al., 2009). Cx. globocoxitus et Cx. australicus sont essentiellement limités à l’Australie. Cx. vagans est rencontrée en Chine, en Inde, en Corée, au Japon, et en Russie. Cx. fatigans et Cx. pervigilans sont rencontrés en Nouvelle Zélande et dans les îles avoisinantes (Belkin, 1968). Et finalement, Cx.
torrentium est une espèce paléarctique présente en Europe et dans certaines
régions asiatiques (Vinogradova, 2000).
Tableau IV. Caractères éco-physiologique des membres du complexe Cx. pipiens
Membre du complexe Autogénie Sténogame (S)/
Eurygame (E)
Diapause
Cx. pipiens forme pipiens Cx. pipiens formemolestus Cx. quinquefasciatus Cx. pallens Cx. globocoxitus Cx. australicus Cx. vagans Culex fatigans Cx. pervigilans Cx. torrentium - + - - ? - - ? ? - E S S S ? E E ? ? E + - - + - - + - ? + ?: non renseigné.
Le moustique Culex pipiens L. existe sous deux formes: une forme molestus et une forme pipiens.La forme molestus est autogène (capable de réaliser une première ponte sans prendre de repas de sang), sténogame (peut s’accoupler dans des
32
espaces confinés) et reste en activité durant la période hivernale (homodynamique). A l’inverse, la forme pipiens est anautogène (exigeant toujours un repas de sang pour réaliser une ponte), eurygame (s’accouple en plein air) et entre en diapause pendant l’hiver (hétérodynamique). De plus, la forme molestus et la forme pipiens se développent respectivement dans des gites épigés et hypogés en Russie et aux USA (Byrne & Nichols, 1999; Huang et al., 2008). Cependant, les deux formes peuvent cohabiter dans des gites hypogés ainsi qu’en gites épigés (Chevillon et al., 1995; Gomes et al., 2009; Reusken et al., 2010). Les deux formes semblent ne pas être isolées génétiquement et leurs hybrides sont présents aux USA, au Sud et au Nord de l’Europe (Fonseca et al., 2004; Gomes et al., 2009; Reusken et al., 2010). Les deux formes présenteraient des préférences trophiques différentes, la forme pipiens se nourrit principalement sur les oiseaux (ornithophile) et la forme molestus sur les mammifères (mammophile). Par ailleurs, les hybrides ont des préférences trophiques mixtes pour les oiseaux et les mammifères.
Cx. pipiens L. est le seul membre du complexe Culex pipiens présent en
Afrique du Nord. C’est un vecteur compétent pour plusieurs agents pathogènes affectant l’homme et/ou l’animal tel est le cas du virus West Nile (Krida et al., 2010), le virus de la fièvre de la vallée de Rift (Hoogstraal et al., 1979; Meegan et al., 1980; Moutailler et al., 2008) et de filaires (Harb et al., 1993; Krida et al., 1998; Abdul-Hamid et al., 2009; Abdul-Abdul-Hamid et al., 2011). Culex pipiens L. a déjà été décrit dans cette région. Il s’agit de descriptions basées sur des caractères morphologiques, physiologiques, reproductifs et écologiques (Roubaud, 1939; Knight & Malek, 1951; Gaud, 1953; Vermeil, 1954; Rioux, 1958; Senevet et al., 1958; Rioux, 1965; Pasteur et al., 1977; Himmi et al., 1995). Dans les zone urbaines, les populations de Cx.
pipiens colonisent les gites hypogés et ont été décrites comme autogènes,
sténogames et anthropophiles. Des populations anautogènes ont été également observées en gites épigés. A l’inverse, Cx. pipiens est anautogène, sténogame et anthropophile ou ornithophile en zones rurales. Cependant, ces caractères restent limités et une identification basée sur les différences génétiques semble nécessaire pour distinguer les membres du complexe Cx. pipiens. Dans cet objectif, plusieurs techniques ont été développées (Tableau V).
33
Tableau V. Marqueurs moléculaires utilisés pour identifier certains membres du complexe Cx.
pipiens
Marqueur Membres du complexe Cx. pipiens Références
Ribosomal Cx. pipiens Cx. restuans Cx. salinarius Crabtree et al. (1995) Ribosomal Cx. pipiens Cx. nigripalpus Aspen et al. (2003)
Nucléaire (Ace2) Cx. pipiens
Cx. quinquefasciatus Cx. pallens
Cx. torrentium Cx. australicus Cx. pervigilans
Smith & Fonseca (2004)
Nucléaire (Ace2) Cx. pipiens
Cx. quinquefasciatus
Aspen & Savage (2003)
Nucléaire (Ace2) Cx. pallens
Cx. pipiens forme molestus
Kasai et al. (2008)
Nucléaire (COI) Cx.pipiens forme pipiens
Cx.pipiens forme molestus
Shaikevich (2007)
Nucléaire (CQ11) Cx.pipiens forme pipiens
Cx.pipiens forme molestus