Acclimatation à la nuit polaire puis au retour de la lumière chez
la diatomée arctique Fragilariopsis cylindrus
Mémoire
Philippe-Israël Morin
Maîtrise en biologie
Maître ès sciences (M.Sc.)
Québec, Canada
© Philippe-Israël Morin, 2017
Acclimatation à la nuit polaire puis au retour de la lumière chez
la diatomée arctique Fragilariopsis cylindrus
Mémoire
Philippe-Israël Morin
Sous la direction de :
iii
Résumé (Français)
Durant l’hiver en Arctique, les algues de glace et le phytoplancton passent près de 6 mois à l’obscurité totale avant que les conditions pour la croissance soient optimales au printemps. Comment les algues polaires, composées principalement de diatomées, réussissent-elles à survivre à d’aussi longues périodes d’obscurité et à croître dès le retour de la lumière? Quels sont les mécanismes physiologiques impliqués? Les objectifs de l’étude présentée visent à caractériser l’état cellulaire d’une diatomée arctique, Fragilariopsis cylindrus, durant une période d’obscurité totale représentative de l’hiver polaire afin de mieux comprendre les mécanismes qui permettent la survie à l’obscurité prolongée et au retour de la lumière. Nous avons mesuré les mécanismes physiologiques impliqués en mesurant plusieurs paramètres à des intervalles précis: les premiers jours, les premières semaines et les trois premiers mois d’obscurité ainsi que les premières heures et les premiers jours des retours à la lumière après 1,5 et 3 mois d’obscurité. Les paramètres mesurés comprenaient le nombre et la taille des cellules, le carbone et l’azote particulaire, les lipides, la composition en pigments, la flurorescence variable, les protéines photosynthétiques (D1, RUBISCO), les paramètres photosynthétiques et le quenching non-photochimique (NPQ). Quelques jours après la transition à l’obscurité, Fragilariopsis cylindrus s’est acclimatée à un état stable qui s’est maintenu jusqu’au retour de la lumière. Cet état est caractérisé par un nombre et une taille des cellules stables, une faible consommation des réserves d’énergie, une faible diminution des pigments photosynthétiques et de très faibles capacités photosynthétiques. Après 1,5 mois d’obscurité, la réexposition à la lumière a déclenché une forte réponse du NPQ et un réassemblement de l’appareil photosynthétique, suivi d’une reprise des activités métaboliques et de la croissance cellulaire. La réexposition après 3 mois s’est caractérisée par une reprise des activités beaucoup plus lente, probablement causée par une mortalité plus importante.
iv
Résumé (Anglais)
Polar winter in the Arctic can last as long as 6 months each year at high latitude. During this period, no light is available for photoautotrophic growth. Nevertheless, when light returns in spring, a sea-ice algae and phytoplankton bloom develops in the surface ocean layers. Therefore, the following questions can be asked: How do photoautotrophic communities (mainly diatoms) survive through winter darkness until light returns in spring? What are the physiological mechanisms underlying such survival? Our goal was to understand the acclimation processes at stake in both darkness and during the return to light by closely looking at the changes in intra-cellular content and functional capacity of a polar sea-ice diatom, Fragilariopsis cylindrus. We measured a set of parameters at specific time-points: the first days and first weeks up to 3 months of darkness, and the first hours up to 6 days upon return to light. This set included cell number and cytometry, cellular carbon and nitrogen quotas, lipid and pigment contents, fluorescence determinations, photosynthetic proteins (D1, RUBISCO), photosynthetic parameters and non-photochemical quenching (NPQ). A rather stable state was reached few days following transition to dark and was maintained throughout until the return of light: stable cell size and number, low energy reserve consumption, slow decrease of photosynthetic pigments and very low photosynthetic capacities. Subsequent transition to light after 1.5 months induced strong NPQ activity and reassembly/renewal of photosynthetic components, followed by metabolic recovery and cell growth. Transition after 3 months showed a much slower recovery and no cell growth, highlighting the increase of potential mortality with longer periods of darkness.
v
Table des matières
Résumé (Français) ... iii
Résumé (Anglais) ... iv
Table des matières ... v
Listes des tableaux ... vii
Listes des figures ... viii
Listes des abbréviations ... x
Listes des annexes ... xii
Remerciements ... xiii
Avant propos ... xiv
Chapitre 1. Introduction ... 1
1.1 Les diatomées en Arctique ... 1
1.2 Floraisons printanières... 1
1.3 Survivre à l’hiver polaire ... 3
1.3.1 Production de spores de résistance ... 6
1.3.2 Nutrition hétérotrophe et métabolisme ... 6
1.3.3 Régulation de la physiologie et des activités métaboliques ... 8
1.3.4 Impact sur la photophysiologie ... 9
1.4 Retour de la lumière ... 11
1.4.1 Photoprotection ... 11
1.4.2 Reprise de la photophysiologie ... 12
Chapitre 2. Problématique ... 14
Chapitre 3. Objectifs et hypothèses de l’étude ... 15
Chapitre 4. Développement ... 16
4.1 Introduction ... 17
4.2 Methods ... 19
4.2.1 Cell culturing ... 19
4.2.2 Sampling design ... 19
4.2.3 Cell number and volume ... 21
4.2.4 Carbon and nitrogen ... 21
4.2.5 Lipid droplets ... 21 4.2.6 Pigments concentration ... 22 4.2.7 Photosynthetic proteins ... 22 4.2.8 Variable fluorescence ... 23 4.2.9 14C incubations ... 24 4.2.10 Statistical analysis ... 26
4.3 Results & discussion ... 28
4.3.1 Dark experiment ... 28
4.3.1.1 Cell and reserves ... 28
4.3.1.2 Photosynthetic apparatus dismantlement ... 30
vi
4.3.2.1 Photosensitivity and photosynthetic apparatus reassembly ... 36
4.3.2.2 Metabolism recovery ... 41
4.4 Conclusion ... 44
Chapitre 5. Conclusion ... 45
6. Références ... 48
vii
Listes des tableaux
Tableau 1 Liste des expériences de survie à l’obscurité chez plusieurs espèces de diatomées. ... 4
viii
Listes des figures
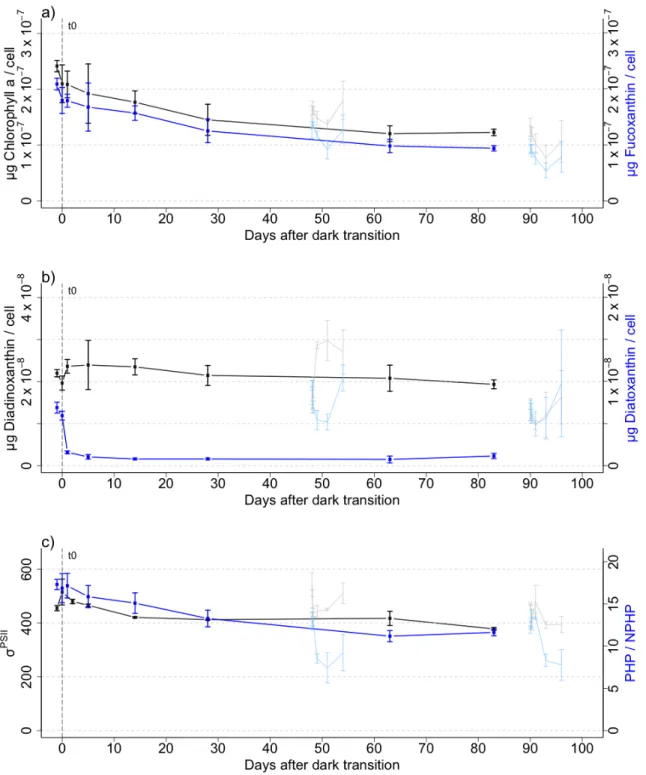
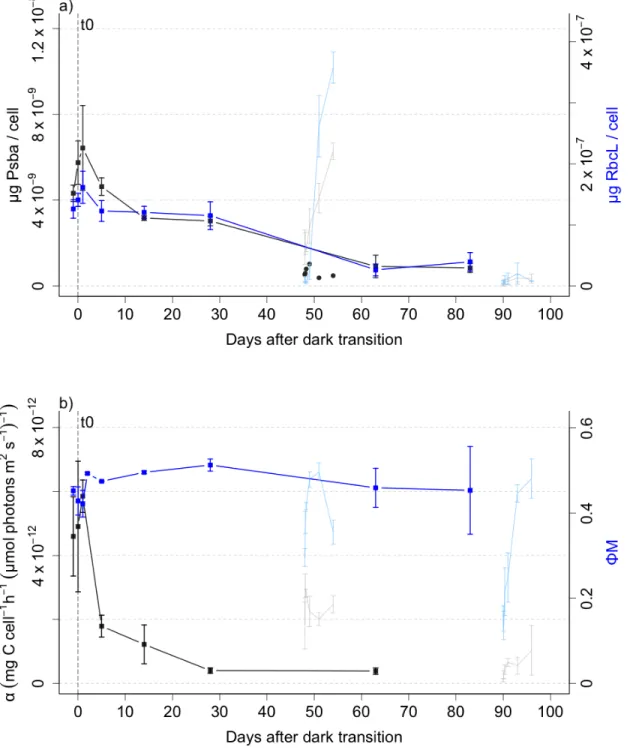
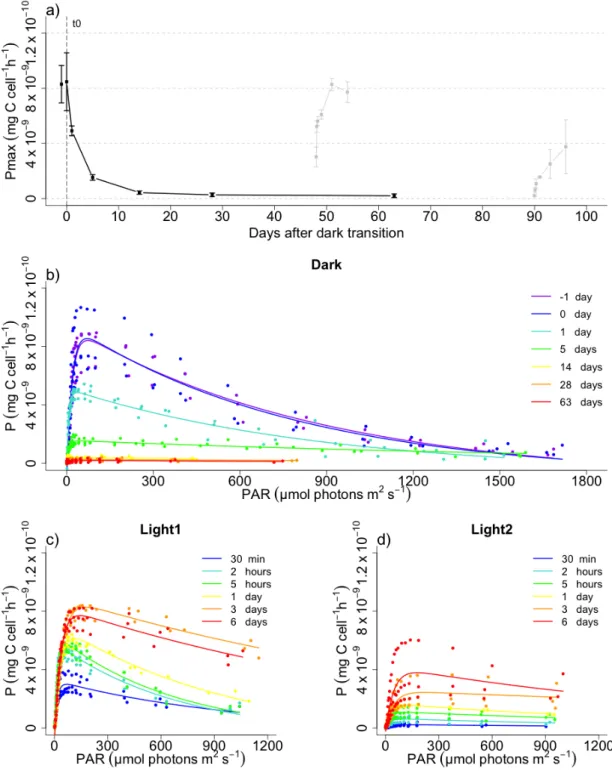
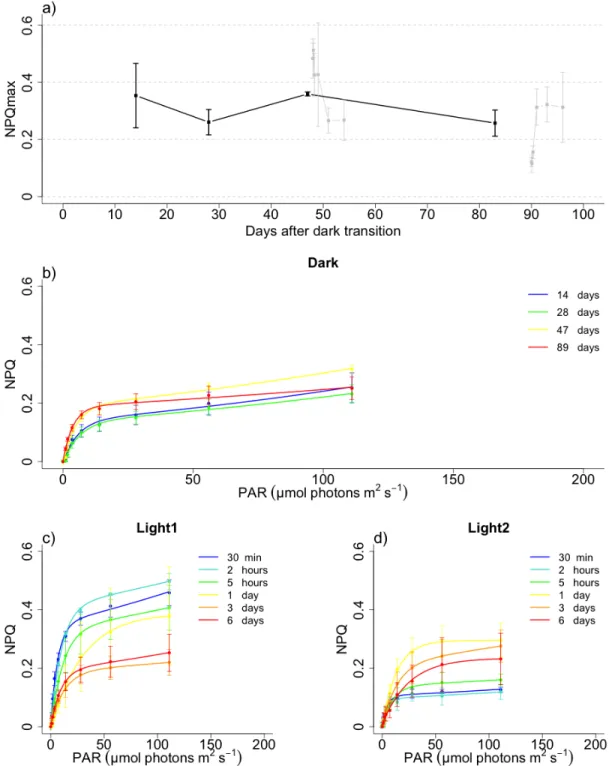
Figure 1 (A) Schémas représentant le développement de la floraison printanière en Arctique selon le temps de l’année. ... 2 Figure 2 Influence de la température sur la survie de différentes espèces à l’obscurité. ... 5 Figure 3 Timeline of the sampling strategy for dark period and light return experiments. The vertical lines show the times of sampling, and the dashed arrow shows transfer of a fraction of the replicate cultures prior to light return #1 at 1.5 months following dark transition. ... 20 Figure 4.a) Biovolume (black, gray) and Cell number per mL (blue, skyblue) b) Cell volume (black, gray) and lipid droplets (blue, skyblue) c) POC (black, gray) and PON (blue, skyblue) per cell of Fragilariopsis cylindrus cultures kept in the dark at 0°C for 90 days and exposed to continuous light of 30 µmol photons m-2 s-1 after 48 days and 90 days of darkness for the light return experiments. ... 29 Figure 5.a) Chlorophyll a (black, gray) and Fucoxanthin per cell (blue, skyblue) b) Diadinoxanthin (black, gray) and Diatoxanthin per cell (blue, skyblue) c) σPSII (black, gray) and PHP/NPHP (blue, skyblue) of Fragilariopsis cylindrus cultures kept in the dark at 0°C for 90 days and exposed to continuous light of 30 µmol photons m-2 s-1 after 48 days and 90 days of darkness for the light return experiments. ... 31 Figure 6.a) PsbA (black, gray) and RbcL (blue, skyblue) per cell b) initial slope of carbon fixation (α) (black, gray) and ΦM (blue, skyblue) of Fragilariopsis cylindrus cultures kept in the dark at 0°C for 90 days and exposed to continuous light of 30 µmol photons m-2 s-1 after 48 days and 90 days of darkness for the light return experiments. ... 33 Figure 7.a) Carbon fixation maximum (Pmax) (black, gray) of Fragilariopsis cylindrus cultures kept in the dark at 0°C for 90 days and exposed to continuous light of 30 µmol photons m-2 s-1 after 48 days and 90 days of darkness for the light return experiments. ... 34 Figure 8.a) Non-photochemical quenching maximum (NPQmax) (black, gray) of
Fragilariopsis cylindrus cultures kept in the dark at 0°C for 90 days and exposed to
continuous light of 30 µmol photons m-2 s-1 after 48 days and 90 days of darkness for the light return experiments. ... 35 Figure 9.a,b) NPQmax (black) and de-epoxidation state (DES) (blue) c,d) Diadinoxanthin (black) and Diatoxanthin (blue) per cell of Fragilariopsis cylindrus cultures for the Light1 and Light2 experiments. ... 37 Figure 10.a,b) Chlorophyll a (black) and Fucoxanthin (blue) per cell b,c) σPSII (black,) and PHP/NPHP (blue) of Fragilariopsis cylindrus cultures for the Light1 and Light2 experiments.. ... 38
ix
Figure 11.a,b) PsbA (black) and RbcL (blue) per cell c,d) Pmax (black) and ΦM (blue) of
Fragilariopsis cylindrus cultures for the Light1 and Light2 experiments. Each points is the
mean of the three cultures with their standard deviation as the error bars. ... 40 Figure 12.a,b) POC (black) and PON (blue) per cell c,d) Cell volume (black) and Lipid droplets (blue) e,f) Biovolume (black) and Cell number per mL (blue) of Fragilariopsis
cylindrus cultures for the Light1 and Light2 experiments. ... 42
x
Listes des abbréviations
POC Carbone organique particulaire PON Azote organique particulaire DOC Carbone organique dissous
BODIPY 4,4-Difluoro-1,3,5,7-Tetramethyl-4-Bora-3a,4a-Diaza-s-Indacene LHCII Complexe antennaire de l’absorption de la lumière au photosystème II LHC Complexe antennaire de l’absorption de la lumière
FCP Complexe protéique antennaire lié à la chlorophylle et la fucoxanthine PSII Photosystème II
CP43-47 Protéines de l’antenne interne du photosystème II RCII Centre réactionnel du photosystème II
Chl a Chlorophylle a Chl c Chlorophylle c Fuco Fucoxanthine
DD Diadinoxanthine
DT Diatoxanthine
DES État de de-époxidation (DT/(DD+DT))
PHP Pigments photosynthétiques (Chl a + Chla c + Fuco) NPHP Pigments non-photosynthétiques (DD+DT)
σPSII Section efficace d'absorption de la lumière du PSII [Å2 (quanta)-1] ΦM Rendemant photochimique maximale au PSII
ΦPSII Rendement photochimique au PSII RLC Rapid light curve protocol
xi
ETRmax Taux maximal relatif du transport d’électron NPQ «Quenching» non-photochimique
NPQmax «Quenching» non-photochimique maximal D1 Protéine du RCII
PsbA Sous-unité de la D1
RUBISCO Ribulose-1,5-bisphophaste carboxylase/oxygénase (Enzyme responsable de la fixation du carbone)
RbcL Grande sous-unité de la RUBISCO
Pchl
Taux spécifique de fixation de carbone [mg C (mg chl a)-1 h-1] Pmax Taux maximal de fixation de carbone (mg C m-3 h-1)
α Coefficient de l’activité photosynthétique ou pente initiale de la courbe P vs E [mg C m-3 h-1 (µmol photons m-2 s-1)-1]
EK Paramètre de saturation de la fixation de carbone (µmol photons m-2 s-1) KE Éclairement auquel le taux de croissance sature (µmol photons m-2 s-1)
xii
Listes des annexes
Annexe 1: Picture of Fragilariopsis cylindrus (Grunow) Krieger CCMP1102 (JGI)……..56 Annexe 2: Culture medium recipe (f/2 and L1)………57 Annexe 3: Picture of the inside of the growth chamber with culture 1(left), culture 2(centerback) and culture 3(right) of Fragilariopsis cylindrus grown in 20L polycarbonate round vessels during light acclimation prior to dark transition……...59 Annexe 4: Spectrum of the different light sources used during the experiment…………...60 Annexe 5: Picture of the culture 1(front), culture 2(middle) and culture 3(back) of
xiii
Remerciements
J’aimerais tout d’abord remercier mon directeur Marcel Babin pour avoir supervisé mes travaux tout au long de ma maîtrise, pour m’avoir bien conseillé lors des différentes étapes de mon cheminement et pour m’avoir transmis les bonnes pratiques de la science. Merci aussi pour toutes les opportunités de collaborations, d’expéditions, de conférences et de réseautages auxquelles j’ai eu accès. Enfin, merci pour avoir contribué à ma formation professionnelle et au développement de mon sens critique et de ma notion sur la rigueur qu’il faut appliquer en recherche.
Pour la mise en œuvre de mon expérience, je remercie particulièrement Flavienne Bruyant. J’ai pu appliqué les bonnes techniques dans le laboratoire dès le départ et éviter de recommencer mes expériences plusieurs fois. Merci aussi pour avoir participé très activement lors des périodes d’échantillonnage. Enfin, merci pour avoir pris le temps de répondre à mes nombreuses questions.
Pour l’évaluation du mémoire ci-présent, j’aimerais remercier les membres du jury d’évaluation composé de Connie Lovejoy, Line Lapointe et Marcel Babin. Merci pour votre temps et pour vos commentaires constructifs.
J’aimerais aussi remercier Johann Lavaud, Joannie Ferland, Marie-Hélène Forget, Thomas Lacour, Pierre-Luc Grondin, Jade Larivière, Natalie Donaher et Doug Campbell pour avoir participé activement lors de l’échantillonnage et/ou lors de la révision de mon manuscript. Merci aussi à Catherine Lalande, Thibaud Dezutter, Marie-Josée Martineau, Gabrièle Deslonchamps, Chris Eberlein, Alexandre Dubé pour leur aide lors de l’analyse d’échantillons. Merci à Joannie Beaupré, Manon Bélanger et Gabriel Khelifi pour leur aide lors de périodes d’échantillonnage. Merci à Nicolas Schiffrine pour son aide en laboratoire pour le partage d’équipements. Merci à José Lagunas-Morales et Guislain Bécu pour leur aide lors de la conception de l’éclairage pour mes expériences. Merci à Marc-André Lemay et à Philippe Massicote pour leur aide en programmation et en statistique. Merci à Julie Sansoulet et Debra Christiansen-Stowe pour leur support administratif. Finalement, merci à toute l’équipe de l’Université de Mount Allison pour m’avoir accueilli lors de ma visite en été 2016 pour l’analyse d’échantillons. Un merci spécial à Natalie et Daniel Donaher pour m’avoir hébergé lors cette visite.
Pour terminer, j’aimerais remercier mes amis pour leur support en dehors de l’université. Merci aussi à mes parents pour leur aide tant sur plan moral que sur le plan financier. Finalement, merci pour tous vos encouragements qui furent très appréciés.
xiv
Avant propos
La soumission de l’article inséré est prévue à l’été 2017 dans New Phytologist. L’étudiant Philippe-Israël Morin est le principal auteur du manuscript présenté. Il a contribué en majeure partie à toutes les étapes menant à la publication de l’article inséré. Les coauteurs listés ont participé activement lors l’acquisition de données et/ou lors de la révision du manuscript.
1
Chapitre 1. Introduction
1.1 Les diatomées en Arctique
Les diatomées sont des eucaryotes unicellulaires et photosynthétiques qui dominent depuis plus de 100 Ma la grande majorité des océans (Armbrust 2009, Bowler et al., 2010). Elles forment le groupe de phytoplancton le plus diversifié et le plus abondant avec plus de 100 000 espèces et produisent à elles seules 40 % de la production primaire marine (Nelson et
al., 1995, Sarthou et al., 2005, Falkowski and Knoll 2007). Leur rôle est essentiel au sein
de la chaine alimentaire marine. En Arctique, les diatomées représentent le groupe de phytoplancton et d’algues de glace le plus abondant durant la floraison printanière (Hsiao 1980, von Quillfeldt 2000, Poulin et al., 2011). Actrices majeures dans l’écosystème arctique, elles font face aux conditions extrêmes de température, salinité et de lumière de cet environnement. Les adaptations à ces conditions extrêmes chez les microorganismes et chez les microalgues ont reçu une attention grandissante au cours des dernières années (Morgan-Kiss et al., 2006, Casanueva et al., 2010, Lyon and Mock 2014, Lacour et al., 2017), mais il reste encore beaucoup à découvrir sur les adaptions particulières des diatomées polaires.
1.2 Floraisons printanières
Aux pôles, quand le printemps approche et le jour s’allonge, la fonte de la banquise annuelle débute et l’éclairement qui pénètre la colonne d’eau s’intensifie. La couche superficielle de l’océan stratifiée par l’eau de fonte est alors riche en nutriments grâce au mélange hivernal. Ces conditions permettent aux communautés phytoplanctoniques d’entrer dans une période de croissance cruciale pour la production primaire et secondaire en Arctique (Leu et al., 2011). Cette période de croissance est appelée la floraison printanière. La production primaire atteint son maximum durant la floraison printanière et elle fournit la majeure partie de la production annuelle en Arctique (Perrette et al., 2011). Les premières à initier une croissance autotrophe au printemps après la nuit polaire sont les « micro-algues de glace » (algues sympagiques) malgré les très faibles lumières qu’elles reçoivent sous la banquise généralement couverte de neige (Mundy et al., 2005, Leu et al., 2011, Wassmann 2011) (Fig. 1). Ces algues de glace peuvent contribuer jusqu’à 57% de la
2
production annuelle dans certaines régions de l’Arctique (Gosselin et al., 1997). Néanmoins, les espèces pélagiques (phytoplancton) contribuent à la majeure partie de la production primaire. Avant que les conditions pour la croissance soient optimales au printemps, les algues de glace et le phytoplancton passent près de 6 mois à l’obscurité presque totale.
Figure 1 (A) Schémas représentant le développement de la floraison printanière en Arctique selon le temps de
l’année. La croissance des algues de glace débute à la mi-mai et est éventuellement remplacée par la floraison du phytoplancton lorsque la banquise se retire. Les mois de juin et juillet voient les communautés photoautotrophes (en vert) se développer jusqu’à ce que les nutriments s’appauvrissent. Les communautés hétérotrophes (en rouge) dominent la fin de l’été et l’automne. Les flèches indiquent le transport vertical de la matière organique. Cette figure est tirée de Wassmann (2011).
Ces organismes sont des photoautotrophes, c’est-à-dire qu’ils utilisent l’énergie de la lumière pour synthétiser du carbone organique par un processus biochimique complexe, la photosynthèse. Les micro-algues peuvent être exposées régulièrement à des périodes d’obscurité plus longues que la nuit. Par exemple, le mélange vertical peut être beaucoup plus profond que la zone euphotique1(Marshall and Schott 1999). Le phytoplancton emporté sous la zone euphotique peut passer une longue période à l’obscurité avant de retourner à la surface. Privé de la photosynthèse, le phytoplancton doit acclimater son métabolisme pour survivre. La survie à l’obscurité est fondamentale chez le phytoplancton et elle l’est d’autant plus pour les espèces soumises à l’hiver polaire. En Arctique, leur métabolisme doit forcément être compatible avec 6 mois d’obscurité, grâce à des adaptations exclusives ou non aux espèces arctiques. Plus particulièrement, on s’intéressera aux espèces de diatomées en raison de leur prépondérance en Arctique.
3
1.3 Survivre à l’hiver polaire
La survie des micro-algues à l’obscurité prolongée a été étudiée à de nombreuses reprises au cours des dernières décennies. On a observé que la croissance reprenait dès le retour à la lumière (Smayda and Mitchell.B 1974, Antia 1976, Palmisano and Sullivan 1983, Peters 1996, Peters and Thomas 1996, Zhang et al., 1998, Luder et al., 2002, Reeves et al., 2011, Martin et al., 2012) (Tableau 1). La durée de la période d’obscurité qui fut imposée aux micro-algues varie selon les expériences. La viabilité de certaines espèces s’est prolongée jusqu’à 3 ans (Antia 1976). Peters and Thomas (1996) et Peters (1996) ont montré dans des expériences séparées que les algues antarctiques semblent être mieux adaptées pour la survie à de longue période d’obscurité que les algues tempérées. Ces résultats suggèrent que les espèces polaires ont développé des adaptations qui leur permettent une meilleure survie à l’obscurité que les espèces tempérées.
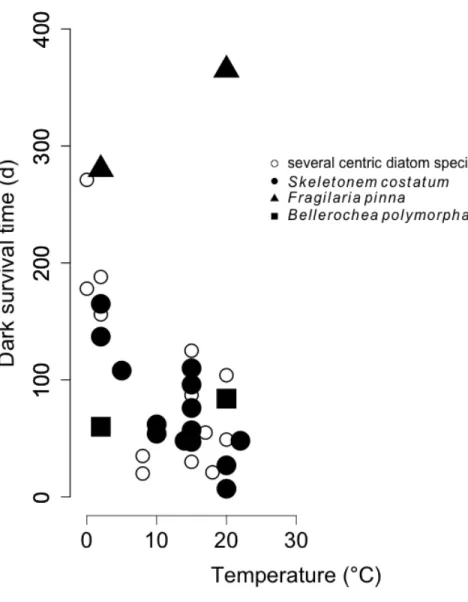
Cependant, la survie pourrait être dépendante de la température du milieu comme cela a été observé chez la diatomée Skeletonema costatum (Smayda and Mitchell.B 1974) et plusieurs autres espèces de diatomées (Peters 1996) (Fig. 2). La survie à l’obscurité chez la majorité des espèces étudiées a diminué lorsque température d’incubation a augmenté. Dans le contexte du réchauffement climatique, les espèces polaires seront vraisemblablement confrontées à des températures moyennes plus élevées (Stroeve et al., 2007, Grebmeier 2012, McMinn and Martin 2013) et pourraient voir leur survie diminuer. Récemment, des expériences menées au noir sur des diatomées polaires ont montré qu’elles tolèrent une élévation de 6°C par rapport à la température ambiante de croissance, soit 4°C de plus que les prédictions sur la hausse des températures de surface des océans d’ici la fin du 21e siècle (Reeves et al., 2011, Martin et al., 2012, McMinn and Martin 2013) (IPCC 2014). Toutefois, ces résultats ont été obtenus à partir d’expériences à l’obscurité inférieures à 60 jours. Dans un contexte où la nuit polaire dure jusqu’à 6 mois et où les conditions physico-chimiques (nutriments, salinité, dynamique du mélange vertical, lumière, température) des couches superficielles de l’océan Arctique peuvent changer, il n’est pas simple de tirer des conclusions claires sur la survie des diatomées polaires sans connaître l’impact synergique de ces variables entre elles.
4
Tableau 1 Liste des expériences de survie à l’obscurité chez plusieurs espèces de diatomées. Toutes les
espèces présentées ont repris la croissance au retour de la lumière. Tableau tiré de Wulff et al., (2008)
Species Temperature Dark exposure times (days) Reference
Achnanthes brevipes Agardh 20°C 56* Antia & Cheng 1970
Achnanthes brevipes Agardh 2, 20°C 364 Antia 1976
Amphiprora paludosa Smith 20°C 56* Antia & Cheng 1970
Amphiprora paludosa var. duplex Donkin 2, 20°C 189, 133 Antia 1976
Amphora coffeaeformis (Ag.) Kütz 7°C 28* Anderson 1975b
Anaulus australis Drebes et Schulz 18°C (±2) 62* du Preez & Bate
Araphid, pennate diatom ca 10 µm -2°C 310 (364)a Palmisano & Sullivan 1982
Asterionella japonica Cleve (Asterionellopsis glacialis (Castracane) Round) 15°C 90* Smayda & Mitchell-Innes 1974
Bacteriastrum sp. 18°C 17* Jochem 1999
Bellerochea polymorpha Hargraves & Guillard (Minutocellus polymorphus
(Hargraves & Guillard) Hasle, von Stosch & Syvertsen) 2, 10, 20°C 63, >140, 84 Antia 1976
Chaetoceros curvisetus Cleve 15°C 90* Smayda & Mitchell-Innes 1974
Chaetoceros didymus Ehrenberg 15°C 90d* Smayda & Mitchell-Innes 1974
Chaetoceros fragile Meunier -1.8°C 93* Bunt & Lee 1972
Chaetoceros gracilis Schütt 20°C 56* Antia & Cheng 1970
Chaetoceros gracilis Schütt 2, 10, 20°C 112,>210*,133 Antia 1976
Cyclotella cryptica Reimann, Lewin & Guillard 20°C 56* Antia & Cheng 1970
Cyclotella cryptica Reimann, Lewin & Guillard 2, 20°C 189,105 Antia 1976
Cyclotella nana Hustedt 20°C 49 Antia & Cheng 1970
Cylindrotheca fusiformis Reimann & Lewin 20°C 56* Antia & Cheng 1970
Cylindrotheca fusiformis Reimann & Lewin 2, 20°C 364 Antia 1976
Ditylum brightwellii (West) Grunow 8, 15°C 35**,30 Peters 1996
Ditylum brightwellii (West) Grunow 15°C 90* Smayda & Mitchell-Innes 1974
Fragilaria pinnata Ehrenberg (Staurosirella pinnata (Ehrenberg) D.M.
Williams & Round) 2, 20°C 280, 364 Antia 1976
Fragilaria sublinearis van Heurck -1.8°C 93* Bunt & Lee 1972
Fragilariopsis kerguelensis (O'Meara) Hustedt 0°C (±1) 127 Peters & Thomas 1996
Lithodesmium undulatum Ehrenberg 15°C 90* Smayda & Mitchell-Innes 1974
Melosira nummuloides Agardh 20°C 56* Antia & Cheng 1970
Melosira nummuloides Agardh 2, 20°C 336, 105 Antia 1976
Navicula incerta Grunow ex Van Heurck 20°C 56* Antia & Cheng 1970
Navicula incerta Grunow ex Van Heurck 2, 20°C 364 (1092)a, 364 wks Antia 1976
Nitzschia angularis Smith 20°C 56* Antia & Cheng 1970
Nitzschia angularis var. affinis (Grunow) Grunow 2, 20°C 364 (1092)a
, 364 Antia 1976
Nitzschia cylindrus (Grunow) Hasle, size 4 gm -2°C 155 (364)b Palmisano & Sullivan 1982
Nitzschia cylindrus (Grunow) Hasle, size 6 gm -2°C 155 (364)b Palmisano & Sullivan 1982
Nitzschia-like 18°C 17* Jochem 1999
Phaeodactylum tricornutum Bohlin 20°C 168* Antia & Cheng 1970
Phaeodactylum tricornutum Bohlin 2, 20°C 364, 364 Antia 1976
Phaeodactylum tricornutum Bohlin 5°C 93 Umebayashi 1972 cited in Anderson 1975b
Porosira pseudodenticulata (Hustedt) Jousé 0°C (±1) 272 Peters & Thomas 1996
Proboscia inermis (Castracane) Jordan & Ligowski 0°C (±1) 214 Peters & Thomas 1996
Rhizosolenia fragilissima Bergon (Dactyliosolen fragilissimus (Bergon) Hasle) 18°C 23* Ignatiades & Smayda
Rhizosolenia setigera Brightwell 8°C 21 Peters 1996
Skeletonema costatum (Greville) Cleve 20°C 7 Antia & Cheng 1970
Skeletonema costatum (Greville) Cleve 2, 10, 20°C 168, 63, 28 wks Antia 1976
Skeletonema costatum (Greville) Cleve 15°C 49 Smayda & Mitchell-Innes 1974
Thalassiosira antarctica Comber 0°C (+1) 214 Peters & Thomas 1996
Thalassiosira fluviatilis Hustedt 20°C 56* Antia & Cheng 1970
Thalassiosira fluviatilis Hustedt 2, 20°C 140, 105 Antia 1976
Thalassiosira gravida Cleve 15°C 90* Smayda & Mitchell-Innes 1974
Thalassiosira pseudonana Hasle & Heimdal 2, 20°C 161, 105 Antia 1976
Thalassiosira punctigera (Castracane) Hasle 8°C 35** Peters 1996
Thalassiosira sp. 15°C 90* Smayda & Mitchell-Innes 1974
*Période maximale testée
**Nombre de cellules constant pendant 63 jours
aViabilité jusqu’à 3 ans
bCulture non-diluée laissée pendant 12 mois et dont la croissance a repris après une phase de latence de 3 à 6
5
Figure 2 Influence de la température sur la survie de différentes espèces à l’obscurité. Figure reproduite de
Peters (1996)
Alors que les premières études confirmant la survie des micro-algues à des périodes d’obscurité prolongées n’ont pas offert d’explications sur les mécanismes physiologiques impliqués, les expériences plus récentes les ont examiné de plus près à l’aide de techniques de pointe maintenant plus accessibles. Les expériences de survie à l’obscurité prolongée n’ont pas exclusivement traité de diatomées, mais les informations obtenues sur d’autres groupes de micro-algues fournissent des pistes qui pourraient être pertinentes vis-à-vis de la physiologie des diatomées.
6
1.3.1 Production de spores de résistance
Plusieurs groupes de micro-algues peuvent produire des spores de résistance lorsque les conditions environnementales deviennent instables. Chez les diatomées, la production de spores de résistance avec une paroi de silice plus épaisse améliore la longévité. Ce type de cellule au repos limite les échanges avec le milieu et réduit la respiration à un taux négligeable (Hargraves and French 1983). Bien que la formation de spores de résistance est souvent déclenchée suite à l’épuisement des nutriments, les changements de lumière et de température pourraient aussi induire leur production chez les diatomées polaires (Doucette and Fryxell 1983). En Antarctique, la production de ces spores chez les diatomées a été documentée à plusieurs reprises dans la littérature (Hart 1942, Hoban et al., 1980, Doucette and Fryxell 1983, Fryxell 1994). Néanmoins, la production de spores de résistance ne peut pas expliquer à elle seule la survie à l’obscurité prolongée. Les expériences réalisées sur la survie au noir n’ont généralement pas signalé la formation de ces spores. Les cellules garderaient leur forme végétative et il semble qu’elles entreraient dans un état physiologique de dormance (Peters and Thomas 1996). À l’opposé des spores de résistance, les cellules végétatives en dormance reviennent à leur état actif en l’espace de quelques heures (Anderson 1975, Sicko-Goad et al., 1986).
1.3.2 Nutrition hétérotrophe et métabolisme
L’hétérotrophie est un mode de nutrition par lequel les organismes utilisent le carbone organique présent dans le milieu comme source d’énergie. Bien que les organismes photosynthétiques puissent fabriquer leur propre carbone organique grâce à l’énergie de la lumière, plusieurs d’entre eux sont capables d’utiliser en plus une variété de substrats organiques, incluant acides aminés et acides gras, pour satisfaire leurs besoins en énergie et en nutriments (Neilson and Lewin 1974). Ces organismes, dits mixotrophes, sont à la fois photoautotrophe et hétérotrophe. Chez les diatomées, la nutrition hétérotrophe a été décrite il y a longtemps déjà (Lewin 1953, Hellebust and Lewin 1977, Tuchman et al., 2006). Dans l’expérience de White (1974), elle a permis à deux diatomées centriques tempérées de survivre et de croître pendant 1 an à l’obscurité dans un milieu enrichi. Les diatomées peuvent ainsi être caractérisées comme des photohétérotrophes, c’est-à-dire qu’elles peuvent satisfaire leurs besoins nutritionnels grâce à des sources de carbone organique autres que celui produit par la photosynthèse (Rivkin 1987, Tuchman et al., 2006). La
7
consommation de différentes sources d’acides aminés et de glucose a été observée chez des diatomées antarctiques dans des conditions d’obscurité et de lumière (Rivkin 1987). La survie des diatomées durant l’hiver polaire pourrait donc faire intervenir l’hétérotrophie. Palmisano and Sullivan (1982) ont mesuré chez des diatomées de glace antarctiques une augmentation de l’hétérotrophie lors d’une simulation expérimentale de la transition été-hiver en Antarctique. En dépit des informations obtenues jusqu’à présent sur l’hétérotrophie des diatomées, la survie des algues polaires durant la nuit polaire grâce à la nutrition hétérotrophe reste incertaine (Popels and Hutchins 2002, McMinn and Martin 2013).
La publication des génomes de Thalassiosira pseudonana et Phaeodactylum tricornutum a permis de comprendre davantage l’endosymbiose en série dans l’évolution des diatomées (Armbrust et al., 2004, Bowler et al., 2008, Bowler et al., 2010). Plusieurs gènes de l’hôte hétérotrophe seraient retenus et plusieurs autres seraient acquis de bactéries par transfert horizontal. Ce mélange de gènes offrirait aux diatomées une panoplie de voies métaboliques à l’origine de leur succès écologique dans un large éventail de conditions environnementales. Par exemple, la voie complète du cycle de l’urée chez les diatomées (absente chez les algues vertes) est vue comme un moyen de redistribuer le carbone et l’azote inorganique dans la cellule lorsque les nutriments sont faibles (Allen et al., 2011, Fernie et al., 2012). Il est possible que les diatomées polaires possèdent aussi plusieurs transporteurs membranaires pour les plus grosses molécules organiques. La publication du génome de Coccomyxa subellipsoidea, une algue verte polaire, révèle par ailleurs un nombre plus élevé de transporteurs pour les acides aminés que chez les espèces tempérées (Blanc et al., 2012). De plus, la publication récente du génome de la diatomée polaire
Fragilariopsis cylindrus révèle une différenciation allélique importante qui serait
avantageuse lors des fluctuations physico-chimiques extrêmes des océans polaires (Mock et
al., 2017). Ces différentes informations laissent à penser que les diatomées arctiques
possèderaient un métabolisme flexible et adapté qui leur permet d’optimiser l’incorporation et l’assimilation des nutriments dans les conditions extrêmement variables de l’Arctique (Lyon and Mock 2014).
8
1.3.3 Régulation de la physiologie et des activités métaboliques
La production de spores de résistance n’a pas été observée dans des expériences au noir impliquant des diatomées polaires (Palmisano and Sullivan 1983, Peters and Thomas 1996) et très peu dans les communautés échantillonnées en Arctique et subséquemment placées au noir (Zhang et al., 1998). Néanmoins, toutes les espèces testées ont repris leur croissance lors du retour à la lumière. Il est possible que les cellules placées à l’obscurité ajustent leur métabolisme et entrent dans un état de « dormance » physiologique. Des mesures de fluorescence par cytométrie en flux ont révélé chez trois chlorophytes une diminution suivie d’une stabilisation de l’activité métabolique lors d’une courte période à l’obscurité (10 jours). Les concentrations de carbone et d’azote organique particulaire par cellule durant 80 jours d’obscurité sont restées stables chez trois diatomées antarctiques (Peters and Thomas 1996). Ces résultats suggèrent que le métabolisme cellulaire a été réduit pour ne pas épuiser rapidement les réserves énergétiques. Des conclusions similaires ont été rapportées suite à une expérience au noir sur des diatomées tempérées et elles suggèrent une réduction concomitante de la respiration cellulaire (Peters 1996).
Le stockage de composés organiques sous forme de lipides est fréquent chez les diatomées et est proposé comme un moyen de survie à l’hiver polaire. Jusqu’à 80% du carbone nouvellement fixé serait incorporé sous forme de lipides chez le phytoplancton antarctique maintenu à faible température et à faible lumière (Smith and Morris 1980). L’accumulation de lipides et de carbohydrates ainsi que leur utilisation subséquente ont été observées chez des diatomées antarctiques lors d’une simulation de la transition lumière-obscurité (Palmisano and Sullivan 1982). Toutefois, cette accumulation n’était peut-être pas suffisante pour assurer les besoins énergétiques durant tout un hiver compte tenu de la courte période expérimentale (30 jours). Néanmoins, le catabolisme des lipides et des carbohydrates semble être important au début de la période d’obscurité. Chez F. cylindrus, une expérience de 7 jours à l’obscurité a montré une augmentation de gènes transcrits impliqués dans le métabolisme des sucres et des lipides (Mock et al., 2017). De plus, Schaub et al., (2017) ont récemment mesuré une dégradation des ressources lipidiques plus intense lors des deux premières semaines d’obscurité chez la diatomée benthique arctique
9
diatomée tempérée Skeletonema Costatum (Handa 1969) et chez la pelagophyceae
Aureococcus anophagefferens (Popels et al., 2007), une dégradation des carbohydrates et
des protéines préférentielle aux lipides a été observée. Ce patron d’utilisation des réserves énergétiques a aussi été mesuré lors d’une expérience plus longue de 3 mois d’obscurité chez la chlorophyceae Scenedesmus acuminatus (Dehning and Tilzer 1989). Les observations accumulées jusqu’à présent suggèrent une utilisation des réserves énergétiques plus importante au début de la période d’obscurité avec une variabilité interspécifique dans le patron d’utilisation. Tous s’entendent sur une diminution du métabolisme et d’une réduction dans le taux d’utilisation des réserves énergétiques avec le nombre de jours passés à l’obscurité.
1.3.4 Impact sur la photophysiologie
L’appareil photosynthétique chez tous les photoautotrophes s’acclimate aux variations de lumière qui surviennent dans l’environnement par différents processus de la photoacclimatation. La photophysiologie s’ajuste selon la lumière disponible par des changements dans la composition macromoléculaire de l’appareil: proportions relative des pigments photoprotecteurs et photosynthétiques, des centres réactionnels des photosystèmes I et II, des complexes de la chaîne de transport des électrons, et des enzymes impliquées dans le cycle de Calvin (Falkowski and Laroche 1991, Demmig-Adams and Adams 1992, Brown et al., 2008). Passant de 24 heures d’ensoleillement par jour en été à l’obscurité totale en hiver et sous une bonne épaisseur de glace couverte de neige, on peut s’attendre à ce qu’un stress survienne au niveau de l’appareil photosynthétique. Généralement, une diminution de la chlorophylle a chez différents groupes de phytoplancton a été observée lors de longues périodes d’obscurité (Dehning and Tilzer 1989, Peters 1996, Baldisserotto et al., 2005a, Baldisserotto et al., 2005b, Ferroni et al., 2007, Veuger and van Oevelen 2011). Des mesures de microspectrofluorimétrie et de microscopie électronique en transmission chez Koliella antartica et Xanthonema sp. (une algue verte et une xanthophyceae de neige) ont aussi révélé des changements rapides dans l’appareil photosynthétique dès les premiers jours d’obscurité (Baldisserotto et al., 2005a, Baldisserotto et al., 2005b, Ferroni et al., 2007). Les chloroplastes sont devenus moins nombreux au centre des cellules et ont montré des signes de dégradation. Les rapports de fluorescence mesurés pour RCII/CP43-47 et LHCII/PSII (indiquent respectivement le degré
10
d’association au cœur du photosystème II et le degré d’assemblage entre l’antenne externe et le photosystème II) ont changé durant la période d’obscurité. Le cœur du photosystème II s’est dégradé plus rapidement, alors que l’association du complexe antennaire LHCII avec le photosystème II est restée plus stable. Cette stabilité du LHCII pourrait être bénéfique au retour de la lumière après l’hiver polaire (Ferroni et al., 2007). Cependant, chez la chlorophyte Chlamydomonas raudensis isolée en Antarctique, le complexe antennaire LHCII serait dissocié du photosystème II durant l’hiver selon le modèle suggéré par Morgan-Kiss et al., (2006). Toutefois, la conservation du complexe pigments-protéines LHCII a été proposée comme une caractéristique qui facilite la réassociation avec le photosystème II dès le retour de la lumière. Malgré ces conclusions, les informations présentées ici ne sont pas issues d’expériences conduites chez des diatomées (bien que
Xanthonema sp. soit plus proche des diatomées que des algues vertes) (Adl et al., 2005).
Une réponse différente pourrait être observée chez une diatomée arctique.
Le taux de fixation maximale de carbone normalisé par la chlorophylle a (PChl) [mg C (mg chl a)-1 h-1] diminue fortement chez plusieurs groupes de phytoplancton (Hellebust and Terborgh 1967, Griffiths 1973, Dehning and Tilzer 1989, Peters and Thomas 1996, Popels
et al., 2007) et chez la diatomée arctique Chaetoceros neogracile (non-publié, Lacour et al.,
2017) lorsqu’ils sont placés à l’obscurité. Cette réponse suggère un démantèlement de l’appareil photosynthétique plus important combiné avec une dégradation partielle de l’antenne comme mentionné ci-haut. Une diminution concomitante de l’activité et de la quantité de RUBISCO (enzyme responsable de fixation de carbone) serait à l’origine des faibles valeurs de PChl mesurées après une longue période d’obscurité (Dehning and Tilzer
1989, Popels et al., 2007) (non-publié, Lacour et al., 2017). Lors d’expériences portant sur des diatomées polaires, des communautés phytoplanctoniques arctiques et antarctiques et des communautés d’algues de glace antarctiques (composées principalement de diatomées), des modifications similaires sur les capacités photosynthétiques des cellules ont été décrites. La diminution des valeurs du rendement photochimique du PSII [unité relative] (ΦPSII), du coefficient d'efficacité́ photosynthétique [mg C m-3 h-1 (µmol photons m-2 s-1)-1] (α), et du taux maximal du transport d’électron [unité relative] (ETRmax) a indiqué une
11
baisse progressive des performances photosynthétiques à l’obscurité (Luder et al., 2002, Reeves et al., 2011, Martin et al., 2012).
1.4 Retour de la lumière
1.4.1 PhotoprotectionAu retour de la lumière après une longue période d’obscurité, les cellules photosynthétiques encore viables doivent gérer les photons qui les atteignent. Elles doivent optimiser leur propriétés d’absorption de la lumière et surtout éviter les dommages par d’éventuels éclairements excessifs. Les algues de glace reçoivent des quantités de lumière qui augmentent à mesure que le jour s’allonge et que la glace s’amincit. Lors de la débâcle, le phytoplancton peut subir une augmentation plus brusque de l’éclairement. Particulièrement, la fonte du manteau neigeux intervient souvent brusquement et s’accompagne de mares de fonte et de chenaux. Différents processus de photoacclimatation permettent aux micro-algues de s’ajuster à ces fluctuations plus ou moins rapides qui impactent la transmission de lumière.
À faible lumière, le complexe antennaire change sa composition pigmentaire pour optimiser l’absorption de lumière et le transfert de celle-ci au centre réactionnel du photosystème. À forte lumière, le complexe antennaire se protège du surplus d’énergie et dissipe l’excès par « quenching » non-photochimique [unités relatives] (NPQ) (MacIntyre et al., 2002). En bref, le NPQ dissipe l’énergie lumineuse en trop avant qu’elle n’atteigne le centre réactionnel du photosystème (Holt et al., 2004). Le rôle photoprotecteur des caroténoïdes grâce au cycle des xantophylles fait partie du NPQ et ce mécanisme est bien connu chez les plantes (Demmig-Adams and Adams 1996). Chez les diatomées, le cycle des xanthophylles repose principalement sur l’inter-conversion de la diadinoxanthine et la diatoxanthine (caroténoïdes), et constitue le mécanisme de première importance pour contrer l’excès de lumière (Arsalane et al., 1994, Goss and Jakob 2010). La composition en protéines fait aussi partie des changements structuraux du complexe antennaire. Les gènes FCP (protéine liant la chlorophylle et la fucoxanthine) appartenant à la grande famille des LHC (complexe antennaire d’absorption) codent pour des protéines qui forment différents complexes selon les conditions de lumière (Wilhelm et al., 2014). Les différents complexes formés se lient à
12
la fucoxanthine, la chlorophylle a et c et à la diadinoxanthine ou diatoxanthine (Alberte et
al., 1981, Beer et al., 2006) Ces complexes sont impliqués dans le transfert d’énergie aux
photosystèmes ou dans la dissipation d’énergie (NPQ) selon leur composition pigmentaire. Une étude portant sur l’expression du transcriptome chez Chaetoceros neogracile lorsque transférée à forte lumière révèle une régulation positive et négative de différents gènes FCPs (Park et al., 2010). Les gènes FCP phylogénétiquement associés à la grande famille LHCx ont montré une régulation positive alors que ceux associés à la famille LHCf ont montré une régulation négative. La famille LHCx regroupe les gènes qui codent pour les protéines impliquées dans le NPQ alors que la famille LHCf code pour celles impliquées dans l’absorption de la lumière (Wilhelm et al., 2014). La régulation positive de gènes qui appartiennent à la famille des LHCx a aussi été mesurée dans d’autres études (Oeltjen et
al., 2002, Becker and Rhiel 2006, Beer et al., 2006) qui confirment leur rôle dans la
photoprotection. Récemment, le génome de Fragilariopsis cylindrus a révélé un nombre supérieur de gènes de la famille des LHCx (FCP) en comparaison à deux autres génomes de diatomées tempérées (T. pseudonana, P. tricornutum) (Mock et al., 2017). Le grand nombre de gènes LHCx observés chez Fragilariopsis cylindrus suggère une adaptation pour une meilleure capacité de photoprotection face aux stress de lumière qui sévissent en milieu polaire. Cette hypothèse est appuyée par les résultats de Petrou et al., (2011) qui présente Fragilariopsis cylindrus comme une espèce adaptée aux conditions de faibles lumières (glace de mer), mais qui possède une grande capacité d’acclimatation à l’augmentation rapide de lumière expliquée par les fortes valeurs de NPQ mesurées. Ces résultats aident à comprendre pourquoi elle peut croître aussi bien dans la glace, dans l’eau de fonte ou en milieu pélagique et qu’elle soit présente en abondance en Antarctique et en Arctique (Gleitz et al., 1998, von Quillfeldt 2000). Une grande capacité à dissiper l’excès de lumière semble être une caractéristique physiologique importante lors du retour de lumière suite à une longue période d’obscurité (McMinn et al., 2010).
1.4.2 Reprise de la photophysiologie
Malgré les changements importants mesurés dans la photophysiologie lors du passage à l’obscurité prolongée, les performances photosynthétiques (PChl, ETRmax, ΦPSII) augmentent fortement en quelques jours après le retour de la lumière (Griffiths 1973, Luder
13
expériences sur Chaetoceros neogracile après un mois d’obscurité ont évalué la capacité de reprendre la croissance au retour de la lumière à différentes intensités (5 à 154 µmol photons m-2 s-1) (non-publié, Lacour et al., 2017). Dans tous les cas, les algues ont entamé une croissance exponentielle en moins de 48 heures grâce à une rapide acclimatation de la photophysiologie. ETRmax et Ek (l’éclairement auquel le taux de transport d’électron sature) ont augmenté dès les premières heures du retour à la lumière. La reprise de la photophysiologie et de la croissance est plus importante pour les plus fortes intensités de lumières (41 et 154 µmol photons m-2 s-1).
14
Chapitre 2. Problématique
Notre compréhension des mécanismes fondamentaux qui permettent la survie des diatomées à de longues période d’obscurité comme celles de l’hiver polaire en Arctique est incomplète malgré les expériences déjà réalisées. Les adaptions des diatomées aux conditions extrêmes de l’Arctique sont de plus en plus documentées (Lacour et al., 2017), mais on ne sait pas encore dans quel état se trouvent les diatomées arctiques lorsqu’elles traversent l’hiver polaire. Aussi, on ne connaît pas bien les processus impliqués lors de la reprise de croissance au retour de la lumière. D’une part, les expériences d’obscurité prolongée de plusieurs mois sur les diatomées polaires conduites à ce jour n’offrent pas suffisamment d’explications sur l’état physiologique des cellules (Antia 1976, Palmisano and Sullivan 1983, Peters and Thomas 1996, Zhang et al., 1998). D’autre part, les expériences dans lesquelles on a mesuré certains paramètres physiologiques ne sont pas suffisamment représentatives de la longueur de l’hiver polaire (Hellebust and Terborgh 1967, Griffiths 1973, Popels et al., 2007, Wulff et al., 2008, Reeves et al., 2011, Martin et
al., 2012, McMinn and Martin 2013, Nymark et al., 2013, Mock et al., 2017) (non-publié,
Lacour et al., 2017), ne traitent pas de diatomées (Dehning and Tilzer 1989, Baldisserotto
et al., 2005a, Baldisserotto et al., 2005b, Ferroni et al., 2007, Popels et al., 2007) ou
n’intègrent pas toutes les réponses physiologiques de la cellule (Veuger and van Oevelen 2011, Schaub et al., 2017).
Une étude qui identifiera les caractéristiques physiologiques et biochimiques des cellules à l’obscurité chez une diatomée arctique et durant une période représentative de la longueur de l’hiver polaire permettra de mieux comprendre la phénologie des communautés de producteurs primaires en Arctique et leur survie durant de longues périodes d’obscurité. La caractérisation plus complète des espèces phytoplanctoniques clés de l’Arctique aidera à mieux prédire leur réponse face aux changements climatiques dans le contexte de la floraison printanière.
15
Chapitre 3. Objectifs et hypothèses de l’étude
L’étude comporte une expérience en laboratoire réalisée à l’aide de bioréacteurs placés dans l’obscurité totale pour une durée qui est représentative de l’hiver polaire. Des mesures physiologiques et biochimiques à des intervalles précis fournissent un suivi temporel de l’état des cellules et des activités métaboliques durant la période de noirceur et lors de la réexposition à la lumière. La diversité des mesures effectuées vise à combiner les informations biochimiques et celles sur les capacités physiologiques.
Objectif 1 :
Caractériser l’état cellulaire d’une diatomée arctique durant une période d’obscurité totale représentative de l’hiver polaire afin de comprendre les mécanismes de survie au noir.
Hypothèse 1 :
La cellule ralentit son métabolisme et démantèle partiellement l’appareil photosynthétique.
Objectif 2 :
Caractériser les processus impliqués dans la reprise de croissance d’une diatomée arctique lorsque qu’elle est réexposée à la lumière suite à une longue période d’obscurité totale représentative de l’hiver polaire.
Hypothèse 2 :
La cellule minimise les dommages grâce aux mécanismes de photoprotection et reprend rapidement les activités photosynthétiques et métaboliques.
16
Chapitre 4. Développement
Response of a sea-ice diatom, Fragilariopsis cylindrus, to simulated polar
winter darkness and spring-like return to light
Morin, Philippe-Israël1; Lacour, Thomas1 ; Grondin Pierre-Luc1; Bruyant, Flavienne1; Ferland, Joannie1; Forget, Marie-Hélène1; Donaher, Natalie2; Campbell, Douglas2 ; Lavaud Johann1 & Babin, Marcel1
1UMI Takuvik, Université Laval, Québec, QC, G1V 0A6, Canada
(philippe-israel.morin.1@ulaval.ca; Thomas.Lacour@takuvik.ulaval.ca;
pierre-luc.grondin.1@ulaval.ca; flavienne.bruyant@takuvik.ulaval.ca;
Joannie.Ferland@takuvik.ulaval.ca; Marie-Helene.Forget@takuvik.ulaval.ca;
Johann.Lavaud@takuvik.ulaval.ca; Marcel.Babin@takuvik.ulaval.ca)
2Mount Allison University, Sackville, NB, E4L 3M7, Canada
17
4.1 Introduction
Diatoms experience a wide range of environmental conditions across the oceans, some of which being extremely stressful for the cells. Light spans the largest variations where diatoms may temporarily experience high light exposure in the sunlit surface layer or darkness due to ocean mixing or during the night. Diatoms may spend several weeks in total darkness during deep ocean mixing events (Cullen and Lewis 1988, Marshall and Schott 1999). Moreover, at high latitudes, darkness takes over for several months as a consequence of sea-ice cover and low sun elevations. Such conditions are exclusive to polar winter in the Arctic and Antarctic Oceans. Winter darkness under sea-ice can last as long as 6 months during which photoautotrophic organisms such as diatoms must survive. Since their main energy source is from sunlight, one can wonder how diatoms satisfy their metabolic needs when no light is available for such a long period of time.
Several studies in the past decades have contributed to the understanding of polar winter darkness survival of microalgaes (including diatoms) (Smayda and Mitchell.B 1974, Antia 1976, Palmisano and Sullivan 1983, Peters 1996, Peters and Thomas 1996, Zhang et al., 1998, Luder et al., 2002, Wulff et al., 2008, Reeves et al., 2011) (unpublished, Lacour et
al., 2017). In all experiments, cell growth recovered after the dark period. Strategies such as
spore production (Doucette and Fryxell 1983) and heterotrophy (Lewin 1953, White 1974, Hellebust and Lewin 1977) may explain diatoms survival to prolonged darkness, but most of the experiments so far have not recorded the presence of spores nor measured heterotrophy. However, a physiological resting state that is characterized by a stabilized metabolism and a low rate of energy reserve consumption may play a significant role (Handa 1969, Palmisano and Sullivan 1982, Dehning and Tilzer 1989, Peters and Thomas 1996, Jochem 1999, Popels et al., 2007, McMinn and Martin 2013, Schaub et al., 2017). Recently, the Fragilariopsis cylindrus transcriptome response to darkness (7 days) was investigated (Mock et al., 2017). Among the different abiotic stresses tested, darkness triggered the largest transcriptome response involving approximately 60% of all genes with most of them downregulated.
18
have investigated the physiological mechanisms involved during the light return recovery (Griffiths 1973, Luder et al., 2002, Popels et al., 2007, Reeves et al., 2011) (unpublished, Lacour et al., 2017). In the latter studies, photosynthetic performances recovered but were low after several weeks of darkness. However, longer periods of darkness could compromise the recovery.
With the aforementioned literature, our study aimed to provide answers to the key question: How do diatoms survive during such conditions of darkness and resume fast growth as soon as light becomes available? What are the physiological mechanisms underlying such survival? Because our understanding of dark survival strategies in diatoms is still limited and nearly lacking for the processes involved upon the return of light, the objectives of this study were to (i) understand the response of diatoms to both darkness and return of light, (ii) to provide an extensive description of relevant physiological mechanisms over a darkness period that mimics the polar winter and (iii) to highlight physiological peculiarities that were not documented previously.
19
4.2 Methods
4.2.1 Cell culturingAxenic cultures of Fragilariopsis cylindrus (National Center for Marine Algae and Microbiota CCMP3323, Annexe 1), collected as CCMP1102 during the Islas Orcas cruise in the Southern Ocean (64,08° S 48,7033 °W) were grown in semi-continuous cultures in pre-filtered L1 medium (Guillard and Hargraves 1993) (Annexe 2). Cultures in triplicate started in 50 mL borosilicate tubes and were subsequently transferred to larger borosilicate vessels several times semi-continuously until a final transfer to 20-L polycarbonate round vessels (Annexe 3). At this step, 5 L of each culture were transferred to the vessels and addition of L1 media followed thereafter to increase culture volume while matching growth rate so that the cell density remains constant (Wood et al., 2005). The illumination was provided continuously with DURIS® E3 LED bands (GW JCLMS1.EC, 4000 K) at 30 µmol photon m-2 s-1 as measured with a QSL-100 quantum sensor (Biospherical instruments, San Diego, CA, USA) placed in the centre of the vessel. This irradiance was chosen based on the parameter KE, i.e. the irradiance at which the growth rate saturated for our F. cylindrus strain. Each culture was gently mixed with a 12.5 cm magnetic stirrer and bubbled with air filtered through a 0.3µm capsule filter (Carbon CAP, 6704-7500). Temperature of the growth chamber was kept at 0°C for the whole experiment.
4.2.2 Sampling design
Sampling was made for the first time (-1 day and 0 day, light acclimated) once the cultures had reached a steady state (MacIntyre and Cullen 2005), i.e when growth rate, cell diameter and chlorophyll a (chl a) were constant and acclimated to the growth condition. Cultures were considered acclimated when those parameters remained unchanged for a minimum of 10 cell generations. In order to avoid light limited growth, the cultures were kept optically thin for the light acclimation period. Cell density ranged from 4×104 to 6×105 cell mL-1 during the exponential growth phase and was maintained around 5×105 cell mL-1 prior to the dark transition. After the light acclimated sampling, the light system was immediately switched off and each vessel was carefully covered with opaque material. Sampling in the dark was made 24 hours following the transition to the dark and subsequent «dark» samplings followed the timeline shown in Fig. 3.
20
The first “return to light” experiment (Light1) took place after 1.5 months (48 days) in the dark and was conducted outside of the initial growth chamber. Culture volume was carefully transferred to gently aerated 3-L vessels cooled with ethylene glycol at 0°C and illuminated at 30 µmol photon m-2 s-1 with a slightly different light spectrum than that of the light acclimation system (pre-acc)(Annexe 4). This second light system was provided by a customized LED system (uncommercialized) encompassing 8 colours independently variable in intensity. The light system surrounded the 3L vessel via 6 panels each equipped with a LED system (Annexe 5). The cultures were sampled at specific times as shown on Fig. 3 until no culture volume was left in the vessels. The second “return to light” (Light2) took place after 3 months (90 days) in the dark.
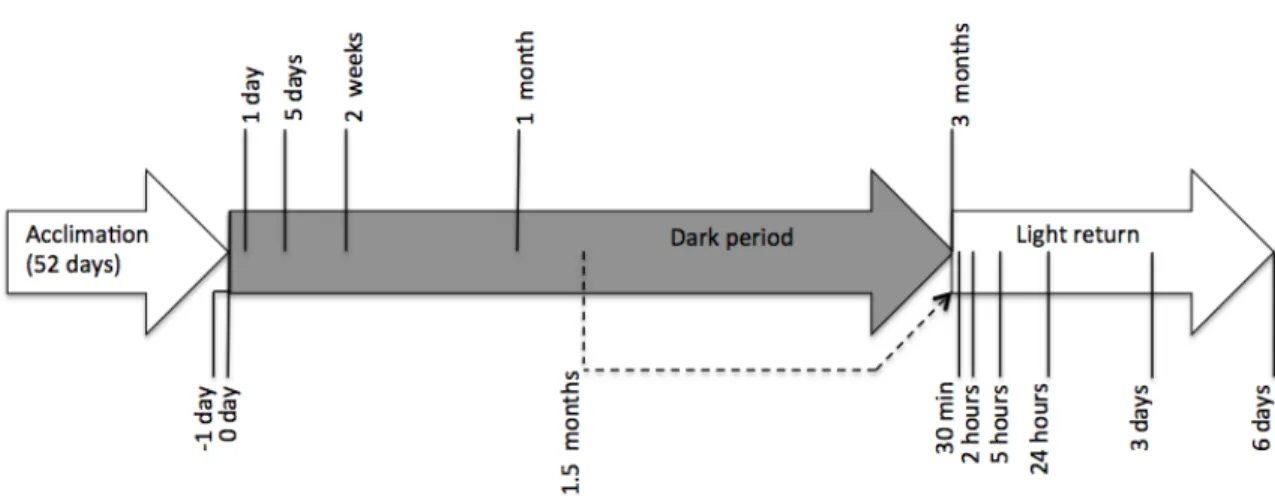
Figure 3 Timeline of the sampling strategy for dark period and light return experiments. The vertical lines
show the times of sampling, and the dashed arrow shows transfer of a fraction of the replicate cultures prior to light return #1 at 1.5 months following dark transition. In the first phase, cultures were acclimated to the light conditions for 52 days. Cultures were then transferred in complete darkness (grey arrow). In the third phase, dark acclimated subsamples were transferred to light after 1.5 months and 3 months.
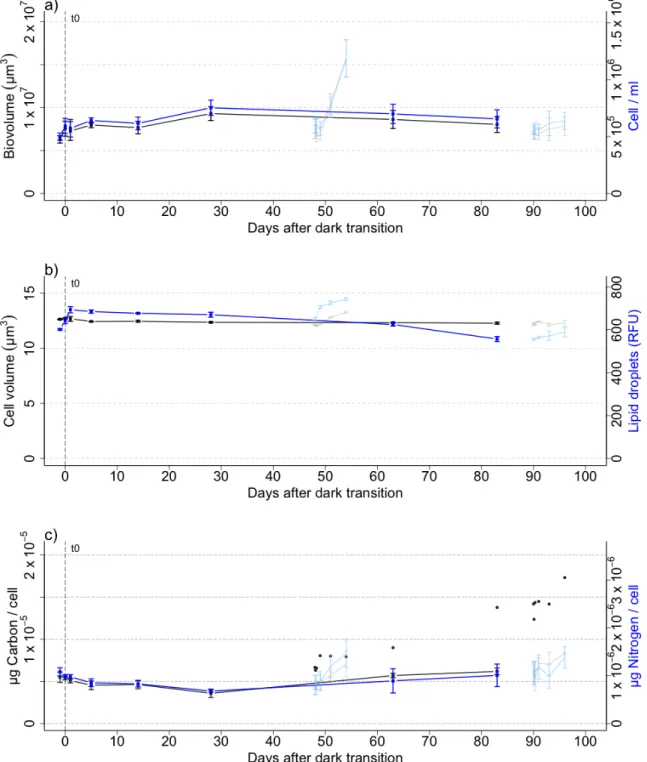
For each sampling time-point, cultures aliquots were harvested to measure cell number, biovolume, cellular organic carbon and nitrogen (POC & PON), lipid droplets, pigments, quantum yields of charge separation in photosystem II (PSII), non-photochemical quenching (NPQ), photosynthetic proteins (D1, RUBISCO) and carbon fixation rates. However, not all variables were measured for every time-point. The NPQ was measured for the light-return experiments and for several time-points during the dark period (2 weeks, 1
21
month, 1.5 months, 3 months). Carbon fixation rates were measured at all points except for the third month of darkness. Lipid droplets were measured from 5 hours to 6 days following both light return experiments and for every time-points during the dark period. 4.2.3 Cell number and volume
Cells were counted and sized using a Beckman Multisizer 4 Coulter Counter. Culture aliquots were first diluted 50 times in Milli-Q water adjusted to 36 ‰, Sodium Chloride (CAS: 7647-14-5, S7653, Sigma Aldrich). Three consecutive countings were systematically achieved for each replicate. Total cell counts ranged from 5115 to 21090 depending on the volume diluted (either 200 or 500 µL) and the sampling time. Near all of the cells (> 95%) ranged between 2.822 and 7.165 µm length with a peak at 3.809 to 4.245 µm (mean size) depending on the sampling time. The system was previously calibrated using 10 µm latex beads (COULTER CC Size Standard L10, REF: 6602796, Beckman Coulter) with an aperture diameter of 50 µm. The cell volume was computed using the mean size as the length and assuming a cylindrical shape with an average diameter of 2 µm. 4.2.4 Carbon and nitrogen
For measuring the cellular content of organic carbon and nitrogen, three replicates were harvested per algal culture. Aliquots of 20 mL were filtered onto glass-fiber filters (0.7µm, 25mm) pre-combusted at 500°C for 24 hours. Filters were then dried at 60°C for at least 12 hours and kept desiccated before elemental analysis with a CHN analyzer (2400 Series II CHNS⁄ O; Perkin Elmer, Norwalk, CT, USA).
4.2.5 Lipid droplets
Cells were assessed for their lipid droplets content using the molecular probe BODIPY® 505/515 (4,4-Difluoro-1,3,5,7-Tetramethyl-4-Bora-3a,4a-Diaza-s-Indacene, REF:D3921, LOT:1740601, www.lifetechnologies.com) according to Brennan et al. (2012). Fluorescence emitted from the BODIPY probes was measured using flow cytometry. The first 2 months of the dark experiment (including Light1 experiment) were covered with a dual laser excitation flow cytometer (Millipore Guava easycyte 8 HT, excitation at 488 nm, emission measured at 525/30 nm). For the third month of dark experiment and the Light2 experiment, another flow cytometer was used (Milipore Guava easycyte HT BGV, excitation at 488 nm, emission measured at 512/18 nm). A 500 µM BODIPY stock solution
22
was prepared by dissolving the dye in anhydrous dimethyl sulfoxide (DMSO) and was ~20 fold-diluted in DMSO for a working solution of 25.43 µM. To determine the optimal BODIPY 505/515 concentration, a range of 17 final concentrations from 0.085 µM to 1.59 µM was assayed. The optimal concentration was of 0.33 µM and 1.32% DMSO, which was 4 µL of the working solution in 300 µL of culture. Samples in three technical replicates for each culture were then incubated for 1 hour into a dark styrofoam box filled with ice in order to keep the temperature as close as possible to the growth chamber (0°C). A 96-well plate containing the samples was used for the fluorescence analysis. Samples were quantified for their relative fluorescence emission with 2000-5000 cells per well. Each cell population was analysed with R©. Technical replicates were averaged together for their mean signal of fluorescence.
4.2.6 Pigments concentration
Samples for pigment analysis were filtered onto glass-fiber filters (GF/F) (0.7µm, 25mm, Millipore). 10 mL of each culture was harvested. Filters were immediately flash-frozen in liquid nitrogen and stored at -80°C until analysis. Pigment separation was performed with high performance liquid chromatography (HPLC) according to Manuel et al. (2000). Prior to HPLC analyses, pigments were extracted in 95% methanol and sonicated during 20 seconds three times. Samples were then centrifuged (4500 rpm) 15 minutes at 4°C and filtered on polytetrafluoroethylene (PTFE) membranes (0.2 µm). Data were analysed using ChromQuest 5.0 software.
4.2.7 Photosynthetic proteins
For RbcL and PsbA quantitation, 30 mL of each culture was harvested onto GF/F. Filters were flash-frozen in liquid nitrogen and stored at -80°C. Protein extractions were performed using the FastPrep-24 and bead lysing “matrix D” (MP Biomedicals), using 3 cycles of 60 s at 6.5 m/s in 300 µL of 1X extraction buffer (Agrisera), then spun at 16 000 g for 5 minutes. The supernatant was removed and spun for 2 additional minutes, then prepared for electrophoresis based on equivalent nitrogen content using 1x sample buffer (Invitrogen) and 50 mM DTT. Separation of proteins was done in a Bolt 4-12% Bis Tris SDS-PAGE gel (Invitrogen). Each gel had a 4-point quantitation curve using RbcL (www.agrisera.se).
23
Proteins were separated via electrophoresis at 200 V for 40 minutes then transferred to polyvinylidene difluoride (PVDF) membranes at 30 V for 60 minutes. Membranes were blocked for 1 h in 2% w/v ECL blocking agent (GE Healthcare) dissolved in TBS-T (Tris, 20 mM; NaCl, 137 mM; Tween-20, 0.1%v/v), then incubated in 1:10 000 rabbit polyclonal anti-RbcL antibody for 1 h (Agrisera) and finally in 1:10 000 goat anti-rabbit IgG HRP conjugated antibody (Agrisera) for 1 h. Membranes were rinsed with TBS-T solution five times after each antibody incubation. Chemiluminescent images were obtained using ECL Ultra reagent (Lumigen, TMA-100) and a VersaDoc CCD imager (Bio-Rad). Band densities for samples were determined against the standard curve using the ImageLab software (v 4.0, Biorad).
4.2.8 Variable fluorescence
Variable in vivo chl a fluorescence was measured using a Fluorescence Induction and Relaxation (FIRe) fluorometer (Satlantic, Halifax, NS, Canada) that applies a saturating, single turnover flash (STF, 100µs) of blue light (455 nm, 60-nm bandwidth) to the incubated sample. The FIRe generates a fluorescence induction curve (fluorescence detected at 680 nm) that can be used to estimate the absorption cross-section (σPSII), the minimum fluorescence (F0) and the maximum fluorescence of dark acclimated cells (FM) with the FIReWORX algorithm (Pers. Comm. Audrey Barnett, www.sourceforge.net). σPSII, F0 and FM were measured on culture subsamples shortly after volume harvest during the dark experiment (already dark-acclimated) or dark-acclimation for 30 min during the Light1 and Light2 experiments. We estimated the maximum quantum yield of PSII (ΦM)as follow.
𝛷! = !!!
! =
!!!!!
!!
(1)
We also measured variable in vivo chl a fluorescence using the Pulse Amplitude Modulated technique with the PhytoPAM (Walz, Germany) instrument. Cells were dark-acclimated for 30 minutes when applicable (Light1 and Light2 experiments) and subsequently exposed to the rapid light curve protocol (RLC). Subsamples were exposed to a 8 step-wise increasing continuous irradiances (1, 1.8, 3.5, 7.1, 14, 28, 56, 111 µmol photons m-2 s-1) for 10 seconds each. For measuring variable fluorescence, light saturation of the photosystems was