1
UNIVERSITÉ PICARDIE JULES VERNE
Faculté de Médecine
Année 2015
Thèse pour le diplôme d’état de docteur en médecine DES d’oto-rhino-laryngologie et chirurgie cervico-faciale
2015-71
Étude de survie des patients ayant développé une
seconde tumeur primitive métachrone après
carcinome épidermoïde des VADS.
Présentée et soutenue publiquement le vendredi 26 juin 2015 à 18 h 00 Par Céline HAREMZA
JURY : Président :
Monsieur le professeur Vladimir STRUNSKI Assesseurs :
Monsieur le professeur Dominique CHEVALIER Monsieur le professeur Claude KRZISCH
Monsieur le professeur Pascal BERNA Directeur de thèse :
3
Table des matières
Remerciements P 5 Abréviations P 17 Introduction P 18 Matériel et Méthodes P 23 Résultats P 26 Discussion P 33 Conclusion P 39 Bibliographie P 40 Annexes P 44
Annexe 1 Classification TNM ORL P 44
Annexe 2 Stade cancer ORL P 45
Annexe 3 Classification TNM poumons P46
Résumé P 48
5
Remerciements
Monsieur le Professeur Vladimir STRUNSKI
Professeur des Universités-Praticien Hospitalier (Oto Rhino Laryngologie) Chef du Service ORL et Chirurgie de la face et du cou Pôle des 5 sens Chevalier dans l'Ordre des Palmes Académiques
Vous me faites l’honneur de présider ce jury, acceptez pour cela mes plus sincères remerciements. Toute ma reconnaissance également pour votre relecture et vos suggestions. Je vous remercie également de m’avoir fait partager votre passion pour l’ORL, pour l’enseignement fourni durant mon internat, aussi bien théorique que pratique.
7 Monsieur le Professeur Dominique CHEVALIER Professeur des Universités-Praticien Hospitalier (Oto Rhino Laryngologie) Chef du service d’Oto-Rhino-Laryngologie et Chirurgie cervico-faciale du CHRU de Lille Chef de pôle spécialités médico-chirurgicales
Vous me faites l’honneur de juger ce travail, veuillez trouver ici l’expression de mes sincères remerciements et de mon profond respect.
Merci de m’avoir accueillie pendant 6 mois, ce fut un plaisir de retourner quelques temps dans ma ville d’origine, et de profiter de votre enseignement.
9 Monsieur le Professeur Claude KRZISCH Professeur des Universités-Praticien Hospitalier (Cancérologie, radiothérapie) Oncopôle
Je vous remercie pour l’intérêt que vous avez immédiatement porté au sujet, vous me faites l’honneur de juger mon travail, veuillez recevoir l’expression de ma respectueuse gratitude.
11 Monsieur le Professeur Pascal BERNA
Professeur des Universités – Praticien Hospitalier Responsable du service de chirurgie thoracique Pôle "Cœur - Thorax - Vaisseaux"
Je te remercie de m’avoir fait l’honneur d’accepter de juger cette thèse, j’en suis touchée et reconnaissante.
Premier chef de service rencontré pendant mon internat, je garde un excellent souvenir des six mois passés dans ton service où j’ai appris beaucoup, même en ORL grâce aux biblios, aux premières nasofibroscopies que j’ai réalisées…
13 Monsieur le Docteur Cyril PAGE
Maître de Conférences des Universités – Praticien Hospitalier (Anatomie)
Un grand merci :
- pour avoir accepté de diriger ce travail,
- pour le surnom (le mien n’était pas trop moche…)
- pour les samedis matins, où tu nous apprends à être rigoureux, tu soulignes l’importance du travail personnel pour que nous soyons compétents, j’espère le devenir pour la suite de mon exercice professionnel.
14 Je tiens à remercier toute ma famille, tous ceux qui sont présents ce soir.
À Maman et Papa, à Mathilde et Didier, pour toutes ses innombrables choses, petites et grandes qui font ce que je suis aujourd’hui.
Merci au docteur Merlusca, à Florence (première co-interne), encore une fois ce stage de chir tho était terrible, c’est aussi grâce à vous.
Merci aux docteurs Mambie, Tedong et Delaveau, qui m’ont fait découvrir l’ORL à Laon, chacun à sa manière, tout en étant complémentaires.
Merci aux docteurs Bonan-Lesur, Bitar et Collin : j’ai passé un très bon semestre en votre compagnie.
Merci aux docteurs Nadjingar, Showk, Hadjali, Bourrel et Lucas qui viennent de m’accueillir dans leur service à Beauvais.
Merci à Gladys et Aurélie pour le compagnonnage, ces moments passés au bloc, en consult, à l’internat... Votre expérience partagée, tout au long de ces stages passés en votre compagnie, était très enrichissante. Le service ne serait pas le même sans vous.
Merci au docteur Kolski, de nous superviser quand nous passons aux « explos ».
Merci à tous mes chefs : Pierrick, Philippe, Guillaume, Mathieu, Maxime. Merci pour tout : pour les (ré)visions, pour les explications, pour la bonne humeur, les blagues, les interventions, l’aide en consultation, toussa toussa. Vous avez formé une super équipe, qui a dépassé le simple cadre professionnel ; c’était un bonheur de travailler et passer du temps en votre compagnie.
Merci à Nathalie pour avoir lu et relu ma thèse, mon mémoire. Pour m’avoir fait réviser pour le DES, m’avoir hébergé, pour le plante-sitting, pour les soirées, les conseils mode, l’enthousiasme, la passion pour la physiologie : je ne l’aurai jamais bossé autant sans toi… Merci à Jérôme et Marine, « internes séniors », ce fut un plaisir de travailler avec vous. Je vous souhaite de beaux bébés à tous les deux… (chacun de votre côté, cela va sans dire…) Rais, je n’ai pas eu la joie de travailler avec toi, mais comme tu fais partie de l’équipe c’est comme si c’était le cas.
15 À mes co-internes : Maxime toujours plus efficace que le 34 000, Caroline plus efficace que closer. Je garde bien sûr vos numéros verts en cas d’urgence…
Les collègues : Delphine, Maxime, Nicolas, Benjamin, Laure-Marine : on se retrouve à chaque cours, congrès et autre, pour certains on se croisera en stage à Bvs…
Aux collègues de l’interchu : ARF l’inimitable, codman évite quand même tout V95.4 ; Marine, Alexandra, Sidonie, Elodie (les copines de Piquet !) Martin, César et Laurent.
À tous mes amis, Clémentine, Émilie, Henri, Antonin, Élodie, Émilie, Benoit, Rémy, Héloïse, Jessica et tous les autres…
Bien sûr je remercie également tous les agents hospitaliers : I(BO)(A)DE, AS, ASH, secrétaires… de tous les services où j’ai pu passer, pour leurs conseils, pour l’ambiance de travail…
16
Abréviations
CH centre hospitalier
CHU centre hospitalier universitaire HPV human papilloma virus
IC95% intervalle de confiance à 95% NC non connu
ORL oto-rhino-laryngologie
RCP réunion concertation pluridisciplinaire SFORL société française d’ORL
STP seconde tumeur primitive TDM tomodensitométrie, scanner
TEP-TDM tomographie par émission de positons VADS voies aéro-digestives supérieures
17
Introduction
En 2012, il y a eu 14 638 nouveaux cas de cancer de la cavité orale, du pharynx et du larynx en France 1.
Entre 1989 et 2007, en France, les taux de survie globale et déterminée à 5 ans des cancers de la cavité orale et du pharynx étaient respectivement de 31 et 34%. Les taux de survie globale et déterminée du cancer du larynx étaient estimés à 47 et 53% 2.
Les trois causes principales de décès chez les patients atteints de cancers des VADS étaient : - décès liés à l’évolution tumorale,
- décès liés aux complications non néoplasiques de la consommation de tabac et de l’abus d’alcool,
- décès liés au développement des secondes tumeurs primitives (STP) 3.
Le risque de décès lié à la croissance tumorale, qu’elle soit loco-régionale ou métastatique, immédiate ou sous forme de récurrence, prédominait surtout les 3 premières années 4 5. L’apparition des STP, représentait à elle seule, un tiers des causes de décès 6
.
Les cancers des VADS étaient essentiellement dominés par les carcinomes épidermoïdes 47. Les traitements de ces cancers étaient décidés en réunion de concertation pluridisciplinaire (RCP). Idéalement à but curatif, ils comprenaient la chirurgie, la radiothérapie, la radio-chimiothérapie concomittante, l’association chirurgie et radiothérapie, et dans certaines indications (préservation laryngée, réduction de volume tumoral) une chimiothérapie d’induction les précèdait 48
.
Une fois le patient traité, une période de suivi permettait de détecter les éventuelles récidives, et secondes lésions cancéreuses. En effet les patients ayant présenté un carcinome épidermoïde des VADS étaient plus à risque que la population générale et même que les patients atteints d’autres cancers, de développer une STP 3 6 9 10
. Le risque relatif de développer une STP quelque soit sa localisation après un cancer des VADS était compris entre 1.8 et 2.2 par rapport à la population générale, à 10 ans, selon les études 6911.
Les critères qui permettaient de considérer une lésion comme une seconde tumeur primitive ont été définis par Warren et Gates en 1932 12 :
- chaque tumeur doit être confirmée histologiquement et être maligne, - la possibilité que l’une soit la métastase de l’autre doit être exclue, - il ne doit pas y avoir de continuité histologique entre elles.
18 D’un point de vue chronologique, les STP étaient considérées comme synchrones si elles survenaient dans les 6 mois suivant le diagnostic de la lésion initiale et métachrones après 6 mois 13141516.
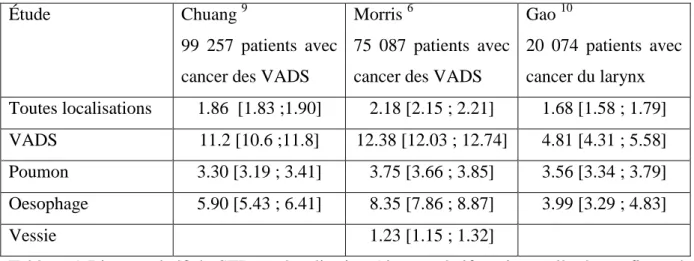
Les localisations préférentielles des STP étaient liées à la consommation de tabac 4 11. En effet, elles concernaient les VADS, les poumons et l’œsophage 6 9 10. Le risque relatif par rapport à la population générale par localisation est montré tableau 1. Pour les autres localisations de STP le risque relatif était le même que celui de la population générale, c’est-à-dire aux alentours de 1 6910.
Étude Chuang 9
99 257 patients avec cancer des VADS
Morris 6
75 087 patients avec cancer des VADS
Gao 10 20 074 patients avec cancer du larynx Toutes localisations 1.86 [1.83 ;1.90] 2.18 [2.15 ; 2.21] 1.68 [1.58 ; 1.79] VADS 11.2 [10.6 ;11.8] 12.38 [12.03 ; 12.74] 4.81 [4.31 ; 5.58] Poumon 3.30 [3.19 ; 3.41] 3.75 [3.66 ; 3.85] 3.56 [3.34 ; 3.79] Oesophage 5.90 [5.43 ; 6.41] 8.35 [7.86 ; 8.87] 3.99 [3.29 ; 4.83] Vessie 1.23 [1.15 ; 1.32]
Tableau 1 Risque relatif de STP par localisation (risque relatif et intervalle de confiance à 95%).
Pour respecter les critères de Warren et Gates, les STP devaient être différenciées des métastases. Ce problème se posait essentiellement pour les lésions pulmonaires. Si l’histologie du cancer des VADS était différente de celle du cancer pulmonaire, ces deux lésions étaient considérées comme indépendantes 17. Si les deux lésions étaient des carcinomes épidemoïdes, la distinction entre STP et métastase était plus délicate 18 19. Elle était habituellement réalisée à l’aide de critères cliniques ou radiologiques.
Les arguments en faveur de la STP 1718 20 étaient : - Localisation centrale ET unique,
- Stade de la tumeur initiale des VADS = 1 ou 2 ET absence de signes de récurrence, - Délai d’apparition supérieur à 3 ans.
19 À l’inverse les arguments en faveur de l’évolution métastatique étaient :
- Localisation périphérique OU multiple,
- Stade de la tumeur initiale des VADS = 3 ou 4 OU signes de récurrence, - Délai d’apparition inférieur à 3 ans.
Mercer proposait également une étude au niveau biomoléculaire pour différencier les STP des métastases par analyse des microsatellites 19. Mais ces analyses biomoléculaires étaient peu validées en routine.
Il existe deux théories expliquant la forte tendance à l’apparition de ces secondes lésions de la muqueuse des VADS, œsophage et poumons. La première date de 1953, Slaughter et al proposaient le concept de « champ de cancérisation». Selon cette théorie, l’exposition prolongée aux carcinogènes, entrainant l’apparition du premier carcinome, agit également sur le reste de la muqueuse, favorisant l’apparition de nouveaux carcinomes sur cette muqueuse 21.
Les carcinogènes évoqués par Slaughter ont été identifiés secondairement : il s’agissait du tabac et de l’alcool 8.
La seconde théorie se base sur la biologie moléculaire. Des études, plus récentes, ont analysé l’origine clonale des lésions tumorales. Elles suggéraient que les cancers multiples peuvent provenir d’un unique clone 22
. Les STP seraient le résultat de micrométastases qui auraient migré de la tumeur initiale et se seraient réimplantées dans le site secondaire.
Ces deux théories coexistent 23.
Environ 15% (10 à 40% selon les séries) des patients atteints de cancer des VADS développaient une STP 3 13 24. L’incidence précise variait selon les séries et était liée à la durée de suivi 25. Elle était bien sûr plus élevée lorsque les cancers synchrones étaient pris en compte également 3.
Le risque annuel de cancer métachrone était de 3 à 7%, toutes localisations confondues 39 10
14
. Ce risque était stable dans le temps 3 9 1014. Le risque annuel de troisième puis quatrième tumeur était de plus en plus important 26.
20 De nombreuses études ont cherché les différents facteurs de risque d’apparition des STP métachrones mais peu ont étudié la survie. En effet, la survie des patients présentant une STP peut paraître à priori plus compromise mais est-elle réellement différente ?
La survie globale à la survenue des STP est-elle différente de celle des cancers des VADS ? L’objectif principal de cette étude est de comparer la survie globale et déterminée des STP métachrones après carcinome épidermoïde des VADS à celle des patients ne développant pas de STP.
Le diagnostic des STP est réalisé lors du suivi. Les localisations des VADS étant accessibles à l’examen clinique 4
, même au stade asymptomatique dans 60% des cas pour Haas 27, une surveillance prolongée à la recherche des STP métachrones semble donc nécessaire 15.
Cette surveillance est bien codifiée en France : la société française d’ORL (SFORL) proposait des recommandations sur les délais de consultation et les examens paracliniques à réaliser : 15
- La surveillance doit être plus intensive chez les patients qui peuvent bénéficier d’un deuxième traitement à visée curative (grade A).
- La recherche de localisations métachrones des VADS repose sur l’examen clinique. Ce risque persiste à vie chez les patients alcoolotabagiques. L’imagerie et l’endoscopie sous anesthésie sont indiquées au moindre doute (consensus professionnel).
- Le patient doit être informé du risque de deuxième localisation pulmonaire et oesophagienne et des symptômes d’alerte (consensus professionnel).
- Pour les STP oesophagiennes, la réalisation systématique d’une fibroscopie oesophagienne de dépistage ne peut-être qu’optionnelle, à la fréquence d’une tous les deux ans. Elle peut dans ce cas s’accompagner de coloration au Lugol. (consensus professionnel)
- Il n’existe pas de marqueurs biologiques validés dans le dépistage des cancers bronchopulmonaire et oesophagien (grade A).
- La SFORL recommandait une surveillance par radiographie de thorax de face : deux la première année, puis une par an (grade C). Le choix d’une radiographie de thorax a été fait en raison de son accessibilité, de son faible coût et de sa capacité de dépistage d’autres pathologies.
21 Lorsque la radiographie pulmonaire était anormale, un scanner thoracique devait être réalisé avec le protocole suivant :
o scanner normal : suivi au rythme d’une radiographie de thorax de face par an. o scanner anormal :
nodule > 1 cm et ou évolutif, concertation pluridisciplinaire. nodule < 1 cm, scanner à 3 mois
non évolutif, surveillance
évolutif concertation pluridisciplinaire. nodules multiples : arrêt des investigations 15
.
Le mode de surveillance des STP pulmonaires recommandé actuellement est la radiographie de thorax de face annuelle 15 16. On sait que l’imagerie en coupe : tomodensitométrie (TDM) est plus sensible que la radiographie 28.
Dans une étude de Henschke, la prévalence du cancer bronchopulmonaire dépisté passait de 0.7% pour la radio de thorax à 2.7% pour le scanner thoracique hélicoïdal « low dose » 29. Dans une étude multicentrique américaine 30, comparant également la radiographie thoracique au TDM low-dose dans une cohorte de 53 454 patients à risque (tabagisme supérieur à 30 paquets-années), la mortalité liée au cancer pulmonaire était réduite de 20% (IC 95% [6.8-26.7] ; p=0.004) dans le groupe suivi par scanner. La mortalité globale était réduite de 6.7% (IC 95% [1.2-13.6] ; p=0.02) dans ce même groupe.
Lors du suivi, certains patients avaient bénéficié de la réalisation d’une imagerie TEP TDM ou TDM thoracique bien qu’elle ne soit pas recommandée. L’objectif secondaire de cette étude était d’étudier le mode de découverte des STP pulmonaires afin d’évaluer l’intérêt de cette pratique.
22
Matériel et Méthodes
Tous les patients consultant en RCP ORL au CHU d’Amiens entre le 1er janvier 2002 et le 31 décembre 2012, qui présentaient un carcinome épidermoïde des VADS, ont étés inclus. Les critères d’inclusion étaient :
- Carcinome épidermoïde des VADS de localisations suivantes : cavité orale, oropharynx, hypopharynx, larynx et adénopathie cervicale sans porte d’entrée.
- Suivi effectué en ORL au CHU d’Amiens, au CH de Doullens, Montdidier ou Péronne.
Les critères d’exclusion étaient :
- Suivi réalisé ailleurs ou patient perdu de vue immédiatement après le traitement. - Tumeur de localisations non reliées à l’abus d’alcool et tabac suivantes 9 14 :
rhinopharynx, glandes salivaires, oreille, sinus paranasaux et fosses nasales, thyroïde, carcinome cutanés.
- Histologie autre que carcinome épidermoïde.
Cette étude épidémiologique était réalisée de manière rétrospective, par consultation des dossiers médicaux.
La tumeur initiale correspondait au premier carcinome épidermoïde des VADS diagnostiqué chez le patient. Dans le cas ou il existait plusieurs cancers synchrones, la tumeur initiale considérée était celle dont les symptômes avaient mené au diagnostic.
Les STP étudiées sont celles survenant au niveau des VADS, œsophage, poumons et vessie. C’est-à-dire celles dont le risque relatif d’apparition après carcinome épidermoïde des VADS était supérieur à 1 dans la littérature 6910.
Les critères de Warren et Gates définissant les STP ont été respectés 12.
Le délai de 6 mois permettait de classer les STP entre synchrones et métachrones. Le recueil des données comprenait pour chaque tumeur initiale :
- sexe,
- âge au moment du diagnostic, - date du diagnostic,
- localisation,
- les facteurs de risques : consommation d’alcool et de tabac : actif, sevré depuis plus d’un an au moment du diagnostic, absent ou non renseigné,
23 - le stade (annexe 2),
- le type de traitement, - la durée de suivi (en mois), - date de décès,
- cause du décès : lié à la pathologie cancéreuse ou non.
Pour chaque STP métachrone, le recueil comprenait : - sexe,
- âge au moment du diagnostic, - date du diagnostic,
- délai d’apparition par rapport à la tumeur initiale,
- localisation : cavité orale, oropharynx, hypopharynx, larynx, adénopathie cervicale sans porte d’entrée, autre localisation des VADS, poumons, œsophage et vessie ;
- le type de traitement, - la durée de suivi (en mois), - la date de décès,
- cause du décès : lié à la pathologie cancéreuse ou non.
Le suivi consistait en la réalisation d’examen clinique tous les 2 mois la première année, tous les 3 mois la deuxième année, tous les 4 mois la troisième année, tous les 6 mois les quatrième et cinquième années puis annuellement. Une radiographie thoracique était demandée une fois par an. Certains patients ont bénéficié de la pratique systématique de TDM thoraciques ou TEP-TDM lors du suivi, à la place de la radiographie thoracique.
Pour les STP pulmonaires, le traitement, le mode de découverte et TNM 31 (annexe 3) étaient répertoriés.
Les différents types de traitement pris en compte pour les tumeurs des VADS étaient : chimiothérapie d’induction suivie de chirurgie ou radiothérapie, la chirurgie seule, la radiothérapie, l’association des deux, le traitement dissocié (chirurgie ganglionnaire suivie de radiothérapie), la chimiothérapie exclusive ou soins palliatifs, le refus de traitement, absence de réalisation du traitement prévu par altération de l’état général ou décès avant le début de celui-ci. Les traitements par radiothérapie pouvaient être associés à de la chimiothérapie concomittante ou à des thérapies ciblées.
24 Pour cette étude, les survies calculées étaient : survie après carcinome épidermoïde des VADS des patients ayant présenté une seule tumeur et survie à partir de la STP pour les patients avec lésion métachrone. L’évènement considéré était le décès quel qu’en soit la cause pour la survie globale. Concernant la survie spécifique, l’évènement étudié était le décès lié au cancer.
Statistiques
Le test du Khi 2 a été utilisé pour comparer les fréquences et le test de Student pour les moyennes. La méthode de Kaplan Meier a permis de calculer les courbes de survie globale et spécifiques ainsi que le taux de survie à 3 et 5 ans. Le test du log rank a été réalisé pour comparer ces courbes de survie. Pour tous ces tests, p < 0.05 était considéré comme significatif.
25
Résultats
Huit cent cinquante-deux patients ont été présentés en RCP ORL au CHU d’Amiens entre le 1er janvier 2002 et le 31 décembre 2012 pour un carcinome épidermoïde des VADS, localisé au niveau de la cavité orale, oropharynx, hypopharynx, larynx ou adénopathie cervicale sans porte d’entrée. Parmi eux, 311 patients ont été exclus car le suivi n’était pas réalisé au CHU d’Amiens, au CH de Doullens, Montdidier ou Péronne, ou perdus de vue (suivi inférieur à 6 mois).
Au total, 541 patients ont étés inclus : 400 ont présenté une seule lésion et constituaient le groupe témoin et 141 patients ont présenté 172 STP métachrones.
Les caractéristiques de la population ont été présentées dans le tableau 2.
Le sexe, l’âge et les facteurs de risque (tabac et alcool) étaient comparables dans les 2 groupes.
La comparaison du stade tumoral du premier carcinome épidermoïde montrait que la tumeur était moins évoluée à la fois localement (stade T), régionalement (stade N) et généralement (stade M) dans le groupe des patients ayant ensuite développé une STP. La stadification globale retrouvait ces résultats avec une proportion plus importante de stade 1 et 2 dans le groupe des patients présentant des STP. À partir du stade 4B, c’était dans le groupe témoin que l’on retrouvait une proportion significativement plus importante.
La répartition des localisations était comparable dans les deux groupes. À noter, 35 patients du groupe témoin avaient des lésions synchrones (dont 10 pulmonaires, 5 oesophagiennes, 12 au niveau des VADS et 8 avaient au moins trois lésions synchrones) et 10 dans le groupe avec STP métachrone. Parmi ces 10 patients, la majorité (6) présentait des doubles localisations des VADS.
Les traitements à but non curatifs n’étaient pas représentés dans le groupe des patients ayant développé une STP.
La durée moyenne de suivi à partir du premier carcinome épidermoïde était de 27.53 mois dans le groupe témoin, avec une médiane de 17.10 mois. Dans le groupe avec STP celle-ci était de 69.32 mois (médiane = 51.08 mois) à partir de la première tumeur, et 16.03 mois (médiane = 6.95 mois) à partir de la STP.
26 Tableau 2 Caractéristiques de la population étudiée.
27 Tableau 3 Caractéristiques des STP.
Le tableau 3 montrait les caractéristiques des STP métachrones. L’âge moyen de survenue de la STP était de 60.79 ans (médiane = 59.70 ans). Les localisations des STP étaient essentiellement représentées par les VADS à 78.1%. Les STP pulmonaires étaient la deuxième localisation la plus représentée avec 16.1%.
Vingt-six patients ont présenté une troisième lésion métachrone, encore majoritairement au niveau des VADS. Pendant la période de suivi, un patient a présenté jusqu’à 6 lésions successives.
La figure 1 montrait la comparaison des courbes de survie globale et la figure 2 les survies déterminées.
28 Figure 1 Comparaison des courbes de survie globale.
Le taux de survie globale était respectivement de 44.7% et 38.1% pour les témoins à 3 et 5 ans alors qu’à partir de la STP métachrone ces taux n’étaient que de 28.5% à 3 ans et 20.3% à 5 ans. La médiane de survie globale était de 21.9 mois IC95% [18.6 ; 35.0] pour les témoins et de 13.9 mois IC95% [9.4 ; 23.6] à partir de la STP métachrone. La moyenne de survie globale était de 51.0 mois +/-3.2 pour les témoins et 26.5 mois +/-2.7 à partir de la STP métachrone. Il existait une différence significative de survie globale entre le groupe métachrone et le groupe témoins p=0.001 (log-rank α = 0.05).
29 Figure 2 Comparaison des courbes de survie déterminée.
Le taux de survie déterminée était respectivement de 50.4% et 47.3% pour les témoins à 3 et 5 ans alors qu’à partir de la STP métachrone ces taux n’étaient que de 33.8% à 3 ans et 24.0% à 5 ans. La médiane de survie déterminée était de 40.5 mois IC95% [21.0 ; NC] pour les témoins et de 18.2 mois IC95% [9.9 ; 26.7] à partir de la STP métachrone. La moyenne de survie déterminée était de 67.7 mois +/-3.7 pour les témoins et 29.2 mois +/-3.0 à partir de la STP métachrone. Il existait une différence significative de survie déterminée entre le groupe métachrone et le groupe témoins p < 0.001 (log-rank α=0.05).
30 La figure 3 montrait la différence de survie globale en fonction de la localisation de la STP. Les STP des VADS avaient une tendance statistique (log rank p = 0.094) à une meilleure survie globale que les STP d’autres localisations (poumons, œsophage et vessie).
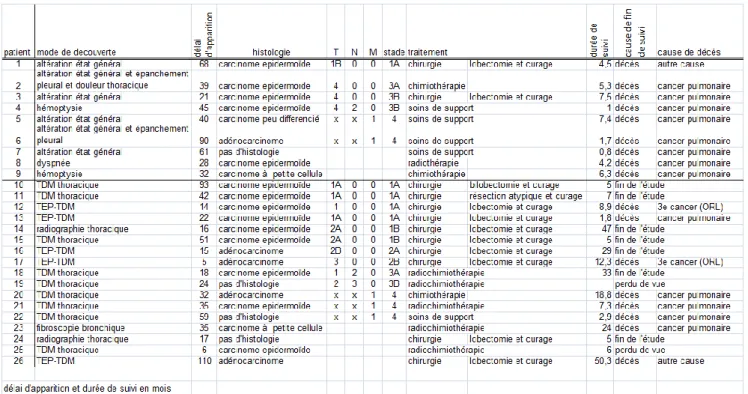
Figure 3 Comparaison de la survie globale en fonction de la localisation de la STP. Le tableau 4 montrait les caractéristiques des cancers métachrones pulmonaires.
31 Vingt-six tumeurs pulmonaires ont été découvertes : 22 comme STP, 2 comme troisième tumeur primitive et 2 synchrones à une STP des VADS. Neuf de ces 26 tumeurs pulmonaires ont été découvertes par l’apparition de signes cliniques tels que l’altération d’état général, hémoptysie, épanchement pleural et dyspnée. Les 17 autres ont été découvertes par des examens systématiques : 1 fibroscopie bronchique, 2 radiographies thoraciques de face, 5 TEP-TDM et 9 TDM thoraciques.
Le risque de décès par cancer pulmonaire était plus important dans le groupe 1 (découverte à la suite de signes cliniques) que dans le groupe 2 (découverte systématique par imagerie) p=0.004.
Les cancers de stade peu avancé (stade 1 et 2) avaient tendance à être découverts par imagerie systématique p=0.067. Concernant le mode de découverte des STP pulmonaires de stades avancés, il n’existait pas de différence p=0.192 entre la découverte par la clinique ou l’imagerie systématique.
32
Discussion
Taux de survie
Le taux de survie globale ou déterminée était moins bon pour la STP que pour la première tumeur des VADS.
Les STP, après cancer des VADS, étaient le plus souvent retrouvées dans les VADS, les poumons et l’œsophage, ce qui menait à une significative baisse de la survie 532. Comparé au taux de survie globale à 5 ans des cancers des VADS, qui avoisinait les 50% 4 25 33 34 35, le taux de survie globale à 5 ans des patients avec cancers des VADS développant une STP était d’environ 20% après le diagnostic de cette STP 91320
.
Dans les différentes études de la littérature, ce taux de survie variait en fonction du type de STP. Le sous-groupe des STP pulmonaires et oesophagiennes avait une survie globale plus faible que les STP des VADS 133233353637. Par exemple, dans l’étude de Chuang qui avait la cohorte la plus importante, le taux de survie globale à 5 ans était supérieur à 30% si la STP était également localisée au niveau des VADS, et chutait aux alentours de 8 % si la STP était en dehors des VADS (poumons et œsophage essentiellement) 9. Dans notre étude cette particularité n’était pas retrouvée de manière significative, peut-être à cause du faible effectif des lésions métachrones hors VADS.
Dans la littérature, le taux de survie globale à 5 ans des STP des VADS était d’environ 30%, soit moins bon que le taux de survie à 5 ans des tumeurs des VADS initiales (50%) 2633. Tout comme les STP des VADS, les STP oesophagiennes et pulmonaires avaient un pronostic moins bon que si ces tumeurs survenaient de princeps 3338.
Dans les STP des VADS, le taux de survie à 5 ans diminuait pour chaque occurrence. Dans l’étude de Leon, sur un panel de 4298 patients, les taux de survie globale diminuaient d’environ 10% à l’apparition de chaque nouvelle tumeur 26
. Dans notre étude, il existait des cas de tumeurs primitives successives multiples, mais l’effectif était insuffisant pour comparer leurs taux de survie.
33 Le taux de STP variait dans la littérature en fonction de la localisation de la tumeur initiale et de celle des STP, et en fonction de la durée de suivi. Dans les séries les plus importantes, le risque cumulé à 20 ans de STP après cancer des VADS était de 36% (sur 99 257 patients) 9 ou 47% après cancer du larynx (20 074 patients) 10.
Les deuxièmes localisations des VADS étaient les plus fréquentes : 50% des tumeurs métachrones. Elles étaient les plus faciles à diagnostiquer, puisqu’elles étaient habituellement accessibles à l’examen clinique. La surveillance clinique était codifiée par la SFORL, mais l’éducation était importante car le taux de STP ne diminuait pas avec le temps alors que les consultations s’espaçaient. Dans la majorité des cas, c’était les symptômes que les patients avaient remarqué eux-mêmes qui avaient mené au diagnostic de STP 27 39. Il était donc important d’informer les patients sur les symptômes possibles qui pouvaient apparaitre et qui devaient mener à une consultation 39. Cette éducation des patients était primordiale, et faisait partie intégrante du suivi. Tous les malades à risque devraient bénéficier d’une surveillance afin d’obtenir un diagnostic précoce de ces STP.
Facteurs de risque de STP
Les facteurs de risque de développer une STP ont par ailleurs beaucoup été étudiés. Yamamoto retrouvait que le risque de STP était plus important chez les hommes 40.
Pour certains, l’âge n’était pas un facteur modifiant le risque d’apparition de STP 13 25. Pour d’autres, l’âge jeune en était un 5 35
. Par exemple, Rennemo montrait que le taux de STP est plus élevé chez les patients sous la médiane d’âge 5
. Et Chuang trouvait que le risque relatif de STP était de 14.6 IC95% [13.6 ;16.3] pour les patients ayant présenté leur tumeur initiale avant l’âge de 56 ans. Ce risque diminuait avec l’augmentation de l’âge au moment de la tumeur initiale (p<0.0001) 9.
Dans notre étude, la moyenne d’âge était plus faible au moment de la tumeur initiale pour les patients ayant présenté une STP.
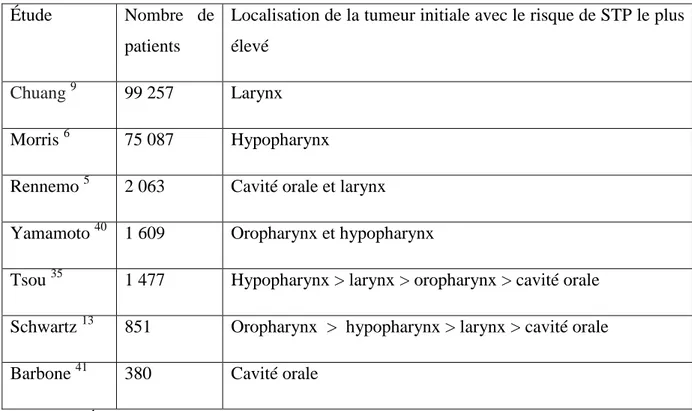
Les auteurs ont cherché à savoir si le risque de STP variait en fonction de la localisation de la tumeur initiale : les résultats montrés tableau 5 étaient discordants.
34
Étude Nombre de
patients
Localisation de la tumeur initiale avec le risque de STP le plus élevé
Chuang 9 99 257 Larynx
Morris 6 75 087 Hypopharynx
Rennemo 5 2 063 Cavité orale et larynx Yamamoto 40 1 609 Oropharynx et hypopharynx
Tsou 35 1 477 Hypopharynx > larynx > oropharynx > cavité orale Schwartz 13 851 Oropharynx > hypopharynx > larynx > cavité orale Barbone 41 380 Cavité orale
Tableau 5 Études montrant les localisations de tumeur des VADS présentant le plus de STP. Dans notre étude, il n’existait pas de localisation initiale préférentielle. Mais il existait un biais de recrutement car les localisations oropharynx et cavité buccale étaient peu représentées. En effet, les patients suivis en chirurgie maxillo-faciale pour ces lésions n’ont pas été inclus.
Concernant la localisation des STP, on retrouvait que leur fréquence variait en fonction de la localisation de la tumeur initiale : les STP des VADS étaient plus classiques après tumeur initiale de la cavité orale et de l’oropharynx 56 143641, alors que les STP pulmonaires étaient plus fréquentes après tumeur initiale laryngée 56103642.
Les patients avec les tumeurs initiales les plus limitées avaient un risque plus important de développer une STP 5, et ce même après ajustement sur la durée de survie 7. Le risque de STP diminuait avec l’augmentation des stades T et N 527.
Dans notre étude, la proportion des tumeurs T2, N0 ou M0 étaient moins élevée et celle des tumeurs T3, N3 ou M1 étaient plus importante dans le groupe témoin que dans le groupe métachrone. Donc, globalement, le premier cancer était moins avancé localement, avec une extension ganglionnaire et métastatique moins importante dans le groupe avec STP.
35 Concernant le stade, les résultats étaient similaires avec une proportion plus importante de stade 1 et 2 dans le groupe avec STP et plus de stade 4B dans le groupe témoin.
L’apparition d’une STP était l’un des facteurs limitant la survie globale des patients quand le contrôle locorégional de la tumeur initiale était atteint 14. Les STP étaient une cause de décès importante chez les patients avec stade faible de cancer des VADS 1333. En effet, les patients avec un pronostic initial médiocre ne vivaient pas assez longtemps pour développer une STP 5.
L’extension de la tumeur initiale influençait le risque de seconde tumeur primitive : la plupart de ces secondes tumeurs primitives apparaissaient chez les patients qui avaient présenté la tumeur initiale la plus petite, à cause de leur meilleure survie 343.
Les STP étaient plus souvent découvertes à un stade moindre que les tumeurs initiales probablement grâce au suivi. Elles restaient tout de même de pronostic moindre que les tumeurs initiales 26
Le tabac et l’alcool sont des facteurs de risque majeurs de cancer des VADS retrouvés dans toutes les études 16. L’alcool favorisait la survenue de STP 7 133537, ainsi que le tabac 7 91113
14 35 37
. Les patients présentant une STP étaient plus probablement des fumeurs actifs 44. Le risque d’apparition de STP augmentait avec le niveau de tabagisme au moment de la tumeur initiale 414344.
Les avis sont également unanimes sur l’incidence de l’arrêt de l’intoxication du tabac et la survenue d’un deuxième cancer : Moore en 1971 a montré la diminution du risque après arrêt du tabac. En effet, 40% des patients qui continuaient de fumer après un cancer des VADS ont développé une STP versus 6% des patients ayant arrêté 45. Le risque de seconde tumeur restait stable plusieurs années, jusque 3 ans après l’arrêt du tabagisme, 4346 puis diminuait 4446. Dans notre étude, le sevrage de l’intoxication alcoolo-tabagique n’a pas pu être répertorié au moment de la STP, par manque de données.
Plus récemment, l’infection par le papilloma virus humain 16 (HPV 16) a été reconnue comme facteur de risque indépendant des carcinomes épidermoïdes des VADS 47. La contamination par HPV serait associée, dans de nombreux pays, à une augmentation de l’incidence des cancers de l’oropharynx et de la langue chez les adultes jeunes 48
. Cependant, en France, la courbe d’incidence par âge de 2012 ne montrait pas de décalage vers les âges
36 plus jeunes par rapport aux courbes des années antérieures 1. L’infection à HPV 16 n’a pas pu être étudiée dans cette série rétrospective.
Un autre facteur de risque potentiel de STP était le traitement par radiothérapie 11. Le risque de STP diminuait lors des 5 premières années (effet protecteur) et ré-augmentait après cette période, dépassant le risque en l’absence de traitement par radiothérapie 48
. L’irradiation avait donc un effet préventif non durable dans le temps 10 48 49. Néanmoins, ce facteur de risque était mineur car le risque relatif n’était que de 1.1 10.
Traitement
Il y avait de moins en moins de traitement à but curatif avec l’apparition de nouvelles tumeurs des VADS même si celles-ci étaient de stade de moins en moins élevé lors de leur découverte. Par exemple dans l’étude de León, sur 4298 patients, la fréquence des traitements palliatifs atteignait 22% pour la STP puis 41% et 75% pour les 3e et 4e tumeur des VADS 26. Cette diminution de traitement à but curatif était essentiellement due aux traitements antérieurs 26. Dans notre étude, les traitements à but curatif type chirurgie seule ou chirurgie suivie de radiothérapie +/- chimiothérapie était plus fréquent dans le groupe avec STP métachrone, alors que les traitements par chimiothérapie ou soins de support palliatifs étaient plus fréquent dans le groupe témoins. Parfois, l’état général ne permettait pas de débuter un traitement dans le groupe témoin. En effet, on observait que les STP ne survenaient que chez les patients ayant pu être traité de leur premier cancer, ou encore, avec la meilleure survie.
STP pulmonaires
Les STP pulmonaires posaient 2 problèmes : celui du diagnostic différentiel avec une évolution métastatique et celui de leur dépistage.
Diagnostic STP versus métastase
Pour distinguer une STP d’une évolution métastatique, l’histologie de la tumeur pulmonaire était importante. L’histologie la plus fréquente était le carcinome épidermoïde 24
. Sur un total de 4522 STP, Milano retrouvait 43.1% de carcinome épidermoïde, 17.5% d’adénocarcinome et 39.4% d’autres histologies 20
37 Sur la base de la technique biomoléculaire de la « perte d’hétérozygotie », Geurts démontrait que plus de 50% des carcinomes épidermoïdes pulmonaires cliniquement classés comme métastases étaient en fait des STP 17. Leong montrait qu’un carcinome épidermoïde solitaire pulmonaire était plus souvent une métastase qu’une STP en utilisant la méthode de l’analyse des microsatellites 18. Ces deux études montraient que la classification clinique et radiologique était insuffisante.
Néanmoins, la distinction entre STP pulmonaire et métastase pulmonaire unique ne modifiait pas le pronostic du patient 50. En effet dans une autre étude de Geurts, la survie après chirurgie d’exérèse de lésions pulmonaires après carcinome épidermoïde des VADS était similaire que cette lésion soit une STP ou une lésion métastatique 50. Il faudrait donc traiter chirurgicalement les tumeurs pulmonaires uniques pour améliorer la survie 50.
Tout comme l’ensemble des STP, les facteurs de risques de développer une STP pulmonaire après cancer des VADS étaient : localisation de la tumeur initiale laryngée, sexe masculin, stade localisé de la tumeur initiale 20 38. Les STP pulmonaires se développaient chez les patients avec une tumeur des VADS de bon pronostic parce que ces patients avaient la meilleure survie 38. Le risque de développer une STP pulmonaire était stable dans le temps, avec une incidence d’environ 1% par an dans l’étude de Milano, sur 61883 patients 20
. Les patients avec STP pulmonaire, quelqu’en soit l’histologie, après cancer des VADS avaient un pronostic plus sombre que l’ensemble des patients présentant un cancer pulmonaire 38
.
Dépistage
La surveillance devait détecter ces STP pulmonaires, de manière précoce, chez les patients aux antécédents de cancer ORL afin de pouvoir proposer un traitement curatif, si possible chirurgical 20 38. Ces stades précoces, n’étaient pas accessibles à l’examen clinique, c’est pourquoi un dépistage par imagerie devait être proposé.
Shah montrait que la radiographie thoracique annuelle n’était pas suffisante comme test de dépistage car 66% des patients avaient eu leur diagnostic de STP pulmonaire après apparition de symptômes. Les patients avaient développé des lésions de croissance rapide donnant des symptômes avant la réalisation de la radiographie annuelle suivante42.
38 Ritoe montrait que le dépistage des STP pulmonaires métachrones par radiographie thoracique ne permettait pas d’améliorer la survie, seulement de détecter la tumeur quelques mois plus tôt 51.
En dehors du contexte de cancer des VADS, le dépistage des cancers pulmonaires par radiographie thoracique permettait de trouver des lésions pulmonaires plus petites en taille, avec un envahissement ganglionnaire moins fréquent, et à des stades plus faibles que les tumeurs découvertes à la suite de symptômes 52.
Dans notre série, parmi les découvertes de STP pulmonaires, celles réalisées grâce à l’imagerie systématique étaient plus fréquemment de stade peu avancé que celles découvertes à la suite de symptômes. Cette imagerie était essentiellement des TDM et TEP-TDM plutôt que des radiographies thoraciques.
Dans le même type de série, Dequanter a montré que sur 412 patients atteints de cancer des VADS, 39 avaient développé des STP pulmonaires dont 14 synchrones et 25 métachrones. Un délai de 12 mois a été utilisé comme définition. La survie globale était meilleure dans le groupe métachrone, et encore meilleure dans le sous-groupe des STP apparaissant après 5 ans (p < 0.0001). 53
39
Conclusion
Les STP métachrones ont un mauvais pronostic et leur prise en charge est limitée par les traitements antérieurs. Malgré l’identification de facteurs de risque de STP, tous les patients restent à risque élevé. Ils doivent être surveillés, et ce d’autant plus, s’ils ont été traités de manière curative de leur tumeur initiale. L’éducation sur les signes d’alerte devant mener à une consultation précoce est primordiale.
L’arrêt de l’intoxication alcoolo-tabagique doit être systématique mais ne dispense pas de la surveillance. Celle-ci doit rester clinique pour les STP des VADS, mais l’imagerie a une place importante pour le diagnostic des localisations pulmonaires. Les modalités de cette imagerie sont encore discutées, car les pratiques cliniques ne suivent pas toujours les recommandations. La pratique des imageries en coupe TDM ou des TEP-TDM doit encore être évaluée.
40
bibliographie
[1] Estimation nationale de l’incidence et de la mortalité par cancer en France entre 1980 et 2012 - Partie 1 - Tumeurs solides - Publications - Institut National Du Cancer [Internet]. Available from: http://www.e-cancer.fr/publications/69-epidemiologie/696-estimation-nationale-de-lincidence-et-de-la-mortalite-par-cancer-en-france-entre-1980-et-2012-partie-1-tumeurs-solides
[2] Grosclaude P, Remontet L, Belot A, Danzon A, Rasamimanana C, Bossard N. Survie des
personnes atteintes de cancer en France, 1989-2007 - Etude à partir des registres des cancers du réseau Francim. Saint-Maurice : Institut de veille sanitaire ; 2013. 412 p.
[3] Cooper JS, Pajak TF, Rubin P, Tupchong L, Brady LW, Leibel SA, et al. Second malignancies in patients who have head and neck cancer: incidence, effect on survival and implications based on the RTOG experience. Int J Radiat Oncol Biol Phys 1989;17:449–56.
[4] Argiris A, Karamouzis MV, Raben D, Ferris RL. Head and neck cancer. Lancet 2008;371:1695– 709.
[5] Rennemo E, Zätterström U, Boysen M. Impact of second primary tumors on survival in head and neck cancer: an analysis of 2,063 cases. The Laryngoscope 2008;118:1350–6.
[6] Morris LGT, Sikora AG, Patel SG, Hayes RB, Ganly I. Second Primary Cancers After an Index Head and Neck Cancer: Subsite-Specific Trends in the Era of Human Papillomavirus-Associated
Oropharyngeal Cancer. J Clin Oncol 2011;29:739–46.
[7] Day GL, Blot WJ, Shore RE, Schoenberg JB, Kohler BA, Greenberg RS, et al. Second cancers following oral and pharyngeal cancer: patients’ characteristics and survival patterns. Eur J Cancer B Oral Oncol 1994;30B:381–6.
[8] Cognetti DM, Weber RS, Lai SY. Head and neck cancer. Cancer 2008;113:1911–32.
[9] Chuang S-C, Scelo G, Tonita JM, Tamaro S, Jonasson JG, Kliewer EV, et al. Risk of second primary cancer among patients with head and neck cancers: A pooled analysis of 13 cancer registries. Int J Cancer 2008;123:2390–6.
[10] Gao X, Fisher SG, Mohideen N, Emami B. Second primary cancers in patients with laryngeal cancer: a population-based study. Int J Radiat Oncol Biol Phys 2003;56:427–35.
[11] Arnold M, Liu L, Kenter GG, Creutzberg CL, Coebergh JW, Soerjomataram I. Second primary cancers in survivors of cervical cancer in the Netherlands: Implications for prevention and surveillance. Radiother Oncol J Eur Soc Ther Radiol Oncol 2014;
[12] Waren, Gates. Multiple primary malignant tumors : A survey of the literature and a statistical study. Am J Cancer 1932;16:1358–414.
[13] Schwartz LH, Ozsahin M, Zhang GN, Touboul E, De Vataire F, Andolenko P, et al. Synchronous and metachronous head and neck carcinomas. Cancer 1994;74:1933–8.
[14] León X, Quer M, Diez S, Orús C, López-Pousa A, Burgués J. Second neoplasm in patients with head and neck cancer. Head Neck 1999;21:204–10.
41 [15] Suivi post-thérapeutique des carcinomes épidermoïdes des voies aérodigestives supérieures de
l’adulte. EM-Consulte.;Available from: http://www.em-consulte.com/article/78375/article/suivi-post-therapeutique-des-carcinomes-epidermoid
[16] Snow GB. Follow-up in patients treated for head and neck cancer: how frequent, how thorough and for how long? Eur J Cancer Oxf Engl 1990 1992;28:315–6.
[17] Geurts TW, Nederlof PM, van den Brekel MWM, van’t Veer LJ, de Jong D, Hart AAM, et al. Pulmonary squamous cell carcinoma following head and neck squamous cell carcinoma: metastasis or second primary? Clin Cancer Res Off J Am Assoc Cancer Res 2005;11:6608–14. [18] Leong PP, Rezai B, Koch WM, Reed A, Eisele D, Lee DJ, et al. Distinguishing second primary
tumors from lung metastases in patients with head and neck squamous cell carcinoma. J Natl Cancer Inst 1998;90:972–7.
[19] Mercer RR, Lucas NC, Simmons AN, Zander DS, Tsongalis GJ, Funkhouser WK, et al. Molecular discrimination of multiple primary versus metastatic squamous cell cancers of the head/neck and lung. Exp Mol Pathol 2009;86:1–9.
[20] Milano MT, Peterson CR, Zhang H, Singh DP, Chen Y. Second primary lung cancer after head and neck squamous cell cancer: population-based study of risk factors. Head Neck 2012;34:1782–8. [21] Slaughter DP, Southwick HW, Smejkal W. Field cancerization in oral stratified squamous
epithelium; clinical implications of multicentric origin. Cancer 1953;6:963–8.
[22] Carey TE. Field cancerization: are multiple primary cancers monoclonal or polyclonal? Ann Med 1996;28:183–8.
[23] Braakhuis BJM, Brakenhoff RH, Leemans CR. Second Field Tumors: A New Opportunity for Cancer Prevention? The Oncologist 2005;10:493–500.
[24] Licciardello JTW, Spitz MR, Hong WK. Multiple primary cancer in patients with cancer of the head and neck: Second cancer of the head and neck, esophagus, and lung. Int J Radiat Oncol 1989;17:467–76.
[25] Van der Haring IS, Schaapveld MS, Roodenburg JLN, de Bock GH. Second primary tumours after a squamous cell carcinoma of the oral cavity or oropharynx using the cumulative incidence method. Int J Oral Maxillofac Surg 2009;38:332–8.
[26] León X, Martínez V, López M, García J, Venegas M del P, Esteller E, et al. Second, third, and fourth head and neck tumors. A progressive decrease in survival. Head Neck 2012;34:1716–9. [27] Haas I, Hauser U, Ganzer U. The dilemma of follow-up in head and neck cancer patients. Eur
Arch Laryngol Off J Eur Fed Laryngol Soc EUFOS Affil Ger Soc Oto-Rhino-Laryngol - Head Neck Surg 2001;258:177–83.
[28] Moro-Sibilot D, Milleron B, Groupe Dépiscan. [Screening for bronchial carcinoma]. Rev Mal Respir 2002;19:707–15.
[29] Henschke CI, McCauley DI, Yankelevitz DF, Naidich DP, McGuinness G, Miettinen OS, et al. Early Lung Cancer Action Project: overall design and findings from baseline screening. Lancet
42 [30] National Lung Screening Trial Research Team, Aberle DR, Adams AM, Berg CD, Black WC, Clapp
JD, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med 2011;365:395–409.
[31] Wiley: TNM Classification of Malignant Tumours, 7th Edition - Leslie H. Sobin, Mary K. Gospodarowicz, Christian Wittekind [Internet]. Available from:
http://eu.wiley.com/WileyCDA/WileyTitle/productCd-1444332414.html
[32] Farhadieh RD, Salardini A, Yang JL, Russell P, Smee R. Diagnosis of second head and neck tumors in primary laryngeal SCC is an indicator of overall survival and not associated with poorer overall survival: A single centre study in 987 patients. J Surg Oncol 2010;101:72–7.
[33] Chen M-C, Huang W-C, Chan CH, Chen P-T, Lee K-D. Impact of second primary esophageal or lung cancer on survival of patients with head and neck cancer. Oral Oncol 2010;46:249–54. [34] Vaamonde P, Martín C, del Río M, LaBella T. Second primary malignancies in patients with
cancer of the head and neck. Otolaryngol--Head Neck Surg Off J Am Acad Otolaryngol-Head Neck Surg 2003;129:65–70.
[35] Tsou Y-A, Hua C-H, Tseng H-C, Lin M-H, Tsai M-H. Survival study and treatment strategy for second primary malignancies in patients with head and neck squamous cell carcinoma and nasopharyngeal carcinoma. Acta Otolaryngol (Stockh) 2007;127:651–7.
[36] Hsu Y-B, Chang S-Y, Lan M-C, Huang J-L, Tai S-K, Chu P-Y. Second primary malignancies in squamous cell carcinomas of the tongue and larynx: an analysis of incidence, pattern, and outcome. J Chin Med Assoc JCMA 2008;71:86–91.
[37] Lin K, Patel SG, Chu PY, Matsuo JMS, Singh B, Wong RJ, et al. Second primary malignancy of the aerodigestive tract in patients treated for cancer of the oral cavity and larynx. Head Neck 2005;27:1042–8.
[38] Jayaprakash V, Cheng C, Reid M, Dexter EU, Nwogu CE, Hicks W, et al. Previous Head and Neck Cancers Portend Poor Prognoses in Lung Cancer Patients. Ann Thorac Surg 2011;92:1056–61. [39] Boysen M, Lövdal O, Tausjö J, Winther F. The value of follow-up in patients treated for
squamous cell carcinoma of the head and neck. Eur J Cancer Oxf Engl 1990 1992;28:426–30. [40] Yamamoto E, Shibuya H, Yoshimura R, Miura M. Site specific dependency of second primary
cancer in early stage head and neck squamous cell carcinoma. Cancer 2002;94:2007–14. [41] Barbone F, Franceschi S, Talamini R, Barzan L, Franchin G, Favero A, et al. A follow-up study of
determinants of second tumor and metastasis among subjects with cancer of the oral cavity, pharynx, and larynx. J Clin Epidemiol 1996;49:367–72.
[42] Shah SI, Applebaum EL. Lung cancer after head and neck cancer: role of chest radiography. The Laryngoscope 2000;110:2033–6.
[43] Narayana A, Vaughan AT, Fisher SG, Reddy SP. Second primary tumors in laryngeal cancer: results of long-term follow-up. Int J Radiat Oncol Biol Phys 1998;42:557–62.
43 [44] Shiels MS, Gibson T, Sampson J, Albanes D, Andreotti G, Freeman LB, et al. Cigarette Smoking
Prior to First Cancer and Risk of Second Smoking-Associated Cancers Among Survivors of Bladder, Kidney, Head and Neck, and Stage I Lung Cancers. J Clin Oncol 2014;JCO.2014.56.8220. [45] Moore C. Cigarette smoking and cancer of the mouth, pharynx, and larynx. A continuing study.
JAMA 1971;218:553–8.
[46] Tomek MS, McGuirt WF. Second head and neck cancers and tobacco usage. Am J Otolaryngol 2003;24:24–7.
[47] Shindoh M, Chiba I, Yasuda M, Saito T, Funaoka K, Kohgo T, et al. Detection of human papillomavirus DNA sequences in oral squamous cell carcinomas and their relation to p53 and proliferating cell nuclear antigen expression. Cancer 1995;76:1513–21.
[48] Rennemo E, Zätterström U, Evensen J, Boysen M. Reduced risk of head and neck second
primary tumors after radiotherapy. Radiother Oncol J Eur Soc Ther Radiol Oncol 2009;93:559–62. [49] Hashibe M, Ritz B, Le AD, Li G, Sankaranarayanan R, Zhang Z-F. Radiotherapy for oral cancer as
a risk factor for second primary cancers. Cancer Lett 2005;220:185–95.
[50] Geurts TW, Balm AJM, van Velthuysen M-LF, van Tinteren H, Burgers JA, van Zandwijk N, et al. Survival after surgical resection of pulmonary metastases and second primary squamous cell lung carcinomas in head and neck cancer. Head Neck 2009;31:220–6.
[51] Ritoe SC, Krabbe PFM, Jansen MMG, Festen J, Joosten FBM, Kaanders JHAM, et al. Screening for second primary lung cancer after treatment of laryngeal cancer. The Laryngoscope
2002;112:2002–8.
[52] Shimizu N, Ando A, Teramoto S, Moritani Y, Nishii K. Outcome of patients with lung cancer detected via mass screening as compared to those presenting with symptoms. J Surg Oncol 1992;50:7–11.
[53] Dequanter D, Shahla M, Lardinois I, Gilbert O, Hanquet O, Tragas G, et al. Second primary lung malignancy in head and neck cancer patients. Eur Ann Otorhinolaryngol Head Neck Dis
44
Annexes
Annexe 1 Classification TNM ORL Cavité orale / oropharynx
T1 : Tumeur ≤ 2 cm.
T2 : Tumeur comprise entre 2 et 4 cm. T3 : Tumeur > 4 cm.
T4 : Envahissement des structures adjacentes (peau, os, muscles profonds, muscles extrinsèques de la langue).
Hypopharynx
T1 : Tumeur limitée à l’un des sites de l’hypopharynx et/ou ≤ 2 cm.
T2 : Tumeur envahissant plus d’un site de l’hypopharynx ou un site adjacent ou > 2 cm et ≤ 4 cm, sans fixation de l’hémilarynx.
T3 : Tumeur > 4 cm ou avec fixation de l’hémilarynx ou extension oesophagienne.
T4 : Tumeur envahissant les structures adjacentes (cartilages laryngés, parties molles du cou, glande thyroïde, os hyoïde, espace prévertébral).
Larynx supraglottique
T1 : Tumeur limitée à un site anatomique, mobilité normale.
T2 : Tumeur étendue à plus d’un site supra glottique ou à la glotte, sans fixation du larynx. T3: Tumeur limitée au larynx avec fixation d’une corde vocale et/ou envahissement post-cricoïdien et/ou tissu pré-epiglottique et /ou espace paraglottique.
T4: Tumeur envahissant le cartilage thyroïde et/ou s’étendant hors du larynx dans les parties molles du cou, à la thyroïde et / ou à l’œsophage.
Larynx plan glottique
T1 : Tumeur limitée aux cordes vocales pouvant envahir les commissures antérieure et postérieure avec mobilité normale.
T1a : limitée à une corde vocale. T1b : envahissant les 2 cordes vocales.
T2 : Tumeur étendue en supra-glottique et/ou en sous glottique et/ou avec une mobilité diminuée de la corde vocale.
T3 : Tumeur limitée au larynx avec fixation de la corde vocale.
T4 : Tumeur étendue à travers le cartilage thyroïde et/ou envahissant d’autres structures extra-laryngées (trachée, parties molles du cou, thyroïde...).
45 Larynx sous glottique
T1 : Tumeur limitée à la sous glotte, mobilité normale.
T2 : Tumeur étendue à une ou aux cordes vocales, mobilité normale ou altérée. T3 : Tumeur limitée au larynx avec fixation d’une corde vocale.
T4 : Tumeur étendue à travers le cartilage thyroïde ou cricoïde et/ou envahissant d’autres structures extra-laryngées.
Envahissement ganglionnaire
N0 : pas d’adénopathie métastatique.
N1 : une seule adénopathie métastatique homolatérale ≤ 3cm. N2 :
N2a : une seule adénopathie métastatique homolatérale > 3cm et ≤ 6cm. N2b : multiples adénopathies métastatiques homolatérales ≤ 6cm. N2c : adénopathies métastatiques bilatérales ou controlatérales, ≤ 6 cm. N3 : adénopathies métastatiques > 6 cm.
Métastases à distance
M0 : pas de métastases à distance. M1 : métastase(s) à distance.
Annexe 2 Stade cancer ORL
Stade I T1 N0 M0 Stage II T2 N0 M0 Stade III T1,2 N1 M0 T3 N0,1 M0 Stade IVA T1,2,3 N2 M0 T4 N0, N1 M0 Stade IVB T4 N2 M0 Tout T N3 M0
46 Annexe 3 Classification TNM poumons.
T1 : Tumeur de 3 cm ou moins dans sa plus grande dimension, entourée par le poumon ou la plèvre viscérale, sans évidence bronchoscopique d’invasion plus proximale que la bronchique lobaire (c’est-à-dire pas la bronche souche).
T1a : Tumeur ≤ 2 cm dans sa plus grande dimension.
T1b : Tumeur > 2 cm et < 3 cm dans sa plus grande dimension.
T2 : Tumeur de plus de 3 cm sans dépasser 7 cm dans sa plus grande dimension ou présentant une des caractéristiques suivantes :
• atteinte de la bronche souche à 2 cm ou plus de la carène, • invasion de la plèvre viscérale,
• présence d’une atélectasie ou d’une pneumopathie obstructive s’étendant à la région hilaire sans atteindre l’ensemble du poumon.
T2a : Tumeur ≥ 3 cm et < 5 cm dans sa plus grande dimension. T2b : Tumeur ≥ 5 cm < 7 cm dans sa plus grande dimension.
T3 : Tumeur de plus de 7 cm ; ou envahissant directement une des structures suivantes : la paroi thoracique (y compris la tumeur de Pancoast), le diaphragme, le nerf phrénique, la plèvre médiastinale, pleurale ou pariétale ou le péricarde ; ou une tumeur dans la bronche souche à moins de 2 cm de la carène sans l’envahir ; ou associée à une atélectasie ou d’une pneumopathie obstructive du poumon entier ; ou présence d’un nodule tumoral distinct dans le même lobe.
T4 : Tumeur de tout taille envahissant directement une des structures suivantes : médiastin, cœur, grands vaisseaux, trachée, nerf laryngé récurrent, œsophage, corps vertébral, carène; ou présence d’un nodule tumoral distinct dans un autre lobe du poumon.
N0 : pas de métastase ganglionnaire lymphatique régionale.
N1 : métastase dans les ganglions lymphatiques intrapulmonaires, péribronchiques et/ou hilaires ipsilatéraux, y compris par envahissement direct.
N2 : métastase dans les ganglions lymphatiques médiastinaux ipsilatéraux et/ou sous-carinaires.
N3 : métastase dans les ganglions lymphatiques médiastinaux controlatéraux, hilaires controlatéraux, scalènes ou sous-claviculaires ipsilatéraux ou controlatéraux.
47 M1 : métastase à distance.
M1a : nodule(s) tumoral distinct dans un lobe controlatéral ; tumeur avec nodules pleuraux ou épanchement pleural (ou péricardique) malin.
M1b : métastase à distance. Stade cancer pulmonaire
Stade IA T1a, b N0 M0
Stade IB T2a N0 M0
Stage IIA T1a, b N1 M0
T2a N1 M0 T2b N0 M0 Stade IIB T2b N1 M0 T3 N0 M0 Stade IIIA T1, T2 N2 M0 T3 N1, N2 M0 T4 N0, N1 M0 Stade IIIB T4 N2 M Tout T N3 M0
Stade IV Tout T Tout N M1
48
Résumé
Introduction : Le risque d’apparition d’une seconde tumeur primitive (STP) après carcinome épidermoïde des voies aérodigestives supérieures (VADS) est connu depuis longtemps. Les localisations de ces STP sont les VADS, les poumons et l’œsophage. L’objectif principal de cette étude était de comparer la survie globale et déterminée des STP métachrones après cancer des VADS à celle des patients ne développant pas de STP.
Matériel et méthodes : Une étude rétrospective a été menée chez les patients atteints d’un cancer des VADS, présentés en réunion de concertation pluridisciplinaire au CHU d’Amiens entre 2002 et 2012.
Résultats : Cinq cent quarante-et-un patients ont étés inclus. Cent quarante-et-un patients ont présenté 172 STP métachrones. Le taux de survie globale était 38.1% pour les témoins à 5 ans alors qu’à partir de la STP métachrone il n’était que de 20.3%. La médiane et moyenne de survie globale étaient respectivement de 21.9 mois IC95% [18.6 ; 35.0] et 51.0 mois +/-3.2 pour les témoins et de 13.9 mois IC95% [9.4 ; 23.6] et 26.5 mois +/-2.7 à partir de la STP métachrone. La survie déterminée était comparable à la survie globale. Il existait une différence significative de survie globale et déterminée entre le groupe métachrone et le groupe témoins p=0.001 (log-rank α=0.05).
Discussion : Les STP avaient un pronostic mois bon que si ces tumeurs survenaient de princeps, quelque soit leur localisation. L’étude des facteurs de risque d’apparition de STP ne permettait pas de déterminer un sous-groupe de patients à risque. Le suivi et l’éducation restent primordiaux pour le diagnostic précoce des STP.
Conclusion : Les STP métachrones avaient un mauvais pronostic.
Mots-clés : seconde tumeur primitive, cancer des voies aérodigestives supérieures, métachrone, survie.
49
Abstract
Objective : The risk of developing a second primary tumor (SPT) after squamous cell carcinoma of the head and neck (SCCHN) was known for a long time. The localisations of these STP were upper aero-digestive tract, lungs and esophagus. The main objective of this study was to compare the overall and specific survival after metachronous SPT to patients with SCCHN not developing SPT.
Study design : A retrospective study was conducted in patients with SCCHN presented in multidisciplinary meeting at University Hospital of Amiens between 2002 and 2012.
Results : Five hundred and forty one patients were included. One hundred forty one patients had developed 172 metachronous SPT. The 5 years overall survival rate was 38.1 % for controls while for metachronous STP it was only 20.3 %. The median and average overall survival was respectively 21.9 months 95% CI [ 18.6 ; 35.0 ] and 51.0 +/- 3.2 months for controls and 13.9 months , 95% CI [9.4 ; 23.6 ] and 26.5 +/- 2.7 months from the metachronous SPT. The specific survival was comparable to overall survival. There was a significant difference in overall and specific survival between the metachronous SPT group and the control group p = 0.001 (log -rank α = 0.05).
Discussion : SPT had a worse prognosis than if these tumors occurred at first, regardless of their localisation. The study of SPT risk factors didn’t determine a subgroup of patients at risk. Follow up and education remained important for early diagnosis of SPT.
Conclusion: Metachronous STP had a poor prognosis.
Keywords : second primary tumor, head and neck cancer, metachronous, survival.
50 Étude de survie des patients ayant développé une seconde tumeur primitive métachrone
après carcinome épidermoïde des VADS.
Résumé : Introduction : Le risque d’apparition d’une seconde tumeur primitive (STP) après carcinome épidermoïde des voies aérodigestives supérieures (VADS) est connu depuis longtemps. Les localisations de ces STP sont les VADS, les poumons et l’œsophage. L’objectif principal de cette étude était de comparer la survie globale et déterminée des STP métachrones après cancer des VADS à celle des patients ne développant pas de STP.
Matériel et méthodes : Une étude rétrospective a été menée chez les patients atteints d’un cancer des VADS, présentés en réunion de concertation pluridisciplinaire au CHU d’Amiens entre 2002 et 2012. Résultats : Cinq cent quarante-et-un patients ont étés inclus. Cent quarante-et-un patients ont présenté 172 STP métachrones. Le taux de survie globale était 38.1% pour les témoins à 5 ans alors qu’à partir de la STP métachrone il n’était que de 20.3%. La médiane et moyenne de survie globale étaient respectivement de 21.9 mois IC95% [18.6 ; 35.0] et 51.0 mois +/-3.2 pour les témoins et de 13.9 mois IC95% [9.4 ; 23.6] et 26.5 mois +/-2.7 à partir de la STP métachrone. La survie déterminée était comparable à la survie globale. Il existait une différence significative de survie globale et déterminée entre le groupe métachrone et le groupe témoins p=0.001 (log-rank α=0.05).
Discussion : Les STP avaient un pronostic mois bon que si ces tumeurs survenaient de princeps, quelque soit leur localisation. L’étude des facteurs de risque d’apparition de STP ne permettait pas de déterminer un sous-groupe de patients à risque. Le suivi et l’éducation restent primordiaux pour le diagnostic précoce des STP.
Conclusion : Les STP métachrones avaient un mauvais pronostic.
Mots-clés : seconde tumeur primitive, cancer des voies aérodigestives supérieures, métachrone, survie.
Survival study of patients who developed a second primary metachronous tumor after squamous cell cancer of head and neck.
Abstract Objective : The risk of developing a second primary tumor (SPT) after squamous cell carcinoma of the head and neck (SCCHN) was known for a long time. The localisations of these STP were upper aero-digestive tract, lungs and esophagus. The main objective of this study was to compare the overall and specific survival after metachronous SPT to patients with SCCHN not developing SPT. Study design : A retrospective study was conducted in patients with SCCHN presented in multidisciplinary meeting at University Hospital of Amiens between 2002 and 2012.
Results : Five hundred and forty one patients were included. One hundred forty one patients had developed 172 metachronous SPT. The 5 years overall survival rate was 38.1 % for controls while for metachronous STP it was only 20.3 %. The median and average overall survival was respectively 21.9 months 95% CI [ 18.6 ; 35.0 ] and 51.0 +/- 3.2 months for controls and 13.9 months , 95% CI [9.4 ; 23.6 ] and 26.5 +/- 2.7 months from the metachronous SPT. The specific survival was comparable to overall survival. There was a significant difference in overall and specific survival between the metachronous SPT group and the control group p = 0.001 (log -rank α = 0.05).
Discussion : SPT had a worse prognosis than if these tumors occurred at first, regardless of their localisation. The study of SPT risk factors didn’t determine a subgroup of patients at risk. Follow up and education remained important for early diagnosis of SPT.
Conclusion: Metachronous STP had a poor prognosis.