Détermination du rôle de la température de lissage et de
la formulation du yogourt brassé sur l’évolution de ses
propriétés durant son entreposage en utilisant la
résonance magnétique et l’analyse d’image
microscopique.
Thèse
Audrey Gilbert
Doctorat en sciences et technologie des aliments
Philosophiæ doctor (Ph. D.)
Détermination du rôle de la température de lissage et
de la formulation du yogourt brassé sur l’évolution
de ses propriétés durant son entreposage en
utilisant la résonance magnétique et l’analyse
d’image microscopique.
Thèse
Audrey Gilbert
Sous la direction de :
Sylvie Turgeon, directrice de recherche
Daniel Saint-Gelais, codirecteur de recherche
ii
Résumé
Dans la littérature, les propriétés physiques du yogourt en fonction du procédé ou de la formulation ont été beaucoup étudiées. Cependant, les effets du procédé de brassage sur les propriétés du yogourt brassé et sa structure sont peu décrits. Le rebodying durant l’entreposage est lui aussi assez peu décrit et les structures impliquées dans ce phénomène sont absentes dans la littérature. Les structures du yogourt brassé sont souvent observées à toute petite échelle (< µm) ou par des méthodes potentiellement destructrices. Le but de ce projet de thèse était d’étudier l’effet d’un paramètre impactant du procédé de brassage (la température de lissage) en combinaison avec les paramètres de formulation (choix d’ingrédients protéiques, ratio protéique et ferments) sur les structures et les propriétés physiques du yogourt brassé durant l’entreposage.
Deux techniques d’analyse innovantes ont été utilisées. Une technique améliorée d’analyse d’image microscopique pour caractériser et quantifier les différences de microstructure des produits obtenues ainsi qu’une technique de RMN à basse fréquence sur les protons (1H-BF-RMN) pour mieux décrire les phénomènes de synérèse dans le gel de yogourt durant l’entreposage. La technique d’imagerie a permis d’observer les structures du gel de yogourt brassé à une échelle entre le micron et le millimètre. Cette technique a permis d’observer des microgels de yogourt et une structure plus diffuse de gel réorganisé. La taille des microgels et le développement du gel réorganisé ont été reliés avec le phénomène de synérèse. Durant l’entreposage, la technique 1H-BF-RMN a permis de suivre la contraction du gel de protéines qui conduit à la fois à une expulsion du sérum durant l’entreposage (synérèse spontanée) et à une immobilisation plus élevée du sérum retenu à l’intérieur du gel.
Durant ce projet, l’effet de la température de lissage a été étudié avec trois échelles différentes : échelle laboratoire dans un rhéomètre, échelle technique et échelle semi-industrielle, puis l’évolution des propriétés des yogourts a été étudiée durant plusieurs jours d’entreposage. Les températures de lissage plus hautes produisaient des yogourts avec de plus gros microgels issus à la fois d’un cisaillement moins destructif et de l’agrégation de microgels individuels. La présence de gros microgels était associée à des yogourts plus visqueux et plus fermes. La présence de ces gros microgels était souvent associée à un faible développement de gels réorganisés menant à la formation de poches de sérum et donc plus de synérèse. Réciproquement, les températures de lissage faibles étaient responsables d’une présence en plus grande quantité de gel réorganisé au dépend des microgels de petite taille donnant lieu à des yogourts de faibles viscosité et fermeté. Par contre en ce qui concerne la synérèse, il semblerait qu’en dessous d’une certaine température de lissage, il n’y ait plus assez de gros microgels pour retenir le sérum, et le gel réorganisé ne retient pas suffisamment le sérum pour limiter la synérèse.
iii
En ce qui concerne les changements de formulation, l’utilisation d’un isolat ou d’un concentrat de protéines du lactosérum pour standardiser le lait n’a eu que très peu d’impact sur les propriétés étudiées du yogourt brassé. Par contre, lorsque la quantité de protéines de lactosérum était augmentée avec des teneurs en caséines et de solides totaux constantes, la fermeté et la viscosité augmentaient avec la taille des microgels, tandis que la synérèse diminuait. De plus, la quantité de protéines sériques contrôle également la capacité des microgels à s’agréger durant l’entreposage. Lorsqu’un changement de ferment était effectué, l’action des exopolysaccharides (EPS) sur les propriétés des yogourts était masquée par le lissage effectué à 4 °C. Globalement, la présence d’EPS texturants empêchait l’agrégation des microgels et produisait des yogourts avec de petits microgels et un gel réorganisé très développé. La présence d’EPS n’a pas permis d’augmenter la fermeté ou la viscosité du yogourt, par contre durant leur écoulement, la structure du gel de yogourt résistait mieux à l’intensité des cisaillements.
Cette thèse démontre que la température de lissage est un outil efficace pour contrôler les structures des yogourts brassés et donc les propriétés physiques qui en découlent. Également, le réglage de la température de lissage permet de moduler les effets provoqués par un changement de formulations. Cette thèse offre également de nouvelles techniques d’étude des microgels avec un fort potentiel prédictif qui pourrait être utilisées en industrie.
iv
Abstract
Yogurt physical properties depending on process, and formulation parameters are widely reported in the literature. However, the effect of the stirring and smoothing process on stirred yogurt and its structure is a subject of fewer studies. The rebodying during storage is also less described and the structures involved are not observed in literature. Stirred yogurt microstructures are often observed at small scales (< µm) or using methods that are destructive. The aim of this project was to study the effect of an impacting stirred yogurt process parameter (smoothing temperature) and the formulation (protein ingredient, protein ratio, and starter) on structural and physical properties of stirred yogurt during storage.
Two innovative techniques of analyses were introduced. One microscopic image analysis to characterize and quantify the different microstructures in the product; and one method based on NMR at low frequency on protons (1H-LF-NMR) to better describe syneresis phenomena in yogurt gel during storage. The microscopic technique allowed observing structures in the range from a few microns to a millimeter range. It also allowed differentiating a looser gel (reorganized gel) from dense microgels. Microgels size and reorganized gel development were linked to syneresis phenomenon. During storage, the 1H-LF-NMR detected the protein gel contraction, which leads to both a higher content of expelled water during storage (spontaneous syneresis), and more immobilization of the serum still inside the network.
During this project, smoothing temperature effect was studied with three different production scales: laboratory scale, technical scale, and semi-industrial scale, then stirred yogurt evolution were studied during storage. Higher smoothing temperature produced larger microgels that came from less destructive shearing and microgel aggregation. Those large microgels were associated with less development of the reorganized gel leading to the formation of areas empty of protein networks responsible for higher syneresis values. However, under a specific smoothing temperature the number and smaller size of microgels are not enough to hold the serum and the reorganized gel is too loose, which produced yogurt with higher syneresis.
The effect of formulation had really little impact when comparing between a whey protein concentrate instead of an isolate as the whey protein ingredient for milk standardization. However, at constant casein and total solid contents, when the whey protein content was increased, firmness, viscosity, and microgel sizes increased, while induced syneresis decreased. Moreover, the whey protein quantity controlled how much the microgels aggregated during storage. When the starter was changed, the polysaccharides (EPS) effects on stirred yogurts properties were masked when the smoothing process was realized at 4 °C. Globally the presence of texturing EPS hindered microgel aggregation and produced yogurt with small microgels and a more developed reorganized gel. The presence of texturing EPS did not increase viscosity or firmness, however, during flow experiments, the gel structure had a better resistance toward shearing.
v
This thesis demonstrates that smoothing temperature is a tool to control stirred yogurt structures and the physical properties that results from structures. Besides, smoothing temperature allows to modulate the effects resulting from formulation changes. This thesis also offers innovative techniques with a strong potential to predict yogurt properties, which can be transferred to industries.
vi
Table des matières
Résumé ... ii
Abstract ... iv
Table des matières ... vi
Liste des figures ... x
Liste des tableaux ... xiii
Liste des équations ... xiv
Liste des abréviations, sigles, acronymes ... xv
Remerciements ... xviii
Avant-propos ... xxi
Introduction ... 1
Chapitre 1 : Revue de littérature ... 3
1.1 Fabrication du yogourt brassé ... 3
1.2 Le lait et ses protéines ... 5
1.2.1 La micelle de caséines ... 6
1.2.2 Les équilibres du phosphate et du calcium ... 9
1.2.3 Les protéines du lactosérum ... 10
1.3. Gélification acide du lait ... 11
1.3.1 Fermentation du lait ... 11
1.3.2 Formation du gel de caséines ... 13
1.3.3 Les protéines sériques et les traitements thermiques : effet sur le gel ... 16
1.4. Microstructures et propriétés du yogourt ... 23
1.4.1 Microstructure des gels et impact sur les propriétés du gel de yogourt ... 23
1.4.2 : Impact de la formulation sur les microstructures des yogourts brassés et fermes. ... 24
1.4.3 Impact du procédé sur les microstructures des yogourts brassés et fermes. ... 31
1.4.4 Effet des procédés de brassage et lissage : construction d’une nouvelle matrice ... 36
1.5 Utilisation des ferments producteurs d’exopolysaccharides ... 44
1.5.1 Les EPS : définition et classification ... 44
1.5.2 Classification biochimique ... 45
1.5.3 Facteurs influençant la production d’EPS ... 46
1.5.4 Effet des EPS sur la microstructure des yogourts et leurs propriétés. ... 48
1.5.5 Impact des procédés de cisaillement sur les yogourts brassés contenant des EPS ... 52
1.6 Mesure de la synérèse et mobilité du sérum : technique de résonnance magnétique nucléaire à basse fréquence sur les protons (1H-LF-RMN) ... 53
1.6.1 Les différentes techniques disponibles ... 53
1.6.2 Principe de la mesure des temps de relaxation en 1H-BF-RMN ... 54
1.6.3 Les informations accessibles par 1H-BF-RMN lors de l’étude des temps de relaxation des protons ... 55
1.7 Problématique ... 59
vii
1.9 Hypothèse ... 60
1.10 Objectif général ... 60
1.11 Objectifs spécifiques ... 60
Chapter 2: Studying stirred yogurt microstructure using optical microscopy: How smoothing temperature and storage time impact microgel sizes related to syneresis. ... 62
2.1 Résumé ... 62
2.2 Abstract ... 63
2.3 Introduction ... 64
2.4 Materials and methods ... 65
2.4.1 Yogurt making ... 65
2.4.2 Yogurt milk analyses ... 67
2.4.3 Analyses of stirred yogurt ... 68
2.4.1 Experimental design and statistical analyses ... 70
2.5 Results and discussion ... 70
2.5.1 Composition and protein particle sizes in milks before fermentation ... 70
2.5.2 Yogurt gel properties ... 71
2.7 Acknowledgments ... 83
2.8 Transition vers la méthode RMN ... 84
Chapter 3: Characterization of syneresis phenomena in stirred acid milk gel using low frequency nuclear magnetic resonance on hydrogen (1H-LF-NMR) and image analyses. ... 85
3.1 Résumé: ... 85
3.2 Abstract: ... 86
3.3. Introduction: ... 87
3.4. Material and methods: ... 89
3.4.1. Dairy products ... 89
3.4.2. Protein solutions ... 89
3.4.3. Milk formulated with dairy powders ... 90
3.4.4. Yogurt production ... 90
3.4.5. Gel structure and image analysis of yogurts and gels ... 90
3.4.6. Induced syneresis ... 91
3.4.7. Low Frequency Nuclear Magnetic Resonance on Hydrogen (LF-1H-NMR) ... 91
3.4.8. Experimental design and statistics ... 92
3.5. Results and discussion ... 93
3.5.1. Relationship between yogurt syneresis and 1H-LF-NMR relaxation time distribution ... 93
3.5.2. Comparison between 1H-LF-NMR results of milk and yogurt ... 95
3.5.3. General pattern and number of peaks ... 100
3.5.4. Potential use of 1H-LF-NMR to predict commercial yogurt syneresis ... 101
3.6. Conclusion ... 105
3.7 Transition vers le chapitre 4 ... 107
Chapter 4: Smoothing temperature and casein to whey protein ratio: two tools to improve non-fat stirred yogurt properties. ... 108
viii
4.1 Résumé ... 108
4.2 Abstract ... 109
4.3 Introduction ... 110
4.4 Materiel and methods ... 112
4.4.1 Yogurt production ... 112
4.4.2 Yogurt milk composition and particle size ... 113
4.4.3 Yogurt analyses ... 114
4.4.4 Experimental design and statistics ... 116
4.5 Results and discussion ... 117
4.5.1 Composition and particle size of yogurt milk with different CN:WP ratios ... 117
4.5.2 Yogurt pH and bacterial concentrations ... 118
4.5.3 Particles size analyses and gel structures ... 119
4.5.4 Rheological properties of stirred gels ... 123
4.6.5 Syneresis and bulk water mobility ... 125
4.6 Conclusion ... 128
4.7 Transition vers le chapitre 5 ... 128
Chapter 5: Smoothing temperature modulates exopolysaccharides impact on non-fat stirred yogurt structure and texture during semi-industrial producing conditions. ... 130
5.1 Résumé ... 130
5.2 Abstract ... 131
5.3 Introduction ... 132
5.4 Material and methods ... 133
5.4.1 Yogurt starter preparation ... 133
5.4.2 Stirred yogurts manufacture ... 134
5.4.3 Bacterial counts ... 135
5.4.4 Milk composition analyses ... 135
5.4.5 EPS content ... 135
5.4.6 Particle size analyses ... 135
5.4.7 Rheological properties ... 136
5.4.8 Firmness ... 136
5.4.9 Induced syneresis ... 137
5.4.10 Experimental design and statistics ... 137
5.5 Results and discussion ... 137
5.5.1 Effects of smoothing temperature on yogurt fermented with different starters. ... 137
5.5.2 Effect of starters on yogurts smoothed at 27 °C ... 148
5.6 Conclusion ... 149
Chapitre 6: Discussion générale ... 150
6.1 Introduction de nouvelles méthodes pour mettre en lien la structure et les propriétés de rétention d’eau du yogourt brassé. ... 150
6.1.1 Analyse d’image microscopique ... 151
ix
6.2 Effet de la température de lissage et de la formulation sur la microstructure et les propriétés physiques
des gels de yogourt brassé. ... 153
6.2.1 Microstructure ... 153
6.2.2 Synérèse et lien avec la microstructure ... 155
6.2.3 Rhéologie et lien avec la microstructure ... 157
6.3 Limite des résultats ... 158
6.4 Retombées du projet ... 159
Conclusion générale ... 161
Perspectives ... 163
Bibliographie ... 164
ANNEXE A : Fonctionnement de la 1H-BF-RMN ... 185
Comment fonctionne la RMN ? ... 185
Organisation de l’appareil ... 190
Signal reçu et interprétation ... 192
Comment décomposer le signal obtenu ? ... 194
Homogénéité du signal magnétique et séquence de pulse ... 195
Caractérisation du temps de relaxation transversale ... 197
ANNEXE B : Matériel supplémentaire – Chapitre 2 ... 201
ANNEXE C: Matériel supplémentaire – Chapitre 3 ... 205
ANNEXE D: Matériel supplémentaire – Chapitre 4 ... 208
x
Liste des figures
Figure 1.1: Procédé de fabrication du yogourt brassé ... 5
Figure 1.2: La matrice du lait cru, composition et structure. ... 6
Figure 1.3: Structure des caséines composant les micelles. ... 7
Figure 1.4: La micelle de caséine. ... 8
Figure 1.5: Les équilibres phosphocalciques dans le lait à pH 6,7. ... 9
Figure 1.6: La composition de la micelle selon les différents traitements physicochimiques appliqués. ... 10
Figure 1.7: Relation symbiotique du métabolisme des ST et LB. ... 12
Figure 1.8: Phénomène de coagulation acide des micelles de caséines. ... 15
Figure 1.9 : Agrégats de protéines sériques attachés à la micelle ou dans le sérum vu par microscopie à balayage électronique (1) et par microscopie électronique à transmission (2). ... 19
Figure 1.10 : Modèle d'agrégation des WP dénaturées autour de la micelle de CN lors de traitements à haute température - temps courts en fonction du pH. ... 20
Figure 1.11 : Répartition des agrégats de WP autour des micelles de caséines selon le ratio CN:WP. ... 21
Figure 1.12 : Formation du réseau secondaire de WP dénaturées entre les micelles de caséine. ... 22
Figure 1.13: Schéma des microstructures et des phénomènes de synérèse dans le gel de yogourt ... 24
Figure 1.14 : Gel de yogourt obtenu selon les traitements thermiques réalisés sur les WP et les CN : ... 30
Figure 1.15 : Propriétés de texture de yogourts formulés à 12 % de solides totaux à partir de poudre de lait écrémé (Ctrl) et 1% de protéines de lactosérum ajoutées sous forme de concentré (CPL), d’isolat (IPL), ou d’hydrolysat (PLH) de protéines de lactosérum. ... 31
Figure 1.16 : Effet du traitement thermique et de la température de gélification sur les propriétés rhéologiques des gels laitiers acides au cours du temps 1,3 % (poids/poids) de (GDL). ... 33
Figure 1.17: Schéma de la formation des microgels du yogourt brassé. ... 36
Figure 1.18 : Microstructure de gel de yogourt (0% MG ; fermentation lactique à 32°C, pasteurisation à 85°C durant 30 min) avant et après brassage observée par microscopie confocale à balayage laser. ... 37
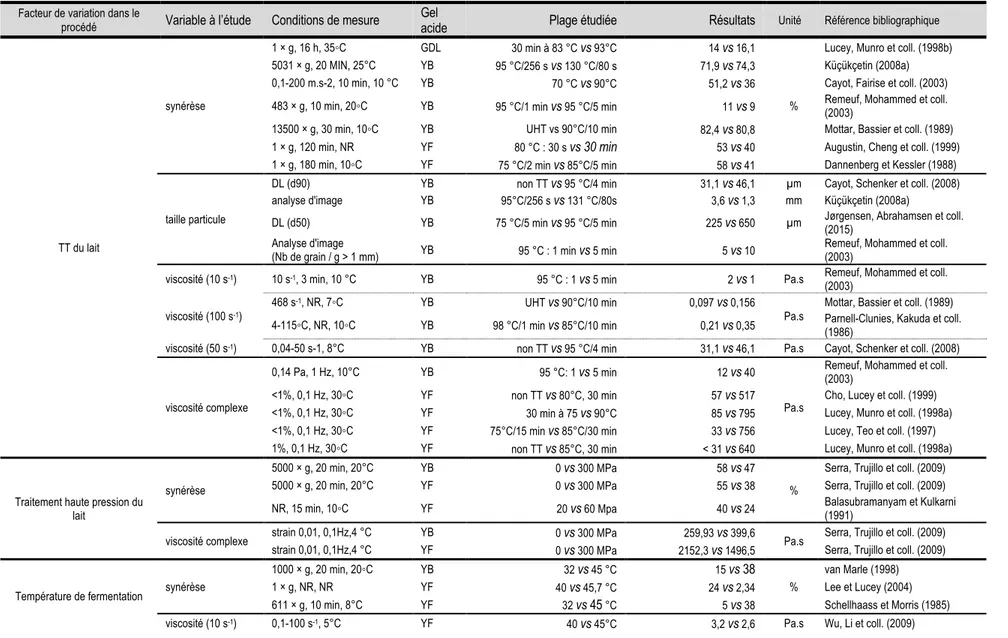
Figure 1.19 : Viscosité du yogourt pour différents cisaillements constants au court du temps. ... 39
Figure 1.20 : Évolution de la microstructure pendant l’écoulement d’une suspension de particules floculées. . 39
Figure 1.21 : Viscosité apparente selon une boucle d’hystérèse de cisaillement pour un yogourt concentré (labneh) à différents temps de stockage. ... 41
Figure 1.22 : Les différents homopolysaccharides produits par les bactéries lactiques. ... 47
Figure 1.23 : Mécanisme de déplétion-floculation entre un colloïde sphérique et un polymère n’interagissant pas. Adaptée de De Kruif et Tuinier 2001. ... 49
Figure 1.24 : Schéma de l’organisation des caséines et des EPS libres neutres dans un gel laitier acide ... 50
Figure 1.25 : Observation par microscopie confocale à balayage laser du développement des microstructures du yogourt contenant des bactéries lactiques productrices d’exopolysaccharides capsulaires (CPS) à pH 6,40 (a), 5,40 (b), 5,35 (c), 5,00 (d). ... 50
xi
Figure 1.27 : Variation de la vitesse de relaxation (1/T2) en fonction la concentration en protéines sériques de
solutions et de gels (mesures effectuées à 20 MHz). ... 57
Figure 1.28 : Évolution des paramètres de relaxations transversale et longitudinale durant la fermentation du yogourt. ... 58
Figure 2.1 : Laboratory-scale heat-treatment system for yogurt milk. ... 66
Figure 2.2: Apparent viscosity measured during yogurt smoothing. ... 73
Figure 2.3 : Induced syneresis of stirred yogurts measured after 3 days of storage. ... 74
Figure 2.4: Volume means D[4,3] of particles sizes from yogurt measured by laser diffraction. ... 75
Figure 2.5 : Microscopic images of stirred yogurts after 4 days of storage. ... 75
Figure 2.6: (A and B) Microgel surface area and (C) protein network heterogeneity index (NHI) measured by image analyses. ... 76
Figure 2.7 : Number of microgels detected per milliliter of yogurt. ... 79
Figure 2.8 : Percentage of the image surface occupied by microgels greater than 104 µm2. ... 80
Figure 2.9: Microgel circularity index depending on microgel surface area class. ... 81
Figure 3.1: Relaxation time distribution and relative signal intensity (A) I2(3); (B) I2(4) of yogurt from pasteurized skim milk: ... 95
Figure 3.2: Transversal relaxation time dispersion of commercial pasteurized skim milk ( ) and its corresponding set yogurt gel made in the laboratory ( ). ... 97
Figure 3.3: Transversal relaxation time T2(2) (A, C) and its relative signal intensity I2(2) (B, D) ... 100
Figure 3.4: Schematic representation of 1H relaxation time distribution pattern for yogurt ... 101
Figure 3.5: Characterization of commercial stirred yogurt at 4 %, 5 %, 6 %, and 10 % protein. ... 104
Figure 4.1: Stirring process technical scale scheme. ... 113
Figure 4.2: pH of stirred yogurts smoothed at different temperatures during storage. ... 119
Figure 4.3: Description of stirred yogurt gel microstructure (top panel) and digital microscopy pictures of stirred yogurt gels at day 1 (bottom panel). ... 120
Figure 4.4: Yogurt microgel size measured by image analysis of digital microscope slides (A; B), and by laser diffraction in milk permeate dilution (C). ... 122
Figure 4.5: Firmness (A; B), consistency (C) and flow behavior index of yogurts (D). ... 124
Figure 4.6: Induced syneresis (A; B), bulk water mobility measured by 1H-LF-NMR (C; D), and spontaneous syneresis measured by 1H-LF-NMR (E) of stirred yogurts. ... 126
Figure 5.1: Stirred yogurt pH. ... 140
Figure 5.2: Volume mean diameter (D [4 3]) of stirred yogurts particles measured by laser diffraction. ... 140
xii
Figure 5.4: Image analysis of digital microscope slides obtained for stirred yogurt gels. ... 142
Figure 5.5: Number of microgel per mL of stirred yogurt counted by image analysis. ... 143
xiii
Liste des tableaux
Tableau 1.1: Caractéristiques des souches des yogourts. ... 13
Tableau 1.2 : Température et pression de dénaturation des principales WP. ... 18
Tableau 1.3 : Résumé de l’effet des principaux paramètres de formulations sur les propriétés des yogourts. . 26
Tableau 1.4 : Composition de trois ingrédients riches en protéines de lactosérum. ... 30
Tableau 1.5 : Résumé des effets de différentes étapes du procédé sur les propriétés des gels de yogourt. .... 34
Table 2.1: Composition and particle size of yogurt milks1 ... 71
Table 3. 1: Commercial stirred yogurts ... 89
Table 3.2: Comparison of the proton pools and their interpretation determined by 1H-LF-NMR using transversal relaxation time analyses on milk or dairy solutions at pH 6.6. ... 98
Table 3.3: Pearson’s correlation1 between 1H-LF-NMR results and induced syneresis and image analysis of commercial stirred yogurts1. ... 105
Table 4.1: Milk composition and particle size1 ... 118
Table 5.1:Fermentation time and exopolysaccharides (EPS) production1. ... 139
Table 5.2: Individual effects of smoothing temperature and storage time on syneresis and rheological properties of stirred yogurt1. ... 144
Table 5.3: Individual effects of starters on yogurt smoothed at 27 °C.1 ... 148
Tableau 6.1: Comparaison des techniques de caractérisation utilisées. ... 151
xiv
Liste des équations
Équation 1.1 : Initiation de la polymérisation. ... 17
Équation 1.2 : Propagation. ... 17
xv
Liste des abréviations, sigles, acronymes
CN : Caséine
1H-BF-RMN (1H-LF-NMR) : Résonance magnétique nucléaire à basse fréquence sur les protons
(hydrogène)
BSA : Sérum albumine bovine
CCP : Nano-cluster de phosphate et calcium CPS : Exopolysaccharides capsulaires CI : Indice de circularité
CN:WP : Ratio caséines : protéines sériques EPS : Exopolysaccharides FL: Fraction de lactosérum GDL : Glucono-δ-lactone GG : Globule gras GMP : Glycomacropeptide HePS : Hétéropolysaccharides HoPS : Homopolysaccharides
I2(i) : Intensité du signal magnétique émis par une population i sur le signal total.
LB : Lactobacillus delbruckeï subsp. bulgaricus MG : Matière grasse
MS : Matière sèche
NHI : Indice d’hétérogénéité du gel de yogourt brassé RMN (NMR) : Résonance magnétique nucléaire ST : Streptococcus thermophilus
T2(i) : Temps de relaxation transversale d’une population d’hydrogène i dans une matrice.
WP : Protéines sériques (de lactosérum)
α-CN : (αs1-CN, αs2-CN) : α-caséine (type s1 ou s2)
α-lac : α-lactalbumine β-CN : β-caséine β-lg : β-lactoglobuline κ-CN : κ-caséine
xvi
xvii
« Je vis de bonne soupe, et non de beau
langage » Molière, les femmes savantes
(1672)
xviii
Remerciements
En premier lieu, je voudrais remercier mes directeurs de thèse Sylvie Turgeon et Daniel St-Gelais, ainsi que Laurie-Eve Rioux. Tout d’abord, sans vous ce doctorat n’aurait pas eu lieu. Ensuite, je vous remercie tous les trois de votre confiance, de votre soutien et de votre patience. Vous avez toujours été à l’écoute de mes idées et de mes questionnements parfois extravagants, et vous m'avez aidée à construire un projet réaliste et réalisable. J’ai pu mener entièrement mon projet, et faire un stage en recherche industrielle en France, ce qui est une grande chance. Je pense que grâce à vous j’ai beaucoup évolué en termes d’esprit critique, de confiance en moi et de compétence scientifique.
Je voudrais aussi remercier Diane Gagnon, la super héroïne du laboratoire. Merci pour ta patience, merci d’être toujours disponible. Merci pour les multiples conseils, les réparations d’urgence, ta bonne humeur, et merci pour le chocolat toujours disponible dans les situations où l’activité de recherche peut être frustrante. C’est une très grande chance de travailler avec toi.
Merci à toute l’équipe du laboratoire pilote : Pascal Lavoie, Mélanie Martineau, et Pierre Côté. Votre aide m’a été précieuse pour concevoir, réaliser et faire fonctionner les divers procédés de fabrication dont j’ai eu besoin pour ce projet.
Je remercie également les membres et les étudiantes de l’équipe du CRD de Saint-Hyacinthe : Valérie Guénard Lampron, Noémie Lussier, Annie Caron et Sophie Turcot et l’équipe de Sébastien Villeneuve avec qui nous avons collaboré sur ce projet.
Je remercie Hélène Fortier, Christine Dumas et Raymonde Gagnon pour leur soutien administratif et leur bonne humeur.
Je remercie également mes stagiaires Christine Coutu et Pascal Laforge pour leur précieuse aide. Je remercie tous les membres de l’équipe qui ont permis une bonne ambiance (Léa Guinot, Laura Chevalier, Christine Vallières, Daniela Perez, Blaise Kuate Kamga, Alexandra Dion-Poulin, Mélanie Lacroix, Thang Xuan, Auriane Feroussier, Guillaume Morin, …)
Merci aux équipes du VTC (Vienne Technical Center) en France grâce auxquelles j’ai pu passer un agréable stage. Merci à Sébastien Fraud de m’avoir accueillie dans son équipe. Sous ta supervision j’ai énormément appris, merci d’avoir accepté mes suggestions, merci pour tes conseils, merci pour ton calme olympien durant
xix
la durée de stage. Merci à Marion Morand, Violaine Pistre de l’équipe Procédé pour votre aide, vos suggestions et votre bienveillance. Merci en particulier à Mathilde Poinsot et Émilie Lhomme (équipe Ferments) de m'avoir formée et de m'avoir transmis de nombreuses connaissances qui m'ont évité certaines erreurs. Merci à Gabrielle Morales et toute son équipe au laboratoire pilote (Aurelie Chazelle, Damien Bouquet, Élodie Tresfield, Maureen Berger, Thomas Ravinel, Pierrick Pascual, Marion Feuillant) pour toute l’aide que vous m’avez apportée. Je remercie aussi les organismes qui ont soutenu financièrement ce projet : le programme FAST carreer de l’INAF, Novalait, et le FRQNT. Également, je suis reconnaissante de la générosité de Biena et Agropur pour nous avoir fourni les matières premières utilisées pour les deux premiers objectifs de ce projet, et à Yoplait France pour nous avoir fourni la matière première pour le dernier objectif de cette thèse, et pour m’avoir accueillie dans leur centre de recherche à Vienne en France.
De façon plus personnelle, je tiens à remercier mes amis et ma famille qui m’ont permis de respirer et de tenir le coup jusqu’au bout :
Tout d’abord Morgane Laurent et Emily Dubois mes anciennes colocataires dans le château des reines, Andréanne Lamarche et Léa Guinot (et son levain « Enrique » !). Nous nous sommes énormément soutenues les unes les autres face aux différentes épreuves. Merci pour les soirées, les randonnées et les voyages, merci pour votre présence et votre amitié.
Merci à Likun Panda et à Deepack Kumar Ja. Merci de votre bienveillance, de votre soutien, de votre générosité, votre humour.
Merci à Christian Garzia, d’une certaine façon le papa de la colocation des reines. Merci pour les nombreuses soirées de danse, les randos et voyages, et ton enthousiasme pour absolument tout.
Merci à Caroline Royer, Jacopo Profili, Sébastien Champagne que j’ai rencontrés plus tard dans mon doctorat qui ont également participé à la bonne humeur générale et à l’entraide mutuelle.
Merci à la station Yoga, à ses professeurs (Geneviève Drolet, Amélie Fisher, Élie-Anne Gée, Kéane Côté-Demers, Élie Dubois Sénéchal, Vicky Levesque), à ses membre réguliers (Mélisse, Myriam, Justine, Martine, Marie-Pierre, Marius, Annie, Monique, …). Ce studio a parfois des allures de petite famille, et certains d’entre vous sont devenus des amis très proche. Je ne sais pas combien de fois vous avez pris le temps de m’écouter quand ça n’allait pas. Venir faire du sport avec vous tous m’a permis d’installer un gros bouclier entre moi et les coups de déprime, de me rappeler qu’il y a une vie à côté du labo, et qu’il faut écouter ses limites.
xx
Merci à ma famille qui est mon plus grand support moral, qui est prête à m’aider envers et contre tous. Merci à mes parents qui m’ont toujours poussé à faire mieux, toujours défendu, toujours soutenu. Merci à mes sœurs, mon Maron et mon Sophipiou, à mon frère le Xav; sans vous je n’aurais aujourd’hui pas d’humour ni d’autodérision. Merci à Laurent et à Guillaume mes beaux-frères qui « sheerlead » à leur manière. Merci à mes grands-parents, envers qui, je pense, j’ai manqué de gratitude, en particulier mon grand-père. J’espère qu’aujourd’hui il aurait été fier de moi. Merci à Nouki et Marceau qui m’ont un jour invitée à venir chez eux au Canada, merci de votre soutien et de votre intérêt. Merci également à Kikibou, Reguinou et Sunchou des prés. Trois chevaux qui sans le savoir m’ont permis de tenir bon et me rappeler ce que je voulais.
xxi
Avant-propos
La présente thèse comporte six chapitres et se termine par une conclusion générale. Le premier chapitre permet de faire l'état des connaissances de base à partir d’une revue de la littérature. Les quatre chapitres suivants sont des articles scientifiques suivis d’une discussion générale des résultats au chapitre 6 mettant en interrelation les travaux menés. Le premier article a été soumis à la revue Journal of dairy science le 11 avril 2019 et a été accepté pour publication le 3 novembre 2019 et publié en mars 2020. Le second article a été soumis à Food Hydrocolloids le 27 mars 2020 et accepté pour publication le 31 mars 2020. Je suis l’auteur principal de ces articles et de toutes les autres parties de la thèse.
J’ai mené ce projet sous la direction de la Professeure Sylvie Turgeon et la codirection du Docteur Daniel St-Gelais. Ils en sont les initiateurs et m’ont aidé à l’élaborer durant toute sa durée avec la participation du Docteure Laurie-Eve Rioux. Le Docteur Sébastien Fraud, scientifique chez Yoplait General Mill a également contribué à la discussion et la planification des travaux du chapitre 5.
Pour sa réalisation j’ai mis en place des protocoles d’étude de gels de yogourts brassés avec des productions allant de l’échelle laboratoire (40 ml) à la production semi-industrielle (250 L de lait traité par jour en moyenne). J’ai collecté la totalité des données, réalisé leurs analyses statistiques et leurs interprétations. Le projet s’est déroulé au sein du département des sciences des aliments de la Faculté des sciences de l’agriculture et de l’alimentation à l’Université Laval. J’ai aussi réalisé un stage de recherche de cinq mois au centre de recherche laitière « Vienne Technical Center » (VTC) de Yoplait-General Mills à Vienne en France.
Le premier chapitre « Revue de littérature » couvre l’état d’avancement des connaissances scientifiques sur la fabrication des yogourts et les phénomènes biochimiques et biophysiques impliqués dans l’obtention des gels lactiques brassés. Les principaux défauts des yogourts brassés et les variables de composition et de procédés d’influence y sont décrits. Cette section se termine par la présentation de la problématique de recherche ainsi que l’hypothèse et les objectifs généraux et spécifiques de cette thèse.
Le second chapitre « Studying stirred yogurt microstructure using optical microscopy: How smoothing temperature and storage time impact microgel sizes related to syneresis » s’intéresse à l’effet des températures de lissage et des ingrédients de protéines sériques pour standardiser les laits de fabrication des yogourts. Ce chapitre propose une technique améliorée d’observation et de mesure des caractéristiques de microstructures des gels de yogourts brassés. Les yogourts brassés étaient réalisés à échelle laboratoire (40 mL). L’effet de ces paramètres a été observé sur les propriétés des microgels et sur la synérèse forcée des yogourts brassés pendant l’entreposage.
xxii
Le troisième chapitre « Characterization of syneresis phenomena in stirred acid milk using low frequency nuclear
magnetic resonance on hydrogen (1H-LF-NMR) and image analyses » présente l’utilisation d’une technique utilisant la résonance magnétique nucléaire (RMN) afin d’étudier la synérèse dans les gels de yogourts. Ce chapitre établit un schéma d’interprétation des résultats obtenus par résonance magnétique à basse fréquence sur l’hydrogène et décomposé par transformation de Laplace. Le but était de regarder l’interrelation entre les résultats en RMN, la méthode classique de synérèse induite et l’étude de microstructure par analyse d’image microscopique.
Le quatrième chapitre « Smoothing temperature and casein to whey protein ratio: two tools to improve non-fat
stirred yogurt properties », est un article investiguant l’effet d’une teneur plus élevée de protéines de lactosérum
ainsi que la température de lissage des yogourts. Les effets de ces paramètres sur les caractéristiques structurales des microgels, la texture, la viscosité, et les phénomènes de synérèse des yogourts y sont expliqués.
Le cinquième chapitre, « Smoothing temperature modulates exopolysaccharide impact on non-fat stirred yogurt
structure and texture during industrial producing conditions », est une étude du potentiel des ferments
producteurs d’exopolysaccharides (EPS) sur l’amélioration de certaines caractéristiques des yogourts brassés en fonction de leur température de lissage. Cette partie du projet s’est faite avec la participation du Dr Sébastien Fraud, permettant des travaux à l’échelle semi-industrielle au centre de recherche de Yoplait à Vienne en France (Vienne Technical Center). Les changements de texture, de viscosité, de thixotropie et de synérèse induite ont été étudiés selon le traitement de température de lissage et de choix des ferments.
Le chapitre six discute de l’ensemble des résultats obtenus dans cette thèse, permettant d’établir les limites de l’étude et ses perspectives. Le dernier chapitre est une conclusion générale de l’ensemble des travaux menés où sont présentées les nouvelles connaissances scientifiques apportées par cette thèse ainsi que les perspectives de futurs travaux sur les problématiques du yogourt brassé.
1
Introduction
Le lait est une des sources complètes de nutriments. Pour conserver ses qualités, la fermentation est l’un des procédés le mieux adapté (Aryana et Olson 2017). Aujourd’hui, il existe plus de 400 produits différents issus de la fermentation laitière à travers le monde, le plus consommé étant le yogourt (Vasbinder, van Mil et coll. 2001; Kilara et Chandan 2013; Aryana et Olson 2017). Ce produit bénéficie d’une image santé très positive (Kilara et Chandan 2013; Isaacs 2016; Aryana et Olson 2017), ce qui en fait un support d’innovation important dans l’industrie laitière. Ainsi, entre 2010 et 2018 la production de yogourt est passé de 300 719 kg à 387 710 kg/ année (augmentation de de 28,9 %) au Canada (Statistique Canada, 2019). L’offre est extrêmement diversifiée, déclinée selon la teneur en matière grasse, l’ajout ou non de fruits, d’arômes, ou de sucre, l’ajout de souches probiotiques, la concentration protéique et enfin l’utilisation ou non du brassage (Aryana et Olson 2017).
Parmi les qualités recherchées dans un yogourt, on distingue les qualités gustatives (acidité, flaveur, odeur, arôme), les qualités de texture (épais, lisse, filant, uniforme, crémeux) (Cayot, Schenker et coll. 2008; Krzeminski, Tomaschunas et coll. 2013) et l’aspect (granuleux, brillance, couleur, homogénéité, présence de sérum en surface, déphasage). Depuis les années 80-90, il existe une grande demande pour des produits pauvres en matière grasse (Aryana et Olson 2017). Malheureusement, certains consommateurs ont tendance à rejeter ces produits, car ils sont moins épais, moins consistants, plus granuleux ou sensibles à la synérèse (Lucey et Singh 1998; Lucey 2001; Cayot, Schenker et coll. 2008; Damin, Alcântara et coll. 2009; Ozcan, Horne et coll. 2011). Il existe cependant des technologies de formulation permettant de limiter ces problèmes, tels que l’ajustement de la teneur en matière sèche laitière non grasse (Sodini, Remeuf et coll. 2004), ou l’ajout d'agents texturants tels que l’amidon, la gélatine, des gommes, ou des fibres solubles (Keogh et O'Kennedy 1998; Fiszman, Lluch et coll. 1999; Everett et McLeod 2005; Oh, Anema et coll. 2007). Dans certains pays, notamment dans le cadre de l’Union Européenne, l’utilisation d’additifs est interdite pour les produits dénommés « yogourts », et les consommateurs se méfient de plus en plus des additifs dans les produits alimentaires (Evans, de Challemaison et coll. 2010; Varela et Fiszman 2013; Asioli, Aschemann-Witzel et coll. 2017). L’industrie a alors recours à l’utilisation de souches bactériennes spécifiques capables de produire des exopolysaccharides (EPS), modifiant les propriétés texturales des yogourts. Ces productions d’EPS par les différentes souches sont de mieux en mieux décrites même si, leur action au sein du gel est encore mal connue pour pouvoir sélectionner ces microorganismes selon la nature des EPS produits.
L’optimisation des procédés peut aussi contribuer à améliorer la qualité des yogourts non gras. Le traitement thermique du lait peut être adapté afin d’augmenter la capacité de rétention d’eau des gels laitiers (Remeuf, Mohammed et coll. 2003; Damin, Alcântara et coll. 2009). La consistance du gel final peut aussi être contrôlée
2
par les températures ou le temps de fermentation et de refroidissement (De Brabandere et De Baerdemaeker 1999; Haque, Richardson et coll. 2001).
Ces techniques et leurs effets ont été largement documentés pour les yogourts de type ferme, mais la littérature est moins abondante pour le yogourt brassé. Ce yogourt est issu d’un cisaillement post-fermentation, lors des étapes de brassage en cuve, de lissage, et au cours de l’étape de refroidissement à travers des conduites ou des échangeurs à plaques avant la mise en pot (INPhO et FAO 1998; O'Rell et Chandan 2013; Mokoonlall, Nöbel et coll. 2016). L’effet de ces procédés mécaniques sur la structuration du gel lactique et comment celle-ci impacte les propriétés du yogourt brassé sans gras commence à être étudié dans des conditions plus proches de la réalité industrielle (Mokoonlall, Nöbel et coll. 2016; Zhang, Folkenberg et coll. 2016). L’intensité des cisaillements est l’effet le plus documenté alors que peu d’études ont visé l’action du refroidissement durant le cisaillement du gel. De plus, certaines structures (nommées de façons différentes selon les études : particule, grain, microgel), à l’origine de la granulosité du produit sont souvent mentionnées, mais il n’existe pas encore de consensus sur leur nature et leur rôle sur les propriétés physiques du gel brassé (van Marle 1998; Zoon 2003; Lee et Lucey 2006).
Les qualités organoleptiques du yogourt dépendent de la matrice du produit, celle-ci étant contrôlée par la combinaison formulation/procédé. Dans le cas de yogourt brassé, issu du cisaillement du yogourt ferme, la question est de savoir à quel point les procédés de lissage modifient cette structure en fonction de la formulation protéique du lait et des ferments lactiques utilisés.
Le but de ces travaux était donc d’une part, de définir les structures du yogourt brassé à l’aide de nouvelles techniques d’investigation et d’autre part, de comprendre l’impact des interactions formulation/procédé sur le gel de yogourt brassé. Les connaissances et les outils ainsi développés permettront aux fabricants de yogourts brassés de disposer de nouvelles stratégies pour répondre aux demandes des consommateurs.
3
Chapitre 1 : Revue de littérature
1.1 Fabrication du yogourt brassé
Le yogourt est un système colloïdal, c’est-à-dire une dispersion de particules dans une matrice aqueuse. Il provient de la fermentation du lait par des bactéries lactiques. Ces bactéries ont la spécificité de transformer le sucre du lait (lactose) en acide lactique grâce à leur métabolisme anaérobique fermentaire.
L’appellation yogourt répond à des normes spécifiques (Codex-Alimentarius 2003) (CODEX STAN 243-2003) : - utilisation de la culture symbiotique de Streptococcus thermophilus et Lactobacillus delbruekii subsp. bulgaricus comme levain
- 2,7 g de protéine par 100 g de yogourt au minimum - 15 g de matière grasse par 100 g de yogourt au maximum - 107 UFC du ferment vivant par gramme de produit au minimum
Selon les pays, d’autres bactéries peuvent également être ajoutées. Dans le cas du yogourt dit naturel en Amérique du Nord et notamment au Canada, les stabilisants et épaississants sont autorisés comme additifs alimentaires et il n’y a pas de restriction sur l’ajout d’autres souches bactériennes. En revanche en Europe, mis à part les ingrédients d’origine laitière, la dénomination « yogourt » interdit l’utilisation d’additifs alimentaires ou d’autres microorganismes fermentaires.
L’ajout d’ingrédients laitiers permet de standardiser le lait pour augmenter la quantité de matière sèche non grasse (poudre de lait écrémé, lait concentré écrémé, lactose pur) (Guzmàn-gonzàlez, Morais et coll. 1999; Sodini, Remeuf et coll. 2004; Damin, Alcântara et coll. 2009; Sodini et Tong 2013) ou les teneurs en protéines spécifiques (caséinate, concentré et isolat de protéines sériques, concentré de protéines laitières) (Lucey et Singh 1998; Lucey, Munro et coll. 1999; Abu Jdayil et Hazim 2002; Sodini, Remeuf et coll. 2004; Ozcan, Horne et coll. 2011; Krzeminski, Tomaschunas et coll. 2013; Sodini et Tong 2013).
La production du yogourt commence par la formulation du mélange laitier (standardisation) et le choix des ferments. Généralement, les souches de fermentation fournies aux industries sont sous formes concentrées congelées ou lyophilisées (O'Rell et Chandan 2013). Pour réduire les temps de production, les souches peuvent être réactivées au préalable dans des fermenteurs plutôt que d’être inoculées directement. Cette étape de pré-fermentation permet d’atteindre la concentration souhaitée de bactéries dans le lait plus rapidement (gain de 1 à 2 h).
4
Le yogourt brassé et le yogourt ferme suivent le même schéma de fabrication jusqu’à la fermentation. Le yogourt ferme fermente en pot, alors que le yogourt brassé subira des étapes supplémentaires après une fermentation en cuve (procédé post-fermentation).
Pour produire les yogourts, le lait est homogénéisé puis chauffé à 90-95 °C de 5 à 10 min (ou plus rarement, 80 °C durant 30 min) après l’ajout des ingrédients laitiers, permettant ainsi de dénaturer 70 à 95 % des protéines sériques. Puis, la température est abaissée à 40-45 °C et les cultures bactériennes décongelées, sèches ou réactivées sont ajoutées (O'Rell et Chandan 2013). Dans le cas du yogourt ferme, le lait inoculé est immédiatement transféré dans des pots qui iront en étuve de fermentation (40-45 °C) le temps nécessaire pour atteindre un pH de 4,6 plus ou moins 0,05 avant d’être refroidis et entreposés à 4 °C. Pour les yogourts brassés, la fermentation est réalisée dans une grande cuve industrielle. Lorsque le pH visé est atteint, le gel est refroidi entre 21 °C et 4 °C et simultanément brassé (Mokoonlall, Nöbel et coll. 2016). U agitateur à pale brasse le gel obtenu pour qu’il soit pompé à l’aide d’une pompe volumétrique (une pompe centrifuge pourrait endommager le produit car trop cisaillante). Il peut éventuellement être acheminé jusqu’à une autre cuve de stockage entre 25 et 4 °C également brassée (Mokoonlall, Nöbel et coll. 2016). Pour obtenir une texture lisse, une étape de lissage s’ajoute. Cette étape peut être réalisée de trois manières : cisaillement en rotor stator, forçage à travers un tamis ou filtre, ou homogénéisation à basse pression (INPhO et FAO 1998). Le yogourt est ensuite acheminé par pompage vers l’étape de mise en pots puis entreposé en chambre froide (4°C) jusqu’à sa distribution et consommation (Figure 1.1).
Après fermentation, le produit final est un gel faible, continu, dans le cas du yogourt ferme. Dans le cas du yogourt brassé, une suspension de microparticules protéiques (que nous définirons dans ces travaux comme microgels) dans une phase continue peu structurée est obtenue (Cayot, Schenker et coll. 2008; Renan, Guyomarc’h et coll. 2008; Mokoonlall, Nöbel et coll. 2016; Laiho, Williams et coll. 2017).
La matrice laitière finale est le résultat d’une combinaison entre la formulation du lait, les propriétés des ferments et les procédés appliqués. Pour comprendre la structuration de la matrice du yogourt brassé, il est nécessaire de d'étudier les conséquences physicochimiques du procédé en fonction des choix de formulation.
5
Figure 1.1: Procédé de fabrication du yogourt brassé
(NDFM = Non Fat Dairy Matter = matière laitière non grasse; MSNF= Milk Solid Non Fat = matière sèche laitière non grasse). Adapté de O’Rell et Chandan (2013)
1.2 Le lait et ses protéines
Le lait est un système complexe. Il s’agit d’une émulsion huile dans eau, dont la phase continue contient des sels minéraux, du lactose, des protéines (caséines et protéines du lactosérum) (Figure 1.2). Deux grands types de protéines sont présents dans le lait, les caséines et les protéines sériques (ou du lactosérum). Elles diffèrent selon leur solubilité et leur capacité à coaguler, à complexer et à former des sous-structures ou des agrégats. Le comportement des protéines est dépendant des autres constituants du lait. Par exemple, le calcium est en équilibre entre un complexe [phosphocalcique/caséine] colloïdal (CCP) dans la micelle de caséines et sa forme solubilisée dans le sérum. Cet équilibre joue au minimum deux rôles dans le lait : le maintien des structures protéiques (Renan, Guyomarc’h et coll. 2008; Peng, Horne et coll. 2009; Ozcan, Horne et coll. 2011; Dalgleish et Corredig 2012) et la mise en place d’un pouvoir tampon maximal autour de pH 5 (Ozcan, Lucey et coll. 2008; Lucey et Horne 2009). Ce dernier est influencé par toutes les autres espèces ioniques contenues dans le lait (citrate, magnésium, protons…), mais aussi par les protéines du lait, ainsi que les températures et pressions (pressions ambiante ou pression plus élevée durant les procédés) auxquelles se trouve le lait (Gaucheron 2005;
6
Lucey et Horne 2009). Lors de la fabrication du yogourt, durant la phase d’acidification, la baisse de pH entraine plusieurs phénomènes, dont la solubilisation du calcium et du phosphate de calcium (CCP). Cette dernière impacte les micelles de caséines et la réorganisation des structures protéiques.
Sur la Figure 1.2, la structure et la composition générale du lait cru de vache sont représentées. Cependant, il est à noter que les valeurs de composition sont des moyennes, il peut y avoir des variations dues à la saison (Heck, van Valenberg et coll. 2009; Chen, Lewis et coll. 2014), la race laitière (Macheboeuf, Coulon et coll. 2009), ou la zone géographique (Allore, Oltenacu et coll. 1997), ce qui explique pourquoi les fabricants de produits laitiers ont besoin de standardiser leur formule laitière.
Figure 1.2: La matrice du lait cru, composition et structure.
MS=matières sèches, MG=matière grasse, MP=matière protéique, GG=globule gras. Composition tirée de Chandan et Kilara (2013).
1.2.1 La micelle de caséines
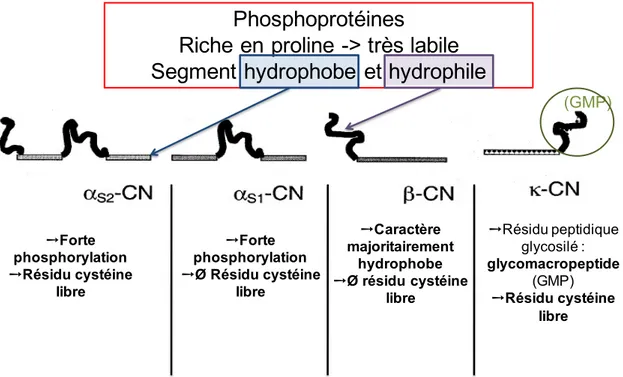
Les micelles de caséines représentent près de 80 % de la masse protéique et 22,9 % de la masse sèche du lait de vache (Dalgleish et Corredig 2012). C’est une structure de 100 à 300 nm constituée de quatre types de caséines (CN): αS1, αS2, β et κ (Figure 1.3). Ce sont toutes des protéines phosphorylées. Elles contiennent des segments peptidiques hydrophobes et hydrophiles leur conférant de très bonnes propriétés amphiphiles (Horne 1998). De plus, du fait de leur teneur élevée en proline, ces protéines sont extrêmement flexibles. Les caséines
GG = émulsion
Lactosérum
Solution de: Lactose 4,7 % Sels minéraux 0,7 %
Protéines sériques solubles (20 % de la MP) Micelle de caséine (80 %de la MP) =
suspension
7 12,2 % MS
3,4 % MG 3,4 % MP
7
αS1 et β, contrairement aux autres, n’ont pas de résidu soufré. La κ-CN est une glycophosphoprotéine : elle comporte une conjugaison glycosylée sur une portion peptidique. Cette portion terminale, appelée glycomacropeptide (GMP), est chargée négativement.
La micelle comporte également des nano-clusters phosphocalciques (CCP) qui sont des complexes de calcium et de phosphore entourés et stabilisés par des CN (Lucey 2002). Le pourcentage de chacune des CN et des CCP contenus dans une micelle dépend essentiellement de la taille de celle-ci. En moyenne les ratios sont de 4:1:3,5:1,5 respectivement pour les caséines αS1, αS2, β et κ. (Dalgleish & Corredig, 2012).
Figure 1.3: Structure des caséines composant les micelles. Adapté de Lucey (2002)
L’organisation interne de la micelle de caséines est encore très débattue. Une structure globale a été déduite des comportements biochimiques (gélification, solubilisation, composition, etc.), de microscopie électronique et de données de diffractions d’ondes (rayons X et faisceau de neutrons). Aujourd’hui, le modèle le plus utilisé pour décrire la micelle et ses comportements reste celui de Horne (1998) repris par Dalgleish et Corredig (2012). Dans ce modèle, les CN sont organisées par deux types de liaisons dans une matrice très hétérogène. Les segments phosphorylés des CN complexent les CCP par liaisons non covalentes, initiant alors des zones de plus forte concentration en calcium et caséines (agrégats de CCP/CN). La construction d’un réseau caséique se fera ensuite via des interactions hydrophobes entre les segments apolaires des chaines peptidiques des CN
Phosphoprotéines
Riche en proline -> très labile
Segment hydrophobe et hydrophile
➙Résidu peptidique glycosilé : glycomacropeptide (GMP) ➙Résidu cystéine libre ➙Caractère majoritairement hydrophobe ➙Ø résidu cystéine libre ➙Forte phosphorylation ➙Résidu cystéine libre ➙Forte phosphorylation ➙Ø Résidu cystéine libre (GMP)
8
reliant les nœuds CCP/CN entre eux. Ce mécanisme permettrait ainsi la construction d’un réseau hétérogène jusqu’à l’apparition d‘une monocouche externe de κ-CN.
Les CN se répartissent selon leurs degrés de phosphorylation et leur polarité. Les α-CN étant les plus phosphorylées, elles sont préférentiellement localisées dans les agrégats CCP/CN. Les β-CN, quant à elles, possèdent le caractère le plus hydrophobe. Malgré quelques liaisons avec les CCP, elles vont essentiellement consolider les interactions hydrophobes de la structure. Les κ-CN se localisent en périphérie de la micelle. Celles-ci jouent deux rôles : elles limitent la croissance de la micelle et elles empêchent la fusion des micelles entre elles. D’une part, la charge négative du GMP terminal et la faible teneur en phosphore de la κ-CN empêchent l’addition d’autres CN ou CCP. D’autre part, il y a création d’une zone d’encombrement stérique et de répulsion électrostatique formant une « chevelure » autour des micelles de caséines. La particularité du modèle décrit par Dalgleish et Corredig (2012) est que la structure sphérique granuleuse de la micelle en forme de mûre (Figure 1.4) est en réalité le résultat d’une structure interne poreuse au travers de laquelle d’autres molécules comme l’eau peuvent diffuser. Un autre exemple est la migration de la β-CN lors du refroidissement du lait.
Figure 1.4: La micelle de caséine.
Vue au microscope à balayage électronique et schéma de structure de la micelle de caséine (orange= α-CN; bleu=β-CN; gris= CCP; vert= para-κ-CN; noir=GMP).
9
1.2.2 Les équilibres du phosphate et du calcium
Les nœuds CCP/CN rendent la structure de la micelle extrêmement dépendante des équilibres phosphocalciques dans le lait. Ces équilibres peuvent être expliqués par une classification simple distinguant le calcium et le phosphate dit colloïdal, c’est à dire présents dans la micelle de caséines, du calcium et phosphate solubilisés dans le sérum soit sous forme d’ions simples ou complexés avec d’autres sels organiques du lait (Figure 1.5). Ce sont les équilibres phosphocalciques entre la phase micellaire et la phase aqueuse. Parmi toutes ces formes, la plus importante est le CCP micellaire (phospho-calcium colloïdal) qui représente 70 % du calcium total (Pierre, Brule et coll. 1983). L’état physique des CCP n’est pas bien connu, il ne s’agit pas de simples sels de phosphate de calcium, mais plutôt une association fortement concentrée en un complexe « phosphate-calcium » appelé nano-cluster, dont l’état cristallin ou amorphe est encore débattu (Gaucheron 2005; Lucey et Horne 2009; Dalgleish et Corredig 2012).
Dans le sérum, le calcium et le phosphate peuvent être sous forme organique, attachés aux résidus phosphosérine des caséines solubilisées, ou sous forme d'ions inorganiques (Gaucheron 2005; Lucey et Horne 2009; Koutina, Knudsen et coll. 2014).
Figure 1.5: Les équilibres phosphocalciques dans le lait à pH 6,7.
Les concentrations des différents complexes de phosphate et calcium sont exprimées en mM. Tirée de Gaucheron (2005)
L’équilibre entre ces différentes formes est influencé par la température, le pH, et la force ionique qui contrôlent les échanges entre les formes colloïdales et aqueuses des sels. L’impact de chacun de ces paramètres est résumé dans Figure 1.6. Il existe une grande mobilité ionique du calcium entre ces différentes formes, et quasiment la totalité du calcium lié directement aux résidus phosphosérine des caséines est échangeable entre ces formes. Par contre, ce n’est pas le cas du calcium contenu à l’intérieur des CCP puisque seulement 65 % du calcium micellaire serait échangeable avec la phase aqueuse (Pierre, Brule et coll. 1983). C’est en partie ce qui explique le pouvoir tampon du lait (Ozcan, Lucey et coll. 2008; Lucey et Horne 2009).
Micelle
de
caséine
10
Figure 1.6: La composition de la micelle selon les différents traitements physicochimiques appliqués. Adaptée de Gaucheron (2005)
1.2.3 Les protéines du lactosérum
Les protéines sériques (WP) sont les protéines globulaires solubles du lait. Elles sont riches en acides aminés essentiels, notamment en cystéine. Elles représentent 20% de la masse protéique du lait de vache (Chandan et Kilara 2013). Elles se composent de quatre types de protéines majeures (Edwards, Creamer et coll. 2008). La lactoferrine et des peptides sériques sont présents également, mais en quantité moindre (< 0,1 % des protéines sériques totales).
La β-lactoglobuline (β-lg, 162 acides aminés ; 18 363 Da) est une apoprotéine (2 unités) globulaire. Un rôle de transport et de protection de molécules hydrophobes, telles que la vitamine A, lui est attribué (Edwards, Creamer et coll. 2008). Elle constitue 60% de la masse des WP.
L’α-lactalbumine (α-lac, 123 acides aminés ; 14 178 Da) est capable de lier le calcium et d’autres ions. Elle participe au contrôle de la synthèse du lactose dans la glande mammaire et à la régulation des équilibres ioniques dans le lait (Edwards, Creamer et coll. 2008). Elle représente 20 % de la masse protéique du lactosérum.
11
L’albumine de sérum bovin (BSA, 583 acides aminés ; 66 399 Da) représente 3 % de la masse des WP. C’est une apoprotéine globulaire impliquée dans le contrôle des réactions oxydoréductrices dans le lait, la libération d’acides gras libres et leur transport à travers les membranes cellulaires (Edwards, Creamer et coll. 2008).
Le groupe de protéines des immunoglobulines (IgG, 689 acides aminés ; 76 110 Da) représente 10 % des WP du lait de vache. Elles assurent la transmission d’une immunité temporaire au jeune veau. C’est pour cette raison que le colostrum contient 40 à 300 fois plus d’IgG. Il s’agit d’anticorps visant à protéger le système gastrique de l’animal (Edwards, Creamer et coll. 2008).
1.3. Gélification acide du lait
1.3.1 Fermentation du lait
La production de yogourt nécessite l’acidification progressive du lait. Ainsi, le pH initial de 6,7 sera réduit jusqu’à 4,6 de façon plus ou moins lente selon le procédé. En laboratoire, il est possible d’acidifier le lait chimiquement en utilisant de la glucono-δ-lactone (GDL). La méthode d’acidification traditionnelle, utilisée industriellement, repose sur une fermentation bactérienne. Les deux souches bactériennes nécessaires à la production des yogourts sont Streptococcus thermophilus (ST) et Lactobacillus delbruekii subsp. bulgaricus (LB). On appelle ferment ou « levain de fermentation », tout cocktail de microorganismes ajouté intentionnellement au lait pour le procédé de transformation fermentaire. En Amérique du Nord, d’autres microorganismes peuvent être ajoutés. Tant que le ferment a un grade alimentaire GRAS (Generally Recognized As Safe), le produit gardera sa dénomination de yogourt (Code national sur les produits laitiers 1997). Souvent, les souches additionnelles sont des probiotiques ou des microorganismes d'intérêt technologique (production d’EPS) tels que
Bifidobacterium infantis, Lactobacillus acidophilus, ou Lactobacillus casei (Chandan et O ’ Rell 2013).
Le choix du cocktail LB / ST n’est pas anodin, ces deux microorganismes vivent en symbiose dans le lait (Figure 1.7) (Chandan et O ’ Rell 2013). Ce sont deux bactéries lactiques acidifiant le milieu en utilisant comme substrat le lactose pour produire l’acide lactique (Figure 1.7). Le LB possède des protéases capables d’hydrolyser les CN et préférentiellement la β-CN fournissant au ST des peptides et des acides aminés libres utilisables pour son métabolisme ; celui-ci pourra en fournir en retour au LB. Comme ST est aérobie facultatif, il est capable de débarrasser le milieu de l’oxygène le rendant plus favorable pour la croissance des LB. Il produit aussi de l’acide formique et du CO2 qui sont des facteurs de croissance pour le LB. Quant à l’ammoniac rejeté par le ST, celui-ci a un rôle de tampon faible dans le milieu (Chandan et O ’ Rell 2013).
Il est nécessaire de sélectionner avec précaution les souches utilisées et les conditions dans lesquelles ces bactéries sont réactivées et prolifèrent. En effet, les ST sont très sensibles aux phages par exemple. La
12
concentration et le ratio des ST et LB détermineront les vitesses d’acidification, les métabolites produits (ex : EPS, arômes, acides organiques) définissant les propriétés de texture et de viscosité, ainsi que les flaveurs développées dans le yogourt. Bien que la plupart des LB et des ST soient symbiotiques, il peut y avoir des problèmes de biocompatibilité des souches (Bullard, St-Gelais et coll. 2017) pouvant entrainer des temps de production trop longs, ou modifier la production de métabolites de chacune des souches, comme la quantité d’EPS par exemple (Bullard, St-Gelais et coll. 2017).
Figure 1.7: Relation symbiotique du métabolisme des ST et LB.
En cours de fermentation, jusqu’à pH 5, la population de ST a une croissance plus élevée que la population LB. Lorsque le pH est inférieur à 5, la tendance s’inverse et la population de LB rattrape celle de ST. Il est toutefois nécessaire de conserver une population de ST égale ou supérieure à la population de LB en fin de fermentation, pour des questions de flaveurs et de stabilité du produit. En effet, les LB ont une meilleure résistance à l’acidité, et leur métabolisme homofermentaire aboutit à une baisse de pH trop rapide et un goût acide trop prononcé (Chandan et O ’ Rell 2013). De plus, leur résistance à pH faible leur permet de poursuivre leur métabolisme fermentaire durant l’entreposage créant ainsi un phénomène de post-acidification responsable de synérèse (Lucey 2001). En outre, leur forte activité protéolytique touchant les CN (β-CN en particulier) peut conduire à la production de goût amer et de défauts de texture. La souche de ST est responsable des flaveurs des yogourts (acide lactique, acétaldéhyde, acétone, diacétyle et autres composés carbonylés). Il est donc nécessaire de
13
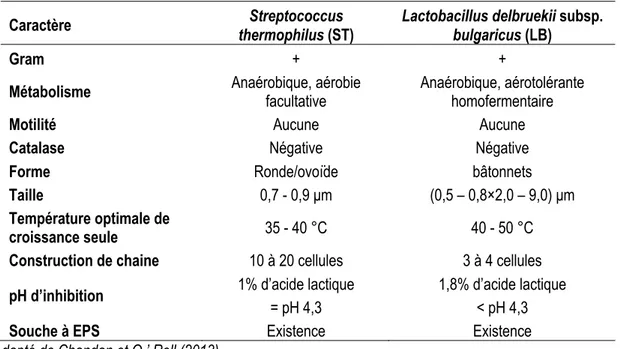
contrôler les cinétiques de diminution de pH et les ratios entre ces deux populations ; d’où l’intérêt de conserver un pouvoir tampon du lait relativement élevé. Ainsi, lorsqu’un ensemencement direct est utilisé, le fournisseur de ferment doit s’assurer du ratio optimal de départ. En revanche, dans le cas où une pré-fermentation commune des deux souches est effectuée, les températures de fermentation sont régulées pour favoriser la croissance des souches ST (température optimale autour de 35-40 °C) et ainsi réactiver les bactéries. Une fois le lait de production ensemencé, une température de 42-43 °C est appliquée. Cette température est un compromis entre les températures de croissance optimales des ST et des LB. Ce compromis de température permet de favoriser la symbiose des souches pour que les deux prolifèrent correctement. Les particularités du développement des LB et ST sont résumées dans le Tableau 1.1.
La température du milieu, le préchauffage du lait, la quantité de matière grasse (Shaker, Jumah et coll. 2000) et la concentration bactérienne de départ sont des facteurs influençant la croissance bactérienne et leurs proportions finales (De Brabandere et De Baerdemaeker 1999). Par conséquent, ces facteurs influencent également les cinétiques d’acidification du milieu. La stérilisation a pour effet de désoxygéner le lait et provoquer des conditions réductrices adéquates au développement bactérien.
Tableau 1.1: Caractéristiques des souches des yogourts.
Caractère thermophilus (ST) Streptococcus Lactobacillus delbruekii subsp. bulgaricus (LB)
Gram + +
Métabolisme Anaérobique, aérobie facultative Anaérobique, aérotolérante homofermentaire
Motilité Aucune Aucune
Catalase Négative Négative
Forme Ronde/ovoïde bâtonnets
Taille 0,7 - 0,9 µm (0,5 – 0,8×2,0 – 9,0) µm
Température optimale de
croissance seule 35 - 40 °C 40 - 50 °C Construction de chaine 10 à 20 cellules 3 à 4 cellules
pH d’inhibition 1% d’acide lactique
= pH 4,3
1,8% d’acide lactique < pH 4,3
Souche à EPS Existence Existence
Adapté de Chandan et O ’ Rell (2013)
1.3.2 Formation du gel de caséines
Pendant la fermentation du lait, le métabolisme des bactéries engendre une diminution du pH. Il en résulte un certain nombre de changements biochimiques aboutissant à la formation du gel lactique de yogourt. La formation du gel repose sur la coagulation des caséines. Cependant, la coagulation ne peut avoir lieu qu’à deux