Université de Poitiers
Faculté de Médecine et de Pharmacie
Ecole doctorale d’Ingénierie Chimique, Biologique et Géologique
Pour l’obtention du Grade de Docteur de l’Université de PoitiersEVALUATION DES SOLUTIONS DE CONSERVATION
CONTENANT DU POLYETHYLENE GLYCOL DANS
DES MODELES DE TRANSPLANTATION RENALE
CHEZ LE PORC LARGE WHITE
INFLUENCE DE LA CONCENTRATION ET DE LA TAILLE
DES POLYMERES DE POLYETHYLENE GLYCOL
Emilie MANGUY
Directeur de thèse : Pr Thierry HAUET
Soutenue le 2 juillet 2009
Membres du Jury:
Pr René FERRERA
Rapporteur
Pr Diethard MONBALIU
Rapporteur
Mme Isabelle RODDE-ASTIER
Examinateur
Pr Michel EUGENE
Examinateur
Malgré les progrès dans le domaine de la transplantation rénale, les lésions d’ischémie-reperfusion exposent les reins à de nombreuses complications à court et à long terme. Les connaissances actuelles mettent en avant l’intérêt de maîtriser cette période d’ischémie reperfusion de la manière la plus optimale possible.
C’est pourquoi, dans une première étude, trois solutions de conservation rénale ont été étudiées à partir d’un modèle d’allo-transplantation porcin. Nous avons comparé la solution de référence, UW, à deux autres solutions commerciales contenant un nouveau colloïde, le PolyEthylène Glycol (PEG) : SCOT30® et IGL-1®. Nous avons alors démontré un effet bénéfique de l’utilisation de PEG sur les lésions chroniques mais également un effet différent selon le type et la concentration de PEG contenu.
Nous avons ensuite comparé PEG 20kDa et 35kDa à différentes concentrations (de 5 à 30g/L) par rapport à UW. Nous avons utilisé un modèle d’auto-transplantation rénal porcin. Nous avons mis en évidence un effet protecteur selon le PEG utilisé, et ce, tout particulièrement pour l’une des solutions testées contenant 15g/L de PEG 20kDa.
Au cours d’une troisième étude, nous avons décidé d’évaluer cette solution en perfusion machine sur un modèle porcin mimant la situation des donneurs décédés après arrêt cardiaque. Nous n’avons pas retrouvé l’effet bénéfique observé en conservation statique dans ce modèle.
En parallèle, nous avons mis au point et validé les techniques de PCR quantitative pour étudier l’expression transcriptomique de différentes familles de gènes d’intérêt dans ces conditions expérimentales. Cette expertise obtenue sur tissu rénal de porcs est d’un grand intérêt pour la suite des travaux envisagés.
Mots clés : Lésions d’Ischémie-Reperfusion, Polyéthylène glycol, solutions de conservation, machine de perfusion, transplantation rénale, modèle porcin
Despite several advances in transplantation, ischemia-reperfusion (IR) of the kidney graft induces many short and long-term pathological pathways. Current knowledges highlight the need for a better understanding and limitation of this process.
Our first study examined three different kidney preservation solutions in a porcine allo-transplantation model. The UW, current gold standard solution, was compared to two other commercial solutions containing a new colloid named Poly
Ethylene Glycol (PEG): SCOT30® et IGL-1®. A beneficial effect of the PEG has been
shown, particularly in regards to chronic injury development. Specifically, this positive effect has also been demonstrated to be size and concentration dependant.
Thereafter, this work compared different solutions presenting two different PEG sizes (20 and 35kDa) at several concentrations (from 5 to 30 g/L), with UW solution as control. This time, a porcine kidney auto-transplantation model has been used. We observed a protective effect against IR injuries, which was strongly dependent the
molecular weight and concentration of PEG used, highlighting SCOT15® as a very
promising solution.
This solution was thus tested in the third project with a machine perfusion strategy in a porcine model reproducing deceased after cardiac arrest donor conditions. However, no benefits were shown.
Independently of these results, the validity of quantitative PCR method as a diagnostic tool was evaluated, and many interesting genes were described in the context of ischemia reperfusion injury. This knowledge is of great interest for the following studies to be conducted this model.
Key Words: Ischemia-Reperfusion injury, Polyethylene Glycol, preservation solution, machine perfusion, kidney transplantation, porcine model.
ABREVIATIONS
ADH : Hormone Antidiurétique
ADN: Acide DésoxyriboNucléique
ADP : Adénosine DiPhosphate
AMP : Adénosine MonoPhosphate
Apaf-1 : Apoptosis protein associated factor-1 ARNm : Acide RiboNucléique messager
ATP : Adénosine Triphosphate
BMP : Bone Morphogenic Protein
Ca2+ : Ion Calcium
CCL2 : Chemokine Ligand 2
CD : Cluster of Differentiation
Cl- : Ion Chlorure
CMH : Complexe Majeur d’Histocompatibilité
CO : Monoxyde de carbone
CPA : Cellules Présentatrices d’antigènes
DDAC : Donneur décédé après arrêt cardique
Dll1 : Delta-like1
DO : Densité Optique
EGF : Epidermal Growth Factor
EOR : Espèces Oxygénées Réactives
FADD : Factor associated death domain Fe2+ : Fer libre à l’état ferreux
FKBP12 : FK506-Binding Protein 12
Flt-1 : Fms like tyrosine kinase ou VEGFR-1
Glut-1 : Glucose transporter-1 H+ : Ion Hydrogène
H2O2 : Peroxyde d'hydrogène ou eau oxygénée
Hb : Hémoglobine
HCO3- : Ion Bicarbonate
HIF-1α : Hypoxia Inducible Factor-1 Alpha
HLA : Human Leukocyte Antigen
HO : Hème Oxygénase
HO-1: Hème oxygénase-1
HRE : Hypoxia Response Element
HSE : Heat Shock Element
HSF : Heat shock factor
HSP: Protéine de choc thermique
IgG : Immunoglobuline G
IGL-1: Institut Georges Lopez-1
IR : Ischémie Reperfusion
I-Smad : Inhibiteur-Smad K+ : Ion Potassium
KDR : Kinase Domain Region ou VEGFR-2 ou Flk-1
KO : Knock Out
LAP : Latency-Associated Peptide
LLC : Large Latent Complex
MEC : Matrice Extracellulaire
MnSOD : Manganèse Superoxyde Dismutase MyD88 : Myeloïd differentiation factor 88 Na+ : Ion Sodium
NH3 : Ammoniac
NICD : Notch Intracellular Domain
NK : Natural Killer
NO : Monoxyde d’azote
O2 : Oxygène
PAMP : Pathogen Associated Molecular Pattern PAS:
•PER : Period protein
•ARNT : Aryl hydrocarbon Receptor Nuclear Translocator
•SIM : Single Minded protein
PEG: Poly Ethylène Glycol
PlGF : Placental Growth Factor
PpO2 : Pression partielle en dioxygène
PRR : Pattern Recognition Receptor
PTPM : Pore de Transition de Perméabilité Mitochondriale
RBPJ : Recombinant Binding Protein J
RE : Réticulum Endoplasmique
RRF : Reprise Retardée de Fonction
R-Smad : Récepteur-Smad
SCOT: Solution de Conservation d’Organes et de Tissus
sHSP : small Heat Shock Protein
SLA : Swine Lymphocyte Alloantigen sytstem
SLC : Small Latent Complex
SOD : Superoxide Dismutase
TAP : Transport Antigen Processing
TGF-β : Transforming Growth Factor-β
TLR : Toll-Like Receptor
TNF : Tumor Necrosis Factor
TSP : Thrombospondine
TβRI : TGF-β Récepteur de type I
UW : University of Wisconsin
VEGF : Vascular Endothelial Growth Factor
VEGF: Facteur de croissance endothéliale vasculaire
VHL : Von Hippel-Lindau
INTRODUCTION
ASPECTS GENERAUX DE LA TRANSPLANTATION RENALE ET DE L’ISCHEMIE REPERFUSION
CHAPITRE 1 : LA TRANSPLANTATION RENALE ...14
I. EVOLUTION DE LA TRANSPLANTATION RENALE... 14
A. La suture vasculaire... 14
B. L'immunosuppression... 14
C. La mort cérébrale ... 15
D. La conservation des organes... 15
II. ACTIVITE ET EVOLUTION DE LA TRANSPLANTATION RENALE EN FRANCE... 16
III. ORIGINE DES GREFFONS... 18
A. A partir de donneurs vivants ... 18
B. A partir de donneurs décédés... 18
IV. DUREE DE VIE DES GREFFONS RENAUX... 20
CHAPITRE 2 : RAPPELS ANATOMIQUES ET PHYSIOLOGIQUES DE LA FONCTION RENALE ..23
I. GENERALITES... 23
II. STRUCTURES INTERNES... 23
III. CIRCULATION SANGUINE... 24
IV. L’UNITE FONCTIONNELLE... 24
V. ROLE DE CHAQUE STRUCTURE NEPHRONIQUE... 25
A. L’urine primitive ... 25
B. L’urine définitive... 26
CHAPITRE 3 : L’ISCHEMIE REPERFUSION ...29
I. LA PHASE D’ISCHEMIE : VOIE ANAEROBIE, PERTURBATIONS MITOCHONDRIALES ET NOUVEAUX ACTEURS.. ... 30
A. Déplétion énergétique et acidose intra cellulaire ... 30
B. Le stress oxydant... 31
C. Altération des transports membranaires et désorganisation cytosquelettique [50-53] ... 32
D. Désorganisation histologique générale ... 33
E. Œdème intracellulaire et interstitiel ... 34
F. La mort cellulaire ... 34
G. Adaptation au stress cellulaire : les protéines du choc thermique (HSP)... 36
II. LA PHASE DE REPERFUSION : ASPECTS PHYSIOPATHOLOGIQUES ET MECANISMES IMPLIQUES... 43
A. Le cytosquelette... 44
B. Stress oxydant ... 44
C. Limitation cellulaire du stress oxydant : l’Hème Oxygénase (HO)-1 et –2 [141, 142] ... 45
D. La mitochondrie et les voies de l’apoptose ... 48
E. Activation de la structure vasculaire ... 48
F. Inflammation ... 49
G. Fibrose ... 71
H. Adaptation des cellules à l’hypoxie... 72
III. LA REPRISE RETARDEE DE FONCTION (RRF)[44,187]... 79
CHAPITRE 4 : MOYENS ACTUELS POUR LIMITER LES LESIONS D’ISCHEMIE REPERFUSION AU COURS DE LA CONSERVATION ET REACTULISATION DES MACHINES DE PERFUSION ...81
I. LA CONSERVATION HYPOTHERMIQUE EN TRANSPLANTATION RENALE HUMAINE... 81
II. LES MOYENS DE PROTECTION TISSULAIRE... 83
A. Le principe des solutions de conservation ... 83
B. Solutions de composition de type intracellulaire ... 91
C. Solution de composition de type extracellulaire ... 92
III. LES MACHINE DE PERFUSION : RENOUVEAU ET PERSPECTIVES... 93
A. Nouveau type de donneurs ... 93
OBJECTIFS
MATERIELS ET METHODES
CHAPITRE 1 : PROTOCOLES EXPERIMENTAUX CHEZ LE PORC LARGE WHITE...100
I. MODELE ANIMAL UTILISE : LE REIN DE PORC (LARGE WHITE) ... 100
II. PROTOCOLE D'ANESTHESIE... 100
III. PROTOCOLE CHIRURGICAL: ... 102
A. Prélèvement du rein gauche: ... 102
B. Auto transplantation ... 103
C. Allo transplantation ... 104
D. Typage du SLA porcin... 104
E. Prélèvement du rein droit : modèle d’étude de la conservation... 106
F. Modèle de donneur décédé après arrêt cardiaque... 107
G. Les limites des modèles utilisés... 107
IV. SUIVI DE L’ANIMAL EN POST GREFFE... 107
V. EUTHANASIE AU SEIN DU PROTOCOLE ET ETHIQUE... 108
VI. PRELEVEMENT ET REALISATION DES BIOPSIES... 109
VII. LES EXPLORATIONS BIOCHIMIQUES ET HISTOLOGIQUES... 110
A. Paramètres fonctionnels : la fonction de filtration glomérulaire... 110
B. Paramètres Histologiques : description des techniques ... 110
C. Quantification de la fibrose interstitielle ... 112
VIII. ANALYSES STATISTIQUES... 113
CHAPITRE 2 : DESCRIPTION DES OUTILS UTILISES POUR L’EVALUATION TRANSCRIPTOMIQUE... 114
I. L’EXPRESSION TRANSCRIPTOMIQUE PAR ANALYSE DE LA REACTION PAR POLYMERASE EN CHAINE (PCR) ... 114
A. Evaluation qualitative et quantitative de l’ARN total extrait ... 114
B. Méthodes d’extraction d’ARN total à partir de biopsies tissulaires porcines : ... 118
C. Le principe de la « transcription inversée » (Reverse Transcription : RT) : de l’ARN à l’ADN complémentaire (ADNc) ... 121
D. Conception des amorces (primers) de PCR spécifique du génome porcin ... 122
E. La réaction par Polymérase en Chaine (PCR) ... 123
F. La PCR en temps réel... 125
G. Utilisation de ce nouvel outil dans les différentes études... 128
RESULTATS...130
ETUDE N°1 : COMPARAISON DES SOLUTIONS DE CONSERVATION COMMERCIALES DANS UN MODELE D’ALLOGREFFE ...131
I. OBJECTIFDUTRAVAIL ... 131
II. RESULTATS... 134
A. La survie des animaux... 134
B. La fonction rénale ... 135
C. La quantification de fibrose interstitielle ... 136
D. Expression transcriptomique de l’inflammation tissulaire et des marqueurs immunologiques... 138
E. Analyse par immunoblot de l’expression de TGF-β1 et Smad 7 ... 139
F. Expression transcriptomique des marqueurs de l’angiogénèse et des marqueurs de défenses cellulaires ... 141
III. DISCUSSION... 142
ETUDE N°2 : COMPARAISON DES EFFETS DE SOLUTIONS DE CONSERVATION CONTENANT
DIFFERENTES TAILLES ET CONCENTRATIONS DE PEG ...145
I. OBJECTIFDUTRAVAIL ... 145
II. RESULTATS... 147
A. Les premières données in vivo ... 147
B. Evaluation des tissus conservés pendant 48 heures en statique en hypothermie ... 151
C. Evaluation des effets de l’utilisation de différentes solutions de conservation contenant du PEG sur les tissus rénaux à long terme... 156
III. DISCUSSION... 166
A. Les effets précoces de l’utilisation du PEG dans les solutions de conservation ... 167
B. Les effets à long terme de l’utilisation du PEG dans les solutions de conservation ... 171
IV. CONCLUSIONSETPERSPECTIVES... 175
ETUDE N°3 : LE PEG DANS LA MACHINE DE PERFUSION ...176
I. OBJECTIFDUTRAVAIL ... 176
II. RESULTATS... 178
A. La survie des animaux... 178
B. La filtration glomérulaire ... 179
C. L’évaluation de la fibrose interstitielle ... 180
D. Expression transcriptomique ... 181
III. DISCUSSION... 184
IV. CONCLUSIONETPERSPECTIVES ... 186
DISCUSSION GENERALE ANNEXE TABLE DES FIGURES ...195
LISTE DES TABLEAUX ...197
BIBLIOGRAPHIE VALORISATION DU TRAVAIL I. COMMUNICATIONS ... 227 A. ORAUX ... 227 B. POSTERS ... 227 II. PUBLICATIONS ... 227
Actuellement le vieillissement de la population et l’augmentation du nombre de personnes diabétiques ou hypertendues ont une répercussion sur le nombre de patients arrivant au stade de l’insuffisance rénale terminale. La transplantation d’organes est un traitement de choix, unanimement reconnu pour le traitement de ces patients. Elle produit également une économie de santé appréciable, justifiant de promouvoir cette activité si l’on se base sur le coût annuel d’un patient sous dialyse (68000 euros) par comparaison au coût annuel engendré par la greffe (11400 euros/patient, prenant en compte le surcoût de la première année post-greffe). Malheureusement, il existe une pénurie d’organes ce qui permet de greffer environ un tiers des patients sur liste d’attente, chaque année rendant ainsi les greffons particulièrement précieux. Cette pénurie d’organe pousse les équipes impliquées à élargir les critères de sélection des donneurs et à s’intéresser à de nouvelles sources d’organes comme ceux provenant des donneurs décédés après arrêt cardiaque.
La transplantation rénale se compose d’étapes distinctes mais les effets délétères de chacune et les mécanismes lésionnels s’associent pour réaliser une continuité dans le développement des lésions. Ce processus plus ou moins réversibles débute lors de la phase de réanimation du donneur et se poursuit lors du passage en mort cérébrale. D’autres lésions peuvent être liées à des difficultés lors du prélèvement et à l’hypothermie et l’hypoxie incontournables durant la phase de conservation de l’organe. Lors de la reperfusion, la réoxygénation et le réchauffement de l’organe qui s’en suivent vont participer à l’aggravation des lésions précédentes. En parallèle, il faut également ajouter les facteurs de risque et de comorbidités du receveur qui peuvent contribuer au développement des lésions du greffon [1, 2]. L’ischémie-reperfusion (IR) est elle-même un facteur non immunologique influençant de façon précoce le devenir du greffon pour différents organes [3-7].
Il est établi aujourd’hui que ces lésions peuvent en partie intervenir dans la reprise de fonction retardée des greffons et jouer un rôle dans la survie globale du greffon à court terme (nécrose tubulaire aigu et facilitation des épisodes de rejet aigu) et à long terme (néphropathie chronique du greffon).
Afin d’élargir le panel de greffons potentiels, les équipes de transplantation se tournent donc vers des donneurs marginaux dont les organes doivent être prélevés et conservés de façon optimale. Compte tenu du fait que la conservation statique à 4°C constitue le moyen le plus répandu pour conserver les organes, nous pouvons nous interroger sur la pertinence de leur capacité à conserver de tels organes.
Un nombre croissant de solutions de conservation sont proposées avec une composition variable dont le but est d’assurer une conservation et une reprise de fonction du greffon optimale.
Mais peu d’études analysent clairement les effets de ces solutions sur les mécanismes lésionnels de l’IR.
Les composants essentiels d’une solution de conservation reposent sur l’utilisation de grosses molécules pour agir au niveau du secteur vasculaire et limiter l’œdème interstitiel [8]. Les imperméants agissent, pour leur part, au niveau membranaire en limitant l’œdème cellulaire via leur poids moléculaire et leur charge. La composition ionique est également un aspect important de ces solutions. Les solutions hyper potassiques, longtemps considérées comme la référence car réputées pour limiter l’entrée d’eau et de sodium (Na+) et de chlore (Cl-) dans la cellule, ont été remises en cause avec l’utilisation récente de solution de polarité extracellulaire. D’autres éléments sont également à considérer. Le rôle des antioxydants pour limiter l’effet des espèces oxygénées réactives (EOR) est plus discuté. De même, des métabolites comme l’adénosine comme précurseur pour la synthèse d’ATP n’ont pas démontré une efficacité prépondérante. D’autres colloïdes ont été évalués et les polymères de la famille des polyéthylène glycols (PEG) semblent avoir des propriétés intéressantes dans le cadre de la conservation [9]. Les travaux préliminaires issus de notre laboratoire ont évalué le PEG de poids moléculaire 20kDa et mis en évidence son rôle bénéfique durant la conservation, dans différents modèles d’organes isolés perfusés et d’auto transplantation rénale chez le porc ainsi que le poumon, pour le cœur et le foie chez le rat et les ilots pancréatiques pour la souris [9-13]. Dans un modèle de cellules tubulaire d’origine porcine, il a été suggéré que le PEG 35kDa était le polymère le mieux adapté à la conservation [14].
Le but de ce travail a été multiple. En utilisant un modèle d’allo transplantation rénal porcin mimant les greffes familiales, notre premier objectif a été de comparer les effets de solutions de conservation commerciales (SCOT30® et IGL-1®) contenant du PEG de 20kDa et 35kDa respectivement par rapport à la solution de référence University of Wisconsin (UW).
Les résultats contradictoires entre le PEG 20kDa et 35kDa, nous ont mené, dans un
deuxième objectif à faire varier les tailles et les concentrations du PEG dans une solution de
conservation, afin d’analyser plus finement le rôle respectif de chacun.
Enfin, notre troisième objectif a été d’évaluer la solution ayant l’efficacité la plus notable dans un modèle de donneur décédé après arrêt cardiaque, en utilisant la technique de conservation par machine de perfusion.
Dans chacune de ces études, nous avons analysé la survie des animaux, les lésions lors de la reprise de fonction du greffon et la fibrose interstitielle. Afin de comprendre ces mécanismes nous avons évalué l’expression transcriptomique tissulaire de marqueurs du
Ce mémoire aborde dans une première partie les aspects généraux de la transplantation rénale et de l’ischémie reperfusion. Les données générales sont présentées et nous nous sommes attachés à préciser autant que possible les points importants en transplantation et clarifier des points de sémantique qui ont leur importance également.
Le problème de l’IR est abordé et nous avons également mis l’accent sur les marqueurs de description plus récente faisant l’objet d’un intérêt évident. Cet aspect de la transplantation est un problème de premier plan et constitue une des voies de recherche prioritaire à part égale avec les aspects immunologiques et les aspects des traitements immunosuppresseurs. L’IR a été considérée comme une priorité pour la recherche en transplantation comme le confirme les conclusions de l’expertise Inserm présentées au grand public en mars 2009. Ces conclusions ont fait l’objet d’un ouvrage intitulé « Transplantation d’organes Quelles voies de recherche » (Expertise collective Inserm).
Nous avons également détaillé les techniques qui ont permis l’analyse transcriptomique des tissus, ce qui constitue un aspect important dans l’approche physiopathologique de l’IR. La mise au point a été délicate et nous a permis, une fois validées ces techniques, de pouvoir aborder l’analyse des échantillons de façon complète. Nous pensons que ces informations peuvent être utiles pour d’autres équipes. Notre souci a été de permettre au lecteur de pouvoir au travers de ce document avoir à sa disposition un outil informatif autant du point de vue des concepts scientifiques, de la sémantique et des aspects législatifs, des techniques employées et de l’état bibliographique.
ASPECTS GENERAUX DE LA
TRANSPLANTATION RENALE ET
CHAPITRE 1 : LA TRANSPLANTATION RENALE
I.
Evolution de la transplantation rénale
Si le XIXème Siècle est parsemé d'expériences de greffes tissulaires, peau, joues de lapin, queues de rat, ... l’essor de la greffe d'organes a lieu principalement durant le XXème siècle, marqué par plusieurs développement fondamentaux. Entrée dans l’histoire en 1952 en France avec la première transplantation rénale, elle permet aujourd’hui à certains patients de survivre grâce à une greffe de foie, de cœur ou de poumon et à d’autres d’améliorer leur survie et leur qualité de vie avec une greffe rénale ou pancréatique.
A.
La suture vasculaire
La première réussite de greffe rénale a été documentée en 1902 chez le chien par Ulmann où le greffon a été auto-transplanté dans le cou de l’animal. En 1906 le français Jaboulay greffe un rein de chèvre au pli du coude d'une femme urémique. La guerre 39-45 impose un long sommeil pour cette recherche. Les travaux reprennent et la transplantation rénale va bénéficier de la concentration des efforts de nombreuses équipes. Boston et Paris sont les villes phares de la greffe rénale chez les donneurs vivants. Ce seront les travaux du chirurgien français Carrel qui vont permettre d’établir les principes des sutures vasculaires incontournables en transplantation d’organes.
B.
L'immunosuppression
En parallèle à la parfaite maîtrise des sutures vasculaires, l’acquisition des premières notions sur le complexe majeur d’histocompatibilité (CMH) avec les travaux de l’immunologiste français Dausset en 1952 ont permis aux chirurgiens américains Murray et Merrill de réussir la première greffe rénale entre vrais jumeaux en 1954 à Boston [15]. En 1956 à Boston puis à Paris, sont effectuées des greffes entre faux jumeaux avec irradiation et corticoïdes. Nous percevons bien que nous ne pouvons en rester à la greffe entre jumeaux et que l'obstacle de l'incompatibilité biologique doit être franchi. L'immunosuppression apparaît alors, elle est induite par irradiation totale, 6-mercaptopurine, corticoïdes, azathioprine, méthotrexate,… et à Richmond, Hume réalise la première greffe avec immunosuppression à partir d'un rein de cadavre. Le début de la décennie 80 apportera la découverte de la cyclosporine. Ajouté à l'expérience accumulée, cet agent immunosuppresseur déclenchera un considérable développement de la transplantation.
C.
La mort cérébrale
En 1959, l'école neurologique parisienne et en particulier celle de Mollaret décrivent l'état de mort cérébrale ouvrant ainsi le champ du prélèvement à cœur battant. L'idée du don d'organes apparaît. Dans ce domaine, les outils modernes et la mise au point de modèles animaux ont permis de faire évoluer considérablement les connaissances et de mettre en évidence des mécanismes physiopathologiques de premier ordre (Figure 1) [2, 16]. Ces mécanismes seront abordés plus loin.
Figure 1 : Représentation de changements physiopathologiques associés à la mort cérébrale
[2]
D.
La conservation des organes
Outre le principe de l’hypothermie, les travaux de Collins puis de Belzer ont permis de développer des solutés de conservation des organes prélevés [17-19]. Les dogmes qui ont conduit à ces solutions reposaient sur l’hypothermie à 4°C afin de permettre la réduction de
Les solutions de type intracellulaire représentent un autre des principes dictant la composition des solutions de conservation. Ce concept reposait sur le principe que le lavage et la conservation avec un milieu intracellulaire permettaient de limiter les échanges au niveau de la membrane cellulaire. Depuis, ces concepts ont été remis en cause compte tenu des effets de ces solutions sur les cellules endothéliales et la microcirculation. De même, les effets de l’hypothermie per se ont été également décrits [21, 22].
Les aspects les plus contributifs dans la mise au point des solutions de conservation sont dus à Belzer et à Southard avec l’introduction des nouveaux composés comme les agents colloïdes et les imperméants [20].
Il faut également préciser que l’évaluation de ces solutions et de leurs composants a été réalisée avec des moyens qui peuvent être considérés comme anciens et pas vraiment adaptés à une évaluation rigoureuse. Il apparait à la lumière des nouvelles techniques utilisées et de l’avancée des connaissances sur la physiopathologie de l’IR que les solutions de conservation usuelles sont mal adaptées pour contrecarrer les processus lésionnels actuellement identifiés.
II.
Activité et évolution de la transplantation rénale en France
2911 greffes de reins ont été réalisées en France en 2007 dont 235 à partir de donneurs vivants (Figure 2). 3510 nouveaux malades ont été inscrits sur la liste nationale d’attente pour une greffe rénale, soit une progression des inscriptions de 6,5% par rapport à l’année 2006. La pénurie d’organes est la plus marquée pour la greffe rénale qui représente 64% de l’activité totale de greffe avec un indice de pénurie de 3,46 (indice de pénurie défini par le nombre total d’inscriptions sur la liste d’attente une année donnée, rapporté au nombre total de greffes réalisées pendant l’année donnée). La durée d’attente sur la liste est aussi la plus longue, soit 17,9 mois pouvant atteindre 33 mois en Ile-de-France.
Les débuts de la transplantation laissaient peu de place pour les patients âgés traités par hémodialyse qui n'avaient qu'un accès très limité à la transplantation rénale. Cela s'expliquait par les résultats médiocres des premières expériences caractérisées par une forte morbimortalité. Dans ce contexte, la priorité était donnée aux receveurs jeunes [23]. De la même manière, la sélection des donneurs était rigoureuse et reposait sur des critères stricts.
Compte tenu de la pénurie en donneurs et de la franche diminution de la mortalité chez les patients potentiellement donneurs de moins de 65 ans (par accident de la voie publique), le nombre de donneurs a été élargi en prélevant des organes chez des individus de plus en plus âgés présentant des facteurs de morbidité associés et dont les causes de décès sont liées à l’état vasculaire (mortalité par accident vasculaire cérébral). En France, en transplantation rénale, l'âge moyen des donneurs de reins est passé de 37,5 ans en 1996 à 46,3 ans en 2004 et les donneurs de plus de 65 ans représentent actuellement 11,8 % de l'ensemble des donneurs.
Face à ces observations, de nouvelles perspectives se dessinent pour pouvoir répondre à cette demande croissante : greffe à partir de donneurs âgés, bigreffe et greffe à partir de donneurs décédés après arrêt cardiaque depuis peu.
Le prélèvement sur donneur décédé après arrêt cardiaque a débuté fin 2006 avec le 1er donneur prélevé. En 2007, 27 donneurs décédés après arrêt cardiaque et prélevés, ont permis la greffe de 42 receveurs dont deux receveurs dans un contexte de bigreffe. Cela implique une conservation optimale des greffons afin d’assurer la meilleure reprise de fonction du greffon, et donc d’optimiser les solutés de conservation dans le but de limiter les dégâts occasionnés lors de la phase de transport et de conservation.
Un autre point marquant a été les résultats de l’étude conduite par EuroTransplant et qui a démontré l’intérêt des machines de perfusion et leur rôle dans la limitation des épisodes de reprise retardée de fonction (RRF) et une meilleure survie à un an du greffon [24].
Figure 2 : Histogramme représentant l’activité de la greffe rénale en France à partir de
III.
Origine des greffons
A.
A partir de donneurs vivants
Pour des raisons diverses, les transplantations à partir d'un donneur vivant ne représentent qu'une faible fraction du nombre total des transplantations rénales réalisées en France chaque année (5 %), contre 24 % en Grande-Bretagne, 38 % en Suisse, 40 % dans les pays scandinaves et 42 % aux Etats-Unis.
En France, le cadre juridique concernant la transplantation à partir d'un donneur vivant a été modifié dans la loi de Bioéthique d'août 2004. En mai 2005, un décret d'application de la loi d'août 2004 pour les donneurs vivants crée des comités d’experts comparables à ceux qui existaient déjà pour la greffe de moelle.
Le cercle des donneurs vivants est étendu : la règle est que le donneur peut être le père ou la mère et, par dérogation avec comité d’experts, le conjoint, les grands-parents, les frères ou sœur, fils ou fille, oncle et tante, cousins germains ou cousines germaines, le conjoint du père ou de la mère, et toute personne apportant la preuve d’une vie commune d’au moins deux ans avec le receveur.
B.
A partir de donneurs décédés
1.
A cœur battant
Le prélèvement est réalisé à partir de donneur en mort encéphalique. Cette forme de décès s'observe uniquement en milieu hospitalier dans les services de réanimation ou de soins intensifs et fait suite à des événements violents (traumatisme crânien grave) ou des pathologies lourdes (accident vasculaire cérébral, etc.). Ce décès correspond à l'arrêt irrémédiable de la perfusion sanguine du cerveau aboutissant à sa destruction alors que tous les autres tissus sont fonctionnels grâce essentiellement au maintien de la respiration artificielle et de l’activité hémodynamique. Cet état de mort encéphalique est mis en évidence par des examens cliniques répétés puis confirmés par un examen paraclinique (habituellement électroencéphalogramme) qui sera répété comme défini dans le décret du 2 décembre 1996.
L’équipe médicale consulte systématiquement le registre national des refus afin de s'assurer que la personne ne s'était pas inscrite comme opposante au prélèvement d'organes et de tissus. Ce registre informatisé et automatisé, géré par l'Agence de la Biomédecine, n'est qu'un des moyens prévus par la loi pour exprimer son opposition à partir de l'âge de 13 ans.
Dans le cas où la personne est inscrite sur le registre le projet de prélèvement est stoppé définitivement. Dans le cas contraire, l'équipe médicale rencontre ses proches afin de rechercher une éventuelle opposition au prélèvement exprimée par la personne de son vivant.
Le coordinateur hospitalier regroupe tous les résultats des examens biologiques complétés par les examens d'imageries concernant la qualité fonctionnelle des organes ainsi que les examens permettant de vérifier la qualité sanitaire des organes (sérologies). Il transmet tous les éléments du dossier du donneur au service de régulation et d'appui de l'Agence de la Biomédecine de sa région.
Le régulateur régional d'astreinte, en accord avec le réanimateur et le coordinateur hospitalier, décide des organes prélevables en fonction de l'estimation de leur qualité et en fonction du bilan organe par organe. Il recherche les receveurs compatibles en appliquant les règles de répartition des greffons.
La répartition des organes est du ressort exclusif de l'Agence de la Biomédecine. L'attribution définitive d'un organe est du ressort de l'équipe médicale de transplantation ayant en charge le receveur. Les règles de répartition sont publiées au Journal Officiel de la république française. Ces règles sont complexes et leur application nécessite un logiciel (CRISTAL) prenant en compte les caractéristiques de tous les sujets en attente et celles du donneur. Il existe tout d'abord des priorités nationales, sujets hyperimmunisés en attente d'un rein, enfants prioritaires pour les organes d'enfants ou de sujets jeunes. En dehors de ces priorités, les greffons sont répartis puis attribués localement s'il y a des receveurs compatibles localement, puis régionalement puis au niveau national en l'absence de receveur régional compatible. La proposition d'un organe peut sortir du cadre national (niveau européen).
La compatibilité correspond au groupe sanguin (nous transplantons toujours en isogroupe), au rapport de poids, de taille et d'âge entre donneur et receveurs, typage Human Leukocyte Antigen (HLA) et immunisation anti-HLA.
2.
Après arrêt cardiaque
Ces prélèvements sont pratiqués par quelques équipes avec des résultats de greffe satisfaisant, après une période où cette technique restait peu envisagée compte tenu des résultats. Depuis août 2005, le frein réglementaire est levé en France où il est maintenant
Après le constat de la mort, il est mis en place un système de perfusion in situ des organes. Le temps pendant lequel il est possible de prélever ces organes est très court. Pour prélever les organes une condition est indispensable : s'assurer de l'absence d'opposition du sujet décédé, par le registre national des refus et avoir un entretien avec les proches.
De plus un nouveau système (LifePort™ Kidney Transporter) constitue une alternative au traditionnel «bac à glace» (méthode statique de conservation d’organe) en améliorant nettement les conditions de transport et le soin des organes à transplanter. Le LifePort™ Transporter consiste en un système sophistiqué fournissant une température et une pression constantes et contrôlables combinées à une perfusion utilisant une solution de conservation appropriée.
Des études ont révélé que la machine à perfusion, comme l’offre ce système, augmente le nombre d’organes disponibles pour la transplantation, en particulier pour ces donneurs décédés après arrêt cardiaque ou à cœur non-battant, un type d’organe souvent rejeté en cas d’utilisation de la conservation statique traditionnelle.
De plus, ces études tendent à indiquer que la perfusion d’organes par une machine avant la transplantation améliore également le fonctionnement de la greffe, sa survie à un an de suivi [24, 26] et contribue ainsi à réduire les coûts généraux de traitement, avec à la clé un effet positif sur le budget de santé publique. Cependant l’utilisation des ces donneurs posent de nombreuses questions d’ordre éthique mais leur utilisation a incontestablement réduit le niveau de pénurie dans les pays qui ont élargi leur utilisation.
IV.
Durée de vie des greffons rénaux
Les taux de survie globaux du greffon rénal pour les 22 857 malades ayant bénéficiés d'une greffe rénale de 1993 à 2004 sont respectivement de 90,4% à un an, 78,8% à cinq ans et 64% à dix ans.
De plus, il est mis en évidence une survie de 90,1% à un an à partir de donneur décédé et de 96,4% à partir de donneur vivant, ainsi qu’une survie après dix ans de 63,4% de receveurs de greffons de donneurs décédés et 81,9% de receveurs de greffons de donneurs vivants (Figure 3).
Figure 3 : Taux de survie des greffons à partir de donneurs décédés et vivants sur 13 ans [25].
Ces résultats expliquent les modifications apportées à la loi bioéthique de 2004 qui facilite désormais les dons à partir de donneurs vivants.
L'âge du donneur et le taux d'anticorps anti-HLA influent significativement sur les taux de survie du greffon à long terme, ainsi que le rang de la greffe et l'âge du receveur. Les différences significatives de durée de vie de greffons peuvent être également expliquées par les deux principaux phénomènes suivants :
• Le temps de conservation du greffon [27] : *donneur vivant : quasi nul
*donneur décédé après arrêt cardiaque : 20,2 ± 7,5 heures
• L’impact de la mort cérébrale sur le système hémodynamique du donneur.
Regardons plus en détail l’impact que la mort a sur les organes internes d’un sujet et en particulier sur les reins. La cause de la mort encéphalique est l'abolition de toute perfusion encéphalique, qui entraîne l'arrêt du métabolisme cellulaire. La grande fragilité des neurones à l'anoxie aboutit à la nécrose ischémique. Deux processus peuvent entraîner l'arrêt de la circulation cérébrale :
• Le premier est l'œdème cérébral entraînant une augmentation massive de la pression intracrânienne. L'arrêt de la circulation encéphalique survient dès que la pression intracrânienne est supérieure à la pression artérielle moyenne dans les vaisseaux cérébraux.
Quand la pression intracrânienne augmente (phase d'agonie), le rythme cardiaque, la pression pulmonaire, la pression artérielle, les résistances vasculaires périphériques augmentent. Nous parlons couramment alors de « tempête du système autonome » [28]. Puis quand la mort est installée le rythme cardiaque diminue, les résistances artérielles pulmonaires diminuent. La régulation hormonale est perturbée par atteinte hypotalamo-hypophysaire, pouvant produire un diabète insipide. D'autres hormones comme la triiodothyronine, le cortisol, l'adrénaline diminuent aussi après la mort encéphalique.
Il y a donc deux phases. La phase du réflexe de Cushing marquée par une augmentation des catécholamines [29], entraînant une défaillance ventriculaire gauche. Il existe alors une hypoxie tissulaire avec une augmentation des lactates, témoins de l'ischémie des organes [30]. Ces anomalies s’associent à une instabilité hémodynamique, à une production de cytokines, à une réaction inflammatoire et à l’activation du complément [2]. Au cours d’une deuxième phase apparaît un diabète insipide, pouvant s’accompagner d’une hypo perfusion du rein. L’endothélium devient activé avec un afflux de cellules inflammatoires et une activation de la coagulation qui vont avoir des conséquences sur le devenir de l’organe.
Des moyens de protection vont se mettre en place dans ces conditions et concernent l’hème oxygénase-1 (HO-1), les heat shock proteins (HSP 70) et la manganèse superoxyde dismutase (MnSOD) [31-33].
La mort encéphalique retentit donc de manière considérable sur tous les organes et explique que les reins prélevés dans ces conditions soient de moins bonne qualité que ceux prélevés chez des vivants. La réanimation des organes d'un donneur décédé reste donc un temps complexe et fondamental avant le prélèvement.
CHAPITRE 2 : RAPPELS ANATOMIQUES ET
PHYSIOLOGIQUES DE LA FONCTION RENALE
I.
Généralités
De morphologie réniforme, le rein a une situation rétro péritonéale, entre la paroi dorsale et le péritoine pariétal, et s'étend de la 12ème vertèbre thoracique à la 3ème vertèbre lombaire. Il pèse environ 150g, pour 12cm de long, 6 de large et 3 d'épaisseur.
Sa face interne, concave, comporte une fente appelée "hile", conduisant à une cavité appelée "sinus rénal", et d'où diverses structures entrent et sortent du rein.
Chaque rein est surmonté d'une glande surrénale, appartenant au système endocrinien.
Il est soutenu par trois couches de tissus :
• La capsule fibreuse, couche interne transparente et brillante, constituant une barrière étanche aux infections des régions voisines.
• La capsule adipeuse couche intermédiaire, soutenant le rein et le protégeant des coups.
• La couche extérieure, le fascia rénal, constituée de tissu conjonctif dense qui ancre l'organe aux structures voisines.
II.
Structures internes
L’anatomie interne du rein révèle trois parties (Figure 4) :
• Le cortex rénal : partie externe
• La médulla rénale présentant des structures pyramidales appelées pyramides rénales
ou de Malpighi, dont les prolongements se projettent dans la cavité excrétrice.
• Le bassinet : tube en forme d'entonnoir, qui se divise en calices mineurs, cavités où
débouchent les papilles des pyramides. Le bassinet sert de collecteur d'urines, d'où l'uretère rejoint la vessie.
Figure 4 : Anatomie du rein. Schémas représentants une coupe sagittale de rein [34].
L’organisation générale du rein humain est multi papillaire et multi lobulaire, caractéristique qu’il partage avec certains primates et le porc à la différence de l’organisation de celui du chien ou des rongeurs [35].
III.
Circulation sanguine
Le rein est un organe richement vascularisé qui est perfusé par environ le quart du volume sanguin total de l’organisme par minute. L’artère rénale qui dirige le sang vers le rein, donne naissance à de nombreuses artérioles afférentes se terminant par un fin réseau de capillaires péri tubulaires qui entourent les différents segments du tubule rénal et viennent ensuite alimenter la veine rénale. Cette circulation est de type terminal et par conséquent toute perturbation des apports aura un retentissement sur le parenchyme fonctionnel.
IV.
L’unité fonctionnelle
Chaque rein comporte environ un million de néphron, unité de filtration où se déroulent les processus formant l'urine. Le néphron (Figure 5A) est composé de structures principales telles que :
• Le glomérule (Figure 5 B et C) : situé dans la partie corticale, composé d'un bouquet
de capillaires artériels entourés d’une capsule fibreuse à paroi très mince, nommée la capsule de Bowman, où est formé le filtrat glomérulaire (urine primitive).
• Le tubule rénal, composé d'un tubule contourné proximal, d'une anse du néphron
Figure 5 : Anatomie du rein. Schémas représentants (A) le détail d’un néphron. (B et C) le
glomérule [36].
V.
Rôle de chaque structure néphronique
Le néphron remplit deux fonctions essentielles : la filtration glomérulaire et les mécanismes de réabsorption et de sécrétion tubulaires.
A.
L’urine primitive
Environ 20% du plasma parvenant aux glomérules est ultrafiltré à travers la paroi des capillaires glomérulaires et forment l’urine primitive qui s’écoule par l’espace de la capsule de Bowman dans le tubule. Ce phénomène d’ultrafiltration est un phénomène passif qui dépend de la pression sanguine rénale, maintenue relativement stable dans les conditions physiologiques grâce à un système d’autorégulation rénal généré par la vasoconstriction ou vasodilatation des artérioles afférentes et efférentes en réponse à leur distension.
B
C A
La pression de filtration glomérulaire, qui correspond à la pression hydrostatique régnant dans les capillaires glomérulaires, diminuée de la pression colloïde osmotique des molécules protéiques et de la pression hydrostatique régnant dans l’espace de Bowman, permet le processus d’ultrafiltration.
Cependant la membrane basale glomérulaire, élaborée par les cellules endothéliales et les podocytes du glomérule, constitue une barrière sélective en fonction de la taille et de la charge au passage des macromolécules et représente, avec l’endothélium des capillaires glomérulaires, le principal obstacle à la filtration des composés plasmatiques. Ainsi, les érythrocytes et les protéines de poids moléculaire supérieur à 68 000 Da sont retenus dans le sang tandis que les substances diffusibles se retrouvent dans l’ultra filtrat à la même concentration que dans le plasma.
Sur chaque néphron se trouve une partie appelée "appareil juxta-glomérulaire", qui se trouve être l'appui d'une artériole afférente sur le tubule contourné distal. La paroi artérielle contient, à cet endroit, des cellules musculaires lisses contenant de la rénine, semblant répondre à des stimuli mécaniques. Associés à un amas de cellules chimio-osmoréceptrices du tubule contourné distal (la macula densa), celles-ci réagissent aux variations de concentration de l'urine dans le filtrat, et joue un rôle important dans la régulation du volume du filtrat et de la pression artérielle.
B.
L’urine définitive
Le débit de filtration glomérulaire est de l’ordre de 120mL/min soit 180L/jour alors que l’élimination urinaire est d’environ 1 à 2L/jour ce qui implique que la composition du filtrat glomérulaire ou urine primitive, isotonique au plasma, soit profondément modifiée dans le tube rénal. L’urine primitive subit trois modifications essentielles au cours de sa traversée tubulaire : la réabsorption de l’eau, la réabsorption du sodium et l’excrétion des ions H3O-.
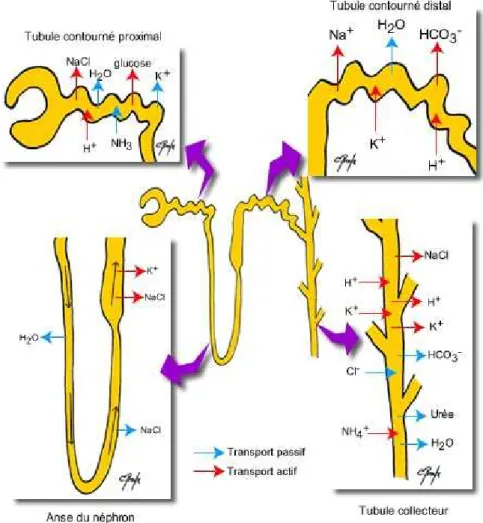
Les mouvements ioniques de sécrétion et de réabsorption des substances contenues dans l’urine sont détaillés à la figure 6. Elles comprennent :
• Des mouvements passifs (flèches bleues) qui se font par diffusion simple ;
• Des mouvements actifs (flèches rouges) qui font intervenir des échangeurs Na+/H+, Na+/HCO3-, Cl-/HCO3-, des co-transporteurs Na+/HCO3-, Na+/substrat,
Figure 6 : Schémas des mouvements de sécrétion et de réabsorption de substances urinaires à
partir d’un néphron chez les vertébrés.
Dans la première partie du tube (tubule contourné proximal) plus de 60% du sodium présent dans l’urine primitive est réabsorbé ce qui créé un gradient électrochimique responsable de la réabsorption des ions chlores et un gradient osmotique responsable de la réabsorption d’eau. D’autres substances telles que le bicarbonate, le sulfate le glucose le potassium (K+) phosphate et acides aminés sont aussi réabsorbés à ce niveau.
La réabsorption de sodium est accompagnée d’une réabsorption d’eau continue au niveau de la branche descendante de l’anse de Henlé alors que la branche ascendante de l’anse, imperméable à l’eau, ne réabsorbe que les ions sodium et chlore.
Au niveau du tubule distal, la réabsorption du sodium est favorisée par la présence d’aldostérone, hormone sécrétée par les glandes surrénales, tandis que le pouvoir de concentration ou de dilution de l’urine est sous la dépendance d’une autre hormone,
Cette réabsorption d’eau et de sodium sous contrôle hormonal se poursuit également au niveau du tube collecteur.
La sécrétion tubulaire se produit uniquement au niveau du tubule proximal et du tubule distal. Ainsi l’excrétion des ions HCO3- participe à la régulation de l’équilibre acido-basique
permettant de protéger l’organisme contre l’acidose. De plus, l’élimination de la fraction excédentaire de bicarbonate de l’organisme, ainsi que l’élimination des ions ammonium NH4+
formés par la combinaison d’ammoniac (NH3), produit et excrété par les cellules tubulaires,
avec les ions HCO3- présents dans la lumière du tubule, contribuent également au maintien de
l’équilibre acido-basique de l’organisme.
La créatinine est un produit de dégradation de la phosphocréatine dans le muscle Celle-ci est utilisée dans les muscles pour régénérer l’ATP lors d’un effort intense. La créatinine est un marqueur utilisé pour évaluer la clairance qui reflète le débit de la filtration glomérulaire contrairement à l’urée ou l’acide urique qui sont eux partiellement réabsorbés au niveau du tubule proximal et extrêmement diffusible.
Ces propriétés fonctionnelles particulières des différentes régions histologiques du rein impliquent que des lésions glomérulaires entraînent une protéinurie, alors que des lésions tubulaires seront responsables de modifications de la composition électrolytique de l’urine.
Un autre aspect remarquable lié à ces considérations anatomiques et physiologiques est celui des spécificités métaboliques des différentes régions du rein. La partie corticale, très vascularisée, a la capacité d’utiliser différentes sources de substrats pour son métabolisme comme les acides gras, le lactate, les corps cétoniques et les acides aminés [35]. La région corticale externe fonctionne en utilisant le succinate et enfin, la région médullaire profonde compte tenu de son environnement hypoxique utilise la glycolyse anaérobie pour fabriquer l’ATP. Ceci implique une résistance différente face aux situations de diminution de l’oxygène, corollaire de l’ischémie/hypoxie [35]. Ces remarques sont vraies pour des durées d’ischémie relativement courtes. Par contre, lorsque la durée d’ischémie s’allonge, l’ensemble de ces structures sera exposé à des lésions de nécrose.
CHAPITRE 3 : L’ISCHEMIE REPERFUSION
Les avancées récentes sur les mécanismes physiopathologiques impliqués dans l’IR ont permis de mettre en évidence les composantes importantes de ce processus [37].
Le syndrome d’IR comprend deux phases distinctes :
• La phase d’ischémie est définie par la réduction ou l’arrêt complet de flux sanguin artériel dans un tissu ou un organe.
Il existe deux principaux types d’ischémie :
* L’ischémie chaude est représentée par une obstruction du flux sanguin à température corporelle ;
* L’ischémie froide débute au moment du prélèvement du greffon jusqu’à sa réimplantation après une période de conservation ex vivo à 4°C de durée variable (la limite pour le rein se situe aux environs de 18 heures [27]).
L’ischémie chaude relative ou tiède, qui correspond aux périodes de réchauffement dans l’abdomen alors que l’organe n’est pas revascularisé, est assimilée à l’ischémie chaude et est globalement à l’origine de lésions proche de celles de l’ischémie chaude. Cependant les mécanismes lésionnels impliqués sont mal décrits.
• La phase de reperfusion est définie par la restauration du flux sanguin artériel dans les tissus ou organes ayant subit une ischémie. Elle commence après la réalisation des anastomoses vasculaires chez le receveur.
Les lésions d’IR augmentent le risque de RRF qui peut conduire à des épisodes de rejet aigu ou chronique à long terme et ainsi diminuer la survie de l’allogreffe. La définition de la RRF est une définition hétérogène et le critère le plus utilisé reste pragmatique et rétrospectif : c’est le fait d’avoir recours à une séance de dialyse dans la semaine qui suit la transplantation [38].
Outre les modifications biochimiques contemporaines de l’IR, les phénomènes inflammatoires et immunologiques associés sont considérés comme étant de plus en plus importants et participent non seulement au développement du rejet aigu mais également au développement des lésions chroniques [39]. De plus dès la mort cérébrale, les organes sont soumis à une série d’événements inflammatoires non spécifiques. Dans un modèle in vivo de rat, il a été démontré que les reins issus de donneurs en mort cérébrale entraînent une moins
Ils ont constatés également une protéinurie plus élevée, une morphologie rénale plus intensément détériorée de manière progressive, une augmentation de transcription de cytokines, et une accélération de la progression des changements à long terme ainsi qu’une augmentation du risque de rejet chronique [28].
I.
La phase d’ischémie : voie anaérobie, perturbations
mitochondriales et nouveaux acteurs
Au niveau cellulaire, la diminution de la pression partielle en oxygène (PpO2) est
responsable d’un dysfonctionnement de la chaîne respiratoire mitochondriale, soulignant le rôle de cet organite. Les conséquences au niveau cellulaire seront décrites. De plus, l’implication et le rôle de protéines mis en évidence de manière récente et faisant l’objet de publication récentes seront abordés décrivant ainsi des mécanismes récents d’adaptation au stress.
A.
Déplétion énergétique et acidose intra cellulaire
L’adénosine triphosphate (ATP), est nécessaire à tous les processus biologiques. Continuellement produite et consommée, elle représente la forme la plus importante d’énergie chimique en alimentant les réactions enzymatiques en énergie catalytique libérée par l’hydrolyse de l’ATP en adénosine diphosphate (ADP), dans les cellules vivantes. La phosphorylation oxydative, due à la chaîne respiratoire mitochondriale, est indispensable à la formation d’ATP. Toutefois, d’autres voies de production d’énergie existent telles que la glycolyse anaérobie, mais elles restent minoritaires lorsque la cellule fonctionne normalement.
Lors de l’hypoxie, des lésions mitochondriales associées à la conservation ont été décrites [40, 41]. En l’absence de d’oxygène (O2), accepteur final d’électrons, la chaîne
respiratoire se découple, interrompant la phosphorylation oxydative La cellule utilise la voie de la glycolyse anaérobie pour produire l’ATP, nécessaire aux besoins énergétiques de la cellule, mais avec un rendement très faible. Cette voie conduit à la formation de lactate et à l’accumulation de protons, responsables avec l’hydrolyse de l’ATP, de l’acidification du cytosol [42]. Il se développe donc une acidose intracellulaire dont l’importance est liée à la durée de l’ischémie et au type cellulaire.
De plus, l’ATP hydrolysée en ADP puis en adénosine monophosphate (AMP) est convertie en hypoxanthine (Figure 7) par la voie de dégradation des purines.
L’hypoxanthine diffuse ensuite à travers la membrane plasmique réduisant le contenu cellulaire en adénine disponible à la reperfusion pour la régénération d’ATP [43].
Lors de l’ischémie, l’hypoxie oriente le métabolisme cellulaire vers les voies anaérobies, seules possibilités de production d’ATP (Figure 7). Cependant, cette voie de production reste transitoire et peu efficace. La déplétion énergétique et le rôle de l’acidose reste un point majeur des lésions ischémiques [20].
Figure 7 : Effets cellulaires de l’hypoxie lors de l’ischémie rénale [44].
B.
Le stress oxydant
L’une des conséquences biologiques majeures de la variation des apports en oxygène est la production d’Espèces Oxygénées Réactives (EOR). Une production excessive d’EOR conduit à un déséquilibre de l’homéostasie oxydo-réductrice de la cellule encore appelé « stress oxydant ». Les EOR, espèces partiellement réduites de l’oxygène, sont des radicaux libres ou des molécules produites par un certain nombre de réactions biologiques dans l’organisme. Leur rôle au cours de la conservation est moins évident car l’hypothermie semble plutôt limiter le métabolisme de la cellule et ralentir ainsi tout processus de synthèse
Des travaux récents ont permis de mettre en évidence le rôle des EOR durant cette phase [45-47]. Le découplage mitochondrial et la perturbation de la tétraréduction de l’oxygène au cours de la conservation est à l’origine d’une petite quantité d’EOR. En effet, il a été démontré que l’oxygène résiduel présent dans les territoires ischémiés pouvait être à l’origine d’un stress oxydant [48, 49].
Les facteurs pouvant initier la production d’EOR sont mis en place lors de la phase d’ischémie et, lors de la réintroduction de l’oxygène, les systèmes antioxydants sont rapidement utilisés ou saturés et ne permettent pas d’éliminer une production radicalaire massive. La production sera ensuite majorée au cours de la reperfusion.
C.
Altération des transports membranaires et désorganisation
cytosquelettique [50-53]
La baisse de la quantité d'ATP contenue par la cellule, lors d’une ischémie entraîne une perturbation des fonctions des transporteurs membranaires assurant le maintien de la différence de potentiel de la cellule, et le gradient entre le milieu intra et extracellulaire en particulier au niveau endothélial et d'une production d'acide lactique.
Ces dérèglements entraînent un afflux cytoplasmique de Ca2+ et de Na+ et une fuite de K+ associés à une perturbation du métabolisme du glucose aux dépends de la glycolyse en condition anaérobie. Il en résulte notamment une activation de phospholipases et de protéases calcium-dépendantes telles que les calpaïnes qui participent à la désorganisation du cytosquelette en clivant la spectrine, molécule participant à la fixation du cytosquelette au pôle basolatéral de la cellule [54, 55].
Ce remaniement du cytosquelette aboutit à une modification structurale et à une perturbation de la polarité de la cellule, indispensable aux mouvements ioniques transcellulaires. Ainsi, la déplétion d’ATP dans une lignée cellulaire issue de tubules rénaux de rein de chien favorise la désorganisation des filaments d’actine [56, 57]. Cette désorganisation entraîne alors une redistribution apicale de la pompe Na+/K+-ATPase, enzyme normalement située au niveau du pôle basolatéral de la cellule, ce qui perturbe le transport de sodium [50, 58].
Une redistribution cytoplasmique de la pompe Na+/K+-ATPase a également été mise en évidence dans les cellules des tubules proximaux humains et intervient entre 10 heures et 20 heures de conservation à 4°C [59].
D.
Désorganisation histologique générale
Au niveau du rein, la zone la plus sensible à l’hypoxie se trouve être la médullaire externe. C’est donc à ce niveau que les lésions tubulaires prédominent [60]. La désorganisation du cytosquelette actinique par une polymérisation anormale est responsable de défauts structuraux et fonctionnels touchant l'endothélium vasculaire et l'épithélium tubulaire [61]. Pour le rein, les études se sont focalisées sur la sensibilité du tubule proximal au cours de l’IR.
Cependant, il est maintenant parfaitement admis que la cellule endothéliale reste une des premières cibles compte tenu des mécanismes mis en jeu comme la production de monoxyde d’azote (NO), la présence de cellules inflammatoires participant au phénomène de « no reflow », la production des médiateurs venant du métabolisme des prostaglandines et ayant un effet vasoconstricteur [62]. L’ischémie froide prolongée et l’augmentation de l’âge du donneur augmentent les dommages vasculaires sévères et un fort taux de nécrose tubulaire (détérioration fonctionnelles et changement structurel) [63, 64].
• Les jonctions adhérentes associées au cytosquelette actinique via les cadhérines assurent l’intégralité de l’endothelium, le contrôle des transports paracellulaires et assurent la polarisation cellulaire [65]. Elles sont particulièrement lésées lors de l'ischémie. Leur dissociation est responsable d'une dépolarisation et d'une augmentation de la perméabilité intercellulaire.
• Les modifications structurelles observées au sein de l'endothélium comprennent un gonflement cellulaire, un défaut d'attachement des cellules entre elles et à la membrane basale vasculaire [66].
• De même, les hémidesmosomes, points d'encrage des cellules épithéliales à la matrice extracellulaire, perdent leur fonctionnalité et la cellule se détache.
Ces évènements sont responsables d'une obstruction tubulaire, d'une rétrofiltration et d'une diminution du débit de filtration glomérulaire. Les modifications cytosquelettiques sont à l'origine d'une disparition des bordures en brosse [67]. Il en résulte une dysfonction de la filtration glomérulaire et des mécanismes de sécrétion et d’excrétion tubulaires [68].
E.
Œdème intracellulaire et interstitiel
Durant la phase de conservation hypothermique, l’accumulation intracellulaire de sodium entraîne une entrée d’eau dans la cellule ce qui est responsable d’un œdème cellulaire. Il entraîne un gonflement mitochondrial qui s’accompagne d’un dysfonctionnement du métabolisme aérobie, d’une augmentation de la production de radicaux libres oxygénés et de la destruction des membranes cellulaires [41]. La perméabilité endothéliale augmentée peut entraîner un œdème interstitiel et une congestion vasculaire [69], qui diminue le débit de perfusion de l’organe au moment de la reperfusion, aggravant l'hypoxie. L’œdème, intracellulaire et interstitiel, est particulièrement délétère sur la viabilité cellulaire et l’intégrité de la matrice extracellulaire.
F.
La mort cellulaire
Il y a depuis longtemps, un débat sur le type de mort cellulaire causée par l’ischémie. Les travaux de Salahudeen et coll. ont montré que la conservation hypothermique d’une lignée de cellules rénales humaines induit une mort cellulaire par nécrose alors que l’intensité de la mort cellulaire par apoptose dépend surtout de la durée de conservation à 4°C [70]. Des études réalisées in vivo ont montré que apoptose et nécrose coexistent dans des greffons rénaux humains à la fin de la période de conservation hypothermique [71, 72]. Ces dernières années, des études de plus en plus nombreuses apportent des arguments en faveur de l’apoptose dans les lésions rénales de l’allogreffe chez l’homme [73-76].
1.
Apoptose [77]
L’apoptose ou mort programmée de la cellule est un processus intracellulaire organisé, déclenché par la libération de protéines mitochondriales soit par activation de la voie intracellulaire, soit par activation de signaux provenant de l’extérieur de la cellule via des récepteurs membranaires. L’apoptose est responsable de modifications morphologiques caractéristiques de la cellule : une cascade d’activation protéique menant à une condensation nucléaire, suivie d’une fragmentation de la chromatine de l’acide désoxyribonucléique (ADN) chromosomique en fragments réguliers de taille proportionnelle approximativement à 180 paires de bases. Cette fragmentation de l’ADN est un point de non-retour et aboutit à la destruction irréversible de la cellule. La cellule se condense et forme alors des corps sphériques appelés corps apoptotiques qui maintiennent une intégrité membranaire permettant d’isoler le contenu cytoplasmique [78].
Les perturbations mitochondriales des cellules entraînent, durant la conservation, un état pro-apoptotique [41]. Le stress oxydant établi par la génération importante d’EOR sur la chaine respiratoire, contribuerait à la dégradation et à la fragmentation des membranes internes de la mitochondrie conduisant à un effondrement du potentiel de membrane. Ainsi la présence d’EOR est corrélée à l’ouverture du pore de transition de perméabilité mitochondriale (PTPM) et à la libération du cytochrome c entraînant la formation du complexe apoptosome constitué par la protéine Apoptosis protein associated factor-1 (Apaf-1), la procaspase 9 et le cytochrome c.
Indépendamment de la voie mitochondriale, l’activation de la caspase 3 par une caspase 8 peut également être induite par un signal extracellulaire (signal de mort) activant la dimérisation des récepteurs Fas de la famille des Tumor Necrosis Factor (TNF)-récepteurs.
Ces 2 voies d’induction de l’apoptose semblent cependant être reliées entre elles par une protéine de la famille Bcl-2. Comme elle est reliée à la 2ème voie, cette protéine favoriserait l’ouverture des PTPM et la libération du cytochrome c intra-mitochondrial.
Au cours de l’ischémie, le nombre de cellules apoptotiques semble limité [72]. Ces lésions sont spécifiques du segment distal du néphron.
2.
Nécrose
La nécrose se définit par des évènements anarchiques, destructeurs et irréversibles du cytoplasme et du noyau des cellules. Elle est caractérisée par une perte progressive de l’intégrité membranaire, suivie d’une entrée massive d’eau, de sodium et de calcium dans la cellule entraînant un gonflement du cytoplasme, une destruction des organites subcellulaires et notamment des mitochondries, libérant de nombreuses enzymes protéolytiques digérant les protéines et conduisant à la dégradation de l’ADN de manière aléatoire.
La nécrose conduit à la fragmentation cellulaire et à la libération du contenu cellulaire dans l’espace extracellulaire [78]. Ainsi elle serait associée à une importante réaction inflammatoire. La nécrose constitue les lésions de nécrose tubulaire aigue particulièrement marquée au niveau du segment proximal du néphron.
![Figure 2 : Histogramme représentant l’activité de la greffe rénale en France à partir de cadavres et de donneurs vivants de 1987 à 2007 [25].](https://thumb-eu.123doks.com/thumbv2/123doknet/7972918.267149/17.892.128.805.744.1039/figure-histogramme-représentant-activité-rénale-france-cadavres-donneurs.webp)
![Figure 3 : Taux de survie des greffons à partir de donneurs décédés et vivants sur 13 ans [25]](https://thumb-eu.123doks.com/thumbv2/123doknet/7972918.267149/21.892.150.828.66.359/figure-taux-survie-greffons-partir-donneurs-décédés-vivants.webp)
![Figure 10 : Représentation des interactions de HSP90 dans son rôle de chaperonne [103]](https://thumb-eu.123doks.com/thumbv2/123doknet/7972918.267149/39.892.188.723.75.367/figure-représentation-interactions-hsp-rôle-chaperonne.webp)
![Figure 12 :Représentation schématique des actions éventuelles des produits de dégradation de l’hème au cours de l’IR en transplantation [141]](https://thumb-eu.123doks.com/thumbv2/123doknet/7972918.267149/46.892.232.659.275.731/figure-représentation-schématique-actions-éventuelles-produits-dégradation-transplantation.webp)
![Figure 14 : Schéma représentant les mécanismes moléculaires déclenchés au moment de la reperfusion [187]](https://thumb-eu.123doks.com/thumbv2/123doknet/7972918.267149/51.892.162.775.344.812/figure-schéma-représentant-mécanismes-moléculaires-déclenchés-moment-reperfusion.webp)
![Figure 16 : Voies de signalisation TLR dépendantes et indépendantes de MyD88 intervenant dans la reconnaissance de bactéries [243]](https://thumb-eu.123doks.com/thumbv2/123doknet/7972918.267149/61.892.115.817.65.590/figure-voies-signalisation-dépendantes-indépendantes-intervenant-reconnaissance-bactéries.webp)
![Figure 17 : Représentation schématique de la structure de TSP-1 et de ses fonctions associées [257]](https://thumb-eu.123doks.com/thumbv2/123doknet/7972918.267149/64.892.142.755.531.929/figure-représentation-schématique-structure-tsp-fonctions-associées.webp)
![Figure 20 : Différentes isoformes du VEGF et leurs interactions avec leurs récepteurs [326]](https://thumb-eu.123doks.com/thumbv2/123doknet/7972918.267149/75.892.294.610.562.888/figure-isoformes-vegf-interactions-récepteurs.webp)