Vaisseau sanguin reconstruit par génie tissulaire :
Développement d'une nouvelle approche pour la
reconstruction de la media
et interaction avec les microparticules
Thèse
Jean-Michel Bourget
Doctorat en biologie cellulaire et moléculaire
Philosophiæ doctor (Ph.D.)
Québec, Canada
© Jean-Michel Bourget, 2014
RÉSUMÉ
La media vasculaire est au cœur des processus physiopathologiques qui entraînent le développement de l’athérosclérose. L’utilisation d’une media reconstruite par génie tissulaire permet d’étudier les cellules musculaires lisses (CML) humaines dans un environnement plus physiologique que les cellules en culture monocouche. Les travaux présentés dans cette thèse sont orientés autour de la media vasculaire reconstruite par génie tissulaire comme modèle d’étude pharmacologique et prothèse vasculaire autologue.
La première partie des travaux porte sur l’étude des interactions de cette tunique avec les microparticules (MP) circulantes. D’abord, nous avons montré que la présence de l’adventice modifie la réponse de la media aux MP produites in vitro à partir des lymphocytes T. Ensuite, l’étude de l’effet des MP isolées du sérum de patients en choc septique sur la media humaine a démontré que ces MP sont en mesure d’augmenter la contraction de la media par un mécanisme impliquant une diminution du NO et une augmentation de l’expression de l’ARN messager de l’interleukine-10. L’incubation de la media reconstruite avec cette cytokine anti-inflammatoire bloque l’hyporéactivité induite par les lipopolysaccharides. Le même phénomène a été reproduit in vivo, chez le rongeur. Ces résultats suggèrent que les SMP auraient un effet protecteur sur la fonction vasculaire, en potentialisant la contraction de la media.
Ensuite, nous avons optimisé l’approche de reconstruction de prothèses vasculaires par auto-assemblage proposée initialement pour l’adapter au contexte particulier des CML. L’objectif principal était de permettre l’étude physiopathologique de la media à partir de toutes les lignées de CML; indépendamment de leur capacité de synthèse de matrice extracellulaire. Pour ce faire, nous avons développé un échafaudage de matrice extracellulaire produit par auto-assemblage à partir de fibroblastes humains. L’utilisation de cet échafaudage génère une media plus résistante et plus contractile que la technique initiale.
Enfin, une anisotropie a été créée dans cet échafaudage pour permettre une orientation physiologique des CML. La media reconstruite devient ainsi plus résistante et plus contractile. Ces améliorations permettent de reconstruire des media à partir des cellules de plus de patients et mèneront à des études pharmacologiques plus représentatives de la population. Cet échafaudage facilitera la translation clinique de ce modèle de media reconstruite par génie tissulaire.
ABSTRACT
The pathological processes that result in the development of atherosclerostic lesions take place in the vascular media layer. This condition is responsible for half of cardiovascular associated fatalities. The development of a tissue-engineered blood vessel can contribute to the in vitro study of the human media in a 3-dimensional environment. This blood vessel can also be used as a prosthesis for arterial bypasses. The work presented here focus on the reconstructed vascular media as a pharmacological model and a potential vascular substitute.
The vascular media reconstructed by self-assembly was used to study the interactions between this layer and circulating microparticles (MPs). We demonstrated that the adventitia layer can influence the response of the media to T-Lymphocytes derived MPs. Next, we investigated the influence of MPs isolated from whole blood of septic shock patients (SMPs), on the human engineered media. This study demonstrated that the SMPs decrease nitric oxide (NO) production and increase interleukin-10 (IL-10) messenger RNA in the media layer. Incubation of reconstructed media with this anti-inflammatory cytokine blocks the hyporeactivity induced by lipopolysaccharides. This finding was confirmed in vivo, in rodents. Therefore, the elevation of MP levels in sepsis is potentially probeneficial to the cardiovascular function in this pathology.
We then investigated the feasibility of improving the reconstructed media in order to facilitate the physiopathological studies of this layer and improve the potential of a smooth muscle cell (SMC)-containing substitutes to be implanted in human. Therefore, the self-assembly approach was used to generate an extracellular matrix (ECM) scaffold, produced in vitro by fibroblasts, in which SMCs can be seeded. After a week of culture in a decellularised matrix scaffold, the SMC-containing sheets were rolled around a mandrel to form a media layer. This engineered media demonstrated an increase mechanical resistance and contractility as compared with the original technique. Finally, we created an anisotropic ECM scaffold that can direct the orientation of SMCs to reproduce the physiological orientation of that layer. Reconstructed media produced using those anisotropic scaffolds were more resistant and contractile than the ones reconstructed using isotropic scaffolds.
These improvements will facilitate the reconstruction of a media layer using pathological cells from patients and could lead to more representative pharmacological study of this layer. Moreover, this scaffold will facilitate the clinical translation of the model from bench to bedside.
TABLE DES MATIÈRES
Résumé ... III Abstract ... V Table des matières ... VII Liste des tableaux ... XI Liste des figures ... XIII Liste des abréviations et des sigles ...XV Remerciements ... XIX Avant-Propos ...XXV ... 1 CHAPITRE 1 Introduction 1.1. Problématique Générale ... 2
1.2. Anatomie et Physiologie Cardiovasculaire ... 3
1.2.1. Le système cardiovasculaire... 3
1.2.2. Les cellules vasculaires ... 5
1.3. Biologie de la Media Vasculaire ... 7
1.3.1. Anatomie et physiologie ... 7
1.3.2. Interaction avec l’endothélium ... 8
1.3.3. Contraction ... 11
1.3.4. Inflammation ... 14
1.3.5. Plasticité phénotypique des cellules musculaires lisses ... 16
1.3.6. Implication pathologique ... 16
1.4. Maladies Cardiovasculaires et Traitements ... 17
1.4.1. L’athérosclérose ... 18
1.4.2. La cardiomyopathie ischémique ... 20
1.4.3. Les maladies vasculaires périphériques ... 21
1.4.4. Les avenues thérapeutiques ... 22
1.5. Les Substituts Vasculaires ... 25
1.5.1. Vaisseaux natifs ... 25
1.5.2. Vaisseaux synthétiques ... 26
1.5.3. Vaisseaux reconstruits par génie tissulaire ... 27
1.6. Alignement des Cellules et de la Matrice... 38
1.6.1. Biologie de l’alignement des cellules ... 38
1.6.2. Mécanismes d’alignement in vivo ... 39
1.6.3. Méthodes d’alignement des cellules et de la matrice ... 40
1.6.4. Microfabrication d’une surface de culture microstructurée ... 42
1.7. Les Microparticules ... 45
1.7.1. Description ... 45
1.7.2. Formation et structure ... 45
1.7.3. Fonctions ... 46
1.7.4. Mécanismes d’action ... 47
1.7.5. Interaction avec les cellules vasculaires ... 47
1.7.6. Implication pathologique ... 48
1.8. Problématique, Hypothèse et Objectifs ... 53
... 57
CHAPITRE 2 Applications of Human Tissue-Engineered Blood Vessel Models to Study the Effects of Shed Membrane Microparticles from T-Lymphocytes on Vascular Function 2.1. Résumé ... 59
2.2. Abstract ... 60
2.3. Introduction ... 61
2.4. Materials and Methods ... 62
2.5. Results ... 66 2.6. Discussion ... 70 2.7. Conclusion ... 73 2.8. Acknowledgements ... 73 2.9. References ... 73 ... 75 CHAPITRE 3 Interleukin-10 Controls the Protective Effects of Circulating Microparticles from Septic Shock Patients on Tissue-Engineered Vascular Media 3.1. Résumé ... 77
3.2. Abstract ... 78
3.3. Introduction ... 79
3.4. Materials and Methods ... 80
3.5. Results ... 84 3.6. Discussion ... 89 3.7. Conclusion ... 91 3.8. Acknowledgements ... 92 3.9. References ... 92 ... 95 CHAPITRE 4 Human Fibroblast-Derived ECM as a Scaffold for Vascular Tissue Engineering 4.1. Résumé ... 97
4.1. Abstract ... 98
4.2. Introduction ... 99
4.3. Materials and Methods ... 100
4.4. Results ... 104
4.5. Discussion ... 109
4.6. Conclusion ... 112
4.7. Acknowledgements ... 112
... 117
CHAPITRE 5 Microstructured Human Fibroblast-Derived ECM Scaffold for Vascular Media Fabrication 5.1. Résumé ... 119
5.2. Abstract ... 120
5.3. Introduction ... 121
5.4. Materials and Methods ... 123
5.5. Results ... 129 5.6. Discussion ... 137 5.7. Conclusion ... 139 5.8. Acknowledgements ... 140 5.9. Supplementary Materials ... 141 5.10. References ... 142 ... 147 CHAPITRE 6 Discussion et Conclusion 6.1. Génie Tissulaire Cardiovasculaire ... 148
6.2. Le vaisseau reconstruit par auto-assemblage comme modèle d’étude des microparticules ... 149
6.2.1. Les microparticules lymphocytaires ... 150
6.2.2. Les microparticules de patients en choc septique ... 151
6.2.3. Directions futures pour les microparticules ... 155
6.3. Optimisation du substitut vasculaire à des fins pharmacologique et clinique ... 156
6.3.1. Développement d’un échafaudage de MEC ... 156
6.3.2. Alignement de l’échafaudage ... 157
6.3.3. Directions futures pour les échafaudages alignés ... 158
6.4. Conclusion Générale ... 161
Références ... 163
LISTE DES TABLEAUX
Tableau 1.1 - Méthodes de reconstruction de vaisseaux par génie tissulaire ... 29
Tableau 1.2 - Contribution significative au génie tissulaire vasculaire ... 31
Tableau 1.3 - Principaux effets des microparticules de différentes origines sur les cellules endothéliales ... 49
LISTE DES FIGURES
Figure 1.1 - Composition des artères et des veines ... 4
Figure 1.2 - Coupe transversale de vaisseaux fémoraux canins ... 8
Figure 1.3 - Interaction entre l’endothélium et le muscle lisse dans la contraction/relaxation vasculaire ... 9
Figure 1.4 - Contraction de la cellule musculaire lisse ... 10
Figure 1.5 - Mécanismes de contraction et de relaxation des cellules musculaires lisses ... 12
Figure 1.6 - Prévalence de l’athérosclérose dans l’artère coronaire selon l’âge ... 18
Figure 1.7 - Phases de progression d’une plaque d’athérome ... 19
Figure 1.8 - Pontage coronaire ... 24
Figure 1.9 - Méthodes de reconstruction vasculaire par génie tissulaire ... 28
Figure 1.10 - Exemples de tissus reconstruits par la technique d’auto-assemblage ... 34
Figure 1.11 - Méthodes d’alignement des cellules et de la matrice dans les vaisseaux reconstruits ... 41
Figure 1.12 - Fabrication d’une surface de culture microstructurée ... 43
Figure 1.13 - Cellules sur une surface de culture microstructurée ... 44
Figure 1.14 - Formation des microparticules ... 46
Figure 1.15 - Mécanismes d’action potentiels pour les microparticules ... 50
Figure 1.16 - Dosage par cytométrie en flux des microparticules sériques de patients en choc septique ... 52
Figure 2.1 - Histological and immunological staining of the constructs ... 65
Figure 2.2 - Concentration-response curves to histamine of the vascular constructs ... 66
Figure 2.3 - Concentration-response curves to histamine of TEVA ... 67
Figure 2.4 - Concentration-response curves to histamine of TEVM ... 68
Figure 2.5 - Concentration-response curves to histamine of TEVMA ... 68
Figure 2.6 - Production of NO and ROS of the vascular constructs ... 69
Figure 2.7 - Western blot analysis of protein expression after MP treatment ... 70
Figure 3.1 - Treatment with MPs increased the reactivity of TEVM to histamine ... 85
Figure 3.2 - Treatment with MPs increased COX-1 expression ... 85
Figure 3.3 - Treatment with MPs increased mRNA expression of IL-10... 86
Figure 3.4 - IL-10 treatment restored LPS-induced hyporeactivity in TEVM ... 87
Figure 3.5 - IL-10 treatment reversed LPS-induced increase of NO in TEVM... 87
Figure 3.6 - IL-10 treatment prevented LPS-induced death and hyporeactivity in aortic rings from mice ... 88
Figure 4.1 - Schematic view and timeline of the processes ... 102
Figure 4.2 - Masson’s trichrome staining of the vascular constructs ... 105
Figure 4.3 - Immunostaining of SMC markers ... 107
Figure 4.4 - Mechanical properties of TEVM ... 108
Figure 4.5 - Vasoreactivity of TEVM ... 109
Figure 5.1 - Experimental design of the study ... 125
Figure 5.2 - Cell alignment as a function of time on aligned and flat TPE ... 130
Figure 5.3 - Cell alignment as a function of time on aligned and unaligned scaffolds ... 131
Figure 5.4 - Visualization of cells cultured on aligned or control scaffolds ... 132
Figure 5.5 - Immunostaining of SMC markers and ECM protein in TEVM ... 133
Figure 5.6 - Histological staining of the TEVM ... 134
Figure 5.7 - Vasoreactivity of TEVM ... 135
Figure 5.8 - Mechanical properties of TEVM ... 136
LISTE DES ABRÉVIATIONS ET DES SIGLES
Abréviation Signification en français Signification en anglais
20-HETE Acide 20-hydroxyeicosatétraénoïque 20-Hydroxyeicosatetraenoic Acid
5-HT 5-Hydroxytryptamine (sérotonine) 5-Hydroxytryptamine (serotonin)
α-SM actin α-Actine de muscle lisse α-Smooth muscle actin
A.U. Unité arbitraire Arbitrary unit
AC Adénylate cyclase Adenylate cyclase
ADN Acide désoxyribonucléique Deoxyribonucleic acid
AMPc / cAMP Adénosine monophosphate cyclique cyclic Adenosine monophosphate
AngII Angiotensine II Angiotensin II
ANOVA Analyse de la variance Analysis of variance
ANSI/AAMI/ISO Institut américaine de standardisation/Association pour l'avancement de l'instrumentation médicale/ Organisation internationale de normalisation
American National Standards Institute/Association for the Advancement of Medical Instrumentation/ International Organization for Standardization
ATP Adénosine triphosphate Adenosine triphosphate
BSA Albumine de sérum bovin Bovine serum albumin
CABG Pontage coronaire Coronary artery bypass graft
CD Famille de différenciation Cluster of differentiation
CE / EC Cellule endothéliale Endothelial cell
cGKIα Protéine kinase dépendante du GMPc Iα cGMP dependant protein kinase Iα
CI Cardiomyopathie ischémique Ischemic cardiomyopathy
CIHR Instituts de recherche en santé du Canada Canadian Institutes of Health Research
CMH 1-Hydroxy-3-méthoxycarbonyl
2,2,5,5-tetraméthyl-pyrrolidine 1-Hydroxy-3-methoxycarbonyl 2,2,5,5-tetramethyl-pyrrolidin
CML / SMC Cellule musculaire lisse Smooth muscle cell
CO2 Dioxyde de carbone Carbon dioxide
COX (1, 2) Cyclo-oxygénase (1 et 2) Cyclooxygenase-1, -2
CSE Cystathionine gamma-lyase (cystathionase) Cystathionine γ-lyase(cystathionase)
CTL Contrôle Control
DAF-FM 4-amino-5-méthylamino-2',7'-difluorofluorescéine 4-amino-5-methylamino-2',7'-difluorofluorescein
DAG Diacylglycérol Diacylglycerol
DETC Diéthyldithiocarbamate Diethyldithiocarbamate
DF Fibroblaste dermique Dermal fibroblast
DIC Microscopie à contraste interférentiel Differential interference contrast
DMEM Modification Dulbecco-Vogt du milieu Eagle Dulbecco-Vogt modified Eagle’s medium
dMS dMS DF dMS SVF adMS idMS
Échafaudage de matrice décellularisé dMS de fibroblastes dermiques dMS de fibroblastes de veine saphène dMS anisotropique de fibroblastes dermiques dMS isotopique de fibroblastes dermiques
decellularised-Matrix scaffold
dMS from dermal fibroblasts dMS from saphenous vein fibroblasts anisotropic dMS from dermal fibroblasts isotropic dMS from dermal fibroblasts
DRDC Recherche et développement pour la défense
Canada
Defence Research and Development Canada
ECE Enzyme de conversion de l'endothéline Endothelin converting enzyme
Abréviation Signification en français Signification en anglais
EDHF Facteur vasorelaxant dérivé de l'endothélium Endothelium derived hyperpolarising factor
EDTA Acide éthylène diamine tétra acétique Ethylenediaminetetraacetic acid
EET Époxyeicosatriénoïque Epoxyeicosatrienoic
EGTA Acide éthylène-diamine-tétra acétique Ethylene glycol tetraacetic acid
ELISA Méthode immuno-enzymatique Enzyme-linked immunosorbent assay
EPR Résonance paramagnétique électronique Electron paramagnetic resonance
ERK Kinase régulée par les signaux extracellulaires Extracellular signal-regulated kinase
ERO / ROS Espèces réactives de l'oxygène Reactive oxygen species
ET-1 Endotheline-1 Endothelin1
É-U / USA États-Unis d'Amérique United-States of America
FCS (FBS) Sérum de veau fœtal Fetal calf serum (fetal bovine serum)
Fe(II)-NO(DETC)2 Fe(II)NO (diéthyldithiocarbamate)2 Fe(II)NO (diethyldithiocarbamate)2
FGF-2 Facteur de croissance fibroblastique-2 Fibroblast growth factor-2
FRQS / FRSQ Fond de Recherche du Québec - Santé / Fond de Recherche en Santé du Québec
—
GC Guanylate cyclase Guanylate cyclase
GDP Guanosine di phosphate guanosine diphosphate
GFP Protéine de fluorescence verte Green fluorescent protein
GM-CSF Facteur de croissance granulocyto-monocytaire Granulocyte macrophage-colony stimulating factor
GMPc / cGMP Guanosine monophosphate cyclique cyclic Guanosine monophosphate
GPCR Récepteur couplé aux protéines G G-protein coupled receptor
GTP Guanosine triphosphate Guanosine triphosphate
H2O2 Peroxyde d'hydrogène Hydrogen peroxide
H2S Sulfure d'hydrogène Hydrogen sulfide
HUVEC Cellule endothéliale de veine de cordon ombilical Human umbilical vein endothelial cell
ICAM1 Molécule d'adhésion intercellulaire 1 Intercellular adhesion molecule 1
IFNβ Interféron bêta Interferon beta
IgG Immunoglobuline G Immunoglobulin G
IKKβ Inhibiteur de la kinase bêta de NFκ-B Inhibitor of NFκ-B kinase beta
IL Interleukine Interleukin
IMA Artère mammaire interne Internal mammary artery
INSERM Institut National de la Santé et de la Recherche
Médicale —
IP3 Inositol 1,4,5-trisphosphate Inositol 1,4,5-trisphosphate
IRAK1 Kinase associée au récepteur de l’interleukine-1 Interleukin-1 receptor-associated kinase 1
IRS-1 Substrat du récepteur de l'insuline-1 Insulin receptor substrate-1
LDL
oLDL Lipoprotéine de faible densité LDL oxydé Low density lipoprotein oxidized LDL
LOEX Laboratoire d’Organogénèse Expérimentale —
LOX Lipoxygénase Lipoxygenase
LPS Lipopolysaccharide Lipopolysaccharide
MCP-1 Protéine d'attraction des monocytes-1 Monocyte chemoattractant protein-1
Abréviation Signification en français Signification en anglais
MCV Maladie cardiovasculaire Cardiovascular disease
MEC / ECM Matrice extracellulaire Extracellular matrix
MIP Protéine inflammatoire des macrophages Macrophage inflammatory protein
MLCK Kinase de la chaîne légère de la myosine Myosin light chain kinase
MLCP Phosphatase de la chaîne légère de la myosine Myosin light chain phosphatase
MMP Métalloprotéinase matricielle Matrix metalloproteinase
MP Microparticule Microparticle
MTT Bromure de 3-(4,5-diméthylthiazol-2-yl)-2,5-diphenyl
tetrazolium Bromure de 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium
MVP Maladie vasculaire périphérique Peripheral vascular disease
NADPH Nicotinamide adénine dinucléotide phosphate Nicotinamide adenine dinucleotide phosphate
NF Facteur nucléaire Nuclear factor
NO Oxyde nitrique ou monoxyde d'azote Nitric oxide
NOS eNOS iNOS nNOS
Synthase de l'oxyde nitrique NOS endothéliale NOS inductible NOS neuronale
Nitric oxide synthase
endothelial NOS inducible NOS neuronal NOS
NOX Oxydase de la NADPH NADPH oxidase
NSERC Conseil de recherche en sciences naturelles et en génie du Canada
Natural Science and Engineering Research Council of Canada
OCT — Optimal cutting temperature®
Ost Ostéopontine Osteopontin
P450 Cytochrome P450 Cytochrome P450
PBS Tampon phosphate physiologique Phosphate-buffered saline
PCP Protéines de cellules planaires Planar cell protein
PDGF Facteur de croissance dérivé des plaquettes Platelet-derived growth factor
PDMS Polydiméthylsiloxane Polydimethylsiloxane
PECAM1 Molécule d'adhésion endothéliale des plaquettes-1 Platelet–endothelial-cell adhesion molecule 1
PFP Plasma pauvre en plaquettes Platelet-free plasma
PG Prostaglandine Prostaglandin
PGA Acide polyglycolique Polyglycolic acid
PGI2 Prostacycline (prostaglandine I2) Prostacyclin (prostaglandin I2)
PI3K Phosphatidylinositide 3-kinases Phosphatidylinositide 3-kinases
PIP2 Phosphatidylinositol 4,5-disphosphate Phosphatidylinositol 4,5-bisphosphate
PIPAAm poly (N-iso-propylacrylamide) poly (N-iso-propylacrylamide)
pIκB IκBα phosphorylé Phosphorylated IκBα
PKA Protéine kinase A (dépendante de l'AMPc) cAMP-dependent protein kinase
PLC Phospholipase C Phospholipase C PTFE ePTFE Polytétrafluoroéthylène PTFE expansé Polytetrafluoroethylene expended PTFE qRT-PCR Réaction en chaîne de la polymérase quantitative
(transcriptase inverse) Quantitative reverse transcriptase-polymerase chain reaction
RE Réticulum endoplasmique Endoplasmic reticulum
Abréviation Signification en français Signification en anglais
RH Humidité relative Relative humidity
RTK Récepteur à activité tyrosine kinase Tyrosine kinase receptor
SD Écart-type Standard deviation
SDF Facteur dérivé des cellules stromales Stromal-cell-derived factor
SDS-PAGE Électrophorèse sur gel de polyacrylamide dénaturant (sodium dodécyl sulfate)
Sodium dodecyl sulfate-polyacrylamide gel electrophoresis
SEBS Styrène(éthylène-butyrène)styrène Styrene-ethylene/butylene-styrene block copolymer
SEM / S.E.M. Erreur standard de la moyenne Standard error of the mean
SEMS Échafaudage de matrice extracellulaire décellularisé Self-assembled extracellular matrix scaffold
Shh Sonic hedgehog Sonic hedgehog
SIDA Syndrome d’immunodéficience acquise Acquired immunodeficiency syndrome
SMP MP isolée du sérum d’un patient en choc septique Septic MP
SNP Nitroprussiate de sodium Sodium nitroprusside
SOD Superoxyde dismutase Superoxide dismutase
SV Veine saphène Saphenous vein
SVF Fibroblaste de veine saphène Saphenous vein fibroblast
TEBV TEVM TEVA TEVMA
Vaisseau sanguin reconstruit par génie tissulaire media reconstruite
adventice reconstruite media et adventice reconstruite
Tissue-engineered blood vessel
tissue-engineered vascular media tissue-engineered vascular adventitia tissue-engineered vascular media-adventitia TEVM sTEVM nTEVM nTEVM DF nTEVM SVF adMS-TEVM idMS-TEVM
Media vasculaire reconstruite par génie tissulaire
TEVM standard
nouveau TEVM (avec dMS)
nTEVM avec des fibroblastes dermiques nTEVM avec des fibroblastes de veine saphène nTEVM reconstruit avec un dMS anisotropique nTEVM reconstruit avec un dMS isotropique
Tissue-engineered vascular media
standard TEVM new TEVM (with dMS) nTEVM from dermal fibroblasts nTEVM from saphenous vein fibroblasts anisotropic dMS-derived nTEVM isotropic dMS-derived nTEVM TGF-β Facteur de croissance de transformation-β Transforming growth factor-β
TGT — Tissue growth technology®
THETA Acide trihydroxy eicosatriénoïque Trihydroxyeicosatrienoic acid
TNF-α Facteur de nécrose tumorale-α Tumor necrosis factor-α
TPE Élastomère thermoplastique Thermoplastic elastomer
TRITC Tétraméthylrhodamine isothiocyanate Tetramethylrhodamine isothiocyanate
TXA2 Thromboxane A2 Thromboxane A2
UTP Uridine triphosphate Uridine triphosphate
UTS Résistance à la rupture Ultimate tensile strength
UV Ultraviolet Ultraviolet
VCAM1 Molécule d'adhésion des cellules vasculaires 1 Vascular-cell adhesion molecule 1
VEGF Facteur de croissance de l'endothélium vasculaire Vascular endothelial growth factor
VF Fibroblaste veineux Vein fibroblast
VIH Virus de l'immunodéficience humaine Human immunodeficiency virus
REMERCIEMENTS
Tout d’abord, j’aimerais remercier Dre Germain de m’avoir accueilli dans son laboratoire, comme stagiaire, puis comme étudiant gradué. Merci également de m’avoir permis de faire des stages à l’étranger et surtout de m’avoir donné une grande latitude dans la poursuite de mes projets et d’être restée ouverte aux nouvelles idées proposées. Je la remercie aussi d’avoir cru en moi au cours de ce parcours et de m’avoir permis de découvrir le monde grâce aux nombreux congrès auxquels j’ai pu participer.
Merci au Dr Veres, mon codirecteur, de m’avoir ouvert les portes de la salle blanche du CNRC et de m’avoir fourni les équipements, l’expertise et le savoir-faire de votre équipe. Je remercie également le Dr Auger, directeur du laboratoire et du groupe vasculaire, de m’avoir accueilli dans le groupe même si je n’étais pas son étudiant. Merci également pour les congrès que vous avez financés.
Merci à mes premières superviseures de stage au LOEX, Dre Claudie Paquet et Dre Stéphanie Proulx, j’ai beaucoup apprécié travailler avec vous. Merci également au Dr Andriantsitohaina, Dre Martinez et tous les gens que j’ai côtoyés à Angers : Lucie Duluc, Chiara Porro, Raffaella Soletti, Ahmed Mostefai, Abdel Agouni et tous les autres. J’ai particulièrement apprécié mon dernier stage en votre compagnie; j’espère vous revoir avant longtemps.
Merci aux évaluateurs, Dr Huot, Dr D’Orléans-Juste et Dre Moulin d’avoir accepté de réviser cette thèse. Une évaluation de thèse demande beaucoup de temps et d'énergie et je vous en suis très reconnaissant. Merci pour votre intérêt, vos commentaires et vos critiques qui permettront d'améliorer et de compléter le contenu scientifique de ce document.
Merci au Dr Robert Gauvin dit « Bob », d’avoir vu le potentiel de mes projets, d’avoir toujours été de bon conseil et d’avoir corrigé savamment mes articles. J’ai beaucoup appris et apprécié travailler et aller en congrès avec toi. Merci à Danielle Larouche, pour les conseils, discussions et corrections. Merci également au Dr Guillemette d’avoir préparé le terrain en ayant mis au point la technique d’alignement utilisée au cours de mes travaux. Merci à nos ingénieurs, en particulier Catherine Tremblay et Véronique Laterreur; le génie tissulaire est un domaine multidisciplinaire et votre contribution à nos travaux est particulièrement appréciée. Merci à tous les membres de l’équipe vasculaire et de l’équipe cellules souches pour les commentaires et discussions qui font avancer les projets.
Je voudrais remercier tous les assistants de recherche qui préparent nos milieux, sérums, additifs et autres; la tâche serait beaucoup plus ardue sans vous. Un merci tout spécial à Cindy Perron, Todd Galbraith et Kathleen Baker qui ont été mes deuxièmes paires de mains pour rouler des vaisseaux ou pour monter des bioréacteurs.
Merci à Sébastien Larochelle et Dre Véronique Moulin pour l’aide avec les vecteurs viraux et la cytométrie. Merci à l’équipe d’histologie, à l’équipe patient et à tous les employés administratifs. Sans oublier les assistants de recherche de Dr Veres au CNRC, Maxence Mounier et Caroline Miville-Godin qui m’ont accueilli chaleureusement dans leur équipe et m’ont fait confiance dans l’utilisation des appareils. Merci également à Sarah-Anne Têtu d’avoir révisé l’orthographe de cette thèse.
Merci également à tous les autres étudiants, assistants de recherche et chercheurs du LOEX, après plus de 7 ans à vos côtés, c’est avec le cœur gros que je vais vous quitter. Je remercie particulièrement ceux qui m’étaient les plus proches : Rémi Parenteau Bareil, Mathieu Blais, Caroline Audet, Audrey Laforce-Lavoie, Marie-Christine Fiola et ceux que j’oublie. Les dernières années n’auraient pas été les mêmes sans la présence de mon amie Marie-Ève Ouellette, une personnalité incroyable, mais surtout une personne et une amie extraordinaire.
Merci à mes parents, Georges et Cécile, de m’avoir encouragé dans tout ce que je faisais. Merci à mes amis, présents et passés, même si je ne suis pas très bon pour garder le contact. Merci également à tous ceux qui m’ont encouragé au cours des années, qui ont cru en moi quand je doutais, qui m’ont donné un coup de pouce au bon moment. Merci aux professeurs qui m’ont motivé à poursuivre mes études toujours plus loin.
Finalement, merci à ma famille, Amélie et Julia. Amélie, tu es toujours là pour moi, pour m’aider professionnellement et personnellement. Je suis un homme comblé à tes côtés. Merci d’avoir donné un côté artistique à certaines de mes figures, un talent que je suis loin de posséder et de m’avoir supporté durant la rédaction de cette thèse. Tu mérites définitivement une part de mon succès. Finalement, Julia, mon bébé, ma grande fille, en plus d’être la plus belle d’entre toutes, tu es la plus intelligente et celle qui compte le plus dans ma vie. Merci d’avoir été un bébé facile, souriant. Tu mets de la joie dans mon cœur et un sourire sur mes lèvres. Je te dédie ce travail, à toi et à tes contemporains. Je souhaite que tu trouves ta passion dans la vie, quoi que ce soit, car c’est ce qui importe le plus.
Imagination is more important than knowledge.
For knowledge is limited, whereas imagination embraces the entire world,
stimulating progress, giving birth to evolution.
À ma Julia
et aux générations futures,
parce que les découvertes d’aujourd’hui
AVANT-PROPOS
Cette thèse comporte l’insertion de quatre articles. Les trois premiers (chapitres 2 à 4) ont été publiés dans des revues scientifiques (Tissue Engineering, Clinical Science et Biomaterials) et les versions manuscrites de ces articles sont présentées en version intégrale. Seules des modifications du format et de la mise en page ont été apportées pour se conformer au style de l’ouvrage déposé. Le dernier article (chapitre 5) sera soumis prochainement à la revue Biomaterials. Ma contribution à chacun des articles est détaillée dans la section Avant-propos qui débute chacun des articles.
CHAPITRE 1
1.1.
Problématique Générale
Les maladies cardiovasculaires (MCV) représentent la première cause de mortalité dans les pays industrialisés. La moitié des décès associés aux MCV est causée par l’obstruction d’une ou de plusieurs artères coronaires, entraînant une cardiomyopathie ischémique et conduisant à un infarctus du myocarde [Go et al., 2013]. Cette condition est souvent la conséquence de la présence de plaques d’athérome au niveau de la media de ces artères de petits calibres. Pour traiter cette pathologie, il existe plusieurs approches incluant : la modification des habitudes de vie, la médication, l’angioplastie percutanée, l’apposition d’un tuteur vasculaire et le pontage artériel. Pour cette dernière approche, la plus efficace, mais également la plus invasive, le choix du greffon est de la plus haute importance afin de maximiser la perméabilité du pontage et d’éviter de réopérer le patient précocement. L’utilisation d’un vaisseau autologue tel que l’artère mammaire interne ou la veine saphène comme greffon est à privilégier pour ce type de pontage (<6 mm de diamètre). Bien que ces vaisseaux donnent des résultats satisfaisants au niveau de la perméabilité [Johnson et al., 2000], ils présentent plusieurs problèmes au niveau de la disponibilité, de la constance (taille, collatérales, propriétés mécaniques) et de la présence de pathologies vasculaires. Il s’avère donc crucial de développer un vaisseau reconstruit par génie tissulaire pour ce type de greffe.
Plusieurs équipes de recherche se sont penchées sur le développement d’une telle prothèse vasculaire. Depuis le gel de collagène de Weinberg et Bell [Weinberg et al., 1986], plusieurs approches se sont révélées prometteuses pour la translation clinique. En effet, le modèle de vaisseaux reconstruits par auto-assemblage [L'Heureux et al., 1998] démontre des résultats très encourageants en essai clinique [McAllister et al., 2009]. Ce vaisseau reconstruit permet également la réalisation d’études in vitro.
Les microparticules (MP) circulantes sont un sujet d’actualité, en effet, leur implication au cours des processus pathologiques ne fait plus de doute. Ces vésicules membranaires, libérées dans le milieu extracellulaire par les cellules activées notamment par un stress ou une blessure, sont en mesure d’agir comme vecteurs de messages. Elles sont présentes dans le plasma et les autres liquides biologiques des individus sains; par contre, leur provenance et leur quantité varient en réponse à certaines conditions pathologiques. Les pathologies impliquant une modulation des taux de MP circulantes sont nombreuses (athérosclérose, diabète, pré-éclampsie, syndrome cardiométabolique, choc septique) et elles ont comme point commun une atteinte vasculaire, inflammatoire ou un état prothrombotique [Burnier et al., 2009]. Cependant, les MP peuvent avoir des effets bénéfiques ou délétères sur la fonction vasculaire en fonction de la pathologie [Hugel et al., 2005]. Malgré le nombre grandissant de publications sur l’implication pathologique des MP sur la fonction vasculaire, un nombre limité d’entre elles étudient les MP isolées de patients dans un vaisseau contenant des cellules humaines.
En plus de sa finalité clinique comme prothèse vasculaire, le vaisseau reconstruit par génie tissulaire peut servir de modèle d’études pharmacologiques [L'Heureux et al., 2001]. Actuellement, ces études sont réalisées sur des animaux modèles qui ne permettent pas de reproduire fidèlement les réactions physiologiques des cellules humaines. Alternativement, les cellules humaines peuvent être isolées et mises en culture, mais elles se retrouvent alors dans un environnement non physiologique ce qui rend leurs réactions peu prédictives du comportement des vaisseaux natifs. L’utilisation de vaisseaux humains explantés est l’approche la plus valable, mais ceux-ci sont disponibles en quantité limitée, sont souvent pathologiques et la variabilité interindividuelle rend l’interprétation des résultats difficile [Stoclet et al., 1996]. Pour être utilisé comme modèle pharmacologique, le vaisseau reconstruit doit présenter certaines caractéristiques essentielles. Il doit être composé de cellules musculaires lisses (CML) différenciées et contractiles, il doit pouvoir être endothélialisé et être suffisamment résistant pour être manipulé sans l’endommager.
Le modèle de vaisseau reconstruit par auto-assemblage présente plusieurs de ces caractéristiques. En effet, les CML sont contractiles et le modèle peut être endothélialisé par une méthode simple. Par contre, la résistance mécanique de la media et les contractions enregistrées sont faibles par rapport à celles des vaisseaux humains ex vivo. De plus, la capacité à former des feuillets manipulables varie d’une population de CML à l’autre. Il est donc primordial d’améliorer le modèle de vaisseau reconstruit par auto-assemblage en augmentant la résistance mécanique, la capacité contractile et la reproductibilité des résultats obtenus d’une population à l’autre. Cette optimisation sera bénéfique à la fois pour l’utilisation du vaisseau reconstruit comme modèle d’études pharmacologiques et pour le développement d’une prothèse vasculaire à partir des cellules de n’importe quel patient.
1.2.
Anatomie et Physiologie Cardiovasculaire
1.2.1. Le système cardiovasculaire
Le système cardiovasculaire regroupe l’ensemble des structures anatomiques responsables du transport et de la distribution des éléments biochimiques nécessaires au fonctionnement des autres systèmes. Il se compose des artères, des veines, du cœur et du sang. Ce système, essentiel au maintien de l’homéostasie, est intimement lié à tous les autres systèmes de l’organisme par son rôle de transporteur de nutriments, d’oxygène, d’hormones, de déchets métaboliques et de dioxyde de carbone (CO2) [Marieb, 2005].
Les artères et les veines constituent le réseau de distribution à travers l’organisme. Les artères sont capables de modifier leur diamètre afin de réguler l’apport sanguin aux différents organes en fonction des besoins de l’organisme. Les vaisseaux sont classés en différentes catégories selon leurs fonctions et leur composition : artères élastiques, artères musculaires, artérioles, veines, veinules et capillaires (Fig. 1.1). Tous ces types de vaisseaux sont constitués d’une ou de plusieurs des trois tuniques vasculaires mais le sont en différentes
proportions selon les vaisseaux. De l’intérieur vers l’extérieur, on distingue l’intima, la media et l’adventice. Les artères transportent le sang du cœur vers les capillaires tandis que les veines transportent ce fluide et son contenue en sens opposé. Leur fonction différente explique leur composition spécifique. Les artères doivent résister à des pressions importantes sans fatigue ni rupture; elles possèdent par conséquent des couches musculaire et élastique prédominante. Les veines font un travail plus passif qui demande moins de capacité élastique et contractile; elles contiennent donc une plus grande proportion de tissu conjonctif. Les valvules présentes au niveau des veines des membres inférieurs permettent le retour veineux unidirectionnel. Les capillaires sont composés d’une monocouche de cellules endothéliales (CE) reposant sur une membrane basale. Ils sont entourés de péricytes, des CML spécialisées qui possèdent un potentiel régénérateur [Caplan, 2008]. Le faible diamètre des capillaires maximise le rapport de la surface sur le volume, assurant des échanges optimaux entre le sang et les tissus à travers l’endothélium.
Figure 1.1 - Composition des artères et des veines
Composition et abondance relative des différentes tuniques dans les vaisseaux sanguins humains. L’abondance du tissu musculaire dans les artères est en accord avec le rôle de ce type de vaisseau qui doit absorber les pulsations cardiaques et créer un flux continu au niveau des artérioles et des capillaires. Le besoin en vaisseaux reconstruits est associé principalement à des artères musculaires (<6 mm de diamètre) comme les coronaires et les fémorales. (Adaptée de [Tortora et al., 2003, Marieb, 2005])
Dans tous les vaisseaux, une monocouche de CE forme l’intima. Elle empêche la coagulation et régule la contraction des CML par la sécrétion de différents facteurs en réponse aux variations de l’environnement intraluminal (pression, débit, hormones). La media est séparée de l’endothélium par la membrane basale et la limitante élastique interne. Cette tunique est composée principalement de CML et de fibres d’élastine. Son abondance est variable entre les différents types de vaisseaux. L’adventice est composée de fibroblastes qui sécrètent une matrice extracellulaire (MEC) riche en collagène, capable de prévenir l’expansion pathologique des vaisseaux, particulièrement au niveau veineux (Fig. 1.1).
Le sang est composé du sérum et des éléments figurés. Parmi ceux-ci, on distingue les érythrocytes, les leucocytes (monocytes, lymphocytes, granulocytes) et les thrombocytes. Chacun des éléments du sang possède une ou des fonctions particulières incluant le transport de l’oxygène et du CO2, la réponse
immunitaire, la coagulation et le transport hormonal.
Le système cardiovasculaire est une circuiterie bien construite qui repose sur un équilibre homéostatique précaire. En effet, il est constamment soumis à différents stress : pression, radicaux libres, lipoprotéines de basse densité (LDL de l’anglais low density lipoproteins) et force de cisaillement. Pour cette raison, ce système est souvent la cible du développement de pathologies comme l’hypertension, le diabète et l’athérosclérose. Ces conditions pathologiques entraînent le développement des MCV, la première cause de décès aux États-Unis (É-U) [Go et al., 2014].
1.2.2. Les cellules vasculaires
1.2.2.1. Les cellules endothéliales
Les CE forment un épithélium simple pavimenteux appelé endothélium qui sépare le sang du reste de l’organisme. Les CE adoptent une forme allongée dans la direction du flux grâce à la mince couche de glycocalyx qui recouvre la surface luminale de l’endothélium. Cette couche de molécules chargées négativement (protéoglycanes, glycosaminoglycanes, glycoprotéines et protéines plasmiques) joue le rôle de mécanotransducteur entre les stimuli provenant du lumen et le cytosquelette d’actine des CE [Bai et al., 2014]. La perturbation du flux cause une altération de leur alignement qui contribue à la dysfonction endothéliale. Ce phénomène se produit principalement dans les zones de branchement, près des valves cardiaques ou en présence de plaques d’athérome [Tricot et al., 2000]. La dysfonction endothéliale est une condition pathologique qui réduit la capacité de l’endothélium à produire des métabolites vasodilatateurs, majoritairement le monoxyde d’azote (NO). Une altération du flux entraîne également une augmentation de l’expression du récepteur de type 1 de l’angiotensine [Ramkhelawon et al., 2009]. Cette condition augmente l’adhésion des plaquettes et des leucocytes ainsi que la perméabilité de l’endothélium aux cellules et aux molécules présentent dans le sérum [Lehoux et al., 2003]. Cette dysfonction est l’étape qui initie la formation des plaques d’athérome [Ross, 1999, Lacolley, 2007]. Les CE jouent plusieurs rôles importants dans le système circulatoire : 1) Hémocompatibilité : l’endothélium n’active pas la coagulation sanguine grâce à la libération de facteurs anticoagulants comme la prostacycline (PGI2) et le NO. Les protéoglycanes tapissant la
surface luminale de l’endothélium interviennent aussi à ce niveau; 2) Barrière semi-perméable : il est capable de laisser passer des cellules, mais de bloquer de petites molécules; 3) Angiogenèse : les nouveaux capillaires seront formés à partir de l’endothélium de vaisseaux préexistants, majoritairement des capillaires;
4) Régulation du tonus myogénique : la sécrétion de facteurs vasoactifs en réponse à différents stimuli
Au niveau des capillaires, la barrière sélective favorise les échanges entre le sang et les tissus et permet ainsi d’approvisionner les cellules en nutriments et en oxygène tout en récupérant les déchets métaboliques comme le CO2. Lorsque l’endothélium est activé par un signal inflammatoire provenant d’un tissu, c’est au niveau des
capillaires que les leucocytes peuvent s’infiltrer dans celui-ci. Dans les artères, la communication entre les CE de l’intima et les CML de la media prend une importance capitale. En effet, plusieurs facteurs vasoconstricteurs et vasodilatateurs sont libérés par l’endothélium et agissent sur la media afin de réguler son niveau de contraction. Ces facteurs seront discutés dans la section 1.3.2 Interaction avec l’endothélium. L’intima et la media sont séparées par la limitante élastique interne, une couche de fibres élastiques d’environ 70 à 100 nm d’épaisseur. Cependant, une communication directe entre les deux types cellulaires se fait via une série de jonctions myo-endothéliales formées à travers des ouvertures dans la limitante élastique interne [Ledoux et al., 2008].
1.2.2.2. Cellules musculaires lisses
Les CML qui forment la media sont liées entre elles par de nombreuses jonctions serrées et elles échangent leur contenu cytoplasmique via des jonctions ouvertes. Elles sont organisées en faisceaux de cellules alignées parallèlement. L’interaction dynamique entre l’intima et la media est au cœur de la régulation des processus physiologiques du système circulatoire. Elle intervient également dans le développement et la progression des pathologies vasculaires. Étant donné l’importance particulière qu’occupe la media dans cette thèse, la section 1.3 Biologie de la Media Vasculaire lui sera consacrée.
1.2.2.3. Les fibroblastes et adipocytes
Les fibroblastes qui composent l’adventice des plus gros vaisseaux possèdent avant tout un rôle de soutien dans la résistance mécanique des vaisseaux, particulièrement au niveau des veines. Néanmoins, il a été suggéré que cette tunique aurait une contribution dans la contraction [Laflamme et al., 2006b]. On retrouve également au niveau de l’adventice des adipocytes formant le tissu adipeux périvasculaire. Celui-ci peut modifier le niveau de contraction de la media via la libération d’adipokines. Les facteurs libérés chez les sujets sains ont un effet vasorelaxant alors que, en situation d’obésité, ces facteurs changent et causent une vasoconstriction, ce qui contribue au développement de pathologies comme l’hypertension [Eringa et al., 2012]. De plus, l’implication des tissus adipeux sous-cutané et viscéral dans le développement et la progression des MCV est bien démontrée. Il produit un état d’inflammation modéré mais systémique qui contribue à la dysfonction endothéliale et donc au développement de l’athérosclérose [Meyers et al., 2007].
1.2.2.4. Les cellules immunitaires
Le rôle principal des leucocytes est de participer aux processus de défense de l’hôte contre les pathogènes. Les cellules immunitaires regroupent les granulocytes (neutrophiles, éosinophiles, basophiles), les monocytes
et les lymphocytes (B et T). Ces cellules utilisent les réseaux vasculaire et lymphatique pour patrouiller l’organisme afin de trouver et de détruire les pathogènes ou corps étrangers. L’interaction des cellules immunitaires avec la paroi vasculaire joue un rôle important dans plusieurs processus pathologiques. Dans les réactions allergiques cutanées, les basophiles libèrent de l’histamine qui cause la dilatation des capillaires, favorise l’extravasation des monocytes et produit une rougeur caractéristique. En effet, les monocytes ont la capacité de traverser l’endothélium vasculaire par un processus appelé diapédèse leur permettant d’atteindre le tissu en inflammation et de se transformer en macrophage [Goldsby et al., 2001]. Ce processus d’extravasation des monocytes est fortement impliqué dans le développement de l’athérosclérose. Le choc septique est, quant à lui, un état d’hypotension vasculaire systémique causé par une réponse incontrôlée du système immunitaire à une infection bactérienne. Les cellules immunitaires ont la capacité de libérer dans la circulation des MP [Martin et al., 2004]. Leurs interactions avec le système vasculaire seront détaillées dans la section 1.7 Les Microparticules. Le rôle de ces MP sur les différentes tuniques vasculaires est encore mal compris, c’est pourquoi leur étude présente un intérêt particulier.
1.3.
Biologie de la Media Vasculaire
1.3.1. Anatomie et physiologie
La media est présente dans tous les vaisseaux à l’exception des capillaires, entourés seulement par les péricytes (Fig. 1.1). La composition et les propriétés de la media des artères sont bien différentes de celles des veines. La media des artères est épaisse et peut supporter des pressions élevées tandis qu’au niveau des veines, elle est plus mince et son rôle est limité à contrer l’évasement de la paroi vasculaire (Fig. 1.2). La media joue plusieurs rôles majeurs dans la physiologie du système cardiovasculaire, particulièrement au niveau artériel. D’abord, elle absorbe les variations de pression produites par les battements du cœur, rendant le débit presque continu au niveau des capillaires. Ensuite, elle modifie l’apport sanguin aux différents organes selon leurs besoins, par la modulation locale du diamètre des artères de résistance. Le système nerveux autonome intervient dans le contrôle de cette contraction. Enfin, elle régule la pression sanguine sous la gouverne de l’endothélium. Ces fonctions sont possibles grâce à la capacité contractile des CML qui permet à la media d’adapter le diamètre de la lumière en fonction de la situation. Cette tunique est impliquée dans le développement de plusieurs pathologies vasculaires, notamment l’athérosclérose et l’hypertension.
L’organisation tridimensionnelle des faisceaux de CML de la media est particulière. Dans la partie la plus luminale de la media, une couche de faisceaux longitudinaux est présente, alors que les faisceaux sous-jacents sont organisés circonférentiellement et hélicoïdalement. Cette organisation circonférentielle de la majorité des faisceaux de CML permet d’optimiser la dépense énergétique nécessaire à la contraction. Cette organisation sera discutée dans la section 1.6 Alignement des Cellules et de la Matrice.
Figure 1.2 - Coupe transversale de vaisseaux fémoraux canins
L’artère (A et C) et la veine (B et D) sont composées des trois tuniques fondamentales. L’endothélium (e) sépare le lumen (l) de la paroi du vaisseau et forme, avec la limitante élastique interne, l’intima (i). La media (m) artérielle contient principalement des cellules et peu de collagène, elle apparaît rouge avec ce type de coloration. Dans la veine, elle est plus mince et contient plus de matrice extracellulaire. L’adventice (a) est composée de collagène et de fibroblastes. Les vasa-vasorum (non visible sur ces coupes) sont retrouvés dans cette tunique, ces capillaires alimentent la paroi du vaisseau. (Coloration trichrome de Masson, barres de mesure : A-B = 500 µm, C-D = 250 µm) (© Bourget, 2014)
1.3.2. Interaction avec l’endothélium
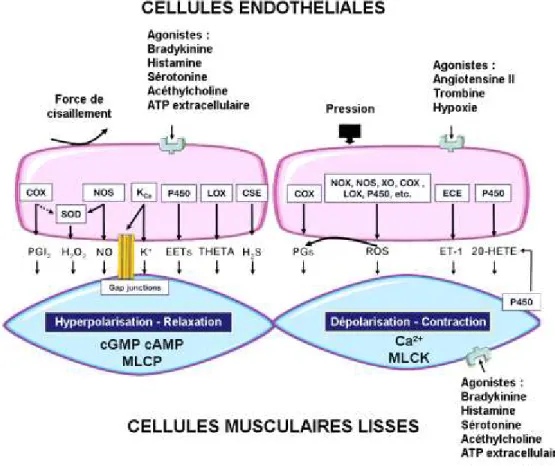
L’endothélium maintient la balance (inhibition/stimulation) de la prolifération et de la migration des CML ainsi qu’entre la contraction et la relaxation de la media (Fig. 1.3). Le débalancement de cet équilibre fragile entraîne la dysfonction endothéliale [Feletou et al., 2006]. L’endothélium produit plusieurs facteurs vasodilatateurs : 1) Le monoxyde d’azote (NO) : ce gaz est produit majoritairement par la NO synthase endothéliale (eNOS de l’anglais endothelial nitric oxide synthase), une enzyme dépendante du calcium [Palmer et al., 1987]; 2) PGI2 : un lipide de la famille des eicosanoïdes produit par la cyclo-oxygénase (COX)
constitutive (COX-1) et inductible (COX-2), il agit également comme agent antiagrégant plaquettaire [Gryglewski et al., 1988]; 3) Les facteurs hyperpolarisants dérivés de l’endothélium (EDHF de l’anglais Endothelium-derived hyperpolarizing factors)
Figure 1.3 - Interaction entre l’endothélium et le muscle lisse dans la contraction/relaxation vasculaire
L’endothélium produit plusieurs facteurs qui influencent la contraction de la media. Certains facteurs causent la relaxation du muscle
lisse vasculaire. C’est le cas de la PGI2, du NO et des membres de la famille des EDHF (l’H2O2, l’EET, THETA, K+, H2S). Inversement,
d’autres facteurs entraînent la contraction de la media. L’ET-1 est le plus puissant de ces facteurs. On retrouve également le 20-HETE et les ROS. Lors du vieillissement ou en situation pathologique, certaines prostaglandines modifiées peuvent se lier aux récepteurs des thromboxanes/endoperoxydes. Plusieurs agonistes sont vasorelaxants lorsqu’ils se lient aux CE, mais produisent l’effet inverse quand ils atteignent directement les CML. C’est le cas de l’acétylcholine, de la sérotonine, de l’histamine et de la bradykinine.
(Adaptée de [Feletou et al., 2009])
Abréviations de l’anglais : PGI2, prostacyclin; NO, nitric oxide; EDHF, endothelium-derived hyperpolarizing factors; H202 , hydrogen
peroxide; EET, epoxyeicosatrienoic acid; THETA, trihydroxyeicosatrienoic acid; K+, potassium ion; H2S, hydrogen sulfide; ET-1,
endothelin-1; CSE, cystathionine γ-lyase; 20-HETE, 20-hydroxyeicosatetraenoic acid; ROS, reactive oxygen species; LOX, lipoxygenase; SOD, superoxide dismutase; P450, cytochrome P450; NOX, NADPH oxidase; XO, xanthine oxidase; ECE, endothelin converting enzyme; cGMP, cyclic guanosine monophosphate; cAMP, cyclic adenosine monophosphate; MLCP, myosin light chain phosphatase; MLCK, myosin light chain kinase; COX, cyclooxygenase; PG, prostaglandin.
(acide époxyeicosatriénoïque (EET de l’anglais epoxyeicosatrienoic), peroxyde d’hydrogène (H2O2),
monoxyde de carbone, sulfure d’hydrogène [H2S], peptide C natriurétique, ions potassiums [K+]). Ces facteurs
vasodilatateurs (NO, PGI2, EDHF) sont produits par les CE lorsqu’un composé vasoactif comme la
G-protein coupled receptor) spécifique. Inversement, l’angiotensine II et la thrombine stimulent la production d’endothéline (ET), un puissant agent vasoconstricteur agissant sur les CML ou des facteurs vasoconstricteurs dérivés de l’endothélium (EDCF de l’anglais endothelium-derived contracting factor) produits par la COX1 à partir de l’acide arachidonique (endoperoxydes, prostaglandines (PG) et thromboxane A2 (TXA2) [Feletou et al., 2009].
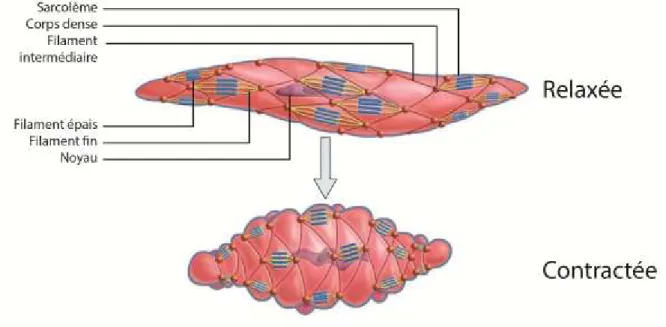
Figure 1.4 - Contraction de la cellule musculaire lisse
Le mouvement des filaments fins sur les filaments épais entraîne le rapprochement des corps denses. Cette figure représente la contraction anisotropique de la cellule, c’est-à-dire que l’axe le plus long de la cellule se contracte alors que le plus court s’allonge légèrement. (Adaptée de [Tortora et al., 2003])
Les composés vasoactifs retrouvés dans la circulation exercent leurs actions sur la fonction vasculaire en interagissant avec l’endothélium. Lorsque l’endothélium est altéré, dans le cas d’une dysfonction endothéliale ou d’un bris de l’endothélium, ces composés entrent directement en contact avec les CML. Dans cette situation, l’effet de plusieurs de ces facteurs vasoactifs sur le niveau de contraction de la media est inversé. Alors qu’une augmentation de calcium dans les CE entraîne la libération de composés vasodilatateurs, l’augmentation de calcium dans les CML cause plutôt la contraction. La formation du clou plaquettaire fait intervenir ce phénomène pour limiter la perte sanguine suite à une blessure [Virdis et al., 2010, Feletou et al., 2011, Rubanyi, 2011, Feletou et al., 2012].
1.3.3. Contraction
La media contrôle le tonus vasculaire grâce à la capacité des CML à modifier l’état de contraction de leur cytosquelette d’actine en réponse à des agents vasocontractiles et vasorelaxants. En effet, c’est la sommation des agonistes aux effets opposés qui détermine le niveau de contraction des cellules et, par conséquent, de la media (Fig. 1.4). La présence des jonctions ouvertes et des jonctions serrées entre les CML est essentielle à leur fonctionnement. Lors d’une situation nécessitant un rétrécissement de la lumière artérielle, la contraction de chacune des cellules se traduit par la contraction de tout le vaisseau. En effet, l’augmentation de calcium dans une cellule est en mesure de se répandre aux cellules adjacentes via les jonctions ouvertes. De plus, comme les cellules sont attachées les unes aux autres via les jonctions serrées et que ces jonctions sont ancrées au cytosquelette d’actine, la contraction de chacune des cellules ne les éloigne pas l’une de l’autre, mais rétrécit plutôt la lumière du vaisseau.
1.3.3.1. Régulation du tonus vasculaire
Il est important pour le fonctionnement de l’organisme que le système artériel soit maintenu sous pression. Cette pression joue un rôle important pour permettre les échanges au niveau des capillaires. La pression et le débit à ce niveau sont pratiquement continus grâce à l’élasticité et à la contractilité de la media artérielle. La pression est certes nécessaire, mais son excès est délétère. En effet, l’hypertension artérielle représente un facteur de risque important de développement de MCV.
Plusieurs mécanismes sont impliqués dans le contrôle de la pression sanguine. En plus des facteurs dérivés de l’endothélium (NO, PGI2, EDRF, EDCF, ET), les stimuli qui influencent le tonus myogénique sont les
médiateurs de la voie rénine-angiotensine [Dostal et al., 1997, Kurtz, 2012], les hormones (adrénaline, noradrénaline, aldostérone), les médiateurs de l’inflammation (chronique ou aiguë), le débit sanguin [Markos et al., 2013], le système nerveux autonome [Zeng et al., 2007], ainsi que l’oxygène et le gaz carbonique [Marieb, 2005]. Ces médiateurs régulent la quantité de métabolites vasocontractiles et vasodilatateurs que l’endothélium libère vers le muscle lisse sous-jacent (Fig. 1.3). Les CML modifient le diamètre de la media par leurs contraction et relaxation en réponse à ces stimuli provenant de l’endothélium ou d’autres sources (inflammatoire, canaux calciques mécanosensitifs).
1.3.3.2. Mécanisme moléculaire de la contraction et relaxation des CML Le niveau de contraction des CML est influencé par une panoplie de facteurs qui se répercutent sur le niveau de calcium intracellulaire. En effet, ce second messager intègre les signaux pour générer une contraction proportionnelle à son niveau. Cette action est cependant antagonisée par les nucléotides monophosphates cycliques comme l’adénosine monophosphate cyclique (AMPc) et la guanosine monophosphate cyclique (GMPc).
Figure 1.5 - Mécanismes de contraction et de relaxation des cellules musculaires lisses
A) Contraction : 1. Liaison d’une molécule vasoactive à son GPCR spécifique; 2. Liaison de la protéine G à un GTP, dissociation des
sous-unités alpha (Gαi ou Gαq) et beta-gamma (β-γ); 3a. Gαi demeure à la membrane plasmique, inhibe l’AC, cause la diminution de l’AMPc (antagonise le mécanisme présenté en (B)); 3b. Gαq demeure à la membrane plasmique, active la PLC, catalyse la transformation du PIP2 en DAG et IP3; 3c. β-γ demeurent à la membrane plasmique et activent la PLC; 4. IP3 entraîne l’ouverture des
canaux calciques de la membrane du RE, libère la réserve de calcium ; 5. Ca2+ entraîne l’ouverture des canaux calciques dépendants
du Ca2+ présents sur la membrane plasmique, entrée de calcium 6. Formation du complexe Ca2+-calmoduline, activation de la MLCK;
7. MLCK phosphoryle les têtes de la myosine, interaction avec l’actine, glissement actine-myosine, contraction.
B) Relaxation : 1. Liaison d’une molécule vasorelaxante à son GPCR; 2. Liaison de la protéine G à un GTP entraîne la dissociation des sous-unités alpha (Gαs) et beta-gamma (β-γ); 3. Gαs active l’AC, augmentation d’AMPc; 4. AMPc active la PKA, qui active (phosphorylation) la MLCP, qui déphosphoryle la myosine; 5. Perte d’interaction actine-myosine, relaxation.
C) Relaxation dépendante du NO : 1. Le NO traverse la membrane et active la GC; 2. augmentation du GMPc; 3. GMPc active la
cGKIα; 4. cGKIα active la MLCP; 5. Activation des canaux potassiques dépendants du calcium, hyperpolarisation de la membrane plasmique; 6. Fermeture des canaux calciques dépendants du voltage, diminution du Ca2+; 7. Relaxation. (© Lavoie, Bourget, 2014)
Abréviations de l’anglais : GPCR, G-protein coupled receptor; GMPc/cGMP, guanosine monophosphate cyclique; GDP, guanosine diphosphate; GTP, guanosine triphosphate; GC, guanylate cylcase; PIP2,phosphatidylinositol 4,5-bisphosphate; DAG, diacylglycerol;
IP3, inositol 1,4,5-trisphosphate; AMPc, adénosine monophosphate cyclique; ATP, adenosine triphosphate; AC, adenylate cyclase;
PKA, cAMP-dependent protein kinase; cGKIα, cGMP-dependent protein kinase type I; MLCP, myosin light chain phosphatase; MLCK,
La contraction des CML vasculaires débute par la liaison d’une molécule vasoactive à son récepteur transmembranaire spécifique, le plus souvent un GPCR. Cette liaison permet l’hydrolyse d’une guanosine triphosphate (GTP) par la protéine G, entraînant la dissociation des sous-unités alpha (Gαi, Gαq) et beta-gamma (β-γ). Les sous-unités β-γ demeurent à la membrane plasmique et activent la phospholipase C (PLC) qui catalyse la transformation du phosphatidylinositol 4,5-disphosphate (PIP2) en diacylglycérol (DAG) et
inositol 1,4,5-trisphosphate (IP3). La sous-unité α demeure également accrochée au feuillet interne de la
membrane plasmique et elle peut soit activer (Gαs) ou inhiber (Gαi) l’adénylate cyclase, modulant le niveau d’AMPc. Elle peut également activer la PLC (Gαq), augmentant le niveau d’IP3. Ce dernier entraîne l’ouverture
des canaux calciques de la membrane du réticulum endoplasmique (RE) et libère la réserve de calcium. L’ouverture subséquente des canaux calciques dépendants du calcium sur la membrane plasmique augmente le niveau de calcium intracellulaire. La formation du complexe calcium-calmoduline permet l’activation de la kinase de la chaîne légère de la myosine (MLCK de l’anglais myosin light chain kinase). Cette kinase phosphoryle les têtes de la chaîne légère de la myosine, leur permettant d’interagir avec les filaments d’actine et de causer le glissement actine-myosine. La phosphatase de la chaîne légère de la myosine (MLCP de l’anglais myosin light chain phosphatase) antagonise l’action de la kinase de ce mécanisme. L’activité de la MLCP est régulée par le niveau de GMPc et d’AMPc (Fig. 1.5). Le mécanisme de relaxation est décrit en détails à la figure 1.5. Celui-ci implique la liaison d’un facteur vasoactif à son GPCR (Gαs) ou la diffusion du NO à travers la membrane plasmique (Fig. 1.5) [Stull et al., 1991, Marieb, 2005].
1.3.3.3. Agents vasoactifs utilisés in vitro
1.3.3.3.1.
Histamine
L’histamine est une molécule vasoactive impliquée dans plusieurs processus liés à l’inflammation. L'histamine est synthétisée à partir de la L-histidine, un acide aminé essentiel, par l'enzyme histidine décarboxylase. Tel que mentionné dans les sections précédentes, elle agit de manière opposée si elle entre en contact avec l’endothélium ou directement avec les CML. On retrouve 4 isoformes de récepteurs de type GPCR (H1, H2, H3, H4) pour cette petite amine de 111 g/mol (C5H9N3). Les CE peuvent porter les récepteurs H1 et H3, mais
le récepteur H1 est le plus commun. La liaison de l’histamine au récepteur H1 (Gαq) sur la CE entraîne l’augmentation du calcium intracellulaire qui résulte en une augmentation de la perméabilité via la contraction de la CE et en la sécrétion du facteur d’activation des plaquettes, du facteur Von Willebrand, de PGI2 et de
NO. Ces deux derniers entraînent, entre autres, la relaxation de la media. Le récepteur H3 (Gαi) cause également l’augmentation de la perméabilité via l’inhibition de l’adénylate cyclase, diminuant le taux d’AMPc. Les CML portent les récepteurs H1 et H2 (Gαs). Le récepteur H1 cause la contraction du muscle lisse via une augmentation de calcium intracellulaire. Inversement, le récepteur H2 cause sa relaxation via la libération de AMPc par l’adénylate cyclase [Hill et al., 1997]. In vitro, la media reconstruite se contracte lors de l’ajout
d’histamine. La réponse du muscle lisse à l’histamine dépendra du nombre de récepteurs et de leur affinité spécifique pour l’histamine. Cette action opposée des récepteurs H1 et H2 permet à la cellule de moduler sa réponse à l’histamine en fonction d’autres facteurs pouvant agir sur l’expression génique des récepteurs [Falus, 2003, Wang et al., 2010b, Ohtsu, 2012].
1.3.3.3.2.
Thromboxane A2
Le TXA2 est un lipide de la famille des eicosanoïdes produit principalement dans les plaquettes par la TXA2 synthase à partir de la prostaglandine H2 qui, elle, est produite par la cyclo-oxygénase 1 (COX1). L’aspirine, inhibant de manière irréversible la COX1, bloque la production de TXA2. Le TXA2 possède des propriétés vasocontractiles et pro-thrombogéniques. Cet agent vasoconstricteur est particulièrement important dans les processus inflammatoires et dans la réponse aux blessures. Le récepteur du TXA2 est un GPCR (Gαq) dont deux isoformes sont connues (α et β). Le TXA2 étant très instable en solution, l’utilisation d’un analogue de cet agent, le 9,11-didéoxy-11α,9α-époxyméthanoprostaglandine F2α (U46619), est préférable en recherche [Huang et al., 2004].
1.3.3.3.3.
Sérotonine
La sérotonine ou 5-hydroxytryptamine (5-HT) est une monoamine dérivée du tryptophane et est à la fois neurotransmetteur et hormone. Dans le système vasculaire, la sérotonine est stockée dans les plaquettes. Lorsqu’elle se lie à son récepteur situé sur une CE, un GPCR (Gαi), elle active la eNOS entraînant la libération de NO par l’endothélium. En situation d’hémostase, la libération massive de sérotonine par les plaquettes lors de la formation du clou plaquettaire permet à cette molécule d’entrer en contact avec la media et de causer la contraction des CML [Vanhoutte, 2010].
1.3.3.3.4.
Nitroprussiate de sodium
Le nitroprussiate de sodium (SNP de l’anglais sodium nitroprusside) est un composé inorganique agissant comme vasodilatateur en libérant en solution des anions divalents [Fe(CN)5NO]2-, relâchant progressivement
du NO. Ce composé est utilisé en clinique pour traiter une hypertension aiguë. En recherche, le SNP sert à démontrer la capacité d’un vaisseau à se dilater de manière indépendante de l’endothélium. La demi-vie du SNP étant de 1 à 2 minutes seulement, le sel doit être dissous juste avant son utilisation [Murad, 1986, Friederich et al., 1995].
1.3.4. Inflammation
L’inflammation est définie comme une réaction de protection d’un tissu à une irritation, une blessure ou une infection. Elle se caractérise par de la douleur, de la chaleur, de la rougeur, de l’enflure et peut éventuellement