T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul Sabatier Discipline ou spécialité : Innovation pharmacologique
JURY
Pr. Angelo PARINI, Professeur des universités/Praticien Hospitalier, Toulouse Président Dr. Jane-Lise SAMUEL, Directrice de recherche à l'INSERM, Paris Rapporteur
Dr. Christos CHATZIANTONIOU, Directeur de recherche à l'INSERM, Paris Rapporteur Dr. Nassim FARES, Maître de conférence à l'Université Saint-Joseph, Liban Membre invité Dr. Jean-Loup BASCANDS, Directeur de recherche à l'INSERM, Toulouse Directeur de thèse
Ecole doctorale : Biologie - Santé - Biotechnologies Unité de recherche : INSERM U858 - Equipe 5 Directeur(s) de Thèse : Dr. Jean-Loup BASCANDS Présentée et soutenue par Rana Youssef CHAAYA
Le 15 octobre 2010
Titre : RÔLE DU STRESS OXYDANT INDUIT PAR LES MONOAMINE OXYDASES DANS LA
FIBROSE RÉNALE :
A
près un parcours de 5 ans d’étude supérieure en France et de 3 ans au sein de l’équipe 5 à l’INSERM U 858 (I2MR) CHU Rangueil à Toulouse, je voudrais remercier :Tout d’abord, Monsieur Angelo Parini de m’avoir fait l’honneur d’accepter de présider cette thèse et de m’avoir m’accueilli dans son institut. Merci pour ses conseils que je me souviendrais dans ma vie professionnelle.
Je remercie sincèrement Monsieur Christos Chatziantoniou et Madame Jane-Lise Samuel, d’avoir accepté d’être mes rapporteurs et d’avoir pris le temps de juger mon travail de thèse. Merci pour vos remarques constructives.
Je remercie Monsieur Nassim Fares qui a accepté d’établir cette thèse en collaboration entre l’université Saint-Joseph et l’université Paul Sabatier. Je le remercie pour sa patience et de m’avoir permis de réaliser une partie de mon travail au Liban dans les meilleures conditions.
Je tiens à remercier enfin mon directeur de thèse, Monsieur Jean-Loup Bascands. Je le remercie de m’avoir permis de réaliser ma thèse au sein de son équipe où j’ai pu découvrir le monde du rein et de la recherche. Il m’a toujours soutenu et encouragé dans les moments les plus difficiles de cette thèse et grâce à son excellent encadrement et ses conseils enrichissants, j’ai pu mener ce travail à bien et finir ma thèse dans les meilleures conditions.
Je remercie les personnes du laboratoire qui m’ont aidées durant cette thèse : Yoost P. Schanstra pour la relecture de mon article et ces nombreux conseils scientifiques et informatiques et Bénédicte Buffin-Meyer qui m’a aidé durant le monitorat avec ses conseils pédagogiques et ses connaissances parfaites dans la physiologie rénale.
Je tiens à remercier Céline Guilbeau-Frugier qui m’a aidé dans l’apprentissage de l’histologie rénale et qui a enrichi ma culture scientifique et lexique. Elle m’a soutenue dans les moments les plus difficiles et a su m’écouter et me donner les bons conseils.
Je remercie les personnes de la zootechnie qui m’ont appris à être efficace en faisant les expériences sur les animaux surtout je remecie Caroline Névoit pour son écoute et son soutien durant cette période et pour les repas qu’on a effectués ensemble.
Je remercie très chaleureusement mes amies du laboratoire Christelle et Chiara. Je vous remercie pour votre amitié qui m’été important durant ces années. Christelle, merci pour les corrections de ma thèse et de mon article et pour tes précieux conseils sur la langue française. Chiara merci pour ta générosité, ton sourire, ton amitié, tes délicats conseils et pour surtout les soirées italiennes.
Je remercie tous les amis libanais qui m’ont soutenu durant ces 5 ans en France et tous les amis toulousains. Merci pour les soirées pizza, les cinés, les randonnées….Vous étiez ma famille en France.
Pour finir, je dédie cette thèse à tous ceux qui me sont chers et pour tout l’amour qu’il me porte :
Ma mère Marie qui a toujours été là avec son amour, sa tendresse, sa patience, elle a su m’écouter et me supporter durant cette période, mon père Youssef qui sans lui je ne serais pas là aujourd’hui, mes frères et sœurs Georges et Maro qui m’ont toujours encouragés, écoutés et priés pour moi, Fadi et Christine qui été pour moi un exemple de force dans les moments difficiles et je remercie ma seconde famille Yazbeck : Georges, Minerva, Soli, Tera, Bach et Rosi.
Enfin, je remercie mon Paul, je ne trouve pas les mots pour le remercier pour son amour et son soutien mais je pourrai dire une chose…….Je remercie Dieu de l’avoir dans ma vie.
ABSTRACT
T
he deterioration of the kidney graft is characterized by progressive renal dysfunction accompanied by interstitial fibrosis and tubular atrophy (IFTA). Immunological and non-immunological stress are the main cause of progression towards IFTA. During my PhD, we focused on the non-immunological injuries induced by ischemia-reperfusion (IR) and cyclosporin toxicity (CsA) which remain two stress factors putting a damper on the outcome of the renal graft. In the kidney, a major endogenous source of reactive oxygen species (ROS) is the mitochondrial enzyme, monoamine oxidase (MAO). Our previous works in the laboratory showed that the blockage of the MAOs by the administration of the irreversible MAO-inhibitor pargyline (Pg) prevents H2O2 production in the early reperfusion stage following IR. However, the role of these enzymes on renal function and chronic diseases has still not been elucidated.The aim of my PhD work was to clarify the role of MAO-induced oxidative stress in renal fibrosis and to investigate the protective effect of early MAO inhibition on renal structure and function on the long-term.
Therefore, we used a rat model of IFTA consisting in unilateral nephrectomy followed by IR and daily CsA administration (IR +CsA). Two groups of rats received a single injection of Pg before or after IR. Animals were sacrificed at 7, 14 and 28 days after IR and renal function, histological alterations, inflammatory and fibrotic genes were evaluated.
Our results showed that the blockage of MAO by Pg either before or after IR improved renal function on the time-period studied and reduced significantly tubular necrosis and apoptosis observed at 7 days after IR+CsA. The prevention of the oxidative stress by Pg administered before IR leads to a net decrease in inflammation associated to lower IL-1 and TNF- genes expression, in TGF-1 expression and in necrosis and apoptosis at 28 days post IR+CsA. This protective effect was accompanied by a significant decrease in the accumulation of the ECM from 7 days as well as the normalization of antioxidant (SOD1, catalase) and inflammatory (COX2, LOX5) genes expression leading to inhibit the appearance of IFAT 28 days after IR+CsA.
In conclusion, our data strongly suggest that the blockage of MAO by pargyline pre-treatment may constitute an important new therapeutic target against IFTA progression during kidney transplantation.
RÉSUME
L
e rejet du greffon constitue un problème majeur dans le domaine de la transplantation rénale. En effet, l’apparition de la fibrose interstitielle et de l’atrophie tubulaire (FIAT) au sein du rein greffé évoluent progressivement vers l’insuffisance rénale chronique entraînant la perte totale du greffon. De nombreux facteurs immunologiques et non-immunologiques sont impliqués dans la FIAT. Parmi les facteurs non-immunologiques, on trouve le stress oxydant produit par l’ischémie reperfusion (IR) et la néphrotoxicité des immunosuppresseurs comme la ciclosporine (CsA). Ce stress oxydant caractérisé par la production massive d’espèces réactives d’oxygène (EROs) est essentiellement produit par les enzymes mitochondriales ; les monoamines oxydases (MAOs). Les MAOs produisent le peroxyde d’hydrogène (H2O2) en catalysant la déamination oxydative des amines biogènes. Des travaux de notre laboratoire montrent que l’administration de la pargyline (Pg), un inhibiteur irréversible des MAOs, avant IR bloque la production excessive d’H2O2 et diminue la mort cellulaire dans la phase précoce de la reperfusion.L’objectif de mon travail de thèse a été d’étudier l’implication du stress oxydant induit par les MAOs dans la fibrose rénale et d’évaluer si les effets protecteurs observés dans la phase aiguë se prolongeaient à plus long terme.
Pour cela, nous avons utilisé un modèle animal mimant la FIAT chez des rats ayant subi une néphrectomie unilatérale suivie d’une IR et d’un traitement quotidien à la CsA (IR+CsA). Deux groupes ont reçu une dose unique de Pg avant ou après IR. Les rats ont été sacrifiés à 7, 14 et 28 jours après IR et, la fonction rénale, les altérations histologiques et l’expression de gènes impliqués dans les processus inflammatoires et fibrotiques a été évaluée.
Nos résultats montrent que l’inhibition de la MAO par la Pg avant ou après IR améliore la fonction rénale et réduit significativement la nécrose et l'apoptose observée 7 jours après IR+CsA. A 28 jours, l’administration de la Pg avant IR diminue l'inflammation et l’expression du gène profibrosant TGF-. Cet effet protecteur est accompagné par une diminution de la mort cellulaire, de l'accumulation des composants de la matrice extracellulaire et d’une diminution de l’expression des gènes antioxydants (SOD1, catalase) et inflammatoires (COX-2, LOX5). L’ensemble de ces modifications est associé à une inhibition de l’apparition de la FIAT à 28 jours post IR+CsA.
En conclusion, nos résultats suggèrent fortement que l’inhibition de la MAO par un pré-traitement à la Pg puisse constituer une nouvelle cible thérapeutique inhibant l’apparition
TABLES DES MATIERES
INTRODUCTION
HISTORIQUE
I. ANATOMO-PHYSIOLOGIE RENALE I.1. Généralités 5I.2. Anatomie du rein 5
I.2.1. Néphron 6
I.2.1.a Glomérule rénal 6
I.2.1.b Tubules rénaux 7
I.2.2. Appareil juxtaglomérulaire 8
I.2.3. Vascularisation 9
I.2.4. Interstitium 9
I.3.Physiologie rénale 9
I.3.1. Filtration glomérulaire 9
I.3.2. Réabsorption tubulaire 10
I.3.3. Sécrétion tubulaire 10
I.3.4. Fonction endocrine 10
II. PHYSIOPATHOLOGIE DE L’INSUFFISANCE RENALE CHRONIQUE
I.1. Généralités 12
I.2. Causes 14
I.2.1. Néphropathies glomérulaires 14
I.2.2. Néphropathies tubulo-interstitielles 15
I.2.3. Néphropathies vasculaires 15
I.2.4. Néphropathies héréditaires 16
I.3. Facteurs de risques 16
I.4. Traitements 17
I.4.1. Avant le stade terminal : traitement conservateur 17
I.4.2. Au stade terminal : Dialyse 17
III. TRANSPLANTATION RENALE
III.1. Généralités 19
III.2. Rejet d’allogreffes 19
III.2.1. Rejet hyperaigu 20
III.2.2. Rejet aigu 20
III.2.3. Rejet chronique 21
III.3. Classification de Banff 21
III.3.1 Historique et principe 21
III.3.2 Diagnostic 22
IV. FIBROSE INTERSTITIELLE ET ATROPHIE TUBULAIRE : FIAT
IV.2. Lésions tubulo-interstitielles de la FIAT 24
IV.2.1. Lésions tubulaires 25
IV.2.2. Fibrose tubulo-interstitielle 25
IV.2.2.a Phase d’inflammation 27
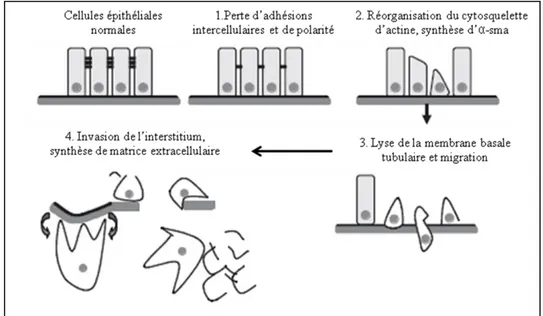
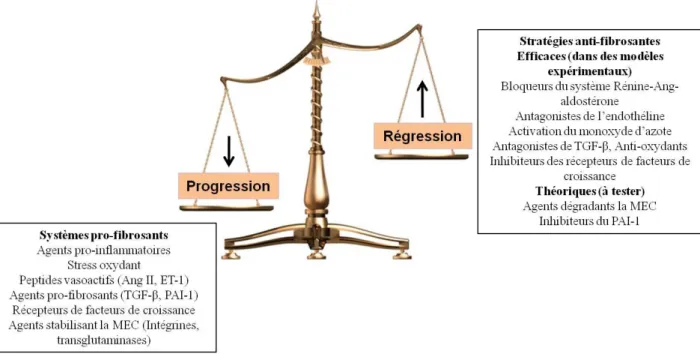
IV.2.2.b Phase d’apparition des myofibroblastes 28 IV.2.2.c Transition épithélio-mésenchymateuse 28 IV.2.2.d Accumulation d’accumulation de la MEC 30 IV.2.2.e Progression et régression de la fibrose 31 IV.2.2.f. Fibrose et transplantation 33
IV.3. Causes 34
IV.3.1. Facteurs immunologiques 35
IV.3.2. Facteur non immunologiques 35
V. TRAITEMENTS IMMUNOSUPPRESSEURS
V.1. Réponse immunitaire suite à une greffe 36
V.2. Différents traitements immunosuppresseurs 37
V.3. Inhibiteurs de la calcineurine : la ciclosporine A 40 V.4. Toxicité des inhibiteurs de la calcineurine 41
V.4.1. Néphrotoxicité aigue de la CsA 42
V.4.2. Néphrotoxicité chronique de la CsA 43
VI. STRESS OXYDANT ET ISCHEMIE REPERFUSION
VI.1. Stress oxydant et rein 45
VI.1.1. Espèces réactives de l’oxygène (EROs) 45
VI.1.2. Sources d’EROs 47
VI.1.3. Systèmes de défense contre les EROs 52
VI .2. Ischémie reperfusion rénale et stress oxydant 53
VI.2.1. Altérations biochimiques 53
VI.2.2. Lésions cellulaires 54
VI.2.3. Phénomènes inflammatoires 56
VI.2.4. Phase de régénération 57
VI.3. Implication du stress oxydant dans l’insuffisance rénale 58 VII. MONOAMINE OXYDASES
VII.1. Isoformes 59
VII.2. Organisation génomique 59
VII.3. Caractéristiques enzymatiques 60
VII.3.1. Réactions enzymatiques 60
VII.3.2. Cofacteur FAD 61
VII.3.3. Site catalytique 61
VII.3.4. Substrats et inhibiteurs 62
VII.4. Régulations 63
VII.5 .2.MAOs et organes périphériques 67
VII.5.3. MAOs rénales 68
VII.6. MAOs et stress oxydant 68
VII.6.1. Apoptose 68
VII.6.2. Prolifération cellulaire 69
VII.6.3. Hypertrophie cellulaire 69
MATERIELS ET METHODES
I. MODELE ANIMAL 72
I.1. Traitements pharmacologiques I.2. Néphrectomie unilatérale
I.3. Réalisation de l’ischémie reperfusion rénale
II. CREATININEMIE ET UREMIE 74
III. ANALYSE HISTOLOGIQUE 74
III.1. Rouge Sirius
III.2. Hématoxyline Eosine III.3. Acide périodique de Schiff
III.4. Analyse semi-quantitative des lésions III.5. Immunhistochimie
III.6. Terminal transferase-mediated dUTP Nick-End Labeling (TUNEL)
IV. ETUDE PROTEIQUE 77
IV.1. Préparation des protéines IV.2. Western Blot
IV.3. Activités enzymatiques IV.3.1. Activité de la MAO-A IV.3.2. Activité de la MMP-2
IV.4. Thiobarbituric Acid Reactive Substances (TBARS)
V. RT-PCR EN TEMPS REEL 79
VI. ETUDE STATISTIQUE 80
RESULTATS EXPERIMENTAUX
Première étude : Résultats à 7 jours post IR 85
Discussion des résultats à 7 jours post IR 97
Deuxième étude : Résultats à 14 jours post IR 101
Discussion des résultats à 14 jours post IR 110
Troisième étude : Résultats à 28 jours post IR 113
Discussion des résultats à 28 jours post IR 127
CONCLUSION
PERSPECTIVES
ABREVIATIONS (les plus fréquentes)
AA acide arachidonique Acs Anticorps
ADH Hormone anti-diurétique ADNc ADN complémentaires Ang II Angiotensine II
BMP Bone Morphogenic Protein BSA Bovine Serum Albumin Coll Collagène
COMT Catéchol-O-méthyltransferase CPA Cellules présentatrice d’antigène
CsA Ciclosporine A
CTGF Connective Tissue Growth Factor CYPs cytochrome P450
DAO Diamine oxidase
DFG Débit de filtration glomérulaire EPO Erythropoïétine
Erk1/2 Extracellular signal-regulated kinases ERN espèces réactives nitrogénées
EROs Espèces réactives de l’oxygène ET-1 Endothéline-1
FAD Flavine Adénine dinucléotide
FIAT Fibrose Interstitielle et Atrophie Tubulaire Figure R Figure résultat
GPX Glutathion peroxydase H2O2 Peroxyde d’hydrogène
HE Hématoxyline Eosine
HIOMT Hydroxyindole-O- méthyltransferase HLA Human leucocyte antigen
HLA Human leucocyte Antigen HTA Hypertension artérielle
ICAM InterCellular Adhesion Molecules ICN Inhibiteur de la calcineurine
IEC Inhibiteur de l'enzyme de conversion IMAO Inhibiteur des MAO
iNOS NO-synthase inductible IR Ischémie reperfusion IRA Insuffisance rénale aiguë IRC Insuffisance rénale chronique IRT Insuffisance rénale terminale
L T Lymphocyte T MAO Monoamine oxydase MEC Matrice extracellulaire MMP Métalloprotéinase matricielle
MPP N- méthyl -4-phénylpyridine
MPTP Méthyle –phényl-tétrahydropyridine NAC N-Acétylcystéine
Nx Néphrectomie
PAI-1 Plasminogen activator inhibitor-1 PAS Acide périodique de Schiff PEA Phényléthylamine
Pg Pargyline
RS Rouge sirius
SMA smooth muscle actin SNC système nerveux central SOD Superoxyde dismutase
SSAO Semicarbazide sensitive amine oxidase TBARS Thiobarbituric Acid Reactive Substances
TBST Tris Buffer Salt-Tween
TEM Transition épithélio-mésenchymateuse TGF-β Transforming Growth Factor - β
TIMP Tissue inhibitors of metalloproteases TNF- α Tumor Necrosis Factor-α
TUNEL Terminal transferase-mediated dUTP Nick-End Labeling 5-HT 5-hydroxytryptamine
LISTE DES FIGURES Figure 1 Anatomie du rein (page 5)
Figure 2 Coupe longitudinale à travers le cortex et la médulla externe (page 6) Figure 3 Le glomérule et l’appareil juxtaglomérulaire (page 8)
Figure 4 Les différentes fonctions du rein (page 11)
Figure 5 Incidence standardisée de l’insuffisance rénale terminale par âge dans les 2 sexes en France. (page 13)
Figure 6 Principales causes d’insuffisance rénale chronique en France (page 14) Figure 7 Survie post greffe (page 20)
Figure 8 Histologie des lésions tubulo-interstitielles rénales (page 26) Figure 9 Les principales étapes de la TEM (page 29)
Figure 10 Systèmes impliqués dans la progression et la régression de la fibrose rénale (page 32)
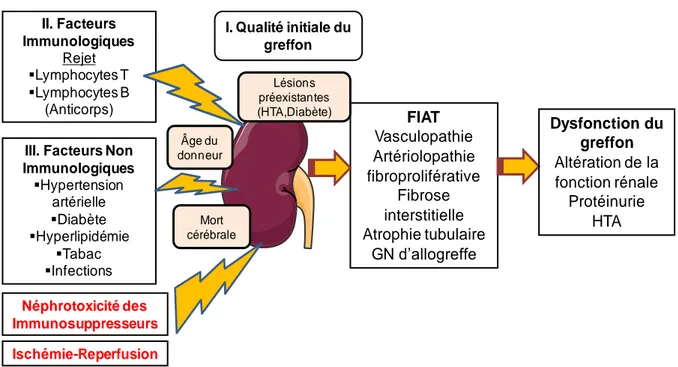
Figure 11 Physiopathologie de la fibrose dans le greffon rénal (page 34)
Figure 12 Facteurs immunologiques et non immunologiques de la dysfonction chronique de l’allogreffe (page 35)
Figure 13 Mécanismes d’activation du lymphocyte T (page 37) Figure 14 Sites d’actions des immunosuppresseurs (page 39) Figure 15 Mécanismes d’action de la ciclosporine A (page 41)
Figure 16 Physiopathologie de la néphrotoxicité de la ciclosporine A (page 42) Figure 17 Néphrotoxicité chronique induite par la CsA (page 44)
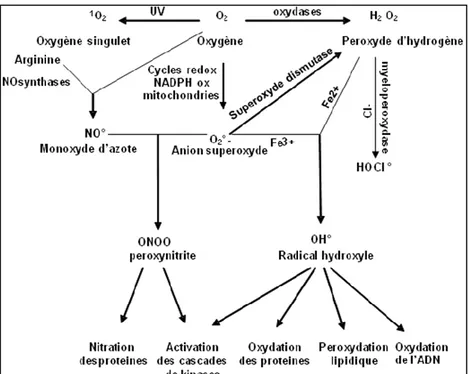
Figure 18 Origine des différents radicaux libres oxygénés primaires et leurs effets biologiques (page 48)
Figure 19 Extension des lésions d’ischémie reperfusion et ses conséquences (page 55)
Figure 20 Lésions tubulaires suite à l’ischémie reperfusion (page 56)
Figure 21 L’équilibre entre le stress oxydant et nitrosants dépend du flux de NO (page 57)
Figure 22 Structure tridimensionnelle des MAOs (page 62)
Figure 23 Néphrectomie du rein gauche des rats mâles Spragues Dawley (page 72) Figure 24 Protocol expérimental d’uninéphrectomie suivie d’une ischémie
reperfusion rénale et un traitement à la ciclosporineA chez des rats mâles Sprague Dawley (page 74).
LISTE DES TABLEAUX
Tableau 1 Classification internationale K/DOQI (page 13)
Tableau 2 Liste des principales néphropathies glomérulaires et vasculaires (page 15) Tableau 3 Critères semi-quantitatifs d’évaluation des lésions du greffon rénal
selon la classification de Banff (page 22)
Tableau 4 Classification de Banff 1997, revue en 2007: 6 catégories diagnostiques des biopsies de transplant rénal (page 23)
Tableau 5 Formes activées de l’oxygène (page 45)
Tableau 6 Principaux substrats et inhibiteurs des monoamine oxydases (page 63) Tableau 7 Expression des MAO-A et MAO-B dans différents tissus périphériques
humains (page 66)
Tableau 8 Liste de primers sens et anti-sens utilisés dans notre étude (page 80)
LISTE DES ANNEXES (Publications)
Annexe 1
Chaaya R, Alfarano C, Guilbeau-Frugier C, Coatrieux C, Kesteman AS, Parini A, Fares N, Gue M, Schanstra JP, Bascands JL. Pargyline reduces renal damage associated with ischemia-reperfusion and cyclosporin. Nephrology Dialysis and Transplantation 2010.
Annexe 2
Gonzalez J, Klein J, Chauhan SD, Chaaya R et al. Delayed treatment with plasminogen activator inhibitor-1 decoys reduces tubulointerstitial fibrosis. Exp Biol Med (Maywood) 2009;234 (12)1511-8.
Annexe 3
Klein J, Gonzalez J,Miravete M, Caubet C, Chaaya R, Decramer S, Bascands JL, Buffin-Meyer B, Schanstra JP. Congenital ureteropelvic junction obstruction: human disease and animal models. Int J Exp Pathol. 2010.
Introduction
L
’’insuffisance rénale chronique (IRC) correspond à un réel problème de santé publique en France et dans tous les pays industrialisés (USRDS 2008).Quelles que soient les causes initiales (diabète, infection, hypertension artérielle), l’IRC conduit à la perte progressive et souvent définitive des fonctions rénales. A partir du moment où l’IRC s’installe, elle s’aggrave progressivement pour aboutir à l’insuffisance rénale terminale (IRT). A ce stade de la pathologie, les patients nécessitent alors une suppléance par dialyse et/ou par transplantation.
La transplantation reste le traitement de choix des patients en IRT. Cependant même si la survie à un an du greffon a été nettement améliorée, il demeure un nombre non négligeable de cas présentant une dysfonction du greffon évoluant vers un rejet d’allogreffe. Ce rejet a longtemps été définie comme la « néphropathie chronique d’allogreffe », mais depuis 2005 ce terme a été remplacé dans la nouvelle classification de Banff par « FIAT », une terminologie descriptive associant fibrose interstitielle (FI) et atrophie tubulaire (AT) (Solez et al. 2007).
De nombreux facteurs immunologiques et non-immunologiques sont impliqués dans la FIAT (Cornell et al. 2005). Les facteurs immunologiques ont été et continuent à être très largement étudiés (Cornell et al. 2008). Parmi les facteurs non-immunologiques, on trouve principalement le stress oxydant induit par l’ischémie-reperfusion (IR) et la néphrotoxicité due à l’administration chronique des immunosuppresseurs tels que la ciclosporine A (CsA).
Le stress oxydant caractérisé par la production massive d’espèces réactives de l’oxygène (EROs) lors de la reperfusion joue un rôle important dans la dysfonction d’allogreffe. Plusieurs études ont montré qu’il entraîne la mort des cellules tubulaires rénales par apoptose ou par nécrose après IR (Legrand et al. 2008). Le traitement des patients par les immunosuppresseurs tels que la CsA est essentiel pour diminuer le risque de rejet aigu du greffon. Toutefois les effets vasoconstricteurs de la CsA augmentent le stress oxydant et induisent une néphrotoxicité associée à l’apparition d’une fibrose interstitielle (Djamali 2007).
Au niveau rénal, le stress oxydant est en majorité généré par des enzymes mitochondriales : les monoamine oxydases (MAOs). Ces derniers produisent du peroxyde d’hydrogène (H2O2) en catalysant la déamination oxydative des amines biogènes (noradrénaline, sérotonine, dopamine). Toutefois, peu de travaux ont étudié leur rôle dans l’initiation et la progression des maladies rénales chroniques.
Introduction
Des travaux effectués dans notre laboratoire sur un modèle d’IR rénale unilatérale ont montré que l’administration de pargyline (Pg), un inhibiteur irréversible des MAOs, avant IR bloque la production d’H2O2 (Kunduzova et al. 2002). L’inhibition de cette production préserve l’intégrité du parenchyme rénal et diminue l’apoptose et la nécrose dans la phase aiguë de la reperfusion (jusqu’à 3 jours) (Kunduzova et al. 2002). Cependant, il n’existe pas à l’heure actuelle de thérapie satisfaisante permettant d’atténuer les lésions rénales chroniques induites par l’IR associée à la CsA.
L’objectif de notre travail a été d’étudier l’implication du stress oxydant induit par les MAOs dans l’apparition et le développement de la fibrose rénale sur un modèle d’IR aggravé par un traitement à la CsA chez le rat (IR+CsA) à 7, 14 ou 28 jours. Nos résultats apportent des éléments supplémentaires dans la compréhension de la pathogenèse de la fibrose rénale.
Anatomo-physiologie rénale
I.ANATOMO-PHYSIOLOGIE RENALE
I.1. Généralités
Les reins sont deux organes vitaux situés de part et d’autre de la colonne vertébrale, en dessous du diaphragme, et composent l’appareil urinaire avec les uretères, la vessie et l’uretère (Figure 1A). Le néphron est l’unité structurale et fonctionnelle du rein. Plusieurs néphrons forment les pyramides de Malpighi, entre les pyramides, se trouvent les colonnes rénales où cheminent les vaisseaux sanguins et les nerfs (Figure 1B) (Bonsib 2007).
I.2. Anatomie du rein
Le rein est formé de deux régions distinctes : le cortex, zone superficielle de couleur brun rougeâtre et la médullaire, plus profonde et plus pâle (Figure 1C).
Figure 1: Anatomie du rein
A) Position des reins dans le corps humain. B) Coupe longitudinale d’un rein. C) Pyramide médullaire et néphron. (D) Néphron (Adaptée de
Anatomo-physiologie rénale
I.2.1. Néphron
Chaque rein en contient environ un million chez l’homme, liés entre eux par des vaisseaux sanguins, des nerfs et des capillaires lymphatiques. Chaque néphron est constitué d’un glomérule et d’un tubule rénal. Le tubule est formé successivement d’un tubule proximal comportant deux segments, l’un contourné et l’autre droit descendant, une anse de Henlé, un tubule distal formé de deux parties, l’une contournée à la base de laquelle se trouve la macula densa et l’autre droite qui est le tube connecteur et le canal collecteur (Figure 1D) (Noël 2008). Les trois fonctions principales du néphron sont : i) la filtration glomérulaire du plasma des capillaires glomérulaires vers la lumière tubulaire ; ii) la réabsorption du liquide tubulaire vers la lumière des capillaires péritubulaires et ii) la sécrétion tubulaire du plasma des capillaires péritubulaires vers la lumière tubulaire.
I.2.1.a Glomérule rénal
Le glomérule, situé dans le cortex (Figure 2), est une sphère globulaire constituée par un bouquet compact de capillaires liés entre eux appelés « capillaires glomérulaires » (Figure 3). Ces derniers possèdent un pôle vasculaire, correspondant à la zone de connexion des artérioles afférente et efférente avec le glomérule et un pôle urinaire correspondant à la zone où débute le tubule contourné proximal.
Figure 2: Coupe longitudinale à travers le cortex et la médulla externe
Sur cette photomicrographie, on distingue le cortex et la médulla externe. La majorité des glomérules rénaux se trouvent dans le cortex (flèches noirs).
Le glomérule est entouré par la capsule de Bowman formée de deux feuillets de cellules : le feuillet viscéral ou interne et le feuillet pariétal ou externe. Le feuillet pariétal de la capsule de Bowman est constitué d’une lame basale pariétale et d’un épithélium pariétal. L’espace situé entre la capsule de Bowman et la structure interne du glomérule forme la chambre glomérulaire (chambre urinaire) contenant l’ultrafiltrat glomérulaire ou urine primitive. Les podocytes sont les cellules qui forment le feuillet viscéral de la capsule. Elles
Anatomo-physiologie rénale
entourent les capillaires glomérulaires, notamment grâce à des prolongements cytoplasmiques ou pieds. Le réseau dense formé par ces prolongements représente une structure importante du filtre glomérulaire. Le sang pénètre dans les reins par l’artère qui se divise ensuite progressivement en branches plus petites pour former les capillaires glomérulaires. C’est à travers la mince paroi du capillaire que filtre l’urine primitive, opération initiale de la formation de l’urine. Le mésangium est un tissu situé au centre du capillaire glomérulaire. Il est formé principalement par des cellules mésangiales entourées par une matrice mésangiale. Les cellules mésangiales ont des propriétés contractiles, macrophagiques et peuvent synthétiser de la MEC. En se contractant, les cellules mésangiales contrôlent le flux sanguin dans les capillaires et influencent ainsi la filtration glomérulaire.
I.2.1.b Tubules rénaux
Tubule proximal
Le tubule proximal est la partie la plus longue du tube. Il comprend le tube contourné proximal situé dans le cortex, et une portion droite située dans la médullaire (Figure 1D). La membrane apicale des cellules du tubule proximal se caractérise par l’abondance des microvillosités qui lui donnent son aspect de bordure en brosse et ont pour effet d’augmenter la surface d’échange entre la lumière et les cellules. La membrane basolatérale est caractérisée par de très nombreux replis ou invaginations entre lesquels les mitochondries sont accumulées. Le tube proximal assure la réabsorption de 75% de l’eau et des électrolytes. Dans les conditions physiologiques normales, le glucose, les acides aminés et les bicarbonates sont totalement réabsorbés.
Anse de Henlé
Elle prolonge la partie terminale du tubule proximal. Elle comporte une branche descendante fine qui descend dans la médulla et une branche ascendante large remontant vers la médulla et des cellules hautes avec des villosités à leur surface. Ce segment du néphron joue un rôle important dans la dilution et la concentration de l’urine et réabsorbe environ 25% du Na+ filtré.
Tubule distal
Le tubule distal chemine entièrement dans la médulla, et comporte deux portions : une portion droite et une portion contournée. Les cellules qui composent ce tubule sont hétérogènes, ne possèdent pas de bordure en brosse et ont moins de mitochondries que celles
Anatomo-physiologie rénale
du tubule proximal. Le tubule contourné distal possède l’activité Na/K ATPase la plus grande du tubule rénal et est responsable de la réabsorption des Na+, Cl- et des ions Ca2+.
Tubule collecteur
Il se compose de la fin du tubule distal, du canal collecteur cortical et du canal collecteur médullaire externe et interne (Figure 1C). Les cellules du tube collecteur sont de deux types : les cellules principales et les cellules intercalaires. Les cellules principales constituent le type le plus représenté et ont un aspect clair car leur cytoplasme est pauvre en mitochondries. Ces cellules réabsorbent activement environ 2% du Na+ filtré et sécrètent le K+ en présence d’aldostérone. Les cellules intercalaires ou foncées sont responsables de l’acidification urinaire.
I.2.2. Appareil juxtaglomérulaire
L’appareil juxtaglomérulaire est une petite structure spécialisée située au pôle vasculaire du glomérule. Elle est constituée par la terminaison de l’artériole afférente, la partie initiale de l’artériole efférente, le mésangium extraglomérulaire, les cellules juxtaglomérulaires et la macula densa. Elle joue un rôle dans le maintien de la pression sanguine et du volume plasmatique (Figure 3).
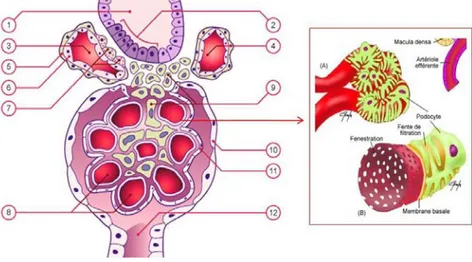
Figure 3 : Le glomérule et l’appareil juxtaglomérulaire.
(1) Tube droit distal (2) Macula densa (3) Artériole afférente (4) Artériole efférente (5) Cellules musculaires de la paroi de l’artériole (6) Endothélium (7) Cellules juxtaglomérulaires (8) Capilaires glomérulaires (9) Cellules mésangiales (10) Feuillet pariétal de la capsule de Bowman (externe) (11) Feuillet viscéral de la capsule de Bowman (interne) (12) Tubule contourné proximal (13) A. Podocyte B. membrane de filtration (Adapté
Anatomo-physiologie rénale
I.2.3. Vascularisation
Le rein est un organe très vascularisé. Il reçoit environ 1,2 litres de sang chaque minute (20% du débit cardiaque total). On y trouve deux réseaux de capillaires en série : un réseau de capillaire glomérulaire artério-artériel et un réseau de capillaires péritubulaires. La majeure partie du sang perfuse le cortex (90%), seuls 10 à 20 % vont dans la médullaire. Cette dernière est donc sensible à l’hypoxie et à l’ischémie. Une partie de la vascularisation de la médulla va entourer l’anse de Henlé, c’est la vasa recta (Figure 1D).
I.2.4 Interstitium
L’interstitium du rein correspond aux espaces extravasculaires intertubulaires. A l’état normal, il est quasiment virtuel puisque les tubes sont accolés les uns aux autres et jointifs. Le volume occupé par l’interstitium dans le cortex est estimé entre 5-10%, alors qu’il est de 40% dans la médullaire profonde.
I.3. Physiologie rénale
Le rein assure plusieurs fonctions essentielles pour l’organisme: il maintient l’équilibre hydro-électrolytique et acido-basique ; Il élimine les déchets d’origines métaboliques (urée, acide urique et créatinine) ainsi que les produits de dégradation des molécules endogènes et/ou exogènes (toxines, médicaments). En plus de sa fonction d’excrétion et d’épuration, le rein possède une fonction endocrine et joue un rôle dans le maintien de la pression artérielle par l’intermédiaire du système rénine angiotensine (Figure 4) (Gougoux 1999).
I.3.1. Filtration glomérulaire
La fonction du glomérule est de filtrer le sang des capillaires glomérulaires et de former l'urine primitive. Cette filtration, passive, est due au gradient de pression qui existe entre la pression artérielle de l'artériole afférente et la pression, plus basse, du glomérule lui-même. Elle se fait librement pour les molécules de petit poids moléculaire, comme l’eau, les électrolytes et les petits peptides. Les protéines de gros poids moléculaire (70 kDa) ne sont pas filtrées sauf lors d’une dysfonction glomérulaire.
Dans les conditions physiologiques, le débit de filtration glomérulaire (DFG) est de 120 ml/min et correspond au volume du filtrat de l’ensemble des glomérules par unité de
Anatomo-physiologie rénale
temps. Environ 180 litres de sang sont filtrés chaque jour et l’urine primitive ainsi formée est réabsorbée à 99 % dans les tubules produisant 1,5 litres d'urine par jour.
I.3.2. Réabsorption tubulaire
La réabsorption tubulaire permet l’obtention de l'urine définitive. En effet, au niveau des tubules rénaux s’effectue des processus de réabsorption. Ces mécanismes permettent de réguler la perte de certains constituants importants pour maintenir l’homéostasie. En effet, l’eau et de nombreux ions et solutés (sodium, potassium, bicarbonates, glucose, ions H+
, etc) filtrés par le glomérule sont réabsorbés entièrement ou dans des proportions différentes dans le sang. La réabsorption met en jeu de nombreux transporteurs (canaux ioniques, pompes, etc.) qui sont sous le contrôle de plusieurs facteurs hémodynamiques et neuro-hormonaux.
I.3.3. Sécrétion tubulaire
La sécrétion tubulaire permet le passage de molécules du sang des capillaires péri-tubulaires vers le filtrat à travers les cellules du tubule. Elle permet l’élimination dans l'urine les substances non filtrées par le glomérule. Les mécanismes sont comparables à ceux de la réabsorption tubulaire.
I.3.4. Fonction endocrine
Hormis sa fonction principale de filtration et d'épuration du sang, le rein possède une fonction endocrine en synthétisant plusieurs hormones comme l’érythropoïétine (EPO), le calcitriol et la rénine (Figure 4).
La rénine joue un rôle important dans la régulation de la pression artérielle. En effet, elle est impliquée dans la production d’angiotensine II (Ang II), peptide hypertenseur majeur. L’Ang II est capable de réguler la sécrétion d’aldostérone et d’adrénaline, stimulant la vasoconstriction et la réabsorption de sodium.
L'EPO, hormone de nature glycoprotéique, est synthétisée essentiellement au niveau du cortex rénal (près de 90% de la production). Cette hormone constitue un facteur de croissance pour les précurseurs des globules rouges dans la moelle osseuse et entraîne par la suite une augmentation du nombre de globules rouges dans le sang. Elle est stimulée par la baisse de la pression partielle de l’oxygène qui se répercute au niveau des artères rénales.
Le calcitriol est la forme physiologiquement active de la vitamine D. Sa production est régulée par une diminution de la calcémie ou par l’hormone parathyroïdienne (PTH). Le
Anatomo-physiologie rénale
calcitriol agit au niveau intestinal en stimulant l’absorption du calcium et du phosphore et favorise la résorption osseuse en association avec la PTH.
Figure 4 : Les différentes fonctions du rein.
A. Maintien de l’homéostasie hydro-électrolytique et acido-basique.
Insuffisance rénale chronique
II. PHYSIOPATHOLOGIE DE L’INSUFFISANCE RENALE CHRONIQUE II.1.Généralités
Un rein normal peut assurer ses fonctions pendant très longtemps puisqu’il lui suffit d’avoir seulement 20% de ses néphrons pour fonctionner. Lorsque les lésions rénales touchent plus de 80% du rein, l’insuffisance rénale chronique (IRC) s’installe. L’IRC se définit par une diminution progressive souvent définitive des fonctions du rein. Elle se caractérise par une perte graduelle des néphrons fonctionnels et se traduit par un ensemble d’anomalies rénales structurelles et de troubles cliniques (Briançon S 2007). La gravité de l’IRC est estimée par le débit de filtration glomérulaire (DFG) à partir d’un marqueur endogène, la créatinine plasmatique. En effet, la créatinine est un produit issu du catabolisme de la créatine musculaire avec des valeurs plasmatiques stables situées entre 50-90 µmol/l chez la femme et entre 80-115 µmol/l chez l’homme. La créatinine est excrétée essentiellement par le rein par filtration glomérulaire ; donc toute élévation de sa concentration plasmatique (à 125-150 µmol/l) doit correspondre à une diminution de sa filtration glomérulaire (Simon 2007). De ce fait, la créatininémie est utilisée en clinique pour estimer le DFG à l’aide de la formule de « Cockcroft et Gault » (pour les sujets < 80 ans) qui calcule la clairance de la créatininémie (Ccr) :
Ccr = [140- âge (années) x poids (Kg) x k / Créatininémie (µmol/l) k = 1,23 chez l’homme
k= 1,04 chez la femme
Le résultat doit ensuite être rapporté à la surface corporelle pour exprimer le DFG en ml/min/1,73m2. L’évolution de l’IRC se manifeste essentiellement par une diminution de la filtration glomérulaire avec l’augmentation de la créatinine (créatininémie) et de l’urée plasmatiques (urémie). L’estimation du DFG permet de définir 5 stades des maladies rénales chroniques (classification internationale K/DOQI) (Tsukamoto 2004) (Tableau 1).
Insuffisance rénale chronique
Tableau 1: Classification internationale K/DOQI
A partir du moment où l’IRC s’installe, elle s’aggrave progressivement pour aboutir à l’insuffisance rénale terminale (IRT). Le patient présente au stade évolué une perte définitive et irréversible de la fonction d’épuration et d’homéostasie rénale qui nécessite le recours à l’épuration extra-rénale (hémodialyse ou dialyse péritonéale) et/ou à la transplantation rénale. De ce fait, l’IRC représente aujourd’hui un problème majeur de santé publique (Meguid El Nahas et al. 2005) et conduit les autorités sanitaires à mettre en place des méthodes de dépistage précoce des maladies rénales et de prévention de l’IRT .
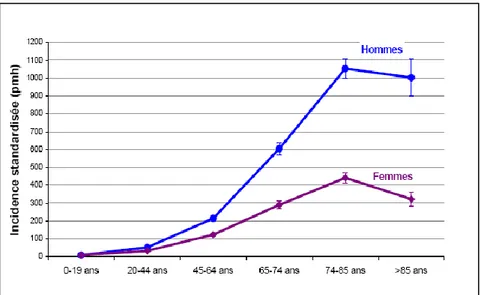
L’IRC et l’IRT sont aujourd’hui 4 fois plus fréquentes après 75 ans que dans la période de moins de 20 ans et 1,7 fois plus fréquentes chez l’homme que chez la femme (selon le registre REIN 2008) (Figure 5).
Figure 5: Incidence standardisée de l’insuffisance rénale terminale par âge dans les 2 sexes en France.
Insuffisance rénale chronique
Le nombre de patients en IRC dans le monde est en augmentation de 8% par an. En France, on compte entre 1,74 et 2,5 millions de personnes en IRC, près de 37000 patients dialysés et 31,000 greffés (REIN 2008). Durant cette dernière année, 9300 nouveaux malades ont débuté un premier traitement de suppléance en France avec un âge médian de 70 ans, 2846 malades ont été greffé et 6595 sont toujours en attente d’une greffe (REIN 2008).
II.2. Causes
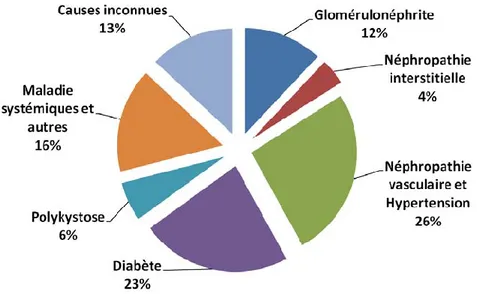
Les causes conduisant à l’IRC sont très variées ainsi que leurs rythmes de progression vers l’IRT (Simon 2007). Certaines sont primitives affectant directement les reins, d’autres sont secondaires résultant des maladies touchant l’organisme telles que le diabète et l’hypertension. Les maladies rénales sont classées selon le mode de classification anatomo-clinique ; le fil conducteur étant la lésion initiale prédominante du compartiment rénal touché. On distingue donc les néphropathies glomérulaires, tubulo-interstitielles, vasculaires et héréditaires. Selon la vitesse et la durée d’évolution de la maladie rénale, on distingue les néphropathies aiguës ou chroniques (Simon 2007) (Figure 6).
Figure 6: Principales causes d’insuffisance rénale chronique en France (Rapport annuel REIN 2008).
II.2.1. Néphropathies glomérulaires
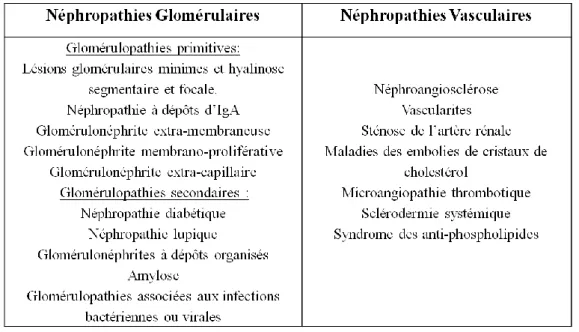
On distingue la glomérulopathie primitive qui représente 11,7 % des causes d’IRC en France (REIN 2008). Il s’agit de maladies qui affectent les glomérules comme la hyalinose segmentaire et focale et la néphropathie à dépôts d’IgA. En outre, les glomérulopathies
Insuffisance rénale chronique
secondaires sont une cause d’IRC de plus en plus fréquente en France (22,9 %). Les principales causes de néphropathie glomérulaire sont représentées dans le Tableau2.
II.2.2. Néphropathies tubulo-interstitielles
Une seconde catégorie de maladies causales est la néphropathie interstitielle (4,1 %) qu’elle soit d’origine obstructive ou infectieuse ou due à une consommation prolongée d’analgésiques, d’anti-inflammatoires et d’immunosuppresseurs. Cette maladie affecte principalement l’interstitium rénal avec des lésions fibrotiques ou inflammatoires et une atteinte secondaire des glomérules, des tubules et des vaisseaux (REIN 2008).
II.2.3. Néphropathies vasculaires
Les néphropathies vasculaires représente 26 % des cas d’IRT (REIN 2008) en France et comporte 3 formes en fonction du calibre du vaisseau atteint i) la néphroangiosclérose, conséquence de l’hypertension artérielle (HTA) et affectant les artères de petit calibre, ii) la néphropathie par embolie cholestérolique et iii) la néphropathie ischémique par sténose des artères de gros calibre. En effet, les altérations vasculaires rénales induisent une diminution de la perfusion rénale et stimulent le système rénine-angiotensine entraînant une hypertension systémique (Tableau 2).
Insuffisance rénale chronique
II.2.4. Néphropathies héréditaires
Parmi les néphropathies héréditaires, la polykystose est la plus fréquente. Du faite de sa transmission autosomique dominante, elle affecte à égalité les deux sexes et représente 6,3 % des causes d’IRC (REIN 2008).
Il reste encore 13,1 % des causes d’IRC inconnues (Figure 6). Cela est dû à la présentation tardive des malades au sein des centres d’hospitalisation et à la difficulté d’un diagnostic dans le stade avancé de la maladie. La nécessité de connaître la cause dans les stades initiaux d’IRC constitue un défit important puisque d’une part, il peut encore être temps de ralentir ou d’arrêter la destruction du rein (d’après le rapport annuel REIN 2008) et d’autre part, certaines maladies rénales peuvent récidiver sur un rein transplanté. Il est donc nécessaire de les avoir identifiées chez les sujets susceptibles d’être transplantés un jour.
II.3. Facteurs de risques
Indépendamment de la néphropathie initiale causale, l’hypertension artérielle, le diabète ou bien la protéinurie aggravent la progression de l’IRC.
Hypertension artérielle
L’HTA ou néphropathie vasculaire est l’une des principales causes d’IRT (26 %). Elle représente un facteur de progression de l’IRC (Taal et al. 2006). En effet, l’augmentation de la tension artérielle systémique est transmise aux capillaires glomérulaires contribuant à l’hypertension glomérulaire et donc au développement des lésions glomérulaires.
Diabète
Le diabète, classé dans la catégorie des glomérulopathies secondaires, est la 2ème cause d’IRT en France (22,9 %). Elle participe également à la progression de l’IRC (Taal et al. 2006). En effet, l’hyperglycémie chronique lors du diabète, aboutit à la formation de produits terminaux de glycation avancée (AGE, Advanced Glycation End-Products). Les AGEs entraînent à leur tour un stress oxydatif et inflammatoire favorisant la détérioration du rein (Meerwaldt et al. 2009).
Protéinurie
La protéinurie est considérée depuis longtemps comme un marqueur de l’IRC puisque la présence de protéines dans les urines reflète une atteinte de la barrière de filtration glomérulaire. Cependant, plusieurs études ont montré qu’une augmentation de la protéinurie était associée à la progression de l’IRC et participait au déclin de la fonction rénale. Cet effet est indépendant des autres facteurs de risques tels que l’HTA (Zoja et al. 2004).
Insuffisance rénale chronique
II.4 Traitements
II.4.1. Avant le stade terminal : traitement conservateur
On désigne par traitement conservateur le traitement médical de l’IRC au stade prédialytique. La mise en place d’un tel traitement est difficile dans la mesure où la maladie rénale reste longtemps silencieuse et asymptomatique. De ce fait les patients sont rarement détectés. Cependant, ce traitement est important dans la mesure où il permet de ralentir, voire d’arrêter la progression de l’IRC. Le principe repose d’une part sur la néphroprotection avec la mise en place de mesures diététiques et pharmacologiques permettant de réduire la protéinurie (restriction protidique, inhibiteur de l’enzyme de conversion, etc.) et d’autre part sur la cardioprotection dont le but est de limiter l’atteinte cardiovasculaire, cause principale de morbidité et de mortalité chez les insuffisants rénaux (anti-hypertenseurs, diurétiques, suppléments calciques). En outre, ce traitement corrige les complications métaboliques et symptomatiques de l’IRC (trouble phosphocalcique, hyperparathyroïdie secondaire, acidose). La seule précaution à prendre durant ce traitement est de respecter impérativement la qualité de vie des patients ainsi qu’un état nutritionnel sain.
II.4.2. Au stade terminal
Les insuffisants rénaux ont recours à deux traitements: la dialyse ou la transplantation rénale (partie développée dans le chapitre suivant).
Dialyse
Ce mode de suppléance concerne actuellement près d’un million d’individus à travers le monde et des milliers en France (Baubeau et al.2004). C’est probablement la première technique médicale utilisant une « machine » qui permet d’assurer la survie du patient tout en préservant relativement sa qualité de vie et en respectant son autonomie. Le principe de la dialyse repose sur l’échange entre le sang du malade et une solution de dialyse (dialysat) proche de celle du plasma normal à travers une membrane semi-perméable.
De nos jours, deux modalités de dialyse sont disponibles en fonction du type de membrane utilisée (Greneche et al. 2005). L’hémodialyse ou dialyse extracorporelle se fait sur un circuit de circulation extracorporelle à travers une membrane artificielle. Cela concerne 89 % des patients dialysés pour plusieurs séances par semaine (12-15 heures par semaine). La dialyse péritonéale ou dialyse intracorporelle est une méthode actuellement courante utilisant le propre péritoine du patient comme membrane (Lobbedez et al. 2009). Cette méthode donne
Insuffisance rénale chronique
Souvent réservée au sujet âgé, elle permet de réduire les dépenses de la prise en charge des patients en IRC. La dialyse corrige les complications de l’insuffisance rénale et cela en favorisant l’extraction des déchets azotés et des toxines urémiques, ainsi que l’ajustement de l’équilibre hydro-électrolytique des reins détruits. Par contre, cette technique ne permet pas de compenser les fonctions endocrines que les reins normaux assurent. La durée de vie des patients dialysés est très variable en fonction de l’état de la pathologie et de l’âge du patient mais des survies extrêmement prolongées au-delà de 30 ans sont la règle.
Toutefois, la dialyse rénale entraîne des altérations pathologiques (McCarley et al. 2008) dues à des infections ou bien à la production des cytokines par les cellules inflammatoires lors du contact avec la membrane utilisée. Parmi les pathologies, l’amylose est une atteinte articulaire douloureuse et invalidante observée chez les dialysés après 7 à 10 ans de dialyse.
Transplantation rénale
III. TRANSPLANTATION RENALE
III.1 Généralités
La transplantation rénale est le traitement de choix des patients parvenus au stade final de l’IRC (5000 nouveaux cas d’IRT/an en France). Ce traitement représente une alternative de la dialyse et offre un allongement de l’espérance de vie ainsi qu’une meilleure qualité de vie (Kovacs et al. 2010) sans restriction diététique ou physique. La première transplantation rénale réussie remonte à l’année 1956. Elle a été effectuée entre des jumeaux homozygotes par John Merril et Joseph Murray à Boston (Merrill et al. 1956). La même année, Jean Hamburger a effectué la première transplantation rénale à Paris entre deux non-jumeaux (Hamburger et al. 1956). Depuis, plus de 450 000 transplantations rénales ont été effectuées dans le monde entier dont près de 35 000 en France. La transplantation rénale est la plus fréquente des greffes d’organes (50% des transplantations en France) et peut être réalisée soit à partir de donneurs vivants (5 %) soit de donneurs en état de mort cérébrale (95 % des cas). Selon le rapport de l’agence de la biomédecine en 2009, 2826 greffes rénales ont été réalisées en France alors qu’il y a 6893 personnes inscrites sur la liste d’attente. Cette pénurie de greffes sera résolue en augmentant le nombre de prélèvements de reins de cadavre ou via le recours aux donneurs vivants apparentés et «marginaux» (Merville 2007). On qualifie de « donneurs marginaux » l’ensemble de donneurs dont le greffon est à risque de moins bonne fonction à long terme (donneurs décédés de cause cardiovasculaire, âgés, ayant présenté un arrêt cardiaque, ect.).
L’évolution de la transplantation au cours des années reste chargée de plusieurs complications, les unes touchant le greffon lui-même (crise de rejet, problème chirurgical, âge du donneur, mort cérébrale), les autres secondaires dues aux traitements immunosuppressifs ou à d’autres complications cliniques et métaboliques liées à la maladie initiale affectant le rein. En revanche, des progrès considérables ont été réalisés dans la compréhension des mécanismes du rejet et de la tolérance, dans le développement de nouveaux traitements immunosuppresseurs et dans la prévention de leurs effets secondaires.
III.2 Rejet d’allogreffes
Suite à la transplantation, le rejet d’allogreffe est une des principales causes de la dysfonction du greffon.
Actuellement en tenant compte de l’ensemble des patients transplantés, la probabilité de survie du greffon est de 92,8 % à un an de la greffe, 80,4 % à 5 ans pour atteindre 63 % 12
Transplantation rénale
ans après la greffe selon le rapport de la Biomédecine 2008 (Figure 7). Selon l’ordre chronologique d’apparition, on distingue plusieurs types de rejet d’allogreffe: le rejet hyperaigu, aigu et le rejet chronique.
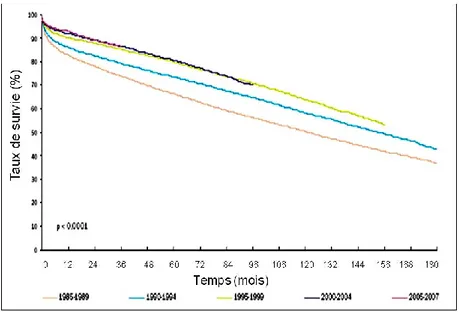
Figure 7 : Survie post greffe
Survie du greffon rénale selon la période de la greffe
(Rapport Biomédecine 2008).
III.2.1. Rejet hyperaigu
Le rejet hyperaigu du rein transplanté se produit très rapidement après la greffe. C’est une complication grave due à la présence d’anticorps (Acs) circulants chez le receveur dirigés contre le système HLA (Human leucocyte Antigen) du rein du donneur. Ce rejet est devenu très rare aujourd’hui avec la pratique systématique du cross match avant la transplantation. Le cross match est un test effectué au préalable de la transplantation qui vise à mettre en évidence la présence dans le sérum du receveur d’Acs dirigés contre les antigènes HLA du greffon. Ce rejet survient dès les premières minutes suivant le déclampage artériel ou parfois de manière retardée (2ème – 15ème Jour) avec l’apparition d’une infiltration cellulaire modérée et de lésions vasculaires suite à l’agression tissulaire.
III.2.2. Rejet aigu
Ce type de rejet survient dans les 3 premiers mois de la transplantation. Il s’agit de l’invasion du greffon par les lymphocytes du receveur. Cela entraîne une altération rapide de la fonction rénale avec une augmentation de la créatininémie, une infiltration lymphoïde de
Transplantation rénale
l’interstitium et une altération des tubes conduisant à une nécrose tubulaire aigue. La plupart des rejets aigus (90 %) sont à médiation cellulaire mettant en jeu les LT CD8+ (Lymphocyte T). En revanche les rejets aigus à médiation humorale (Acs contre le greffon) sont plus rares. Le rejet aigu cellulaire est souvent réversible et plusieurs crises surviennent chez environ 50 % des patients surtout si le rein est prélevé à partir d’un cadavre. Le traitement se fait immédiatement avec des fortes doses de corticostéroïdes.
III.2.3. Rejet chronique
Ce rejet est considéré comme étant la principale cause de l’échec de la transplantation rénale puisque environ 40% des patients transplantés perdent leurs greffons 10 ans après l’intervention chirurgicale (REIN 2008). Ce rejet s’installe progressivement lorsque plusieurs épisodes de rejet aigu se sont produits. Il correspond à une altération lente et irréversible du parenchyme rénal et se traduit par un dysfonctionnement de la fonction rénale.
III.3 Classification de Banff
III.3.1. Historique et principe
La classification de Banff, établie la première fois en 1993 dans la ville de Banff au Canada (Solez et al. 1993) permet d’analyser et de quantifier les lésions qui apparaissent dans les allogreffes rénales selon une grille descriptive (lésions vasculaires, interstitielles, tubulaires et glomérulaires) et d’établir un diagnostic reproductible (Racusen et al. 1999). Cette classification révisée récemment en 2007 (Solez et al. 2008) repose sur l’analyse des lésions histologiques rénales au niveau des biopsies du greffon ce qui établit des scores semi-quantitatifs allant de 0 (lésions légères) à 3 (lésions sévères). Quel que soit le type du rejet (aigu ou chronique), l’analyse méthodique repose sur une grille descriptive des lésions au niveau de l’interstitium (l’infiltrat mononuclée interstitiel «i» et la fibrose interstitielle «ci») ; du glomérule (la glomérulite «g», la glomérulopathie d’allogreffe «cg» et l’hyperplasie mésangiale «mm») ; du tubule (la tubulite «t», l’atrophie tubulaire «ct») et du vaisseaux (l’artérite intimale «v», l’endartérite fibreuse «cv», l’hyalinose artériolaire «ah» et le score de la capillarite péritubulaire «cpt») (Tableau 3).
Transplantation rénale
Tableau 3: Critères semi-quantitatifs d’évaluation des lésions du greffon rénal selon la classification de Banff (Solez K et al. 2007).
Interstitium Infiltrat mononuclée interstitiel "i" i0 : pas d'inflammation interstitielle, ou inflammation banale (< 10% du parenchyme) i1 : 10 à 25 % d'inflammation parenchymateuse i2 : 26 à 50 % d'inflammation parenchymateuse i3 : > 50 % d'inflammation parenchymateuse * : placé sur i * indique la présence en proportion remarquable (> 10 % de l'infiltrat) d'éosinophiles, polynucléaires.
Fibrose interstitielle "ci" ci0 : fibrose interstitielle < 5 % de l'aire corticale
ci1 : fibrose interstitielle légère intéressant 6 à 25 % de l'aire corticale
ci2 : fibrose interstitielle modérée intéressant 26 à 50 % de l'aire corticale
ci3 : fibrose interstitielle modérée intéressant plus de 50 % de l'aire corticale
Tubule Tubulite "t"
t0 : pas de cellule mononucléaire dans les tubes t1 : foyers avec 1 à 4 cellules par section tubulaire, ou 10 cellules dans tube t2 : foyers avec 5 à 10 cellules par section tubulaire
t3 : foyers avec > 10 cellules par section tubulaire, ou présence d'au moins 2 zones de destruction de la membrane basale tubulaire accompagnée par une atteinte interstitielle
Atrophie tubulaire "ct" ct0 : par d'atrophie tubulaire
ct1 : atrophie tubulaire jusqu'à 25 % des tubes de la corticale
ct2 : atrophie tubulaire intéressant 26 à 50 % des tubes de la corticale
ct3 : atrophie tubulaire intéressant plus de 50 % des tubes de la corticale
Glomérule Glomérulite "g" g0 :pas de glomérulite
g1 : glomérulite dans < 25 % des glomérules g2 : glomérulite segmentaire ou globale dans environ 25 à 75 % des glomérules
g3 : glomérulite (essentiellement globale) dans > 75 % des glomérules
Augmentation du tissu mésangial "mm" mm0 : pas d'augmentation du tissu mésangial mm1 : augmentation modérée intéressant jusqu'à 25 % des glomérules non fibreux
mm2 : augmentation modérée intéressant 26 à 50 % des glomérules non fibreux
mm3 : augmentation modérée intéressant plus de 50 % des glomérules non fibreux
Glomérulopathie de l’allogreffe "cg" cg0 : pas de glomérulopathie
cg1 : épaississement de la membrane basale avec images de double contours intéressant jusqu'à 25 % des anses capillaires au niveau des glomérules les plus atteints
cg2 : comme cg1, mais en plus marqué et intéressant 26 à 50 % des glomérules les plus atteints (mais non fibreux)
cg3 : lésions classiques et sévères de la glomérulopathie du transplant avec doubles contours intéressant plus de 50 % des anses capillaires des glomérules les plus atteints (mais non fibreux)
Vaisseaux Artérite intimale "v" v0 : pas d'artérite
v1 : artérite intimale légère à modérée sur au moins 1 section artérielle
v2 : artérite intimale sévère avec au moins 25% de perte de lumière vasculaire sur au moins 1 section artérielle
v3 : dépôt fibrinoïde artérielle et/ou artérite transmurale avec nécrose des cellules
musculaires lisses de la media avec infiltration lymphocytaire
Epaississement hyaline artériolaire "ah" ah0 : pas d'épaississement hyalin PAS + ah1 : épaississement hyalin PAS + léger à modéré dans au moins 1 artériole
ah2 : épaississement hyalin PAS + modéré à sévère dans > 1 artériole
ah3 : épaississement hyalin PAS + sévère dans de nombreuses artérioles
Epaississement fibreux de l’intima "cv" cv0 : pas d'atteinte chronique des vaisseaux cv1 : jusqu'à 25 % de rétrécissement de la lumière vasculaire par un épaississement fibreux des artères
cv2 : comme cv1 mais en plus marqué, avec un rétrécissement de 26 à 50 % de la lumière vasculaire
cv3 : lésions vasculaires sévères avec un rétrécissement > 50 % de la lumière vasculaire notez si les lésions sont caractéristiques du rejet chronique (ruptures de l'intima, cellules inflammatoires dans les zones de fibrose)
Capillarite péritubulaire "cpt" cpt0 : <10 % de capillaires présentant plus de 3 éléments
cpt1 : 3 à 4 cellules par section capillaire cpt2 :5 à 10 cellules par section capillaire cpt3 : > 10 cellules par section capillaire
Transplantation rénale
III.3.2. Diagnostic
Les pourcentages obtenus par l’analyse des lésions histologiques permettent de les classer en plusieurs grades : grade I (lésions minimes) ; grade II (lésions modérées) et grade III (lésions sévères). L’association de ces grades avec les données cliniques et biologiques permet de distinguer 6 catégories diagnostiques :
1) normal ; 2) rejet à médiation humorale aigu ou chronique ; 3) lésions borderline; 4) rejet à médiation cellulaire T aigu ou chronique ; 5) fibrose interstitielle et atrophie tubulaire sans élément d’orientation étiologique; 6) Autres (Tableau 4) (Solez et al. 2007; Solez et al. 2008).
Tableau 4 : Classification de Banff 1997, revue en 2007: 6 catégories diagnostiques des biopsies de transplant rénal (selon Solez K et al. 2007)
1. Normal
2. Rejet à médiation humorale Rejet humoral aigu
I. Nécrose tubulaire aiguë, infiltrat interstitiel minime
II. Capillarite péritubulaire et/ou glomérulaire et/ou thromboses III. Nécrose fibrinoïde artérielle et/ou artérite transmurale (v3)
Rejet humoral chronique actif (nouvelle classe)
Glomérulopathie d’allogreffe et/ou un aspect feuilleté de la membrane basale des capillaires péritubulaires et/ou une fibrose interstitielle avec atrophie tubulaire et/ou une endartérite fibroproliférative et Cd4+
3. Lésions Borderline
Infiltrat inflammatoire interstitiel absent ou léger avec tubulite de n’importe quelle intensité en absence d’artérite intimale.
4. Rejet à médiation cellulaire T (nouvelle classe) Rejet aigu cellulaire T
Ia. Infiltrat interstitiel significatif (>i2) et tubulite modérée (t2) plurifocale I b. Infiltrat interstitiel significatif (>i2) et tubulite marquée (t3) plurifocale IIa. Artérite intimale légère ou modérée (v1)
II b. Artérite intimale sévère avec diminution > 25 % de la lumière vasculaire (v2)
III. Artérite transmurale et/ou nécrose fibrinoïde de la média avec infiltration lymphocytaire de la paroi vasculaire (v3)
Rejet chronique actif cellulaire T (nouvelle classe)
Vasculopathie chronique d’allogreffe
5.Fibrose interstitielle et atrophie tubulaire (FIAT) sans élément d’orientation étiologique
I: Légère fibrose interstitielle et atrophie tubulaire (<25% de la surface corticale) II: Fibrose interstitielle et atrophie tubulaire modérées (26 à 50 % de la surface corticale) III : Fibrose interstitielle et atrophie tubulaire sévères (>50 % de la surface corticale)
6. Autres
Toutes les lésions n’étant pas considérées comme des lésions de rejet : pyélonéphrite aigue, néphropathie virale, lésions de toxicité des immunosuppresseurs.
FIAT
IV. FIBROSE INTERSTITIELLE ET ATROPHIE TUBULAIRE : FIAT
IV.1. Généralités
La dysfonction chronique d’allogreffe est une altération de la structure du greffon rénal conduisant à la dégradation de sa fonction. Sur le plan lésionnel, la dysfonction correspond à la « néphropathie chronique d’allogreffe » ou CAN (chronic allograft nephropathy) (Racusen et al. 1999; Nankivell et al. 2003). Selon la nouvelle classification de Banff, cette dénomination a été remplacée par une catégorie descriptive et diagnostique en « Fibrose Interstitielle (FI) et Atrophie Tubulaire (AT) sans élément d’orientation étiologique » ou FIAT (Solez et al. 2008).
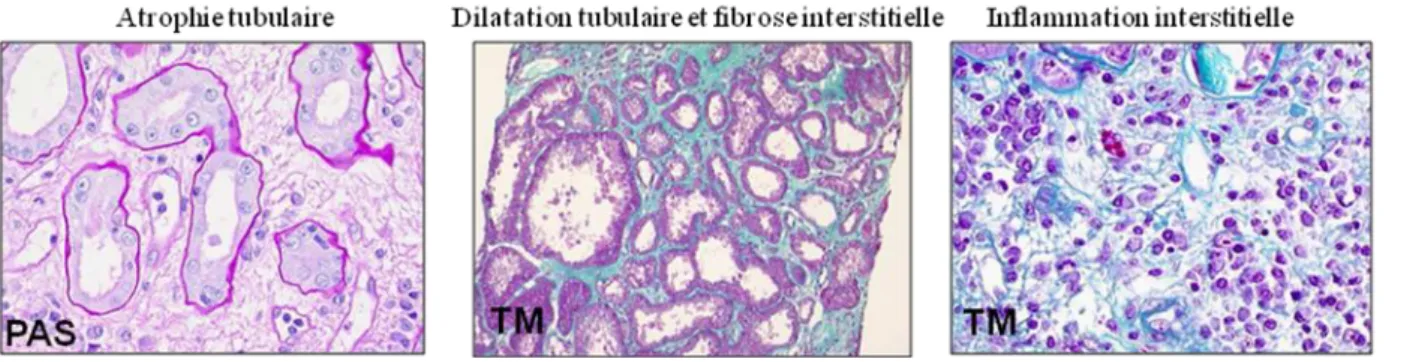
La FIAT est un marqueur histologique de la dysfonction chronique qui correspond à une perte progressive et irréversible du parenchyme rénal avec l’apparition de fibrose tubulo-interstitielle, d’atrophie tubulaire, d’occlusion vasculaire et de glomérulosclérose dès 3 mois post-greffe. Ces lésions histologiques sont classées en fonction du pourcentage de cortex atteint en 3 grades :
i) Grade I qui correspond à une légère FI et AT (< 25 % de la surface corticale), ii) Grade II avec FI et AT modérées (26 à 50 % de la surface corticale) et
iii) Grade III caractérisé par une FI et AT sévères (> 50 % de la surface corticale).
Sur le plan fonctionnel, la dysfonction chronique est caractérisée par la dégradation lente et progressive de la fonction rénale avec une diminution du DFG, une protéinurie (<1,5 g / 24 h) et une HTA. A plus long terme, la FIAT progresse vers une insuffisance rénale chronique, conduisant à la perte définitive du greffon. A ce stade, le patient est obligé de reprendre la dialyse et dans certains cas si le traitement immunosuppresseur est interrompu, le greffon peut évoluer vers la nécrose totale nécessitant alors une deuxième transplantation rénale.