La levure Geotrichum candidum, diversité et
applications en fromagerie
Mémoire
Stéphanie Vignola
Maîtrise en sciences et technologie des aliments
Maître ès Sciences (M. Sc.)
Québec, Canada
La levure Geotrichum candidum, diversité et
applications en fromagerie
Mémoire
Stéphanie Vignola
Sous la direction de :
iii
Résumé
Geotrichum candidum est une levure dimorphique qui occupe plusieurs rôles importants au sein de l’écosystème microbien de la surface des fromages à croute fleurie et à croute lavée. Ses différentes activités, notamment celles d’alcalinisation et de production de composés aromatiques, sont toutefois reconnues pour être souche-dépendantes. Peu d’études ont été menées sur la génétique de l’espèce G. candidum, bien que celle-ci mériterait d’être exploitée dans l’optique d’optimiser la production de ferments d’affinage utilisés dans les fromages affinés en surface.
Dans le cadre de ce travail, les génomes de 11 souches de Geotrichum/Galactomyces spp. isolées de produits laitiers ou de l’environnement, ont été séquencés et comparés au niveau génomique. Également, afin d’avoir une caractérisation complète des souches, leur morphologie, leur capacité à croître en présence de différentes sources de carbone et à 35 °C, ainsi que leur capacité à se développer dans des caillés modèles ont été évaluées. Des divergences ont été observées entre les séquences génomiques des souches de Geotrichum spp. et Galactomyces spp., conduisant à la distinction des différentes espèces étudiées et à la formation de différents sous-groupes au sein de l’espèce G. candidum qui sont similaires à ceux établis par une étude préalablement réalisée par « Multilocus Sequence Typing » (MLST). Des différences ont également été observées entre les souches de l’espèce Geotrichum spp. en ce qui concerne leur morphologie, leur capacité à assimiler différentes sources de carbone ainsi que leurs propriétés alcalinisantes et protéolytiques lors de l’affinage de caillés modèles.
La caractérisation génomique et phénotypique de souches de Geotrichum spp. fournit ainsi de nouvelles informations sur leurs caractéristiques et leur comportement dans différents milieux. Ce travail est donc d’une grande importance pour favoriser une meilleure sélection des souches de Geotrichum candidum pour le développement et l’amélioration de fromages affinés en surface.
iv
Abstract
Geotrichum candidum is a dimorphic yeast which plays several important roles within the surface microbial ecosystem of mold- and smear-ripened cheeses. Its various abilities, in particular those of alkalinization and production of aromatic compounds in cheeses are, however, recognized to be strain-dependent. Few studies have been carried out on the genetics of the species G. candidum, although this kind of information would be very useful in order to optimize the production of ripening cultures used in different types of surface ripened cheeses.
In this project, the complete genomes of 11 Geotrichum/Galactomyces spp. strains isolated from dairy products or the environment were sequenced. Furthermore, in order to have a complete characterization of the strains, their morphology and their ability to grow in presence of different carbon sources, at 35°C, and in soft-cheese model curds were tested. Our results showed divergence between the genomic sequences of Geotrichum spp. and Galactomyces spp. strains, leading to the distinction of the different species studied and to the identification of different sub-groups among the G. candidum species that are consistent with those established in a previous study using Multilocus Sequence Typing (MLST). Differences were also observed between Geotrichum spp. strains for their morphology, their ability to metabolize different carbon sources, and their alkalinisation and proteolytic activities on soft-cheese model curd.
The genome sequencing and the phenotypic characterization of the Geotrichum spp. strains provide new information about their characteristics and behavior in different media. This work is therefore of great importance to perform a better selection of G. candidum strains for the development and improvement of surface ripened cheeses.
v
Table des matières
Résumé ... iii
Abstract...iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations ... x
Remerciements ... xii
Avant-propos ... xiii
Chapitre 1 – Introduction ... 1
Chapitre 2 – Revue de littérature... 3
2.1. Les fromages affinés en surface : une succession de microflores ... 3
2.1.1. Les fromages à croute fleurie et à croute lavée... 4
2.1.2. Activités souche-dépendante en fabrication fromagère ... 6
2.2. Geotrichum candidum... 8
2.2.1. Taxinomie et origine... 9
2.2.2. Caractéristiques intrinsèques générales ...10
2.3. Diversité des caractéristiques technologiques de l’espèce G. candidum ...11
2.3.1. Morphotype et activité physiologique ...11
2.3.2. Protéolyse et catabolisme des acides aminés...15
2.3.3. Lipolyse et catabolisme des acides gras...19
2.3.4. Interactions avec les autres microorganismes d’affinage...21
2.4. La génomique : un outil pour mieux comprendre l’activité et la diversité au sein d’une espèce ...22
2.4.1. Plasticité des génomes de microorganismes laitiers et environnementaux ...23
2.4.2. La génétique de la levure Geotrichum candidum ...26
Chapitre 3 - Problématique, hypothèses de recherche et objectifs ...31
3.1. Problématique ...31
3.2. Hypothèse de recherche ...32
3.3. Objectifs ...32
Chapitre 4 – Caractérisation phénotypique et génomique de souches de Geotrichum spp. et Galactomyces spp. ...33
4.1. Résumé ...33
4.2. Abstract ...34
vi
4.4. Materials and Methods ...37
4.4.1. Phenotypic Characterization of the Strains ...37
4.4.1.1. Biological Material, Culture Conditions and Isolation of Arthrospores...37
4.4.1.2. Assimilation of Carbon Compounds ...38
4.4.1.3. Growth at 35°C ...39
4.4.2. Genomic Characterization of the Strains ...39
4.4.2.1. Biological Material, Culture Conditions and Genomic DNA Extractions...39
4.4.2.2. Library Preparation, Genomic DNA Sequencing and Genome Assembly ...40
4.4.2.3. Genomic Content Comparison ...40
4.4.2.4. Gene Prediction and Functional Annotation ...41
4.4.3. Strains Activity Evaluation in Soft-Cheese Model Curd ...42
4.4.3.1. Biological Material and Culture Conditions ...42
4.4.3.2. SCMC Production, Preparation and Ripening Conditions...42
4.4.3.3. SCMC Sampling, pH Measurement and Microscopic Observation ...43
4.4.3.4. DNA Isolation and Quantification with Real-Time qPCR Assays ...43
4.4.3.5. Proteolysis Assessment...44
4.4.4. Statistical Analysis ...44
4.5. Results ...45
4.5.1. Phenotypic Characterization of the Strains ...45
4.5.2. Genomic Characterization of the Strains ...47
4.5.3. Strains Activity Evaluation in Soft-Cheese Model Curd ...51
4.6. Discussion...56
4.7. Acknowledgements ...62
Chapitre 5 – Discussion générale ...63
5.1. Retour sur les méthodes traditionnelles de caractérisation phénotypique ...64
5.2. Retour sur les méthodes de biologie moléculaire ...66
Chapitre 6 – Conclusions et perspectives ...69
vii
Liste des tableaux
Tableau 1. Caractères clés pour identifier les espèces du genre Galactomyces. ...10
Tableau 2. Activité physiologique décrivant l’espèce Geotrichum candidum. ...14
Tableau 3. Liste des composés aromatiques produits par Geotrichum candidum par catabolisme des acides aminés. ...18
Tableau 4. Liste des composés aromatiques produits par Geotrichum candidum par catabolisme des acides gras. ...20
Table 5. Origin of Geotrichum spp. and Galactomyces spp. strains...37
Table 6. Assembly statistics for Geotrichum spp. and Galactomyces spp. strains. ...48
viii
Liste des figures
Figure 1. Représentation schématique des changements survenant au cours de l’affinage du fromage
de type Camembert en raison de la croissance de P. camemberti... 5
Figure 2. Représentation schématique des changements survenant au cours de l’affinage du fromage
de type Tilsit en raison des interactions ayant lieu entre les espèces dominant la surface des fromages à croute lavée. ... 6
Figure 3. Aspect des souches de Geotrichum candidum LMA-75 (A) et LMA-21 (B) sur milieu
gélosé YEG après 4 jours de croissance à 25 °C dans l'obscurité...11
Figure 4. Microculture de G. candidum à 25 °C après 17h sur milieu d’extrait de malt. [1] Hyphes
végétatives légèrement segmentées. [2] Hyphes sporulées correspondant aux futures arthrospores. ...12
Figure 5. Dégradation de l’acide aminé L-méthionine chez différents microorganismes d’affinage.
KMBA = acide 4-méthylthio-2-oxobutyrique; α-KG = α-cétoglutarate; L-Glu = L-glutamate; MTL = méthanethiol; DMDS = Disulfure de diméthyle; DMTS = Trisulfure de diméthyle.. ...17
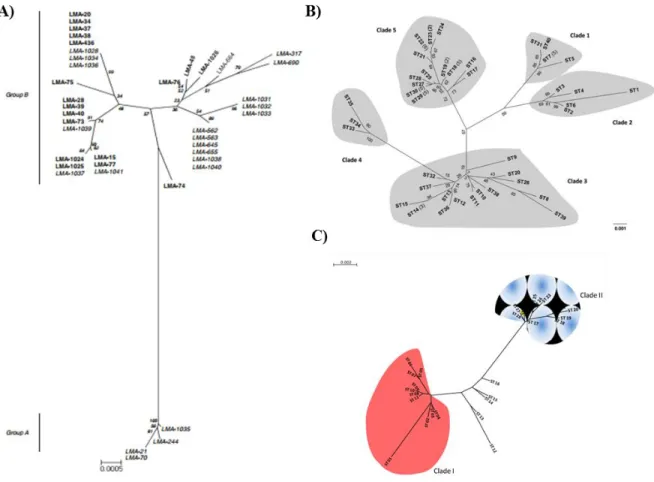
Figure 6. Arbres phylogénétiques (Neighbour-joining) générés à partir des STs identifiés par MLST
pour des souches de G. candidum.. ...28
Figure 7. Diversity of Galactomyces spp. and Geotrichum spp. strains. (Left panel) Phylogenetic tree
(neighbor-joining) for the Euclidean distances obtained from the normalized set of k-mers (31 bp fragments) shared between the partial genomes of Galactomyces spp. and Geotrichum spp. strains. Phylogenetic analyses were conducted in MEGA6. (Center panel) Similarity heatmap for the normalized set of k-mers shared between the partial genomes of Galactomyces spp. and Geotrichum spp. strains. (Right panel) Ability of Geotrichum spp. strains to grow on carbon compounds. ...46
Figure 8. Morphology of Geotrichum spp. strains of dairy origin on YEG culture media. (Left)
Macroscopic observations. (Right) Microscopic observations. (A) Mold-like (LMA-1028). (B) Intermediate (LMA-244). (C) Intermediate (LMA-40). (D) Yeast-like (LMA-1146). ...47
Figure 9. Functional classification of gene clusters shared between all Geotrichum spp. strains. M:
Cell wall/membrane/envelope biogenesis, N: Cell motility, O: Postranslational modification/protein turnover/chaperones, T: Signal transduction mechanisms, U: Intracellular trafficking/secretion/vesicular transport, V: Defense mechanisms, W: Extracellular structures, Y: Nuclear structure, Z: Cytoskeleton, A: RNA processing and modification, B: Chromatin structure and dynamics, J: Translation/ribosomal structure/biogenesis, K: Transcription, L: Replication/recombination,/repair, C: Energy production and conversion, D: Cell cycle control/cell division/chromosome partitioning , E: Amino acid transport and metabolism, F: Nucleotide transport and metabolism, G: Carbohydrate transport and metabolism, H: Coenzyme
ix
transport and metabolism, I: Lipid transport and metabolism, P: Inorganic ion transport and metabolism, Q: Secondary metabolites biosynthesis, transport and catabolism. ...50
Figure 10. Morphology of Geotrichum spp. strains of dairy origin on SCMC of 42 days
(Top) Macroscopic observations. (Bottom) Microscopic observations. ...52
Figure 11. pH evolution of soft-cheese model curds after 8 and 21 days of ripening. Values with
different letters are significantly different (D8: P = 0.0039, D21: P < 0.0001). ...53
Figure 12. Changes in soluble nitrogenous fractions of soft-cheese model curds after 8 and 21 days
of ripening. (A) Protein and non-protein nitrogen. (B) protein nitrogen < 3000 Da. (C) Non-protein nitrogen < 600 Da. Values with different letters are significantly different (D21: P < 0.0001). ...55
x
Liste des abréviations
α-KG : α-cétoglutarate
a.a. : amino acids (acides aminés) ADN : Acide désoxyribonucléique ADNr : ADN ribosomique
ATCC : American Type Culture Collection cgl : cystathionine-y-lyase
CBS : Centraalbureau voor Schimmelcultures
CLIB : Collection de Levures d'Intérêt Biotechnologique CSV : Composés Soufrés Volatils
DMS : dimethylsulfide (Sulfure de diméthyle)
DMDS : dimethyldisulfide (Disulfure de diméthyle)
DMTS : dimethyltrisulfide (Trisulfure de diméthyle)
ITS(1) : Internal Transcribed Spacer (1) KMBA : acide 4-méthylthio-2-oxobutyrique LMA : Laboratoire de Mycologie Alimentaire
LTR : Long Terminal Repeats (séquence terminale longue répétée) Mb : Méga bases
MLST: Multilocus sequence typing MPA : Acide mycophénolique, MTA : S-méthyl-thioacétate MTB : S-méthyl-thiobutyrate MTIB : S-méthyl-thioisobutanoate MTIV : S-méthyl-thioisovalerate
xi MTH : S-méthyl-thiohexanoate
MTP : S-méthyl-thiopropionate MTL : méthanethiol
NSLAB : Non Starter Lactic Acid Bacteria (Bactéries lactiques non levain) pb : paires de bases
PCR : Polymerase Chain Reaction (réaction en chaîne de la polymérase) PDB : Potato Dextrose Broth (Bouillon de pomme de terre et dextrose) PFGE : Pulsed Field Gel Electrophoresis (Électrophorèse en champs pulsés) qPCR : quantitative PCR (PCR quantitative)
RAM-PCR : Random Amplified Microsatellite by PCR RAPD-PCR : Random Amplified Polymorphism DNA by PCR
SCMC : Soft-cheese model curd (Caillé modèle de fromages à pâte molle) SNPs : Single Nucleotide Polymorphisms
SRAG : Specifically Retained Ancestral Genes ST : Séquence Type
YEG : Yeast Extract and Glucose (extrait de levure et glucose)
xii
Remerciements
J’aimerais tout d’abord remercier mon directeur de maîtrise, Steve Labrie, pour m’avoir offert l’opportunité de plonger dans un monde qui m’était quelque peu inconnu. Merci pour la confiance et l’indépendance qu’il m’a accordées, merci pour son enthousiasme contagieux envers mon projet, merci pour m’avoir accueilli à bras grands ouverts dans son équipe, et enfin merci pour m’avoir toujours encouragée à me perfectionner et à présenter mes résultats de recherche, autant au national qu’à l’international, lorsque les occasions se sont présentées.
Je souhaite également remercier tout spécialement notre valeureuse professionnelle de recherche Marie-Hélène Lessard. Merci pour son soutien, ses encouragements et ses conseils si précieux. Merci d’avoir ensoleillé chaque moment, heureux ou malheureux, tout au long de ma maîtrise. Je tiens également à remercier tous les autres membres du laboratoire LMA, Catherine Viel, Marine Béguin, Annick, Julien, Laura, Andréanne, Vincent, Virginie, et certains membres des autres laboratoires du STELA, Mélanie Martineau, Pascal Lavoie, Diane Gagnon, que ce soit pour leur support technique ou moral. Merci également aux membres de l’équipe de Jacques Corbeil, Pier-Luc Plante et Frédéric Raymond, ainsi qu’aux membres de Calcul Québec, Félix-Antoine Fortin et Maxime Boissonneault, pour leurs précieux conseils et pour leur soutien. Sans cette aide, la bioinformatique serait encore une boîte noire à mes yeux.
Je tiens aussi à exprimer ma reconnaissance envers les différents organismes subventionnaires sans qui ce projet n’aurait pu être réalisé. Merci au CRSNG, au FRQNT, à l’INAF, au STELA, à la Fondation INITIA et au CTAQ pour leur soutien financier. Merci également aux correcteurs qui ont accepté de prendre le temps d’évaluer ce mémoire et de m’offrir leurs conseils et commentaires. Enfin, un grand merci à mes parents Anne et Michel, mes deux plus grands modèles, ainsi qu’à mon copain Philippe, pour leur support sans limites, leur grande écoute, leur patience, leurs encouragements et leurs précieux conseils.
xiii
Avant-propos
Ce mémoire est divisé en six chapitres. Le chapitre 1 est le chapitre d’introduction, mettant en contexte la problématique du projet de maîtrise. Le chapitre 2 est une revue de littérature résumant les connaissances actuelles sur la microflore des fromages affinés en surface, et particulièrement sur le rôle de l’espèce de levure Geotrichum candidum dans le développement des fromages à croute fleurie et à croute lavée. Les caractéristiques générales de l’espèce G. candidum et ses capacités en tant que ferment d’affinage sont ainsi explorées. La diversité observée au sein de cette espèce de levure est de fait mise en évidence en raison de ses nombreuses capacités dites souche-dépendantes. Une attention particulière est également accordée à l’utilisation de la biologie moléculaire pour caractériser de manière complémentaire la plasticité génomique de souches de différentes espèces. Les techniques de génotypage et de génomique appliquées à l’étude de l’espèce G. candidum sont ainsi abordées, mettant en valeur l’importance de mieux caractériser les souches de cette espèce pour optimiser leur utilisation en fabrication fromagère.
L’hypothèse et les objectifs du projet de maîtrise sont ensuite présentés au chapitre 3. Le chapitre 4 est écrit sous forme d’article scientifique, en anglais, et présente tous les résultats obtenus dans le cadre de ce projet. L’article sera soumis pour publication dans la revue scientifique Applied and Environmental Microbiology (AEM). L’auteure de ce mémoire a réalisé la majorité du travail expérimental ainsi que l’ensemble de l’analyse des résultats et la rédaction de l’article scientifique, dont elle est la première auteure. La préparation des librairies de séquençage a été faite par la Dre Marie-Hélène Lessard, le séquençage des génomes a été effectué par le Dr Frédéric Raymond et l’annotation fonctionnelle des gènes été effectuée en collaboration avec le candidat au doctorat Pier-Luc Plante. La Dre Marie-Hélène Lessard a cosupervisé le travail et participé activement à la correction du mémoire et de l’article. Le Dr Steve Labrie a obtenu les fonds de recherche, a supervisé le travail et a participé activement à l’écriture du mémoire et de l’article.
Au chapitre 5, une discussion générale du mémoire est présentée, mettant en lumière les principales réalisations du projet, leur apport au développement des connaissances sur G. candidum, mais également leurs contraintes. Enfin, le chapitre 6 présente les conclusions générales du projet ainsi que les perspectives à explorer dans des projets futurs.
Une partie des résultats de l’article ont été présentés sous forme d’affiche scientifique intitulée « Genome sequencing and phenotypic characterization of Geotrichum spp. strains isolated from milk and cheeses » lors du sommet mondial laitier de la Fédération Internationale du Lait (FIL-IDF) à
xiv
Rotterdam (Pays-Bas) en 2016. La majorité des résultats de cet article ont été présentés sous forme de conférence intitulée « La levure Geotrichum candidum, diversité et application en fromagerie »lors du Colloque STELA à Québec (Canada) en 2017.
xv
Un scientifique dans son laboratoire n'est pas un simple technicien : il est aussi un enfant confronté à des phénomènes naturels qui l'impressionnent comme des contes de fées. - Marie Curie
1
Chapitre 1 – Introduction
Au Canada, la préférence pour les fromages de spécialité est en hausse. En effet, entre 2003 et 2016, la production de fromage de spécialité au Canada est passée de 89 622 tonnes à 467 860 tonnes (1). De fait, en 2016, 31,5 % des fromages produits étaient des fromages de spécialité, ce qui inclut les fromages à pâte molle, semi-ferme ou ferme, et parfois affinés en surfaces (1). Cette catégorie exclut ainsi le Cheddar, le Mozzarella, le fromage fondu, le fromage Cottage et le fromage à pizza. Depuis 2014, la production de fromages de spécialité par rapport à la production totale de fromages a cependant légèrement chuté au Québec, passant de 48,1 à 43,5 % en 2016 (1). Avec l’accord de libre-échange dernièrement signé entre le Canada et l’Union européenne, certaines inquiétudes ont été exprimées par les acteurs du secteur laitier en ce qui concerne leur capacité à concurrencer l’arrivée de 32 000 tonnes de fromages européens par année, ce qui représente 7,5 % du marché canadien (2). L’intérêt grandissant pour la production de fromages de spécialité attire son lot de problèmes et de défis. Effectivement, la constance de la qualité des fromages produits, autant au niveau organoleptique (texture, arômes, altération par des contaminants) que sanitaire (présence de pathogènes), est un enjeu de taille pour les fromageries. De plus, afin de rester compétitives, les fromageries doivent souvent faire preuve d’innovation. Une bonne compréhension et une bonne gestion de la fabrication des fromages de spécialité s’imposent alors pour éviter d’importantes pertes économiques et pour maintenir l’intérêt et la confiance des consommateurs.
Les fromages de spécialité présentent un écosystème microbien complexe et dynamique, en constante évolution au cours de la production et de l’affinage. La coexistence de différents microorganismes (bactéries, levures, moisissures) influence ainsi la nature même des fromages de spécialité et oriente le développement de caractéristiques uniques à chacun (3). Conséquemment, au cours de l’affinage, différents microorganismes se succèdent, coopèrent et entre en compétition les uns avec les autres (microflore indigène, culture de départ, microflore secondaire) et coopèrent les uns avec les autres, et ce, en fonction de leur activité métabolique au sein de la matrice fromagère (glycolyse, lipolyse, protéolyse). Ces phénomènes sont entre autres observés pour les fromages affinés en surface, comme les fromages à croute fleurie et à croute lavée (4-6). Dans ce type de fromage, les levures (Geotrichum candidum, Kluveryomyces lactis, Debaryomyces hansenii, Saccharomyces cerevisiae, Yarrowia lipolytica) sont souvent reconnues pour s’implanter au premier stade de l’affinage afin de favoriser l’activité subséquente de la microflore secondaire constituée de bactéries (Micrococcus sp., Brevibacterium linens, Arthrobacter sp., Corynebacterium sp.) et parfois de moisissures
2
(Penicillium camemberti, Penicillium roqueforti) (4, 7, 8). Parmi ces levures, Geotrichum candidum occupe un rôle essentiel et souvent sous-estimé par la communauté scientifique dans la formation des croutes des fromages affinés en surface.
Ayant longtemps été considérée comme un microorganisme nuisible (9), la levure G. candidum est maintenant reconnue pour ses capacités alcalinisantes (consommation de l’acide lactique et production de métabolites alcalins) (7, 10), sa grande compétitivité envers les contaminants (par exemple Mucor sp.) (7), ses capacités aromatisantes (activités protéolytiques et lipolytiques) (11, 12) et l’action de certaines souches contre les pathogènes (Listeria monocytogenes) (13).
Ces diverses capacités et activités sont cependant reconnues pour être souche dépendantes. Ainsi, une grande diversité au sein même de l’espèce de G. candidum a été observée, d’abord au niveau morphologique (14) et ensuite au niveau métabolique (15-17). De plus, des études moléculaires ont permis d’identifier des différences entre les souches en se référant à la taille des chromosomes (18), ou encore aux gènes domestiques (housekeeping genes) (19). Cette dernière étude a d’ailleurs permis de distinguer différents groupes phylogénétiques au sein de l’espèce G. candidum.
Le haut niveau de polymorphisme, la grande variabilité des caractéristiques phénotypiques et la difficulté de réalisation des tests de croissance chez les souches de Geotrichum candidum sont trois facteurs compliquant leur identification et leur caractérisation par les méthodes microbiologiques traditionnelles (20, 21). L’utilisation des méthodes moléculaires et du séquençage génétique deviennent ainsi les meilleures alternatives pour augmenter le niveau de connaissances des levures d’affinage comme G. candidum, et par conséquent avoir une meilleure maîtrise des procédés d’affinage.
Contrairement à d’autres levures laitières, peu d’informations génétiques concernant Geotrichum candidum sont disponibles. À ce jour, seuls un génome partiel et un génome complet sont disponibles pour cette espèce (22, 23). De plus, deux études se sont récemment intéressées à l’expression de certains gènes de souches spécifiques de G. candidum lors de l’affinage de fromages (24, 25). Puisque plusieurs souches de G. candidum présentent des capacités fromagères non seulement essentielles, mais également uniques à chacune, une recherche approfondie sur la génétique de ces différentes souches laitières s’avère nécessaire. À la suite de ces travaux, les ferments d’affinage existants pourront être mieux exploités, de manière à sélectionner les souches en fonction de la variété de fromage à produire et aussi améliorer la constance de la qualité des fromages. En plus, de nouveaux ferments pourront potentiellement être développés dans le but d’augmenter la diversité des fromages offerts sur le marché.
3
Chapitre 2 – Revue de littérature
2.1. Les fromages affinés en surface : une succession de microflores
Composés d’une matrice protéique renfermant de la matière grasse, des sucres résiduels et des minéraux, les fromages affinés en surface ont la particularité de présenter un écosystème microbien complexe et dynamique. De ce fait, la communauté microbienne de ces fromages est composée de bactéries, de levures et de moisissures diverses qui sont actives tout au long de la production et de l’affinage des fromages. Ainsi, en plus de participer au développement de leur apparence, ces microorganismes contribuent également de façon directe (activité métabolique) ou indirecte (libération d’enzymes par la lyse des cellules) au développement de la texture et des saveurs des fromages (26, 27).
Cette microflore diversifiée peut être séparée en deux catégories : les bactéries lactiques d’une part, et la microflore secondaire d’autre part. Les bactéries lactiques telles que Lactococcus spp., Streptococcus thermophilus, Lactobacillus delbrueckii et Lb. helveticus sont ajoutées comme culture de départ dans le but d’acidifier le lait par production d’acide lactique (27). Ces microorganismes sont ainsi majoritairement actifs lors de la phase de fabrication des fromages affinés en surface. La microflore secondaire peut, quant à elle, être séparée en plusieurs sous-catégories : les bactéries lactiques secondaires (non-starter lactic acid bacteria, NSLAB) telles que les Lactobacillus spp., Leuconostoc spp., Pedicoccus spp. et Enterococcus spp. (27); les levures telles que Geotrichum candidum, Debaryomyces hansenii, Kluyveromyces lactis, K. marxianus et Yarrowia lypolitica (26, 28); les moisissures telles que Penicillum camemberti et P. roqueforti (26, 28); et les bactéries, telles que Corynebacterium spp., Staphylococcus spp., Micrococcus spp. et Propionibacterium spp. (28). Ces microorganismes sont pour leur part essentiellement actifs lors de la phase d’affinage des fromages affinés en surface, et ce dans un ordre bien précis. En effet, une fois la majorité du lactose métabolisé par les bactéries lactiques et transformé en acide lactique, les activités biochimiques subséquentes entreprises par la microflore secondaire sont majoritairement l’assimilation de l’acide lactique, la protéolyse et le catabolisme des acides aminés, ainsi que la lipolyse et le catabolisme des acides gras (29). Or, l’activité des microorganismes et leurs interactions sont directement reliées aux conditions locales rencontrées dans le fromage, et de fait dépendantes de leurs capacités intrinsèques, notamment leur tolérance aux faibles valeurs de pH, aux températures
4
variables et aux concentrations plus élevées en sel (27, 30), en plus de leur niveau de compétitivité (31-33).
Les bactéries lactiques et les microorganismes de la microflore secondaire peuvent être ajoutés volontairement, être naturellement présents dans le lait, ou encore peuvent provenir des équipements ou de l’environnement de la fromagerie. Certains ont également une meilleure capacité à se développer au cœur des fromages, alors que d’autres sont davantage retrouvés en surface (28, 34). Le type de fromage produit détermine généralement quels microorganismes seront présents dans le fromage et dans quel équilibre ils s’y retrouveront au cours du temps, ce qui influencera le développement des caractéristiques physico-chimiques et organoleptiques des fromages. Deux types de fromages affinés en surface sont de fait reconnus pour présenter une succession de microflores importante lors de leur affinage, soient les fromages à croute fleurie et les fromages à croute lavée.
2.1.1. Les fromages à croute fleurie et à croute lavée
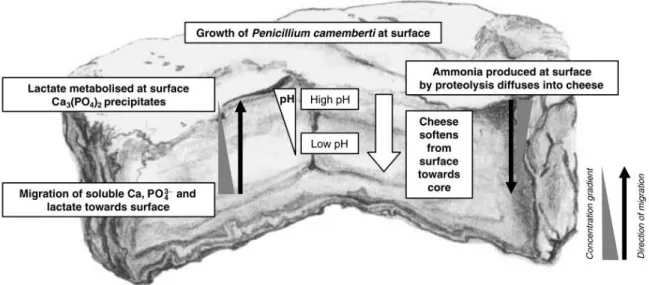
Les fromages à croute fleurie sont majoritairement des fromages à pâte molle (Brie ou Camembert) connus pour leur aspect blanc et duveteux en surface en raison de la présence prédominante de la moisissure P. camemberti. En effet, ce microorganisme joue un rôle prédominant dans le développement de la texture molle et des arômes caractéristiques des fromages à croute fleurie (champignon, beurre, ammoniac, floral, fruité, ail), par ses activités glycolytique, lipolytique et protéolytique (35, 36). Cependant, pour un développement complet d’un fromage typique à croute fleurie, l’activité d’une série d’autres microorganismes est nécessaire (9, 37), notamment celle de certaines levures (G. candidum, D. hansenii, K. lactis et K. marxianus) et bactéries (lactocoques, microcoques et corynébacteries). En début d’affinage, l’activité principale des levures et de P. camemberti est de consommer l’acide lactique présent dans le fromage pour croître, créant ainsi une remontée de pH en surface du fromage (5, 9, 36, 38). Le gradient de pH établi entre la surface et le centre du fromage permet alors l’implantation d’une microflore acido-sensible en surface (9, 38), favorise les réactions enzymatiques d’origine microbienne (3, 9) et modifie le degré de solubilité des composants majeurs du fromage (Fig. 1) (9, 27, 29). Après une vingtaine de jours d’affinage, la texture coulante et la majorité des arômes typiques du fromage à croute fleurie sont ainsi développés majoritairement en raison de l’activité protéolytique (production de composés aromatiques soufrés et d’ammoniac) et lipolytique (production de méthyl-cétones) des microorganismes présents (36-38).
5
Figure 1. Représentation schématique des changements survenant au cours de l’affinage du fromage
de type Camembert en raison de la croissance de P. camemberti. Figure tirée intégralement de McSweeny et Fox (39).
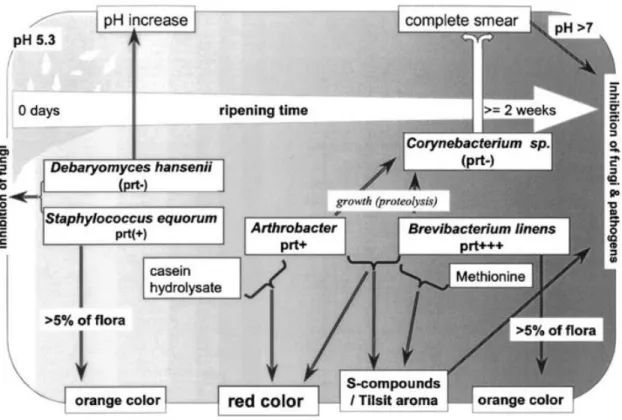
Contrairement aux fromages à croute fleurie, les fromages à croute lavée présentent une plus grande diversité en termes de types de pâte (molle, semi-ferme ou ferme), de temps d’affinage (2 semaines à 1 an) et de microflore (unique à chaque fromagerie) (40, 41). Malgré cette diversité, ils sont tous reconnus pour leur croute légèrement visqueuse, abrasive et colorée, due à leur frottement régulier avec une saumure contenant une microflore d’affinage mixte provenant de ferments sélectionnés, mais également de l’environnement de la fromagerie (38, 40). En général, des bactéries corynéformes des genres tels que Corynebacterium spp., Brevibacterium spp., Arthrobacter spp., Microbacterium spp. et Staphyloccocus spp. sont dominants à la surface de ce type de fromage (40-42). Brevibacterium linens est souvent considérée comme étant la bactérie principalement responsable de la couleur typique orangée des fromages à croute lavée, bien que certaines espèces du genre Arthrobacter (dont A. nicotianae) auraient également un rôle important dans le développement de la couleur (Fig. 2) (41, 42). Des levures comme D. hansenii et G. candidum sont également retrouvées dans les fromages à croute lavée, intervenant activement dans la désacidification de la pâte (consommation d’acide lactique et production d’ammoniac), le développement de saveurs (composés aromatiques soufrés) et l’apparence en surface des fromages (4, 32, 33, 40, 43, 44). Comme dans les fromages à croute fleurie, l’augmentation du pH de la surface du fromage vers son centre permet la croissance de microorganismes acido-sensibles, et dans le cas des fromages à croute lavée, tolérants au sel (Fig. 2) (32, 38, 40). Le développement de composés aromatiques soufrés volatils, souvent
6
associés à des notes d’ail, sont les arômes typiques des fromages à croute lavée découlant de l’activité métabolique de B. linens et G. candidum, et parfois même de Y. lipolytica (32, 38, 41-43).
Autant pour les fromages à croute fleurie que pour ceux à croute lavée, la fabrication standardisée de fromages affinés en surface (utilisation de lait pasteurisé et sélection d’une microflore d’affinage connue) provoque la perte de saveurs typiques. Or, l’utilisation de certaines souches de la levure G. candidum permettrait de retrouver ces arômes particuliers et plus prononcés, notamment ceux de ferme, d’ail et de chou (7, 10, 17, 37).
Figure 2. Représentation schématique des changements survenant au cours de l’affinage du fromage
de type Tilsit en raison des interactions ayant lieu entre les espèces dominant la surface des fromages à croute lavée. Figure tirée intégralement de Bockelmann (41).
2.1.2. Activités souche-dépendante en fabrication fromagère
Il est évident que la sélection de la microflore oriente la production fromagère et influence le développement de la texture, de l’apparence et des saveurs du fromage au cours de l’affinage. En
7
effet, le rôle des microorganismes dans les fromages affinés en surface est unique à chaque espèce, la plupart du temps selon les conditions environnementales dans lesquelles celle-ci se retrouve. Or, au sein même d’une espèce, les capacités métaboliques identifiées peuvent être parfois variables d’une souche à l’autre, ce qui demande une attention supplémentaire lors de la sélection des ferments utilisés en fabrication fromagère. Par exemple, pour obtenir une production satisfaisante d’un fromage Camembert, le développement de la souche de P. camemberti doit être adéquat, notamment en rapport à la couleur, la longueur et la densité de son mycélium, caractéristiques qui peuvent dépendre de la souche sélectionnée (28, 37). Dans le même ordre d’idées, la sélection de la souche optimale de B. linens dans la production d’un fromage à croute lavée est critique pour obtenir la couleur typique orangée en surface puisque le «pigment du rouge» n’est pas produit par toutes les souches (28).
Autant les espèces de la microflore de départ que celles de la microflore d’affinage ont démontré des capacités dites souche-dépendantes. En effet, des isolats identifiés en tant que Lactococcus lactis ssp. lactis provenant de fromages de chèvre ont démontré une grande variabilité en ce qui a trait à leur capacité acidifiante, leurs activités protéolytique et peptidolytique, ainsi que leur activité antibactérienne contre différents agents pathogènes ou indésirables (E. coli, Y. enterocolitica, S. aureus, B. cereus, L. monocytogenes, et E. faecalis) (45). Par ailleurs, des souches de Lactococcus sp. et Enterococcus sp. isolées de différents types de fromages espagnols provenant de plusieurs fermes ont démontré des profils variables d’activité fermentaire au sein de leur espèce (46). Des isolats des espèces Lactobacillus casei et L. paracasei provenant de fromages, de yogourt ou de levain ont pour leur part démontré des profils très variables en rapport à leurs activités protéolytique et peptidolytique, et spécifiquement en rapport à l’activité de leurs aminotransférases aromatiques (47). Par conséquent, selon les souches de bactéries lactiques sélectionnées, non seulement leur activité acidifiante doit être prise en compte, mais également leur rôle dans l’affinage des fromages et leur compétitivité avec d’autres microorganismes.
Dans le cadre d’une étude où plusieurs espèces de levures ont été isolées de fromages semi-fermes de lait cru de chèvre ou de brebis (48), parmi lesquelles des souches généralement retrouvées dans les fromages affinés en surface étaient présentes (Y. lipolytica, D. hansenii, K. lactis et K. marxianus), une grande variabilité a été observée entre les souches d’une même espèce en rapport à leurs activités protéolytique et lipolytique. Une certaine diversité a également été observée au niveau des moisissures, soit pour des isolats de P. roqueforti retrouvés dans des fromages ou dans l’environnement pour lesquels une grande variabilité a été identifiée par rapport à leur niveau de production de mycotoxines (notamment l’acide mycophénolique, MPA) et leur potentiel
8
mycotoxigène (49). Certaines souches de l’espèce P. camemberti ont également été reconnues pour produire une mycotoxine à de très faibles niveaux, l’acide chloplazonique (28). La production variable de mycotoxines a aussi été observée pour des isolats de P. roqueforti provenant de différents fromages bleus ou encore de l’environnement, ces derniers présentant en outre des profils aromatiques (production de composés volatils) et protéolytiques très différents selon les isolats (50). Une étude préalablement réalisée sur ces mêmes isolats a, par ailleurs, permis de démontrer leur grande variabilité morphologique, autant au niveau macroscopique que microscopique (51). Lors du processus de sélection des souches de moisissures et de levures selon le type de fromage produit, il est ainsi important de prendre en compte tous ces types de caractères phénotypiques pour assurer un développement sécuritaire et satisfaisant des propriétés sensorielles des fromages affinés en surface. Une espèce de levure couramment utilisée dans la microflore secondaire des fromages à croute fleurie et à croute lavée dont les propriétés d’affinage sont grandement dépendantes de la souche est Geotrichum candidum (7). Autrefois redoutée par les fromagers en raison du défaut de « peau de crapaud » qui y était associé (38), G. candidum a démontré de grandes variabilités phénotypiques (morphologie, activité métabolique) selon les souches étudiées, permettant ainsi de sélectionner celles qui présentent des profils optimaux pour leur utilisation caractéristique en surface des fromages (9). Les particularités de cette espèce parfois négligée, mais combien importante, seront ainsi couvertes dans les sections suivantes.
2.2. Geotrichum candidum
L’espèce G. candidum a été retrouvée dans une grande diversité de fromages (52), allant des fromages affinés en surface à croute fleurie (Camembert, Chabichou, Perail, Brie) et à croute lavée (Livarot, Tilsit, Saint-Nectaire, Pont-L’Évêque, Reblochon, Morbier, Époisses), jusqu’aux fromages de type caillé lactique (Quargel, Harzer), bleu (Cabrales), Gruyère, Parmesan, Cheddar de chèvre, Suisse et Jalsberg (10, 36, 38, 53, 54). Il est parfois difficile de savoir si cette espèce est ajoutée volontairement avec les ferments d’affinage ou s’il s’agit d’un microorganisme naturellement présent provenant de l’environnement de la ferme ou de la fromagerie, des travailleurs ou de l’équipement (53). Or, dans plusieurs cas, cette espèce s’est retrouvée parmi les plus dominantes lors de l’affinage de différents fromages (20, 43, 44, 55-57).
Qu’elle soit ajoutée volontairement ou non, la présence de la levure G. candidum dans l’affinage des fromages apparaît nécessaire au développement des propriétés organoleptiques de différents
9
fromages (apparence, texture, goût), notamment grâce à ses capacités alcalinisantes, texturantes et aromatisantes mentionnées précédemment pour l’affinage des fromages à croute fleurie et à croute lavée. Cependant, afin de bien comprendre son impact sur l’affinage des fromages, il est important de bien connaître cette espèce, notamment les caractéristiques phénotypiques et génotypiques qui sont spécifiques à chacune des souches de G. candidum.
2.2.1. Taxinomie et origine
Identifiée pour la première fois par Link en 1809 à partir d’un échantillon de sol (58), l’espèce G. candidum a ensuite été isolée et identifiée à la surface d’un lait en 1850 par Fresenius (59). D’abord considérée comme une moisissure, puis ensuite comme une levure, G. candidum a été nommée de multiples façons, les synonymes les plus communément utilisés étant Oidium lactis ou Oospora lactis (59, 60). L’appellation Geotrichum candidum désigne la forme anamorphe (asexuée) de l’espèce, cette dernière se retrouvant en grande abondance dans la nature, alors que l’appellation Galactomyces candidus désigne la forme téléomorphe (sexuée) de l’espèce, celle-ci étant présente en bien plus faible abondance (60). Les formes asexuée et sexuée descendent chacune du règne des Fungi, sous le phylum des Ascomyta, la classe des Hemiascomycetes et l’ordre des Saccharomycetales, mais diffèrent par leur famille, respectivement celle des Candidaceae et celle des Dipodascaceae (38). Le genre Geotrichum est de fait composé de 22 espèces, celles-ci étant relativement éloignées phylogénétiquement (38).
G. candidum peut être définie comme une espèce ubiquitaire se retrouvant dans l’eau, le sol et l’air, dans les céréales, le riz, le maïs et les fruits très mûrs (raisins, agrumes, tomates, bananes, concombres), puis dans le lait (présent naturellement) et les produits laitiers (souvent ajouté volontairement comme agent d’affinage) (7, 38, 61, 62). Malgré qu’elle soit indésirable en production végétale et maraîchère (pathogène), G. candidum a été reconnue comme ayant un potentiel pathogène pratiquement nul pour le développement d’infections chez les humains sauf pour de rares cas d’humains immunosupprimés et dans des conditions de santé graves (63). De fait, cette espèce de levure a grandement été exploitée dans le domaine alimentaire, particulièrement dans le secteur des produits laitiers, bien qu’elle soit considérée comme un contaminant pour certains d’entre eux (yogourt, fromage à la crème, babeurre, fromage Cottage) (38, 64). Par ailleurs, des souches de G. candidum ont démontré un fort potentiel d’utilisation en biotechnologie en raison de leurs enzymes cellulolytiques (22) ou encore leurs lipases (65).
10
2.2.2. Caractéristiques intrinsèques générales
G. candidum présente une croissance optimale à 25 °C, pour un intervalle de pH entre 5,0 et 5,5 en présence d’oxygène (38). Cette levure a toutefois la capacité de croître à des températures aussi éloignées qu’entre 5 et 38 °C (66) et sur un large intervalle de pH, soit entre 2,2 et 11, dépendamment de la souche (7). G. candidum est reconnue pour son activité fermentaire quasi-nulle, cette dernière étant incapable de fermenter le lactose et le sucrose, et très variablement le glucose (7, 38). Cette espèce de levure a cependant la capacité de croître en présence de différentes sources de carbone, dont le D-glucose, le D-galactose, le DL-lactate, le L-sorbose, le D-xylose et le D-mannitol, ainsi que dans des milieux sans vitamines (61). Par ailleurs, G. candidum est très peu tolérante au sel, sa croissance étant affectée à partir de 1-2 % de NaCl et inhibée à une concentration de 5-6 % (38). Enfin, G. candidum est une espèce qui tolère facilement de faibles concentrations en O2 et de hautes concentrations en CO2 (36). Il est possible
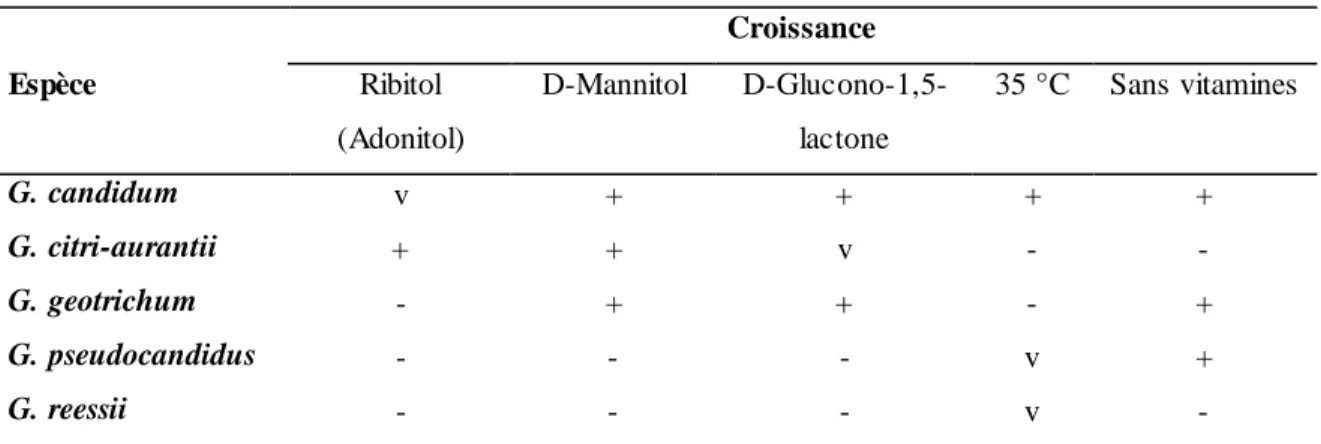
de différencier l’espèce G. candidum des autres espèces du genre Galactomyces en se basant sur le tableau récapitulatif suivant :
Tableau 1. Caractères clés pour identifier les espèces du genre Galactomyces.
Croissance Espèce Ribitol (Adonitol) D-Mannitol D-Glucono-1,5-lactone 35 °C Sans vitamines G. candidum v + + + + G. citri-aurantii + + v - - G. geotrichum - + + - + G. pseudocandidus - - - v + G. reessii - - - v -
+ = positif; - = négatif; v = variable. Tableau tiré intégralement de de Hoog et Smith (61).
Tel que mentionné précédemment, l’espèce G. candidum présente plusieurs caractéristiques phénotypiques qui sont uniques à chaque souche, rendant leur identification par les méthodes traditionnelles plus difficile (20, 67). Ces caractéristiques souche-dépendantes, qui ont majoritairement un impact direct sur l’affinage des fromages, seront décrites dans les sections suivantes.
11
2.3. Diversité des caractéristiques technologiques de l’espèce
G. candidum
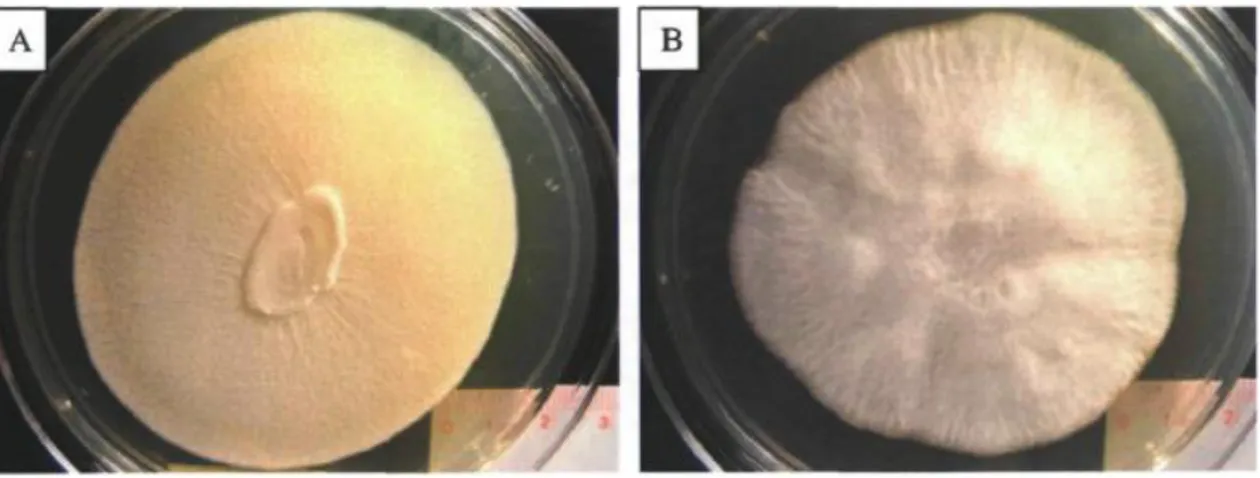
2.3.1. Morphotype et activité physiologique
G. candidum présente la particularité d’être une levure dimorphique, c’est-à-dire qu’au sein de cette espèce, deux morphologies distinctes peuvent être observées selon les souches étudiées (Fig. 3). Le premier morphotype (Fig. 3A) réfère à des colonies de couleur beige-crème, d’aspect levuriforme, qui produisent une grande quantité d’arthrospores (spores asexuées) et dont la température optimale de croissance varie entre 22 et 25 °C (36, 68). Le second morphotype (Fig. 3B) réfère à des colonies blanches et feutrées, d’aspect filamenteux, qui présentent une prédominance en hyphes végétatifs, produisent peu d’arthrospores, et dont la température optimale de croissance varie entre 25 et 30 °C (36, 68). Certaines souches peuvent aussi présenter des morphologies intermédiaires entre les deux précédentes, celles-ci n’ayant pas de descriptions spécifiques, mais formant plutôt un continuum entre le type levuriforme et le type filamenteux (36, 68).
Figure 3. Aspect des souches de Geotrichum candidum LMA-75 (A) et LMA-21 (B) sur milieu
gélosé YEG après 4 jours de croissance à 25 °C dans l'obscurité. Figure tirée intégralement de Alper (69).
12
Dans certains cas, la morphologie des souches de G. candidum a été associée à leur origine, soit le milieu (souvent un produit laitier) duquel elles ont été isolées. Ainsi, les souches isolées de fromages à pâte ferme ou à pâte pressée sont majoritairement de type levuriforme, alors que les morphotypes de souches isolées de fromages à pâte molle peuvent être plus diversifiés selon les études, soit à la fois de type levuriforme, intermédiaire et filamenteux dans certains cas, ou encore majoritairement de type filamenteux dans d’autres situations (7, 32, 68).
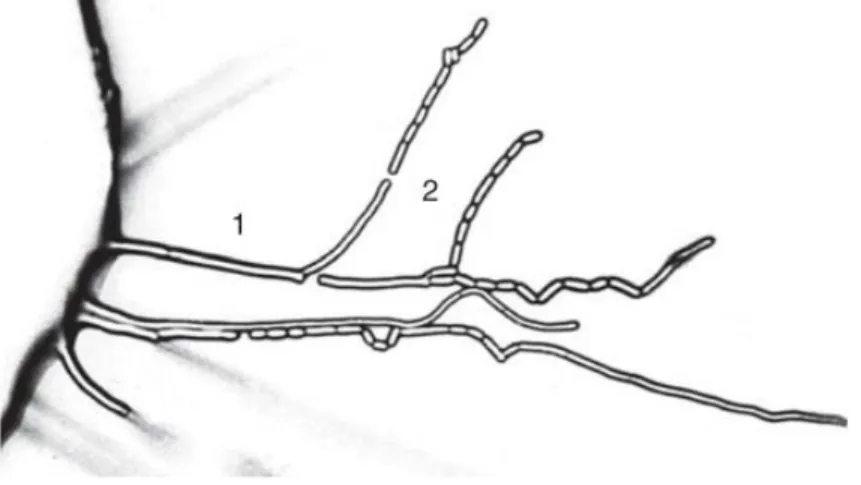
Les hyphes développées dans les colonies de G. candidum sont dichotomiquement ramifiées alors que les arthrospores sont formées suite à la rupture des hyphes (Fig. 4), et non dû au bourgeonnement des cellules, comme c’est le cas pour plusieurs espèces de levures (38). Les arthrospores peuvent avoir une forme cylindrique, ellipsoïdale ou en forme de tonneau, et peuvent avoir des tailles très variables selon le morphotype identifié, soit de 2-6 x 3-25 μm (38, 68).
Figure 4. Microculture de G. candidum à 25 °C après 17h sur milieu d’extrait de malt. [1] Hyphes
végétatives légèrement segmentées. [2] Hyphes sporulées correspondant aux futures arthrospores. Figure tirée intégralement de Eliskases (38).
Les différentes morphologies identifiées pour les souches de G. candidum ont déjà été associées avec certaines de leurs activités métaboliques. En effet, dans le cadre de deux études différentes, des souches levuriformes ont démontré de faibles activités alcalinisante et protéolytique, alors que des souches filamenteuses, dont la croissance mycélienne est souvent plus prononcée, ont pour leur part démontré des activités alcalinisante et protéolytique plus élevées (68, 70). Or, cette corrélation ne semble pas applicable pour toutes les souches de G. candidum puisqu’une autre étude plus récente où
13
l’activité métabolique de huit souches de G. candidum a été documentée a démontré que le taux d’activité protéolytique était très variable, toutes morphologies confondues (15). La résistance des souches au froid a également été associée à leur caractère morphologique. Effectivement, les souches de type levuriforme seraient plus résistantes à des conditions à basses températures du fait qu’elles produisent moins d’hyphes (38, 71). Sachant qu’en industrie alimentaire les ferments sont utilisés sous forme congelée ou lyophilisée, cette caractéristique pourrait devenir un critère intéressant pour orienter le mode de sélection des souches ou du moins en tenir compte lors du traitement de congélation.
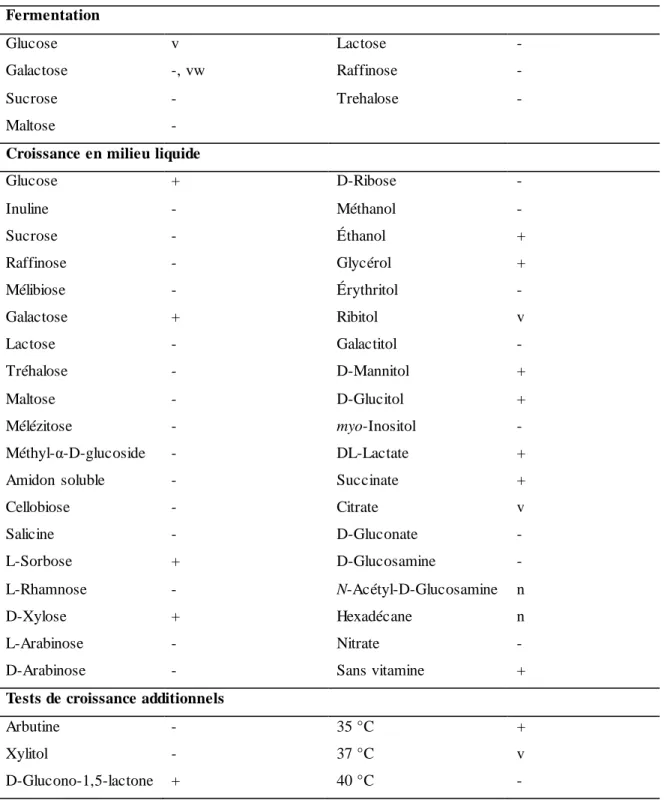
Qu’elle soit reliée ou non à leur morphologie, l’activité physiologique des souches, souvent associée à leurs capacités de fermentation et de croissance sous différentes conditions, démontre également une certaine diversité. De fait, des variabilités en rapport à la fermentation du glucose et du galactose, à l’assimilation du ribitol (adonitol), du citrate, du lactate et du D-mannitol, ainsi qu’en rapport à la croissance à 37 °C ont été identifiées chez différentes souches de G. candidum d’origine laitière ou environnementale (10, 56, 61, 64). Une révision de l’activité physiologique de l’espèce G. candidum a été réalisée par de Hoog et Smith (61) pour permettre une meilleure identification de cette espèce (Tableau 2).
L’évaluation de la morphologie des souches de G. candidum, en plus de leur activité physiologique , a prouvé qu’il existe une énorme diversité au sein de celles-ci. D’une part, cela complique leur identification précise au niveau de l’espèce, nécessitant souvent des tests complémentaires faisant appel à la biologie moléculaire (20, 67). D’autre part, l’évaluation de ces caractéristiques phénotypiques sur des souches clairement identifiée comme étant d’espèce Geotrichum candidum fournit davantage d’informations sur l’activité de ces souches, facilitant leur sélection pour le développement de ferments d’affinage (28).
14
Tableau 2. Activité physiologique décrivant l’espèce Geotrichum candidum.
Fermentation
Glucose v Lactose -
Galactose -, vw Raffinose -
Sucrose - Trehalose -
Maltose -
Croissance en milieu liquide
Glucose + D-Ribose - Inuline - Méthanol - Sucrose - Éthanol + Raffinose - Glycérol + Mélibiose - Érythritol - Galactose + Ribitol v Lactose - Galactitol - Tréhalose - D-Mannitol + Maltose - D-Glucitol + Mélézitose - myo-Inositol - Méthyl-α-D-glucoside - DL-Lactate +
Amidon soluble - Succinate +
Cellobiose - Citrate v Salicine - D-Gluconate - L-Sorbose + D-Glucosamine - L-Rhamnose - N-Acétyl-D-Glucosamine n D-Xylose + Hexadécane n L-Arabinose - Nitrate -
D-Arabinose - Sans vitamine +
Tests de croissance additionnels
Arbutine - 35 °C +
Xylitol - 37 °C v
D-Glucono-1,5-lactone + 40 °C -
+ = positif; - = négatif ; v = variable; w = weakly positive (faiblement positif); n = no data. Tableau tiré intégralement de de Hoog et Smith (61).
15
2.3.2. Protéolyse et catabolisme des acides aminés
L’activité protéolytique de G. candidum est très variable selon la souche étudiée, parfois en raison de sa morphologie, tel que mentionné précédemment, parfois en raison de son origine (industrielle ou indigène), parfois pour des raisons encore non identifiées (7, 15, 36, 38). Cette activité peut être mesurée de différentes façons, soit par l’évaluation du niveau d’activité des enzymes (protéases) intra- et extracellulaires, ou encore par l’évaluation physico-chimique de la dégradation des protéines au cours du temps (dosage des peptides et/ou acides aminés libres par exemple).
L’étude de l’activité enzymatique intra- et extracellulaire de différentes souches de G. candidum a démontré dans la majorité des cas que les enzymes intracellulaires étaient davantage actives que les enzymes extracellulaires, bien que ces deux types d’enzymes présentaient des caractères similaires lorsque soumises aux mêmes conditions de croissance (36, 72, 73). De plus, des souches de G. candidum ont pu être séparées dans certains cas en deux groupes distincts selon leur niveau d’activité enzymatique extracellulaire, la majorité se classant avec une faible activité protéolytique, et la minorité se classant avec une intense activité protéolytique (70, 73). Les protéinases des souches de G. candidum sont reconnues pour hydrolyser les caséines β et αs1 à des valeurs optimales de pH
entre 5,5 et 6,0 (38, 72). Autant les méthodes physico-chimiques que métatranscriptomiques ont permis d’établir que celles-ci sont principalement actives en début d’affinage des fromages, particulièrement lors des deux premières semaines (12, 24, 25). Ce phénomène représente la phase primaire de la protéolyse où les caséines sont réduites en fragments peptidiques de grandes et moyennes tailles, contribuant ainsi directement à la modification de la texture du fromage par le ramollissement de la pâte (29).
Les souches de G. candidum utilisées ou retrouvées dans les fromages affinés en surface peuvent non seulement être actives en phase primaire de protéolyse, mais plus encore en phase secondaire de protéolyse. Lors de cette dernière, les aminopeptidases et les carboxypeptidases des souches de G. candidum dégradent les peptides de grands et moyens poids moléculaires en des peptides de plus petits poids moléculaires et en acides aminés libres, ceux-ci constituant d’importants précurseurs de composés aromatiques (7, 12, 35, 74). Encore une fois, les méthodes physico-chimiques et métatranscriptomiques ont permis d’établir que l’expression des peptidases est pratiquement simultanée avec celles des protéinases chez des souches de G. candidum, soit lors des deux premières semaines d’affinage (12, 24, 25). Parmi les acides aminés libres produits par activité peptidolytique, l’acide aminé L-méthionine est le plus important de tous (35). Ce composé est précurseur de
16
nombreux composés soufrés volatils (CSV) responsables des arômes caractéristiques des fromages de type Camembert (7, 35, 75).
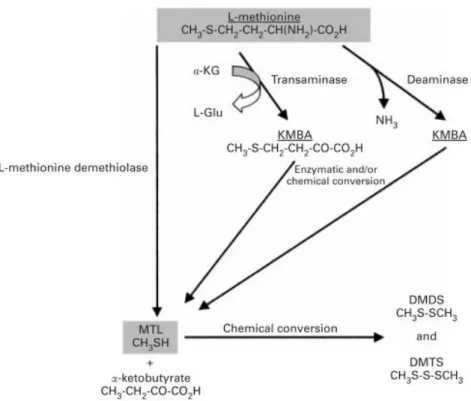
Deux voies principales ont été identifiées pour le métabolisme de l’acide aminé L-méthionine chez différents microorganismes (Fig. 5). La première se fait en une étape par l’action d’une déméthiolase, souvent la méthionine γ lyase intracellulaire, qui transforme la L-méthionine en méthanethiol (MTL), et qui produit par le fait même de l’ammoniac (NH3) et de l’α-cétobutyrate (32, 75, 76). Cette réaction de bioconversion peut également être induite par deux autres enzymes, la cystathionine β lyase et la cystathionine γ lyase, cette dernière se retrouvant chez l’espèce G. candidum et ayant été exprimée par certaines souches dans le cadre de différentes études (11, 24, 25, 77). La seconde voie possible se réalise en deux étapes : 1) une amino-transférase ou transaminase produit de l’acide 4-méthylthio-2-oxobutyrique (α-keto ɣ-methyl thio-oxobutyric acid, KMBA) et du glutamate à partir de l’acide aminé L-méthionine et en présence d’un accepteur d’amine, souvent l’α-cétoglutarate (α-ketoglutarate); 2) une déméthiolase catalyse la conversion du KMBA en MTL (32, 75, 76). Cette voie métabolique a également été exprimée dans le cadre de différentes études évaluant l’influence de l’activité enzymatique de G. candidum sur le développement d’arômes, notamment par la production de CSV (75, 76, 78, 79).
Le MTL ainsi produit est connu pour être rapidement transformé par G. candidum en CSV aromatiques, tels que les S-méthyl-thioesters et les sulfures (Tableau 3). La concentration du MTL et des différents composés aromatiques libérés est grandement variable selon la souche de G. candidum utilisée. En effet, l’évaluation du niveau de production de ces composés dans différents milieux (milieu modèle de fromage liquide (80), caillé tamponné (81), caillé lactique (82), milieu de culture PDB (potato dextrose broth) (75), milieu modèle de fromage (15)) a permis de prouver cette variabilité entre plusieurs souches de G. candidum, mettant encore en évidence l’importance d’une sélection réfléchie pour un ferment d’affinage. Cependant, bien que la production de composés soufrés puisse être faible pour certaines souches, le seuil de détection de l’odorat humain pour ces composés aromatiques est reconnu pour être très bas, par exemple à partir de 0,02 ppm pour le MTL et 60 ppm pour le DMS (diméthylsulfide) (32, 35).
Le métabolisme d’autres acides aminés peut également mener à la production d’ammoniac et à celle de plusieurs composés aromatiques d’importance (35). En effet, l’acide glutamique, l’acide aspartique, la leucine, la phénylalanine, la glutamine, l’alanine, la valine, l’isoleucine, l’arginine, la cystéine, la sérine et la thréonine sont tous des acides aminés pouvant être catabolisés par G. candidum (15, 25, 74, 83).
17
Figure 5. Dégradation de l’acide aminé L-méthionine chez différents microorganismes d’affinage.
KMBA = acide 4-méthylthio-2-oxobutyrique; α-KG = α-cétoglutarate; L-Glu = L-glutamate; MTL = méthanethiol; DMDS = Disulfure de diméthyle; DMTS = Trisulfure de diméthyle. Figure intégralement tirée de Bonnarme et coll. (76).
De fait, par réaction de désamination oxydative, ces acides aminés peuvent d’abord être transformés en α-cétoacides, puis en aldéhydes par des décarboxylases (désamination), pour ensuite être réduits en alcools primaires ou oxydés en acides par des déshydrogénases ou des oxydases (7, 29, 35). Il semblerait que l’acide glutamique est une source importante d’énergie pour G. candidum puisque l’expression de l’enzyme NAD-glutamate-déshydrogénase (directement impliquée dans le métabolisme de cette substance) a largement été observée pour cette espèce dans certaines études transcriptomiques (24, 25, 83). Par ailleurs, il a été démontré dans des modèles fromagers que des souches de G. candidum ont la capacité de produire certains alcools primaires et certains acides par le catabolisme d’acides aminés (Tableau 3) (15, 82).
Somme toute, l’action de Geotrichum candidum sur la protéolyse et le catabolisme des acides aminés en fabrication fromagère a un impact direct sur le développement de la texture et des arômes. Or, il a été démontré que cette activité est très variable selon la ou les souches de G. candidum sélectionnées,
18
chacune d’entre elles pouvant être notamment rattachée à une ou plusieurs voies cataboliques des acides aminés bien spécifiques, et donc à une libération bien variable d’arômes (11, 17, 84).
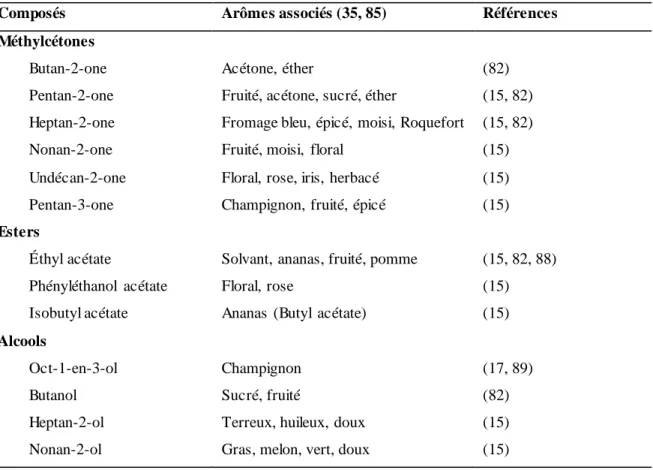
Tableau 3. Liste des composés aromatiques produits par Geotrichum candidum par catabolisme des
acides aminés.
Composés Arômes associés (35, 85, 86) Références
S-méthyl-thioesters
S-méthyl-thioacétate (MTA) Chou-fleur cuit, alliacé (75, 78-81, 87)
S-méthyl-thiobutyrate (MTB) Non précisé (78, 80)
S-méthyl-thiopropionate, (MTP) Fromager, alliacé (78-80)
S-méthyl-thioisobutanoate (MTIB) Animal, sulfureux (80)
S-méthyl-thioisovalérate (MTIV) Non précisé (80)
S-méthyl-thiohexanoate (MTH) Non précisé (80)
Sulfures
Sulfure de diméthyle (DMS) Chou, chou bouilli, sulfureux, (75, 78-82)
Disulfure de diméthyle (DMDS) Chou-fleur, ail, fromage très affiné (15, 75, 78-82, 87) Trisulfure de diméthyle (DMTS) Alliacé, viande, fromage très
affiné (75, 78-82, 87)
Alcools a
Propanol Alcool, sucré (15)
2-Méthylpropan-1-ol Alcool (15, 82, 88, 89)
3-Méthylbutan-1-ol Alcool, fruité (15, 82, 89)
Phényléthanol Rose, floral (15)
Phénol Floral, médical (15)
Acides a
Acide 2-méthylpropanoïque Sucré, pomme, rance, beurre (15)
Acide butanoïque Fromager, putride, rance, sueur (15, 88)
Acide 3-Methylbutanoïque Fruité, sûr, sueur (15)
Acide 2-Methylbutanoïque Fruit pourri, sueur, léger (15)
Acide pentanoïque (15)
Acide hexanoïque Âcre, sûr, fromage bleu (15)
Acine octanoïque Cire, savon, chèvre, moisi, rance,
fruité (15)
19
2.3.3. Lipolyse et catabolisme des acides gras
Souvent utilisées pour enrichir certaines huiles en acides gras polyinsaturés ou encore en acide linoléique conjugué, les lipases de G. candidum sont également grandement utilisées pour l’hydrolyse des lipides et la production de composés aromatiques dans les aliments, notamment les fromages (65). Tout comme pour l’activité protéolytique, l’activité lipolytique de G. candidum est spécifique à chaque souche (38, 65). Plusieurs études sur la caractérisation des lipases extracellulaires de G. candidum ont permis de déterminer qu’il existait deux gènes homologues codant pour deux lipases (I et II, ou A et B selon les études) légèrement différentes (des isoformes), notamment en rapport à leurs séquences en acides aminés ainsi qu’à leur spécificité pour les substrats, soit les acides gras insaturés (7, 16, 38, 90-92). De fait, la spécificité des lipases pour leurs substrats semble varier selon la souche de G. candidum (93).
Les lipases de certaines souches de G. candidum ont ainsi démontré une spécificité pour l’hydrolyse des triacylglycérols présentant des acides gras insaturés à longue chaîne avec un double lien en position cis-9, notamment l’acide oléique (18:1) (36, 65). De fait, les grandes proportions d’acide oléique retrouvées dans les fromages de type Camembert en début d’affinage sont majoritairement dues à l’action de ces lipases chez G. candidum (8, 37, 38). Certaines souches vont également présenter une spécificité pour d’autres acides gras insaturés en position cis-9, tels que l’acide linoléique (18:2), l’acide linolénique (18:3) et l’acide palmitoléique (16:1) (38, 65). La libération et l’utilisation de certains acides gras saturés à courtes chaînes (4:0 à 14:0) a également été observée en début d’affinage d’un fromage de type Camembert pour une souche de G. candidum (94) et dans un fromage. Dans la même étude, une importante libération d’acides gras 16:0 et 18:0 par G. candidum a également été observée en fin d’affinage.
Il a été rapporté que l’action lipolytique de G. candidum avait un effet direct sur l’affinage des fromages, notamment pour le développement des arômes, comme celui typique du Camembert (7, 65, 94). De fait, certaines lipases ont démontré une activité optimale dans des intervalles de pH plutôt similaires à ceux des fromages affinés en surface (entre 5,5 et 8,0) (7, 91, 93). Les acides gras libres sont à eux seuls des composés importants dans le développement de l’arôme des fromages, mais ils sont également de précieux précurseurs d’arômes pour les méthylcétones, les alcools, les lactones, les acides et les esters (Tableau 4)(35). Par conséquent, les acides linoléique et linolénique ont été reconnus comme les précurseurs d’un alcool majeur retrouvé dans les fromages à croute fleurie, l’oct-1-en-3-ol (35). Ce dernier peut toutefois apporter des défauts de saveurs (carton) s’il est produit en trop grande quantité (17). Également, l’acide oléique a été identifié comme le précurseur majeur
20
des méthylcétones, les composés les plus abondants dans le fromage de type Camembert (25-60 μmol/100 g de gras) qui sont produits par β-oxydation (β-cétoacyl-coenzyme A) puis décarboxylation (β-céto-acyl-décarboxylase) (17, 35). Ces derniers peuvent procurer des arômes spécifiques aux fromages (Tableau 4), bien qu’ils puissent également être transformés par des réductases en alcools secondaires (35).
Tableau 4. Liste des composés aromatiques produits par Geotrichum candidum par catabolisme des
acides gras.
Composés Arômes associés (35, 85) Références
Méthylcétones
Butan-2-one Acétone, éther (82)
Pentan-2-one Fruité, acétone, sucré, éther (15, 82)
Heptan-2-one Fromage bleu, épicé, moisi, Roquefort (15, 82)
Nonan-2-one Fruité, moisi, floral (15)
Undécan-2-one Floral, rose, iris, herbacé (15)
Pentan-3-one Champignon, fruité, épicé (15)
Esters
Éthyl acétate Solvant, ananas, fruité, pomme (15, 82, 88)
Phényléthanol acétate Floral, rose (15)
Isobutyl acétate Ananas (Butyl acétate) (15)
Alcools
Oct-1-en-3-ol Champignon (17, 89)
Butanol Sucré, fruité (82)
Heptan-2-ol Terreux, huileux, doux (15)
Nonan-2-ol Gras, melon, vert, doux (15)
Encore une fois, la production de composés aromatiques est fortement dépendante de la souche de G. candidum utilisée, le type d’arôme libéré ainsi que sa concentration pouvant grandement varier (15, 17, 82).