HAL Id: dumas-01757548
https://dumas.ccsd.cnrs.fr/dumas-01757548
Submitted on 3 Apr 2018
HAL is a multi-disciplinary open access L’archive ouverte pluridisciplinaire HAL, est
Réadmissions après chirurgie urologique en france :
étude nationale de 2010 à 2012
Quentin Manac’H
To cite this version:
Quentin Manac’H. Réadmissions après chirurgie urologique en france : étude nationale de 2010 à 2012 . Médecine humaine et pathologie. 2017. �dumas-01757548�
AVERTISSEMENT
Cette thèse d’exercice est le fruit d’un travail approuvé par le jury de soutenance et réalisé dans le but d’obtenir le diplôme d’Etat de docteur en médecine. Ce document est mis à disposition de l’ensemble de la communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l’auteur. Ceci implique une obligation de citation et de référencement lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite encourt toute poursuite pénale.
Code de la Propriété Intellectuelle. Articles L 122.4
UNIVERSITÉ PARIS DESCARTES
Faculté de Médecine PARIS DESCARTES
Année 2017
N° 197
THÈSE
POUR LE DIPLÔME D’ÉTAT
DE
DOCTEUR EN MÉDECINE
Réadmissions après chirurgie urologique en France :
étude nationale de 2010 à 2012
Présentée et soutenue publiquement
le 4 octobre 2017
Par
Quentin MANAC’H
Né le 8 août 1988 à Paris (75)
Dirigée par Mme Le Docteur Véronique Phé, CCA
REMERCIEMENTS
À M. Le Professeur Marc-Olivier Bitker.
Qui me fait l’honneur de présider le jury de cette thèse. Vous avez encadré avec bienveillance mes premiers pas d’interne d’urologie, et avez accepté de poursuivre votre enseignement à travers mon futur clinicat. Je vous remercie pour votre disponibilité et votre écoute.
À Mme Le Docteur Véronique Phé.
Qui a accepté de diriger ce travail. Tu m’as encadré durant tout mon internat sur de nombreux projets, en restant toujours disponible, même dans l’urgence. Pour ta présence et ta gentillesse, merci.
À M. Le Professeur Emmanuel Chartier-Kastler.
Qui me fait l’honneur de juger ce travail. Je vous remercie de votre pédagogie dont j’ai pu profiter à de multiples reprises, en tant qu’interne à la Pitié, puis à Garches et à l’occasion de nombreux congrès. Je suis heureux de pouvoir de nouveau bientôt travailler avec vous.
À M. Le Professeur Morgan Rouprêt.
Qui me fait l’honneur de juger ce travail. Merci de ton encadrement, de ton soutien, et de ta confiance ces dernières années.
À M. Le Docteur Yann Neuzillet.
Qui me fait l’honneur de juger ce travail. Six mois à Foch sont passés vite, mais j’ai pu pleinement profiter de ton encadrement chirurgical et de ta bonne humeur. Merci.
À mes parents.
Qui m’ont soutenu durant toutes ces années d’études et m’ont permis, à travers leur expérience et leur sagesse, de toujours avoir avec le recul nécessaire. Merci.
À mes frères.
Qui, dans un registre différent, ont toujours su trouver du temps pour s’occuper de leur petit frère.
À mes amis.
Harold, toujours fidèle, 15 ans d’amitié, de poker et de Citadelle, de squash et de Spritz… Cyrillus, des urgences de Monastir à la salle de garde de Mignot, en passant par le café de France de Marrakech et les frozen margaritas de la Perla, que de souvenirs et de rigolades, le meilleur reste à venir…
Mes sous-khôleur : Manu, Corentin, Christophe et Kenza, que de soirées passées ensemble !! À mes collègues de médecine : Aude, Louise, Féli, Capu, Malte, Jean, H, Brenier, Damien, Xav et Charles.
Les années passent mais l’amitié reste.
À mes co-internes : Serge, Charles, Julien et Julien (Dream team), Constance, Simon, Laura, Greg et Guillaume (les Mousquetaires), Marie, Ionut, Hanna, Nathalia et Julia.
Aux fidèles de la Roche : Seb, Charles, Greg et Bertrand.
À Jeanne.
Sans qui ce travail eut été impossible. Merci pour votre patience, et en espérant mener d’autres travaux avec vous.
Et surtout, à Valou, qui a accepté de partager ma vie, et qui donne un sens à celle-ci. Jamais personne n'aimera tes qualités autant que je ne peux vivre sans tes défauts.
TABLE DES MATIÈRES
REMERCIEMENTS... 2
LISTE DES ABRÉVIATIONS ... 6
INTRODUCTION ... 7
1.Les réadmissions : définition et implication dans les systèmes de santé ... 7
2.Les réadmissions : état des connaissances ... 10
2.1 Les réadmissions en France ... 10
2.2 Les réadmissions en urologie ... 10
3.Objectifs ... 13
MATÉRIELS ET MÉTHODES ... 14
1.Collecte des données ... 14
2.Critères de jugement ... 16
3.Analyses statistiques ... 18
4.Éthique ... 19
RÉSULTATS ... 20
1.Population étudiée ... 20
2.Analyse globale des réadmissions ... 21
3.Stratification selon la procédure chirurgicale ... 23
DISCUSSION... 26
1.Taux de réadmission... 26
2.Facteurs de risque de réadmission ... 28
3.Prévention des réadmissions ... 30
4.Limites de l’étude ... 32
CONCLUSION ... 33
ANNEXES ... 34
1.La détermination des Groupes Homogènes de Séjours ... 34
2.Publication... 36
BIBLIOGRAPHIE ... 37
RÉSUMÉ ... 49
LISTE DES ABRÉVIATIONS
ATIH Agence Technique de l’Information sur l’Hospitalisation
CCAM Classification Commune des Actes Médicaux CIM Classification Internationale des Maladies CH Centre Hospitalier non universitaire CHU Centre Hospitalier Universitaire CMD Catégorie Majeure de Diagnostic
CNIL Commission Nationale de l'Informatique et des Libertés DGOS Direction Générale de l'Offre de soins
DS Durée de Séjour
ESPIC Établissement de Santé Privé d'Intérêt Collectif GHM Groupe Homogène de Malades
GHS Groupe Homogène de Séjours
HAS Haute Autorité de Santé
HRRP Hospital Readmission Reduction Program
OR Odds Ratio
PMSI Programme de Médicalisation des Systèmes d'Information PSI Patient Safety Indicators
RRAC Récupération Rapide Après Chirurgie RSS Résumé de Sortie Standardisé
INTRODUCTION
1. Les réadmissions : définition et implication dans les systèmes de santé
Les réadmissions hospitalières sont des situations fréquentes au décours d’une prise en charge chirurgicale (1–3). L’étude de ces réadmissions s’est développée de manière concomitante à l’émergence de la chirurgie ambulatoire, dont elle constitue un des principaux critères d’évaluation (4). Plusieurs raisons justifient l’utilisation des taux de réadmission comme indicateur de qualité des établissements de santé (5). Premièrement, il a été décrit une association entre la qualité des soins de l’hospitalisation initiale et le taux de réadmission (6– 8). Deuxièmement, les réadmissions sont des évènements fréquents, qui peuvent survenir pour un large éventail de pathologies, contrairement au décès par exemple. Troisièmement, les données nécessaires pour calculer les taux de réadmission, et les ajuster en fonction des données cliniques, sont disponibles dans la plupart des systèmes de santé des pays développés (5).
Une réadmission est définie comme toute ré-hospitalisation, inattendue ou programmée, se déroulant dans les 30 jours après la chirurgie initiale (4). Cette définition, qui est actuellement la plus couramment admise et utilisée (4,9–11), a néanmoins ses limites. Pour certains auteurs, seules les réadmissions ayant un caractère inattendu, ou réadmissions en urgence, devraient être prises en compte, afin de limiter l’impact des réadmissions programmées, par exemple pour un second acte chirurgical (12–15). La principale limite de cette définition est l’exclusion systématique des réadmissions planifiées pour le traitement d’une complication,
un seuil de 90 jours (18–20), quand certains étudient l’impact du délai de réadmission sur la gravité de celle-ci (21). Enfin, l’intérêt des réadmissions comme marqueurs de qualité des soins en chirurgie est parfois remis en cause, car considéré comme non dépendant de la qualité de l’acte chirurgical (22), ou comme trop dépendant de facteurs socio-économiques non pris en compte dans la majorité des études (23,24). La variété de ces définitions, qui sont le plus souvent motivées par les spécificités des actes réalisés et de leurs complications, reflètent la complexité du sujet.
Néanmoins, la définition retenue dans la grande majorité des études reste identique : est considérée comme réadmission toute ré-hospitalisation dans les 30 jours suivant l’acte chirurgical. C’est d’ailleurs cette définition qui est utilisée par les systèmes de santé comme indicateur de qualité des soins (4,14,25). Au cours des dernières années, les autorités de tutelles des systèmes de santé, notamment des pays anglo-saxons, ont mis au point de nombreuses initiatives visant à réduire les réadmissions afin de contrôler les dépenses de santé et d'améliorer la qualité des soins.
Aux États-Unis, la réduction du nombre de réadmissions non planifiées est une priorité médicale et politique. Plusieurs études ont évalué, toutes pathologies chirurgicales confondues, des taux de réadmission à 30 jours entre 5 et 20%, entraînant des coûts additionnels de 40 milliards de dollars par année (10). Un programme national de réduction de réadmission a été mis en place en 2012, appelé Hospital Readmission Reduction Program (HRRP). Ce programme a fixé initialement des seuils de réadmissions pour 3 pathologies médicales (syndrome coronarien aigu, œdème aigu pulmonaire et pneumopathie), élargis en 2015 à 2 procédures chirurgicales (pose de prothèse de hanche et arthroplastie de genou) (15,26). En cas de taux de réadmission supérieurs à la moyenne pour ces pathologies ciblées, les remboursements alloués aux hôpitaux concernés sont réduits. La mise en place de ce programme a entraîné une diminution du taux de réadmission entre 2012 et 2013 de 18,5 à
17,5 % (14,27,28). Cependant, ce programme a provoqué un allongement de la durée moyenne de séjour, et a aggravé l’endettement des établissements de santé prenant majoritairement en charge des patients socialement précaires (14,24,29).
2. Les réadmissions : état des connaissances
2.1 Les réadmissions en France
En France, la Direction Générale de l'Offre de Soins (DGOS) et la Haute Autorité de Santé (HAS) ont mis en place depuis 2009 une programme d’évaluation d’indicateurs de sécurité des soins hospitaliers, ou Patient Safety Indicators (PSI) (30). Les réadmissions à 30 jours font partie des critères en cours d’évaluation avec pour objectif, à terme, de les intégrer dans les démarches d’accréditation des établissements de santé (4).
En France, peu d'études ont exploré les taux de réadmission après chirurgie dans une perspective nationale (31,32). À partir de l’analyse de 1 686 602 procédures réalisées en 2010, Lefèvre et al. rapportent un taux de réadmission à 30 jours de 5,9% toutes chirurgies confondues (32). Deux procédures urologiques – la résection transurétrale de prostate et l’urétéroscopie – font partie des 10 procédures ayant les taux de réadmission les plus élevés, avec des taux respectifs de 8,0% et 12,6%. Selon un autre étude publiée en 2015, le taux de réadmission dans les 30 jours suivant une intervention chirurgicale urologique a augmenté de 12 à 14% entre 2002 et 2012, ce qui en fait le deuxième plus grand secteur chirurgical pourvoyeur de réadmissions après l'ophtalmologie (33).
2.2 Les réadmissions en urologie
Plusieurs études ont tenté d'identifier les facteurs prédictifs de réadmission après chirurgie urologique afin de cibler les mesures préventives nécessaires pour les patients à haut risque. Il coexiste deux types d’études selon la nature des bases de données exploitées. Les études « classiques » exploitent les données du dossier médical du patient. Souvent de plus faible ampleur, elles offrent l’avantage d’identifier des facteurs de risque précis sur la pathologie (stade TNM, taille du calcul, etc.) ou sur le déroulement du séjour (méthode chirurgicale, complication per ou post opératoire, fragments résiduels, etc.), et de connaître clairement le diagnostic lors de la réadmission. À l’inverse, l’exploitation des bases nationales
administratives (Programme de Médicalisation des Systèmes d'Information (PMSI) en France, State Inpatient Database aux États-Unis), permet de réaliser des études de grande ampleur,
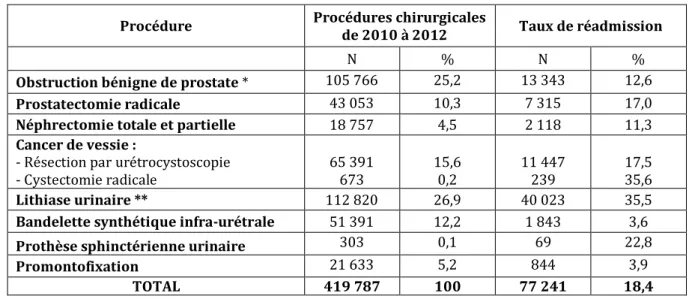
mais avec des données cliniques plus limitées. Le tableau 1 résume les taux de réadmission et les facteurs de risque après une chirurgie urologique rapportés dans les études antérieures (1– 3,34–54).
Tableau 1 : Revue de la littérature des principales études sur les réadmissions dans les 30
jours après chirurgie urologique
Référence Intervention réadmission à Taux de
30 jours Facteur de risque Rambachan3 Fagerström34 Résection transurétrale de prostate 4,2–10,2 -Âge -Score ASA -Trouble de l’hémostase -Résection monopolaire Pilecki35 Schmid36 Leow2,37 Chappidi38 Fridriksson39 Prostatectomie radicale 3,8–10,0 -Âge -Score ASA -Tabagisme -Faible volume d’activité -Complication post opératoire -Chirurgie ouverte Stimson40 Hu41 Leow2 Minnillo1 Pak42 Chappidi43 Cystectomie radicale 20,7–28,5 -Âge -Score de Charlson -IMC -Sexe féminin -Temps opératoire -DS courte -Complication post opératoire -Type de dérivation urinaire
-Sortie dans un centre de convalescence Leow2 Autorino44 Hwang45 Schmid36 Brandao46 Maurice47 Néphrectomie totale ou partielle 6,3–9,7 -Score de Charlson 5 -Score ASA -Diabète -Complication post opératoire -Chirurgie ouverte -DS prolongée -RENAL nephrometry score Buldu48 Scales49 Beiko50 Tepeler51 Bloom52 Chirurgie lithiasique 4,0–15,6 -Fragments résiduels -Complication post opératoire -DS longue
-Faible volume d’activité -Absence de sonde urétérale préopératoire -Anomalie anatomique
Cohen53
Rambachan3 Bandelette sous
urétrale 0,85–0,9 -Indice de comorbodité modifié ≥3 (mFI) -Complication peropératoire -Âge Pederzoli54 Prothèse sphinctérienne 7,9 -Score de Charlson -Diabète -DS longue ASA= American Society of Anesthesiologists, DS= Durée de Séjour
À partir de ces études, on peut classifier les facteurs de risque de réadmission en trois catégories :
- les facteurs de risque liés au patient : âge, sexe, indice de comorbidité, classification de la pathologie (stade TNM, RENAL score, taille du calcul, etc.) ;
- les facteurs de risque liés à l’établissement : statut administratif, volume d’activité chirurgicale ;
- les facteurs de risque liés au séjour : durée du séjour, complication per ou postopératoire, procédure chirurgicale (voie d’abord, méthode de fragmentation lithiasique, etc.).
Par ailleurs, des liens ont été établis, hors chirurgie urologique, entre le volume d’activité chirurgicale, le statut universitaire de l’établissement et les taux de réadmission (55,56).
3. Objectifs
Compte-tenu du manque d’études à l’échelle nationale, notre objectif était d'évaluer les taux de réadmission dans les 30 jours après une procédure chirurgicale urologique planifiée en France et d'identifier les facteurs prédictifs de réadmission.
MATÉRIELS ET MÉTHODES
1. Collecte des données
Les données relatives aux hospitalisations ont été obtenues grâce à des requêtes effectuées dans la base de données nationale française, le Programme de Médicalisation des Systèmes d'Information (PMSI). Il recueille les données de tous les hôpitaux français dans un but épidémiologique et surtout pour permettre l'allocation des ressources. Cette base française contient toutes les données administratives relatives aux soins de courte durée réalisés dans les établissements de santé français. L’exhaustivité du recueil est estimée supérieure à 99% de l’intégralité des séjours, et sa fiabilité est soumise à des vérifications itératives organisées par l’Agence Régionale de Santé (ARS) (57). Un numéro anonyme unique est attribué à chaque patient, ce qui permet de suivre le circuit de santé du patient dans le système de santé français. Les données disponibles comprennent des informations sur la démographie du patient (sexe et âge), les codes des diagnostics principaux et associés (selon la Classification Internationale des Maladies ou CIM, 10ème édition), les codes des procédures réalisées durant le séjour
(selon la Classification Commune des Actes Médicaux ou CCAM, 11ème édition), la
destination après la sortie (retour à domicile, transfert dans un autre hôpital, décès), la durée du séjour à l'hôpital (DS) et le code d'identification de l'hôpital. La comorbidité et la gravité de la maladie pour chaque patient ont été classées selon le Groupe Homogène de Malades (GHM). Selon la sévérité et le nombre d’antécédents, le patient est affecté à un GHM allant de 1 (base) à 4 (le plus grave). Les GHM sont mis à jour annuellement par l’Agence Technique de l’Information sur l’Hospitalisation (ATIH). Ils ne tiennent pas compte de la complexité de la chirurgie. L’annexe 1 détaille les modalités de sélection d’un GHM et de son niveau de sévérité.
Les données de toutes les hospitalisations concernant la chirurgie urologique programmée et enregistrées entre janvier 2010 et novembre 2012 en France ont été analysées (tableau 2).
Afin de limiter les interactions entre les hospitalisations récentes et l’intervention chirurgicale urologique, nous n'avons sélectionné que des patients de novo (patient non hospitalisé durant les 12 mois précédant la chirurgie urologique). Nous avons également exclu :
- Les patients âgés de moins de 16 ans ;
- Les patients hospitalisés pour un diagnostic principal non urologique ou avec une autre intervention chirurgicale non urologique réalisée durant le même séjour ;
- Les patients décédés ou transférés dans un autre établissement après la procédure urologique.
Les patients pris en charge en décembre 2012 ont également été exclus car nous n’avions pas le recul nécessaire pour collecter les données de suivi.
Tableau 2 : Détail des procédures chirurgicales et codes CCAM
Pathologie Procédure chirurgicale Code CCAM
Obstruction bénigne de prostate
Résection par urétrocystoscopie JGFA015
Adénomectomie par voie haute JGFA005/009
Cancer de prostate Prostatectomie radicale* JGFC001-JGFA006
Cancer du rein Néphrectomie*
JAFA002/009/010/023/029/032 JAFC001/006/010
Néphrectomie partielle* JAFA008/019/024/030-JAFC005
Cancer de vessie Résection par urétrocystoscopie JDNE001-JDFE001/002
Cystectomie radicale JDFA001/005/008/016/021/023/024/025
JFFA001/003/018/22
Lithiase urinaire
Pose d'une sonde urétérale JCLE001
Lithotritie extracorporelle JCNM001/002-JANM001/002
Urétéroscopie rétrograde JCGE001/005/006-JANE002/005
Néphrolithotomie percutanée JAGF001/003
Incontinence urinaire Bandelette synthétique infra-urétrale JDDB001/005/007
Prothèse sphinctérienne urinaire JELA002/003
Prolapsus d’organe
pelvien Promontofixation * JKDC001-JLDC015-JKDA002/003 JLDA001/003
2. Critères de jugement
Notre critère de jugement principal était le taux de réadmission dans les 30 jours suivant une procédure chirurgicale urologique planifiée. Les facteurs de risque de réadmission ont été évalués à partir des variables indépendantes suivantes (tableau 3) :
- Sexe ; - Âge ;
- Groupes Homogènes de Malades séparés en deux catégories : faible morbidité (GHM 1 ou 2) et morbidité élevée (GHM 3 ou 4) ;
- Durée de séjour (DS) de l’hospitalisation initiale ;
- Modalité d'hospitalisation initiale : hospitalisation ambulatoire ou conventionnelle ; - Volume d’activité de l’hôpital : nombre de procédures chirurgicales urologiques
annuelles réalisées dans l’établissement initial ;
- Volume hospitalier de chirurgie ambulatoire : nombre de procédures chirurgicales urologiques annuelles réalisées en ambulatoire dans l’établissement initial ;
- Volume d’activité spécifique de l’hôpital : nombre de procédures annuelles réalisées dans l’établissement initial ;
- Statut administratif de l’établissement de santé : Centre Hospitalier Universitaire (CHU), Centre Hospitalier non universitaire (CH) et Établissement de Santé Privé d'Intérêt Collectif (ESPIC), ou hôpital privé hors ESPIC.
Tableau 3 : Facteurs de risque étudiés
CHU= Centre Hospitalier Universitaire, CH= Centre Hospitalier non universitaire, ESPIC= Établissement de Santé Privé d'Intérêt Collectif
Liés au patient Liés à l’établissement Liés au séjour
- Âge - Sexe - Groupe Homogène de Malades : • GHM 1-2 • GHM 3-4 - Statut administratif : • CHU • CH et ESPIC • Privé hors ESPIC
- Volume global d’activité
urologique
- Volume d’activité urologique en ambulatoire
- Volume d’activité spécifique
- Durée du séjour initial - Modalité d’hospitalisation initiale :
• Ambulatoire • Conventionnelle
3. Analyses statistiques
Les statistiques descriptives comprennent les tableaux de fréquences, les moyennes et les écarts types. En analyse univariée, le test de χ2 et l’analyse de variance ont été effectués pour
identifier les facteurs de risque de réadmission. Une valeur p de <0,05 a été considérée comme statistiquement significative. Seuls les facteurs de risque significatifs en univariée ont été inclus dans l’analyse multivariée. En analyse multivariée, la régression logistique a été réalisée pour évaluer les facteurs de risque. Les analyses statistiques ont été effectuées à l'aide du logiciel SAS/STAT (édition 9.3).
4. Éthique
Cette étude a utilisé des données de patients anonymisées qui ne nécessitaient pas l'approbation d'un comité d'éthique selon la loi française. Toutefois, l'utilisation de cette base de données aux fins de recherche en santé publique a été soumise et acceptée par la Commission Nationale de l'Informatique et des Libertés (CNIL).
RÉSULTATS
1. Population étudiée
Entre janvier 2010 et novembre 2012, 918 274 procédures chirurgicales urologiques ont été effectuées, représentant 880 386 séjours hospitaliers. Au total, 419 787 patients ont été inclus, dont 77 241 (18,4%) ont été réadmis au cours des 30 jours suivant l’intervention et comparés avec les 342 546 patients restants (figure 1).
2. Analyse globale des réadmissions
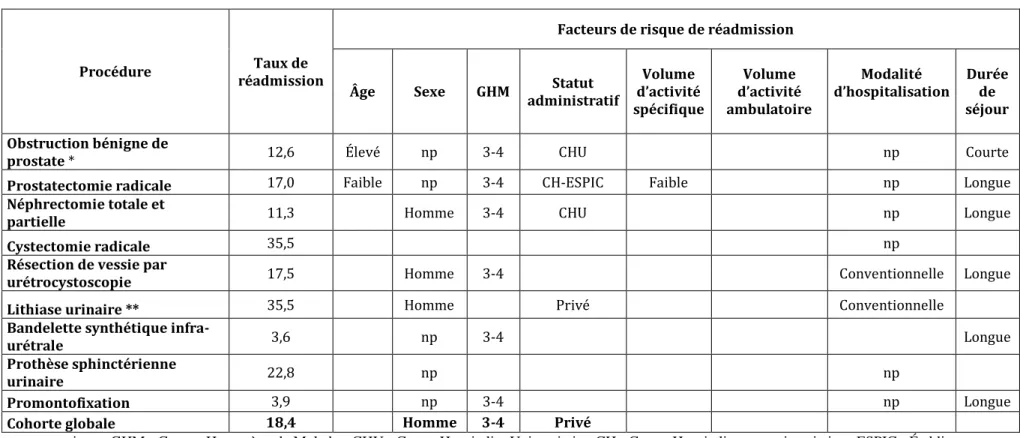
Le taux de réadmission dans les 30 jours suivant la chirurgie urologique programmée était de 18,4%. Le tableau 4 montre les taux de réadmission par procédure urologique. Le taux de réadmission variait de 3,6% après une pose de bandelette sous urétrale à 35,5% suite à une intervention pour lithiase urinaire.
Tableau 4 : Taux de réadmission par procédure urologique
* Résection par urétrocystoscopie et adénomectomie par voie haute
** Sonde urétérale, lithotritie extracorporelle, urétéroscopie rétrograde, néphrolithotomie percutanée
Le tableau 5 montre l'analyse univariée des facteurs de risque de réadmission. Tous les facteurs étudiés ont eu un effet significatif sur le taux de réadmission. Après analyses multivariées, la prise en charge initiale dans un hôpital privé a été associée à un risque plus élevé de réadmission dans les 30 jours (hôpital privé versus CHU : OR = 1,13 [CI95% : 1,11-1,16], hôpital privé versus CH et ESPIC : OR = 1,21 [CI95% : 1,18-1,23]). Les autres facteurs de risque de réadmission mis en évidence étaient le sexe masculin (OR = 1,84 [CI95% : 1,81-1,88]) et un haut niveau de comorbidité (GHM 3-4 versus GHM 1-2 : OR = 2,14 [CI95% :
Procédure Procédures chirurgicales de 2010 à 2012 Taux de réadmission
N % N %
Obstruction bénigne de prostate * 105 766 25,2 13 343 12,6
Prostatectomie radicale 43 053 10,3 7 315 17,0
Néphrectomie totale et partielle 18 757 4,5 2 118 11,3
Cancer de vessie :
- Résection par urétrocystoscopie - Cystectomie radicale 65 391 673 15,6 0,2 11 447 239 17,5 35,6 Lithiase urinaire ** 112 820 26,9 40 023 35,5
Bandelette synthétique infra-urétrale 51 391 12,2 1 843 3,6
Prothèse sphinctérienne urinaire 303 0,1 69 22,8
Promontofixation 21 633 5,2 844 3,9
Tableau 5 : Analyse univariée des facteurs de risque de réadmission après chirurgie
urologique dans la cohorte globale
Cohorte globale Réadmis (%) Non réadmis (%)
p N= 419 787 N= 77 241 (18,4) N= 342 546 (81,6) Âge 61,5 (+/- 14,6) 59,0 (+/-16,1) 62,1 (+/-14,0) <0,0001 Sexe : - Homme - Femme 285 682 (68,1) 134 105 (31,8) 58 715 (76,0) 18 526 (24,0) 226 967 (66,3) 115 579 (33,7) <0,0001
Groupe homogène de malades :
- GHM 1-2 - GHM 3-4 391 942 (93,4) 27 845 (6,6) 70 670 (91,5) 6 571 (8,5) 321 272 (93,8) 21 274 (6,2) <0,0001 Statut administratif : - CHU - CH et ESPIC - Privé hors ESPIC
47 426 (11,3) 104 589 (24,9) 267 772 (63,8) 7 117 (9,2) 15 616 (20,2) 54 508 (70,6) 40 309 (11,8) 88 973 (26,0) 213 264 (62,2) <0,0001
Volume d’activité global
(nombre de procédures annuel) 1 189 (+/-739) 1 255 (+/-741) 1 174 (+/-737) <0,0001
Volume d’activité globale en ambulatoire (nombre de
procédures annuel)
192 (+/-225) 219 (+/-251) 186 (+/-219) <0,0001
Durée de séjour 4,4 (+/-4,4) 4,3 (+/-5,3) 4,4 (+/-4,2) <0,0001
CHU= Centre Hospitalier Universitaire, CH= Centre Hospitalier non universitaire, ESPIC= Établissement de Santé Privé d'Intérêt Collectif
3. Stratification selon la procédure chirurgicale
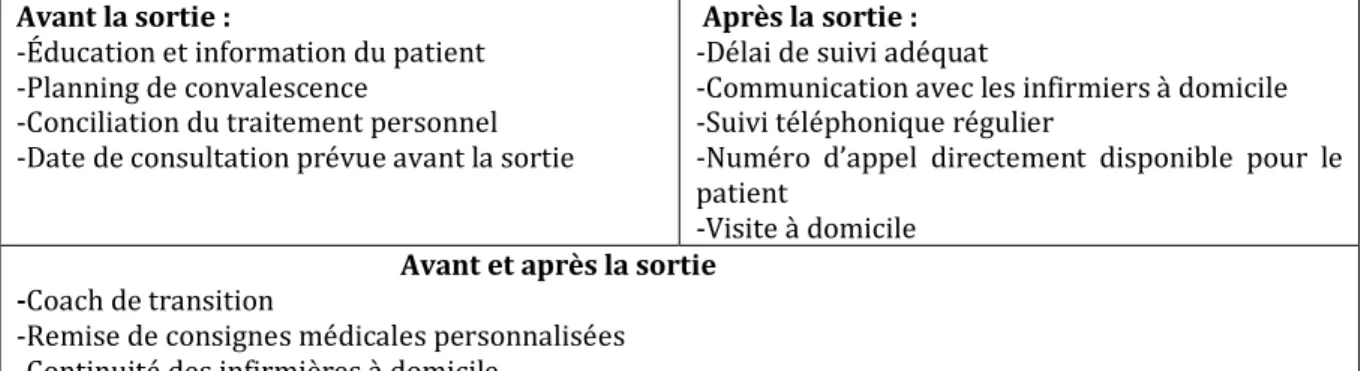
Le tableau 6 montre les taux d'admission pour chaque type de chirurgie urologique et synthétise les facteurs de risque de réadmission après analyse multivariée. Le tableau 7 détaille les odds ratio des facteurs de risque inclus dans l’analyse multivariée pour chaque type de procédure. Les facteurs de risque les plus récurrents identifiés étaient un GHM élevé, une DS initiale élevée et le sexe masculin. À l'inverse, une durée de séjour initiale plus courte était associée à un taux de réadmission plus élevé pour les cas de prostatectomie radicale (OR = 0,95 [CI95% : 0,94-0,96]). L'influence du statut hospitalier variait en fonction du type de procédure. Par exemple, pour les pathologies lithiasiques, le risque de réadmission apparaissait plus élevé dans les hôpitaux privés (CHU versus privé : OR = 0,24 [CI95% : 0,23-0,25], CH et ESPIC versus hôpital privé : OR = 0,31 [IC95% : 0,30-0,32]), alors que le contraire était vrai pour la prostatectomie radicale (CHU versus privé : OR = 1,44 [IC95% : 1,33-1,35], CH et ESPIC versus hôpital privé : OR = 2,17 [CI95% : 2,01-2,30]). Pour les procédures couramment effectuées en chirurgie ambulatoire (résection transurétrale de la vessie, chirurgie lithiasique), l’hospitalisation conventionnelle était associée à un risque accru de réadmission. Un faible volume d'activité spécifique a été associé à un taux de réadmission plus élevé uniquement pour la prostatectomie radicale avec un odds ratio à la limite de la significativité (OR = 0,99 [CI95% : 0,98-0,99]).
Tableau 6 : Analyse multivariée des facteurs de risque de réadmission après chirurgie urologique pour chaque procédure
Procédure réadmission Taux de
Facteurs de risque de réadmission
Âge Sexe GHM administratif Statut d’activité Volume
spécifique Volume d’activité ambulatoire Modalité d’hospitalisation Durée de séjour Obstruction bénigne de
prostate * 12,6 Élevé np 3-4 CHU np Courte
Prostatectomie radicale 17,0 Faible np 3-4 CH-ESPIC Faible np Longue
Néphrectomie totale et
partielle 11,3 Homme 3-4 CHU np Longue
Cystectomie radicale 35,5 np
Résection de vessie par
urétrocystoscopie 17,5 Homme 3-4 Conventionnelle Longue
Lithiase urinaire ** 35,5 Homme Privé Conventionnelle
Bandelette synthétique
infra-urétrale 3,6 np 3-4 Longue
Prothèse sphinctérienne
urinaire 22,8 np np
Promontofixation 3,9 np 3-4 np Longue
Cohorte globale 18,4 Homme 3-4 Privé
np= non pertinent, GHM= Groupe Homogène de Malades, CHU= Centre Hospitalier Universitaire, CH= Centre Hospitalier non universitaire - ESPIC= Établissement de Santé Privé d'Intérêt Collectif
* Résection par urétrocystoscopie et adénomectomie par voie haute
Tableau 7 : Odds ratio des facteurs de risque de réadmission après analyse multivariée pour chaque procédure
Facteur de risque
Cohorte globale et cancer urologique
Cohorte globale Prostatectomie radicale Néphrectomie totale et partielle Résection de vessie par
urétrocystoscopie Cystectomie radicale
OR CI 95 % OR CI 95 % OR CI 95 % OR CI 95 % OR CI 95 % Âge 0,99 0,99-1,01 0,99* 0,98-0,99 1,00 0,99-1,00 1,00 0,99-1,00 Sexe masculin 1,84* 1,81-1,88 1,25* 1,14-1,38 1,32* 1,26-1,40 1,00 0,99-1,02 Durée de séjour 0,99 0,98-1,00 0,95* 0,94-0,96 1,05* 1,04-1,06 1,07* 1,07-1,08 GHM 3-4 vs. GHM 1-2 2,14* 2,10-2,21 1,8* 1,61-2,0 1,33* 1,16-1,52 1,37* 1,27-1,47 0,99 0,96-1,03 CHU vs. Privé 0,66* 0,64-0,68 1,44* 1,33-1,55 1,34* 1,16-1,55 1,01 0,95-1,08 CH et ESPIC vs. Privé 0,72* 0,71-0,74 2,17* 2,01-2,30 1,08* 0,97-1,23 0,98 0,93-1,04
Volume d’activité spécifique 1,00 0,99-1,01 0,99* 0,98-0,99* 1,00 1,00-1,01 1,00 0,99-1,00
Volume d’activité ambulatoire 1,00 0,99-1,01 1,00 0,99-1,01
Hospitalisation conventionnelle vs.
Ambulatoire 1,19* 1,10-1,32
Facteur de risque
Lithiase urinaire et urologie fonctionnelle
Lithiase urinaire Obstruction bénigne de prostate synthétique infra-Bandelette
urétrale Promontofixation Prothèse sphinctérienne urinaire OR CI 95 % OR CI 95 % OR CI 95 % OR CI 95 % OR CI 95 % Âge 1,09* 1,06-1,11 0,99 0,98-1,00 Sexe masculin 1,07* 1,04-1,10 Durée de séjour 1,00 1,00-1,01 1,02* 1,01-1,03 1,10* 1,07-1,13 1,08* 1,05-1,11 GHM 3-4 vs. GHM 1-2 0,99 0,98-1,01 1,53* 1,45-1,61 1,80* 1,28-2,47 1,51* 1,13-1,98 CHU vs. Privé 0,24* 0,23-0,25 1,27* 1,19-1,35
DISCUSSION
1. Taux de réadmission
Dans toutes les disciplines chirurgicales, la relation entre les soins chirurgicaux et la réadmission est méconnue. À notre connaissance, nous rapportons la première étude analysant le taux de réadmission après une chirurgie urologique planifiée à partir d’un recueil national. Le tableau 1 résume les taux de réadmission et les facteurs de risque après une chirurgie urologique rapportés dans des études antérieures (1–3,34–54).
Dans notre étude, le taux de réadmission dans les 30 jours suivant une chirurgie urologique planifiée (18,4%) était élevé par rapport aux taux de réadmission rapportés dans les études précédentes, qui se situent entre 0,87 et 28,0% (1–3,34–54). Cependant, ce taux de réadmission intègre des hospitalisations planifiées pour une deuxième intervention chirurgicale. Par exemple, le taux de réadmission après chirurgie lithiasique est particulièrement élevé (35,5%) et ces réadmissions représentent plus de 50 % de la cohorte globale des patients réadmis. Étant donné que nous n'avions pas accès aux données cliniques, nous ne pouvons pas exclure la possibilité que certaines des réadmissions observées aient été programmées.
Deux types de procédures présentent un taux de réadmission à 30 jours élevé à hauteur de 35% : la chirurgie lithiasique et la cystectomie radicale. Elles reflètent cependant deux problématiques différentes. La chirurgie lithiasique est classiquement décrite comme responsable d’un nombre conséquent de réadmissions, notamment via la consultation au service des urgences pour douleur ou fièvre postopératoire (58). Parallèlement à ces complications pouvant entraîner une hospitalisation voire une seconde intervention en urgence, certains cas nécessitent la réalisation de plusieurs interventions dans un délai rapproché (59,60). La littérature sur les facteurs de risque de réadmission après chirurgie lithiasique est abondante, et elle met en avant le choix de techniques chirurgicales en fonction
des caractéristiques du calcul (taille, localisation), la présence de complications postopératoires ou de fragments résiduels (48,51,61–63). Les données issues du PMSI ne permettant pas d’avoir accès aux caractéristiques de la pathologie lithiasique, il apparaît peu contributif de comparer le taux de réadmission des différentes procédures chirurgicales à partir de leur analyse (lithotritie extracorporelle, urétéroscopie rétrograde, et néphrolithotomie percutanée).
À l’inverse, pour les cystectomies radicales, la littérature met en avant des facteurs de risque propres au patient : âge, sexe, comorbidité (score de Charlson, score d’ASA), indice de masse corporelle (2,40,43). Dans notre étude, nous n'avons sélectionné que des patients de novo (patients non hospitalisés au cours de l'année précédant la chirurgie urologique). Cela a entraîné une perte de séjours, notamment pour les cystectomies radicales qui nécessitent la réalisation fréquente d’hospitalisation avant la chirurgie (résection de vessie, chimiothérapie néo-adjuvante). Ainsi, nous n’avons inclus que 607 cystectomies radicales, pour un nombre attendu de 10 500 procédures sur 3 ans (64). Ce faible nombre de séjours a entraîné une perte importante de puissance, ne permettant pas de confirmer les facteurs de risque de réadmission connus dans la littérature.
2. Facteurs de risque de réadmission
Notre étude a mis en évidence différents facteurs de risque de réadmission après chirurgie urologique : le sexe masculin, un GHM et une DS élevés pour certaines pathologies. Notre étude confirme l’impact d’un niveau de comorbidité élevé et du sexe masculin, déjà décrit dans d'autres études (1–3). La DS initiale avait un impact variable sur les taux de réadmission selon les interventions étudiées. Ainsi, dans notre série, une DS initiale prolongée était associée à un risque plus élevé de réadmission pour la majorité des procédures étudiées. Plusieurs études, notamment en chirurgie digestive, ont montré un lien significatif entre une DS initiale prolongée et la présence de complications postopératoires avec un taux de réadmission important et des coûts élevés (65,66). À l'inverse, une DS courte a été associée à un risque plus élevé de réadmission dans certaines études, en particulier dans les cas de cystectomie radicale (1,67). Ces résultats contradictoires peuvent être expliqués de différentes façons. Tout d'abord, l'accès à des structures de soins de suite qualifiées qui traitent des patients post-chirurgicaux complexes diffère selon les pays (67). Ainsi, dans certaines études, les patients transférés dans des structures de soins de suite ont, paradoxalement, des taux de réadmission et de mortalité plus élevés que les patients réalisant leur convalescence à domicile (1,68). Deuxièmement, le bénéfice des DS prolongées semble être réservé aux patients âgés de plus de 70 ans, ce qui pourrait expliquer les résultats contradictoires en fonction de l'âge moyen de la population étudiée (67). De plus, une DS prolongée peut être un signe de complication postopératoire, et donc entraîner une augmentation indirecte du taux de réadmission.
Un volume d’activité chirurgicale faible était un facteur de risque indépendant de réadmissions uniquement en cas de prostatectomie radicale, avec un odds ratio à la limite de la significativité (OR = 0,99 [CI95% : 0,98-0,99]). De nombreuses études ont souligné la relation entre le volume d’activité chirurgicale et les résultats postopératoires (69). Ainsi, dans
le cas des prostatectomies radicales, un volume d’activité chirurgicale élevé a été associé à une diminution des taux de morbidité et mortalité hospitalières et à une diminution de la DS (39,70). Des résultats similaires ont été trouvés pour la cystectomie radicale, notamment sur les taux de mortalité et de complications postopératoires (71,72). En conséquence, de nombreux systèmes de santé préconisent actuellement de concentrer les soins médicaux à haut risque dans les hôpitaux à grand volume afin d’optimiser les résultats (72,73).
En ce qui concerne l'influence du statut administratif hospitalier sur le taux de réadmission, notre étude a montré (après analyses multivariées) que la prise en charge initiale dans un hôpital privé était associée à un risque de réadmission plus élevé dans les 30 jours. En Amérique du Nord, des précédentes études montrent que les centres universitaires fournissent de meilleurs soins aux patients, en particulier en raison de l'adhésion plus rigoureuse aux recommandations et de l’utilisation systématique de protocoles de prise en charge (74,75). Cependant, cette relation illustre une moyenne et n'implique pas que les établissements universitaires offrent toujours de meilleurs soins. En effet, dans notre étude, l'influence du statut hospitalier variait selon la pathologie étudiée. En outre, les délais d'attente de prise en charge, y compris pour la programmation d’actes chirurgicaux, sont généralement plus courts dans les hôpitaux privés (76). Ainsi, la planification d'une deuxième chirurgie dans les 30 jours suivant la chirurgie initiale y est courante, notamment après une chirurgie lithiasique. Cela a pu conduire à une surestimation du nombre de réadmissions, qui étaient en fait des interventions chirurgicales programmées.
3. Prévention des réadmissions
En résumé, nos données mettent en évidence un profil de patients présentant un risque de réadmission plus élevé : un patient masculin avec un haut niveau de GHM et une DS élevée pour certaines pathologies. Les efforts croissants en matière de coordination des soins pour ces patients peuvent aider à réduire les réadmissions. Plusieurs mesures, dites de soins de transition, ont été décrites comme réduisant le taux de réadmission après une hospitalisation : une planification de la sortie avant l’hospitalisation, un appel téléphonique précoce systématique après la sortie, la remise d’un document d’instructions postopératoires axées sur le patient, un rendez-vous de consultation précoce avec une infirmière ou avec un médecin, ou encore l’implication systématique d’une assistance sociale dans l’organisation de la convalescence. Ces différentes mesures ont été formalisées et classées par Coleman et al. en 3 catégories d’interventions : procédures appliquées avant la sortie, après la sortie ou durant toute la prise en charge du patient (tableau 8) (77). Ces différentes mesures restent à évaluer en urologie, notamment pour les interventions oncologiques majeures.
Tableau 8 : Classification des interventions évaluées pour réduire le taux de réadmission à 30
jours (77)
Avant la sortie :
-Éducation et information du patient -Planning de convalescence
-Conciliation du traitement personnel -Date de consultation prévue avant la sortie
Après la sortie : -Délai de suivi adéquat
-Communication avec les infirmiers à domicile -Suivi téléphonique régulier
-Numéro d’appel directement disponible pour le patient
-Visite à domicile Avant et après la sortie
-Coach de transition
-Remise de consignes médicales personnalisées -Continuité des infirmières à domicile
De même, des protocoles de Récupération Rapide Après Chirurgie (RRAC) ont été utilisés avec succès dans la pratique clinique après chirurgie colorectale, entraînant une diminution des taux de complication postopératoires de 50%, de la DS de 30% ainsi que du taux de réadmission, abaissant ainsi les dépenses de santé (78,79). Les RRAC sont des programmes de soins multidisciplinaires qui visent à uniformiser et à améliorer la gestion périopératoire. Le tableau 9 synthétise les mesures évaluées dans le cadre de ces protocoles (80–95). Le bénéfice de ces protocoles de réhabilitation précoce reste à évaluer en chirurgie urologique (96), et en particulier après une cystectomie (97).
Tableau 9 : Éléments des protocoles de Récupération Rapide Après Chirurgie
*Intervention ayant démontré un bénéfice (durée de séjour, taux de complication ou de réadmission) après cystectomie radicale Références Interventions Cerantola80 Nygren81 Hamilton-Reeves82 Xu83 Awad84
Préopératoire -Information préadmission*
-Optimisation préopératoire :
• Conditionnement physique et entraînement musculaire • Arrêt du tabac*
• Immunonutrition* -Absence de préparation digestive
-Diminution de la période de jeune préopératoire -Apport glucosé
-Apport antagoniste des récepteurs opioïdes (Alvimopan)*
-Médication préopératoire : absence de benzodiazépine d’action longue -Prophylaxie antibiotique et préparation cutanée*
Kurz85
Wuethrich86
Patel87
Pillai88
Peropératoire -Prévention de l’hypothermie
-Chirurgie mini-invasive
-Limitation du remplissage vasculaire*
Mukhatr95 Donat89 Fitzgerald90 Zingg91 Lewis92 Xu93 Klein94
Postopératoire -Retrait précoce de la sonde naso-gastrique* -Retrait précoce des drains pelviens
-Prévention systématique des nausées et vomissements -Prévention de l’iléus postopératoire :
• Administration de Chewing–gum* • Laxatif
-Reprise précoce de l’alimentation
-Optimisation de l’analgésie postopératoire : épargne opioïde* -Mobilisation précoce
4. Limites de l’étude
Notre étude présente des limites. Tout d'abord, nos données sont extraites de la base du PMSI, qui est une base de données administratives, et non cliniques. Plusieurs paramètres importants ne sont pas présents dans cette base et n’ont donc pas pu être inclus dans notre analyse, notamment certaines données cliniques du patient (indice de masse corporelle, médicaments, classification TNM pour les tumeurs) et certaines données de l’hospitalisation initiale (complications postopératoires ou transfusions sanguines). Cependant, nous avons tenté de compenser ce manque de données en procédant à un ajustement des risques basé sur le GHM. Deuxièmement, pour limiter les interactions entre les hospitalisations ou les interventions chirurgicales récentes, nous n'avons sélectionné que des patients de novo (patients non hospitalisés au cours de l'année précédant la chirurgie urologique). Par conséquent, le nombre de séjours inclus dans notre analyse a diminué, en particulier pour les interventions chirurgicales nécessitant plusieurs procédures dans un court intervalle, entraînant ainsi une perte de puissance dans nos analyses statistiques. Enfin, les données exploitées couvrent la période 2010-2012 et ne sont pas nécessairement représentatives des pratiques actuelles. L'étude des données contemporaines serait intéressante et permettrait d'évaluer l'impact des mesures de coordination des soins et des protocoles de réhabilitations précoces sur les taux de réadmission.
CONCLUSION
Un taux significatif de réadmission (~ 20%) après chirurgies urologiques planifiées a été trouvé dans notre étude. Des efforts accrus en matière de coordination des soins chez les patients ayant une chirurgie urologique peuvent aider à réduire ce taux de réadmission. Le volume d’activité chirurgicale n'était pas associé au taux de réadmission. Ce taux de réadmission n'est pas négligeable et toutes les raisons qui mènent à cette situation devraient être soigneusement évaluées à un moment où les gouvernements mettent l'accent sur la nécessité de développer la chirurgie ambulatoire.
ANNEXES
1. La détermination des Groupes Homogènes de Séjours
Le séjour de chaque patient fait l’objet d’un Résumé de Sortie Standardisé (RSS) qui en décrit les caractéristiques médicales et administratives, en agrégeant les Résumés d’Unité Médicale (RUM) produits par les différentes unités où est passé le patient. Ce RSS est codé et traité selon un algorithme qui prend en compte le diagnostic principal (regroupement par catégorie majeure de diagnostic, CMD), l’existence d’actes opératoires classants, et si besoin, d’autres informations (âge, complications et morbidités associées (CMA), etc.) ainsi que la durée d’hospitalisation (98). Cela permet d’affecter le séjour à un Groupe Homogène de Malades (GHM). Depuis la version 11 de la classification (2009), qui a introduit un critère de sévérité en quatre niveaux au sein d’un même type de séjour, on compte près de 2 600 GHM répartis en 29 CMD (équivalant à des domaines d’activité comme la chirurgie viscérale, les atteintes du système nerveux, etc.). Le choix du niveau du GHM est fonction des morbidités associées, de l’âge pour certains GHM, de la durée de séjour et du mode de sortie (décès ou vivant). L’un des principes de fonctionnement de la T2A est que les coûts de production des GHM doivent globalement être couverts par les tarifs : chaque GHM est associé à son pendant
financier, le Groupe Homogène de séjours (GHS). En règle générale à chaque type de séjour
décrit par un GHM correspond un unique GHS. Des coûts de référence sont calculés par un
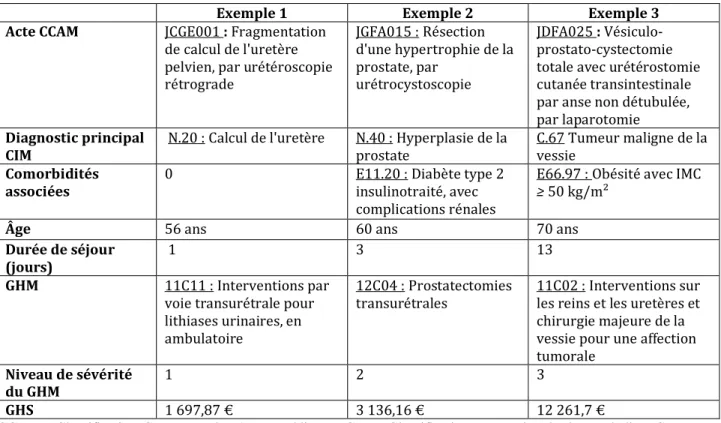
établissement public administratif, l’Agence Technique de l’Information sur l’Hospitalisation (ATIH). Ils servent de base à l’élaboration des tarifs des GHM qui seront payés par l’Assurance maladie pour chaque séjour hospitalier. Le tableau 10 illustre, à partir de 3 exemples de procédures urologiques, le niveau de sévérité des GHM et les GHS correspondants.
Tableau 10 : Exemples de classification en Groupe Homogène de Malades
Exemple 1 Exemple 2 Exemple 3
Acte CCAM JCGE001 : Fragmentation
de calcul de l'uretère pelvien, par urétéroscopie rétrograde JGFA015 : Résection d'une hypertrophie de la prostate, par urétrocystoscopie JDFA025 : Vésiculo-prostato-cystectomie totale avec urétérostomie cutanée transintestinale par anse non détubulée, par laparotomie
Diagnostic principal
CIM N.20 : Calcul de l'uretère N.40 : Hyperplasie de la prostate
C.67 Tumeur maligne de la vessie
Comorbidités
associées 0 E11.20 : Diabète type 2 insulinotraité, avec
complications rénales
E66.97 : Obésité avec IMC
≥ 50 kg/m²
Âge 56 ans 60 ans 70 ans
Durée de séjour
(jours) 1 3 13
GHM 11C11 : Interventions par
voie transurétrale pour lithiases urinaires, en ambulatoire
12C04 : Prostatectomies transurétrales
11C02 : Interventions sur les reins et les uretères et chirurgie majeure de la vessie pour une affection tumorale
Niveau de sévérité
du GHM 1 2 3
GHS 1 697,87 € 3 136,16 € 12 261,7 €
CCAM= Classification Commune des Actes Médicaux, CIM= Classification Internationale des Maladies, GHM= Groupe Homogène de Malades, GHS= Groupe Homogène de Séjours
2. Publication
Ce travail a été l’objet d’une publication parue en juin 2017 dans European Urology Focus référencée sur PubMed :
Manach Q, Rouprêt M, Reboul-Marty J, Drouin S.J, Guillot-Tantay C, Matillon X, Parra J, Mozer P, Bitker M-O, Lefèvre J.H, Phé V. Hospital readmissions after urological surgical procedures in France: a nationwide cohort study over three years. Eu Urol Focus. Jun 2017.
BIBLIOGRAPHIE
1. Minnillo BJ, Maurice MJ, Schiltz N, Pillai AC, Koroukian SM, Daneshgari F, et al. Few modifiable factors predict readmission following radical cystectomy. Can Urol Assoc J J Assoc Urol Can. 2015;9(7‑8):E439-446.
2. Leow JJ, Gandaglia G, Sood A, Ruhotina N, Klett DE, Sammon JD, et al. Readmissions after major urologic cancer surgery. Can J Urol. 2014;21(6):7537‑46.
3. Rambachan A, Matulewicz RS, Pilecki M, Kim JYS, Kundu SD. Predictors of readmission following outpatient urological surgery. J Urol. juill 2014;192(1):183‑8.
4. Gauduchon L, Sabbagh C, Regimbeau JM. Re-admission after gastro-intestinal surgery. J Visc Surg. déc 2015;152(6 Suppl):S97-104.
5. Eggli Y. Réadmissions potentiellement évitables. Sqlape. 2012;
6. Wei F, Mark D, Hartz A, Campbell C. Are PRO discharge screens associated with postdischarge adverse outcomes? Health Serv Res. août 1995;30(3):489‑506.
7. Ashton CM, Kuykendall DH, Johnson ML, Wray NP, Wu L. The association between the quality of inpatient care and early readmission. Ann Intern Med. 15 mars 1995;122(6):415‑21.
8. Stein J, Ossman P, Viera A, Moore C, Brubaker BA, French J, et al. Was This Readmission Preventable? Qualitative Study of Patient and Provider Perceptions of Readmissions. South Med J. juin 2016;109(6):383‑9.
9. Zuckerman RB, Sheingold SH, Orav EJ, Ruhter J, Epstein AM. Readmissions, Observation, and the Hospital Readmissions Reduction Program. N Engl J Med. 24 févr 2016;
11. Benlice C, Seyidova-Khoshknabi D, Stocchi L, Hull T, Steele S, Gorgun E. Decreasing readmissions by focusing on complications and underlying reasons. Am J Surg. 21 juill 2017;
12. Ansari MZ, Collopy BT, Booth JL. Hospital characteristics associated with unplanned readmissions. Aust Health Rev Publ Aust Hosp Assoc. 1995;18(3):63‑75.
13. Milne R, Clarke A. Can readmission rates be used as an outcome indicator? BMJ. 17 nov 1990;301(6761):1139‑40.
14. McIlvennan CK, Eapen ZJ, Allen LA. Hospital Readmissions Reduction Program. Circulation. 19 mai 2015;131(20):1796‑803.
15. van Walraven C, Jennings A, Taljaard M, Dhalla I, English S, Mulpuru S, et al. Incidence of potentially avoidable urgent readmissions and their relation to all-cause urgent readmissions. CMAJ Can Med Assoc J. 4 oct 2011;183(14):e1067‑72.
16. Graham KL, Dike O, Doctoroff L, Jupiter M, Vanka A, Davis RB, et al. Preventability of early vs. late readmissions in an academic medical center. PLoS ONE [Internet]. 16 juin
2017 [cité 12 août 2017];12(6). Disponible sur:
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC5473551/
17. Chin DL, Bang H, Manickam RN, Romano PS. Rethinking Thirty-Day Hospital Readmissions: Shorter Intervals Might Be Better Indicators Of Quality Of Care. Health Aff Proj Hope. 1 oct 2016;35(10):1867‑75.
18. Dandolu V, Pathak P. Health resource utilization and costs during the first 90 days following robot-assisted hysterectomy. Int Urogynecology J. 7 août 2017;
19. Bendvold B, Refsum A, Schjøth-Iversen L, Bringedal K, Husby A, Brudvik KW. Unplanned readmission and outpatient examination 90-days after acute appendectomy in adults. Am J Surg. 21 juill 2017;
90-Day after Radical Cystectomy in Patients on Early Recovery after Surgery Protocol. Bladder Cancer Amst Neth. 27 janv 2017;3(1):51‑6.
21. Lefèvre JH, Reboul-Marty J, de Vaugrigneuse S, Zeitoun J-D. Readmissions After Surgery: A French Nationwide Cross-Sectional Study of 1,686,602 Procedures Performed in 2010. World J Surg. janv 2017;41(1):31‑8.
22. Barber EL, Doll KM, Gehrig PA. Hospital readmission after ovarian cancer surgery: Are we measuring surgical quality? Gynecol Oncol. août 2017;146(2):368‑72.
23. Zogg CK, Olufajo OA, Jiang W, Bystricky A, Scott JW, Shafi S, et al. The Need to Consider Longer-term Outcomes of Care: Racial/Ethnic Disparities Among Adult and Older Adult Emergency General Surgery Patients at 30, 90, and 180 Days. Ann Surg. juill 2017;266(1):66‑75.
24. Caracciolo C, Parker D, Marshall E, Brown J. Excess Readmission vs Excess Penalties: Maximum Readmission Penalties as a Function of Socioeconomics and Geography. J Hosp Med. août 2017;12(8):610‑7.
25. OCDE. Panorama de la santé 2013 : Les indicateurs de l’OCDE. Éditions OCDE. 2013;
26. Kansagara D, Englander H, Salanitro A, Kagen D, Theobald C, Freeman M, et al. Risk prediction models for hospital readmission: a systematic review. JAMA. 2011;306(15):1688‑98.
27. United States Department of Health and Human Services. New HHS data shows major strides made in patient safety, leading to improved care and savings. http:// innovation.cms.gov/Files/reports/patient-safety-results.pdf.
29. Rothberg M, Lee N. Reducing Readmissions or Length of Stay-Which Is More Important? J Hosp Med. août 2017;12(8):685‑6.
30. Le Pogam M. Modalités d’utilisation et de diffusion des PSI (in dicateurs de sécurité des soins hospitaliers) dans les pays de l’OCDE : revue des études publiées et interview des experts internationaux. https://www.has-sante.fr/portail/upload/docs/application/pdf/2012-06/ipaqss_4pages_utilisation_psi_ocde.pdf.
31. Parc Y, Reboul-Marty J, Lefevre JH, Shields C, Chafai N, Tiret E. Factors influencing mortality and morbidity following colorectal resection in France. Analysis of a national database (2009 - 2011). Colorectal Dis Off J Assoc Coloproctology G B Irel. 2015;
32. Lefèvre JH, Reboul-Marty J, de Vaugrigneuse S, Zeitoun J-D. Readmissions After Surgery: A French Nationwide Cross-Sectional Study of 1,686,602 Procedures Performed in 2010. World J Surg. janv 2017;41(1):31‑8.
33. Yilmaz E, Vuagnat A. Tarification à l’activité et readmission. Économie et statistique. 2015;475‑6.
34. Fagerström T, Nyman CR, Hahn RG. Complications and clinical outcome 18 months after bipolar and monopolar transurethral resection of the prostate. J Endourol. juin 2011;25(6):1043‑9.
35. Pilecki MA, McGuire BB, Jain U, Kim JYS, Nadler RB. National multi-institutional comparison of 30-day postoperative complication and readmission rates between open retropubic radical prostatectomy and robot-assisted laparoscopic prostatectomy using NSQIP. J Endourol. avr 2014;28(4):430‑6.
36. Schmid M, Chiang HA, Sood A, Campbell L, Chun FK-H, Dalela D, et al. Causes of hospital readmissions after urologic cancer surgery. Urol Oncol. mai 2016;34(5):236.e1-236.e11.
Versus Open Radical Prostatectomy: A Contemporary Analysis of an All-payer Discharge Database. Eur Urol. 10 févr 2016;
38. Chappidi MR, Kates M, Stimson CJ, Bivalacqua TJ, Pierorazio PM. Quantifying Nonindex Hospital Readmissions and Care Fragmentation after Major Urological Oncology Surgeries in a Nationally Representative Sample. J Urol. janv 2017;197(1):235‑40.
39. Friðriksson JÖ, Holmberg E, Adolfsson J, Lambe M, Bill-Axelson A, Carlsson S, et al. Rehospitalization after radical prostatectomy in a nationwide, population based study. J Urol. 2014;192(1):112‑9.
40. Stimson CJ, Chang SS, Barocas DA, Humphrey JE, Patel SG, Clark PE, et al. Early and late perioperative outcomes following radical cystectomy: 90-day readmissions, morbidity and mortality in a contemporary series. J Urol. oct 2010;184(4):1296‑300.
41. Hu M, Jacobs BL, Montgomery JS, He C, Ye J, Zhang Y, et al. Sharpening the focus on causes and timing of readmission after radical cystectomy for bladder cancer. Cancer. 1 mai 2014;120(9):1409‑16.
42. Pak JS, Lascano D, Kabat DH, Finkelstein JB, RoyChoudhury A, DeCastro GJ, et al. Patterns of care for readmission after radical cystectomy in New York State and the effect of care fragmentation. Urol Oncol. oct 2015;33(10):426.e13-19.
43. Chappidi MR, Kates M, Stimson CJ, Johnson MH, Pierorazio PM, Bivalacqua TJ. Causes, Timing, Hospital Costs and Perioperative Outcomes of Index vs Nonindex Hospital Readmissions after Radical Cystectomy: Implications for Regionalization of Care. J Urol. févr 2017;197(2):296‑301.
45. Hwang YJ, Minnillo BJ, Kim SP, Abouassaly R. Assessment of healthcare quality metrics: Length-of-stay, 30-day readmission, and 30-day mortality for radical nephrectomy with inferior vena cava thrombectomy. Can Urol Assoc J J Assoc Urol Can. avr 2015;9(3‑4):114‑21.
46. Brandao LF, Zargar H, Laydner H, Akca O, Autorino R, Ko O, et al. 30-day hospital readmission after robotic partial nephrectomy--are we prepared for Medicare readmission reduction program? J Urol. sept 2014;192(3):677‑81.
47. Maurice MJ, Ramirez D, Kara Ö, Nelson RJ, Caputo PA, Malkoç E, et al. Non-modifiable factors predict discharge quality after robotic partial nephrectomy. Int Urol Nephrol. janv 2017;49(1):37‑41.
48. Buldu I, Tepeler A, Karatag T, Ozyuvali E, Elbir F, Yordam M, et al. Which factors affect the hospital re-admission and re-hospitalization after flexible ureterorenoscopy for kidney stone? World J Urol. sept 2016;34(9):1291‑5.
49. Scales CD, Saigal CS, Hanley JM, Dick AW, Setodji CM, Litwin MS. The impact of unplanned postprocedure visits in the management of patients with urinary stones. Surgery. mai 2014;155(5):769‑75.
50. Beiko D, Elkoushy MA, Kokorovic A, Roberts G, Robb S, Andonian S. Ambulatory percutaneous nephrolithotomy: what is the rate of readmission? J Endourol. avr 2015;29(4):410‑4.
51. Tepeler A, Karatag T, Tok A, Ozyuvali E, Buldu I, Kardas S, et al. Factors affecting hospital readmission and rehospitalization following percutaneous nephrolithotomy. World J Urol. janv 2016;34(1):69‑73.
52. Bloom J, Matthews G, Phillips J. Factors Influencing Readmission after Elective Ureteroscopy. J Urol. mai 2016;195(5):1487‑91.
53. Cohen AJ, Packiam VT, Nottingham CU, Alberts BD, Faris SF, Bales GT. 30-Day Morbidity and Reoperation Following Midurethral Sling: Analysis of 8772 Cases Using a National Prospective Database. Urology. sept 2016;95:72‑9.
54. Pederzoli F, Chappidi MR, Collica S, Kates M, Joice GA, Sopko NA, et al. Analysis of Hospital Readmissions After Prosthetic Urologic Surgery in the United States: Nationally Representative Estimates of Causes, Costs, and Predictive Factors. J Sex Med. août 2017;14(8):1059‑65.
55. Tsai TC, Joynt KE, Orav EJ, Gawande AA, Jha AK. Variation in surgical-readmission rates and quality of hospital care. N Engl J Med. 2013;369(12):1134‑42.
56. Kim H, Hung WW, Paik MC, Ross JS, Zhao Z, Kim G-S, et al. Predictors and outcomes of unplanned readmission to a different hospital. Int J Qual Health Care. déc 2015;27(6):512.
57. Boudemaghe T, Belhadj I. Data Resource Profile: The French National Uniform Hospital Discharge Data Set Database (PMSI). Int J Epidemiol. 7 févr 2017;
58. Bloom J, Matthews G, Phillips J. Factors Influencing Readmission after Elective Ureteroscopy. J Urol. mai 2016;195(5):1487‑91.
59. Yamashita S, Kohjimoto Y, Iba A, Kikkawa K, Hara I. Stone size is a predictor for residual stone and multiple procedures of endoscopic combined intrarenal surgery. Scand J Urol. avr 2017;51(2):159‑64.
60. Hein S, Miernik A, Wilhelm K, Schlager D, Schoeb DS, Adams F, et al. Endoscopically Determined Stone Clearance Predicts Disease Recurrence Within 5 Years After Retrograde Intrarenal Surgery. J Endourol. juin 2016;30(6):644‑9.
62. Zhang W, Zhou T, Wu T, Gao X, Peng Y, Xu C, et al. Retrograde Intrarenal Surgery Versus Percutaneous Nephrolithotomy Versus Extracorporeal Shockwave Lithotripsy for Treatment of Lower Pole Renal Stones: A Meta-Analysis and Systematic Review. J Endourol. juill 2015;29(7):745‑59.
63. Sabnis RB, Jagtap J, Mishra S, Desai M. Treating renal calculi 1-2 cm in diameter with minipercutaneous or retrograde intrarenal surgery: a prospective comparative study. BJU Int. oct 2012;110(8 Pt B):E346-349.
64. Léon P, Seisen T, Rouprêt M. Surgical landscape of radical cystectomy for bladder cancer in France over the last 10 years. World J Urol. 28 juin 2014;
65. Carter J, Philp S, Wan KM. Optimising recovery after surgery: Predictors of early discharge and hospital readmission. Aust N Z J Obstet Gynaecol. 2016;
66. Cloyd JM, Huang L, Ma Y, Rhoads KF. Predictors of readmission to non-index hospitals after colorectal surgery. Am J Surg. 2016;
67. Moschini M, Gandaglia G, Dell’Oglio P, Fossati N, Cucchiara V, Burgio G, et al. Incidence and Predictors of 30-Day Readmission in Patients Treated With Radical Cystectomy: A Single Center European Experience. Clin Genitourin Cancer. 2016;14(4):e341-346.
68. Legner VJ, Massarweh NN, Symons RG, McCormick WC, Flum DR. The significance of discharge to skilled care after abdominopelvic surgery in older adults. Ann Surg. 2009;249(2):250‑5.
69. Trinh Q-D, Bjartell A, Freedland SJ, Hollenbeck BK, Hu JC, Shariat SF, et al. A systematic review of the volume-outcome relationship for radical prostatectomy. Eur Urol. 2013;64(5):786‑98.
70. Wilt TJ, Shamliyan TA, Taylor BC, MacDonald R, Kane RL. Association between hospital and surgeon radical prostatectomy volume and patient outcomes: a systematic
review. J Urol. 2008;180(3):820-828; discussion 828-829.
71. Santos F, Zakaria AS, Kassouf W, Tanguay S, Aprikian A. High hospital and surgeon volume and its impact on overall survival after radical cystectomy among patients with bladder cancer in Quebec. World J Urol. 2015;33(9):1323‑30.
72. Sun M, Ravi P, Karakiewicz PI, Sukumar S, Sammon J, Bianchi M, et al. Is there a relationship between leapfrog volume thresholds and perioperative outcomes after radical cystectomy? Urol Oncol. 2014;32(1):27.e7-13.
73. Allareddy V, Ward MM, Allareddy V, Konety BR. Effect of meeting Leapfrog volume thresholds on complication rates following complex surgical procedures. Ann Surg. févr 2010;251(2):377‑83.
74. Trinh Q-D, Schmitges J, Sun M, Shariat SF, Sukumar S, Bianchi M, et al. Radical prostatectomy at academic versus nonacademic institutions: a population based analysis. J Urol. 2011;186(5):1849‑54.
75. Vartak S, Ward MM, Vaughn TE. Do postoperative complications vary by hospital teaching status? Med Care. 2008;46(1):25‑32.
76. Siciliani L, Hurst J. Explaining waiting times variations for elective surgery across OECD Countries. OECD Econ Stud. 2004;38:96‑122.
77. Coleman EA, Min S, Chomiak A, Kramer AM. Posthospital Care Transitions: Patterns, Complications, and Risk Identification. Health Serv Res. oct 2004;39(5):1449‑66. 78. Varadhan KK, Lobo DN, Ljungqvist O. Enhanced recovery after surgery: the future of improving surgical care. Crit Care Clin. juill 2010;26(3):527‑547, x.
80. Cerantola Y, Valerio M, Persson B, Jichlinski P, Ljungqvist O, Hubner M, et al. Guidelines for perioperative care after radical cystectomy for bladder cancer: Enhanced Recovery After Surgery (ERAS(®)) society recommendations. Clin Nutr Edinb Scotl. déc 2013;32(6):879‑87.
81. Nygren J, Thacker J, Carli F, Fearon KCH, Norderval S, Lobo DN, et al. Guidelines for perioperative care in elective rectal/pelvic surgery: Enhanced Recovery After Surgery (ERAS(®)) Society recommendations. World J Surg. févr 2013;37(2):285‑305.
82. Hamilton-Reeves JM, Bechtel MD, Hand LK, Schleper A, Yankee TM, Chalise P, et al. Effects of Immunonutrition for Cystectomy on Immune Response and Infection Rates: A Pilot Randomized Controlled Clinical Trial. Eur Urol. mars 2016;69(3):389‑92.
83. Xu R, Zhao X, Zhong Z, Zhang L. No advantage is gained by preoperative bowel preparation in radical cystectomy and ileal conduit: a randomized controlled trial of 86 patients. Int Urol Nephrol. déc 2010;42(4):947‑50.
84. Awad S, Varadhan KK, Ljungqvist O, Lobo DN. A meta-analysis of randomised controlled trials on preoperative oral carbohydrate treatment in elective surgery. Clin Nutr Edinb Scotl. févr 2013;32(1):34‑44.
85. Kurz A, Sessler DI, Lenhardt R. Perioperative normothermia to reduce the incidence of surgical-wound infection and shorten hospitalization. Study of Wound Infection and Temperature Group. N Engl J Med. 9 mai 1996;334(19):1209‑15.
86. Wuethrich PY, Studer UE, Thalmann GN, Burkhard FC. Intraoperative continuous norepinephrine infusion combined with restrictive deferred hydration significantly reduces the need for blood transfusion in patients undergoing open radical cystectomy: results of a prospective randomised trial. Eur Urol. août 2014;66(2):352‑60.