Université Bordeaux Segalen
Année 2012
Thèse n°1909
THÈSE
pour le
DOCTORAT DE L’UNIVERSITÉ BORDEAUX 2
Mention : Sciences, Technologie, Santé Option : Œnologie
Présentée et soutenue publiquement le 29 octobre 2012
par
Grégory PASQUIER
Né le 15 avril 1984 à Talence
Etude de l’impact de l’Esca sur la qualité des raisins par une
approche protéomique
Membres du Jury
Mme. O. LAUREANO, Professeur, Université de Lisbonne ... Président Mme. M. NADAL, Professeur, Universitat Rovira i Virgili ... Rapporteur M. E. PETERLUNGER, Professeur, Università di Udine ... Rapporteur M. M. BONNEU, Professeur, Université Bordeaux Segalen ... Examinateur M. P.L. TEISSEDRE, Professeur, Université Bordeaux Segalen ... Examinateur M. B. DONECHE, Professeur, Université Bordeaux Segalen ... Directeur de thèse
Remerciements
Monsieur le professeur Bernard Donèche, doyen de la faculté d’œnologie de Bordeaux m’a confié un sujet de recherche en phase avec les problématiques actuelles de la viticulture. Ses conseils avisés et son soutien amical ont été décisifs dans la réalisation de ce travail. Qu’il soit assuré de mon entière reconnaissance.
Les professeurs Laureano, Nadal et Peterlunger m’ont fait l’immense honneur d’évaluer ce travail. Je leur témoigne ma très respectueuse gratitude.
Je remercie chaleureusement Monsieur le professeur Bonneu qui a montré un vif intérêt pour mon travail en m’accueillant dans son laboratoire et en m’apprenant les principes de l’analyse protéomique. Il m’a soutenu durant les moments difficiles et a toujours montré une grande disponibilité. Ces conseils m’ont été, me sont et me seront bénéfiques.
Monsieur le professeur Teissedre, qui a toujours cru en moi, et qui a pris sur son temps et mis en œuvre tous les moyens nécessaires pour que je réussisse cette thèse. Les six mois que j’ai passés il y a quelques années dans son laboratoire, avaient constitué ma première expérience scientifique et forgé mon goût pour la recherche. J’en suis très honoré et je le remercie vivement.
Messieurs les professeurs Darriet, De Revel et Dubourdieu qui ont contribué à un moment donné à ma réflexion scientifique et à mes choix professionnels. Je les remercie vivement de leur soutien et de leurs conseils.
Mes remerciements vont également à Annie L’Hyvernay, Céline Cholet, Claudia Meza et Alvaro Gonzalez, membre du laboratoire de biochimie et de physiologie du raisin, Maria Silva, Isabelle Ky, Bénédicte Lorrain et Michael Jourdes du laboratoire de chimie appliquée, Delphine Lapaillerie, Sébastien Vilain, Jean-William Dupuy, Anne-Marie Lomenech et Stéphane Claverol de la Plateforme protéome du centre de génomique fonctionnelle de Bordeaux, avec qui j’ai eu l’honneur de travailler et qui m’ont apporté toute leurs expertises et leur bonne humeur tout au long de cette thèse.
Je suis très reconnaissant envers les équipes de recherche avec lesquelles j’ai pu collaborer, UMR 1065 SAVE, Patrice Rey, Lucia Guérin-Dubrana, Marc Fermaud, Jean Roudet, UMR EGFV, Ghislaine Hilbert, GESVAB, Alison Pawlus, Laboratoire de chimie analytique, Marie-Claire Pérello et qui ont pris une part importante dans la réalisation de ces travaux.
Une thèse c’est également l’occasion de rencontrer des gens intéressants avec qui j’ai pu échanger, les docteurs les plus anciens Andréa, Axel, Greg, Guillaume, Katarina, Kléo, Philippe, Sophie les plus jeunes Guilherme et les futurs, Armin, Christelle, Davide, Georgia, Julien, Marion ainsi que des personnels permanents Cécile, Geoffrey, Julie, Patrick… Merci également à Delphine Perrin et Dominique Franchini pour leur soutien.
Cette thèse n’aurait pu se finir sans le soutien de ma famille, mon grand père, ma mère, mon père, ma tante, mes cousins et cousines, Evelyne, Sabine, Lion, Elisheva, Lévy et mes amis, Vincent (et toute la famille), Wilfried, Ludwig et leur maman, Clément, Sylvain, Nico… les moments difficiles au cours d’une thèse son légion mais grâce à eux j’ai trouvé le courage pour finir ce travail, merci à tous.
iii
Résumé
La vigne est sensible à de nombreuses maladies cryptogamiques qui vont altérer la qualité des raisins et des vins. Depuis plusieurs années, l’Esca est devenue un fléau pour la viticulture moderne, car elle est responsable de la mort des pieds de vigne lorsqu’elle se présente sous forme apoplectique. Sa forme chronique est liée à la présence d’un cortège de champignons pathogènes dans le tronc et les bras, qui vont provoquer le plus souvent des symptômes foliaires. L’altération de la photosynthèse que cela provoque, va avoir des conséquences sur la maturation du fruit. Cependant, peu de travaux de recherche ont été menés pour caractériser précisément l’impact de cette maladie sur le métabolisme et la composition chimique des baies de raisin.
Notre étude avait pour but d’apprécier, grâce à une approche protéomique, les conséquences de cette maladie sur la qualité des raisins. Nos travaux ont permis de mettre en évidence que l’expression de symptômes foliaires d’Esca provoque une modification d’abondance des protéines liées aux mécanismes de défense et de stress oxydatif de la pellicule du raisin. Il est également observé un changement de capacité antioxydante par modulation des teneurs en peroxyde d’hydrogène, en glutathion ou en pyridoxine. Les concentrations en molécules d’intérêt œnologique comme les acides aminés, les amines biogènes ou les tannins sont également modifiées en présence de symptômes foliaires d’Esca.
Mots clés: Composition chimique, Esca, qualité, métabolomique, parois cellulaires,
iv
Abstract
The vine is susceptible to many fungal diseases that will affect the quality of grapes and wines. For several years, Esca has become the bane of modern viticulture because it is responsible for the death of the vines when presented in the form apoplectic. Its chronic form is associated with the presence of a procession of pathogenic fungi in the trunk and arms that will most often cause leaf symptoms. The alteration of photosynthesis that this causes will affect fruit ripening. However, little research has been conducted to characterize precisely the impact of this disease on the metabolism and chemical composition of grape berries.
Our study aimed to assess, using a proteomic approach the disease's impact on the quality of grapes and get specific markers. Our work allowed us to demonstrate that the expression of foliar symptoms of Esca causes a change in abundance of proteins related to defense mechanisms and oxidative stress in the grape skin. It is also observed a change in antioxidant capacity by modulating levels of hydrogen peroxide, glutathione or pyridoxine. The concentrations of molecules of oenological interest such as amino acids, biogenic amines or tannins are also modified in the presence of foliar symptoms of Esca.
Keywords: Chemical composition, Esca, quality, metabolomics, cell walls,
v
Table des Matières
Résumé iii
Abstract iv
Table des Matières v
Liste des Figures 9
Liste des Tableaux 11
Liste des abréviations 12
Liste des publications et communications 14
INTRODUCTION GENERALE 17 CHAPITRE 1 20 Contexte bibliographique 20 1. La vigne 20 1.1. Présentation botanique 20 1.2. Cycles de développement 20 2. Le raisin 21
2.1. Phase de croissance herbacée 22
2.2. Phase de maturation 23
2.3. Composition chimique du raisin et évolution au cours de la phase de croissance herbacée et de la maturation 23
2.3.1. Les sucres 23
2.3.2. Les acides organiques 24
2.3.3. Les substances azotées 24
2.3.4. Cas particulier des acides aminés 25 2.3.4.1. Rôle des acides aminés chez les plantes 26 2.3.4.2. Rôle des acides aminés dans la relation plante/stress 27 2.3.4.3. Rôle des acides aminés en œnologie 30
2.3.5. Les substances minérales 32
3. Pellicule des raisins rouges 32
3.1. Evolution de la pellicule au cours de la maturation : aspects histologiques et cytologiques 33 3.2. Composition de la pellicule et évolution au cours de la maturation : aspects chimiques 34
3.2.1. Les polyphénols 34
3.2.1.1. Les composés non-flavonoïdes 34 3.2.1.2. Les composés flavonoïdes 35 3.2.1.3. Rôles des polyphénols chez les plantes 39 3.2.1.4. Rôles des polyphénols en œnologie 40
3.2.2. Les protéines 42
3.2.2.1. Protéomique et maturation 42
3.2.2.2. Protéomique et stress 43
3.2.2.3. Cas particulier des « Pathogenesis related proteins » ou PR-protéines 44
3.2.2.4. Protéines et vin rouge 45
3.3. Pellicule et pathogènes 46
vi
3.3.2. Défenses induites 49
3.3.3. Rôle de l’activité de l’eau 50
4. Les parois cellulaires 52
4.1. Structure et composition 52
4.2. Protéines 53
4.3. Pathogènes 55
4.4. Evolution des parois cellulaires au cours de la maturation du raisin 56
5. L’Esca 58
5.1. Historique de la maladie 58
5.2. Biologie 59
5.2.1. Différents types de syndromes et symptômes internes 59
5.2.2. Symptômes externes 61
5.2.3. L’apoplexie 62
5.2.4. Champignons associés à l’Esca 63 5.2.4.1. Champignons trachéomycotiques 63
5.2.4.2. Basidiomycètes 65
5.2.4.3. Autres champignons associés à l’Esca 66 5.2.5. Molécules impliquées dans l’apparition des symptômes 67 5.2.5.1. Toxines produites par Phaeomoniella chlamydospora et Phaeoacremonium aleophilum 68 5.2.5.2. Toxines produites par les basidiomycètes 69 5.2.5.3. Mode d’action des toxines 69 5.2.5.4. Enzymes produites par les champignons responsables de l’Esca 70
5.2.6. Epidémiologie 71
5.3. Paramètres environnementaux favorisant l’Esca 73
5.4. Contrôle de l’Esca 74
5.5. L’Esca et l’œnologie 75
6. Le stress oxydant 77
6.1. Rôle de la phosphorylation oxydative dans la réponse au stress oxydant et la production de radicaux oxygénés 78
6.2. Facteurs impliqués dans le stress oxydatif chez les plantes 80
6.3. Rôle du glutathion 81
6.3.1. Implication dans la relation plante / stress 81
6.3.2. Incidences œnologiques 83
6.3.2.1. Implication dans le contrôle des oxydations chimiques et enzymatiques 83 6.3.2.2. Le glutathion en tant que précurseur d’aromes 84 6.3.2.3. Effet négatif du glutathion 84
6.4. Rôle de la Pyridoxine 84
CHAPITRE 2 86
Matériel et Méthodes 86
1. Matériel végétal 86
1.1. Parcelle expérimentale 86
1.2. Caractéristiques climatiques des années 2009 et 2010 86
1.3. Méthodologie de prélèvement 88
2. Paramètres liés à la maturation du raisin 89
2.1. Analyses « classiques » 89
vii
3. Protéomique 90
3.1. Etude du protéome soluble de la pellicule des baies de raisin 90
3.1.1. Extraction 90
3.1.2. Précipitation et réhydratation 91
3.1.3. Dosage 91
3.1.4. 2-DE 91
3.1.5. Analyse des gels, traitement des données, analyses statistiques 92 3.1.6. Digestion « in-gel » des spots d’intérêt 93
3.1.7. Analyse MS/MS 94
3.1.8. Analyse des données, blast, prédiction de localisation 94 3.2. Etude du protéome pariétal de la pellicule des baies de raisin 95 3.2.1. Préparation des parois cellulaires 95 3.2.2. Evaluation de la pureté des parois cellulaires par microscopie 96
3.2.3. Extraction des protéines 97
3.2.4. Réhydratation, digestion et analyse MS des protéines pariétales 98 3.2.5. Analyse des données, blast et prédiction de localisation 98
4. Stress oxydatif 99 4.1. Extraction 99 4.2. Activité antioxydante 100 4.2.1. Test ORAC 100 4.2.2. Test FRAP 100 4.2.3. Test DPPH 101 4.2.4. Test ABTS+ 101 4.3. Peroxyde d’hydrogène 102
4.4. Glutathion réduit et oxydé 102
4.5. Pyridoxine 103
5. Métabolomique 104
5.1. Extraction 104
5.1.1. Acides aminés et amines biogènes 104
5.1.2. Tannins 105
5.2. Dosage 105
5.2.1. Acides aminés 105
5.2.2. Amines biogènes 106
5.2.3. Tannins totaux 107
5.2.4. Monomères et dimères de flavan-3-ols 108 5.2.5. Degré de polymérisation moyen 109
6. Analyses statistiques 110
7. Validation des méthodes analytiques mises au point au cours de la thèse 111
CHAPITRE 3 113
Etude de l’impact de l’Esca sur les protéines de la pellicule des baies de raisin 113
1. Introduction 113
2. Conclusion 115
CHAPITRE 4 117
viii
mécanismes de maturation 117
1. Introduction 117
2. Conclusion 120
CHAPITRE 5 122
Etude de l’impact de L’Esca sur les mécanismes de stress oxydatif des baies de raisin 122
1. Introduction 122
2. Conclusion 124
CHAPITRE 6 126
Etude de l’impact de l’Esca sur le métabolisme de molécules d’intérêt œnologique dans les baies de
raisin 126 1. Introduction 126 2. Conclusion 129 CONCLUSION GENERALE 132 PERSPECTIVES 140 REFERENCES 141
Liste des Figures
Figure 1 : Stades phénologiques de la vigne d’après Meier (2001)
Figure 2 : Représentation schématique du développement du raisin d’après
Robinson et al. (2000)
Figure 3 : Assimilation du soufre et biosynthèse des composés de défense
contenant du soufre d’après Raush et al. (2005)
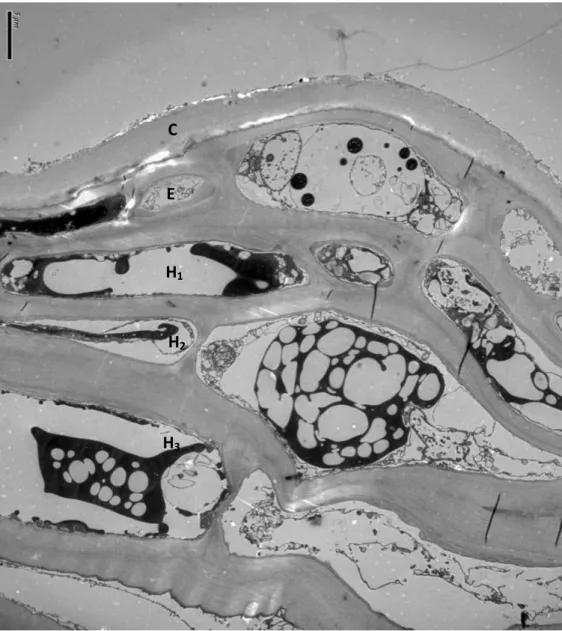
Figure 4 : Ultrastructure d’une pellicule de Cabernet sauvignon à maturité par
microscopie électronique à transmission. C : Cuticule ; E : Epiderme ; H1 : Première
assise cellulaire de l’hypoderme ; H2 : Seconde assise cellulaire de l’hypoderme ;
H3 : Troisième assise cellulaire de l’hypoderme. Cliché réalisé en collaboration avec les
pôles photoniques et électroniques du Bordeaux Imaging Center Figure 5 : Structure de base des acides hydroxycinnamiques Figure 6 : Structure de base des flavonoïdes
Figure 7 : Structure des principales anthocyanes du raisin Figure 8 : Structure des principaux flavan-3-ols du raisin
Figure 9 : Structure de la paroi cellulaire des plantes d’après Cosgrove (2005)
Figure 10 : Evolution de l’Esca/BDA en Aquitaine depuis 2003 (source IFV -
http://www.vignevin.com/)
Figure 11 : Nécroses noires et exsudats visqueux caractéristiques de la maladie de
Pétri d’après Stewart et al. (2005)
Figure 12 : Association entre des nécroses centrales (a) et sectorielles (d) molles et
des nécroses centrales dures (b) avec une bande brune (c) et des ponctuations (e). C: Association entre des nécroses centrales (a) et sectorielles (c) dures, avec bande brune (b) et (d) des ponctuations. D’après Kuntzmann et al. (2010)
10
Figure 14 : Carpophore de Fomitiporia mediterranea sur un vieux tronc de la vigne
d’après Graniti (2006)
Figure 15 : Nécroses sectorielles associées à de la pourriture blanche
caractéristiques de l’Esca dans une coupe transversale de tronc d’après Larignon et
al. (2010)
Figure 16 : Symptômes externes de la maladie de Pétri d’après Gubler et al.
(http://www.lodiwine.com/Canker_Diseases.pdf)
Figure 17 : Fissures dans le tronc provoquées par la pourriture blanche d’après
Mugnai et al. (1999)
Figure 18 : Exemples de symptômes externes précoces et terminaux d’Esca d’après
Surico (2009)
Figure 19 : Exemples de « black measles » d’après Gubler et al.
Figure 20 : Exemples de fissures sur baies d’après Mugnai et al. (1999) Figure 21 : Symptômes d’apoplexie d’après Mugnai et al. (1999)
Figure 22 : Principaux systèmes antioxydants au niveau des mitochondries d’après
Noctor et al. (2006)
Figure 23 : Choix des pieds pour l’expérimentation Figure 24 : Cliché de l’embout du pénétromètre Figure 25 : Cliché de l’Aw-mètre
Figure 26 : Schéma simplifié du protocole d’extraction et de précipitation des
protéines solubles
Figure 27 : Chromatogrammes et spectres de masse du standard de pyridoxine
dans l’eau et de pyridoxine dans l’échantillon
Figure 28 : Paramètres de validation de la méthode de dosage de la pyridoxine Figure 29 : Chromatogrammes et spectres de masse du standard de tryptophane
11
Figure 30 : Paramètres de validation de la méthode de dosage du tryptophane Figure 31 : Chromatogrammes et spectres de masse du standard de tryptamine
dans l’eau et de la tryptamine dans l’échantillon
Figure 32 : Paramètres de validation de la méthode de dosage de la tryptamine Figure 33 : Schéma de principe du dosage des tannins à partir d’extrait de pellicule
de raisin
Liste des Tableaux
Tableau 1 : Composition des raisins. Valeurs minimales et maximales retrouvées à
maturité d’après Cabanis et al. (1998), Ribéreau-Gayon et al. (2004) et Bell et al. (2005)
Tableau 2 : Familles de PR-protéines associées à leurs activités biologiques et à
leurs sites d’action
Tableau 3 : Métabolites isolés de culture de Phaeomoniella chlamydospora, Phaeoacremonium aleophilum et Fomitiporia mediterranea
12
Liste des abréviations
AA Acide ascorbique
ABTS 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid ACN Acétonitrile
ADP Adénosine diphosphate AGP Arabinogalactane protéine ALA Alanine
AOX Antioxydant
APX Ascorbate peroxydase ARG Arginine
ASP Asparagine AT Acidité totale Aw Activity water
BCAA Branched chain amino acid CAT Catalase
Cat Catéchine
DAA Day after anthesis
DHAR Deshydroascorbate réductase DPm Degré de polymérisation moyen DPPH 2,2-diphenyl-1-picrylhydrazyl DTT Dithiothréitol
Epi Epicatéchine
Fmed Fomitiporia mediterranea
FV Fin véraison
GABA Acide γ-aminobutyrique GLN Glutamine
GLU Glutamate GLY Glycine
GPOX Guaiacol peroxidase GPX Glutathion peroxydase GR Glutathion réductase GRP Grape reaction product GSH Glutathion réduit GSSG Glutathion oxydé
GST Glutathion s-transférase H2O2 Peroxyde d'hydrogène HCl Acide chlorhydrique HCOOH Acide acétique HIS Histidine
HPLC Chromatographie liquide haute performance HRGPS Glycoprotéines riches en hydroxyproline ILEU Isoleucine
13 KOH Hydroxyde de potassium
LEU Leucine LYS Lysine
MDHAR Monodeshydroascorbate réductase MET Méthionine
NACl Chlorure de sodium ORN Ornithine
Pal Phaeoacremonium aleophilum
Pch Phaeomoniella chlamydospora
PHE Phénylalanine Pi Point isoélectrique PLP Pyridoxal 5-phosphate PRO Proline
PRP Pathogenesis related protein RLA Résistance locale acquise ROS Reactive oxygen specie
RSA Résistance systémique acquise SAM S-adenosylmethionine
SER Sérine
SOD Superoxyde dismutase THR Thréonine
TRY Tryptophane TYR Tyrosine UV Ultraviolet VAL Valine
14
Liste des publications et communications
PUBLICATIONS
Pasquier G, Lapaillerie D, Vilain S, Dupuy JW, Lomenech AM, Claverol S, Gény L, Bonneu M, Teissedre PL, Donèche B. Impact of foliar symptoms of “Esca proper” on proteins related to defense and oxidative stress of grape skins during ripening.
Proteomics, accepted, 2012.
Pasquier G, Lapaillerie D, Dupuy JW, Lomenech AM, Claverol S, Bonneu M, Gény L, Teissedre PL, Donèche B. Development of a method for the extraction and analysis of grape skin proteins strongly bounded to cell wall. Journal International
des Sciences de la Vigne et du Vin, submitted, 2012.
Pasquier G, Lapaillerie D, Dupuy JW, Lomenech AM, Claverol S, Teissedre PL, Bonneu M, Donèche B. Comparison of cell wall protein profile of grape skin during ripening. Journal of the Science of Food and Agriculture, submitted, 2012.
Pasquier G, Ky I, Teissedre PL, Donèche B, Impact of foliar symptoms of Esca on the Mechanisms of Oxidative Stress During Grape Ripening. Plant Pathology, submitted, 2012.
Pasquier G, Silva M, Perello MC, Hilbert G, Guerin-Dubrana L, Rey P, De Revel G, Teissedre PL, Donèche B. Impact of foliar symptoms of Esca on amino acid metabolism, levels of biogenic amines and tannins in grape skin during ripening.
Phytopathologia mediterranea, submitted , 2012.
Lorrain B, Ky I, Pasquier G, Jourdes M, Guerin Dubrana L, Gény L, Rey P, Donèche B, Teissedre PL. Effect of Esca disease on the phenolic and sensory attributes of Cabernet Sauvignon grapes, musts and wines. Australian Journal of Grape and
15
Wine Research, 18, 64–72, 2012.
Ky I, Lorrain B, Jourdes M, Pasquier G, Fermaud M, Gény L, Rey P, Donèche B, Teissedre PL. Assessment of grey mould (Botrytis cinerea) impact on phenolic and sensory quality of Bordeaux grapes, musts and wines for two consecutive vintages.
Australian Journal of Grape and Wine Research, 18, 215-22, 2012
COMMUNICATIONS INTERNATIONALES
Pasquier G, Lapaillerie D, Dupuy JW, Lomenech AM, Claverol S, Bonneu M, Gény L, Donèche B. Proteome analysis of grape skin cell wall during ripening. In vino Aanlytica Scientia 2011, Session 1 Chemical Analysis and Composition of Grapes, Wines and Spirits, 21-23 July 2011, Convention Center, Gratz University, Gratz, Austria.
Pasquier G, Lapaillerie D, Vilain S, Dupuy JW, Lomenech AM, Claverol S, Gény L, Bonneu M, Donèche B. Impact of Esca in the protein profile of grape skin. 6P4, Macrowine 2012, 18-21 June 2012, Agora, Domaine du Haut Carré, Bordeaux, France.
Pasquier G, Silva M, Perello MC, Hilbert G, Guerin-Dubrana L, Rey P, De Revel G, Teissedre PL, Donèche B. Esca impact on amino acid metabolism, level of biogenic amines and tannins in grape skin during ripening. 6P5, Macrowine 2012, 18-21 June 2012, Agora, Domaine du Haut Carré, Bordeaux France.
Pasquier G, Lapaillerie D, Dupuy JW, Lomenech AM, Claverol S, Bonneu M, Gény L, Donèche B. Proteome analysis of grape skin cell wall during ripening. 9éme Symposium International d’oenologie, Oeno 2011, 15-17 juin, Bordeaux, France.
16 Ky I, Pasquier G, Jourdes M, L'hyvernay A, Gény L, Donèche B, Teissedre PL. Effects of Botrytis cinerea and Esca on berries and wines phenolic composition. Third International Symposium MacroWine 2010 on Macromolecules and Secondary Metabolites of Grapevine and Wines. Torino (Italy), 16-18 June 2010. p 79-81.
Ky I, Lorrain B, Pasquier G, Jourdes M, Fermaud M, L’Hyvernay A, Gény L, Donèche B, Teissedre PL. Effect of Botrytis cinerea and Esca on berries and wines phenolic composition of 2009 and 2010. WAC 2011 International Conference, Wine Active Compounds, 24-26 march 2011 Beaune, Palais des congrés, France, Proceedings, p51–p52.
Lorrain B, Ky I, Pasquier G, Jourdes M, L'Hyvernay A, Fermaud M, Gény L, Donèche B, Teissedre PL. Botrytis cinerea and Esca impact on phenolic and sensory quality of Bordeaux grapes and their derived wines. 9éme Symposium International d’oenologie, Oeno 2011, 15-17 juin, Bordeaux, France, III.12.
Lorrain B, Ky I, Pasquier G, Jourdes M, Fermaud M, L’Hyvernay A, Gény L, Donèche B, Teissedre PL. Botrytis cinerea and Esca impact on phenolic and sensory quality of Bordeaux grapes and their derived wines. XXXIV World Congress of Vine and Wine and 9th General Assembly of Vine and Wine International Organization (O.I.V.), Porto, 20-27 juin 2011, Portugal, 4p.
Lorrain B, Ky I, Pasquier G, Jourdes M, L’Hyvernay A, Fermaud M, Gény L, Donèche B, Teissedre PL. Effect of two vine cryptogamic diseases (Botrytis Cinerea and Esca) on phenolic and sensory quality of Bordeaux grapes and their derived wines. European Symposium for Fruits and Vegetables Processing, 18-21 avril, Avignon, France, 2011.
17
Introduction Générale
Les surfaces plantées en vigne dans le monde représentent environ 7.5 millions d’hectares pour une production annuelle de vin proche de 260 millions d’hl. L’Europe cultive 59% des surfaces du vignoble mondial dont la majorité est localisée en Espagne, en France et en Italie. Avec 840 000 hectares de vigne, la viticulture française occupe 2.9% de la surface agricole utile (SAU) ce qui représente 15% de la valeur de la production agricole totale. En 2009, la France était le deuxième producteur mondial de vin (46 millions d’hl) derrière l’Italie, faisant de la viticulture une composante importante de la production de richesse nationale (source FranceAgriMer).
L’Aquitaine est le premier vignoble à appellation d’origine de France (144 000 ha, 8 millions d’hl) et réunit 70 appellations d’origine contrôlée dont 55 en Gironde. Les vins rouges et rosés représentent 84% de l’ensemble de la production des vins dans cette région. Les principaux cépages noirs sont le Merlot et le Cabernet sauvignon et les cépages blancs sont le Sauvignon et le Sémillon.
18 Avant d’élaborer un vin rouge, l’œnologue ou le viticulteur doivent s’assurer de la qualité parfaite de leurs raisins. Ceci passe par des pratiques culturales adaptées aux conditions locales menant ces fruits à la maturité optimale. Les rendements et l’expression végétative, les statuts hydriques et azotés sont autant de paramètres qui vont conditionner le développement des baies et définir « une composition idéale permettant d’obtenir le modèle de vin souhaité ». Mais la qualité des vendanges ne se définit pas exclusivement par des caractéristiques physico-chimiques « optimales » des raisins, acquises tout au long du processus de maturation, mais également par un état sanitaire irréprochable.
La vigne est sensible à de nombreuses maladies provoquées par des champignons, des insectes ou des virus. Elle a d’ailleurs, lors des deux derniers siècles, été dévastée par plusieurs bioagresseurs qui ont marqué son histoire. Les conséquences économiques qui en découlèrent ont été catastrophiques.
A l’heure actuelle, la plupart des pathologies viticoles font appel à des moyens de lutte exclusivement à base de produits chimiques. Pourtant ceci génère, directement ou indirectement, des effets indésirables pour l’environnement et pour l’homme. Mais les autres moyens de lutte, considérés comme des méthodes alternatives, sont pour le moment peu nombreux. C’est dans ce contexte qu’une réduction de moitié des traitements phytosanitaires dans les dix années a été fixée lors du Grenelle de l’environnement tenu le 25 octobre 2007.
Pour atteindre cet objectif, il est primordial de développer de nouveaux moyens alternatifs de lutte contre les maladies cryptogamiques, tout en maintenant la qualité des raisins et des vins à un niveau optimal.
Dans ce cadre, le projet MICROQUAL vise à rassembler, autour d’un même objectif, différentes équipes de l’Institut des Sciences de la Vigne et du Vin. Ce projet rassemble deux axes principaux de recherche ; DEVMICRO visant à étudier « l’influence des facteurs de développement de la vigne et de son microbiote sur les maladies du bois et l’oïdium » et CRYPTOQUAL étudiant « l’impact organoleptique et les conséquences hygiéniques des maladies cryptogamiques de
19 la vigne (Esca et Botrytis cinerea) sur les raisins et les vins ». Cette thèse s’inscrit dans cette dernière thématique.
Des raisins ont été prélevés sur des pieds exprimant ou non des symptômes foliaires d’Esca sur une parcelle expérimentale de cépage rouge Cabernet sauvignon, suivis depuis l’année 2004 par l’UMR 1065 Santé Végétale, à différents stades de maturité. L’étude du protéome soluble, du stress oxydatif et des molécules d’intérêt œnologique devait définir si cette maladie a des répercussions sur la composition et les caractéristiques des raisins et des vins.
Le premier objectif de cette thèse est de déterminer si la présence de symptômes foliaires d’Esca peut modifier le profil protéique de la pellicule des baies de raisins. Cette approche qui s’est appuyée sur une précédente étude menée dans notre laboratoire (Deytieux et al., 2007), devait permettre d’identifier des voies métaboliques modifiées par l’Esca et qui pourrait avoir des conséquences sur la qualité des raisins.
Le deuxième objectif est d’appuyer les résultats obtenus lors de l’analyse protéomique par une analyse des protéines de parois cellulaires. Pour ce faire, il apparaît nécessaire de mettre au point une méthode d’extraction et d’identification de ces protéines et d’appliquer ce protocole pour étudier leur rôle dans le processus de maturation de raisin sain ou affecté par l’Esca.
Le troisième objectif est de confirmer à partir des résultats de protéomique, que la présence de symptômes foliaires provoque une modification du potentiel antioxydant des raisins, une synthèse d’espèce réactive de l’oxygène ainsi qu’une modification de régulation des molécules à activité antioxydante comme le glutathion ou la pyridoxine.
Le dernier objectif de cette thèse est d’analyser des modifications métaboliques au niveau des raisins qui pourraient avoir un intérêt dans la production des vins, à partir des modifications de régulation des voies métaboliques identifiées par l’analyse protéomique.
20
Chapitre 1
Contexte bibliographique
1.
La vigne
1.1.
Présentation botanique
La vigne, Vitis sp., est une plante angiosperme dicotylédone de la famille des Vitaceae. Cette famille rassemble en majorité des plantes ligneuses ou herbacées, ainsi que des arbustes à tiges sarmenteuses. Parmi les Vitaceae, le genre
Vitis comprend deux sous-genres, Muscadinia et Euvitis (Gallet, 2000a). La plupart
des vignes cultivées fait partie de ce dernier sous-genre qui comprend lui-même 3 groupes : américain, euro-asiatique et asiatique sensus stricto. Le premier groupe, présent en Europe et en Asie occidentale, ne comporte que l’espèce Vitis vinifera qui se subdivise en milliers de variétés, appelées cépages ou cultivars, qui résultent de croisements naturels ou de sélection. Au XIXème siècle, la destruction d’une partie des cultures de vignes en Europe par le phylloxéra, a conduit à l’utilisation de porte-greffes d’origine américaine naturellement résistants à cette maladie. Le porte-greffe produit le système racinaire qui va coloniser le sol et le greffon est donc constitué d’un tronc, de bras et de rameaux ou de sarments qui pourront porter des feuilles ou/et des inflorescences. Après fécondation ces inflorescences donneront des grappes (Gallet, 2000b).
1.2.
Cycles de développement
Suite au repos hivernal, le développement de la vigne va correspondre à la superposition du cycle végétatif et du cycle reproducteur. Baggiolini en 1952 (Baggiolini, 1952) a décomposé le cycle annuel de développement de la vigne en
Stade principal 0 : bourgeonnement ou débourrement
00 Dormance : les bourgeons d’hiver sont pointus à arrondis, suivant la variété ils sont brun clair à foncé et les écailles sont plus ou moins appliquées aux bourgeons
01 Début du gonflement des bourgeons : les bourgeons s’allongent à l’intérieur des écailles
03 Fin du gonflement des bourgeons, les bourgeons ne sont pas encore verts
05 « Stade de la bourre » : une protection cotonneuse est nettement visible
07 Début de l’éclatement des bourgeons (débourrement) : l’extrémité verte de la jeune pousse est juste visible
09 Débourrement : l’extrémité verte de la jeune pousse est nettement visible
Stade principal 1 : développement des feuilles
11 Première feuille étalée et écartée de la pousse 12 2 feuilles étalées
13 3 feuilles étalées 1 . Et ainsi de suite...
19 9 ou davantage de feuilles sont étalées
Stade principal 5 : apparition des inflorescences
53 Les grappes (inflorescences) sont nettement visibles
55 Les grappes augmentent de taille, les boutons floraux sont agglomérés
57 Les grappes sont bien développées, les fleurs se séparent
Stade principal 6 : la floraison
60 Les premiers capuchons floraux se séparent du réceptacle 61 Début de la floraison : 10% des capuchons floraux sont
tombés
62 20% des capuchons floraux sont tombés
63 Floraison partielle : 30% des capuchons floraux sont tombés 64 40% des capuchons floraux sont tombés
65 Mi-floraison : 50% des capuchons floraux sont tombés 66 60% des capuchons floraux sont tombés
67 70% des capuchons floraux sont tombés
68 La floraison s’achève : 80% des capuchons floraux sont tombés 69 Fin de la floraison
Stade principal 7 : développement des fruits
71 Nouaison : début du développement des fruits, toutes les pièces florales sont tombées
73 Les fruits (baies) ont la grosseur de plombs de chasse, les grappes commencent à s’incliner vers le bas
75 Les baies ont la grosseur de petits pois, les grappes sont en position verticale
77 Début de la fermeture de la grappe (les baies commencent à se toucher)
79 La fermeture de la grappe est complète, les fruits ont fini de grossir
Stade principal 8 : maturation des baies
81 Début de la maturation : les baies commencent à s’éclaircir et/ou à changer de couleur
83 Eclaircissement et/ou changement de couleur en cours 85 Les baies deviennent molles au toucher
89 Les baies sont mûres pour la vendange
Stade principal 9 : sénescence ou début du repos végétatif
91 Après la vendange : l’aoûtement du bois est terminé 92 Début de la coloration des feuilles
93 Début de la chute des feuilles 95 50% des feuilles sont tombées 97 Fin de la chute des feuilles 99 Baies mûres en phase de conservation
21 « stades phénologiques ». Eichhorn et Lorenz en 1977 (Eichhorn & Lorenz, 1977) et Meier en 2001 (Meier, 2001) (échelle BBCH : Biologische Bundesanstalt, Bundessortenamt and Chemical industry) (Fig. 1) ont affiné cette description en subdivisant les stades existants.
Le cycle végétatif commence à la fin de l’hiver lorsque la température du sol s’élève. L’absorption d’eau et d’éléments minéraux au niveau du système racinaire ainsi que la mobilisation des réserves vont se matérialiser par un écoulement de sève (pleurs) au niveau des plaies de taille. Dans le sud-ouest, le débourrement (stade 01-BBCH) a lieu fin mars - début avril et se poursuit par l’étalement et le développement des feuilles (stades 11 à 19-BBCH). Les inflorescences vont apparaître (stade 53-BBCH) et l’évolution de l’appareil reproducteur va se poursuivre jusqu’au stade 89-BBCH. L’aoûtement (stade 91-BBCH) des rameaux se termine et les feuilles deviennent sénescentes puis tombent (stade 92 à 97-BBCH).
La floraison (stade 60 à 69-BBCH) débute au mois de mai jusqu’à la chute des capuchons floraux. L’ovaire est ensuite fécondé pour devenir un fruit (stade 71-BBCH). Les raisins grossissent (petits pois, stade 75-BBCH) jusqu’à la fermeture de la grappe (stade 77 à 79-BBCH). Le changement de couleur correspond à la véraison (stade 81-BBCH) qui marque le début de la maturation. La vendange (stade 89-BBCH) est réalisée lorsque les raisins ont atteint des caractéristiques physico-chimiques optimales.
2.
Le raisin
La plupart des composés du vin sont produits par la vigne dans les feuilles et/ou dans les baies. La qualité des vins dépend en grande partie du matériel végétal, des pratiques culturales au vignoble et des conditions climatiques. Des observations empiriques ont d’ailleurs conduit à définir cinq conditions qui déterminent un grand millésime de vin rouge :
22 - La nouaison doit se faire avec un début de contrainte hydrique pour
limiter la taille des baies et assurer la future richesse tannique,
- La véraison a lieu après l’arrêt de croissance de la vigne imposée par une forte contrainte hydrique,
- La maturation doit être complète, assurée par une surface foliaire suffisante et un temps sec sans chaleur excessive,
- La vendange des raisins à maturité optimale par temps sec, afin de limiter les phénomènes de dilution ainsi que l’apparition de la pourriture grise. Le développement et la maturation du raisin ont été très étudiés du fait de leur implication majeure pour l’obtention d’un vin de qualité. Les différentes phases d’évolution du raisin sont la somme de changements biochimiques et physiologiques qui vont rendre les baies comestibles et désirables vis-à-vis des animaux.
Les facteurs modifiant la taille, la couleur, l’acidité, l’odeur et le goût des baies font partie des principales préoccupations des viticulteurs. C’est dans ce cadre que de nombreuses études ont permis, depuis plusieurs années, d’apporter des informations scientifiques essentielles afin de fixer précisément une date de vendange et ainsi obtenir une qualité optimale du raisin (Ribéreau-Gayon et al., 2004).
2.1.
Phase de croissance herbacée
Le développement des raisins suit une courbe en double sigmoïde avec deux phases de croissance distinctes séparées par une phase de latence (Fig. 2) (Robinson & Davies, 2000, Coombe, 1992). La première phase, de la fécondation à la nouaison, est sous le contrôle d'hormones de développement comme auxines, cytokinines et gibbérellines qui vont favoriser les divisions cellulaires et l'expansion des cellules. Ces hormones atteignent une concentration maximale avant la véraison, puis diminuent tout au long de la maturation. Cette première
Tableau 1 Composition des raisins. Valeurs minimales et maximales retrouvées à maturité d’après Cabanis et al. (1998), Ribéreau-Gayon et al. (2004) et Bell et al. (2005)
Acide tartrique 3.56-7.42 Glucose 70-125 Azote ammoniacal 30.10-3-0.10 Potassium 0.4-1.84
Acide malique 0.7-8.6 Fructose 70-125 Azote nitrique 4.10-3-25.10-3 Calcium 30.10-3-0.2
Acide D-malique 46.10-3-76.10-3 Arabinose 0.01-0.3 Azote aminé 80.10-3-0.3 Magnesium 40.10-3-0.16
Acide citrique 0.13-0.9 Xylose ND-0.15 Azote peptidique 0.1-0.2 Sodium 3.10-3-50.10-3
Acide ascorbique 10.10-3-75.10-3 Trehalose 0.02 Azote protéique 10.10-3-0.1 Silicium 20.10-3-90.10-3
Acide oxalique ND-50.10-3 Saccharose 0.5-15 Alanine 10-227 Phosphate 0.1-0.8
Mesoinositol 0.32-0.75 Arginine 20-2322 Sulfate 40.10-3-0.6
Mannitol 0.03-0.1 Asparagine 1-171 Chlorure 10.10-3-0.2
Sorbitol 0.01 Acide aspartique 10-138 Fer 25.10-3-13.10-3
Citrulline 0.1-83 Manganèse 24.10-3-7.5.10-3
Cystéine 1-8.2 Zinc 40.10-3-7.8.10-3
Glutamine 9-4499 Aluminium 0.1.10-3
-2.75.10-3
Acide glutamique 27-454 Cuivre 10.10-6-1.8.10-3
Glycine 1-20 Nickel 5.10-6-90.10-6 Histidine 5-197 Lithium 5.10-6-0.12.10-3 Isoleucine 1-117 Chrome 4.10-6-90.10-6 Leucine 2-160 Molybdène 1.10-6-15.10-6 Lysine 0.7-45 Cobalt 1.10-6-15.10-6 Méthionine 1-33 Vanadium 4.10-6-0.45.10-3 Ornithine 0.1-27.2 Bromure 10.10-6-2.6.10-3 Phénylalanine 2.8-138 Iodure 2.10-6-30.10-6 Proline 9-2257 Fluorure 40.10-6-1.7.10-3 Sérine 13-330 Plomb 10.10-6-0.35.10-3 Thréonine 9-284 Arsenic 1.10-6-12.10-5 Tryptophane 0.2-11 Cadmium 10.10-9-5.10-5 Tyrosine 2-33 Sélénium 0.2.10-6-0.8.10-6 Valine 7-116 Mercure 10.10-9-60.10-9 Platine ND-24.10-6 Cyanre 4.10-6-66.10-6
Sucres (g/L) Substances minérales (g/L)
23 phase de croissance est généralement suivie par une phase de latence. La durée de cette phase est spécifique du cépage et finit en même temps que la phase de croissance herbacée du fruit (Blouin & Guimberteau, 2000).
2.2.
Phase de maturation
Le début de la maturation correspond à la véraison qui définit un changement de couleur de la pellicule. Cette phase commence en Août dans l'hémisphère nord et dure environ 45 jours, en fonction des conditions environnementales. C’est durant cette phase que se produisent les principales modifications de composition des baies. Les trois principales hormones impliquées dans le processus de maturation des raisins sont l'acide abscissique qui va s’accumuler surtout après la véraison, l'éthylène qui est à un très faible niveau tout au long du développement et de la maturation, et les brassinostéroïdes dont la concentration augmente au début de la maturation (Coombe & Hale, 1973). La taille des raisins va doubler durant cette phase essentiellement à cause d’une accumulation importante d’eau. Il a d’ailleurs été bien montré qu’un déficit hydrique important au niveau du sol limitait la taille des baies.
2.3.
Composition chimique du raisin et évolution au cours de la
phase de croissance herbacée et de la maturation
2.3.1. Les sucres
Le saccharose, produit par la photosynthèse au niveau des feuilles, est le principal glucide qui va être transporté dans la plante. Pourtant ce sont le glucose et le fructose qui sont les deux principaux sucres (Tableau 1) qui vont s’accumuler dans les raisins. Leurs teneurs vont fortement augmenter pour atteindre 1 M d’hexose contenu dans les baies avec un ratio glucose/fructose proche de 1. Différentes isoformes d’invertases localisées dans les parois cellulaires, les vacuoles et le cytoplasme des raisins vont permettre une hydrolyse du saccharose favorisant
24 l’accumulation du glucose et du fructose après la véraison (Fillion et al., 1999). Cette accumulation est directement liée à l’intensité lumineuse, le statut hydrique et ionique, l’équilibre hormonal et les stress biotiques (Octave et al., 2006). La teneur en sucres des raisins est un des indicateurs importants permettant de déterminer un niveau de maturité des raisins et de fixer une date de vendange. La plupart des sucres étant fermentescible et transformée au cours de la fermentation alcoolique en éthanol par les levures, les teneurs en sucres des moûts permettent d’estimer une teneur d’alcool finale contenue dans les vins.
2.3.2. Les acides organiques
L’acide tartrique et l’acide malique représente entre 70 et 90% de tous les acides organiques présents dans les raisins (Kliewer, 1966) alors que les acides citrique, succinique, lactique ou acétique sont en quantité beaucoup plus faible à maturité. L'acide tartrique est formé par le catabolisme de l'acide L-ascorbique dans les baies de raisin. Toutefois, la biosynthèse de cet acide est limitée de la période post-anthèse à la véraison (Saito & Kasai, 1982). Sa diminution durant la phase de maturation est liée à une dilution à cause du grossissement des raisins. L’acide malique varie au cours du développement et de la maturation des baies et il atteint une concentration maximale avant la véraison. La diminution des teneurs en acides organiques au début de la maturation est associée à l'oxydation du malate. Il a été suggéré que l’acide malique pouvait être transformé en glucose et fructose ou utilisé comme source de carbone et d’énergie pour la respiration (Harris et al., 1971). Comme pour les sucres, l’acidité totale (AT) est une mesure réalisée pour suivre l’évolution de la maturation du raisin. Le rapport sucre/AT, qui est généralement compris entre 35 et 50, est souvent calculé pour déterminer une date de récolte (Ribéreau-Gayon et al., 2004).
2.3.3. Les substances azotées
Dans la baie, l'azote peut être trouvé sous forme minérale (ion ammonium, NH4+ ; ion nitrate, NO3- ; ion nitrite, NO2-) et organique (acides aminés libres,
25 protéines et autres composés azotés organiques tels que l'urée, carbamate d'éthyle et des acides nucléiques). Il y a une accumulation d’azote total à la nouaison, de la véraison à la mi-maturité et en fin de maturation. L'azote minéral (NH4+) peut
représenter jusqu'à 80% de l'azote total avant la véraison, mais diminue à 5-10% durant la phase de maturation. Les teneurs en NO3- et NO2- sont négligeables avec
0,5-2 mg/L et 5-40 µg/L, respectivement (Blouin & Cruège, 2003). L’azote organique, notamment sous forme d’acide aminé, augmente au cours de la maturation et va représenter de 50 à 90% de l’azote total dans les raisins à maturité. L'azote assimilable, qui est généralement de 150 à 200 mg/L, représente l’azote fermentescible par les levures au cours de la fermentation alcoolique. Il est mesuré dans les moûts afin d’ajuster si nécessaire la teneur avant le début de la fermentation (Ribéreau-Gayon et al., 2004).
2.3.4. Cas particulier des acides aminés
Les acides aminés jouent un rôle important dans le métabolisme de la vigne, mais seule la partie assimilable (acide aminé total moins la proline et l’hydroxyproline) a une importance œnologique. Les différents acides aminés communément trouvés dans le raisin entier et le jus de raisin sont : alanine (Ala), arginine (Arg), asparagine (Asn), acide aspartique (Asp), citrulline, cystéine (Cys), glutamine (Gln), acide glutamique (Glu), glycine (Gly), histidine (His), isoleucine (Ile), leucine (Leu), lysine (Lys), méthionine (Met), ornithine (Orn), phénylalanine (Phe), proline (Pro), sérine (Ser), thréonine (Thr), tryptophane (Try), tyrosine (Tyr), valine (Val). Les teneurs totales en acides aminés peuvent varier de 300 à 5000 mg/L à maturité ce qui représente environ 20-50% de l'azote total dans le moût et la concentration de chaque acide aminé dépend du cépage, du porte-greffe, de l'origine géographique, des conditions climatiques, du niveau de maturité, des pratiques culturales et des stress biotiques (Huang & Ough, 1989, Holland et al., 1995). Seulement sept acides aminés sont généralement présents en quantités supérieures à 100 mg/L: Pro, Arg, Gln, Ala, Glu, Ser et Thr. En général, la L-arginine et la L-proline constituent la plus grande partie des acides aminés
26 présents dans le raisin (Stines et al., 2000).
Les teneurs totales en acides aminés dans les raisins augmentent de la véraison à la récolte (Hernández-Orte et al., 1999, Hilbert et al., 2003). Toutefois, dans certains cas, la concentration en acides aminés dans le moût atteint un pic avant la récolte, après quoi, elle se stabilise et/ou baisse lentement jusqu'à la récolte (Kliewer, 1968). La proline commence à s’accumuler dans la baie après la véraison jusqu’à la maturité (Stines et al., 2000). Comme pour les acides aminés totaux, il peut y avoir parfois un pic d’accumulation avant la maturation, puis une stabilisation, voir une diminution jusqu’à la récolte (Ough & Stashak, 1974). Dans la plupart des cas, l'arginine commence à s’accumuler avant la véraison pour atteindre un maximum au cours de la phase de maturation, puis à diminuer jusqu’à la récolte (Hernández-Orte et al., 1999, Stines et al., 2000). Cette réduction vers la fin de la maturation serait reliée à la remobilisation de l'azote vers les organes de stockage (racines) pour préparer la saison suivante. L'azote est stocké principalement sous forme d'arginine. De plus, l'arginine pourrait être convertie en proline, qui s'accumule principalement dans les derniers stades de maturation.
La majorité des acides aminés (89 à 92%) est localisée dans la pellicule et dans la pulpe (Miele et al., 2000). Toutefois, le pourcentage dans chaque partie des baies diffère d'un terroir à l'autre. En effet, une étude française a montré que 40% du total des acides aminés étaient dans la pulpe et 53% dans la pellicule des baies de Cabernet Sauvignon (Miele et al., 2000). En revanche, une étude australienne qui a utilisé le même cépage a montré que 77% de la concentration totale en acides aminés étaient dans la pulpe et seulement 15% dans les pellicules (Stines et al., 2000). Les pratiques culturales et les caractéristiques spécifiques de chaque terroir peuvent modifier le pourcentage d'acides aminés dans chaque partie des baies. Les pratiques culturales comme l'application d'azote dans la vigne augmentent significativement la concentration en acides aminés dans le moût de raisin.
2.3.4.1. Rôle des acides aminés chez les plantes
27 protéine et dans la floraison et le développement des fruits. L’acide γ-aminobutyrique (GABA) agit à la fois, en tant que tampon dans le métabolisme du carbone et de l’azote, comme régulateur du pH cytosolique, comme molécule de signal intracellulaire et comme médiateur dans l’interaction entre les plantes et les autres organismes (Shelp et al., 2006). De nombreuses recherches ont porté sur les acides aminés branchés car, dans les plantes, ils sont précurseurs de nombreux métabolites secondaires (Lea & Ireland, 1999). La cystéine est l’unique donneur de soufre pour l’ensemble des constituants cellulaires qui en renferment sous forme réduite. La synthèse de cystéine se situe à la fin de la séquence d’assimilation de soufre et au début de nombreuses voies de biosynthèse. Cette molécule et ses métabolites dérivés, possédant un groupement sulfhydryle libre sont communément appelés « thiols ». Les résidus cystéine sont importants pour stabiliser la conformation tertiaire et quaternaire des protéines par la formation de pont disulfure. La conversion des groupements thiols libres en pont disulfure et vice versa constitue un système réactif dynamique qui est à la base des échanges redox dans les protéines. Ces échanges sont impliqués dans la modulation du métabolisme cellulaire essentiel dans la réponse à l’environnement (Paget & Buttner, 2003). Libre ou liée aux protéines, la méthionine possède des fonctions très ubiquistes chez les plantes. Hormis son rôle en tant que constituant des protéines et son rôle central dans l’initiation de la traduction de l’ARNm, la méthionine régule indirectement une variété de processus cellulaires en tant que précurseur de « S-adenosylmethionine » (SAM) (Ravanel et al., 1998, Amir, 2010). SAM est le principal donneur biologique de groupements méthyle. Les substrats qui dépendent de ce précurseur participent à la fois au métabolisme primaire et secondaire.
2.3.4.2. Rôle des acides aminés dans la relation plante/stress
La proline et le GABA sont deux molécules décrites comme pouvant intervenir dans la réponse au stress des plantes. L’accumulation de proline a notamment été montrée en conditions de sécheresse (Choudhary et al., 2005), de salinité élevée (Yoshiba et al., 1995), d’irradiation aux UV (Saradhi et al., 1995), en
28 présence de métaux lourds (Schat et al., 1997), de stress oxydatif (Yang et al., 2009) et en réponse à des stress biotiques (Fabro et al., 2004, Haudecoeur et al., 2009). Le GABA agit en tant que protecteur contre le stress oxydatif et la défense contre les herbivores. Il est accumulé dans les plantes en réponse à différents stress, incluant la stimulation mécanique, les blessures chimiques, les chocs thermiques, l’hypoxie et l’acidification cytosolique (Bown & Shelp, 1997, Wallace et al., 1984).
Les acides aminés branchés (BCAA) sont également directement impliqués dans la réponse au stress des plantes. Par exemple, la proline, décrite précédemment, contribue seulement à hauteur de 10% du total des acides aminés libres induits lors de la réponse à la sécheresse ou au vieillissement chez Lathyrus
sylvestris L., ceci est inférieur à l’augmentation de valine, d’isoleucine, de leucine et
de méthionine (Shen et al., 1989). Des résultats similaires ont été constatés dans les feuilles d’Arabidopsis lors d’un stress hydrique, puisque l’augmentation d’isoleucine (90 fois) et de leucine (150 fois) était plus importante que l’augmentation de proline (80 fois) (Nambara et al., 1998, Joshi & Jander, 2009). L’augmentation plus importante des concentrations en BCAAs, par rapport à la proline en condition de stress hydrique a été également montrée dans des feuilles de tomate (Joshi & Jander, 2009). De plus, l’expression d’une « BCAAs aminotransferase », enzyme impliquée dans la dernière étape de biosynthèse de BCAAs, est induite en réponse à une déshydratation (Urano et al., 2009). L’augmentation des concentrations en valine et en leucine a aussi été observée en même temps que celle du pyruvate lors d’un stress hydrique (Good & Zaplachinski, 1994). Il a été proposé que ces BCAAs pouvaient servir à la synthèse de protéines induites lors d’un stress, mais également agir comme molécule signal de régulation de l’expression de certains gènes en condition de stress (Nambara et al., 1998).
La glycine, la lysine, l’alanine ainsi que la sérine peuvent parfois être impliquées dans la réponse au stress. Par exemple, il a été montré que l’alanine pouvait être accumulée dans les plantes en condition de stress hypoxique (Vanlerberghe et al., 1991), elle peut même devenir un des acides aminés
Figure 3 Assimilation du soufre et biosynthèse des composés de défense contenant du soufre d’après Raush et al. (2005)
29 majoritairement accumulé en condition anoxique ou hypoxique chez Medicago
truncatula (Ricoult et al., 2005, Ricoult et al., 2006). La sérine peut, quant à elle, être
le précurseur de glycine bétaine, qui est un osmoprotectant (Mansour, 2000, Venkatesan & Chellappan, 1998).
Même si la phénylalanine, au même titre que les acides aminés branchés par exemple, peut être synthétisée en plus grande quantité lors d’un stress osmotique (Shen et al., 1989), cet acide aminé ainsi que la tyrosine, l’histidine et le tryptophane, sont impliqués dans la voie des phénylpropanoïdes qui est responsable de la synthèse de molécules de défense telles que les composés phénoliques, des alcaloïdes ou des amines plus complexes (amines biogènes, polyamines).
Les concentrations en cystéine peuvent augmenter dans les plantes durant un stress provoqué par des températures basses (Guy et al., 1984, Walker & Mckersie, 1993). L’augmentation de synthèse de ce composé est reliée à une augmentation d’activité des trois enzymes clés de la réduction du sulfate assimilable (Brunner et al., 1995). De plus, les stress abiotiques provoqués par les métaux lourds ou le stress oxydatif affectent l’assimilation du soufre (Fig. 3). Par exemple, des plantes exposées à des métaux lourds tels que le cadmium synthétisent des phytochélatines (g-Glu-Cys)n-Gly à partir de cystéine (Domı nguez-Solı s et al., 2001, Nocito et al., 2002). Il a également été montré que l’augmentation de synthèse de cystéine chez du tabac transgénique qui surexprime une O-Acetylserine(thiol) Lyase modifie la réponse des plantes à un stress oxydatif (Youssefian et al., 2001).
La méthionine n’est pas directement impliquée dans la réponse aux stress des plantes. Néanmoins, elle est précurseur de molécules ayant un rôle dans cette relation. La S-adenosylmethionine intervient dans la synthèse d’alcaloïde, de flavonoïdes, d’acide hydroxycinnamique et de stilbènes (Kagan & Clarke, 1994, Sanja, 2006). Ces molécules peuvent intervenir dans les mécanismes de défenses des plantes lors d’attaques par des pathogènes. La méthionine est impliquée dans la synthèse de S-methylmethionine, qui est considéré comme un précurseur de
30 métabolite secondaire tel que le 3-dimethyl-sulfoniopropionate, un osmoprotectant accumulé par certaines plantes à fleurs ou par certaines algues (Hanson et al., 1994). Dans la famille des Brassicaceae, la méthionine est capable d’être l’intermédiaire réactionnel de la synthèse de divers métabolites secondaires appartenant à la famille des glucosinolates, qui sont impliqués dans la défense contre les pathogènes et les insectes (Gigolashvili et al., 2007, Hirai et al., 2007). Pour finir, la régulation de la méthionine, est fortement corrélée au métabolisme des acides aminés branchés (branched-chain amino acids) en condition de stress.
2.3.4.3. Rôle des acides aminés en œnologie
Les acides aminés constituent une source majeure de nutriment pour les levures et les bactéries lors des fermentations. Ces micro-organismes peuvent libérer des acides aminés après la fermentation, mais les vins sont généralement moins riches en acides aminés que les moûts. Le rôle des acides aminés sur le goût du vin est limité, même s’il a été montré qu'ils peuvent intervenir dans la sensation d'acidité en raison de leur capacité tampon (Dartiguenave et al., 2000). Ils peuvent aussi servir en tant que précurseurs pour la synthèse de composés aromatiques, tels que l'acétate d'isoamyle, l'acide isovalérique et l'acide isobutyrique et leurs esters éthyliques, ainsi que certains alcools, qui sont tous des sous-produits du métabolisme des levures (Ferreira et al., 2000).
L'arginine est une source importante d'azote pour la levure en raison de son catabolisme par l'arginase pour former la L-ornithine et l'urée, qui dans des conditions appropriées peuvent former du glutamate et de l'ammonium, respectivement (Large, 1986). L'excrétion de l'urée, qui résulte de ce métabolisme, par certaines souches de levure a des conséquences sur la formation de carbamate d'éthyle dans le vin (Henschke & Ough, 1991). L’arginine peut également être directement incorporée dans des protéines qui vont être transportées vers les vacuoles des levures et servir de réserve d'azote (Watson, 1976). La L-Proline est très peu utilisée lors de la fermentation alcoolique.
31 levures Saccharomyces cerevisiae, ou les bactéries lactiques Oenococcus oeni, va modifier significativement le profil aromatique des vins. La flore levurienne peut utiliser les acides aminés non seulement comme source d’azote, mais aussi comme agent réducteur sous condition restrictive en oxygène. Parmi ces acides aminés on peut retrouver la cystéine, qui va être utilisée par la levure pour restaurer la balance redox intracellulaire par oxydation du NADH en excès (Mauricio et al., 2001, Victoria Moreno-Arribas & Polo, 2005). La cystéine est également le précurseur d’hétérocycle contenant du soufre, tel que le thiazole. Les bactéries lactiques de type Oenoccocus oeni, sont capables de métaboliser la cystéine en différentes molécules aromatiques ayant comme descripteur les notes « soufré, floral, fruité, toasté » ou « rôti » (Pripis-Nicolau et al., 2004). Les thiols volatiles sont des constituants importants de l’arôme de différents aliments et boissons. Les vins de Sauvignon blanc, de Scheurebe ou de Verdelho contiennent des concentrations élevées de ces molécules (Darriet et al., 1995, Tominaga et al., 2000). Trois composés dans ce groupe appelés « methy-sulfanylpentan-2-one », « 4-methyl-4-sulfanylpentan-2-ol » et « 3-sulfanylhexanol » ont été retrouvés dans les raisins uniquement sous forme de précurseurs conjugués à la cystéine non volatile et inodore (Tominaga et al., 1998). Il a été montré que Saccharomyces cerevisiae pouvait hydrolyser la liaison entre l’unité aromatique et la cystéine, de ces précurseurs, grâce à une « cystéine-S-conjugate-lyase » lors de la fermentation alcoolique, permettant ainsi une libération d’arôme (Howell et al., 2005).
La méthionine intervient dans de nombreuses réactions lors de la vinification. La flore levurienne est capable de produire du méthionol (odeur de choux cuit) à partir de la méthionine. Il a été montré qu’une supplémentation en méthionine de moûts de raisin avant la fermentation alcoolique, augmente les teneurs en méthionol et en esters correspondants. Ces observations suggèrent que la quantité de méthionol dans le vin pourrait être autant influencée par les niveaux de méthionine que par la concentration en azote assimilable des moûts (Moreira et al., 2002, Bell & Henschke, 2005). Des bactéries lactiques isolées du vin sont capables de dégrader la méthionine pour former du méthanethiol, du
3-32 (methyldisulphanyl) propan-1-ol, du dimethyle disulphide, et de l’acide 3-(methyldisulphanyl) propionique. Ces composés sont formés en grandes quantités par Oenoccocus oeni et les deux premières molécules citées sont notamment caractérisées par des odeurs de « putréfaction » et de « chou cuit » respectivement (Pripis-Nicolau et al., 2004).
2.3.5. Les substances minérales
Les raisins sont riches en potassium, qui est un des macronutriments essentiels pour la croissance et le développement des baies. L'accumulation du potassium dans le fruit est lente avant la véraison et augmente fortement lorsque la phase de maturation commence (Blouin & Cruège, 2003, Ollat & Gaudillère, 1996). Le potassium est le cation principal du moût ( 900 mg/L en moyenne) (Blouin & Cruège, 2003) et il va avoir une forte influence sur le pH. Les teneurs en calcium, en magnésium et en oligoéléments métalliques vont diminuer au cours de la maturation, alors que les anions minéraux vont augmenter tout au long du développement du raisin.
3.
Pellicule des raisins rouges
La baie de raisin contient principalement trois types de tissus : la pellicule, la pulpe et les pépins. A coté de ces derniers qui contiennent notamment des tannins oligomères, la pellicule est la structure essentielle déterminant la qualité des raisins et des vins, puisqu’elle est le siège de l’accumulation des principales molécules d’intérêt œnologique telles que les composés phénoliques et les précurseurs d’arômes. Elle permet également au raisin de résister aux conditions climatiques et à la pression mécanique exercée par l’expansion des cellules de la pulpe.
De plus, le changement d’état des baies et notamment son ramollissement au cours de la maturation est corrélé à de profondes modifications structurales et chimiques de la pellicule. Différents travaux ont mis en évidence les propriétés
Figure 4 Ultrastructure d’une pellicule de Cabernet sauvignon à maturité par microscopie électronique à transmission. C : Cuticule ; E : Epiderme ; H1 : Première assise cellulaire de l’hypoderme ; H2 : Seconde
assise cellulaire de l’hypoderme ; H3 : Troisième assise cellulaire de l’hypoderme. Cliché réalisé en
collaboration avec les pôles photoniques et électroniques du Bordeaux Imaging Center
C E H1 H2 H1 H3
33 mécaniques de la baie en relation avec la maturation (Rolle et al., 2008, Maury et al., 2009, Torchio et al., 2010). Cette modification de texture va entraîner non seulement une libération de molécules à la surface de la pellicule, que l’on appelle des exsudats, mais elle va également faciliter la pénétration d’agents pathogènes qui étaient jusqu’alors bloqués par une pellicule rigide et intacte.
3.1.
Evolution de la pellicule au cours de la maturation : aspects
histologiques et cytologiques
Sous le terme « pellicule » sont généralement regroupés l’épicarpe correspondant à la cuticule, l’épiderme et l’hypoderme (Fig. 4). Cette structure représente de 5 à 20% du poids total de la baie et constitue la principale interface entre l’intérieur du raisin et son environnement.
La cuticule est la partie la plus externe du raisin, elle est constituée à 65% d’acide polyhydroxylique, d’acide gras (3%) et d’acide oléique. Elle est épaisse durant la première phase de croissance du raisin, puis s’amincit de la véraison à la maturité.
L’épiderme est constitué d’une couche de cellules au niveau desquelles s’effectuent les dernières divisions cellulaires lors de la croissance végétative. Elles vont ensuite s’allonger durant la seconde phase favorisant la déformabilité et l’élasticité de la baie.
Enfin, l’hypoderme constitué d’une dizaine d’assises cellulaires, fait l’interface vers la pulpe. De forme régulière proche de l’épiderme, les cellules deviennent irrégulières à proximité du mésocarpe ; elles peuvent même, après véraison, évoluer en cellules de pulpe (Fougère-Rifot M. et al., 1996).
Avant la véraison, les parois cellulaires de l’épiderme et de l’hypoderme sont fines (1,5 µm). Dans les cellules, les vacuoles, les mitochondries, le réticulum endoplasmique, les appareils de Golgi et les chloroplastes sont nombreux et à proximité du noyau. A partir de la véraison, les parois cellulaires sont plus
R
3
R
2
R
1
COOH
Figure 5 Structure de base des acides hydroxycinnamiques
Acides hydroxycinnamiques R1 R2 R3
p-Coumarique H OH H
Caféique OH OH H
Férulique OCH3 OH H
34 épaisses (3 µm). Les vacuoles sont fragmentées, les plastes contiennent de nombreux thylacoïdes, le réticulum endoplasmique est moins développé et les mitochondries sont plus petites (Hardie et al., 1996).
3.2.
Composition de la pellicule et évolution au cours de la
maturation : aspects chimiques
3.2.1. Les polyphénols
Métabolites secondaires des plantes, les composés phénoliques sont des molécules qui possèdent un ou plusieurs cycles aromatiques avec des groupements hydroxyles. La réactivité de ces molécules est due aux propriétés acides de leur fonctions phénols et au caractère nucléophile du noyau benzénique (Morrison & Boyd, 1992). L’activité antioxydante de ces composés est une conséquence de la capacité des liaisons conjuguées à délocaliser des électrons des espèces réactives de l’oxygène (Vermerris & Nicholson, 2006). Plus de 10000 structures polyphénoliques allant d’une dizaine de Dalton à plus de 30000 Daltons sont connues. Ils sont présents dans de nombreuses plantes et fruits et dans les produits transformés qui en découlent comme le thé, le cidre, le chocolat ou le vin (Quideau et al., 2011).
Les polyphénols sont généralement répartis dans le groupe des flavonoïdes ou des non-flavonoïdes (Ribéreau-Gayon, 1968).
3.2.1.1. Les composés non-flavonoïdes
Les composés non-flavonoïdes du raisin regroupent les acides phénols et les stilbènes.
Les acides phénols regroupent :
- les acides hydroxybenzoïques, à 7 atomes de carbone, qui se trouvent dans le raisin sous formes libres, hétérosidiques ou estérifiées et dont l’acide gallique est le plus abondant (Chira et al., 2008b),