HAL Id: tel-01081507
https://tel.archives-ouvertes.fr/tel-01081507
Submitted on 8 Nov 2014HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Biodisponibilité de la bile et effets bénéfiques des
chirurgies bariatriques de type by-pass
Daisy Goncalves
To cite this version:
Daisy Goncalves. Biodisponibilité de la bile et effets bénéfiques des chirurgies bariatriques de type by-pass. Biologie moléculaire. Université Claude Bernard - Lyon I, 2014. Français. �NNT : 2014LYO10171�. �tel-01081507�
N° d’ordre : 171 - 2014
THÈSE DE L’UNIVERSITÉ DE LYON
Délivrée par
L’UNIVERSITÉ CLAUDE BERNARD LYON I
ÉCOLE DOCTORALE BMIC
Pour l’obtention du
DIPLOME DE DOCTORAT
(arrêté du 7 août 2006)
Soutenue publiquement le 29 septembre 2014
par
Daisy GONCALVES
Biodisponibilité de la bile et effets bénéfiques des chirurgies
bariatriques de type by-pass
Directeur de thèse : Mr Gilles Mithieux
JURY: Mr Bart Staels – Président du jury Mr Bertrand Cariou – Rapporteur Mr Fabrizio Andreelli – Rapporteur Mr Jean-Marc Vanacker – Examinateur Mr Damien Roussel – Examinateur Mr Gilles Mithieux – Directeur de thèse
2
UNIVERSITE CLAUDE BERNARD - LYON 1
Président de l’Université
Vice-président du Conseil d’Administration
Vice-président du Conseil des Etudes et de la Vie Universitaire Vice-président du Conseil Scientifique
Directeur Général des Services
M. François-Noël GILLY
M. le Professeur Hamda BEN HADID M. le Professeur Philippe LALLE M. le Professeur Germain GILLET
M. Alain HELLEU
COMPOSANTES SANTE
Faculté de Médecine Lyon Est – Claude BernardFaculté de Médecine et de Maïeutique Lyon Sud – Charles Mérieux
Faculté d’Odontologie
Institut des Sciences Pharmaceutiques et Biologiques Institut des Sciences et Techniques de la Réadaptation
Département de formation et Centre de Recherche en Biologie Humaine
Directeur : M. le Professeur J. ETIENNE Directeur : Mme la Professeure C. BURILLON Directeur : M. le Professeur D. BOURGEOIS Directeur : Mme la Professeure C. VINCIGUERRA Directeur : M. le Professeur Y. MATILLON Directeur : Mme. la Professeure A-M. SCHOTT
COMPOSANTES ET DEPARTEMENTS DE SCIENCES ET TECHNOLOGIE
Faculté des Sciences et TechnologiesDépartement Biologie
Département Chimie Biochimie Département GEP
Département Informatique Département Mathématiques Département Mécanique Département Physique
UFR Sciences et Techniques des Activités Physiques et Sportives Observatoire des Sciences de l’Univers de Lyon
Polytech Lyon
Ecole Supérieure de Chimie Physique Electronique Institut Universitaire de Technologie de Lyon 1 Ecole Supérieure du Professorat et de l’Education Institut de Science Financière et d'Assurances
Directeur : M. F. DE MARCHI
Directeur : M. le Professeur F. FLEURY Directeur : Mme Caroline FELIX Directeur : M. Hassan HAMMOURI Directeur : M. le Professeur S. AKKOUCHE
Directeur : M. Georges TOMANOV
Directeur : M. le Professeur H. BEN HADID Directeur : M. Jean-Claude PLENET
Directeur : M. Y.VANPOULLE Directeur : M. B. GUIDERDONI Directeur : M. P. FOURNIER Directeur : M. G. PIGNAULT Directeur : M. C. VITON Directeur : M. A. MOUGNIOTTE Directeur : M. N. LEBOISNE
3
4 Calvin & Hobbes par Bill Watterson, 31 octobre 1989
5
REMERCIEMENTS
Mes premiers remerciements s’adressent aux membres de mon jury de thèse. Merci à mes rapporteurs Bertrand Cariou et Fabrizio Andreelli pour le temps que vous avez accordé à la lecture de ce manuscrit et pour vos commentaires constructifs. Je remercie grandement Bart Staels et Jean-Marc Vanacker pour nos discussions lors des comités de suivi de thèse qui m’ont permis de faire évoluer au mieux le sujet. Merci à Damien Roussel d’avoir accepté d’examiner ce travail.
À Gilles Mithieux, mon directeur de thèse, merci de m’avoir confié le « bébé bile » puis accordé ta confiance pour mener à bien ce projet. Je tiens également à te remercier pour m’avoir encouragée à aller toujours plus loin et faire toujours mieux.
Parce que la thèse ce n’est pas que de la recherche, mais aussi du monitorat, merci à Christophe Chouabe et Damien Roussel de m’avoir aidée à passer de l’autre côté de la barre. Vous m’avez tout d’abord transmis votre passion pour la physiologie lorsque j’étais sur les bancs de la faculté puis transmis celle pour l’enseignement.
Un grand merci à Fabienne et Amandine d’avoir considéré ma candidature pour un stage de master il y a 5 ans, alors que mes mails finissaient probablement dans les spams de Gilles. Merci d’avoir toujours été disponibles pour des corrections et pour vos suggestions pertinentes. Amandine, merci d’avoir à chacune de mes questions pris le temps de m’expliquer la complexité de la régulation de la transcription génique. Tu as réussi à me faire aimer ces nombreux facteurs (ou co-facteurs peut-être) de transcription. Ta gentillesse, ta patience et ta force font de toi un modèle à suivre. Merci également à Maud, notre chercheuse en devenir, pour toutes nos discussions scientifiques et les conseils que tu as pu m’apporter.
Ma plus grande reconnaissance revient à Adeline qui m’a guidée dans mes premiers pas au laboratoire et tout appris des manips. Merci pour tous les moments passés autour d’un rat et d’avoir toujours été disponible pour moi. Tu es la personne la plus gentille et la plus patiente que je connaisse, un vrai sourire pour la vie.
Pour votre bonne humeur et votre disponibilité sans faille, merci à tous les membres de l’unité U855. Un check spécial à mes deux acolytes Magic Filou et Nonch-Nonch pour tous les délires et les fous rires que nous avons eus. Merci Carine pour ta gentillesse et pour avoir été mon encyclopédie de microchirurgie. Un clin d’œil aux anciens thésards Sylvie, Julien, Aya et Élodie de m’avoir donné envie de faire une thèse quand j’étais en stage de master. À mon tour de souhaiter bon courage à la nouvelle doctorante Mo-monika, je mets un point d’honneur à placer un jour dans une conversation
la phrase que tu m’as apprise en macédonien. Aux reines de l’animalerie du 8ème étage, merci
Fanouch et Margaux R. de m’avoir accueillie dans votre bureau lors des derniers jours de rédaction de ce manuscrit. Merci à Anne S., Marie-Ange, Anne D. et aux anciennes Armelle et Valérie avec qui j’ai eu le plaisir de travailler durant ma thèse. Je remercie également mes stagiaires que j’ai eu le plaisir d’encadrer, en particulier Margaux M-M. pour m’avoir donné un bon coup de main dans l’étude cholestyramine.
6 Mille mercis à ma brochette… À mon grand Audeuh, pour m’avoir appris les choses funs de la vie. À ma jumelle Youlie, avec qui j’ai composé le tube de l’été 2013. À mon complice Blandin, parce que depuis Martigues rien n’est plus pareil entre nous. À mon Jean-Jean, car il n’y a que toi pour me faire rire jusqu’aux larmes. À mon Tiflore, parce que Docteur F. est tout aussi surprenante que Miss T. À mon Titane, pour avoir ouvert la porte à Yves-René. Les mots me manquent pour vous remercier de tous les beaux moments d’amitié que nous avons partagés, mais après tout VMVC que TMVC. Vous êtes sans conteste la plus belle partie de ma thèse.
Une pensée pour mes amis de Master : merci à Roméo, car j’adore voyager dans ton monde, ainsi qu’à Ouafa et Thomas pour avoir été des binômes de chocs. Merci à mes amies vaudaises avec qui j’ai grandi : mon Zonzon pour nos nombreux moments de complicité mais aussi à Hajer et Morgane pour nos rendez-vous trimestriels qui font toujours chaud au cœur. Un grand merci à mes amis danseurs, en particulier à mes cg.com ChaCha et Dodo, car il n’y a pas mieux que la danse avec vous pour décompresser d’une journée de manip.
Un détour à Aix-en-Provence pour remercier grandement Florian de m’avoir soutenue durant la rédaction de cette thèse. Tu as su trouver les mots en me citant les plus grands poètes pour que je « garde la pêche » dans les instants difficiles. Merci pour tous nos moments de complicité qui m’apportent beaucoup au quotidien.
Enfin, je remercie du fond de mon cœur mes parents, ma sœur, mon frère et sa petite famille. Merci d’avoir toujours pris soin de moi et de m’avoir encouragée dans mes études. Je ne vous remercierai jamais assez pour tout ce que vous m’apportez, je vous dois tout … Merci à Dulce d’être une sœur exceptionnelle et d’avoir toujours respecté mes kiffs. Un clin d’œil à Chaton, la mascotte de la famille. La famille Gonçalves serait bien incomplète sans la famille Azevedo, j’ai donc une pensée pour mes parrains et mon cousin. À ma famille, merci tout simplement d’avoir été là.
7
LISTE DES ABREVIATIONS
ABC : ATP binding cassette AgRP : agouti-related protein
AMPc : adénosine monophosphate cyclique
ASBT : apical sodium-dependent bile salt transporter ATP : adénosine triphosphate
BSEP : bile-salt export pump
C/EBP : CAAT/enhancer binding protein CBP : CREB binding protein
ChREBP : carbohydrate response element binding protein CREB : cAMP response element binding protein
CRE : cAMP response element
CRTC2 : CREB regulated transcription coactivator 2 CYP7A1 : cytochrome p450 cholestérol 7α-hydroxylase CYP27A1 : cytochrome p450 stérol 27-hydroxylase CYP8B1 : cytochrome p450 12α -hydroxylase
FGF15/19 : fibroblast growth factor 15 (rongeur)/19 (humain) FGFR4 : fibroblast growth factor receptor 4
FoxO1 : forkhead box protein O1 FXR : farnesoid X receptor FXRE : FXR response element IL-6 : interleukin-6
IRE : insulin response element IMC : indice de masse corporelle G6Pase : glucose-6-phosphatase
G6PC : sous-unité catalytique de la G6Pase
G6PT : sous-unité de la G6Pase transportant le glucose-6-phosphate GLP-1 : glucagon like peptide-1
GLUT2 : glucose transporter 2 GR : glucocorticoid receptor
HIF-1α : hypoxia-inducible factor 1α
HNF1/4α: hepatocyte nuclear factor 1 or 4α I-BABP : ileal bile acid-binding protein
8 ISBT : ileal sodium-dependent bile salt transporter
LDL : low density lipoprotein LRH1 : liver receptor homologue 1 LXR : liver X receptor
MC3/4R : melanocortin receptor 3 or 4 MDR1A : multidrug export pump 1a
MRP2/3/4 : multidrug resistance-associated protein 2, 3 or 4 NPY : neuropeptide Y
NTCP : sodium-taurocholate cotransporting cotransporting polypeptide OATP1/2/3 : organic anion transporting polypeptide 1, 2 or 3
OSTα/β : organic solute transporter α/β PEPCK : phosphoénolpyruvate carboxykinase
PGC-1α : peroxisome proliferator-activated receptor gamma coactivator 1α POMC : pro-opiomélanocortine
PXR : pregnane X receptor PYY : peptide YY
RXR : retinoid X receptor
SHP : small heterodimer partner
SMRT : silencing mediator of retinoic acid and thyroid hormone receptor TGR5 - GPBAR1 : G protein-coupled bile acid receptor 1
TNF-α : tumor necrosis factor α VDR : vitamin D receptor
VIP : vasoactive intestinal peptide VLDL : very low density lipoprotein
9
AVANT-PROPOS
Face à l’expansion inquiétante de l’obésité et de ses pathologies associées tel que le diabète de type II, les chirurgies bariatriques connaissent un véritable essor. En effet, elles représentent actuellement le meilleur traitement contre l’obésité morbide. L’intervention la plus connue est la réduction de la taille de l’estomac par la pose d’un anneau gastrique. Une deuxième technique plus invasive concerne les chirurgies de type by-pass qui consistent à dériver les aliments directement dans l’intestin distal en associant ou non une réduction gastrique. Conçues à la base pour créer une malabsorption des nutriments, les chirurgies de type by-pass ont dévoilé des effets inattendus sur le métabolisme glucidique et énergétique. En effet, les patients présentent une amélioration, voire une rémission, de leur diabète quelques jours seulement après l’opération, indépendamment d’une perte de poids (Thaler and Cummings, 2009; Rubino et al., 2010b). Ces patients reportent également une diminution de leur sensation de faim ainsi que de leur envie de consommer des aliments riches en sucres et en lipides (Mathes and Spector, 2012).
Ce travail de thèse porte sur la meilleure compréhension des mécanismes par lesquels les chirurgies de type by-pass induisent des effets bénéfiques sur le diabète et les comportements alimentaires. Nous nous sommes plus particulièrement intéressés à deux conséquences de ces chirurgies: la régulation de la production endogène de glucose et la modification de la biodisponibilité de la bile.
Une synthèse bibliographique introduit ce manuscrit et décrit, tout d’abord, les chirurgies de l’obésité et leurs effets sur le diabète et les comportements alimentaires, puis la régulation de la production endogène de glucose, et enfin le rôle des acides biliaires dans la régulation du métabolisme glucidique et énergétique. L’étude menée lors de mon doctorat est ensuite introduite par une démarche expérimentale puis présentée sous forme d’article (soumis à ce jour). Enfin, une discussion générale replace les principaux résultats de ce travail dans les connaissances scientifiques actuelles et ouvre sur des perspectives d’études.
10
TABLE DES MATIERES
Données bibliographiques ... 12
I. Les chirurgies bariatriques comme traitement de l’obésité et du diabète de type II ... 13
1. Obésité et diabète de type II : une double épidémie métabolique ... 13
2. Les différentes techniques de chirurgie de l’obésité ... 14
a. Les chirurgies restrictives ... 14
b. Les chirurgies de type by-pass ... 15
c. Les autres techniques ... 16
3. De la chirurgie bariatrique à la chirurgie métabolique ... 17
a. Les effets antidiabétiques des chirurgies de type by-pass ... 17
b. Les effets sur les sensations de faim des chirurgies de type by-pass... 18
c. De multiples mécanismes mis en jeu ... 19
d. La sleeve gastrectomie : une chirurgie restrictive pas comme les autres ! ... 23
4. De la chirurgie bariatrique à la chirurgie comportementale ... 24
a. Les changements de préférence alimentaire après chirurgie de type by-pass ... 24
b. Les mécanismes proposés ... 25
II. La production endogène de glucose ... 27
1. Les voies métaboliques de production de glucose ... 27
a. La glycogénolyse ... 27
b. La néoglucogenèse ... 28
2. La glucose-6-phosphatase au carrefour de la production endogène de glucose ... 29
a. Expression tissulaire du complexe glucose-6-phosphatase ... 29
b. Régulation transcriptionnelle de l’unité catalytique de la glucose-6-phosphatase ... 29
3. Organes néoglucogéniques : à chacun sa fonction ! ... 32
a. La contribution des organes glucoformateurs au maintien de la glycémie ... 32
b. Le contrôle de l’homéostasie glucidique et énergétique par les organes glucoformateurs . 33 4. La production endogène de glucose dans les chirurgies de type by-pass ... 34
III. Un nouveau rôle pour les acides biliaires... 35
1. Physiologie des acides biliaires... 35
a. La synthèse des acides biliaires ... 35
b. Le cycle entérohépatique ... 36
11 2. Les acides biliaires : de nouveaux régulateurs métaboliques ... 38
a. Les récepteurs des acides biliaires ... 38
b. FXR et l’homéostasie des acides biliaires ... 40
c. Les acides biliaires et le métabolisme lipidique ... 41
d. Les acides biliaires et le métabolisme glucidique... 42
e. Les acides biliaires et le métabolisme énergétique ... 45
3. Les acides biliaires dans les chirurgies de l’obésité ... 46 Démarche expérimentale ... 47 Dérivations biliaires : protocole ... 50 Article ... 54 Discussion générale ... 81 Références bibliographiques ... 89 Travaux personnels ... 108 Annexes ... 111 Durrafourd et al. 2012 ... 112 De Vadder et al. 2014 ... 132
12
DONNEES BIBLIOGRAPHIQUES
Classification IMC (kg/m²) Maigreur < 18,5 Poids normal 18,5 – 24,9 Surpoids ≥ 25,0 Pré-obésité 25,0 – 29,9 Obésité ≥ 30,0 Classe I (modérée) 30,0 – 34,9 Classe II (sévère) 35,0 – 39,9 Classe III (morbide) ≥ 40,0
IMC P o pu lat io n français e (%)
Figure 1 : L’obésité en chiffre
(A) Classification de l’obésité en fonction de l’indice de masse corporelle (IMC) – D’après l’Organisation Mondiale de la Santé
(B) Prévalence de l’obésité en France - D’après Obépi Roche 2012
13
I. Les chirurgies bariatriques comme traitement de l’obésité et du
diabète de type II
1. Obésité et diabète de type II : une double épidémie métabolique
L’obésité est caractérisée par une accumulation excessive de graisse corporelle pouvant nuire à la santé. On définit le surpoids lorsque l’indice de masse corporelle (IMC) est supérieur à 25, et
l’obésité lorsqu’il dépasse 30 (Fig. 1A). L’obésité résulte principalement d’un déséquilibre
énergétique entre les calories consommées et dépensées. Le changement d’alimentation en faveur d’une plus grande consommation de produits riches en graisses et en sucres ainsi que la tendance à la sédentarisation observés au niveau mondial jouent un rôle incontestable dans l’émergence de cette pathologie. D’après l’Organisation Mondiale de la Santé, le surpoids concernerait 1,4 milliard de personnes dans le monde, dont 500 millions d’individus obèses. En France, la prévalence de
l’obésité est estimée à 15% (Fig. 1B - Obépi Roche 2012). La prévention de l’obésité devient donc
nécessaire, d’autant plus qu’elle est un facteur de risque de pathologies cardio-vasculaires, musculo-squelettiques, de certains cancers et du diabète de type II.
Le diabète de type II est la complication majeure de l’obésité et on estime que 80 à 90% des diabétiques sont obèses. L’Organisation Mondiale de la Santé évalue à 347 millions le nombre d’individus diabétiques et prévoit qu’en 2030 le diabète sera la septième cause de décès dans le monde. Cette pathologie est définit par une hyperglycémie chronique (≥ 126 mg/dl ou 7 mmol/l à jeun) provoquée par des altérations du métabolisme glucidique et responsable de nombreuses complications microcirculatoires (cardiopathies, neuropathies, rétinopathies, néphropathies). La dérégulation de la glycémie résulte, d’une part, d’un défaut d’action de l’insuline à stimuler le captage du glucose par le tissu adipeux et les muscles squelettiques ainsi qu’à inhiber la production endogène de glucose, et d’autre part, d’anomalies de la sécrétion d’insuline par le pancréas endocrine.
La prise en charge de l’obésité allie conseils diététiques, activité physique, accompagnement psychologique et traitement des comorbidités. Le traitement chirurgical n’est proposé qu’en seconde intention, après échec du traitement médical bien suivi pendant 6 à 12 mois, dans le cas d’obésité morbide avec un IMC ≥ 40 ou avec un IMC ≥ 35 associé à des comorbidités (recommandations de la Haute Autorité de Santé). Bien que la chirurgie bariatrique connaisse un véritable essor avec un nombre d’interventions doublé entre 2006 et 2011, on estime que seul 4% de la population cible a été opérée en 2011 en France (étude 2013 de l’Assurance Maladie).
A.
Gastroplastie verticale calibréeB.
Anneau gastrique ajustableC.
Sleeve gastrectomieFigure 2 : Les chirurgies restrictives
14
2. Les différentes techniques de chirurgie de l’obésité
Les chirurgies bariatriques visent à modifier l’anatomie du tractus digestif afin de diminuer la quantité d’aliments ingérés et/ou l’assimilation des nutriments. Elles peuvent être classées en deux catégories : les chirurgies restrictives diminuant le volume stomacal et les chirurgies malabsorptives de type by-pass consistant en un court-circuit de l’intestin et pouvant allier une réduction de la taille de l’estomac.
a. Les chirurgies restrictives
x La gastroplastie verticale calibrée
La gastroplastie verticale calibrée a été décrite par Mason et MacLean dans les années 80. Cette intervention consiste à agrafer l’estomac afin de créer une petite poche gastrique proximale,
calibrée à son extrémité distale par un anneau non-ajustable (Fig. 2A). Très populaire dans les années
80, cette procédure est de moins en moins utilisée.
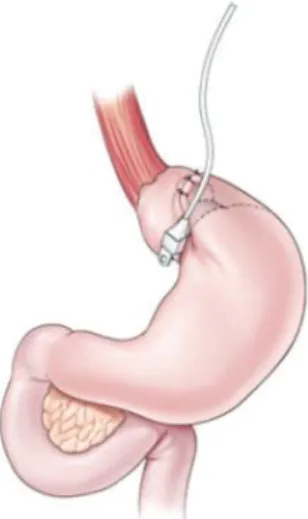
x L’anneau gastrique ajustable
L’anneau gastrique est constitué d’une bande siliconée reliée à un boitier implantable en sous cutané. Il est placé autour de la partie supérieure de l’estomac dans le but de créer une poche
gastrique d’environ 20 ml. Son diamètre peut être réglé par injection de liquide dans le boitier (Fig.
2B). Développée dans les années 90, cette technique représente actuellement 25% et 42% des
chirurgies de l’obésité pratiquées en France et aux Etats-Unis respectivement.
x La sleeve gastrectomie ou gastrectomie longitudinale
La sleeve gastrectomie consiste en une résection verticale d’environ 80% de l’estomac incluant
la grande courbure et le fundus. Le volume gastrique est alors d’environ 150 à 200 ml (Fig. 2C). La
sleeve gastrectomie était initialement associée à la diversion biliopancréatique (cf § I.2.b). Au début des années 2000, les chirurgiens ont proposé une approche chirurgicale en deux temps pour le traitement de patients obèses morbides, avec la sleeve gastrectomie comme première étape, suivie quelques mois plus tard d’une procédure de court-circuit intestinal. Face à la remarquable perte de poids observée dès la première intervention, la sleeve gastrectomie a alors été considérée comme une procédure bariatrique à part entière (Mognol et al., 2005; Silecchia et al., 2006). Cette intervention connait une popularité de plus en plus importante et représente actuellement la chirurgie bariatrique la plus pratiquée en France (étude 2013 Assurance Maladie).
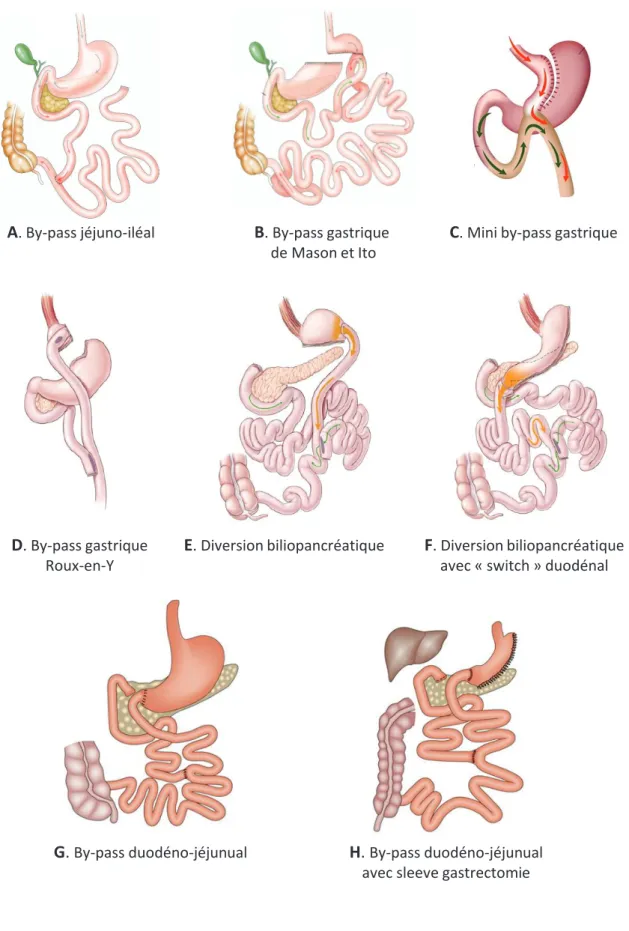
A
. By-pass jéjuno-iléalD
. By-pass gastrique Roux-en-YE
. Diversion biliopancréatiqueB
. By-pass gastrique de Mason et ItoC
. Mini by-pass gastriqueF
. Diversion biliopancréatiqueavec « switch » duodénal
G.
By-pass duodéno-jéjunualH.
By-pass duodéno-jéjunualavec sleeve gastrectomie
Figure 3 : Les chirurgies de type by-pass
15
b. Les chirurgies de type by-pass
x Le by-pass jéjuno-iléal
Le by-pass jéjuno-iléal a été la première procédure bariatrique réalisée dans les années 50 par Mason et Ito. A visée purement malabsorptive, cette chirurgie consistait à connecter 30 à 45 cm de l’intestin proximal directement aux derniers 10 cm de l’iléon, excluant ainsi une majeur partie de
l’intestin grêle du trajet des aliments (Fig. 3A). Elle a cependant été abandonnée car responsable
d’effets secondaires sévères incluant insuffisance hépatique, arthrite et complications dermatologiques (Singh et al., 2009).
x Le « mini » by-pass gastrique ou by-pass gastrique en oméga
En 1967, Mason et Ito proposent le by-pass gastrique qui allie restriction du contenu stomacal et court-circuit intestinal sans les effets secondaires du by-pass jéjuno-iléal (Mason and Ito, 1967, 1969). Cette procédure consistait en la création d’une petite poche gastrique connectée à l’intestin distal (environ 200 cm après le ligament de Treitz). L’intestin est alors divisé en deux anses en « oméga » : une anse bilio-pancréatique et une anse commune où les aliments rencontrent les
sécrétions digestives (Fig. 3B). L’anastomose gastro-entérale étant proche de l’œsophage, le by-pass
en gastrique en oméga entrainait des reflux de la bile dans ce segment du tube digestif. Ce type de by-pass gastrique a alors été abandonné au profit d’autres modèles de chirurgies bariatriques mais connait actuellement un regain d’intérêt. En effet, en 1997, Rutledge propose le « mini » by-pass gastrique comme une amélioration du modèle de Mason et Ito en créant un tube gastrique plus long
afin d’éviter les reflux biliaires (Fig. 3C).
x Le by-pass gastrique Roux-en-Y
Le by-pass gastrique Roux-en-Y est la technique la plus pratiquée au niveau mondial et correspond à une évolution du modèle de Mason et Ito. Dans cette procédure, l’estomac est divisé afin de créer une petite poche gastrique de 15 à 30 ml qui est anastomosée au jéjunum (30 à 75 cm après le ligament de Treitz). L’intestin est alors divisé en trois anses organisées en « Y » : une anse alimentaire d’une longueur d’environ 75 à 150 cm où seuls les aliments transitent ; une anse bilio-pancréatique permettant le flux des sécrétions gastriques (issues de l’estomac exclu), biliaires et pancréatiques ; et une anse commune correspondant à la jonction des anses alimentaire et
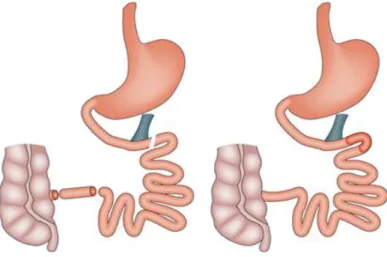
A. Interposition iléale
B. Endo-barrière intestinale
Figure 4 : Les autres techniques de chirurgie bariatrique
16
x La diversion biliopancréatique
La diversion biliopancréatique a été décrite pour la première fois en 1979 par Scopinaro (Scopinaro et al., 1979). Cette opération consiste tout d’abord à créer une poche gastrique d’environ 200 à 500 ml par gastrectomie horizontale. Comme pour le by-pass gastrique Roux-en-Y, l’intestin est organisé en trois anses mais avec une connexion de l’anse bilio-pancréatique à l’anse alimentaire (d’environ 250 cm) à environ 50 cm avant la fin de l’intestin-grêle. La taille de l’anse commune, i.e. la portion intestinale dans laquelle les aliments sont mixés avec les sécrétions digestives, est donc
considérablement diminuée par rapport à celle du by-pass gastrique Roux-en-Y (Fig. 3E).
La diversion biliopancréatique avec « switch » duodénal a été conçue en 1998 et correspond à une modification de la diversion biliopancréatique de Scopinaro. Cette procédure inclue une sleeve gastrectomie (Hess and Hess, 1998; Marceau et al., 1998). Le duodénum est sectionné environ 2 cm après le pylore et une anastomose duodéno-iléale est effectuée. La jonction de l’anse alimentaire et bilio-pancréatique est réalisée de sorte que l’anse commune ait une longueur plus importante que
celle de la diversion biliopancréatique classique soit environ 100 cm (Fig. 3F).
x Le by-pass duodéno-jéjunal
Le by-pass duodéno-jéjunal a été récemment décrit par Rubino (Rubino and Marescaux, 2004). Cette procédure ne comprend pas de restriction stomacale mais une liaison directe du jéjunum distal au niveau du pylore. Les longueurs des trois anses intestinales ainsi créées sont comparables à celles
du by-pass gastrique Roux-en-Y (Fig. 3G). Le by-pass duodéno-jéjunal peut-être combiné avec une
sleeve gastrectomie afin de potentialiser la perte de poids (Fig. 3H).
c. Les autres techniques
x L’interposition iléale
L’interposition iléale a été décrite dans les années 80 dans des modèles animaux (Koopmans et al., 1982) mais n’est pratiquée que depuis une dizaine d’années chez l’Homme. Cette chirurgie consiste à insérer un segment de 10 à 20 cm d’iléon distal au niveau du duodénum, juste en aval des sécrétions exocrines du foie et du pancréas. Le segment d’iléon est ainsi exposé à des aliments
non-digérés (Fig. 4A). L’interposition iléale peut être associée à une sleeve gastrectomie.
x L’endo-barrière intestinale
L’endo-barrière intestinale est un tube flexible d’environ 60 cm placé au niveau de l’intestin proximal, empêchant ainsi le contact des aliments avec la muqueuse duodénale comme les by-pass
Mas se corporelle (% d u poids basal)
Temps après chirurgie (années)
Témoin
Anneau gastrique Gastroplastie verticale
calibrée By-pass Roux-en-Y
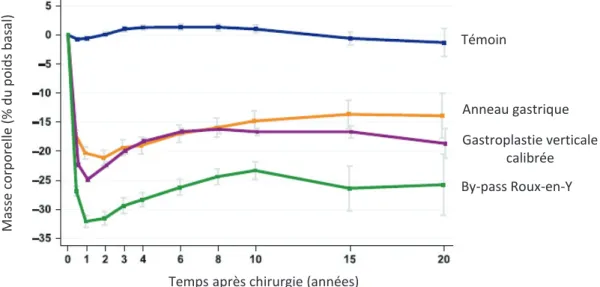
Figure 5 : Evolution du poids après chirurgies bariatriques
Ce graphique est issu de l’étude SOS (Swedish Obese Subjects) qui compare 2010 patients ayant subi une chirurgie bariatrique (68% gastroplastie verticale calibrée, 19% anneau gastrique et 13% by-pass Roux-en-Y) à 2037 patients obèses sous prise en charge médicale standard.
17
Roux-en-Y et duodéno-jéjunal (Fig. 4B). Cette procédure est moins invasive que les autres chirurgies
bariatriques car le dispositif est placé par endoscopie.
3. De la chirurgie bariatrique à la chirurgie métabolique
Les chirurgies bariatriques provoquent une importante perte de poids sur le long terme. Généralement, on observe une perte de poids maximale lors des deux premières années après la chirurgie, puis une augmentation de la masse corporelle qui se stabilise au bout de la huitième année (Sjöström et al., 2012). Les chirurgies de type by-pass entrainent une perte de poids plus importante que les chirurgies purement restrictives avec une diminution de la masse corporelle de 30 à 40% pour la diversion biliopancréatique, 25 à 35% pour le by-pass Roux-en-Y et 20 à 30% pour l’anneau
gastrique et la sleeve gastrectomie (Fig. 5 - Dixon et al., 2012; Sjöström et al., 2012). Initialement
développées pour traiter l’obésité, les chirurgies bariatriques entrainent également des améliorations au niveau de différentes fonctions de l’organisme. En plus de leurs effets bénéfiques sur la prévention de la mortalité, des cancers et des maladies cardiovasculaires, les chirurgies bariatriques sont notamment apparues comme un traitement efficace du diabète de type II (Sjöström, 2013).
a. Les effets antidiabétiques des chirurgies de type by-pass
Après chirurgie bariatrique, le diabète est amélioré pour 87% et résolu pour 78% des patients (Buchwald et al., 2009). De nombreuses études cliniques ont montré que les chirurgies de l’obésité sont plus efficaces que la prise en charge médicamenteuse seule dans le traitement du diabète de patients obèses (Dixon et al., 2008; Mingrone et al., 2012; Schauer et al., 2012). Les chirurgies bariatriques réduisent également le risque de développer un diabète de 96%, 84% et 78% après respectivement 2, 10 et 15 ans chez les patients obèses non-diabétiques (Carlsson et al., 2012).
L’obésité étant le facteur de risque majeur du diabète de type II, il est logique de penser que la perte de poids induite par les chirurgies bariatriques est à l’origine de leurs effets bénéfiques sur l’équilibre glucidique. Allant dans ce sens, les effets de l’anneau gastrique sur l’amélioration du diabète sont directement associés à une importante perte de poids (Korner et al., 2006; Stefater et al., 2012). Cependant, de nombreuses études ont montré que les chirurgies de type by-pass entrainent une amélioration du métabolisme glucidique avant une perte de poids significative. Plus précisément, le by-pass gastrique Roux-en-Y diminue la glycémie et améliore la sensibilité à l’insuline des patients obèses et diabétiques dès le sixième jour post-opératoire alors que la perte de poids est modeste à ce stade (Pories et al., 1995; Wickremesekera et al., 2005). De même, une diminution de
18 la glycémie associée à une amélioration de la sécrétion d’insuline est observée dès le premier mois après diversion biliopancréatique alors que les patients présentent toujours une obésité sévère (Briatore et al., 2008). Confirmant un effet antidiabétique indépendant d’une perte de poids des chirurgies de type by-pass, une étude comparant l’effet d’une restriction calorique à un by-pass gastrique Roux-en-Y a montré qu’après une perte de poids équivalente, les patients opérés présentent une meilleure tolérance au glucose que les patients ayant suivi le régime (Laferrère et al., 2008). De la même manière, chez des patients ayant un IMC et un temps post-opératoire similaires, la diminution de la glycémie et de l’insulinémie est plus importante après by-pass gastrique Roux-en-Y qu’après anneau gastrique (Korner et al., 2009). Ces améliorations de l’homéostasie glucidique indépendantes de la perte de poids ont été retrouvées dans des modèles animaux de by-pass intestinal (Rubino and Marescaux, 2004; Troy et al., 2008; Meirelles et al., 2009; Chambers et al., 2011a). Par ailleurs, les effets des chirurgies de type by-pass sur l’amélioration du contrôle glucidique sont spectaculaires puisqu’une adaptation du traitement antidiabétique pharmacologique est nécessaire après intervention afin d’éviter des épisodes hypoglycémiques. Un arrêt du traitement après by-pass gastrique Roux-en-Y est même observé pour 79% des patients ayant une insulinothérapie en préopératoire (Schauer et al., 2003). Enfin, la diversion biliopancréatique et le by-pass gastrique Roux-en-Y présentent un meilleur taux de rémission du diabète sur le long terme que l’anneau gastrique avec, respectivement, 96% et 71% contre 58% (Buchwald et al., 2009). L’ensemble de ces données suggèrent fortement un effet spécifique de la modification du tractus intestinal dans les effets bénéfiques et rapides sur l’homéostasie glucidique des chirurgies de type by-pass.
Ces résultats cliniques inattendus posent actuellement la question de la place des chirurgies de type by-pass dans le traitement des patients diabétiques non-obèses (Couzin, 2008; Rubino, 2008). Les premiers essais sont actuellement en cours et une récente méta-analyse rapporte une rémission du diabète post-chirurgicale associée à une perte de poids minime chez 85% des patients ayant un IMC inférieur à 35 (Fried et al., 2010).
b. Les effets sur les sensations de faim des chirurgies de type by-pass
En accord avec leur objectif premier de diminuer la quantité d’aliments ingérés, les chirurgies bariatriques provoquent une diminution de la prise alimentaire sur le long terme (Sjöström et al., 2004). Cependant, le by-pass gastrique Roux-en-Y entraine une diminution de la prise alimentaire plus importante que l’anneau gastrique suggérant que cette diminution n’est pas strictement dépendante de la restriction du volume stomacal (Kenler et al., 1990). En accord avec cette hypothèse, les patients opérés par une chirurgie de type by-pass reportent une diminution de leur sensation de faim et se sentent rassasiés plus rapidement pendant un repas (Morínigo et al., 2006;
19 Schultes et al., 2010). De même, une étude menée chez des patients opérés par by-pass jéjuno-iléal a montré que ces patients présentent une atténuation de l’envie de manger (Näslund et al., 1997). Dans des modèles animaux, la diminution de la faim est retrouvée après chirurgie de type by-pass mais pas après anneau gastrique (le Roux et al., 2006; Troy et al., 2008). L’ensemble de ces observations suggère que les effets sur la satiété des chirurgies de type by-pass dépendraient de la modification du tractus intestinal.
c. De multiples mécanismes mis en jeu
De nombreuses hypothèses ont été émises pour expliquer les effets sur le diabète et les sensations de faim des chirurgies de type by-pass. La littérature suggère une implication de plusieurs mécanismes agissant en synergie. Cependant, ces mécanismes ne sont pas encore clairement identifiés et les hypothèses proposées sont largement débattues.
x La restriction calorique
L’amélioration rapide des paramètres glucidiques observée après chirurgie de type by-pass pourrait être expliquée par la restriction calorique sévère à laquelle sont soumis les patients pendant les premiers jours qui suivent la chirurgie (<500 kcal/jour en moyenne). Une importante restriction calorique est en effet connue pour restaurer la glycémie chez les patients diabétiques mais est également associée à une aggravation de la situation métabolique lorsque les patients retrouvent une alimentation normale. Deux arguments vont néanmoins à l’encontre de cette hypothèse. Les restrictions caloriques étant les mêmes pour toutes les chirurgies bariatriques, une rémission rapide du diabète devrait être observée pour toutes les interventions. De plus, les restrictions caloriques sont prescrites en péri-opératoire dans de nombreuses chirurgies générales alors qu’aucun effet bénéfique sur le métabolisme glucidique n’est rapportée (Andreelli et al., 2009; Thaler and Cummings, 2009).
x L’hypothèse du « hindgut »
L’hypothèse du « hindgut » soutient que l’arrivée directe d’aliments non digérés dans l’intestin distal exercerait des effets bénéfiques sur l’homéostasie glucidique et énergétique. Dans un premier temps, cette arrivée modifierait la structure et le métabolisme de l’intestin distal. En accord avec ceci, des études ont démontré une hyperplasie et une hypertrophie de l’anse alimentaire après by-pass gastrique Roux-en-Y mais aussi, après mise en place d’une endo-barrière chez le rat, de la muqueuse intestinale située en aval de celle-ci (Saeidi et al., 2013; Habegger et al., 2013a). Dans le cas du by-pass gastrique Roux-en-Y, cette différenciation est associée à une reprogrammation du métabolisme des entérocytes de l’anse alimentaire en faveur d’une utilisation accrue de glucose. Les
20 auteurs ont alors suggéré que cette augmentation de la consommation d’énergie par l’intestin contribuerait à l’amélioration de l’homéostasie glucidique observée après chirurgie de type by-pass (Saeidi et al., 2013).
Dans un deuxième temps, l’arrivée directe des aliments non digérés dans l’intestin pourrait stimuler la sécrétion du glucagon-like peptide 1 (GLP-1) et du peptide YY (PYY) par les cellules entéro-endocrines L, deux hormones diminuant la prise alimentaire (Flint et al., 1998; Turton et al., 1996; Tschöp et al., 2004). Le GLP-1 est également un modulateur du métabolisme glucidique. En plus de potentialiser la sécrétion d’insuline, le GLP-1 inhibe la sécrétion de glucagon, stimule la prolifération des cellules β du pancréas et augmente la sensibilité à l’insuline (Drucker, 2006). En accord avec l’hypothèse du « hindgut », les sécrétions postprandiales de GLP-1 et PYY sont augmentées après by-pass gastrique Roux-en-Y et diversion biliopancréatique mais pas après anneau gastrique chez l’Homme (Morínigo et al., 2006; Borg et al., 2007; Korner et al., 2006, 2007). Une augmentation du taux circulant postprandial de GLP-1 est également retrouvée dans un modèle d’endo-barrière intestinale chez le rat génétiquement obèse et diabétique (fa/fa) (Habegger et al., 2013a). De plus, une combinaison de l’anneau gastrique avec un traitement par un analogue du GLP-1 permet une meilleure amélioration des paramètres glucidiques par rapport à l’anneau gastrique seul chez le rat obèse et diabétique (Habegger et al., 2013b). Un autre argument soutenant cette théorie a été mis en évidence par l’interposition iléale. Cette procédure, qui inclue la transposition proximale d’un segment d’iléon où les cellules L sont fortement exprimées, provoque une amélioration du contrôle glucidique ainsi qu’une augmentation des sécrétions de GLP-1 et PYY (Strader et al., 2005; DePaula et al., 2008; Wang et al., 2008). L’action du GLP-1 n’est cependant pas suffisante pour expliquer les effets des chirurgies de type by-pass sur le métabolisme glucidique et énergétique. En effet, l’inhibition de l’action du GLP-1 annule les effets du by-pass intestinal sur la sécrétion d’insuline mais n’empêche pas la diminution de la prise alimentaire et l’amélioration de la sensibilité à l’insuline chez la souris (Troy et al., 2008). De la même manière, les effets bénéfiques du by-pass gastrique Roux-en-Y sur l’équilibre glucidique et la perte de poids sont préservés chez les souris invalidées pour le récepteur du GLP-1 (Mokadem et al., 2014; Ye et al., 2014).
x L’hypothèse du « foregut »
L’hypothèse du « foregut » suggère que l’exclusion de l’intestin proximal du trajet des aliments activerait des signaux antidiabétiques. Dans la littérature, cette théorie est soutenue par les résultats du by-pass duodéno-jéjunal, de l’endo-barrière intestinale et de la perfusion de nutriments dans l’intestin distal. En effet, le by-pass duodéno-jéjunal exclut le duodénum du trajet des aliments et corrige les paramètres glucidiques sans effet majeur sur la perte de poids chez l’Homme et le rat diabétiques non-obèses (Ramos et al., 2009; Cohen et al., 2012; Rubino and Marescaux, 2004; Wang
21 et al., 2008). De même, l’endo-barrière intestinale empêche le contact des aliments avec la muqueuse duodénale et améliore la tolérance au glucose sans diminuer de manière importante la masse corporelle chez l’Homme et le rat (Neff et al., 2013; Aguirre et al., 2008). Enfin, la perfusion de nutriments directement dans le jéjunum distal améliore la sensibilité à l’insuline chez le rat mince et les patients obèses et diabétiques (Breen et al., 2012; Salinari et al., 2013). Cependant, ces trois procédures incluent également une arrivée directe des aliments dans l’intestin distal. Il est donc difficile de faire la part entre les signaux provenant de l’intestin proximal (hypothèse du « foregut ») ou distal (hypothèse du « hindgut ») dans les effets bénéfiques sur l’homéostasie glucidique de ces procédures.
x La ghréline
La ghréline est une hormone orexigène sécrétée principalement par des cellules endocrines du fundus de l’estomac et du duodénum, i.e. des parties du tractus digestif exclues du trajet des aliments dans la majorité des chirurgies de type by-pass. La ghréline a également des effets sur le métabolisme glucidique en diminuant la sécrétion d’insuline et en augmentant celle du glucagon (Pradhan et al., 2013). De nombreuses études se sont intéressées à l’implication de la ghréline dans les effets métaboliques des chirurgies de type by-pass mais leurs résultats sont contradictoires. En effet, selon les études, le taux circulant de ghréline après by-pass gastrique Roux-en-Y ou diversion biliopancréatique est diminué, augmenté ou inchangé (Tymitz et al., 2011). L’ambiguïté de ces résultats peut être expliquée par des différences entre les temps post-opératoires où le taux de ghréline a été mesuré. En prenant en compte ce paramètre, une diminution de la sécrétion de ghréline est plutôt associée à un temps post-opératoire court (moins d’un an). Compliquant l’interprétation de ces résultats, le taux circulant de ghréline est inversement proportionnel à la masse grasse (Tschöp et al., 2001). En d’autres termes, la perte de poids significative des patients après chirurgie de type by-pass devrait se traduire par une augmentation de la concentration circulante de ghréline. (Tymitz et al., 2011; Stefater et al., 2012). Ces études ne nous permettent donc pas de conclure sur une corrélation possible entre la sécrétion de ghréline et les effets métaboliques des chirurgies de type by-pass. De plus, aucune étude n’a déterminé de lien causal entre ces deux phénomènes à ce jour.
x L’hypothalamus
Le noyau arqué de l’hypothalamus est un acteur clé de la régulation de la prise alimentaire. Il est composé de deux populations de neurones aux effets opposés. Le premier groupe synthétise la pro-opio-mélanocortine (POMC), précurseur des hormones mélanotropes α et β qui réduisent la prise alimentaire et augmentent la dépense énergétique de repos via leur fixation sur les récepteurs
22 MC3R et MC4R (melanocortin receptor 3 and 4). Le second groupe de neurones co-exprime le neuropeptide Y (NPY) et l’agouti-related protein (AgRP) qui stimulent la prise alimentaire notamment par antagonisme sur le récepteur MC4R. Récemment, plusieurs études menées chez l’animal ont mis en évidence le rôle du système mélanocortinergique dans les effets sur l’homéostasie glucidique et énergétique des chirurgies de type by-pass. Une première étude a montré que le by-pass gastrique Roux-en-Y n’entraine pas de perte de poids chez les souris invalidées pour le récepteur MC4R (Hatoum et al., 2012). Une autre équipe a confirmé ces observations et démontré que le récepteur MC4R est également impliqué dans les effets sur le métabolisme glucidique indépendants de la perte de poids du by-pass gastrique Roux-en-Y (Zechner et al., 2013). Néanmoins, les études menées chez l’Homme nuancent le rôle du récepteur MC4R dans les effets bénéfiques des chirurgies de type by-pass. En effet, les effets sur la perte de poids du by-pass gastrique Roux-en-Y sont retrouvés chez les patients ayant une mutation hétérozygote du gène codant pour MC4R (Aslan et al., 2011; Hatoum et al., 2012).
Une étude récente a montré que l’antagonisme des récepteurs MC4R et MC3R entraine une augmentation de la prise alimentaire et, par conséquent, une prise de poids chez les rats opérés par by-pass gastrique Roux-en-Y. Cet effet étant également observé chez les rats témoins non-opérés, les auteurs ne concluent pas sur un rôle clé du système mélanocortinergique dans les effets sur les sensations de faim des chirurgies de type by-pass. Cependant, cette étude montre que les rats ont la capacité de manger plus après by-pass gastrique Roux-en-Y et confirme ainsi que la diminution de la prise alimentaire après chirurgie de type by-pass n’est pas uniquement due à une restriction du contenu stomacal, mais est aussi le reflet d’une diminution de la sensation de faim (cf § I.3.b) (Mumphrey et al., 2014).
x Les adipokines
Les adipokines sont des facteurs sécrétés par le tissu adipeux qui participent à l’homéostasie glucidique et énergétique. Parmi elles, la leptine et l’adiponectine voient leur concentration plasmatique respectivement augmentée et diminuée chez les patients obèses insulino-résistants. A l’inverse, un taux élevé d’adiponectine est associé à un faible risque de développer un diabète de type 2 (Ballantyne et al., 2005). Le tissu adipeux sécrète également des facteurs pro-inflammatoires comme IL-6 (interleukin-6) et TNF-α (tumor necrosis factor α) qui altèrent la sensibilité à l’insuline (Schenk et al., 2008). Les chirurgies bariatriques diminuent les taux circulants de leptine, d’IL-6 et de TNF-α et augmente celui d’adiponectine. Cependant, ces changements semblent être directement liés à la perte de poids ce qui suggère un rôle des adipokines sur la sensibilité à l’insuline après chirurgie bariatrique sur le long terme, et non pas dans les effets rapides sur le métabolisme
23 glucidique spécifiques des chirurgies de type by-pass (Ballantyne et al., 2005; Korner et al., 2006; Viana et al., 2013).
x Le microbiote intestinal
De nombreuses études ont suggéré que le microbiote intestinal pourrait participer à la régulation du métabolisme énergétique de l’hôte (Delzenne et al., 2011; Tremaroli and Bäckhed, 2012). A l’appui de cette hypothèse, un changement de composition de la flore intestinale est observé chez les souris et sujets obèses. Cette composition permettrait notamment une augmentation de l’extraction calorique des aliments (Ley et al., 2005, 2006). De plus, les souris axéniques (exemptes de tout germe) colonisées avec un microbiote de souris obèses ont une prise de poids doublée par rapport à des souris colonisées avec un microbiote de donneur mince (Turnbaugh et al., 2006). Une modification de la composition de la flore intestinale est également observée après by-pass gastrique Roux-en-Y (Zhang et al., 2009). Une étude récente a proposé un rôle causal de la composition du microbiote intestinal dans les effets bénéfiques sur le métabolisme énergétique des chirurgies de type by-pass. Les auteurs ont mis en avant une perte de poids chez des souris axéniques colonisées avec un microbiote de souris opérées d’un by-pass gastrique Roux-en-Y (Liou et al., 2013). Néanmoins, cette étude est sujette à controverse. En effet, plusieurs études ont montré que la colonisation d’un microbiote de souris minces entraine une prise de poids chez les souris axéniques (Bäckhed et al., 2004; Turnbaugh et al., 2006). Or, cet effet n’est pas retrouvé chez les souris axéniques témoins de l’étude de Liou et al..
d. La sleeve gastrectomie : une chirurgie restrictive pas comme les autres !
x Les effets antidiabétiques de la sleeve gastrectomie
De manière inattendue, la sleeve gastrectomie a démontré des effets spectaculaires sur le métabolisme glucidique. Une méta-analyse a rapporté une rémission du diabète chez 66% des patients après sleeve gastrectomie (Gill et al., 2010). Par ailleurs, cette procédure améliore les paramètres glucidiques de manière plus efficace que l’anneau gastrique (Omana et al., 2010). Plus précisément, les effets bénéfiques sur le contrôle glucidique après sleeve gastrectomie sont comparables à ceux observés après chirurgie de type by-pass. Ils sont en effet observés dès les premiers jours après l’opération et sont indépendants de la perte de poids (Vidal et al., 2008; Abbatini et al., 2010; Rizzello et al., 2010). Ces observations cliniques ont été reproduites dans des études menées chez le rat (Chambers et al., 2011a, 2011b). Bien que classée parmi les chirurgies restrictives, la sleeve gastrectomie apparait plus proche des chirurgies de type by-pass en terme d’effets sur le métabolisme glucidique.
24
x Les hypothèses proposées
Une hypothèse émise pour expliquer les effets rapides sur le métabolisme glucidique de la sleeve gastrectomie concerne la résection de la partie de l’estomac sécrétant la ghréline (cf § I.3.c). En accord avec cette hypothèse, la concentration plasmatique de ghréline est diminuée après sleeve gastrectomie (Langer et al., 2005; Wang and Liu, 2009). Cependant, les effets métaboliques de la sleeve gastrectomie sont préservés chez les souris déficientes en ghréline ce qui suggère que cette hormone n’est pas un acteur clé des effets antidiabétiques de la procédure (Chambers et al., 2013).
L’hypothèse du « hind-gut » est actuellement proposée pour expliquer les effets
antidiabétiques de la sleeve gastrectomie. Une étude a montré que la vitesse de vidange gastrique est augmentée après sleeve gastrectomie chez l’Homme (Braghetto et al., 2009). Une hypothèse suggère que cette augmentation pourrait conduire à la propulsion plus rapide du bol alimentaire dans l’intestin distal et déclencher in fine l’activation de signaux hormonaux (Stefater et al., 2012). En accord avec ceci, les sécrétions postprandiales de GLP-1 et PYY sont augmentées après sleeve gastrectomie (Peterli et al., 2009; Chambers et al., 2011a). Néanmoins, nous avons précédemment exposé dans ce manuscrit plusieurs arguments allant à l’encontre de l’hypothèse du « hindgut » dans le cas des chirurgies de type by-pass (cf § I.3.c).
4. De la chirurgie bariatrique à la chirurgie comportementale
Suite à une chirurgie de type by-pass, les patients présentent des changements dans leurs habitudes alimentaires favorables à une perte de poids. Dans un premier temps, on observe chez ces patients une réduction de la prise alimentaire, notamment due à une diminution des sensations de faim (cf § I.3.b.). D’autre part, ces patients présentent des modifications de leur préférence alimentaire en faveur d’une diminution de leur appétence pour les aliments gras et sucrés.
a. Les changements de préférence alimentaire après chirurgie de type by-pass
Les chirurgies de type by-pass provoquent spécifiquement des modifications dans les choix alimentaires des patients. Après by-pass gastrique Roux-en-Y, les patients adoptent une alimentation plus saine car ils diminuent leur consommation d’aliments hypercaloriques (sodas, bonbons, glaces) et optent plus volontiers pour les fruits et légumes. Ces changements de préférence alimentaire ne sont pas observés après anneau gastrique ou gastrectomie verticale calibrée (Kenler et al., 1990; Brolin et al., 1994; Olbers et al., 2006; Ernst et al., 2009; Mathes and Spector, 2012). Plus précisément, les patients reportent une diminution de leur préférence pour les aliments gras après chirurgie de type by-pass, phénomène que l’on retrouve dans les modèles animaux de by-pass gastrique Roux-en-Y (Näslund et al., 1997; Zheng et al., 2009; le Roux et al., 2011). Actuellement,
25 aucune étude portant sur les choix alimentaires après sleeve gastrectomie n’a été conduite chez l’Homme et les études menées chez le rat sont en contradiction (Saeidi et al., 2012; Wilson-Pérez et al., 2013). Ces données confèrent aux chirurgies de type by-pass un rôle inattendu sur le comportement alimentaire directement lié à l’appétence pour les aliments.
b. Les mécanismes proposés
Un enjeu actuel concerne la meilleure compréhension des mécanismes par lesquels les chirurgies de type by-pass diminuent l’appétence des patients pour les aliments gras et sucrés. L’identification de ces mécanismes pourrait en effet permettre de développer des stratégies innovantes ciblant la perte de poids. La littérature fait état de régulations centrales impliquant les systèmes gustatif, de récompense et d’aversion.
x Les recommandations diététiques
Après chirurgie bariatrique, les patients sont soumis à des recommandations diététiques
basées sur une alimentation pauvre en sucres, graisses et fibres durant le 1er mois post-opératoire.
Les changements de préférences alimentaires sont cependant indépendants de ces recommandations. En effet, les modifications de préférence alimentaire sont spécifiques des chirurgies de type by-pass alors que les indications diététiques post-opératoires sont globalement les mêmes pour toutes les chirurgies bariatriques. Par ailleurs, le désintérêt pour les aliments gras et sucrés est également retrouvé dans les études menées chez l’animal où la nourriture enrichie en lipides et en sucres est proposée ad libitum après chirurgie de type by-pass (Zheng et al., 2009; le Roux et al., 2011).
x La détection du goût
Un facteur pouvant contribuer dans les choix alimentaires des patients après chirurgie de type by-pass concerne la détection des stimuli du goût. Plusieurs études ont mis en avant une diminution du seuil de détection du goût sucré après by-pass gastrique Roux-en-Y chez l’Homme et le rat. En d’autres termes, la sensibilité de la détection du goût sucré est augmentée après by-pass gastrique Roux-en-Y et pourrait contribuer à la diminution de la consommation d’aliments riches en sucre (Scruggs et al., 1994; Burge et al., 1995; Bueter et al., 2011).
D’un point de vue mécanistique, l’action du GLP-1 a été proposée pour expliquer le changement de la détection du goût après chirurgie de type by-pass. En effet, le récepteur au GLP-1 est exprimé dans les fibres nerveuses des papilles gustatives et les souris invalidées pour ce récepteur sont moins sensibles au goût sucré (Shin et al., 2008). De plus, les taux circulants de GLP-1 sont augmentés après chirurgie de type by-pass en période postprandiale (Borg et al., 2007; Korner
26 et al., 2009). Deux études ont cependant écarté cette hypothèse. Une première équipe a en effet montré que l’inhibition ou l’activation du récepteur du GLP-1 n’a pas de conséquence sur la réponse au goût sucré après by-pass gastrique Roux-en-Y chez le rat (Mathes et al., 2012). La seconde étude a démontré que les souris invalidées pour le récepteur du GLP-1 présentent une diminution de leur préférence pour la nourriture riche en lipides comparable à celle des souris témoins après by-pass gastrique Roux-en-Y (Ye et al., 2014).
x Le système de récompense
Le système de récompense, associé à la consommation d’aliments, comprend les notions de plaisir (faim hédonique) et de motivation à manger. Plusieurs études ont testé l’implication de ce système dans les modifications de préférences alimentaires après chirurgie de type by-pass. Une réduction de l’activité des régions cérébrales impliquées dans la récompense a été observée en réponse à des aliments et/ou des images d’aliments hypercaloriques chez les patients opérés par by-pass gastrique Roux-en-Y par rapport aux patients opérés par anneau gastrique ou obèses (Ochner et al., 2012; Scholtz et al., 2014). Plus précisément, à l’aide d’un questionnaire évaluant l’appétit pour des aliments très palatables, des études ont montré que la réponse hédonique est augmentée chez les patients obèses par rapport à des sujets sains et que le by-pass gastrique Roux-en-Y inverse cet effet (Schultes et al., 2010; Ullrich et al., 2013). Confirmant ces observations faites chez l’Homme, le by-pass gastrique Roux-en-Y induit une diminution du plaisir lié à la consommation d’une solution fortement concentrée en saccharose chez le rat (Shin et al., 2011). Par ailleurs, les patients opérés par by-pass gastrique Roux-en-Y présentent également une diminution de leur motivation à consommer des aliments gras et sucrés (Miras et al., 2012). Les deux composantes du système de récompense liées à la prise alimentaire semblent donc être modifiées après chirurgie de type by-pass et pourrait contribuer à la diminution de l’appétence pour les aliments gras et sucrés. Les mécanismes sous-jacents restent cependant à être identifiés.
x L’aversion
Une explication possible pour les changements de préférence alimentaire après chirurgie de type by-pass concerne l’apparition de symptômes aversifs à la suite de la consommation de certains aliments. Après ces opérations, les inconforts digestifs se manifestent majoritairement les trois premiers mois puis diminuent graduellement avec le temps (Suter et al., 2007). Le dumping syndrome est l’inconfort digestif le plus rapporté des chirurgies de type by-pass. Ce syndrome est la conséquence d’une arrivée trop rapide d’aliments sucrés ou gras dans l’intestin et se manifeste par des nausées, douleurs abdominales, diarrhées, palpitations et rougeurs au visage (Stefater et al.,
Figure 6 : La glycogénolyse
La glycogène phosphorylase permet la dégradation des chaînes linéaires de glycogène (en bleu) en glucose-1-phosphate. La phosphoglucomutase puis la glucose-6-phosphatase catalysent la transformation du glucose-1-phosphate en glucose. Les composantes glucosyltransférase et α(1-6)-glucosidase de l’enzyme débranchante permettent, respectivement, le transfert de 3 résidus glucose (en orange) sur la chaîne linéaire et l’hydrolyse du dernier résidu de glucose de la ramification (en vert).
27 2012). Ces effets secondaires gênants pourraient être à l’origine d’une aversion vis-à-vis des aliments gras et sucrés et ainsi conduire à un changement dans les choix alimentaires des patients opérés. Néanmoins, cette hypothèse est en contradiction avec les résultats obtenus après anneau gastrique. En effet, cette intervention est la plus contraignante des chirurgies bariatriques en termes de confort alimentaire puisqu’elle est associée à une importante fréquence de vomissements et de nausées (Suter et al., 2007; Stefater et al., 2012). De plus, l’anneau gastrique instaure progressivement une intolérance alimentaire pour de nombreux aliments (viande, poisson, riz, pâtes, pain…) (Schweiger et al., 2010). Or, les patients opérés d’un anneau gastrique ne reportent pas de changement de préférence alimentaire, ce qui va en l’encontre d’une implication de phénomènes d’aversions dans les choix alimentaires des patients après chirurgie bariatrique (Kenler et al., 1990; Brolin et al., 1994; Ernst et al., 2009).
II. La production endogène de glucose
Le maintien de la glycémie autour de 1 g/l (5,5 mmol/l) est indispensable au métabolisme cellulaire, notamment dans les tissus sensibles à des situations d’hypoglycémies (cerveau, hématies, reins et muscles à contractions rapides). L’homéostasie glucidique résulte de la balance entre l’apport alimentaire ou endogène de glucose d’une part, et la capture et l’utilisation de glucose par les organes d’autre part.
La production endogène de glucose est une fonction cruciale de l’organisme car elle permet le maintien de la glycémie lors des périodes inter-prandiales ou de jeûne. Elle est tout d’abord assurée par la glycogénolyse dans le foie puis par la néoglucogenèse dans le foie, les reins et l’intestin.
1. Les voies métaboliques de production de glucose
a. La glycogénolyseLa glycogénolyse permet la production de glucose à partir de glycogène, un polymère de glucose stocké principalement dans le foie et les muscles. Tandis que le muscle mobilise ses stocks de glycogène pour un apport énergétique in situ, le foie fournit le glucose nécessaire au fonctionnement de tout l’organisme. La dégradation du glycogène est assurée par l’action de quatre enzymes :
La glycogène phosphorylase, qui clive le glycogène en glucose-1-phosphate via
l’incorporation d’un phosphate inorganique ;
L’enzyme débranchante à double activité (glucosyltransférase et α-1,6 glucosidase), qui remodèle le glycogène pour la dégradation par la phosphorylase ;
Figure 7: La néoglucogenèse
Les enzymes spécifiques et les substrats de la néoglucogenèse sont encadrées respectivement en orange et en bleu. Les enzymes communes aux voies de la néoglucogenèse et de la glycolyse sont indiquées en gris italique.
28 La phosphoglucomutase, qui catalyse l’isomérisation du 1-phosphate en
glucose-6-phosphate ;
La glucose-6-phosphatase (G6Pase), qui hydrolyse le glucose-6-phosphate en glucose et
phosphate inorganique (Fig. 6).
Le glycogène est une source d’énergie rapidement mobilisable en l’absence de glucose alimentaire, cependant ses réserves s’épuisent après 24h de jeûne chez l’Homme et 12h chez la souris.
b. La néoglucogenèse
La néoglucogenèse correspond à la synthèse de novo de glucose à partir de substrats non glucidiques tels que :
Le lactate et l’alanine via leur conversion en pyruvate par, respectivement, la lactate deshydrogénase et l’alanine aminotransférase. Le pyruvate est ensuite transformé en oxaloacétate par la pyruvate carboxylase. Ces substrats néoglucogéniques sont majoritairement utilisés par le foie ;
Le glycérol issu de l’hydrolyse des triglycérides. Son entrée dans la voie de synthèse de glucose nécessite la présence de la glycérokinase, notamment exprimée dans le foie et l’intestin ;
La glutamine via sa conversion en glutamate par la glutaminase dite « rénale ». Cette enzyme est également exprimée dans l’intestin, ce qui confère à ces deux organes une spécificité d’utilisation de la glutamine comme substrat néoglucogénique ;
Les acides aminés glucoformateurs qui alimentent le cycle de Krebs et conduisent à la formation d’oxaloacétate ;
Le propionate issu de la fermentation des fibres solubles par le microbiote intestinal. Le métabolisme du propionate fournit in fine du succinyl-coA susceptible d’entrer dans le cycle de Krebs. Connu pour être le principal substrat de la néoglucogenèse hépatique chez les ruminants, le propionate a récemment été décrit comme substrat de la néoglucogenèse intestinale (De Vadder et al., 2014).
Les étapes de la néoglucogenèse sont réalisées en majorité par les enzymes qui catalysent les réactions réversibles de la glycolyse (voie d’oxydation du glucose). Seules trois réactions sont irréversibles et font intervenir des enzymes spécifiques de la production endogène de glucose, constituant ainsi des cibles clés de sa régulation. Ces enzymes sont :
La phosphoénolpyruvate carboxykinase cytosolique (PEPCK), qui convertit l’oxaloacétate en phosphoénolpyruvate ;
Figure 9: Expression tissulaire de la G6PC dans les organes producteurs de glucose
Analyse immunohistochimique de la G6PC dans le foie (A-B), les reins (C-D), le duodénum (E) et l’iléon (F). La G6PC est détecté dans les hépatocytes de la région périportale (A), les canaux biliaires intra-hépatiques (B), les tubules proximaux du cortex rénal (C), l’épithélium urinaire des tubes collecteurs et les calices rénaux (D), et l’axe entéro-villositaire de l’intestin (E-F).
L’immunomarquage de la G6PC est brun et les noyaux sont marqués en bleu par hématoxyline. PP : hépatocytes périportaux, PV : hépatocytes périveineux, CT : tubes collecteurs, Ca : calices, BAT : tissu adipeux brun
(D’après Rajas et al., 2007)
G6PC
Cytosol Lumière du REG6
PT
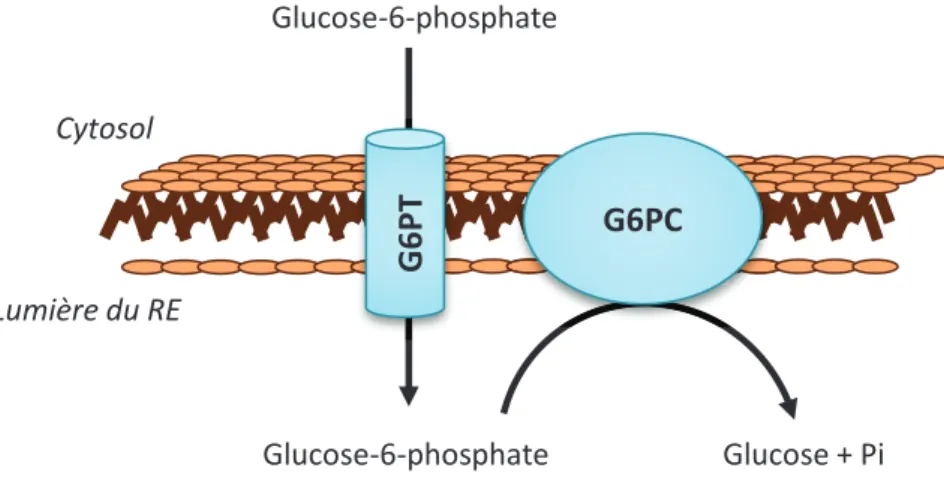
Glucose-6-phosphate Glucose-6-phosphate Glucose + PiFigure 8: Le complexe glucose-6-phosphatase
La 6-phosphatase est composée de deux sous-unités. La G6PT transporte le glucose-6-phosphate à l’intérieur du réticulum endoplasmique (RE) le rendant ainsi accessible au site catalytique de la G6PC qui transforme le glucose-6-phosphate en glucose et phosphate inorganique (Pi).
A
B
F
C
D
E
29 La fructose-1,6-biphosphatase, qui transforme le fructose-1,6-biphosphate en
fructose-6-phosphate ;
La G6Pase, qui transforme le glucose-6-phosphate en glucose (Fig. 7).
2. La glucose-6-phosphatase au carrefour de la production endogène de
glucose
La G6Pase est l’enzyme clé de la production endogène de glucose car elle catalyse la dernière étape commune à la glycogénolyse et à la néoglucogenèse. Cette réaction enzymatique précède la libération du glucose dans la circulation sanguine et confère ainsi à la G6Pase une position stratégique dans la régulation de l’homéostasie glucidique.
a. Expression tissulaire du complexe glucose-6-phosphatase
La G6Pase est un complexe enzymatique situé dans la membrane du réticulum endoplasmique. Elle est constituée de deux sous-unités : une sous-unité transportant le glucose-6-phosphate du cytoplasme à la lumière du réticulum endoplasmique (G6PT) et une sous-unité
catalytique (G6PC) (Fig. 8). Alors que l’expression de la G6PT est ubiquitaire, celle de la G6PC est
restreinte au foie, aux reins et à l’intestin. Dans l’intestin, la G6Pase est exprimée selon un gradient décroissant du duodénum à l’iléon (Rajas et al., 1999). Une étude par immunohistochimie de notre laboratoire a permis de préciser la localisation cellulaire de la G6Pase. Attestant d’une activité néoglucogénique dans ces tissus, la G6Pase est co-localisée avec la PEPCK dans les hépatocytes périportaux, les tubules proximaux du cortex rénal et le sommet des villosités intestinales. D’une manière surprenante, la G6Pase est également localisée dans des tissus n’exprimant pas la PEPCK tels que les canaux biliaires intra-hépatiques, les cryptes des villosités intestinales, l’épithélium
urinaire des tubules collecteurs et les calices rénaux (Fig. 9 - Rajas et al., 2007). Dans ces tissus, la
G6Pase pourrait être impliquée dans le transport de glucose et constituer une voie alternative d’absorption trans-épithéliale de glucose n’impliquant pas le transporteur GLUT2 (glucose transporter 2 - Stümpel et al., 2001).
b. Régulation transcriptionnelle de l’unité catalytique de la glucose-6-phosphatase
x Régulations tissulaires
Contribuant à l’expression restreinte de la G6Pase dans le foie, les reins et l’intestin, la transcription du gène G6pc est dépendante de facteurs tissulaires spécifiques tels que HNF1 (hepatocyte nuclear factor 1) et C/EBP (CAAT/enhancer binding protein) (Yabaluri and Bashyam,
Figure 10: Régulation hormonale de la transcription du gène G6pc dans un
contexte hépatique
En présence d’insuline, FoxO1 est exporté dans le cytoplasme et ne lie plus le promoteur G6pc. Le taux de recrutement du complexe de la RNA polymérase II (RNAPolII) est plus faible ce qui diminue la transcription.
Le glucagon stimule la production d’AMPc via l’activation de l’adénylate cyclase. L’AMPc induit l’expression l’expression de PGC-1 qui pourra être recruté sur le prmoteur G6pc par HNF4 et FoxO1. L’AMPc induit également la phosphorylation de CREB, ce qui lui permet de recruter CBP. CBP, stabilisé par son interaction avec PGC-1, HNF1, HNF6 et C/EBP, recrute plus efficacement le complexe de la RNAPolII ce qui induit la transcription.