ROYAUME DU MAROC
UNIVERSITE MOHAMMED V DE RABAT FACULTE DE MEDECINE ET DE PHARMACIE
RABAT
CIRCONSTANCES DE DÉCOUVERTE
DES PATHOLOGIES HÉMORRAGIQUES
CONSTITUTIONNELLES
DE L’HÉMOSTASE
A PROPOS DE 63 CAS
Année : 2019Présentée est soutenue publiquement le ../06/2019 par
Née le 25/02/1993 à Rabat
POUR L’OBTENTION DU DIPLÔME DE DOCTEUR EN MEDECINE Motsclé : Antécédents fAMiliAux héMorrAgiques, histoire héMorrAgique personnelle, consAnguinité, syMptoMAtologie héMorrAgique, syMptoMAtologie non
spécifique, déficits enfActeurs.
Professeur de Pédiatrie Professeur de Pédiatrie
Professeur de réanimation médicale Professeur de pédiatrie
Mlle Nour Al Houda HAJJI
Mme BENJELLOUN DAKHAMA Badr Sououd
PRÉSIDENTE RAPPORTEURJUGES M. EL KHORASSANI Mohamed
Mme BELAYACHI Jihane
Mme KARBOUBI Lamya
M. MASRAR Azlarab
MEMBRES DU JURY
Thèse
I don’t believe that life can be
counted by years or days, but
by experience and how you
leave the world by the way you
live.
Jerri nielsen Ice Bound: A Doctor’s Incredible Battle For Survival atDOYENS HONORAIRES :
1962 – 1969 : ProfesseurAbdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH 1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI 2003 – 2013 : Professeur Najia HAJJAJ – HASSOUNI
ADMINISTRATION : Doyen
Professeur Mohamed ADNAOUI
Vice Doyen chargé des Affaires Académiques et estudiantines Professeur Brahim LEKEHAL
Vice Doyen chargé de la Recherche et de la Coopération Professeur Taoufiq DAKKA
Vice Doyen chargé des Affaires Spécifiques à la Pharmacie Professeur Jamal TAOUFIK
Secrétaire Général
Mr. Mohamed KARRA UNIVERSITE MOHAMMED V
FACULTE DE MEDECINE ET DE PHARMACIE RABAT
1-
ENSEIGNANTS-CHERCHEURS MEDECINS ET PHARMACIENS
PROFESSEURS :Décembre 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale
Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation
Pr. SETTAF Abdellatif pathologie Chirurgicale
Novembre et Décembre 1985
Pr. BENSAID Younes Pathologie Chirurgicale
Janvier, Février et Décembre 1987
Pr. LACHKAR Hassan Médecine Interne
Pr. YAHYAOUI Mohamed Neurologie
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
Janvier et Novembre 1990
Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique
Pr. TAZI Saoud Anas Anesthésie Réanimation
Février Avril Juillet et Décembre 1991
Pr. AZZOUZI Abderrahim Anesthésie Réanimation
Doyen de la FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale
Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale
Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZZAD Rachid Gynécologie Obstétrique
Méd Chef Maternité des Orangers
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie
Dir. du Centre National PV Rabat
Pr. TAOUFIK Jamal Chimie thérapeutique
V.D à la pharmacie+Dir duCEDOC+Directeur du Médicament
Décembre 1992
Pr. AHALLAT Mohamed Chirurgie Générale Doyen de FMPT
Pr. BENSOUDA Adil Anesthésie Réanimation
Pr. CHRAIBI Chafiq Gynécologie Obstétrique
Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Pr. BENJAAFAR Noureddine Radiothérapie
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocrinologie et Maladies Métaboliques
Doyen de la FMPA
Pr. EL AMRANI Sabah Gynécologie Obstétrique
Pr. EL BARDOUNI Ahmed Traumato-Orthopédie
Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale
Directeur CHIS -Rabat
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie
Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie
Directeur Hôpital My Ismail Meknès
Pr. ABDELHAK M’barek Chirurgie – Pédiatrique
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie – Obstétrique
Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie
Pr. CHERKAOUI Lalla Ouafae Ophtalmologie
Pr. LAKHDAR Amina Gynécologie Obstétrique
Pr. MOUANE Nezha Pédiatrie
Mars 1995
Pr. ABOUQUAL Redouane Réanimation Médicale
Pr. AMRAOUI Mohamed Chirurgie Générale
Pr. BAIDADA Abdelaziz Gynécologie Obstétrique
Pr. BARGACH Samir Gynécologie Obstétrique
Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation
Pr. EL MESNAOUI Abbes Chirurgie Générale
Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Directeur du Service de Santé des FAR
Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie
Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali RéanimationMédicale
Décembre 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie
Pr. BOULANOUAR Abdelkrim Ophtalmologie
Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale
Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie Directeur Hôp. Mil.d’Instruction Med V Rabat
Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. KADDOURI Noureddine Chirurgie Pédiatrique
Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TAOUFIQ Jallal Psychiatrie Directeur Hôp. Arrazi Salé
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
Novembre 1998
Pr. BENOMAR ALI Neurologie – Doyen de la FMP Abulcassis
Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. ER RIHANI Hassan Oncologie Médicale
Pr. BENKIRANE Majid* Hématologie
Janvier 2000
Pr. ABID Ahmed* Pneumophtisiologie
Pr. AIT OUMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Directeur Hôp. My Youssef
Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale
Pr. ECHARRAB El Mahjoub Chirurgie Générale
Pr. EL FTOUH Mustapha Pneumo-phtisiologie
Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation
Pr. TACHINANTE Rajae Anesthésie-Réanimation
Novembre 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie Directeur Hôp. Chekikh Zaied
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques
Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Pr. ROUIMI Abdelhadi* Neurologie
Décembre 2000
Pr. ZOHAIR ABDELAH* ORL
Décembre 2001
Pr. BALKHI Hicham* Anesthésie-Réanimation
Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie
Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie
Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale
Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation
Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique
Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie Directeur. Hôp.d’Enfants Rabat
Pr. GAZZAZ Miloudi* Neuro-Chirurgie
Pr. HRORA Abdelmalek Chirurgie Générale
Pr. KABBAJ Saad Anesthésie-Réanimation
Pr. KABIRI EL Hassane* Chirurgie Thoracique
Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique
Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale
Pr. MIKDAME Mohammed* Hématologie Clinique
Pr. MOHSINE Raouf Chirurgie Générale
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique
Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie
Pr. BERNOUSSI Zakiya Anatomie Pathologique
Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHOHO Abdelkrim * Chirurgie Générale
Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL FELLOUS Sidi Zouhair Chirurgie Pédiatrique
Pr. EL HAOURI Mohamed * Dermatologie
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
Pr. MABROUK Hfid* Traumatologie Orthopédie
Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique
Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie
Pr. RACHID Khalid * Traumatologie Orthopédie
Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumophtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique
Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie
Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr. BOUGHALEM Mohamed* Anesthésie Réanimation
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique
Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. EL YOUNASSI Badreddine* Cardiologie
Pr. HACHI Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie
Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire
Pr. OUBAAZ Abdelbarre* Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique
Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. AZIZ Noureddine* Radiologie
Pr. BAHIRI Rachid Rhumatologie Directeur. Hôp. Al Ayachi Salé
Pr. BARKAT Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. DOUDOUH Abderrahim* Biophysique
Pr. EL HAMZAOUI Sakina* Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire
Pr. LYAGOUBI Mohammed Parasitologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique
Pr. ZERAIDI Najia Gynécologie Obstétrique
Avril 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique
Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire
Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation
Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation
Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique
Pr. LAATIRIS Abdelkader* Pharmacie Galénique
Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie
Decembre 2006
Pr SAIR Khalid Chirurgie générale Dir. Hôp.Av.Marrakech
Octobre 2007
Pr. ABIDI Khalid Réanimation médicale
Pr. ACHACHI Leila Pneumo phtisiologie
Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi* Chirurgie cardio vasculaire
Pr. AMHAJJI Larbi* Traumatologie orthopédie
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed* Anesthésie réanimation Directeur ERSSM
Pr. BALOUCH Lhousaine* Biochimie-chimie
Pr. BENZIANE Hamid* Pharmacie clinique
Pr. BOUTIMZINE Nourdine Ophtalmologie
Pr. CHARKAOUI Naoual* Pharmacie galénique
Pr. EHIRCHIOU Abdelkader* Chirurgie générale
Pr. EL BEKKALI Youssef * Chirurgie cardio-vasculaire
Pr. ELABSI Mohamed Chirurgie générale
Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice
Pr. HADADI Khalid* Radiothérapie
Pr. ICHOU Mohamed* Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar* Anesthésie réanimation
Pr. LOUZI Lhoussain* Microbiologie
Pr. MADANI Naoufel Réanimation médicale
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologie biologique
Pr. MRANI Saad* Virologie
Pr. OUZZIF Ez zohra* Biochimie-chimie
Pr. RABHI Monsef* Médecine interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine* Microbiologie
Pr. SIFAT Hassan* Radiothérapie
Pr. TABERKANET Mustafa* Chirurgie vasculaire périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour* Traumatologie orthopédie
Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Décembre 2008
Pr TAHIRI My El Hassan* Chirurgie Générale
Mars 2009
Pr. ABOUZAHIR Ali* Médecine interne
Pr. AGDR Aomar* Pédiatre
Pr. AIT ALI Abdelmounaim* Chirurgie Générale
Pr. AIT BENHADDOU El hachmia Neurologie
Pr. AKHADDAR Ali* Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. AMINE Bouchra Rhumatologie
Pr. ARKHA Yassir Neuro-chirurgie Directeur Hôp.des Spécialités
Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae* Biochimie-chimie
Pr. BOUI Mohammed* Dermatologie
Pr. BOUNAIM Ahmed* Chirurgie Générale
Pr. BOUSSOUGA Mostapha* Traumatologie orthopédique
Pr. CHTATA Hassan Toufik* Chirurgie vasculaire périphérique
Pr. DOGHMI Kamal* Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale
Pr. EL OUENNASS Mostapha* Microbiologie
Pr. ENNIBI Khalid* Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique
Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique
Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-phtisiologie Octobre 2010
Pr. ALILOU Mustapha Anesthésie réanimation
Pr. AMEZIANE Taoufiq* Médecine interne
Pr. BELAGUID Abdelaziz Physiologie
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine aéronautique
Pr. DAMI Abdellah* Biochimie chimie
Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie pédiatrique
Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie plastique et réparatrice
Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro entérologie
Pr. LAMALMI Najat Anatomie pathologique
Pr. MOSADIK Ahlam Anesthésie Réanimation
Pr. MOUJAHID Mountassir* Chirurgie générale
Pr. NAZIH Mouna* Hématologie biologique
Pr. ZOUAIDIA Fouad Anatomie pathologique
Decembre 2010
Pr.ZNATI Kaoutar Anatomie Pathologique Mai 2012
Pr. AMRANI Abdelouahed Chirurgie Pédiatrique
Pr. ABOUELALAA Khalil* Anesthésie Réanimation
Pr. BENCHEBBA Driss* Traumatologie Orthopédique
Pr. DRISSI Mohamed* Anesthésie Réanimation
Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale
Pr. EL KHATTABI Abdessadek* Médecine Interne
Pr. EL OUAZZANI Hanane* Pneumophtisiologie
Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie pathologique
Pr. MEHSSANI Jamal* Psychiatrie
Pr. RAISSOUNI Maha* Cardiologie
Février 2013
Pr. AHID Samir Pharmacologie – Chimie
Pr. AIT EL CADI Mina Toxicologie
Pr. AMRANI HANCHI Laila Gastro-Entérologie
Pr. AMOUR Mourad Anesthésie Réanimation
Pr. AWAB Almahdi Anesthésie Réanimation
Pr. BELAYACHI Jihane Réanimation Médicale
Pr. BELKHADIR Zakaria Houssain Anesthésie Réanimation
Pr. BENCHEKROUN Laila Biochimie-Chimie
Pr. BENKIRANE Souad Hématologie biologique
Pr. BENNANA Ahmed* Informatique Pharmaceutique
Pr. BENSGHIR Mustapha* Anesthésie Réanimation
Pr. BENYAHIA Mohammed* Néphrologie
Pr. BOUATIA Mustapha Chimie Analytique et Bromatologie
Pr. BOUABID Ahmed Salim* Traumatologie Orthopédie
Pr. BOUTARBOUCH Mahjouba Anatomie
Pr. CHAIB Ali* Cardiologie
Pr. DENDANE Tarek Réanimation Médicale
Pr. DINI Nouzha* Pédiatrie
Pr. ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation
Pr. ECH-CHERIF EL KETTANI Najwa Radiologie
Pr. ELFATEMI Nizare Neuro-Chirurgie
Pr. EL GUERROUJ Hasnae Médecine Nucléaire
Pr. EL HARTI Jaouad Chimie Thérapeutique
Pr. EL JOUDI Rachid* Toxicologie
Pr. EL KABABRI Maria Pédiatrie
Pr. EL KHANNOUSSI Basma Anatomie Pathologie
Pr. EL KHLOUFI Samir Anatomie
Pr. EL KORAICHI Alae Anesthésie Réanimation
Pr. EN-NOUALI Hassane* Radiologie
Pr. ERRGUIG Laila Physiologie
Pr. FIKRI Meryim Radiologie
Pr. GHFIR Imade Médecine Nucléaire
Pr. IMANE Zineb Pédiatrie
Pr. IRAQI Hind Endocrinologie et maladies métaboliques
Pr. KABBAJ Hakima Microbiologie
Pr. KADIRI Mohamed* Psychiatrie
Pr. LATIB Rachida Radiologie
Pr. MAAMAR Mouna Fatima Zahra Médecine Interne
Pr. MEDDAH Bouchra Pharmacologie
Pr. MELHAOUI Adyl Neuro-chirurgie
Pr. MRABTI Hind Oncologie Médicale
Pr. NEJJARI Rachid Pharmacognosie
Pr. OUBEJJA Houda Chirurgie Pédiatrique
Pr. RAHALI Younes Pharmacie Galénique
Pr. RATBI Ilham Génétique
Pr. RAHMANI Mounia Neurologie
Pr. REDA Karim* Ophtalmologie
Pr. REGRAGUI Wafa Neurologie
Pr. RKAIN Hanan Physiologie
Pr. ROSTOM Samira Rhumatologie
Pr. ROUAS Lamiaa Anatomie Pathologique
Pr. ROUIBAA Fedoua* Gastro-Entérologie
Pr. SALIHOUN Mouna Gastro-Entérologie
Pr. SAYAH Rochde Chirurgie Cardio-Vasculaire
Pr. SEDDIK Hassan* Gastro-Entérologie
Pr. ZERHOUNI Hicham Chirurgie Pédiatrique
Pr. ZINE Ali* Traumatologie Orthopédie
Avril 2013
Pr. EL KHATIB Mohamed Karim* Stomatologie et Chirurgie Maxillo-faciale MAI 2013
Pr.BOUSLIMAN Yassir Toxicologie
MARS 2014
Pr. ACHIR Abdellah Chirurgie Thoracique
Pr. BENCHAKROUN Mohammed * Traumatologie- Orthopédie
Pr. BOUCHIKH Mohammed Chirurgie Thoracique
Pr. EL KABBAJ Driss * Néphrologie
Pr. EL MACHTANI IDRISSI Samira * Biochimie-Chimie
Pr. HARDIZI Houyam Histologie- Embryologie-Cytogénétique
Pr. HASSANI Amale * Pédiatrie
Pr. HERRAK Laila Pneumologie
Pr. JANANE Abdellah * Urologie
Pr. JEAIDI Anass * Hématologie Biologique
Pr. KOUACH Jaouad* Génycologie-Obstétrique
Pr. LEMNOUER Abdelhay* Microbiologie
Pr. MAKRAM Sanaa * Pharmacologie
Pr. OULAHYANE Rachid* Chirurgie Pédiatrique
Pr. RHISSASSI Mohamed Jaafar CCV
Pr. SABRY Mohamed* Cardiologie
Pr. SEKKACH Youssef* Médecine Interne
Pr. TAZI MOUKHA Zakia Génécologie-Obstétrique
AVRIL 2014
PROFESSEURS AGREGES : DECEMBRE 2014
Pr. ABILKASSEM Rachid* Pédiatrie
Pr. AIT BOUGHIMA Fadila Médecine Légale
Pr. BEKKALI Hicham * Anesthésie-Réanimation Pr. BENAZZOU Salma Chirurgie Maxillo-Faciale Pr. BOUABDELLAH Mounya Biochimie-Chimie
Pr. BOUCHRIK Mourad* Parasitologie Pr. DERRAJI Soufiane* Pharmacie Clinique Pr. DOBLALI Taoufik* Microbiologie Pr. EL AYOUBI EL IDRISSI Ali Anatomie
Pr. EL GHADBANE Abdedaim Hatim* Anesthésie-Réanimation Pr. EL MARJANY Mohammed* Radiothérapie
Pr. FEJJAL Nawfal Chirurgie Réparatrice et Plastique Pr. JAHIDI Mohamed* O.R.L
Pr. LAKHAL Zouhair* Cardiologie
Pr. OUDGHIRI Nezha Anesthésie-Réanimation
Pr. RAMI Mohamed Chirurgie Pédiatrique
Pr. SABIR Maria Psychiatrie
Pr. SBAI IDRISSI Karim* Médecine préventive, santé publique et Hyg. AOUT 2015
Pr. MEZIANE Meryem Dermatologie Pr. TAHRI Latifa Rhumatologie JANVIER 2016
Pr. BENKABBOU Amine Chirurgie Générale Pr. EL ASRI Fouad* Ophtalmologie Pr. ERRAMI Noureddine* O.R.L
Pr. NITASSI Sophia O.R.L JUIN 2017
Pr. ABI Rachid* Microbiologie Pr. ASFALOU Ilyasse* Cardiologie
Pr. BOUAYTI El Arbi* Médecine préventive, santé publique et Hyg. Pr. BOUTAYEB Saber Oncologie Médicale
Pr. EL GHISSASSI Ibrahim Oncologie Médicale Pr. OURAINI Saloua* O.R.L
Pr. RAZINE Rachid Médecine préventive, santé publique et Hyg. Pr. ZRARA Abdelhamid* Immunologie
2- ENSEIGNANTS – CHERCHEURS SCIENTIFIQUES
PROFESSEURS / PRs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie – chimie
Pr. ALAOUI Katim Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique
Pr. BARKIYOU Malika Histologie-Embryologie
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques
Pr. CHAHED OUAZZANI Lalla Chadia Biochimie – chimie
Pr. DAKKA Taoufiq Physiologie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. IBRAHIMI Azeddine Biologie moléculaire/Biotechnologie Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie Pr. ZAHIDI Ahmed Pharmacologie
Mise à jour le 10/10/2018 Khaled Abdellah
À ma mère, la lumière de ma vie et mon cher soutien.
À mon père, le pilier de notre famille et sa force.
À ma sœur Hana, ma force et ma faiblesse.
À mon frère Jamal, mon héros et ami. À Salma Majidi, le nouveau sourire de la famille et ma chère belle-sœur. À toute ma famille maternelle, qui m’a vu grandir et qui m’a bercé d’amour et de joie pendant toute ma
vie.
À toute ma famille paternelle, qui est un rappel de bonté, une terre de compassion et une main tendue
quand j’en ai besoin.
À ma meilleure amie Lina, la douce et la confidente fidèle.
À Khaoula, Lhajja et à toute sa famille, mon second foyer et refuge. À toutes mes ami(e)s : Khadija, Sara, Maryam, Imane, Jihane, Mouna, Monya, Meryem, Hind, Intissar, Badiaa, Rihab, Ikrame, Hamza, Nawfel, Anas, mes compagnons de
À Notre Maître,
Présidente du jury Madame le Professeur BENJELLOUN Dakhama
Badr Sououd
Pour avoir accepté d’être la présidente du jury de ce mémoire. Vous nous avez marqué autant sur le
niveau académique que humain; Votre compétence et savoir, et vos qualités humaines, sont incontestablement un exemple à suivre pour tout médecin désirant atteindre le niveau élevé où vous
vous tenez aujourd’hui.
Veuillez accepter, chère Maître, l’assurance de notre profond respect.
À Notre Maître,
Rapporteur de thèse Monsieur le Professeur EL KHORASSANI Mohamed Professeur de Pédiatrie Pour avoir encadré, avec professionnalisme et passion, ce
travail de recherche.
Vous m’avez été d’une grande aide, et sans votre chère et précieuse contribution, ce travail n’aurait pas atteint la maturité nécessaire à son
accomplissement.
Veuillez trouver ici, cher Maître, l’expression de ma respectueuse
À Nos Maîtres et Juges de thèse Monsieur le professeur MASRAR
Azlarab
Madame la professeure KARBOUBI Lamya
Madame la professeure BELAYACHI Jihane
Pour nous avoir honorer de leur présence et de leur contribution à l’évaluation de ce travail de fin d’étude. Votre apport à ce travail est indéniablement d’une grande valeur. Veuillez accepter mon respect, mon admiration et remerciements Envers votre compétence et votre qualité
SOMMAIRE
INTRODUCTION GÉNÉRALE 1
RAPPEL PHYSIOLOGIQUE DE L’HÉMOSTASE 3
I. Généralités 4
II. Physiologie de l’hémostase primaire 6
1. Facteurs de l’hémostase primaire 6
1.1. La paroi vasculaire 6
1.2. Les plaquettes 7
1.3. Le facteur Von Willebrand 8
1.4. Le fibrinogène 9
2. Mise en jeu des différents paramètres de l’hémostase primaire 9
2.1. Le spasme vasculaire 9
2.2. L’adhésion plaquettaire 9
2.3. L’activation plaquettaire 9
2.4. L’agrégation plaquettaire 9
III. Physiologie de la coagulation 12
1. Les cellules et facteurs impliqués 12
2. Facteurs de la coagulation et leurs inhibiteurs 13
3. Activation de la coagulation 14
3.1. Représentation classique 14
3.2. Représentation moderne 14
4. Mécanismes de régulation 17
IV. Physiologie de la fibrinolyse 19
PARTICULARITÉS DE L’HÉMOSTASE EN PÉDIATRIE 20
I. Généralités : 21
II. Particularités physiologiques de l’hémostase du nouveau-né, du nourrisson
et de l’enfant 23
1. L’hémostase primaire 23
2. La coagulation plasmatique 24
3. Les facteurs de la coagulation 24
4. Les inhibiteurs de la coagulation 27
5. Les composantes de la fibrinolyse 27
III. Implications cliniques 28
PREMIÈRE PARTIE
LES PATHOLOGIES HÉMORRAGIQUES CONSTITUTIONNELLES DE L’HÉMOSTASE ET LEURS CIRCONSTANCES DE DÉCOUVERTE
I. Les pathologies de l’hémostase primaire 30
1. La maladie de Willebrand 30 1.1. Historique 30 1.2. Définition 31 1.3. La classification 31 1.4. Epidémiologie 32 1.5. Le diagnostic positif 32
2.1.1. Historique 34 2.1.2. Définition 35 2.1.3. Le diagnostic positif 35 2.2. Le syndrome de Bernard-soulier 37 2.2.1. Historique 37 2.2.2. Définition 38 2.2.3. Le diagnostic positif 39
2.3. Les autres thrombopathies 40
3. Les thrombopénies constitutionnelles 40
3.1. Généralités 40
3.2. La classification 41
3.3. À propos d’un cas de la littérature 43
3.4. Démarche diagnostique 44
II. Pathologies de la coagulation 47
1. L’hémophilie 47 1.1. Historique 47 1.2. Définition 48 1.3. Epidémiologie 48 1.4. Génétique 49 1.5. Le diagnostic biologique 50
2. Les déficits rares de la coagulation 50
III. Pathologies de la fibrinolyse 55
1. Déficit en α2-antiplasmine 55
2. Déficit en PAI-1 56
IV. Circonstances de découverte des pathologies constitutionnelles de l’hémostase 57
1. Symptomatique 57
1.1. Symptomatologie hémorragique 57
1.2. Symptomatologie non spécifique 69
2 .Découverte fortuite 72
V. Démarche diagnostique devant un syndrome hémorragique de l’enfant 73
1. Syndrome hémorragique clinique 73
1.1. L’interrogatoire 73
1.2. L’Examen physique 75
1.3. Les éléments cliniques de gravité 75 2. Particularités des phases de traitement biologique 76
2.1. L’étape pré-analytique 76
2.2. L’étape analytique 77
2.3. L’étape post analytique 78
3. Exploration d’un syndrome hémorragique 78 3.1. L’exploration de l’hémostase primaire 79
3.2. Exploration de la coagulation 81
DEUXIÈME PARTIE
ETUDE RÉTROSPECTIVE DESCRIPTIVE ET ANALYTIQUE: À PROPOS DE 63 CAS
2. Matériels et méthodes 86
2.1. Critères d’inclusion 86
2.2. Critères d’exclusion 87
2.3. Matériel 87
2.4. Le circuit des patients 87
RÉSULTATS 92
I. Données épidémiologiques 95
1. Répartition selon l’année d’admission 95
2. Répartition selon le sexe 95
3. Répartition selon l’âge 96
3.1. Age à l’admission 96
3.2. Age au diagnostic 97
3.3. Age des premiers symptômes hémorragiques 98
4. Répartition selon l’origine géographique 99
5. Répartition selon le niveau socio-économique 100
II. Antécédents familiaux 101
1. Consanguinité 101
2. Maladie hématologique hémorragique au sein de la famille 102
3. Décès dans la famille lié à une pathologie de l’hémostase 104
III. Antécédents personnels 106
1. Conduite des parents face à ces premiers événements hémorragiques 106 2. Age de survenue du premier antécédent hémorragique 107
3. Nombre d’épisodes hémorragiques 108
4. Evénement déclenchant 109
5. Type de saignement 110
IV. Circonstances de découverte 111
1. Symptomatologie hémorragique 112 1.1. Type de saignement 112 1.2. le mode d’apparition 114 1.3. Gravité du saignement 115 1.3.1. Degré du saignement 115 1.3.2. Transfusion 116
1.3.3. Etat hémodynamique à l’admission 116
2. Découverte fortuite 117
3. Enquête familiale 118
4. Symptomatologie non spécifique 118
DISCUSSION 119
LIMITES DE L’ÉTUDE 132
CONCLUSION 134
LISTE DES FIGURES
Figure 1 : Caillot sanguin
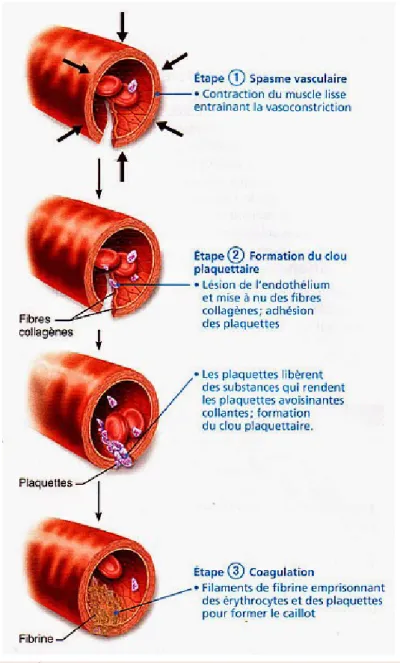
Figure 2 : Étapes de l’hémostase primaire
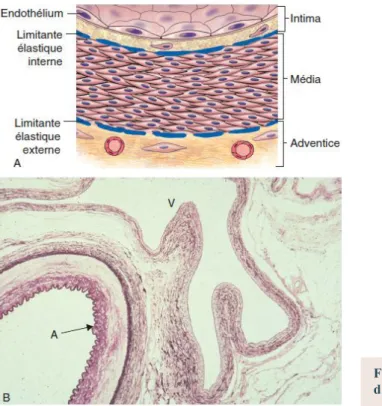
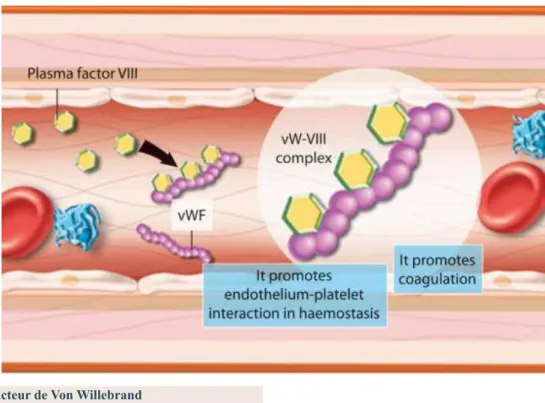
Figure 3: Coupe histologique transversale d’une artère Figure 4 : Image reconstituée en 3D des plaquettes sanguines Figure 5: Facteur de Von Willebrand
Figure 6 : Rôle des plaquettes dans l’hémostase primaire Figure 7 : Fibrinoformation
Figure 8 : Caillot d’hémostase
Figure 9 : La cascade de la coagulation
Figure10 : Portrait de Erik Adolf Von Willebrand Figure 11 : Portrait d’Edouard Glanzmann Figure 12 : Platelet function analyser (PFA)
Figure13 : Aspect d’une Thrombasthénie de Glanzmann sur un test fonctionnel plaquettaire Figure14 : Quatre hématologistes au congrès de Buffalo (1949) de gauche à droite: Jean Pierre Soulier, Marcel Bessis, Jean Bernard, Jean Dausset (DR).
Figure 15 : Pseudocorps de Döhle (B). Figure16 : Portrait de la reine Victoria.
Figure 17 : Hématome suite à une ponction veineuse chez un enfant hémophile de3ans. Figure 18 : Hémarthrose de la cheville.
Figure 19 : Hémarthrose du genou.
Figure 20 : Ecchymoses (stades de la biligénie).
Figure 21 : TDM cérébrale d’un enfant de 5ans qui a présenté des troubles de la conscience. Elle montre des hématomes sous duraux : Frontopariétal droit mesurant 11mm et Basitemporal droit mesurant 4,5mm. Déficit en facteur VI.
Figure 22 : Hématome extradural mesurant 5 mm d’épaisseur associé à une fracture pariétale gauche chez un nourrisson de 7 mois qui a eu un traumatisme crânien. Diagnostic retenu: hémophilie B.
Figure 23 : Tube miniCollect®, de chez Greiner.
Figure 24 : Conduite à tenir devant un allongement du temps de saignement. Figure 25 : Déficits en facteurs selon les résultats de la TCA et du temps de Quick. Figure 26 : Arbre décisionnel devant la diminution du TQ et l’allongement du TCA. Figure 27 : Graphe montrant la répartition des cas selon leur provenance.
Figure 28 : Répartition des cas selon la pathologie. Figure 29 : Répartition des cas selon le sexe.
Figure 30 : Carte du Maroc montrant la répartition des cas étudiés sur les 12 régions. Figure 31 : Distribution des cas selon leur couverture sociale.
Figure 32 : Pourcentage de consanguinité dans notre série. Figure 33 : Répartition selon le degré de consanguinité.
Figure 34 : Le nombre de cas ayant une fratrie atteinte de la même pathologie.
Figure 36 : Le pourcentage de décès lié à une pathologie de l’hémostase dans la famille. Figure 37 : Distribution des patients selon la présence ou non d’antécédents hémorragiques personnels.
Figure 38 : Pourcentage de patients ayant consultés devant le premier symptôme hémorragique. Figure 39 : Répartition selon le nombre d’épisodes hémorragiques antécédents.
Figure 40 : La distribution selon le mécanisme déclenchant. Figure 41 : Pourcentage de chaque type de saignement.
Figure 42 : Circonstances de découverte des pathologies hémorragiques héréditaires en pourcentage.
Figure 43 : Distribution des patients selon le type de saignement. Figure 44 : Pourcentage des différents types de saignements muqueux. Figure 45 : Répartition selon le mode d’apparition.
Figure 46 : Répartition des cas selon la gravité de l’hémorragie. Figure 47 : Distribution des cas selon la nécessité d’une transfusion. Figure 48 : Répartition des cas selon leur état hémodynamique. Figure 49 : Distribution selon le type de bilan fortuit.
LISTE DES FIGURES Figure 1 : Caillot sanguin
Figure 2 : Étapes de l’hémostase primaire
Figure 3: Coupe histologique transversale d’une artère Figure 4 : Image reconstituée en 3D des plaquettes sanguines Figure 5: Facteur de Von Willebrand
Figure 6 : Rôle des plaquettes dans l’hémostase primaire Figure 7 : Fibrinoformation
Figure 8 : Caillot d’hémostase
Figure 9 : La cascade de la coagulation
Figure10 : Portrait de Erik Adolf Von Willebrand Figure 11 : Portrait d’Edouard Glanzmann Figure 12 : Platelet function analyser (PFA)
Figure13 : Aspect d’une Thrombasthénie de Glanzmann sur un test fonctionnel plaquettaire Figure14 : Quatre hématologistes au congrès de Buffalo (1949) de gauche à droite: Jean Pierre Soulier, Marcel Bessis, Jean Bernard, Jean Dausset (DR).
Figure 15 : Pseudocorps de Döhle (B). Figure16 : Portrait de la reine Victoria.
Figure 17 : Hématome suite à une ponction veineuse chez un enfant hémophile de3ans. Figure 18 : Hémarthrose de la cheville.
Figure 19 : Hémarthrose du genou.
Figure 20 : Ecchymoses (stades de la biligénie).
Figure 21 : TDM cérébrale d’un enfant de 5ans qui a présenté des troubles de la conscience. Elle montre des hématomes sous duraux : Frontopariétal droit mesurant 11mm et Basitemporal droit mesurant 4,5mm. Déficit en facteur VI.
hémophilie B.
Figure 23 : Tube miniCollect®, de chez Greiner.
Figure 24 : Conduite à tenir devant un allongement du temps de saignement. Figure 25 : Déficits en facteurs selon les résultats de la TCA et du temps de Quick. Figure 26 : Arbre décisionnel devant la diminution du TQ et l’allongement du TCA. Figure 27 : Graphe montrant la répartition des cas selon leur provenance.
Figure 28 : Répartition des cas selon la pathologie. Figure 29 : Répartition des cas selon le sexe.
Figure 30 : Carte du Maroc montrant la répartition des cas étudiés sur les 12 régions. Figure 31 : Distribution des cas selon leur couverture sociale.
Figure 32 : Pourcentage de consanguinité dans notre série. Figure 33 : Répartition selon le degré de consanguinité.
Figure 34 : Le nombre de cas ayant une fratrie atteinte de la même pathologie.
Figure35 : Répartition de la maladie hémorragique au sein de la famille (en dehors de la fratrie).
Figure 36 : Le pourcentage de décès lié à une pathologie de l’hémostase dans la famille. Figure 37 : Distribution des patients selon la présence ou non d’antécédents hémorragiques personnels.
Figure 38 : Pourcentage de patients ayant consultés devant le premier symptôme hémorragique. Figure 39 : Répartition selon le nombre d’épisodes hémorragiques antécédents.
Figure 40 : La distribution selon le mécanisme déclenchant. Figure 41 : Pourcentage de chaque type de saignement.
Figure 42 : Circonstances de découverte des pathologies hémorragiques héréditaires en pourcentage.
Figure 43 : Distribution des patients selon le type de saignement. Figure 44 : Pourcentage des différents types de saignements muqueux. Figure 45 : Répartition selon le mode d’apparition.
Figure 46 : Répartition des cas selon la gravité de l’hémorragie. Figure 47 : Distribution des cas selon la nécessité d’une transfusion. Figure 48 : Répartition des cas selon leur état hémodynamique. Figure 49 : Distribution selon le type de bilan fortuit.
LISTE DES TABLEAUX
Tableau 1 : Facteurs et protéines de la coagulation
Tableau 2 : Principales études définissant les valeurs de référence pour les paramètres d’hé-mostase dans des populations pédiatriques. Principales caractéristiques démographiques des populations étudiées.
Tableau 3 : valeurs de référence en pédiatrie selon Andrew (A) et Monagle (M). Tableau 4 : La classification SSC-ISTH de la maladie de Willebrand
Tableau 5 : Thrombopénies constitutionnelles. Classification en fonction de l’anomalie génétique.
Tableau 6 : Principales thrombopénies constitutionnelles. Classification en fonction de la taille des plaquettes et du caractère isolé ou syndromique.
Tableau 7 : Some features of rare coagulation disorders.
Tableau 8 : Caractéristiques différenciant les déficits rares de la coagulation d’une hémo-philie d’après S.S. Acharya.
Tableau 9 : Initial features suggestives of pathologic bleeding in children. Tableau 10 : Nombre et Pourcentage de chaque pathologie.
Tableau 11 : Répartition des cas selon leur année d’admission. Tableau 12 : Répartition selon l’âge à l’admission au CHOP.
Tableau 13 : Répartition selon l’âge des patients au moment du diagnostic.
Tableau 14 : Tableau montrant l’âge des patients aux premiers symptômes hémorragiques. Tableau 15 : Âge de survenue du 1er antécédent de nature hémorragique.
Tableau 16 : Les mécanismes déclenchant les hémorragies et leur effectif. Tableau 17 : Anomalies biologiques de l’hémostase rencontrées.
Tableau 18 : Comparaison de la fréquence des pathologies hémorragiques héréditaires dans 3 études différentes.
Tableau 19 : Comparaison des Antécédents hémorragiques de nos patients avec ceux d’une étude faite au Caire.
Tableau 20 : Présentation clinique hémorragique dans notre étude comparée à deux autres études.
Tableau 21 : Traductions cliniques non spécifiques de certains troubles de l’hémostase (cas cliniques du CHOP).
LISTE DES ABRÉVIATIONS
AT: Antithrombine ATCD: Antécédents
ATP : Adénosine triphosphate BSS: Bernard Soulier Syndrom
CHOP: centre d’hématologie et d’oncologie pédiatrique DHPC: Déficit rare en protéine coagulante
FT: Facteur tissulaire
FVW: Facteur de Von Willebrand HER: Hôpital d’enfants de Rabat
MAIPA: Antibody-specific Immobilization of Platelet Antigens MW : maladie de Willebrand
NO: Monoxyde d’azote PC: protéine C
PDF: Produits de dégradation de la fibrine PFA : Platelet Function Analyser
PS : protéine S
PTAI: Purpura thrombopénique auto-immun RFC: Réseau FranceCoag
RIPA : Ristocetin-Induced Platelet Agregation SBS: Syndrome de Bernard Soulier
TC: thrombopénies constitutionnelles TCA: Temps de Céphaline + Activateur TCK: Temps de Céphaline Kaolin TDM: Tomodensitométrie
TFPI: Tissue Factor Pathway inhibitor TG : Thrombasthénie de Glanzmann TP: Temps de prothrombine
t-PA: tissue Plasminogen Activator TS: Temps de saignement
INTRODUCTION GÉNÉRALE
Le XXe siècle est sans doute le siècle des découvertes et travaux scientifiques les plus récents
en hématologie. D’énormes progrès dans la compréhension des phénomènes physiologiques de l’hémostase et de leurs acteurs (facteurs de la coagulation, facteur de Willebrand, facteur VIII…) ont été accomplis. Il s’agit d’un grand tournent historique où furent découvertes toutes les pathologies hémorragiques constitutionnelles de l’hémostase que nous connaissons aujourd’hui à l’exception de l’hémophilie qui est connue depuis des millénaires.
Le domaine de l’hémostase pédiatrique, à l’instar de la pédiatrie, a bénéficié ces quarante dernières années de progrès remarquables et du développement des méthodes d’exploration biologique et d’imagerie adaptés à l’enfant, au petit enfant et au fœtus. Ceci dans un premier temps a permis de mettre en évidence les particularités d’un système hémostatique dit en développement et de publier des valeurs de référence des paramètres de la coagulation suivant le terme et l’âge de l’enfant. Ce qui a aidé à mieux aborder une seconde étape qui est la compréhension et le diagnostic des principales pathologies hémorragiques de l’enfant. Les pathologies constitutionnelles de l’hémostase forment un groupe de pathologies pouvant prédisposer à des saignements parfois très graves. Elles sont liées à une anomalie génétique et sont donc présentes dès la naissance (anomalies constitutionnelles) et plusieurs membres de la famille peuvent être atteints (anomalies héréditaires). De ce fait, elles peuvent toucher aussi la descendance.
Nous nous sommes intéressés dans ce travail de thèse aux circonstances de découverte de ces pathologies constitutionnelles. Nous avons donc mené dans ce sens une étude rétrospective sur 3 années afin de déterminer les conditions dans lesquelles les patients porteurs de ce type d’affection sont diagnostiqués. Ceci pour une meilleure approche diagnostique et prise en charge de ces maladies rares mais invalidantes de l’enfant.
Quelles sont donc ces pathologies hémorragiques constitutionnelles de l’hémostase ? Dans quelles circonstances sont-elles découvertes ? S’agit -t-il toujours d’une symptomatologie hémorragique spécifique à ce type d’anomalies ?
Quelle est la démarche diagnostique à suivre devant la suspicion d’une maladie hémorragique congénitale de l’hémostase chez l’enfant ?
3
RAPPEL
PHYSIOLOGIQUE
DE L’HÉMOSTASE
I. GÉNÉRALITÉS
1. QU’EST-CE L’HÉMOSTASE ? (QUOI ?)
3. COMMENT ? [3]
2. QUAND EST CE QUE CE PHÉNOMÈNE PHYSIOLOGIQUE EST-IL DÉCLENCHÉ? (QUAND ?)
L’hémostase (du grec aima, sang et stasis, arrêt) est définie, étymologiquement, par l’arrêt d’un saignement et, en Hématologie par l’ensemble des mécanismes physiologiques qui permet la prévention et l’arrêt des hémorragies en cas de lésion de la paroi vasculaire. Elle joue également un rôle dans le maintien de la fluidité du sang par la mise en jeu de systèmes inhibiteurs de la coagulation. [1]
L’hémostase peut être subdivisée en trois étapes distinctes mais imbriquées et dépendantes l’une de l’autre :
1. l’hémostase primaire qui est un mécanisme d’urgence qui aboutit à la formation du clou plaquettaire ou thrombus blanc formé par un agrégat de plaquettes adhérés à l’endothélium et qui dure de 3 à 5 minutes.
2. La cascade de coagulation dont le produit final est la fibrine qui vient renforcer le clou plaquettaire formant ainsi le caillot en une durée de 5 à 10 minutes.
3. La fibrinolyse assurant secondairement la dégradation enzymatique de la masse L’hémostase s’oppose à la perte de sang consécutive à la lésion de petits vaisseaux.
Pour qu’il y ait saignement il faut qu’il y ait une brèche dans la paroi des vaisseaux par où le sang sort sous l’effet de la différence de pression entre leur intérieur et leur extérieur. Les mécanismes naturels de l’hémostase sont normalement adéquats pour obturer la brèche et arrêter le saignement des petits vaisseaux, artérioles, capillaires et veinules qui sont fréquemment lésés par les traumatismes de la vie quotidienne qui sont la cause la plus courante de saignements alors même que l’on ne s’est pas rendu compte dans tous les cas que l’on s’est blessé. L’hémostase réduit à un minimum le saignement de ces petites lésions vasculaires. Les plus rares saignements provenant de vaisseaux de moyen ou grand diamètre ne sont pas en règle générale arrêtés par les seuls mécanismes hémostatiques.[2]
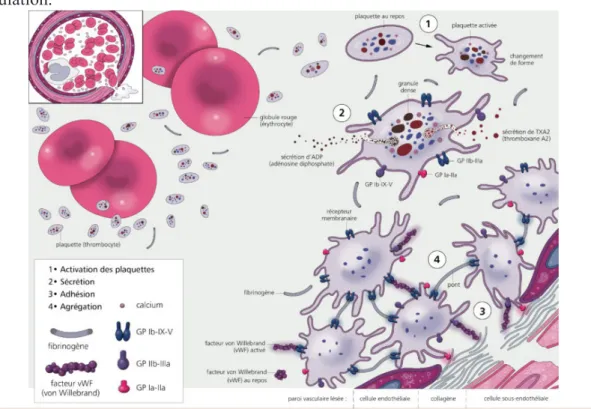
Fig2 : Étapes de l’hémostase primaire
fibrinoplaquettaire initialement formée à l’issue de la réparation vasculaire qui peut durer de 48 à 72 heures.
Ces différentes phases de l’hémostase sont hautement régulées par un système d’activateurs et d’inhibiteurs plasmatiques assurant un contrôle local de la constitution du caillot et évitant l’activation de la coagulation à distance de la brèche vasculaire.
II. PHYSIOLOGIE DE L’HÉMOSTASE PRIMAIRE
[4], [5]
1. FACTEURS DE L’HÉMOSTASE PRIMAIRE
1.1. La paroi vasculaire
Pour étudier la physiologie de cette première étape il est primordial de détailler les éléments qui entrent en jeu dans ce processus naturel, et qui sont : la paroi vasculaire, les plaquettes, le facteur de Willebrand et le fibrinogène.
Au niveau de l’intima, tunique au contact de la lumière vasculaire, on distingue l’endothélium constitué d’une monocouche de cellules endothéliales et le sous endothélium formé de tissu conjonctif et de cellules musculaires lisses. L’endothélium au contact du sang est thromborésistant car il produit différentes molécules inhibant l’activation plaquettaire (prostaglandine I2, monoxyde d’azote), régulant négativement la coagulation (thrombomoduline, inhibiteur de la voie du facteur tissulaire [TFPI]) ou ayant une activité profibrinolytique (activateur tissulaire du plasminogène [t-PA]). Le sous-endothélium, riche en molécules adhésives (collagène, facteur Willebrand), est lui, spontanément thrombogène.
Fig3 : Coupe histologique transversale d’une artère
1.2. Les plaquettes
Dans une communication en 1881 adressée à l’académie royale de médecine de Turin, le médecin italien Giulio Bizzozero révéla la présence dans le sang humain d’éléments discrets qu’il nomma («bluttplatchen» dans un journal Allemand et «petites plaques» dans une communication en Français). Décrites avant comme étant de simples «agrégats granulaires» non fonctionnels, ils seront depuis au cœur de l’explication des phénomènes hémostatiques et thrombotiques.
Les plaquettes sanguines ne sont pas des cellules proprement dites mais des fragments cellulaires qui se sont détachés par bourgeonnement de très grandes cellules résidentes de la moelle osseuse appelées mégacaryocytes qui proviennent des mêmes cellules souches indifférenciées que les érythrocytes et les lignées de leucocytes. Dans le sang, les plaquettes sont au nombre de 150 000 à 450000/mm3. Leur durée de vie est de 8 à 10 jours. La plaquette est une cellule anucléée, ayant une forme de disque à l’état de repos. Cette cellule est délimitée par une membrane plasmique composée de glycoprotéines et de phospholipides. Dans le cytoplasme, on retrouve des granules denses et des granules alpha. Ces granules contiennent des composés importants qui interviennent dans la phase d’agrégation plaquettaire[1].
1.3. Le facteur Von Willebrand
Le Facteur Willebrand est une glycoprotéine plasmatique synthétisée par les cellules endothéliales de la paroi vasculaire et les mégacaryocytes, puis stockée dans des granules spécifiques : corps de Weibel-Palade dans les cellules endothéliales, granules alpha dans les plaquettes et enfin sécrétée dans la circulation au cours de l’activation plaquettaire. Il a une structure multimérique. Les multimètres de haut poids moléculaire sont essentiels à son activité biologique.
Le facteur Willebrand a une double fonction : la première, dans l’hémostase primaire, où il joue un rôle clé dans l’interaction des plaquettes et de la paroi vasculaire lésée ; la deuxième au cours de la coagulation proprement dite, où il assure le transport et la protection du facteur VIII dans le sang circulant.
On note une augmentation du FW chaque fois qu’il y a stress, un exercice physique intense, au cours de la grossesse (synthèse par le placenta), dans les états de détérioration vasculaire, après perfusion intraveineuse lente de MINIRIN® (ce médicament est utilisé pour préparer les patients ayant un déficit modéré en FW à une intervention chirurgicale ou à une ponction d’organe profond) [6].
1.4. Le fibrinogène
2.1. Le spasme vasculaire réduit l’écoulement de sang dans le vaisseau lésé
2.2. L’adhésion plaquettaire
Le fibrinogène est une glycoprotéine plasmatique synthétisée par le foie. Il joue un rôle très important dans la coagulation mais c’est aussi le cofacteur de l’agrégation plaquettaire.
Un vaisseau sectionné ou déchiré se contracte aussitôt ce qui explique pourquoi le saignement est réduit pendant les 30 premières secondes avant d’augmenter par la suite. Le mécanisme sous-jacent n’est pas bien élucidé, mais on pense qu’il s’agit d’une réponse intrinsèque déclenchée par un médiateur paracrine libéré par l’endothélium du vaisseau lésé qui déclenche une brève vasoconstriction des muscles lisses de la paroi en amont de la lésion. Cette vasoconstriction favorise l’accumulation locale de substances hémostatiques. La sérotonine et le thromboxane A2 (TXA2) libérés par les plaquettes activées, sont de puissants agents vasoconstricteurs. En même temps, il y a mise en contact du facteur tissulaire qui provient de l’extérieur du vaisseau, avec les facteurs plasmatiques de la coagulation. C’est le point de départ de la coagulation qui aboutit à la formation précoce de thrombine. Normalement, les Plaquettes n’adhèrent pas à l’endothélium des vaisseaux. Quand il y a rupture de continuité de l’endothélium à la suite d’une lésion vasculaire, les structures sous endothéliales hautement thrombogènes sont mises à nu et mises en contact avec les plaquettes. Ces dernières adhèrent au sous endothélium par l’intermédiaire du facteur de Willebrand. Ce dernier, comme précédemment cité est une molécule multimérique de très haut poids moléculaire synthétisée par la cellule endothéliale et le mégacaryocyte. Sa liaison au collagène induit sa modification conformationnelle, permettant ainsi sa liaison à la glycoprotéine plaquettaire GPIb-IX-V.
2-MISE EN JEU DES DIFFÉRENTS PARAMÈTRES DE L’HÉMOSTASE PRIMAIRE : [2], [7]
Cette mise en jeu est rapide, elle aboutit à la formation d’un thrombus blanc de nature plaquettaire qui va colmater la brèche vasculaire. Les diverses phases sont les suivantes :
2.4. L’agrégation plaquettaire
L’agrégat plaquettaire va croître par apposition successive de nouvelles plaquettes. Au niveau de la membrane plaquettaire, le complexe glycoprotéinique IIb/IIIa est indispensable. Grâce à ce site, le fibrinogène va se fixer sur la membrane pour former avec le Ca++ des ponts interplaquettaires qui permettent la formation de l’agrégat. Une fois que leur agrégation a
2.3. L’activation plaquettaire
L’activation des cellules plaquettaires est caractérisée par deux phénomènes principaux, leur changement de forme et leur activation métabolique. Il s’agit de processus actifs nécessitant de l’énergie, sous forme d’ATP dérivant du métabolisme du glucose, et la disponibilité intracytoplasmique des ions calcium (Ca++) indispensables à l’activation du système contractile actine-myosine. Discoïdes à l’état de repos, les plaquettes activées deviennent sphériques, émettent des pseudopodes et s’étalent sur la surface d’adhésion. Les granules intra cytoplasmiques fusionnent avec le système canaliculaire ouvert et y libèrent leur contenu, qui se déverse ainsi dans le plasma environnant. Ce phénomène de sécrétion plaquettaire, libère de nombreuses substances proagrégantes (ADP, fibrinogène, sérotonine), pro coagulantes (facteur V, VWF, fibrinogène) ou vasomotrices (sérotonine, NO, TXA2) contribuant à l’amplification du processus d’hémostase primaire et créant les conditions favorables à la coagulation plasmatique.
Par ailleurs, la plaquette activée génère de nombreuses substances pharmacologiquement actives à partir de ses phospholipides membranaires comme l’acide arachidonique. Celui-ci est métabolisé par la phospholipase A2 pour aboutir à la TXA2, puissant agent vasoconstricteur (L’Aspirine* exerce un effet anti-agrégant plaquettaire en bloquant la synthèse des précurseurs du TXA2) et proagrégant, et à d’autres prostaglandines modulant les activités plaquettaire et vasculaire.
Un autre phénomène essentiel se déroule au cours de la phase d’activation plaquettaire est le phénomène de «flip-flop» membranaire, permettant aux structures internes de la membrane de se repositionner vers l’extérieur en contact avec le plasma. Cette modification permet aux phospholipides chargés négativement, et notamment la phosphatidylsérine, de s’extérioriser et de devenir disponibles pour la fixation des facteurs de la coagulation vitamine K-dépendants, amplifiant par-là considérablement les processus enzymatiques de la cascade de la coagulation.
Fig6 : Rôle des plaquettes dans l’hémostase primaire
commencé, les plaquettes libèrent plusieurs substances chimiques importantes notamment le diphosphate d’adénosine (ADP). L’ADP rend adhésive la surface des plaquettes circulant à proximité de sorte qu’elles adhèrent à la première couche de plaquettes agrégées et produisent à leur tour ces mêmes substances chimiques ce qui cause encore plus de plaquettes à s’empiler et ainsi de suite. C’est ainsi que ce constitue rapidement le clou plaquettaire par un mécanisme de rétroaction positive.
L’agrégation des plaquettes étant auto-entretenue, comment se fait-il qu’elle soit limitée au siège de la lésion vasculaire et ne s’étende pas à l’endothélium voisin? Une raison cruciale est que l’ADP ainsi que d’autres substances libérées par les plaquettes activées simulent la production de prostacycline et de monoxyde d’azote par l’endothélium sain voisin et inhibent fortement l’agrégation dans leur territoire, ce qui confine le clou plaquettaire à la zone lésée et s’oppose à son extension aux zones saines.
Il se forme finalement un gros amas plaquettaire, l’agrégat plaquettaire hémostatique, qui arrête en partie l’hémorragie mais qui doit être consolidé par le réseau de fibrine créé par la coagulation.
III. PHYSIOLOGIE DE LA COAGULATION
La 1ère description de la coagulation remonte à 1905 par PAUL MORAWITZ, médecin allemand, qui proposa une théorie afin d’expliquer le phénomène de la coagulation dans laquelle quatre acteurs sont cités comme étant nécessaires et suffisants : la thrombokinase, la prothrombine, le fibrinogène et le calcium. Bien qu’incomplète cette théorie pose les bases de la cascade de la coagulation.Au cours des années 1950, les chercheurs ont identifié les facteurs de la coagulation.Dans un article publié en 1964 dans la revue Nature, on décrivait en détails le processus de la coagulation. L’interaction des différents facteurs nécessaires à la coagulation sanguine a alors pris le nom de réactions en cascade de la coagulation.[8] La coagulation est le plus puissant des mécanismes de l’hémostase et est nécessaire à l’arrêt du saignement, l’hémostase obtenue par le clou plaquettaire étant fragile et temporaire, elle doit être consolidée par la génération d’un réseau protéique qui réalise ainsi une hémostase permanente.
La coagulation correspond à la conversion du fibrinogène, protéine soluble, en fibrine, une molécule filamenteuse insoluble, qui constitue l’armature du caillot. Cette conversion est la conséquence d’une cascade de réactions enzymatiques à laquelle participent plusieurs protéines plasmatiques appelées facteurs de la coagulation.
La coagulation doit être appréhendée de manière dynamique. Après son initiation, elle s’amplifie. Mais elle doit rester localisée à la brèche vasculaire et ne pas être associée à une hypercoagulabilité circulante ou systémique. À cet effet, des mécanismes régulateurs importants sont mis en jeu. Les principaux inhibiteurs de la coagulation sont le tissue factor
pathway inhibitor (TFPI), l’Antithrombine (AT), le système de la protéine C (protéines C et
S).
1. LES CELLULES ET FACTEURS IMPLIQUÉS
La coagulation ne peut se dérouler qu’en présence de cellules ou des composants qui en sont issus. Les cellules les plus importantes dans la coagulation sont les cellules endothéliales, les monocytes, les plaquettes et les cellules périvasculaires. La coagulation a lieu à la surface
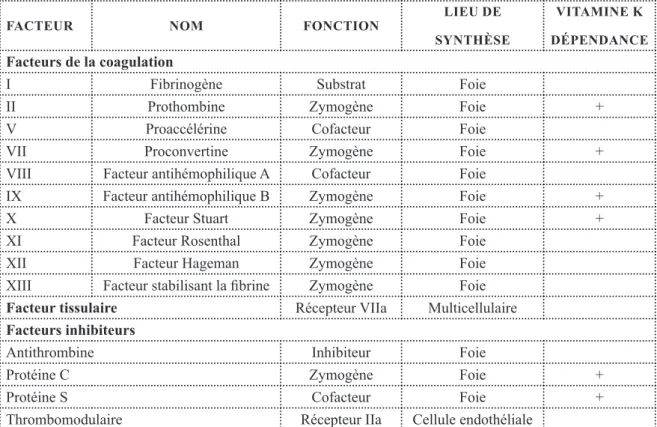
Tableau 1 : Facteurs et protéines de la coagulation
FACTEUR NOM FONCTION LIEU DE
SYNTHÈSE
VITAMINE K DÉPENDANCE
Facteurs de la coagulation
I Fibrinogène Substrat Foie
II Prothombine Zymogène Foie +
V Proaccélérine Cofacteur Foie
VII Proconvertine Zymogène Foie +
VIII Facteur antihémophilique A Cofacteur Foie
IX Facteur antihémophilique B Zymogène Foie +
X Facteur Stuart Zymogène Foie +
XI Facteur Rosenthal Zymogène Foie
XII Facteur Hageman Zymogène Foie
XIII Facteur stabilisant la fibrine Zymogène Foie
Facteur tissulaire Récepteur VIIa Multicellulaire
Facteurs inhibiteurs
Antithrombine Inhibiteur Foie
Protéine C Zymogène Foie +
Protéine S Cofacteur Foie +
Thrombomodulaire Récepteur IIa Cellule endothéliale
des plaquettes activées, dont la membrane expose alors des phospholipides anioniques au niveau desquels les facteurs de la coagulation vont pouvoir se fixer.
2. FACTEURS DE LA COAGULATION ET LEURS INHIBITEURS
La majorité des facteurs de la coagulation a été découverte entre 1940 et 1950. Initialement appelés par les noms des premiers malades porteurs de pathologies hémorragiques héréditaires liées à un déficit de synthèse, la dénomination par les chiffres romains s’est imposée en 1954 pour en simplifier l’usage. On entend par facteurs de la coagulation des protéines plasmatiques participant au processus de la coagulation et dont on distingue trois groupes différents : les protéines à activité enzymatique, les protéines dénuées d’activité enzymatique mais servant de cofacteurs et les protéines ayant un rôle de substrat (Tableau ci-dessous).
3. ACTIVATION DE LA COAGULATION :[7], [9]
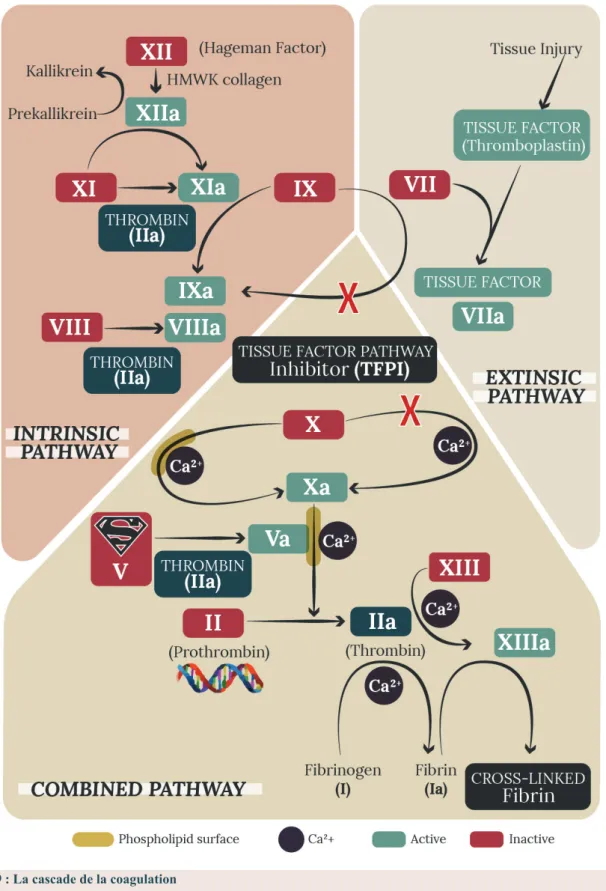
3.1. Représentation classique
Le schéma classique et historique de la coagulation comporte deux voies d’activation : -La voie intrinsèque dans laquelle la coagulation est déclenchée par un activateur
de la phase contact. Physiologiquement, le système du « contact », appelé ainsi car activé lors du contact du sang avec une surface mouillable comme le verre (ou le Kaolin, la silice ou l’acide ellagique utilisés dans les tests de laboratoire), et comprenant notamment le facteur FXII, ne joue pas de rôle significatif. En effet le FXII n’est associé à aucun risque de saignement.
-La voie extrinsèque qui est activée par le récepteur cellulaire du FVII; le facteur
tissulaire (FT), correspondant à la thromboplastine utilisée par les laboratoires.
Cette conception duelle de la coagulation reflète assez justement les mécanismes mis en jeu in vitro, c’est-à-dire lors de l’exploration de la coagulation au laboratoire, c’est donc en se fondant sur ce schéma qu’on raisonne pour interpréter les tests de la coagulation usuels, qui sont le Temps de céphaline+ Activateur pour l’exploration de la voie intrinsèque et le temps de prothrombine (TP) pour la voie extrinsèque. En revanche, cela ne correspond pas réellement à ce qui se passe in vivo au décours d’une lésion vasculaire.
3.2. Représentation moderne
La conception actuelle de la coagulation est plus dynamique que la précédente, elle est aussi plus représentative des phénomènes in vivo initiés par la mise à nu du FT (composant de la thromboplastine). En effet, il est aujourd’hui admis que l’élément déclenchant de la coagulation in vivo est l’expression à la surface des cellules d’une protéine membranaire appelée «facteur tissulaire» (FT). Certaines cellules en contact permanent avec le flux sanguin, n’expriment le FT que lorsqu’elles sont activées c’est le cas des monocytes et des cellules endothéliales. D’autres l’expriment de façon constitutive et donc permanente : ce sont des cellules périvasculaires (fibroblastes, myocytes, cellules mésenchymateuses) qui ne sont pas en contact avec le flux sanguin en l’absence de rupture de la continuité vasculaire. Plusieurs étapes sont identifiées :
• 1ère étape : déclenchement de la coagulation par activation du facteur VII ;
• 2éme étape : activation du facteur X et formation du complexe enzymatique prothrombinase; • 3ème étape : formation de la thrombine ;
• 4ème étape : formation du réseau de fibrine insoluble.
3.2.1. Déclenchement de la coagulation par activation du facteur VII
La rupture de la tunique endothéliale thromborésistante, secondaire à une lésion vasculaire, permet le contact du sang circulant avec les structures sous-endothéliales. La fixation du facteur VII plasmatique au facteur tissulaire, qui est exprimée de façon constitutive par les cellules musculaires lisses et les fibroblastes, représente le signal du déclenchement de la cascade enzymatique. La liaison du facteur VII permet en outre son auto activation, amplifiant considérablement l’activité du complexe facteur tissulaire-facteur VII (FT-FVII).
3.2.2. Activation du facteur X et formation du complexe enzymatique prothrombinase
Le complexe FT-FVII active très rapidement par protéolyse le facteur X en facteur Xa. Celui-ci active en retour le facteur VII, rendant le complexe beaucoup plus actif et amplifiant ainsi sa propre production. Le facteur Xa forme, en association avec les phospholipides plaquettaires, le calcium et le cofacteur Va, un complexe enzymatique assurant le clivage protéolytique de la prothrombine(FII) qui génère ainsi la molécule de thrombine, d’où son nom de complexe prothrombinase.
Par ailleurs, le complexe FT-FVII active, mais beaucoup plus lentement, le facteur IX (facteur antihémophilique B) en facteur IXa. Il se forme de la même façon un complexe enzymatique, appelé complexe tenase, associant facteur IXa, phospholipides plaquettaires, calcium, et le cofacteur VIIIa, qui active le facteur X en facteur Xa, amplifiant considérablement le rendement de la production de prothrombinase. Il existe donc deux voies d’activation protéolytique du facteur X qui sont distinctes dans leur cinétique. L’activation directe par le complexe FT-FVII est très rapide, et constitue le starter de la cascade enzymatique, pour aboutir précocement aux premières molécules de thrombine, alors que la voie indirecte passant par l’activation du facteur IX est beaucoup plus lente à se mettre en place mais est
quantitativement prépondérante. Il existe une autre voie d’activation passant par le facteur XI qui est activé lentement par la thrombine nouvellement formée. Le facteur XIa active en retour le facteur IX pour renforcer la génération du complexe tenase. Le facteur XI peut également être activé par les facteurs contacts après exposition des composants du sous-endothélium, mais l’importance de cette voie d’activation est mineure.
3.2.3. Formation de la thrombine
Le complexe prothrombinase assure la protéolyse de la prothrombine (facteur II) en thrombine (facteur IIa), protéine clé de la coagulation responsable de la génération du caillot de fibrine. En outre, la thrombine assure une amplification du rendement de la cascade enzymatique en activant les cofacteurs V et VIII qui accélèrent considérablement l’activité des complexes de la prothrombinase (Va) et de la tenase (VIIIa), conduisant à un accroissement explosif de la production de la thrombine. On considère en effet que la présence du cofacteur activé au sein du complexe enzymatique accroît son rendement par un facteur 106. Ce phénomène est
nommé double boucle de rétroactivation de la génération de thrombine sur laquelle repose toute l’efficacité et la puissance du système.
3.2.4. Fibrinoformation
La dernière étape repose sur la transformation du fibrinogène soluble par l’hydrolyse de
Fig7 : Fibrinoformation
ces différentes chaînes polypeptidiques en monomères de fibrine,qui s’associent les unes aux autres grâce à des liaisons hydrogène de faible affinité pour formerun gel de fibrine,