HAL Id: tel-01015874
https://tel.archives-ouvertes.fr/tel-01015874
Submitted on 27 Jun 2014HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Rôle du facteur de transcription STOX1 dans la
physiopathologie de la prééclampsie : apport d’un
modèle cellulaire et d’un modèle murin de transgénèse
additive
Ludivine Gouny-Doridot
To cite this version:
Ludivine Gouny-Doridot. Rôle du facteur de transcription STOX1 dans la physiopathologie de la prééclampsie : apport d’un modèle cellulaire et d’un modèle murin de transgénèse additive. Médecine humaine et pathologie. Université René Descartes - Paris V, 2013. Français. �NNT : 2013PA05T017�. �tel-01015874�
UNIVERSITE PARIS DESCARTES
THESE
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE PARIS DESCARTES
Champ disciplinaire : Sciences du vivant et environnement
Discipline : Biologie, médecine et santé
Spécialité : Génétique
Ecole Doctorale de rattachement : Gc2iD
(Génétique, Cellules, Immunologie, Infectiologie, Développement)
Présentée et soutenue publiquement par
Ludivine GOUNY-DORIDOT
Le 27 juin 2013
ROLE DU FACTEUR DE TRANSCRIPTION STOX1 DANS
LA PHYSIOPATHOLOGIE DE LA PREECLAMPSIE :
APPORT D’UN MODELE CELLULAIRE ET D’UN MODELE
MURIN DE TRANSGENESE ADDITIVE
Directeur de thèse : Daniel VAIMAN
JURY
Pr Marc DELPECH Président
Dr Michel COHEN-TANNOUDJI Rapporteur
Pr Lionel CARBILLON Rapporteur
Dr Nathalie LEDEE Examinatrice
Dr Olivier SANDRA Examinateur
Pr Alexandre HERTIG Examinateur
A mon mari bien aimé et à ma famille,
grâce au soutien desquels j’ai pu arriver jusque là…
«
This is not the end.
It is not even the beginning of the end.
But it is, perhaps, the end of the beginning
»Remerciements
Je tiens à e e ie l e se le du ju pou a oi a ept d alue e t a ail et de e i oute lo s de la soute a e. Je remercie Marc Delpech, pour avoir accepter de présider ce jury. Je remercie les deux rapporteurs, Michel Cohen-Tannoudji et Lio el Ca illo , d a oi o sa du temps à la correction de mon manuscrit. Et je remercie également Nathalie Ledée, Olivier Sandra et Ale a d e He tig d a oi a ept d t e e a i ateu s.
Je veux également adresser mes plus vifs remerciements à Daniel Vaiman, qui a encadré ette th se e t ou a t l uili e u il e fallait e t e di ige et a o pag e . Je le e e ie de a oi fait pa tage sa isio des hoses su de o eu sujets, ta t s ie tifi ues ue so i tau . Cela a eau oup appo t . So soutie a t d u e i po ta e d te i a te. Son enthousiasme scientifique fait de la recherche un jeu quotidien passionnant. J esp e ue les o asio s d ha ge perdureront au délà de cette thèse.
Je remercie également chaleureusement tous les membres du labo, qui ont rendu mon environnement de travail si agréable. Avec une pensée particulière, je remercie Sandrine, pour sa patience et ses conseils, Céline, pour ses longs discours qui changent les idées et nous en donnent de nouvelles, Ahmed, pour son écoute et son thé à la menthe, Jana, pour ses conseils protéinés et sa gentillesse. Evidemment, je remercie vivement Capucine dont la bonne humeur, les sourires et l oute sa e t embellir les journées les plus difficiles, et qui est devenue au cours de ces quatres années une personne à laquelle je tiens beaucoup.
Je e e ie gale e t toutes les pe so es a e ui j ai t a aill di e te e t, a ie es ou ou elles. Ai si, je e e ie So ia et Vi gi ie, ui so t pass es a a t oi et o t do e des clés pou ette a e tu e. Je e e ie gale e t les stagiai es ue j ai e ad s et a e les uels j ai beaucoup appris : Dorothée, Milena, Mathilde et Aurélien.
Je e e ie tous les e es de l asso iatio JeCCo a e les uels j ai dis ut et pa tag d aut es t pes d e p ie es.
Je e e ie es a ies, th sa des, ui o t pu o p e d e ette e p ie e et e so ti de temps en temps : Rosa, Emma, Marija, Charlène, Marion. Leur présence a également participé à me faire évoluer et a rendu cette formation plus enrichissante.
Je remerice également ma famille et ma belle-famille, dont de nombreux membres me font le plaisi d assiste à a soute a e. Je e e ie e pa ti ulie de tout œu mes parents dont le soutie sa s faille a pe is d a i e jus ue là. Ce so t eu ui o t e t ete u a u iosit et o t donné la confiance nécessaire pour entreprendre ces longues études. Je remercie également mon pa ai , ui a fait d ou i le o de du la o atoi e et a pla t e oi ette petite g ai e de chercheu ui a e suite fait ue g a di .
E fi , je e e ie Ga iel, o a i, ui a soute ue uotidie e e t au ou s de es années de thèse, et ui, lui aussi, a do o fia e et soutie . Il a notamment su me faire sortir de ma thèse afin de profiter également de ce que la vie a de meilleur à offrir.
Résumé
La p la psie est u e aladie f ue te de la g ossesse, a a t is e pa l appa itio de
novo d u e h pe te sio et d u e p ot i u ie à pa ti de la ème se ai e d a o h e. Ces
s ptô es s agg a e t au lo g de la g ossesse, o duisa t e tuelle e t à la o t ate elle e l a se e de p ise e ha ge di alis e. La th apeuti ue d fi iti e l e t a tio du pla e ta, et do du fœtus, e ui i duit u e importante prématurité iatrogène. Les causes restent mal définies, ais il est ie ad is ue des a o alies au i eau de la ise e pla e du pla e ta so t au œu de sa ph siopathologie. U d faut d i asio t opho lasti ue des a t es spi al es ut i es semble être une constante de la maladie.
Des do es pid iologi ues d o t e t u il e iste u e fo te o posa te g ti ue dans la prééclampsie, et en 2005, un clonage positionnel dans des familles hollandaises, aboutit à l ide tifi atio de STOX1 comme le premier gène lié à cette maladie. STOX1 code un facteur de t a s iptio i te e a t da s le o t ôle de la p olif atio et de l i asio des t opho lastes. Da s ot e la o atoi e, l tude de STOX a t i iti e pa su e p essio da s des ellules de ho io a i o e hu ai od le de t opho lastes sui ie d u e a al se t a s ipto i ue. Celle-ci a l ue les alt atio s d e p essio g i ue o se es suite à la su e p essio de STOX1 étaient significativement corrélées à celles trouvées dans des placentas prééclamptiques. La création de souris transgéniques exprimant la version humaine de STOX1 sous le o t ôle d u p o oteu ubiquitaire a alors été entreprise.
Mes travaux de thèse ont principalement consisté à caractériser le phénotype de ces souris. Nous avons décidé de croiser des mâles transgéniques avec des souris sauvages afin de limiter l e p essio du t a sg e à l u it fœto-placentaire. Ces souris sauvages développent au cours de leur gestation une hypertension sévère, et une protéinurie. Elles constituent donc un nouveau od le de p la psie. De plus, ous a o s o se des a o alies ue l o t ou e gale e t hez les patientes : une fibrose rénale, une élévation des taux sériques de facteurs pro-angiogéniques (le récepteur soluble du VEGF et l e dogli e solu le . Ces sou is o t gale e t des a ueu s d h pe t ophie a dia ue, attesta t de l i pa t s e de l h pe te sio .
Pour mieux comprendre comment STOX1 peut induire ce syndrome, nous avons étudié son impact dans le modèle cellulaire surexprimant STOX1 et nous avons pu montré une altération de la gestion du stress oxydatif et de la fonction mitochondriale.
En conclusion, nous avons obtenu et caractérisé un modèle de prééclampsie sévère, le seul existant montrant un phénotype hypertensif très marqué et très précoce. Ce modèle est un outil puissant pour découvrir de nouvelles voies impliquées dans la physiopathologie de la prééclampsie, pour rechercher de potentiels marqueurs diagnostiques précoces, tester des approches thérapeutiques innovantes et explorer les mécanismes responsables des conséquences à long terme de la prééclampsie.
1
TABLE DES MATIERES
TABLE DES MATIERES ... 1
TABLE DES ILLUSTRATIONS ... 5
LISTE DES TABLEAUX... 5
LISTE DES ABBREVIATIONS ... 7
Introduction ... 9
Chapitre Un Le placenta ... 11
I. Généralités ... 13
II. Les différents types de placenta des mammifères euthériens ... 15
III. Le développement du placenta humain ... 17
1. De la fécondation au blastocyste ... 17
2. L e do t e et l a ueil du lasto ste ... 19
3. L i pla tatio et la ise e pla e des illosit s ho iales ... 21
4. L i asio p ofo de de la ème à la 12ème semaine de grossesse) ... 23
5. Le o t ôle de l i asio p ofo de ... 25
6. Le placenta de la 4ème semaine au terme ... 29
IV. Le développement du placenta murin ... 30
1. De la fécondation au blastocyste : le développement préimplantatoire ... 30
2. L e do t e et l a ueil du blastocyste ... 33
3. L i pla tatio et le d eloppe e t du pla e ta ... 37
4. Les gènes du développement placentaire ... 40
V. Les fonctions placentaires ... 44
1. Assu e la oissa e fœtale ... 44
2. Rôle endocrine et sécrétoire ... 46
i. La sécrétion hormonale par le placenta humain ... 47
ii. La sécrétion hormonale par le placenta murin ... 48
iii. La sécrétion de facteurs de croissance et de cytokines ... 48
iv. Autres types de sécrétions ... 49
3. Induire une tolérance immunologique ... 49
i. L u it fœto-placentaire : une hémi-allogreffe ... 49
ii. La tol a e i u itai e de l u it fœto-pla e tai e hez l hu ai ... 50
iii. La tol a e i u itai e de l u it fœto-placentaire chez la souris ... 51
iv. Les a is es d adaptatio du s st e i u itai e ate el ... 52
4. P ot ge le fœtus ... 56
Chapitre Deux La prééclampsie ... 58
2
1. Définition et données cliniques ... 60
2. Incidence et données épidémiologiques ... 62
3. Facteurs de risques ... 64
i. Les facteurs de risque liés à la mère ... 65
ii. Les facteurs de risque liés au père ... 66
iii. Les facteurs de risque liés au couple ... 66
iv. Les facteurs de risque liés à la grossesse ... 68
v. Les facteurs de risque liés au mode de vie ... 69
4. Traitements ... 70
i. Le seul moyen curatif : eti e l u it fœto-placentaire ... 70
ii. Les traitements des symptômes ... 71
iii. Les traitements préventifs ... 72
5. Vers un diagnostic précoce ? ... 74
II. La génétique de la prééclampsie ... 77
1. Les tudes à l helle du g o e e tie ... 78
2. Les études d asso iatio de g e-candidats ... 79
3. Perspectives concernant la génétique de la prééclampsie ... 81
III. Physiopathologie de la prééclampsie ... 81
1. Le pla e ta, l o ga e do t les d fauts so t à l o igi e de la p la psie ... 81
2. Première étape : une placentation défectueuse ... 82
3. Deuxième étape : le syndrome maternel ... 85
i. La dysfonction endothéliale et le déséquilibre des facteurs vasoactifs ... 86
ii. La coagulopathie ... 88
iii. Le stress oxydatif et le métabolisme des lipides ... 89
iv. L i fla atio ... 90
v. L i u it ... 90
Chapitre Trois Les od les d tude de la p la psie ... 93
I. Les modèles cellulaires ... 95
1. Les trophoblastes isolés à partir de placenta ... 95
2. Les lignées de chorio-carcinome humain... 96
i. Les cellules BeWo ... 96
ii. Les cellules JEG-3 ... 96
iii. Les cellules JAR ... 96
3. Les lignées dérivées de cytotrophoblastes ... 97
i. HTR8/Svneo... 97
ii. SGHPL ... 97
4. Les trophoblastes dérivées de cellules souches humaines ... 98
3
II. Les modèles murins ... 99
1. Modèle murin : un bon modèle pour étudier les pathologies placentaires ? ... 100
2. Les différents modèles de prééclampsie obtenus chez la souris ... 101
i. La surexpression de sFlt1 ... 101
ii. Les gulateu s de l h pe te sio ... 102
iii. L i u it i e et l auto-immunité ... 103
iv. Comt et l h po ie ... 104
v. Les gènes soumis à empreinte parentale ... 104
3. Bilan... 105
Chapitre Quatre Le facteur de transcription STOX1 ... 106
I. Sa découverte ... 108
1. L ide tifi atio d u e gio li e à la p la psie et sou ise à u effet de l o igi e parentale ... 108
2. STOX1, un gène soumis à empreinte ... 109
3. STOX1 : un facteur de transcription ... 110
II. Sa remise en cause ... 111
1. STOX1 et la prééclampsie : association génétique ?... 112
2. Le statut d e p ei te de STOX1 ... 113
III. Sa difficile réhabilitation ... 114
1. STOX1 serait soumis à empreinte uniquement dans les cytotrophoblastes extravilleux des olo es ou e tai s d e t e eu ... 114
2. L e p essio de STOX au er trimestre ... 115
3. Les études visant à comprendre la fonction de STOX1 et sa pertinence vis à vis de la prééclampsie ... 116
i. STOX1, la p olif atio et l i asio ... 116
ii. Impact de la surexpression de STOX1 dans un modèle cellulaire ... 116
Résultats ... 119
Article 1 Les s pto es de p la psie i duits pa l e p essio fOeto-placentaire de STOX1 so t p e us pa l aspi i e ... 123
Article 2 La su e p essio de STOX da s l u it Foeto-placentaire induit une fonction pla e tai e alt e ai si u u e surcroissance foetale... 139
Article 3 La fonction cardiovasculaire dans un modèle murin de prééclampsie ... 163
Article 4 STOX est espo sa le d u e fo tio ito ho d iale alt e da s les ellules trophoblastiques ... 179
Discussion et perspectives ... 201
I. Bilan des principaux résultats obtenus ... 203
II. Le modèle murin STOX1 ... 204
1. Comprendre comment le syndrome se développe dans nos souris ... 204
4
3. Explorer les conséquences à long terme ... 208
III. STOX1 ... 208
IV. Conclusion ... 209
Références ... 211
Annexes ... 239
Annexe 1 Revue : Comparative analysis of mice models for preeclampsia ... 241
Annexe 2 Revue : DNA methylation, an epigenetic mode of gene expression regulation in reproductive science ... 249
Annexe 3 la Régulation de mir34-A dans les pathologies placentaires ... 291
Annexe 4 Les facteurs de transcription à doigt de Zinc sont dérégulés dans les pathologies placentaires ... 311
Annexe 5 Genetic and epigenetic mechanisms collaborate to control SERPINA3 expression and its association with placental diseases ... 331
Annexe 6 Combination of promoter hypomethylation and PDX1 overexpression leads to TBX15 decrease in vascular IUGR placentas ... 345
Annexe 7 Congrès ... 357
I. Communications orales en français ... 359
II. Communications orales en anglais ... 359
5
TABLE DES ILLUSTRATIONS
Figure 1 : L a e phylogénétique des vertébrés simplifié ... 13
Figure 2 : L o igi e des tissus p i itifs hez les a if es ... 14
Figure 3 : Le placenta chorio-vitellin du wallaby Macropus eugenii ... 15
Figure 4 : Forme globale des placentas des mammifères euthériens... 15
Figure 5 : Les différents types de barrières hémato-placentaires ... 16
Figure 6 : Le trajet et la rencontre des gamètes dans les voies génitales féminines ... 18
Figure 7 : Le d eloppe e t p o e hez l hu ai ... 21
Figure 8 : Le développement des villosités choriales ... 23
Figure 9 : Les villosités choriales au 1er trimestre de grossesse ... 23
Figure 10 : Les cytotrophoblastes extravilleux (CEV) ... 24
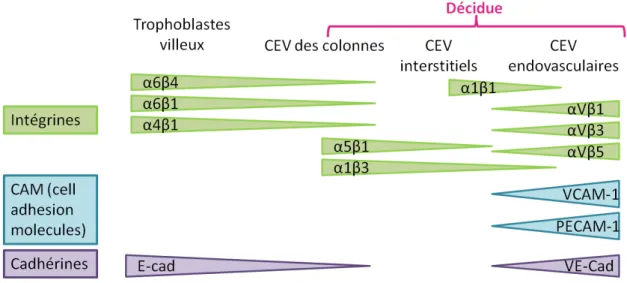
Figure 11 : Les ol ules d adh sio s e p i es pa les t opho lastes à l i te fa e fœto-maternelle ... 26
Figure 12 : La gulatio d pe da te de l o g e ia HIF ... 29
Figure 13 : La circulation materno-fœtale au ou s de la g ossesse ... 29
Figure 14 : Le placenta à la fin du 3ème mois ... 29
Figure 15 : Le développement préimplantatoire murin in vitro ... 31
Figure 16 : Le développement préimplantatoire murin in vivo ... 32
Figure 17 : Les bases moléculaires du premier lignage au sein du blastocyste ... 33
Figure 18 : L i plantation chez la souris ... 37
Figure 19 : Le développement du placenta murin ... 38
Figure 20 : Les lig ages t opho lasti ues et l o igi e des diff e ts t pes de TGCs ... 39
Figure 21 : Les i ulatio s sa gui es ate elle et fœtale à o t e-courant au cours de la gestation chez la souris ... 40
Figure 22 : Les p i ipau ha ges fœto-maternels ... 44
Figure 23 : HLA-G et la tolérance immunitaire pendant la grossesse ... 51
Figure 24 : Le système du complément et sa régulation ... 56
Figure 25 : Les régions chromosomiques associées à la prééclampsie. ... 78
Figure 26 : Le défaut de remodelage des artères spiralées utérines en cas de prééclampsie ... 83
Figure 27 : Les placentas humain et murin ... 100
Figure 28 : Les symptômes de prééclampsie dans les différents modèles murins ... 105
Figure 29 : Mod le d h ita ilit pig ti ue et g ti ue de la p la psie ... 108
Figure 30 : Les différentes isoformes de STOX1 ... 110
Figure 31 : STOX est appa e t à la fa ille des fa teu s FOX et so do ai e de liaiso à l ADN est très conservé ... 111
Figure 32 : L e p essio i-allélique de STOX1 dans le placenta ... 113
Figure 33 : Corrélation entre les modifications transcriptomiques des cellules surexprimant STOX1 et des placentas prééclamptiques ... 118
LISTE DES TABLEAUX
Tableau 1 : Les o ple es ajeu s d histo o pati ilit MHC hu ai et u i ... 50Tableau 2 : Les principaux facteurs de risque de la prééclampsie ... 65
Tableau 3 : Les principaux ma ueu s p o es du futu d eloppe e t d u e PE ... 75
7
LISTE DES ABBREVIATIONS
Corin : atrial natriuretic peptide-converting enzyme DC(s) : cellule(s) dendritique(s) (Dendritic Cell(s)) EGF : Epidermal Growth Factor
eNOS : endothelial Nitric Oxide Synthase HLA : Human Leucocyte Antigen
IFN : interféron
IGFBP-1 : Insulin-like Growth Factor Binding Protein 1 KIR : Killer-cell immunoglobulin-like receptor
MAC : complexe d’attaque membranaire (du système du complément) MAPK : Mitogen-activated protein kinases : MEK, Erk
MHC : système majeur d’histocompatibilité MMP : métalloprotéases
NADH : Nicotinamide adenine dinucleotide phosphate NO : Oxide Nitrique
PDGF : Platelet-Derived Growth Factor PE : prééclampsie
PECAM-1 : Platelet Endothelial Cell Adhesion Molecule-1 PlGF : Placental Growth Factor
ppO2 : pression partielle en dioxygène
PTGS2 : prostaglandin-endoperoxide synthase 2 (aussi dénommée COX2) RCIU : Retard de Croissance Intra-Utérin
ROS : Reactive Oxygen Species sENG : Endogline soluble
sFLT-1 : soluble de Fms-like tyrosine kinase 1, récepteur soluble du VEGF SNP : Single Nucleotide Polymorphism
TGC(s) : cellule(s) trophoblastique(s) géante(s) TGF : Transforming Growth Factor
TLR : Toll Like Receptor
TNFα : Tumor Necrosis Factor α uNK : cellules utérines Natural Killer uPA : plasminogène de type urokinase
VCAM-1 : Vascular Cell Adhesion Molecule-1 VE-cadhérine : Vascular Endothelial-cadherin VEGF : Vascular Endothelial Growth Factor
9
11
CHAPITRE UN
L
13
I. Généralités
Le placenta est un organe transitoire d’échanges physiologiques entre un organisme et sa descendance. Le placenta existe sous des formes variées au sein des êtres vivants. Il est
retrouvé au sein de nombreux taxons, dans le règne animal et dans le règne végétal. Ainsi,
il est décrit chez les plantes à fleurs dans lesquelles il se définit comme la partie de la surface d'un carpelle sur laquelle sont insérés les ovules (Larousse.fr - Dictionnaires). Il existe
également chez certaines espèces d’invertébrés comme les scorpions et chez des vertébrés non
mammaliens tels que certaines espèces de requins (Sélaciens Pleurobranches Figure 1)
(Kaufmann, 1991).
Figure 1 : L’arbre phylogénétique des vertébrés simplifié
D’après l’institut français de l’éducation (1 : Agnathes, 2 : Chondrychtiens)
http://acces.ens-lyon.fr/evolution/logiciels/phylogene/telechargements-enseignants/arbres-de-reference
Chez les amniotes (Figure 1), il y a quatre membranes fœtales :
- l’amnios, d’origine ectodermique, entoure la cavité amniotique et protège le fœtus des chocs mécaniques ;
- le sac vitellin dérivé de l’endoderme et du mésoderme extra-embryonnaire constitue
une réserve nutritive pour l’embryon, il entoure l’œuf chez les oiseaux et chez certains
14 - l'allantoïde, d’origine endodermique, est une extension de la vessie embryonnaire, dérivant elle-même du sinus urogénital et stocke les produits d'excrétion ;
- le chorion, formé par du mésoderme extra-embryonnaire et une couche de trophoblaste, est responsable des sécrétions endocrines (Figure 2). Le chorion peut fusionner avec le sac vitellin pour former le placenta chorio-vitellin ou avec l'allantoïde pour former le placenta chorio-allantoïde, suivant les espèces de mammifères et/ou les périodes de la gestation.
Figure 2 : L’origine des tissus primitifs chez les mammifères
Adapté de Developmental Biology (Gilbert and Singer, 2010)
Le placenta chorio-vitellin est un type de placenta dans lequel les villosités choriales sont irriguées par des vaisseaux vitellins dont l’origine est la vésicule vitelline lorsqu'elle entre en contact avec le chorion. C’est le type de placenta de la plupart des marsupiaux (Figure 3). Le placenta chorio-vitellin permet non seulement des échanges nutritifs et gazeux, mais également une reconnaissance maternelle (immunitaire) au cours de la grossesse et il sécrète en outre de nombreuses hormones (Renfree, 2010; Wildman et al., 2006). Il convient de noter que le blastocyste des marsupiaux n’a pas de masse cellulaire interne, et qu’on ne connait chez ces espèces ni les signaux, ni les gènes qui vont déterminer le devenir des différentes cellules (Renfree, 2010).
15
Figure 3 : Le placenta chorio-vitellin du wallaby Macropus eugenii
Adapté de (Renfree, 2010)
Le placenta chorio-allantoïde est défini par la participation de l’allantoïde vascularisée
pour l’établissement de la circulation fœto-maternelle. La vésicule allantoïdienne est une extension de l’intestin embryonnaire. Ce placenta est caractéristique de tous les mammifères
euthériens (mais pas seulement, puisqu’il est également retrouvé chez les saurophidiens –dont les lézards et les serpents) (Ferner and Mess, 2011). En général, les placentas allantoïdiens envahissent plus profondément l'endomètre utérin.
Par la suite, nous nous intéresserons plus particulièrement aux placentas chorio-allantoïdes des mammifères euthériens. On estime l’apparition de ce type de placenta à environ 160 milliard d’années, au cours du Jurassique (Luo et al., 2011).
II. Les différents types de placenta des mammifères
euthériens
Il existe également une grande variété de formes placentaires chez les mammifères euthériens. Les différents types de placenta ont ainsi été décrits selon divers critères
morphologiques : la forme globale du placenta, l’interdigitation des tissus maternels et
fœtaux, ou encore la profondeur de l’invasion des trophoblastes au sein du tissu maternel
utérin.
Ainsi, concernant la forme globale du placenta (Figure 4), on distingue les placentas diffus (porc, cheval) offrant une très large surface d’échange ; cotylédonaires (ruminants), avec des amas indépendants ; zonaires (félins) ; discoïdes (primates, souris) en forme de disque avec une face lisse du côté fœtal et une face irrégulière du côté maternel. On peut
remarquer que dans le cas de l’espèce humaine, la face maternelle est creusée de sillons qui se croisent et délimitent des formes carrées nommées lobes placentaires (constitués d’un groupe de villosités séparés par des cloisons incomplètes), on dit que le placenta humain est
pseudo-cotylédoné (ces lobes n’étant pas indépendants les uns des autres).
Figure 4 : Forme globale des placentas des mammifères euthériens
16 La surface de contact restreinte entre la mère et l'enfant peut être augmentée par une interdigitation intense. L’interdigitation peut être plissée (porc), lamellaire, villeuse (homme), trabéculaire ou labyrinthique (souris).
Les mécanismes d'échange materno-fœtaux, tels que diffusion, transport de solutés et transport vésiculaire actif sont influencés par l'épaisseur des couches tissulaires séparant l'embryon de la mère. Cette barrière tissulaire sera d'autant plus mince que le trophoblaste pénétrera de manière invasive dans la muqueuse utérine. Elle constitue la barrière
hémato-placentaire. Il en existe 3 types histologiques : épithéliochoriale, endothéliochoriale et
hémochoriale (Figure 4).
Figure 5 : Les différents types de barrières hémato-placentaires
Adapté de La reproduction chez les mammifères et l'homme (Thibault and Levasseur, 2001)
Du côté fœtal sont invariablement présents, l'endothélium fœtal, le mésenchyme allantoïdien et le trophoblaste. Du côté maternel en revanche, la composition est variable. Soit l'épithélium utérin est intact (placenta épithéliochorial), soit seul l'endothélium des vaisseaux maternels est intact (placenta endothéliochorial), soit comme c'est le cas chez l'homme, les deux font défaut (placenta hémochorial).
Dans le placenta hémochorial, le trophoblaste est en contact direct avec le sang maternel (Aplin, 1991). Et là encore, il y a une subdivision en fonction du nombre de couches cellulaires séparant la circulation fœtale de la circulation maternelle (Figure 5). Ainsi, dans
l’espère humaine, on parle de placenta hémomonochorial car à la fin de la grossesse, il n’y a plus qu’une couche de syncytiotrophoblaste séparant les deux circulations. Chez la souris, on
dit que le placenta est hémotrichorial car trois couches de trophoblastes séparent les deux circulations.
Dans les placentas endothéliochoriaux et hémochoriaux, il y a une invasion plus marquée, avec la disparition de l’épithélium de l’endomètre maternel. L’endomètre maternel
va se modifier au niveau du site d’implantation et devenir la décidue, qui sera expulsée lors de
17 Comme les marsupiaux ont un placenta peu invasif de type épithéliochorial, on pourrait penser que le placenta chorio-allantoïdien ancestral était également de type épithéliochorial. Cependant, une étude récente basée sur la phylogénétique moléculaire et la phylogénie comparative placentaire tend à montrer que le placenta de l’ancêtre commun aux mammifères euthériens était hémochorial, de forme discoïde et avec une interdigitation de type labyrinthique (Wildman et al., 2006). Ainsi, les critères morphologiques utilisés dans la description des placentas ne correspondent pas à des critères évolutifs et différentes caractéristiques semblent être apparues de manière indépendante et répétée au cours de
l’évolution des mammifères euthériens.
III. Le développement du placenta humain
1.
De la fécondation au blastocyste
La fécondation proprement dite est l’ensemble des phénomènes qui résultent de la rencontre d’un gamète mâle (spermatozoïde) avec un gamète femelle (ovocyte II). Cette
rencontre est précédée de la différenciation cellulaire des cellules de la lignée germinale
(gamétogénèse) et d’un long cheminement des gamètes dans les voies génitales (Figure 6). Les gamétogénèses mâle et femelle ne seront pas détaillées ici mais elles ont été bien décrites dans Human Reproduction (Baggott, 1997). Il est cependant important de comprendre que,
d’une part, les spermatozoïdes subissent un ensemble de maturations dans les voies génitales mâles (épididyme, canal déférent, canal éjaculateur et urètre) puis femelles (col de l’utérus,
cavité utérine, trompes) indispensables à la réussite de la fécondation, notamment grâce à un ensemble de mécanismes nommés « capacitation ». D’autre part, au cours de chaque cycle menstruel, l’organisme maternel produit un ovule (ovocyte II ayant expulsé son premier globule polaire, entouré d’une zone pellucide séquestrant le globule polaire et de cellules du cumulus) et se prépare à recevoir un potentiel embryon sous l’effet d’un taux élevé
d’œstrogènes et une sécrétion croissante de progestérone (phases ovulatoire et lutéale). En effet, au niveau de la trompe, il y a une diminution de l’épaisseur de l’épithélium, une
activation des mouvements ciliaires, une contraction des muscles lisses ainsi qu’une accentuation de la vascularisation (ces modifications permettent de faciliter la migration de
l’œuf, s’il y a eu fécondation) ; il y a également des modifications de l’endomètre (voir partie
18 Quelques centaines spermatozoïdes seulement (sur les 100 millions éjaculés environ) arrivent à proximité de l’ovocyte ; ceux-ci doivent tout d’abord traverser les cellules du
cumulus et la zone pellucide qui entourent l’ovocyte convoité. Cette traversée peut être
réalisée grâce à la réaction acrosomique, durant laquelle les spermatozoïdes libèrent
plusieurs types d’enzymes stockées dans leurs acrosomes (situés à la tête des
spermatozoïdes) : les hyaluronidases digèrent la matrice extracellulaire (acide hyaluronique) agrégeant normalement les cellules du cumulus, et des enzymes protéolytiques (telles que
l’acrosine) fragilisent la structure de la zone pellucide. Cette réaction est accompagnée d’une
hyperactivation des spermatozoïdes qui se traduit par une plus grande motilité grâce à une
plus grande ampleur des mouvements latéraux du flagelle, facilitant ainsi leur passage. S’en
suit une étape d’adhésion/fusion, pour laquelle deux protéines sont indispensables : CD9 sur l’ovocyte et IZUMO-1 sur le spermatozoïde (Inoue et al., 2005; Ziyyat et al., 2006). Le mécanisme de fusion des membranes gamétiques reste cependant un grand mystère. Suite à la
pénétration du spermatozoïde dans l’ovocyte, une réaction corticale se produit avec une sécrétion vésiculaire importante, ayant comme résultat d’empêcher d’autres spermatozoïdes de pénétrer dans l’ovocyte (monospermie) (Ghetler et al., 1998; Sengoku et al., 1999).
L’ovocyte va alors reprendre sa méiose puis les pronoyaux mâle et femelle vont se
décondenser, se répliquer et fusionner. La première division de l’œuf peut alors se faire (environ 24h après la fusion des deux gamètes).
Figure 6 : Le trajet et la rencontre des gamètes dans les voies génitales féminines Adapté d’après Bio Web : cours de bio en ligne (Boseret, 2010)
Le zygote va alors migrer dans la trompe tout en continuant à se diviser : c’est la
segmentation. Ainsi, les 2 cellules (appelées blastomères) vont en donner 4 puis 8, 16, 32 et
au 4èmejour de développement, on atteint les 64 cellules, c’est le stade morula.
Entre le 4ème jour et le 5ème jour de développement, la zone pellucide va disparaitre et
du liquide va s’infiltrer, ce qui va créer une cavité : le blastocœle. Au 6èmejour, l’embryon est
alors au stade blastocyste. On peut alors distinguer la masse cellulaire interne qui donnera
notamment l’embryon, des cellules en périphérie qui s'organisent en épithélium, constituant le
trophectoderme (dont les cellules sont des trophoblastes). Le destin vers l’un ou l’autre de
ces types cellulaires semble être sous la dépendance de facteurs transcriptionnels, dont le
19 ont été mis en évidence dans le trophectoderme (CDX2) ou dans la masse cellulaire interne (OCT4, NANOG) au niveau messager (ARN) et protéique (Adjaye et al., 2005; Niakan and Eggan, 2012). Toutefois, leur nécessité pour cette différenciation initiale n’est pas encore clairement démontrée.
Il est important de noter que le bon déroulement de l’ensemble des étapes décrites ci-dessus, ainsi que celles de la nidation, l’implantation et la placentation (qui seront décrites plus loin) est essentiel à la reproduction et qu’une anomalie dans l’une ou l’autre de ces étapes peut être responsable d’une hypofertilité ou d’une infertilité.
2.
L’endomètre et l’accueil du blastocyste
À chaque cycle menstruel, l’endomètre se prépare à accueillir une éventuelle
grossesse. Ainsi, sous l’influence de l’œstradiol (1ère
partie du cycle), il y a une phase
proliférative puis sous l’influence de la progestérone (après l’ovulation), il y a une phase
sécrétoire (chimio-attraction de l’éventuel blastocyste). Ces modifications permettent de définir une « fenêtre d’implantation » qui dure environ 4 jours chez la femme (soit 6 à 10
jours après l’ovulation). Cette fenêtre d’implantation est finement contrôlée par l’expression
coordonnée de chimiokines, de métalloprotéases, de molécules d’adhésion, de facteurs de croissance et de cytokines pro-inflammatoires (Merviel et al., 2010).
Lorsqu’il y a eu fécondation et que le blastocyste s’appose à l’endomètre, on parle de
réaction déciduale, qui se caractérise par la transformation de l’endomètre en décidue. Cette
transformation est la somme des modifications ayant lieu à chaque cycle menstruel, et de celles induites par la présence du blastocyste, leurs spécificités (en fonction de la présence ou
de l’absence du blastocyste) n’étant pas toujours très claires. Elles sont principalement sous
contrôle hormonal : du coté meternel, le 17- -œstradiol et la progestérone, et du coté fœtal,
l’hormone chorionique gonadotrope sécrétée par le syncytiotrophoblaste, dérivé du
trophectoderme. Ces modifications semblent être également influencées par l’environnement
immunitaire, qui est fortement modifié suite à un rapport sexuel (impact du liquide séminal
et des spermatozoïdes) (Remes Lenicov et al., 2012; Robertson, 2005; Robertson et al., 2011; Sharkey et al., 2007, 2007, 2012). Par exemple, l’équipe de Sarah Robertson a démontré récemment que le plasma séminal, riche en protéines membres de la famille du TGF jouait un rôle pivot dans l’activation inflammatoire du tissu utérin. De plus, une série
20 de travaux au cours des dix dernières années montre que l’activation inflammatoire de
l’utérus (provoquée suite à une blessure au niveau de l’endomètre, par exemple) joue un rôle prépondérant dans la réussite de l’implantation (revue par Almog et al., 2010; Dekel et al., 2010; Gnainsky et al., 2010; Huang et al., 2011; Kalma et al., 2009). A noter que le TGF est un acteur essentiel de la transformation des cellules T naïves en cellules T régulatrices (Jhunjhunwala et al., 2012; Zhang et al., 2010).
Au niveau de l’endomètre, on observe différentes modifications : les vaisseaux de l’endomètre deviennent congestifs et dilatés, les glandes endométriales se développent (avec
une sécrétion riche en glycogène et en mucus) et la paroi utérine devient localement
œdémateuse. Il y a également une augmentation de la vascularisation locale, avec une
spiralisation des vaisseaux. La matrice extracellulaire endométriale subit également des
modifications qui concourent à la rendre plus perméable à l’invasion trophoblastique
(hydratation, changement de type de collagène, apparition de protéoglycanes).
Pendant la fenêtre d’implantation, les intégrines α1 1 (récepteur au collagène), α5 1 (récepteur à la fibronectine) et αV γ (récepteur à la vitronectine) sont toutes les trois
exprimées sur l’épithélium de l’endomètre. D’après des expériences in vitro, le blastocyste stimule l’expression de αV γ via l’interleukine IL-1 (Lessey et al., 1996; Simón et al.,
2000). Ces cellules épithéliales expriment également de façon importante la mucine MUC-1,
une glycoprotéine qui aurait un rôle inhibant l’adhésion et serait d’après des expériences in vitro induite lors de l’apposition du blastocyste ; celui-ci serait alors capable d’inhiber
MUC-1, on le dit ainsi compétent (Meseguer et al., 2001). Ces protéines interviennent dans le
contrôle de l’adhésion, de la migration et de l’invasion au cours de l’implantation et de la
placentation (Staun-Ram and Shalev, 2005).
La sécrétion de protéines par l’épithélium glandulaire, comme la glycodéline, participe notamment à la tolérance (Scholz et al., 2008; Soni and Karande, 2010). Les cellules stromales vont augmenter en taille et se différencier en volumineuses cellules déciduales. Elles produisent alors un grand nombre de facteurs de croissance et de régulateurs de ces facteurs : notamment l’Epidermal Growth Factor (EGF), le Fibroblast Growth Factor (FGF), le Transforming Growth Factor (TGF- ) et l’Insulin-like Growth Factor Binding Proteins 1 (IGFBP-1). Elles sécrètent également des hormones telles que la prolactine et la rénine (Healy, 1991). L’ensemble de ces sécrétions participe à la prolifération
21
Pendant la fenêtre d’implantation, le tissu endométrial subit également une infiltration
lymphoïde (macrophages, lymphocytes, cellules NK, basophiles). Une régulation des cellules
Natural Killer utérines (uNK) semble être essentielle à l’implantation, puisqu’un défaut ou
un excès en uNK a été observé chez des patientes avec un échec d’implantation suite à une fécondation in vitro (FIV) (Sifer and Poncelet, 2011). Leurs recrutements dépendent notamment de la prolactine sécrétée par les cellules décidualisées (Carlino et al., 2008). Ces
cellules de l’immunité sécrètent des cytokines qui jouent un rôle primordial dans la tolérance immunitaire de la grossesse, l’implantation et le contrôle de l’invasion profonde (décrite à la
partie III-5) (Eastabrook et al., 2008).
3.
L’implantation et la mise en place des villosités choriales
Après l’apposition du blastocyste (Figure 7, a) sur l’endomètre maternel, qui a lieu environ 6 jours après la fécondation dans l’espèce humaine, le trophoblaste prolifère et se différencie en deux types cellulaires : le syncytiotrophoblaste primitif en périphérie formant une couche multinucléée sans limites cellulaires distinctes (syncytium) et le cytotrophoblaste sous-jacent, composé de cellules mononucléées, dont la fusion alimente le syncytiotrophoblaste. Cette fusion est favorisée notamment par l’expression d’ERVWE1, un
gène issu d’un rétrovirus endogène codant pour la Syncytin 1, une glycoprotéine membranaire
(Cáceres and Thomas, 2006), dont l’interaction avec la connexine 4γ conditionne la fusion
(Dunk et al., 2012). Aux environs de 7-8 jours, ce syncytiotrophoblaste primitif s’infiltre entre les cellules épithéliales de la muqueuse utérine : c’est l’implantation (Figure 7, b). Cette implantation est de type interstitiel, le complexe embryonnaire pénétrant entièrement dans le tissu conjonctif maternel hautement vascularisé. Le syncytiotrophoblaste prolifère rapidement, en synthétisant des enzymes protéolytiques qui lysent les tissus endométriaux, ce qui permet la pénétration de l’ensemble du blastocyste dans l’épaisseur de l’endomètre (Figure 7, c). Cette lyse de l’endomètre va engendrer une réaction inflammatoire locale, ce
qui va déclencher la réaction déciduale (décrite dans le paragraphe III-2).
Figure 7 : Le développement précoce chez l’humain
22
Au cours de la première semaine, l’embryon se nourrit par simple diffusion. Mais par
la suite, sa croissance reposera sur la performance de la circulation utéro-placentaire, dont la mise en place débute à partir de 9 jours. Cette circulation repose sur l’unité structurale et
fonctionnelle du placenta : la villosité choriale. Tout d’abord, des lacunes trophoblastiques
commencent à se former au sein du syncytiotrophoblaste grâce à la confluence de vacuoles extra-cytoplasmiques : c’est le stade lacunaire (Figure 7, c). Entre 10 et 12 jours, les lacunes
trophoblastiques vont former des réseaux intercommunicants qui forment l’ébauche des
espaces intervilleux du placenta. Le syncytiotrophoblaste érode les capillaires du stroma maternel, ce qui permet une infiltration de ce réseau lacunaire (Figure 7, c). Cela crée une
circulation utéro-placentaire primitive (il est important de noter qu’il s’agit de la
circulation d’un infiltrat sans hématies maternelles, ce qui sera détaillé plus loin). Cette microcirculation permet notamment le passage de l’hormone Chorionique Gonadotrope
(hCG) sécrétée par le syncytiotrophoblaste vers la circulation sanguine maternelle. La
sécrétion d’hCG est aussi utilisée pour détecter la grossesse grâce à une prise de sang ou un
test urinaire.
Vers 13-14 jours, le cytotrophoblaste va s’infiltrer dans les travées du syncytiotrophoblaste, formant les villosités primaires (Figure 8, a) (Castellucci et al.,
1990). Du mésenchyme allantoïdien dérivé du mésoderme extra-embryonnaire extra
cœlomique (Figure 7, d) va ensuite s’infiltrer dans ces villosités, qui deviennent alors
secondaires (Figure 8, b). Au sein de ce mésenchyme, vers 17-19 jours, des angioblastes se différencient en tissu conjonctif mésenchymateux et en îlots vasculo-sanguins primitifs, sous
l’effet du VEGF (Vascular Endothelial Growth Factor), du PlGF (Placental Growth Factor) et
de l’angiopoïétine sécrétés par les cytotrophoblastes (Zhou et al., 2003). Ces sécrétions sont
dépendantes de l’état physiologique hypoxique (ppOβ ≈ γ%) des villosités à ce stade (Burton et al., 2009). Ces processus de vasculogénèse et d’angiogénèse donnent naissance aux premiers capillaires et aux premières cellules sanguines fœtales (érythroblastes) au sein de
l’axe mésenchymateux nouvellement formé. Peu après, les vaisseaux sanguins s’anastomosent avec les vaisseaux ombilicaux de l’embryon. Les villosités contenant des
vaisseaux sanguins différenciés sont appelées villosités tertiaires (Figure 8, c). Les cytotrophoblastes situés au sommet des villosités proliférèrent et referment les chambres
23 syncytiotrophoblaste de la muqueuse utérine. Au cours de ce développement villositaire, il y a une importante ramification et deux types de villosités choriales se forment : les villosités
flottantes, qui flottent dans la chambre intervilleuse, et les villosités crampons, qui sont
ancrées sur la caduque inter-utéro-placentaire (Figure 9, a).
Figure 8 : Le développement des villosités choriales
Adapté d’après Embryologie Humaine – Le site (Rabineau et al., 2004)
Ainsi, vers la fin de la 3ème semaine de grossesse, les villosités placentaires sont
fonctionnelles. Elles sont constituées de leur axe de tissu conjonctif contenant les cellules
mésenchymateuses et les vaisseaux embryonnaires. Cet axe est entouré par une couche interne de cytotrophoblastes villeux prolifératifs et d’une couche externe de syncytiotrophoblaste
proliférant peu. La barrière placentaire est alors constituée de quatre couches tissulaires :
l'endothélium capillaire des villosités, le tissu conjonctif lâche qui en occupe l'axe, les cytotrophoblastes villeux et le syncytiotrophoblaste (Figure 9, b : coupe de villosité choriale au 1er trimestre). Le système permettant la circulation utéro-placentaire proprement dite est ainsi mis en place (mais ne sera réellement effectif qu’à 1β semaines).
Figure 9 : Les villosités choriales au 1er trimestre de grossesse Adapté d’après Embryologie Humaine – Le site (Rabineau et al., 2004)
4.
L’invasion profonde (de la 3
èmeà la 12
èmesemaine de grossesse)
Certaines cellules cytotrophoblastiques ne font pas strictement partie de l’arbre villositaire, ce sont les cytotrophoblastes extravilleux (CEV, Figure 10, a), ainsi retrouvés au sommet des villosités crampons (coques cytotrophoblastiques accolées à la muqueuse utérine), dans la décidue ou encore dans la paroi des vaisseaux maternels. Au sommet des villosités crampons, les CEV sont prolifératifs et groupés en colonne. Certains CEV vont
progressivement perdre leur caractère prolifératif et migrer pour envahir l’endomètre maternel
en interagissant avec les cellules déciduales et les cellules immunocompétentes intra-déciduales, telles que les cellules uNK. Ces interactions semblent jouer un rôle clé dans
24
l’immunotolérance de l’hémi-allogreffe que constitue le fœtus (voir partie V-3). Les CEV
migrent également dans la décidue et dans le premier tiers du myomètre, produisant ainsi une
invasion particulièrement profonde. Ces CEV sont dits CEV interstitiels. Certains de ces
CEV vont persister dans la paroi utérine et terminer leur migration en se différenciant en
cellules géantes bi- ou tri-nucléées, dont le rôle demeure mystérieux. Ces cellules géantes
libéreraient des vasodilatateurs (notamment oxyde nitrique, NO, et monoxyde de carbone, CO), agissant sur les artères utérines spiralées (Lyall, 2003, 2005). D’autres CEV migrent plus spécifiquement au niveau des artérioles maternelles et forment des bouchons
intraluminaux (Figure 10, a), ce qui créé une obstruction de la lumière artérielle. Il en
résulte l’absence d’hématies maternelles dans la chambre intervilleuse jusqu’à la 10ème
semaine de grossesse (la chambre intervilleuse contient alors un infiltrat sans élément figuré sanguin). Cet environnement hypoxique (environ 3% de pression partielle en Oxygène, ppO2) est considéré comme physiologique (Carbillon et al., 2001; James et al., 2006). Cette hypoxie est probablement nécessaire pour deux raisons principales : 1) limiter l’afflux
d’oxygène vers l’embryon qui n’a pas encore synthétisé la machinerie permettant la
destruction des radicaux libres de l’oxygène pour ainsi le protéger des effets tératogènes de
ces radicaux libres pendant la phase d’organogénèse ; et 2) permettre la prolifération rapide des cellules trophoblastiques dont les divisions sont induites dans une situation d’hypoxie
(Mondon et al., 2005).
Figure 10 : Les cytotrophoblastes extravilleux (CEV)
Adapté d’après (Alsat et al., 1999)
Cependant le maintien de cette hypoxie physiologique conduit à la désagrégation progressive des bouchons, et permet une augmentation progressive de la ppO2 jusqu’à environ 10-12% à la fin du 1er trimestre de la grossesse (Rodesch et al., 1992). Cette augmentation va constituer un signal de différentiation qui va rendre les CEV interstitiels et ceux des bouchons invasifs. Les CEV invasifs vont ainsi migrer de façon spécifique vers les parois des artères spiralées utérines qu’ils vont envahir par voie endo- et péri-vasculaire. Les CEV vont ensuite progressivement se substituer aux cellules endothéliales maternelles (Figure 10, b) pour se différencier en CEV endovasculaires avec des caractéristiques de cellules endothéliales (Aplin, 1991; Damsky and Fisher, 1998). Ceci se fait notamment grâce à une apoptose des cellules endothéliales induites par les CEV via des interaction
25 Fas/FasL (Ashton et al., 2005). Au cours de cette invasion, on observe également la disparition totale de la tunique musculaire lisse qui est remplacée par une paroi fibreuse atone insensible aux molécules vasoactives. Ce n’est qu’à partir de 12 semaines post-fécondation, que la circulation utéro-placentaire devient réellement fonctionnelle grâce à la dissolution des bouchons luminaux (Figure 10, b). Elle constitue alors un système d'échange très performant et une mise en contact intime (3 couches cellulaires : l’endothélium embryonnaire, les cytotrophoblastes et le syncytiotrophoblaste) des circulations sanguines maternelle et
fœtale.
Ainsi, les artères spiralées utérines perdent leurs capacités constrictrices caractéristiques, assurant un flux sanguin régulier et abondant, fondamental à la croissance
fœtale. Cette invasion très profonde, jusqu’au premier tiers du myomètre est spécifique de
l’espèce humaine, et pourrait être lié aux besoins particulièrement importants de la
croissance cérébrale du fœtus, qui drainent environ 50% des besoins en oxygène contre
environ 20% dans les autres espèces de mammifères (Robillard et al., 2002).
5.
Le contrôle de l’invasion profonde
L’invasion profonde par les trophoblastes extravilleux, essentielle à la croissance fœtale et donc à la grossesse, est finement contrôlée par différents mécanismes : une
régulation spatio-temporelle des molécules d’adhésion et des métalloprotéases, et une
régulation par la tension en oxygène. C’est sans doute le bon fonctionnement de ces régulations qui font de l’invasion cytotrophoblastique un exemple unique d’invasion
« pseudotumorale » contrôlée. Une comparaison de ce contexte et du contexte tumoral permettrait sans doute de déterminer certains des mécanismes menant à une invasion incontrôlée (pour revue, voir Louwen et al., 2012).
La différenciation progressive des cytotrophoblastes extravilleux (CEV) en cellules à phénotype invasif semble dépendante de la régulation spatio-temporelle des molécules
d'adhérence qu’ils expriment (Harris et al., 2009a), telles que les intégrines (qui participent à l'adhésion entre les cellules et les constituants de la matrice extra-cellulaire), les cadhérines, les immunoglobulines-like et les sélectines. En effet, au cours de l’invasion de la décidue et
de ses vaisseaux, la différenciation des CEV et l’acquisition de différents phénotypes
26 marqueurs cytologiques spécifiques (Figure 11). Le rôle primordial des intégrines de surface exprimées par les CEV au cours de leur migration est bien établi (Damsky et al., 1994). Ainsi, les cellules prolifératives expriment les intégrines formées par les chaînes α6 4 qui n'interagissent pas avec la muqueuse utérine alors qu’en revanche, les cellules interstitielles
expriment les intégrines α5 1 capables d’interagir avec cette muqueuse. Les CEV
endovasculaires expriment des molécules d'adhésion de type vasculaire au contact du sang maternel telles que VCAM-1 (vascular cell adhesion molecule-1), PECAM-1 (platelet endothelial cell adhesion molecule-1) ou la VE-cadhérine (vascular endothelial-cadherin) comme d'authentiques cellules endothéliales (Zhou et al., 1997a). Les CEV changent également de récepteurs de surface au cours de leur migration et de l’évolution de leur
phénotype. Par exemple, les CEV perdent leurs récepteurs à l’EGF au profit du récepteur à l’oncogène c-erbB2 à des stades plus invasifs (Jokhi et al., 1994). Au cours de la migration des CEV, la décidue est un partenaire indispensable, et lors de la réaction déciduale, des modifications essentielles de la matrice extracellulaire de l’endomètre ont lieu (voir partie III-2). La décidue intervient alors pour guider les CEV par des mécanismes de reconnaissance cellule-matrice et produit un certain nombre de facteurs diffusibles qui vont moduler cette invasion, tels que le facteur de croissance EGF ou le régulateur du facteur de croissance IGF-1, l’IGFBP-1. Ce dernier peut interagir avec les CEV interstitiels grâce aux intégrines α5 1
(Jones et al., 1993).
Figure 11 : Les molécules d’adhésions exprimées par les trophoblastes à l’interface
fœto-maternelle
27 Afin de progresser au sein de la décidue, les cytotrophoblastes sécrètent des enzymes protéolytiques qui solubilisent la matrice maternelle, et la rendent ainsi plus perméable.
L’efficacité de l'invasion dépend donc de la capacité des CEV à sécréter ces facteurs (Cohen and Bischof, 2007). Il s'agit notamment des métalloprotéases matricielles (MMP) de type collagénases et gélatinases et des activateurs du plasminogène de type uPA (urokinase plasminogen activator) et t-PA (tissue plasminogen activator) (Multhaupt et al., 1994; Polette et al., 1994). Les CEV synthétisent également des inhibiteurs spécifiques de ces protéases, respectivement les TIMP (tissue inhibitors of metalloproteases), PAI-1 (Plasminogen Activator Inhibitor-1 ou SERPINE1) et PAI-2 (Plasminogen Activator Inhibitor-2 ou SERPINB2), permettant une autorégulation du système et empêchant une protéolyse excessive (Eastabrook et al., 2008; Graham and Lala, 1991; Huppertz et al., 1998). Le type de MMP synthétisées et activées par les CEV est différent suivant le stade de différenciation des CEV au sein de la décidue. Ainsi, la MMP-9 (gélatinase B) remplace progressivement la MMP-2 (gélatinase A) à des étapes plus invasives. Parallèlement, les CEV interagissent avec les diverses cellules intra-déciduales (cellules épithéliales, fibroblastes, macrophages, lymphocytes et uNK) ce qui participe à la migration des CEV, notamment du fait de la sécrétion de facteurs de croissance et de cytokines. De ce point de vue, les cellules immunitaires maternelles jouent un rôle majeur. Ces facteurs solubles, stimulant ou inhibant
l’invasion, agissent notamment en régulant la synthèse des protéines matricielles, des
protéases et de leurs inhibiteurs (Eastabrook et al., 2008). Des cytokines au sein de
l’utérus jouent également un rôle dans la régulation de l’expression des MMP et de leurs
inhibiteurs tissulaires (TIMPs). Par exemple, le TNFα régule l’expression de MMP-9
(Bischof, 2001), l’IL-1 régule positivement les MMP-2, MMP-9 et uPA, alors que le
TGF-1 régule positivement les inhibiteurs TIMP-TGF-1 et -2, PAI-TGF-1 et -2 (Karmakar and Das, 2002). Il a également été montré in vitro que des facteurs dérivés de cellules stromales déciduales augmentaient les capacités invasives de lignées cellulaires trophoblastiques et altéraient
l’expression d’intégrines, de MMP et de TIMPs (Godbole et al., 2011).
La migration trophoblastique et la différenciation des CEV sont également modulées par la tension en oxygène dans l’environnement cellulaire. L’analyse des modalités de
l’arrivée du sang maternel a mis en évidence une hypoxie physiologique s’interrompant en
fin de premier trimestre. Avant 10 semaines, l’observation de coupes de placenta montre du
plasma dépourvu d’hématies circulant dans l’espace intervilleux. Cette situation induit
28 déclencher la transcription cellulaire des gènes régulés par l’hypoxie. Au-delà de 10 semaines,
le sang circule dans l’espace intervilleux, et sa ppO2 ainsi que celle des tissus déciduaux s’élève (ppO2 à environ 10-12%). Cette élévation est probablement en rapport avec la présence d’hémoglobine et l’augmentation du débit sanguin. L’ouverture des artères
utéro-placentaires, en augmentant la ppO2 dans l’espace intervilleux, semble intervenir dans les
processus de différenciation des CEV et l’acquisition de leurs caractéristiques phénotypiques (molécules de surfaces, MMP exprimées, etc.). Vraisemblablement, en condition hypoxique
(avant 10 semaines de grossesse), c’est le phénotype non invasif qui s’exprime et les CEV
prolifèrent. Après 10 semaines, en présence d’une ppO2 plus élevée, les CEV cessent de
proliférer et acquièrent un phénotype invasif. En effet, des travaux montrent que des explants
de villosités crampons extraites à 8 semaines d’aménorrhées, cultivés en présence de 2 %
d’O2 (hypoxie), développent des excroissances produites par la prolifération du
cytotrophoblaste. À l’inverse, en présence de β0 % d’O2 (hyperoxie), ces excroissances n’apparaissent pas et la prolifération cellulaire cesse. De même, in vitro, des travaux montrent
que le profil des molécules d’adhésion exprimées par le trophoblaste est influencé par l’oxygène (Genbacev et al., 1992, 1997; Mondon et al., 2005). L’oxygène apparaît ainsi
comme un facteur clé dans le mécanisme de la placentation en raison du contrôle qu’il exerce
sur la transcription de certains gènes.
Ce contrôle s’effectue grâce à des molécules sensibles à la ppO2. Plusieurs facteurs de transcription inductibles par l’hypoxie, HIF-1, -2 et -3 (Hypoxia Inducible Factor -1,-2-3) ont été mis en évidence. Dans le cas d’HIF-1, la sous-unité HIF-1α est stabilisée en hypoxie
et, après sa translocation dans le noyau, elle forme un hétérodimère avec la sous-unité HIF-1 (également appelé ARNT, Aryl Hydrocarbon Receptor Nuclear Translocator). La liaison du dimère HIF-1 à une séquence régulatrice HRE (Hypoxia Response Element) de l’ADN avec
d’autres cofacteurs, induit la transcription des gènes sensibles à l’hypoxie. En revanche,
dans un contexte normoxique, les prolyl-hydroxylases (PHD) sont activées et vont hydroxyler les prolines du domaine carboxy-terminal d’HIF1α dès sa sortie du noyau (Lee et al., 2004). La forme hydroxylée fixe alors le facteur suppresseur de tumeur de von Hippel-Lindau (pVHL), qui participe à la formation d’un complexe ayant une activité Eγ-ubiquitine-ligase (Cockman et al., 2000). L’HIF-1α se lie alors à des ubiquitines et est dégradé par le
29
Figure 12 : La régulation dépendante de l’oxygène via HIF1 Adapté d’après (Carroll and Ashcroft, 2005)
6.
Le placenta de la 4
èmesemaine au terme
Au début de la grossesse, les villosités se sont développées dans toutes les directions, en formant la sphère choriale. Au sein de cette sphère, les villosités choriales tertiaires se ramifient à partir de la 4ème semaine (Figure 12, a) et dans chaque arborescence, une différenciation vasculaire a lieu et une unité vasculaire se forme (Figure 12, b). L’axe vasculaire est alors constitué d’une veine centrale (vaisseau efférent) et de deux artérioles
para-centrales (vaisseaux afférents) reliés entre elles par un réseau capillaire sous trophoblastique. Ce système vasculaire est lui-même relié aux vaisseaux ombilicaux.
Figure 13 : La circulation materno-fœtale au cours de la grossesse Adapté d’après Embryologie Humaine – Le site (Rabineau et al., 2004)
À partir de la fin du deuxième mois, les villosités choriales orientées vers la cavité utérine vont progressivement dégénérer et cela formera le chorion lisse (couche avasculaire
constituée d’une seule couche de cytotrophoblaste et de mésenchyme extra-embryonnaire). À l’opposé, les villosités faisant face à la paroi utérine continuent à se développer et forment le
placenta discoïde typique de l’espèce humaine à la fin du 3ème mois (Figure 14). Au cours du 4ème mois, les cytotrophoblastes villeux cessent de proliférer et disparaissent des villosités pour ne subsister que sous la forme de quelques amas de cellules isolées sous le syncytiotrophoblaste (Figure 13, c). Le sang maternel n’est alors séparé des vaisseaux fœtaux
que par une couche trophoblastique (le syncytiotrophoblaste) : le placenta hémomonochorial
est formé. La coque trophoblastique fait, quant à elle, place à du tissu conjonctif. Des
cytotrophoblastes confluent alors entre les chambres intervilleuses et constituent les septa inter-cotylédonaires qui délimitent les cotylédons apparents sur la face maternelle du placenta observables lors de la délivrance.
Figure 14 : Le placenta à la fin du 3ème mois
30 À la fin de la grossesse, le placenta humain mesure environ 20 cm de diamètre et 3 cm d’épaisseur, il pèse environ 500 g. L’ensemble des villosités représente une surface de 10 à 14 m2 et contient un réseau sanguin capillaire de 50 km. Il y a environ 2 à 6 µm entre le
sang fœtal et le sang maternel. Le débit sanguin maternel est évalué à 500 mL par minute dans
le placenta.
IV. Le développement du placenta murin
La souris est indubitablement le modèle animal mammifère le plus utilisé, initialement de par sa petite taille, sa gestation relativement courte (19 jours environ) et la taille de ses portées (4 à 12 petits). Dès le début du 20ème siècle, on en réalise ainsi l’élevage et différentes lignées sont établies au milieu du siècle (avec un fond génétique stable) (Nagy,
2003). Les études du développement précoce chez la souris commencent également vers les
années 1950 avec les premières cultures de blastocystes in vitro (Hammond, 1949; Whitten, 1956), alors qu’elles étaient auparavant plutôt effectuées chez le lapin (gamètes de taille
supérieure). De plus, avec la mise au point de la transgénèse (Gordon and Ruddle, 1981; Gordon et al., 1980), de l’invalidation de gène (Hooper et al., 1987; Kuehn et al., 1987)
dans les années 1980, et la disponibilité (publique) de la séquence et de l’assemblage du génome murin en 2001 (Lindblad-Toh et al., 2001), la souris est de loin l’outil le plus
puissant pour déterminer le rôle fonctionnel de gènes du développement en situation physiologique ou physiopathologique.
1. De la fécondation au blastocyste : le développement préimplantatoire
Chez la souris, l’accouplement se fait normalement au cours de la nuit alors que la femelle est en œstrus (le cycle œstral dure environ 4 à 5 jours). Environ 50 millions de
spermatozoïdes sont éjaculés, mais seuls 100 à 200 atteindront les ampoules des oviductes où sont les ovocytes (8 à 12 à chaque cycle). Les spermatozoïdes arrivés à proximité des ovocytes doivent tout d’abord traverser les cellules du cumulus et la zone pellucide qui entourent ces ovocytes, comme c’est le cas dans l’espèce humaine. De même que chez
31
accompagnée d’une hyperactivation des spermatozoïdes. Une fois cette traversée effectuée,
des échanges entre les gamètes via la trogocytose ou des structures vésiculaires (exosome-like) ont été décrits (Barraud-Lange et al., 2007; Miyado et al., 2008). Cependant, le rôle
de ces échanges n’a pas encore été déterminé. S’en suit une étape d’adhésion/fusion, pour laquelle, comme chez l’homme, les deux protéines Cd9 et Izumo-1 sont indispensables (Inoue et al., 2005; Kaji et al., 2000; Miyado et al., 2000; Le Naour et al., 2000).De nombreuses protéines ont été décrites comme augmentant l’efficacité de l’adhésion/fusion (ADAMs, intégrines, Crisp, GPI-APs…), cependant les mécanismes précis contrôlant ces étapes restent à découvrir. Une réaction corticale se produit également après la pénétration d’un spermatozoïde (responsable de la monospermie) (Burkart et al., 2012). L’ovocyte va alors
reprendre sa méiose puis les pronoyaux mâle et femelle vont se décondenser, se répliquer et fusionner. Chez la souris, plusieurs ovocytes sont expulsés à chaque cycle mais ni ces ovulations ni les fécondations qui vont s’en suivre ne sont synchrones. Ainsi, le 1er clivage des différents ovocytes fécondés se fait au cours de plusieurs heures, environ 24h après la fusion des deux gamètes. On parle alors du développement préimplantatoire.
Il faut noter qu’il existe beaucoup d’études sur le développement préimplantatoire, principalement réalisées dans des conditions de cultures in vitro (Figure 15), et notamment des études transcriptomiques à haut débit (Hamatani et al., 2004; Wang et al., 2004; Zeng et al., 2004).
Figure 15 : Le développement préimplantatoire murin in vitro Adapté d’après (Valley et al., 2010)
Chez la souris, suite à l’accouplement, un bouchon muqueux se forme à la sortie du
vagin, qui permet de déterminer le début de la gestation (E0,5 pour « Embyonic day » le jour où ce bouchon est observé, soit environ 12h après la fécondation). In vivo, le zygote va migrer
au sein de l’oviducte pendant environ γ jours (Figure 16) tout en continuant à se diviser :
c’est la segmentation. Au stade 8 cellules, l’embryon se compacte : l’adhésion entre les cellules se fait plus marquée et les cellules s’aplatissent. La cadhérine E a été montrée
comme essentielle pour ce phénomène (De Vries et al., 2004). Les cellules deviennent alors
polarisées, avec un domaine apical dirigé vers l’extérieur de l’embryon (Cockburn and Rossant, 2010). Les divisions suivantes seront soit symétriques (si le plan de division se trouve sur un rayon de la sphère formé par l’embryon), soit asymétriques (si le plan de