HAL Id: tel-01690672
https://tel.archives-ouvertes.fr/tel-01690672
Submitted on 23 Jan 2018HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Maxime Jacquot
To cite this version:
Maxime Jacquot. Biodiversité et fonctionnement écologique des agroécosystèmes à base de man-guiers à La Réunion. Biodiversité et Ecologie. Université de la Réunion, 2016. Français. �NNT : 2016LARE0036�. �tel-01690672�
UMR Peuplements Végétaux et Bioagresseurs en Milieu tropical Cirad - Université de La Réunion
thèse
Présentée parMaxime JACQUOT
Pour obtenir le diplôme de
doctorat en sciences
Discipline : Biologie des populations et écologie
Biodiversité et fonctionnement écologique
des agroécosystèmes à base de manguiers
à La Réunion
Soutenue publiquement le 17 novembre 2016 devant le jury composé de :
Jean-Noël AUBERTOT Directeur de recherche, INRA Toulouse Rapporteur Sabrina GABA Chargée de recherche HDR, INRA Dijon Rapporteure Sergine PONSARD Professeur, Université de Toulouse 3 Rapporteure Dominique STRASBERG Professeur, Université de La Réunion Examinateur Jean-Philippe DEGUINE Chercheur HDR, CIRAD Réunion Directeur de thèse Philippe TIXIER Chercheur HDR, CIRAD Montpellier Membre invité
La réalisation de ce travail a été permis grâce aux contributions de nombreuses personnes. Tout d’abord, je tiens à remercier mon directeur de thèse, Jean-Philippe Deguine, et mon co-directeur de thèse, Philippe Tixier. Je remercie Jean-Philippe de m’avoir permis de réaliser cette thèse et de m’avoir donné les moyens de la réaliser, merci pour son encadrement et en particulier pour m’avoir énormément appris sur l’écriture, merci de m’avoir donner l’opportunité d’être formateur et de participer aux ouvrages de vulgarisation et de transfert. Je remercie Philippe pour avoir partagé son expérience dès la conception de la thèse, merci pour son encadrement et sa disponibilité, malgré les milliers de kilomètre nous séparant. Merci à vous deux pour votre sympathie.
Je tiens à remercier les membres du jury, Jean-Noël Aubertot, Sabrina Gaba, Sergine Ponsard et Dominique Strasberg, pour avoir accepté d’évaluer ce travail.
Je remercie mes co-encadrants et les membres du comité de thèse pour leurs conseils avisés et l’orientation qu’ils ont donné à ce travail ; merci à : Pierre-François Duyck, Claire Lavigne, François Massol, Jean-Pierre Sarthou et Muriel Valantin-Morison.
Je tiens à remercier les nombreux membres de l’équipe qui ont contribué à ce travail et pour le plaisir d’avoir travaillé à leurs côtés. Je remercie Morguen Atiama, Cédric Ajaguin Soleyen, Marie-Ludders Moutoussamy et Tristan Schmitt pour leurs aides dans les (très) nombreuses activités réalisées depuis mon arrivée au CIRAD. Je remercie Carla Baltzer, Justin Collard et Ségolène Plessix pour leur aide précieuse dans les échantillonnages et les tris des échantillons. Je remercie mes collègues VSC entomologistes pour leur motivation, leur investissement et le travail conséquent que nous avons réalisé pour déterminer ces dizaines de milliers d’arthropodes. Ce fut un plaisir de travailler avec vous, merci à Brice Derepas, David Muru, Mickaël Tenailleau. Je remercie Frédéric Chiroleu pour m’avoir initié et aidé dans l’utilisation de R et pour son appui en statistique. Merci également aux « Frédettes » : Charlotte Giraud-Carrier, Sandrine Le Squin et Agathe Allibert, pour leur
aide.
Je tiens à remercier mes collaborateurs. Je remercie les entomologistes et les arach-nologues pour leurs formations et leurs aides dans l’identification des arthropodes, merci à : Grégory Casanove, Gérard Delvare, Antoine Franck, Sophie Gasnier, Jean-Claude Ledoux, Olivier Levoux, Bruno Michel, Franck Noël, Jacques Poussereau, Serge Quilici, Jacques Rochat, Pascal Rousse, Joëlle Sadeyen et Jean-Claude Streito. Je remercie Olivier Flores pour m’avoir initié au bayésien et pour son aide indispensable pour les analyses et la rédaction de mon premier article. Je remercie François Massol pour avoir travaillé activement à mes côtés et pour la grande disponibilité qu’il a montrée lors des analyses. Je remercie Cyril Jourda pour m’avoir appris à utiliser le cluster de calcul.
Je tiens à remercier l’ensemble des membres du projet Biophyto, les partenaires et les agriculteurs pour leur aide et tout simplement pour le plaisir que cela a été de travailler
et Stéphane Poussier, pour m’avoir accueilli au sein de l’unité. Je tiens à remercier l’ensemble des collègues du Pôle de Protection des Plantes pour leur accueil et pour leur sympathie, ainsi que pour les moments que nous avons partagés aux pauses café et déjeuner, et à l’extérieur du 3P ; merci à Abir, Adrien, Alassane, Cathleen, Chantal, Christophe, Cynthia, David, Enric, Florent, Hélène, Hugo, Issa, Jean-Mi, Jean-Pierre, Jim, Johanna, Magalie, Martial, Micheline, Océane, Samuel, Serge, Sylvain, Vincent, et bien d’autres...
Je tiens à remercier les naturalistes qui m’ont énormément appris depuis mon enfance. Je remercie en particulier les membres de la Société d’Etude du Milieu Naturel en Mâconnais d’avoir partagé leurs savoirs et leurs passions. Ce travail n’aurait pas été permis sans eux.
Je tiens à remercier ma famille et mes amis pour leur soutient tout au long de ce projet. Je tiens à remercier mes amis pour les bons moments que l’on a partagé ici ou ailleurs ; merci à Brice, David D., David M., Coline et Emeric, Alicia et Mathieu, Laura et Gwen, Jocelyn, Jane-Lore, Solène, Caro et Pierre, Guillaume...
Merci à mes parents, mon frère et mes grands-parents pour m’avoir toujours encouragé dans mes passions et mes objectifs, merci de m’avoir accompagné, mille merci pour tout ! ! ! Enfin, je tiens à adresser d’énormes remerciements à Sylvia pour m’avoir accompagné, soutenu et encouragé tout au long de la thèse, malgré la réalisation de sa propre thèse, merci pour m’avoir donné un équilibre indispensable.
Ce travail de thèse a été financé par une bourse de thèse octroyée par le CIRAD, les activités relatives à la thèse ont été financées par l’Union Européenne (FEDER, FEADER), Le Ministère de l’Agriculture, de l’agroalimentaire et de la forêt (projet CASDAR « Biophyto », projet ECOPHYTO « Rescam »), par la Région Réunion, le Conseil départemental de La Réunion et le CIRAD. Je tiens à remercier l’ensemble des financeurs pour m’avoir permis de réaliser ce travail. Je remercie, tout particulièrement, le CIRAD qui, outre les financements de la bourse de thèse et de mes activités, a financé ma participation à des congrès internationaux et des formations.
Liste des figures . . . 5
Liste des tableaux . . . 7
Liste des publications . . . 8
Introduction générale 11 1 Contexte et enjeux . . . 11
1.1 La biodiversité dans les communautés . . . 12
1.2 La biodiversité dans les agroécosystèmes . . . 15
1.3 Enjeux scientifiques de l’étude de la biodiversité dans le fonctionnement écologique des agroécosystèmes . . . 16
2 Modèle d’étude : les agroécosystèmes à base de manguiers à La Réunion . . . 17
2.1 La culture du manguier à La Réunion . . . 17
2.2 Les insectes nuisibles aux inflorescences . . . 19
La Cécidomyie des fleurs . . . 19
La Punaise du manguier . . . 19
Les Thrips . . . 21
La Cochenille des Seychelles . . . 21
La lutte chimique dans une impasse . . . 22
3 Objectifs et démarche scientifique . . . 22
1 Biodiversité et fonctionnement écologique des écosystèmes pour la ré-gulation naturelle des insectes nuisibles des cultures 27 Introduction . . . 27
1.1 Mechanisms involved in the relationship between biodiversity and ecosystem processes . . . 29
1.1.1 Biodiversity of a single trophic level . . . 29
1.1.2 Biodiversity in consumer-resource systems (2 trophic levels) . . . . 30
1.1.3 Biodiversity in systems with more than two trophic levels . . . 34
1.2 Regulation of arthropod pests in agroecosystems : effects of biodiversity, agricultural practices and landscape . . . 36
1.2.1 Bottom-up and top-down effects of biodiversity on the control of arthropod pests . . . 36
Effect of plant diversification through habitat manipulation . . . 38
Effects of farming intensity . . . 40
1.2.3 Landscape effects . . . 41
1.2.4 Simultaneous effects of agricultural practices and landscape . . . 43
Effects considered separately . . . 43
Impact of landscape on the effect of agricultural practices . . . 45
2 Caractérisation des agroécosystèmes à base de manguiers à La Réunion 47 Introduction . . . 47
2.1 Cadre de l’étude : le projet Biophyto . . . 49
Objectifs de Biophyto . . . 49
Dispositif de Biophyto . . . 49
2.2 Matériels et méthodes . . . 51
2.2.1 Localisation de l’étude . . . 51
2.2.2 Démarche de collecte des données . . . 51
2.2.3 Caractérisation des communautés d’arthropodes . . . 51
Echantillonnage . . . 52
Identification des arthropodes . . . 53
Attribution des espèces à des groupes trophiques . . . 53
Analyses isotopiques . . . 54
2.2.4 Caractérisation des pratiques agricoles . . . 54
Gestion de la végétation adventice (communautés végétales) . . . . 55
Traitements insecticides . . . 55
2.2.5 Caractérisation du paysage . . . 56
2.3 Les communautés d’arthropodes . . . 57
2.3.1 Importance des groupes taxonomiques . . . 57
2.3.2 Composition et importance des groupes trophiques . . . 57
Les groupes trophiques par type de piège et par strate échantillonnée 61 Analyses isotopiques des communautés des inflorescences de manguiers 61 2.4 Pratiques agricoles . . . 63
2.4.1 Communautés végétales . . . 63
2.4.2 Traitements insecticides . . . 64
2.5 Paysage . . . 65
2.6 Conclusion . . . 65
3 Interactions multi-trophiques dans les communautés des vergers 67 Introduction . . . 67
Evidence of bottom-up and top-down biodiversity controls in a tropical agroeco-system . . . 69
3.1 Introduction . . . 70
3.2.1 Study area and sampling . . . 73
3.2.2 Arthropod communities . . . 74
3.2.3 Farming practices . . . 74
3.2.4 Landscape complexity . . . 74
3.2.5 Structural equation models . . . 75
3.3 Results . . . 77
3.3.1 Composition of arthropod communities . . . 77
3.3.2 SEM based on diversities of trophic groups . . . 77
3.3.3 SEM based on abundances of trophic groups . . . 79
3.4 Discussion . . . 79
3.5 Conclusion . . . 83
Acknowledgements . . . 84
4 Régulation naturelle des insectes nuisibles dans les vergers 85 Introduction . . . 85
4.1 Contrasting predation services of predator and omnivore diversity mediated by invasive ants in a tropical agroecosystem . . . 87
4.1.1 Introduction . . . 88
4.1.2 Materials and methods . . . 89
Study area and sampling . . . 89
Predation rate . . . 90 Arthropod sampling . . . 90 Community metrics . . . 91 Model . . . 91 4.1.3 Results . . . 93 4.1.4 Discussion . . . 95 Acknowledgements . . . 98
4.2 Quels facteurs influencent l’abondance des arthropodes nuisibles ? . . . 100
4.2.1 Introduction . . . 100
4.2.2 Matériels et Méthodes . . . 101
4.2.3 Résultats et Discussions . . . 101
5 Discussion générale 105 5.1 Caractérisation des communautés d’arthropodes et de plantes . . . 105
5.2 Les facteurs influençant les fonctions et le maintien de la biodiversité . . . 107
5.2.1 Contrôles descendants (top-down) et ascendants (bottom-up) de la biodiversité dans un agroécosystème tropical . . . 107
5.2.2 Influence des fourmis envahissantes sur le service de prédation . . . 109
5.2.3 Limites communes . . . 110
5.3 Implications pour la gestion agroécologique des arthropodes nuisibles . . . 111
5.3.2 Gestion agroécologique des insectes nuisibles et de la diversité des ennemis naturels . . . 112 5.4 Réflexions sur la démarche et recommandations pour des études futures . . 113 5.4.1 « Et si c’était à refaire... » . . . 113 5.4.2 Perspectives générales et recommandations . . . 116 5.5 Apports de la thèse . . . 118
Conclusion générale 121
Références bibliographiques 146
Annexes 1
A Liste des espèces d’arthropodes collectés 1
B Liste des espèces de plantes échantillonnées 15
C Seven newly recorded species and families of spiders from Reunion
Island (Malagasy region) (Araneae, Araneomorphae) 19
D A literature-based review of hymenopteran Parasitica from Reunion
Island 33
E Arthropod communities in mango orchards during the flowering
sea-son in Reunion Island : effects of agroecological and agrochemical
prac-tices 49
F Catalogue des espèces de Coléoptères des vergers de manguiers à La
Réunion 55
G Appendices of Contrasting predation services of predator and omnivore
1 Pourcentage d’espèces éteintes sur le nombre d’espèces de vertébrés évaluées par l’Union internationale pour la conservation de la nature (Ceballos et al., 2015). . . 11 2 Exemple de deux communautés présentant la même richesse spécifique
(quatre espèces) et la même abondance (12 individus), mais différentes par leur équitabilité. . . 13 3 Représentation schématique de la structure trophique d’une communauté,
de sa biodiversité et des interactions dans un agroécosystème (adaptée, d’après Duffy et al. (2007)). . . 14 4 Biodiversité et utilisation des terres. . . 15 5 Surfaces en vergers de manguiers récoltés (ha/km2) à l’échelle mondiale (Monfreda
et al., 2008). . . . 17
6 Inflorescence de manguier, insectes nuisibles et dégâts. . . 20 7 Organisation des chapitres de la thèse. . . 25 1.1 Schematic representation of the mechanisms involved in the relationship
between biodiversity and ecosystem function within a single trophic level (Adapted from Loreau et al. (2001)) . . . 29 1.2 Schematic representation of the resource specialization hypothesis . . . 32 1.3 Schematic representation of the top-down effects involved in associational
resistance and susceptibility . . . 33 1.4 Schematic representation of the top-down effect involved in the enemies
hypothesis. . . 34 1.5 Schematic representation of hypothetical mechanisms determining
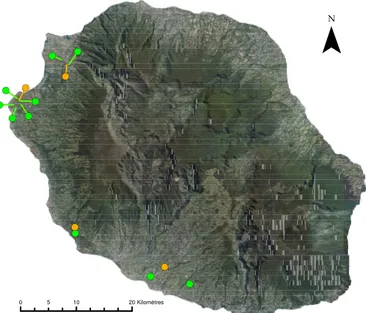
abun-dance and diversity of trophic levels within a tri-trophic food web . . . 37 2.1 Localisation des exploitations suivies pendant le projet Biophyto (vert et
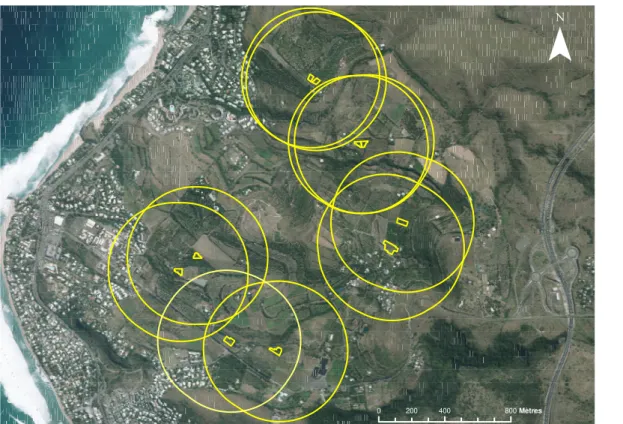
orange) et pour la thèse (vert) à La Réunion (Orthophotographies IGN 2012). 49 2.2 Piège à fosse . . . 52 2.3 Échantillonnage des communautés végétales . . . 55 2.4 Parcelles situées sur la commune de Saint-Gilles dont les zones tampons
2.5 Abondance et nombre d’espèces par ordre d’arthropodes. . . 58 2.6 Boîte à moustache de la richesse spécifique des groupes trophiques par type
d’échantillonnage. . . 62 2.7 Signatures isotopiques en δ13C et δ15N pour le manguier (feuilles et
inflores-cences) et les espèces d’arthropodes les plus abondantes sur les inflorescences de manguiers. . . 63 2.8 Boîte à moustache de l’abondance et du nombre d’espèces végétales par
mètres linéaires . . . 64 2.9 Évolution du nombre de traitements insecticides appliqué en période de
floraison des manguiers dans les deux types de parcelles du projet Biophyto 65 2.10 Analyses en composantes principales sur les variables de paysage . . . 66 3.1 Schematic representation of hypothetical mechanisms determining
abun-dance and diversity of trophic levels within our tri-trophic food web. . . 72 3.2 Path diagram of tested multitrophic interactions in structural equation
models. . . 75 3.3 Food webs of the soil surface and mango tree canopy biodiversity. . . 80 4.1 Path representation of the hierarchical Bayesian model predicting the
pre-dation rate of bait eggs . . . 96 5.1 Positionnement de la thèse, de certaines études et de la situation idéale
(protocole recommandé) selon le contrôle et la prise en compte de deux gradients : un gradient de contrôle du paysage et un gradient de contrôle expérimental des facteurs à l’échelle locale. . . 114 5.2 Cartes représentant les variations d’altitudes (A), de température moyenne
annuelle (B) et de pluviométrie (C) à La Réunion. . . 118 5.3 Les apports de la thèse selon trois niveaux, dans quatre des thématiques
2.1 Composition taxonomique des 6 principaux groupes trophiques d’arthropodes 60 3.1 Evidence ratio (ER), model-averaged parameter estimates (95% credibility
interval) for the structural equation models of the two strata for each metric (diversity and abundance). . . 78 4.1 Model-averaged mean parameter estimates and posterior distribution for
the hierarchical Bayesian models (Equations 4.1, 4.4, and 4.6). . . 94 4.2 Paramètres estimés pour les modèles d’explication de l’abondance des quatre
espèces (ou groupes d’espèces) d’insectes nuisibles présentes en période de floraison des manguiers. . . 102
Les travaux de la thèse et les travaux annexes ont fait l’objet d’une valorisation scientifique et technique. Ces livrables sont listés ci-dessous par type de publication. Articles dans des revues internationales avec comité de lecture
Jacquot M., Tixier P., Flores O., Muru D., Massol F., Derepas B., Chiroleu F., & Deguine J.-P. (sous presse). Contrasting predation services of predator and omnivore diversity mediated by invasive ants in a tropical agroecosystem. Basic and Applied Ecology. 10.1016/j.baae.2016.09.005
Jacquot M., Atiama M., Muru D., Chiroleu F., Tenailleau M., Gasnier S., Rochat J., Plessix S., Moutoussamy M.-L., Ajaguin Soleyen C., & Deguine J.P. (accepté). Arthropod communities in mango orchards during the flowering season in Reunion Island : effects of agroecological and agrochemical practices. Proceedings of the 11th International Mango Symposium, Acta Horticulturae.
Jacquot M., Massol F., Muru D., Derepas B., Tixier P., & Deguine J.-P. (soumis en octobre 2016). Evidence of bottom-up and top-down controls of biodiversity in a tropical agroecosystem. Journal of Animal Ecology.
Jacquot M., Rusch A., Sarthou J.-P, & Deguine J.-P. (en préparation). Linking biodiversity, ecosystem functioning and biological control of arthropod pest in agroecosystems : a review. Agronomy for Sustainable Development.
Muru D., Madl M., Jacquot M., & Deguine J.-P. (soumis en octobre 2016). A literature-based review of hymenopteran Parasitica from Reunion Island. ZooKeys.
Deguine J.-P., Jacquot M., Allibert A., Chiroleu F., Graindorge R., Laurent P., Albon B., Marquier M., Vanhuffel L., Vincenot D., & Aubertot J.-N. (soumis en décembre 2016). Agroecological protection of mango orchards in Reunion. Sustainable Agriculture Reviews, Special Issue ‘Ecology for Agriculture’. Deguine J.P., Atiama-Nurbel T., Aubertot J.N., Augusseau X., Atiama M., Jacquot M. & Reynaud B. (2015). Agroecological management of cucurbit-infesting fruit fly : a review. Agronomy for Sustainable Development, 35, 937–965.
Articles dans des revues nationales avec comité de lecture
Jacquot M., Derepas B., & Deguine J.-P. (accepté). Seven newly recorded species and families of spiders from Reunion Island (Malagasy region) (Araneae, Araneomorphae). Bulletin de la Société entomologique de France, 121 (4), 2016 : 421-430.
Deguine J.-P., Albon B., Brun-Vitelli J., Graindorge R., Jacquot M., Laurent P., Marquier M., Vanhuffel L., & Vincenot D. (2017). La protection agroécologique des vergers de manguiers à La Réunion. Innovations Agronomiques.
Jacquot M., Tenailleau M., Chiroleu F., Giraud-Carrier C., & Deguine J.-P. (2013). La biodiversité fonctionnelle dans les vergers de manguiers à La Réunion. Effets de facteurs écosystémiques et paysagers sur les arthropodes prédateurs terrestres épigés. Innovations Agronomiques 32, 365-376.
Chapitres d’ouvrage (en français)
Sarthou J.-P., Jacquot M., & Deguine J.-P. (2016). Biodiversité fonctionnelle du sol et aérienne. In : Deguine J.-P., Gloanec C., Laurent P., Ratnadass A., Aubertot J.-N. (eds), Protection agroécologique des cultures. Editions Quae, Versailles, 199-205.
Gloanec C., Deguine J.-P., Vincenot D., Jacquot M., & Graindorge R. (2016). Applications en cultures fruitières : l’expérience Biophyto. In : Deguine J.-P., Gloanec C., Laurent P., Ratnadass A., Aubertot J.-N. (eds), Protection agroécologique des cultures. Editions Quae, Versailles, 97-126.
Supports de formation et d’information
Atiama M., Ramage T., Deguine J.-P., Jacquot M. (2015). Fiche de reconnaissance des punaises Mirides dans les vergers de manguiers à La Réunion. Fiche de terrain - Livrable Agriculteurs Saint-Denis : Chambre d’Agriculture de La Réunion, 2 p.
Deguine J.-P., Gloanec C., Graindorge R., Jacquot M., Le Roux K., Roux E., Suzanne W., Vincenot D., & Laurent P. (2014). Application de l’agroécologie à la protection des cultures. Support de formation, Certificat Universitaire de Qualification Professionnelle. Institut Universitaire de Technologie de La Réunion, Saint-Pierre, 84 p.
Jacquot M.(2014). Les auxiliaires des cultures. In : Deguine J.-P., Gloanec C., Graindorge R., Jacquot M., Le Roux K., Roux E., Suzanne W., Vincenot D.,Laurent P. (eds). Application de l’agroécologie à la protection des cultures. Support de formation,Certificat Universitaire de Qualification Professionnelle. Institut Universitaire de Technologie de La Réunion (Saint-Pierre), 54-58.
Deguine J.-P., Jacquot M., & Gloanec C. (2014). La lutte biologique de conservation : un des trois piliers de la protection agroécologique des cultures. In : Deguine J.-P., Gloanec C., Graindorge R., Jacquot M., Le Roux K., Roux E., Suzanne W., Vincenot D.,Laurent P. (eds). Application de l’agroécologie à la protection des cultures. Support de formation,Certificat Universitaire de Qualification Professionnelle. Institut Universitaire de Technologie de La Réunion (Saint-Pierre), 65-74.
Communications à des congrès internationaux
Jacquot M., Tixier P., Massol F., Flores O., & Deguine J.- P (2016). Causes and consequences of arthropod diversity in a tropical agroecosystem : implications for conservation biological control (présentation orale). International Conference on Ecological Sciences sfécologie 2016, 24-28 october, Marseille, France. Jacquot M., Atiama M., Muru D., Chiroleu F., Tenailleau M., Gasnier S., Rochat J., Plessix S., Moutoussamy M.-L., Ajaguin Soleyen C., & Deguine J.P. (2015). Do agroecological practices enhance abundance and species richness of arthropods ? A case study in mango orchards in Reunion (poster présenté par M. Atiama). XI International Mango Symposium, 28 september-2 october 2015, Darwin, Australia.
Jacquot M., Tixier P., Muru D., Flores O., Derepas B., Chiroleu F., & Deguine J.-P. (2015). Contrasting effects of predator and omnivore species richness on predation service in an invasion context (poster). 2015 Annual Meeting of the British Ecological Society, 13-16 December, Edinburgh, Scotland.
Jacquot M., Muru D., Duyck P.-F., Chiroleu F., Tixier P., & Deguine J.-P. (2014). Influence of plant diversity, insecticide applications and landscape on arthropod species richness of two trophic levels in mango orchards (présentation orale). Joint 2014 Annual Meeting British Ecological Society and Société Française d’Ecologie, 9-12 Décembre, Lille, France.
Communications à des congrès nationaux
Jacquot M., Chiroleu F., & Deguine J.-P. (2015). Richesse spécifique et recouvrement des couvertures végétales en période de floraison des manguiers à La Réunion. In : Deguine J.-P., Gloanec C., Schmitt T. (eds), 2015. Biodiversité et protection agroécologique des cultures. Actes du Séminaire Biophyto, Saint-Pierre, La Réunion. 21-24 octobre 2014. Saint-Denis : Chambre d’agriculture de La Réunion, 216 p.
Jacquot M., Muru D., Chiroleu F., Tenailleau M., Gasnier S., Rochat J., Plessix S., Moutoussamy M.-L., Ajaguin Soleyen C., Tixier P., & Deguine J.-P. (2015). Effet des pratiques agroécologiques sur l’évolution des communautés d’arthropodes en vergers de manguiers à La Réunion. In : Deguine J.-P., Gloanec C., Schmitt T. (eds), 2015. Biodiversité et protection agroécologique des cultures. Actes du Séminaire Biophyto, Saint-Pierre, La Réunion. 21-24 octobre 2014. Saint-Denis : Chambre d’agriculture de La Réunion, 216 p.
Jacquot M., Tenailleau M., Chiroleu F., Giraud-Carrier C., Moutoussamy M.-L., Ajaguin Soleyen C., & Deguine J.-P. (2015). Effet des couvertures végétales, des pratiques culturales et du paysage sur les arthropodes prédateurs épigés dans les vergers de manguiers à La Réunion. In : Deguine J.-P., Gloanec C., Schmitt T. (eds), 2015. Biodiversité et protection agroécologique des cultures. Actes du Séminaire Biophyto, Saint-Pierre, La Réunion. 21-24 octobre 2014. Saint-Denis : Chambre d’agriculture de La Réunion, 216 p.
Atiama M., Ramage T., Schmitt T., Moutoussamy M.-L., Matocq A., Ajaguin Soleyen C., Muru D., Jacquot M., & Deguine J.-P. (2015). Bioécologie de la Punaise du manguier, Orthops palus. In : Deguine J.-P., Gloanec C., Schmitt T. (eds), 2015. Biodiversité et protection agroécologique des cultures. Actes du Séminaire Biophyto, Saint-Pierre, La Réunion. 21-24 octobre 2014. Saint-Denis : Chambre d’agriculture de La Réunion, 216 p.
Muru D., Jacquot M., Tenailleau M., Derepas B., Gasnier S., Rochat J., Atiama M., Moutoussamy M-L., Ajaguin Soleyen C., & Deguine J.-P. (2015). Biodiversité des arthropodes dans les vergers de manguiers à La Réunion : Inventaires et catalogues. In : Deguine J.-P., Gloanec C., Schmitt T. (eds), 2015. Biodiversité et protection agroécologique des cultures. Actes du Séminaire Biophyto, Saint-Pierre, La Réunion. 21-24 octobre 2014. Saint-Denis : Chambre d’agriculture de La Réunion, 216 p.
Schmitt T., Muru D., Jacquot M., Jacquot M., Ajaguin Soleyen C., Moutoussamy M.-L., & Deguine J.-P. (2015). Insertion de plantes pièges, refuges ou réservoirs d’arthropodes en vergers de manguiers à La Réunion. In : Deguine J.-P., Gloanec C., Schmitt T. (eds), 2015. Biodiversité et protection agroécologique des cultures. Actes du Séminaire Biophyto, Saint-Pierre, La Réunion. 21-24 octobre 2014. Saint-Denis : Chambre d’agriculture de La Réunion, 216 p.
Vincenot D., Graindorge R., Jacquot M., Gloanec C., Laurent P., Rossolin G., Roux E., Techer K., & Deguine J.-P. (2015). Bilan des actions de formation, d’information et de communication ; transfert et développement de la protection agroécologique des cultures (PAEC). In : Deguine J.-P., Gloanec C., Schmitt T. (eds), 2015. Biodiversité et protection agroécologique des cultures. Actes du Séminaire Biophyto, Saint-Pierre, La Réunion. 21-24 octobre 2014. Saint-Denis : Chambre d’agriculture de La Réunion, 216 p. Deguine J.-P., Ratnadass A., & Jacquot M. (2015). Protection agroécologique des cultures et gestion de la biodiversité. In : Deguine J.-P., Gloanec C., Schmitt T. (eds), 2015. Biodiversité et protection agroécologique des cultures. Actes du Séminaire Biophyto, Saint-Pierre, La Réunion. 21-24 octobre 2014. Saint-Denis : Chambre d’agriculture de La Réunion, 216 p.
Deguine J.-P., Albon B., Dijoux A., Gloanec C., Jacquot M., Graindorge R., Laurent P., Le Roux K., Lucas E., Marquier M., Schmitt C., Suzanne W., Techer K., Vincenot D. (2015). Protection agroécologique contre les ravageurs en vergers de manguiers à La Réunion. Actes de la 5ème Conférence internationale sur les méthodes alternatives de protection des plantes, Lille, 11-13/03/2015.
Deguine J.-P., Jacquot M. (2014). Protection agro-écologique des cultures : principes, application sur le terrain, impact sur la biodiversité fonctionnelle. Séminaire Agroécologie d’Agropolis, 9 décembre 2014, Montpellier.
1 Contexte et enjeux
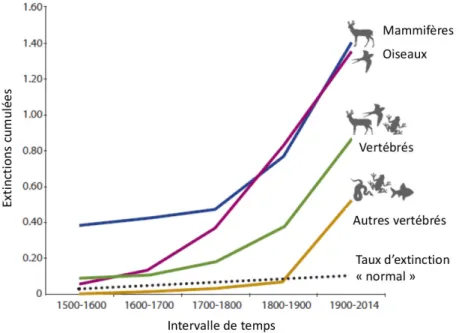
Depuis le milieu du 20èmesiècle, les activités humaines sont si importantes à l’échelle de la planète, qu’elles laissent une signature dans les couches sédimentaires ; ainsi notre époque, l’Anthropocène, est en passe d’être reconnue comme une période distincte géologiquement de la précédente (Waters et al., 2016). L’Anthropocène est caractérisée notamment par l’apparition de matériaux manufacturés dans les sédiments, comme l’aluminium et les plastiques, mais aussi par des taux d’élévation du niveau de la mer et de perturbation du système climatique, qui dépassent les taux connus dans les 11700 dernières années (Holocène) (pour une synthèse, voir Waters et al., 2016). L’Anthropocène est également marquée par un taux d’extinction des espèces supérieur aux estimations du taux d’extinction attendu, comme cela été montré pour les espèces de vertébrés (Ceballos et al., 2015) (Fig. 1). A l’échelle locale, les perturbations d’origine anthropique sont responsables d’une baisse de 18,3 % du nombre d’espèces, les trois causes majeures étant les changements d’utilisation du sol (des habitats naturels vers des habitats urbains ou agricoles, Fig. 4), les invasions biologiques et la destruction des habitats (Murphy & Romanuk, 2014).
Figure 1 – Pourcentage du nombre d’espèces éteintes sur le nombre d’espèces de vertébrés évaluées par l’Union internationale pour la conservation de la nature (Ceballos et al., 2015). Le taux d’extinction « normal »correspond à une moyenne de 2 extinctions par million d’espèces par an.
La prise de conscience de l’érosion de la diversité biologique a eu lieu dans les années 1980 (Wilson, 1985 ; National Science Foundation, 1989). Elle s’est traduite au niveau international par le lancement du programme Diversitas en 1991, visant à répondre aux questions scientifiques relatives à la connaissance, l’importance, au maintien et à la perte de la biodiversité. Puis, en 1992 lors du troisième Sommet de la Terre à Rio, l’adoption de la Convention sur la diversité biologique a marqué la volonté internationale de conserver la diversité biologique et de définir les règles d’une utilisation durable et juste de ses éléments. Ce traité a également officialisé le terme de biodiversité et sa définition, comme : «la variabilité des organismes vivants de toutes origines y compris, entre autres, les écosystèmes terrestres, marins et autres écosystèmes aquatiques et les complexes écologiques dont ils font partie ; cela comprend la diversité au sein des espèces et entre espèces ainsi que celle des écosystèmes». Le concept de biodiversité s’applique donc à de nombreux niveaux d’organisation, des gênes jusqu’aux biomes.
1.1 La biodiversité dans les communautés
En un lieu donné, l’ensemble des organismes présents forment une communauté et ils forment un écosystème avec leur environnement abiotique (Morin, 2011). Lorsque la grande partie des espèces d’une communauté est exploitée pour une production agricole, on le dénomme agroécosystème. A l’échelle des communautés, la biodiversité correspond notamment à la variété et à l’abondance des espèces présentes (?). Plus précisément, la biodiversité a deux composantes : la richesse spécifique et l’équitabilité. La richesse spécifique est le nombre total d’espèces présentes dans l’unité étudiée (?). Cette mesure, simple en apparence, engendre deux préoccupations importantes. La première est qu’elle nécessite une très bonne connaissance taxonomique de l’unité considérée pour être complète. La seconde concerne l’échantillonnage, puisque des échantillonnages exhaustifs sont très coûteux pour des communautés diversifiées, et puisque certaines espèces sont difficilement détectables par leur rareté ou leur comportement. La richesse spécifique est donc reportée à une unité biologique ou à une unité d’échantillonnage (surface, nombre de pièges). Elle peut être également estimée en prenant en compte le taux d’ajout de nouvelles espèces dans un inventaire (courbes d’accumulation d’espèces) ou encore l’abondance ou l’occurrence des espèces rares dans les échantillonnages (estimateurs non-paramétriques) (?). L’équitabilité exprime, quant à elle, l’abondance relative des espèces dans une communauté. A richesse spécifique et à abondance égales, une communauté dont chaque espèce présente le même nombre d’individus (communauté équitable) est considérée comme plus diversifiée qu’une communauté dominée par une ou plusieurs espèces abondantes et dont les autres espèces sont rares (Fig. 2). Les indices de diversité sont généralement calculés en utilisant à la fois la richesse et la proportion relative des espèces, comme c’est le cas pour l’indice de
Shannon (?).
La biodiversité et les communautés qu’elle décrit, ont également comme attributs, des structures (Fig. 3) et des fonctions (Noss, 1990). Les écologues structurent les communautés
Figure 2 – Exemple de deux communautés présentant la même richesse spécifique (quatre espèces) et la même abondance (12 individus), mais différentes par leur équitabilité.
sur la base des interactions trophiques existant entre des consommateurs et des ressources, qui ont lieu entre des espèces ou des groupes d’espèces. On parle alors de réseaux trophiques (Morin, 2011). Les espèces peuvent être regroupées en entités fonctionnelles et trophiques,
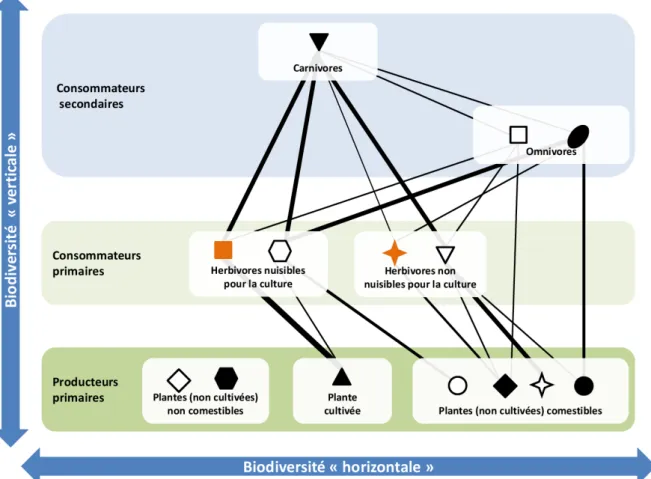
correspondant aux ressources qu’elles utilisent (guildes), aux fonctions qu’elles réalisent (groupes fonctionnels ou groupes trophiques) ou encore à la façon dont elles acquièrent l’énergie (niveaux trophiques : producteurs primaires, détritivores, consommateurs pri-maires, consommateurs secondaires, etc.) (Morin, 2011). Duffy et al. (2007) définissent ainsi la biodiversité dans les réseaux trophiques selon deux dimensions : la biodiversité « horizontale » qui correspond à la diversité au sein des niveaux trophiques et la diversité « verticale » qui correspond à la diversité entre niveaux trophiques (Fig. 3).
La biodiversité est en relation étroite avec le fonctionnement des écosystèmes, c’est-à-dire avec les processus, les biens et les services écosystémiques (ces concepts définis ci-dessous d’après Christensen et al. (1996)). Les processus écosystémiques sont le cycle et le stockage de l’eau, la productivité biologique, les cycles et les stockages biogéochimiques, la décomposition et le maintien de la diversité biologique. Les deux autres notions sont anthropocentriques. D’une part, les biens écosystémiques correspondent aux propriétés des écosystèmes qui ont une valeur marchande directe, comme les aliments, les matériaux de construction, les produits médicinaux ou encore les gènes pour l’amélioration des plantes et les agents de lutte biologique (classique ou inondative). D’autre part, les services écosystémiques sont les propriétés des écosystèmes dont l’Homme tire des bénéfices directs ou indirects et qui n’ont, historiquement, pas de valeur marchande. Les valeurs de ces services ont néanmoins été évaluées pour souligner leur importance auprès des décideurs (Costanza et al., 1997).
A partir de la fin des années 1980, une période intense de recherches a débuté, pour comprendre l’influence de la perte de biodiversité sur le fonctionnement des écosystèmes. Ces recherches ont fait l’objet de synthèses régulières (Loreau et al., 2001 ; Hooper et al., 2005 ; Duffy et al., 2007 ; Cardinale et al., 2009). Il est aujourd’hui reconnu que la biodiversité contribue au fonctionnement des écosystèmes, la perte de diversité étant même l’une des causes importantes de l’altération du fonctionnement des écosystèmes, comparable notamment à l’effet du changement climatique (Hooper et al., 2012). Les résultats de ces recherches soulignent également que la biodiversité apporte de nombreux
Figure 3 – Représentation schématique de la structure trophique d’une communauté, de sa biodiversité et des interactions dans un agroécosystème (adaptée, d’après Duffy et al. (2007)). La communauté est composée de 14 espèces, regroupées en 3 niveaux trophiques et 7 groupes trophiques. Les 19 relations trophiques indiquées par des traits (dont l’épaisseur indique la force de la relation) reliant les espèces forment un réseau trophique comportant 16 chaînes alimentaires. La biodiversité horizontale correspond au nombre d’espèces ou au nombre de groupes trophiques par niveau trophique. La comestibilité des producteurs primaires est en référence aux consommateurs primaires et secondaires. D’après les relations trophiques, les espèces présentent différents degrés de spécialisation pour la ressource (niche horizontale plus ou moins large). Les deux espèces spécialistes sont représentées en orange. L’espèce la plus généraliste est l’espèce de carnivore. Les composantes de la biodiversité verticale sont : les chaînes trophiques ; et, la variation de largeur de la niche verticale entre des espèces qui exploitent uniquement des espèces du niveau trophique inférieur (herbivores) et des espèces omnivores exploitant des ressources à plusieurs niveaux trophiques. Les interactions non trophiques, les interactions intraguildes, ainsi que les détritivores n’ont pas été représentées sur la figure pour ne pas surcharger et pour mieux assurer sa lecture. Notons que cette figure peut être appliquée aux communautés aériennes et au communautés du sol, mais elle ne représente pas les interactions entre les différents compartiments.
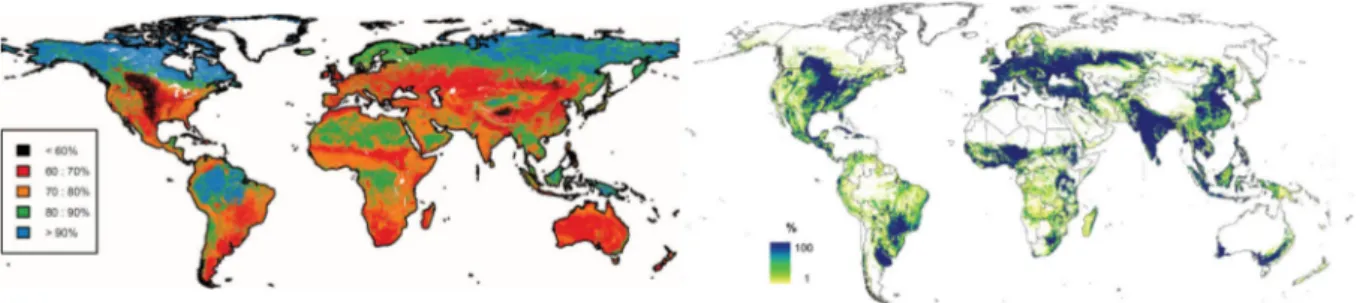
Figure 4 – Biodiversité et utilisation des terres. Pourcentage d’intégrité du nombre d’espèce présentes dans la végétation primaire (Newbold et al., 2016) (à gauche) ; pourcentage d’occupation du sol par des zones cultivées (Fritz et al., 2015) (à droite)
biens et services à l’Homme (Diaz et al., 2006 ; Cardinale et al., 2012 ; Mace et al., 2012). Ces connaissances importantes proviennent en majorité d’expériences qui ont manipulé la biodiversité d’un groupe trophique et étudié l’influence de la diversité sur la fonction ou sur les fonctions de ce niveau trophique (pour une revue bibliographique sur ce thème, voir chapitre 1). Les études qui ont incorporé la dimension verticale de la biodiversité (en étudiant plusieurs niveaux trophiques) soulignent la complexité des effets de la biodiversité au sein des réseaux trophiques (voir chapitre 1). D’après Brose & Hillebrand (2016), les futures études sur les relations entre la biodiversité et le fonctionnement des écosystèmes devront à la fois prendre en compte cette composante multi-trophique des communautés et également comprendre ces relations dans de plus larges échelles spatiales et temporelles.
1.2 La biodiversité dans les agroécosystèmes
Les habitats agricoles occupent plus de 30 % des surfaces des terres émergées, formant l’un des plus importants biomes terrestres (Foley et al., 2005). Sur la base de données de l’année 2000, les terres cultivées et les pâturages représentent respectivement 12 % (Fig. 4) et 22 % des surfaces des terres émergées (Ramankutty et al., 2008). Cette importance de l’agriculture à l’échelle globale a deux implications. Premièrement, les habitats agricoles représentent des zones d’intérêt pour la conservation de la biodiversité et les services écosystémiques (Pimentel et al., 1992 ; Tscharntke et al., 2005 ; Iverson et al., 2014). Deuxièmement, l’agriculture est un des facteurs les plus importants dans la perte de biodiversité et le changement global (Tscharntke et al., 2005). Par exemple, les activités agricoles sont responsables de 48 % de la perte de diversité due au changement d’utilisation du sol (Murphy & Romanuk, 2014).
L’impact de l’agriculture ne se limite pas à la destruction d’habitats naturels par l’utilisa-tion des terres : les pratiques agricoles influencent également la nature des agroécosystèmes dans lesquels elles sont conduites et des écosystèmes adjacents. Ainsi, l’intensification de l’agriculture, par l’augmentation de l’utilisation des intrants chimiques et l’homogénéisation des paysages, est une cause majeure de la perte de diversité (Tscharntke et al., 2005). Les impacts de cette intensification dépassent l’effet délétère sur la biodiversité ; par exemple, l’utilisation des pesticides a des effets négatifs sur l’environnement et sur la santé humaine
(Bourguet & Guillemaud, 2016).
Face aux enjeux environnementaux et sanitaires, en parallèle des recherches concernant l’influence de la perte de diversité sur le fonctionnement des écosystèmes, des scientifiques ont promu le développement d’une agriculture durable qui conserve la biodiversité, qui gère ses différents services et, notamment ceux fournis aux agroécosystèmes (Pimentel
et al., 1992 ; Altieri, 1999). Cette idée d’une agriculture plus durable et respectueuse
de l’environnement a pris de nombreuses formes : l’agriculture biologique (Bellon & Penvern, 2014), l’agroécologie (Deguine et al., 2016) ou encore l’intensification écologique de l’agriculture (Gaba et al., 2014 ; Geertsema et al., 2016). La gestion de la biodiversité et de ses services est au centre de ces formes d’agriculture durable, elle fait également l’objet de pratiques spécifiques comme la gestion des habitats (Gurr et al., 2004).
Dans les agroécosystèmes, l’Homme bénéficie des services écosystémiques. L’estimation de leurs valeurs montre qu’ils représentent au total 92 $/ha/an, dont le service d’approvi-sionnement par la production alimentaire (54 $/ha/an) et deux services de régulation : le contrôle biologique des organismes nuisibles (24 $/ha/an) et la pollinisation (14 $/ha/an) (Costanza et al., 1997). Cette estimation souligne notamment l’importance du contrôle
biologique des organismes nuisibles dans les agroécosystèmes. Dans notre étude, nous nous intéressons à ce service et, plus précisément, à la régulation biologique des arthropodes nuisibles des cultures.
Dans les communautés, les arthropodes nuisibles des cultures dépendraient de deux types de contrôles trophiques : (i) du contrôle ascendant par la diversité des plantes ; et (ii) du contrôle descendant par la diversité des ennemis naturels (Gurr et al., 2012). La diversité des ennemis naturels et la diversité des plantes favorisent, dans la majorité des cas, le contrôle des nuisibles ; de surcroît, les pratiques agricoles et le paysage influencent à la fois les ennemis naturels, les plantes et, aussi, directement les nuisibles (voir chapitre 1). Cependant, les mécanismes sous-jacents sont rarement élucidés. De plus, l’importance respective de ces différents facteurs est rarement quantifiée, ce qui limite la disponibilité de connaissances nécessaires pour permettre un contrôle efficace des nuisibles.
1.3 Enjeux scientifiques de l’étude de la biodiversité dans le
fonc-tionnement écologique des agroécosystèmes
Outre les enjeux globaux, le développement d’une agriculture intégrant la biodiversité représente des enjeux scientifiques. Il s’agit d’acquérir des connaissances sur le fonctionne-ment des agroécosystèmes, en particulier sur, les facteurs qui influent sur la conservation de la biodiversité et sur la provision de ses services. Les enjeux respectifs de l’écologie des communautés (approches multi-trophiques à une large échelle spatio-temporelle) et de la protection des cultures (approches mécanistes à de multiples échelles) offrent un cadre pertinent pour comprendre, à la fois, les mécanismes qui permettraient un contrôle accru des ravageurs et, aussi, les relations entre la biodiversité et le fonctionnement des
écosystèmes, dans des contextes multi-trophiques et à de plus grandes échelles spatiales et temporelles.
La présente thèse s’inscrit dans ces enjeux scientifiques. Par des approches multi-trophiques et multi-échelles et en s’appuyant sur le réseau d’un projet de développement de pratiques agroécologiques, nous étudions la place et le rôle de la biodiversité dans le fonctionnement écologique des agroécosystèmes à base de manguiers à La Réunion.
2 Modèle d’étude : les agroécosystèmes à base de
man-guiers à La Réunion
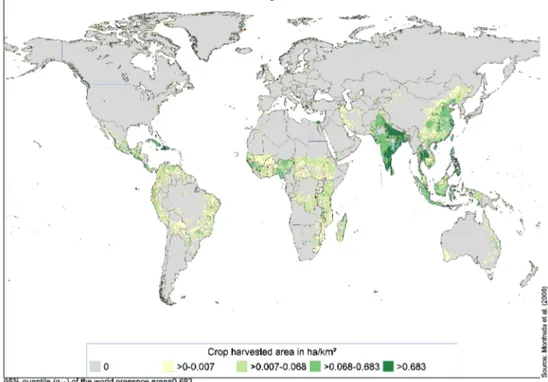
Le manguier Mangifera indica L. est un arbre de la famille des Anacardiacées, originaire l’Inde. La mangue est la principale culture fruitière tropicale après la banane, avec 33 million de tonnes de mangues produites par an (Food and Agriculture Organization, 2015). La zone principale de production est l’Asie, avec en tête des pays producteurs l’Inde, la Chine et la Thailande (Fig. 5).
Figure 5 – Surfaces en vergers de manguiers récoltés (ha/km2) à l’échelle mondiale (Monfreda
et al., 2008).
2.1 La culture du manguier à La Réunion
Conditions de cultureA La Réunion, la production de mangues est également d’importance économique et culturelle, il s’agit de la cinquième production fruitière de l’île, avec une production de
1900 t/an (www.reunion.chambagri.fr). Deux variétés sont principalement cultivées : la variété locale José et la variété américaine Cogshall. Pour assurer une bonne productivité, les manguiers doivent être implantés dans une zone où règne un climat tropical semi-aride, présentant une saison humide et une saison sèche distinctes. Pendant la floraison, les températures minimales doivent être supérieures à 15◦C. A La Réunion, la culture du manguier est donc restreinte à l’Ouest de l’île, entre 0 et 400 m d’altitude.
Dans ces conditions, la floraison a lieu durant une partie de l’hiver austral (juillet à octobre). Elle est hétérogène, aussi bien à l’échelle de l’île que dans les vergers. Les fleurs de manguier (3-4 mm) sont regroupées par centaines, en panicules. Après fécondation, quelques unes se développent en drupes charnues : les mangues. Il faut ensuite 3 à 4 mois entre la nouaison et la récolte des mangues. La période de récolte des fruits s’étale donc d’octobre pour les plus précoces, à février pour les plus tardives. La précocité de la récolte a un double enjeu pour les producteurs. Le premier est d’éviter la perte des récoltes par les cyclones qui se produisent le plus souvent aux mois de décembre et de janvier. Le deuxième est d’éviter la concurrence avec les autres fruits de fin d’année comme le litchi. Pratiques culturales
Les interventions culturales dans les vergers de manguiers se résument à la gestion des organismes adventices (plantes) et nuisibles (insectes, bactéries, etc.) et à la taille (Vincenot & Normand, 2009). Le travail du sol est réalisé seulement lors de la plantation des arbres. Les pratiques culturales les plus répandues consistent en des traitements chimiques préventifs contre les organismes nuisibles et l’application d’herbicides (glyphosate) a lieu une fois par an dans le rang de plantation des manguiers. Dans les vergers de manguiers certifiés en Agriculture Biologique (AB), l’absence de traitement herbicide permet le développement d’une couverture végétale sur l’ensemble de la parcelle. Les traitements insecticides homologués en AB sont effectués lorsque les seuils de nuisibilité sont atteints. Les arbres sont taillés tous les deux ans pour assurer une bonne aération du feuillage et des vergers.
Bioagresseurs
A La Réunion, les manguiers sont les cibles de nombreux bioagresseurs : 13 espèces d’arthropodes (Amouroux & Normand, 2013), une bactérie et deux champignons (Vincenot et al., 2015). Pendant la croissance et le mûrissement des fruits, quatre espèces de Mouches des fruits (Diptera : Tephritidae), l’anthracnose du manguier Colletotrichum gloeosporioides (Fungi Ascomycota) et la maladie des tâches noires provoquée par Xanthomonas citri pv.
mangiferaeindicae (Bacteria) déprécient la qualité des fruits, limitant ou empêchant leur
commercialisation.
Pendant la floraison, qui est la période clé de construction de la production, les inflorescences et les jeunes fruits sont confrontés à de nombreux insectes nuisibles (Fig. 6). La Cécidomyie des fleurs de manguiers (Diptera : Cecidomyiidae), la Punaise du
manguier (Heteroptera : Miridae) et des espèces de thrips (Thysanoptera) peuvent causer la perte totale de la production par leur dégâts sur les inflorescences. L’Oïdium mangiferae (Fungi Ascomycota) est également une cause importante de perte des inflorescences. La Cochenilles des Seychelles (Hemiptera : Margarodidae) est présente toutes l’année. Elle provoque un affaiblissement des arbres et impacte l’ensemble des stades phénologiques du manguier.
La gestion des bioagresseurs pendant la floraison étant une opération essentielle à la production de mangues, notre étude est concentrée sur cette période clé et sur les insectes nuisibles associés.
2.2 Les insectes nuisibles aux inflorescences
La Cécidomyie des fleursProcontarinia mangiferae Felt est un diptère galligène monophage inféodé aux
man-guiers. Originaire d’Inde, il occupe actuellement une aire géographique pantropicale, suite à l’expansion de la culture de sa plante hôte. Procontarinia mangiferae peut se développer sur les inflorescence et les jeunes feuilles du manguier (Amouroux et al., 2014). Les pertes économiques sont causées par le développement de l’insecte dans l’inflorescence des man-guiers, notamment lorsque les cécidomyies s’alimentent sur de jeunes inflorescences, qui ne peuvent alors plus produire de fleurs (Amouroux, 2013).
Le cycle de vie de cette espèce de cécidomyie est le suivant. Durant l’hiver austral, les adultes de la première génération (2 mm) émergent de pupes présentes dans le sol. Pendant leur courte durée de vie (2 à 3 jours), les femelles adultes pondent leurs œufs dans les inflorescences. Après éclosion, les larves pénètrent et forment une galle dans l’organe de la plante, en s’alimentant de ses tissus. Elles s’y développent pendant 7 à 12 jours, avant de rejoindre le sol pour la pupaison. Les individus au stade pupal de cette nouvelle génération donnent une nouvelle émergence la même année ou bien entrent en diapause pour émerger l’année suivante (Amouroux et Normand, 2010).
La Punaise du manguier
Orthops palus Taylor est un nuisible qui peut provoquer d’importantes pertes dans
vergers de manguiers. En effet, les piqûres des larves et des adultes de cet insecte succivore provoquent le dessèchement partiel ou total des inflorescences. Ils peuvent aussi s’alimenter des feuilles et des tiges des jeunes rameaux de manguiers, sans toutefois engendrer de dégâts économiques (Atiama, 2016).
Cette espèce est polyphage : 14 espèces de plantes hôtes appartenant à 10 familles différentes ont été recensées à La Réunion (Atiama, 2016). A l’exception du manguier, sur lequel l’espèce s’alimente sur les inflorescences et les jeunes feuilles, cette punaise a été retrouvée uniquement sur les inflorescences des plantes. Les dégâts économiques sont signalés uniquement sur le manguier. Les plantes hôtes principales, sur lesquelles le nombre
Figure 6 – Inflorescence de manguier, les insectes nuisibles et leurs dégâts. A. Inflorescence de manguier saine (M. Jacquot) ; B. Cochenilles des Seychelles (Icerya seychellarum) et développement de fumagine sur feuille (AF) ; C. Punaise du manguier (Orthops palus) (AF) ; D. Dégâts de Thrips sur inflorescence (D. Vincenot) ; E. Thrips sur une fleur de manguier (AF) ; F. Dégâts de Cécidomyies des fleurs (Procontarinia
moyen d’individus est le plus important, sont trois plantes cultivées, l’avocatier (Persea
americana, Lauraceae), le litchi (Litchi chinensis, Sapindaceae) et le manguier, ainsi qu’une
plante exotique envahissante, le faux-poivrier (Schinus terebinthifolius, Anacardiaceae). Dans les zones de production de mangues, la plante hôte la plus abondante (mis à part le manguier) est le faux-poivrier, présent dans les haies et les ravines. Orthops palus semble être une espèce multivoltine, effectuant plusieurs générations par an, en suivant la succession des floraisons de ses plantes hôtes. Son cycle de développement dure 17.29 ± 3.75 jours, elle ne semble pas passer par le sol sous le manguier pour l’effectuer (Atiama, 2016).
Les Thrips
Deux espèces de Thysanoptera de la famille des Thripidae, Scirtothrips aurantii Faure et Selenothrips rubrocinctus (Giard), sont connues comme nuisibles des inflorescences et des fruits des manguiers à La Réunion.
Scirtothrips aurantii, le Thrips Sud-africain des agrumes, est une espèce pantropicale
polyphage, nuisible à de nombreuses productions fruitières et légumières, dont la mangue. Les Scirtothrips ssp. provoquent chez leurs plantes hôtes, la sénescence de l’épiderme des organes ciblés, en s’alimentant du contenu des cellules (CABI, 2016). Dans son pays d’origine, l’Afrique du Sud, S. aurantii a été répertoriée sur 50 espèces de plantes hôtes (Faure, 1929) ; son nom vernaculaire lui vient des dégâts importants qu’il inflige au genre
Citrus. Un certain nombre d’espèces végétales répertoriées en Afrique du Sud comme
plantes hôtes (cultivées ou rudérales) sont présentes à La Réunion, dans une variété d’habitats. Les adultes émergent de pupes situées dans le sol, pour s’alimenter de la plante hôte et se reproduire. Puis la femelle pond ses œufs dans les tissus jeunes de l’hôte. Après le développement de deux stades larvaires aux dépens des tissus de l’hôte, les larves tombent au sol. Dans le sol, elles réalisent deux stades pupaux (propupa et pupa) (CABI, 2016). L’espèce est multivoltine. Pour sa part, Selenothrips rubrocinctus est également polyphage ; à la différence de S. aurantii, l’ensemble du cycle de développement a lieu sur les feuilles de la plante hôte (OzThrips, 2016).
La Cochenille des Seychelles
Quatre espèces de cochenilles ont été recensées dans les vergers de manguiers à La Réunion (Amouroux & Normand, 2013). Parmi elles, Icerya seychellarum Westwood a connu une très forte croissance de ses populations sur l’ensemble de l’île à partir de 2011, qui est notamment due au parasitisme de son principale ennemi naturel, la coccinelle
Rodolia chermesina Mulsant, suite à l’invasion par Homalotylus eytelweinii (Ratzeburg)
(Hymenoptera : Encyrtidae) (Delpoux et al., 2013). Icerya seychellarum est une espèce d’insecte succivore à répartition pantropicale. Elle entraîne un affaiblissement de ses plantes hôtes selon deux effets : un effet direct par ponction de la sève élaborée des plantes ; un effet indirect de réduction des capacités photosynthétiques à cause du développement de
fumagine (champignons) sur le miellat excrété sur les feuilles des plantes hôtes. A La Réunion, des espèces de plantes appartenant à 17 familles différentes ont été répertoriées comme hôtes (Delpoux et al., 2013). Ces plantes occupent tous les types d’habitats : urbains, cultivés ou semi-naturels. L’intégralité du cycle biologique a lieu sur les plantes hôtes.
La lutte chimique dans une impasse
Les 4 espèces d’insectes nuisibles présentées ci-dessus ont des bioécologies différentes : une espèce monophage et trois espèces polyphages ; des espèces qui réalisent une partie de leur cycle biologique dans le sol, et d’autres non. La Punaise du manguier et la Cécidomyie des fleurs sont les deux ravageurs principaux des inflorescences de manguiers (Amouroux et Normand, 2013). Avant le projet Biophyto, le seul moyen de lutte pratiqué contre les insectes nuisibles des inflorescences était l’utilisation d’insecticide à base de lambda cyhalothrine (e-phy.agriculture.gouv.fr). Ce moyen de lutte apparaît inefficace et, de surcroît, représente un risque environnemental et sanitaire. Le développement de méthodes de lutte alternatives est un enjeu pour cette production fruitière, importante à La Réunion, et dans l’ensemble de la zone tropicale.
3 Objectifs et démarche scientifique
Le développement d’une production de mangues sans insecticides nécessite l’utilisation du service de régulation des insectes nuisibles, par la gestion des pratiques agricoles et du paysage. L’objectif général de la thèse est de décrire et de comprendre le rôle et la place de la biodiversité dans le fonctionnement écologique des agroéco-systèmes à base de manguiers à La Réunion, avec une attention particulière portée sur le service de régulation des insectes nuisibles, et en prenant en compte l’effet des pratiques agricoles et du paysage.
L’objectif général se décline en 4 objectifs spécifiques :
• faire l’état des connaissances bibliographiques sur le rôle de la biodiversité dans le fonctionnement des communautés, et les facteurs qui influencent la biodiversité et le contrôle des insectes nuisibles ;
• caractériser l’agroécosystème étudié : les communautés, les pratiques et les contextes paysagers ;
• identifier et comprendre le rôle et la place de la biodiversité dans les interactions multi-trophiques agissant dans les réseaux trophiques, en considérant les pratiques agricoles et le paysage ;
• identifier les services de la diversité des ennemis naturels et l’influence des pratiques agricoles et du paysage sur le contrôle des ravageurs.
Pour répondre à ces objectifs, la démarche scientifique développée dans cette thèse s’appuie principalement sur deux approches. Premièrement, nous développons une ap-proche systémique, en étudiant simultanément les objets et les facteurs à de multiples échelles : les communautés d’arthropodes et de plantes, les pratiques agricoles et le paysage. Cette approche nécessite de faire appel, à la fois, aux outils respectifs des disciplines cor-respondantes (entomologie au sens large, botanique, agronomie, écologie des communautés et écologie du paysage) et, également, d’utiliser des méthodes d’analyses statistiques spéci-fiques (modèles hiérarchiques, modèles d’équations structurelles). Deuxièmement, nous utilisons une approche observationnelle, plus qu’expérimentale. En effet, les travaux de la thèse sont réalisés sur un réseau de parcelles existant (réseau du projet Biophyto, visant à la production de mangues sans insecticides). Ce projet nous a permis d’étudier un réseau de 10 couples de parcelles, avec des différences de pratiques agricoles entre les parcelles d’un même couple, et entre les couples. Les objectifs et les contraintes spécifiques du projet n’ont pas donné lieu à un contrôle expérimental des pratiques agricoles, et le contexte de paysage n’a pas pu être choisi dans la constitution du réseau de parcelles.
Le manuscrit est organisé en 5 chapitres (Fig. 7) :
• le chapitre 1 présente l’état des connaissances sur : les relations entre la biodiversité et le fonctionnement des écosystèmes ; l’utilisation de la biodiversité pour le contrôle des arthropodes nuisibles des cultures ; les facteurs qui influencent les ennemis naturels et les insectes nuisibles ;
• le chapitre 2 présente les caractéristiques de l’agroécosystème étudié, aux 3 échelles d’étude. Il présente également le projet Biophyto, ainsi que les matériels et les méthodes employées pour l’acquisition des données utilisées dans les chapitre 3 et 4. Il présente enfin les résultats d’inventaires et de caractérisation écologique des communautés d’arthropodes ainsi que les caractéristiques des pratiques culturales et du paysage des parcelles étudiées ;
• le chapitre 3 traite de la compréhension des facteurs qui influencent la diversité des groupes trophiques et, en particulier, il vise à identifier le sens des interactions entre les groupes trophiques et les mécanismes sous-jacents ;
• le chapitre 4 traite des facteurs qui influencent la régulation des insectes nuisibles dans l’agroécosystème étudié. Nous testons l’influence de différents facteurs : la diversité des ennemis naturels, les pratiques agricoles et le paysage sur le service de prédation en général et sur l’abondance de quatre espèces d’insectes nuisibles des manguiers en particulier.
• le chapitre 5 constitue la discussion générale. Nous confrontons l’ensemble des résultats obtenus dans la thèse à la littérature ; nous proposons des perspectives de recherche, avant de revenir de manière critique sur les méthodologies employées ; nous présentons les applications possibles des résultats de la thèse pour le développement d’une production de mangues sans insecticides à La Réunion ; nous terminons par
un récapitulatif des apports de la thèse, à la fois par rapport aux connaissances scientifiques préalables et pour les implications dans la protection agroécologique des cultures.
Quelques repères sur l’organisation du manuscrit
• Les références bibliographiques de l’ensemble du manuscrit sont rassemblées dans une partie commune p. 125.
• Les annexes sont rassemblées en fin de manuscrit, après les références bibliogra-phiques.
• Les articles, publiés ou en cours de préparation, relatifs à chaque chapitre, sont brièvement présentés dans l’introduction des chapitres, puis ils sont présentés in
Biodiversité et fonctionnement
écologique des écosystèmes pour la
régulation naturelle des arthropodes
nuisibles des cultures
Introduction
Ce chapitre dresse l’état des connaissances touchant à plusieurs domaines d’étude : la place de la biodiversité (des espèces) dans les écosystèmes ; l’utilisation de la biodiversité pour le contrôle des arthropodes nuisibles des cultures ; les facteurs qui influencent les ennemis naturels et les insectes nuisibles. Cet état des connaissances vise à répondre à trois questions principales : quels sont les mécanismes qui interviennent, dans les communautés, dans le maintien de la biodiversité et dans les relations entre la biodiversité et le fonctionnement des écosystèmes ? Comment la diversité influence la régulation des arthropodes nuisibles des cultures ? Quels facteurs influencent la diversité et la régulation des arthropodes nuisibles dans les agroécosystèmes ?
Pour répondre à ces trois questions, nous adoptons la démarche suivante. Premièrement nous présentons les mécanismes généraux (supposés et/ou vérifiés) qui expliquent la relation entre la biodiversité et le fonctionnement des écosystèmes, issus de différents types d’écosystèmes. Nous étudions les effets de la biodiversité sur le fonctionnement des écosystèmes dans un ordre croissant de complexité : pour un niveau trophique, dans les relations consommateur-ressource, puis dans systèmes à au moins 3 niveaux trophiques. Deuxièmement, nous traitons des mécanismes impliqués et de la nature des relations entre la biodiversité et le contrôle des herbivores nuisibles. Troisièmement, nous nous intéressons aux facteurs qui influencent la biodiversité et ce service dans les agroécosystèmes, toujours dans un ordre croissant de complexité, en traitant d’abord de l’effet de la diversité des plantes à l’échelle locale, puis des comparaisons de pratiques agricoles d’intensités différentes et, enfin, des effets du paysage et des effets simultanées à l’ensemble de ces échelles.
Cette synthèse souligne que ces différents domaines nécessitent le développement d’approches mécanistiques, qui à la fois prennent en compte la composition multi-trophique des communautés et considèrent les processus à des échelles larges de temps et d’espace (paysage). Il ressort qu’il y aurait une plus-value à partager les outils et les approches des études sur les relations entre la biodiversité et le fonctionnement des écosystèmes et les études visant à identifier des leviers pour la régulation naturelle des arthropodes nuisibles dans les agroécosystèmes.
Cette synthèse bibliographique est largement rédigée et va être soumise, avant la fin 2016, au journal Agronomy for Sustainable Development :
Jacquot M., Rusch A., Sarthou J.-P, & Deguine J.-P. (en préparation). Linking biodiversity, ecosystem functioning and biological control of arthropod pest in agroecosystems : a review.
Les deux premières parties de cette synthèse sont présentées, en anglais, telles qu’elles seront soumises dans l’article. La troisième partie est en cours de rédaction. Sur la base des processus mis en avant dans les parties précédentes, elle analyse qualitativement les situations dans lesquelles les leviers pour augmenter la régulation naturelle fonctionnent ou ne fonctionnent pas. Enfin, cette partie proposera des perspectives et identifiera des besoins de recherche sur ces questions.
1.1 Mechanisms involved in the relationship between
biodiversity and ecosystem processes
1.1.1 Biodiversity of a single trophic level
Studies of the relationship between biodiversity and ecosystem function began with one tropic level in the majority of plants (primary producers) and one of their function : the production of biomass (Balvanera et al., 2006 ; Cardinale et al., 2006b). These studies suggest two mechanisms to explain the effects of biodiversity on a single trophic level, at a given time, on ecosystem function : complementarity effects and the selection effect (Loreau & Hector, 2001).
Figure 1.1 –Schematic representation of the mechanisms involved in the relationship between biodiversity and ecosystem function within a single trophic level (Adapted from Loreau et al. (2001))
Complementarity occurs when the performance of a species assemblage is greater than what is expected from the respective performances of the component species (Tilman
between species. Selection effect is the processes leading to dominance of species with particular traits in a community (Loreau & Hector, 2001). Added to this is the sampling effect ; many authors consider this as synonymous with the selection effect, but like Loreau & Hector (2001), we consider it to be a mechanism that works upstream of the selection effect and complementarity. The sampling effect is a random process : the greater the number of species in a community, the greater the diversity of traits. This results in a greater probability that the community supports species with particular traits that can be dominant and/or form combinations of species with complementary traits. The mechanisms of selection and complementarity are not mutually exclusive, rather, they form a continuum between pure dominance and pure complementarity (Loreau et al., 2001) (Fig. 1.1).
The meta-analysis done by Cardinale et al. (2006b), on the effect of biodiversity on the functioning of four trophic groups (plants, herbivores, predators and detritivores) in two ecosystems (aquatic and terrestrial), provides a significant contribution to understanding the effects of biodiversity. It is based on 111 experimental studies that have manipulated biodiversity to observe the effect on the ecosystem function. Their results show, on average, the more a trophic group is species-rich, the greater its abundance and biomass, leading to a decrease in the resource it consumes. Moreover, Cardinale et al. (2006b) show that there is no difference between the effect of the most diversified species assembly and the effect of the most productive species in the experiment. The authors attribute this result to the sampling effect coupled with the selection effect : a more diverse community would increase the probability of dominance by the most productive species. Note that for consumer trophic groups, the impact of biodiversity goes beyond their trophic level, since they impact lower trophic levels by consuming them.
Communities are exposed to changes in their environment over time. According to the insurance hypothesis (Yachi & Loreau, 1999), the biodiversity of a trophic level has long-term effects on ecosystem function. Species with different functional characteristics respond simultaneously to their environment ; this helps stabilize ecosystem processes by reducing their variability (buffer effect) and increasing the temporal average of processes (performance-enhancing effect) (Yachi & Loreau, 1999). Species that appear redundant at a specific time can be complementary over time (Loreau et al., 2001). Biodiversity also offers insurance of space for ecosystem processes via species complementarity in an environment which changes over time and is heterogeneous in space (Loreau et al., 2003).
1.1.2 Biodiversity in consumer-resource systems (2 trophic
le-vels)
There are two opposing forces in consumer-resource systems, top-down forces of consumers on resources and bottom-up forces of resources on consumers (Leroux & Loreau, 2015).