Anesthésie pour fracture du col du fémur chez le
sujet âgé :
Comparaison entre rachianesthésie standard et rachianesthésie
continu à propos de 42 cas
Mémoire Présenté par
Dr El bouti Anass
Sous la direction du Pr Bensghir Musapha
En vue de l’obtention du
Diplôme National de Spécialité en anesthesie et reanimation
Remerciements
Je présente mes remerciements, mon respect et ma gratitude :
A monsieur le professeur BENSOUDA Adil
Professeur d'enseignement supérieur Chef de l’unité pédagogique et de
recherche d’anesthésie-réanimation de Rabat
A Monsieur le colonel major BAIT ABDELOUAHED
Professeur d'enseignement supérieur Chef de pole Anesthésie-Réanimation de
l’hôpital militaire d'instruction MEDV de RABAT
A Monsieur le professeur AHMED EL HIJRI
Professeur d'enseignement supérieur Chef de service d’anesthésie-réanimation
chirurgicale de l’hôpital Avicenne de Rabat
A Monsieur le professeur ZAKARIA HOUSSAIN BELKHADIR
Professeur d'enseignement supérieur
Chef de Service de Réanimation Anesthésie et traitement de la Douleur. Institut
National d’Oncologie-CHU Rabat
A Monsieur le Professeur Bensghir Mustapha
Professeur d'enseignement supérieur Service d’Anesthésiologie d’HMIMV
A TOUS MES MAITRES
Nous vous remercions d’avoir partagé avec nous votre passion pour l’anesthésie réanimation, vous avez guidé nos pas durant toutes ces années. Nous resterons à jamais
reconnaissants.
Liste des figures
Figure 1 : Incidence par pays des fractures de la hanche chez les femmes en fonction de l’âge ...
Figure 2 : Classification de Pauwels des fractures du col fémoral ...
Figure 3 : Classification de Garden de la fracture du col fémoral ...
Figure 4 : Evolution de la mortalité opératoire en fonction de l’âge des patients ...
Figure 5 : Modifications pharmacocinétiques liées à l’âge ...
Figure 6 : Contenu du canal rachidien ...
Listes des tableaux
Tableau 1 : Modifications du système nerveux chez le sujet âgé et implications anesthésiques ...
Tableau 2 : Modifications cardiovasculaires chez le sujet âgé et implications anesthésiques .... Tableau 3 : Modifications de l’appareil respiratoire chez le sujet âgé et implications Anesthésiques ... Tableau 4 : Modifications de l’appareil digestif chez le sujet âgé et implications Anesthésiques ... Tableau 5 : Modifications de l’appareil urogénital chez le sujet âgé et implications anesthésiques. ... Tableau 6 : Modifications physiologiques liées au vieillissement ... Tableau 7 : Consultation d’anesthésie et évaluation préopératoire ... Tableau 8 : évaluation de la réserve énergétique en équivalent métabolique (MET) ... Tableau 9 : principales complications postopératoires ... Tableau 10 : diagnostic du syndrome confusionnel ... Tableau 11 : Algoplus®, échelle d’évaluation comportementale de la douleur aiguë chez la personne âgée présentant des troubles de la communication verbale ... Tableau 12 : Caractéristiques démographiques des patients... Tableau 13 : Données per opératoire des patients ... Tableau 14 : Causes de retard intervention pour fracture du col de fémur... Tableau 15 : Délai d’intervention pour fracture du col de fémur ... Tableau 16 : Algorithme de prise en charge pour fracture du col de fémur ...
Table de matières
Les sommaires ...
Liste des figures ...
Listes des tableaux ...
Table de matières ...
Partie théorique: Fracture du col de fémur ...
I. Epidémiologie et facteurs de risques ...
A. Epidémiologie ...
B. Facteurs de risque: ...
II. Etude Radio-Clinique ...
III. Classification anatomopathologique ...
IV.Traitement ...
Partie théorique: Particularitées anesthésique du sujet âge ...6
I. Introduction ...
II. Modifications physiologiques ...
III. Modifications pharmacologiques ...
A. Modifications pharmacocinétiques ...
B. Modifications pharmacodynamiques ...
IV. Évaluation préopératoire ...
V. Période per opératoire ...
A. Installation per opératoire ...
B. Monitorage ...
C. Induction et entretien de l’anesthésie ...
F. Choix de la technique anesthésique ...
1. Anesthésie générale ...
2. Anesthésie locorégionale ...
3. Anesthésie péri médullaire ...
a. Anatomie ...
c. Anesthésie épidurale...
d. Rachianesthésie Continue ...
VI. Période postopératoire ...
A. Confusion mentale ...
B. Dysfonction cognitive postopératoire ...
C. Prévention de la maladie thromboembolique ...
D. Douleur postopératoire ...
1.Evaluation de la douleur ...
2.Traitement ...
* Opiacés ...
* Anti-inflammatoires non stéroïdiens ...
* Anesthésie locorégionale ...
Partie Pratique...
I. Introduction ...
II. Patients et méthodes ...
A. Type d’étude ...
B. Lieu de l’étude et période d’étude ...
C. Critères d’inclusion ...
D. Critères d’exclusion ...
E. Randomisation ...
F. Technique anesthésique ...
G. Comparaison entre les deux groupes ...
1. Objectif principal...
2. Objectifs secondaires ...
H. Post opératoire ...
I. Analyse statistique ... 41
B. Sexe ...
C. L’index de masse corporel ...
D. Classe ASA ...
E. Les traitements antérieurs ...
F. Délai admission/ intervention ...
G. Espace abordé...
H. Type d’abord ...
I. Echec...
J. Hypotension ...
K. Régression du bloc sensitif ...
L. Satisfaction chirurgiens/ Patients ...
M. Les mouvements enzymatiques ...
N. Effets secondaires / complications ...
IV. Discussion ...
A. Fracture du col de fémur ...
1. Données épidémiologique ...
2. Gravité...
a. La mortalité ...
b. Cadre de vie ...
c. Capacités fonctionnelles ...
d. Risque d’altération des fonctions cognitives ...
B. Délai d’intervention chirurgicale ...
C. Causes de retard de l’intervention ...
D. Evaluation et préparation du patient...
1. Evaluation du patient ...
2. Préparation du patient ...
a. Optimisation cardiovasculaire ...
c. Optimisation métabolique ...
d. Optimisation des traitements ...
E. Choix de la technique anesthésique ...
1. Rachianesthésie standard ...
2. Rachianesthésie continue ...
V. Les limites de l’étude ...
Conclusion ...
Résumé ...
Abstract ...
صخلملا ...
Partie théorique:
I.
Epidémiologie et facteurs de risques
Les fractures du col fémoral après 50 ans sont des pathologies Fréquentes et graves. Elles représentent une forte proportion des patients hospitalisés pour traumatisme dans Les pays industrialisés.
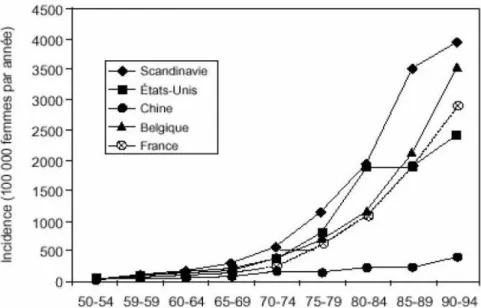
L’incidence estimée en France est de 11 pour 1000 femmes entre 75 et 84ans et de 33 pour 1000 femmes après 85ans selon la DREES [1], l’augmentation de La population et son vieillissement font que cette incidence Augmentera de façon exponentielle dans les années à venir [2]. C’est une pathologie grave, qui est responsable d’un décès péri-opératoire sur deux en orthopédie traumatologie, et d’une lourde morbidité [3]. La mortalité à un an varie autour de 26% [4].
Les troubles cognitifs postopératoires sont responsables de fréquentes ré-hospitalisations et d’une perte d’autonomie dans près de la moitié des cas [5-6]. Ce mauvais pronostic est plus le reflet de l’état général préfracturaire des malades que de la gravité de la fracture elle-même , comme en témoignent les facteurs de risque de mortalité et morbidité (grand âge, sexe, score ASA, autonomie. . .) rapportés dans la littérature [7, 8,9].
Figure 1 : Incidence par pays des fractures de la hanche chez les
femmes en fonction de l’âge (10)
Parmis les facteurs de risque , on distingue l’osteoporose , la perte de poids s'accompagnant d'une perte de masse grasse, l'augmentation de l'âge de plus de 65 ans et le
sexe féminin .
II.
Diagnostic de fracture du col fémoral
Le diagnostic de fracture du col fémoral est généralement facile, il repose sur des éléments cliniques (heure de la fracture , circonstances de survenue à savoir une chute de sa hauteur ou un AVP , le mécanisme , l’age et les antécédents du patient, les signes
fonctionnels à savoir une douleur vive au niveau de la hanche associée à une impotence fonctionnelle totale du membre inférieur , avec à l’examen clinique une attitude vicieuse en adduction avec rotation externe, amyotrophie quadricipitale ou fessière, boiterie et un raccourcissement du membre par mesure de la distance EIAS- Malléole interne.)
L'étude radiologique consiste à analyser le trait de fracture, sa topographie et son orientation, à évaluer le degré de déplacement sans oublier d’apprécier l'état des berges fracturaire liées à la recherche de sclérose.
III.
Classification anatomopathologique
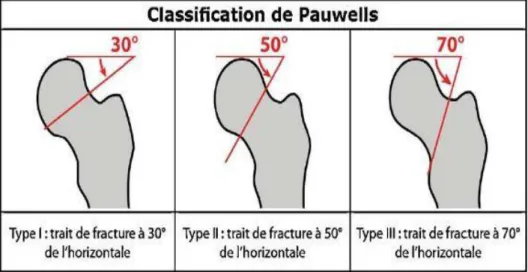
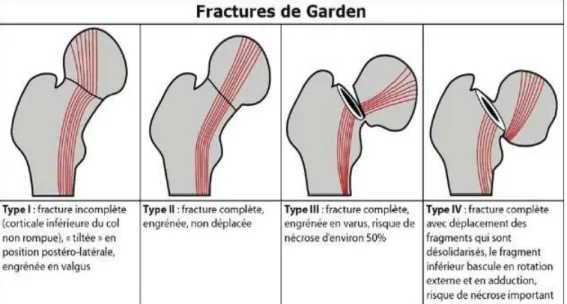
Plusieurs classifications ont été decrite , en fonction de la direction du trait de fracture (classification de Pauwels ayant une valeur pronostic) et en fonction de la direction des travées osseuses (Classification de Garden). Figures 2 et 3 [11-12]
Figure 3 : Classification de Garden de la fracture du col fémoral (12)
IV.
Traitement
[13,14,15,16]Le traitement doit être précoce vise à sauver la vie du patient en évitant les complications du décubitus par une thérapeutique chirurgicale permettant un lever et un appui précoces . Ainsi qu’à préserver la fonction du membre fracturé.
Pour ce qui concerne les moyens therapeutiques , Le traitement est medico-chirugico-orthopedique.
Les moyens medicaux sont : les antalgiques , antis -inflammatoires non stéroïdiens , anti-œdémateux et myorelaxants.
Le traitement orthopédique : mise en traction jusqu’à guérison d'une fracture de l'extrémité supérieure du fémur peut donner lieu à de nombreuses complications liées à de longues périodes d'alitement et d'immobilisations.
Le traitement chirurgical : par ostéosynthèse , se répartissent en vissage multiple et en vis-plaque , l’arthroplasties (trois types d'arthroplasties ont été proposés dans les fractures cervicales vraies récentes: cervico-céphaliques, simples, intermédiaires,
Concernant les indications : le traitement chirurgical des fractures du col fémoral a fait ces dernières années des progrès indiscutables:
Chez le sujet jeune : L'ostéosynthèse en urgence permet de donner à la tête fémoraletoutes ses chances de revascularisation, le taux actuel de nécrose ne devrait plus être lié qu'aux lésions vasculaires initiales, non accessible à quelconque geste chirurgical.
Chez les personnes âgées : L'arthroplastie reste l'indication essentielle pour lesfractures déplacées Entre 40 et 60 ans : l,2 de Garden ostéosynthèse, 3 et 4 de Garden: prothèse totale de la hanche.
Ainsi les prothèses cervico-céphaliques sont réservées pour les sujets dont l'espérance de vie est courte, et les sujets en état d'indépendance, vu le taux élevé de l'usure cotyloïdienne retrouvé dans ce type de prothèse.
Particularitées
anesthésique du sujet
âgé
I.
Introduction
Il y a deux décennies l’organisation mondiale de la santé définissait la vieillesse par un âge supérieur à 60 ans. En raison de l’allongement de la durée de vie, cette définition n’est plus adaptée, et on estime que le sujet âgé (vieillard) est celui qui a plus de 75 ans. Un âge supérieur à 90 ans définit le grand vieillard.
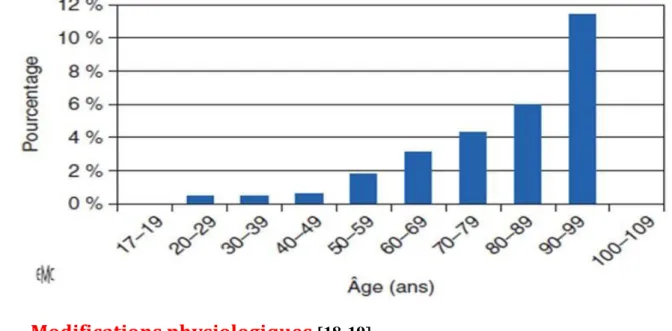
La population âgée nécessite plus fréquemment une intervention chirurgicale, notamment en orthopédie, urologie, gynécologie et ophtalmologie. Les interventions sont réalisées plus souvent en urgence. Dans de nombreuses études, l’âge est un facteur de risque opératoire indépendant (Figure 4) Ce chapitre traitera des modifications physiologiques et pharmacologiques liées au vieillissement, de l’évaluation préopératoire, de la prise en charge per opératoire, des techniques anesthésiques, anesthésie générale et anesthésies locorégionales, de la période postopératoire.
Figure 4 : Evolution de la mortalité opératoire en fonction
de l’âge des patients (17)
II.
Modifications physiologiques
[18-19]Le vieillissement s’accompagne d’un déclin et d’une détérioration des fonctions de tous les organes. Ceci se traduit par une diminution des réserves fonctionnelles qui altère l’homéostasie et diminue l’adaptabilité aux agressions. L’intensité et la progression du vieillissement ne sont pas parallèles à l’âge chronologique. De même, au niveau des différents
appareils, les modifications liées au vieillissement ne surviennent pas à un rythme identique. Les maladies chroniques (maladies cardiovasculaires, pulmonaires, neurodégénératives, diabète) se surajoutent au vieillissement normal et sont un facteur supplémentaire d’amputation des réserves fonctionnelles . En pratique, il est souvent difficile de distinguer ce qui est lié au vieillissement physiologique et aux maladies associées.
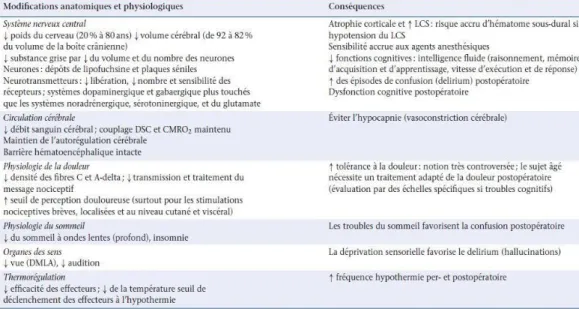
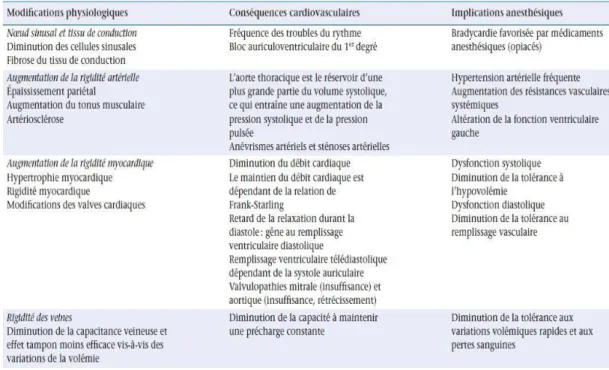
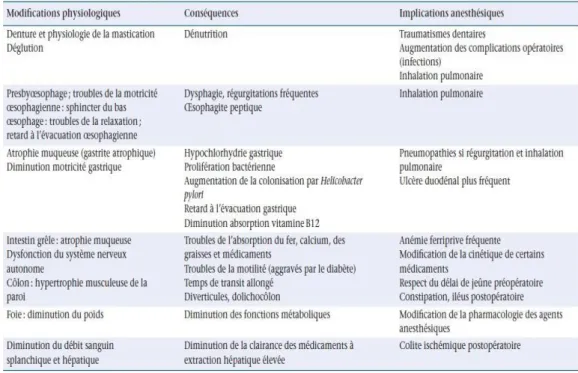
Les principales modifications physiologiques et leurs Implications anesthésiques sont résumées dans les Tableaux 1 à 5.
Tableau 1 : Modifications du système nerveux chez le sujet âgé
et implications anesthésiques
Tableau 2 : Modifications cardiovasculaires chez le sujet âgé
et implications anesthésiques
Tableau 3 : Modifications de l’appareil respiratoire chez le sujet âgé
et implications Anesthésiques
Tableau 4 : Modifications de l’appareil digestif chez le sujet âgé
et implications Anesthésiques
Tableau 5 : Modifications de l’appareil urogénital chez le sujet âgé
et implications anesthésiques.
III.
Modifications pharmacologiques
[20-21]Les modifications anatomiques et physiologiques liées au vieillissement modifient la pharmacocinétique et la pharmacodynamie des médicaments. Les maladies associées ajoutent leurs effets, de même que des facteurs génétiques et environnementaux.
Plus encore que chez l’adulte jeune la variabilité individuelle est grande. Les traitements médicamenteux multiples accroissent le risque des interférences médicamenteuses (sous-dosage ou sur(sous-dosage). Les mécanismes en cause associent l’interaction au niveau des sites de fixation aux protéines et l’interaction au niveau des sites de métabolisme (induction ou inhibition enzymatique) et d’élimination rénale.
Les études pharmacocinétiques chez les sujets de plus de 80 ans sont rares et, de plus, les études longitudinales qui fournissent le plus d’informations sont inexistantes.
A. Modifications pharmacocinétiques
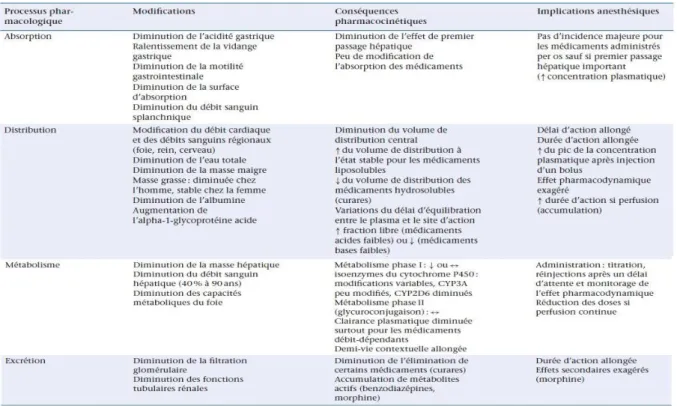
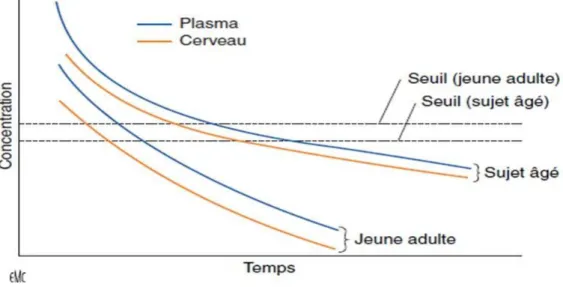
Les différentes étapes de la distribution et de l’élimination des médicaments sont modifiées à des degrés variables par le vieillissement (Tableau 6 et figure 5) .
Tableau 6 : Modifications physiologiques liées au vieillissement
et effets sur la pharmacocinétique des médicaments
Figure 5 : Modifications pharmacocinétiques liées à l’âge.
La diminution de la clairance plasmatique totale entraîne une décroissance plus lente de la concentration cérébrale et plasmatique de l’agent anesthésique. Le résultat est un allongement de la durée d’action. Le même raisonnement s’applique aux curares non dépolarisants et à la jonction neuromusculaire.
B. Modifications pharmacodynamiques
Le sujet âgé a une sensibilité accrue à l’effet des médicaments qui peut s’expliquer par deux mécanismes différents. Soit il s’agit d’une modification de la réactivité de l’organe cible (réduction du nombre des récepteurs ou action accrue ou diminuée au niveau des récepteurs), soit les modifications pharmacocinétiques sont en cause. La distinction entre ces deux mécanismes est difficile, et peu d’études chez des sujets très âgés sont disponibles. La sensibilité accrue aux effets des anesthésiques est objectivée par une diminution de la CE50 (concentration plasmatique pour laquelle l’effet est réduit de 50 %). Une sensibilité accrue du système nerveux central est démontrée pour le propofol, les morphiniques, les benzodiazépines et les anesthésiques volatils (diminution de la minimal alveolar concentration [MAC]). Pour les autres médicaments, l’intervention à des degrés variables des deux mécanismes est vraisemblable
IV.
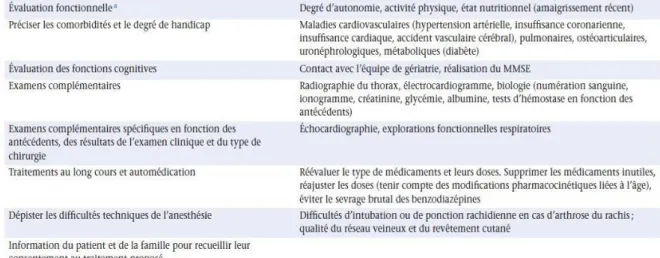
Évaluation préopératoire
Les objectifs spécifiques de la consultation d’anesthésie chez le sujet âgé sont résumés dans le Tableau 7 [22–23]. La concertation pluridisciplinaire est indispensable pour choisir la technique et proposer une intervention complexe chez un patient souffrant de démence et dépendant. La consultation pré anesthésique doit évaluer les fonctions cognitives et l’existence de comorbidités en raison de leur importance dans la qualité de l’évolution postopératoire [24]. La présence de troubles cognitifs est un des principaux facteurs prédictifs de complications postopératoires.
La dépression est fréquente chez le sujet âgé et son diagnostic n’est pas toujours établi avant l’hospitalisation. En cas de doute, Une évaluation spécialisée est conseillée [24]. Le syndrome démentiel, très fréquent chez le patient chirurgical au-delà de 80 ans, est un état d’altération progressive et irréversible des fonctions cognitives. On distingue les démences dégénératives corticales (maladie d’Alzheimer, démences fronto-temporales), les démences dégénératives sous-corticales (paralysie supra nucléaire progressive), et les démences vasculaires.
Le degré d’autonomie du patient est un élément essentiel dans le choix thérapeutique. La dépendance du sujet vis-à-vis de son environnement est évaluée par deux échelles qui mesurent, l’une les activités basales du sujet dans la vie courante (activity of DailyLiving [ADL]), et l’autre, l’instrumental ADL (IADL) qui évalue les activités qui nécessitent un instrument ou une relation (par exemple : utiliser le téléphone, prendre un moyen de transport, manipuler de l’argent) [24]. Si ces tests ne sont pas disponibles, l’évaluation de la capacité du patient à se déplacer sans aide est un bon critère du maintien d’une capacité fonctionnelle suffisante pour faire face au stress chirurgical.
Les déficits sensoriels et cognitifs rendent difficiles les explications et le recueil du consentement éclairé exigé par la famille permet de s’informer des désirs du patient quant à sa prise en charge.
La réalisation des examens complémentaires (biologie, exploration cardiovasculaire) est décidée en fonction des données de l’anamnèse, de l’examen clinique et de l’importance de l’acte chirurgical [25].
L’évaluation cardiaque suit les recommandations de l’European society of Anesthesiology [26]. Le score de Lee (Revised CardiacRisk Index) est le score le plus utilisé, mais il a une moins bonne valeur prédictive des complications cardiovasculaires chez le sujet de plus de 75 ans [27].
Le risque cardiaque est fonction de la capacité fonctionnelle du patient. La classe fonctionnelle est basée sur la capacité à réaliser certains efforts exprimés en metabolic equivalents (MET ou équivalents métaboliques). Le risque cardiaque est augmenté lorsque le MET est inférieur à 4. Cette évaluation fonctionnelle est plus difficile chez le sujet âgé [28].
L’électrocardiogramme (ECG) est systématique, mais il n’a que peu de valeur prédictive des complications cardiovasculaires [29].Les anomalies ECG sont fréquentes et augmentent avec l’âge. Par exemple, dans l’étude de Framingham, une onde Q d’infarctus du myocarde est découverte fortuitement chez 46 % des femmes âgées de 85 à 95 ans.
La dysfonction diastolique est une cause fréquente (près de50 % des cas) d’insuffisance cardiaque chez le sujet de plus de80 ans. Lorsque la dysfonction diastolique est isolée, il y a en général une hypertension artérielle systolique et une hypertrophie ventriculaire gauche. Le diagnostic est écho cardiographique par l’analyse du flux transmitral, de la vitesse du flux dans les veines pulmonaires et le doppler tissulaire [30].
Lorsque le diagnostic d’insuffisance cardiaque est incertain, le dosage de certains marqueurs comme le pro-peptide natriurétique cérébral (pro-BNP) peut aider au diagnostic. Néanmoins, ces marqueurs ne permettent pas de différencier la dysfonction diastolique de la dysfonction systolique, et leur utilisation en routine pour l’évaluation préopératoire n’est pas conseillée.
L’attitude vis-à-vis des médicaments cardiovasculaires n’a pas de spécificité. La plupart des médicaments ne sont pas interrompus [24]. Il faut veiller au maintien des bêtabloquants et des statines. Les inhibiteurs de l’enzyme de conversion (IEC) et les antagonistes des récepteurs à l’angiotensine (ARA) prescrits pour traiter l’hypertension artérielle sont arrêtés 24 à 48 heures avant une intervention majeure. Leur arrêt n’est pas nécessaire en cas d’intervention mineure ou lorsqu’ils sont prescrits pour traiter l’insuffisance cardiaque.
L’acide acétylsalicylique n’est interrompu que pour certains actes (urologie). Le clopidogrel est arrêté en fonction du type d’acte et en concertation avec le chirurgien ou l’endoscopiste (Recommandations de la spécialité).
La prise en charge du patient diabétique obéit aux règles habituelles. Chez le patient âgé, il ne faut pas viser une normalisation trop stricte de la glycémie, une glycémie inférieure à 1,80 g/l étant acceptable [31].
La dénutrition est fréquente. Elle est difficile à quantifier et les deux critères les plus simples sont l’hypo albuminémie et un indice de masse corporelle (IMC) inférieur à 20 kg m2 Au terme de la consultation d’anesthésie, le patient peut se situer entre deux extrêmes. D’une part, le cas du « vieillissement réussi », il s’agit du patient qui n’a aucune comorbidité, aucune dépendance et aucune limitation fonctionnelle. Ce patient est identique à un adulte de moins de 70 ans. À l’opposé, le patient peut cumuler tous les désavantages, âge très avancé (plus de 85 ans), plus de deux comorbidités et perte d’autonomie. Il est évident que les choix thérapeutiques seront différents dans ces deux cas.
Tableau 7 : Consultation d’anesthésie et évaluation préopératoire
Les réserves fonctionnelles sont évaluées par le niveau d’activité physique, exprimé en MET (équivalents métaboliques) que le patient est capable de fournir. Une réserve fonctionnelle inférieure à 4 MET est une contre-indication relative à un acte chirurgical majeur [26].
Tableau 8 : évaluation de la réserve énergétique en équivalent
métabolique (MET) (32)
V.
Période per opératoire
A. Installation per opératoire
Le sujet âgé est très sensible aux compressions et élongations cutanées, musculaires, ostéoarticulaires et nerveuses. L’installation sur la table d’opération doit protéger les points d’appui et éviter les positions extrêmes (proclive, position de Trendelenburg, lombotomie). Il faut éviter l’extension excessive de la colonne cervicale (traction sur les carotides, cervicalgies postopératoires) et lombosacrée (lombalgies).
La prévention de l’hypothermie doit débuter dès l’entrée en salle d’opération, par la mise en place d’un système à air pulsé. Les bas de contention participent à la prévention de la maladie thromboembolique.
B. Monitorage
Pour les interventions courantes, le monitorage standard est suffisant. Le positionnement correct des électrodes de l’ECG permet la surveillance des troubles du rythme cardiaque et l’analyse du segment ST en l’absence de bloc de branche intra ventriculaire.
La mesure non invasive de la pression artérielle (PNI) nécessite quelques précautions comme le choix d’un brassard adapté à la circonférence du bras et le placement correct du brassard pour éviter les lésions cutanées liées aux compressions itératives. La sclérose des artères et l’arythmie complète par fibrillation auriculaire diminuent la précision de la mesure. Pour les interventions majeures, la mise en place d’un cathéter artériel radial permet la surveillance continue de la pression artérielle et les prélèvements sanguins pour les examens biologiques.
De nombreuses méthodes non invasives de surveillance du débit cardiaque sont utiles dans la conduite du remplissage vasculaire.
C. Choix de la technique anesthésique
1. Anesthésie générale
La position opératoire et la durée de l’anesthésie obligent à la sécurisation des voies aériennes supérieures par intubation orotrachéale. L’anesthésie associe un hypnotique intraveineux et /ou par inhalation (gaz halogéné) à un morphinique pour lutter contre les réactions sympathiques liées aux temps douloureux de la chirurgie. L’utilisation d’un myorelaxant (curare) peut être utile pour intubation, surtout chez les sujets âgés ou fragiles. La curarisation peut également faciliter certaines phases de la chirurgie, mais n’est pas obligatoire [33].
2. Anesthésie locorégionale
Les techniques d’anesthésie locorégionale (ALR) sont multiples et peuvent être réalisées à différents niveaux du système nerveux central et périphérique. Le choix dépend avant tout de la topographie du geste chirurgical, mais aussi de la nature et de la durée de l’intervention.
Longtemps relativement méconnus et peu enseignés, les blocs périphériques ont connu un certain nombre de développements techniques et d’indications nouvelles au cours de la dernière décennie. Ils ont ainsi progressivement gagné une place particulière entre les anesthésies générales et les anesthésies péri médullaires, dont ils ne partagent ni tous les avantages, ni tous les inconvénients. L’anatomie topographique et fonctionnelle des sites en cause doit impérativement être connue, condition indispensable à la maîtrise des techniques de repérage et des complications potentielles des diverses techniques.
Pour les blocs périphériques, il faut bien évidemment respecter les règles de sécurité qui sont celles de toute anesthésie, et la réalisation d’un bloc périphérique, si simple qu’elle puisse paraître, ne doit pas constituer un alibi à une paupérisation des moyens mis en œuvre.
Une information claire, précise et loyale, délivrée lors de la consultation d’anesthésie, est une règle incontournable et le prélude indispensable à une bonne acceptation de la technique envisagée. Les patients doivent notamment être informés de la possibilité, jamais nulle, d’échec technique. Une technique refusée par un patient doit être considérée comme contre-indiquée. La consultation permet en outre, par un interrogatoire et une recherche anamnestique précise, de dépister d’éventuelles contre-indications d’ordre allergique, hémostatique ou infectieux. La préparation du patient est la même que pour une anesthésie générale, notamment en ce qui concerne la prémédication anxiolytique, pas toujours impérative. Au bloc opératoire, une voie veineuse périphérique est mise en place et pourra, le cas échéant, servir à administrer une sédation de complément, soit pour réaliser le geste anesthésique, soit pour optimiser le confort psychique per opératoire.
Avant toute ALR, le matériel et les produits nécessaires à une réanimation cardiovasculaire et respiratoire, notamment ceux permettant de faire face à un accident cardiotoxique induit par les anesthésiques locaux (AL), doivent être préparés et immédiatement disponibles (oxygène, matériel d’intubation, thiopental, succinylcholine…). La zone de ponction est préalablement désinfectée à l’aide d’une solution antiseptique et le point de ponction est infiltré par un bouton intradermique de lidocaïne à 1%.
Dans les nerfs périphériques, le nombre d’axones et la vitesse de conduction diminuent, surtout dans les fibres motrices [34]. La réduction de la quantité de myéline augmente la perméabilité des fibres aux anesthésiques locaux, notamment par modification des canaux ioniques sodés. Il en résulte une diffusion accrue et Une plus grande sensibilité à l’action des anesthésiques locaux. De plus, le tissu conjonctif est moins dense, facilitant l’accès aux fibres nerveuses des anesthésiques. De nombreux facteurs, et l’influence de l’âge n’est pas aisée à Identifier. Pour le bloc du plexus brachial, on observe une installation plus rapide et une durée allongée (pratiquement doublée) [35].
La réalisation des blocs nerveux est guidée par l’échographie associée ou non à la stimulation électrique. La réduction de la population nerveuse des nerfs périphériques pourrait
Ce risque n’a pas été clairement identifié par des études prospectives.
3. Anesthésie péri médullaire
a. AnatomieLa colonne vertébrale se compose de 33 vertèbres séparées par des disques intervertébraux. La colonne vertébrale n’est pas rectiligne. Dans le plan médio sagittal, elle présente deux courbures à convexité antérieure (lordoses cervicale et lombaire) et deux courbures à convexité postérieure (cyphoses dorsale et sacro coccygienne).
À l’exception des deux premières vertèbres cervicales (atlas, axis) et des vertèbres sacro coccygiennes, les vertèbres ont de nombreux points communs. Elles comprennent toutes une partie antérieure cylindrique, le corps vertébral. De la face postérieure du corps vertébral s’étendent de chaque côté les pédicules qui se continuent par les lames vertébrales. L’espace limité par la face postérieure du corps vertébral, les pédicules et les lames forme le trou vertébral, et les trous vertébraux superposés constituent le canal rachidien. Les bords supérieur et inférieur des pédicules délimitent, avec les bords correspondants des pédicules sus- et sous-jacents, les trous intervertébraux (ou trou de conjugaison) par lesquels sortent les nerfs rachidiens. À la jonction du pédicule et de la lame vertébrale se détachent en haut et en bas les apophyses articulaires, et latéralement l’apophyse transverse. Enfin, de la réunion des deux lames naît l’apophyse épineuse.
C’est l’orientation des apophyses épineuses qui détermine celle de l’aiguille pour pénétrer dans l’espace épidural ou intrathécal. Cette orientation est horizontale au niveau cervical, inclinée en bas et en arrière en se chevauchant au niveau thoracique, et horizontal avec une faible inclinaison vers le bas au niveau lombaire.
Le contenu du canal rachidien est illustré dans la figure 6. La moelle épinière s’étend de la
première vertèbre cervicale à la deuxième vertèbre lombaire (L2). Elle présente deux renflements : cervical et lombaire, correspondant à l’émergence des racines spinales destinées aux membres. Au renflement lombaire fait suite un court segment médullaire de forme conique : le cône terminal, prolongé par le filum terminale. De la moelle naissent les racines spinales. Les racines postérieures ou sensitives présentent une dilatation, le ganglion spinal et s’unissent aux racines antérieures ou motrices à proximité des trous intervertébraux, pour
former les nerfs rachidiens. Il existe 31 paires de nerfs rachidiens : 8 paires cervicales, 12 dorsales, 5 lombaires, 5 sacrées et une coccygienne.
Chaque nerf rachidien est relié au système nerveux sympathique par les rameaux communiquant. Les premiers nerfs cervicaux sont presque horizontaux et sortent du canal rachidien à un niveau voisin de leur émergence médullaire. Ensuite, au fur et à mesure que l’on se dirige vers le bas, ils deviennent de plus en plus verticaux.
Dans le canal rachidien, la moelle et les racines sont protégées par les enveloppes méningées. La pie-mère est un feuillet très fin et richement Vascularisé qui adhère étroitement à la moelle et aux racines. Qu’elle suit jusqu’à leur émergence du trou intervertébral. Latéralement, de chaque côté de la moelle, la pie-mère envoie une expansion jusqu’à la dure-mère, sur laquelle elle se fixe de façon discontinue, pour former le ligament dentelé qui sépare de chaque côté les racines antérieures des racines postérieures. La dure-mère est une membrane fibreuse épaisse qui tapisse le canal rachidien jusqu’au sacrum. Elle est séparée des vertèbres par un espace graisseux très riche en vaisseaux : L’espace épidural.
La dure-mère est traversée par les nerfs rachidiens qu’elle engaine jusqu’à la sortie du trou intervertébral. La face interne de la dure-mère est tapissée par une fine membrane, l’arachnoïde, dont elle est séparée par un espace virtuel : l’espace sous-arachnoïdien.
L’arachnoïde est séparée de la pie-mère par un large espace rempli de liquide céphalo-rachidien (LCR) : l’espace sous-arachnoïdien.
L’espace compris entre le cône terminal de la moelle (L2) et l’extrémité inférieure du sac dural est occupé par les derniers nerfs lombaires et les nerfs sacro coccygien constituant la queue de cheval.
Figure 6 : Contenu du canal rachidien
b. Rachianesthésie standard
La dose d’anesthésique local est le facteur le plus important pour déterminer l’extension de la rachianesthésie. Utiliser de petites doses permet donc de limiter la hauteur du bloc sympathique et dans ce cas d’engendrer peu d’effets hémodynamiques [36]. Le risque devenant le manque d’efficacité anesthésique, il devient alors nécessaire d’adjoindre un morphinique [36]. Il est également possible de réaliser une rachianesthésie latéralisée du côté à opérer afin de minimiser les conséquences hémodynamiques : c’est la rachianesthésie unilatérale [37-38]. La rachianesthésie unilatérale consiste à « fixer » l’anesthésie rachidienne du côté à opérer. Le bloc sympathique étant alors unilatéral, les conséquences hémodynamiques sont moindres. Pour cela, il faut injecter en intrathécale une solution d’anesthésique local en dirigeant l’orifice de l’aiguille vers le côté à opérer, chez un patient positionné en décubitus latéral et qui sera maintenu ainsi de dix à vingt minutes jusqu’à obtention d’un bloc anesthésique prédominant sur un côté. On utilise une solution hyperbare si la chirurgie se déroule en décubitus dorsal (membre à opérer vers le bas), ou hypobare pour la traumatologie ou si la chirurgie se déroule en décubitus latéral (membre à opérer vers le haut). La bupivacaïne est, à l’heure actuelle, l’anesthésique local de choix. La
lévobupivacaïne à les mêmes indications que la bupivacaïne, mais procure un bloc légèrement plus court. Malgré des avantages théoriques, la ropivacaïne ne s’est pas imposée dans ce domaine en raison de l’imprévisibilité du bloc obtenu. Les doses de bupivacaïne recommandées dans cette indication varient de 3,5 à 8 mg, mais la dose donnant un bloc fiable avec un faible retentissement hémodynamique se situe entre 4 et 6 mg. Une limite de cette technique est qu’il peut être difficile d’obtenir un bloc unilatéral « pur », nous faisant retomber dans le cas d’une rachianesthésie à petite dose.
L’inconvénient principal des techniques à injection unique à petite dose (unilatéral ou non) est le risque de levée du bloc avant la fin de la chirurgie ou en cas de reprise chirurgicale immédiate (malposition du matériel d’ostéosynthèse…). En effet, lorsqu’on diminue les doses, on raccourcit également la durée du bloc. On s’expose aussi au risque de niveau sensitif insuffisant pour la chirurgie.
c. Anesthésie épidurale
L’anesthésie épidurale consiste à injecter une solution anesthésique dans l’espace épidural, anciennement appelé espace péridural. La rachianesthésie s’étant beaucoup développée pour le per opératoire, elle est maintenant surtout utilisée pour l’analgésie obstétricale ou postopératoire.
L’espace épidural s’étend autour de la dure-mère du trou occipital jusqu’au hiatus sacro coccygien ; il est limité en avant par le ligament vertébral commun postérieur, latéralement par les pédicules et en arrière par les ligaments jaunes. En avant, du fait d’accolements de la dure-mère avec les structures osseuses, l’espace épidural est très mince, presque virtuel. En arrière, espace de diffusion de la solution anesthésique, il est plus large, s’amincissant de bas en haut et au niveau des deux renflements de la moelle. L’espace épidural est occupé par les racines rachidiennes, les plexus veineux intrarachidiens, les artères, les lymphatiques, du tissu conjonctif et de la graisse.
d. Rachianesthésie Continue
La rachianesthésie continue consiste à introduire un cathéter dans le LCR pour fractionner la dose d’anesthésique local administré. Une asepsie rigoureuse est nécessaire pour la réalisation du geste. L’insertion du cathéter ne doit pas être excessive de façon à éviter une distribution non homogène de la solution anesthésique. La dose initiale d’anesthésique
local doit être faible et complétée par une dose additionnelle si l’extension du bloc est insuffisante.
Le fractionnement de la dose d’anesthésique local prévient la survenue d’une hypotension et en fait une technique adaptée aux sujets âgés instables au plan hémodynamique.
Rappel historique [39]
La rachianesthésie continue a été décrite pour la première fois en 1907 par Dean qui a eu l’idée de laisser une aiguille intrarachidienne en place afin d’injecter l’AL en fonction des besoins. Le risque de lésions nerveuses et de rupture de l’aiguille lors de la mobilisation du patient condamna rapidement la technique. Il fallut attendre 1940 pour qu’un système d’aiguille malléable connectée à un cathéter permette de délivrer des doses itératives d’AL dans l’espace sous-arachnoïdien. En 1944, Tuohy proposait l’utilisation d’une sonde urétérale introduite de 4 à 5cm dans l’espace sous-arachnoïdien, mais s’interrogeait déjà sur les aléas de la mise en place du cathéter et du risque de direction erratique. En 1947, Saklad et al. Utilisèrent la technique décrite par Tuohy pour obtenir un bloc segmentaire thoracique. Le cathéter introduit via une aiguille de Tuohy au niveau lombaire était avancé de 15 à 35 cm, Les travaux du début des années 1950 arrêtèrent le développement de cette technique suite à la description de plusieurs complications : la RAC entraînait un taux plus élevé d’échecs (8 % versus 1,9 %), plus de difficultés techniques liées à la mise en place du cathéter et plus de paresthésies transitoires (33 % versus 13 %) que la rachianesthésie classique. C’est seulement dans les années 1960 et avec l’avènement de nouvelles aiguilles (20—21 G) et de nouveaux cathéters plus fins que la RAC retrouva un intérêt.
Intérêt de la rachianesthésie titrée
Les dernières enquêtes épidémiologiques sur la mortalité liée à l’anesthésie, objectivent la survenue d’arrêt cardiaque au cours de la rachianesthésie conventionnelle notamment chez le sujet âgé [40-41]. Ces études ne font que rappeler la très mauvaise tolérance hémodynamique d’un bloc sympathique étendu et brutal chez des patients fragiles. Le problème principal de la rachianesthésie conventionnelle étant l’absence de prédictibilité de l’étendue et de la durée du bloc sensitif [42], il en résulte souvent en pratique, un surdosage anesthésique.
En effet, la durée de la rachianesthésie mais aussi son niveau sensitif étant tous deux proportionnels à la dose injectée [43], il est compréhensible que par crainte d’échec en termes de niveau et/ou de durée, une dose importante soit administrée. La mise en place d’un cathéter dans l’espace sous-arachnoïdien permet de s’affranchir de ce dilemme. La présence d’un cathéter permet l’administration de très faible dose d’anesthésique local jusqu’à l’obtention du niveau sensitif désiré, c’est le concept de la titration intrathécale, tout en maîtrisant la durée du blocage grâce à la possibilité de réinjections itératives en fonction de la durée de l’acte chirurgical.
Enfin l’obtention du niveau sensitif maximal est progressive, s’étalant pendant toute la durée de la titration.
Technique
Le choix du matériel [44-45-46]
Le choix du matériel est un élément important. Des cathéters fins ont été développés ces dernières années, dans le but de limiter l’incidence des céphalées post brèche dure mérienne. Des cathéters de 32G associés à une aiguille de 26G ont même été utilisés mais l’incidence élevée de problèmes techniques pouvant atteindre 20 % (impossibilité de monter le cathéter ou d’injecter l’AL, rupture du cathéter), ces cathéters ne sont plus recommandés à ce jour. De plus, l’incidence de céphalées postopératoires chez le sujet jeune n’est pas diminuée par l’usage de cathéters de 28G par comparaison à ceux de 20 G. Enfin, la survenue de syndrome de la queue de cheval a conduit, en 1992, à l’interdiction des cathéters plus fins que 27G aux États- Unis. L’orientation caudale du cathéter qui occasionnait une concentration de la solution d’anesthésique local au niveau de la région sacrée était tenue pour en partie responsable de cette complication. Il est en effet plus difficile d’obtenir une orientation céphalique des cathéters lorsque ces derniers sont fins L’orientation caudale du cathéter étant à éviter, il est recommandé de ne pas introduire le cathéter dans l’espace sous-arachnoïdien de plus de 3 cm. Par ailleurs, une insertion du cathéter chez un patient en position assise augmenterait les chances qu’il prenne une direction céphalique, comparé au patient en décubitus latéral .
La possibilité de complication neurologique en partie en rapport avec les cathéters les plus fins, en marquant les esprits, a néanmoins constitué un frein au développement de la RAC . En France, cinq cathéters sont disponibles.
Les modalités de la réalisation (figure 7)
Les modalités de réalisation doivent tenir compte des récentes recommandations pour la pratique clinique (2006) de la SFAR concernant les blocs péri médullaires chez l’adulte [47]. La RAC doit être réalisé dans des conditions d’asepsie d’autant plus rigoureuse qu’elle comporte l’insertion d’un matériel étranger dans l’espace sous-arachnoïdien. Le port d’un casque stérile est recommandé. Une désinfection large du point de ponction doit être réalisée. Le patient est le plus souvent en décubitus latéral mais la position assise est envisageable. Si l’abord médian est le plus fréquent, l’abord paramédian est une alternative possible. Lorsque l’aiguille pénètre dans l’espace sous-arachnoïdien (reflux de LCR), elle doit être orientée de façon à ce que le cathéter soit dirigé en direction céphalique. Ce dernier doit s’introduire sans résistance, sur une distance maximale de 3 à 4cm. L’aiguille est alors retirée et le cathéter fixé. Après avoir raccordé un filtre antibactérien, l’AL peut être injecté lentement, en ayant au préalable pris soin de vérifier la présence d’un reflux de LCR par Le cathéter. De nombreux protocoles d’administration utilisent la bupivacaïne. En effet, la responsabilité de la lidocaïne dans la survenue de syndrome de la queue de cheval n’est plus à démontrer. Cet AL ne doit plus être administré en rachianesthésie [47].
Figure 7 : Rachianesthésie continue
Dose d’induction de la rachianesthésie titrée
L’intérêt de la technique étant d’éviter un bloc sympathique, sensitif et moteur étendu, la dose d’induction doit être faible. Une dose de seulement 2,5 mg de bupivacaïne isobare procure régulièrement, chez le sujet âgé, un niveau en T11, suffisant pour la chirurgie de la hanche [48]. Si cette dose d’induction est insuffisante pour obtenir le niveau sensitif désiré, des réinjections successives de 2,5mg de bupivacaïne toutes les cinq minutes seront effectuées. En revanche, un bolus d’induction de 5mg de bupivacaïne isobare ou hyperbare est excessif chez la personne âgée car le niveau obtenu peut atteindre T2, avec d’importantes répercussions hémodynamiques [49].
Choix de la baricité de la solution anesthésique
Comme au cours de la rachianesthésie conventionnelle, les solutions hyperbares ou franchement hypobares sont plus maniables que les solutions isobares. Leur distribution est plus prévisible car fonction de la position du patient et de l’inclinaison de la table. Il est donc logique de choisir les solutions isobares ou hypobares dans la chirurgie de la hanche en décubitus latéral ce qui évite de bouger le patient après l’induction anesthésique. Les solutions hyperbares étant réservées à la chirurgie réalisée en décubitus dorsal ou si l’on veut réaliser
Les principales indications
Les patients âgés, pour toute chirurgie incluant les territoires sacrés, lombaires et thoraciques bas.
Les patients porteurs d’hypertension artérielle mal équilibrée.
L’insuffisance cardiaque.
Le rétrécissement aortique serré.
Le syndrome de Shy-Drager.
L’insuffisance coronarienne sévère. Les contre-indications
Les contre-indications (CI) de la RAC sont identiques à celles des blocs péri médullaires [47]. Les CI absolues sont :
Le refus du patient.
La présence d’anomalies de l’hémostase.
Un problème infectieux au niveau point de ponction.
Les états de choc.
Cette technique n’est pas recommandée chez les patients sous anticoagulants et chez ceux traités par les inhibiteurs des récepteurs plaquettaires GIIbIII a (thienopyridines).
Complications :
La distribution non homogene :
Par rapport à une rachianesthésie conventionnelle où les anesthésiques locaux sont injectés à partir du biseau de l’aiguille, dans la RAC les anesthésiques locaux sont injectés à partir de l’extrémité du cathéter sous- arachnoïdien. Cette particularité peut rendre compte des anomalies de distribution parfois rencontrées au cours des RAC. En effet, lorsque l’induction de la rachianesthésie s’effectue chez un patient en décubitus dorsal, table à l’horizontale, il existe une corrélation entre le niveau de l’extrémité du cathéter et le niveau sensitif obtenu [44]. Le niveau sensitif sera d’autant plus élevé que l’extrémité du cathéter
sera céphalique, et inversement. Lorsque le cathéter intrathécal est correctement inséré, à partir d’une ponction en L4—L5, voire L3—L4, avec une direction céphalique sur 30mm au maximum, son extrémité se situe au niveau lombaire et la diffusion des anesthésiques locaux est homogène de part et d’autre du sommet de la lordose lombaire. La diffusion de la solution d’anesthésique local lors d’une RAC s’apparente à celle observée lors d’une rachianesthésie conventionnelle avec un blocage des métamères sacrés, lombaires et thoraciques bas. En revanche, si le cathéter est inséré sur une longueur excessive une distribution non homogène, exclusivement thoracique ou exclusivement sacrée peut survenir.
o La distribution thoracique
Elle correspond à un cathéter dont l’extrémité se trouve au niveau de la concavité thoracique. Cette situation est le résultat d’un cathéter trop avancé dans l’espace sous-arachnoïdienne, continuant sa progression en direction céphalique et/ou d’une ponction lombaire haute, non exceptionnelle chez le sujet âgé souffrant de cyphoscoliose. Chez un patient en décubitus dorsal, table à l’horizontale, les anesthésiques locaux s’accumulent dans la concavité thoracique. Il en résulte une anesthésie thoracique suspendue, les racines lombosacrées n’étant pas bloquées. La prévention de ce phénomène réside dans l’insertion du cathéter sur une distance maximale 30mm et sur l’écho-repérage du point de ponction chez certains patients [50].
o La distribution sacrée
Elle correspond à un cathéter dont l’extrémité est au niveau de la concavité sacrée. Cette situation résulte d’un cathéter trop poussé et ayant pris une direction caudale après avoir buté sur les racines de la queue-de-cheval. Chez un patient en décubitus dorsal, table à l’horizontale, les anesthésiques locaux s’accumulent dans la concavité du sacrum, entraînant un blocage limité aux racines sacrées et lombaires [44,47]. Les injections suivantes n’augmentant que très peu le niveau sensitif qui reste inférieur à T12. C’est cette accumulation en région sacrée qui a été à l’origine des syndromes de la queue de-cheval décrits sous RAC après injection de fortes doses cumulées de lidocaïne [47].
Trois mesures simples doivent permettre d’éviter la survenue d’une telle complication. La première consiste à déceler précocement une distribution sacrée afin de ne pas atteindre une concentration neurotoxique d’anesthésique local au niveau des racines de la
cheval. Il convient de suspecter une accumulation sacrée si 10 mg de bupivacaïne iso ou hyperbare procurent un bloc inférieur à T12. Il est alors aisé d’obtenir un niveau sensitif plus étendu en poursuivant l’induction en décubitus dorsal mais en positionnant la table en Trendelenburg et en utilisant une solution hyperbare afin que la solution anesthésique se distribue au niveau thoracique. La deuxième mesure consiste à éviter que le cathéter ne prenne une direction caudale. L’utilisation d’aiguilles à biseau directionnel, de type Sprotte ou Tuohy, permet de diriger le cathéter et d’obtenir une direction céphalique du cathéter dans tous les cas si les cathéters ne sont pas insérés de plus de 3 cm [50]. Enfin la troisième mesure est de réaliser l’induction chez un patient en décubitus latéral. En effet, en décubitus latéral il n’existe plus aucune corrélation entre le niveau de l’extrémité du cathéter et le niveau sensitif obtenu [51] car les courbures physiologiques antéropostérieures du rachis ne peuvent plus influencer la distribution des anesthésiques locaux.
Complications communes aux rachianesthésies Céphalées post ponction durale L’incidence des céphalées post-ponction durale est très faible chez le patient âgé avec l’utilisation d’un matériel spécifique utilisant des aiguilles 19 gauge et des cathéters 22 ou 23 gauge. À l’inverse, chez les patients jeunes le taux de céphalées peut atteindre 33 %, même en utilisant des micros cathéters 28 gauge [52].
Hématomes périduraux ou spinaux
Leur prévention repose sur le respect des contre-indications en cas de trouble de l’hémostase et sur une technique rigoureuse. La prise isolée d’aspirine, souvent notée dans la population de patients pouvant bénéficier de la rachianesthésie titrée, ne contre-indique pas la technique, la ponction devant être le moins traumatique possible [53].
Complications infectieuses
Leur prévention repose sur le respect d’une asepsie de type chirurgicale au cours de la mise en place des cathéters.
Avec une technique correcte de pose, la mise en culture systématique des cathéters rachidiens ne retrouve aucune contamination à 24 heures, une colonisation bactérienne significative n’apparaissant.
VI.
Période postopératoire
Les complications postopératoires sont plus fréquentes chez le sujet âgé (Tableau 9). Une attitude préventive est préférable, par exemple en surveillant le patient en soins intensifs pendant 48 à 72 heures après une intervention majeure. Le diagnostic de la complication doit être précoce, car chez le sujet âgé le traitement est plus difficile et moins souvent efficace.
Tableau 9 : principales complications postopératoires
A. Confusion mentale
La confusion mentale (état confusionnel, delirium) postopératoire est une perturbation transitoire et fluctuante de l’état de conscience. Elle correspond à un état de faillite temporaire et réversible du fonctionnement cérébral. Selon les critères diagnostiques retenus (Tableau 10), la fréquence de la confusion postopératoire est de très variable en fonction des etudes de 5 à 52 % [54,55,56]. La fréquence la plus élevée est observée au cours de la chirurgie cardiaque, puis dans la chirurgie pour fracture du col du fémur et la chirurgie aortique.
Le mode de survenue est caractérisé par une installation rapide en quelques heures ou quelques jours (pic vers le deuxième jour). Le tableau clinique varie d’un patient à l’autre et fluctue rapidement chez un même patient. La vigilance est altérée et varie au cours de la journée : phases stuporeuses, hébétude, agitation psychomotrice, périodes de lucidité. L’inversion du cycle Nycthéméral est fréquente.
La survenue d’une confusion postopératoire est un facteur défavorable dans l’évolution postopératoire immédiate (allongement de la durée d’hospitalisation, décès intra hospitalier) et à long terme (mortalité à distance augmentée) [58]. De nombreux scores pour détecter les troubles comportementaux postopératoires ont été décrits, mais sont peu utilisés [59].
En période postopératoire, de nombreux facteurs favorisent ou déclenchent un état confusionnel (demence préoperatoire , AVC , epilepsie , anemie , dysglycemie , benzodiazepine , corticotherapie….) [60]. La survenue d’un delirium dépend de l’interaction de facteurs favorisants (qui préexistent et peuvent être détectés) et de facteurs déclenchant (Douleur, anémie, administration de médicaments tels les benzodiazépines) qu’il est possible d’éviter ou d’atténuer. Néanmoins, le plus souvent, aucun facteur déclenchant précis ne peut être identifié.
La confusion mentale est source de complications, inhalation bronchique, retrait accidentel des voies veineuses, des pansements, des drains, de la sonde gastrique, nécessité de sondage urinaire.
Si la survenue d’un état confusionnel est souvent imprévisible, Il a été montré dans une étude après fracture du col du fémur que l’application de mesures simples peut en réduire la fréquence [61]. Il s’agit de fournir au patient ses aides auditives et ses lunettes, respecter les périodes de repos pour favoriser le sommeil, traiter la douleur et contrôler l’équilibre hydro électrolytique.
Lorsque la confusion met en danger le patient et le personnel soignant, un traitement pharmacologique est nécessaire.
Les benzodiazépines sont à éviter, sauf si un sevrage est en cause.
L’halopéridol est le médicament de référence, à la dose de 0,5mg par voie intraveineuse, à répéter par intervalles de 30 minutes. Le début d’action est en 10 à 30minutes
[58]. Le Loxapine (Lozapac®) est administré par voie intramusculaire à la dose de 50 à 100mg, à renouveler après six à huit heures si nécessaire. L’halopéridol en prévention a été préconisé chez les patients à haut risque de delirium [39].
Tableau 10 : diagnostic du syndrome confusionnel
B. Dysfonction cognitive postopératoire
Après une intervention chirurgicale, les patients âgés ou leur entourage signalent souvent une diminution de leurs fonctions intellectuelles supérieures. La dysfonction cognitive postopératoire (DCPO ou postoperative cognitive dysfunction [POCD]) désigne les modifications persistantes des performances cognitives évaluées par des tests neuropsychologiques [62–63].
Les signes les plus fréquents de la DCPO touchent la mémoire, L’attention, la concentration, la rapidité des réponses mentales et motrices, et les difficultés d’apprentissage.
Dans les trois premières semaines, la DCPO touche environ 30 % des patients après chirurgie majeure et 7 % après chirurgie mineure. Entre la troisième semaine et le sixième mois, la DCPO s’améliore. Au-delà de six mois, les études notent des tests psychométriques le plus souvent identiques à ceux réalisés avant l’intervention [64].
Les facteurs qui favorisent la DCPO sont multiples à savoir l’age avancé , les demences pré-existantes , alccolisme , les chirurgies majeurs et le type d’anesthesie. Le type de chirurgie a un rôle dans la DCPO observée dans la première semaine postopératoire. Une fréquence
mois, la fréquence de la DCPO est indépendante de la nature de la chirurgie. Le rôle de l’hypotension artérielle per opératoire dans la survenue de la DCPO n’est pas clairement démontré [64,66]. La nature des agents anesthésiques n’a pas d’influence majeure sur la survenue d’une DCPO.
C. Prévention de la maladie thromboembolique
Les sujets âgés sont classés dans les groupes à risque moyen ou élevé de maladie Thromboembolique postopératoire. Ceci justifie une prévention qui associe les moyens physiques et les anticoagulants [67,68,69]. La prophylaxie médicamenteuse utilise les héparines de bas poids moléculaire (HBPM), le fondaparinux et l’héparine non fractionnée.
Les HBPM exposent au risque de surdosage, surtout en cas d’insuffisance rénale et de faible poids. Parmi les HBPM, la daltéparine (Fragmine®) est moins sensible à la fonction rénale. Lorsque la clairance calculée de la créatinine est inférieure à 30 ml min−1, il est conseillé d’utiliser l’héparine non fractionnée. Le fondaparinux (Arixtra®) 2,5 mg sous-cutané par jour, débuté six heures après la fin de la chirurgie, est conseillé pour la prophylaxie après chirurgie pour fracture du col du fémur.
D. Douleur postopératoire
1. Evaluation de la douleur
Les déficits sensoriels et cognitifs rendent l’évaluation de la douleur difficile [70]. Pour les démences légères (MMS≥18) l’autoévaluation EST souvent possible. Les échelles numériques (Numerical Rating Scale [NRS]) et verbales simples (Verbal Rating Scale [VRS]) sont plus faciles à utiliser que l’échelle visuelle analogique (EVA).
Si la démence est plus sévère (MMS < 13) il faut recourir à l’hétéroévaluation [71]. Chez les patients déments, la douleur est exprimée par des modifications comportementales : Expression faciale, agitation, hostilité, mouvements du corps, vocalisation. Plusieurs échelles d’hétéroévaluation ont été validées [70].
Néanmoins, du fait de leur complexité, elles sont surtout utiles dans les unités de long séjour, et elles sont moins adaptées à une utilisation en situation aiguë telle la période postopératoire.
Le score Algoplus® permet l’évaluation de la douleur aiguë chez le patient non communiquant [72] (Tableau 11). Un score de 2 sur 5 nécessite un traitement antalgique.
Tableau 11 : Algoplus®, échelle d’évaluation comportementale de la
douleur aiguë chez la personne âgée présentant des troubles de la
communication verbale
2. Traitement
Le concept d’analgésie multimodale est applicable chez le sujet âge [73]. Au paracétamol sont associés les analgésiques de palier 2 et 3 selon l’intensité de la douleur. Les effets secondaires des analgésiques sont plus fréquents, et il est souvent nécessaire d’éviter le néfopam et le tramadol.
Opiacés
Les modifications pharmacocinétiques (clairance réduite) et pharmacologiques (puissance analgésique augmentée) de la morphine nécessitent une adaptation des doses et de l’intervalle d’administration. Cependant, une réduction systématique de la dose initiale aboutit souvent à un sous-dosage. La titration en salle de réveil évite un traitement insuffisant. Dans une étude réalisée en salle de réveil, la dose moyenne nécessaire pour obtenir une EVA
inférieure à 3 est identique entre les sujets âges et jeunes, respectivement 0,14mg/kg et 0,15mg/kg [74].
Les doses de réinjection par voie sous-cutanée et les doses pour la PCA sont moindres [75]. Par exemple, après prothèses totales de hanche, la dose de morphine sous-cutanée Administrée toutes les quatre heures selon l’EVA est de 0,11 plus ou moins 0,11 mg/kg versus 0,18 plus ou moins 0,18 mg/kg chez les sujets jeunes [75]. La voie sous-cutanée appliquée correctement avec le respect des doses et des intervalles d’administration est aussi efficace que la PCA, qui est souvent d’utilisation difficile chez les sujets âgés [76].
Les effets secondaires de la morphine les plus fréquents sont les troubles dysphoriques, la rétention urinaire, la sédation excessive et la dépression respiratoire. Il faut éviter une administration prolongée de morphine en cas d’insuffisance rénale, en raison de l’accumulation du métabolite 6-morphine- glucuronide qui a un effet dépresseur respiratoire important. Un des effets secondaires le plus fréquent est la rétention urinaire. La recherche d’un globe vésical est facilitée par l’utilisation de l’échographie vésicale.
Anti-inflammatoires non stéroïdiens
Les anti-inflammatoire non stéroïdiens (AINS) ne sont pas formellement contre-indiqués [106]. Le kétoprofène par voie intraveineuse a l’avantage d’une demi-vie courte. L’insuffisance rénale allonge la demi-vie des AINS et, à l’inverse, les AINS altèrent la fonction rénale. Ils sont contre-indiqués en cas D’insuffisance rénale, d’insuffisance cardiaque et pour les interventions majeures. Il faut rappeler l’interférence des AINS avec la warfarine et les HBPM.
Anesthésie locorégionale
L’anesthésie locorégionale assure une analgésie efficace durant les premières heures postopératoires. Comme chez le sujet plus jeune, l’infiltration de la cicatrice avec des anesthésiques locaux de longue durée d’action et les blocs périphériques avec ou sans cathéter péri nerveux sont Applicables en fonction de l’expertise de l’équipe chirurgicale et Anesthésique.
I.
Introduction
La fracture du col du fémur représente un véritable tournent dans la vie des patients. Différentes techniques d’anesthésie et d’analgésie ont été pratiquées pour ce type de chirurgie. Les patients présentant une fracture du col du fémur représentent un véritable défi anesthésique vu le risque péri opératoire majeur.
La rachianesthésie (RA) représente environ 40% des anesthésies locorégionales réalisées en France. Son intensité et sa vitesse d’installation sont à l’origine des effets secondaires vasculaires, cardiaques et respiratoires.
La rachianesthésie continue (RAC) ou rachianesthésie titrée est une technique permet d’éviter d’administrer une dose d’emblée élevée d’AL et semble être ainsi un bon moyen de limiter ces conséquences, notamment hémodynamiques.
Dans cette étude nous nous sommes proposé d’évaluer l’efficacité la rachianesthésie continue (RAC) pour les fractures du col du fémur chez ces patients à haut risque anesthésique péri opératoire et d’apprécier le bénéfice cardiovasculaire de cette technique par rapport à la rachianesthésie conventionnelle.
II.
Patients et méthodes
A. Type d’étude
Il s’agissait d’une étude prospective randomisée.
B. Lieu de l’étude et période d’étude
Cette étude était réalisée au service d’anesthésiologie de l’Hôpital Militaire d’Instruction Mohamed V de Rabat sur une période de 2 ans.
C. Critères d’inclusion
Etaient inclus durant cette étude, tous les patients classés ASA II, ASA III, ASA IV présentant une fracture du col du fémur relevant d’un geste chirurgicale.