HAL Id: tel-01628884
https://tel.archives-ouvertes.fr/tel-01628884
Submitted on 5 Nov 2017HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Développement d’une plateforme d’analyse couplant la
séparation de peptides amyloïdes à une
immuno-détection digitale en gouttes pour le diagnostic
de la maladie d’Alzheimer
Nacera Aboud
To cite this version:
Nacera Aboud. Développement d’une plateforme d’analyse couplant la séparation de peptides amy-loïdes à une immuno-détection digitale en gouttes pour le diagnostic de la maladie d’Alzheimer. Chimie analytique. Université Paris-Saclay, 2016. Français. �NNT : 2016SACLS358�. �tel-01628884�
NNT : 2016SACLS358
Thèse de doctorat
de
L’Université Paris-Saclay
préparée à l’Université Paris Sud
Faculté de Pharmacie de Châtenay-Malabry
Ecole Doctorale n° 571
Sciences chimiques : molécules, matériaux, instrumentation et biosystèmes
(2MIB)
Spécialité de doctorat : Chimie
Par
Mme Nacéra Aboud
Développement d'une plateforme d’analyse couplant la séparation de
peptides amyloïdes à une immuno-détection digitale en gouttes pour le
diagnostic de la maladie d'Alzheimer
Thèse présentée et soutenue à Châtenay-Malabry, le 04 Novembre 2016
Directrice de thèse : N. Thuy Tran - MC- Université Paris-Sud, Chatenay-Malabry Co-directrice de thèse : Claire Smadja - PU- Université Paris-Sud, Chatenay-Malabry Président du Jury : Fathi Moussa - PU - Université Paris-Sud, Chatenay-Malabry Rapporteur : Valérie Taly - Directeur de recherche - Université Paris Descartes, Paris Rapporteur : Anne Varenne - PU - Chimie ParisTech, Paris
Examinateur : Isabelle Turbica - MC - Université Paris-Sud, Chatenay-Malabry
3
Remerciements
Mes remerciements s’adressent en premier lieu à mes deux directrices de thèse, le Professeur Claire Smadja et le Docteur Nguyet Thuy Tran pour leur soutien et leur grand dévouement durant ces années de thèse. Claire, je suis très reconnaissante ta gentillesse maternelle, tes précieux conseils, et d’avoir partagées tes connaissances multidisciplinaires avec moi durant toute cette thèse. Thuy, je te remercie énormément pour ta patience, ta bienveillance, ta persévérance et ta rigueur incontestable. Je vous remercie toutes les deux pour vos qualités à la fois humaines et professionnelles.
Je remercie très chaleureusement la directrice du laboratoire, le Professeur Myriam Taverna, pour m’avoir accueilli dans son laboratoire, pour sa confiance et ses encouragements durant toutes ces années. Myriam, je te suis très reconnaissante pour m’avoir incité et avoir insisté à ce que je m’ouvre plus et que je prenne plus confiance en moi durant mes présentations orales. Ce fût un plaisir d’avoir été responsable de communication au sein de ton laboratoire.
Je voudrais ensuite remercier le Professeur Anne Varenne, le Docteur Valérie Taly, le Professeur Fathi Moussa, le Docteur Isabelle Turbica et le Docteur Farid Oukacine qui me font l’honore d’être membres de mon jury de thèse.
Je remercie toute l’équipe du Professeur Jean-Louis Viovy et lui-même pour m’avoir accueillie chaleureusement dans leurs locaux et en particulier, le Docteur Stéphanie Descroix pour tous ses conseils et sa bienveillance. Je remercie naturellement le Docteur Davide Ferraro, mon sauveur de la microfluidique, qui m’a initié à ce nouveau domaine. Je remercie aussi Iago, Marco, Emilie, Amel et Giuliana.
J’exprime ma gratitude envers tous les membres de mon équipe les étudiants doctorants, post doctorants et stagiaires que j’ai pu rencontrer durant cette thèse à savoir Sonia avec qui j’ai lié d’amitié, Dimitri pour sa gentillesse inné, Kiarach pour m’avoir transmis ses connaissances en puce, Romain pour son humour décalé, Emmanuel pour sa bonne humeur, Szymon avec qui j’ai pu améliorer mon anglais, Ludivine pour sa sympathie, Anne-Lise pour son sens du travail, Lin pour son enthousiasme contagieux ainsi que Sarah l’Allemande, Amal la tunisienne, Yasmine l’italienne, Claudine, Christelle, Alison et Youmna pour les bons moments passés ensembles. Je tiens à remercier en particulier mon ancien binôme de bureau, Monica, avec qui j’ai passé des bons moments (mais parfois durs moments) dans la salle des puces. Merci pour ton amitié infaillible et ton enthousiasme sans égal. Je suis également très reconnaissante envers Duc qui a repris le projet DigiDiag et avec qui j’ai pris un grand plaisir à travailler. J’ai appris énormément de ton esprit vif. Je remercie sincèrement
4 Cédric pour toutes ses qualités humaines et scientifiques mais également son aide en informatique, en bricolage, en rangement et en fait en un peu de tout. Ce fût un plaisir de travailler avec toi dans le même bureau durant ma dernière année de thèse (on a bien rigolé). Merci à Jeanne pour les bons moments passés ensembles, je te souhaite une très belle thèse. Merci à Claire G. avec qui j’ai beaucoup discuté sur la façon de vivre plus sainement en privilégiant ce que nous offre la nature. Je remercie également Corentin et Coralie les petits derniers du laboratoire pour leur sympathique compagnie toujours prêt à délirer ou à piquer une sieste pour certain...
Je remercie également Isabelle et Antoine pour leur sympathie. Je n’oublie pas Marie-Claude qui est toujours là pour nous aider et nous orienter mais que je remercie surtout pour ses bons petits plats !
Je remercie naturellement les personnes sans qui je ne serai pas là, mes chers parents, que j’aime énormément qui m’ont toujours soutenu et qui croient toujours en moi. Merci à ma sœur Sarah pour avoir toujours été à mes côtés et pour son investissement personnel dans tout ce que j’entreprends. Merci à mes petits frères qui grandissent trop vite mais que je considère toujours comme des petits garçons. Merci à ma grande et formidable famille et en particulier mes tantes et mes oncles qui me sont très chers. Merci à mes très bonnes amies Katya, Nawel et Rishmi qui m’ont toujours soutenu et avec qui j’ai passé des années inoubliables. Merci à tous mes voisins et voisines de Gagny et de Massy pour leur bonté innée. Merci à tous mes amis de l’association universitaire de l’UPMC avec qui j’ai tissé des liens forts.
Je terminerai en remerciant l’homme de ma vie, Rachid, pour m’avoir accompagné au quotidien et qui m’épate chaque jour que l’on passe ensemble.
6
Abréviations
Ac Anticorps
ADN acide désoxyribonucléique
AMPS acrylamido-2-methyl-1-propanesulfonique ApoE Apoliprotein E
APP Amyloid precursor protein AVC accident cardio-vasculaire Aβ β-amyloïde
BACE-1 Beta-amyloid cleaving enzyme 1 BSA Albumine de sérum bovin
cIEF Focalisation isoélectrique en capillaire CJD démence de Creutzfeldt-Jacob
COC Copolymères de cyclooléfines DigiDiag Digital Diagnosis
DLFT démence du lobe fronto-temporale EC électrophorèse capillaire
ECZ électrophorèse capillaire de zone
ECZ-LIF électrophorèse capillaire de zone couplée à la fluorescence induite par laser EG Electrophorèse en gel
Elisa Enzyme Linked Immunosorbent Assay ESI Ionisation par électronébuliseur
FDG fluorodeoxyglucose FEO flux électroosmotique FEP fluoro ethylène propylène FITC isothiocyanate fluorescéine GFAP glial fibrillaryacidic protein HFABP heart fatty acid binding protein HRP horseradishperoxidase
IATI Innotest amyloid tau index IEF Focalisation isoélectrique
IRM imagerie par résonnance magnétique kDa kilo dalton
LED diode électroluminescente LBD démence du corps de Lewy LCR liquide céphalorachidien MA maladie d’Alzheimer mAc anticorps monoclonal
MAP protéines associées aux microtubules MCI mild cognitive impairment
MCP-1 monocyte chemotactic protein 1 MMSE Mini-Mental State Examination MoCA Montreal cognitive assessment MSD MesoScale Discovery
7 µECZ microélectrophorèse capillaire de zone
NFTs enchevêtrements neuro-fibrillaires NSE neuron-specific enolase
PC polycarbonate
PCR réaction en chaîne par polymérase PDMS Polydimethylsiloxane
PEO poly(éthylène) oxyde PETG Polyéthylène Téréphtalate pI point isoélectrique
PIB Pittsburgh Compound-B PMMA Polyméthacrylate de méthyle p-Tau Protéine Tau hyperphosphorylée RPE R-phycoerythrin
SDS dodecylsulfate de sodium Simoa single molecule array SM spectrométrie de masse SRM selected reaction monitoring Tau tubule-associated unit
TEMED Tétraméthyléthylènediamine
TEP tomographie par émission de positons
THV Tétrafluoro éthylène héxafluoropropylène vinylidène fluoride TI Tripsin inhibitor
TMB 3,3',5,5'-tétraméthylbenzidine t-Tau Protéine Tau totale
UV ultraviolet
VIH virus de l'immunodéficience humaine VLP-1 visinin-likeprotein 1
8
Symboles
ζ potentiel de surface
r
la constante diélectrique de l’électrolyteo
permittivité du videσ densité de charge de surface
δ épaiseur de la double couche électrique R la constante des gaz parfait
T température absolue F la constante de Faraday FI force ionique de l’électrolyte Veo vitesse électroosmotique µeo mobilité électroosmotique E champ électrique
viscosité
Vep vitesse électrophorétique µep mobilité électrophorétique q charge électrique
r rayon de Stokes
Leff longueur effective de séparation D coefficient de diffusion
N nombre de plateaux théoriques µapp mobilité apparente
Lt longueur totale du capillaire tm le temps de migration U tension appliquée Rs résolution
Δµep différence de mobilité électrophorétique effective
γ
tension de surfaceΔpI différence de pI J densité de courant
kcath conductivité du catholyte Vdérive vitesse de la dérive Ca nombre de capillaire
9
Sommaire
Introduction générale ... 12
PARTIE BIBLIOGRAPHIQUE ... 16
Chapitre 1 : Etat de l’art de la maladie d’Alzheimer ... 17
1. Epidémiologie ... 17
2. Processus physiopathologiques de la maladie ... 17
a. L’amyloïdogénèse ... 18
b. Dégénérescence fibrillaire ou Tauopathie ... 20
3. Les étapes de la physiopathologie de la MA ... 22
4. Traitements de la MA ... 24
Chapitre 2 : Biomarqueurs moléculaires et diagnostic de la MA ... 27
1. Les biomarqueurs de la MA ... 27
a. Définition ... 27
b. Les biomarqueurs validés de la MA ... 27
c. Présentation d’autres biomarqueurs potentiels et les nouvelles approches ... 29
2. Le diagnostic actuel de la MA ... 35
a. Tests cognitifs et imageries ... 35
b. Dosage des biomarqueurs dans le LCR en clinique ... 37
3. Les immunoessais pour l’analyse des biomarqueurs de la MA dans le LCR ... 39
a. Principe de l’Elisa ... 39
b. Test Elisa et dosage des biomarqueurs de la MA ... 40
c. Analyses multibiomarqueurs ... 40
Chapitre 3: L’électrophorèse capillaire et la miniaturisation ... 46
1. L’électrophorèse: principe ... 47
a. Phénomène de transport... 47
b. Limitations ... 50
2. Modes de séparation électrocinétique ... 55
a. L’électrophorèse capillaire de zone (ECZ) ... 55
b. La focalisation isoélectrique en capillaire (cIEF) ... 56
c. L’électrophorèse en milieux non aqueux (NACE) ... 63
3. Systèmes microfluidiques pour l’analyse de bio-molécules ... 67
a. Matériaux des microsystèmes pour l’électrophorèse sur puce ... 68
b. Traitements de surface ... 70
4. Séparation sur puce de protéines et peptides ... 75
5. Microsystèmes ou interfaces microfluidiques couplant la séparation à la compartimentalisation en gouttes ... 81
10
b. Couplage : séparation et compartimentalisation en gouttes... 83
PARTIE EXPERIMENTALE ... 87
Introduction du projet ... 89
Chapitre 4 : Fractionnement d’un mélange de peptides amyloïdes par focalisation isoélectrique capillaire .. 92
1. Introduction ... 92
2. Matériels et méthodes ... 94
a. Matériels et réactifs ... 94
b. Méthodes ... 95
3. Résultats et discussion ... 96
a. cIEF : choix des conditions initiales ... 96
b. Optimisation de la méthode ... 98
c. Adaptation de la méthode CIEF pour la mise en place de la collecte des peptides amyloïdes... 101
d. Fractionnement des peptides amyloïdes ... 101
e. Analyse des fractions de collecte de peptides amyloïdes par ECZ-LIF ... 102
Chapitre 5 : Dosage des peptides amyloïdes avec la plateforme d'immuno-dosage en gouttes ... 108
1. Introduction ... 108
2. Article 1: Magnetic bead-based immunoassays coupled with isoelectric focusing of amyloid-β peptides: towards droplet manipulation in a microfluidic device ... 112
3. Résultats-Discussion ... 128
a. Immuno-essai sur billes magnétiques en suspension ... 128
b. Immuno-essais en gouttes sur la plateforme microfluidique ... 129
c. Etude du couplage cIEF-immuno essai sur billes magnétiques (batch et gouttes) ... 129
d. Traitement d’échantillons biologiques (LCR) pour l’analyse CIEF ... 133
4. Conclusion ... 135
Chapitre 6 : Séparation électrocinétique sur puce ... 136
1. Séparations électrocinétiques sur puce en THV ... 136
a. Introduction ... 136
b. Article 2 : Dyneon THV, a fluorinated thermoplastic as a novel material for microchip capillary electrophoresis ... 139
c. Conclusion ... 153
2. Analyse IEF de peptides amyloïdes marqués sur puce en verre couplée à la détection par fluorescence 154 a. Introduction ... 154
b. Matériels et méthodes ... 156
c. Résultats et discussion ... 158
d. Conclusion ... 163
11
Annexes ... 169
12
Introduction générale
Actuellement plus de 45 millions de personnes sont atteintes d’une démence définie par une dégradation de la mémoire, du raisonnement, du comportement et de l’aptitude à réaliser les activités quotidiennes. Parmi les personnes atteintes de démence 60 à 70% souffrent de la maladie d’Alzheimer (MA) dont l’origine est encore inconnue. Cette maladie est l’une des principales causes d’handicap et de dépendance parmi les personnes âgées dans le monde. Elle est particulièrement éprouvante physiquement, psychologiquement, socialement et économiquement, non seulement pour les malades, mais aussi pour les personnes qui prodiguent les soins et leur famille. Cette maladie neurodégénérative évolue progressivement et son diagnostic repose essentiellement sur la combinaison de tests cognitifs, de techniques d’imagerie et d’analyses biochimiques. Il a été démontré que des déséquilibres moléculaires pourraient apparaitre dix à vingt ans avant l’apparition des signes cliniques 1. A l’heure actuelle, les variations les plus significatives observées sont celles de la concentration en peptide Aβ 1-42, en protéine Tau hyperphosphorylée (p-Tau) et en protéine Tau totale (t-Tau) dans le liquide céphalo-rachidien (LCR). La combinaison de ces trois biomarqueurs validés permet d’obtenir un diagnostic précis de la MA présentant une sensibilité et une spécificité supérieures à 80% 2. Par conséquent, les dosages biochimiques de biomarqueurs en association avec les examens cliniques tendent à se généraliser en pratique hospitalière dans des centres experts mais à un stade encore tardif. La détection de ces déséquilibres moléculaires pour retarder ou stopper l’évolution de la maladie est de ce fait un enjeu majeur dans le domaine des maladies neurologiques. Cependant, leur détection à des stades précoces est difficile à cause de leur plus faible abondance dans les fluides biologiques. Aussi, beaucoup d’efforts sont déployés pour trouver de nouveaux biomarqueurs de la MA ou de nouvelles formulations combinant plusieurs biomarqueurs pour un diagnostic plus précoce qui est crucial pour aider les patients à maintenir leurs capacités cognitives le plus longtemps possible. Un des défis majeurs est le développement d’outils de diagnostic sensible et peu coûteux capable de détecter à partir d’un fluide biologique (LCR ou sang) un ensemble de biomarqueurs reflétant spécifiquement une MA naissante.
Les microsystèmes d’analyse totale (µTas) ou « laboratoire sur puce » représente une alternative prometteuse dans un contexte où les méthodes d’analyse tendent vers la miniaturisation. Ce concept de miniaturisation appliqué aux méthodes d’analyse repose sur la microfluidique qui permet la manipulation de faibles volumes réduisant ainsi la consommation d’échantillon et de réactifs. Ceci représente un intérêt majeur pour l’analyse d’échantillons biologiques à faible coût. De nombreux autres avantages caractérisent les systèmes microfluidiques tels que la réduction du temps des analyses grâce au rapport surface sur volume élevé. La réduction des dimensions du système offre
13 par ailleurs de nombreuses possibilités d’intégration en ligne d’un nombre important d’étapes analytiques (réaction chimique ou biologiques, mélanges, séparation, détection...). Aussi, l’émergence de la microfluidique de gouttes ouvre des perspectives encore plus attractives pour contrôler une réaction biologique dans un environnement confiné et indépendant. Ceci combiné à la manipulation de particules magnétiques utilisées comme support solide permet de réaliser des réactions d’immunodosage en gouttes complexes avec des perspectives d’automatisation du système.
Dans le cadre du projet DigiDiag, notre objectif est de développer un nouvel outil d’analyse qui consistera à coupler la séparation par focalisation isoélectrique (IEF) de biomarqueurs de la MA à leur immunodétection en gouttes. Cette plateforme microfluidique sera appliquée à terme au diagnostic de la MA. L’intérêt de séparer les peptides amyloïdes par IEF avant l’immunodétection s’explique par un manque d’anticorps commercialement disponibles pour les formes de peptides amyloïdes tronqués en N-terminale. Nous avons privilégié ces biomarqueurs pour lesquels les stratégies Elisa en format microfluidique restent insuffisantes.
La partie bibliographique de cette thèse est divisée en trois chapitres. Nous commençons par dresser un état de l’art de la MA en décrivant le contexte épidémiologique, les principaux processus physiopathologiques supposés responsables de l’apparition de lésions dans le système nerveux central et les traitements actuellement proposés. Le chapitre 2 est consacré à une vue d’ensemble des biomarqueurs et du diagnostic actuel de la MA. Les nouvelles approches pour le diagnostic de la MA y sont également abordées ainsi que les immunoessais actuellement utilisés pour l’analyse des biomarqueurs issus de fluides biologiques. L’électrophorèse faisant partie des techniques d’analyse les plus très prometteuses pour l’analyse d’un mélange complexe de biomarqueurs, le chapitre 3 est dédié à l’apport de l’électrophorèse pour l’analyse des protéines dans les microsystèmes intégrés. Ce chapitre décrit les principaux modes de migration et de séparation de l’électrophorèse ainsi que les limites de la méthode avec les précautions à prendre pour les contourner. Une autre partie est consacrée aux matériaux émergeants pour la conception de microsystèmes plus accessibles et moins coûteux ainsi qu’aux traitements de surface utilisés pour pallier aux problèmes d’adsorption non-spécifique des protéines. Pour finir, des exemples de microsystèmes pour la séparation de protéines, pour le diagnostic de maladies ou encore pour le couplage de l’électrophorèse à la microfluidique de gouttes y sont présentés.
Au cours de cette thèse, nous avons exploré deux stratégies pour développer le dispositif recherché qui sont décrites dans la partie expérimentale. La première stratégie a consisté à coupler en off-line (en mode indirect) la séparation des peptides par focalisation isoélectrique en capillaire (cIEF) à une plateforme d’immunodosage en gouttes combinée à des particules magnétiques. Les deux premiers
14 chapitres expérimentaux (chapitres 4 et 5) décrivent ces travaux. Le chapitre 4 est consacré au développement d’une méthode cIEF pour la séparation des peptides amyloïdes tronqués à l’extrémité N-terminal (Aβ 1-40, Aβ 2-40 et Aβ 5-40). Nous nous sommes appuyés sur cette méthode de cIEF pour mettre au point la collecte des peptides séparés dans différentes solutions. Les solutions de collecte ont été analysées par électrophorèse capillaire de zone couplée à la fluorescence induite par laser (ECZ-LIF) afin de vérifier la présence des peptides. Le chapitre 5 est consacré à la mise au point de l’immunodosage en gouttes des peptides amyloïdes. Dans un premier temps, l’immunodosage sur particules magnétiques en batch (particules suspendues dans une solution non-confinée) a été appliqué au dosage des peptides Aβ 1-40, Aβ 2-40 et Aβ 5-40 standards précédemment collectés et au dosage des peptides Aβ 1-40 et Aβ 1-42 issus du LCR. Ensuite, différentes optimisations ont été réalisées pour le dosage séquentiel de deux peptides standards (Aβ 1-40 et Aβ 1-42) à l’aide de la plateforme d’immunodosage en gouttes. Ce travail fait l’objet d’une publication en cours de rédaction intitulée « Magnetic bead-based immunoassays coupled with isoelectric focusing of amyloid-β peptids : towards droplet manipulation in a microfluidic device ».
La deuxième stratégie de la thèse consiste à développer un microsystème couplant en ligne la séparation par IEF des biomarqueurs de la MA, la compartimentalisation en gouttes des bandes séparées et l’immunodétection en gouttes, ce qui présentera une avancée scientifique majeure dans le domaine des µTas. Le chapitre 6, divisé en deux parties, est consacré à un travail préparatoire en vue de la conception de ce microsystème. Une partie est consacrée la caractérisation approfondie des puces en THV Dyneon. Ce matériau innovant présentant des propriétés intéressantes pour la microfluidique de gouttes facilitera le couplage du module de séparation avec le module de compartimentalisation. Ce matériau n’a jamais été utilisé pour des séparations électrocinétiques sur puce. Nous avons ainsi caractérisé les puces en THV par des méthodes physico-chimiques pour les comparer avec d’autres matériaux. Compte-tenu de la tendance des protéines à s’adsorber à la surface de ces puces, des traitements de surface ont été proposés pour remédier à ce problème en vue de réaliser la séparation de protéines par ECZ. Afin de démontrer la versatilité de la puce, la séparation par l’électrophorèse en milieu non-aqueux de molécules hydrophobes a été réalisé sur ces puces. Ce travail a fait l’objet d’un article intitulé « Dyneon THV, a fluorinated thermoplastic as a novel material for microchip capillary electrophoresis » publié dans le journal The Analyst (DOI: 10.1039/c6an00821f). La deuxième partie du chapitre 6 concerne la mise au point d’une méthode IEF pour la séparation de peptides amyloïdes marqués par un agent fluorescent. Un agent de marquage compatible avec les analyses IEF (la molécule de Chromeo P540) a été utilisé pour l’analyse des peptides Aβ 1-40 et Aβ 2-40. Cette méthode IEF couplée à la détection à fluorescence a été développée en vue d’analyser les peptides marqués dans les puces en THV Dyneon.
15 Ce manuscrit se termine par une conclusion générale et des perspectives complémentaires pour répondre au besoin du projet.
16
PARTIE BIBLIOGRAPHIQUE
17
Chapitre 1 : Etat de l’art de la maladie d’Alzheimer
1. Epidémiologie
En un siècle, l’espérance de vie globale a plus que doublé, principalement en raison des avancées médicales et des progrès sanitaires, et celle-ci ne cesse de progresser. Toutefois, cette longévité accrue pose de nouveaux défis auxquels doit faire face la société avec une population vieillissante et notamment l’augmentation de maladies neurodégénératives telle que la MA. La MA est une maladie évolutive dont les symptômes de démence s’aggravent progressivement au fil des ans. Aux premiers stades, les pertes de mémoire sont légères, mais à un stade plus avancé, les individus perdent leur capacité à maintenir une conversation et à répondre à leur environnement. D’après le rapport de « World Alzheimer Report 2015 », la répartition du nombre de patients atteints de la MA dans le monde est très hétérogène avec plus de 22 millions de cas en Asie, 10.5 millions en Europe, 9.4 millions en Amérique et 4 millions en Afrique. En Europe occidentale, la prévalence est la plus élevée en France avec aujourd’hui environ 900 000 personnes souffrant de la MA et probablement 1,3 million de personnes seront touchées en 2020. Ces chiffres ne cessent d’augmenter et au rythme actuel le rapport prévoit que le nombre total de malades dans le monde pourrait doubler tous les 20 ans, ce qui en fait un problème majeur en santé publique à l’échelle mondiale.
L’allongement de l’espérance de vie est en effet une des principales causes de l’augmentation de la prévalence de la MA dont le facteur de risque majeur est l’âge. D’autres facteurs de risque peuvent être mis en cause tels qu’un mode de vie de plus en plus sédentaire, une alimentation en excès de graisse, sel et sucre, et la consommation de tabac. Néanmoins, l’adoption d’un mode de vie différent incluant une alimentation méditerranéenne, une activité intellectuelle et sportive plus importante aurait des effets protecteurs diminuant ainsi le risque de démence 3–5. Pour prévenir les phénomènes d’inflammation et de stress oxydatif en partie responsable de la dégénérescence neuronale, des méthodes neuro-protectrices peuvent être suivies comme la restriction calorique et le jeûne intermittent 6. D’autres auteurs suggèrent que la consommation de curcuma peut être bénéfique du fait de ses propriétés anti-oxydantes et anti-inflammatoires naturelles 7.
2. Processus physiopathologiques de la maladie
Les deux hypothèses principales de l’étiologie de la MA sont d’une part l’accumulation anormale de peptides amyloïdes en plaques amyloïdes qui entrainerait une cascade d’évènements appelée cascade
18 amyloïde (ou amyloïdogénèse) et d’autre part l’hyperphosphorylation de la protéine Tau qui entrainerait son accumulation intra-neuronale sous forme de fibrilles appelés enchevêtrements neuro fibrillaires causant ainsi la dégénérescence neuronale (ou tauopathie). Ces deux processus physiopathologiques sont décrits dans les paragraphes suivants.
a. L’amyloïdogénèse
La description de la composition des plaques amyloïdes date de 1984 avec l’identification des peptides amyloïdes (Aβ) comme agent pathogène de la MA8. Ceux-ci sont dérivés d’une protéine transmembranaire précurseur appelée APP (amyloid precursor protein) de 87 kDa. Cette protéine est métaboliquement clivée par différentes enzymes (β-sécrétase, α-sécrétase et γ-sécrétase) conduisant à une voie amyloïdogénique et non-amyloïdogénique (figure 1). L’activité de la α-sécrétase qui est responsable de la voie non-amyloïdogénique prévient la production des peptides Aβ en libérant un fragment neuro-protecteur appelé sAPPα. Une étude sur des souris transgénique (APP humain) a montré qu’une surexpression modérée de la α-sécrétase en particulier la protéase ADAM10 permettait de réduire la production de peptides Aβ et prévenait la formation de plaques amyloïdes 9. Ceci supporte l’hypothèse que la réduction de l’activité de la α-sécrétase contribue au développement de la MA. Les peptides β-amyloïdes (36 à 43 acides aminés) sont générés par la protéolyse de l’APP suivant la voie amyloïdogénique par des actions enzymatiques séquentielles. Une première coupure par la sécrétase BACE-1 (Beta-amyloid cleaving enzyme 1) suivie d’une digestion enzymatique par la γ-sécrétase conduit à la formation de peptides amyloïdes, notamment les peptides Aβ 42 et Aβ 40 10.
19 Néanmoins, la voie amyloïdogénique ne conduit pas systématiquement à un caractère pathogène. L’élément initiateur de la cascade des lésions neurologiques serait le déséquilibre entre la production d’Aβ et sa clairance physiologique. Ce déséquilibre serait dû à certaines mutations génétiques. Il faut cependant noter que la MA est une maladie multifactorielle et complexe, ainsi une classification a été établie pour distinguer deux formes de MA 11. Les formes familiales sont souvent diagnostiquées avant 65 ans. Ces formes sont causées, soit par une mutation du gène de l’APP, soit par une mutation au niveau des gènes présénilines 1 et 2, cette dernière étant la cause la plus fréquente. Ces mutations pathologiques des présénilines entrainent une augmentation du rapport de concentration Aβ42/ Aβ40, ce qui favoriserait la formation d’oligomères pathologiques 12. Cependant, ces formes sont très rares avec une prévalence inférieur à 1% 13. Les formes sporadiques ou non-héréditaires, les plus communes, sont souvent développées après 65 ans. Les facteurs de risque peuvent être de nature environnementale 14,15 mais le plus important est la présence de l’allèle ε4 sur le gène codant pour l’apolipoprotéine E (ApoE). Des études chez l’homme et les souris transgéniques ont montré que les isoformes (ε4, ε3, ε2) de l’ApoE jouent un rôle crucial dans la modulation du métabolisme de l’APP, de l’agrégation et de la déposition des peptides Aβ 16. En effet, elles régulent différemment le niveau du cholestérol qui module l’activité de la γ-sécrétase et la production des peptides A. Par ailleurs, les peptides Aβ sont éliminés du cerveau au niveau de la barrière hémato-encéphalique via l’ApoE mais l'efficacité de cette clairance est très altérée par l’ApoE4 qui lie les peptides Aβ avec une affinité moindre que l’ApoE3 et l’ApoE2, ce qui entraine leur accumulation dans le cerveau favorisant ainsi la formation de plaques amyloïdes 17,18. Cependant, le mécanisme pathogène n’est pas encore totalement élucidé en particulier sur la nature de l’influence de l’allèle ε4 qui entrainerait également un gain de toxicité, une perte des fonctions protectrices ou les deux en même temps 18. La revue de Mohan Giri et al. présente de manière approfondie la relation entre la MA et ces gènes à risque ainsi que les caractéristiques neuropathologiques qui sous-tendent la MA 19.
D’autre part, l’hypothèse de cascade amyloïde causant les lésions neurologiques repose sur la surproduction ou la mauvaise élimination des peptides extrêmement hydrophobes à l’état de monomères qui vont vite s’agréger en oligomères solubles. Ces oligomères prennent alors un aspect β plissé et s’accumulent jusqu’à la formation de fibrilles insolubles qui constituent les plaques amyloïdes intracérébrales (figure 2). Ces plaques recouvrent petit à petit le cortex cérébral et mènent à la mort neuronale. Cette hypothèse n’étant pas totalement validée, l’accumulation de fibrilles amyloïdes conduisant à la démence selon cette séquence d’événements est encore discutée. L’origine des plaques amyloïdes est donc liée à la forte tendance des peptides amyloïdes à s’agréger et en
20 particulier les peptides Aβ42. En effet, il a été démontré que la diminution de la concentration en Aβ 1-42 issus du LCR des patients atteints de la MA est corrélée avec la présence de plaques amyloïdes 20.
Figure 2 : Hypothèse de la cascade amyloïde15 (DNF : dégénérescence neuro-fibrillaire)
Durant la cascade amyloïdogénique, un état oligomérique intermédiaire composé de 3 à 8 monomères a été mis en évidence. Ces formes solubles non fibrillaires de faibles poids moléculaires sont dorénavant connues pour leur forte toxicité à l’égard des cellules neuronales 21. Le groupe de Walsh a montré que les monomères et les oligomères à faibles poids moléculaires sont particulièrement toxiques et responsables de la perturbation de l’activité synaptique 22. Ainsi, les oligomères solubles sont des candidats prometteurs pour le diagnostic de la MA 23,24.
b. Dégénérescence fibrillaire ou Tauopathie
Les protéines Tau (tubule-associated unit) proviennent de la famille des protéines associées aux microtubules. Elles sont principalement exprimées dans les neurones et jouent un rôle essentiel dans l’assemblage de monomère tubuline en microtubules, constituant du squelette neuronal. Les microtubules sont impliqués dans le maintien de la forme des cellules mais servent également de support pour le transport axonal. Une phosphorylation anormale de la protéine Tau serait responsable d’un processus d’agrégation conduisant à sa perte d’affinité avec les microtubules. Son
hyper-21 phosphorylation la rendrait insoluble et déstabiliserait l’auto-assemblage des microtubules ayant pour conséquence la dégénérescence neuro-fibrillaire (figure 3). Le processus d’agrégation conduirait à la formation de structures en filaments hélicoïdaux appariés, appelées enchevêtrements neuro-fibrillaires (NFTs) qui constituent un biomarqueur histologique fiable du processus de dégénérescence. Cette phosphorylation anormale est associée à une augmentation de l’activité kinase ou à une diminution de l’activité phosphatase qui normalement permet la régulation du taux de phosphorylation nécessaire 25,26.
Figure 3: Représentation d’un neurone sain (a) et d’un neurone malade (b) 27
Par ailleurs, les protéines Tau sont traduites à partir d’un seul gène localisé sur le chromosome 17. Son expression est régulé par un mécanisme d'épissage alternatif et six isoformes différentes existent dans le cerveau humain adulte 28. Les formes les plus étudiées correspondent aux thréonines 181 et 231. C’est l’élévation des protéines Tau phosphorylées (T181 et T231) et de la protéine Tau totale dans le LCR qui constitue un très bon biomarqueur pour prédire une MA naissante chez les patients au stade MCI 29. Cependant, les protéines p-Tau sont aussi décrites comme constituants majeurs des lésions fibrillaires gliales et intra-neuronales dans de nombreuses maladies neurodégénératives associées aux tauopathies comme la démence fronto-temporale 26.
L’hyper-phosphorylation ne se résume pas qu’à la perte des fonctions d’assemblage et de stabilisation des microtubules mais s’accompagne aussi d’un gain de toxicité. Tout comme les oligomères d’Aβ, les formes d’agrégation intermédiaires des protéines Tau sont cytotoxiques 30,31.
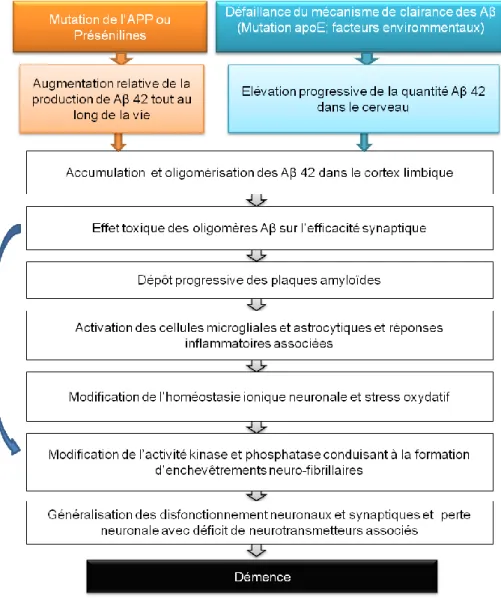
22 3. Les étapes de la physiopathologie de la MA
La compréhension de la progression de la maladie est une étape cruciale car elle permet d’envisager des interventions médicales à différents stades de la maladie. Les séquences d’événements débutant avec les premiers disfonctionnements métaboliques, les réponses inflammatoires à un stress oxydatif jusqu’au dysfonctionnement synaptique et à la perte des neurones responsable de la pathologie sont décrites dans le schéma de la figure 4. Sur ce même schéma, les oligomères Aβ peuvent directement causer la formation d’enchevêtrement neuro-fibrillaire (flèche bleu). En effet, des travaux récents ont mis en évidence une interaction directe entre les oligomères Aβ 1-42 et la kinase GSK3 α impliquée dans l’hyper-phosphorylation de la protéine Tau 32. Les oligomères Aβ 1-42 stimulerait l’activité de la protéine kinase GSK3α responsable de la phosphorylation de la protéine Tau, confirmant ainsi la toxicité avérée des oligomères Aβ dans la régulation de l’activité des kinases.
23 Les lésions asymptomatiques apparaissent bien avant le déclenchement des symptômes cliniques (stade de démence) qui commence par la perte de la mémoire, avec ensuite des troubles du langage et de la compréhension. Une étude de cohorte1 de 128 participants a démontré que le niveau de peptides Aβ 1-42 dans le LCR pourrait augmenter progressivement pendant 25 ans avant le début du stade de démence. Ceci a pour conséquence l’apparition de dépôts amyloïdes dans le cortex cérébral. L’augmentation de la concentration de la protéine Tau dans le LCR avec un début d’atrophie a été observée au moins 15 ans avant l’apparition des premiers symptômes cliniques et des changements hypo-métaboliques du cerveau et les troubles épisodiques de la mémoire peuvent apparaitre 10 ans avant l’apparition des premiers symptômes. Ci-dessous sont détaillés les différentes phases pathologiques identifiées et les changements associés ressortant de l’étude de cohorte1:
Une première phase pré-symptomatique (préclinique) où les fonctions cognitives sont encore intactes est mise en évidence par des taux faible en peptide Aβ42 et l’apparition de plaques amyloïdes. A ce stade, une faible concentration en Aβ 1-42 dans le LCR est un excellent biomarqueur en absence de symptômes cognitifs. Cette diminution peut être corrélée à la formation de plaques amyloïdes détectées par imagerie tomographie par émission de positons (TEP) 34. Néanmoins, il reste encore difficile de prédire son évolution vers une forme de démence.
Une deuxième phase pré-démentielle clinique connue sous le nom de mild cognitive impairment (MCI) avec déficit cognitif à différents degrés de sévérité a été mise en évidence. Ce stade se réfère aux personnes dont la mémoire et certaines capacités cognitives sont anormales mais pour lesquelles aucun diagnostic clinique n’est établi. Leur état peut évoluer vers différentes pathologies comme la MA, la démence vasculaire, la démence fronto-temporale ou la démence à corps de Lewy, mais souvent ces personnes présentent un déclin cognitif normal lié à l’âge. A ce stade, en plus de la diminution du peptide Aβ 1-42 dans le LCR et la formation des plaques amyloïdes plus importante, d’autres anomalies apparaissent. Selon le groupe d’expert de l’institut national « Aging-Alzheimer’s association », on peut y ajouter d’autres biomarqueurs moléculaires comme la concentration élevée des protéines t-Tau et p-t-Tau dans le LCR et des indicateurs de lésions neuronales tels que (i) la variation du volume du domaine de l’hippocampe ou l’atrophie du domaine temporal médial, (ii) le taux d’atrophie du cerveau observée sur l’imagerie par résonnance magnétique (IRM), (iii) des changements hypo-métaboliques du cerveau détectés par imagerie TEP ou IRM fonctionnelle 35. Généralement, les techniques d’imagerie ne suffisent pas pour un diagnostic différentiel vis-à-vis d’autres pathologies neurodégénératives d’où l’importance des biomarqueurs moléculaires. Des études cliniques ont démontré la capacité des biomarqueurs du LCR à
24 prédire une MA naissante au stade MCI à l’aide de la combinaison de biomarqueurs (Aβ 1-42, Tau, pTau) avec une sensibilité de 95% et une spécificité de 83–87% 2.
Enfin, le stade tardif de la MA correspond à un état de démence grave en raison de la multiplicité et de la sévérité des déficiences cognitives irréversibles. Il s’agit de troubles de la mémoire associés à l’altération d’une ou plusieurs fonctions intellectuelles (orientation dans le temps et l'espace, langage, réalisations gestuelles, reconnaissance des objets et des visages, jugement et raisonnement, anticipation, initiation et planification des tâches…) qui altèrent de manière considérable la vie quotidienne, ce qui nécessite une aide spécifique pour le patient. La quantification des biomarqueurs moléculaires peut encore aider pour un diagnostic différentiel à ce stade.
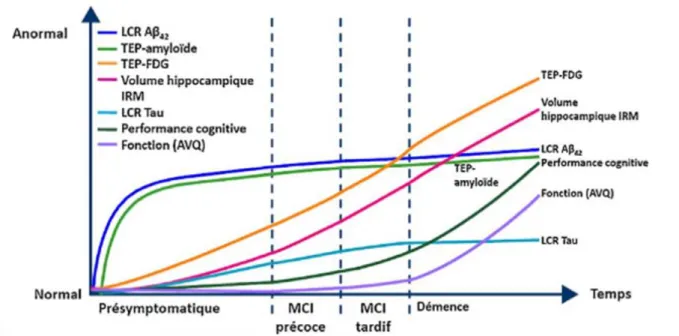
La figure 5 met en évidence l’évolution temporelle des différents processus neurophysiologiques d’un état normal à un état anormale en cohérence avec la chronologie des changements biologiques et cliniques observés durant l’étude de cohorte. Néanmoins, ce modèle n’est confirmé que pour les formes familiales de la MA (formes rares).
Figure 5 : Modèle d’évolution des biomarqueurs de MA au cours du temps 36. LCR : liquide
céphalorachidien ; IRM : imagerie par résonnance magnétique ; TEP : tomographie par émission de positons ; FDG, fludéoxyglucose ; AVQ : activités de la vie quotidienne.
4. Traitements de la MA
Après l’âge, d’autres facteurs peuvent augmenter les risques de prévalence de la MA comme les maladies cardio-vasculaires incluant l’hypercholestérolémie, l’hypertension, athérosclérose, la
25 maladie du cœur coronarien, le tabac, l’obésité et le diabète 4. Le déficit le plus important chez des patients atteints de la MA concerne le système cholinergique fortement impliqué dans les mécanismes de la mémoire. Ainsi, plusieurs traitements inhibiteurs de l’acétyl-cholinestérase sont indiqués dans le traitement symptomatique de la maladie. Les méta-analyses ont confirmé le bénéfice sur les fonctions cognitives, le comportement et les activités de la vie quotidienne 37. Cependant, ces traitements restent symptomatiques et ne traitent pas la cause de la maladie. De plus, ces traitements n’agissent que sur un seul des facteurs impliqués dans le processus de la MA alors que plusieurs déficits (défaillance des systèmes noradrénergiques, sérotoninergiques, histaminergiques et neuropeptidiques) ont été observés.
De nouvelles approches thérapeutiques basées sur le processus physiopathologique de la maladie sont en cours de développement afin de retarder, voire d’enrayer les processus neuro-pathologiques. Des travaux focalisés sur la cascade amyloïde emploient par exemple des inhibiteurs enzymatiques (BACE-1, γ-sécrétase) responsable de la formation des peptides Aβ 1-40 et Aβ 1-42 ou des activateurs de la α-sécrétase pour orienter le métabolisme de l’APP vers la voie physiologique non-amyloïdogénique ou encore des immunothérapies 37. En revanche, ces travaux ne sont pas concluants. Ceci peut s’expliquer par une intervention thérapeutique à un stade trop tardif par rapport à l’état pathologique du patient. Par conséquent, un diagnostic plus précoce pourrait permettre une intervention plus efficace notamment avant le développement irréversible du processus neuropathologique.
Une étude américaine récente a mis en place un traitement personnalisé multithérapeutique qui consiste à cibler les différents facteurs pouvant prévenir ou empêcher la progression des processus neuropathologiques 38. La stratégie consiste à cumuler les différentes données précliniques et épidémiologiques récoltées à ce jour pour intervenir sur plusieurs volets :
La santé physique via de l’exercice, un temps de sommeil optimal (8h par nuit) et un régime alimentaire adapté
La santé psychologique à travers des séances de yoga ou de méditation L’activité cérébrale en le stimulant
Le dysfonctionnement du métabolisme biochimique à l’aide d’un régime alimentaire adapté, un jeûne intermittent, la consommation d’épices naturelles anti-inflammatoires (curcuma), la prise de vitamines et de médicaments hormonaux et biotiques
Parmi les dix patients traités, neuf patients ont vu une nette amélioration dont six ont pu retourner à leur activité professionnelle interrompue à cause de leur handicap. Cette étude a montré que certains stades de la MA peuvent être réversibles avec une amélioration soutenue. Cependant, ces résultats
26 sont préliminaires car réalisés uniquement sur un petit groupe de patients. Cela reste à confirmer sur une cohorte plus grande réalisée par différents groupes de cliniciens. Cette stratégie de traitement reste toutefois prometteuse pour le traitement des malades de MA.
Ainsi, nous avons montré dans ce chapitre l’importance de l’interprétation clinique et de l’imagerie pour le diagnostic. Cependant, il apparait clairement que cela ne suffit pas pour établir un diagnostic et un suivi rigoureux de la pathologie. L’importance de la mesure du taux de peptides amyloïdes notamment dans le LCR est également primordiale. Aussi, le chapitre suivant est centré sur l’importance des biomarqueurs, plus particulièrement moléculaire, dans le diagnostic et le suivi de la MA.
27
Chapitre 2 : Biomarqueurs moléculaires et diagnostic de la MA
1. Les biomarqueurs de la MA a. Définition
Un biomarqueur est défini comme une caractéristique qui est objectivement mesurée et évaluée comme indicateur d’un processus physiologique normal ou pathologique ou d’une réponse à la suite d’une intervention thérapeutique. Il peut donner une information sur les effets de médicaments sur une cible ou sur une maladie. Ainsi, il est aussi un indicateur de l’état de santé d’une personne.
D’après la conférence de consensus du « Working Group on Molecular and Biochemical Measures » 39, le biomarqueur idéal pour le diagnostic de la MA doit répondre aux critères suivants (toujours valable actuellement):
Détecter une caractéristique fondamentale de la neuropathologie ; Être validé par des autopsies post-mortem ;
Avoir une sensibilité supérieure ou égale à 80 % pour dépister la MA par rapport à des sujets témoins ;
Présenter une spécificité supérieure ou égale à 80 % pour distinguer des autres pathologies ; Être fiable, reproductible, non-invasif, simple à exécuter et peu coûteux.
Pour évaluer la validité intrinsèque (spécificité et sensibilité) d’un test de diagnostic, on mesure la capacité du test à prédire si la maladie est présente. La sensibilité se mesure chez les malades seulement et correspond à la probabilité que le test soit positif si la maladie est présente. La spécificité se mesure chez les non-malades seulement et correspond à la probabilité d'obtenir un test négatif chez les non-malades.
b. Les biomarqueurs validés de la MA
Parmi tous les biomarqueurs moléculaires associés à la MA, seuls trois biomolécules du LCR ont été validées à l’aide des tests Elisa selon les critères indiqués précédemment :
Le peptide Aβ 1-42 diminue d’environ 50% chez le patient malade par rapport au sujet sain Les protéines t-Tau augmentent d’environ 300% chez le patient malade par rapport au sujet
sain
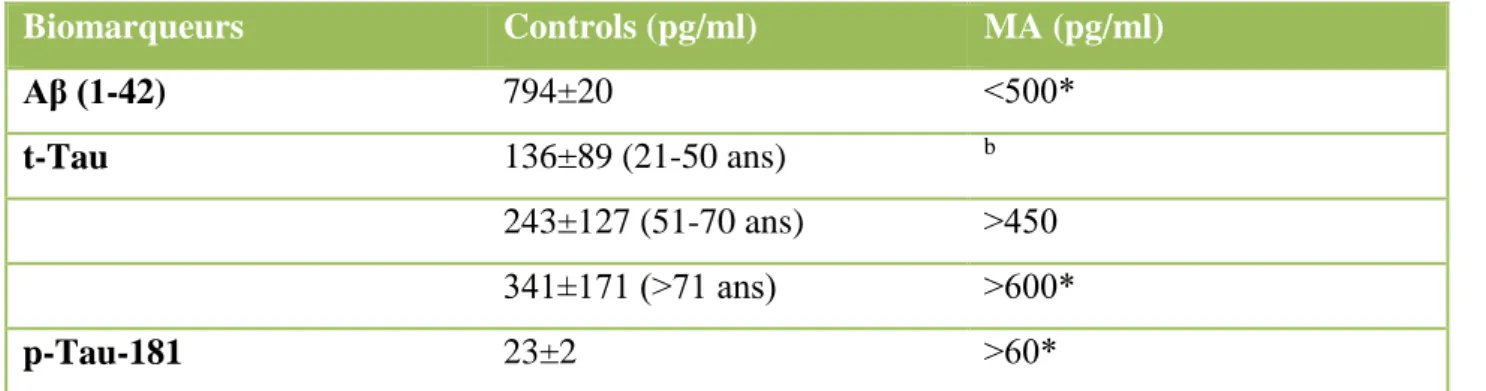
28 Le tableau 1 présente les variations de concentration des biomarqueurs de la MA observées chez les patients malades et les sujets sains.
Biomarqueurs Controls (pg/ml) MA (pg/ml) Aβ (1-42) 794±20 ˂500* t-Tau 136±89 (21-50 ans) b 243±127 (51-70 ans) ˃450 341±171 (˃71 ans) ˃600* p-Tau-181 23±2 ˃60*
a Résultat obtenue en utilisant les kits Elisa (Innogenetics) b Ne s’applique pas pour les formes sporadiques de la MA *P˂0,001
Tableau 1 :Valeurs seuils de références internationales des biomarqueurs du CSF pour le diagnostic de MAb
40
Une méta-analyse portant sur la mesure de ces trois biomarqueurs moléculaires en employant le kit Elisa de la compagnie Innogenetics 41 a montré une sensibilité de plus de 80 % de chacun de ces marqueurs et une spécificité de plus de 90 %. Cependant, c’est l’approche combinant les trois biomarqueurs qui améliore significativement le diagnostic de la MA en permettant une détection précoce de la MA sur des patients au stade MCI.
Plusieurs combinaisons ont été proposées : le ratio t-Tau/Aβ1-42 ; le ratio p-Tau/Aβ1-42 et la combinaison [Aβ 1-42]/(240 +1,18 x [t-Tau]) appelé « Innotest Amyloid Tau Index » (IATI). Le test IATI permet de définir un score. Le pronostic est favorable à un état de santé sain pour un score supérieur à 1.2. Un score inférieur à 0.8 est assimilé à une dégénérescence neuronale anormale. Un score inférieur à 0.8 combiné à une concentration de p-Tau supérieure à 60 pg/mL conduit au diagnostic de la MA avec une sensibilité de 92% et une spécificité de 83% 42. Actuellement en France,
c’est ce score qui est le plus utilisé en clinique bien que c’est l’approche combinant le ratio t-Tau/Aβ1-42 avec une sensibilité de 95% et une spécificité de 83% 2,43 qui est généralement admise comme étant la plus pertinente dans de nombreuses études 40.
Les variations observées sur ces trois biomarqueurs validés issus du LCR dans différentes maladies du système nerveux central sont présentés dans le tableau 2. Ces biomarqueurs combinés peuvent différencier une MA naissante de symptômes liés à l’âge, de démence liée à l’alcool ou à la maladie de Parkinson. Cependant, il reste difficile de différencier la MA vis-à-vis des autres pathologies comme la démence du corps de Lewy (LBD) où la diminution du peptide Aβ1-42 et l’augmentation des protéines t-Tau et p-Tau sont comparables pour ces deux maladies. L’utilisation de nouveaux
29 biomarqueurs ou de l’imagerie TEP en plus de ces biomarqueurs validés va permettre d’améliorer le diagnostic différentiel vis-à-vis d’autres pathologies.
Maladies Aβ 1-42 t-Tau p-Tau 181
AVC - ↑ (↑) -
Démence liée à l’alcool - - -
MA ↓ ↑ ↑ CJD ↓↓ ↑↑↑ - Dépression - - - DFTL ↓ ↑ - LBD ↓ ↑ ↑ Neuro-inflammation ↓ - -
Changement normal lié
à l’âge - - -
Maladie de Parkinson - - -
Démence vasculaire ↓ (↓) ↑ -
Tableau 2 : Changements observés sur les biomarqueurs du LCR dans différentes maladies du système
nerveux central 40. (-) pas de changement, (↑) augmente, diminue (↓). AVC : accident cardio-vasculaire ;
MA : maladie d’Alzheimer ; CJD : Démence de Creutzfeldt-Jacob ; DFTL : démence du lobe fronto-temporale ; LBD : démence du corps de Lewy
c. Présentation d’autres biomarqueurs potentiels et les nouvelles approches
Ces dernières années, beaucoup de travaux ont porté sur la recherche de nouveaux biomarqueurs dans le LCR qui constitue le milieu extracellulaire du cerveau reflétant le mieux les changements moléculaires survenant lors de la MA. D’autres biomarqueurs sont également recherchés dans des fluides biologiques plus accessibles tels que le sang ou le plasma 44, les urines 45 voire même la salive 46. Mais le LCR reste le fluide, le plus étudié du fait d’une plus grande complexité des autres fluides et de leur faible teneur en biomarqueurs d’intérêt. Le sang fait cependant l’objet de nombreuses études actuellement 47,48.
Les biomarqueurs de l’amyloïdogénèse dans le LCR
Il existe deux principaux biomarqueurs potentiels de l’amyloïdogénèse de la MA, les plaques amyloïdes détectées par TEP qui mesure la quantité d’agrégat sur le parenchyme cérébral et les analyses biochimiques des différentes espèces d’Aβ et des produits issus de la dégradation enzymatique de l’APP.
30 Les peptides Aβ sont présents sous différentes formes. La forme la plus connue et la plus étudiée que l’on retrouve majoritairement dans les plaques amyloïdes est le peptide Aβ 1-42. De plus, c’est le seul peptide dont la concentration soit corrélée avec la formation de plaques amyloïdes dans le cortex cérébral 20. Le premier ligand développé et le plus étudié en imagerie TEP pour lier les agrégats des plaques amyloïdes est le Pittsburgh Compound-B (11C-PIB). Cependant, le 11C –PIB a une durée de vie radioactive très courte (20 min), les chercheurs ont ainsi développé un ligand de structure proche (le 18F-AZD4694) avec une durée de vie plus longue (110 min) qui est plus adapté aux analyses cliniques 49. La combinaison de l’imagerie TEP avec les biomarqueurs du LCR permet l’obtention d’un diagnostic précoce bien que la relation temporelle entre la concentration du peptide Aβ 1-42 dans le LCR et l’imagerie TEP des plaques amyloïdes soit encore discutée 50. Les autres peptides Aβ tronqués en N-terminal ou en C-terminal (figure 6) peuvent améliorer le diagnostic différentiel de la MA.
Figure 6 : Séquence primaire des peptides Aβ les plus étudiés
Le peptide Aβ 1-40 est 10 fois plus abondant que le peptide Aβ 1-42 mais sa concentration dans le LCR n’est presque pas modifiée chez les personnes atteintes de la MA. Cependant, le ratio Aβ 1-42/ Aβ 1-40 a montré un fort potentiel de diagnostic supérieur au taux de Aβ 1-42 seul entre les patients atteints de la MA et les sujets sains. Ceci est lié à la variation de la production des Aβ totaux qui peut varier d’un individu à l’autre 51. La quantification des peptides tronqués Aβ 39, Aβ 38 et Aβ 1-37 en plus du ratio Aβ 1-42/ Aβ 1-40 réalisés à l’aide d’un western blot a permis de rendre le diagnostic de la MA plus discriminant vis-à-vis de la neuro-inflammation chronique et des autres maladies neuropsychiatriques 52. Récemment, un brevet (Patent WO2011124376 A1) reposant sur l’utilisation des rapports des peptides Aβ 1-42 / Aβ 2-42 ou Aβ 1-42 / Aβ 2-40 a été déposé comme une nouvelle méthode pour le diagnostic de la MA dans les fluides biologiques (LCR et sang) par western blot 53. Les combinaisons Aβ 1-42/Aβ 1-38 et Aβ 1-42/Aβ 2-42 ont également montré un fort potentiel pour le diagnostic différentiel de la MA vis-à-vis de la DLFT avec une sensibilité et une spécificité supérieures à 82% 54. Mais c’est le ratio Aβ 2-42/Aβ 1-38 qui semble améliorer considérablement la sensibilité du diagnostic différentiel entre la MA et la DLFT 54.
31 En revanche, les peptides tronqués en N-terminal (Aβ 2-X) dans le LCR sont 6 à 10 fois moins concentrés que le peptide Aβ 1-42 (tableau 3). Il est important de noter que les peptides Aβ sont de structures très proches et que l’immunodétection simultanée des différentes formes tronquées à l’extrémité N-terminale et C-terminale des peptides Aβ a été possible seulement grâce à la séparation par électrophorèse sur gel (SDS-PAGE) en amont de l’immunodétection. Malgré ces travaux intéressant, la technique utilisée est longue à mettre en place et dès lors difficile à envisager pour des analyses de routine en clinique.
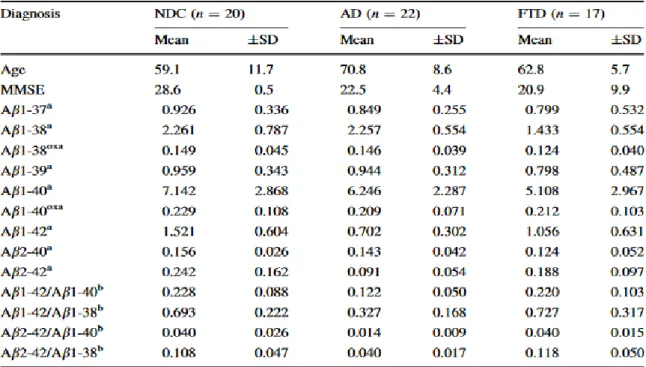
a Concentration totale de peptide Aβ (ng/ml) b Ratios des peptides Aβ
ox dérivée oxydée
Tableau 3 : Tableau récapitulant l’âge, le score MMSE et les concentrations (en ng/mL) ou les ratios d’Aβ des patients non atteints de démence cognitive (NDC), des patients atteints de la MA (AD) ou de la DFT
(FTD)54. MMSE : Mini-Mental State Examination.
Les formes oligomériques ont également été étudiées et l’utilisation de ces formes a démontré un fort potentiel pour le diagnostic de la MA 24. L’augmentation de l’activité de l’enzyme BACE-1 serait lié à un stade précoce de la pathologie 55. Ainsi, les produits (sAPPβ et sAPPα) issus du métabolisme de l’APP après clivage par l’enzyme BACE-1 et l’enzyme elle-même ont été essentiellement étudiés pour suivre l’impact de traitements thérapeutiques sur le métabolisme de l’APP 56.
32
Autres biomarqueurs
Différents travaux 57,58 ont mis en évidence la présence d’autres biomarqueurs dans le LCR. Ces biomarqueurs ont été classés en différentes catégories. On y trouve, en plus des biomarqueurs de l’amyloïgénèse (produits de l’APP, BACE-1) et de la tauopathie (NFTs), les biomarqueurs de la perte synaptique ou neuro-dégénération (récepteurs neuronaux, S100A1 et VGF par exemple), de l’inflammation (les cytokines, YKL-40, MCP-1 et GFAP), du stress oxydatif (F2-isoprostanes), du métabolisme du cholestérol (les apolipoprotéines), de l’expression génétique (microANRs) et bien d’autres dont la fonction reste encore mal connue. D’autres études tendent à chercher de nouveaux biomarqueurs de MA dans le sang 59. Une liste de biomarqueurs dont la plupart sont en commun avec le LCR a été présentée dans la revue de Schneider et al. 60. Ainsi, on y retrouve notamment les marqueurs liés aux mécanismes immunologiques, aux changements micro-vasculaires et aux biomarqueurs du plasma basés sur des analyses protéomiques.
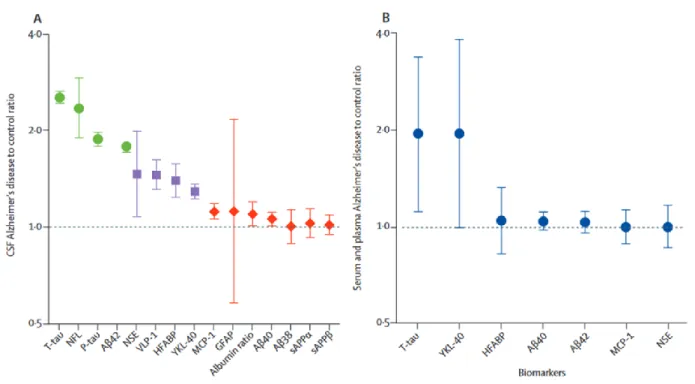
Néanmoins, la revue d’Olsson et al. 48 de 2016 présente une méta-analyse de quinze biomarqueurs du LCR et du sang pouvant être considérés comme les plus prometteurs de 1984 à 2014 (figure 7). Ces biomarqueurs reflètent essentiellement le processus de neuro-dégénérescence (t-Tau, NFTs, NSE, VLP-1 et HFABP), le métabolisme de l’APP (Aβ42, Aβ40, Aβ38, sAPPα et sAPPβ), la pathologie liée à la protéine Tau (p-Tau), l’altération de la barrière hémato-encéphalique (ratio de l’albumine dans le LCR et dans le sérum) et l’activité gliale à travers des marqueurs de l’inflammation (YKL-40, MCP-1 et GFAP). Cette étude démontre que les analyses du LCR portant sur la détermination des taux de peptides Aβ 1-42, t-Tau, p-Tau et des enchevêtrements neuro-fibrillaires restent, à l’heure actuelle, les plus prometteuses pour un diagnostic robuste. Les biomarqueurs du LCR émergeants (NSE, VLP-1, HFABP et YKL-40) sont modérément associés à la MA. Dans le sang, c’est la protéine Tau total qui est le seul biomarqueur permettant une meilleure discrimination entre les patients sains des patients atteints de MA. Cependant, cette méta-analyse ne met en évidence que les performances isolées de ces quinze biomarqueurs alors que de nombreuses études tendent à démontrer l’intérêt de la combinaison de plusieurs biomarqueurs potentiels.
33 Figure 7 : Evaluation des performances des biomarqueurs de la MA par rapport au control dans le LCR (A)
et dans le sérum et plasma (B).48NFL : neurofilament light protein ; NSE : neuron-specific enolase ; VLP-1 :
visinin-like protein 1 ; HFABP : heart fatty acid binding protein ; sAPPα / sAPPβ : α/β cleaved soluble amyloid precursor protein; MCP-1 : monocyte chemotactic protein 1 et GFAP : glial fibrillary acidic protein.
Nouvelles approches
Ces dernières années, d’autres études ont porté sur des techniques permettant un screening des fluides biologiques. A titre d’exemple, la spectrométrie de masse (souvent couplée à d’autres techniques) est très utilisée pour une analyse multiplexée de protéines, de lipides, de métabolites et d’autres molécules du LCR 61 ou du sang 47,62. L’étude réalisée par O’Bryan et al. a démontré l’efficacité d’un algorithme permettant la combinaison de onze biomarqueurs potentiels (sérum/ plasma avec les résultats d’analyses cliniques et les données démographiques. Les différentes données utilisées sont présentées dans le tableau 4.
Facteurs de risque
Bio-marqueurs potentiels Protéine C Reactive ; Adiponectine; Polypeptide pancréatique; Protéine FABP; Récepteur IL 18 ; Beta 2 Microglobuline ; Tenascine C ; Récepteur I.309; Facteur VII ; molécule VCAM 1; Protéine MCP 1
Analyses cliniques Cholestérol total ; Triglycérides ; homocysteine Données démographiques Le genre, l’âge, l’éducation, la mutation de l’apoE
Tableau 4 : Facteurs de risque parmi les biomarqueurs potentiels, les analyses cliniques et les données
34 Le tableau 5 reporte les valeurs de sensibilité et spécificité pour les données seules ou combinées. L’approche combinant les biomarqueurs potentiels avec les données cliniques et démographiques a permis d’obtenir des valeurs de spécificité et sensibilité de 75% et de 91% respectivement. Par rapport aux autres combinaisons, ces valeurs se rapprochent le plus de celles obtenues avec le ratio de t-Tau/Aβ 1-42 (biomarqueurs validés du LCR) généralement utilisé qui présentent des valeurs de spécificité et sensibilité de 84% et 100% respectivement. Cette démarche est prometteuse pour éviter le dosage des biomarqueurs issus du LCR en utilisant un prélèvement invasif mais elle nécessite néanmoins l’accès à des données très variées (cliniques, démographiques et biologiques).
Sensibilité (%) Spécificité (%)
Biomarqueurs + Clinique + démographique 75 91
Biomarqueurs + démographique 79 87
Biomarqueurs + Clinique 73 60
Score biomarqueurs marqués seuls 54 78
Variables cliniques seules 53 72
Variables démographiques seules 70 92
Ratio Tau/Aβ (LCR) 84 100
Tableau 5 : Précision du diagnostic des différentes formulations combinées ou non (sensibilité/spécificité) 62
L’émergence d’entreprises qui analysent uniquement le sang pour le diagnostic de la MA confirme finalement son potentiel de diagnostic. L’entreprise française Alzohis créée en 2014 a mis au point un diagnostic reposant sur une nouvelle combinaison de biomarqueurs conduisant à une "signature" caractéristique détectable dans le sang. Cette signature est capable de distinguer les patients atteints de MA de ceux souffrant d'autres maladies neurodégénératives avec une spécificité de 85% et une sensibilité de 70%. La valeur de sensibilité reste cependant encore en dessous du seuil limite défini par le groupe d’expert qui est de 80%. D’autres entreprises utilisent des biomarqueurs plus conventionnels. Par exemple, la société espagnole Araclon a développé un diagnostic reposant sur un test Elisa pour l’analyse des peptides Aβ 1-42 et Aβ 1-40 dans le sang. Cependant, les études sur le ratio Aβ 1-42/Aβ 1-40 dans le sang restent encore controversées.
35 2. Le diagnostic actuel de la MA
Selon l’association France Alzheimer, il existe de nombreux signaux qui doivent alerter le patient et son entourage notamment lorsque plusieurs des symptômes suivants coexistent chez une même personne. Ces signes sont : les pertes de mémoire, les difficultés à accomplir les tâches quotidiennes, les problèmes de langage, la désorientation dans le temps et dans l’espace, les difficultés dans les raisonnements abstraits comme effectuer les formalités administratives, la perte d’objets, l’altération du jugement, la modification du comportement, des pertes de motivation et le changement de personnalité. A l’apparition de ces symptômes, un médecin averti doit juger s’ils suscitent une attention particulière après une ou plusieurs consultations du patient et, si possible avec un accompagnant. L’entretien initial évalue le type et l’origine de la plainte, recherche les antécédents médicaux, tout changement altérant les activités quotidiennes du patient et l’évolution progressive des troubles dans le but de reconstituer l’histoire de la maladie avec le patient et son accompagnant. Une évaluation psychologique précise est très importante car un patient Alzheimer peut être diagnostiqué par erreur comme une personne atteinte de dépression nerveuse 63. Un examen clinique sur l’état général et un examen cardio-vasculaire du patient est dès lors établi puis suivi par des tests fonctionnels et cognitifs. Si ces tests montrent une altération de l’état du patient, alors des examens cliniques plus approfondis seront réalisés par des techniques d’imagerie et éventuellement des tests biochimiques.
a. Tests cognitifs et imageries
Les tests cognitifs consistent à établir un bilan neuropsychologique et un examen neurologique. L’examen neurologique, souvent normal au début de la maladie, a pour objectif de déceler d’éventuels troubles neurologiques tels que des troubles oculomoteurs, troubles de la marche, troubles de l’équilibre, syndrome parkinsonien, etc… Le bilan neuropsychologique évalue chacune des fonctions cognitives telle que la mémoire épisodique, la mémoire sémantique, les fonctions exécutives, l’attention et les fonctions instrumentales (langage, communication, praxies, gnosies, fonctions visio-constructives, calcul). A partir de ce bilan, un profil cognitif est dressé. Ce bilan met en évidence les fonctions déficitaires mais précise également celles qui sont préservées. Plusieurs tests existent : le test de Folstein ou Mini-Mental State Examination (MMSE), l’épreuve de rappel des 5 mots (Memory Impairment Screen) ou encore les tests de repérage.
36 La Haute Autorité de Santé recommande d’utiliser une évaluation globale et standardisée à l’aide du MMSE. Ce test, effectué par un médecin expérimenté, explore l'orientation temporo-spatiale, l'apprentissage, la mémoire, l'attention, le calcul, le raisonnement, le langage et les praxies constructives qui se caractérisent par une difficulté à définir les relations des objets entre eux dans l'espace. L’évaluation régulière de l’atteinte cognitive permet ainsi de détecter un éventuel déclin cognitif rapide. Le test dure environ 15 minutes et permet d’obtenir un score sur 30 points. Le score de 24/30 est considéré comme le score au-dessous duquel une pathologie cognitive est avérée mais il doit toujours être considéré avec précaution du fait de la faible sensibilité de la méthode d’évaluation. Le « montreal cognitive assessment » (MoCA) est un autre test proche du MMES mais il insiste davantage sur l’évaluation de l’attention vision-temporelle en incluant des tâches telles que le test de l’horloge et le test de piste (relier un ensemble de points de manière précise). Une étude a montré que le test MoCA présente une meilleure sensibilité que le test MMES (92 % vs 82%) mais une plus faible spécificité (67% vs 76%) 64. Malgré toutes ces observations cliniques et les évaluations cognitives, ces méthodes ne permettent pas de poser un diagnostic différentiel étant donné que les troubles peuvent être communs à plusieurs maladies neurodégénératives. En présence d’un trouble cognitif avéré, la Haute Autorité de Santé recommande de s’orienter vers des examens paracliniques. Des examens biochimiques (dosage de la thyréostimuline hypophysaire, de la vitamine B12) et une imagerie morphologique du cerveau (IRM) sont systématiquement réalisés afin de ne pas méconnaître l’existence d’une autre cause (séquelle d’accident vasculaire par exemple) ou maladies associées. Si malgré toutes les observations, l’évaluation est en faveur d’un déclin cognitif alors la réalisation d’examen plus approfondi à l’aide d’imageries fonctionnelles est nécessaire.
La combinaison de l’IRM avec d’autres techniques d’imagerie telles que la TEP permet d’évaluer les modifications morphologiques du cerveau (atrophie) et les changements métaboliques (glucose). L’IRM permet d’évaluer en particulier la région hippocampique qui est très touchée chez les patients atteints de la MA. Cependant, l’IRM seule ne permet pas de différentier la MA des autres maladies neurodégénératives. L’hypo-métabolisme des cortex pariétal, temporal et postérieur identifié par l’imagerie 18F-fluorodeoxyglucose (FDG)-TEP peut être utilisé afin d’estimer le taux d’utilisation du glucose par le cerveau. Une faible activité synaptique peut être attribuée au processus pathologique de la MA qui réduit le métabolisme du glucose et, par conséquent, réduit également la fixation du FDG dans le cerveau des patients atteints de MA. Cet indicateur peut aussi différentier la MA de certaines démences telles que la maladie DFTL et il permet de prédire la progression d’un stade MCI vers un stade de démence MA avec une précision élevée 11. L’imagerie TEP permet de détecter le dépôt de plaques amyloïdes dans le cortex cérébral, spécifique de l’amyloïdogénèse bien que les