Faculté de Médecine et de Pharmacie RABAT
FACTEURS PREDICTIFS D’ECHEC DE MOBILISATION
DES CELLULES SOUCHES HEMATOPOÏETIQUES (CSH)
POUR AUTOGREFFE : AGIR EN AMONT !
EXPERIENCE DU SERVICE D’HEMATOLOGIE CLINIQUE DE L’HOPITAL MILITAIRE D’INSTRUCTION MOHAMMED V DE RABAT ET DE LA BANQUE
DE TISSUS ET DE CELLULES, SERVICE DE TRANSFUSION ET D’IMMUNOLOGIE DE CHU IBN SINA DE RABAT
R
EALISE PAR:
Docteur Houda RABII
RAPPORTEUR :
Professeur Kamal DOGHMI
CO-RAPPORTEUR:
Professeur Assistant El Mehdi MAHTAT
Session Décembre 2020
MEMOIRE DE FIN D’ETUDES
POUR L’OBTENTION DU DIPLÔME DE SPECIALITE MEDICALE SPECIALITE : HHEEMMAATTOOLLOOGGIIEE CCLLIINNIIQQUUE E
Mémoire effectué sous la direction de mon maître
Le Professeur Kamal Doghmi
Vous m’avez fait un grand honneur en acceptant de me confier ce travail. Je vous remercie pour votre disponibilité, vos encouragements et vos précieux conseils. Votre compétence, votre dynamisme et votre rigueur ont suscité une grande admiration et un profond respect.
Vos qualités professionnelles et humaines me servent d’exemple. Veuillez croire à l’expression de ma profonde gratitude et de mon grand respect.
Au Cher Pr Mohammed Mikdame,
Vous nous avez marqué à jamais par votre amour pour l’enseignement, par votre talent à transmettre le savoir, par vos compétences, et vos qualités humaines.
Veuillez trouver, cher Maître, en ce travail l’expression de ma profonde reconnaissance et de mes remerciements les plus vifs.
Je ne serai jamais reconnaissante à toutes les personnes qui de prés ou de loin ont contribué à la réalisation de ce travail.
En premier lieu, je remercie le Pr Assistant El Mehdi Mahtat, il a fait preuve d’une grande disponibilité à mon égard, il m’a guidée dans ce travail et m’a aidée à trouver les solutions
pour avancer.
Je remercie enfin les honorables membres du jury pour le temps précieux qu’ils vont consacrer à la lecture de ce mémoire.
Liste des abréviations utilisées :
CSH : Cellules souches hématopoïétiques
ASCT : autogreffe de cellules souches périphériques (autologous stem cells transplantation).
MM : myélome multiple
LNH : lymphome non hodgkinien LH : lymphome hodgkinien
GCSF : (granulocyte colonystimulating factor), facteur de croissance granulocytaire RC : rémission complète
VGPR : très bonne réponse partielle (very good partial response) PR : réponse partielle (partial response)
SD : maladie stable (stable disease)
PD : maladie progressive (progressive disease)
TRM : (toxicityrelatedmortality) : toxicité relative à la toxicité de la greffe CD34+ : cluster de différenciation 34
Figure 1 : Répartition des pathologies objets de l’autogreffe des CSH. ...8
Figure 2 : Distribution des scores ISS ...9
Figure 3 : Répartition des patients selon les groupes de risques ... 10
Figure 4 : Etat de la moelle osseuse au diagnostic ... 11
Figure 5 : Répartition des lignes de chimiothérapie avant mobilisation par patient ... 12
Figure 6 : Le type des régimes mobilisateurs employés dans notre série. ... 13
Figure 7 : Stratification des patients en fonction de la richesse des greffons. ... 14
Figure 8 : Modèle de régulation des niches hématopoïétiques à l’état de base (16, 17). ... 20
Figure 9 : G-CSF dérègle le fonctionnement de la niche hématopoïétique et provoque la mobilisation des CSH. ... 22
Figure 10 : Schéma de mobilisation préemptive. ... 24
Figure 11 : Schéma d’algorithme pour mobilisation de CSH, approche dynamique pour une mobilisation des cellules souches hématopoïétiques. ... 37
Figure 12 : Algorithme pour le déclenchement de la 1re cytaphérèse selon le taux de cellules CD34 + dans le sang circulant dans le cas d'une mobilisation sous G-CSF seul. Les cas les plus fréquents sont représentés par des traits pleins, les cas moins fréquents par des traits en pointillés (74). ... 42
Tableau 1 : Comparaison en analyse univariée et multivariée des facteurs de risque d’échec de mobilisation ou de mobilisation pauvre. ... 16 Tableau 2 : Début de G-CSF et du monitoring des CD34+ lors de la mobilisation par chimiothérapie (64). ... 34 Tableau 3 : Calcul du score de mobilisateurs pauvres prévus pPM et score simplifié PM : s-pPM (65). ... 36 Tableau 4 : Avantages et limites des stratégies mobilisatrices ... 44 Tableau 5 : Facteurs affectant le recueil des cellules CD34+... 44 Tableau 6 : Comparaison des coûts de la mobilisation par Perixafor/GCSF et Chimiothérapie/G-CSF ... 46
Patients et méthodes ... 5
A. Patients de l’étude : ... 6
B. Analyse statistique : ... 6
Résultats de l’étude ... 7
A. Caractéristiques des patients : ... 8
1. L’âge moyen au diagnostic: ... 8
2. Le sexe : ... 8
3. Les antécédents médicaux et toxiques : ... 8
4. Poids à la mobilisation : ... 8
5. Maladies de base ... 8
6. Stades de la maladie : ... 9
7. Pronostics : ... 10
8. Moelle osseuse au diagnostic: ... 11
9. Traitements reçus : ... 11
10. Usage de myélotoxiques : ... 12
11. Antécédent d’autogreffe de CSH : ... 12
12. ATCD d’échec de mobilisation : ... 12
13. NFS avant mobilisation : ... 12
B. Procédure de la mobilisation : ... 13
1. Régimes mobilisateurs ... 13
2. Mode d’administration du G-CSF ... 13
3.Dosage des cellules CD34+ dans le sang périphérique la veille de la cytaphérèse(cellules/µl) : ... 13
4. Nombre de cytaphérèses : ... 14
5. Richesse des greffons : ... 14
6. Performance des procédures de mobilisation :... 15
7. Définition de l’échec : ... 15
C. Analyse des facteurs de risque en analyse uni et multivariée : ... 15
Discussion ... 17
A. La cellule souche hématopoïétique et niche hématopoïétique : ... 18
B. Mécanismes de la mobilisation : ... 21
1. Le G-CSF :... 21
2. Cyclophosphamide : ... 23
3. Antagonistes CXCR4: ... 23
4. Les anticorps anti Integrin α4 (CD49d) : ... 23
C. Les stratégies de mobilisations des cellules souches hématopoïétiques : . 24 1. Les modalités de mobilisation des CSH : ... 24
2. Objectifs du recueil : ... 27
3. Effets secondaires et complications lors de la mobilisation (39) :... 27
D. Les facteurs de risque prédictifs d’un échec de mobilisation ou « mobilisation pauvre » : ... 28
1. Effet de la maladie sous-jacente : ... 29
2. Effect des traitements préalables: ... 29
3. L’effet de l’âge sur la qualité de la mobilisation:... 31
4. Mobilisation pauvre d’origine constitutionnelle : ... 31
5. Autres facteurs : ... 32
E. Stratégies d’optimisation des régimes mobilisateurs courants : ... 33
1. Age des donneurs : ... 33
2. Planning de la mobilisation : ... 33
3. Optimisation de la cytaphérèse pour améliorer le rendement : ... 33
4. Recommandations pour les mobilisations : 1ère ligne : ... 38
5. Recommandations en cas d’usage des thérapies myélotoxiques ou nouvelles : ... 39
6. Recommandations pour les re-mobilisation : ... 40
7. Appliquer une gestion axée sur les bonnes pratiques : ... 40
F. Stratégies d’amélioration du rendement chez les mobilisateurs pauvres : 41 Conclusion générale ... 47
Résumé ... 60 Annexes ... 63
1
2
L’intensification thérapeutique combinée à l’autogreffe de cellules souches hématopoïétiques ASCT : autologoushematopoeitic stem cell transplantation, est la largement utilisée dans le traitement des hémopathies malignes, notamment, le myélome multiple MM et différents types de lymphomes. Cette combinaison thérapeutique a prouvé une amélioration significative de la survie sans progression PFS (progression free survival) et survie globale OS (overalsurvival) chez les patients (1). Actuellement, cette technique est pratiquée, chez la majorité des patients par infusion des CSH périphériques (2), ainsi, la mobilisation des CSH en pratique, représente la pierre angulaire du processus de transplantation. Les régimes mobilisateurs ont connu un grand progrès, passant d’une mobilisation basée exclusivement sur la chimiothérapie, non dénudée de risque à court et long terme, à une mobilisation axée sur une meilleure connaissance des niches hématopoïétiques et des mécanismes d’ancrage des CSH à leur microenvironnement. Néanmoins, les taux d’échecs de la procédure de mobilisation ne sont pas négligeables et représentent selon les séries entre 5-35,2% (3).
Le dosage des cellules mononuclées et des CD34+ dans le sang périphérique durant le processus de mobilisation, permet de prédire l’efficience du recueil ainsi que le timing propice pour le faire (4). Néanmoins, un petit nombre d’études rapportent un changement du taux des cellules CD34+ durant le processus de mobilisation. Le groupe GITMO (Groupo Italiano Trapianto di MidolloOsseo) avait proposé une définition des « Mobilisateurs Pauvres MP » dans le lymphome et le myélome multiple selon un processus d’analyse hiérarchique (AnalyticHierarchyprocess) AHP, en identifiant deux groupes de MP (5):des MP prouvés et des MP prédits, afin d’améliorer des stratégies de mobilisation, favoriser la faisabilité de la greffe et réduire des coûts inhérents à celle-ci.
3
Définitions des mobilisateurs pauvres prouvés et prévisibles : Patients avec MM ou lymphome candidat à une ASCT,sont:
Mobilisateurs pauvres prouvés :
- Si le patient reçoit une mobilisation adéquate (dose de G-CSF ≥10µg/kg quand il est utilisé seul ou ≥5µg/kg après chimiothérapie) et montre un pic des cellules CD34+ circulantes à un taux <20/µl à J4-J6 du début de la mobilisation par GCSF seul et au-delà de J20 après chimiothérapie suivie de G-CSF.
- Ou en cas d’une mobilisation pauvre, définie par un taux de cellules CD34+ recueillies <2. 10.6/kg de poids corporel après ≤3 cytaphérèses.
Mobilisateurs pauvres prévisibles : s’il répond au moins à un critère majeur ou 2 critères mineurs :
- Critères majeurs :
1. Antécédent d’échec de mobilisation.
2. Antécédent de radiothérapie extensive au tissu hématopoïétique 3. Cures complètes de chimiothérapie incluant Melphalan,
Fludarabine ou autre traitement affectant potentiellement la mobilisation des cellules souches
- Critères mineurs :
1. Stade avancé de la maladie, avec au moins 2 lignes de chimiothérapie précédentes.
2. Maladie réfractaire
3. Envahissement de la moelle osseuse à la mobilisation 4. Cellularité médullaire pauvre <30% à la mobilisation 5. Age>65ans
4
Autres groupes ont été identifiés :
- Ceux qui relèvent d’une « zone grise » ou encore appelés « mobilisateurs pauvres borderline », ceux-ci ont mobilisé entre 11 et 19 cellules CD34+ prélevées sur sang périphériques.
- Les mobilisateurs pauvres relatifs : sont ceux qui ont mobilisé entre 6 et10 cellules CD34+/µl de sang périphérique.
Le même groupe italien, a mis en œuvre un score prédictif des mobilisateurs pauvres pPM score (predictifpoormobilizer score), ayant comme objectif d’identifier ces patients qui vont surement nécessiter une approche plus incisive quant au régime de mobilisation et probablement utiliser le Plerixafor front line afin de limiter le surcoût d’une cytaphérèse additionnelle ou bien même orienter le patient à une allogreffe de cellules souches dont la mortalité liée au traitement TRM (therapy related mortality) n’est pas négligeable.
Objectif du travail :
Identifier les facteurs de risque d’échecs de mobilisation des CSH chez nos patients traités pour MM ou lymphomes sur une série rétrospective et proposer des régimes mobilisateurs adaptés au risque selon un score prédictif de mobilisation pauvre afin d’agir en amont et réduire les risques d’échecs de l’autogreffe et les coûts additionnels de la procédure de cytaphérèse.
5
6
A. Patients de l’étude :
Il s’agit des patients traités dans notre structure pour myélome multiple ou lymphomes hodgkiniens et non hodgkiniens avec une indication de greffe de cellules souches autologues, et qui sont prélevés au niveau du centre de thérapie cellulaire et banque de sang de Rabat.
83 procédures de mobilisations ont été analysées sur la période s’étalant d’Avril 2015 à Septembre 2020.
B. Analyse statistique :
Les données ont été analysées par EXCEL et SPSS version 13.0. Les variables quantitatives ont été exprimées en moyenne +/- écart type ou médiane. Celles qualitatives ont été exprimées en pourcentage.
7
8
A. Caractéristiques des patients :
1. L’âge moyen au diagnostic:
- La médiane d’âge de nos patients est de 56 ans [18 ; 66 ans]
2. Le sexe :
- Le sexe masculin représente 66% (55Hommes) et les femmes 34% (28 femmes) avec un sexe ration de 2.
3. Les antécédents médicaux et toxiques :
- 20% des patients étaient des fumeurs chronique à plus de 15paquets-années
4. Poids à la mobilisation :
- Le poids moyen à la mobilisation était de 72g (44Kg-110Kg).
5. Maladies de base
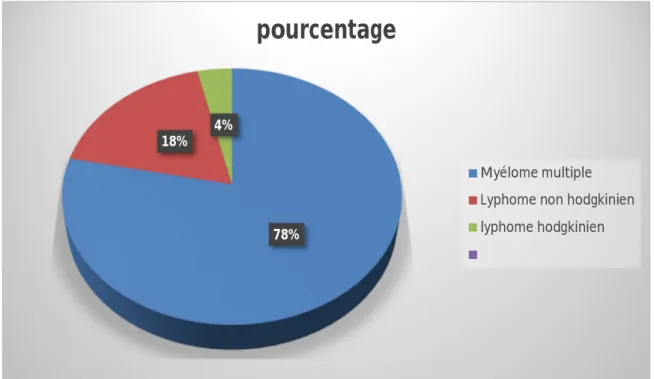
La majorité des patients qui sont greffés dans notre service sont porteurs d’un myélome multiple avec 78,3% (65patients), les patients porteurs de LNH et LH représentaient 18,1% (15patients) et 3,6% (3 patients) respectivement.
Figure 1 : Répartition des pathologies objets de l’autogreffe des CSH.
78% 18%
4%
pourcentage
Myélome multiple Lyphome non hodgkinien lyphome hodgkinien
9 6. Stades de la maladie :
Myélome Multiple :
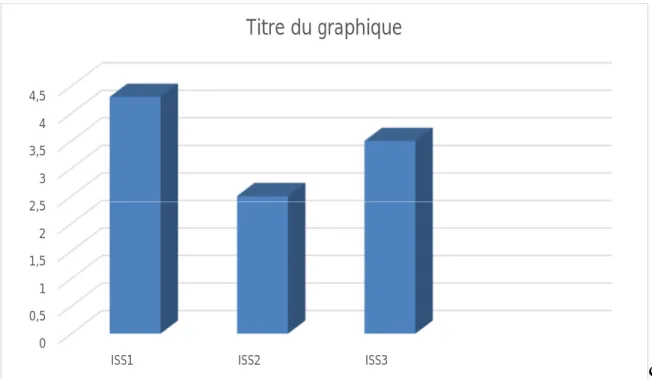
La stadification pronostique ISS pour le myélome multiple a été effectuée chez 92% de nos patients :
- ISS/R-ISS1 : 19 patients, soit 29,2% - ISS/R-ISS 2: 17 patients,soit 26,15% - ISS/R-ISS3 : 29 patients, soit 44,61%
Figure 2 : Distribution des scores ISS
Lymphomes :
Les patients traites pour lymphome hodgkinien ou non hodgkinien ont été classes selon la classification d’Ann Arbor, avec comme sous-groupes définis, les stades localises pour les stades I et II, et les stades avances pour les stades III et IV.
- Stades localisés : 3 patients avaient des maladies localisées au diagnostic, soit 17%. 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5
ISS1 ISS2 ISS3
10
- Stades avancés : 15 patients avaient un stade avancé au diagnostic, soit 83%.
7. Pronostics :
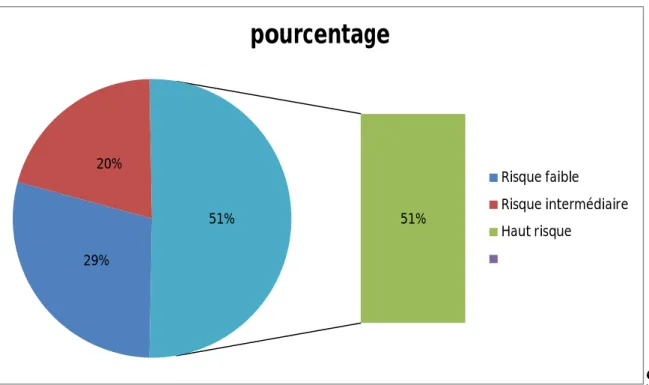
Le pronostic a été défini selon la maladie sous-jacente, afin de déterminer trois groupes de risque :
1. Risque faible : ISS/R-ISS ou IPI ou IPIaa ou FLIPI ou MIPI faible 2. Risque intermédiaire : ISS/R-ISS ou IPI ou IPIaa ou FLIPI ou MIPI
intermédiaire
3. ,Haut risque : ISS/R-ISS ou IPI ou IPIaa ou FLIPI ou MIPI eleve Les patients ayant une maladie faible risque représentaient dans notre
série 29% (24 patients), les patients ayant un risque intermédiaire et haut risque représentaient 20% et 50% respectivement.
Figure 3 : Répartition des patients selon les groupes de risques
29% 20% 51% 51%
pourcentage
Risque faible Risque intermédiaire Haut risque11 8. Moelle osseuse au diagnostic:
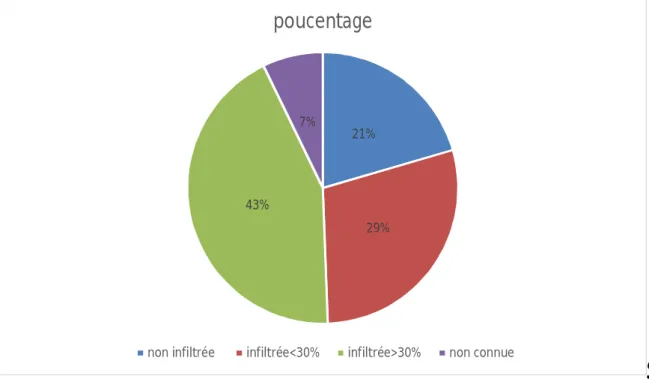
- L’évaluation de l’envahissement de la moelle osseuse par les cellules malignes au diagnostic a été possible chez 77 patients, dont 17 avaient une moelle non envahie, 24 patients avaient une moelle envahie à moins de 30% et 36 patients avaient plus de 30% de cellules malignes dans moelle.
Figure 4 : Etat de la moelle osseuse au diagnostic 9. Traitements reçus :
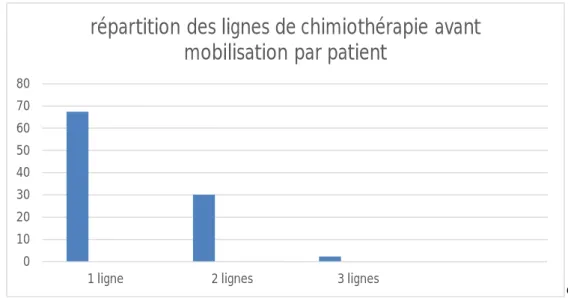
- L’étude de la lourdeur des traitements antérieurs a été évaluée grâce aux nombres de lignes de chimiothérapie préalables reçues par les patients, dont la moyenne est de 1,3 (1-3), 56 patients, soit 67,5% ont reçu une seule ligne, 25 patients soit 30% ont eu 2 lignes et seulement 2 patients ont reçu 3 lignes de chimiothérapie avant la mobilisation.
21%
29% 43%
7%
poucentage
12
Figure 5 : Répartition des lignes de chimiothérapie avant mobilisation par patient 10. Usage de myélotoxiques :
Les traitements myéloablatifs préalables à la mobilisation ont été utilisés chez nos patients, avec seulement 1 patient qui a reçu de la fludarabine, 2 patients ayant reçu lenalidomide avec plus de 4 cycles, 1 patient avait reçu lenalidomide associé au melphalan, deux patients avaient reçu une radiothérapie localisée et deux patients avaient reçu lenalidomide associé à la radiothérapie.
11. Antécédent d’autogreffe de CSH :
Une autogreffe de cellules souches hématopoïétiques a été réalisée auparavant chez 6 patients, soit 7% de la série.
12. ATCD d’échec de mobilisation :
Un seul patient ayant échoué à une mobilisation antérieure était repris dans notre série.
13. NFS avant mobilisation :
Taux moyen d’Hb (g/dl) : 12g/dl (9g/dl-16g/dl).
Taux moyen des Leucocytes (x10.9) :7,5 G/l (2,6G/l-15,2G/l) Taux moyen des Neutrophiles (x10.9) : 4,3G/l (1,194G/l-11,9G/l) Taux moyen des Plaquettes (x10.9) : 170G/l (94G/l-484G/l)
0 10 20 30 40 50 60 70 80
1 ligne 2 lignes 3 lignes
répartition des lignes de chimiothérapie avant mobilisation par patient
13
B. Procédure de la mobilisation :
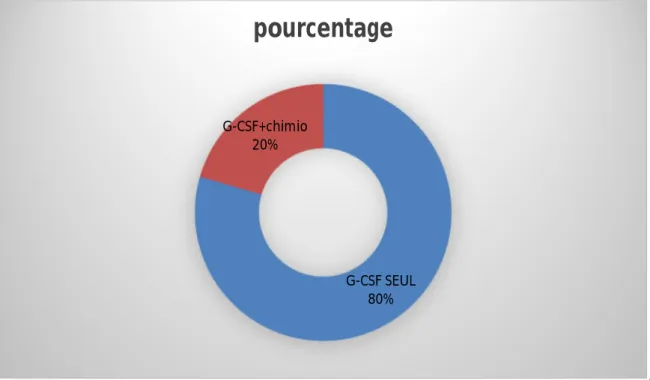
1. Régimes mobilisateursLes patients ont été mobilisés en « Steady state » dans 80% des cas, soit 66 patients et la mobilisation par chimiothérapie associée au G-CSF a concerné 20%, soit 17 patients.
Figure 6 : Le type des régimes mobilisateurs employés dans notre série.
2. Mode d’administration du G-CSF
Les patients ont été mobilisés au sein de l’hôpital dans 76% des cas et ceux qui ont été mobilisés selon un mode ambulatoire représentaient 24% des cas.
3. Dosage des cellules CD34+ dans le sang périphérique la veille de la cytaphérèse (cellules/µl) :
On a effectué un dosage du Pic des cellules CD34+ sur sang périphérique chez 75 patients, soit 90% de la série.
Le taux moyen des CD34+ est de 25 cellules/µl (1-200 cellules/µl).
G-CSF SEUL 80% G-CSF+chimio
20%
14 4. Nombre de cytaphérèses :
74 patients ont eu la cytaphérèse : avec 62% (soit 46 patients) ayant eu une seule, et 38% (soit 28 patients) ont en reçu 2.
5. Richesse des greffons :
La richesse moyenne de la première poche d’aphérèse était de 4.106 cellules CD34+/Kg de poids corporel et celle de la seconde poche était de 1,3.106 cellules CD34+/Kg de poids corporel, avec une richesse moyenne de 4,17.106 cellules CD34+/Kg de poids corporel.
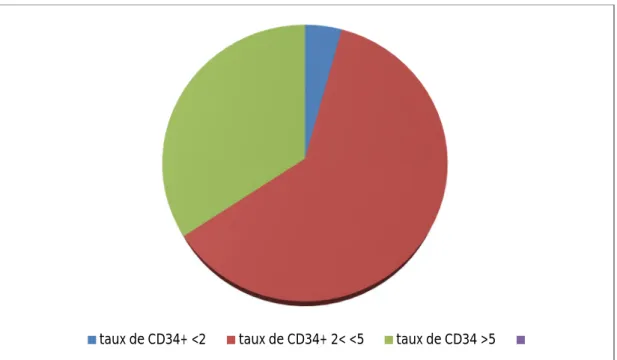
Les patients qui ont obtenu un greffon de richesse totale supérieure à 5 représente 34,3%, ceux qui ont en eu entre 2 et 5 représentent 61,4% et ceux ayant eu moins de 2 représentent 4,3%.
Figure 7 : Stratification des patients en fonction de la richesse des greffons.
15
6. Performance des procédures de mobilisation :
Sur 83 procédures de mobilisations entreprises chez nos patients, nous avons pu mobiliser 83% des patients soit 96 patients, avec donc un taux d’échec de 17%.
7. Définition de l’échec :
Les patients étaient déclarés en échec de mobilisation puisque le pic des cellules CD34+ est revenu faible chez 12% (10 patients) des patients ou l’association des deux indicateurs d’échec de mobilisation, à savoir le pic des cellules CD34+ faible et la richesse du greffon en deçà des objectifs fixés, qui a été relevé chez 5% des patients (soit 4 patients).
C. Analyse des facteurs de risque en analyse uni et multivariée :
1. En analyse univariée :La pathologie sous-jacente, notamment la pathologie non-myélome (LH et LNH) impacte négativement la mobilisation avec un p : 0.002 (CI : 1,893-15,276), le nombre de lignes de chimiothérapie préalables à la mobilisation impact négativement la richesse et le succès de la mobilisation avec un p : 0.0001 (CI : 4,236-96,293). Le régime mobilisateur semble avoir un impact significatif, puisque la mobilisation en « steady state », est associé à plus d’échec avec un p : 0.0010(CI : 0.032-0.400), l’usage de drogues myélotoxiques impacte significativement la mobilisation et associé à un plus grand nombre d’éche p : 0.0030(CI : 2.042-30.368), le mode d’administration hospitalière impacte positivement la collecte des CSH avec p : 0.003 (CI : 0.046-0.539), et enfin un antécédent de greffe impacte négativement la collecte p : 0.042 (CI : 1.071-33.605).
16 2. En analyse multivariée :
On retrouve un seul facteur qui impacte significativement la mobilisation qui est le nombre de lignes thérapeutiques préalables à la mobilisation avec un p : 0.0003 (CI : 2.750-119.046)
Analyse univariée
des facteurs de risque présumés d’échec de mobilisation Analyse multivariée Facteurs de risque prédictifs présumés Odds ratio (95% CI) Probabilité p Odds ratio (95% CI) Probabilité p Age (années) 0,224-0,564 0,224 Sexe(feminin) 0,334-3,698 0,864 Tabagisme(>15PA) 0,117-2.526 0,437 Pathologie sous-jacente (Lymphomes) 1,893-15,276 0,002 (0,048-8,917) 0,750 Nombre de lignes préalables
(>1ligne) 4,236-96,293 0,0001 (2,750-119,046) 0,003 Usage de drogues myélotoxiques avant mobilisation 2,042-30,368 0,003 (0,787-1,932) 0,361 Leucocytes<5G/l 0,070-1,143 0,076 Plaquettes <170G/l 0,203-2,068 0,464 Régime mobilisateur : G-CSF seul 0,032-0,400 0,001 Mode d’administration du G-CSF (Ambulatoire) 0,046-0.539 0,003 (0,016-9,767) 0,574 Antécédent de greffe de CSH 1,071-33,605 0,042
Tableau 1 : Comparaison en analyse univariée et multivariée des facteurs de risque d’échec de mobilisation ou de mobilisation pauvre.
17
18
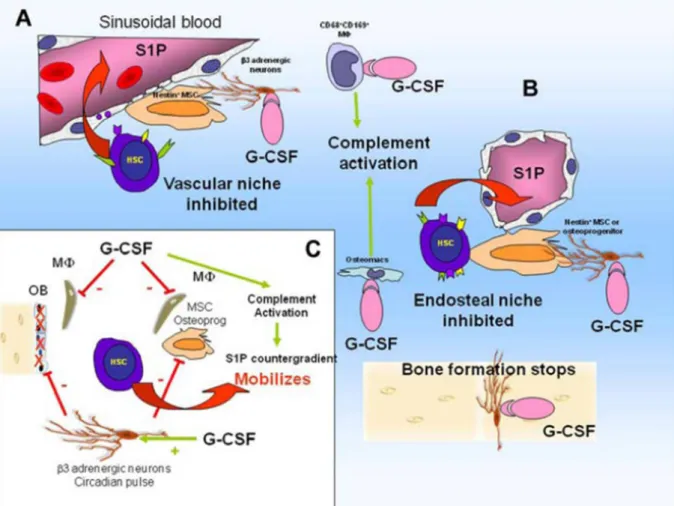
A. La cellule souche hématopoïétique et niche hématopoïétique :
Les CSH sont très rares, représentent environ 0.003% des cellules mononuclée d’une moelle de souris adulte (8), mais en renouvellement constant, ce qui leur permet une production des cellules hématopoïétiques tout au long de la vie de l’individu. Cette longévité est régulée par des facteurs moléculaires intrinsèques dont les facteurs de transcription et les régulateurs épigénétiques. Cependant, ces propriétés intrinsèques sont largement modulées par différents facteurs issus de leur environnement immédiat et produits à la fois par les cellules hématopoïétiques et non hématopoïétiques. En effet, en plus d’être le siège de l’hématopoïèse, la moelle osseuse abrite une multitude de populations cellulaires très diverses de type mésenchymateux, endothélial, myofibroblastique et nerveux formant des territoires où les CSH sont enclavées. Dans ces territoires, les molécules d’adhérence, les cytokines et les chimiokines déterminent la localisation spatiale des CSH qui se répartissent au niveau de structures anatomiques spécialisées appelées « niches ». Deux types anatomiques de niches des CSH ont été décrits chez la souris :
- une niche vasculaire où les CSH sont en contact avec les cellules souches mésenchymateuses CSM périvasculaires et les cellules endothéliales sinusoïdales (9, 10)
- Une niche endostéale où les CSH logent jouxtant les ostéoblastes recouvrant la surface endostéale de l’os et les CSM (11, 12, 13)
- Un modèle émergeant indiquant que les CSH actives qui contribuent au renouvellement du système hématopoïétique sont localisées au niveau des niches vasculaires, tandis que les CSH assurant la réserve sont préférentiellement localisées au niveau des niches endostéales, qui sont hypoperfusées et hypoxiques. (14, 15)
19
Les principaux acteurs de la niche hématopoïétique :
L’espace de la niche: délimité par les CSM périvasulaires pluripotentes et les progéniteurs ostéogéniques
Les interactions chimiotactiques et adhésives : les CSM périvasulaires et leurs progéniteurs ostéogéniques expriment des molécules telles que VCAM-1/CD106 qui se lie à son récepteur integrin_4_1 exprimé par la CSH, ainsi que SCF transmembranaire (Kit ligand) qui se lie à son récepteur c-Kit (117) exprimé sur laCSH et le SDF1/CXCL12 (stromalderived factor 1) qui se lie à son récepteur CXCR4 sur la CSH.
Les cellules de support au niveau de la niche : une population de macrophages phagocytes CD68_CD169, adjacentes aux CSM et aux ostéoblastes formant la niche. Ces macrophages sont nécessaires pour que les CSH de la niche expriment des cytokines et CXCL12 (16, 17) et essentielles pour l’intégrité de la fonction des niches. L’ablation de ces macrophages perturbe la fonction de la niche et par conséquent une sous-expression des VCAM-1, SDF-1 et SCF avec une mobilisation des CSH comme conséquence.
20
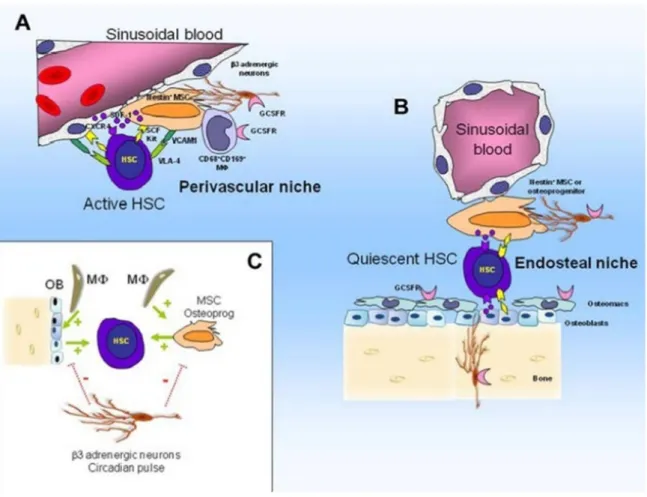
Figure 8 : Modèle de régulation des niches hématopoïétiques à l’état de base (16, 17).
A- niche péri-vasculaire contenant des CSH actives B- nicheendostéalecontenant des CSH quiescentes
C- interactions entre les cellules de la niche, les CSH et neurones adrénergiques.
21
B. Mécanismes de la mobilisation :
La mobilisation est définie par l’augmentation iatrogène des CSH circulantes, plusieurs voies ont été identifiées durant ces dernières décennies.
1. Le G-CSF :
a- Rôle des protéases : La chimiothérapie et le G-CSF entrainent des
altérations dans la composition des CSH de la niche, y compris une sous-régulation des processus d’adhésion comme VCAM1, SDF-1 et SCF (16, 18, 19). Les investigations initiales suggéraient que les granulocytes et leurs progéniteurs libéraient une grande quantité de protéases au sein de la moelle osseuse mobilisée, comme l’Elastase neutrophile, Cathepsin G, matrix metalloproteinase-9 (MMP-9). Ces protéases en concert avec autres proétases comme CD26 (exprimé sur la CSH), le C3 et le C5 (protéines de la cascade du complément), clivent et inactivent le VCAM-1, SDF-1, CXCR4, c-Kit et SCF.
b- Rôle des macrophages de la MO : l’administration du G-CSF
entraine la perte de ces macrophages, à l’origine d’une sous expression des SDF-1, SCF et VCAM par les cellules de la niche. Il a été aussi rapporté que la perte de ces macrophages est responsable d’une inhibition de l’ostéogenèse et des fonctions des cellules de support de la niche et contribue à la mobilisation induite par G-CSF (20).
c- Rôle du complément, de la voie de thrombolyse et gradients chimiotactique du SDF-1 et sphingosine-1-phosphate S1P : l’administration
du G-CSF active la voie du complément et de la thrombolyse qui jouent un rôle dans la mobilisation par le G-CSF. L’activation du complément est responsable du relargage du S1P érythrocytaire dans le plasma, qui est un chimio-attractant fort pour les CSH.
d- Rôle du système nerveux sympathique β adrénergique : à l’état
de base, les CSH suivent un rythme circadien sous le contrôle des nerfs sympathiques adrénergiques qui promeuvent des oscillations rythmiques dans la
22
production du SDF-1 par les cellules de la niche hématopoietique et l’expression des CXCR4 par les CSH. Par conséquent, chez les souris, l’expression du SDF-1 dans la MO et celle des CXCR4 au niveau des CSH est au plus bas niveau 5 heures après le lever du jour quand les CSH périphériques circulantes sont au pic (21, 22). Dans une étude rétrospective comprenant 85 donneurs volontaires sains mobilisés, ce pic était observé l’après-midi avec 85% plus de CD34+ que celui observé le matin (22)
Par conséquent, il semble que la mobilisation par G-CSF implique les macrophages et le système sympathique adrénergique (figure 8).
Figure 9 : G-CSF dérègle le fonctionnement de la niche hématopoïétique et provoque la mobilisation des CSH.
23 2. Cyclophosphamide :
La mobilisation des CSH a lieu lors de la phase de sortie d’aplasie post cyclophosphamide. Une réduction remarquable des ostéoblastes, macrophages médullaires et l’expression de CXCL12 est responsable du chute de gradient CXCL12. L’action synergique du G-CSF serait à l’origine d’une sous régulation des CXCL12 combinée à un plus grand nombre de CSH médullaires grâce à une induction de l’auto-renouvellement des CSH en réponse à la chimiothérapie (23).
3. Antagonistes CXCR4:
Le blocage du CXCR4 avec des antagonistes ou l’administration d’analogues stable de SDF-1 mobilisent les CSH. Seul, Plerixafor, mobilise rapidement les CSH avec obtention d’un pic à 6-9heures (24, 25). Il se lie directement au CXCR4 et bloque le signal au niveau de la cellule (26, 27), favorise le largage du SDF-1 lié au CXCR4 des cellules ostéoblastiques et endothélialesdans la circulation (28). Il contre le gradient chimiotactique du SDF-1 entre la moelle osseuseet le sang périphérique favorisant la sortie des CSH de la MO. En raison de leurs mécanismes différents mais complémentaires, le Plerixafor agit en très bonne synergie avec le G-CSF (25, 29). Il persiste, néanmoins, environ 30% des patients ne répondant pas au G-CSF, qui échouent au Plerixafor.
4. Les anticorps anti Integrin α4 (CD49d) :
Les integrin α4β1 jouent un rôle de médiateur à l’adhésion des VCAM-1 aux CSH. Une dose unique de natalizumab (300mg), un anticorps anti CD49d humanisé prescrit aux patients présentant une sclérose en plaque en rechute, a montré qu’elle augmentait 5 fois le taux de CD34+ après un jour d’administration. Il pourrait trouver sa place chez les patients qui échouent à la mobilisation après utilisation de G-CSF et de Plerixafor.
24
Figure 10 : Schéma de mobilisation préemptive.
C. Les stratégies de mobilisations des cellules souches
hématopoïétiques :
Aspects cliniques.
1. Les modalités de mobilisation des CSH :
Les modalités de mobilisation des CSH ont connu de nombreux progrès ces dernières années. On définit deux stratégies différentes :
La stratégie basée sur les facteurs de croissance seuls : dite à l’état stable « Steady state ».
25
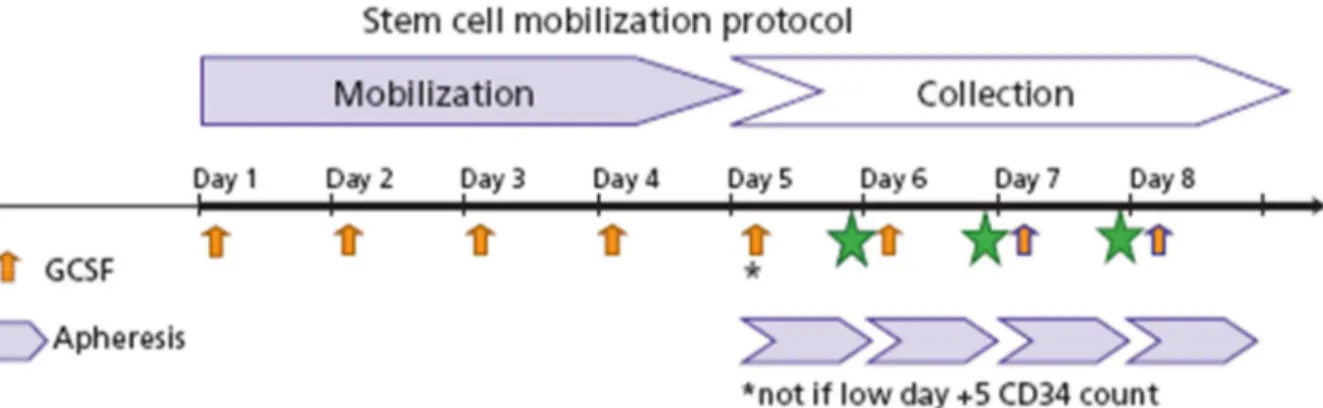
a. Mobilisation sans chimiothérapie : « Steady state » : (30),
- Cette approche est basée sur l’usage exclusif des cytokines. Le seul facteur de croissance recommandé pour la mobilisation des CSH étant le G-CSF. En pratique, le lenograstim et le filgrastim ont l’AMM dans la mobilisation des CSH.
- La dose recommandée pour le filgrastim est de 10µg/Kg/jour en sous cutané pendant 5 à 7 jours consécutifs, et pour le lenograstim est de
10µg/Kg/jour pendant 4 à 6 jours consécutifs. L’administration unique
ou biquotidienne ne semble pas faire de différence en matière de performance (31). Les biosimilaires des G-CSF ont une efficacité égale (32).
- La dose du G-CSF est déterminée en fonction du poids corporel (33). - La cytaphérèse est pratiquée à J5 de l’administration du G-CSF. Le
dosage des CD34+ n’est pas obligatoire mais doit aider à prédire la richesse du greffon et la durée de la cytaphérèse. Si le nombre de cellules collectées est inadéquat, la mobilisation avec du G-CSF doit être poursuivie pendant 1 à 2 jours. Cependant, si l’objectif du recueil n’a pas été atteint au bout de la 3ème cytaphérèse, on peut déclarer l’échec de la mobilisation.
- Parmi les avantages majeurs de la mobilisation en « steady state » : une toxicité moindre, le timing prévisible de la leucophérèse, la possibilité d’administration en ambulatoire et le coût relativement réduit par rapport à une chimio-mobilisation.
- L’inconvénient majeur de cette stratégie reste le taux variable d’échec de mobilisation et le taux de CD34+ relativement faible par rapport à une chimio-mobilisation.
- Son usage devrait être réservé à des patients ne nécessitant plus davantage de chimiothérapie pour contrôler la pathologie sous-jacente.
26
b. Mobilisation avec chimiothérapie:
- L’utilisation de la chimiothérapie en combinaison avec le G-CSF représente la stratégie de choix chez les patients qui ont besoin de réduire la charge tumorale et /ou ont besoin d’un plus grand nombre de CSH.
- Cyclophosphamide à la dose de 2-4 g/m2 est largement utilisé pour la mobilisation des CSH.
- Il est également possible de mobiliser les CSH lors du traitement spécifique de la maladie, ex : mobilisation des CSH suite à un traitement de rattrapage avec R-DHAP ou R-ICE chez les patients suivis pour lymphome.
- Les doses recommandées de G-CSF pour mobilisation après cure de chimiothérapie, 5µg/kg/jour pour le filgrastim et 150µg/m2/jour (équivalent 5µg/kg/jour), pour le lenograstim par voie sous cutanée.
- La mobilisation par G-CSF devrait commencer après achèvement de chimiothérapie. La plupart des protocoles recommandent le début du G-CSF 1 à 5 jours après fin de la cure de chimiothérapie.
- L’avantage primordial de cette stratégie, hormis, le contrôle tumoral, est le nombre réduit de cytaphérèse nécessaires pour le recueil des CSH (34).
- L’inconvénient majeur de la chimio-mobilisation est la toxicité liée au traitement, le séjour à l’hôpital, la toxicité médullaire qui pourrait compromettre une mobilisation ultérieure et majorer les coûts.
- Il est également difficile de prédire le jour exact de la cytaphérèse qui coïnciderait avec le pic de CD34+ dans le sang périphérique dont le monitoring doit se faire quotidiennement.
2. Dosage des cellules CD34+ et horaires de la cytaphérèse :
Le dosage des cellules CD34+ dans les produits sanguins périphériques mobilisés représente un paramètre important dans la qualité du greffon, comme il est le seul paramètre reconnu comme prédictif d’une prise de greffon stable après autogreffe (35). Le dosage des CD34+ dans le sang périphérique est
27
optionnel lors des greffes en « steady state », mais primordial lors des chimio-mobilisation. Suite à la chimiothérapie, une numération formule sanguine quotidienne est recommandée, et le dosage des CD34+ devrait démarrer au moins lorsque le taux de leucocytes dépassent 1G/l durant la sortie d’aplasie. La cytaphérèse devrait commencer si le taux des CD34+ ≥ 20/µl (36).
3. Objectifs du recueil :
L’objectif du recueil correspond au nombre de cellules CD34+ que l’on souhaite obtenir après cytaphérèse, avant congélation. Il dépend de la maladie sous-jacente. EBMT. La majorité des patients avec LNH ou LH ne nécessiterait pas plus d’une autogreffe (de rares cas de LH pourraient bénéficier d’une double autogreffe). Le taux minimal de cellules CD34+ recueillies accepté pour procéder à une autogreffe est de 2.10 6 cellules/Kg de poids corporel. (36). Cependant, des taux plus importants, 4 à5. 106/kg, sont exigés par certains centres puisqu’ils sont associés à des sorties d’aplasie plus précoces, avec une hospitalisation de plus courte durée, moins de transfusions sanguine et moins d’utilisation d’antibiothérapie (37, 38). Selon les situations cliniques, une double intensification peut être planifiée et donc nécessiter d'emblée la collecte d'un double greffon avec un minimum de 2.106 CD34+ /Kg de poids corporel par greffon. Le nombre de cytaphérèse doit être compris entre 1 et deux, exceptionnellement trois.
4. Effets secondaires et complications lors de la mobilisation (39) :
Les effets indésirables les plus fréquents associés à l’utilisation de G-CSF sont :
- Les douleurs osseuses - Les céphalées
- Fatigue - Nausées
Les effets secondaires rarement rencontrés lors de l’utilisation du G-CSF :
28
- Anxiété
- Douleurs thoraciques non cardiaques - Myalgies - Insomnie - Sueurs nocturnes - Erythème - Vertiges - Vomissement
- Réactions locales à l’injection
Ces effets secondaires sont généralement gérés par un traitement symptomatique.
Les effets secondaires très rarement rencontrés lors de l’utilisation du G-CSF :
- Rupture spontanée de la rate nécessitant une splénectomie en urgence.
Exceptionnellement :
- Réaction anaphylactique à l’injection du G-CSF.
D. Les facteurs de risque prédictifs d’un échec de
mobilisation ou « mobilisation pauvre » :
La mobilisation pauvre peut être innée, inhérente à une combinaison génétique spécifique d’une personne ou acquise en conséquence au vieillissement, traitements antérieurs ou la maladie elle-même (40).
L'atteinte peut concerner plusieurs niveaux :
- Nombre insuffisant de cellules souches hématopoïétiques à cause de facteurs intrinsèques des CSH.
- Nombre insuffisant de CSH en raison d’un déficit quantitatif ou qualitatif des niches hématopoïétiques.
29
- Inadéquation du nombre ou de la réponse des cellules effectrices et ou de support comme les macrophages médullaires ou les terminaisons nerveuses β adrénergiques.
1. Effet de la maladie sous-jacente :
L’envahissement médullaire par la maladie est associé à un rendement pauvre. (41, 42). Il y aurait un nombre relativement faible de CSH en partie dû à l’endommagement des niches hématopoïétiques saines par les cellules malignes au niveau de la moelle osseuse, ou une compétition entre les CSH et les cellules malignes pour un nombre limité de niches.
Par ailleurs, le lymphome non hodgkinien par opposition au lymphome hodgkinien, les syndromes lympho-prolifératifs indolents et la leucémie aigue ont été identifiés comme facteurs de risque indépendants. Cependant il y aurait d’autres mécanismes physiopathologiques en rapport avec ces pathologies qui restent à élucider (43, 44).
2. Effect des traitements préalables:
L’échec de mobilisation des CSH chez les patients prévus pour une autogreffe est corrélé aux nombre de lignes de chimiothérapie antérieure reçues. La majorité des traitements cytotoxiques ainsi que les thérapies ciblées peuvent avoir un effet délétère sur les CSH et les niches où elles résident.
- les agents alkylants comme melphalan ou carmustine, ou les analogues
de purines comme la fludarabine sont associés à un très haut risque d’échec de
mobilisation des cellules souches (45, 46).
- Les drogues cytotoxiques qui ne ciblent pas spécifiquement la phase S du cycle cellulaires (ex : anthracyclines, cisplatin, fludarabine, carmustine et melphalan) peuvent potentiellement tuer les CSH quiescentes et leurs niches.
- La fludarabine exerce un effet « double hit » sur les progéniteurs ainsi que leurs niche altérant ainsi doublement le mécanisme de mobilisation (47). La chimiothérapie intensive comme le protocole HyperCVAD (hyper
30
fractionedcyclophosphamide, vincristine, doxorubicine et dexamethasone avec methotrexate et Aracytine) est associé à un haut risque d’échec de mobilisation au-delà du 2-4 cycles de chimiothérapie.
- Lenalidomide est associé à une mobilisation pauvre, en particulier après la 4ème cure. Ceci serait dû à une diminution de la mobilité des CSH comme c’est le cas sur les cellules endothéliales (48). L’effet anti-antigénique du lenalidomide pourrait altérer la mobilisation (49). En plus il a été démontré que le lenalidomide augmenterait l’expression des CXCR4 qui favorisent la liaison des CSH à leurs niches (50).
- La radiothérapie extensive préalable est associée à un échec de mobilisation (51). Ceci serait secondaire à l’effet toxique combiné sur les CSH, leurs niches et les cellules de support. Elle augmenterait également l’expression des inhibiteurs de protéases comme l’α 1 antitrypsine ce qui entraverait la mobilisation des CSH.
- L’introduction du daratumumab dans l’arsenal thérapeutique du myélome a suscité la question de la faisabilité de la greffe après utilisation de cette drogue, que ce soit à la rechute mais aussi comme traitement de première ligne. L’essai CASSIOPEIA, comparant le D-VTd au VTd en première ligne chez la patients éligibles à la greffe, a conclu à la faisabilité de la mobilisation et de la collection des CSH avec l’induction à base de D-VTd, néanmoins, le régime mobilisateur sur lequel s’est basé l’essai reste une chimiothérapie à base de cyclophosphamide 3g/m2+G-CSF pour les deux bras et un recours au Plerixafor à hauteur de 21,7% dans le bras expérimental versus 7,9% dans le bras standard, un nombre moyen de cytaphérèse deux fois plus élevé dans le bras expérimental et une richesse moyenne moindre dans le bras expérimental d’environ 30% (52).
31
3. L’effet de l’âge sur la qualité de la mobilisation:
Une mobilisation pauvre est souvent observée chez les sujets âgés de plus de 60ans (53). Sénescence liée à l’âge des CSH par raccourcissement du télomère (54). Baisse de la réserve en CSH secondaire à une baisse des fonctions des niches avec déplétion des cellules mésenchymateuses médullaires et des ostéoprogéniteurs (55). Baisse des ostéoblastes responsables d’une diminution des niches endostéale (56). Une inhibition de la dégradation osseuse par un traitement à base de bisphosphonates comme le pamidronate et le zoledronate favorise la mobilisation des CSH en réponse au G-CSF chez les souris. L’efficacité de la parathormone est à démontrer également pour rattraper un échec de mobilisation, mais ces travaux sont en cours d’essais cliniques.
4. Mobilisation pauvre d’origine constitutionnelle :
Environ 5% des donneurs sains échouent à la mobilisation avec les régimes standards en absence de tout facteur de risque. La physiopathologie est toujours mal comprise. Des études génétiques sur des souris isogéniques a permis d’identifier des locis associés à une mobilisation pauvre. Il s’agit vraisemblablement d’une anomalie au niveau de la voie de signalisation des EGFR (epidermalgrowth factor receptor) dont l’inhibition par l’erlotinib pourrait améliorer la mobilisation par le G-CSF chez les souris répondeuses pauvres (57). Chez l’humain l’analyse du polymorphisme génétique a permis d’identifier des polymorphismes génétiques impliqués dans la réponse à la mobilisation par le G-CSF au niveau des régions non traduites responsables de la régulation des gènes codant pour les G-CSF R, les molécules d’adhésion (VCAM-1, CD44), et les chimiokines (SDF-1), tous connus impliqués dans la régulation du trafic des CSH. Ce polymorphisme génétique pourrait prédire une mobilisation pauvre, néanmoins, l’application pour le screening afin d’identifier les mobilisateurs pauvres reste prématurée.
32 5. Autres facteurs :
- Recours au G-CSF (non systématiquement donné) lors des cures de chimiothérapie, est prédictible d’une mobilisation pauvre.
- Une thrombopénie de base (<100G/l à <150G/l), est fortement associée une mobilisation pauvre (58).
- Diabète sucré:les patients diabétiques mobilisaient moins bien que les patients non diabétiques, il s’agirait probablement d’un défaut de migration des CSH de la moelle osseuse vers le sang périphérique après tentative de mobilisation par GCSF seul. Les CSH chez le diabétique est localisée d’une manière aberrante au sein de la niche hématopoïétique et les anomalies de nombre et de fonction des terminaisons nerveuse sympathiques étaient associées à cette anomalie de localisation. Il en résulte une aberration de réponse aux stimuli b-adrénergiques de la moelle osseuse y compris une incapacité des cellules souches mésenchymateuses médullaires de réprimer le chimiokine CXCL12 en réponse au G-CSF. Une rescue de ce défaut de mobilsation a pu être rattrapé par le Plerixafor. Ces données, suggèrent que le diabète sucré induit des changements au niveau de la physiologie de la moelle osseuse et de sa micro- anatomie et implique l’intervention d’autres drogues capables de corriger ce problème de déconnexion afin de lutter contre les échecs de mobilisation chez les patients diabètiques (59).
- Tabagisme : les effets négatifs du Tabagisme chronique a été démontré dans certaines études, avec en particulier des séries faites sur des donneurs sains pour allogreffe ou le taux de CD34+ était environ le double chez les patients non fumeurs par rapport aux patients fumeurs, avec un écart significatif au-delà de 15PA (60).
- Obésité : effet controversé, alors que certaines études ne retrouvent pas d’effet négatif de l’obésité sur l’efficience et la sécurité de la mobilisation des CSH et leur collection (61), d’autres avancent que les donneurs sains obèses avaient un taux de base de CD34+ plus important que chez les non obèses.
33
E. Stratégies d’optimisation des régimes mobilisateurs
courants :
1. Age des donneurs :
On sait déjà que l’âge avancé des patients représente un facteur de risque d’échec de mobilisation des CSH lors de la procédure d’autogreffe, néanmoins, ce facteur reste non modifiable d’autant plus que ce déterminant n’est plus retenu comme contre indication à l’autogreffe.
Actuellement, aux Etats Unies d’Amériques, les patients MMfits jusqu’à l’âge de 75ans sont autogreffés, en Europe, ils y vont jusqu’à l’âge de 70ans hors protocole (62, 63).
2. Planning de la mobilisation :
Programmer la collecte des CSH assez tôt dans la prise en charge des patients sous chimiothérapie extensive ou intensive comme HyperCVAD et aussi après de courts cycles à base de Fludarabine ou lenalidomide.
Les cytopénies pré-greffe sont également des facteurs d’échec de mobilisation des CSH, l’emploi de facteurs promouvant la croissance des CSH peut être envisagé (SCF) ou celui du cyclophosphamide.
3. Optimisation de la cytaphérèse pour améliorer le rendement :
- Le dosage des cellules CD34+ au niveau du sang périphérique permet de guider la cytaphérèse et de réduire les coûts.
Si le taux de CD34+ ≥ 20cellules/µl, on programme la collecte des CSH.
Si le taux de CD34+ <5 cellules/µl, on annule l’aphérèse.
Si le taux de 10<CD34+<20 cellules/µl on envisage une approche adaptée au risque.
- En cas de mobilisation par G-CSF seul : le pic des cellules CD34+ est observé entre J4 et J6 du début de la mobilisation, en pratique, il est
34
recommandé de démarrer la mobilisation le vendredi et programmer la cytaphérèse le mardi suivant.
- En cas de mobilisation par chimiothérapie+G-CSF combinés : le pic des CD34+ a lieu à partir de J12 du début de la chimiothérapie, avec une moyenne entre J14 et J15, à noter que les patients lourdement traités, mobilisent plus tard, il est donc recommandé de démarrer la cure à la deuxième moitié de la semaine avec introduction du G-CSF le lendemain ou surlendemain de la fin de la chimiothérapie, et dès la sortie d’aplasie, faire le dosage des CD34+ dans le sang périphérique, pour que la cytaphérèse soit réalisée le lundi ou mardi de la semaine d’après.
- Il est recommandé de pratiquer un large volume d’aphérèse qui aboutit à un meilleur rendement des CSH et pourrait réduire les nombre d’aphérèse.
Chimiothérapie Début de G-CSF Début monitoring CD34+
Cy 2g/m2 Jour 5 Jour 10
CAD Jour 9 Jour 13
(R) CHOP/CHOEP Jour6 Jour 11
(R) DHAP Jour 9 Jour 14
(R) ICE Jour 6 Jour 12
(R) AraC/IT Jour 5 Jour 10
Jour 1 : premier jour de chimiothérapie (sans Rituximab)
Tableau 2 : Début de G-CSF et du monitoring des CD34+ lors de la mobilisation par chimiothérapie (64).
L’élaboration d’algorithme :
- Un algorithme est proposé par différents centres en fonction des données locales,des méthodes de screening, de leur expérience et des moyens disponibles.
- Il permet l’intégration d’une stratégie basée sur le risque déterminé par plusieurs méthodes, en particulier celle adoptée par le groupe GITMO, en l’occurrence le pPM score, qui permet de définir des groupes de risque en y
35
intégrant les facteurs de risque significatifs d’échec de mobilisation ou de greffon pauvre.
- De ce fait, il semble que le score prédictif pPM couplé à un algorithme pour mobilisation guidée par le taux des CD34+ permettent de guider la mobilisation pour limiter les risques d’échec de cette procédure dont les conséquences ont un impact négatif sur l’évolution de la maladie.
Calcul d’un score prédictif de la réussite ou de l’échec de la mobilisation :
- En se basant sur le score prédictif élaboré par le groupe GITMO (65), une stratégie de la mobilisation des CSH basée sur les facteurs de risque non modifiables permet d’anticiper les techniques pourvoyeuses de réussite de la mobilisation.
- Un seuil est défini selon le score employé, par exemple, quand on emploie un score prédictif non simplifié, un seuil significatif a été défini de : 7,862 au-dessus duquel des stratégies plus robustes doivent être employées.
- ce seuil a été ajusté à 6,5 lors de l’emploi du score simplifié plus facile à utiliser par les équipes. Les différents scores calculés sont relatés dans le tableau 4.
36 Score pPM
Age entre 46-60ans 0,3796
Age >60ans 0,7592
Diagnostic de lymphome Hodgkinien 0.5535 Infiltration de moelle osseuse par ≥ 30% de
cellules malignes
1.269
Nombre de lignes de chimiothérapie préalable 0,5888 x nombre de lignes préalables
Traitement préalable « myélotoxique » 0,77388929 Taux d’Hb entre 8g/dl et 13g/dl 1,1165
Taux d’Hb<8g/dl 2,233
Taux des leucocytes <5G/l 0,7185 Taux de plaquettes <170G/l 0,5869 Mobilisation avec GCSF seul 2,251 Plerixafor non prévu en « Frontline » 2,7292 Echec préalable de mobilisation des CSH 1,906
Score s-pPM simplifié
Age >60ans 0,5
Diagnostic de lymphome Hodgkinien 0,5 Infiltration de moelle osseuse par ≥ 30% de cellules malignes
1
Nombre de lignes de chimiothérapie préalable 0,5 x nombre de lignes préalables
Traitement préalable « myélotoxique » 0,5 Taux d’Hb entre 8g/dl et 13g/dl 1
Taux d’Hb<8g/dl 2
Taux des leucocytes <5G/l 0,5 Taux de plaquettes <170G/l 0,5 Mobilisation avec GCSF seul 2 Plerixafor non prévu en « Frontline » 2 Echec préalable de mobilisation des CSH 1,5
Tableau 3 : Calcul du score de mobilisateurs pauvres prévus pPM et score simplifié PM : s-pPM (65).
37
Figure 11 : Schéma d’algorithme pour mobilisation de CSH, approche dynamique pour une mobilisation des cellules souches hématopoïétiques.
Taux des cellules CD34+ avant cytaphérèse
>20cellules/µl 10-20 cellules/µl <10cellules/µl
Approche dynamique basée sur les
caractéristiques de la maladie et les traitements reçus
Cytaphérèse (objectif de richesse cellulaire= 2.106 CD34+cellules/kg poids corporel) Plerixafor en préemptif
38
4. Recommandations pour les mobilisations : 1ère ligne :
Prévention des échecs de mobilisation :
- Le taux d’échec des mobilisations devrait rester en dessous de 5%, afin de minimiser les complications relatives à la mobilisation et optimiser l’utilisation des ressources.
- Le dosage des pics CD34+ avant la cytaphérèse doit être la base de la procédure de cytaphérèse afin d’identifier les mobilisateurs pauvres avant échec de la procédure globale
- Plerixafor en préemptif basé sur le monitoring des cellules C34+ dans le sang périphérique semble prévenir l’échec de la procédure
- La mobilisation en première ligne et en « steady state » reste une stratégie fiable pour prévenir une éventuelle remobilisation.
- La mobilisation par Cyclophosphamide+Perixafor+G-CSF= demeure une stratégie émergeante de mobilisation qui mérite d’être réévaluer par des essais prospectifs.
Stratégies de mobilisation première ligne : Pour les patients MM :
- Mobilization en steadystate: par du G-CSF: 10-16µg/kg/jour est une option mais doit être limitée chez les patients n’ayant pas reçu plus d’une ligne de traitement, qui n’ont pas été traités par melphalan ou plus de cycles de Lenalidomide.
- Chez ces patients, le dosage des CD34+ ainsi que lePlerixafor en préemptif devrait permettre une mobilisation réussie chez la majorité des cas.
Pour les patients qui ont un LNH :
- Mobilization en steady state avec du GCSF à la dose de 10-16g/kg/j est faisable chez les patients à faible risque d’échec de mobilisation car elle reste moins toxique et plus facile à programmer, néanmoins, elle est pourvue d’un taux d’échec important pour les autres patients.
39
- L’usage du plerixafor en préemptif permet de prévenir les échecs dans cette catégorie de patients.
- Mobilisation par Endoxan : soit intégré dans le régime de chimiothérapie d’induction ou comme traitement de rattrapage. En dehors de ces schémas, la mobilisation par Endoxan semble être plus coûteuse et plus toxique. Cette stratégie est donc à réserver aux patients qui n’ont pas eu de réponse optimale au traitement de rattrapage ou chez les patients qui ont échoué à la mobilisation en steady state.
- Considérer l’usage du plerixafor en front line chez les patients dont l’objectif de prélèvement des CSH est plus important et en fonction du monitoring des CD34+
5. Recommandations en cas d’usage des thérapies myélotoxiques ou nouvelles :
Lenalidomide :
- Faire une collection précoce des CSH (entre la 2ème et la 4ème cure de Lenalidomide).
- Faire une fenêtre thérapeutique de 2 ou 4 semaines entre la dernière prise de Lenalidomide et le début de la mobilisation.
- L’approche P+GCSF et CM ont démontré leur supériorité sur les méthodes steady state.
La mobilisation en steady state est clairement insuffisante chez les patients ayant reçu plus de 4 cures de lenalidomide, et doit être évitée.
Bortezomib :
- Pas d’impact sur la mobilisation des CSH pour la majorité des auteurs, néanmoins, une légère tendance à l’échec a été retrouvée avec cette thérapie dans des études récentes (66).
40
- Récemment introduite dans l’arsenal thérapeutique des MM et des Lymphomes, mais les données suggèrent la faisabilité de la mobilisation après exposition à la Bendamustine (67, 68).
Fludarabine: il a été prouvé que l’usage de la Fludarabine altérait la collection des CSH à la mobilisation, en particulier lorsqu’on atteint une dose cumulative de 150mg/m2 (69).
6. Recommandations pour les re-mobilisation :
- Les cytokines seules ne sont pas indiquées pour les remobilisations, malgré de plus fortes doses de G-CSF.
- La re-mobilisation par Cyclophosphamidea longtemps été recommandée en cas d’échec de mobilisation par cytokines seules, avec cependant un taux d’échec de 74% (70).
- Il a été démontré que la stratégie basée sur P-GCSF était associée au plus faible taux d’échec à moins de 30% (71, 72).
- La remobilisation doit donc être basée sur Plerixafor qu’il soit omis en première ligne ou non.
- Son association au cyclophosphamide doit être évaluée dans des études prospectives larges.
- Le prélèvement de moelle osseuse doit rester une option de 3ème ligne et chez certains malades sélectionnés.
7. Appliquer une gestion axée sur les bonnes pratiques :
- Comme pour l’allogreffe des cellules souches hématopoïétiques, il est recommandé d’adopter les Standards Internationaux pour la Collecte, le Processing et l’Administration des produits de thérapie cellulaire FACT-JACIE et son manuel d’accréditation produit par la fondation pour l’accréditation de la thérapie cellulaire FACT (Foundation for the Accreditation of Cellular Therapy) et JACIE (Joint AccreditationCommitee and International Society for TherapyEuropean Group for Blood and Marrow Transplantation.
41
F. Stratégies d’amélioration du rendement chez les
mobilisateurs pauvres :
Les approches les plus prometteuses actuellement demeurent la combinaison du G-CSF avec le plerixafor avec ou sans chimiothérapie.
- Plerixafor :
En pratique clinique, le Plerixafor est administré par voie sous cutanée à la dose de 240µg/m2 la veille 10 à 11heures avant la cytaphérèse du premier jour. Le dosage des CD34+ dans le sang périphérique doit être réalisé le lendemain avant la cytaphérèse, sans que celle-ci soit retardée. 2 à 3 doses quotidiennes peuvent être requises chez certains patients.
Son usage rationnel répond à un algorithme qui est proposé par plusieurs centres de greffe, oùil trouve sa place :
- En préemptif chez les mobilisateurs pauvres prévus.
- Traitement de rattrapage en cas de mobilisation sous optimale - Remobilisation en cas d’échec de mobilisation.
NB : En cas d’échec de mobilisation, une nouvelle tentative de recueil est recommandée à distance (>4semaines) après une autre cure de chimiothérapie ou par rattrapage par G-CSF seul, et permet le plus souvent d’obtenir un greffon satisfaisant.
- Prélèvement de moelle osseuse de sauvetage :
Les greffes de moelle osseuses sont généralement associées à un retard de prise de greffon, affectant particulièrement le recouvrement des plaquettes par rapport aux greffes des cellules souches hématopoïétique périphériques. Ce problème est majoré chez les patients ayant échoué à la mobilisation par les méthodes conventionnelles avec une TRM plus importante (73). Le rattrapage par un prélèvement de moelle osseuse devrait être restreint à quelques rares conditions :
42
- Mobilisation pauvre réfractaire malgré l’usage des nouveaux agents. - Quand ceux-ci sont non disponibles.
- Ou en cas de présence de contre indications à un prélévement de CSH périphériques ou à la mobilisation.
Figure 12 : Algorithme pour le déclenchement de la 1re cytaphérèse selon le taux de cellules CD34 + dans le sang circulant dans le cas d'une mobilisation sous G-CSF seul. Les cas les plus fréquents sont représentés par des traits pleins, les cas moins fréquents par
43 En pratique :
Les arguments forts qui pourraient nous guider dans la prise de décision lors du pilotage stratégique de la procédure de mobilisation des cellules souches sont résumés ci-dessous :
Les enjeux d’un échec de mobilisation ou d’une mobilisation sous
optimale serait à l’origine de :
- Plus de jours de cytaphérèse
- Recours à un prélèvement de moelle osseuse - Inéligibilité à l’autogreffe
- Une source d’anxiété et de déception pour le patient.
- Un greffon pauvre pourrait causer une prise de greffe retardée, partielle ou une non prise.
- Des besoins transfusionnels importants - Des coûts élevés
Le régime idéal pour la mobilisation est celui qui :
- Permet un recouvrement d’un taux de neutrophile et de plaquettes adéquat
- Est sûr - Prédictible
- Dispose d’un taux d’un faible d’échec. - Est à toxicité limitée
- A un nombre de jours limités pour la cytaphérèse - A une contamination tumorale faible
44
Avantages et limites des stratégies mobilisatrices
Régimes Avantages Inconvénients
Facteurs de croissance - Simple
- Toxicité faible - Coût faible
- Haut risque d’échec - Richesse faible du greffon Facteurs de croissance +chimiothérapie - Effet anti-tumoral possible - Recueil riche en CSH - Toxicité - Coût élevé - Risque d’échec Facteurs de croissance+Plerixafor - Faible toxicité - Risque faible d’échec
- Recueil plus riche en CSH
- Coût élevé
- Toxicité spécifique du plerixafor.
Tableau 4 : Avantages et limites des stratégies mobilisatrices
Objectifs du recueil :
- ≥2x10.6 cellules CD34+/kg assure un minimum requis pour un prise de greffon.
- 5x10.6 cellules CD34+ serait le seuil requis pour un recouvrement rapide des plaquettes sanguines et serait associé à une évolution meilleure.
Facteurs affectant le recueil des cellules CD34+
En rapport avec le patient En rapport avec la procédure
- Age - Sexe ?
- Régimes mobilisateurs choisis - Infiltration de la moelle osseuse - Diabète - Nombre de lignes thérapeutiques et traitement préalable : - Alkylants, Lenalidomide, Fludarabine, Radiothérapie
- Certains facteurs affectent l’efficience de la collection des CSH :
- voie veineuse centrale
- matériel séparant les cellules - hématocrit
- Volume sanguin utilisé.
45
Quels régimes mobilisateurs ?
Une comparaison « head to head” entre une mobilisation par G-CSF versus Chimiothérapie+GCSF :
- Les cellules CD34+ sont plus élevées lors des chimiomobilisation - La toxicité et le temps de mobilisation sont significativement plus
élevés lors des chimiomobilisation.
- Les taux d’échec de mobilisation et ou mobilisation pauvre sont plus importante dans les mobilisations par G-CSF seul
- L’évolution clinique est la même pour les deux régimes. Quelle place pour Plerixafor ?
- Efficacité démontrée dans des essais phase I, II et III (75). - Safety et sécurité démontrée
- Un taux de succès des mobilisations des cellules CD34+ plus élevé. - La stratégie préemptive reste la plus efficience en cas d’utilisation du
Plerixafor Front line avec un taux d’échec qui passe de 19% dans le bras sans Plerixafor versus 1% dans le bras Plerixafor (76).
Les algorithmes sont-ils suffisants pour guider la décision ? - Un algorithme est l’équivalent d’un tableau de bord de l’autogreffe - Cependant, il ne permet pas une anticipation en amont de la
cytaphérèse
- Nécessité d’une concertation entre les hématologistes et les médecins de la thérapie cellulaire pour adopter une stratégie adaptée au contexte médico-économique de notre pays.
- La nécessité d’une injection tard le soir pour la stratégie guidée par le taux des cellules CD34+ périphériques.
46
Une stratégie basée sur l’identification personnalisée du risque de
chaque patient qui bénéficiera d’une autogreffe de cellules souches périphériques dans le cadre du traitement intensif de sa maladie :
- Utilisation du score pPM ou S-pPM va permettre de guider la décision et d’envisager d’intégrer le Plerixafor dans la stratégie de mobilisation afin de garantir le maximum de chances pour réussir une mobilisation efficiente.
- L’emploi du Plerixafor s’est révélé moins coûteux que la mobilisation basée sur la chimiothérapie+GCSF dans une étude de Shaughnessy et al. (77).
Tableau 6 : Comparaison des coûts de la mobilisation par Perixafor/GCSF et Chimiothérapie/G-CSF
47