-1-
I
I
n
n
t
t
r
r
o
o
d
d
u
u
c
c
t
t
i
i
o
o
n
n
g
g
é
é
n
n
é
é
r
r
a
a
l
l
e
e
-2-
Le fer, un des atomes centraux de la vie, est indispensable à l’immense majorité des organismes vivants qui ont élaboré différents systèmes pour le récupérer de l’environnement externe. Les échanges avec l’extérieur sont très réduits imprimant au métabolisme martial un caractère très fermé.
Les états infectieux chroniques, les cancers, les hémopathies malignes, ainsi que les maladies rhumatismales comportant une composante inflammatoire sont si fréquents en milieu hospitalier. Ils induisent la soustraction rapide du fer libre, le détournant de son utilisation habituelle pour l’érythropoïèse, au profit de sa mise en réserve, en agissant sur la synthèse des différentes protéines liant le fer. Ils s’accompagnent également d’un effet inhibiteur propre sur l’érythropoïèse aggravé par une carence relative en EPO. Ces perturbations sont induites par le jeu de cytokines inflammatoires et ont pour conséquence l’apparition d’une anémie dont les caractéristiques clinico-biologiques sont bien établies [1]. Cela explique la nécessité de disposer d’outils diagnostiques performants sensibles et spécifiques pour définir ou diagnostiquer une éventuelle carence martiale au cours de ces pathologies chroniques. Un tel diagnostic semble délicat de par l’existence de contexte inflammatoire les caractérisant. C’est au vu de ce constat que notre travail se propose d’évaluer la pertinence d’un nouveau marqueur biologique du bilan martial : le récepteur soluble de la transferrine en le comparant aux autres paramètres classiques au cours de l’Anémie des Maladies Chroniques, une situation de méprise où deux mécanismes pourraient être intriqués : l’inflammation et la carence en fer. Cet objectif constitue la clé de voûte de la présente étude.
-3-
Dans un premier temps, nous nous attacherons à rappeler dans la partie théorique les dernières nouveautés concernant le métabolisme du fer ainsi que des notions se rapportant à la carence en fer et à l’AMC.
Dans un second volet, réservé à la partie pratique, nous présenterons les résultats de notre étude qui seront discutés avant de conclure.
-4-
P
P
a
a
r
r
t
t
i
i
e
e
t
t
h
h
é
é
o
o
r
r
i
i
q
q
u
u
e
e
R
R
e
e
v
v
u
u
e
e
d
d
e
e
l
l
a
a
l
l
i
i
t
t
t
t
é
é
r
r
a
a
t
t
u
u
r
r
e
e
-5-
I. METABOLISME DU FER : RAPPEL PHYSIOLOGIQUE
Le fer est un élément paradoxal . En effet, indispensable à toute forme de vie, essentiellement pour assurer le transport d’oxygène et catalyser des réactions de transfert d’électrons, de fixation d’azote ou de synthèse d’ADN. Le fer est également toxique, en raison de sa capacité à réagir avec l’oxygène et à catalyser la production de formes radicalaires [2, 3]. La découverte récente de nombreuses enzymes à activité ferroxydase (héphaestine, céruloplasmine) ou ferriréductase (Dcytb), ainsi que de transporteurs de cations divalents (Nramp2/DMT1, ferroportine) impliqués dans le transport du fer a mis en évidence l’existence d’un réseau protéique complexe et finement réglé permettant de mobiliser le fer à partir des aliments, de le transporter à travers les membranes cellulaires et de le véhiculer dans les fluides biologiques. L’homéostasie du fer repose sur un contrôle strict de son absorption intestinale, au niveau du duodénum, et de son recyclage après dégradation des globules rouges sénescents par les macrophages [2].
A. Répartition du fer dans l’organisme humain (fig.1 [4])
Un adulte possède environ 4g de fer (l’équivalent du poids d’un clou) dont la répartition peut être conçue de plusieurs manières. Mais, il est usuel de distinguer trois secteurs principaux :
- le fer fonctionnel, - le fer de transport, - et le fer de stockage.
-6-
1. Le fer fonctionnel
Il est contenu dans :
L’Hb (transporteur d’oxygène) : cela représente environ 66% du fer total, La myoglobine (transporteur de l’oxygène du muscle) : environ 3%,
Les autres protéines héminiques (cytochrome c, peroxydases, catalase) et les flavoprotéines : environ 0,2%.
Au niveau des organes cibles, le complexe fer-transferrine est capté par le récepteur de la transferrine en présence d’autres protéines, dont la protéine HFE, qui module probablement cette fixation. Deux récepteurs ont été identifiés :
Rtf 1, de haute affinité : les précurseurs érythroblastiques peuvent
exprimer jusqu’à 1 million de molécules de Rtf 1 à leur surface
alors que les macrophages tissulaires ou les entérocytes en possèdent peu,
Rtf 2, de faible affinité, dont l’expression est principalement limitée
au foie. Son rôle précis est mal connu. Des mutations de ce gène sont responsables de l’hémochromatose héréditaire de type 3. L’hémojuvéline semble jouer un rôle dans cette absorption, les mutations de son gène sont responsables de l’hémochromatose héréditaire de type 2B.
Après fixation, le récepteur est libéré et le fer transporté vers le cytoplasme par l’intermédiaire de DMT. Le fer peut suivre deux voies : être utilisé ou être stocké.
Le fer exporté par la ferroportine est oxydé par la ceruléoplasmine avant d’être pris en charge par la transferrine. Les malades atteints
-7-
d’aceruléoplasminémie héréditaire développent progressivement une surcharge en fer [5].
2. Le fer de transport plasmatique et d’alimentation tissulaire
Il représente 0,1% du fer total. Le fer est transporté dans le plasma par la transferrine. Il circule essentiellement entre trois organes cibles qui expriment le récepteur de la transferrine :
le compartiment d’utilisation principal : la moelle osseuse, siège de l’érythropoïèse,
le compartiment de recyclage : macrophages de la moelle ou de la rate phagocytant les GR vieillis,
le compartiment de stockage (le foie, à un moindre degré, la rate).
Dans les conditions normales, la saturation de la transferrine est de l’ordre de 30%. Lorsque la capacité de fixation est saturée, du fer libre non liée à la transferrine, peut apparaître dans le plasma. Ce fer pénètre facilement dans les cellules (foie et cœur particulièrement) par diffusion passive ou à l’aide d’un système qui n’est pas encore identifié. Il contribue à la survenue de la surcharge tissulaire [5].
3. Le fer des réserves (ferritine, hémosidérine)
Le fer est mis en réserve essentiellement dans le foie et la rate
(macrophages du système réticulo-endothélial), sous deux formes
quantitativement égales :
-8-
l’hémosidérine non hydrosoluble, plus riche en fer, produit de dégradation partielle de la ferritine dans laquelle le fer est peu mobilisable et qui constitue une réserve martiale stable.
Dans les situations de surcharge, le fer s’accumule dans les organes de stockage. La toxicité liée à l’accumulation tissulaire du fer résulte de son potentiel oxydant conduisant à la génération de radicaux libres et à la peroxydation des lipides membranaires [5].
Figure 1 : Distribution du fer dans l’organisme humain
B. Mouvement du fer dans l’organisme : Apports, pertes
Le métabolisme du fer se situe, pour la plus grande partie, dans un système clos avec échanges entre les différents compartiments de l’organisme.
-9-
Les apports, qui compensent simplement les pertes, représentent une part minime de la masse totale, l’organisme étant avare de son fer (fig.1).
1. Apports en fer
La quantité de fer disponible dans l’organisme humain d’un adulte (4 g) provient pour une faible partie de l’alimentation (fer d’origine animale ou fer héminique et celui d’origine végétale ou fer non héminique) et pour l’essentiel, du recyclage du fer à partir de la lyse des globules rouges sénescents. Ce dernier mécanisme implique notamment les macrophages de la rate et de la moelle osseuse et dans une moindre mesure, les cellules de kupffer [3]. La phagocytose des GR vieillis par les macrophages de la moelle et de la rate assure un recyclage des atomes de fer. Ce recyclage permanent suffit à assurer les besoins de l’érythropoïèse. Le fer récupéré peut suivre deux voies :
être stocké dans le macrophage, ou être recyclé dans le plasma.
Environ 80% du fer plasmatique circule entre la moelle osseuse et le système réticulo-endothélial. La sortie du fer des macrophages est assurée par la ferroportine qui est impliquée dans l’hémochromatose héréditaire de type 4 [5].
2. Pertes en fer
Les pertes de fer représentent 1 à 2 mg /j, essentiellement du fait de la desquamation cellulaire, digestive et cutanée. Cependant une très faible quantité de fer est aussi perdue par les voies biliaires et urinaires. Chez la femme s’y ajoutent les pertes gynécologiques qui représentent environ 0,5 à 1 mg/j et les pertes liées au transfert du fer au foetus lors de la grossesse, ainsi que celles liées à l’allaitement. Enfin, les donneurs de sang perdent régulièrement du fer à
-10-
chaque don de sang puisque 500 mg de fer sont retirés chaque fois que 1 litre de sang est soustrait [6, 7, 8, 9].
C. Régulation du métabolisme martial
Les mécanismes de régulation des mouvements du fer sont restés très longtemps méconnus. La connaissance du métabolisme du fer a considérablement progressé au cours des dernières années et ne cesse actuellement de s’affiner [10]. Plusieurs protéines d’intérêt majeur ont été découvertes [3]. L’absorption intestinale est une étape capitale, car la régulation de l’homéostasie du fer n’est possible qu’à ce niveau [5].
1. Absorption digestive du fer
Après libération de ses complexes alimentaires, puis réduction en fer divalent, le fer est essentiellement absorbé au niveau des récepteurs de la muqueuse duodénale, mais en proportion variable suivant la nature du fer ingéré. En effet, le fer non héminique (végétaux) est très peu absorbé car de nombreux inhibiteurs (tanins, phytates, ovalbumine, phosphate….) forment avec lui des complexes insolubles ou inabsorbables.
Le fer héminique a un rendement d’absorption très supérieur à celui du fer absorbé alors qu’il ne constitue que le tiers des apports. Son absorption est peu influencée par les autres nutriments. Les aliments plus riches en fer héminique sont les viandes et les poissons. L’absorption a lieu dans les entérocytes matures de la muqueuse intestinale. Le modèle de la programmation des cellules de la crypte est une des hypothèses avancées pour expliquer l’absorption du fer et sa régulation (fig.2) [3, 6, 11].
-11-
Figure 2 : Régulation de l’homéostasie du fer [2]
Les entérocytes proviennent de cellules indifférenciées situées dans les cryptes intestinales. Elles se différencient en 2 à 3 jours en migrant vers le sommet de la villosité pour être ensuite exfoliées. Leur maturation en entérocytes matures est importante dans le processus de régulation de l’absorption du fer et de son passage dans le sang. Les cellules cryptiques détectent les besoins en fer de l’organisme et se programment en conséquence au cours de leur maturation en cellules villositaires pour exprimer les protéines du transport du fer en quantité appropriée (fig.2).
L’absorption du fer héminique est mal connue. Il passe dans l’entérocyte au sein de la molécule d’hème par l’intermédiaire d’un récepteur non identifié à ce jour. Le fer ferreux est ensuite libéré sous l’action de l’hème oxygénase (HMOX1).
-12-
Pour le fer non héminique, l’absorption a lieu dans le duodénum au niveau des entérocytes matures présents au sommet des villosités intestinales. Une première étape consiste à mobiliser le fer en le réduisant en fer II au moyen d’une réductase membranaire Dcytb. Un transporteur de fer, DMT1 (divalent métal transporter 1, aussi appelé NRAMP2 ou SLC1A2) capte ensuite le fer au pôle apical de l’entérocyte (fig.3) [12, 13, 14].
Figure 3 : Mécanismes d’absorption du fer alimentaire par les entérocytes duodénaux [3]
Le fer capté peut suivre deux voies :
être stocké par la ferritine puis ensuite éliminé par desquamation des cellules intestinales,
-13-
être adressé au pôle basolatéral de l’entérocyte pour être exporté dans le plasma.
A ce niveau, deux protéines interviennent et agissent ensemble, la ferroportine (ou SLC40A1) et l’hephaestine qui assure la conversion en fer ferrique (Fe III) [15, 16]. L’hephaestine [17] est une protéine à ancrage membranaire qui est homologue de la céruloplasmine. Appartenant à la famille des multicopper oxydases, elle possède une activité ferroxydase qui permet
l’oxydation du Fe2+
en Fe3+ et ainsi la captation secondaire des atomes par
l’apotransferrine plasmatique, qui ne peut lier que le Fe3+
. A l’inverse, si le fer a été dirigé vers la ferritine, il va être perdu pour l’organisme lors de la desquamation entérocytaire physiologique. Les concentrations des transporteurs membranaires du fer (DMT1 et ferroportine) exprimés par l’entérocyte mature déterminent la quantité du fer absorbé. Par un mécanisme non encore élucidé, la protéine HFE présente en grande quantité sur le pôle basal des entérocytes de la crypte, modulerait l’absorption du fer intestinal. Elle s’associe au Rtf et facilite l’endocytose du complexe fer-transferrine. La mutation C282 du gène HFE est responsable de l’hémochromatose de type 1 en empêchant l’expression d’HFE sur la membrane. Certaines mutations dans le gène de le ferroportine sont responsables de l’hémochromatose héréditaire de type 4.
L’absorption intestinale du fer est influencée par la quantité de fer récemment apportée par l’alimentation, on parle dans ce cas de régulateur alimentaire. Ainsi, une quantité excessive de fer dans l’alimentation, pendant plusieurs jours, peut induire une moindre absorption du fer présent dans le bol alimentaire. Ce phénomène appelé bloc muqueux, peut être observé même lorsqu’il existe une carence en fer de l’organisme [3].
-14-
2. Système IRE/ IRP
Il existe un système original qui vise en particulier à stabiliser au maximum le pool de transit et fait intervenir le couple IRE/ IRP permettant le contrôle de l’équilibre entre les trois pools de fer intracellulaire [6, 18]. Ceci est réalisé en régulant, à un niveau post-transcriptionnel, l’expression du récepteur 1 de la transferrine et de la ferritine. L’IRE est une séquence nucléotidique présente sur l’ARNm de la ferritine en région 5' non traduite et en plusieurs exemplaires sur celui du récepteur de la transferrine, en région 3' non traduite [6].
Lorsque le contenu cellulaire en fer est trop bas, l’IRP peut se lier sur les séquences IRE entraînant une stabilisation de l’ARNm de la transferrine. Ceci conduit à une production soutenue du récepteur de la transferrine, alors que parallèlement la fixation de l’IRE en 5' de l’ARNm de la ferritine empêche sa traduction et donc la synthèse de la ferritine. La cellule utilise donc ce système pour s’adapter à un déficit en fer en augmentant l’expression du récepteur de la transferrine permettant l’entrée du fer transferrine et en diminuant la synthèse de ferritine (devenue «inutile»). A l’inverse, lorsqu’il existe un excès cellulaire de fer, l’IRP ne peut se lier à l’IRE ce qui favorise la dégradation de l’ARNm de la transferrine et l’accroissement de la synthèse de la ferritine. Ceci favorise l’entrée du fer lié à la transferrine dans la cellule et l’augmentation de la synthèse de ferritine qui sera utilisée pour stocker le fer en excès et donc protéger la cellule (fig.4) [6, 13, 19].
-15-
Figure 4 : Régulation de la biosynthèse de la ferritine et du Rtf 1 par les protéines
IRPs [3]
3. Hepcidine
L’hepcidine est une molécule qui a été identifié chez l’homme, tout dans le plasma [10, 20] puis dans l’urine [10, 21], sous la forme d’un polypeptide de 25, 22 ou 20 acides aminés. Ces différentes formes sont le résultat du processus de maturation d’une pro forme de 84 acides aminés principalement assuré par le foie [10, 20, 21]. Le gène humain codant l’hepcidine est localisé sur le chromosome 19 [10, 22]. La pro forme de l’hepcidine présente trois domaines successifs que sont une séquence peptide signal qui oriente la protéine vers la voie de sécrétion, une portion intermédiaire et enfin la partie terminale de la molécule représentée par ses 25 derniers acides aminés. Ces derniers seraient finalement libérés grâce à l’action des protéines de la famille des convertases
-16-
pour lesquelles un site de clivage potentiel a été repéré juste en amont [10, 20,
22]. La forme mature de la protéine est tout à fait particulière car elle comprend
8 cystéines sur 25 acides aminés. Cette richesse en résidus cystéine permet la création de 4 ponts disulfures, l’un d’entre eux étant original car il intéresse 2 acides aminés voisins [10, 21]. L’importance de ces ponts disulfures est certainement extrême car ils permettent à la molécule d’adopter une conformation tridimensionnelle en deux feuillets bêta antiparallèles reliés par une structure en boucle [10, 23, 24].
La charge positive de la molécule hepcidine explique probablement l’effet antimicrobien de la molécule qui est active sur certaines bactéries et fungi [10,
20, 21]. L’inductibilité de l’ARNm de l’hepcidine en réponse à l’infection et à
l’IL 6 alors que TNF-alpha ne possédait que peu d’effet, a conduit à proposer l’appartenance de l’hepcidine aux protéines de type II de la réaction de phase aigue [10, 25]. Des modèles murins, ainsi que des dosages d’hepcidine urinaire chez l’homme, ont montré que les états inflammatoires ou infectieux stimulent très fortement l’expression de l’hepcidine [10, 25, 26]. La répression de l’hepcidine observée au cours d’une anémie hémolytique expérimentale ou en situation d’hypoxie [2, 25] est probablement une condition nécessaire, mais pas nécessairement suffisante, à la stimulation de l’absorption intestinale du fer après activation de l’érythropoïèse [2].
L’hepcidine produite en excès, entraîne une diminution de l’absorption du fer et favorise sa rétention dans le système macrophagique. A l’inverse, une baisse du niveau de production de l’hepcidine a pour effet de favoriser l’absorption du fer et de diminuer sa rétention dans les macrophages [3, 27].
-17-
4. Recyclage du fer des érythrocytes sénescents
Le recyclage du fer des érythrocytes sénescents permettent la remise à disposition, dans le plasma, du fer à l’ensemble des cellules et assurent donc la biodisponibilité du fer présent dans l’organisme. Peu de données sont actuellement disponibles sur le mécanisme ou la régulation de ce phénomène
[3].
II. CARENCE EN FER – DEFICIT EN FER ET INFLAMMATION A. Anémie par carence en fer
1. Epidémiologie
Depuis plusieurs années, l’OMS a pris conscience du problème posé par l’anémie nutritionnelle dans le monde. Les premières recherches ont démarré en 1955 [28] et la première réunion internationale a lieu en 1958. L’ensemble des efforts a permis de comprendre la pathologie, de déterminer la prévalence et d’établir une stratégie de contrôle. L’OMS a réalisé en 1997 une estimation de la prévalence dans le monde des anémies par carence en fer.
Dans les pays en développement, les taux de prévalence les plus élevés se retrouvent chez les femmes enceintes (56%) suivies directement des enfants d’âge scolaire (53%). Cependant dans les pays industrialisés, les femmes enceintes ne sont touchées qu’à raison de 18% suivies par les enfants d’âge scolaire à raison de 17% [29].
En 2007, un tiers de la population marocaine souffre d’anémie ferriprive dont la prise en charge représente à elle seule une perte de plus de deux milliards de dirhams chaque année [28]. Dans la province de Kenitra, une étude réalisée
-18-
sur une population scolaire, pendant la préadolescence, a concerné 306 élèves. Les résultats de cette étude ont objectivé une prévalence de l’anémie qui dépasse 30% sans différence significative selon le sexe [29].
A l’échelon Maghrébin, une étude réalisée sur une population de 1288 enfants scolarisés âgés de 11 à 14 ans dans une région du grand Tunis a montré que 33,8 % d’enfants sont carencés [30].
On estime que plus de demi-milliard d’individus vivent avec un déficit martial plus ou moins profond. La fréquence de l’anémie hypochrome dépend de facteurs individuels conditionnant les besoins en fer (croissance, flux menstruels, grossesse, maladies associées), de facteurs collectifs conditionnant la couverture des besoins (apports nutritionnels) et de facteurs géographiques conditionnant l’épidémiologie de certaines affections telles que les parasitoses hématophages (ankylostomiase, anguillulose). Dans les populations à faible niveau de vie, ces facteurs se cumulent. Une enquête de l’OMS montre que 80% des habitants de milieux ruraux du nord de l’inde ont une anémie hypochrome. Dans les pays à haut niveau de vie, le déficit en fer est fréquent en dépit d’un bon niveau nutritionnel et de médicalisation : 17% des femmes en suède, jusqu’à 20% aux Etats Unis ont des réserves en fer nulles et la moitié d’entre elles ont une anémie hypochrome hyposidérémique. La prépondérance féminine s’explique par les besoins supérieurs liés aux menstrues et aux grossesses. Chez l’enfant, plusieurs études issues des grands centres urbains aux Etats-Unis et en France révèlent une forte incidence d’anémies microcytaires par carence en fer
entre le 6ème et le 36ème mois (30% des enfants), puis après le 36ème mois (5% des
enfants). Une étude menée dans la région parisienne a révélé une anémie carentielle chez 12% des nourrissons âgés de 10 mois [31].
-19-
2. Définition
L’anémie est définie par une diminution de l’hémoglobine inférieure à un seuil limite qui varie en fonction de l’âge et du sexe. Ainsi, d’après l’OMS, ce seuil est fixé à 120g/l pour les femmes non enceintes et 130g/l pour les hommes. Une anémie par carence martiale est due à une déplétion des réserves de l’organisme se traduisant par une microcytose [32].
La carence en fer et l’anémie microcytaire, qui en est souvent l’expression hématologique lorsqu’elle se prolonge, résultent d’un déséquilibre chronique entre les pertes en fer, trop souvent considérées comme banales en particulier chez les femmes réglées, et les apports insuffisants pour compenser ces pertes. La carence en fer affecte toutes les tranches d’âge, y compris dans les pays à niveau de vie élevé [33]. Elle évolue en deux grandes étapes :
La première étape correspond à une diminution des réserves en fer de l’organisme sans anomalie de l’hémogramme. A ce stade, le test le plus sensible en routine est le dosage de la ferritinémie qui montre des valeurs basses différentes en fonction du sexe et de la méthode de dosage, comme nous le verrons plus loin,
La seconde étape correspond à un épuisement des réserves en fer qui cette fois a un retentissement sur l’érythropoïèse. Ce retentissement se traduira initialement à l’hémogramme par une diminution de la teneur corpusculaire moyenne en hémoglobine (TCMH) inférieure à 28 pg (hypochromie), et du volume globulaire moyen (VGM) inférieure à 80 fl (microcytose). Puis secondairement, par une anémie si l’érythropoïèse sidéroprive se poursuit [34].
-20-
En effet, le défaut de synthèse en hémoglobine induit un avortement intramédullaire des érythroblastes. La numération des réticulocytes est alors inférieure à 120 g/l (caractère arégénératif). Classiquement, l’anémie ferriprive isolée est dite microcytaire hypochrome arégénérative. Il faut donc retenir que l’anémie ne peut être ferriprive que s’il existe une microcytose. La détermination isolée de la concentration en hémoglobine dans le dépistage de la carence martiale est un marqueur peu spécifique et peu sensible. En effet, elle reste une traduction tardive de la déplétion ferrique ; et selon Cook [34], il existe deux grands mécanismes entraînant une érythropoïèse déficiente en fer: les anémies par carence martiale et les pathologies interférant sur le métabolisme du fer, à savoir, les maladies chroniques inflammatoires ou néoplasiques, objet de notre étude.
3. Signes d’appel
L’Hb est une protéine contenant du fer. Elle a un rôle dans le transport de l’oxygène des poumons vers les cellules du corps entier. Au stade de carence martiale sans anémie constituée, il peut être retrouvé, à l’interrogatoire, une asthénie isolée [35, 36]. L’anémie ferriprive est de constitution très progressive permettent ainsi une adaptation physiologique à l’hypoxie. Ce qui explique une tolérance clinique parfois remarquable malgré des valeurs de l’Hb extrêmement basses. Les patients éprouvent, dans ces cas, une asthénie croissante, une difficulté à assurer des efforts physiques et intellectuels, des manifestations neurosensorielles (vertiges, acouphènes). D’autres manifestations plus exceptionnelles témoignent de la gravité de la carence en fer et de son retentissement tissulaire : troubles de croissance des ongles dont la courbure s’inverse (koïlonychie), glossite atrophique, dysphagie par rétraction de la
-21-
muqueuse oesophagienne (syndrome de Plummer-Vinson), comportement compulsif vis-à-vis de substances sans valeur nutritive : géophagie (consommation de terre), pagophagie (consommation de glaçons), trichophagie (mastication des cheveux). Chez le nourrisson et le petit enfant, on impute à l’anémie par carence martiale des difficultés de développement cognitif et psychomoteur [33, 37].
4. Diagnostic biologique
La diminution du VGM est un bon marqueur pour le dépistage d’une carence martiale, même si elle n’est pas immédiate. Il existe quatre causes principales de l’anémie microcytaire hypochrome : la carence martiale, le syndrome inflammatoire, les anémies sidéroblastiques et les syndromes thalassémiques. Le diagnostic repose sur l’exploration du métabolisme martial. Alors qu’une normo ou une hypersidérémie oriente vers un syndrome thalassémique ou une anémie sidéroblastique, une hyposidérémie est observée dans les carences martiales et les syndromes inflammatoires prolongés justifiant une interprétation rigoureuse des dosages sériques suivants : le fer, la transferrine et son coefficient de saturation, la ferritine et le récepteur soluble de la transferrine [38].
Lorsque la carence martiale entraîne une diminution du taux d’hémoglobine, la variation de ces paramètres et notamment du fer sérique est franche. Le diagnostic est assez simple lorsqu’il n’existe pas d’autres pathologies associées ayant une influence sur le cycle du fer [32].
-22-
5. Prise en charge diagnostique
Le métabolisme du fer est contrôlé aussi bien par son absorption que par son excrétion. Tout déséquilibre de cette balance martiale doit en faire rechercher la cause. Ainsi la mise en évidence d’une carence martiale doit être associée à la recherche d’une éventuelle spoliation sanguine car physiologiquement, l’organisme ne perd que 1mg de fer par jour qui est largement compensé par l’apport alimentaire dans les pays industrialisés. En l’absence de cause évidente, cette enquête étiologique est généralement réalisée par le médecin traitant. Les différentes étiologies de la carence martiale sont classées en deux catégories [32].
Les causes physiologiques, représentées par la croissance, cause la plus fréquente chez l’enfant, les saignements gynécologiques chez la femme en période d’activité génitale, la grossesse, les dons de sang répétés,
Les causes pathologiques dont les plus fréquents chez l’homme et la femme ménopausée sont les saignements du tractus digestif souvent d’origine néoplasique [39]. Les étiologies les moins fréquentes sont les saignements d’origine utérine (fibrome, endométriose, cancer), les malabsorptions, l’hémosidérose pulmonaire, le syndrome de Goodpasture ou encore des saignements provoqués (pathomimie du syndrome de Lasthénie de Ferjol ou de Münchausen au sens plus général d’automutilations) [32].
-23-
6. Diagnostic différentiel
Il importe de bien distinguer l’anémie ferriprive des autres anémies hypochromes ou microcytaires. Cela est en règle générale possible à l’aide des analyses et méthodes biologiques appropriées ou par la mise en évidence de la carence martiale, notamment en ce qui concerne les thalassémies et les hémoglobinopathies (HPLC, électrophorèse de l’Hb et méthodes de biologie moléculaire), le saturnisme (taux de plomb) et les anémies sidéroblastiques (examen microscopique du frottis de sang ou de moelle osseuse avec coloration du fer) [5].
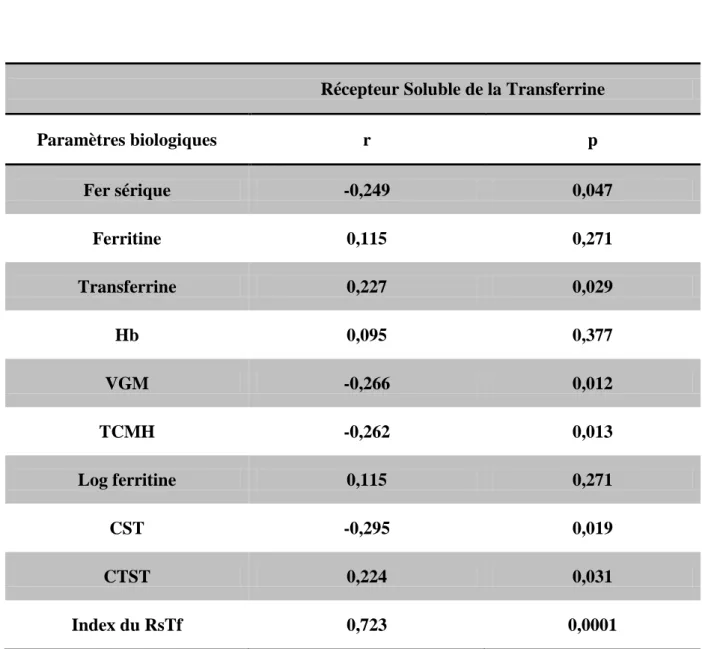
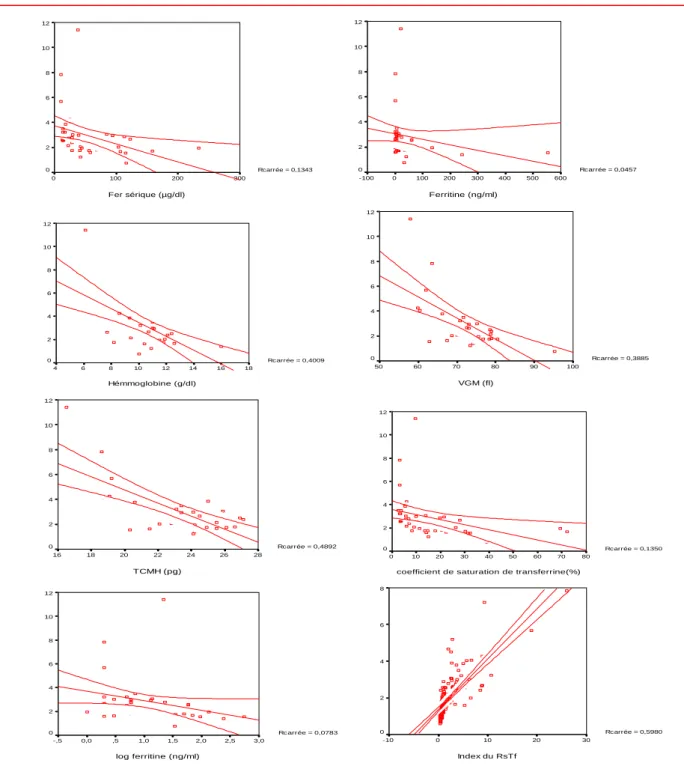
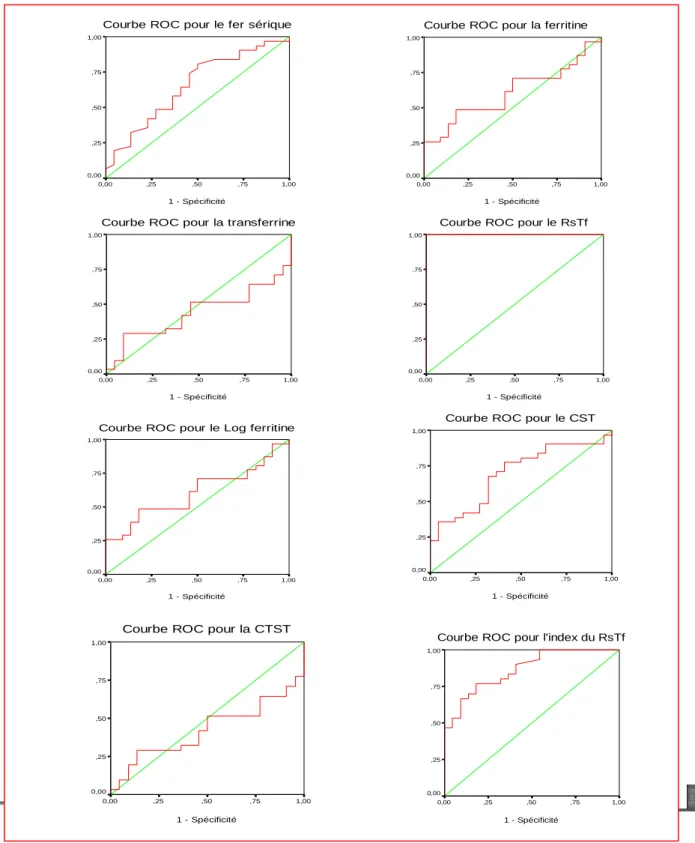
Le diagnostic différentiel entre l’anémie inflammatoire, relativement fréquente, et l’anémie ferriprive est en général beaucoup plus difficile. Le dosage de la ferritine à lui seul permet rarement de diagnostiquer une carence en fer chez un patient simultanément atteint d’une affection inflammatoire. Une situation typique est celle du patient qui reçoit un antirhumatismal non stéroïdien pour le traitement de ses douleurs et développe ensuite une gastrite érosive aiguë, voire un ulcère gastrique. Le saignement chronique des lésions entraîne d’abord une carence en fer et ultérieurement une anémie ferriprive. En même temps, il souffre aussi d’une anémie inflammatoire consécutive à l’inflammation articulaire chronique [5]. Le dosage du RsTf peut être utile dans ces cas-là, c’est ce que ce travail se propose d’étudier.
7. Prise en charge thérapeutique
Le traitement repose tout d’abord sur le traitement de l’étiologie. Celui substitutif repose classiquement sur l’apport oral de sels de fer [32]. L’apport du fer peut être par voie intraveineuse en cas de malabsorption digestive, de pertes
-24-
sanguines non contrôlables, d’intolérance ou de non adhérence au traitement martial per os. Les transfusions sanguines sont indiquées lorsqu’il existe des signes de mauvaise tolérance de l’anémie. Afin de prévenir l’éventuelle constitution d’une carence martiale chez les donneurs de sang réguliers, les enfants et les femmes en période d’activité génitale, il peut être préconisé de rappeler des règles de diététique permettant une alimentation équilibrée riche en fer [32, 40].
B. Fer et états inflammatoires dans le contexte des maladies chroniques
1. Définition et physiopathologie des AMC
L’AMC se définit habituellement comme l’anémie survenant lors des infections ou des inflammations chroniques et des néoplasies lorsque l’on exclut les cas où existent au premier plan un envahissement médullaire tumoral, un saignement ou une hémolyse. Les insuffisances endocriniennes, rénales ou hépatiques ne doivent pas non plus être inclues dans ce cadre. L’AMC se caractérise par une hyposidérémie contrastant avec des stocks totaux de fer non abaissés. Elle représente environ 50% des anémies rencontrées en milieu hospitalier [41].
Les états inflammatoires induisent la soustraction rapide du fer libre, le détournant de son utilisation habituelle pour l’érythropoïèse, au profit de sa mise en réserve, en agissant sur la synthèse des différentes protéines liant le fer [42]. Comme cela a déjà été souligné, toute inflammation ou infection peut stimuler très fortement l’expression de l’hepcidine [10, 25, 26]. Cette protéine produite en excès, entraîne une diminution de l’absorption du fer et favorise sa rétention dans le système macrophagique [3, 27]. Les états inflammatoires
-25-
s’accompagnent également d’un effet inhibiteur propre sur l’érythropoïèse aggravé par une carence relative en érythropoïétine. Toutes ces perturbations sont induites par le jeu de cytokines inflammatoires, TNFα et IL I et 6 et ont pour conséquence l’apparition d’une anémie dont les caractéristiques clinico-biologiques sont bien établies [42].
2. Caractères biologiques
L’anémie est en général modérée (taux d’Hb habituellement supérieur à 8 g/dl, mais parfois plus bas), normocytaire, normochrome ou plus rarement microcytaire, hypochrome. Lorsqu’il existe une microcytose, celle-ci est habituellement moins marquée qu’en cas de carence martiale. Cette anémie est non régénérative (taux de réticulocytes normal ou diminué) [41]. Elle peut s’accompagner fréquemment d’une élévation des taux de leucocytes et/ou de plaquettes dans un contexte inflammatoire. Une polynucléose marquée est un signe orientant plus particulièrement vers une infection bactérienne [41, 43].
Les perturbations biologiques liées au syndrome inflammatoire sont toujours nettes : les « protéines positives » de la réaction inflammatoire (CRP, fibrinogène, haptoglobine, orosomucoïde, ferritine) sont augmentées alors que les « protéines négatives » de l’inflammation (albumine, transferrine) sont diminuées. Le problème qui reste le plus souvent difficile à résoudre en pratique est de savoir distinguer l’existence d’une carence martiale vraie lorsqu’il existe un syndrome inflammatoire associé, qu’il soit lié directement ou non à la cause de la carence en fer. Le diagnostic de la carence en fer au cours des états inflammatoires pose un problème difficile, en particulier chez des patients âgés
-26-
3. Outils évaluant le métabolisme martial au cours des anémies inflammatoires
Profil de répartition du fer au myélogramme
La meilleure technique pour évaluer le stock martial de l’organisme est l’examen d’un frottis médullaire après coloration de Perls. Dans les mécanismes inflammatoires, on retrouve une surcharge des macrophages en hémosidérine et, à l’opposé, une absence de fer dans les érythroblastes (diminution du taux de sidéroblastes à moins de 20%). Bien sûr, en pratique clinique, cet examen ne fait pas partie du bilan systémique [41].
Dosage plasmatique du fer et de la transferrine
Le pool de transport est mesuré directement par la sidérémie et la transferrinémie. Ce dernier paramètre est exprimé par la capacité totale de fixation (CTF). La sidérémie s’abaisse en cas de carence en fer ou d’inflammation alors que le CTF ne s’élève que dans le premier cas par un mécanisme compensateur. La diminution du taux de fer plasmatique peut être mise en évidence quelques heures après le début du processus inflammatoire
[41].
Ferritinémie
La concentration sérique de la ferritine témoigne de l’importance du pool de réserve. Une baisse évoque une carence martiale (au dessous de 10 mg/l, il s’agit d’un diagnostic de certitude). La ferritine est une protéine de la phase aiguë de l’inflammation. Elle s’élève lors des processus inflammatoires [44]. Elle peut être paradoxalement normale lorsqu’un déficit martial s’y associe [41].
Récepteur soluble de la transferrine
Le dosage du RsTf est arrivé plus récemment en biologie clinique. Il s’agit d’un bon indicateur du stock cellulaire total en Rtf et de l’intensité de
-27-
l’érythropoïèse [45]. Le taux de RsTf augmente dans les anémies ferriprives et reste normal lors des AMC [46, 47].
4. Signes cliniques
Les signes cliniques de l’anémie inflammatoire n’offrent guère de spécificité, celle-ci étant rarement intense. Ses signes sont difficiles à distinguer parmi ceux liés à l’inflammation. Ainsi, l’asthénie, la dyspnée, la tachycardie et la pâleur peuvent être induites ou au moins potentialisées par la maladie sous-jacente. Fièvre, sueurs nocturnes et amaigrissement dominent souvent [42].
5. Etiologies
Nous énumérons ci-dessous un certain nombre de causes d’AMC, sans prétention d’exhaustivité, en insistant sur les anémies des cancers et celles liées au VIH, qui représentent deux entités particulières sur le plan physiopathologique et thérapeutique [41].
Anémie causée par des processus inflammatoires chroniques [41]:
- Infections chroniques sévères (tuberculose, ostéomyélite, abcès,
endocardites, infections urinaires sur sonde à demeure, brucellose, viroses prolongées, mycoses profondes….),
- Maladies systémiques ou dysimmunitaires (LED, PR, périartérite noueuse, maladie de Horton, dermatomyosite, sclérodermie, fasciite à éosinophiles, entéropathies (maladie de Crohn), maladie de still…),
- Sarcoϊdose.
Anémie des cancers [41]
Les cancers représentent les premières causes des fortes inflammations prolongées. Il peut s’agir de tumeurs solides (en particulier rénales,
-28-
pulmonaires, digestives, génito-urinaires, ou hépatiques et/ou au stade métastatique) ou d’hémopathies (lymphomes principalement).
Anémie liée à l’infection par le VIH [41].
6. Prise en charge thérapeutique
La première thérapeutique d’une anémie inflammatoire est le traitement de la pathologie responsable du syndrome inflammatoire [48, 49]. Les transfusions sont rarement nécessaires et doivent être réservées en cas de mauvaise tolérance (cci étant plus liée d’ailleurs à la maladie causale qu’à l’anémie en elle-même) [50].
III- PARAMETRES D’EXPLORATION DU METABOLISME MARTIAL Nous avons vu que les échanges de fer s’opèrent entre trois compartiments métaboliques principaux : fonctionnel, de transport et de réserves. A chaque compartiment correspond des tests d’exploration spécifiques qui relèvent de la biochimie et de l’hématologie.
A. Quels sont ces tests ?
1. Evaluation du compartiment fonctionnel
L’exploration biologique du fer fonctionnel consiste à évaluer le fer hémoglobinique. Deux sortes de paramètres étroitement associés doivent être distingués, le taux d’Hb et les indices érythrocytaires (VGM et TCMH) [4].
2. Evaluation du compartiment de transport
Pour ce type de fer, l’exploration biologique est focalisée sur les dosages suivants : le fer sérique, la transferrine, la CTST, le CST, et le RsTf.
-29-
2-1. Le fer sérique
Chez le sujet normal, le fer circulant sous une autre forme que l’hémoglobine est presque exclusivement du fer lié à la transferrine (et très peu à la lactoferrine ou à la ferritine). Par contre à l’état pathologique, on peut trouver aussi du fer d’origine hémoglobinique (hémolyse), du fer lié à la ferritine en quantité élevée (nécrose hépatique, surcharge), une forme atypique de fer non lié à la transferrine (hémochromatose) ou du fer chélaté sous forme de ferrioxamine
[4].
2-2. La transferrine
La transferrine ou sidérophiline est une glycoprotéine assurant le transport du fer depuis les entérocytes intestinaux jusqu’aux érythroblastes par le système macrophagique. Il s’agit d’une β globuline synthétisée par le foie et présentant
une très forte affinité pour les ions Fe+++. Chaque molécule possède deux sites
de fixation du fer indépendants, si bien que l’on peut trouver à tout moment dans le plasma quatre formes moléculaires distinctes de transferrine : di ferrique (ayant fixé le fer sur les deux sites), mono ferrique (n’ayant fixé le fer que sur l’un ou l’autre des deux sites), apotransferrine (n’ayant pas fixé de fer) [4].
2-3. Les Paramètres calculés
Ils sont représentés par la CTST et le CST. 2-4. Le RsTf
C’est un nouveau paramètre d’utilité importante dans l’exploration du statut martial, objet de ce travail, nous lui consacrerons tout un chapitre pour bien l’étudier en détail.
-30-
3.
Evaluation du compartiment des réserves3-1. Ferritine sérique
C’est pratiquement le dosage de ferritine sérique qui résume l’exploration du fer des réserves, protéine de mise en réserve du fer avec disponibilité permanente adaptée aux besoins. Au contraire de l’hémosidérine, la ferritine est plus chargée en fer mais moins soluble et semble représenter une forme stable de stockage, ne se mobilisant qu’à long terme [4].
La ferritine est une protéine de poids moléculaire élevé (au moins 440000). Elle est formée d’une coque sphérique, l’apoferritine, comportant en son centre une cavité divisée en quatre lobes, dans laquelle se trouvent des cristaux de fer sous forme de polyhydroxyphosphate ferrique. Des canaux percés entre le core central et la surface permettent l’entrée et la sortie du fer. On pense que la ferritine peut emmagasiner ainsi de 4000 à 4500 atomes de fer mais, le plus souvent, elle n’en contiendrait pas plus de 2000.
La coque protéique est formée de l’assemblage de 24 sous-unités polypeptidiques immunologiquement distinctes, appelées H (Heavy) et L (Light). En fonction de la proportion de ces sous-unités, on a isolé chez l’homme plus de 20 sortes de ferritine différentes (ou isoferritines). Ainsi, les ferritines acides contiennent une forte proportion de chaînes H et sont surtout présentes dans le cœur, le rein, le placenta et l’érythroblaste. En revanche, les ferritines basiques sont riches en ferritine L. On les trouve surtout dans le foie, la rate et le plasma (fig.5) [4].
-31-
Figure 5 : structure de la ferritine
3-2. Ferritine érythrocytaire
La ferritine érythrocytaire est un résidu de la ferritine érythroblastique, dont la concentration est influencée par deux facteurs essentiels :
la saturation en fer de la transferrine, le niveau de synthèse de l’Hb.
Elle se présente ainsi sous deux formes :
Acide (forme H prédominante), constituant une réserve temporaire du fer en vue de la synthèse de l’hème,
Basique (forme L majoritaire), permettant le dépôt intracellulaire de l’excès de fer.
Le dosage de la ferritine érythrocytaire se déroule en 3 étapes :
Elimination des leucocytes, 1000 fois plus riches en ferritine que les hématies,
-32-
Dosage de la ferritine dans l’hémolysat.
Afin de s’affranchir de l’influence du VGM et de l’hématocrite, la concentration est rapportée à l’érythrocyte, d’où la nécessité d’une numération globulaire effectuée le jour du dosage. Les résultats, exprimés en
attogramme/cellule (10-18 g/cellule), sont obtenus après le calcul suivant :
Ferritine du lysat x Hb du sang total Ferritine érythrocytaire =
GR du sang total x Hb du lysat
Les valeurs usuelles sont : chez la femme : 3 à 24 attogramme/cellule chez l’homme : 2,8 à 36,8 attogramme/cellule
Le dosage de la ferritine érythrocytaire présente de l’intérêt essentiellement dans deux situations :
Recherche de carence martiale chez le sujet présentant un syndrome inflammatoire, car le taux de ferritine érythrocytaire n’est pas influencé par l’inflammation. Sa diminution intervient rapidement, puisque la diminution des réserves précède l’altération de la synthèse de l’Hb ;
Distinction entre les surcharges secondaires modestes liées à l’alcoolisme (taux de ferritine intraérythrocytaire x 5) et les hémochromatoses génétiques (taux de ferritine intraérythrocytaire x 50) [5].
Néanmoins, son dosage demeure peu pratiqué car plus délicat. 3-3. Ferritine glycosylée
La ferritine sérique est constituée par 60 à 80% de ferritine glycosylée (provenant d’un phénomène de sécrétion-glycosylation par les monocytes-macrophages) et de ferritine non glycosylée, issue de l’excrétion des cellules parenchymateuses. La demi-vie de la ferritine glycosylée est plus longue et sa
-33-
détermination reflète la lyse tissulaire lors des surcharges en fer ou des affections malignes.
Le dosage de la ferritine glycosylée trouve son indication dans l’interprétation d’une hyperferritinémie difficile à cerner. Dans les hyperferritinémie d’origine inflammatoire, le pourcentage de glycosylation reste normal. Plusieurs maladies s’accompagnent d’une augmentation préférentielle de la ferritine non glycosylée : hépatite aiguё, tumeur, maladie de still.
Le dosage différentiel des ferritines glycosylée et non glycosylée repose sur l’affinité élective de la ferritine glycosylée pour la concanavaline A [5]. Cette technique délicate, mise au point par différentes équipes (Worwood, Cazzola) n’est pratiquée que dans quelques laboratoires spécialisés.
B. Dosage
1. Paramètres du compartiment fonctionnel
1.1. Phase pré analytique
Ce dosage requiert un prélèvement sanguin réalisé sur un tube avec EDTA comme anticoagulant.
1.2. Phase analytique
1.2.1. Taux d’Hb
Il s’agit d’un dosage spectrophotométrique bien standardisé consistant à transformer l’Hb en cyanméthémoglobine et à lire l’absorbance à 540 nm. Un standard international est largement utilisé pour la calibration. En fait, cette mesure est depuis longtemps intégrée dans les automates électroniques de cytologie où elle constitue l’une des composantes de la formule sanguine.
Le taux d’Hb ne doit pas être interprété isolément, mais en relation avec les deux indices érythrocytaires ci-dessous [4].
-34-
1.2.2. VGM
Il s’agit d’un indice mesuré pendant une courte période au cours de laquelle les globules rouges en suspension dans un liquide de dilution passent à travers un orifice et déclenchent une impulsion électronique. Le nombre d’impulsions enregistrées correspond au nombre de globules rouges et l’amplitude de l’impulsion permet de mesurer le VGM. Le VGM est aussi donné par les automates électroniques de cytologie où il constitue l’une des composantes de la formule sanguine [4].
1.2.3. TCMH
Indice calculé en divisant le taux d’Hb (exprimé en g/l) par le nombre de globules rouges (exprimé par µl) [4]. La TCMH est aussi donnée par les automates électroniques de cytologie.
1.2.4. IDGR
Certains automates donnent un indice érythrocytaire appelé IDGR. Un IDGR augmenté (> 15%) traduit une anisopoïkilocytose et incite à examiner attentivement les frottis [4].
1.3. Phase post analytique (Valeurs usuelles et utilité pratique) - Hb
Homme : 13- 17,5 g/dl Femme : 11,5- 16 g/dl Enfant (à partir d’un an) : 11,5- 14,5 g/dl - VGM: 80- 100 fl (10-15 l)
-TCMH: > 27 pg/GR
L’intérêt de l’exploration de ces paramètres réside presque exclusivement dans le diagnostic de l’anémie par carence en fer (anémie hypochrome ferriprive) où ils sont abaissés (sauf l’IDRG qui est augmenté). Ces résultats
-35-
indiquent une diminution de la livraison du fer aux érythroblastes, mais ne signifient pas obligatoirement qu’il n’existe plus de réserves en fer. A noter que la TCMH est le premier paramètre à baisser, suivi par le VGM puis par le taux de l’Hb. Ces paramètres peuvent être aussi de quelque utilité dans l’évaluation de la réponse à une thérapeutique martiale [4].
2. Tests explorant le compartiment de transport
2.1. Fer sérique
2.1.1. Phase pré analytique
Le prélèvement doit être réalisé sur tube sec (les anticoagulants peuvent entraîner des interférences), entre 8h et 10h du matin et toujours à la même heure s’il s’agit d’un suivi. Le fer sérique présente en effet d’importantes variations nycthémérales [4].
2.1.2. Phase analytique
A l’état physiologique, le fer sérique accessible au dosage se définit comme le fer lié à la transferrine. La quantité de fer liée à la ferritine sérique est infime et intervient peu dans le dosage. Néanmoins, dans les nécroses tissulaires, le fer de la ferritine s’ajoute de manière significative au fer de la transferrine. De même, dans les surcharges en fer, il existe une fraction de fer non liée à la transferrine, qui est également mesurée avec le fer lié à la transferrine. Son dosage spécifique est délicat et reste du domaine de la recherche.
Le fer fait partie des éléments traces et son dosage présente donc deux difficultés :
- contamination éventuelle (matériel de prélèvement, cupules de dosage…), - détermination précise des faibles concentrations.
-36-
La méthode de référence a été décrite par l’ICSH. Elle consiste en une précipitation des protéines sériques avec relargage du fer de la transferrine par un agent réducteur. Après centrifugation, le fer ferreux est détecté dans le surnageant par une technique faisant appel à un chromogène (ferrozine ou férène, plus sensible). A partir de cette technique, diverses variantes ont été développées, visant à automatiser, éviter la précipitation des protéines, minimiser les interférences avec les chromogènes et travailler sur des quantités minimes de sérum [5].
L’interprétation de la sidérémie est souvent délicate. Le fer sérique suit un rythme circadien, avec un maximum le matin (entre 8 – 12 H) et un minimum vers 20 H. Ces variations sont considérablement amoindries en cas de franches hypo ou hypersidérémies. La sidérémie diminue également au cours des règles. La prise médicamenteuse de fer ou un repas riche en fer augmente la concentration post prandiale de fer sérique [5].
2.1.3. Phase post analytique (Valeurs usuelles et utilité pratique) - Nouveau-né : 10 à 36 µmol/l
- Nourrisson, enfant : 11 à 23 µmol/l - Homme : 10 à 30 µmol/l - Femme : 8 à 28 µmol/l [4]
S’il est certain que le dosage de le sidérémie fournit un message aisément appréhendable pour les patients, sa variabilité et son défaut de sensibilité en tant qu’indicateur d’hémochromatose ou de carence martiale limitent considérablement son intérêt clinique. En pratique son dosage isolé est sans
-37-
intérêt. Il ne se justifie que couplé à celui de la transferrine afin d’apprécier son coefficient de saturation.
L’hyposidérémie s’observe dans deux situations :
Les anémies par carence martiale : Au début de l’installation d’une carence en fer, la sidérémie est maintenue constante au dépens des réserves échangeables. La synthèse de la transferrine augmente
dans un 2ème temps. Ce n’est que tardivement que la sidérémie
diminue avec apparition d’une anémie hypochrome,
Les syndromes inflammatoires : Par le jeu des cytokines inflammatoires, les états inflammatoires induisent la synthèse d’hépcidine et détournent le fer libre de son utilisation habituelle pour l’érythropoïèse au profit de sa mise en réserve. Ils agissent sur la synthèse des différentes protéines liant le fer (la transferrine diminue et la ferritine augmente).
En pratique, le diagnostic de déficit en fer repose sur le dosage de ferritine sérique, indicateur le plus précoce de la déplétion des réserves. Mais, ce marqueur manque de spécificité dans certaines situations de méprise (inflammation, infection, cancer, pathologie hépatique) [51].
2.2. Transferrine
2.2.1. Phase pré analytique
La transferrine est dosée sur un échantillon de plasma ou sérum obtenu à partir d’un prélèvement sanguin réalisé respectivement sur tube contenant l’heparinate de Li comme anticoagulant ou tube sec sans anticoagulant.
-38-
2.2.2. Phase analytique
Le dosage préconisé pour la transferrine est un dosage immunochimique direct par immunoprécipitation en phase liquide (immuno-néphélémétrie, immuno-turbidimétrie) [4].
2.2.3. Phase post analytique (Valeurs usuelles et utilité pratique) -Nouveau-né : 1,6 à 2,8 g/l
-Nourisson, enfant : 2 à 4 g/l
-Adulte : 2 à 3,2 g/l [48]
La quantité totale de transferrine présente dans l’organisme une corrélation inverse avec l’état des réserves en fer. Ainsi, la synthèse de la transferrine augmente lorsque les réserves diminuent, et ceci bien avant l’apparition de l’anémie. C’est par ailleurs le degré de saturation en fer de la transferrine circulante qui conditionne sa fixation sur les récepteurs membranaires des érythroblastes. Cette fixation est meilleure et la livraison du fer se fait avec plus d’efficacité lorsque prédominent les formes di ferriques [4].
2-3. Paramètres calculés
La CTST et CST sont deux paramètres calculés suivant les relations : CTST = Tf (en µmol/l) x 2
Soit CTST = (Tf (g/l)/80000) x 2 x 106
Soit CTST = Tf (g/l) x 25
CST = fer sérique (µmol/l) / CTST (µmol/l) Valeurs usuelles et utilité pratique
1. CTST : Adulte (H et F) : 60-95 µmol/l Enfant (1 an – puberté) : 55-100 µmol/l
-39- 2. CST : Homme : 20- 40 % Femme : 15- 35 % Enfant (1 an – puberté) : 15- 40 %
Le CST (et non la CTST qui est plutôt corrélée avec les réserves, comme nous le verrons plus loin) est un bon indicateur du transport du fer et de son alimentation tissulaire. Toute diminution de ce coefficient au dessous de 15% traduit sans aucun doute une diminution de la livraison du fer à l’érythropoïèse (ce qui ne signifie pas forcément que l’on se trouve en présence d’une anémie carentielle, car cela se voit aussi dans les anémies inflammatoires). A l’opposé, toute augmentation de ce coefficient au-delà de 55% témoigne d’un danger de surcharge tissulaire en fer du type hémochromatose. Son emploi reste fréquent dans le « screening » de l’hémochromatose génétique [4].
3. Tests explorant le compartiment de réserve : Dosage de la ferritine sérique
3.1. Phase pré analytique
La ferritine est dosée sur un échantillon de plasma ou de sérum obtenu à partir d’un prélèvement sanguin réalisé respectivement sur tube contenant l’heparinate de Li comme anticoagulant ou tube sec sans anticoagulant.
3.2. Phase analytique
La ferritine sérique circulante, dont l’origine est mal connue, est pauvre en fer et proche de l’isoferritine hépatosplénique. De faible durée de vie, elle est rapidement captée par le foie où elle est rapidement métabolisée. Elle est considérée comme l’évaluateur biologique de référence du stock en fer de l’organisme.
-40-
Son dosage est réalisé par immunoenzymologie, chimi- ou
électrochimiluminescence, immunonéphélémétrie et immunoturbidimétrie. Les
standards doivent être calibrés par rapport au 2ème étalon international (OMS
80-578). Cependant, selon la nature de l’immunogène utilisé (hétérogénéité des ferritines de foie et de rate), le type d’anticorps (poly ou monoclonal) et la nature du marqueur ; les résultats peuvent différer d’une technique à l’autre, particulièrement dans les valeurs élevées. Il est donc recommandé d’assurer le suivi des patients par le même réactif.
En cas de traitement martial, il est conseillé de doser la ferritine à quelques jours de distance [5].
3.3. Phase post analytique (Valeurs usuelles et utilité pratique) - Enfant : 0 à 10 jours : 50-400 µg/l 10 à 31 jours : 90-600 µg/l 1 à 3 mois : 140-400 µg/l 3 à 6 mois : 40-220 µg/l 6 mois à 15 ans : 15-100 µg/l - Homme : 30- 300 µg/l - Femme : 20- 200 µg/l [48]
La ferritine sérique présente, chez l’homme normal, une corrélation étroite avec le fer des réserves. Toute diminution en delà des valeurs précédentes évoque une baisse des réserves en fer et une évolution possible vers l’anémie hypochrome ferriprive. Le mécanisme est différent dans l’inflammation et l’infection où, le fer étant transféré directement de l’Hb aux réserves réticulo-histiocytaires, la ferritine sérique peut être normale ou même augmentée. Lorsque les réserves en fer augmentent, la ferritine sérique augmente aussi, mais cette élévation n’est pas spécifique puisqu’elle est retrouvée dans d’autres
-41-
éventualités non liées au métabolisme du fer, telles que la nécrose hépatique et certaines tumeurs [4].
L’hypoferritinémie est l’un indicateur fiable de la carence martiale. C’est le premier signe biologique et infraclinique de la carence avant la baisse des constantes érythrocytaires (TCMH et VGM) et le stade ultime d’anémie microcytaire hypochrome. Lors des traitements supplétifs, les résultats érythrocytaires s’élèvent en premier avant la correction de l’anémie. L’augmentation de la ferritine qui témoigne de la restauration des réserves nécessite plusieurs mois de traitement. Néanmoins, la carence martiale peut être masquée par l’augmentation de la ferritine lors d’un syndrome inflammatoire associé. Dans ce cas, l’augmentation du taux du RsTf présente un grand intérêt diagnostique.
L’hyperferritinémie associée à un taux de fer sérique bas évoquent un syndrome inflammatoire. La ferritine est une protéine de la phase aiguё de l’inflammation.
L’hyperferritinémie associée à un taux de fer sérique normal ou augmenté peut relever d’étiologies diverses :
une lyse cellulaire conséquente induisant une hyperferritinémie : Cas d’hépatites aigues où la ferritine peut dépasser 10000 µg/l mais aussi des hépatites chroniques, des hémolyses, des nécroses médullaires et myocardiques ainsi que des rhabdomyolyses,
l’alcoolisme : hyperferritinémie, fer sérique élevé et CST augmenté. Les causes rares sont représentées par les hyperthyroïdies, les tumeurs malignes (carcinome hépatocellulaire, pulmonaire et mammaire), les maladies hématologiques malignes (LMNH, leucémies, syndrome hyperferritinémie-cataracte lié à la présence de mutation dans l’IRE du gène L-ferritine) [52].
-42-
C. Etude critique des paramètres classiques du bilan martial 1. Hémogramme
Le dosage de l’hémoglobine, à la recherche d’une anémie, n’est perturbé qu’à un stade tardif de la carence et témoigne déjà des réserves effondrées. Il ne présente donc qu’un faible intérêt dans un bilan systématique de première intention.
Les autres paramètres érythrocytaires tels que VGM, TCMH bien que variant plus précocement que l’Hb, restent insuffisants pour le diagnostic précoce de la carence martiale. De plus une macrocytose d’origine alcoolique par exemple rend ininterprétable la valeur du VGM.
2. Fer sérique
Trop souvent prescrit en première intention dans le cadre d’un bilan de dépistage d’une carence martiale, son dosage est en pratique très décevant du fait de nombreuses variabilités :
- Variabilité individuelle liée d’une part au rythme circadien (concentration maximale à midi, minimale à minuit, avec une amplitude de 30 à 40% en moyenne) [4] et d’autre part de l’extrême labilité du pool sérique circulant
[53],
- Variabilité interindividuelle et en fonction du sexe,
- Enfin et surtout, variabilité en fonction de nombreux facteurs de méprise : hémolyse, nécroses, syndrome inflammatoire.
En résumé, la sidérémie est une investigation qui manque à la fois de spécificité et de sensibilité pour le dépistage des carences martiales, tout en conservant un intérêt certain dans celui des surcharges en fer.
-43-
3. Transferrine
Sa détermination immunologique sert à calculer la capacité totale de fixation puis, couplée à celle du fer sérique, le coefficient de saturation de la transferrine [54]. Ce dernier étant entaché par les variations de la sidérémie et de la transferrine elle-même.
Les variations en sont plus précoces que celle de l’Hb (augmentation de la CTST et diminution du CST en cas de carence). Mais l’interprétation devient difficile en cas de pathologies associées qui peuvent fausser sa véritable signification : par exemple dans le cadre d’une carence martiale associée à un syndrome inflammatoire, la concentration de la transferrine peut être normale, son augmentation par la carence étant masquée par sa diminution. Ces facteurs de variations sont essentiellement :
- Un syndrome inflammatoire, - Une insuffisance hépato-cellulaire, - Une dénutrition,
- Une hyperandrogénie,
- Les fuites urinaires, gastro-intestinales et cutanées.
A l’inverse, une imprégnation oestrogénique peut élever la transferrine et faire évoquer une carence en fer qui n’existe pas (tableau 1) [54].
-44-
Tableau 1 : principaux facteurs de variation de la transferrine [54]
Facteurs de variation variations observée
Variations pré analytiques et analytiques
Efforts violents Garrot si pose prolongée
Variations analytiques / Variations biologiques Age - nouveau-né - personnes âgées Sexe féminin Grossesse Médicaments Contraceptifs oraux Danazol L-asparaginase D-péniccillamine Variations intra-individuelles / Variations pathologiques
Inflammations chronique et aigue Insuffisance hépato-cellulaire Dénutrition Fuites urinaire, gastro-intestinale et cutannée Hyperandrogénie
![Figure 3 : Mécanismes d’absorption du fer alimentaire par les entérocytes duodénaux [3]](https://thumb-eu.123doks.com/thumbv2/123doknet/15059172.698162/12.892.208.698.357.783/figure-mécanismes-absorption-fer-alimentaire-entérocytes-duodénaux.webp)
![Figure 4 : Régulation de la biosynthèse de la ferritine et du Rtf 1 par les protéines IRPs [3]](https://thumb-eu.123doks.com/thumbv2/123doknet/15059172.698162/15.892.101.818.83.499/figure-régulation-biosynthèse-ferritine-rtf-protéines-irps.webp)