École doctorale Sciences de la Nature et de l’Homme - ED227
THÈSE
Pour obtenir le grade de
DOCTEUR DU MUSÉUM NATIONAL D’HISTOIRE NATURELLE
Spécialité Sciences des matériaux
Présentée et soutenue publiquement le 9 Octobre 2014
par
Giliane Pauline ODIN
Étude expérimentale de spécimens pyriteux :
altérations de schistes argileux fossilifères et
traitements de bois lignitisés.
Sous la direction de Madame ROUCHON Véronique, HDR, Ingénieure de recherche
et Monsieur LELIÈVRE Hervé, HDR, Professeur
JURY :
Sylvain BERNARD
Chargé de recherche, IMPMC, MNHN, Paris
Examinateur
Maguy JABER
Professeur, LAMS, UPMC, Paris
Examinateur
Hervé LELIÈVRE
Professeur, CR2P, MNHN, Paris
Directeur de thèse
Laurent MICHOT
Directeur de recherche, PHENIX, UPMC, Paris Rapporteur
Didier NÉRAUDEAU
Professeur, Géosciences Rennes, Rennes 1
Rapporteur
Mes premiers remerciements vont à mes deux directeurs de thèse, Véronique Rouchon, du CRCC et Hervé Lelièvre, du CR2P. Je les remercie de m’avoir guidée durant ces trois années de thèse par leur soutien, leurs conseils et leur disponibilité. Leurs critiques furent d’une grande aide et je tiens à remercier plus particulièrement la première notamment pour les discussions sur la jungle des possibilités post-doctorat accessibles.
Je tiens ensuite à exprimer ma reconnaissance aux membres du jury pour avoir accepté de faire la critique de ce travail : Messieurs Laurent Michot et Didier Néraudeau en tant que rapporteurs, Madame Maguy Jaber et Messieurs Sylvain Bernard et Philippe Refait en tant qu’examinateurs. Je veux particulièrement remercier ces deux derniers pour les échanges fructueux qui ont émaillés ces trois années de thèse. Les idées ne manquaient pas, seul le temps a fait défaut.
Ma gratitude va également à Bertrand Lavédrine, directeur du CRCC, pour m’avoir accueillie dans son laboratoire.
Je tiens ensuite à adresser mes plus chaleureux remerciements aux paléontoloques/ paléobo-tanistes/ paléoentomologistes qui m’ont confié quelques-uns de leurs spécimens ou fait découvrir leurs chantiers de fouilles. Ils ont, chacun à leur manière, facilité mon immersion dans le monde de la paléontologie.
Je remercie ainsi Sébastien Steyer et Georges Gand pour m’avoir fait découvrir le site de Muse, ainsi que Dominique Chabard et Sylvain Charbonnier pour avoir étendu cette exploration à l’ensemble du Bassin d’Autun et aux collections de nodules qui en sont issues. Merci à Ronan Allain pour l’accès aux fouilles du site d’Angeac, tout comme à Renaud Vacant qui a aidé à la préparation et au transport d’échantillons. Merci Renaud pour les discussions et pour ton retour d’expérience sur les produits utilisés en préparation.
J’ai eu la chance de pouvoir échantillonner le site - désormais clos - de Rivecourt grâce à Dario de Franceschi, qui a par ailleurs fourni de beaux (du moins de mon point de vue) spécimens pyriteux. C’est également le cas de Jean Dejax qui a ouvert les portes de la collection Flouest, point de départ de ce travail. Merci à tous les deux. Que Romain Thomas soit remercié pour son aide et sa complicité, aussi bien sur les chantiers de fouille (alors que tout le monde cherche des restes de sauropodes au contraire de deux individus qui se contentent... de bois !) qu’au Muséum (les chaussures fermées sont obligatoires en TP de chimie).
Enfin, ces remerciements ne seraient pas complets s’ils n’incluaient Olivier Béthoux, fournis-seur officiel d’échantillons chinois. Merci de t’être plié aux exigences "anoxiques" que les quelques kilos d’échantillons ( !) que tu as ramené requerraient. Merci aussi de ta passion dévorante et communicative pour les insectes fossiles, pour tes cours de pal’ personnalisés et tes corrections d’anglais. Et puis aussi pour Derek, pour les bières et d’autres choses encore. Thanks for all, Obi-Wan.
tiroirs de la galerie de Minéralogie, jusque dans la salle - bien gardée - du Trésor.
Considérant comme un immense privilège d’avoir eu accès, accompagnée par leurs réflexions scientifiques pertinentes, aux vastes et merveilleuses collections hébergées au Muséum, qu’ils soient ici remerciés de l’enrichissement pluridisciplinaire qu’ils ont développé.
D’autres spécialistes que je ne saurais oublier de remercier : Vincent Rommevaux, qui a pu préparer quelques lames minces et apporter un soutien matériel adéquat aux échantillons et Marie Madeleine Blanc-Valleron, qui a été d’une grande aide dans le dépouillement des diffrac-togrammes.
Un peu plus loin mais toujours au Muséum, j’adresse mes remerciements à Matthieu Lebon, Simon Puaud et Xavier Gallet de l’IPH, pour m’avoir donné accès à un petit - mais néanmoins utile - matériel. Merci Matthieu pour les interludes entre deux de tes missions au Maroc, agré-mentés de thé à la menthe (et au miel) ; j’espère que le chemin parcouru depuis le C2 il y a maintenant 5 ans va se prolonger encore quelques temps.
Je tiens également à remercier les collègues biologistes du Laboratoire de Recherche des Monuments Historiques, Faisl Bousta, Alexandre François et Geneviève Orial qui ont très aima-blement débroussaillé ce qu’il y avait de bactérien (ou non) dans mes échantillons. Merci Alex d’avoir toujours répondu aimablement (et très rapidement) à mes innombrables questions.
Restons au LRMH pour adresser un grand merci à Jean-Didier Mertz, qui a été d’une aide primordiale dans la caractérisation des argiles, et qui a éclairé de ses précieux renseignements l’étude des roches étudiées, notamment leur structure. J’en profite par conséquent pour remer-cier Thomas Cabaret, qui, à l’aide de Jean-Didier, a contribué à cette caractérisation et initié quelques tests quant à l’efficacité de produits de conservation.
J’adresse une pensée particulière à Thomas Onfroy et Pascale Massiani, du Laboratoire de Réactivité de Surface de l’UPMC. Vos machines "capricieuses" me resteront en mémoire mais votre gentillesse et votre appui durant ces expériences les surpasseront toujours. Merci de m’avoir accueillie quelques temps, alors que vos champs d’investigation étaient si loin de ce que je vous proposais.
Les analyses Mössbauer ont été très gracieusement faites par Alain Wattiaux de l’Institut de Chimie de la Matière Condensée de Bordeaux. Qu’il en soit ici remercié.
Enfin, je tiens à remercier Fréderik Vanmeert, Koen Janssens, François Farges et Delphine Vantelon pour les aides, commentaires et divers soutiens fournis lors des analyses menées sur la ligne synchrotron LUCIA. Un merci plus particulier à Fréderik, compagnon toujours égal et agréable lors de ces temps de faisceau, apte à enseigner quelques mots de flamand et à participer à des concours de dessin (de synchrotron évidemment) avec deux personnes rendues un peu folles par une semaine de manip’ synchrotron.
Restons dans cet environnement si particulier du synchrotron pour entamer les derniers re-merciements. Tout d’abord, je tiens à remercier Pierre Gueriau, pour m’avoir permis de passer un échantillon de vitrinite sur son temps de faisceau à DISCO, et ensuite pour la visite privée de l’antre nommée Ipanema. Nos longues discussions me resteront en mémoire, qu’elles soient
chocolat)
Je veux ensuite remercier tout le personnel du Centre de Recherche sur la Conservation des Collections, pour l’accueil et l’ambiance durant ces trois années passées au laboratoire. Bien évidemment, j’adresse un grand merci aux "jeunes" (Oulfa, Sophie, Céline, Camille, Fabien, Olivier, Anne, Aurélie et un peu avant Chiara, Marie et Eléonora) pour les soirées/ activités/ pauses déjeuner/ discussions un peu plus détendues et tous ces bons moments passés ensemble. Je souhaite remercier plus particulièrement certains collègues, à commencer par Laurianne Robinet, pour ton écoute, ton soutien et ton aide, à divers moments de la thèse. Ton épaule dis-crète m’a toujours été d’un grand réconfort et le déplacement de dernière minute de ton colloque d’octobre 2014 m’a fait un plaisir immense. Merci à ma sauveuse Oulfa, pour tellement de choses ! Ton écoute, ton travail, ta patience, ton soutien, ta bonne humeur, ton entrain, (ton crunch ?)... bref, en fait, tout simplement pour m’avoir accompagnée dans les déboires et réussites durant ces trois années de thèse. Merci à Sophie, totalement délurée, pour ta passion partagée des opérettes d’Offenbach, pour avoir été ma comparse jusqu’à 19h30/20h de nombreux soirs et puis pour une soirée mémorable. Merci de m’avoir permis de respirer un peu plus cette dernière année et de m’avoir libérée, délivrée de cette thèse... Merci également à Aurélie et Céline, un peu toquées elles aussi, mais d’humeur souvent joyeuse, d’entrain infatigable et en ce qui concerne la première, pour ton rire irrésistible.
Je clôture ces remerciements avec un merci à la famille. Aux deux géniteurs, pour la liberté accordée, qui a pris au cours de ces trois dernières années un second aspect. Le premier, vous me l’avez offert il y a déjà longtemps, mais je vous remercie à nouveau tous les deux d’avoir accepté mes choix et leurs répercussions hypothétiques, d’autant qu’elles vous touchaient directement. Aux frangins/frangines pour avoir à leur manière soutenu et essayé de comprendre ce que je faisais. A mon cousin germain, pour avoir également veillé sur moi, proposé et agréablement accordé son aide à plusieurs reprises. Enfin, un merci particulier à GSO, naturaliste par excellence, qui a éveillé ses enfants au monde extérieur, par son savoir immense ; pour avoir également été un reviewer (je sais que tu adores les anglicismes) exigeant, pointilleux et scrutateur, de conseils trop justes pour être ignoré ; et enfin quitte à me faire accuser de plagiat, pour être arrivé tardivement dans la vie de l’auteur.
Une étude expérimentale menée sur des spécimens pyriteux de deux types différents (schistes argileux fossilifères et bois lignitisé) a été entreprise afin de mieux comprendre les phénomènes à l’origine des dégradations constatées en collection et de mettre au point des traitements de conservation pour les éviter.
Une étude de comportement de schistes argileux fossilifères a été menée par vieillissement artificiel. Nous avons choisi d’étudier du matériel provenant du Bassin d’Autun (Saône-et-Loire, France ; Permien) car, d’une part, nous disposons de matériel historique dégradé permettant de caractériser un état final (collection Flouest, MNHN), et d’autre part, il a été possible de collecter du nouveau matériel, assimilable à un état initial et utilisable pour nos expérimentations. Ces expérimentations ont permis d’observer 1/ dans l’encaissant, une oxydation des composés soufrés réduits, donnant lieu à du sulfate de calcium, généralement peu nuisible ; 2/ à l’interface encaissant/fossile, des efflorescences plus dommageables de sulfates de fer dues à la dégradation de pyrite framboïdale, soufre et pyrrhotite.
Concernant le bois lignitisé, différents traitements visant à améliorer sa conservation ont été expérimentés. Les essais de séchage ont montré que ce dernier génère des dégâts d’ordre méca-nique et/ou un développement d’efflorescences sur nos échantillons, et ne résout pas le problème de réactivité chimique. Des lavages additionnels ont donc été menés. Ils ont permis d’oxyder les sulfures présents dans le bois et de dissoudre les ions sulfates formés, rendant le matériau moins réactif et plus aisé à sécher. Le lavage à l’eau s’avère plus lent mais plus respectueux du matériau que le lavage au peroxyde d’hydrogène.
Mots-clé : pyrite, soufre, sulfures, oxydation, collection, paléobotanique, bois, lignite, schistes argileux, fossiles, conservation, XANES, Raman, DRX
An experimental study of pyritic specimens of two different types (fossiliferous shales, and lignitized wood) was undertaken in order to better understand the processes responsible for degradations observed in historical collections, and to work out conservative treatments in order to avoid them.
A behavioral study of fossiliferous shales was conducted by artificial ageing. We focused on material from the Autun Basin (Saône-et-Loire, France ; Permian) because, on one hand, damaged historical specimens, allowing a final state to be characterized, are available (collection Flouest, MNHN), and, on the other hand, it was possible to collect new material, comparable to an initial state, available for our experiments. These experiments allowed to observe 1/ in the matrix, an oxidation of reduced sulfur compounds into calcium sulfate, usually little harmful ; 2/ at the matrix/fossil interface, more damaging efflorescence of iron sulfates, due to the degradation of framboidal pyrite, pyrrhotite and sulfur.
Regarding lignitized wood, various treatments aiming to improve conservation were tested. Experiments using drying showed that this technique generates cracks and/or efflorescence, and does not solve the chemical reactivity issue ; therefore additional washes were conducted. They allowed oxidizing the sulfides occurring in the wood and dissolving the sulfates ions formed, ma-king the material less reactive and easier to dry. Water washing is slower but more respectful of the material than washing using hydrogen peroxide.
Keywords : pyrite, sulfur, sulfides, oxidation, collection, paleobotany, wood, lignite, shale, fossils, conservation, XANES, Raman, XRD
manuscrit
Liste des abréviations
On répertorie dans ce paragraphe toutes les abréviations futures dont le lecteur pourrait avoir besoin.
BSO : bactérie sulfo-oxydante BSR : bactérie sulfato-réductrice
DO (S, Ca, ...) : degré d’oxydation (du soufre, du calcium, ...) DRX : diffraction des rayons X
HR : humidité relative
ICP-AES : inductively coupled plasma - atomic emission spectroscopy IRTF : infra rouge à transformée de Fourier
MEB : microscopie électronique à balayage MO : matière organique
OD : oxygène dissous
SDE : sonde à dispersion d’énergie
UPS : ultraviolet photoelectron spectroscopy (spectroscopie photoélectronique UV) XANES : X-ray absorption near-edge structure
δ : déplacement isomérique ∆ : éclatement quadrupolaire Γ : largeur à mi hauteur
ν : nombre d’onde (= 1/ λ avec λ, la longueur d’onde) σ : conductivité
Distinctions diverses
Des distinctions entre termes proches ont été réalisées arbitrairement par l’auteur. Afin de rendre ces différences plus lisibles, nous les listons ci-dessous.
pyriteux= qui contient en son sein de la pyrite
pyritisé= relatif au processus de pyritisation (terme normalement non utilisé, sauf mégarde) ligniteux= qui contient en son sein du lignite (terme normalement non utilisé, sauf mégarde) lignitisé= relatif au processus de charbonisation
Lorsque nous parlerons dans les résultats des échantillons de bois de Rivecourt, cela englobera à la fois les échantillons Rivmou et Rivdur, dont nous expliquerons la distinction au cours de ce
Enfin, on se permettra après la présentation du site d’Angeac-Charente de le désigner sous l’appellation Angeac, comme d’autres auteurs avant nous l’ont fait [1]. Ces deux appellations désignent néanmoins sans distinction aucune le même lieu.
Vocabulaire anglophone
La plupart des acronymes (de techniques notamment) a été traduite en langue française. Néanmoins, on s’excusera d’avance de garder les acronymes anglais de deux techniques, à cause de leur très faible notoriété en langue française. Nous garderons donc les acronymes d’ICP-AES pour désigner la spectroscopie d’émission atomique par plasma à couplage inductif et celui du XANES, pour la spectroscopie de structure près du front d’absorption de rayons X.
Table des matières
Remerciements i
Résumé v
Abstract vii
Précisions sur la rédaction du manuscrit ix
I
Introduction aux matériaux pyriteux
1
1 Problématique 3
2 De la pyrite 5
2.1 Entre pyrite et "or des fous", histoire d’une dénomination . . . 5
2.2 Présence et formation . . . 8
2.2.1 Présence sédimentaire . . . 8
2.2.2 Genèse de la pyrite sédimentaire . . . 8
2.2.3 Pyrite et collections patrimoniales . . . 10
2.3 Mécanismes d’oxydation . . . 11
2.3.1 Mécanisme chimique en milieu atmosphérique humide . . . 12
2.3.2 Mécanisme électrochimique . . . 13 2.3.3 Mécanisme biologique . . . 14 2.4 Paramètres d’altération . . . 15 2.4.1 Surface exposée. . . 15 2.4.2 Impuretés chimiques . . . 15 2.4.3 Eau . . . 16 2.4.4 Oxygène . . . 16 2.4.5 Autres paramètres . . . 16 3 Du système {fossile/pyrite} 21 3.1 Erreurs de diagnostic. . . 21 3.2 Oxydation en collection . . . 22 3.2.1 Mécanisme . . . 22 3.2.2 Paramètres . . . 22 3.3 Altérations afférentes. . . 23 3.3.1 Dégâts chimiques . . . 23 3.3.2 Dommages mécaniques. . . 25
3.4 Conservation et traitements . . . 26
4 Des matériaux étudiés 29 4.1 Objectifs de la thèse . . . 29
4.2 Schistes argileux . . . 30
4.2.1 Considérations géologiques et chimiques . . . 30
4.2.2 Origine des roches et fossiles étudiés . . . 32
4.3 Bois lignitisés . . . 35
4.3.1 Définition : origine et chimie . . . 35
4.3.2 Site d’Angeac-Charente, Charente, Crétacé Inférieur . . . 37
4.3.3 Site de Rivecourt, Oise, Paléocène Supérieur . . . 37
II
Expérimentation
39
5 Échantillonnage 41 5.1 Schistes argileux du Bassin d’Autun, Saône-et-Loire, Permien . . . 415.1.1 Expérimentations préalables. . . 41
5.1.2 Description des campagnes de fouille . . . 41
5.2 Bois lignitisé . . . 44
5.2.1 Expérimentations préalables. . . 44
5.2.2 Fouilles effectuées à Rivecourt. . . 45
5.2.3 Prélèvements réalisés à Angeac . . . 46
6 Procédure de vieillissement artificiel des schistes argileux 51 6.1 Objectif des vieillissements successifs . . . 52
6.2 Protocole suivi . . . 52
7 Protocole de traitement du bois lignitisé 55 7.1 Séchage et tenue mécanique . . . 55
7.2 Lavage du bois dans l’eau et le peroxyde d’hydrogène. . . 57
7.2.1 Protocole de lavage. . . 57
7.2.2 Succession des bains . . . 58
7.2.3 Lavage de cristaux isolés de pyrite . . . 59
7.2.4 Évaluation du rôle des bactéries. . . 60
8 Méthodes analytiques employées 61 8.1 Microscopie Électronique à Balayage - Sonde à Dispersion d’Énergie (MEB-SDE) 61 8.2 Diffraction des Rayons X (DRX) . . . 62
8.3 Microspectroscopie Raman. . . 63
8.4 Spectroscopie Infra-Rouge à Transformée de Fourier (IRTF) . . . 64
8.5 Inductively Coupled Plasma - Atomic Emission Spectroscopy (ICP-AES) . . . . 64
8.6 Spectroscopie Mössbauer. . . 65
8.7 Spectroscopie d’absorption. . . 65
8.8 Analyses élémentaires . . . 69
8.9 Mesures en solution . . . 69
III
Résultats du vieillissement artificiel mené sur des schistes
argi-leux
73
Publication A : Accelerated ageing of shale of palaeontological
inter-est : Impact of temperature conditions
79
Publication B : Experimental vs natural alterations of fossil-bearing
shales (Autun, France ; Permian)
95
9 Part I : Combined use of Mössbauer spectroscopy, X-ray diffraction, porosi-metry and permeability measurements for characterizing iron speciation and
its vulnerability to weathering. 95
9.1 Introduction. . . 96
9.2 Samples and geological settings . . . 98
9.2.1 Shale samples of historical specimens (HS) from the Flouest collection . . 98
9.2.2 Newly excavated shale samples . . . 98
9.2.3 Cautions taken during shale sampling . . . 99
9.3 Analytical methodology . . . 99
9.3.1 Elemental analyses . . . 99
9.3.2 X-ray diffraction . . . 100
9.3.3 Mössbauer spectroscopy . . . 100
9.3.4 Mercury intrusion porosimetry . . . 101
9.3.5 Permeability measurements . . . 101 9.4 Results. . . 102 9.4.1 Elemental analyses . . . 102 9.4.2 X-ray diffraction . . . 103 9.4.3 Mössbauer Spectroscopy . . . 104 9.4.4 Porosimetry measurements . . . 107
9.4.5 Water vapor and air permeability. . . 107
9.5 Discussion . . . 108
9.5.1 Questioning the occurrence of iron sulfide . . . 108
9.5.2 The speciation of iron in shale . . . 109
9.5.3 Porosimetry and water vapor permeability measurements . . . 110
9.5.4 Connecting iron speciation to permeability measurements . . . 110
9.6 Conclusion . . . 111
10 Part II : Monitoring sulfur oxidation by S K-edge XANES analysis 115 10.1 Introduction. . . 116
10.2 Samples and geological settings . . . 117
10.2.1 Fossil specimens from the Flouest collection . . . 117
10.2.2 Newly excavated shale samples (NS) . . . 119
10.2.3 Artificial ageing at controlled and constant temperature and relative humidity120 10.3 Analytical techniques. . . 121
10.3.1 Rock-Eval pyrolysis . . . 121
10.3.2 Fourier Transform Infrared spectroscopy (FTIR) . . . 122
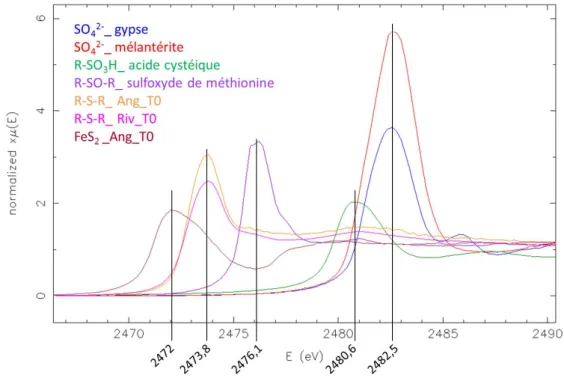
10.3.3 X-ray Absorption Near Edge Structure (XANES) spectroscopy . . . 122
10.4 Results. . . 123
10.4.2 FTIR spectroscopy . . . 123
10.4.3 S K-edge XANES spectroscopy . . . 125
10.4.4 Ca K-edge XANES spectroscopy . . . 129
10.5 Discussion . . . 132
10.5.1 Questioning the type of organic matter . . . 132
10.5.2 The impact of on-site weathering on shale . . . 132
10.5.3 Evolution of speciation versus ageing. . . 133
10.5.4 Comparing the effect of natural (museal) and artificial ageing . . . 134
10.6 Conclusion . . . 134
11 Part III : Framboïdal pyrite, pyrrhotite and sulfur as the origin of damaging efflorescence 141 11.1 Introduction. . . 142
11.2 Samples and geological settings . . . 143
11.2.1 Geological settings . . . 143
11.2.2 Set of samples used for artificial ageing . . . 143
11.2.3 Naturally damaged samples, kept in museal conditions . . . 144
11.2.4 Methodology . . . 145
11.3 Results. . . 147
11.3.1 Artificial ageing of newly excavated shale . . . 147
11.3.2 Micro analysis of the damaged samples kept in museal conditions . . . 150
11.4 Discussion . . . 152
11.4.1 Effect of artificial ageing . . . 152
11.4.2 Toward a better understanding of the damage observed on HS . . . 153
11.5 Conclusion . . . 154
IV
Résultats des essais de stabilisation de bois lignitisé
157
IV-A/ Essais de séchage
161
12 Composition initiale du bois 161 12.1 Composition élémentaire . . . 16112.2 Origine du fer . . . 162
12.3 Composés soufrés . . . 164
12.4 Composés de calcium. . . 166
12.5 Aspect de la structure initiale . . . 167
12.6 Spectres IRTF du bois . . . 167
12.7 Activité bactérienne . . . 168
12.8 Discussion . . . 169
12.8.1 Chimie du bois . . . 169
12.8.2 Composés du fer et du soufre initiaux . . . 170
13 Influence de l’oxygène, de l’humidité et des contraintes mécaniques sur les séchages 173 13.1 Observation visuelle du bois . . . 173
13.1.1 Répercussions de la présence d’oxygène et d’humidité . . . 173
13.1.2 Séchage avec contrainte mécanique . . . 175
13.2 Suivi de la perte de poids des échantillons . . . 178
13.3 XANES au seuil du soufre . . . 178
13.3.1 Influence de l’oxygène et de l’humidité sur la composition en soufre. . . . 178
13.3.2 Étude de la cinétique d’oxydation des composés soufrés . . . 181
13.4 Discussion . . . 184
13.4.1 Entre tension mécanique et efflorescences . . . 184
13.4.2 Susceptibilité des sulfures et autres composés soufrés réduits . . . 185
13.4.3 Recherche de systèmes de séchage plus performants. . . 185
14 Conclusions et recommandations de séchage du bois lignitisé 187 14.1 Conclusions . . . 187
14.2 Recommandations . . . 188
IV-B/ Traitement par lavage
191
15 Influence des lavages sur le bois fossile 191 15.1 Évolution du bois au cours des lavages . . . 19115.1.1 Aspect visuel . . . 191
15.1.2 Conservation de la structure du bois . . . 193
15.1.3 Spectres IRTF du bois . . . 193
15.1.4 Composition élémentaire. . . 196
15.1.5 Évolution des composés soufrés . . . 197
15.2 Discussion . . . 200
15.2.1 Évolution de la composition chimique au cours des lavages. . . 200
15.2.2 Évolution de l’aspect du bois avec le lavage . . . 200
16 Étude de la composition des solutions de lavage 203 16.1 Résultats obtenus dans les solutions de lavage à l’eau stérile . . . 203
16.1.1 Aspect visuel des solutions . . . 203
16.1.2 Suivi physico-chimique des solutions . . . 204
16.1.3 Évolution de la composition élémentaire des solutions . . . 206
16.1.4 Composition ionique finale des solutions . . . 209
16.2 Discussion . . . 211
16.2.1 Rôle des ions dans l’évolution du système . . . 211
16.2.2 Modélisation simple et complète des solutions de lavage . . . 213
16.3 Résultats obtenus dans les solutions de lavage au peroxyde d’hydrogène à 1% . . 219
16.3.1 Aspect visuel des solutions . . . 219
16.3.2 Analyse des dépôts formés. . . 220
16.3.3 Suivi physico-chimique des solutions . . . 224
16.3.4 Évolution de la composition élémentaire des solutions . . . 226
16.3.5 Composition ionique finale des solutions . . . 229
16.4 Discussion . . . 231
16.4.1 Rôle des ions dans l’évolution du système . . . 231
16.4.2 Modélisation incomplète du système . . . 233
17 Conclusions et recommandations sur le lavage du bois lignitisé 237 17.1 Conclusions . . . 237
V
Conclusions générales et perspectives
239
Conclusions générales
241
Perspectives
245
Bibliographie 249VI
Annexes
259
Compléments d’expériences 261Compléments d’informations sur quelques techniques analytiques 269
Chapitre 1
Problématique
La conservation et la préservation des collections d’histoire naturelle constituent un défi récent dans le monde de la conservation du patrimoine culturel : présence d’arsenic ou de chlorure de mercure dans les collections de taxidermie, substitution du formaldéhyde dans les collections stockées en liquides, dangerosité des traitements contre les insectes (parabichlorobenzène)... sont autant de préoccupations remises au goût du jour depuis le milieu des années 80 [2,3,4]. S’il est un problème connu et récurrent dans les collections de paléontologie, c’est celui de l’oxydation de la pyrite. Dès l’Antiquité, le grec Théophraste (372/287 av J.C.) dit de la pyrite "qu’il n’y a point de pierre qui se mettent plutôt en pièces que la pyrite quand elle a été exposée quelques temps à l’air" [5].
Étudiées et agrandies depuis la création du Muséum National d’Histoire Naturelle en 1793, les collections de paléontologie du Muséum National d’Histoire Naturelle de Paris (France) ren-ferment en leur sein des centaines de spécimens dits pyriteux qui n’échappent pas à la règle.
Capables de se maintenir en bon état pendant des millions d’années sous terre, ces fossiles sont cependant sujets à oxydation dès leur sortie de terre. Néanmoins, si le mécanisme d’oxydation de la pyrite pure est étudié depuis une vingtaine d’années [6, 7, 8, 9], il n’en est pas de même lorsque la pyrite est associée à d’autres minéraux. Aussi reste t-il de nombreuses zones d’ombre dans le cas des collections de paléontologie, où le mécanisme est rendu d’autant plus complexe par la présence d’autres composés, minéraux et organiques, constituant le fossile et l’encaissant. Cette oxydation provoque des dégradations telles que des efflorescences, des effritements, des craquelures, etc, fragilisant la structure jusqu’à parfois "émietter" les fossiles, qui perdent toute tenue physique. De plus, une dégradation de l’environnement proche (tiroirs, fossiles, étiquettes) est également observée [10].
Obtenir des moyens de conservation a alors été la préoccupation de nombreux ateliers de préparation de paléontologie. Ont ainsi été proposées des traitements préventifs (isolation des spécimens, conditionnement sous atmosphère contrôlée) mais également curatifs (traitement à l’ammoniac [11], imprégnation par des résines [11], neutralisation des produits acides [12]). Néan-moins, les effets secondaires, l’efficacité à long terme ou bien les seuils minimum à respecter sont autant de données très peu documentées.
C’est dans ce contexte que s’inscrit le travail mené ces trois dernières années, avec des objectifs concernant à la fois la compréhension des phénomènes de dégradation et le développement de traitements de conservation.
Chapitre 2
De la pyrite
2.1 Entre pyrite et "or des fous", histoire d’une
dénomina-tion
Bien qu’étant définie par le baron d’Holbach [13] comme étant le minéral le "plus universel-lement répandu dans la nature" et "la mine la plus ordinaire et la plus abondante du soufre", la pyrite (FeS2) est un minéral dont les mentions doivent être considérées avec prudence car, selon les époques, le terme pyrite a englobé des minéraux plus ou moins bien déterminés.
Son nom proviendrait du grec pyros, le feu, en référence soit au soufre, élément inflammable qu’elle contient, soit aux étincelles qu’elle produit lorsqu’on la frappe. La première mention qui y est faite remonte à la Grèce Antique, où le philosophe Théophraste (3ème siècle avant J.C) la mentionne dans son ouvrage Traité des pierres (Περι Λιθωυ)[5]. Est alors regroupé sous ce terme et pendant des siècles, un vaste ensemble de sulfures à reflets métalliques (chalcopyrite, arsénopyrite, pyrrhotite...). Ces mêmes minéraux seront dénommés par les arabes via le terme marqachita (marcassite) [14, 15]. En Europe, à partir du 18ème siècle, on sait que pyrite et marcassite (illustrés Figure2.1) sont de "composition interne identique" [13] mais on distingue l’utilisation de ces deux termes, marcassite étant utilisé pour désigner des pyrites bien cristallisées et anguleuses [13,16], à l’inverse de ce qui se fait aujourd’hui.
Pour essayer de distinguer ces minéraux, des tentatives de classifications ont été successive-ment effectuées aussi bien en fonction de
– l’aspect extérieur,
– la composition élémentaire, – la couleur.
A titre d’exemple, Agricola distinguait en 1556 les purites des purites argentis coloris [17] et deux siècles plus tard, Henckel (1725) les pyrites sulfureuses, arsénicales ou cuivreuses. A la même époque, le baron d’Holbach publie la première classification dans l’article pyrite de l’Enclyclopédie de Diderot et d’Alembert [13] (Table2.1). Quelques vingt ans plus tard, en 1773, Bernard Nicolas Bertrand complètera sa classification [18], dont une image est présentée Figure 2.2.
Table 2.1 – Classification des pyrites faite par le baron d’Holbach
Pyrite Remarques Synonyme
géométrie sphérique rondes, ovales, mamelonnées
anguleuse composée d’angles marcassite
couleur jaune d’or composée de Fe, S, ± Cu
jaune clair composée de Fe, S, très peu/pas Cu pyrite martiale
blanche composée de Fe, S, ± As pyrite arsénicale
usage sulfureuse dont on extrait le soufre
vitriolique donnant du vitriol
Figure 2.2 – Classification des pyrites, issue de Éléments d’oryctologie ou Distribution métho-dique des fossiles
A cette dénomination imprécise s’ajoute la ressemblance de la pyrite avec l’or, qui a longtemps préoccupé les savants et engendré de nombreuses notes à propos des traces d’or contenues dans les pyrites ; Agricola, en 1556, précise que l’on pouvait trouver de l’or dans les pyrites, quoique rarement en grande quantité [17] ce que confirme le baron d’Holbach en 1751 qui explique que "c’est accidentellement que ces métaux précieux se trouvent joints à la pyrite" [13]. De même, lorsqu’au 3ème siècle av J.C. Théophraste mentionne des pierres métalliques contenant de l’or et de l’argent, John Hill, dans sa traduction de 1754 [5], ajoute une note selon laquelle "il y a tant de différentes espèces de mines d’or et d’argent que l’on en trouve une variété presque infinie [...] [notamment], dans plusieurs des marcassites et pyrites ordinaires". Néanmoins, la confusion perdure et atteint son apogée lors de la ruée vers l’or, où on la baptise "or des fous" de par son effet sur les mineurs qui confondent les deux minéraux. Ainsi, en fut-il en Europe, lors de la découverte en 1878 des Iguanodons (reptiles terrestres) de Bernissart (province de Hainaut, Belgique ; Crétacé), où les mineurs prirent la pyrite cristallisée dans les os pour de l’or [19].
C’est grâce au minéralogiste René Just Haüy, en 1814, qu’on distingue enfin les deux poly-morphes (marcassite et pyrite), mettant un peu d’ordre dans la dénomination des sulfures [15]. Aujourd’hui, c’est par diffraction des rayons X ou bien par observation en lumière polarisée qu’on peut formellement identifier ces phases ; le tableau2.2récapitule certains sulfures de fer connus et leurs propriétés cristallines.
Table 2.2 – Sulfures de fer
DO (S) Nom Composés Formule Système cristallin
-II troilite FeIIS–II hexagonal keilite isométrique sulfure de mackinawite (Fe,Ni) II (1+x)S –II tétragonal
fer (II) avec x=0/0,07
pyrrhotite Fe II (1-x)S –II monoclinique avec x=0/0,171
sulfure de greigite FeIIFeIII2 S–II4 isométrique
fer (II) fer(III) pentlandite (Ni,Fe)0(Ni,Fe)II 8S
–II
8 isométrique
-I di-sulfure pyrite FeIIS–I2 cubique
de fer(II) marcassite orthorhombique
Ces usages anciens de la dénomination pyrite ont entraîné des confusions considérables en termes d’identification, de présence ou de réactivité des sulfures. Aujourd’hui encore, la simple observation de dégradations-types fait rentrer le matériau dans la catégorie "pyriteux" sans plus d’analyses. Une vigilance doit donc être de mise dans le cadre de collections muséales et des analyses systématiques devraient être proposées car de la nature précise du ou des sulfures de fer dépend sa réactivité en collection.
2.2 Présence et formation
Bien qu’également produite de façon hydrothermale, (c’est-à-dire à haute température via une eau riche en ions métalliques [20]), la pyrite rencontrée dans notre étude est produite de façon sédimentaire, c’est pourquoi nous allons uniquement nous focaliser sur celle-ci.
2.2.1
Présence sédimentaire
La pyrite est un acteur majeur du cycle géochimique du fer des domaines sédimentaires marin et continental. Dans le domaine marin, les 2 sources principales de fer sont [21] :
– côté continental : le fer apporté par les fleuves, issu de l’altération (précipite sous forme d’oxy-hydroxydes de fer : goethite, magnétite)
– côté océan : le fer juvénile libéré à partir des rides océaniques (fractures tectoniques). Ce fer va ensuite être mobilisé lors de la formation de pyrite, induite par la présence de matière organique. Celle-ci est en effet à la fois la source de l’un des éléments constituant (le soufre) et la cause de la constitution d’un micro-environnement semi-confiné réducteur, nécessaire à la formation de la pyrite. Celle-ci peut alors avoir lieu sur tout le plancher océanique, à la surface du sédiment, où se rencontrent les restes organiques issus de la colonne d’eau marine et le fer.
Néanmoins, dans le domaine marin, le soufre peut également être présent sous forme de sulfates et sa réduction par des bactéries nécessite des conditions anoxiques. C’est alors plus en profondeur que se forme la pyrite [22]. Dans tous les cas, cela conduit à l’association de la fossilisation et de la genèse de la pyrite.
Sur le continent, dans les fleuves ou les étendues d’eau, le fer est présent dans les argiles, sous forme colloïdale (complexes organiques tels les humates) ou dissoute (ions). Néanmoins, les teneurs en sulfates sont, elles, beaucoup moins fortes qu’en milieu marin [22] d’où une plus faible abondance des fossiles pyritisés.
2.2.2
Genèse de la pyrite sédimentaire
La pyrite est un minéral authigénique (cristallisation in situ) sédimentaire dont la formation est relativement bien connue. Nous reportons ici une synthèse des différents travaux de Berner, qui a abondamment étudié la pyrite [22,23,24,25].
De façon générale, la production de pyrite sédimentaire se fait dans des micro-environnements semi-confinés, par réduction sulfato-bactérienne dans des milieux ni trop acides ni trop réducteurs [26,27], donnant naissance à la pyrite dite framboïdale.
Selon Berner, la matière organique, les sulfates ou les minéraux réactifs riches en fer vont constituer les facteurs limitants de la formation de la pyrite. Ils constituent en effet les trois composants indispensables à la formation de la pyrite, comme illustré sur la Figure2.3.
La réaction notée (1) sur la Figure2.3se fait en environnement anoxique grâce à des bactéries sulfato-réductrices qui réduisent les sulfates en utilisant la matière organique comme accepteur d’électrons. Le soufre est alors réduit, passant d’un degré d’oxydation +VI (sulfates) à -II (sulfure d’hydrogène). Cette réaction se modélise sous la forme [28] :
(1) 2 CH2O + SO42–−−→ H2S + 2 HCO3–
où CH2O est une modélisation stœchiométrique de la matière organique. Dans le cas de sédiments
pauvres en sulfates (eaux douces par exemple), la production d’H2S peut se faire directement par la décomposition de composés organiques soufrés (Berner cite ainsi les protéines [23]) mais de façon limitée et minoritaire. L’anoxie est généralement obtenue grâce à la matière organique, qui en plus d’être un réactif, agit comme barrière contre l’oxygène. La diffusion moléculaire des vagues et du courant ou la bioturbation peuvent venir perturber légèrement cette anoxie
Figure 2.3 – Formation sédimentaire de la pyrite, repris de Berner, 1983 [22]. Les flèches en violet représentent les réactions mettant en jeu l’action de bactéries
mais les apports d’O2 induits sont toutefois compensés par l’action de bactéries oxiques, qui le consomment en rejetant du CO2.
D’après Berner, le sulfure d’hydrogène va ensuite réagir avec le fer contenu dans des minéraux ferreux (biotite, amphiboles, pyroxènes) [22], selon la réaction :
(2) Fe2++ H2S −−→ FeS + 2 H+.
Bang propose la même réaction mais à partir cette fois d’ions ferreux déjà présents en milieu aqueux [29]. Berner note également que les oxydes ferriques hydratés (goethite, hématite [24]) sont plus réactifs que les minéraux ferreux, sans toutefois proposer de réaction. Schopf penche pour des hydroxydes ferriques issus de bactéries [30]. La quantité et la réactivité du fer disponible sont alors des facteurs déterminants dans la production des sulfures de fer.
De la réaction (2) est alors produit un monosulfure de fer (FeS), dont l’évolution divise les chercheurs (Table 2.3)2. Les conditions de température et les réactifs soufrés semblent être à l’origine des différents sulfures de fer formés. Ainsi, la réaction (3) conduisant à la formation de la pyrite, pourrait se produire selon [25,31] :
(3.a) 2 H2S + O2−−→ 2 S0+ 2 H2O
puis FeS + S0−−→ FeS2
ou (3.b) FeS + H2S −−→ FeS2+ 2 H++ 2 e–,
En considérant que les ions H+peuvent être réduits en dihydrogène, cette réaction s’écrit aussi : (3.b’) FeS + H2S −−→ FeS2+ H2
D’autres réactions sont thermodynamiquement possibles et tiennent compte des spécificités du contexte sédimentaire :
en milieu sulfaté :
(3.d) FeS + 3 H2S + SO42–+ 2 H+−−→ FeS2+ 3 S0+ 4 H2O en milieu calcaire :
(3.e) 4 FeS + 4 H2S + HCO3–+ H+−−→ 4 FeS2+ CH4+ 3 H2O en milieu azoté :
(3.f) 3 FeS + 3 H2S + N2−−→ 3 FeS2+ 2 NH3
2. Allen et Bourdoiseau et al. ne traitent pas de la formation de sulfure de fer en contexte géologique mais discutent de l’évolution du sulfure initial, en contexte expérimental de laboratoire.
Les propositions (3.a) et (3.b) sont notamment soutenues par Berner et Sweeney [25,32] qui ont expérimentalement synthétisé de la pyrite framboïdale à partir de soufre de degré d’oxydation 0 ou du disulfure d’hydrogène et d’un monosulfure de fer.
Table 2.3 – Évolution des sulfures
FeS sulfure initial évolution
Allen,1912 [31] pyrrhotite pyrite
Sweeney,1973 [32] FeS amorphe et pyrrhotite puis greigite puis pyrite et mackinawite
Bourdoiseau mackinawite FeIII-mackinawite puis greigite en milieu
et al., 2011 [33] atmosphérique, ambiant
FeIII-mackinawite puis greigite + pyrite en milieu acide, anoxique, à 80˚C
2.2.3
Pyrite et collections patrimoniales
Cas des fossilesLa bonne préservation de certains spécimens lors de leur fossilisation -notamment structurelle-est due à une rapide minéralisation, qui peut advenir entre autres, par phosphatisation (apatite notamment), calcitisation ou encore pyritisation [28] , celle-ci permettant une fossilisation de très bonne qualité, voire exceptionnelle (cas des tissus mous).
Chez les végétaux, Rickard et al. soulignent que la cristallisation de la pyrite au sein des cellules leur permet de résister aux déformations dues à l’enfouissement, à l’action microbienne ou aux lyses car elles sont renforcées par leur remplissage pyriteux. Ils précisent également que ceci est rendu possible par la rapidité de la réaction (quelques semaines à quelques mois) [34].
Chez les animaux, la pyrite peut également remplir ou doubler des cavités (dans des os par exemple) mais aussi remplacer les parties dures calcitiques, telles les coquilles (Figure2.4). Dans le premier cas (remplissage), la pyrite a envahi les cavités naturelles du reste organique dans le sédiment, créant un moulage interne des squelettes. Ce cas, le plus fréquent, intervient typiquement avec les ammonites. Dans des circonstances exceptionnelles, la pyrite peut également former des stalactites au sein de leurs loges [27]. Dans le deuxième cas (remplacement), la pyrite s’est substituée au squelette, aboutissant parfois à un fossile très précis de la coquille, révélateur de détails morphologiques. Enfin, phénomène plus rare, la forme des tissus mous, généralement détruits en premier, peut également être conservée grâce à sa pyritisation, comme c’est le cas des trilobites de Beecher’s Bed, dans l’état de New York [35]. Dans ce dernier cas, seule une minéralisation authigénique très précoce peut permettre de la conserver, par remplissage ou remplacement. La rareté de ce type de préservation est une illustration de la difficulté d’obtention de la bonne chronologie et des conditions adéquates à la pyritisation.
Cas des épaves
Des cristallisations de pyrite à des temps récents peuvent également avoir lieu, comme dans le cas des épaves de vaisseaux [20].
En 2008, Fors et al. [36] ont essayé de reconstituer le processus de cristallisation de la pyrite sur des épaves, tel que cela a pu se produire pour les vaisseaux Mary Rose (Angleterre, 1545) et Vasa (Suède, 1628) notamment. Pour cela, ils ont immergé des blocs de pin frais dans une
Figure 2.4 – (a) Coquille de bivalve partiellement pyritisée (Jurassique Inférieur, North York-shire Coast, UK) (b) Remplissage des chambres d’une ammonite (coupe sagittale d’une Kosmo-ceras, Jurassique Moyen, Mikhailov, Russie) (c) Trilobite dont la forme des parties molles a été partiellement pyritisée (Triarthus catoni, Ordovicien, Taconic Foreland Basin, USA).
solution contenant des sulfates et du FeIIavec une association bactérienne constituée de bactéries d’érosion et sulfato-réductrices. Ils ont démontré qu’après quatre ans d’immersion en conditions anaérobiques, le bois comportait des sulfures, notamment de la pyrrhotite (Fe(1-x)S). Selon eux, les bactéries d’érosion s’attaquent aux zones riches en lignine, présentant du soufre organique (thiols notamment), lesquelles zones sont ensuite attaquées par les bactéries sulfato-réductrices conduisant à la formation du sulfure de fer.
De façon générale, on peut souligner que malgré leur nature différente, bois et fossiles pyriteux sont formés via des processus identiques (production d’H2S par réaction entre matière organique et sulfates puis réaction d’H2S avec Fe2+) et sont donc susceptibles d’évoluer de la même manière.
2.3 Mécanismes d’oxydation
Bien qu’exceptionnellement, certains cristaux, tels ceux des gisements de l’île d’Elbe, soient reconnus pour être stables, la pyrite est perçue comme un minéral particulièrement réactif. Son oxydation aboutit à une grande diversité de produits finaux (sulfates, oxydes ou hydroxydes [37,38]), reflétant ainsi la complexité des mécanismes conduisant à la production d’efflorescences. Les équations bilans proposées dans la littérature font notamment intervenir l’eau et l’oxygène
dans des proportions différentes pour expliquer la multitude des produits soufrés [39, 40]3 : – sulfates : (4) FeS2+72O2+ H2O −−→ Fe 2++ 2H++ 2SO 4 2– – thiosulfates : (5) FeS2+32O2−−→ Fe 2++ S 2O3 2– – dithionates : (6) FeS2+74O2+ H + −−→ Fe2++1 2S4O6 2–+1 2H2O
– soufre natif : (7) FeS2+ 2Fe 3+
−−→ 3Fe2++ 2 S0 – ...
Les mécanismes, quant à eux, ne sont que partiellement élucidés et trois modes d’oxydation sont actuellement proposés, à savoir : oxydation chimique en milieu atmosphérique, oxydation électrochimique et oxydation biologique. Sans qu’aucun mécanisme ne se dessine comme pré-dominant, le rapport pyrite/eau a été proposé comme critère par Smith et Shumate [41] pour distinguer un mécanisme bactérien d’un mécanisme chimique. En effet, les bactéries mises en cause ayant besoin d’eau pour leur métabolisme, ils suggèrent qu’un ratio pyrite/eau fort pri-verait les bactéries de l’eau nécessaire à leur fonctionnement, privilégiant ainsi un mécanisme chimique. Au contraire, un ratio faible (<400 g de pyrite pour un litre d’eau) privilégierait l’activité des bactéries.
2.3.1
Mécanisme chimique en milieu atmosphérique humide
En milieu atmosphérique humide, tel qu’en collection par exemple, l’oxygène de l’air et la vapeur d’eau sont en compétition pour s’adsorber sur les sites actifs de la pyrite [42], formant des liaisons Fe3+-O–. Des études de surface, menées par UPS, ont montré que leur association oxyde la surface de façon plus intense qu’un équivalent, en concentration molaire, composé uniquement de dioxygène [43].
Concernant le mécanisme, des calculs théoriques ont montré que dans le cas de O2, la liaison Fe3+-O–se faisait par chimisorption dissociative, donnant directement lieu à deux liaisons (Figure 2.5). Dans le cas de l’eau, la molécule s’adsorbe par l’atome d’oxygène et ne se dissocie qu’en présence d’une molécule de dioxygène dissociée proche [43].
Figure 2.5 – Chimisorption dissociative du dioxygène sur une surface de pyrite (100). Bleu = fer ; jaune = soufre ; rouge = oxygène.
3. Tous les produits mentionnés dans ce paragraphe ont été prouvées expérimentalement comme produits de l’oxydation de la pyrite.
Une étude expérimentale menée sur de la pyrite broyée a montré que l’action successive de l’eau et du dioxygène produisait des sulfates et des hydroxydes [42]. Néanmoins, l’ordre dans lequel interviennent ces deux réactifs a un rôle sur la quantité des deux familles de produits ainsi que sur la provenance de l’oxygène des sulfates. Un marquage isotopique a ainsi permis de démontrer que lorsque l’eau s’adsorbe en premier, c’est de cette molécule que provient l’oxygène des sulfates alors que si c’est le dioxygène, l’oxygène des sulfates provient des deux réactifs [42].
2.3.2
Mécanisme électrochimique
Le mécanisme électrochimique a été décrit comme un processus se déroulant en trois étapes, et ce, aussi bien en laboratoire qu’en milieu naturel [44]. Ce processus oxyde dans une première étape la pyrite par adsorption d’O2(réaction (8)) puis les ions ferreux (réaction (9)), tandis que la troisième étape est une oxydation de la pyrite par les ions ferriques (réaction (10)). Ces deux dernières réactions (modélisées respectivement en violet et en rouge Figure 2.6) créent un cycle d’oxydation continu, emballant la réaction une fois amorcée, d’où le rôle de catalyseur du couple Fe2+/Fe3+.
Figure 2.6 – Schématisation de l’oxydation chimique de la pyrite (dans un contexte de drainage minier acide). D’après Singer, 1970 et Lowson, 1982 [44,45].
Les réactions sont résumées par les équations-bilans suivantes : (8) FeS2+72O2+ H2O −−→ Fe2++ 2H++ 2SO42–
(9) Fe2++14O2+ H+−−→ Fe3++1 2H2O
(10) FeS2+ 14 Fe3++ 8 H2O −−→ 15Fe2++ 16H++ 2SO42–
Bien que reflétant la réaction générale, ces équations ne donnent aucune indication quant au développement des composés intermédiaires et au processus de formation. Une approche électrochimique, développée dans les travaux de Chandra [9] et Rimstidt [46], permet de pallier à ces manques, en proposant un processus en trois étapes :
– une réaction anodique (réaction (11))
La pyrite y cède par étapes successives des électrons ; lorsqu’elle s’oxyde en sulfates, ce sont sept électrons qui vont être donnés, le soufre passant du degré d’oxydation -I à +VI. – un transfert d’électrons
Grâce aux propriétés semi-conductrices de la pyrite, les électrons produits dans un site anodique vont pouvoir être transférés à travers le cristal vers un site cathodique.
– une réaction cathodique (réaction (12))
Sur ce site, des accepteurs d’électrons, le plus souvent Fe3+ou O2vont être réduits en Fe2+ ou H2O, contre-balançant les sulfates produits à l’anode.
A l’anode, les étapes élémentaires menant à la production d’électrons sont les suivantes :
(11.a) py−S−S −−→ py−S−S++ e–
(11.c) py−S−S−OH −−→ py−S−SO + H++ e–
(11.d) py−S−SO + H2O −−→ py−S−SO2+ 2 H++ 2 e–
(11.e) py−S−SO2+ H2O −−→ py−S−SO3+ 2 H++ 2 e–
(11.f) py−S−SO3−−→ py−S−S+O3+ e–
(11.g) py−S−S+O3+ H2O −−→ py−S++ SO42–+ 2 H+4
Au total, l’oxydation d’un soufre de FeS2aura bien produit un anion SO42–et huit protons, le tout nécessitant 4 molécules d’eau. Ces proportions sont celles que l’on retrouve dans la réaction (2). De plus, sept électrons auront bien été fournis pour aboutir à la formation d’un anion SO42–. Ces électrons sont ensuite transférés et arrivent sur un site cathodique où ils sont consommés. Dans le cas d’un oxydant Fe3+, les électrons sont consommés un par un et permettent la réduction de Fe3+(H2O)6 en Fe2+(H2O)6. Dans le cas d’un oxydant O2, après adsorption d’une molécule d’O2, les électrons consommés vont conduire à la formation de deux hydroxydes selon les étapes élémentaires décrites ci-dessous :
(12.a) py−Fe2+· · · O2−−→ py−Fe3+· · · O2– (12.b) py−Fe3+· · · O2 – −−→ py−Fe2+· · · H2O (12.c) py−Fe2+· · · H2O −−→ py−Fe 3+ · · · H2O – (12.d) py−Fe3+· · · H2O – −−→ py−Fe2+· · · H2O25
(12.e) py−Fe2+· · · H2O2−−→ py−Fe3+· · · OH·+ OH–
(12.f) py−Fe3+· · · OH·−−→ py−Fe2+· · · OH·
(12.g) py−Fe2+· · · OH·−−→ py−Fe3++ OH–
(12.h) py−Fe3+−−→ py−Fe2+6
Néanmoins, le milieu réactionnel étant acide, la production d’ions hydroxydes est probable-ment neutralisée par les ions Fe3+, H+, ... Il faut également souligner que cette réaction catho-dique est probablement la réaction cinétiquement déterminante, car dépendante de la concentra-tion en oxydant (Fe3+ou O2) [48, 49].
2.3.3
Mécanisme biologique
Selon Rixon, un mode d’oxydation de la pyrite d’origine "animale" a été évoquée dès 1929 par Radley qui parlait d’origine microbienne et non bactérienne [11] comme c’est le cas aujourd’hui. La nature des microorganismes impliqués dans ce mécanisme d’oxydation peut être assez va-riée, aussi bien pour les bactéries (Thiobacillus, Ferrobacillus, Sulfobacillus) que pour les archea [50,51]. Néanmoins, la plupart des études expérimentales se focalisent sur les Thiobacillus fer-rooxidans, capables notamment de dégrader la pyrite par oxydation du fer ferreux en fer ferrique (études réalisées en milieu acide)[52,53,54]. Par ailleurs, d’autres études expérimentales menées en laboratoire sur les Thiobacillus thioooxidans ont démontré que ces dernières sont incapables d’oxyder seules la pyrite mais accélèrent l’activité de Thiobacillus ferrooxidans [55].
De façon générale, ce mode d’oxydation exige des conditions de pH comprises entre 2 et 4,5, les bactéries sus-nommées étant inactives en dehors de ces valeurs. A noter cependant que les publications citées ci-dessus font références à des systèmes expérimentaux, où les environnements sont ceux propices à la culture des bactéries étudiées et non forcément corrélés au milieu réel. De même, la pyrite étudiée est pure (>98 %) et souvent broyée.
4. A noter que cette dernière réaction se produit à pH faible. A pH haut, des thiosulfates pourraient être formés selon : py−S−SO3 −−→ py2++ S
2O3
2–voire, dans le cas de bases faibles, aboutir au complexe : py−S−SO
3+
M2+ −−→ py2++ MS
2O3. Néanmoins, leur production reste incertaine, et plus encore dans le cas où Fe3+est
l’oxydant.
5. La production de peroxyde d’hydrogène a été attestée par Schoonen [47]. 6. La notation · · · indique une liaison de type adsorption.
Deux mécanismes sont envisagés [56]. Un premier mécanisme, dit "indirect", associe l’action de ces bactéries à des réactions purement chimiques. Ainsi, la réaction d’oxydation du FeII en FeIII (réaction (9)) est cette fois-ci provoquée par les Thiobacillus ferrooxidans, tout comme l’oxydation du soufre élémentaire (réaction (13)) produit par la réaction (7). Cette oxydation du soufre peut également advenir par l’action des Thiobacillus thioooxidans.
(13) 2S0+ O2+ 2 H2O −−→ 4H++ 2SO42–
Le second mécanisme, dit "direct" celui-là, met en jeu le même type de bactéries, lesquelles interviennent cette fois en produisant un "agent biologique" responsable de l’oxydation, dont la nature n’a cependant pas été déterminée (cystéine, phospholipides...) [56].
2.4 Paramètres d’altération
Les paramètres potentiellement responsables de la dégradation de la pyrite sont nombreux, allant aussi bien de sa cristallinité à l’environnement dans lequel elle est stockée. A noter qu’en fonction du mécanisme envisagé, les paramètres à prendre en compte ne se classent pas dans le même ordre et n’agissent pas toujours dans le même sens. Une revue rapide des connaissances générales existantes est donc proposée ci-après.
2.4.1
Surface exposée
Le paramètre intrinsèque le plus fréquemment cité dans la littérature à propos de la réactivité des pyrites est la surface de réaction exposée. La distribution en taille des cristaux et leur mor-phologie vont en effet engendrer des surfaces de réaction différentes et donc modifier la quantité de composés oxygénés potentiellement en contact avec les sites actifs du minéral [20,57]. Ainsi, Pugh note un accroissement de la vitesse d’oxydation par un facteur 1,5 lors du doublement de la surface de réaction [58]. Ce paramètre serait donc selon Smith et Shumate [41] le facteur majori-taire influençant la réactivité de la pyrite. Newman relate cependant une étude de Caruccio selon laquelle une pyrite à gros grains réduite en particules de 0,5 µm ne montre aucune altération après 3 semaines, d’où il en conclut que la taille des particules seule ne suffit pas à expliquer l’altération [59].
Intervient alors la notion de pyrite framboïdale, évoquée comme variété plus instable que la forme massive [15]. Définie par Ohfuji et Rickard comme un amas de "clusters microscopiques sub-sphéroïdaux composés de microcristaux équidimensionnels (usuellement < 2µm) et équimor-phiques (cube ou octaèdre)" [60], cette morphologie est supposée réactive à cause de la grande surface exposée mais également de sa porosité importante [61]. Parallèlement, la cristallinité et la pureté chimique des cristaux sont des facteurs importants à prendre en compte.
2.4.2
Impuretés chimiques
L’incorporation d’éléments sous forme de traces pouvant varier aléatoirement, ce facteur a été considéré comme pouvant expliquer l’imprévisibilité de la pyrite à se dégrader. Deux effets différents, induits par l’incorporation d’impuretés chimiques lors de la cristallisation de la pyrite, pourraient ainsi agir sur sa réactivité.
• Réseau cristallin. Chaque élément chimique possédant son propre diamètre, une incorporation de nouveaux éléments modifie la structure cristalline et notamment les espaces atomiques du réseau, changeant ainsi les propriétés du minéral et par conséquent sa réactivité.
• Conductivité. Dans le cas de mécanisme de type électrochimique, une relation entre réactivité des pyrites et éléments présents à l’état de traces pourrait être envisagée via le rôle de ces derniers dans la conductivité de la pyrite [9,46]. Pouvant opérer en tant que semi-conducteur de type p
(déficient en e–) et n (excédent en e–) au sein du même minéral, les impuretés agiraient comme
sites actifs lors de l’oxydation cathodique [20].
Cette hypothèse est par exemple avancée pour expliquer la stabilité des cristaux formés à l’île d’Elbe ou au Brésil, de composition chimique très pure. L’arsenic, lui, a été à plusieurs reprises cité comme source de déstabilisation [16,62,63].
Néanmoins, Fellowes a relevé dans la littérature de nombreuses contradictions concernant le rôle précis des éléments [20]. Celles-ci ont donc conduit certains auteurs a finalement conclure que les éléments traces n’étaient pas un facteur majoritaire [41].
2.4.3
Eau
L’eau est répertoriée comme l’un des facteurs de dégradation les plus importants [41,64]. En effet, celle-ci intervient dans tous les processus chimiques mentionnés plus haut, mais a également un rôle plus concret dans l’augmentation significative de la vitesse d’oxydation de la pyrite. Waller calcule par exemple sur des expériences menées en laboratoire qu’une augmentation de 26% d’humidité relative double la vitesse d’oxydation [64].
Si elle est généralement évoquée sous forme aqueuse, l’eau peut également intervenir en milieu atmosphérique humide sous forme de gaz, où, par pénétration dans le réseau poreux de la pyrite, elle se condense au cœur du matériau et mène à des dégradations internes. A la surface de la pyrite, son adsorption en mono ou multi couches est décrite par Howie, qui distingue plusieurs étapes selon la concentration en eau, définie par l’humidité relative (HR) [15].
– Jusqu’à 30 % HR, l’eau s’adsorbe sous forme de monocouche ;
– entre 30 et 60 % HR, des multicouches se forment et l’eau adsorbée permet pratiquement des réactions d’oxydation aqueuses. Cette oxydation conduit à des sulfates de FeII, génèrant une expansion de volume [64], et à la formation d’une couche de passivation (oxyhydroxydes) qui permet de ralentir la dégradation ;
– au-dessus de 60 % HR enfin, il y a absorption par le spécimen de l’humidité et introduction de l’eau dans le réseau poreux interne.
A noter qu’à des humidités supérieures, la couche de passivation créée peut être dissoute et la solubilisation des composés dés-inhibe alors la réaction d’oxydation [41,64,59,65], à l’instar d’une oxydation purement aqueuse.
2.4.4
Oxygène
Autre facteur-clé, l’oxygène est, on l’a vu, l’oxydant général responsable de la dégradation de la pyrite. Ainsi, après exposition à l’air libre d’un échantillon de pyrite broyé, un confinement sous diazote a provoqué la chute de sa vitesse d’oxydation [41]. Les mêmes auteurs ont également démontré la dépendance en dioxygène de la vitesse d’oxydation pour des concentrations très faibles (jusqu’à 0,01 %, voir Figure2.7).
Au vu de la courbe, on peut supposer l’existence d’une asymptote horizontale, fixant un seuil à partir duquel la vitesse reste inchangée. Cela est confirmé par Hammack qui démontre (dans le cas d’un mécanisme chimique, en absence de bactéries, à température ambiante et 88 % HR) que la dépendance n’est valable que jusqu’à 10 % d’oxygène [66], soit moitié moins que la quantité usuelle de l’air (20,8 %).
2.4.5
Autres paramètres
Comparés aux facteurs précédemment évoqués, les causes de dégradation évoquées dans ce paragraphe apparaissent comme minoritaires à négligeables dans le cadre de collections muséales. Nous en faisons néanmoins un bref survol.
Figure 2.7 – Influence de la concentration en oxygène sur la vitesse d’oxydation de grains (diamètre 0,15/0,2 mm) de pyrite (pureté : 85%), en phase aqueuse. D’après Smith et Shumate [41]
Température
L’influence de la température sur la vitesse d’oxydation a beaucoup été discutée, néanmoins, la seule étude, à notre connaissance, où nous disposons des résultats expérimentaux est celle de Smith et Shumate, dont nous reproduisons Figure 2.8 le graphique présentant leurs résultats. Ceux-ci tendent à prouver qu’une température croissante augmente la vitesse d’oxydation, et ce, en obéissant à l’un des postulats de la loi d’Arrhénius.
Celle-ci décrit la variation de la vitesse de réaction en fonction de la température et s’écrit : k = Ae−Ea/RT
avec : k : la constante de vitesse A : le facteur de fréquence7
Ea : l’énergie d’activation en J · mol–1
R : la constante des gaz parfaits (8,314 J · mol–1· K–1) T : la température, en K
Selon cette loi, en considérant une HR constante, une température proche de 25˚C et des énergies d’activation d’environ 50-60 kJ·mol–1(condition réaliste puisque dans le cas de la pyrite, Lowson liste des valeurs variant de 40 à 60 kJ · mol–1[45]), la vitesse d’oxydation double quand la température augmente de 10˚C.
Plusieurs auteurs se font l’écho de ce fait marquant [20, 64], mais seule l’étude de Smith et Shumate vient corroborer expérimentalement cette affirmation. L’application de la loi d’Arrhé-nius ne fait ainsi pas l’unanimité et Schoonen et al., tout en reconnaissant l’influence catalytique
7. k et A ont la même unité, dépendante de l’ordre de la réaction. Si cet ordre est de (m+n), l’unité se note
Figure 2.8 – Influence de la température sur la vitesse d’oxydation de grains (diamètre 0,15/0,2 mm) de pyrite (pureté : 85%). D’après Smith et Shumate [41]
de la température, la réfutent à cause des différents chemins réactionnels possibles et donc des différentes énergies d’activation (Ea) possibles [67].
pH
Les valeurs du pH n’ont de signification qu’en milieu aqueux, aussi ce paramètre n’intervient-il pas dans le cadre de collections muséales.
De plus, les résultats concernant le pH sont très variables d’un auteur à l’autre, comme en témoigne le tableau 2.4et les relèves faites par Lowson [45] ; cette divergence de résultats reste à ce jour encore incomprise.
Table 2.4 – Effet du pH sur la vitesse d’oxydation de la pyrite
Selon pH effet sur la vitesse d’oxydation
Smith and shumate, 1970 [41] 1-10 augmentation
Nordstrom,1982 [68] < 3 pas d’effet
Mc kibbens and barnes,1986 [39] 1-4 peu d’effet
Howie, 1992 [15] > 7 diminution (passivation)
Ciminelli and Osseo-Asare, 1995 [69] 1,5-12,5 augmentation
Lumière
La pyrite est un semi-conducteur de faible gap de bande (entre 0,9 et 1,2 eV à 27 ˚C [45]) ; celui-ci pourrait donc être théoriquement franchi avec l’énergie de lumière visible8. La migration
8. D’après la relation E = hc/λ, cela correspond à des longueurs d’onde nécessaires inférieures à 1050 nm, ce qui est le cas de la lumière visible.
d’électrons de la bande de valence vers la bande de conduction créerait alors des trous (chargés positivement) pouvant s’oxyder en acceptant des électrons de la partie anodique de la pyrite. Néanmoins, Schoonen et al., qui ont comparé l’oxydation de spécimens exposés ou abrités de la lumière visible, attribuent plus le changement de vitesse d’oxydation observé à un éventuel échauffement produit par la lumière qu’à l’effet lumineux lui-même [67].
Bactérie post-formation
Smith et Shumate ont démontré dès 1970 [41] que Thiobacillus ferrooxidans et T. thiooxidans étaient capables d’accroître la vitesse d’oxydation de la pyrite. Néanmoins, Howie [57] évoque quelques années plus tard différentes raisons qui, selon lui, mettent les bactéries hors de cause dans le cadre de musées, à savoir :
– l’inefficacité des traitements bactéricides à ralentir l’oxydation, – la dégradation d’un matériel préalablement stérilisé,
– l’incapacité de Thiobacillus ferrooxidans à produire des sulfates dans les proportions expé-rimentalement observées,
– l’incapacité de Thiobacillus thiooxidans à oxyder seule la pyrite.
A noter également que les trois autres paramètres vu dans ce paragraphe ont des valeurs spécifiques pour les bactéries : les conditions optimales de prolifération sont généralement des températures ambiantes et des pH acides (<4,5). Enfin, si elles sont de sensibilité différente à la lumière, celles impliquées dans notre étude sont détruites par les rayons UV-C.
Chapitre 3
Du système {fossile/pyrite}
3.1 Erreurs de diagnostic
Qu’ils soient recherchés pour leur intérêt paléontologique ou esthétique, les fossiles pyriteux doivent leur nom à la pyrite qu’ils renferment. Pourtant, la reconnaissance d’un fossile pyriteux est parfois hasardeuse et deux cas peuvent se présenter. Dans le cas des fossiles où le sulfure est de taille macroscopique, la qualification de pyriteux est généralement juste. Le second cas concerne les fossiles pour lesquels la pyrite est invisible à l’œil nu, mais qui présentent des altérations. Leur dénomination est alors due à l’observation d’efflorescences "typiques" de l’oxydation de la pyrite. Nous ont ainsi été présentés des fossiles dits pyriteux car montrant des altérations d’aspect visuel similaire aux sulfates de fer, phases cristallines caractéristiques de l’altération de la pyrite. Après analyse des efflorescences, il s’est révélé que le premier exhibait des sulfates de magnésium et non de fer (Figure3.1b), mettant la pyrite hors de cause, tandis que le second avait simplement été saupoudré de talc pour améliorer le rendu du relief lors d’une prise photographique (Figure 3.1a). Ces anecdotes illustrent de façon concrète les a priori dont les fossiles pyriteux font l’objet.
Figure 3.1 – Fossiles qualifiés de pyriteux, présentant (a) des résidus de talc (spécimen figuré MNHN.F.R01409, Ammonites communis, Toarcien moyen, Whitby, UK) et (b) des sulfates de magnésium (spécimen référencé B dans Rouchon et al., 2012 [70], Callipteridium costei, Carbo-nifère, Montceau-les-Mines, France). Aucune trace de pyrite ou de sulfate de fer n’a été détectée sur ces deux échantillons.

![Table 3.2 – Exemples de sulfates rencontrés dans les collections du MNHN [70]](https://thumb-eu.123doks.com/thumbv2/123doknet/14667206.741115/43.892.139.699.180.465/table-exemples-sulfates-rencontrés-collections-mnhn.webp)