31
A mon cher père dr. Jaafar Ben Abdelouahab
Tous les mots du monde ne sauraient exprimer l’immense amour que
je vous porte, ni la profonde gratitude que je vous témoigne pour tous
les efforts et les sacrifices que vous n’avez jamais cessé de consentir
pour mon instruction et mon bien-être.
C’est à travers vos encouragements que j’ai opté pour cette noble
profession, et c’est à travers vos critiques que je me suis réalisée.
J’espère avoir répondu aux espoirs que vous avez fondé en moi.
Je vous rends hommage par ce modeste travail en guise de ma
reconnaissance éternelle et de mon infini amour.
Permettez-moi de vous témoigner tout le respect que vous méritez
ainsi que ma profonde affection.
Merci pour votre soutien durant les moments difficiles.
Que Dieu tout puissant vous garde et vous procure santé, bonheur et
longue vie pour que vous demeuriez le flambeau illuminant le chemin de
vos enfants.
A ma très chère mère Mariam Afailal
Affable, honorable, aimable : Tu représentes pour moi le symbole de
la bonté par excellence, la source de tendresse et l’exemple du
dévouement qui n’a pas cessé de m’encourager et de prier pour moi.
Ta prière et ta bénédiction m’ont été d’un grand secours pour mener
à bien mes études. Aucune dédicace ne saurait être assez éloquente pour
exprimer ce que tu mérites pour tous les sacrifices que tu n’as cessé de
me donner depuis ma naissance, durant mon enfance et même à l’âge
adulte.
Tu as fait plus qu’une mère puisse faire pour que ses enfants
suivent le bon chemin dans leur vie et leurs études.
Je te dédie ce travail en témoignage de mon profond amour.
Puisse Dieu, le tout puissant, te préserver et t’accorder santé,
longue vie et bonheur.
A mon très cher mari Mohamed Nouiouar
Quand je t’ai connu, j’ai trouvé l’homme de ma vie, mon âme sœur
et la lumière de mon chemin.
Ma vie à tes cotés est remplie de belles surprises.
Tes sacrifices, ton soutien moral et matériel, ta gentillesse sans égal,
ton profond attachement m'ont permis de réussir mes études.
Sans ton aide, tes conseils et tes encouragements ce travail n'aurait
vu le jour.
Que dieu réunisse nos chemins pour un long commun serein et que
ce travail soit témoignage de ma reconnaissance et de mon amour sincère
et fidèle.
A ma chère fille Yousra
Je te dédie ce travail en témoignage de mon grand amour que je n'ai su exprimer avec les mots.
A ma chère sœur Rabab, à son mari Yassine Bouchri
et à ses enfants
Adam, Lilia et Soraya
Je ne peux exprimer à travers ces lignes tous mes sentiments
d’amour et de tendresse envers vous.
Je vous souhaite un avenir florissant et une vie pleine de bonheur,
de santé et de prospérité.
A mon cher frère Mohamed
Mon cher grand frère présent dans tous les moments de ma vie par
son soutien moral et ses belles surprises sucrées.
Je te souhaite un avenir plein de joie, de bonheur, de réussite et de
sérénité.
Je t’exprime à travers ce travail mes sentiments de fraternité et
d’amour.
A ma tante Amal Afailal, à son mari Rachid et leurs
enfants
Ismail et Kenza
Je vous remercie énormément et j’espère que vous trouverez dans
cette thèse l’expression de mon affection pour vous.
A ma grand-mère Hafsa El khatib
A tous mes oncles et tantes maternel et paternel
A mes deux meilleures amies Hind Lmajidi et Nabila Elalaoui Mdaghri
Puisse Dieu renouveler encore et encore les bons moments passés ensemble.
Merci beaucoup pour votre soutien tout au long de mes études
A mes amies Ferdaouss ,Balkiss, Iman,
Khadija,Ilham,Kaoutar,Ikram,
A mes cousines Bahia et Alia et à tous mes cousins et cousines
A mes beaux parents Hamid Nouiouar et Naima Elkhachani
A mes belles sœurs Samira et Ahlam et leurs maris
A mon beau frère Youssef et sa femme
A la mémoire de mes grands parents Idriss Afailal,Mohamed
Ben Abdelouahab,Fatima Ben Abdelouahab et Mohamed
Afailal.
A la mémoire de mon oncle Mostapha Ben Abdelouahab
A tous le personnel de l’hôpital Mohamed 6 de M’dik
A ma chère confrère dr. Yassine Asmae
Je suis très reconnaissante pour la spontanéité avec laquelle vous
avez accepté de m’aider à la réalisation de ce travail.
A mon cher confrère dr. Moussaid Rachid et dr.
Miftah Azzelarab
Votre haute compétence, votre gentillesse et vos conseils nous ont
facilité l’élaboration de ce travail.
Votre modestie, vos qualités humaines et votre esprit scientifique
resteront toujours présents en mémoire.
A Notre Maitre et Président de thèse
Monsieur le Professeur BENTAHILA Benali
Professeur de pédiatrie
C'est pour nous un grand honneur et privilège que vous ayez
accepté de présider le jury de cette thèse.
Votre modestie, vos qualités humaines et votre esprit scientifique
restent toujours présents en mémoire.
Veuillez trouver dans ce modeste travail le sincère témoignage de
notre profond respect et notre reconnaissance.
A Notre Maitre et Rapporteur de thèse
Monsieur le Professeur GAOUZI Ahmed
Professeur en endocrinologie pédiatrique
Vous nous avez toujours accueilli avec amabilité et sympathie,
malgré vos nombreuses occupations professionnelles.
Votre haute compétence, votre gentillesse et vos conseils nous
ont facilité l’élaboration de ce travail.
Que ce travail soit l’expression de notre profonde gratitude et le
témoignage de notre grande estime.
A Notre Maitre et Juge de thèse
Madame Le Professeur CHKIRATE Bouchra
Professeur de pédiatrie
Nous sommes sensibles à l’honneur que vous nous faites en
acceptant de participer au jury de notre thèse et très touchés par la
gentillesse avec laquelle vous nous avez accueillis.
Puisse ce travail être pour nous, l’occasion de vous exprimer
notre profond respect et notre gratitude la plus sincère.
A Notre Maitre et Juge de thèse
Madame le Professeur KRIOUILE Yamna
Professeur de pédiatrie
Nous vous remercions pour la spontanéité avec laquelle vous avez
accepté de nous juger.
Nous sommes heureux de l’honneur que vous nous faites en
s’intéressant à ce travail.
Qu’il nous soit permis de vous exprimer notre estime et notre sincère
reconnaissance.
ABREVIATONS SRY : Sex-determining Region of Y chromosome AMH : Hormone anti- Müllérienne
hCG : Hormone gonadotrophine chorionique DHT : Dihydrotestostérone
GnRH : Gonadotropin Releasing Hormone SOX : SRY-related HMG-box
HMG : L'hormone chorionique gonadotrope humaine ADN : L'acide désoxyribonucléique
CHU : Centre hospitalier universitaire DS : Déviation standard
Cm : Centimètre
HTA : Hypertension artériel OGE : Organes génitaux externe CSS : Caractère sexuel secondaire FSH : L'hormone folliculo-stimulante LH : Hormone lutéinisante
IRM : L'imagerie par résonance magnétique IgF1 : Insulin-like growth factor-1
TDF : testis determining factor DSS : Dosage Sensitive Sex-reversal
SF1 : Stéroidogenic Factor 1 WT1 : wilms tumor 1
DAX1: dosage-sensitive sex reversal, adrenal hypoplasia critical region, on
chromosome X, gene 1
TGF: transforming growth factor GH: Growth hormone
ABP : androgen binding protein DHEA : déhydroépiandrostérone
17OHP : 17-alpha-hydroxyprogestérone
LHRH: Hormone de libération de la lutéinostimuline IPA : Insensibilité Partielle aux Androgènes.
TNE : testostérone no ester DOC : désoxycorticostérone ACTH : adrénocorticotrophine
17OH PNE :17 hydroxy pregnenolone IS : insuffisance surrénalien
TAR : Thrombocytopénie avec Absence de Radius HHC : Hypogonadisme hypogonadotrope congénital AR : autosomique recessif
TAD : transactivation domain IM : intramusculaire
DDT : Dichlorodiphenyltrichloroethane BMI : Body Mass Index
D4 :delta 4 androstènedione T : Testostérone
Introduction ...1 Revue de littérature ...4
I. Embryologie des organes génitaux: ...5 1. La différenciation des organes génitaux internes : ...7 2. La différenciation des organes génitaux externes ...9 3. La mini-puberté ... 13 II. Etude génétique dans le développement sexuel : ... 15 1. Le déterminant testiculaire SRY ... 16 2. Les autres gènes de la cascade (15) ... 19 III. Epidémiologie ... 27 1. Variation en fonction de l’appartenance ethnique : ... 27 2. Pesticides et micropénis :... 27 3. Fréquence ... 27 IV. Démarche diagnostique: ... 29 1. Circonstance de découverte : ... 29 2. Le diagnostic positif : ... 30 3. Diagnostic différentiel : ... 33 V. Démarches étiologique ... 35 1. Interrogatoire : ... 35 2. Données de l’examen clinique ... 36 3. Examens complémentaire ... 38 3.1. Bilan biologique : ... 38 3.2. Bilan radiologique : ... 49 VI. Etiologies ... 50 1. Anomalies de l’axe gonadotrope ... 50 a. Hypogonadisme hypogonadotrope ... 50 b. Atteinte testiculaire ... 50 2. Anomalie de synthèse de testostérone ... 52 a. Déficit en GH ... 52 b. Déficit en 17βhydroxylase: ... 52 c. Déficit en 17-20 desmolase : ... 52 d. Déficit en 3ßhydroxystéroide déshydrogénase ... 53 e. Déficit en 17ßhydroxystéroide déshydrogénase ... 53
3. Défauts d’action de la testostérone ... 53 a. Résistance partielle aux androgènes ... 53 b. Déficits en 5α-réductase ... 54 4. Syndromes polymalformatifs ... 54 a. Syndrome de Noonan ... 54 b. Syndrome de Laurence Moon ... 55 c. Willi Prader ... 55 d. Bardet-Biedl ... 56 e. Syndrome de Gordon Holmes : ... 57 f. Syndrome de Charge : ... 57 5. Anomalies chromosomiques ... 58 a. Syndrome de Klinefelter ... 58 b. Trisomie 21... 59 c. Les triploïdies ... 59 6. Les causes idiopathiques :... 60 VII. La prise en charge thérapeutique :... 61 1. Evolution dans la prise en charge du micropénis: ... 61 2. Les moyens thérapeutiques: ... 61 a. Traitement hormonal: ... 61 b. TTT chirurgical :... 64 c. Prothèse d’étirement. ... 68 Matériel et méthode ... 69 Résultats ... 72 Discussion... 81 Conclusion ... 91 Résumés ... 93 Bibliographie ... 97
1
2
Le Micropénis est un diagnostic médical souvent incorrectement fait.
Un mauvais diagnostic peut causer de l'anxiété parentale et peut conduire à des examens et des tests inutiles.
Le micropénis est un symptôme et non pas un syndrome.
Il constitue un motif fréquent de consultation en période néonatale, dans l’enfance mais surtout à l’adolescence.
Il est vraisemblable que la pollution chimique environnementale, à travers les, perturbateurs endocriniens, contribue a l’augmentation actuelle de la fréquence de cette insuffisance du développement de la verge.(1,2)
Le terme du micropénis se réfère à un trouble spécifique qui a un ensemble de facteurs étiologiques et un ensemble différent de modalités de traitement.
Ses étiologies sont multiples centrales ou périphériques, voire idiopathique. Le diagnostic correct est fait en mesurant la longueur étiré du pénis.
La première description de la longueur du pénis standard pour l'âge a été utilisée par Schonfeld et Beebe (3). Dans le temps, la définition de micropénis a été acceptée comme la longueur du pénis plus petit que 2,5 écarts-types (SD) en dessous de la moyenne (4).
La prise en charge thérapeutique doit être initié le plutôt possible dans les premiers mois de vie avant l’âge de 2 ans, ainsi le traitement hormonal n’est pas efficace après l’âge de l’adolescence ce qu’est source de problèmes psychologiques et sociales.
Ne pas atteindre exactement la longueur du pénis moyenne de la population en bonne santé ne signifie pas l'échec.
3
Après puberté on a parfois recours au traitement chirurgical.
La chirurgie cosmétique du pénis est associée à un risque d’exposition médicolégale important et toute indication chirurgicale doit être posée après une concertation multidisciplinaire, à l’issu d’un temps de réflexion donné au patient après une information complète. (5)
Micropénis peut survenir comme une anomalie indépendante par lui-même ou en tant que signe clinique de nombreux syndromes.
L’objectif de notre travail est double, connaitre la physiopathologie du micropénis et décrire les différentes modalités thérapeutiques appliquées, selon chaque cas, ainsi que leurs aspects évolutifs en étudiant une série de 50 enfants vus en consultation d’endocrinologie pédiatrique à l’Hôpital d’enfant de Rabat.
4
5
I. Embryologie des organes génitaux:
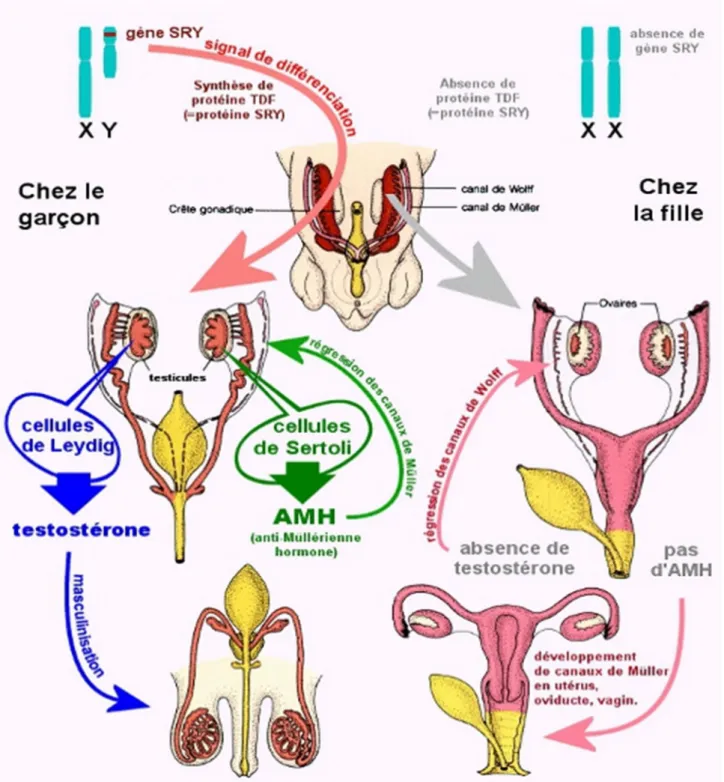
Le développement sexuel masculin débute avec la détermination du testicule, qui se poursuit par la différenciation sexuelle et le développement des organes génitaux.
Jusqu’à 7 semaines, chez le fœtus humain, les organes génitaux internes sont exactement semblables dans les deux sexes : ce sont les canaux de Wolff et
Müller.
Les canaux de Wolff sont les canaux excréteurs du rein primitif, le mésonéphros. Ils s’incorporent dans le système génital masculin quand le développement du rein définitif est terminé.
6
7
1. La différenciation des organes génitaux internes :
Les travaux d’Alfred Jost dans les années 1940 ont démontré le rôle fondamental du testicule fœtal dans le développement des organes génitaux internes masculins (déférents, vésicules séminales, prostate).
Dans l’espèce humaine, le double système indifférencié de canaux internes symétriques et parallèles se termine au niveau du sinus urogénital.
Quand il existe un testicule, les cellules de Sertoli fœtales synthétisent l’hormone anti- Müllérienne (AMH), protéine qui agit via un récepteur membranaire.
L’AMH fait régresser les canaux de Müller.
Les cellules de Leydig synthétisent précocement la testostérone, qui stabilise les canaux de Wolff et permet le développement de l’épididyme, des canaux déférents et des vésicules séminales.
Ces cellules de Leydig vont aussi produire un facteur de croissance, INSL3, responsable de la descente intra-abdominale des testicules. (6)
8
Figure 3 : différenciation des organes génitaux interne au cours de la phase embryonnaire. (8)
9
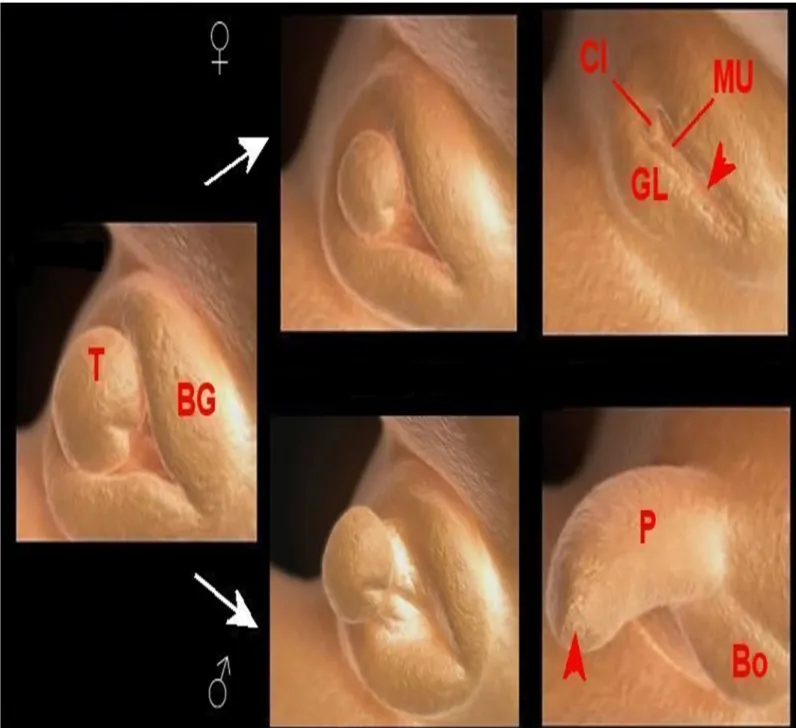
2. La différenciation des organes génitaux externes
10
• Chez la fille, le tubercule génital (T) évolue en clitoris (Cl) et les
bourrelets génitaux (BG) forment les lèvres (GL). La flèche indique l'orifice génital distinct du méat urinaire (MU).
• Chez le garçon, le tubercule génital (T) évolue en pénis (P) et les
bourrelets génitaux (BG) forment les bourses (Bo). La flèche indique l'orifice
uro-génital
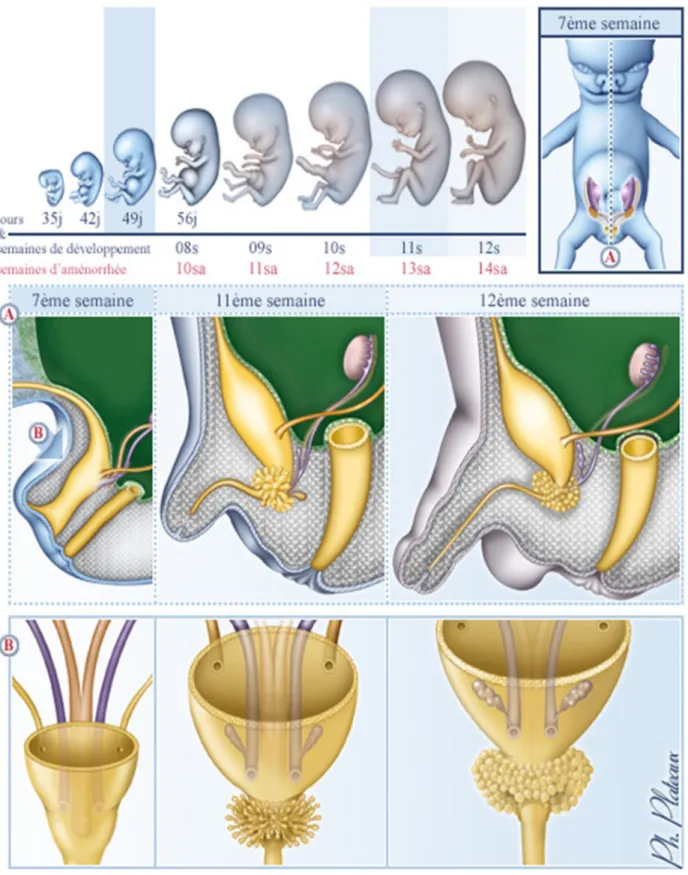
A la 8 ème semaine de grossesse, l’hCG maternel placentaire stimule la
production de testostérone par les cellules de Leydig fœtales.
Chez les garçons, à partir de 10 à 11 semaines de grossesse, le sinus urogénital se développe et donne l’urètre masculin qui va s’aboucher à l’extrémité du pénis par la fusion des replis urétraux.
Les limites de la gouttière urétrale fusionnent sur la ligne médiane pour former la peau de la face ventrale du pénis (raphé médian).
L’urètre, une fois refermé, est entouré d’une condensation de mésenchyme qui donnera le corps spongieux.
À la 12–14e semaine, la fusion constituant l’urètre pénien est achevée et va
jusqu’au bout du gland. En parallèle, le bourgeon génital s’allonge. Les bourrelets latéraux fusionnent sur une ligne médiane pour donner le scrotum. Ces phénomènes sont sous le contrôle de la dihydrotestostérone (DHT), un métabolite dérivé de la testostérone.
Pendant la deuxième partie de la vie fœtale, la croissance du pénis est assurée principalement par les androgènes fœtaux, régulés par la LH hypophysaire fœtale.
11
À 15 semaines de grossesse, la verge, le gland et l’orifice urétral, ainsi que
le scrotum, sont identifiables. Ainsi, la différenciation et le développement normal d’une verge de structure normale nécessitent la présence de tissu testiculaire.
La présence d’un micropénis pré-ou néonatal est donc le signe d’un défaut hormonal survenu après 12–14 semaines de grossesse. (6)
12
13 3. La mini-puberté
Quelques minutes après la naissance, un bref pic de LH est repérable chez les nouveau-nés de sexe masculin. Il est suivi par un pic de testostérone qui durera environ 36 heures.
Après la section du cordon ombilical, les stéroïdes dérivés du placenta chutent, et effondrent les concentrations de GnRH hypophysaires, qui seront à nouveau détectable vers 1–2 semaines de vie post-natale.
Cette sécrétion de GnRH, de gonadotrophines et de testostérone va durer 4 à 6 mois, et est appelée mini-puberté. (11)
Figure 6. Croissance du pénis et taux moyens de testostérone plasmatique totale (liée à un transporteur et libre) en fonction de l'âge chronologique. Il existe deux phases de croissance rapide du pénis, une juste après la naissance et une au moment de la puberté.
14
Ainsi, la différenciation et le développement des organes génitaux externes, notamment de la verge, nécessitent :
1. des testicules normalement différencies : gènes SRY, SF1, WT1, SoX9... ; 2. une production de testostérone normale avec implication des gènes régulant
l’action de l’hCg et de la LH, ainsi que des gènes qui gouvernent la steroidogénèse testiculaire
3. une réceptivité normale aux androgènes qui dépend des gènes de la 5-alpha réductase et du récepteur des androgènes.
Il est vraisemblable que des gènes spécifiques de la croissance de la verge, ou des gènes participants la croissance cellulaire (par exemple du système de l’IgF1), interviennent dans cette régulation (13).
15
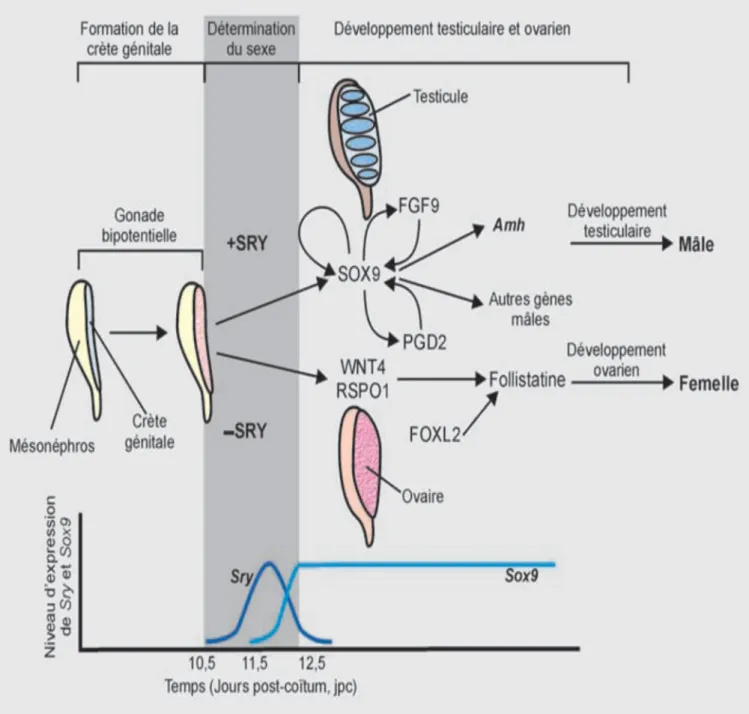
II. Etude génétique dans le développement sexuel :
Chez tous les mammifères, le sexe est déterminé génétiquement à la fécondation selon que le spermatozoïde est porteur ou non du chromosome Y (XX pour la femelle et XY pour le mâle).
16
Le fait que la détermination des testicules dépende de la présence d'un chromosome Y est connu depuis le début des années 60, et a été déduit de l'observation d'anomalies chromosomiques des humains 45,XO (Turner) ne montrent pas de développement de tissu testiculaire. De plus, un caryotype humain 47,XXY (Klinefelter) entraîne un phénotype mâle.
Le facteur, encore inconnu, codé par un gène du chromosome Y, et déterminant la différenciation des testicules, a été appelé TDF (testis determining factor). (15)
1. Le déterminant testiculaire SRY
L'identification de TDF a été réalisée en 1989, grâce à l'étude d'individus humains dont le sexe phénotypique est en discordance avec le sexe chromosomique; hommes possédant deux X (46,XX) ou femmes possédant un X et un Y (46,XY).
Ces individus phénotypiquement mâles et porteurs d'un caryotype 46,XX, renfermaient dans leur génôme une séquence provenant du chromosome Y. L'analyse de ce segment d'ADN montra une séquence codante (open-reading frame ou ORF) qui fut appelée: "région déterminant le sexe" du chromosome Y ou SRY (Sex-determining Region of Y chromosome).
Ce gène est situé sur le bras court du chromosome Y humain et répond aux caractéristiques attendues d'un "TDF":
ce gène est conservé sur le chromosome Y
la protéine déduite du gène SRY possède un domaine permettant sa liaison à l'ADN. Ce domaine, homologue à celui des protéines du HMG (high mobility group) définit une nouvelle famille de gènes appelé SOX
(SRY-17
related HMG-box) qui interviennent dans de nombreux processus de développement;
la chronologie de l'expression de ce gène coïncide avec la période de détermination du sexe. On trouve des transcrits (ARNm) de ce gène dans le testicule adulte;
des individus qui développent un phénotype femelle malgré la présence d'un Y (46,XY) présentent une mutation dans le gène SRY, le rendant non fonctionnel;
enfin la meilleure démonstration fut obtenue par transgénèse chez la souris; l'introduction d'un fragment de 14Kb d'ADN contenant le gène Sry (en minuscule = murin), dans une souris femelle XX, entraîne le développement de testicules, ce qui suggère que c'est le seul gène du chromosome Y impliqué dans la détermination testiculaire.(15)
SRY est donc responsable de l'établissement du sexe gonadique, c'est le TDF tant attendu!
Période d'expression et mode d'action de SRY
Chez l'homme le gène SRY est transcrit pendant une période plus longue dans les cellules de Sertoli, de la formation des crêtes génitales jusqu'après la différenciation de ces cellules. Dans le testicule adulte, ce gène s'exprime dans les cellules germinales méiotiques et post-méiotiques.
La protéine SRY humaine se compose de 204 acides aminés. Elle se lie spécifiquement, par son domaine HMG renfermant environ 80 acides aminés, à l'ADN bicaténaire portant la séquence 5'A/TAACAAA/T 3'.Après fixation de cette protéine, la molécule d'ADN subit une courbure de 70 à 80° dans la
18
direction du grand sillon. Cela pourrait permettre le rapprochement et l'interaction entre des facteurs de transcription fixés sur le ou les gènes cibles de SRY, dont les sites de liaison sont éloignés les uns des autres. Comme on retrouve la protéine SRY dans le noyau des cellules de Sertoli mais aussi dans les cellules germinales, on peut penser que ce gène permet non seulement la différenciation de la gonade vers la voie mâle mais présente aussi d'autres fonctions.
Ainsi le sexe génétique est déterminé à la fécondation, selon le chromosome sexuel apporté par le spermatozoïde. L'établissement du sexe gonadique est sous contrôle génétique et dépend de la présence du gène SRY.
Suite à l'action du gène SRY, une cascade d’autres gènes est activée dans le testicule. Cette période de différenciation gonadique se réalise chez l'homme entre la 5ème et 8ème semaine de gestation.
L'établissement du sexe phénotypique se réalise, quant à lui, sous l'effet des hormones sécrétées par la gonade différenciée, à deux périodes de la vie: le tractus génital se différencie pendant la vie fœtale et les caractères sexuels secondaires, à la puberté.(15)
19
2. Les autres gènes de la cascade (15)
GENE Localisation chromosomique Caractéristique de sa protéine Rôle de la protéine SRY bras court du chromosome Y 204 aa, possède un domaine de liaison à l'ADN entraînant sa courbure différenciation de la gonade en testicule WT1 bras long du chromosome 11 différentes isoformes protéiques présentant une capacité de liaison à
l'ADN (par des
domaines en doigt de Zinc) jouant le rôle de facteur d'épissage ou de transcription indispensable à la morphogénèse de la cête génitale et régulerait la transcription du gène SRY
SOX9 bras long du
chromosome 17 509 aa, un domaine de liaison à l'ADN activation de l'expression du gène de l'AMH
DAX1 bras court du
chromosome X
470 aa, possède une zone de liaison à l'ADN et une zone similaire aux sites de liaison des ligands
des récepteurs nucléaires inhibition de l'action de SF1 SF1 bras long du chromosome 9
récepteur nucléaire active
l'expression de gènes
impliqués dans la
stéroïdogénèse
AMH bras court du
chromosome 19
homologie avec certains facteurs de croissance (TGF-bêta) provoque la régression des canaux de Müller et inhibe l'aromatase
20
Figure 8 : LE DETERMINISME GENETIQUE DU SEXE (15)
Le gène WT1
Ce gène, localisé sur le bras long du chromosome 11, mesure 50kb et comprend 10 exons.
21
Il existe différents phénotypes sexuels associés à des mutations du gène WT1 :
- Le syndrome de Denys-Drash qui touche des enfants en bas âge, des deux sexes, associe une insuffisance rénale aigüe, un néphroblastome (tumeur de Wilms, 1/20 000 enfant) et, chez la plupart des individus XY concernés, une dysgénésie gonadique avec ambiguité génitale.
- Le syndrome de Frasier, lui, se caractérise par une néphropathie à évolution lente et une dysgénésie gonadique qui entraîne, chez les individus XY, un phénotype complètement féminin.
Le gène WT1 semble nécessaire à double dose (deux allèles normaux) pour la détermination du testicule, alors que le développement de l'ovaire peut se faire en présence d'un seul allèle normal.
Ainsi le gène WT1 est impliqué dans la morphogénèse de la crête
urogénitale mais aussi dans la différenciation testiculaire.
Comme WT1 et SRY sont tous les deux exprimés dans les cellules de Sertoli, et qu'il existe, sur le promoteur du gène SRY, un site capable de se lier avec une protéine WT1, on suppose que WT1 contrôle directement la transcription de SRY.
Enfin, l'une des isoformes protéiques du gène WT1 est impliquée dans la transcription du gène de l'AMH.(15)
Le gène SOX9
Il appartient à la famille des gènes SOX, puisqu'il code pour une protéine (509 acides aminés) possédant un domaine de fixation à l'ADN de type HMG présentant une forte homologie (71% des aminoacides) avec celui de la protéine
22
SRY. De plus sa protéine possède (dans sa partie C-terminale) un domaine impliqué dans l'activation de la transcription.
L'inactivation du gène SOX9 est responsable d'un syndrome:
- La dysplasie campomélique :Les personnes atteintes présentent des anomalies osseuses diffuses, et pour les trois-quarts des malades possédant un caryotype 46/XY, des anomalies gonadiques. Ces dernières sont diverses, allant de testicules à des ovaires dysgénésiques avec quelques follicules primordiaux, ce qui constitue donc une inversion sexuelle. Le phénotype externe est alors ambigu ou franchement féminin.
Le gène a été localisé sur le bras long du chromosome 17 humain (17q). La protéine SOX9 ne déclenche pas la lecture du gène de l'AMH mais pourrait être responsable de l'élévation de son expression dans le testicule fœtal.
Un taux élevé (trois allèles normaux, cas pathologique, ou deux allèles, cas normal) de protéine SOX9 entraînant une masculinisation, par activation de la transcription du gène de l'AMH, alors qu'un taux faible (un seul allèle normal) n'assure pas cette masculinisation.(15)
Le gène DAX1
Dans l'espèce humaine, la duplication d'une région du chromosome X, localisée sur le bras court (Xp), entraîne le développement d'un phénotype féminin, avec dysgénésie gonadique, chez des individus de caryotype 46/XY.
Cette région, de 160Kb, a été appelée DSS (Dosage Sensitive Sex-reversal) car elle contient au moins un gène capable, à double dose (deux allèles) d'inhiber la différenciation testiculaire.
23
Chez l'homme des mutations du gène DAX1 sont responsables d'hypogonadotrophie.(15)
Le gène SF1
Ce gène, localisé, chez l'homme, sur le bras long du chromosome 9 (9q), code pour une protéine appelée SF1, pour Stéroidogenic Factor 1. Cette protéine est un récepteur nucléaire d'un type particulier, régulant la transcription d'un grand nombre de gènes d'enzymes impliquées dans la stéroidogénèse des tissus surrénalien et gonadique.
SF1 régule également des gènes d'hormones protéiques hypophysaire (sous-unité bêta de la LH et la FSH) ou testiculaire (AMH en particulier).
Le gène de l'AMH
Il est localisé, dans l'espèce humaine, sur le chromosome 19. L'AMH (hormone anti-Müllérienne) présente, dans sa partie C-terminale qui doit être clivée au niveau de la cellule cible pour devenir bio-active, une nette homologie avec certains facteurs de croissance de la famille du TGF-bêta.
Pour un sexe donné il faut remarquer la chronologie relative de l'expression des différents gènes.
La comparaison des profils dans les deux sexes montre en particulier l'absence d'expression du gène de l'AMH chez la femelle et la différence dans la période d'expression du gène SOX9.
24
Vu l'influence de l'AMH dans la différenciation somatique, c'est le gène de cette hormone qui, par la régulation de son expression, va être responsable de l'engagement du tractus génital vers une voie mâle ou femelle.
Chez l'homme, le facteur SF1 régule la transcription de l'hormone anti-Müllérienne, mais SF1 n'agit pas seul, il fait partie d'un complexe de plusieurs facteurs de transcription, associant en particulier SOX9 et DAX1. De plus, l'une des isoformes protéiques du gène WT1 agit en synergie avec SF1 pour activer la transcription du gène de l'AMH.
De plus, par des expériences de liaison protéique, on a montré que les facteurs SOX9 et SF1 (humains) interagissent directement l'un avec l'autre, SOX9 par son domaine de liaison à l'ADN, et SF1 par sa région terminale.
Par ailleurs, des expériences ont prouvé que la protéine DAX1 est un inhibiteur de l'action de SF1 sur ce promoteur.
Dans la gonade mâle, le taux élevé de facteur SOX9 (gène autosomique) et faible de DAX1 (un seul chromosome X) permettrait l'interaction du complexe de transcription SOX9/SF1 sur le promoteur du gène de l'AMH, assurant ainsi, par la production de cette hormone, une masculinisation des voies génitales. (15)
25
26
En déduit que chez le mâle de mammifère, la détermination testiculaire est déclenchée par SRY dans les précurseurs des cellules de Sertoli. Le gène SOX9 est alors fortement transcrit et, en interaction avec SF1, initie l'expression du gène de l'AMH. L'une des isoformes protéiques du gène WT1 agit en synergie avec SF1 pour activer la transcription du gène de l'AMH. Dans les cellules de Leydig, le facteur SF1 active l'expression de gènes d'enzymes intervenant dans la stéroïdogénèse et de la testostérone est produite. (15)
27 III. Epidémiologie
1. Variation en fonction de l’appartenance ethnique :
Selon certains Etudes on trouve que la taille du pénis varie selon le groupe ethnique.
En Occident, ce seraient les hommes à la peau noire. Ce préjugé remonterait à l’époque coloniale et serait un préjugé raciste (16). Il semble pourtant bien que ce ne soit guère plus qu’une rumeur infondée selon certaines statistiques(17)
Cependant, ces études sont toujours sujettes à discussion, en raison de leur méthodologie très variable et parfois contestable. La seule étude fiable couramment citée dans la littérature est l'étude américaine Kinsey, de l’UCSF, n’ayant pu établir de corrélation entre le groupe ethnique et la taille du pénis. Une deuxième étude américaine datant de juillet 2013, a écarté la corrélation entre origine ethnique et la taille du pénis en érection (18)
2. Pesticides et micropénis :
Bien que les causes des malformations congénitales masculines soient multifactorielles pour expliquer l’augmentation de cette prévalence, certaines études avaient soutenu l’hypothèse que la contamination prénatale par les pésticides pourrait être un facteur de risque potentiel des malformations des organes génitaux externe chez le nouveau née de sexe masculin.(19)
3. Fréquence
La fréquence internationale est de 0 ,6% de la population (20)
28
d’augmenter dans le monde. (21)
Au CHU Montpellier le nombre des cas de micropénis a augmenté de 12 nouveaux cas en 1998- 1999 , 31 en 2OO2-2OO3 à 40-50 nouveaux cas en 2011 . (22)
L’incidence du micropénis dans notre service était de :
7 nouveaux cas en 2003, 17 nouveaux cas en 2006,
22 nouveaux cas en 2011,
29 IV. Démarche diagnostique:
Le micropénis se définit comme une hypoplasie congénitale de la verge, une insuffisance de développement mais de configuration anatomique normale. (24)
Le diagnostic précoce du «vrai micropénis » est important, parce qu’il permet d’utiliser dès le début diverses options de traitement.
La première étape dans le diagnostic du micropénis est l’examen des
organes génitaux externes du patient.
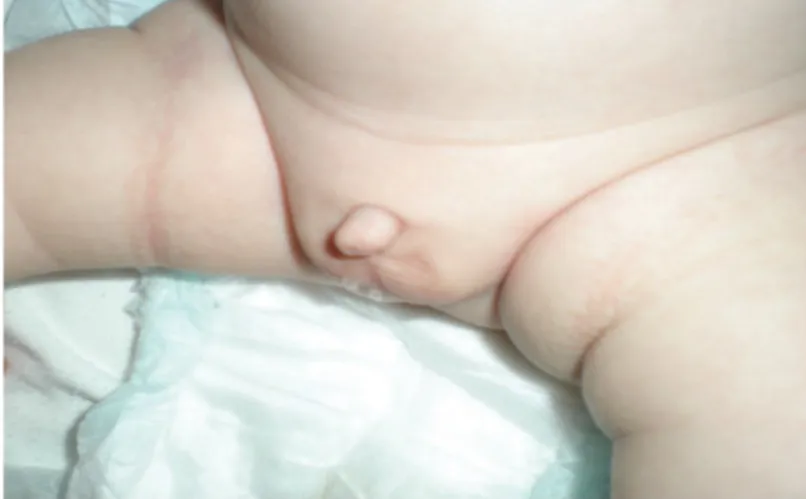
Figure 9 : Micropénis chez un nouveau-né (25)
1. Circonstance de découverte :
Par le patient lui-même, Ses parents,
L’entourage ou le médecin traitant lors d’un examen systématique surtout en cas d’obésité, cryptorchidie, retard pubertaire ou hernie inguinale
30 2. Le diagnostic positif :
L’examen clinique est essentiel et doit éliminer, en premier lieu, un pénis enfoui dans le tissu adipeux, un pénis enlise avec implantation antérieure du scrotum, voire une verge Coudée. La recherche d’un hypospadias et d’une cryptorchidie doit être systématique. (26)
La mesure correcte de la longueur du pénis est importante parce que le diagnostic du vrai micropénis en dépend.
Pour la mesure de la longueur du pénis il y a les méthodes traditionnelles utilisant une règle ou un étrier.
L’évaluation rigoureuse de la longueur de la verge doit être réalisée chez l’enfant allongé. La longueur de la verge est mesurée sur sa face dorsale, de la racine a l’extrémité du gland, en traction légère mais pas en extension, ni en érection (27).
Figure 10 : Mesure de la longueur du pénis, à partir du pubis jusqu’ à la pointe du pénis étiré
31
Autre technique:
Utiliser une seringue jetable de 10 ml dont la construction est modifiée. L'extrémité de l'aiguille est enlevée, et le piston est inséré dans l'extrémité coupée. Ensuite placé sur le pénis qui va être aspiré dans l'injecteur. Une fois le pénis est tendu au sein de la seringue au cours d'aspiration optimale, la longueur du pénis est lue sur l’échelle. Cette méthode élimine la variabilité des mesures provoquées par la graisse sus pubienne. (28)
Figure 11 : seringue modifié pour mesurer la taille de la verge. (28).
Au sein de notre étude la seule méthode utilisé c’est la traditionnel vu le refus des patients suite à des difficultés pour faire comprendre cette technique.
La mesure doit être comparée aux valeurs des tables de référence La plus connue est la courbe de Schonfeld Fig. 12.
L’évaluation de la cinétique de croissance ne doit pas être négligée chez l’enfant. Le diagnostic de micropenis est évoqué si la longueur mesurée est
<2,5 cm à la naissance, ou
<-2,5 DS par rapport à l’âge selon les courbes de référence (Schonfeld, Feldman)
32
Figure 12 : Tailles normales de la verge(29) Table 1 : La longueur normale du pénis (cm)(30)
Normal SPL Age Mean ± SD Mean - 2.5SD
Newborn, 30-week gestation 2.5 ± 0.4 1.5 Newborn, 34-week gestation 3.0 ± 0.4 2.0 0–5 months 3.9 ± 0.8 1.9 6–12 months 4.3 ± 0.8 2.3 1–2 years 4.7 ± 0.8 2.6 2–3 years 5.1 ± 0.9 2.9 3–4 years 5.5 ± 0.9 3.3 4–5 years 5.7 ± 0.9 3.5 5–6 years 6.0 ± 0.9 3.8 6–7 years 6.1 ± 0.9 3.9 7–8 years 6.2 ± 1.0 3.7 8–9 years 6.3 ± 1.0 3.8 9–10 years 6.3 ± 1.0 3.8 10–11 years 6.4 ± 1.1 3.7 Adult 13.3 ± 1.6 9.3
33 3. Diagnostic différentiel :
Eliminer les faux micropénis à savoir :
Verge enfouie: verge de taille normale mais enfouie dans la graisse sus
pubienne.
Figure 13 : verge enfouie.
Verge enlisée: en raison de l’implantation très antérieure de la peau du
scrotum.
34
Verge incurvée ou coudée
Figure15 : Torsion de la verge: rare, souvent à gauche
Agénésie de la verge: rare, absence du corps caverneux et spongieux. Le méat urétéral a une position périnéale médiane.
35
. Troubles de la perception de la longueur de la verge: il est important de déterminer si les plaintes des patients qui jugent leur pénis trop petit sont réellement fondées. Un grand nombre de garçons demandent une augmentation de la verge même si leur pénis est de taille normale. Ces garçons ont généralement des attentes irréalistes concernant les dimensions d’un pénis normal (souvent influencées par l’environnement social, les médias ou la pornographie) et il est généralement possible d’atténuer leurs craintes en les rassurant que la taille de leur pénis correspond à la normale (31). Lorsque cela ne suffit pas, il est recommandé de proposer une thérapie cognitivo-comportementale (32). Malheureusement, certains garçons continuent de s’inquiéter de la taille de leur pénis malgré la thérapie et peuvent souffrir de dysmorphophobie pénienne.
V. Démarches étiologique 1. Interrogatoire :
Grace à un interrogatoire minutieux, l’orientation étiologique est plus aisée. De ce fait :
La présence d’un cas similaire dans la famille oriente vers un trouble de l’hormono-synthèse ou à une insensibilité aux androgènes.
La présence des hypoglycémies ou le retard de croissance staturo-pondérale oriente vers un déficit en GH ou à un pan-hypopituitarisme
La présence d’une anosmie ou d’hyposmie oriente vers un Kallmann syndrome
La présence d’une anomalie congénitale oriente vers un syndrome génétique
36
Rechercher un traitement par les œstrogènes chez la mère.
2. Données de l’examen clinique
Ex général :
Taille : retard statural (insuffisance somatotrope), poids : obésité,
HTA
Signe de syndrome de perte de sel : Déshydratation, vomissement, diarrhée, perte pondérale…
Sd dysmorphique.
Ex des OGE/ CSS :
Défaut de masculinisation/ ambigüité sexuelle Position du méat urétral : Hypospadias, phimosis
degré de virilisation des bourrelets génitaux (plissement ; pigmentation et soudure)
L’examen des testicules: en précisant la situation, la taille, la consistance à la recherche d’une cryptorchidie, hypotrophie, agénésie
Évaluer le degré du développement des caractères sexuels secondaires selon la classification de Tanner.
37
Gynécomastie
Stade Pilosité pubienne homme
Testicules et pénis chez l'homme
I
Absence de pilosité pubienne ; un fin duvet couvre la zone génitale
Testicules, scrotum et pénis de taille prépubère II Quelques poils légèrement pigmentés, droits, allongés, en général à la base du pénis Croissance du scrotum et des testicules ; peau scrotale plus rouge et augmentation du volume du pénis
III
Poils pubiens bien visibles, pigmentés, bouclés, étalés latéralement Croissance du pénis en longueur. Allongement duscrotum et augmentation du volume testiculaire IV
Pilosité de type adulte, plus drue
Le volume testiculaire et le scrotum continuent
d'augmenter ; pigmentation plus marquée du scrotum ; le pénis continue de grandir et le contour du gland devient visible.
V
Pilosité adulte qui s'étend sur la surface interne des cuisses
Les testicules, le scrotum et le pénis atteignent leur taille et leur forme adultes.
38
Figure 17: Gynécomastie chez un enfant présentant le syndrome de Klinefelter (33)
3. Examens complémentaire 3.1. Bilan biologique :
Dosage de la Testostéronémie :
La testostérone est une hormone stéroïdienne, du groupe des androgènes. Elle est sécrétée essentiellement par les gonades, en plus faible quantité par les glandes surrénales et quelques autres tissus produisent également de la testostérone. C'est la principale hormone sexuelle mâle et le stéroïde anabolisant « originel ».
39
Figure18 : Courbe de la croissance taux moyens de testostérone plasmatique totale (liée à un transporteur et libre) en fonction de l'âge chronologique.
Les valeurs usuelles : (34)
Testostérone totale (nmol/l)
Adultes : 9.0 - 35.0 Enfants: 1 à 5 mois 0.5 - 6.1 6 à 11 mois <0.5 1 à 5 ans 0.5 - 0.9 6 à 9 ans 0.5 - 1.0 Stade de Tanner: I 0.5 - 0.8 II 0.5 - 2.4 III 0.5 - 9.7 IV 3.6 - 18.9 V 9.2 - 27.7
40
La dihydrotestostérone: La dihydrotestostérone (DHT) est l'hormone qui possède la plus forte activité androgénique. Elle est produite exclusivement par conversion périphérique de la testostérone sous l'action de la 5-alpha réductase.(35)
Les valeurs usuelles : (36)
Age Dihydrotestostérone ng /dL 1 à 6 mois Enfant prépubère Tanner II-III Tanner IV-V 12 - 85 <5 3 - 33 22 - 75
41
Figure 19 : Synthèse de la testostérone et de la dihydrotestostérone.(37)
FSH, LH :
LH : se lie à des récepteurs spécifiques sur les cellules de Leydig testiculaires et stimule la production de testostérone.
La LH est nécessaire au maintien d’un taux intratesticulaire élevé de testostérone, lui-même nécessaire à la spermatogenèse.
42
Le rôle de la FSH chez l’homme n’est pas encore parfaitement clair. Il apparaît que la LH peut maintenir ou rétablir seule la spermatogenèse mais que l’administration conjointe de FSH permet une spermatogenèse quantitativement et qualitativement normale. (38)
La FSH stimule la sécrétion de l’androgen binding protein (ABP), de l’inhibine et de certains facteurs paracrines qui vont participer à la croissance et à la différenciation des cellules germinales. (39)
Les valeurs usuelles: (36)
Age FSH mU/ml LH Enfant prépubertaire Enfant pubère 0,0 - 2,8 1,4 - 14,4 0,0 - 1,6
AMH : chez le garçon, les cellules de Sertoli synthétisent des quantités importantes d’AMH dès la différenciation fœtale du testicule : Il provoque la régression des canaux de Müller chez le fœtus. C’est un excellent marqueur de l’activité fonctionnelle et du nombre de cellules de Sertoli avant la puberté, sans stimulation nécessaire exogène par les gonadotrophines. En pédiatrie, sa détermination positive permet d’affirmer l’existence de tissu sertolien. Son dosage est également utile lors de l’exploration un hypogonadisme gonadotrope.( 40)
43
Figure 20 : Productions hormonales du testicule en fonction de l'âge (41)
delta4 Androstènedione : est un androgène d'origine mixte. L'hormone circulante provient de la sécrétion par les testicules, les surrénales, et de la conversion périphérique d'autres androgènes, surtout de la DHEA. La delta 4 androstènedione est, elle-même, un précurseur de la testostérone et de l'oestrone.
Figure 21: Biogénèse des androgènes. (42)
Cholestérol Prégnénolone Progéstérone 17,hydroxy-prégnénolone 17,hydroxy-progéstérone Déhydro-épi-androstérone Androstènedione Androstènediol Testostérone
44
La 17-alpha-hydroxyprogestérone : (17-OH progestérone, 17OHP) est un stéroïde intermédiaire dans la biosynthèse des glucocorticoïdes et des androgènes, dont l'origine est mixte surrénalienne et gonadique. Elle provient de la progestérone et de la 17 hydroxyprégnénolone. Elle est métabolisée en delta-4-androstènedione ou 11-désoxycortisol, lui-même précurseur du cortisol. (43)
Valeurs usuelles chez l’homme : 0.4 - 3.6 ng/mL
Inhibine B :est une hormone glycoproteique d’origine gonadique identifié initialement comme le principal facteur capable de réguler négativement la production de FSH.(44)
Figure 22 : Evolution simultanée des sécrétion de l’inhibine B , AMH et la testostérone.(45)
45
Évaluation de l’activité de la 5α réductase:
La 5α réductase est une enzyme qui transforme la testostérone en DHT. L’étude de l’activité de cette enzyme peut être réalisée sur des fibroblastes de peau génitale réalisée sur culture, mais cette méthode comporte beaucoup de faux négatifs .la confirmation de diagnostic se fait par la biologie moléculaire du gène.
Au cours de notre étude l’activité de la 5 α réductase est faite par mesure du rapport testostérone / DHT après test à l’HCG.
Caryotype : Les indications du caryotype en cas de micropénis sont les suivantes :
La présence d’un syndrome dysmorphique
46
La bifidité scrotale
Figure 24: La bifidité scrotale chez un nourrisson
L’ectopie testiculaire
47
Tests de stimulation : Test au Pregnyl :
L’analyse de la production de la testostérone à l’état basal et surtout après stimulation par l’hCG est informative, particulièrement en période néonatale et péri-pubertaire, pour apprécier l’activité leydigienne. (46)
- Chez l'enfant : Après stimulation par l’hCG (1500 UI 1 j/2 x 7)
Prélèvement le lendemain de la 3ème injection Dosage de la testostérone, DHT, Delta4 A
- Chez le nourrisson : 500 unités toutes les 48 heures.
Test au LH RH :
L’évaluation de la sécrétion des gonadotrophines de base et après stimulation par la LH-RH est souvent utile, chez le nouveau-né comme chez l’adolescent, pour identifier un éventuel hypogonadisme hypogonadotrope (46) .Ce test au LHRH est à interpréter selon le stade pubertaire.
48
49
Résultats de l’exploration endocrinienne en fonction des différentes étiologies et du statut pubertaire.(46)
T : testostérone ; IPA : Insensibilité Partielle aux Androgènes.
3.2. Bilan radiologique :
Echographie pelvienne et testiculaire IRM hypothalamo-hypophysaire :
Analyse la morphologie de l’axe hypothalamo-hypophysaire ainsi que les bulbes et sillons olfactifs, elle permet d’étoffer le bilan étiologique surtout en cas hypogonadisme hypogonadotrope.
Elle peut objectiver une lésion organique tels un processus tumoral, une maladie infiltrative ou inflammatoire, une nécrose hypophysaire ou une interruption de la tige pituitaire.(47)
FSH, LH basales T. de base T .après hCG Prépuberté Hypog hypoG Dysg. Test. IPA Idiopathique N N N N basse N basse N N Retardée Insuffisante N N Puberté Hypog hypoG Dysg. Test. IPA Idiopathique N N Retardée Insuffisante Inutile N
50
Une agénésie ou une hypoplasie des bulbes olfactifs oriente vers un syndrome de Kallmann.
Une hypoplasie de l’antéhypophyse, voire une posthypophyse ectopique vers une anomalie du développement de l’hypophyse.(48)
L’IRM cérébrale peut également être normale (49) Autres :
coelioscopie si ectopie testiculaire.
VI. Etiologies
1. Anomalies de l’axe gonadotrope a. Hypogonadisme hypogonadotrope
En période fœtale : micropénis et cryptorchidie à la naissance.
En période pubertaire : retard pubertaire avec micropénis + Testicule atrophique.
Biologie: TNE↓, FSH ET LH N ou ↓, test prégnyl +
Congénital (Kalmann de morsier, mutation gène LHRH ; leptine..)/ acquis (tumorales ’craniopharyngiome++) infiltratives ’histiocytose++’ chimio ou Radiothérapie HH…
b. Atteinte testiculaire
Anorchidie
Syndrome des testicules évanescents, Régression testiculaire après masculinisation.
51
Mutation SF1: phénotype féminin ou ambigu (+ micropénis), isolé ou + insuffisance surrénale.
Mutation WT1: phénotype féminin ou ambigu (+ micropénis), associée: tumeur de wilms, sclérose mésangiale avec proténurie (syndrome Denys Drash) sclérose glomérulaire focale (sde Frasier)
Mutation SOX9 : Micropénis +Phénotype ambigu+ Anomalies osseuses: dysplasie campomélique (incurvation des os longs , anomalies du bassin et du thorax, fente palatine, malformations cérébrales et cardiaques.
52
2. Anomalie de synthèse de testostérone a. Déficit en GH
Figure 33 : enfant avec déficit en GH.
Congénital : micropénis + crytorchdie+ hypoglycémie + ictère néonatal+RCIU. L’action de l’axe HH dépend des taux circulants de GH et IGF1
b. Déficit en 17βhydroxylase:
=>bloc partiel : virilisation incomplète à la puberté avec
Micropénis+Gynécomastie+Pilosité peu fournie +HTA (accumulation DOC).
=>Biologie: PNE et PNE ↑ stimulable par ACTH et HCG, TNE et cortisol bas, hypokaliémie, alcalose métabolique, FSH et LH ↑ à la puberté.
c. Déficit en 17-20 desmolase :
Insuffisance gonadique +/-complète sans insuffisance surrénalienne. Micropénis+ hypospadias +ectopie testiculaire.
53
d. Déficit en 3ßhydroxystéroide déshydrogénase
Bloc testiculaire et surrénalien
Bloc partiel :Micropénis + hypospadias + IS
Bio: TNE↓ après prégnyl.↑ de 17OH PNE et DHEA. ↑ d’ACTH et cortisol ↓.
e. Déficit en 17ßhydroxystéroide déshydrogénase
Bloc testiculaire rare, autosomique récessif.
Diagnostic à la puberté : exceptionnellement phénotype masculin ambigu (micropénis + ectopie ou cryptorchidie testiculaire +gynécomastie). Le plus souvent phénotype F.
Bio : TNE N ou ↓ et Δ4 androsténedione ↑ après test au prégnyl.
3. Défauts d’action de la testostérone a. Résistance partielle aux androgènes
Tableau clinique:
=> Nourrisson : ambigüité sexuelle avec hypertrophie clitoridienne. => Puberté : Virilisation incomplète avec Micropénis avec ou sans gynécomastie.
Par mutation des Récepteurs des androgènes (transmission liée à l’X)→ Résistance aux androgènes
Biologie : T/DHT < 10. FSH et LH élevés à la puberté
Confirmation : étude moléculaire du gène du récepteur des androgènes/études des Récepteurs sur biopsie cutanée des OGE.
54
• rapport T/DHT >10. LH normale ou un peu élevée, FSH normale à la puberté.
• Confirmation: étude moléculaire de gène 5 α réductase.
b. Déficits en 5α-réductase
D’un point de vue clinique, le déficit en 5 -réductase est hétérogène, il engendre des phénotypes variables allant de l’hypospadias à une apparence génitale féminine avec un pseudo-vagin.
4. Syndromes polymalformatifs a. Syndrome de Noonan
55
phénotype turnérien
Transmission autosomique dominante mutation Chromosome 12. Complications: cardiovasculaire, oculaire, osseuse.
Retard de croissance et retard pubertaire (micropénis Et cryptorchidie).
b. Syndrome de Laurence Moon
Syndrome autosomique récessif.
Paraparésie spastique, atteinte cérébelleuse, retard statural et mental sans obésité sans hexadactylie.
c. Willi Prader
56
Secondaire à une délétion du chromosome 15 d’origine paternel. L’hypogonadisme est associe à:
Hypotonie néonatale
dysmorphie faciale : front étroit, rétraction temporal, yeux en amande, lèvres sup fines, retard mental.
Obésité massive. Petite taille. Acromicrie
d. Bardet-Biedl
Figure 32 : micropénis, obésité et hexadactylie chez un enfantsuivi pour un syndrome de Bardet Biedel.
57
Syndrome à TAR rare, associe une obésité, rétinite pigmentaire, hexadactylie, atteinte rénale et retard mental.
e. Syndrome de Gordon Holmes :
Association très rare d’un HHC et d’une ataxie cérébelleuse. Le(s) gène(s) responsables ne sont pas identifiés.
Souvent familiale à transmission A R.
L’association à une dystrophie choriorétinienne = Boucher-Neuhauser.
L’IRM: Normale ou atrophie du cervelet.
f. Syndrome de Charge :
Anomalie chromosomique TAD : 8q12,1
C . = Colobome rétinien (fente de la rétine) H. = Heart disease (malformation cardiaque)
A .= Atrésie des choanes (les narines ne communiquent pas avec les voies
respiratoires
R. = Retard de croissance et du développement
G. = Génital hypoplasia (micropénis chez le garçon plus un défaut de descente
des testicules
E. = Ear anormaly (malformations de l'oreille interne et/ou externe : surdité,
58 5. Anomalies chromosomiques
a. Syndrome de Klinefelter
59
Le micropénis est associée à une cryptorchidie ou atrophie testiculaire, macroskelie, retard intellectuel majeur, troubles du caractère.
Gynécomastie dans 50% des cas.
La testostéronemie : limite inférieure de la normale ou rarement effondrée. • Les gonadotrophines : élevées par rapport à l’âge.
• Rapport oestradiol/ testostérone : 2-4 x supérieur au rapport normal. • Caryotype : Formule 47, XXY et de nombreuses combinaisons et mosaïques ont été retrouvé : XXXY, XXYY, XY/ XXY….
Le mécanisme de l’aberration chromosomique peut être : une non-disjonction des chromosomes sexuels au cours de la 1e ou de la 2e division méiotique chez l’un des parents, ou de la 1e mitose de l’œuf fécondé.
b. Trisomie 21 c. Les triploïdies
60 6. Les causes idiopathiques :
Diagnostic d’élimination.
Testostérone normal, stimulée à L’HCG/ Bourgeon répond à la testostérone exogène.(51)
Selon les principales données de la littérature, les altérations de l’axe
gonadotrope représentent 30 à 40 % des causes de micropénis, les anomalies génétiques 10 %.
Dans la moitie des cas, l’étiologie du micropénis isolé reste méconnue a ce jour. Pour ces micropénis considérés comme ≪ idiopathiques ≫, il est hautement probable que les perturbateurs endocriniens environnementaux jouent un rôle prépondérant.
Toutefois, comme nous l’avons récemment montré ces micropénis ≪ idiopathiques≫ peuvent aussi être rattachés à des anomalies génétiques non
détecté (52). De plus, l’association d’un micropénis a un hypospade, et/ou a une cryptorchidie, est évocatrice d’une anomalie de la différenciation sexuelle XY dont il est fondamental d’identifier la cause.
61
VII. La prise en charge thérapeutique :
1.
Evolution dans la prise en charge du micropénis:Historiquement, le Micropénis a été traité par la réaffectation de genre du
bébé à la naissance. (53)
L'Argent de John, le fondateur de la Clinique d'Identité de Genre au Centre Médical d'Université de John Hopkins à Baltimore a publié, en 1975, un document sur la réussite d'une étude de réaffectation de genre, dans laquelle un fils jumeau avait été élevé avec succès en tant que fille. (54)
Plus tard cette étude a été critiquée par le journaliste Colapinto de Milton car l’enfant génétiquement mâle qui avait été élevé autant que femelle décide de nouveau de changer son sexe. (54)
Le règlement de micropénis appliqué actuellement selon l'Association BRITANNIQUE d'Intersex (UKIA) préconise la thérapie hormonale, qui peut produire une longueur pénienne dans « la marge normale », ainsi que la chirurgie d’allongement au lieu de la chirurgie esthétique du changement de sexe, qui est classé comme en tant que « mauvais traitement à enfant ».(55)
2.
Les moyens thérapeutiques: a. Traitement hormonal: Androgénothérapie : Les différentes formes :
Aperçu historique de l’évolution des préparations de testostérone:
Nieschlag E. et al . (2004) décrivent l'évolution du traitement hormonale de 1940 à 2004 :
62
En 1940, un traitement à la testostérone a été mis sur le marché et sous la forme d'un réservoir implantable sous-cutanée.
A la fin des années 50 La seconde forme est venue sur le marché sous forme d'injection intramusculaire.
Les préparations orales ont commencé leur ascension en 1977 depuis 1992, les premiers patchs étaient sur le marché.
En 1992, ce fut encore le patch du scrotum,
En 1995 et 1998 ont été les timbres transdermiques. En 2002, les gels ont été commercialisés
en 2004, les premiers préparatifs buccales et des injections
intramusculaires de testostérone.
63
Actuellement :
Les injections IM :
Testostérone sterops (25-50 mg) Testoviron (50 -100 mg)
Effets secondaires : Virilisation -Accélération de la croissance et de la maturation osseuse
Androgénothérapie locale :
Andractim 2,5 % Gel pour application locale Tube gradué de 80 g
- Une graduation correspond à 5g de gel
- Composition : pour dose de 5g : 125 mg d’Androstanolone +alcool
- Effets secondaires : prise de poids, irritabilité (qui traduisent généralement
un surdosage),acné, peau grasse.
- Application : les applications d'Andractim doivent être faites par l'homme
lui-même, indifféremment le soir ou le matin, après la toilette. Etaler largement le gel sur le fourreau de la verge, en évitant l'application directe sur les muqueuses (gel alcoolique - 45°). et laisser sécher avant de remettre un vêtement sur la zone d'application. (57)
64
LH et FSH recombinante :
Chez les patients atteints d'hypogonadisme hypogonadotrophique, le traitement avec LH et de la FSH recombinante pendant la première année de la vie a réussi à induire la croissance des testicules et une faible augmentation de la longueur du pénis.
Les effets indésirables : augmentation de la pilosité et la pigmentation ainsi que des nausées intermittente.(58)
b. TTT chirurgical :
Génitoplastie masculinisante: Doit être précoce (4ème et 6 mois de la vie). Désenfouissement de la verge.
Découdure du bourgeon génital et corps caverneux.
Urétroplastie: amener le méat urétral au niveau de la fossette naviculaire. Intervention difficile.
Doit être Précédée par le traitement hormonal. Génitoplastie féminisante:
Doit être précoce
Clitoridoplastie : Résection du corps caverneux et Conservation du pédicule vasculo-nerveux dorsal. +Plastie vaginale+labioplastie en un seul temps chirurgical.
→ La gastration testiculaire : si ectopie testiculaire car risque de dégénérescence