Le préconditionnement ischémique à distance en
chirurgie de remplacement valvulaire aortique
isolé
: évaluation de l'effet cardioprotecteur
Mémoire
Annie Boisvert
Maîtrise en sciences cliniques et biomédicales - avec mémoire
Maître ès sciences (M. Sc.)
Le préconditionnement ischémique à distance en
chirurgie de remplacement valvulaire aortique isolé :
Évaluation de l’effet cardioprotecteur
Mémoire
Annie Boisvert
Sous la direction de :
Dr Pierre Voisine, directeur de recherche
Dr Yvan Douville, codirecteur de recherche
Résumé
Contexte En chirurgie cardiaque, la lésion myocardique ischémique péri-opératoire est
associée à une augmentation significative de la morbidité et de la mortalité cardiovasculaire. L’exposition au préconditionnement ischémique à distance (remote ischemic preconditioning ou RIPC) pourrait prévenir aider cette lésion myocardique. L’effet du RIPC lors d’une chirurgie de remplacement valvulaire aortique isolé a été étudié.
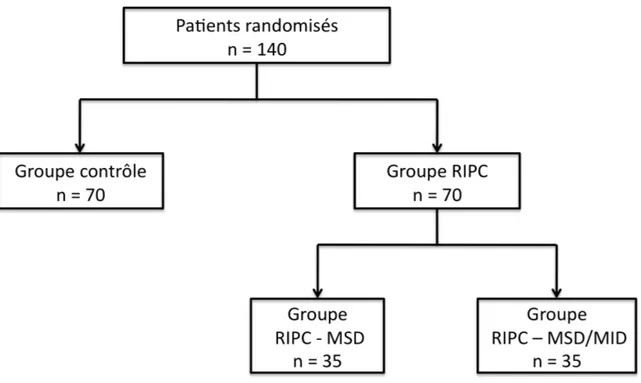
Méthodes Entre mai 2014 et juin 2018, dans un centre hospitalier tertiaire (Institut
universitaire de cardiologie et de pneumologie de Québec, [IUCPQ], Québec, Canada), 81 patients ont été randomisés, en double aveugle, au groupe RIPC ou au groupe contrôle. Le RIPC était effectué à l’aide de sphygmomanomètres, soit au membre supérieur droit ou aux membres supérieur et inférieur droits. L’issue primaire impliquait le dosage sérié des biomarqueurs d’ischémie myocardique en période postopératoire.
Résultats Les patients étaient majoritairement des hommes (58%) et l’âge moyen était de
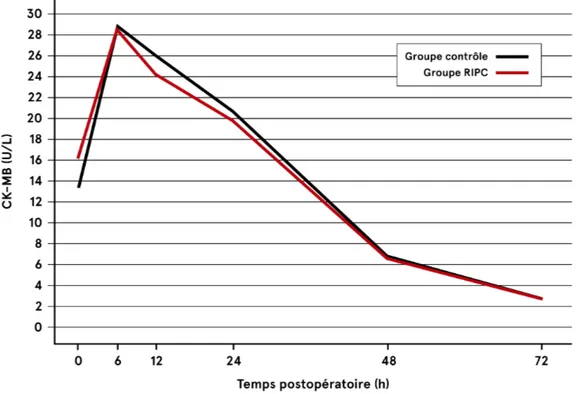
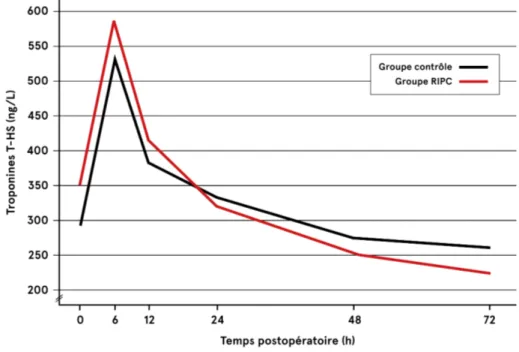
68,7 ans. Les caractéristiques de base étaient similaires dans les deux groupes, sauf pour la classe fonctionnelle. Il n’y avait pas de différence significative entre les deux groupes en regard des taux de troponines T HS et de CK-MB postopératoires (p>0,05). Les analyses de sous-groupes n’ont pas démontré de différence dans l’élévation des troponines T HS selon le nombre de sites d’ischémie et de reperfusion (p>0,05). Le RIPC n’était pas associé à une réduction de la mortalité à 30 jours (p=1,0) et n’influençait pas la fonction cardiaque (p=0,9) ou la classe fonctionnelle (NYHA p=0,09; CCS p=0,05) au suivi à 3 mois.
Conclusion Le RIPC n’a pas démontré d’effet cardioprotecteur lors d’une chirurgie de
remplacement valvulaire aortique isolé. D’autres essais cliniques randomisés d’envergure seront nécessaires pour statuer sur le potentiel effet cardioprotecteur du RIPC en chirurgie valvulaire.
Abstract
Background Perioperative myocardial injury is associated with a significant increase in
cardiovascular morbidity and mortality in the cardiac surgery population. The use of remote ischemic preconditioning (RIPC) could help preventing myocardial injury. We studied the effect of RIPC in patients undergoing isolated aortic valve replacement surgery.
Methods Between May 2014 and June 2018, in a tertiary care center (Institut universitaire
de cardiologie et de pneumologie de Québec, [IUCPQ], Quebec, Canada), 81 patients were randomized in a double blind fashion to RIPC or control group. RIPC was performed using a pressure cuff either only on the right upper extremity or on both the right upper and lower extremities. Primary outcome was defined as post-operative elevation of cardiac enzymes.
Results Patients were predominantly male (58%) with a mean age of 68.7 years. Baseline
characteristics of both groups were similar except for NYHA functional class. There were no significant differences in the postoperative levels of troponins HS T and CK-MB in the RIPC group when compared to the control group (p>0.05). In subgroup analysis, the use of multiple sites RIPC did not show a difference in troponins HS T levels when compared to the use of a single site RIPC or control group (p>0.05). RIPC was not associated with a reduction in postoperative all-cause mortality (p=1.0). RIPC did not influence cardiac function (p=0.9) or physical activity tolerance (NYHA p=0.09; CCS p=0.05) at 3 months follow-up.
Conclusion RIPC has not demonstrated a cardioprotective effect during aortic valve
replacement surgery. Larger multicenter randomized controlled trials are needed to further investigate the potential cardioprotective effect of RIPC.
Table of Contents
Résumé ... ii
Abstract... iii
Liste des tableaux... vi
Liste des figures... vii
Liste des abréviations francophones... viii
Liste des abréviations anglophones ... ix
Remerciements ... x
Introduction ... 1
Ischémie myocardique et chirurgie cardiaque ...1
Historique des techniques de cardioprotection...3
Techniques de cardioprotection contemporaines reconnues ...5
Temps de clampage ...5
Cardioplégie hyperkaliémique23...5
Arrêt circulatoire et hypothermie...6
Technique de cardioprotection à l’étude...7
Le concept de conditionnement ischémique...7
Mécanismes d’action du préconditionnement ischémique à distance...8
Le préconditionnement ischémique direct ...9
Préconditionnement ischémique à distance...11
Étude ERICCA42... 15
Étude RIPHeart43... 16
Conclusion des études contemporaines sur le RIPC ...17
Agents anesthésiques et cardioprotection ...18
Propofol intraveineux et préconditionnement ischémique à distance...19
Préconditionnement ischémique à distance et atteinte cardiaque ...21
Maladie coronarienne athérosclérotique (MCAS) significative ...21
Sténose aortique sévère ...23
Sténose aortique sévère et protection myocardique périopératoire ... 25
Préconditionnement ischémique à distance et chirurgie valvulaire ... 26
Site anatomique du préconditionnement ischémique à distance ...28
Résumé ...29
1. Protocole de recherche... 30
1.1 Devis de recherche...30
1.2 Objectifs de recherche ...31
1.2.1 Objectif principal...32
1.3 Questions et hypothèses de recherche...32
1.3.1 Question de recherche principale...32
1.3.2 Hypothèses principales de recherche ...32
1.3.2.1 Troponines T HS ... 32
1.3.2.2 CK-‐MB... 33
1.3.3 Question de recherche secondaire ...33
1.3.4 Hypothèse de recherche secondaire...34
1.4 Variables à l’étude ...34
1.4.1 Issues primaires...34
1.4.2 Issues secondaires...35
1.5 Population à l’étude...38
1.6 Taille de l’échantillon ...40
1.7 Échantillonnage et procédure de recrutement ...41
1.8 Méthodologie ...41
1.8.1 Randomisation ...41
1.8.2 Intervention expérimentale -‐ RIPC...42
1.8.2.1 Intervention – Groupe expérimental ... 43
1.8.2.2 Intervention – Groupe contrôle ... 44
1.8.3 Intervention chirurgicale...44
1.9 Profil de sécurité de l’intervention ...46
1.10 Analyses statistiques...47
1.11 Protocole portant sur l’analyse de biopsies cardiaques ...49
2. Résultats... 50
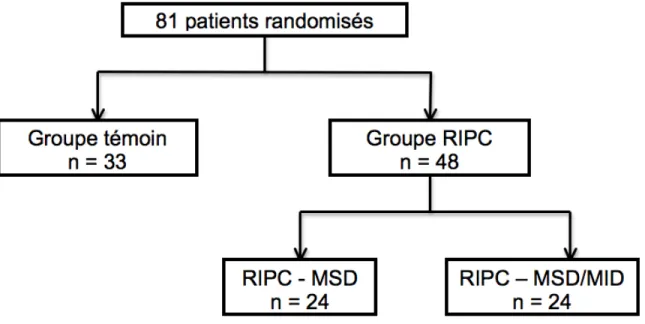
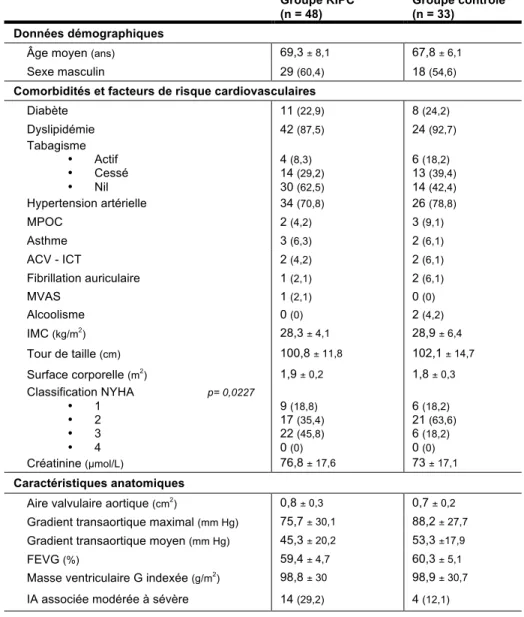
2.1 Population à l’étude...50
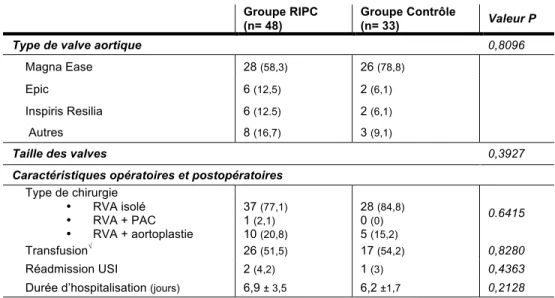
2.2 Issues primaires ...55
2.3 Issues secondaires...61
2.4 Complications et effets indésirables...64
3. Discussion... 66
3.1 Population à l’étude...66
3.2 Issues primaires ...68
3.3 Issues secondaires...71
3.4 Profil de sécurité et complications postopératoires...72
3.5 Limitations et forces de l’étude ...73
Conclusion... 76
Bibliographie ... 77
Annexes ... 87
Annexe 1 : Consentement général : Formulaire d’information et de consentement ...88
Annexe 2: Protocole d’anesthésie standardisé ...94
Liste des tableaux
Tableau 1 : Critères échocardiographiques de la sténose aortique selon la classification de
l’American Heart Association (AHA) ...24
Tableau 2 : Indications chirurgicales de remplacement valvulaire aortique...25
Tableau 3 : Variables indépendantes et dépendantes à l’étude ...35
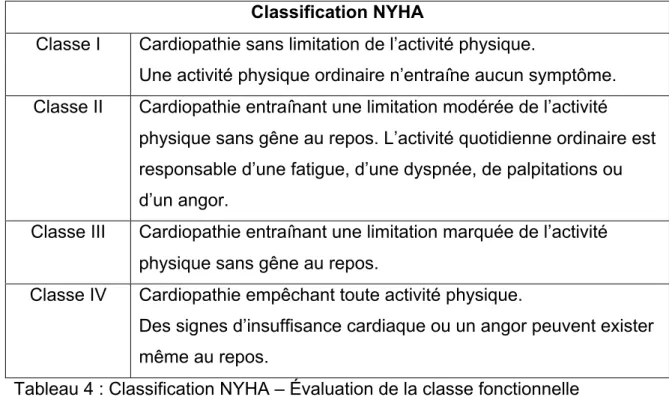
Tableau 4 : Classification NYHA - Évaluation de la classe fonctionnelle...37
Tableau 5 : Classification de la CCS - Gradation de l’angine selon le niveau d’effort ...37
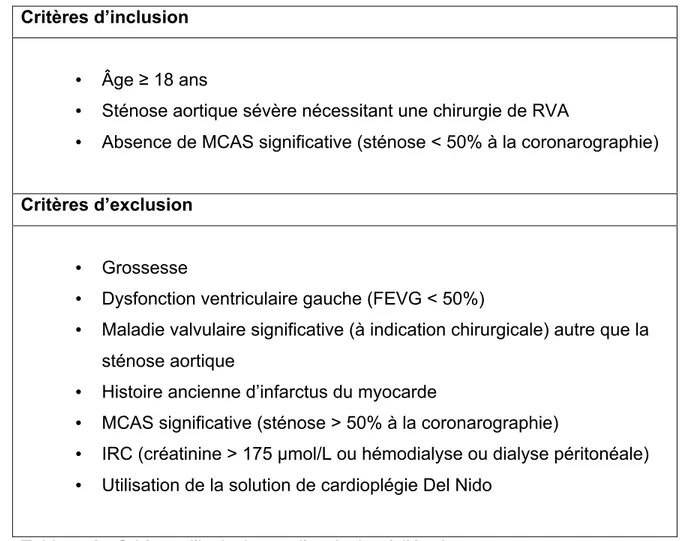
Tableau 6 : Critères d’inclusion et d’exclusion à l’étude ...40
Tableau 7 : Caractéristiques de base - Données démographiques, comorbidités et facteurs de risques cardiovasculaires et caractéristiques anatomiques dans la population à l’étude...53
Tableau 8 : Caractéristiques péri-opératoires ...55
Tableau 9 : Issues secondaires - Mortalité à 30 jours, classe fonctionnelle et fonction cardiaque à 3 mois ...63
Tableau 10 : Complications postopératoires locales et systémiques suivant une chirurgie de remplacement valvulaire aortique isolée ...65
Liste des figures
Figure 1 : Questionnaire aidant à la détermination de la classe fonctionnelle du patient selon la
classification de la NYHA...38
Figure 2: Distribution attendue des patients inclus dans l’étude...42
Figure 3 : Diagramme de flot - Distribution des patients randomisés ...50
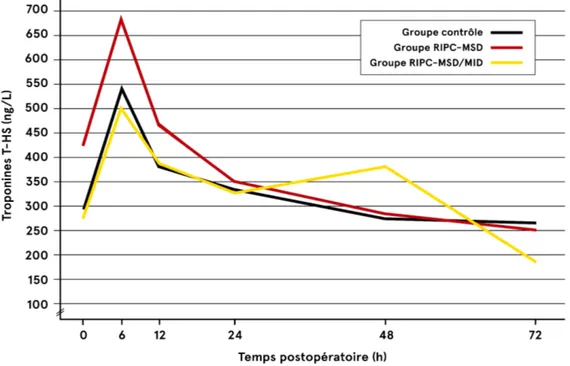
Figure 4 : Issue primaire : Élévation des CK-MB en période postopératoire de RVA isolé ...56
Figure 5 : Issue primaire : Élévation des Troponines T HS en période postopératoire de RVA isolé.56 Figure 6 : Élévation des Troponines T HS en période postopératoire de RVA isolé en excluant les valeurs extrêmes ...58
Figure 7 : Analyse de sous-groupes - Élévation des Troponines T HS en postopératoire de RVA isolé, une comparaison selon le nombre de sites de RIPC ...59
Figure 8 : Analyse de sous-groupes - Élévation des Troponines T HS en postopératoire de RVA isolé, une comparaison selon le nombre de sites de RIPC en excluant les valeurs extrêmes...60
Figure 9 : Analyse de sous-groupes - Élévation des Troponines T HS selon les valeurs médianes en postopératoire de RVA isolé, une comparaison selon le nombre de sites de RIPC...61
Liste des abréviations francophones
ATP Adénosine triphosphate AVC Accident vasculaire cérébral BBD Bloc de branche droit
BBG Bloc de branche gauche CEC Circulation extracorporelle
FEVG Fraction d’éjection du ventricule gauche HVG Hypertrophie ventriculaire gauche IA Insuffisance aortique
ICT Ischémie cérébrale transitoire IMC Indice de masse corporelle IRA Insuffisance rénale aiguë IRC Insuffisance rénale chronique
IUCPQ Institut universitaire de cardiologie et de pneumologie de Québec
IV Intraveineux
MCAS Maladie coronarienne athérosclérotique MID Membre inférieur droit
MPOC Maladie pulmonaire obstructive chronique MSD Membre supérieur droit
NO Oxyde nitrique
PAC Pontage aorto-coronarien PI3K Phosphatidylinositol-3-kinase PLC Phospholipase C
RVA Remplacement valvulaire aortique T HS Troponines T de haute sensibilité USI Unité de soins intensifs
Liste des abréviations anglophones
AHA American Heart Association CABG Coronary artery bypass graft CCS Canadian Cardiovascular Society CK-MB Creatine kinase-muscle/brain
ERRICA Effect of Remote Ischemic Preconditioning on Clinical Outcomes in CABG Surgery
HIF-1α Hypoxia-inducible factor 1 alpha
MACCE Major cardiovascular and cerebral events NEJM New England Journal of Medicine
NYHA New York Heart Association
PCI Percutaneous coronary intervention RIPC Remote ischemic preconditioning
RIPHeart Remote Ischemic Preconditioning in Heart Surgery STEMI ST segment elevation myocardial infarction
Remerciements
Je remercie tout d’abord mon directeur de maîtrise, Dr Pierre Voisine, pour son soutien, ses bons conseils et tout le temps investi dans mon projet de recherche. Merci de m’avoir donné, il y a déjà plusieurs années, cette belle opportunité. Merci de m’avoir initié au monde de la recherche en me faisant confiance dans la réalisation d’un projet d’envergure. Et surtout, merci de votre compréhension et de votre support à chacune des étapes.
Un merci tout spécial à Dre Nathalie Gilbert, ma directrice de programme de résidence en chirurgie vasculaire et co-directrice de maîtrise. Merci de votre compréhension, de votre enthousiasme et de votre support constant. Et surtout, merci d’avoir toujours cru en moi et de m’avoir encouragée à mener de front ces deux magnifiques projets.
Merci à Dr Yvan Douville pour son support et ses judicieux conseils toujours les bienvenus.
Merci à Dre Myriam Létourneau-Montminy et Dr Pascal Rhéaume pour vos conseils et vos encouragements.
Je remercie aussi la faculté de médecine de l’Université Laval et sa plateforme de recherche, le département de chirurgie cardiaque de l’IUCPQ ainsi que M. Hugo Tremblay, sans qui la réalisation de ce projet de recherche n’aurait pas été possible.
Introduction
Ischémie myocardique et chirurgie cardiaque
L’ischémie implique un manque d’oxygène à un organe cible. Ce manque en oxygène peut être attribuable à différentes situations cliniques. En ce qui a trait au cœur, la souffrance du muscle cardiaque peut être secondaire à une augmentation de la demande en oxygène du myocarde, comme lors d’un effort important ou d’un stress physiologique majeur. Par ailleurs, l’ischémie myocardique peut aussi être liée à une diminution de l’apport en sang oxygéné, comme dans la maladie coronarienne athérosclérotique significative. En effet, une sténose hémodynamiquement significative au sein d’une artère coronaire implique une diminution de l’apport en sang oxygéné en aval de cette lésion. En somme, l’ischémie myocardique résulte d’un déséquilibre entre la demande et l’apport en sang oxygéné au muscle cardiaque.
Les biomarqueurs sériques permettant de mesurer l’ischémie myocardique en clinique sont les CK-MB (créatine kinase muscle/brain) et les troponines1,2. Il existe plusieurs sous-types de troponines, dont les troponines T et I. Ces biomarqueurs sont utilisés en clinique et ils aident au diagnostic du syndrome coronarien aigu. Le stress physiologique relié à une intervention chirurgicale peut entrainer une lésion myocardique de plus ou moins grande envergure en période périopératoire, et ce, selon deux mécanismes distincts. D’une part, il peut se produire une rupture ou une érosion au niveau d’une plaque d’athérosclérose entrainant une thrombose subséquente au sein d’une artère coronaire. Il s’agit alors d’un infarctus du myocarde de type 1. D’autre part, il peut y avoir un déséquilibre entre l’apport et la demande en oxygène du myocarde menant à de l’ischémie du myocarde sans qu’il y ait d’instabilité ou de thrombose de la plaque d’athérosclérose. On parle alors d’infarctus du myocarde de type 2.3
L’ischémie myocardique n’est souhaitable en aucune circonstance, et le domaine chirurgical ne fait pas exception. Il a été démontré que le stress chirurgical initie une cascade inflammatoire, tout en entrainant une hyperactivité sympathique et un état d’hypercoagulabilité.4 À cela s’ajoutent l’hypotension en lien avec les saignements, la vasodilatation systémique et l’hypovolémie, de même que l’anémie et la tachycardie fréquemment présentes en période périopératoire. Conséquemment, il en résulte souvent une hypoperfusion du muscle cardiaque secondaire à un déséquilibre prolongé entre l’apport et la demande en oxygène menant à de l’ischémie myocardique en période périopératoire.1,2
Dans le domaine chirurgical, la littérature est vaste en ce qui concerne les risques associés à l’ischémie myocardique à la suite d’une intervention chirurgicale. Il a été démontré qu’une élévation postopératoire des troponines sériques est associée à une augmentation de la morbidité et de la mortalité cardiovasculaire, et ce, pour tous types de chirurgies. En effet, l’élévation postopératoire des troponines est un facteur prédictif indépendant de complications cardiovasculaires importantes et de mortalité à 30 jours et à un an après toute intervention chirurgicale non cardiaque et non vasculaire.7 Les investigateurs de l’étude VISION8, qui incluait des patients bénéficiant de chirurgies non cardiaques, ont aussi démontré une association significative entre l’élévation postopératoire des troponines de haute sensibilité et la mortalité à 30 jours. Cette association demeurait significative chez les patients présentant une élévation postopératoire isolée des troponines sans autre signe clinique d’ischémie myocardique (douleur rétrosternale ou changement à l’électrocardiogramme).
Le domaine de la chirurgie cardiaque ne fait pas exception à la règle. L’augmentation postopératoire des troponines et des CK-MB est fréquente, et ce, peu importe le type de chirurgie cardiaque. Plusieurs mécanismes causaux ont été mis de l’avant pour expliquer cette ischémie myocardique périopératoire. Parmi ceux-ci, notons entre autres une protection myocardique inadéquate durant la période de clampage aortique et d’arrêt cardiaque, la cardioversion
électrique/défibrillation, le trauma chirurgical et l’infarctus aigu du myocarde.9 Mokhtar et al.10 ont étudié l’impact clinique de l’élévation postopératoire des troponines sériques sur la mortalité intra-hospitalière chez les patients adultes et pédiatriques bénéficiant d’une chirurgie cardiaque non urgente. Ils ont démontré une association claire et indépendante entre l’élévation des troponines postopératoires (> 0,6 ng/mL) et la mortalité intra-hospitalière. Ils ont aussi démontré que cet effet sur la mortalité est proportionnel au degré d’élévation des troponines. Ces trouvailles sont en accord avec celles d’autres équipes qui ont établi que l’élévation postopératoire des troponines en chirurgie cardiaque est un facteur prédictif de complications postopératoires.9,11
Toutes les procédures chirurgicales cardiaques, que ce soit les chirurgies valvulaires ou de revascularisation coronarienne, sont considérées comme des procédures à risque élevé. Malgré l’amélioration des techniques chirurgicales contemporaines et des solutions de cardioplégie qui visent une meilleure protection myocardique périopératoire, les atteintes ischémiques du muscle cardiaque demeurent une complication fréquente en chirurgie cardiaque moderne. Par conséquent, les acteurs principaux du domaine, incluant les chirurgiens cardiaques, sont en recherche constante de techniques cardioprotectrices nouvelles pour améliorer l’évolution postopératoire cardiaque et globale des patients nécessitant une intervention chirurgicale cardiaque.
Historique des techniques de cardioprotection
Pour des raisons techniques évidentes, la majorité des chirurgies cardiaques se déroulent sur un cœur arrêté, non battant. Pour ce faire, le chirurgien doit induire une ischémie globale et transitoire du cœur en procédant au clampage de l’aorte thoracique ascendante et en arrêtant le cœur. Une circulation extracorporelle est alors nécessaire pour prendre le relais de la circulation systémique pendant l’arrêt du cœur.
Depuis les débuts de la chirurgie cardiaque en 1950, des techniques cardioprotectrices ont été instaurées pour limiter les effets délétères de cette ischémie cardiaque induite chirurgicalement. Historiquement, les premières chirurgies cardiaques furent effectuées sous arrêt circulatoire transitoire en combinaison avec une hypothermie systémique à 28°C14, l’hypothermie étant reconnue comme un mécanisme de protection par diminution des besoins en oxygène des organes cibles, surtout le cerveau.
Le développement de la circulation extracorporelle, en 1954, a révolutionné le domaine de la chirurgie cardiaque en permettant la perfusion systémique de sang oxygéné et en prévenant les lésions ischémiques au cerveau et aux autres organes cibles pendant l’intervention.15
Malgré l’utilisation de la circulation extracorporelle, il n’en demeurait pas moins que la mortalité périopératoire était alors très élevée. Le phénomène de cœur de pierre (stone heart) était alors fréquemment décrit. Ce phénomène commun dans les années 1960 et 1970 résultait d’une contracture soutenue et irréversible du muscle cardiaque, précipitée par l’utilisation d’ATP durant la période d’ischémie myocardique prolongée peropératoire.16
La véritable révolution de la cardioprotection en chirurgie cardiaque eut lieu dans les années 1970, grâce à l’introduction des solutions de cardioplégie à base de potassium développées aux États-Unis et en Grande-Bretagne.17 La solution de cardioplégie St. Thomas fut développée par le biochimiste David Hearse à Londres et utilisée pour la première fois lors d’une chirurgie cardiaque en 1976.18,19 La solution de cardioplégie St. Thomas était une solution cristalloïde caractérisée par une concentration élevée (16-20 mmol/L) de potassium et de magnésium et une concentration de calcium ionisé similaire à la concentration plasmatique. Il s’agissait alors de la solution de cardioplégie la plus utilisée mondialement. Ainsi, la cardioplégie à base de cristalloïde était alors la technique de cardioprotection prédominante mondialement.20
Bruckberg développa ensuite les solutions de cardioplégie à base de sang du patient.21 Ainsi, à ce jour, les solutions de cardioplégie hyperkaliémique à base de sang demeurent les plus utilisées dans le domaine de la chirurgie cardiaque moderne.20,22
Techniques de cardioprotection contemporaines reconnues
Les techniques de cardioprotection contemporaines de base reconnues et utilisées universellement de nos jours seront revues dans cette section.
Temps de clampage
L’ischémie myocardique peropératoire associée au clampage aortique et à l’arrêt du cœur est un processus progressif. En effet, la durée du clampage est associée à une ischémie plus ou moins prolongée. Une ischémie myocardique qui se prolonge est associée à des changements moléculaires et cellulaires de plus en plus sévères qui peuvent éventuellement, sans techniques concomitantes de protection myocardique comme la cardioplégie et/ou une reperfusion en temps opportun, mener à la mort cellulaire des myocytes.23 Pour limiter toute lésion ischémique irréversible du myocarde pendant une chirurgie cardiaque, il est donc important de restreindre la durée du clampage aortique dans les limites du possible.
Cardioplégie hyperkaliémique
23L’arrêt cardiaque via l’administration d’une solution de cardioplégie froide demeure à ce jour la technique cardioprotectrice de référence en termes de technique cardioprotectrice en chirurgie cardiaque. Ces solutions présentent une concentration élevée de potassium et peuvent être à base de cristalloïde ou de sang provenant du patient. Le principe d’action des solutions de cardioplégie hyperkaliémique est basé sur l’arrêt cardiaque par dépolarisation cellulaire. L’hyperkaliémie induit un nouveau potentiel de repos positif au sein des myocytes,
qui deviennent dépolarisés comparativement à la normale, ce qui entraine l’arrêt cardiaque.
L’administration de la cardioplégie peut être antégrade, soit en perfusant les ostia des artères coronaires, ou rétrograde via le sinus coronaire selon la situation clinique. L’administration d’une solution de cardioplégie hyperkaliémique doit être répétée à intervalles réguliers d’environ 15 à 20 minutes lors d’une intervention chirurgicale prolongée pour optimiser l’effet cardioprotecteur.
Arrêt circulatoire et hypothermie
L’arrêt circulatoire sous hypothermie profonde demeure une technique de protection utilisée en association avec la cardioplégie lors de chirurgies cardiaques complexes impliquant l’aorte. Cette technique a été décrite pour la première fois en 1975 en chirurgie aortique par Griepp et al.24 comme une méthode de protection cérébrale. D’une part, l’arrêt circulatoire permet au chirurgien de travailler dans un champ opératoire exempt de sang et d’autre part, l’hypothermie profonde diminue le métabolisme cérébral au minimum, ce qui favorise la protection neurologique et optimise la prévention des séquelles neurologiques pouvant découler de l’arrêt transitoire de perfusion25. L’arrêt circulatoire systémique hypothermique en
association avec une canule de perfusion cérébrale antégrade sélective favorise encore davantage la protection neurologique.26
L’hypothermie systémique a aussi été prouvée comme un moyen de protection très efficace de tout organe. En effet, le métabolisme d’un organe diminue de 50% à chaque baisse de 6°C de la température corporelle.27
Ainsi, l’arrêt circulatoire et l’hypothermie ne sont pas exclusivement des techniques de cardioprotection, mais également des techniques de protection cérébrale et systémique.
Technique de cardioprotection à l’étude
Le concept de conditionnement ischémique
Parmi les techniques cardioprotectrices étudiées, on retrouve depuis longtemps le concept du conditionnement ischémique dans la littérature chirurgicale, mais aussi plus spécifiquement dans la littérature de chirurgie cardiaque. Ce concept fut rapporté pour la première fois en 1986 par Murry et al.13 Il est reconnu que le conditionnement ischémique offre une protection cardiaque en diminuant la taille de l’infarctus en lien avec une période prolongée d’ischémie coronarienne, à condition que cette période d’ischémie soit suivie d’une période de reperfusion. Le conditionnement ischémique n’offre aucune protection dans le contexte d’une occlusion coronarienne irréversible.35 Dans un article de synthèse publié en 2016 sur le sujet par Heusch et Rassaf12, plusieurs concepts clés en lien avec le conditionnement ischémique fréquemment mentionnés dans la littérature ont été définis:
- Ischémie : Période de blocage du flot sanguin artériel entrainant un manque d’apport en sang oxygéné à un organe cible.
- Reperfusion : Période correspondant à la levée du blocage du flot sanguin suite à une période d’ischémie entrainant le retour du flot sanguin artériel dans un organe cible.
- Préconditionnement ischémique (ou préconditionnement ischémique direct): Épisodes transitoires d’ischémie et de reperfusion myocardique effectués directement au niveau du cœur précédant une occlusion coronarienne prolongée pouvant mener à un infarctus du myocarde.
- Post-conditionnement ischémique : Épisodes transitoires de ré-occlusion coronarienne et de reperfusion dans la phase immédiate de reperfusion suivant une occlusion coronarienne prolongée ayant mené à un infarctus du myocarde.
- Conditionnement ischémique à distance : Épisodes transitoires d’ischémie et de reperfusion d’un organe à distance de l’organe cible, soit le cœur. Ces brèves périodes d’ischémie et de reperfusion peuvent précéder (Préconditionnement ischémique à distance ou Remote ischemic preconditioning
(RIPC)), suivre (post-conditionnement ischémique à distance) ou se produire en
parallèle (perconditionnement ischémique à distance) l’occlusion coronarienne mettant à risque d’infarctus du myocarde.
Mécanismes d’action du préconditionnement ischémique à distance
Le ou les mécanismes d’action exacts du préconditionnement ischémique à distance en chirurgie cardiaque demeurent inconnus à ce jour. Toutefois, de multiples hypothèses ont été avancées.
Les lésions myocardiques d’ischémie et de reperfusion se définissent comme le dommage aux cardiomyocytes lorsque le flot sanguin est restauré après une période plus ou moins prolongée d’ischémie. Il en résulte des dommages oxydatifs et une augmentation de l’inflammation au sein du myocarde, ce qui peut mener à une dysfonction cardiaque.55
Dans la littérature, le préconditionnement ischémique est souvent associé à deux fenêtres de protection myocardique56, soit la fenêtre initiale, qui s’étend jusqu’à 3 heures suivant la reperfusion myocardique, et la deuxième, qui a lieu dans les 12 à 72 heures suivant l’intervention.57 Le mécanisme impliqué dans cette protection en deux temps n’est pas bien compris encore aujourd’hui.
Plusieurs molécules et substances susceptibles d’expliquer l’effet cardioprotecteur du préconditionnement ont été étudiées. Parmi celles-ci, on retrouve deux voies de signalisation intracellulaire impliquant le phosphatidylinositol-3-kinase (PI3K) et la phospholipase C (PLC). L’oxyde nitrique (NO) et les récepteurs l’adénosine semblent aussi impliqués.58
Le facteur HIF-1α (Hypoxia-inducible factor 1 alpha) a été étudié en lien avec le préconditionnement ischémique à distance. HIF-1α est un facteur de transcription ayant un rôle clé dans l’adaptation cellulaire à l’hypoxie et à l’ischémie.59 Le rôle de l’activation du facteur HIF-1α dans l’effet cardioprotecteur du préconditionnement ischémique à distance a été étudié chez l’animal et l’humain59,60,61. Toutefois, les résultats de plusieurs études sont contradictoires et le rôle exact du facteur HIF-1α dans l’effet cardioprotecteur du préconditionnement reste à établir.
Le préconditionnement ischémique direct
Le préconditionnement ischémique direct en chirurgie cardiaque est un concept connu dans la littérature médicale depuis plus de 30 ans. Initialement étudié chez les animaux, il fut par la suite étudié chez l’humain. Le préconditionnement ischémique direct implique de soumettre le cœur lui-même à des périodes transitoires et répétées d’ischémie et de reperfusion avant la période de clampage aortique prolongé associé à la procédure chirurgicale.12
En effet, si on retourne aux premières expérimentations effectuées sur les animaux, des chercheurs de l’université Duke démontraient dans les années 80 que de soumettre un organe à des périodes brèves et répétées d’ischémie n’avait pas d’effet délétère notable.36 En effet, ils démontrèrent que de soumettre un organe à 4 périodes de 10 minutes d’ischémie produisait une déplétion en ATP moins importante qu’une occlusion prolongée de 40 minutes. De plus, de courtes occlusions intermittentes n’entraînaient pas de mort cellulaire, tandis qu’une occlusion prolongée entraînait des changements irréversibles associés à une mort cellulaire. Ainsi, Reimer et al. démontraient alors que la reperfusion intermittente a un effet protecteur sur les effets cumulatifs négatifs d’un dommage ischémique. Ces périodes de reperfusion intermittente permettraient, en quelque sorte, de nettoyer les tissus des catabolites accumulés durant le temps d’ischémie.
En 1986, Murry et al.13 ont étudié l’effet du préconditionnement ischémique direct en procédant à de courtes occlusions répétées de l’artère circonflexe
entrecoupées de périodes de reperfusion, pour finir avec une occlusion soutenue de la coronaire (40 minutes). Le groupe contrôle était soumis à une occlusion soutenue de l’artère circonflexe (40 minutes). Les auteurs ont démontré une diminution significative de la taille de l’infarctus dans le groupe expérimental, soit 25% de la taille de la zone d’infarctus dans le groupe contrôle. Lorsque l’occlusion était prolongée à 3 heures, il n’y avait pas de différence entre les deux groupes quant à la taille de l’infarctus. Ainsi, l’effet bénéfique du préconditionnement ischémique était perdu lors d’une période très prolongée d’occlusion coronarienne. Par ailleurs, avec leur étude, Murry et al. étaient parmi les premiers à établir un corollaire entre leurs résultats portant sur le préconditionnement ischémique direct et la maladie coronarienne athérosclérotique (MCAS). Ils suggéraient alors que les périodes d’angor précédant souvent l’infarctus aigu du myocarde chez l’homme pouvaient avoir un certain effet protecteur et retarder la mort cellulaire suivant l’occlusion coronaire prolongée. Ils avançaient aussi que ce préconditionnement ischémique naturel en MCAS significative permet le sauvetage d’un plus grand capital myocardique si une intervention de reperfusion coronarienne est effectuée dans un délai raisonnable.
Toutefois, le préconditionnement ischémique direct implique une intervention invasive directement au niveau du cœur. Les périodes d’ischémie et de reperfusion directes sont réalisées en procédant à un clampage séquentiel des artères coronaires ou de l’aorte ascendante proximale, exposant ainsi le cœur lui-même à de courtes périodes d’ischémie monitorées. Les périodes de reperfusion du réseau coronaire qui suivent chaque période brève d’ischémie visent à prévenir les effets néfastes cumulatifs des insultes ischémiques répétées.13 En chirurgie cardiaque,le but premier de cette technique est de préparer le muscle cardiaque à la période d’ischémie myocardique prolongée inévitable pendant l’intervention. En effet, le myocarde sera soumis à un stress ischémique prolongé lors de l’arrêt du cœur, pendant la période de clampage aortique, permettant ainsi au chirurgien de procéder à son intervention chirurgicale.
Ainsi, le préconditionnement ischémique direct est une technique invasive qui s’associe à des risques non négligeables, notamment le risque de déchirure et de dissection de la paroi artérielle pouvant avoir des conséquences graves, voire fatales pour le patient.
Les études antérieures portant sur le sujet ont principalement porté sur l’effet du préconditionnement direct en chirurgie de pontages aorto-coronariens en mesurant les biomarqueurs sériques de l’ischémie myocardique, soit les CK-MB et/ou les troponines en période postopératoire. Bien que les résultats de l’ensemble de ces études soient quelque peu hétérogènes, les dernières études publiées sur le sujet par Ji et al.37, Amr et al.38 et Forouzannia et al.39 ont démontré des résultats
encourageants en ce qui a trait au potentiel cardioprotecteur de la technique en chirurgie de revascularisation coronarienne. Le concept de préconditionnement ischémique direct n’a donc pas été complètement délaissé dans le domaine de la chirurgie cardiaque. Cependant, devant son profil de complications majeures potentielles et l’absence de grandes études prospectives démontrant hors de tout doute l’effet cardioprotecteur du préconditionnement ischémique direct, cette technique n’est pas utilisée de façon routinière en chirurgie cardiaque moderne. L’utilisation du préconditionnement direct ayant été assombrie par le caractère invasif de la technique, cela n’a toutefois pas diminué l’intérêt scientifique associé au concept de conditionnement ischémique. C’est en cherchant une technique moins invasive, donc moins risquée pour le patient, que le concept de préconditionnement ischémique à distance fit son apparition dans la littérature chirurgicale au début des années 2000.12
Préconditionnement ischémique à distance
Le préconditionnement ischémique à distance, de l’anglais remote ischemic
preconditioning (RIPC), a été introduit dans le domaine chirurgical comme une
alternative sécuritaire au préconditionnement ischémique direct. Le RIPC implique qu’un organe à distance du cœur, soit un membre supérieur et/ou un membre inférieur, soit soumis en alternance à de courtes périodes d’ischémie et de
reperfusion avant la période d’ischémie myocardique peropératoire attendue. Ce concept veut que ces cycles de préconditionnement effectués sur un organe à distance protègent le cœur de potentielles lésions ischémiques durant une chirurgie cardiaque nécessitant l’arrêt cardiaque et l’utilisation d’une circulation extracorporelle.
Traditionnellement, les périodes d’ischémie du membre sont réalisées à l’aide d’un sphygmomanomètre standard qui est positionné au niveau du bras ou de la cuisse. Le brassard est gonflé à un niveau de pression supérieur à la tension artérielle systolique du patient, soit entre 200 et 220 mm Hg, pour occlure le réseau artériel et induire une période transitoire d’ischémie des muscles squelettiques du membre donné. Ces brèves périodes d’ischémie sont entrecoupées de périodes de reperfusion durant lesquelles le brassard à pression est complètement dégonflé, permettant ainsi une récupération de la circulation sanguine au niveau du membre. Le préconditionnement ischémique à distance est typiquement pratiqué dans les minutes précédant le début de l’intervention chirurgicale et l’initiation de la circulation extracorporelle. Le patient est alors sous anesthésie générale et ne ressent pas d’inconfort en lien avec les périodes d’ischémie du membre.
On considère le RIPC comme une alternative sécuritaire et non invasive au préconditionnement ischémique direct. Le fait de gonfler un brassard à pression pour occlure la circulation artérielle d’un membre pour de courtes périodes n’entraine aucune lésion ischémique significative. En effet, si on regarde la littérature de chirurgie orthopédique et de chirurgie plastique, il est sécuritaire d’exposer un membre à une courte période d’ischémie à l’aide d’un brassard à pression faisant office de garrot. Une étude rétrospective portant sur 500 patients ayant bénéficié d’une intervention chirurgicale au membre supérieur avec utilisation concomitante d’un garrot pneumatique a démontré que l’utilisation du garrot pneumatique est sécuritaire40. Dans la population étudiée, il n’y a eu aucune complication immédiate ou retardée, locale ou systémique associée à l’utilisation
du garrot pneumatique. Les auteurs concluent donc que l’utilisation d’un garrot à une pression de 250 mmHg ou moins pour une durée maximale de deux heures d’ischémie est sécuritaire, même chez les patients âgés présentant de multiples comorbidités.40
Au cours des vingt dernières années, de nombreuses études portant sur les effets du préconditionnement ischémique à distance en cardiologie et chirurgie cardiaque ont été publiées. Heusch et Rassaf12 ont répertorié les publications portant sur le RIPC. De multiples publications portant sur le préconditionnement ischémique à distance en contexte de MCAS significative sont répertoriées dans le domaine de la cardiologie. Le RIPC en contexte d’infarctus aigu du myocarde avec élévation du segment ST (STEMI) et en contexte d’angioplastie coronarienne percutanée (PCI) élective a été étudié par plus de vingt équipes de recherche, avec des résultats encourageants démontrant pour la plupart un effet cardioprotecteur du RIPC en STEMI et en revascularisation coronarienne élective.
L’étude du préconditionnement ischémique à distance en chirurgie cardiaque n’a toutefois pas démontré des résultats aussi clairs quant à l’effet cardioprotecteur potentiel de la technique.12 En effet, le RIPC a été étudié chez différentes populations de patients en chirurgie cardiaque37,41,42,43. La majorité des publications sur le sujet portent sur une population de patients nécessitant une revascularisation coronarienne par pontages aorto-coronariens, associée ou non à une autre procédure chirurgicale comme un remplacement valvulaire, par exemple. Plusieurs équipes ont aussi étudié le préconditionnement ischémique à distance chez une population de patients d’âge adulte ou pédiatrique, nécessitant une chirurgie cardiaque sans égard au type d’intervention pratiquée. Ainsi, les populations étudiées étaient souvent hétérogènes et les résultats obtenus lors de ces études, quant au potentiel cardioprotecteur du RIPC en chirurgie cardiaque, sont tout aussi hétérogènes. Donc, la diminution attendue des biomarqueurs sériques de l’ischémie myocardique lors d’une exposition au RIPC n’a pas été observée de façon reproductible dans les études publiées à ce jour.
Une revue systématique avec méta-analyse regroupant les essais cliniques randomisés portant sur le RIPC a été publiée en 2015 par Le Page et al.41 Cette revue systématique inclut des études portant sur des populations à risque élevé de lésion myocardique, notamment en revascularisation coronarienne percutanée et en chirurgie cardiaque ou lors de chirurgies vasculaires majeures. Les données concernant l’élévation des biomarqueurs (CK-MB et troponines) en postopératoire ainsi que les issues cliniques pertinentes comme la mortalité, l’infarctus du myocarde et les complications majeures cérébrales et cardiovasculaires (MACCE :
major cardiovascular and cerebral events) étaient comptabilisées. Cette
méta-analyse, bien que portant sur une population hétérogène de patients médicaux et chirurgicaux, a démontré que le préconditionnement ischémique à distance est une méthode de cardioprotection efficace pour diminuer les lésions myocardiques ischémiques et qu’il diminue les complications cliniques à long terme, incluant la mortalité et les MACCE.
Les résultats de Le Page et al.41 vont dans le même sens que ceux publiés dans la méta-analyse de Yang et al.72 publiée en 2013. En effet, cette méta-analyse portait sur l’étude du préconditionnement ischémique à distance en chirurgie cardiaque et incluait des patients d’âges pédiatrique et adulte. Tous les types de chirurgie cardiaque étaient inclus dans la revue systématique, dont les pontages aorto-coronariens, les chirurgies valvulaires et les chirurgies cardiaques congénitales. Yang et al. concluaient que le préconditionnement ischémique à distance a un effet cardioprotecteur en chirurgie cardiaque. En effet, ils ont démontré une diminution de l’élévation des biomarqueurs de l’ischémie myocardique, les CK-MB et les troponines, lorsque les patients sont exposés au RIPC. Ils n’ont toutefois pas démontré d’impact sur la mortalité postopératoire.72
Dans un même ordre d’idée, Haji Mohd Yasin et al.73 publiaient en 2014 une méta-analyse qui étudiait l’effet du RIPC en chirurgie cardiaque sur le cœur, mais aussi sur des organes à distance comme les reins et les poumons. Elle regroupe
les résultats de 16 études portant sur l’effet cardioprotecteur du préconditionnement ischémique à distance en chirurgie cardiaque de tous types. Les résultats de la méta-analyse ont démontré un effet cardioprotecteur significatif du RIPC. Cependant, aucun effet protecteur du RIPC au niveau rénal et pulmonaire n’a été mis en évidence. Les études s’attardant à l’effet rénal (n=6) et à l’effet pulmonaire (n=3) étaient toutefois peu nombreuses.
Bien que de tels résultats soient encourageants quant à l’effet cardioprotecteur de préconditionnement ischémique à distance, les résultats des méta-analyses présentées précédemment41,72,73 n’incluent pas les deux études d’envergure de
phase III publiées dans le New England Journal of Medicine (NEJM).42, 43 En 2015,
les études ERICCA (Effect of Remote Ischemic Preconditioning on Clinical
Outcomes in CABG Surgery) et RIPHeart (Remote Ischemic Preconditioning in Heart Surgery) ont été publiées et concluent toutes les deux à un effet neutre du
RIPC. Ces deux études phares seront revues plus en détails.
Étude ERICCA42
Devis Il s’agit d’un essai clinique randomisé prospectif multicentrique britannique
dont le but premier était de déterminer si le préconditionnement ischémique à distance améliore les issues cliniques des patients bénéficiant d’une chirurgie de revascularisation coronarienne.
Protocole L’étude incluait 1612 patients à risque chirurgical élevé ayant bénéficié
de pontages aorto-coronariens impliquant une circulation extracorporelle et l’utilisation d’une solution de cardioplégie à base de sang. La chirurgie de revascularisation coronarienne pouvait être associée ou non à une chirurgie valvulaire. Les participants étaient assignés aléatoirement au groupe préconditionnement ischémique à distance ou au groupe contrôle. Le protocole de RIPC impliquait 4 cycles de 5 minutes d’ischémie au membre supérieur, à l’aide d’un brassard à pression gonflé à 200 mm Hg, entrecoupés de périodes de
reperfusion de 5 minutes. Il est à noter que la gestion anesthésique et périopératoire des patients inclus dans l’étude ERRICA n’était pas standardisée.
Issues L’issue primaire composée de l’étude incluait la mortalité de causes
cardiovasculaires, l’infarctus du myocarde, la nécessité de revascularisation coronarienne supplémentaire et l’accident vasculaire cérébral (AVC) à 12 mois. L’issue secondaire incluait entre autres l’aire sous la courbe de l’élévation postopératoire à 72 heures des troponines T HS.
Conclusion L’étude ERICCA n’a pas démontré de différence significative entre les
deux groupes en ce qui a trait aux issues primaires et secondaires préalablement établies. Le RIPC n’a donc pas eu d’impact clinique bénéfique à 12 mois, ni d’impact sur la diminution de la lésion myocardique postopératoire en comparaison avec le groupe contrôle.
Étude RIPHeart43
Devis L’étude RIPHeart est un essai clinique randomisé prospectif à double
aveugle s’étant déroulé dans 14 centres hospitaliers en Allemagne. Cette étude d’envergure avait pour objectif de déterminer si le préconditionnement ischémique à distance pouvait avoir un impact clinique bénéfique en chirurgie cardiaque.
Protocole L’étude incluait 1403 patients d’âge adulte ayant bénéficié d’une
chirurgie cardiaque nécessitant une circulation extracorporelle, peu importe la nature exacte de l’intervention chirurgicale. Les participants étaient assignés aléatoirement au groupe préconditionnement ischémique à distance ou au groupe contrôle. Le protocole de RIPC était presque en tout point similaire à celui de l’étude ERICCA42. Il impliquait lui aussi 4 cycles de 5 minutes d’ischémie au membre supérieur entrecoupés de période de reperfusion (5 minutes). Les périodes d’ischémie étaient réalisées à l’aide d’un brassard à pression gonflé à 200 mm Hg ou à au moins 15 mm Hg de plus que la tension artérielle systolique
du patient. Le protocole anesthésique était standardisé et impliquait le maintien de l’anesthésie générale sous propofol intraveineux.
Issues L’issue primaire composée de l’étude incluait la mortalité, l’infarctus du
myocarde, l’AVC et l’insuffisance rénale aiguë lors de l’hospitalisation postopératoire. L’issue secondaire incluait les mêmes complications que l’issue primaire mais à 90 jours.
Conclusion L’étude RIPHeart s’est avérée neutre. En effet, l’utilisation du
préconditionnement ischémique à distance n’a pas apporté de bénéfice clinique significatif à court et moyen terme chez une population de patients nécessitant une chirurgie cardiaque.
Conclusion des études contemporaines sur le RIPC
En somme, les études antérieures portant sur le préconditionnement ischémique à distance en chirurgie cardiaque ont, à ce jour, offert des résultats contradictoires et le bénéfice réel du RIPC comme technique cardioprotectrice reste à prouver. Plusieurs publications sur le RIPC, incluant les deux études d’envergure publiées dans le NEJM en 201542,43, impliquent des populations chirurgicales hétérogènes,
incluant même parfois une clientèle pédiatrique. Ces études incluent des patients bénéficiant d’une variété de chirurgies cardiaques, mais majoritairement des chirurgies de pontages aorto-coronariens en situation de maladie coronarienne athérosclérotique significative, ce qui pourrait avoir un impact sur l’effet du préconditionnement ischémique à distance. En effet, la maladie coronarienne constitue potentiellement un facteur de préconditionnement ischémique en elle-même, puisqu’elle résulte en des périodes d’ischémie myocardique répétées. Face à une telle hétérogénéité dans les populations étudiées, il est légitime de se demander si un potentiel effet cardioprotecteur du préconditionnement ischémique à distance en chirurgie cardiaque a été camouflé. Effectivement, une multitude de pathologies cardiaques peuvent mener à une intervention chirurgicale. La
pathophysiologie de chacune de ces conditions diffère et elles ne sont pas toutes associées à la même susceptibilité myocardique à l’ischémie lors d’une intervention chirurgicale nécessitant un arrêt cardiaque et l’utilisation d’une circulation extracorporelle.
Récemment, plusieurs équipes de recherche se sont intéressées à des populations plus homogènes de patients chirurgicaux, soit les patients nécessitant une chirurgie valvulaire. Ce sujet sera abordé dans une section à venir.
De plus, le concept de conditionnement anesthésique est aussi bien connu en chirurgie cardiaque. Tel que mentionné brièvement dans une section précédente, le propofol et les gaz volatiles, comme le sévoflurane et l’isoflurane, ont été étudiés et leur effet cardioprotecteur est reconnu.31,32,33,34 Toutefois, l’association du
propofol et du préconditionnement ischémique à distance en chirurgie cardiaque ne semble pas avoir l’effet cardioprotecteur global attendu des deux mécanismes de conditionnement.
Agents anesthésiques et cardioprotection
Le propofol (2,6-diisopropylphenol) est un agent anesthésique intraveineux fréquemment utilisé pour l’induction et le maintien de l’anesthésie générale en chirurgie cardiaque. Le propofol est reconnu pour ses propriétés cardioprotectrices. Des études expérimentales sur les animaux ont prouvé que le propofol diminue les lésions myocardiques d’ischémie et de reperfusion.28,29,30 Lemoine et al. ont démontré en 2016 l’implication de la mitochondrie dans l’effet cardioprotecteur du propofol chez l’humain.31
L’effet cardioprotecteur du propofol fut aussi étudié lors de différents types de chirurgie cardiaque. Xia et al ont démontré que l’administration de propofol à haute dose lors d’une chirurgie de revascularisation coronarienne sous circulation extracorporelle diminue le dommage myocardique postopératoire mesuré par le
dosage des troponines I lorsque comparé à un anesthésique volatil, l’isoflurane.32 Jovic et al. ont quant à eux démontré que l’association du propofol et du sévoflurane avait un effet cardioprotecteur lors d’une chirurgie de remplacement valvulaire aortique isolé avec circulation extracorporelle dans le contexte d’une sténose aortique sévère. Cet effet cardioprotecteur ressortait dans différentes voies de signalisation mitochondriales.33
Lors d’études chez les animaux, il a été démontré que les anesthésiques volatils, et plus spécifiquement le sévoflurane44 et l’isoflurane45,46,47, diminuent la taille d’un infarctus lorsqu’administrés avant la période d’ischémie myocardique. Chez l’humain, l’isoflurane administré avant la clampage aortique en chirurgie de pontages aorto-coronariens semble efficace pour diminuer l’ischémie myocardique.48 Cependant, les études portant sur le préconditionnement
anesthésique avec les agents volatiles n’ont pas démontré des résultats aussi uniformes chez l’humain que chez l’animal. L’effet cardioprotecteur des agents volatiles n’a pas été démontré sans équivoque en chirurgie cardiaque.49,50-51
Finalement, des équipes de recherche ont aussi étudié l’effet du propofol lorsqu’ajouté à la solution de cardioplégie sur la cardioprotection lors d’une chirurgie cardiaque nécessitant une circulation extracorporelle. Lim et al. ont démontré que le propofol en ajout à une solution de cardioplégie protège le cœur des lésions d’ischémie et de reperfusion lors d’une chirurgie cardiaque.34
Propofol intraveineux et préconditionnement ischémique à distance
Tel que discuté précédemment, on retrouve dans la littérature des éléments qui démontrent que le propofol et les agents anesthésique volatils ont un effet cardioprotecteur en chirurgie cardiaque. Par contre, cet effet bénéfique ne semble pas le même en association avec le préconditionnement ischémique à distance.Lorsque comparée à celle des agents anesthésiques volatils, comme l’isoflurane, il a été démontré que l’utilisation du propofol en chirurgie cardiaque abolit l’effet cardioprotecteur potentiel du préconditionnement ischémique à distance. Un essai clinique randomisé par Kottenberg et al.52 démontrait que, en chirurgie de revascularisation coronarienne, la combinaison du RIPC et de l’anesthésie générale sous isoflurane diminuait la lésion myocardique mesurée par l’élévation postopératoire des troponines. Aucun effet cardioprotecteur ne fut toutefois noté lorsque le protocole de RIPC était effectué en combinaison avec une anesthésie générale sous propofol intraveineux.
D’autres équipes en sont aussi venues à la même conclusion quant à l’abolition de l’effet cardioprotecteur du préconditionnement ischémique à distance lors de l’utilisation du propofol.53 Notamment, Bautin et al.53 ont démontré un effet
cardioprotecteur du RIPC en chirurgie de remplacement valvulaire aortique (RVA) isolé lorsque le sévoflurane était utilisé comme agent anesthésiant. Le préconditionnement ischémique à distance en combinaison avec l’utilisation du propofol n’était pas associé à une diminution de la lésion myocardique ischémique en RVA isolé.
Par ailleurs, une méta-analyse publiée en 2015 vient confirmer les résultats des études précédemment mentionnées.54 En effet, Zangrillo et al. concluent qu’en chirurgie cardiaque l’utilisation d’agents volatils seuls ou en combinaison avec le préconditionnement ischémique à distance a un effet cardioprotecteur et diminue la mortalité lorsque comparée à l’utilisation d’un protocole d’anesthésie intraveineuse totale.
En somme, le propofol comme agent anesthésiant en combinaison avec le préconditionnement ischémique à distance en chirurgie cardiaque semble abolir l’effet cardioprotecteur tant recherché.53,54 Plusieurs questionnements relatifs à l’effet cardioprotecteur réel du RIPC et à son ampleur font surface lorsqu’une telle notion est mise à jour. Effectivement, il est légitime de se questionner quant aux
résultats neutres des deux études d’envergure de phase III publiées en 2015 dans le NEJM.42,43 Le protocole d’anesthésie utilisé lors des cas randomisés dans l’étude ERICCA42 n’était pas standardisé et plus de 90% des patients ont reçu du propofol lors de leur anesthésie générale. Quant aux patients randomisés dans l’étude RIPHeart43, ils ont tous bénéficié d’une anesthésie générale avec propofol intraveineux. Ainsi, l’association du préconditionnement ischémique à distance et du propofol pourrait expliquer l’absence d’effet cardioprotecteur noté chez les patients chirurgicaux exposés au RIPC.
Préconditionnement ischémique à distance et atteinte cardiaque
Maladie coronarienne athérosclérotique (MCAS) significative
La maladie coronarienne athérosclérotique est répandue dans la population adulte et demeure encore aujourd’hui une cause majeure de morbidité et de mortalité cardiovasculaire au Canada.64 Selon Statistique Canada, 29% des décès étaient causés par une pathologie cardiovasculaire en 2011. Parmi ces décès, 54% étaient secondaires à une atteinte cardiaque ischémique.65
Historiquement, on considère une sténose coronarienne comme significative et nécessitant un traitement lorsqu’elle atteint au moins 50% du diamètre de l’artère.62 Il s’agit du seuil reconnu et utilisé dans le traitement de la maladie coronarienne depuis 1976.63
Le traitement de la MCAS est complexe et a beaucoup évolué dans les dernières années. Le traitement médical optimal demeure la pierre angulaire de la prise en charge de la MCAS.64 L’angioplastie coronarienne percutanée prend de plus en plus de place dans le traitement de la MCAS de nos jours. Toutefois, bien que le traitement endovasculaire de la MCAS soit en plein essor, la revascularisation chirurgicale par pontages aorto-coronariens a encore sa place dans l’algorithme de traitement de la MCAS.
Selon les dernières lignes directrices publiées en 2014 par la Société canadienne de cardiologie64, les recommandations actuelles favorisent la revascularisation chirurgicale chez certaines populations spécifiques de patients. Les patients porteurs d’une maladie coronarienne pluri-tronculaire devraient être considérés pour des pontages aorto-coronariens, surtout dans le contexte de diabète et/ou d’insuffisance cardiaque concomitants. Les patients porteurs d’une valvulopathie à indication chirurgicale et d’une MCAS significative sont aussi candidats à des pontages aorto-coronariens dans le même temps chirurgical que leur intervention valvulaire.
Malgré les développements majeurs et l’amélioration du traitement médical préventif, la maladie coronarienne demeure très répandue et son traitement chirurgical demeure à ce jour la procédure la plus souvent pratiquée en chirurgie cardiaque. Ainsi, il n’est pas surprenant que les patients bénéficiant de pontages aorto-coronariens constituent la catégorie de patients la plus représentée dans les études portant sur le RIPC. Toutefois, tel que mentionné précédemment, force est d’admettre que les résultats de ces études n’ont pas démontré un effet cardioprotecteur clair et reproductible du préconditionnement ischémique à distance dans cette population particulière de patients nécessitant une chirurgie cardiaque.12,41,42,43
Se pourrait-il que la physiopathologie de la MCAS significative soit en fait l’explication des résultats neutres des études portant sur le RIPC dans cette population spécifique?
Les patients porteurs d’une MCAS à indication chirurgicale présentent des sténoses coronariennes significatives d’au moins 50% impliquant un frein hémodynamique certain à l’apport sanguin myocardique. Que le mode de présentation de leur MCAS soit un infarctus aigu du myocarde ou de l’angor, ces patients ont été exposés de façon plus ou moins importante à de l’ischémie myocardique chronique.
Déjà en 1986, Murry et al.13, qui commençaient à étudier le préconditionnement ischémique direct, suggéraient, suite à leurs premières expérimentations, que les multiples épisodes d’angor qui précèdent souvent un infarctus du myocarde pourraient retarder la mort cellulaire qui suit l’occlusion d’une artère coronaire. Ainsi, cela permettrait de préserver un plus grand capital myocardique lors de la reperfusion coronarienne.
Dès lors, il est légitime de se demander si la population de patients candidats à une chirurgie de PAC, n’est pas dans les faits exposée à un préconditionnement ischémique naturel de par la physiopathologie de l’atteinte cardiaque. Ainsi, le fait d’exposer ces patients à du préconditionnement ischémique à distance préalablement à leur intervention chirurgicale n’apporte peut-être pas de bénéfice supplémentaire de cardioprotection. Cela n’implique toutefois pas que le RIPC n’a pas sa place dans des chirurgies cardiaques autres que celles de revascularisation coronarienne.
Quelle est donc la population la plus susceptible de bénéficier du préconditionnement ischémique à distance?
Sténose aortique sévère
La population étant vieillissante, on retrouve de plus en plus de patients atteints d’une sténose aortique sévère dans le contexte d’une calcification de leur appareil valvulaire aortique. En effet, la sténose aortique est, de nos jours, la valvulopathie nécessitant le plus fréquemment une chirurgie de remplacement valvulaire.66
La sténose aortique se caractérise par un épaississement des feuillets et une calcification de l’appareil valvulaire. Il s’en suit une perte de mobilité des feuillets de la valve aortique entrainant conséquemment une augmentation des gradients de pression transvalvulaire et une diminution significative de l’aire valvulaire aortique. L’étiologie la plus fréquente de la sténose aortique est une atteinte
dégénérative. La bicuspidie et l’atteinte valvulaire rhumatismale sont aussi souvent retrouvées comme causes de cette pathologie. La sténose aortique est une maladie lentement progressive qui demeure souvent asymptomatique. La triade de symptômes les plus souvent associés à la sténose aortique sévère inclut l’angine, la dyspnée et la syncope.67
L’American Heart Association (AHA) a établi une classification de la sévérité de la sténose aortique selon des critères échographiques spécifiques. On décrit trois stades de sévérité de la sténose aortique68 :
Sévérité de la sténose aortique Critères échocardiographiques Légère Modérée Sévère
Aire valvulaire aortique (cm2) 1,5 – 2,5 1,0 – 1,5 < 1,0 Gradient de pression moyen (mm Hg) 15 - 25 25 - 40 > 40
Vélocité (m/s) < 3,0 3,0 – 4,0 > 4,0
Tableau 1 : Critères échocardiographiques de la sténose aortique selon la
classification de l’American Heart Association (AHA).68
La sténose aortique s’accompagne inévitablement d’une surcharge de pression au niveau ventriculaire gauche. Face à une atteinte sténosante significative de l’appareil valvulaire, il se produit, avec le temps, un remodelage pathologique du ventricule gauche. On retrouve donc, en contexte de sténose aortique sévère, une hypertrophie ventriculaire gauche (HVG) concentrique, un mécanisme compensatoire visant à combattre la surcharge de pression au niveau de l’appareil valvulaire.69 Initialement, ce remodelage permet de compenser l’augmentation de la résistance au niveau de la valve, mais au long cours il s’avère insuffisant et l’HVG concentrique importante devient un facteur de mauvais pronostic.70,71
L’AHA68 et la Canadian Cardiovascular Society (CCS)66 ont établi des lignes directrices quant au traitement de la sténose aortique. Les recommandations des deux associations reconnues sont très semblables. Retenons que les patients présentant les critères suivants devraient être référés en chirurgie cardiaque pour une évaluation en vue d’un remplacement valvulaire aortique :
Recommandations de classe 1
Une sténose aortique sévère symptomatique
Une sténose aortique sévère chez un patient candidat à une chirurgie cardiaque pour une autre pathologie
Une sténose aortique sévère asymptomatique accompagnée d’une dysfonction ventriculaire gauche (FEVG < 50%)
Recommandations de classe 2a
Une sténose aortique modérée chez un patient candidat à une chirurgie cardiaque pour une autre pathologie
Une sténose aortique très sévère (vélocité aortique > 5,0 m/s) asymptomatique chez un patient à risque chirurgical faible
Tableau 2 : Indications chirurgicales de remplacement valvulaire aortique.66,68
Sténose aortique sévère et protection myocardique périopératoire
L’augmentation du capital myocardique en lien avec l’HVG concentrique retrouvée en contexte de sténose aortique sévère rend les patients porteurs de cette valvulopathie plus susceptibles au dommage myocardique ischémique lors d’une chirurgie de remplacement valvulaire.
En effet, les patients porteurs d’une sténose aortique sévère isolée, sans autre atteinte valvulaire concomitante ni MCAS significative, présentent une grande
susceptibilité à l’ischémie myocardique peropératoire. Ces patients ne présentent pas de sténose coronarienne significative et ne sont donc pas exposés à un certain degré d’ischémie myocardique chronique.12 De plus, la masse musculaire cardiaque susceptible à l’ischémie lors de la chirurgie est augmentée dans le contexte d’une HVG concentrique. Les techniques usuelles de cardioprotection, notamment l’administration d’une solution de cardioplégie23, ne garantissent pas la
protection de l’ensemble du capital myocardique chez ces patients.
Donc, il est évident que toutes les cardiopathies à critères chirurgicaux n’ont pas le même profil de susceptibilité à l’ischémie myocardique peropératoire. Tel qu’exposé pécédemment, les patients nécessitant une chirurgie valvulaire isolée semblent présenter un plus grand risque de lésions d’ischémie et de reperfusion périopératoires que les patients présentant une maladie coronarienne significative nécessitant des pontages coronariens. Il est aussi évident que, de par leur physiopathologie et les atteintes anatomiques qui en résultent, certaines atteintes cardiaques peuvent bénéficier davantage de techniques cardioprotectrices efficaces.
Ainsi, les patients porteurs d’une sténose aortique sévère isolée nécessitant une chirurgie de remplacement valvulaire aortique (RVA) sont parmi ceux pouvant le plus bénéficier du préconditionnement ischémique à distance.
Préconditionnement ischémique à distance et chirurgie valvulaire
Ainsi, dans les dernières années, plusieurs équipes de recherche ont étudié le préconditionnement ischémique à distance chez des populations plus homogènes comme les patients nécessitant des chirurgies valvulaires isolées. Certaines de ces études, incluant des patients ne présentant que des pathologies valvulaires chirurgicales sans maladie coronarienne significative associées, seront revues dans la prochaine section.