Étude des mécanismes moléculaires précoces de la réponse
neuro-immunitaire dans des modèles de la maladie de Parkinson
Mémoire
Catherine Fontaine-Lavallée
Maîtrise en neurobiologie
Maître ès sciences (M.Sc.)
Québec, Canada
© Catherine Fontaine-Lavallée, 2016
Résumé
Ce mémoire porte sur l’étude des mécanismes d’action de la neurotoxine MPTP et sur les processus menant à l’activation des cellules immunitaires innées. Dans un premier volet, une étude sur la chronologie des évènements immunitaires prenant place dans ce contexte expérimental a été menée grâce à l’utilisation des souris transgéniques cis-NF-ĸBeGFP, CX3CR1GFP et lysMeGFP montrant une
activité inflammatoire très précoce dans ce tissu. Dans un deuxième volet, une étude mécanistique portant sur la capacité des cellules immunitaires à transporter la toxine a été réalisée en utilisant l’analogue fluorescent du MPP+, l’APP+. Les cellules immunitaires peuvent transporter cet analogue,
et donc pourraient être modulables par la neurotoxine. Finalement, dans un troisième volet, un protocole de conditionnement in vitro avec des monocytes et des neurones dopaminergiques a permis de montrer l’importance d’une combinaison entre l’effet du MPP+ sur les neurones
dopaminergiques et un environnement pro-inflammatoire pour engendrer des altérations de ces neurones.
Abstract
This thesis focuses on the study of the mechanisms of action of the neurotoxin MPTP and the process leading to innate immune cells activation. In the first part, a study of the chronology of immune events taking place in this experimental context was performed using the transgenic mice cis-NF-ĸBeGFP, CX3CR1GFP and lysMeGFP showing very early inflammatory activities in the myenteric
plexus. In a second phase, a mechanistic study on immune cells ability to carry the toxin was conducted using the fluorescent analog of MPP+, APP+. Immune cells can indeed carry this analog,
and therefore may be modulated by the neurotoxin. Finally, in a third aspect, an in vitro conditioning assay with monocytes and dopaminergic neurons showed the importance of a combination of the effect of MPP+ on dopaminergic neurons and a pro-inflammatory environment to generate alterations
in these neurons.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... xi
Liste des abréviations et sigles ... xiii
Remerciements ... xv
Introduction ... 1
I. Maladie de Parkinson ... 1
I.1 Épidémiologie ... 1
I.2 Symptômes ... 1
I.3 Description de la pathologie ... 2
I.4 Forme familiale ... 6
I.5 Traitements ... 7
II. Hypothèse de Braak ... 9
III. Régions étudiées ... 11
III.1 Le système nerveux entérique... 11
III.2 Le système nerveux central ... 14
IV. Système immunitaire inné ... 15
IV.1 Introduction ... 15
V. Modèle MPTP ... 20
VI. Historique du laboratoire ... 22
VII – Mon projet de recherche ... 23
Résultats ... 1
I. Étude du décours temporel de la réponse immunitaire au sein du plexus myentérique ... 25
I.1 Chronologie de la réponse immunitaire au sein du plexus myentérique ... 25
II. Étude mécanistique ... 33
II.1 Étude in vitro avec le traceur fluorescent APP+ ... 33
II.2 Étude in vitro de la distribution intracellulaire de l’APP+ ... 35
II.3 Étude in vitro de conditionnement de monocytes et neurones DAergiques humains ... 39
II.4 Étude ex vivo avec l’APP+ ... 42
Discussion ... 1
Perspective ... 51
Références ... 53
Liste des tableaux
Tableau 1 - Symptômes non-moteurs de la maladie de Parkinson ... 2
Tableau 2 - Médicaments traitant les symptômes moteurs de la MP. ... 7
Tableau 3 - Lignées cellulaires utilisées dans l’étude in vitro du traceur fluorescent APP+ ... 34
Tableau 4 - Marqueurs fluorescents ... 36
Tableau 5 - Lignées cellulaires utilisées dans l'étude de la distribution de marqueurs fluorescents ... 36
Tableau 6 - Traitements utilisés pour le protocole de conditionnement ... 40
Liste des figures
Figure 1 - Progression de la maladie de Parkinson ... 1
Figure 2 - Biosynthèse des neurones catécholamiques ... 3
Figure 3 - Voies dopaminergiques du SNC ... 3
Figure 4 - Dégénérescence des neurones DAergiques de la substance noire ... 4
Figure 5 - Ganglions de la base ... 4
Figure 6 - Schématisation de la communication entre les ganglions de la base chez le patient parkinsonien .... 5
Figure 7 - Activation microgliale chez le patient parkinsonien ... 6
Figure 8 - Catabolisme de la dopamine ... 8
Figure 9 - Stades de Braak ... 10
Figure 10 - Corps de Lewy dans la paroi de l’estomac ... 11
Figure 11 - Hypothèse de Braak ... 11
Figure 12 - Structure histologique de la paroi intestinale ... 12
Figure 13 - Axe cerveau-intestin ... 14
Figure 14 - Voie nigro-striée chez l'homme et chez la souris ... 14
Figure 15 - Origine des monocytes et macrophages ... 16
Figure 16 - Voies de signalisation menant à la polarisation des macrophages ... 16
Figure 17 - Vie d'un neutrophile: de la différenciation au site de l'inflammation ... 19
Figure 18 - Mécanismes des inflammasomes ... 20
Figure 19 - Hypothèse ... 24
Figure 20 - Réponse NF-κB dans le temps ... 28
Figure 21 - Étude du dynamisme cellulaire chez la souris CX3CR1-GFP... 30
Figure 22 - Étude du dynamisme cellulaire chez la souris lysMeGFP ... 32
Figure 23 - Étude par FACS de la toxicité de l'APP+ sur différents types cellulaires dans le temps ... 34
Figure 24 - Étude par FACS de la cinétique de capture de l'APP+ par différents types cellulaires ... 35
Figure 25 - Étude mécanistique in vitro sur des cellules N2A avec des marqueurs fluorescents... 37
Figure 26 - Étude mécanistique in vitro sur des cellules RAW.267 avec des marqueurs fluorescents ... 37
Figure 27 - Comparaison du stress oxydatif suite au traitement à la LPS et au MPP+ chez les cellules SH-SY5Y ... 38
Figure 28 - Comparaison du stress oxydatif suite au traitement à la LPS et au MPP+ chez les cellules RAW.267 ... 38
Figure 29 - Protocole de conditionnement ... 39
Figure 30 - Étude in vitro de la viabilité cellulaire et de la production de nitrite suite à un conditionnement de cellules THP-1 et SH-SY5Y à différents traitements de LPS. ... 41
Figure 31 - Étude in vitro de la viabilité cellulaire et de la production de nitrite suite à un conditionnement de cellules THP-1 et SH-SY5Y à différents traitements de MPTP ... 41
Figure 32 - Étude in vitro de la viabilité cellulaire et de la production de nitrite suite à un conditionnement de cellules THP-1 et SH-SY5Y à différents traitements de MPP+ ... 42
Figure 33 - Étude ex vivo de la capacité des neurones et des macrophages résidents à capter l’APP+ ... 43
Figure 34 - Schématisation des effets du MPP+ sur les cellules THP-1 et SH-SY5Y ... 48
Liste des abréviations et sigles
1-méthyle-4-phényle-1,2,3,6-tétrahydropyridine (MPTP) 1-méthyle-4-phényle-4-propionoxypiperidine (MPPP) 1-méthyle-4-phénylepyridinium (MPP+) Iodure de 4-(4-Diméthyle-amino)phényle-1-méthylepyridinium (APP+)Absent in melanoma 2 (AM2)
Acide désoxyribonucléique (ADN)
Acide L-aminé aromatique décarboxylase (L-AADC) Acide nitrique (NO)
Acide γ-aminobutyrique (GABA) Activation alternative (M2) Activation classique (M1)
Activator protein 1 (AP1)
Adénosine triphosphate (ATP) Aldéhyde déshydrogénase (AD)
Anti-inflammatoires non-stéroïdiens (AINS)
Apoptosis-associated speck-like protein (ASC)
Arginase 1 (Arg1)
Axe hypothalamique-pituitaire-surrénalien (HPS)
C-AMP response element-binding protein (CREB)
catéchole-O-méthyle transférase (COMT)
CCAAT/enhancer binding protein beta (C/EBPβ)
Cellule dendritique (DC)
Cellule progénitrice érythro-myéloïde (EMPs)
Chitinase 3-like 3 (Ym1)
Common lymphoid progenitor (CLP) Common monocyte progenitor (CMoP)
Corps de Lewy (CL)
Danger-associated molecular patterns (DAMPs)
Dérivés réactifs de l’oxygène (ROS) Dopamine (DA)
Dopamine β-hydroxylase (DBH) Dopaminergique (DAergique)
Enhanced green fluorescent protein (eGFP)
Ganglions de la base (GB)
Granulocyte-monocyte progenitor (GMP) Hematopoietic stem cell (HSC)
Heure (h)
Interferon gamma (IFNγ)
Interferon gamma receptor (IFNγR) Interferon-regulatory factor (IRF)
Interleukine (IL)
Leucine-rich repeat kinase 2 (LRRK2)
Lipopolysaccharide (LPS)
Lymphocyte antigen 6C (ly-6C)
Complexe majeur d’histocompatibilité de classe II (MCH II)
Maladie de Parkinson (MP)
Mannose receptor 1 C-type (Mrc1)
Monocyte/macrophages and dendritic celles precursor
(MDP)
Monoamine-oxydase-B (MAO-B)
Myeloid progenitor (CMP)
Nerf glosso-pharyngien (IX) Nerf vague (X)
Neurite de Lewy (NL) Oxide nitrique synthase (NOS)
NLR family, CARD domain containing 4 (NLRP4) NOD-like receptor family, pyrin domain containing 1
(NLRP1)
NOD-like receptor family, pyrin domain containing 3
(NLRP3)
Noyau thalamique ventral antérieur (VA) Noyau thalamique ventral latéral (VL)
Nuclear factor kappaB (NF-ĸB)
Paraformaldéhyde (PFA)
Pathogen-associated molecular patterns (PAMPs)
Peptide vasoactif intestinal (VIP)
Peroxisome proliferator-activated receptor gamma
(PPARγ)
Peroxyde d’hydrogène (H2O2)
Phényléthanolamine N-méthyltransférase (PNMT) Protéine adaptatrice MyD88 (Myd88-/-)
PTEN-induced putative kinase 1 (PINK1) Resistin-like-alpha (Fizz1)
Sérotonine (5-HT)
Signal transducer and activator of transcription (STAT)
Substance noire pars compacta (SNpc) Superoxyde (O2-)
Symptômes non-moteurs (SNM) Système immunitaires inné (SII) Système nerveux autonome (SNA) Système nerveux central (SNC) Système nerveux entérique (SNE) Système nerveux parasympathique (PΣ) Système nerveux sympathique (Σ) Tampon phosphate salin (PBS)
Toll-like receptors (TLRs)
Transporteur de la dopamine (DAT)
Tumor necrosis factor alpha (TNF-α)
Tyrosine hydroxylase (TH) α-synucléine (α-syn)
Remerciements
Pour commencer, j’aimerais remercier mon directeur de recherche, le Dr Denis Soulet, pour m’avoir prise comme étudiante à la maîtrise dans son équipe. J’ai rapidement compris que notre équipe était privilégiée d’avoir un directeur de recherche aussi présent et disponible. L’importance que tu accordes au cheminement scolaire et professionnel de tes étudiants est très appréciée, et tu es très généreux de ta personne pour nous conseiller sur ces sujets. Ton but est que nous réussissions, et ça paraît. J’ai grandement apprécié être envoyée dans un congrès international en Allemagne et développer mes qualités en communication tout le long de ma maîtrise avec les Journal Club. Merci pour tout.
J’aimerais aussi remercier mes collègues de travail, Mélissa Côté, Andrée-Anne Poirier et Benoît Aubé, pour leur aide, leur support et leur bonne humeur. Être une petite équipe a ses avantages puisque ça a fait en sorte que nous soyons tissés serrés. Je donne une mention spéciale à Mélissa puisqu’elle était non seulement doctorante, mais aussi technicienne, professionnelle de recherche et professeure. Franchement, qu’aurais-je fait sans toi!? Je vous souhaite à tous de continuer votre passion des sciences (incluant la paléontologie et la mixologie) et une belle vie personnelle et professionnelle. De toutes manières, on reste en contact!
Aussi, il importe que je remercie ma famille et mon chum, qui m’ont supporté dans les moments de stress. La science est une grande montagne russe avec ses hauts et ses bas. Merci à mon chéri de me pardonner pour les fins de semaine passées au laboratoire plutôt qu’à la maison. Je pense que ça en valait la peine!
Finalement, un mot pour remercier Benoît Mailhot, le «Master d’ImageJ», pour son aide très appréciée pour éditer mes nombreuses images et vidéos.
Encore une fois, merci à tous!!!
1
Introduction
I. Maladie de Parkinson
La maladie de Parkinson (MP) est une maladie neurodégénérative qui est caractérisée par l’atteinte préférentielle et progressive des neurones dopaminergiques (DAergiques) de la voie
nigro-striée1. Cependant, il est maintenant largement accepté que ce système neuronal ne soit pas le seul
à être atteint dans le cadre de cette pathologie. À ce jour, l’étiologie de la MP reste incomprise et la
maladie est incurable2.
I.1 Épidémiologie
La maladie de Parkinson est la deuxième maladie neurodégénérative en importance après la
maladie d’Alzheimer3. Au Canada, 1 à 3% de la population âgée de plus de 65 ans souffre de cette
maladie4,5. De plus, celle-ci toucherait plus de 5 millions de personnes à travers le monde, un nombre
en constante croissance puisqu’il est lié au vieillissement de la population6. En effet, la prévalence de
cette maladie augmente avec l’âge, et est plus importante chez la classe des 60-69 ans (428 pour
100 000) par rapport à la classe inférieure des 55-64 ans (173 pour 100 000)7. L’âge est aussi en lien
avec le nombre de nouveaux patients parkinsoniens annuels, une incidence moyenne de 13,4 pour
100 000 selon une étude américaine8. De manières intéressantes, plusieurs études ont montré une
différence entre les hommes et les femmes, les hommes étant en fait plus nombreux à être atteints
de la maladie de Parkinson5,7.
I.2 Symptômes
I.2.1 Symptômes moteurs
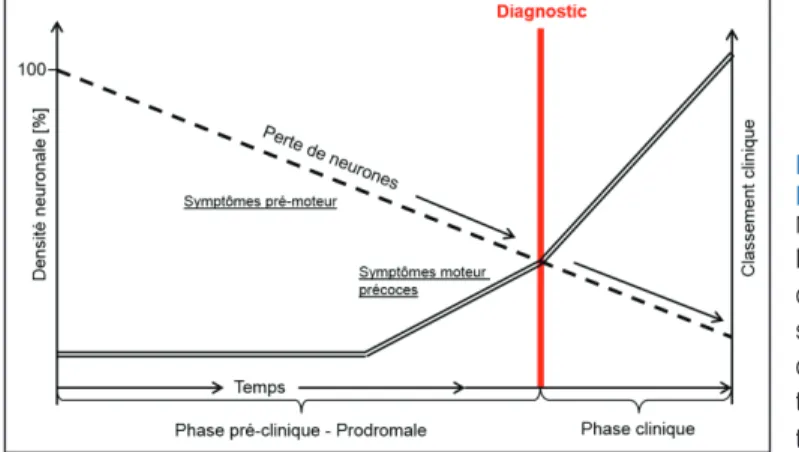
Le dysfonctionnement de la voie nigro-striatale est une caractéristique importante de la MP. En effet, les patients parkinsoniens souffrent de symptômes moteurs liés, entre autres, à l’atteinte de ce système. Ceux-ci se manifestent principalement par des tremblements au repos, de la
bradykinésie et de la rigidité musculaire9. Cependant, l’apparition de ces manifestations physiques
fait suite à une perte importante, entre 60 et 80%, des neurones dopaminergiques de la substance
noire pars compacta (SNpc)2. Ce délai dans l’émergence des conséquences de la
neurodégénérescence est dû à la mise en place d’un mécanisme de compensation au niveau de ces
neurones10. La progression de la
maladie est schématisée dans la figure 1 ci-contre.
Figure 1 - Progression de la maladie de Parkinson
Modifié de Miller et O’Callaghan (2015)2
L’apparition des symptômes moteurs ne se fait qu’après une perte neuronale importante de la substance noire pars compacta. Cette perte se fait de manière chronique sur une longue période de temps. Le diagnostic de la maladie se fait donc tardivement.
2
I.2.2 Symptômes non-moteurs
Bien qu’étant une caractéristique importante de la maladie de Parkinson, les neurones DAergiques ne sont pas les seules cellules neuronales du système nerveux central (SNC) à être touchées au sein de cette pathologie11. En effet, plusieurs études ont montré l’atteinte d’autres
populations neuronales telles que noradrénergiques12, sérotoninergiques13, cholinergiques14 et
hypocrétines15. Cette neurodégénérescence hétérogène, incluant les neurones DAergiques, donne
lieu à l’apparition de divers symptômes dits non-moteurs (SNM) chez les gens souffrant de la maladie de Parkinson16.
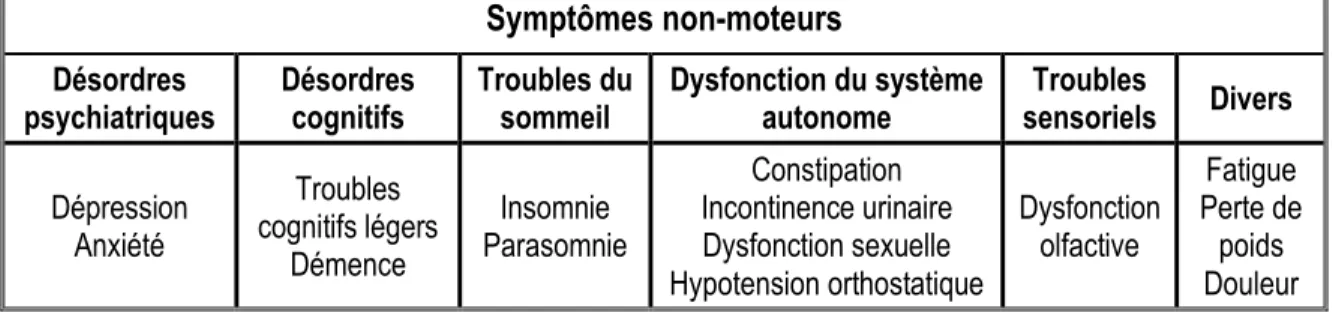
En effet, les patients parkinsoniens peuvent souffrir de jusqu’à 12 SNM, dépendamment de l’avancement de la maladie, dont les principales catégories sont classées dans le tableau suivant avec des exemples :
Symptômes non-moteurs
Désordres
psychiatriques Désordres cognitifs Troubles du sommeil Dysfonction du système autonome sensoriels Troubles Divers
Dépression Anxiété Troubles cognitifs légers Démence Insomnie Parasomnie Constipation Incontinence urinaire Dysfonction sexuelle Hypotension orthostatique Dysfonction olfactive Fatigue Perte de poids Douleur Tableau 1 - Symptômes non-moteurs de la maladie de Parkinson
Tiré de Jankovic (2008)17, Chaudhuri (2008)18
Cette multitude de symptômes de natures différentes complique le diagnostic des patients. Depuis plusieurs années, un travail de conscientisation est fait afin d’informer la population de la complexité de la maladie de Parkinson, et une grille d’évaluation des SNM a été créée pour les cliniciens19.
Aussi, il est intéressant de noter que certains de ces symptômes peuvent apparaître plusieurs années avant les premiers symptômes moteurs18. La section sur l’hypothèse de Braak, plus loin dans
ce mémoire, traitera de ce sujet plus en détail. I.3 Description de la pathologie
I.3.1 Neurones dopaminergiques
L’étude des neurones catécholaminergiques, c’est-à-dire des neurones utilisant un neurotransmetteur dérivé de la tyrosine20, remonte aux années 196021 où les neurones
noradrénergiques et dopaminergiques ont été identifiés grâce aux nouveaux outils d’immuno-fluorescence22. Outre ces deux types neuronaux, cette famille inclue aussi les neurones
adrénergiques.
Les neurones catécholaminergiques se différencient entre eux par la présence, ou l’absence, d’enzymes nécessaires à la transformation de la tyrosine au niveau de leurs synapses. Comme illustré par la figure 2, le neurone DAergique possède deux enzymes : la tyrosine hydroxylase (TH) et l’acide L-aminé aromatique décarboxylase (L-AADC). Le produit final de ces réactions est la
3
dopamine. Les neurones noradrénergiques possèdent en plus l’enzyme dopamine β-hydroxylase (DBH) qui convertie la dopamine en noradrénaline. Finalement, les neurones adrénergiques possèdent toutes les enzymes mentionnées précédemment ainsi que l’enzyme phényléthanolamine N-méthyle transférase (PNMT) qui ajoute un groupement méthyle à la noradrénaline pour la convertir
en adrénaline23.
Les neurones DAergiques sont principalement présents au niveau de la substance noire SNpc ainsi
que dans l’aire tegmentale ventrale (ATV)24, deux structures du mésencéphale. Ceux-ci forment trois
voies principales ascendantes au sein de notre système nerveux central : la voie nigro-striatale, la
voie méso-corticolimbique et la voie tubéro-infundibulaire25. Ces voies sont illustrées par la figure 3.
La diversité des voies DAergiques crée un éventail de fonctions neuro-modulatrices de la dopamine.
En effet, la dopamine intervient, par exemples, dans le comportement26, la motivation27, le système
de récompenses28,29, le sommeil30 et le système moteur31-33. Son dérèglement quant à lui donne lieu
à diverses maladies telles que la MP, mais aussi la schizophrénie34 et l’addiction35.
Dans la MP, nous nous intéressons particulièrement aux neurones DAergiques de la substance noire puisque ce sont ces derniers qui sont touchés par cette pathologie. Effectivement, une
dégénérescence de ceux-ci est visible chez les patients atteints comme indiqué dans la figure 436.
Figure 2 – Biosynthèse des neurones catécholamiques
Catherine Fontaine-Lavallée (2015)©
Enzymes participant à la synthèse des neurotransmetteurs catécholaminergiques selon le type de neurone.
Abréviations: TH ; tyrosine hydroxylase, L-AACD ; L-aminé aromatique décarboxylase, DBH ; dopamine β-hydroxylase, PNMT ; phényléthanolamine N-méthyltransférase.
Figure 3 - Voies dopaminergiques du SNC
Catherine Fontaine-Lavallée (2015)©
Schéma représentant les trois voies dopaminergiques du SNC. Bleu pâle. Voie méso-corticolimbique dont les projections DAergiques trouvent leur origine dans l’ATV du mésencéphale et dont la cible est 1) le système limbique et 2) le cortex frontal.
Bleu foncé. Voie nigro-striée dans laquelle les neurones DAergiques de la substance noire innervent le striatum. Vert.
Voie tubéro-infundibulaire où la dopamine joue un rôle hormonal dans l’axe hypothalamo-hypophysaire. Cette voie prend naissance dans l’hypothalamus et les prolongements DAergiques sont projetés sur l’éminence médiane où la dopamine est relâchée dans la veine porte antéhypophysaire.
4
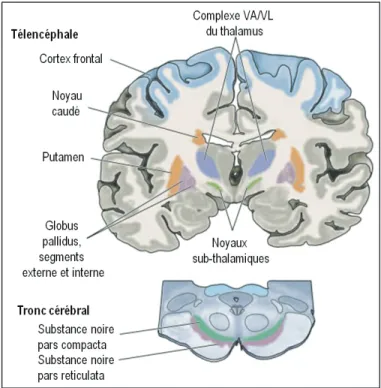
La dysfonction de la voie nigro-striatale affecte le système moteur, plus précisément les fonctions des noyaux gris centraux, ou ganglions de la base (GB), avec lesquels cette voie est connectée. Les GB sont un système composé de plusieurs structures corticales dont la substance noire elle-même,
le striatum, le globus pallidus et les noyaux sous-thalamiques37. Les différentes structures formant les
GB sont représentées par la figure 5 ci-dessous38.
Figure 5 - Ganglions de la base
Modifié de Purves et coll., Neuroscience, Sinauer Associates Inc, 3e édition, 200438
Schéma anatomique montrant les différentes structures et noyaux faisant partie des ganglions de la base. Abréviations: VA ; noyau thalamique ventral antérieur, VL ; noyau thalamique ventral latéral.
Figure 4 – Dégénérescence des neurones DAergiques de la substance noire
Dauer et al (2003)36
Densité neuronale de la substance noire pars compacta ainsi que l’illustration de la voie nigro-striée. A. Cerveau d’une personne saine. B. Cerveau d’un patient atteint de la MP chez lequel la densité des neurones DAergiques de la SNpc est diminuée de manière importance ce qui affecte les prolongements de ces neurones vers le striatum.
5 La figure 6 schématise les effets de la dégénérescence des neurones DAergiques de la SNpc sur la transmission et l’intégration des informations motrices par les GB.
I.3.2 Alpha-synucléine
La MP est aussi caractérisée par la présence d’inclusions à l’intérieur des corps cellulaires de neurones DAergiques survivants36, ainsi qu’au niveau d’autres types neuronaux39. Ces inclusions,
appelées corps de Lewy (CL), et neurites de Lewy (NL) si retrouvés au niveau des prolongements neuronaux, sont composées, entre autres, d’agrégats d’α-synucléine (α-syn) et d’ubiquitine36.
L’α-syn est une protéine de 14 kDa et de 140 amino-acides qui est observée dans les terminaisons synaptiques, le noyau40ainsi que liée à des membranes cellulaires41. Bien que son rôle à l’intérieur
de la cellule ne soit pas encore bien défini, cette protéine est suspectée d’avoir un lien important avec la MP. Effectivement, en conditions pathologiques, cette protéine adopte un changement de conformation qui facilite son agrégation sous forme d’oligomères et de fibrilles à l’intérieur des cellules42. Ces formes toxiques peuvent ensuite avoir des effets néfastes sur les neurones touchés
via différents mécanismes hypothétiques :
Empêcher les fonctions normales de la protéine et affecter ainsi la relâche de dopamine (DA)43,44;
Altérer les structures mitochondriales et l’activité du complexe I en plus de leur dynamisme et autophagie45,46;
Interrompre le transport vésiculaire entre l’appareil de Golgi et le réticulum endoplasmique ce qui résulterait en un stress oxydatif47,48;
Altérer les mécanismes de dégradation protéiques49.
Figure 6 - Schématisation de la
communication entre les ganglions de la base chez le patient parkinsonien
Purves et al, Neuroscience, Sinauer Associates Inc, 3e édition, 200438
A. Chez le patient parkinsonien, les
informations provenant de la SNpc sont diminuées, rendant difficile l’inhibition du globus pallidus par le noyau caudé et le putamen (striatum). La réponse du noyau sub-thalamique en est augmentée, ce qui mène à une inhibition plus importante du thalamus et, finalement, à une diminution de l’excitation du cortex frontal.
6
I.3.3 Système immunitaire
Une autre caractéristique de la MP est l’activation chronique du système immunitaire, tant au
niveau des systèmes nerveux central que périphérique50. Des cellules microgliales activées ont en
effet été détectées chez des patients parkinsoniens51, en plus de l’augmentation de cytokines
inflammatoires notoires telles que l’interleukine (IL) -1β, IL-6 et tumor necrosis factor (TNF)-α dans le
liquide céphalo-rachidien, dans la substance noire et enfin dans le putamen52,53. La figure 7
ci-dessous illustre d’ailleurs un exemple de cette activation microgliale chez l’humain.
En périphérie, la réponse inflammatoire du tractus intestinal a fait l’objet de récentes études tant chez
l’humain54,55 que chez des modèles animaux parkinsoniens56. Il est cependant difficile d’interpréter le
rôle des cellules immunitaires dans la dégénérescence neuronale, à savoir, par exemple, si cette dernière est une cause ou une conséquence de la pathologie.
I.4 Forme familiale
Bien que la majorité des cas de MP soient idiopathiques, environ 5 à 10% des cas peuvent être
associés à des mutations génétiques57. Ainsi, plusieurs gènes ont été identifiés comme étant des
facteurs de risque de la MP. Cette section détaille certains des gènes impliqués dans cette dernière. Un des gènes associés à la MP est celui codant pour la protéine α-syn : le SNCA. Une mutation à
l’intérieur de celui-ci peut mener à une forme autosomale dominante de la maladie58. D’autres gènes
inclus PTEN-induced putative kinase 1 (PINK1) et parkine, des gènes liés à la mitophagie59, qui
induisent une forme autosomale récessive lorsque mutés60,61. Puisque la MP est caractérisée par
une inflammation chronique et un stress oxydatif important, le lien génétique avec les mitochondries
est fort intéressant62. Le gène leucine-rich repeat kinase 2 (LRRK2) muté induit une forme
autosomale dominante, et est un facteur de risque important de la MP63. De manière intéressante,
des mutations de ce gène ont aussi été liées à la maladie de Crohn, une forme de maladie
inflammatoire chronique intestinale64. Ainsi, la MP et la maladie de Crohn pourraient partager
certaines composantes étiologiques. Finalement, certains gènes mentionnés plus haut auraient des
effets inflammatoires au sein de la MP dont les gènes LRRK2 et parkine65. De plus, le gène de la
protéine déglycase DJ-1 dont les mutations peuvent mener à une forme autosomale récessive de la
MP serait aussi lié au système immunitaire66.
Figure 7 - Activation microgliale chez le patient parkinsonien Adapté de Ouchi et al (2005)51
Tomographie par émission de positrons avec un traceur radioactif, [11C] (R)-PK11195, pour les microglies activées. Le rouge
représente la plus haute valeur alors que le violet foncé représente la plus faible.
Bien que le niveau de potentiels de liaison soit faible chez le contrôle sain, celui-ci est largement augmenté chez le patient parkinsonien, indiquant une activation des cellules microgliales. Plus précisément, cette activation est importante au niveau du putamen et corrèle positivement avec la sévérité des symptômes moteurs du patient.
7 I.5 Traitements
I.5.1 Traitements existants
Comme mentionné précédemment, la MP est à ce jour incurable, et les traitements existants ne permettre qu’une atténuation relative des symptômes ressentis par les patients atteints. En effet, malgré les traitements disponibles, la majorité des patients développent progressivement des handicaps liés à leur condition9.
Pour ce qui a trait aux traitements des symptômes moteurs, peu de développements thérapeutiques sont survenus au cours de la dernière décennie si ce n’est de l’amélioration de la livraison des médicaments à leurs cibles, leurs dosages ainsi que l’utilisation de thérapies combinées67. Parmi les
traitements disponibles, trois stratégies pharmacologiques sont à noter :
Livraison de 3,4-dihydroxyphénylalanine (L-DOPA) au cerveau
La L-DOPA est le précurseur de la dopamine, et cette molécule est utilisée plutôt que la dopamine puisque celle-ci est capable de traverser la barrière hémato-encéphalique pour être délivrée dans le SNC des patients. Il s’agit du traitement le plus efficace indépendamment des stades de la maladie68. Le traitement le plus utilisé consiste à donner des comprimés renfermant deux
molécules : la lévodopa (L-DOPA) et la carbidopa69. Cette dernière est un inhibiteur de l’enzyme
L-AADC responsable de la conversion de la L-DOPA en dopamine et empêche ainsi cette réaction de se produire en périphérie70.
Inhibiteurs de la mono-oxydase-B (MAO-B)
Cette stratégie consiste à empêcher la conversion de la dopamine du SNC en ses métabolites afin de la garder disponible pour les neurones DAergiques. Pour se faire, des inhibiteurs de la MAO-B sont utilisés71. De plus, il existe des inhibiteurs pour une autre enzyme qui, elle,
dégrade la dopamine : l’enzyme catéchole-O-méthyle transférase (COMT). Deux exemples de ces inhibiteurs disponibles sur le marché sont le tolcapone (Tasmar©) et l’entacapone (Comtan©)72.
Agonistes de la dopamine
Enfin, des agonistes des récepteurs DAergiques, tels que le pramipexole (Mirapex©) et le
ropinirole (Requip©), peuvent être utilisés pour contrer le manque de dopamine dans la MP. Ces
différentes molécules ont des effets sur des récepteurs DAergiques spécifiques73.
Les principaux types de molécules pharmacologiques sur le marché sont classés dans le tableau 2 ici-bas selon leur mode de fonctionnement.
Tableau 2 - Médicaments traitant les symptômes moteurs de la MP.
L-DOPA Agonistes dopamine Inhibiteurs MAO-B Inhibiteurs COMT
Molécule commercial Nom Molécule commercial Nom Molécule commercial Nom Molécule commercial Nom Lévopoda/
carbidopa Sinemet© Pramipexole Ropinirole Requip
©
8
Ces diverses stratégies sont combinées entre elles afin d’obtenir des effets bénéfiques optimaux et des effets néfastes minimaux chez les patients, dépendamment, entre autres, de l’âge des patients
ainsi que du stade de développement de la pathologie73,74. En effet, chez de jeunes patients,
l’utilisation d’agonistes de la dopamine ou d’inhibiteurs de la MAO-B sera privilégiée avant celle de la lévodopa/carbidopa puisque ce dernier traitement induit généralement le développement de
fluctuations motrices et de dyskinésie6.
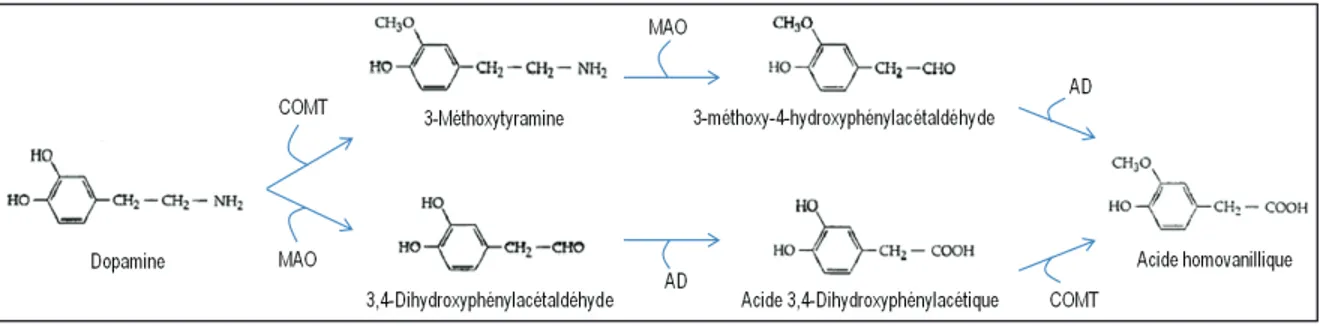
Le catabolisme de la dopamine est détaillé par la figure 8 afin de comprendre le site d’action des
différentes molécules mentionnées précédemment75.
Comme expliqué plus haut, les symptômes moteurs ne sont que la pointe de l’iceberg de la MP puisque les patients parkinsoniens souffrent aussi d’un grand nombre de SNM. Cette complexité symptomatique complique le traitement médicamenteux de ceux-ci. En effet, bien qu’il existe sur le marché des médicaments pour contrer les SNM, certains peuvent entrer en interaction avec les traitements des symptômes moteurs en diminuant, par exemple, leur efficacité. De plus, le patient devra prendre plusieurs types de médicaments, dépendamment de ses symptômes, qui ont pour certains des effets secondaires qui s’ajoutent à leurs conditions de base et affectent la qualité de vie
de ces patients76-78.
I.5.2 Stratégies futures
Greffe de cellules dopaminergiques
Cette stratégie consiste à remplacer les neurones DAergiques dégénérés du SNC chez les patients en greffant des cellules progénitrices de ceux-ci. Plusieurs essais ont déjà été faits, mais les
résultats sont mitigés79. En effet, bien que ce traitement permette un soulagement des symptômes
moteurs à long-terme (jusqu’à 18 ans après la greffe)80, les « nouveaux » neurones DAergiques
peuvent montrer des signes de vieillissement précoce chez certains patients greffés. Plus
précisément, la présence de CL81,82 et d’accumulation d’α-syn soluble dans le cytoplasme de
neurones greffés ont été observés dans des tissus post-mortem de patients ayant reçu une greffe de
cellules fœtales neuronales83.
Figure 8 - Catabolisme de la dopamine
Catherine Fontaine-Lavallée (2015)©
Schéma représentant les deux voies enzymatiques menant à la synthèse finale de l’acide homovanillique à partir de la dopamine. Abréviations: COMT; catéchole-O-méthyle transférase, MAO; monoamine-oxydase, AD; aldéhyde déshydrogénase.
9
Immunothérapie
Cette stratégie thérapeutique vise 2 composantes importantes de la MP : la protéine α-syn84
et le système immunitaire85. Des vaccins sont effectivement en développement pour l’une ou l’autre
de ces cibles, et certains sont même déjà testés sur des modèles animaux. Pour l’α-syn, il s’agit de créer une réponse prophylactique qui induit la destruction de cette protéine par le système immunitaire alors que la stratégie est différente pour la seconde option. En effet, un vaccin ciblant le système immunitaire créera une réponse thérapeutique puisqu’elle module la réponse immunitaire qui se déclenche dans un contexte pathologique en la rendant, par exemple, tolérante85.
Traitements anti-inflammatoires
En réponse à l’activation du système immunitaire dans le cadre de la MP, plusieurs études ont été réalisées concernant le rôle potentiellement thérapeutique, ou préventif, des molécules anti-inflammatoires déjà sur le marché. Ce traitement pourrait être jumelé avec d’autres types de traitements tels que ceux favorisant la régénérescence neuronale86. Une réduction du risque d’être
atteint de la MP a été observée chez des patients parkinsoniens ayant pris des anti-inflammatoires non-stéroïdiens (AINS) autres que l’aspirine, p. ex. l’ibuprofène, mais ces données sont préliminaires. De plus, les connaissances sur les effets de différentes molécules individuelles sont insuffisantes pour recommander leur utilisation de manière préventive87,88. Malgré le peu de résultats
concrets, cette stratégie est intéressante et doit être explorée. De plus, il est important d’étudier la réponse immunitaire dans la MP afin de trouver des cibles plus précises à viser par ce genre de thérapies.
II. Hypothèse de Braak
Depuis quelques années, un nombre croissant d’études chamboule la conception de la communauté scientifique sur la maladie de Parkinson : l’origine de la MP pourrait-elle se trouver ailleurs que dans le SNC ?
Ceci découle de l’évolution des connaissances sur la pathologie depuis les dernières décennies, montrant que la MP est une maladie neuronale complexe touchant, de ce fait, des types neuronaux autres que DAergiques. En parallèle, des études sur les SNM de la MP ont complété le tableau en démontrant leurs importances, aux côtés des symptômes moteurs, pour décrire cette pathologie complexe89. De manières intéressantes, tel que mentionné précédemment, il a été rapporté que
certains SNM peuvent apparaître plusieurs années avant les symptômes moteurs chez les patients parkinsoniens. Parmi ceux-ci, les problèmes gastro-intestinaux sont prédominants90, comme une
déficience de la vidange gastrique et la constipation91-93.
L’hypothèse de Braak fait suite aux travaux d’un chercheur allemand, le Dr Heiko Braak, qui a voulu étudier la progression spatio-temporelle des agrégats d’α-syn chez les patients parkinsoniens. Dans une étude de 2002, Braak et son équipe concluaient que l’origine de la MP ne se trouvait pas dans la SN puisque des agrégats d’α-syn étaient présents dans des types neuronaux autres que DAergiques avant l’atteinte de cette région. Les neurones touchés se localisaient, entre autres, au niveau des
10
noyaux moteurs dorsaux des nerfs glosso-pharyngien (IX) et vague (X), de la zone réticulaire intermédiaire ainsi que du complexe cœruleus/sub-cœruleus du tronc cérébral94.
Un an plus tard, Braak et son équipe publiaient une nouvelle étude où ils classifiaient la MP en six stades de progression, les stades de Braak, qui concordent avec l’apparition des SNM95. Ceux-ci
sont illustrés dans la figure 9 tirée de Doty et coll. (2012)96 ici-bas.
Les stades 1 et 2 de Braak correspondent à la phase symptomatique pré-motrice de la MP dans laquelle des perturbations de l’olfaction et du système nerveux autonome (SNA) sont observées. Telle qu’illustrée, la présence des corps de Lewy débute dans la partie basse du SNC, plus précisément au niveau du tronc cérébral, avant de progresser et coloniser les zones cérébrales plus profondes et les zones corticales du SNC dans les stades de Braak suivants13,95.
L’observation de corps de Lewy à l’intérieur du noyau moteur dorsal du nerf X permet de faire un lien intéressant avec le tractus intestinal dans lequel des corps de Lewy ont été identifiés auparavant97 et
qui est connecté au nerf X. Effectivement, des agrégats d’α-syn ont été observés dans des neurones des parois gastrique et intestinale appartenant aux deux plexus neuronaux du système nerveux entérique (SNE) : les plexus de Meissner et d’Auerbach98,99. Le SNE sera décrit plus en détail dans
une partie ultérieure de ce mémoire. La figure 10 qui suit illustre d’ailleurs ces observations faites dans la paroi gastrique de patients parkinsoniens.
Figure 9 - Stades de Braak
Doty (2012)96
Images illustrant l’avancement de la MP telle que divisée en stades dits «de Braak». Les stades 1 et 2 correspondent à la phase symptomatique pré-motrice où les CLs sont présents au niveau du tronc cérébral, mais peu dans le cortex. Les stades suivants montrent la colonisation des zones cervicales profondes (3 et 4) et finalement celle du cortex (5 et 6).
11 Le fait que les différents noyaux touchés dans la MP soient interconnectés entre eux par des voies neuronales connues rend possible l’idée que la pathologie se propagerait à l’intérieur de notre organisme95. Ceci, combiné avec la connexion du nerf X et du SNE, nous amène à l’hypothèse de
Braak : une toxine ou bien un pathogène pourrait traverser la muqueuse intestinale et entrer en contact avec les neurones du SNE, d’abord ceux du plexus de Meissner puis ceux du plexus d’Auerbach, pour remonter via un transport rétrograde du nerf X vers le SNC98.
III. Régions étudiées
III.1 Le système nerveux entérique
Le système nerveux entérique (SNE) est le réseau neuronal de l’appareil digestif à l’intérieur duquel plusieurs circuits neuronaux régulent les fonctions motrices, le débit sanguin local, ainsi que le transport et les sécrétions à travers la muqueuse intestinale100. Il s’agit plus précisément d’une
sous-division du SNA, tout comme les systèmes nerveux sympathique (Σ) et parasympathique (PΣ) qui l’innervent101. Ses boucles réflexes lui confèrent une autonomie qu’aucun autre système nerveux
ne possède vis-à-vis du SNC. Il est d’ailleurs communément surnommé le «deuxième cerveau» en lien avec cette autonomie, mais aussi en lien avec le grand nombre de neurones qui le compose, c.-à-d. environ le même nombre que dans la moelle épinière soit environ 100 millions de neurones102.
Figure 10 - Corps de Lewy dans la paroi de l’estomac
Braak et al (2006)98
Immuno-histochimie avec un anticorps contre l’α-syn réalisée dans la paroi gastrique de patients parkinsoniens.
a. Inclusions présentent dans des axons à l’intérieur d’un nerf périphérique (section
transverse) passant à travers le fundic advantitia. b-d. NLs et CLs dans le plexus myentérique. c. Agrégation d’α-syn (flèches) dans le corps cellulaire de 2 neurones du SNE dans le fundus. d. NLs, tels des fils, à l’intérieur des fibres interconnectant les ganglions du plexus myentérique. e. Quelques fibres immuno-réactives générées dans le plexus myentérique. A. Bifurquent de manière répétée et se séparent en ramifications terminales le long des cellules du muscle lisse de la couche musculaire adjacente (m). f. Faisceau d’une fibre nerveuse du plexus muqueux évoluant à travers la sous-muqueuse gastrique.
Figure 11 - Hypothèse de Braak
Braak et al (2006)98
Schéma montrant les connexions entre le SNE et le SNC via le nerf vague. Les 2 plexus du SNE sont en effet interconnectés, puis des informations provenant de leur réseau remontent ensuite par le nerf vague vers le SNC en passant par le noyau moteur dorsal du bulbe rachidien.
12
Le SNE est formé de deux plexus principaux : les plexus myentérique et sous-muqueux. Ces derniers consistent chacun en un feuillet composé de petits regroupements de neurones connectés entre eux dans la paroi du tube digestif103. La figure 12 schématise la structure histologique de ce
dernier104. Les types neuronaux retrouvés dans le SNE sont nombreux ; sa composition neuronale
étant en fait aussi diversifiée que celle du SNC105. Cependant, certains types neuronaux jouent des
rôles prédominants dans ses diverses fonctions, tels que ceux décrits dans les sections suivantes.
III.1.1 Plexus sous-muqueux
Le plexus sous-muqueux, ou de Meissner, forme un réseau neuronal continu entre la muqueuse intestinale et le muscle circulaire du tube digestif à partir du duodénum jusqu’au sphincter anal, avec en plus quelques ganglions au niveau de l’estomac105. Il a un rôle important concernant la
sécrétion glandulaire ainsi que la régulation chimique de la paroi intestinale. Cela est possible grâce au contrôle des neurones sécréto-moteurs, dont les corps neuronaux sont généralement retrouvés dans ce plexus, qui modulent la perméabilité de la muqueuse intestinale à l’eau et aux électrolytes. En effet, alors que les neurones cholinergiques (32%) du PΣ ont un effet d’activation sur ce système, les neurones vipergiques (42%), c.-à-d. qui utilisent le peptide vaso-actif intestinal (VIP), ont au contraire un effet inhibiteur sur celui-ci via des synapses inhibitrices du SNΣ. L’activité du SNΣ est, elle, modulée par les changements de la pression sanguine et du volume sanguin sous le contrôle des centres réflexes du SNC. De plus, certains neurones VIP forment des prolongements vers le plexus myentérique permettant ainsi, possiblement, une connexion entre les fonctions de sécrétion et de motilité de la paroi intestinale105,106.
III.1.2 Plexus myentérique
Le plexus myentérique, ou d’Auerbach, se retrouve entre les couches musculaires longitudinale et circulaire tout le long du tube digestif, soit de l’œsophage au sphincter anal105. Il joue,
Figure 12 – Structure histologique de la paroi intestinale
Modifié de Low et Benarroch (2008)104
Schéma de la paroi intestinale et de ses composantes structurelles. Le plexus myentérique se retrouve entre les couches de muscle longitudinale et circulaire. Le plexus sous-muqueux se situe, quant à lui, entre la couche de muscle circulaire et la couche sous-muqueuse du tube digestif.
13 quant à lui, un rôle dans la régulation de la motilité de l’intestin, et est aussi impliqué dans le péristaltisme. Le fait que celui-ci soit collé à la couche musculaire longitudinale nous permet de l’isoler en micro-disséquant la paroi intestinale et étudier ainsi ses caractéristiques dans le cadre de nos études. Il s’agit d’ailleurs du principal site d’investigation du laboratoire pour les raisons suivantes :
D’abord, cette décision fait suite à l’hypothèse de Braak sur la propagation des CLs de régions périphériques vers les régions corticales. Le SNE est en effet innervé par le nerf vague dans lequel des CLs ont été observés dans la phase symptomatique pré-motrice. De plus, des CLs ont été rapportés dans le SNE dès 1984107, alors que Lebouvier et coll. (2010)108 ont montré l’intérêt
d’étudier des biopsies de patients parkinsoniens comme outil de diagnostic pré-mortem de la MP en plus de donner des informations quant à la progression de la maladie. Par ailleurs, les symptômes gastro-intestinaux sont les SNM les plus fréquents109, dont la gastroparésie et la constipation
retrouvées chez environ 70% et 59% respectivement des patients parkinsoniens110. Les
dysfonctionnements gastro-intestinaux peuvent être liés à l’altération des neurones DAergiques du SNE, et plus précisément du plexus myentérique. Une étude de Singaram et coll. (1995) avait effectivement montré qu’il y avait une baisse en DA au niveau du plexus myentérique dans des biopsies de colon de patients parkinsoniens, sans cependant mesurer une diminution du nombre de neurones DAergiques ou de métabolites111. Finalement, la présence d’un nombre très important de
cellules immunitaire dans la paroi intestinale, environ 70% de celles-ci, fait du SNE un site d’interactions riches entre le système immunitaire et le microbiote112. De plus, une augmentation de
la perméabilité de l’épithélium intestinal a été observée chez des patients parkinsoniens où une infiltration d’Escherichia coli a été mesurée dans des biopsies de colon113.
La motilité intestinale est nécessaire à la digestion en permettant aux aliments d’être brassés afin de les exposer aux enzymes digestives et aux microvillosités intestinales qui absorbent les nutriments. De plus, celle-ci permet le déplacement des aliments ingérés le long des différents segments du tube digestif. Cette fonction motrice est créée par le contrôle en alternance des neurones excitateurs et inhibiteurs qui innervent les muscles de la paroi intestinale105. Les principaux neurones excitateurs
sont des neurones ayant comme co-transmetteurs l’acétylcholine et la tachykinine alors que les neurones utilisant l’acide nitrique (NO) et le VIP sont les principaux neurones inhibiteurs106.
Finalement, des neurones DAergiques sont aussi présents à l’intérieur de ce plexus, mais leurs rôles au sein du SNE et dans la motilité intestinale sont encore mal compris114.
III.1.3 Axe cerveau-intestin
Tel qu’expliqué plus haut, une communication bidirectionnelle existe entre le SNC et le SNE grâce à des innervations neuronales dont le nerf vague. Cependant, cette communication est aussi possible à d’autres niveaux, entre autres via des médiateurs cellulaires liés au système immunitaire ainsi qu’à l’axe hypothalamique-pituitaire-surrénalien (HPS)115. En effet, l’axe cerveau-intestin est
d’une grande complexité, avec des interactions entre les systèmes nerveux central, autonome et entérique ainsi que les systèmes lymphatique et neuroendocrinien50. La figure 13 illustre d’ailleurs les
14
Les interactions entre ces différents systèmes sont connues depuis plusieurs décennies, mais l’importance du microbiote intestinal n’a été prise en compte que très récemment. Aujourd’hui, et depuis quelques années déjà, la population de bactéries commensales de l’intestin est le sujet de
nombreuses recherches démontrant les effets systémiques de la fluctuation du microbiote116. Ainsi, il
a été montré que le microbiote module différentes réponses neuronales, immunitaires et endocrines
et serait lié à diverses maladies telles que l’obésité, le diabète, l’autisme et l’athérosclérose117,118.
III.2 Le système nerveux central
Afin de faire un parallèle avec ce qui se passe au niveau périphérique, certaines zones du SNC peuvent être étudiées dans le cadre de mon projet de recherche. Nous nous intéressons particulièrement à la SNpc et au striatum, c’est-à-dire aux structures de la voie nigro-striée.
La SN est un noyau situé dans le mésencéphale dont les neurones, de la SNpc spécifiquement, innervent la structure sous-corticale qu’est le striatum. Celui-ci fait partie des GB dont il a été question plus tôt dans le texte. La figure 14 illustre la voie nigro-striée chez l’homme en comparaison à celle de la souris, le modèle animal utilisé par le laboratoire.
Figure 14 - Voie nigro-striée chez l'homme et chez la souris
Catherine Fontaine-Lavallée (2015)©
Schéma anatomique détaillant la voie nigro-striée chez l’humain en comparaison à celle de la souris.
Figure 13 - Axe cerveau-intestin Modifié de Collins et coll. (2012)50
Schéma représentant l’axe cerveau-intestin, comprenant des interactions entre le microbiote et le SNC.
Le microbiote est au centre des interactions entre différents systèmes de l’organisme puisque les bactéries sécrètent différentes molécules agissant sur ceux-ci. Abréviations: 5-HT; sérotonine, DC; cellule dendritique, GABA; acide γ-aminobutyrique.
15
IV. Système immunitaire inné
IV.1 Introduction
Notre système immunitaire se divise en deux systèmes de défense complémentaires : les systèmes immunitaires inné (SII) et adaptatif. Le SII correspond à la première ligne de défense, après la peau, pour contrer les pathogènes. Effectivement, les cellules leucocytes qui le composent patrouillent notre organisme, prêts à agir en réponse à un stimulus119,120. Ce chapitre porte plus
particulièrement sur deux familles de cellules immunitaires innées : les monocytes, macrophages et microglies, et les neutrophiles.
IV.1.1 Monocytes, macrophages et microglies
Les monocytes, les macrophages et les microglies sont des leucocytes phagocytaires, c.-à-d. des phagocytes, qui se différencient entre eux par leur localisation dans notre organisme, ainsi que par leurs caractéristiques morphologiques et génétiques distinctes.
Classiquement, il était accepté que les monocytes circulent dans le sang puis, suite à un signal inflammatoire, infiltrent le tissu endommagé pour se différencier en macrophages. Ces derniers étant en effet les phagocytes résidents des tissus, alors que les microglies se retrouvent spécifiquement dans le SNC. Cependant, plusieurs études ont démontré la complexité de la relation monocyte-macrophage de par les origines multiples des monocyte-macrophages durant le développement, mais aussi durant la vie adulte.
IV.1.1.1 Origine
Monocytes
Les monocytes dérivent de cellules progénitrices myéloïdes des organes lymphoïdes primaires, tels que la moelle osseuse et le foie fœtal, durant l’hématopoïèse embryonnaire et adulte. Aussi, il semble qu’une production de monocytes puisse se faire à partir de la ratte en conditions inflammatoires chez la souris121,122.
Macrophages
Les macrophages peuvent être de deux sources différentes : (1) Dérivés de monocytes ayant infiltrés le tissu cible ou (2) dérivés de cellules progénitrices lors du développement121. Ces deux voies de
différenciation sont illustrées par la figure 15 à la page suivante. En complément, Perdiguero et coll. (2015) ont montré que les macrophages résidents des tissus, dont les microglies, proviennent de cellules progénitrices érythro-myéloïdes (erythtro-myeloid progenitors, EMPs), et ne seraient que marginalement remplacées par des cellules souches hématopoïétiques (HSC) après le développement chez la souris123.
Microglies
Des études récentes ont montré que les microglies sont ontologiquement différentes des monocytes et des macrophages dérivés de la moelle osseuse et retrouvés en périphérie124. Ces cellules
16
système circulatoire afin de coloniser ce qui deviendra le SNC. Ceci se passe très tôt dans le développement, avant le jour embryonnaire 8.5 chez la souris125.
IV.1.1.2 Phénotype
Ces trois phagocytes mononucléaires décrits précédemment ont la capacité de se polariser vers des phénotypes complexes, mais relativement semblables entre ces types cellulaires, en réponse aux signaux de leur microenvironnement. L’activation de récepteurs membranaires, tels que les toll-like receptors (TLRs) ou les récepteurs aux cytokines, déclenche des voies de signalisation spécifiques et une activation de la cellule immunitaire126. Ces changements occurrent tels un
continuum dans lequel deux polarisations extrêmes peuvent être identifiées : l’activation classique (M1) ou l’activation alternative (M2)127,128.
Le phénotype de type M1 est considéré comme étant pro-inflammatoire, ce dernier faisant suite à une activation via des médiateurs de l’inflammation comme le tumor necrosis factor (TNF)-α, l’IL-1β et le NO129. Le phénotype de type M2,
quant à lui, joue un rôle anti-inflammatoire, ou pro-réparateur, en facilitant les réparations tissulaires post-inflammatoires et le retour à l’homéostasie du microenvironne-ment touché130.
Figure 15 - Origine des monocytes et macrophages
Pittet et al (2014)121
Carte topo-ontogénique des macrophages/monocytes et de leurs cellules souches. Dans la moelle osseuse, les HSCs produisent différentes populations de cellules souches intermédiaires, lesquelles perdent progressivement leur capacité à s’auto-régénérer alors qu’elles deviennent une lignée cellulaire donnée. Les monocytes dérivés des HSCs sont retrouvés dans le sang et dans un réservoir splénique. Les premiers peuvent ensuite migrer vers différents tissus et se différencier en macrophages. Finalement, la majorité des macrophages résidents123 se développent dans
l’embryon (sac vitellin/foie fœtal) avant l’apparition des HSCs et sont maintenus indépendamment de la moelle osseuse.
Figure 16 - Voies de signalisation menant à la polarisation des macrophages
Liu et coll. (2014)126
Schématisation de diverses voies de signalisation cellulaires polarisant la cellule immunitaire vers un phénotype M1 ou M2.
Abréviations: IFNγ; interferon gamma, IFNγR; IFNγ receptor, LPS; lipopolysaccharide, TLR4; toll-like receptor 4, TNF; tumor necrosis factor, IL;
interleukine, STAT; signal transducer and activator of transcription, IRF; interferon-regulatory factor, NF-κB; nuclear factor kappa B, PPARγ;
peroxisome proliferator-activated receptor gamma,AP1; activator protein 1, CREB; C-AMP response element-binding protein, NOS; Oxide nitrique
synthase, C/EBPβ; CCAAT/enhancer binding protein beta, Arg1; arginase 1, Mrc1; mannose receptor 1 C-type, MHC II; Complexe majeur d’histocompatibilité de classe II, Ym1; chitinase 3-like 3, Fizz1; resistin-like-alpha
Abréviations: HSC; hematopoietic stem cell, CMP; myeloid progenitor,
GMP; granulocyte-monocyte progenitor; MDP, monocyte/ macrophages and dendritic cells precursor, CMoP; common monocyte progenitor, Ly-6C; lymphocyte antigen 6C.
17 La figure 16 ci-haut illustre certaines voies signalétiques menant à la polarisation vers l’un ou l’autre de ces phénotypes cellulaires126.
La majorité des nouveaux monocytes circulant dans le sang sont de type M1, et sont ainsi prêts à agir immédiatement à des signaux inflammatoires131,132. Cependant, il est important de noter que
cette nomenclature ne permet pas de représenter de manière fidèle l’hétérogénéité des populations de phagocytes mononucléaires qui est fort complexe. Malheureusement, celle-ci est effectivement simplifiée par rapport à la réalité, et même les chercheurs à l’origine de cette nomenclature mettent en garde la communauté scientifique contre l’ultra-simplification des interprétations liées à ces immuno-phénotypes133.
Finalement, même si la majorité des modèles étudiés ont montré les effets néfastes des cellules M1 et les effets protecteurs des cellules M2, certaines exceptions s’appliquent. Par exemple, bien que les macrophages pulmonaires M2 jouent un rôle bénéfique dans la réparation tissulaire et la régulation de l’homéostasie du poumon en cas d’asthme, une population excessive de ces macrophages alimente une réponse inflammatoire accrue, une augmentation de la sécrétion de mucus et une augmentation de la déposition de collagène126,134,135.
IV.1.1.3 Rôles dans SNC et SNE
IV.1.1.3.1 SNC
Les microglies sont considérées comme étant les macrophages résidents du parenchyme cérébral, et sont le type cellulaire de l’immunité innée le plus nombreux du SNC où elles représentent 10% à 15% du nombre de cellules totales136. Il n’est pas surprenant donc que les microglies jouent
un rôle de première ligne dans l’immunité du SNC, ayant d’abord un rôle de surveillance en conditions normales, puis d’initiation de la réponse immunitaire lors d’attaques pathogènes137.
En conditions normales, les microglies montrent un phénotype quiescent, avec leur petit corps cellulaire et leurs longues ramifications qui font contact dynamiquement avec les neurones et les astrocytes qui les voisinent. Elles veillent à l’homéostasie de leur microenvironnement, grâce à leur fonction de pinocytose138 et à la présence de nombreux récepteurs membranaires137,139. Une fois
activées par des signaux inflammatoires ou des pathogènes, elles prennent une forme amiboïde active afin de générer une réponse inflammatoire. Elles ont, par exemple, la capacité de produire des cytokines, des chimiokines et du NO en réponse à l’activation de leurs TLRs140,141, en plus de se
déplacer vers la zone touchée et de phagocyter les débris142.
Par ailleurs, il semble que les microglies soient importantes pour des fonctions autres qu’immunologiques au sein du parenchyme cérébral. En effet, des rôles dans la survie neuronale143
et la synaptogénèse144,145 ont été rapportés grâce à l’excrétion de facteurs trophiques par les
microglies. Aussi, les microglies auraient la capacité d’induire l’apoptose planifiée chez les neurones durant le développement du SNC pour ensuite phagocyter les débris cellulaires146.
18
IV.1.1.3.2 SNE
L’intestin est le site de la plus grande présence de cellules immunitaires de l’organisme de par sa proximité avec un large bassin d’antigènes132. En effet, le microbiote et les matières digérées
ne sont séparés du parenchyme intestinal que par l’épithélium intestinal et son mucus147.
Deux groupes de macrophages résident dans la paroi intestinale : les macrophages de la muqueuse, et ceux des muscles (muscularis). Les premiers sont en contact avec les antigènes traversant la barrière épithéliale, et agissent de concert avec les cellules de l’immunité adaptatives pour éliminer les menaces pathologiques. En effet, ces macrophages ont la capacité de présenter des antigènes aux lymphocytes T naïfs des organes lymphatiques à proximité de l’épithélium, mais n’ont pas une grande activité phagocytaire148,149. La deuxième population se retrouve au niveau de la couche
musculeuse, loin de la lumière intestinale150. Ces macrophages ont des caractéristiques inverses des
premiers, puisqu’ils ont une grande activité phagocytaire, peu d’habilité à imprégner les lymphocytes T naïfs et sont absents des organes lymphatiques148,149,151.
IV.1.2 Neutrophiles
Le neutrophile est le type de leucocyte retrouvé en plus grand nombre dans le sang chez l’homme, avec 50% à 70% des cellules circulantes152. Une machinerie biologique importante est
mise en place pour fournir notre organisme en neutrophiles, avec une production de 1011 cellules par
jour153. Ce chiffre fort impressionnant est dû à la vie très courte du neutrophile, entre 8 et 12 heures
en circulation et jusqu’à 48 heures dans les tissus, qui doit être remplacé rapidement154. Cependant,
une étude récente de Pillay et coll. (2010) a montré que ces chiffres sont véridiques chez la souris, mais que la durée de vie de certains types de neutrophiles serait bien plus longue chez l’humain : 5,4 jours155!
IV.1.1.1 Origine
Les neutrophiles proviennent des cellules hématopoïétiques de la moelle osseuse156. Ceux-ci
resteront dans cet organe jusqu’à leur maturation pour être ensuite relâchés dans la circulation sanguine. La figure 17 à la page suivante résume les différentes étapes de différenciation nécessaires à la formation des neutrophiles ainsi que leur recrutement en cas d’inflammation ou d’infection157.
IV.1.1.2 Phénotype
Les neutrophiles sont des cellules très difficiles à étudier de par leur courte durée de vie dans l’organisme et en culture157. Alors que l’hétérogénéité de ce type cellulaire est connue depuis
plusieurs années158, de récentes études apportent de nouvelles preuves de ce concept en montrant
une hétérogénéité marquée des phagosomes159 et des granules160 exprimés par les neutrophiles.
IV.1.1.3 Rôles dans SNC et SNE
Tel qu’illustré par la figure 17, les neutrophiles en circulation dans le sang peuvent traverser l’endothélium des vaisseaux sanguins afin de se déplacer vers la source d’une infection ou d’une inflammation grâce au chimiotactisme. Arrivés au site de la réponse inflammatoire, ces cellules sont en mesure de procéder à l’élimination de la menace par phagocytose, dégranulation et NETose161.
19 En effet, les pathogènes ou autres molécules seront phagocytés, puis des agents nocifs comme des dérivés réactifs de l’oxygène162 et des granules intracellulaires163 seront déversés dans le
phagosome afin de tuer et digérer les éléments phagocytés161.
De plus, les neutrophiles peuvent utiliser une fonction « kamikaze », la NETose, où la cellule déverse son contenu intracellulaire qui forme alors un filet où sont emprisonnés les pathogènes. Ces filets contiennent, entre autres, des complexes d’acide désoxyribonucléique (ADN) et de molécules anti-microbiennes125. D’autres cellules immunitaires, telles que les macrophages et cellules dendritiques,
seront ensuite activées par ces filets et veilleront à l’élimination des pathogènes162,164.
À ces fonctions d’extermination, s’ajoute un rôle des neutrophiles dans l’orchestration de la réponse immunitaire grâce à la relâche de médiateurs inflammatoires dans le tissu cible165.
IV.1.3 Voie de l’inflammasome
Cette section a pour but d’introduire la voie de l’inflammasome par laquelle les cellules immunitaires peuvent être activées suite à divers signaux. L’inflammasome est un complexe de protéines qui se construit autour de protéines particulières, telles que NOD-like receptor family, pyrin domain containing 3 (NLRP3), et dont l’activation mène au clivage de la caspase-1 conduisant à la sécrétion de l’IL-1β par la cellule immunitaire, ou tout autre type cellulaire possédant cette machinerie Figure 17 - Vie d'un neutrophile: de la différenciation au site de l'inflammation
Eyles et al (2006)157
Schématisation des étapes de la vie d’un neutrophile, de son développement jusqu’à sa mort ou son rôle immunitaire. Dans la moelle osseuse, un type de cellule souche donne lieu à des cellules souches intermédiaires qui, suite à plusieurs différenciations, donnent naissances aux neutrophiles. Ceux-ci sont relâchés dans la circulation sanguine où, si aucune alerte immunologique ne se produit, ils entreront en apoptose après quelques heures. Si au contraire une alerte est lancée, les neutrophiles seront recrutés et, par extravasation, pénétreront le tissu vers le site d’inflammation ou d’infection afin de contrôler ces dernières par leurs effets anti-microbiaux.
20
cellulaire, comme les neurones166,167. De plus, cette voie peut mener vers une forme de mort
cellulaire particulière : la pyroptose168,169.
Les signaux reconnus par l’inflammasome diffèrent selon le type d’inflammasome, c.-à-d. la protéine particulière dont est composé l’inflammasome. Parmi ces signaux figurent les pathogen-associated molecular patterns (PAMPs) et les danger-associated molecular patterns (DAMPs)170. D’ailleurs, le
stress oxydatif et les dysfonctions mitochondriales peuvent mener à l’activation de cette voie171,172.
V. Modèle MPTP
Notre laboratoire travaille avec un modèle de neurotoxine, utilisant plus précisément la neurotoxine 1-méthyle-4-phényle-1,2,3,6-tétrahydropyridine (MPTP). Celle-ci est un dérivé issu de la synthèse de la desmétyleprodine, une drogue synthétique de la famille des opioïdes ayant des propriétés similaires à celles de la morphine173. Son ingestion accidentelle chez l’humain cause des
symptômes très proches de ceux de la MP et ainsi, un syndrome parkinsonien irréversible174. Les
caractéristiques motrices principales de la MP sont d’ailleurs incluses dans ces symptômes, dont la rigidité, la bradykinésie, l’instabilité posturale et les tremblements au repos175. De plus, des
symptômes non-moteurs tels que des problèmes gastro-intestinaux étaient rencontrés par certains patients176.
Il s’agit d’un modèle largement utilisé chez les rongeurs et les primates non-humains de par la possibilité de comparer les résultats expérimentaux avec ceux observés chez les patients humains ayant été en contact avec celle-ci et de par la proximité des symptômes engendrés par la neurotoxine avec ceux de la MP177. De plus, certaines caractéristiques biologiques spécifiques à
cette maladie peuvent être observées chez ce modèle telles que la perte de neurones DAergiques dans la SN ainsi qu’une déplétion en dopamine dans le striatum178 en plus de la présence d’une
Figure 18 - Mécanismes des inflammasomes
Walsh et coll. (2014)170
Schéma illustrant les mécanismes d’activation de différents types d’inflammasome menant à la sécrétion de l’IL-1β et de l’IL-18.
Abréviations: NF-ĸB; nuclear
factor ĸB, ASC; apoptosis-associated speck-like protein, NLRP3; NOD-like receptor family, pyrin domain containing 3, NLRC4; NLR family, CARD domain containing 4, NLRP1; NOD-like receptor family, pyrin domain containing 1, AIM2; absent in melanoma 2.