© Daphné Govare-Monroe, 2020
Étude de la fonctionnalité et des propriétés des
transporteurs d'influx Lsi1 du
silicium chez les
plantes
Mémoire
Daphné Govare-Monroe
Maîtrise en biologie végétale - avec mémoire
Maître ès sciences (M. Sc.)
ii
Résumé
Le silicium (Si) ne figure pas parmi les éléments essentiels des plantes, mais son effet prophylactique contre divers stress biotiques et abiotiques a été rapporté chez plusieurs espèces. Il existe toutefois une grande variabilité du taux d’absorption du Si au sein du règne végétal, qui est corrélée avec la protection que les plantes en retirent. Cette variabilité s’explique par un transporteur d’influx (Lsi1), une aquaporine de la famille des NIPIII qui assure la perméabilité du Si au niveau des cellules racinaires. Un filtre sélectif aromatique/arginine (ar/R) de type G-S-G-R est aujourd’hui reconnu comme étant essentiel pour la sélectivité du Si, bien que de nouvelles données suggèrent autrement. L’objectif a été d’étudier la fonctionnalité du transporteur Lsi1 afin de déterminer le premier résidu clé du filtre sélectif impliqué dans la sélectivité du Si. Différentes substitutions d'acides aminés ont été étudiées dans le filtre ar/R chez les Lsi1 afin d’évaluer l’impact de ces mutations sur la perméabilité au Si. L’étude a révélé que le résidu glycine à la première position du filtre sélectif n’est pas essentiel à la sélectivité du Si. L’acide aminé glycine adjacent, très conservé au sein des transporteurs de Si, a semblé en revanche plus décisif dans l’accumulation. Ces résultats apportent une meilleure compréhension de la fonctionnalité du transporteur Lsi1 pour mieux exploiter ses propriétés bénéfiques. L’espèce Brassica napus figure parmi les faibles accumulateurs de Si en raison de l’absence du gène Lsi1. Le deuxième objectif a été de mesurer l’effet du Si chez les plants de canola transformés avec le gène Lsi1. Alors que les plants transformés ont accumulé significativement plus de Si, il ne semble pas que la différence ait été suffisante pour contrer la maladie causée par Leptosphaeria maculans. Des études supplémentaires sont nécessaires en vue d’améliorer le taux d’absorption du Si chez le canola.
iii
Abstract
Silicon (Si) is not considered an essential element for higher plants despite its prophylactic role against many biotic and abiotic stresses. One of the most puzzling properties of Si is its differential absorption by plants, which is correlated with the level of protection. This variability would be explained by the presence or absence of an influx transporter (Lsi1), a NIPIII aquaporin that allows Si absorption in roots cells. A selectivity filter aromatic/arginine (ar/R) composed of four amino acids G-S-G-R is known to determine the selectivity for silicic acid although new data suggest otherwise. The first objective of this project was to determine the first key residue in the ar/R filter to optimize Si accumulation in plants. For this purpose, we conducted several substitutions of residues within the filter and evaluated the impact of each mutation on Si permeability. Our results revealed that the first glycine in the filter is not required for permeability. On the other hand, the adjacent glycine, highly conserved in many aquaporins, plays an essential role. These findings bring new insights into the functionality of Lsi1 transporters that can be applied to better exploit the beneficial properties of Si in agriculture. Brassica napus is considered as a low Si accumulator due to the absence of a functional Lsi1. The second objective was to measure the effects of Si absorption in canola plants transformed with the Lsi1 gene. Even if the transformants were able to accumulate more Si, it seems that the difference was not enough to give a protection against Leptosphaeria maculans. Additional studies are needed to improve Si absorption in canola.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Liste des tableaux ... vi
Liste des figures ... vii
Remerciements ... viii
Introduction ... 1
Hypothèses et objectifs ... 3
Chapitre 1 : Revue de littérature ... 4
Le silicium ... 5
Le silicium dans l’environnement et chez les plantes ... 5
Effets bénéfiques du Si chez les plantes ... 6
Mécanismes d’action du Silicium ... 9
Hypothèse mécanique ... 9
Hypothèse du Si soluble ... 9
Les transporteurs de Si ... 10
Les aquaporines ... 11
Les transporteurs d’efflux Lsi2 ... 15
Expression des transporteurs ... 16
Le canola (Brassica napus) ... 16
Leptosphaeria maculans ... 17
Chapitre 2 : Étude fonctionnelle des transporteurs d’influx Lsi1 du silicium chez les plantes ... 20
Introduction ... 21
Matériels et méthodes ... 23
Résultats ... 29
Activité de transport en influx du Si chez les mutants de OsLsi1 dans les oocytes de Xenopus ... 29
Activité de transport en influx du Si chez les mutants de EaLsi1 dans les oocytes de Xenopus ... 30
Immunofluorescence ... 31
Test de perméabilité à l’eau ... 33
Discussion ... 34
Chapitre 3 : Étude de l’accumulation en silicium et de la résistance à Leptosphaeria maculans chez Brassica napus génétiquement modifié avec le gène Lsi1 ... 38
v
Introduction ... 39
Matériels et méthodes ... 41
Résultats ... 44
Caractérisation des plantes transgéniques ... 44
Accumulation de Si chez le canola transformé avec VaLsi1 ... 45
Accumulation de Si chez le canola transformé avec CaLsi1 ... 46
Sévérité de la maladie causée par Leptosphaeria maculans chez les plants de canola transformés avec VaLsi1 ou CaLsi1 et fertilisés en Si. ... 47
Discussion ... 50
Conclusions générales ... 55
vi
Liste des tableaux
Tableau 1 Amorces utilisées pour insérer le gène Lsi1 dans le vecteur Pol1 ... 24 Tableau 2 Amorces utilisées pour la mutagénèse dirigée ... 25 Tableau 3 Amorces utilisées pour insérer l'épitope Myc dans les gènes Lsi1 ... 27 Tableau 4 Amorces utilisées pour détecter le transgène VaNIP2-1 ou CaNIP2-1 chez le canola transgénique. ... 42
vii
Liste des figures
Figure 1 Activité en influx des transporteurs OsLsi1 et de ses mutants mesurée chez les oocytes de Xenopus laevis. ... 30 Figure 2 Activité en influx des transporteurs EaLsi1 et de ses mutants mesurée chez les oocytes de Xenopus laevis ... 31 Figure 3 Localisation des aquaporines et leurs mutants par immunofluorescence. ... 32 Figure 4 Activité en influx des transporteurs de silicium (Si) contenant un tag Myc chez les oocytes de Xenopus laevis. ... 33 Figure 5 Test de perméabilité à l’eau chez différentes aquaporines. ... 34 Figure 6 Gels illustrant les amplifications par PCR de l’insert VaLsi1 chez les différents plants de canola issus d’une transformation. ... 44 Figure 7 Gels illustrant les amplifications par PCR de l’insert CaLsi1 chez les différents plants de canola issus d’une transformation. ... 45 Figure 8 Contenu en silicium (Si) des feuilles de plants de canola Westar WT et de plants transformés avec le gène VaLsi1 fertilisés (Si+) ou non (Si-) avec une solution de Si (1,7 mM). ... 46 Figure 9 Contenu en Si dans les feuilles chez les plants de canola Westar WT et les plants transformés avec le gène CaLsi1 fertilisés (Si+) ou non (Si-) avec une solution de Si (1,7 mM). ... 47 Figure 10 Aire des lésions causées par Leptosphaeria maculans sur les feuilles de plants de canola Westar WT, de plants transformés avec le gène VaLsi1 ou CaLsi1 fertilisés (Si+) ou non (Si-) avec une solution de Si (1,7 mM). ... 48 Figure 11 Lésions causées par Leptosphaeria maculans chez des plants de canola non transgéniques (WT), transformés avec le gène Lsi1 de Vigna angularis (VaLsi1) ou avec le gène Lsi1 de Cicer arietinum (CaLsi1) traités ou non avec le silicium (Si) ... 49 Figure 12 Contenu en Si dans les feuilles centrales des plants inoculés avec Leptosphaeria maculans chez le canola transgénique et non transgénique. ... 50
viii
Remerciements
Ce projet, qui m’a permis d’acquérir une quantité considérable de connaissances et d’aptitudes, n’aurait jamais été possible sans la confiance et le support offerts par mon directeur Richard Bélanger. Vous êtes un professeur à l’écoute de vos étudiants, un excellent conférencier et un chercheur d’une grande rigueur et passionné. Je dois avouer m’être considérée particulièrement chanceuse de travailler dans votre laboratoire. Toutes les conditions étaient rassemblées pour se sentir bien et pour progresser dans mes travaux et apprentissages en toute confiance. Merci de m’avoir encouragée et conseillée tout au long de mon projet. Votre disponibilité et votre appui ont fait une immense différence et je vous en remercie. Ces deux dernières années ont été non seulement extrêmement enrichissantes d’un point de vue professionnel, mais je garde également de très bons souvenirs du quotidien au laboratoire.
Je souhaite également remercier Dr. Paul Isenring pour ses conseils et ses ressources offertes dans son laboratoire qui ont été essentielles à l’avancement de mes travaux. Un grand merci particulièrement à Marie-Jeanne qui a été spécialement présente auprès de moi tous les jours lors de mes travaux dans votre laboratoire. Sa patience, son ouverture, ses encouragements quotidiens ont rendu mes journées plus faciles et particulièrement agréables sans compter toute l’aide qu’elle m’a apportée!
Merci à Devrim Coskun pour le temps accordé à me montrer tous les travaux liés aux transporteurs. Il fut un mentor soucieux de ma compréhension et de ma réussite. Je remercie aussi Partha Santhanam pour sa grande générosité et son aide en biologie moléculaire. Évidemment, un immense merci à Caroline Labbé toujours disponible et ouverte à m’aider autant lors de petites difficultés ou pour m’accompagner dans des tâches plus laborieuses. Son travail a apporté une grande stabilité dans mes travaux au quotidien. Elle est étonnante à voir aller avec une mémoire sans faille et une impressionnante polyvalence!
Merci aussi à tous les membres du laboratoire, avec lesquels j’ai adoré partager mes journées. Merci à Amandine Lebreton pour son aide et son soutien moral. Merci à Matteo, Chloé, Vanessa et Maxime et Geneviève pour nos discussions divertissantes et votre bonne humeur constante. Finalement, je tiens à remercier mon conjoint Benjamin pour son écoute, ses conseils et surtout sa patience.
1
Introduction
Parmi les nombreux défis auxquels est confrontée l’agriculture, on retrouve entre autres la nécessité d’augmenter la production et les rendements tout en diminuant les impacts environnementaux. Pourtant, cette augmentation de la demande alimentaire n’est pas sans conséquences puisque cela entraine le recours aux pratiques intensives et l’utilisation à grande échelle de pesticides chimiques. Dans un contexte planétaire de changements climatiques, les cultures doivent souvent subir et résister à des stress supplémentaires comme des sécheresse prolongées, l’arrivée massive d’insectes ravageurs ou le développement sévère de maladies, entrainant par le fait même une augmentation des pesticides dans l’environnement. La nécessité de développer de nouvelles stratégies de lutte durables pour la protection des cultures figure donc parmi les priorités. Les recherches sur le silicium (Si) en agriculture s’inscrivent directement dans cette perspective. Les effets bénéfiques du Si sur la croissance, le développement, le rendement et en particulier sur la résistance aux maladies ont été observés chez une grande variété d’espèces végétales. Cet élément est connu pour apporter des effets positifs sur la croissance des plantes particulièrement lorsqu’elles sont exposées à des conditions de stress. De plus, en dépit des concentrations auxquelles sont exposées les plantes, le Si est l’unique élément qui ne cause jamais de phytotoxicité.
Le rôle prophylactique du Si chez les plantes fait de la fertilisation en cet élément une approche de lutte contre les agents pathogènes en agriculture et a le potentiel de diminuer l’utilisation de composés de synthèses souvent nuisible pour l’environnement (Liang et al., 2015). Les études révèlent que certaines espèces végétales comme le riz, le concombre et la prêle répondent très fortement à une fertilisation en Si, tandis que d’autres espèces, incluant plusieurs dicotylédones, ne semblent pas répondre au traitement. En réalité, il existe une variabilité d’absorption en Si chez les plantes et l’importance des effets bénéfiques est directement liée au taux d’accumulation dans les tissus (Coskun et al., 2019). La découverte des gènes Lsi1 et Lsi2, responsables de l’entrée de l’acide silicique dans les cellules racinaires et du transport vers le xylème, expliquent aujourd’hui cette variabilité (Ma et al., 2006; 2007). En effet, il a été reconnu que l’absence d’un transporteur Lsi1 fonctionnel était en cause dans la faible accumulation en Si chez plusieurs espèces (Sonah et al., 2017). Ces observations confirment que le Lsi1 est un déterminant clé pour l’entrée du Si dans les plantes. Ce premier
2
transporteur Lsi1 est une aquaporine de la sous-famille des Nodulin-26-like intrinsic proteins-III (NIPIII). Chez ce type de protéine membranaire, un canal composé d’un mécanisme de filtre, appelé le filtre ar/R, contrôle la sélectivité des molécules transportées. Ce filtre sélectif est composé de quatre résidus participant directement au mécanisme de contrôle du passage des solutés. Il est aujourd’hui reconnu que le transporteur Lsi1 des plantes supérieures possède une signature moléculaire de type G-S-G-R au niveau de son filtre ar/R (Coskun et al., 2019). Or, certaines plantes possèdent un Lsi1 fonctionnel composé d’un filtre A-S-G-R permettant un transport élevé en Si (Trembath-Reichert et al., 2015). Bien que l’identification des deux transporteurs Lsi1 et Lsi2 soulève la possibilité d’améliorer le taux d’absorption du Si chez les plantes, une meilleure compréhension des déterminants moléculaires impliqués dans le transport de l’élément est nécessaire. La première partie de ce mémoire est consacrée à l’étude du premier résidu du filtre ar/R impliqué dans le contrôle du passage du Si chez l’aquaporine Lsi1.
Parmi les dicotylédones, la famille des Brassicacées comporte de nombreuses espèces d’importance économique par la production d’huile et de légumes pour la consommation humaine. La production de ces cultures est cependant affectée par une grande variété de stress biotiques et abiotiques. Les membres de la famille des Brassicacées sont considérés comme étant de faibles accumulateurs de Si, les empêchant ainsi de bénéficier des effets protecteurs de cet élément. En outre, il a été démonté que des plantes ne possédant pas naturellement de Lsi1, comme Arabidopsis, pouvaient devenir des accumulatrices de Si via l’introduction d’un transporteur Lsi1 d’une autre espèce (Montpetit et al., 2012; Vivancos et al., 2015). La deuxième partie du présent projet vise à mesurer l’effet d’un ajout du transporteur Lsi1 chez le canola. L’espèce Brassica napus figure aujourd’hui comme l’une des principales cultures d’oléagineux au monde (Canola Council of Canada, 2019). Au Canada, la superficie ensemencée en canola a presque doublé au cours des 20 dernières années (Statistique-Canada, 2018). Une capacité d’absorption en Si supérieure chez le canola pourrait constituer une stratégie prometteuse pour améliorer la résistance aux divers stress. Cela permettrait au secteur de demeurer compétitif sur le marché par le maintien ou l'amélioration de leur rendement tout en diminuant l'utilisation de pesticides.
3
Hypothèses et objectifs
Ce projet se divise en deux parties distinctes ayant pour objectif commun d’approfondir les connaissances sur le transport du Si par le transporteur Lsi1 en vue d’améliorer son accumulation chez les plantes. Dans la première partie du projet, nous avons étudié le rôle de certains résidus dans la sélectivité au Si chez les aquaporines Lsi1. Nous avons énoncé l’hypothèse que le filtre sélectif permettant la perméabilité du Si chez les Lsi1 n’est pas basé sur le modèle actuel de filtre GSGR. L’objectif a consisté à étudier la fonctionnalité du transporteur Lsi1 afin de déterminer le premier résidu clé du filtre sélectif impliqué dans la sélectivité du Si. Différentes substitutions d'acides aminés ont été étudiées dans le filtre ar/R chez les transporteurs de Si afin d’évaluer l’impact de ces mutations sur la perméabilité au Si.
Dans la deuxième partie du projet, nous nous sommes intéressés à mesurer l’effet du Si chez les plants de canola (Brassica napus) transformés avec le gène Lsi1. Nous avons posé la première hypothèse que les plants de canola transformés avec Lsi1 accumulaient des quantités supérieures de Si dans leurs parties aériennes comparativement aux plants non transformés. Nous avons ensuite émis l’hypothèse que les plants transformés avec Lsi1 étaient plus résistants au champignon hémibiotrophe Leptosphaeria maculans. L’objectif sous-jacent visait à démontrer que les plants de canola génétiquement modifiés avec le gène Lsi1 bénéficient d’apports supérieurs en Si.
4
5
Le silicium
Le silicium dans l’environnement et chez les plantes
Le silicium (Si) est un métalloïde tétravalent omniprésent dans l’environnement. En représentant environ 28 % de la croûte terrestre, il se positionne comme le deuxième élément le plus abondant sur terre (Liang et al., 2015). Chimiquement, le Si forme des liaisons à une très faible variété d’atomes et produit principalement des silicates ainsi que des polymères
de dioxyde de silicium (SiO2). L’importance du Si se reflète au travers du sol, dont sa masse
est composée entre 50 et 70 % de SiO2 (Ma et Yamaji, 2008). Malgré cette prépondérance,
le Si n’est pas considéré comme un élément essentiel pour les plantes en raison de l’absence d’évidences sur son implication dans le métabolisme de base des plantes (Arnon et Stout, 1939). En revanche, Epstein et Bloom redéfinissent l’essentialité en indiquant qu’un élément est essentiel s’il respecte l’un des deux critères suivants : 1. l’élément fait partie d’une molécule qui elle-même est un composé structural intrinsèque ou un composé impliqué dans le métabolisme de la plante. 2. Une trop faible quantité de l’élément peut affecter la plante de manière à démontrer une faiblesse de sa performance comparativement aux plantes y ayant accès en plus grande quantité (Epstein et Bloom, 2005). Puisque l’absence de Si peut affecter la performance de nombreuses espèces végétales, on peut le qualifier de « quasi-essentiel » pour la croissance des plantes supérieures (Ma et Yamaji, 2008).
Comme l’ensemble des éléments, le Si n’est pas toujours assimilable par les plantes. C’est
sous la forme d’acide silicique (Si(OH)4) qu’il se retrouve disponible dans le sol. Cette
molécule non chargée peut être absorbée par la plante à des pH inférieurs à 9 et est soluble dans l’eau jusqu’à 2 mM à 25°C (Ma et al., 2001). À de plus hautes concentrations, le Si commence à se polymériser sous forme de gel (Takahashi, 1978). C’est d’ailleurs grâce à cette polymérisation que le Si présent en forte concentration ne montre aucun signe de toxicité chez les plantes, une caractéristique distinctive par rapport aux autres minéraux (Ma et Takahashi, 2002). Dans la solution du sol, l’acide silicique se retrouve généralement à des concentrations allant de 0,1 à 0,6 mM (Ma et al., 2001). Une fois absorbée par les racines, la molécule doit d’abord passer au travers de la zone corticale, elle est ensuite transportée vers les parties aériennes via le xylème pour y être déposée sous forme de silice amorphe ou de
6
dans les tissus plus âgés de la plante (Ma et Yamaji, 2006). Sa déposition sous forme polymérisée a lieu sous la cuticule dans l’apoplasme des cellules des feuilles, des tiges et des
gousses et forme une double couche SiO2/cuticule. Chez certaines espèces comme le riz et le
blé, la déposition se fait dans des cellules spécifiques appelées « cellules silicaphiles » (Côté-Beaulieu et al., 2009; Ma et Takahashi, 2002).
Toutes les plantes terrestres possèdent du Si dans leurs tissus, mais la proportion de cet élément varie, allant de 0,1 % jusqu’à 10 % du poids sec (Liang et al., 2015). Cette très grande variabilité s’explique par la capacité relative des plantes à absorber l’élément. On divise celles-ci en trois catégories selon leur teneur en Si, soit les faibles accumulateurs (< 0,5 %), les accumulateurs intermédiaires (0,5 % - 1,5 %), et les forts accumulateurs (˃ 1,5 % du poids sec) (Hodson et al., 2005). Chez les monocotylédones, les Poacées et les Cyperacées accumulent des taux de Si élevés (Hodson et al., 2005). Parmi elles, le riz, l’orge et le blé sont de très forts accumulateurs. Le riz est d’ailleurs l’une des espèces les plus fortement accumulatrices connues à ce jour dans le règne végétal. Les dicotylédones, quant à elles, accumulent généralement que de très faibles quantités de Si. À titre d’exemple, le Si contenu chez les Brassicaceae et les Solanaceae est quasi négligeable, bien que l’on retrouve des niveaux modérés chez les Urticales et les Cucurbitales. Puis, en dehors des angiospermes, de forts accumulateurs se retrouvent chez l’embranchement des Bryophyta ainsi que chez les classes des Lycopsida, des Sphenopsida et des Equisetopsida provenant de la division des Pteridophyta (Ma et Takahashi, 2002). Comme l’ensemble des Gymnospermes et la majorité des Angiospermes n’accumulent pas ou peu de Si, cette capacité demeure restreinte au sein du règne végétal. Il est reconnu à ce jour que la présence de Si a de nombreux effets positifs chez les plantes et l’importance de ces effets est directement liée au taux d’accumulation dans la plante (Coskun et al., 2019).
Effets bénéfiques du Si chez les plantes
Depuis deux décennies, des centaines d’études rapportent les conséquences positives du Si autant au niveau physiologique que physique. Ces effets bénéfiques sont retrouvés spécifiquement chez les espèces ayant la capacité d’accumuler le Si dans leurs parties aériennes. On constate également que son influence se fait remarquer uniquement en condition de stress. D’un point de vue physique, le Si contribue à augmenter la force
7
mécanique des plantes, affecte les propriétés de la surface des plantes, favorise l’élongation des cellules et augmente la rigidité des parois cellulaires. Cependant, c’est du côté physiologique que la majorité des études sur le Si se sont concentrées en démontrant une meilleure résistance à divers stress abiotiques et biotiques.
Le Si influence de nombreux aspects physiologiques majeurs chez les plantes. Notamment, plusieurs éléments dont le manganèse, le fer, l’aluminium, de cadmium, l’arsénique, le chrome le plomb, le cuivre et le zinc occasionnent des problèmes de phytotoxicité moins importants en présence de Si (Liang et al., 2015). À titre d’exemple, l’ajout de Si dans la fertilisation du haricot a fait passer le seuil de toxicité du manganèse dans la solution nutritive de 0,5 μM à 5,10 μM (Horst et Marschner, 1978). Une meilleure tolérance à la toxicité des métaux est donc engendrée par une accumulation en Si, mais les mécanismes y étant liés sont encore incompris.
Un nombre considérable d’études démontrent également que le Si participe à une augmentation de la tolérance aux stress de salinité. Les plantes sous stress salin se voient bénéficier du Si par ses effets d’augmentation de l’activité photosynthétique, de la surface foliaire et du contenu en chlorophylle, soit des paramètres généralement affectés à la baisse dans de telles conditions. Le Si joue un rôle dans le maintien de la turgescence à travers l’inhibition du taux de transpiration et d’une réduction des pertes en eau permis grâce aux dépôts de silice sous les cellules épidermiques des feuilles et des tiges (Bélanger et al., 1995). Ce sont donc principalement les répercussions de l’amélioration par le Si du taux
d’assimilation en CO2 dans la plante qui expliquent une meilleure tolérance aux stress salins,
mais plusieurs autres mécanismes sont en cause et demeurent peu connus (Liang et al., 2015). Le Si améliore également la tolérance à la sécheresse et aux basses températures chez les plantes. Les plants stressés par ce type de conditions montrent des taux de photosynthèse supérieurs lorsqu’ils ont été fertilisés en Si. Gong et al. (2005) rapportent en effet que les
plants de blé sous stress hydrique et fertilisés en Si montrent des taux d’assimilation en CO2
supérieurs comparativement aux plants sans Si (Gong et al., 2005). Les mécanismes y étant reliés sont principalement les mêmes que ceux en cause dans la tolérance au stress de salinité. Ceux-ci incluent une meilleure activité des enzymes de la photosynthèse, une diminution des pertes par transpiration, une augmentation de l’absorption en eau ainsi que le nettoyage des
8
dérivés réactifs de l’oxygène via l’amélioration de l’activité antioxydante (Liang et al., 2015). Divers autres effets ont été rapportés en lien avec des stress abiotiques. On retrouve entre autres une meilleure résistance aux déséquilibres nutritifs, aux extrêmes de températures et aux radiations UV.
L’effet du Si le plus étudié chez les végétaux demeure de loin la tolérance aux stress biotiques. Bien que certaines recherches mesurent l’impact du Si en cas d’infection bactérienne, virale ou par des nématodes, c’est particulièrement au niveau des infections fongiques que le rôle prophylactique de cet élément se fait remarquer. Ce sont plus précisément les champignons biotrophes et hémibiotrophes qui se voient le plus affectés par le Si chez les plantes. Les blancs poudreux, des champignons strictement biotrophes, sont rapidement identifiés comme des espèces largement affectées par la présence de Si chez les plantes (Miyake et Takahashi, 1983). C’est d’ailleurs dès 1991 que l’équipe de Menzies et al. révèle une taille de colonies et un taux de germination des conidies de Sphaerotheca fuliginea significativement plus faibles chez le concombre fertilisé en Si (Menzies, Ehret, Glass, Helmer, et al., 1991). La littérature présente un nombre important de plantes bénéficiant de l’accumulation du Si dans la lutte contre cette maladie. Le blé, l’orge, le rosier, le raisin, le pissenlit, le fraisier ainsi que plusieurs cucurbitacées ont en effet été décrits (Liang et al., 2015). Deux maladies d’importance chez le riz causées par les champignons pathogènes Magnaporthe grisea, (Rodrigues et al., 2004) et Bipolaris oryzae (Ning et al., 2014) sont des espèces hémibiotrophes significativement réprimées par le Si. Malgré le faible effectif de champignons nécrotrophes influencés par le Si, on retrouve tout de même quelques espèces pathogènes d’importance comme Rhizoctonia solani (Rodrigues et al., 2003) chez le riz et Pythium ultinum chez le concombre (Chérif et al., 1992). Ainsi, un ensemble d’espèces fongiques démontrent être affectées par l’accumulation de Si chez une multitude de plantes accumulatrices (Wang et al., 2017).
Les insectes et autres types d’arthropodes figurent aussi parmi les types de stress biotiques pouvant être contrôlés par le Si. Les premiers chercheurs proposant un effet du Si dans l’attaque des plantes par les insectes herbivores sont l’équipe de McColloch et Salmon en 1923 en indiquant qu’une accumulation de l’élément chez le maïs induirait une meilleure résistance à la mouche de Hesse (McColloch et Salmon, 1923). Depuis, les études révélant
9
l’influence du Si dans la tolérance des plantes aux insectes piqueurs-suceurs et aux broyeurs sont retrouvées en abondance dans la littérature (Reynolds et al., 2009).
Finalement, les effets bénéfiques du Si s’observent en état de stress des plantes. Sans compter les effets physiques, le Si permet principalement une meilleure résistance aux stress biotiques et abiotiques, incluant particulièrement un rôle prophylactique dans la lutte contre les infections fongiques. Plus une plante absorbe des quantités élevées de Si, plus les conséquences positives seront importantes (Ma, 2004). Ainsi, les plantes n’ayant pas la capacité d’absorber le Si ne peuvent pas bénéficier de ses répercussions, d’où la pertinence de mieux comprendre les mécanismes d’action de cet élément.
Mécanismes d’action du silicium
Hypothèse mécaniqueEncore à ce jour, les mécanismes d’action du Si demeurent incompris. La première théorie proposée par la communauté scientifique pour expliquer ses effets chez les plantes est celui
de la barrière physique (Wagner, 1940). La double couche cuticule-SiO2 déposée dans les
tissus âgés des parties aériennes agirait comme obstacle mécanique. Cette double couche de Si polymérisé contribuerait à ralentir le processus d’infection par les agents pathogènes et augmenterait la rigidité des tissus. La pénétration des tissus par les champignons pathogènes et la mastication par les insectes seraient plus difficiles et protègeraient par conséquent la plante de manière passive en lui offrant un arsenal de défense supplémentaire. (Ma et Yamaji, 2006).
Hypothèse du Si soluble
Au début des années 90, Samuel et al. (1991) et Chérif et al. (1992) réfutent l’hypothèse voulant que le Si agirait simplement comme barrière physique. Ils sont les premiers à lier la présence de Si soluble à des changements métaboliques et à l’accumulation de composés de défense dans les plantes. Il est aujourd’hui démontré que le Si ne joue pas strictement un rôle mécanique, mais qu’il a également un rôle actif dans la résistance. En réaction à une infection fongique, plusieurs réponses biochimiques comme la production accrue de phytoalexines, de composés phénoliques, de chitinases, de peroxidases, de glucanases, de protéines PR-1 ont été liées au traitement en Si (Fauteux et al., 2005; Rodrigues et al., 2005; Rodrigues et al.,
10
2004). En constatant que ces molécules étaient mesurées uniquement en présence de Si sous forme soluble, l’hypothèse indique que l’acide silicique serait impliqué activement dans son effet prophylactique en agissant comme modulateur de composés clés du signal de stress. Le concept de « priming » des réactions de défenses a d’abord été suggéré par Fawe et al. (1998; 2001). Le Si aurait un rôle de « primer », c’est-à-dire qu’il ferait office d’activateur du système de défense, permettant ainsi une réponse plus rapide et efficace aux divers stress tout en ayant un coût métabolique minimal. En 2015, Vivancos et al. indiquent toutefois que le Si activerait d’autres mécanismes de défense qui ne dépendent pas de ce composé.
Les études plus récentes sur les effecteurs ont ensuite amené une autre hypothèse sur le mécanisme d’action du Si. Les effecteurs sont des molécules sécrétées par le champignon et sont impliquées dans la pathogénicité chez les plantes. Comme le site de déposition du Si a lieu au même endroit que la cible de nombreux effecteurs, soit dans l’apoplasme sous la cuticule, il est suggéré que le Si interfèrerait aussi avec les effecteurs libérés par les agents pathogènes. Cette interaction empêcherait les effecteurs d’atteindre leur cible, priverait ainsi le pathogène d’aller moduler les défenses de la plante et préviendrait l’invasion fongique. Rasoolizadeh et al. (2018; 2020) appuient cette hypothèse en démontrant que l’expression des gènes codant pour les effecteurs de P. sojae était significativement réduite lors de l’interaction avec des plants de soya fertilisés au Si.
Les transporteurs de Si
Anciennement, on estimait que seule la transpiration dictait l’accumulation de Si chez les plantes. La découverte en 2006 et 2007 de deux transporteurs de Si nommés Lsi1 et Lsi2, apporte les premières explications quant à la grande variation du taux de Si retrouvée chez les plantes supérieures (Ma et al., 2006; Ma et al., 2007). La translocation du Si est bel et bien facilitée par la transpiration, mais il est aujourd’hui reconnu que les transporteurs jouent le rôle décisif dans l’accumulation de cet élément. Les transporteurs Lsi1 et Lsi2 agissent de concert pour permettre au Si de pénétrer au travers des cellules racinaires et être envoyé dans le xylème pour atteindre les parties aériennes.
11
Les aquaporines
Les aquaporines (AQPs) sont des canaux protéiques retrouvés au niveau de la membrane plasmique et de plusieurs autres membranes intracellulaires autant chez les archées, les bactéries que chez les eucaryotes (Wu et Beitz, 2007). Initialement identifiées chez l’humain par l’équipe de Peter Agre (Borgnia et al., 1999), il a été découvert par la suite qu’une diversité nettement supérieure d’aquaporines était présente chez les plantes. Ces importantes protéines, appartenant à la famille des Major Intrinsic Proteins (MIPs), jouent un rôle fondamental dans le transport des molécules d’eau et d’éléments nutritifs, ce qui les rend essentielles à la survie des plantes (Hove et Bhave, 2011). Une variabilité considérable de substrats, de profils d’expression, de régulation et de localisation existe au sein des MIPs, leur attribuant des fonctions diverses dans la plante (Hove et Bhave, 2011). Par exemple, les
aquaporines peuvent être perméables à l’eau, au glycérol, au dioxyde de carbone (CO2), à
l’oxyde nitrique (NO), à l’ammoniac (NH3), au peroxyde d’hydrogène (H2O2), à l’arsénite
(As(OH)3), à l’urée (CH4N2O) et à l’acide silicique (Si(OH)4) (Wu et Beitz, 2007). Cette
diversité chez les aquaporines végétales a permis leur subdivision en sept familles en fonction de leur localisation intracellulaire et de leur séquences homologues. On y retrouve les Plasma membrane intrinsic proteins (PIPs), les Tonoplast intrinsic proteins (TIPs), les Nodulin-26-like-intrinsic proteins (NIPs), les Small basic intrinsic proteins (SIPs), les GlpF-like intrinsic proteins (GIPs), les Hybrid intrinsic proteins (HIPs) et les Uncategorized X intrinsic proteins (XIPs). Cependant, les GIP et les HIP sont retrouvées uniquement chez les plantes primitives (Deshmukh et al., 2015). Les PIP et les TIP, quant à elles, jouent essentiellement un rôle de transport de l’eau et sont généralement exprimés dans les racines et les tissus végétatifs (Deshmukh et al., 2017). Le présent projet s’intéresse plus particulièrement aux NIP puisqu’on y retrouve parmi elles une sous-famille fortement perméable au Si.
Structurellement, les MIP sont des tétramères dont chaque monomère possède un pore permettant le passage des molécules de substrat. En effet, la conformation tridimensionnelle des aquaporines forme un canal servant de barrière ou de porte d’entrée des différentes molécules. Ce pore joue un rôle sélectif dans le passage des différents solutés afin de contrôler l’osmolarité selon les besoins de la plante. Les monomères se caractérisent par la présence de six hélices alpha transmembranaires (TM1-TM6) reliées par trois boucles extracytoplasmiques (LA, LC et LE) et deux boucles intracytoplasmiques (LB et LD) (Hove
12
et Bhave, 2011). La présence de deux motifs Asn-Pro-Ala (NPA) dans les boucles LB et LE permet le repliement du monomère et la formation d’une première constriction. Une seconde constriction composée de quatre résidus, forme le filtre aromatique/arginine (ar/R) permettant le passage sélectif du substrat dans le canal. Le premier résidu de ce filtre se trouve dans l’hélice H2, le deuxième est dans l’hélice H5 et les deux derniers sont dans les boucles LE. L’acide aminé le plus conservé du filtre ar/R est le dernier résidu arginine (R) et servirait de donneur de liaisons hydrogènes permettant le transport de l’eau ou de molécules de glycérol (Jensen et al., 2003). Quant aux trois premiers acides aminés du filtre sélectif, ils sont spécifiques aux sous-familles d’aquaporines et permettent la formation des liaisons Van der Waals avec les molécules de substrat (Hove et Bhave, 2011).
Plus d’un rôle et bénéfice sont attribués à la présence d’aquaporines chez les plantes. Non seulement elles sont reconnues pour permettre le mouvement des nutriments, mais elles jouent également un rôle dans l’élongation des parties aériennes et des racines. Les aquaporines participent au développement optimal des graines, à l’hydratation du pollen et à sa germination. Ces protéines membranaires sont aussi impliquées dans le mouvement des stomates, renforçant la tolérance des plantes à la sécheresse (Deshmukh et al., 2017). Leur grande diversité et leur régulation permettent aux plantes une meilleure adaptation aux diverses conditions environnementales (Maurel et al., 2008). Aux vues des perturbations climatiques à venir, il semble primordial de mieux comprendre le fonctionnement de ces protéines membranaires. Malgré l’intérêt majeur que porte la communauté scientifique sur la question du rôle des aquaporines en conditions de stress, ce sujet demeure largement incompris.
Les transporteurs d’influx du Si
La découverte des transporteurs de Si marque un point tournant dans l’étude du mécanisme d’absorption de cet élément chez les plantes. Le transporteur Lsi1 (Low silicon rice 1), est une aquaporine (AQP) appartenant à la sous-famille des Nodulin 26-like intrinsic protein-III (NIPIII) permettant l’entrée en influx de l’acide silicique du sol vers les cellules racinaires. Cette protéine membranaire contrôle de manière passive l’accumulation du Si (Ma et Yamaji, 2006). D’abord découvert chez le riz (Oryza sativa) (Ma et al., 2006), ce transporteur a par la suite été identifié chez plusieurs autres plantes. Il n’est pas retrouvé chez toutes les espèces
13
végétales et sa présence explique en grande partie la forte accumulation de Si possible chez ces plantes. En effet, les espèces faiblement accumulatrices étudiées à ce jour ne possèdent pas de Lsi1. À titre d’exemple, Arabidopsis thaliana, Brassica napus et Eruca vesicaria, tous de faibles accumulateurs de Si, ne possèdent pas le gène Lsi1 (Sonah et al., 2017). À l’inverse Cucumis sativus, Glycine max, Oryza sativa, et plusieurs autres sont à la fois de forts accumulateurs et porteurs du gène Lsi1. Plusieurs homologues ont été identifiés jusqu’à maintenant chez l’orge (HvLsi1), le blé (TaLsi1), le maïs (ZmLsi1), le concombre (CSiT-1), la citrouille (CmLsi1) et le soya (GmLsi1) (Ma et Yamaji, 2015). Le transporteur Lsi1 est non seulement perméable à l’acide silicique mais également à l’eau en plus d’agir de manière bidirectionnelle en influx et en efflux (Mitani et al., 2008a).
La localisation du Lsi1 varie selon les espèces. Chez le riz, l’aquaporine est située dans la membrane plasmique à l’extrémité distale des cellules de l’exoderme et de l’endoderme au niveau de la bande de Caspari. Tandis que chez le l’orge et le maïs, elle est localisée du côté distal des cellules épidermiques et corticales (Chiba et al., 2009; Ma et al., 2006). À l’inverse, le CmLsi1 chez la citrouille est localisé dans toutes les cellules racinaires et ne montre aucune disposition polaire (Mitani et al., 2011). Physiquement, le Lsi1 est retrouvé dans les régions matures des racines principales et secondaires, mais est très peu présent dans les extrémités racinaires comme l’apex (Ma et al., 2006).
Comme expliqué précédemment, chaque aquaporine possède une signature moléculaire spécifique contenant les deux domaines NPA ainsi que le filtre sélectif composé de quatre acides aminés. Dans le cas du transporteur Lsi1, une étude indique que les deux domaines NPA semblent devoir être séparés par 108 acides aminés pour que les NIPIII puissent laisser passer le Si. Chez la tomate par exemple, une plante faiblement accumulatrice, la séparation de 109 acides aminés entre les deux domaines NPA explique l’incapacité de cette espèce à absorber le Si (Deshmukh et al., 2015). Malgré le fait que ces deux domaines soient fortement conservés au sein des NIPIII, ils semblent cependant n’avoir qu’un rôle restreint dans le passage sélectif du Si. En effet, OsNIP1;1 et OsNIP2;1 possèdent les deux domaines NPA alors qu’uniquement OsNIP2;1 transporte l’acide silicique (Mitani et al., 2008a). Quant au filtre sélectif ar/R, une signature moléculaire spécifiquement liée à l’acide silicique semble caractériser les NIPIIIs. Plus précisément, les résidus du filtre de type Gly88, Ser207, Gly216
14
et Arg222 semblent largement conservés chez les transporteurs Lsi1. Une constriction plus large (≥6Å) permise par les résidus G-S rendrait possible le passage de l’acide silicique (4.38 Å) (Hove et Bhave, 2011). Ces quatre acides aminés G-S-G-R, de position bien précise dans la séquence protéique, semblent être le critère actuel pour déterminer la capacité d’une aquaporine à transporter le Si. C’est le cas pour les transporteurs OsNIP2;1 (Ma et al., 2006) du riz, TaNIP2;1 du blé (Montpetit et al., 2012), GmNIP2;1 du soya (Deshmukh et al., 2013), ZmNIP2;1 du maïs (Mitani et al., 2008b), HvNIP2;1 de l’orge (Chiba et al., 2009) et pour la majorité des aquaporines de type Lsi1 décrites à ce jour. Une étude révèle même que la mutation d’un acide aminé du filtre GSGR occasionne une diminution marquée du transport du Si par l’aquaporine (Mitani-Ueno, Yamaji, Zhao, et al., 2011).
Lsi1 chez le riz comme transporteur modèle
Le premier transporteur d’influx du Si a été identifié chez le riz (Oryza sativa) par Ma et al. en 2006 où l’inhibition de l’expression de OsNIP2;1 résultait en une réduction de l’absorption de Si (Ma et al., 2006). Ce sont d’ailleurs les résultats de ces expérimentations qui ont mené au nom de Low silicon rice (Lsi1) donné au gène responsable de l’absorption du Si chez les plantes. Chez cette espèce, le gène Lsi1 est situé sur le chromosome 2 et inclut 5 exons et 4 introns. La séquence codante du gène (cDNA) est de 1409 pb et la protéine qui en résulte est composée de 298 acides aminés. Sa signature moléculaire est bien composée des deux domaines NPA et du filtre ar/R de type GSGR comme l’ensemble des plantes supérieures étudiées jusqu’à maintenant. Les connaissances acquises sur le transporteur OsLsi1 autant au niveau de sa composition moléculaire, de son expression et de son activité facilitent les études de fonctionnalité des transporteurs et le rendent un transporteur modèle idéal.
Lsi1 chez la prêle comme transporteur modèle
Parmi les transporteurs d’influx du Si caractérisés à ce jour, une espèce présente certaines exceptions. La prêle (Equisetum arvense), une plante ancestrale dont la survie dépend du Si, possède des aquaporines perméables au Si. Ces dernières font partie de la famille d’aquaporines des NIPII, contrairement aux NIPIII chez plantes supérieures. Bien qu’ils appartiennent à des familles différentes, leurs séquences présentent toute de même une homologie élevée. Reconnues pour être perméables à l’acide borique, les NIPII ont été décrites chez Arabidopsis (Takano et al., 2006). Contrairement aux aquaporines perméables
15
au Si chez les plantes supérieures, la signature moléculaire de EaNIP3 au niveau du filtre sélectif n’est pas constituée des résidus GSGR, mais plutôt des résidus STAR. Il s’agit en réalité d’une différence majeure. Les deux domaines NPA sont, quant à eux, bien présents (Grégoire et al., 2012). Comme les Equisetum sont d’origine ancestrale, il se pourrait que leurs transporteurs de Si aient évolué indépendamment des angiospermes. Malgré leurs différences, l’efficacité des EaNIP3 à transporter le Si les rend des modèles intéressants pour l’étude des mécanismes d’absorption du Si chez les plantes.
Les transporteurs d’efflux Lsi2
Les transporteurs Lsi2 sont responsables du passage du Si en efflux, faisant sortir l’élément des cellules racinaires vers l’apoplasme et permettant de charger le xylème. Ce sont des protéines appartenant à une classe non caractérisée de transporteurs d’anions putatifs qui possèderaient 11 domaines transmembranaires. Bien que les Lsi2 se retrouvent aussi au niveau de la membrane plasmique, ils sont généralement positionnés du côté proximal, contrairement aux Lsi1 (Ma et al., 2007). Cette localisation polaire entre le Lsi1 et le Lsi2 démontre bien que ces deux transporteurs agissent de manière complémentaire afin de permettre l’entrée efficace de l’acide silicique dans le xylème chez les espèces fortement accumulatrices. À l’origine identifiés chez le riz, de nombreux homologues ont par la suite été identifiés chez d’autres espèces dont l’orge (HvLsi2), le maïs (ZmLsi2), la prêle (Vivancos et al., 2016) et la citrouille (CmLsi2) (Mitani-Ueno, Yamaji, et Ma, 2011; Mitani et al., 2009). Cependant, il existe une certaine variation dans le type de cellules racinaires où se trouvent ces transporteurs. Chez le riz, le Lsi2 est présent du côté proximal de l’exoderme et de l’endoderme des racines, tandis que chez l’orge et le maïs il est uniquement situé à l’endoderme (Mitani et al., 2009). Ces variations seraient probablement dues aux structures racinaires distinctes au sein des espèces. On retrouve les transporteurs d’efflux dans les racines principales et latérales, mais aucune expression n’a lieu au niveau des radicelles et des apex racinaires (Ma et al., 2007). Malgré ces ressemblances avec le transporteur d’efflux de l’arsénite des bactéries et des archées ainsi que sa capacité à transporter le Si chez le riz, peu de connaissances sur le Lsi2 sont disponibles. En effet, le type de transport membranaire effectué par le Lsi2 reste encore à étudier, en marge du processus actif et anti porteur
Si(OH)4/H+ suggéré par Ma et al. (2007). Il est aujourd’hui reconnu que les transporteurs
16
Si dans les tissus de la plante. En dépit de leurs différences importantes, une comparaison des régions promotrices révèle que ces deux transporteurs possèdent des domaines communs (Ma et al., 2007).
Expression des transporteurs
Tel que rapporté plus tôt, les deux transporteurs Lsi1 et Lsi2 sont localisés au niveau de la membrane plasmique, mais leur expression varie selon les espèces, le type de tissus et de cellules (Ma et Yamaji, 2015). Les spécificités de localisation cellulaire et d’expression de chacun de ces transporteurs démontrent qu’ils sont impliqués dans des étapes distinctes mais complémentaires dans le processus d’accumulation du Si. Un knockout de l’un ou l’autre des gènes a occasionné une diminution significative de l’accumulation en Si (Ma et al., 2006). En d’autres termes, la présence conjointe de ces deux transporteurs serait le facteur clé pour une accumulation optimale du Si chez les plantes. Des études réalisées chez le riz indiquent qu’il y aurait une relation inverse entre le niveau d’expression des transporteurs de Si et le niveau d’accumulation de l’élément dans les feuilles. Plus précisément, un taux d’accumulation en Si élevé dans les feuilles induit une régulation négative de l’expression des transporteurs dans les racines (Mitani-Ueno et al., 2016). L’expression de ces deux transporteurs est également régulée négativement par l’indication d’un stress comme une sécheresse ou la présence d’acide abscissique (Yamaji et Ma, 2007). Aucun consensus sur l’expression des transporteurs n’a cependant été établie.
Le canola (Brassica napus)
L’espèce Brassica napus, appartenant à la famille des Brassicaceae, est connu sous le nom commun de colza ou de canola. Cette espèce amphidiploïde serait dérivée des espèces diploïdes B. nigra, B. rapa et B. oleracea. Le terme canola est spécifiquement employé pour les variétés de B. napus issues d’un processus d’amélioration génétique visant à améliorer les propriétés de l’huile en la rendant plus saine pour la consommation humaine et animale. Plus spécifiquement, l’appellation contrôlée « canola » doit être employée uniquement pour les variétés à faible teneur en acide érucique et en glucosinolate dont les teneurs ne doivent pas excéder des seuils bien précis. Cette variété, développée dans les années 1970 par la recherche d’Agriculture et Agroalimentaire Canada, est depuis devenue l’une des cultures d’oléagineux la plus importante mondialement et largement cultivée au Canada (Canola
17
Council of Canada, 2019). La production mondiale de canola était estimée à 68 millions de tonnes en 2016 (USDA, 2017). Au Canada, la superficie ensemencée en canola a presque doublé au cours des 20 dernières années passant de 12 millions d’acres en 1997 à 23 millions d’acres en 2017 (Statistique-Canada, 2018). La culture intensive de canola fait aujourd’hui face à plusieurs difficultés comme le développement de maladies, la compétition des mauvaises herbes et des problèmes de sécheresse majeurs. Pour affronter ces défis, de nouvelles variétés de canola ont été développées par l’introduction de gènes de résistance. Par exemple, différents cultivars plus résistants au champignon pathogène Leptosphaeria maculans ont été développés (Zhang et al., 2016). Le cultivar Westar, performant mais sans aucun gène de résistance à la maladie, est rapidement devenu moins intéressant à cultiver. Pour cette raison, de nouveaux cultivars rendus résistants à L. maculans grâce au gène de résistance Rlm3 ont été introduits à grande échelle dans les années 90. Toutefois, l’efficacité de ces cultivars a rapidement été anéantie au début des années 2000 par le développement de races fongiques résistantes (Zhang et al., 2016). Malgré la mise en place de variétés possédant plus d’un gène de résistance, les problèmes liés aux maladies chez le canola demeurent des enjeux majeurs.
Tel que mentionné, les Brassicacées ne possèdent pas de transporteurs Lsi1. Des études ont cependant démontré qu’en transformant une plante faiblement accumulatrice comme Arabidopsis avec un gène d’absorption du Si du blé (TaLsi1), la plante devenait plus tolérante au blanc poudreux en présence de Si (Vivancos et al., 2015). Sachant qu’Arabidopsis fait partie de la même famille que le canola, une telle transformation serait éventuellement possible chez ce dernier. La facilité à manipuler génétiquement le canola en laboratoire rend plus aisée l’amélioration génétique et la création de cultivars plus performants et polyvalents.
Leptosphaeria maculans
La maladie de la jambe noire (blackleg) est causée par un champignon pathogène hémibiotrophe des Brassicaceae. Leptosphaeria maculans, faisant partie de la famille des ascomycètes, correspond à la forme sexuée de la maladie, tandis que Phoma lingam est sa forme asexuée. Cette maladie peut entraîner des dommages majeurs en particulier chez le canola. C’est d’ailleurs devenu dans l’Ouest canadien l’agent pathogène engendrant les pertes économiques les plus importantes dans cette culture au cours de la dernière décennie
18
(Canola Council of Canada, 2019). Géographiquement, il se retrouve principalement en Australie, en Nouvelle-Zélande, au Canada, en Europe, en Afrique du Sud et aux États-Unis (West et al., 2001). Les pertes de rendements à la récolte engendrées par L. maculans sont généralement supérieures à 10 % et peuvent atteindre 30 à 50 % (West et al., 2001). Les principales raisons expliquant l’accélération des problèmes liés à cette maladie sont l’augmentation des surfaces cultivées, l’absence de rotations de cultures ainsi que la perte d’efficacité des gènes de résistance utilisés à ce jour (Zhang et Fernando, 2018). La forme anamorphe du champignon produit des spores de type pycnidiospores (3-5 x 1.5-2 μm) contenues dans une matrice hygroscopique noire appelée pycnide (Williams, 1992). Ces pycnides sont produites dans les tissus infectés et nouvellement morts de la plante et libèrent les pycnidiospores pouvant être disséminées sur quelques mètres grâce aux éclaboussures de la pluie. La forme téléomorphe, quant à elle, produit des structures fructifères noires et globuleuse appelées des pseudothèces. Ces ascocarpes contiennent de nombreux asques où se retrouvent les spores de type ascospores de forme cylindrique à ellipsoïdale (35-70 x 5-8 μm) (Williams, 1992). Contrairement aux spores asexuées, les ascospores se propagent par le vent sur plusieurs kilomètres (West et al., 2001).
Peu importe le stade sexué ou asexué, l’infection est initiée par la pénétration des spores via les stomates ou les blessures. Leptosphaeria maculans est donc susceptible d’attaquer presque toutes les parties de la plante incluant les cotylédons, les feuilles, les tiges, les racines
et les siliques. Les premiers symptômes sont généralement des lésions foliaires circulaires de
couleur blanc à gris où apparaissent ensuite des points noirs représentant les pycnides. Durant la phase biotrophe, les hyphes se développent dans les tissus via les espaces intercellulaires et accèdent aux pétioles où elles peuvent atteindre la tige. Une fois les vaisseaux atteints, la croissance du champignon peut générer un contour noir à la base de la tige et former un chancre. Ces chancres peuvent affecter le transport de l’eau, engendrer un remplissage prématuré des siliques, des graines échaudées et peuvent même finir par sectionner la base du plant. Bien que le chancre soit le stade le plus sévère de la maladie, la présence importante de lésions foliaires peut également affecter la maturité des plants et la qualité des siliques (West et al., 2001).
19
Après la récolte, le champignon entre dans sa phase nécrotrophe où les tissus morts sont colonisés d’abord par la forme asexuée qui produira des pycnides ou entrera dans la phase sexuée, participant ainsi à l’augmentation du degré d’inoculum. Cet agent pathogène peut survivre sur les débris végétaux ou les graines de canola pendant plusieurs années sous forme de mycélium, de pycnides ou de pseudothèces. Sa survie est favorisée par des conditions estivales sèches et des hivers froids (Howlett et al., 2001). Il existe plusieurs groupes de pathogénicité de ce champignon (PG); soit PG1 qui englobe les races faiblement virulentes tandis que PG2, PG3 et PG4 comprennent les races très virulentes (Chen et Fernando, 2006).
20
Chapitre 2 : Étude fonctionnelle des transporteurs d’influx Lsi1
du silicium chez les plantes
21
Introduction
Le silicium (Si) est un élément appartenant aux métalloïdes qui est présent en abondance dans l’environnement. Il correspond à environ 28 % de la croûte terrestre, ce qui le positionne comme le deuxième élément le plus abondant sur terre (Liang et al., 2015). Les taux élevés
en SiO2 du sol, généralement entre 50 et 70 % de la masse, exposent les plantes à de grandes
quantités de cet élément (Ma et Yamaji, 2008). Malgré cette omniprésence, le Si ne figure pas parmi les éléments essentiels des plantes. En réalité, toutes les plantes terrestres possèdent du Si dans leurs tissus, mais les taux varient de 0,1 à 10 % du poids sec (Liang et al., 2015).
C’est sous forme d’acide silicique (Si(OH)4) que le Si est disponible pour les plantes. Les
concentrations généralement retrouvées de cette molécule dans la solution du sol vont de 0,1 à 0,6 mM, mais elle est soluble dans l’eau jusqu’à 2mM (Ma et al., 2001). Étant un élément peu mobile, le Si s’accumule avant tout dans les tissus plus âgés de la plante (Ma et Yamaji, 2006). Il se dépose sous forme polymérisée sous la cuticule dans l’apoplasme des cellules
des feuilles, des tiges et des gousses et forme une double couche SiO2/cuticule. Les plantes
sont subdivisées en trois grandes catégories selon leur teneur en Si dans leurs tissus. On retrouve les faibles accumulateurs (< 0,5 %), les accumulateurs intermédiaires (0,5 % - 1,5 %), et les forts accumulateurs (˃ 1,5 % du poids sec) (Hodson et al., 2005). La variabilité du taux de Si dans les plantes est liée à leur capacité relative à accumuler l’élément dans leurs tissus. Le riz (Oryza sativa) et la prêle des champs (Equisetum arvense) figurent parmi les plus forts accumulateurs.
L’intérêt principal de la communauté scientifique porté sur le Si est lié à ses multiples effets bénéfiques chez les plantes. Non seulement le Si augmente la rigidité des parois cellulaires et favorise l’élongation des cellules végétales, mais de nombreux effets physiologiques ont également été rapportés. Plusieurs de ces effets engendrent une tolérance accrue aux stress biotiques et abiotiques (Liang et al., 2015). Pour ce qui est des stress abiotiques, une réduction des problèmes de phytotoxicité des métaux, de salinité et de déséquilibres nutritifs sont largement rapportés dans la littérature. Le Si contribue également à améliorer la tolérance des plantes à la sécheresse, aux extrêmes de températures ainsi qu’aux radiations UV. L’effet du Si le plus étudié chez les végétaux est de loin la tolérance aux stress biotiques. Des centaines d’études démontrent une réduction des problèmes liés aux infections fongiques chez une multitudes de plantes accumulatrices (Chérif et al., 1992; Menzies, Ehret, Glass, et
22
Samuels, 1991; Rodrigues et al., 2004). Les insectes et autres arthropodes figurent aussi parmi les stress biotiques pouvant être réprimés par le Si (Reynolds et al., 2009). Ainsi, l’influence du Si se fait uniquement remarquer en condition de stress. Il est aujourd’hui reconnu que ses effets positifs et leur importance relative sont directement liés au taux d’accumulation du Si dans la plante (Coskun et al., 2019). En d’autres termes, plus la plante accumule de Si dans ses tissus, plus elle en bénéficie.
Les variations d’accumulation de Si au sein du règne végétal ont été expliquées grâce à la découverte des transporteurs de Si chez les plantes, appelés Lsi1 et Lsi2 (Ma et al., 2006; Ma et al., 2007). Ces transporteurs, situés au niveau de la membrane plasmique des cellules racinaires, agissent ensemble afin de permettre l’accumulation efficace du Si dans les parties aériennes. L’entrée de l’acide silicique de la solution du sol vers les cellules racinaires est canalisée par le transporteur d’influx Lsi1. Le transporteur d’efflux Lsi2 agit ensuite de manière à faire sortir le Si des cellules racinaires vers l’apoplasme afin de charger le xylème. La présence de ces deux gènes est aujourd’hui l’explication moléculaire de la capacité relative des plantes à accumuler le Si (Ma et Yamaji, 2015).
Le transporteur Lsi1 est en réalité une protéine appartenant à la grande famille des Major intrinsic proteins (MIPs), aussi appelées sous le nom d’aquaporines (AQPs) (Hove et Bhave, 2011). Plus précisément, le Lsi1 appartient à la sous famille des Nodulin 26-like intrinsic protein-III (NIPIII). Comme chez l’ensemble des aquaporines, la conformation tridimensionnelle du Lsi1 forme deux constrictions impliquées dans le passage des différentes molécules. La première constriction est composée de deux motifs Asn-Pro-Ala (NPA), tandis que la seconde, formée de quatre acides aminés, constitue le filtre aromatique/arginine (ar/R) permettant la sélectivité des molécules transportées. Dans le cas du Lsi1, une étude indique qu’une séparation des deux domaines NPA par 108 acides aminées serait un des critères permettant le passage du Si chez les NIPIII (Deshmukh et al., 2015). Au niveau du filtre sélectif, les résidus Gly-Ser-Gly-Arg (GSGR) constituent la signature moléculaire permettant le transport du Si chez les aquaporines Lsi1. Ces quatre acides aminés de position bien précise dans la séquence protéique ainsi que la distance de 108 acides aminés entre les domaines NPA, semblent être les critères actuels pour déterminer la capacité d’une aquaporine à transporter le Si (Coskun et al., 2019).
23
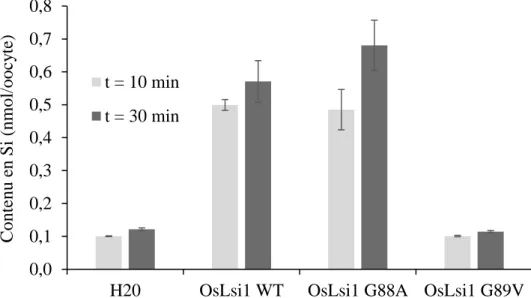
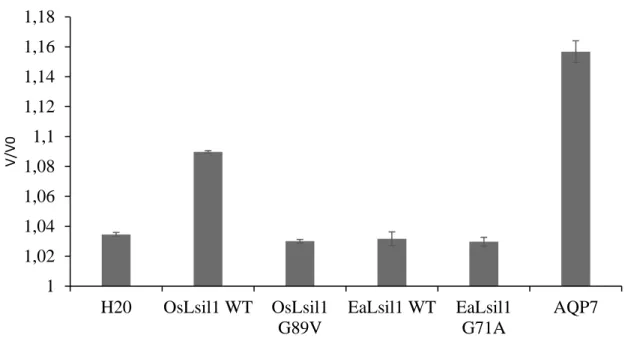
Malgré le présent consensus quant aux quatre résidus GSGR impliqués dans la sélectivité du Si, on retrouve au sein du règne végétal plusieurs espèces fortement accumulatrices de Si présentant un filtre sélectif de type ASGR. À titre d’exemple, Phaseolus vulgaris, Vigna radiata, et Vigna angularis sont toutes les trois de fortes accumulatrices de Si et possèdent pourtant un Lsi1 composé d’un filtre ar/R de type Ala-Ser-Gly-Arg (ASGR). Des tests par expression hétérologue dans les oocytes de Xenopus laevis révèlent que le transporteur Lsi1 de ces dernières espèces est bel et bien actif dans le transport du Si (données non publiées). À partir de ces informations, la première position du filtre sélectif du Lsi1 permet le transport du Si qu’elle soit composée de l’acide aminé Glycine ou Alanine. Il a d’autant plus été remarqué que le résidu Glycine à la position adjacente au premier acide aminé du filtre sélectif dans la séquence protéique (Gly88 chez OsLsi1) est davantage conservé au sein des NIPIII que cette première position. Le transporteur de Si chez la prêle (EaLsi1), appartenant à la sous-famille des NIPII, présente également une conservation de l’acide aminé Glycine à la position adjacente de celle du premier résidu du filtre ar/R. Une question se pose ainsi quant à l’implication dans la sélectivité du Si de ce résidu adjacent fortement conservé chez les transporteurs Lsi1. Nous avons donc posé l’hypothèse que le filtre sélectif permettant la perméabilité du Si chez les Lsi1 n’est pas basé sur le modèle actuel de filtre GSGR. Le présent objectif est de déterminer le premier résidu clé du filtre sélectif impliqué dans la sélectivité du Si au sein des Lsi1. L’activité de transport du Si chez des Lsi1 mutés au niveau de leur filtre sélectif a ainsi été testé chez le riz et la prêle par le système d’expression hétérologue d’oocytes de X. laevis afin de déterminer l’impact de la mutation sur la fonctionnalité du transporteur.
Matériels et méthodes
Clonage des gènes et construction des plasmides pour l’expression hétérologue dans les oocytes de Xenopus laevis
Pour le clonage des gènes d’intérêts, l’ARN des tissus de Oryza sativa et Equisetum arvense a été préalablement isolé. L’ADNc a ensuite été synthétisé par transcription inverse et les gènes OsLsi1 (numéro d’accession AB222272) et EaLsi1 (numéro d’accession HE858197) ont été amplifiés par PCR à partir de l’ADN complémentaire (ADNc). Ces étapes ont été réalisées préalablement à ce projet.
24
Pour faire les constructions, les séquences codantes de OsLsi1 et EaLsi1 ont été amplifiées en utilisant des amorces PCR créées de manière à introduire les sites de restrictions SpeI/BglII chez OsLsi1 et EcoRI/HindIII chez EaLsi1 aux extrémités. L’amplicon obtenu a été inséré dans le vecteur d’expression de Xenopus laevis Pol1 comprenant un promoteur T7, la région globuline non transcrite de X. laevis et une queue poly(A). Pour l’insertion, le vecteur Pol1 a été prédigéré avec les enzymes respectives (SpeI/BglII pour OsLsi1 et EcoRI/HindIII pour EaLsi1). Tous les vecteurs ont été clonés dans les souches compétentes E. coli TOP10 et gardés à -80°.
Tableau 1 Amorces utilisées pour insérer le gène Lsi1 dans le vecteur Pol1
Nom de
l’amorce Direction Séquence Commentaire
OsLsi1-Bgl2-F F
CTATAGATCTATGGCCAGCAACAACT CGAG
Pour intégrer le gène
OsLsi1 dans le vecteur Pol1 OsLsi1-Spe1-R R GTTAACTAGTTCACACTTGGATGTTCT C
Pour intégrer le gène
OsLsi1 dans le vecteur Pol1 EaLsi1-EcoRI-F F AGTGGAATTCATGACGAAAGGGGAG ATATCGATTC
Pour intégrer le gène
EaLsi1 dans le vecteur Pol1 EaLsi1-HindIII-R R CCCAAGCTTTTAAGTGCTTTCATCTTC TAGTTTGAG
Pour intégrer le gène
EaLsi1 dans le
vecteur Pol1
Mutagénèse dirigée
En se basant sur un large alignement de séquences d’acide aminés provenant d’homologues Lsi1 (NIP2), l’analyse a révélé que le résidu glycine (G) adjacent à la première position du filtre sélectif est conservé au sein des Lsi1 de toutes les espèces (données non publiées). Le logiciel PROVEAN (Protein Variation Effect Analyzer) a été utilisé pour prédire l’effet d’un changement d’acide aminé à ces positions sur la fonctionnalité de la protéine (Choi et al., 2012). À la lumière de ces analyses, le résidu glycine à la position 88 remplacé avec l’alanine (G88A) ainsi que le résidu glycine à la position 89 remplacé avec la valine (G89V) ont été ciblés pour l’étude de fonctionnalité chez OsLsi1. Chez EaLsi1, le résidu sérine à la position
25
70 remplacé par le résidu glycine ou thréonine (S70G et S70T) ainsi que le résidu glycine à la position 71 remplacé par le résidu alanine (G71A) ont été ciblés.
La méthode de mutagénèse dirigée par PCR a été utilisée pour réaliser les substitutions spécifiques grâce aux amorces créées pour induire la mutation désirée. Les amorces utilisées pour générer chaque mutant sont indiquées au Tableau 2. Les mutagénèses ont été réalisées avec l’ADN polymérase Phusion Taq polymerase (New England Biolabs). Les produits issus de la réaction PCR ont ensuite été digérés avec l’enzyme DpnI pour dégrader l’ADN génomique méthylé. Puis la transformation dans des cellules compétentes E. coli TOP10 a été réalisée. Toutes les séquences ont été confirmées par séquençage des plasmides.
Tableau 2 Amorces utilisées pour la mutagénèse dirigée Nom de
l’amorce Direction Séquence Commentaires
OsLsi1-G88A-F F
GTCGATCGCCGCTGGCCTCATCGT GACGGTGATG
Mutagénèse dirigée du mutant OsLsi1 G88A
OsLsi1-G88A-R R
CGATGAGGCCAGCGGCGATCGAC TGTCCCAGCTG
Mutagénèse dirigée du mutant OsLsi1 G88A OsLsi1-G89V-F F CGATCGCCGGTGCCCTCATCGTGACGGTGATGATC Mutagénèse dirigée du mutant OsLsi1 G89V OsLsi1-G89V-R R CACGATGAGGACACCGGCGATCG ACTGTCCCAGC Mutagénèse dirigée du mutant OsLsi1 G89V EaLsi1G7 1A-F F AGCAGCTTCTGCCTTGGCGGTCAT GATGATAATTC Mutagénèse dirigée du mutant EaLsi1 G71A EaLsi1G7
1A-R R
TGACCGCCAAGGCAGAAGCTGCT GCTAAACCAAATG
Mutagénèse dirigée du mutant EaLsi1 G71A F-EaLsi1-S70T F AGCAGCAGCTACTGGCTTGGCGG TCATGATGATAA Mutagénèse dirigée du mutant EaLsi1 S70T R-EaLsi1-S70T R CCGCCAAGCCAGTAGCTGCTGCT AAACCAAATGAGC Mutagénèse dirigée du mutant EaLsi1 S70T F-EaLsi1-S70G F TAGCAGCAGCTGGTGGCTTGGCG GTCATGATGATAA Mutagénèse dirigée du mutant EaLsi1 S70G R-EaLsi1-S70G R ACCGCCAAGCCACCAGCTGCTGC TAAACCAAATGAG Mutagénèse dirigée du mutant EaLsi1 S70G Préparation de l’ARNc
À partir des cellules compétentes E. coli TOP 10 préalablement transformées avec les différentes constructions et entreposées à -80°C, une culture bactérienne fraîche a été faite. Les plasmides ont été récupérés en utilisant le kit QIAprep Spin Miniprep (QIAGEN). La