Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées
Institut de chimie des milieux et matériaux de Poitiers - IC2MP (Diplôme National - Arrêté du 25 mai 2016)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Chimie théorique, physique, analytique
Présentée par :
Delphine Dru
Synthèse, optimisation et caractérisation des nouvelles architectures catalytiques pour une application
en pile à combustible PEMFC
Directeur(s) de Thèse :
Christophe Coutanceau, Pierrick Buvat
Soutenue le 01 septembre 2016 devant le jury
Jury :
Président François Jérôme Directeur de recherche CNRS, Université de Poitiers Rapporteur Cristina Iojoiu Chargée de recherche CNRS, Université de Grenoble Rapporteur Marc Cretin Professeur des Universités, Université de Montpellier Membre Christophe Coutanceau Professeur des Universités, Université de Poitiers
Membre Pierrick Buvat Ingénieur de recherche, CEA Le Ripault
Membre Stève Baranton Maître de conférences, Université de Poitiers
Pour citer cette thèse :
Delphine Dru. Synthèse, optimisation et caractérisation des nouvelles architectures catalytiques pour une
application en pile à combustible PEMFC [En ligne]. Thèse Chimie théorique, physique, analytique. Poitiers :
THESE
Pou l o te tio du G ade de DOCTEU‘ DE L UNIVE‘SITE DE POITIE‘S (Faculté des Sciences Fondamentales et Appliquées)
(Diplôme National - Arrêté du 7 août 2006)
É ole Do to ale : S ie es pou l E i o e e t Ga Lussa . Secteur de Recherche : Chimie Théorique, Physique, Analytique
Présentée par :
Delphine DRU
***********************************************************************
SYNTHESE, OPTIMISATION ET CARACTERISATION DES NOUVELLES
ARCHITECTURES CATALYTIQUES POUR UNE APPLICATION EN PILE A
COMBUSTIBLE PEMFC
*********************************************************************** Directeur de Thèse : Christophe COUTANCEAU
Co-directeur de thèse : Pierrick BUVAT
************************
Soutenance soutenue le 01 septembre 2016 devant la Commissio d E a e ************************
JURY
François JEROME, Directeur de recherche Président
(IC2MP, Université de Poitiers)
Cristina IOJOIU, Chargée de recherche HDR Rapporteur
(LEPMI, Université de Grenoble)
Marc CRETIN, Professeur Rapporteur
(IEM, Université de Montpellier)
Stève BARANTON, Maître de conférences Examinateur
(IC2MP, Université de Poitiers)
Pierrick BUVAT, Ingénieur de recherche HDR Examinateur
(CEA Le Ripault)
Christophe COUTANCEAU, Professeur Examinateur
A o Parrai …
"Le succès n'est pas définitif, l'échec n'est pas fatal, c'est le courage de continuer
qui compte" Winston Churchill
Table des matières
TABLE DES MATIERES ... 5
GLOSSAIRE
I
INTRODUCTION GENERALE... 3
CHAPITRE 1 - ETUDE BIBLIOGRAPHIQUE ... 9
1 Introduction ... 9
2 La pile à combustible à membrane échangeuse de protons (PEMFC) ... 10
La technologie PEMFC ... 10
Architectures et composants ... 11
Caractérisations électrochimiques ... 16
3 Les verrous scientifiques ... 22
P odu tio , sto kage et dist i utio de l’h d og e ... 22
Le catalyseur à base de platine ... 24
La membrane ... 24
Durabilité ... 24
Conclusion ... 25
4 La catalyse ... 26
La réduction du dioxygène à la surface des nanoparticules de platine ... 26
Catal se de la du tio de l’o g e da s u e PEMFC ... 30
Taux de charge en platine et les limites du point triple ... 32
Mécanisme de dégradation des électrodes50 ... 33
5 Les nanoparticules de platine modifiées ... 39
Généralités ... 39
Synthèse de nanoparticules métalliques supportées par voie colloïdale ... 39
Fonctionnalisation des nanoparticules de platine ... 42
Greffage de polymères à la surface des nanoparticules de platine ... 48
6 La polymérisation radicalaire contrôlée ... 52
Principe de la polymérisation radicalaire contrôlée ... 53
Polymérisation radicalaire par Transfert d'Atomes en surface ... 55
7 Travaux préliminaires : g effage d’u pol e o du teu de p oto s à la su fa e de nanoparticules de platine supportées sur carbone ... 57
Synthèse de complexes catalytiques ... 58
Caractérisations électrochimiques ... 58
Tests en pile ... 59
Bilan 59 8 Conclusion ... 59
Références bibliographiques ... 62
CHAPITRE 2 - MATERIELS ET METHODES DE CARACTERISATION ... 71
1 Nomenclature des complexes catalytiques ... 71
2 Caractérisations physico-chimiques ... 72
Résonnance magnétique nucléaire : RMN ... 72
Spectroscopie infrarouge à transformée de Fourier (IRTF) ... 72
Analyse thermogravimétrique (ATG) ... 73
Analyses élémentaires ... 74
Diffraction des rayons X (DRX) ... 75
Ch o atog aphie d’e lusio st i ue SEC ... 76
Microscopie électronique à transmission (MET) ... 76
Microscopie électronique à balayage (MEB) + microanalyse EDS ... 77
3 Caractérisations électrochimiques1 ... 78
Matériels... 78
Protocole mesures électrochimiques ... 80
4 Test en pile sur banc monocellule ... 88
Préparation des Assemblages Membrane-Electrodes (AME) ... 88
Caractérisations électrochimiques in situ ... 89
Performance en pile ... 90
Références bibliographiques ... 92
CHAPITRE 3 - SYNTHESE DES COMPLEXES CATALYTIQUES NANO-COMPOSITES 94
1 Introduction ... 94S th se et a a t isatio s de l’a o eu A d’ATRP... 96
Pol isatio pa t a sfe t d’ato es ATRP ... 99
Caractérisations physico-chimiques ... 100
3 Optimisation de la synthèse du polystyrène sulfonate de sodium ... 103
Etude de l’a o eu ... 103
Etude du polymère de deuxième génération ... 108
4 Synthèses et caractérisations de polymères fluorés avec des chaînes pendantes hydrophiles ... 109
Synthèse et caractérisations du polymère GFO ... 110
Synthèse et caractérisations des composés GFS et GF via la fonctionnalisation du poly(2,3,4,5,6-pentafluorostyrène) ... 113
Bilan 119 5 Synthèses et caractérisations de nanoparticules de platine supportées sur carbone 121 Synthèses des nanoparticules de platine supportées ... 121
Caractérisations physico-chimiques ... 125
Bilan 129 6 Greffage du polymère sur les nanoparticules de platine supportées ... 130
Synthèses des complexes catalytiques par post-greffage ... 130
Caractérisations des complexes catalytiques ... 132
7 Conclusion ... 140
8 Partie expérimentale ... 143
Synth se de l’a o eu A ... 144
S th se de l’a o eu B ... 145
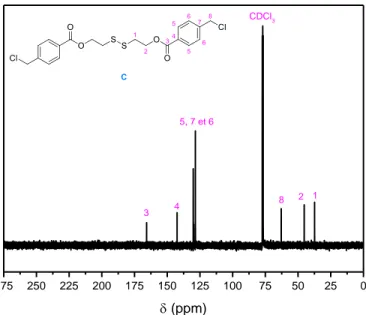
S th se de l’a o eu C ... 146
Polystyrène sulfonate de sodium... 147
Synthèse du 2,3,5,6-tetrafluoro-4-vinylphénol (TFSOH)... 148
Synthèse du 3-(2,3,5,6-tetrafluoro-4-vinylphénoxy)propane-1-sulfonate de sodium 149 ATRP of TFSSNa ... 149
Synthèse du poly(2,3,4,5,6-pentafluorostyrène) ... 150
Synthèse de GF ... 151
Synthèse de GFS ... 152
Synthèse des nanoparticules de platine supportées sur carbone ... 153
Greffage du polymère sur les nanoparticules de platine ... 155
Références bibliographiques ... 157
CHAPITRE 4 - CARACTERISATIONS ELECTROCHIMIQUES ... 161
1 Introduction ... 161
2 Caractérisations électrochimiques des complexes nano-composites en milieu support 161 Mesure de la surface active des complexes catalytiques en demi-cellule ... 162
Stabilité électrochimique de la couronne organique... 165
Influence des paramètres des complexes catalytiques sur la surface active des catalyseurs 167 Bilan 174 3 Caractérisations électrochimiques des complexes en milieu oxydant ... 174
Mesu e de l’a tivit du atal seu vis-à-vis de la a tio de du tio de l’o g e 174 I flue e des a a t isti ues des o ple es atal ti ues su l’a tivit ... 178
Mesure de la sélectivité du catalyseur vis-à-vis de la réaction de réduction de l’o g e 183 4 Conclusion ... 186
Références bibliographiques ... 188
CHAPITRE 5 -
DE LA MISE EN ŒUVRE DES ELECTRODES A LA CARACTERISATION EN
PILE A COMBUSTIBLE ... 191
1 Etudes préliminaires ... 191
2 Conditionnement des assemblages ... 192
Composition des assemblages... 192
Conditions de préparations des assemblages ... 192
Conditionnement de la pile ... 193
3 Mises e œuv e des le t odes ... 194
Complexes nano-hybrides de deuxième génération ... 203
5 Complexes nano-hybrides GFx-PMW-5b ... 214
6 Tests de durabilité en pile ... 217
Tests de durabilité autotherme ... 217
Tests de durabilité à 60 °C ... 219
7 T a spositio à l’ helle de 25 cm² ... 220
8 Conclusion ... 221
Références bibliographiques ... 222
CONCLUSION GENERALE ... 225
PERSPECTIVES ET RESULTATS PRELIMINAIRES ... 231
1 Greffage du polymère conducteur protonique sur le carbone et le platine ... 231
2 Synthèse de copolymère PSSa-PPFS ... 233
Glossaire
ADEME : Agence De l Energie et de la Maît ise de l Environnement AME : Assemblage Membrane-Electrodes
ATG : Analyse ThermoGravimétrique
ATRP : Polymérisation Par T a sfe t d Atomes
CEA : Co issa iat à l Energie Atomique et aux énergies alternatives DMAc : diméthylacétamide
DMAP : N,N-diméthylaminopyridine DMSO : diméthylsulfoxyde
DPn : Degré de Polymérisation en Nombre
DRX : Diffraction des Rayons X
EASA ou « SA » : ElectroActive Surface Area ERH: Electrode Réversible à Hydrogène ESH : Electrode Standard Hydrogène GDE : Gas Diffusion Electrode
GDL : Gas Diffusion Layer HR : Humidité Relative
Ip : Indice de Polymolécularité
IRTF : InfraRouge à Transformée de Fourier MEB : Microscope Electronique à Balayage MET : Microscope Electronique à Transmission OCV : Tension à Circuit Ouvert
PC : Polyol Classique PCL poly(-caprolactone) PEG : poly(éthylène glycol)
PEMFC ou « PEM » : pile à combustible à membrane échangeuse de protons PFS : 2,3,4,5,6-pentafluorostyrène
PMW : polyol activée microondes
PPFS : poly(2,3,4,5,6-pentafluorostyrène) PPM : Partie Par Million
PTFE : polytétrafluoroéthylène PSSa : acide polystyrène sulfonique PSSNa : polystyrène sulfonate de sodium
PVDF-HFP : Poly(vinylidene fluoride-hexafluoropropylene) RE : Range to Extender
RMN : Résonance Magnétique Nucléaire SEC : Ch o atog aphie d E lusio Stérique Tg : Transition vitreuse
THF : TetraHydroFurane WO : water in oil
Introduction générale
« Da s u o de où tout s’a l e, où le esoi de vo age , de se d pla e , est omniprésent et où les questions environnementales deviennent cruciales. Imaginez : vous marchez da s u e ville e espi a t l’ai f ais et e e te da t le ha t des oiseau … Da s u e ville où les personnes peuvent communiquer sans être interrompues par le bruit de moteurs de voiture, de s oote ou de a io … u e ville sa s pa ti ules pollua tes, sa s gaz à effet de se e… ». L’h d og e peut e d e ela el.
Aujou d hui, les p o l es e g ti ues et e i o e e tau so t au œu des préoccupations de notre société.
E effet, la di i utio pe a e te des se es d e gies fossiles, tels que le pétrole, le gaz naturel et le charbon, ainsi que les difficultés de leur approvisionnement entraînent une réelle prise de conscience.
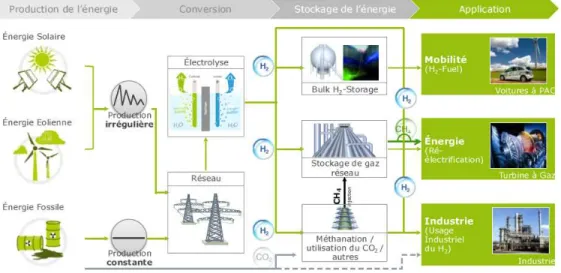
Par ailleurs, la problématique environnementale et le développement durable deviennent des enjeux très forts. Depuis quelques années, des moyens ont été mis en place pour le d eloppe e t des e gies e ou ela les, e e ploita t l e gie solai e photo oltaï ues ou l e gie olie e. Ces e gies p se te t, epe da t, u p o l e. La p odu tio d e gie est pas o sta te su le le d u e a e. L e gie est pas sto k e lo s u elle est fou ie e e s. Les te h ologies h d og es peu e t pe ett e de sto ke de l e gie, g â e à l le t ol se de l eau. La Figure 1 p se te le s h a de alo isatio de l e gie issue des s st es e ou ela les, de la o e sio de ette e gie à l appli atio .
Figure 1-S h a de alo isatio de l e gie e de tai e des énergies renouvelables et applications possibles
Parmi les différentes formes de valorisation ue t ou e l h d og e, les piles à o usti le poss de t u fo t pote tiel d appli atio s, da s de o eu do ai es. E pa ti ulie , la pile à combustible à membrane échangeuse de protons (PEMFC) apparaît comme la technologie la plus p o etteuse o e o e tisseu d e gie pou des fai les à o e es puissa e W à quelques kW). La PEMFC est un système électrochimique qui convertit en continu une énergie chimique en énergie éle t i ue. Cette pile utilise ai si l h d og e et l o g e de l ai afi de p odui e de l le t i it . Ces s st es p oduise t gale e t de la haleu , e tuelle e t valorisable, mais surtout, ne libèrent comme sous-p oduit des a tio s, ue de l eau. Dans le contexte environnemental et énergétique actuel, les PEMFC présentent donc des intérêts non gligea les o e o e de p odu tio p op e d le t i it , e pa ti ulie pou les transports. De plus, leurs très faibles nuisances sonores facilitent leur utilisation en milieu urbain, par exemple.
Si les piles PEMFC commencent à émerger sur certains marchés spécifiques (sites isolés, flottes de véhicules), leur généralisation sur ces marchés et leur déploiement sur de plus larges marchés ne pourra cependant se faire que si les verrous technologiques et scientifiques tels que le coût, le rendement et la durabilité sont levés.
Le œu de pile, o stitu de l le t ol te solide et des le t odes, fait l o jet de nombreuses études. Les résultats présentés dans le cadre de ces travaux de thèse, financés par
Le fo tio e e t du œu de pile epose esse tielle e t su des a tio s électrochimiques ayant lieu aux électrodes. A l a ode, l o datio de l h d og e est pas u e a tio li ita te o t ai e e t à la a tio de du tio de l o g e se d oula t à la athode. Ces a tio s essite t do la p se e d u atal seu à ase de plati e, tal a e, noble, stratégique et donc très cher. Les réactions électrochimiques ne peuvent avoir lieu que si, et seule e t si, au e poi t du atal seu , oe iste t u o usti le h d og e à l a ode ou un comburant (oxygène à la cathode), une espèce conductrice protonique et une espèce conductrice électronique. Ce point à la surface du platine est appelé point triple. Le contrôle des zones de point triple est essentiel pour obtenir un bon fonctionnement en pile.
Dans les systèmes PEMFC conventionnels, les couches actives des électrodes sont préparées à partir de nanoparticules de platine supportées sur carbone et d'une solution d'électrolyte liquide telle que du Nafion® (conducteur protonique perfluoré, développé par Dupo t de Ne ou s . Aujou d hui, es o epts essite t l utilisatio de ua tit s i po ta tes de platine afin de former le plus de points triples possible. Ces électrodes présentent des limites. La Figure 2 présente un aspect limitant de ces électrodes classiques. En réalité, malgré ce taux de platine élevé, certaines particules de platine (en rose) ne sont pas en contact avec le Nafion® (en vert). Ces particules ne forment donc pas de point triple. Le catalyseur est donc inactif et une quantité non négligeable de catal seu est ai si pas ou peu utilis e.1
Figure 2-Electrodes classiques
Pa ailleu s, o pte te u du oût i po ta t du plati e ≈ €.kg-1) et des ressources
mondial), son recyclage est primordial. Les électrodes sont ainsi généralement pyrolysées en fin de vie. Or, pendant ce processus, la présence du matériau perfluoré dans les électrodes classiques entraîne la libératio d a ide fluo h d i ue, p oduit faste pou l e i o e e t et pou la santé.
C est pou uoi il est i po ta t de d eloppe de ou eau s st es atal ti ues da s le ut d a lio e la du a ilit des s st es et d e dui e les oûts tout e fa ilita t leur recyclage.
Ce p ojet de e he he a po t su la t a spositio du poi t t iple à l helle ol ulai e
via le développement de catalyseurs nano-hybrides présentant des propriétés de conduction
protonique et électronique conduisant au point triple à l helle ol ulai e.
Ces travaux se sont articulés en trois grandes parties, une partie synthèse, une partie caractérisations électrochimiques et une partie tests en pile.
Ce manuscrit se décompose en cinq chapitres. Un descriptif de la pile à combustible PEMFC et de ses e ous s ie tifi ues, ai si u u tat de l a t su les atal seu s utilis s pou les piles à combustible et sur la fonctionnalisation des nanoparticules sont présentés dans le chapitre 1. Le chapitre 2 détaille les matériels et méthodes de caractérisations utilisés. Le chapitre 3 présente la préparation des différents complexes catalytiques, de la synthèse du polymère à la fonctionnalisation des nanoparticules de platine. Les caractérisations électrochimiques de ces complexes, afin de d te i e leu s p op i t s le t o hi i ues, o stitue t le œu du hapit e 4. Enfin, le chapitre 5 présente les études réalisées en pile, de la formulation des électrodes jus u au fo tio e e t e o o-cellule.
Chapitre 1 - Etude bibliographique
1
Introduction
La pile à combustible à hydrogène est d fi ie o e u s st e da s le uel l e gie chimique de l h d og e ol ulai e est convertie, directement et simultanément, en électricité, eau et chaleur (Figure 3 . L a a tage ue p se te u e pile, is-à- is d u e atte ie, est sa capacité de fonctionner en continu ta t u elle est alimentée en réactif. La force électromotrice (f.e.m) de la pile correspond à la différence de potentiel des électrodes.
Figure 3-Schéma de principe de conversion directe en électricité
Aujou d hui, les e he hes se o e t e t su les piles du t pe PEMFC Pile à o usti le à Membrane Echangeuse de Protons). Cette technologie à électrolyte solide semble la plus apte à répondre aux besoins actuels en termes de coût, de performance et de compacité dans les diff e ts do ai es d appli atio s des piles. Les piles à o usti le à le t ol te pol e de type PEMFC sont particulièrement prometteuses compte tenu de leur rendement, de leur modularité, de leur température de fonctionnement (bonne durabilité des matériaux), de leur
2
La pile à combustible à membrane échangeuse de protons (PEMFC)
La technologie PEMFC
La pile à combustible PEMFC2 est actuellement le type de piles le plus étudié à travers le
monde car cette technologie semble être prometteuse pour des applications dans les domaines des transports, du stationnaire et du portable. Elle connait un réel engouement du fait de ses nombreux avantages :
Insensibilité au CO2 ;
Démarrage rapide permettant une grande souplesse de fonctionnement ; Temps de réponse très rapide ;
Large spectre de puissance accessible ; Faible température de fonctionnement ; Compacité et une structure tout solide.
Le principe de fonctionnement de la pile à combustible est le suivant : à l a ode, le dihydrogène gazeux H2 est o d au o ta t d u atal seu e li a t des p oto s et des
le t o s. Les p oto s ig e t de l a ode à la athode à t a e s l le t ol te et les le t o s génèrent un courant électrique par leur circulation dans un circuit extérieur. Enfin, à la cathode, les p oto s et les le t o s so t o so s pa la du tio de l o g e e fo a t de l eau (Figure 4).
Architectures et composants
U e pile à o usti le de t pe PEMFC se o pose d u e se le de ellules l e tai es montées en série, dont le nombre est fonction de la puissance à fournir par le module. Chaque cellule élémentaire est constituée de deux plaques bipolaires et deux électrodes séparées par une membrane conductrice protonique. Les électrodes et la membrane forment l asse lage membrane-électrodes (AME) appelé aussi « œu de pile ». Cet AME est obtenu soit par simple empilement, soit par pressage à chaud de la membrane échangeuse de protons entre les deux électrodes (anode et cathode) (Figure 5).
Figure 5-S h a d asse lage d u e ellule l e tai e de PEMFC
L e se le de es o posa ts so t au œu d tudes app ofo dies a ha u des éléments joue un rôle important au sein de la pile. Dans cette partie, les composants de la PEMFC sont décrits brièvement.
2.2.1 Les plaques bipolaires
Au sein de la pile, les plaques bipolaires (Figure 6) assurent différentes fonctions. Tout d a o d, elles pe ette t la dist i utio ho og e des gaz a tifs jus u au le t odes et la collecte des électrons. Par ailleurs, elles g e t l a uatio de l eau et la dissipatio de la chaleur hors du système. Les matériaux constituants les plaques bipolaires doivent donc être conducteurs d le t o s et hi i ue e t i e tes afi de siste à l ag essi it du ilieu de la ellule. Le graphite était le matériau le plus couramment utilisé à l o igi e du d eloppe e t des PEMFC
ais l usi age o ple e de la su fa e fo atio des a au e t aî e u oût p ohi itif pou la o e ialisatio de es l e ts. D aut es oies plus économiques comme les plaques bipolaires métalliques, ou encore les plaques bipolaires en matériaux composites ont été développées. Les plaques métalliques sont plutôt destinées aux applications mobiles tandis que les plaques composites sont plus adaptées aux applications stationnaires.
Figure 6-Plaque bipolaire
2.2.2 L le t ol te
Le ôle de l le t ol te est d assu e le t a spo t des p oto s de l a ode e s la athode. Il doit aussi être imperméable aux électrons pour éviter les courts-circuits et aux gaz réactifs pour éviter la recombinaison directe H2/O2. Pou la PEMFC, l le t ol te solide est u e e a e
polymère échangeuse de protons. La membrane est un film mince de polymère devant présenter les propriétés suivantes :
Une bonne conduction protonique ;
De bonnes stabilités chimique et électrochimique dans les conditions de fo tio e e t e pile sta le à l o datio , à l h d ol se e ilieu a ide et au radicaux libres) ;
De bonnes propriétés mécaniques dans une large gamme de température (- 40 °C < T < 120 °C);
Une imperméabilité aux gaz réactifs ; Isolation électrique.
2.2.2.1 Les membranes conductrices protoniques
Pour assurer la migration des protons, les polymères doivent présenter des groupements o du teu s p oto i ues, est-à-di e u ils doi e t poss de des p oto s suffisa e t dissociés pou u ils puisse t i ule . Les e a es conductrices possèdent des fonctions de types soit carboxylique (-CO2H), soit sulfonylimide (-SO2-NH-SO2-), soit sulfonique (-SO3H) ou encore
phosphonique (-PO3H2). Si, à température élevée (T > 120 °C), les groupements phosphoniques
sont les seuls à permettre une conduction protonique à faible humidification,3, 4 à basse
température, ils ne conduisent pas suffisamment les protons pour permettre un démarrage à froid de la pile. En revanche, les groupements sulfoniques5 permettent d o te i u e disso iatio
complète des paires d io s o t ai e e t aux groupements carboxyliques en raison de leur faible acidité) et leur introduction sur un polymère est facilement réalisable (contrairement au sulfonylimide6). Ainsi, les polymères sulfoniques sont à l heu e a tuelle les at iau les plus
étudiés.
Aujou d hui, la e a e de t pe Nafio ® (Dupont, Figure 7), copolymère perfluoré contenant des groupements acide sulfonique, demeure la référence dans le domaine des PEMFC en termes de performances électrochimiques et de propriétés physico-chimiques. Dans sa structure, le polymère associe une hydrophobicité extrêmement forte en raison de son squelette perfluoré et une composante hydrophile également très forte due à la présence, en bout de chaîne pendante, de groupements -SO3H échangeurs de protons. Cependant, ces polymères
présentent deux inconvénients majeurs : une faible performance à haute température (T > 80 °C) et un coût élevé.
Figure 7-a) Structure de la membrane Nafion® b) Membrane Nafion® en roll
2.2.2.2 Les membranes alternatives
Face aux limitations rencontrées avec le Nafion®, de nombreux travaux sont actuellement menés sur le développement de polymères conducteurs protoniques alternatifs dans le but d a lio e la te ue en température, les performances et de proposer des matériaux moins coûteux. Les polymères aromatiques non fluorés ont été largement étudiés. Ces composés p se te t d e elle tes p op i t s a i ues te p atu e de transition vitreuse (Tg) élevée) et une bonne tenue mécanique. Pour conférer les propriétés de conduction, ces matériaux sont sulfonés sur les noyaux aromatiques. Plusieurs méthodes de sulfonation sont décrites dans la littérature7 (post sulfonation, monomère pré sulfoné, etc.). Ces composés englobent
principalement les polystyrènes (PS), les polybenzylsiloxanes, les polyphénylènes (PPBP), les poly(phénylquinoxalines), les poly(étheréthercétones) (PEEK), les poly(éthersulfones) (PES), les poly(sulfure de phénylène) (PPS), les poly(oxyde de phénylène) (PPO), les poly(benzylimidazoles) (PBI), les polyimides (PI) (Figure 8)8.
Figure 8-Exemples de structures de polymères thermostables sulfonés8 : (1) PS, (2) poly(acide sulfonique de
benzylsiloxane), (3) PPBP, (4) poly((phénylquinoxaline), (5) PEEK, (6) PES sulfoné, (7) PPS sulfoné, (8) PPO sulfoné, (9) PBI sulfoné
Des membranes hybrides nanocomposites performantes alternatives au Nafion® ont été
développées au CEA.9, 10L o igi alit de e t a ail a t de disso ie les p op i t s a i ues,
chimiques et thermiques du polymère conducteur. La fonctionnalisation a été réalisée par le
SO3H n O Si O O CH2 SO3H n O O n SO3H N N O n (1) (2) (3) (4) O O O n SO3H O O S O SO3H O n (5) (6) SO3H S n HO3S O n N N H N H N R SO3H n (7) (8) (9)
8, (1)) sur des particules de silice. La membrane est obtenue par dispersion des charges de silice fonctionnalisées par du polystyrène sulfonate de sodium dans une matrice « low cost » de type PVDF-HFP.
2.2.3 Les électrodes
L le t ode est l e d oit où se p oduise t les a tio s le t o hi i ues, d o datio de l h d og e à l a ode et de du tio de l o g e à la athode. Au le t odes, u e atal se efficace est obtenue si au même endroit sont présents le conducteur protonique, le conducteur le t o i ue et le gaz a tif pou fo e e ue l o appelle u poi t de t iple o tact ou plus communément le point triple. La description et les explications concernant le point triple sont p se t es da s u e pa tie ult ieu e. C est au i eau de la athode, siège de la réaction de du tio de l o g e, que se situent les phénomènes limitant le plus les performances de la pile. Ai si, l le t ode doit p se te plusieu s a a t isti ues sp ifi ues :
Une bonne activité vis-à-vis de la réaction électrochimique considérée ; Une bonne conductivité électrique ;
Une bonne diffusion des gaz ;
U e su fa e de o ta t i po ta te a e l le t ol te solide ; Des stabilités chimiques et mécaniques importantes.
2.2.3.1 Le catalyseur
Le ôle du atal seu est d a aisse la a i e e g ti ue pe etta t la t a sfo atio des réactifs en produits de chacune des demi- a tio s d o do-réduction.11 Dans les conditions
de température de fonctionnement de la PEMFC (- 20 °C à 100 °C), l utilisatio du catalyseur est i dispe sa le afi d a l e sig ifi ati e e t les réactions électrochimiques, en particulier à la cathode. Le rôle du catalyseur sera détaillé ultérieurement dans le paragraphe 4.
2.2.3.2 La couche de diffusion
Placée entre les électrodes et les plaques bipolaires, la couche de diffusion12 ou encore
GDL Gas Diffusio La e est o stitu e d u e at i e po euse o du t i e le t o i ue et the i ue tissu ou papie de a o e pe etta t d assu e l app o isio e e t e gaz des sites du catalyseur. Cette couche de diffusion est rendue hydrophobe (généralement par dépôt
de pol t t afluo o th l e pou assu e l a uatio de l eau fo e à la athode afi d ite l e go ge e t des sites a tifs. Elle est la passe elle le t i ue e t e les sites a tifs et les plaques bipolaires. Enfin, elle assure le maintien mécanique (répartitions des contraintes) de la membrane électrolyte entre les plaques bipolaires.
Caractérisations électrochimiques
2.3.1 Approche thermodynamique
L app o he the od a i ue de la pile à o ustible permet de déterminer la tension a i ale th o i ue d li e pa u tel s st e. Cette aleu a i ale de la te sio s o tie t pa le al ul de la a iatio d e gie li e de Gi s lo s de la a tio glo ale de la pile da s les conditions standards.
La réaction globale ise e jeu da s la pile à o usti le PEMFC est l o datio de l h d og e pa l o g e : A l a ode H2 2H+ + 2e- Ea0= 0,000 V vs ESH ( 1 ) A la cathode O2 + 4H+ + 4e- 2H2O Ec0= 1,229 V vs ESH ( 2 ) H2 + ½ O2 2H2O Eeq0,H2/O2= 0 c E - 0 a E = 1,229 V vs ESH
A l uili e, da s les o ditio s sta da ds de pression et de temp atu e, l uatio de Nernst ( 3 ) pe et d esti e u e aleu de la diff e e de pote tiel i itiale th o i ue Eth).13
1/2 / 0 / 2 2 2 2 2 2 2 ln 2 ln 2 HO O H O H O H P F RT P P F RT E E avec E0 : Potentiel standard, R : Constante des gaz parfaits, F : Constante de Faraday, P : Pression, T : Température.
Pour une pile à combustible fonctionnant avec un système de gaz H2/air à 25 °C la tension
a i ale ui pou a t e o te ue est de l o d e de , V. Cepe da t, le pote tiel des de i-a tio s le t o hi i ues d ites pi-a les ui-atio s et est elui ui o espo d à l ti-at d uili e. Ai si la te sio de la pile o te ue pa le al ul the od a i ue est ala le ue lo s ue le s st e est pa ou u pa au u ou a t. O appelle cette tension maximale
open-circuit voltage, tension en circuit ouvert (OCV). En effet, lors de la fermeture du circuit, des
limitations cinétiques entrent en jeu et provoquent des pertes en tension.
2.3.2 Les mécanismes de pertes de tension
Différents mécanismes sont responsables des pertes de tension observées lors du fo tio e e t d u e pile. Ces diff e ts ph o es d o d es cinétiques sont développés dans ette pa tie : les su te sio s d a ti atio , la hute oh i ue et la li ite de diffusio des a tifs.
2.3.2.1 Surtensions d a ti ation
Les su te sio s d a ti atio so t ep se tati es de la i ti ue de a tio . Pou démarrer une réaction chimique et plus particulièrement une réaction électrochimique, il est essai e de f a hi u e a i e d a ti atio ui est plus ou oi s le e. Da s le ad e de la pile à combustible PEMFC, cette barrière est relativement importante, notamment à la cathode.
L uatio de Butle -Volmer ( 4 ), représente la vitesse de réaction électrochimique à la cathode (avec 0 < c < 1). act c c act c c RT nF RT nF j j 0 exp (1 ) exp
avec j0 : De sit de ou a t d ha ge, c : Coefficient de transfert de charge, n : Nom e d le t o s i pli u s
dans la réaction, R : Constante des gaz parfaits, T : Température, F : Constante de Faraday, c : Surtension
d a ti atio .
Les réactions inverses (réversibles) peuvent être négligées lorsque les surtensions sont suffisamment élevées. E e ui o e e la athode d u e PEMFC, ela e ie t à di e ue la a tio de d gage e t de l o g e peut t e glig e et u e uatio de Bulte -Volmer simplifiée ( 5 ) s it : act c c c c RT F n j j 0, exp (1 )
Dans le cas de la pile à hydrogène, la réaction limitante étant la réaction de réduction du dioxygène, la contribution anodique peut être, en première approximation, négligée. La
( 5 )
su te sio d a ti atio athodi ue et do pa e te sio la su te sio de la PEMFC est d fi ie pa l uatio ( 6 ). O et ou e do l uatio de Tafel ( 7 ).
act act c j nF RT j nF RT j j nF RT 2 ln 2 ln( 0) 2 ln( ) 0
j b a act .ln avec j0 : De sit de ou a t d ha ge, c = 0,5, n : No e d le t o s i pli u s da s l tape li ita te de la
réaction, R : Constante des gaz parfaits, T : Température, F : Constante de Faraday, act c
: Su te sio d a ti atio et act : Su te sio d a ti atio au sei de la pile. .
Cette su te sio d a ti atio est d pe da te du catalyseur (Figure 9). Le rôle du catalyseur est de di i ue la a i e d a ti atio ais s ajoute u e se o de fo tio à la atal se, la sélectivité.
Figure 9-Diag a e d e gie d u e a tio le t o hi i ue
Plus la a i e d a ti atio se a fai le, plus la a tio se a apide et les su te sio s se o t do a aiss es. Plus le atal seu est s le tif, oi s il a de possi ilit de s p odui e des réactions parasites. Les réactions parasites utilisent une partie de la surface du catalyseur, ce qui fait chuter le rendement vis-à-vis de la réaction voulue.
( 6 ) ( 7 ) ∆ ≠ ∆ ≠ ∆� ∆ = ∆ + � �
2.3.2.2 Surtension ohmique-chute ohmique
Lors du fonctionnement de la pile, les résistances de transferts électroniques et ioniques enge d e t des pe tes de te sio . Les pe tes oh i ues espo sa les d u d gage e t de chaleur par effet joule entraînent une chute importante du rendement. La chute ohmique a plusieurs origines :
Electrodes : résistances électriques et protoniques ; Interfaces : résistances électriques et protoniques ; Membranes : résistances protoniques.
Les sista es des le t odes et de la e a e o isse t à la loi d Oh ( 8 ). La perte oh i ue totale peut s e p i e pa l uatio li ai e suivante :
i R
ohm
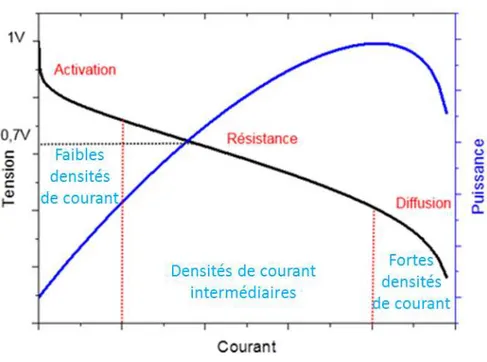
En pratique, la résistance ohmique totale provient majoritairement de la résistance protonique de la membrane. La chute ohmique intervient dans la région intermédiaire linéaire sur la courbe de polarisation courant/tension (Figure 9).
2.3.2.3 Limitation de diffusion des réactifs
Une réaction électrochimique se déroule en trois étapes : l adso ptio des a tifs, le transfert électronique et la désorption des produits. Cependant, il est possi le ue l tape limitante soit le transport des réactifs vers les sites catalytiques, une surtension de concentration apparaît alors.
Il e iste u g adie t de o e t atio d esp es au oisi age de l le t ode, lo s ue la itesse est li it e pa l appo t des a tifs. Les lois de Fi k et de Tafel permettent de déterminer la surtension de diffusion :
= |ln −
, − ln − , |
avec jl,c : Densité de courant limite à la cathode, jl,a : De sit de ou a t li ite à l a ode, j : Densité de courant,
n : No e d le t o s i pli u s da s la a tio , ‘ : Constante des gaz parfaits, T : Température, F : Constante de Faraday, : Su te sio d a ti atio .
( 8 )
Cette expression de surtension de diffusion ( 9 ) peut être simplifiée et mise sous la forme suivante :
= |ln ( − )|
Ainsi aux fortes densités de courant, la limitation de transfert de matière peut être due : A la athode, à u o age de l le t ode pa la g a de ua tit d eau p oduite pa
la a tio la diffusio de l o gène est alors gênée par le phénomène d i o datio des sites ou à u dess he e t de la e a e ui peut diminuer la conduction protonique ;
A l a ode, à u ass he e t du o du teu io i ue ui peut e p he le t a sfe t des protons.
La densité limite de diffusion est donc caractéristique de la couche active cathodique.
2.3.3 Point de fonctionnement
La ou e de pola isatio , a a t isti ue d u e pile à o usti le PEMFC, sulte des diff e ts a is es de pe te e te sio . Il est possi le d o te i la ourbe de polarisation complète en sommant les différentes surtensions.14
= − ln
, − × − ln ( )
avec Eeq: Pote tiel à l uili e, jl : Densité de courant limite, j0,C: De sit de ou a t d ha ge à la athode,
j : Densité de courant, n : No e d le t o s i pli ués dans la réaction, R : Constante des gaz parfaits, T : Température, F : Constante de Faraday
Il est possible de séparer la courbe de polarisation en trois parties (Figure 10). La première partie, à faible courant, o espo d à u do ai e où les su te sio s d a ti atio so t les phénomènes prédominants. Dans la partie linéaire de la courbe, la chute ohmique est le phénomène prédominant, correspondant aux limitations de la membrane. Enfin, dans la troisième partie, le ph o e ajeu est li à l appo t des a tifs.
( 10 )
Figure 10-Courbe de polarisation : tension réelle et point de fonctionnement
La puissa e fou ie aug e te a e la de sit de ou a t de a d e jus u à u a i u Pmax. Au-delà de ette aleu , l appa itio des p o l es de t a sport de matière se traduit par
u e pe te de puissa e. La zo e de t a ail d u e pile à o usti le PEMFC se situe do da s la partie pseudo linéaire de polarisation ohmique. Contrairement au moteur thermique, le point de fo tio e e t o i al est pas hoisi au poi t de puissa e a i u ais au / de Pmax,
soit à u e te sio de ellule d e i o 0,7 V, qui correspond au meilleur rendement (55 %). Cette caractéristique permet donc à la pile, en cas de besoin, de fournir 25 % de puissance supplémentaire, ce qui est intéressant en particulier pour les applications automobiles. Ce point de fonctionnement électrique peut varier en fonction des paramètres physicochimiques de fonctionnement de la pile à co usti le te p atu e, p essio , gaz, d it, stœ hio t ie, pureté des gaz).
3
Les verrous scientifiques
La pile à o usti le de t pe PEMFC o te ue pa l asse lage de plusieu s o posa ts aux caractéristiques spécifiques, présente des intérêts comme moye de p odu tio d le t i it . Les piles PEMFC ont déjà franchi la phase de démonstration avec différents prototypes fonctionnant à travers le monde2, 15 (Figure 11). Leur commercialisation commence par des
marchés spécifiques (range extender (RE), sites autonomes) et la levée de verrous technologiques et scientifiques permettra à cette technologie de conforter sa position sur les différents marchés. Pour espérer une commercialisation massive, le coût, le rendement et la compacité des PEMFC doivent encore être nettement améliorés, ainsi que des moyens fiables de production, stockage et distribution de l h d og e.
Figure 11-Prototypes fonctionnant avec la technologie PEMFC
Production, stockage et
dist i utio de l h d og e
Le développement de la pile à combustible pour les transports ne pourra se faire sans une filière hydrogène. En effet, le principal verrou technologique concerne le développement de systèmes de production, de stockage et de distribution fiable. La production renouvelable d h d og e est aujou d hui u des d fis ajeu s asso iée à la atio d u e fili e e g ti ue
Bateau 100 passagers Hambourg 2008
Green GT 2012 - Voiture de course 24 h du Mans en 2013
Honda 2005 Phantom Eye (Drone)
Boeing 2012
Toyota FCV Concept 2014 Prototype du véhicule commercialisé depuis 2015
reposant sur cette molécule, gaz très léger, fuyant et explosif. Théoriquement, plusieurs procédés sont envisageables.
La p odu tio d h d og e est possi le pa diff e tes thodes de s th se plus ou moins « verte », résumé par Holladay et al.16 en 2009. Trois grands axes sont à considérer pour la
production d h d og e :
Traitement de sources pétrolières (hydrocarbure) : reformage des hydrocarbures, efo age de l a o ia ue, d sulfu isatio , et . ;
Production à partir de la biomasse : photo-fermentation, fermentation dans le noir, reformage de biomasse et de biogaz, etc. ;
L le t ol se de l eau e ouplage a e les e gies e ou ela les.
Le sto kage de l h d og e est le se o d e ou s ie tifi ue o e a t l h d og e. T ois grandes méthodes de stockage sont actuellement développées et peuvent être distinguées :
Le stockage massif dans des cavités naturelles ;
Le sto kage sous fo e de se oi , est-à-di e o p essio de l h d og e au sei d u e outeille. Cette méthode présente un inconvénient au niveau du coût en matériaux et pour la mise sous pression ;
Le sto kage sous fo e d h d u es epose su la apa it de e tai s at iau à fo e de faço e si le des h d u es au sei d u e at i e solide. L i o ie t de ette thode est la apa it de sto kage li it e % en masse d h d og e sto k pa appo t au poids total du at iau .
E e ui o e e la dist i utio de l h d og e des app o hes de od les de d ploie e t e iste t. Tout d a o d le modèle Allemand et Californien qui se basent sur le fi a e e t d i f ast u tu e de d ploie e t afi de fa o ise la o e ialisatio de hi ule particulier. Le modèle français est lui basé sur des clusters de flottes professionnelles gravitant autou d u e statio . De i e es od les se pose t des uestio s te h i ues : quelles sont les pressions en phase avec les utilisateurs et les modèles économiques ? Où localiser la production d h d og e ?
Le catalyseur à base de platine
Le platine est le matériau incontournable pour activer les réactions électrochimiques au sein des piles à combustible de type PEMFC. Le coût du platine pèse lourdement sur la compétitivité des piles à combustible actuelles. En effet, le prix du platine a été multiplié par trois e l espa e de a s. A e p o l e s ajoute t eu de l e t a tio et de la a et du tal au sein de la croûte terrestre.
De nombreux matériaux catalytiques sont activement étudiés pour surmonter cet obstacle majeur. Les recherches fondamentales et appliquées sont intenses. Ces deux dernières années, les prix de fabrication des AME ont été réduits de 35 %.17 De plus, de nombreux travaux de
e he hes so t e s su le e lage des œu s de pile et notamment sur le recyclage des métaux.
La membrane
Peu de at iau ussisse t aujou d hui à i alise e te es de performances (résistance a i ue et the i ue, o du ti it photo i ue, ise e fo e, apa it d h d atatio , et . avec les matériaux perfluorés tels que la référence Nafion® produit par Dupont de Nemours.
La mise au point de matériaux alternatifs présente des intérêts des points de vue scientifiques et économiques. Du point de vue scientifique, le fonctionnement à plus haute température (120 °C) améliorerait les phénomènes de transfert thermique et le rendement énergétique. Du point de vue économique, le Nafion® coûte a tuelle e t € le ², e ui revie t a tuelle e t à u oût de €.kW-1. Ce caractère prohibitif est un des freins à la création
d u e fili e pile à o usti le auto o ile ota e t lo s ue l o ajoute à ela le p i d u tal atal ti ue tel ue le plati e. Cepe da t, da s l h poth se où le a h se d eloppe ait, les coûts de production de la membrane ne peuvent que baisser, tandis que la part du platine
gie pa les se es o diales et les apa it s d e t a tio e peut u aug e te .
Durabilité
Le d eloppe e t des piles PEMFC est li it pa l i suffisa e de leu du e de ie plusieu s illie s d heures de fonctionnement sont exigées) et de leur fiabilité. Les causes
fondamentales de défaillance sont généralement attribuées au point réputé le plus faible du dispositif, à sa oi le œu de pile. De o eu fa teu s peu e t alt e les p op i t s intri s ues de l AME. Le ieillisse e t p atu des asse lages est u ph o e o ple e qui concerne à la fois les domaines de la science des matériaux (vieillissement des électrodes, d g adatio s hi i ues et/ou ph si ues de l le t ol te et de l le t ochimie (vieillissement des le t odes, aisse des pe fo a es . E out e, la atu e de es œu s de pile est essai e e t multi-matériaux et multi-échelles, ce qui ajoute à la diversité scientifique une diversité topologi ue u il est i dispe sa le de p e d e e o pte si l o souhaite opti ise la du e de vie des systèmes : l e do age e t se p oduit-il dans la membrane, aux interfaces entre l le t ol te et les ou hes a ti es, ou da s les le t odes ?
Conclusion
Malgré ces nombreux points en suspens, des véhicules équipés de piles à hydrogène sont a tuelle e t e i ulatio ais il e s agit ue de uel ues e tai es de hi ules desti es à fou i u etou d e p ie e au o st u teu s auto o iles. La date de o e ialisatio estimée varie selon les acteurs. General Motors, Toyota, Honda, Daimler et Hyundai avaient prévu une première commercialisation en 2015, mais seuls Toyota et Hyundai ont mis un modèle sur le marché en 2015 (Figure 11). Toutefois cela ne devrait représenter que quelques milliers de hi ules. Au u e p odu tio e s ie est p ue a a t pou les hi ules pa ti ulie s. Mais le marché des flottes a e l optio ‘E de ait pe ett e de fa ilit l e ge e des piles dans le domaine des transports.
4
La catalyse
La réduction du dioxygène à la surface des nanoparticules de platine
La du tio de l o g e a t la ge e t tudi e su diff e ts at iau d le t odes, en milieux acides et basiques, depuis les années soixante, pour des applications telles que l le t ol se hlo e-soude,18 les piles métal-air19, 20 et les piles à combustible.21
4.1.1 Structure électronique de l o g e
La ol ule de dio g e est elati e e t sta le. A l tat fo da e tal, les seize le t o s de l o g e so t dist i u s da s les o itales ol ulai es suivantes : (g1s)2 (u*1s)2 (g2s)2 (u*2s)2 (g2pz)2 (u2px,y)4 (g*2px,y)2 (Figure 12).
Figure 12-Diagramme orbitalaire pour la molécule de dioxygène.
La distribution orbitalaire de la molécule fait apparaître six orbitales de valence avec deux électrons célibataires dans les orbitales antiliantes. Ces deux électrons étant des spins non appa i s, la ol ule est pa a ag ti ue et da s u tat t iplet. L tat t iplet de la ol ule est respo sa le de la fai le a ti it de l o g e ol ulai e su la ajo it des su st ats ui eu
s*2p zantiliante *2p x *2py *antiliante 2pA 2pB 2px 2py liante s2pzliante s*2santiliante 2sA 2sB s2sliante O O2 O Energie
a tilia tes pou fo e espe ti e e t l io supe o de O2-, l io pe o de O22- et l esp e
(O2-). Les liaisons oxygène-oxygène se trouvent alors affaiblies dans ces différentes espèces : 1,21
Å, , Å et , Å espe ti e e t da s l o g e ol ulai e, l io supe o de et l io pe o de. Par ailleurs, la liaison O-O est une liaison forte (∆�� = - 498,7 kJ.mol-1), donc difficile à rompre
e ui e pli ue les diffi ult s ua t à la du tio de l o g e da s ette o figu atio .
4.1.2 Aspect thermodynamique
E ilieu a ide, la a tio de du tio de l o g e peut p odui e diff e tes espèces que so t l eau ( 12 ) et le pe o de d h d og e ( 13 ), selo le o e d le t o s ha g s.
Figure 13-Demi-équations de la réduction du dioxygène en milieu acide
Le pe o de d h d og e fo peut, à so tou , t e duit e eau et il est alo s u u intermédiaire réactionnel de la réduction à 4 électrons (Figure 14), ou être relâché dans le milieu extérieur et il devient alors un produit de réaction.
Figure 14-Demi-équation de la réduction de peroxydes d h d og e e ilieu a ide
Les énergies libres de formation de chacune de ces espèces permettent de calculer les pote tiels sta da ds de la du tio de l o g e e ha u de es deu p oduits Figure 15).
Figure 15-Potentiels standards des uili es de l o g e a e l eau et le pe o de d h d og e22, donnés par
rapport à ERH
La du tio de l o g e e eau est u e a tio irréversible quelle que soit la voie de a tio , e ui e t aî e de fo tes su te sio s d a ti atio . La du tio de l o g e e pe o de d h d og e, dite du tio à deu le t o s, est g ale e t fa o is e. Le passage du pe o de d h d og e à l eau fait i te e i des i te diai es a tio els i sta les essita t
( 12 ) ( 13 )
u e aug e tatio de l e gie li e due à la rupture de la liaison O-O. De même, la réduction dite di e te de l o g e e eau essite la uptu e de ette liaiso i pli ua t le plus sou e t u e adsorption dissociative de la molécule. Il est donc nécessaire de réaliser cette réduction sur un catalyseur limitant les surtensions de la réaction et favorisant une adsorption dissociative de l o g e pou pe ett e u e du tio di e te à quatre électrons.
4.1.3 Aspect cinétique
Cette a tio , ui i pli ue l ha ge de uat e le t o s, est elati e e t o plexe et peut avoir lieu à la surface du catalyseur suivant différents mécanismes. Le schéma général de réduction du dioxygène, proposé par Wroblowa et al., est décrit par le mécanisme illustré en Figure 16.22
avec O2 : Dioxygène dissous en solution, (O2)sur: Dio g e au oisi age de l le t ode,
(O2)ads : Dioxygène adsorbé à la surface.
Figure 16-Chemin réactionnel de la réaction de réduction de l o g e22
La plupart des études cinétique utilise t epe da t pas le s h a o plet23-26 et
ig o e t l tape d adso ptio de l o g e. La a tio se d oule alo s su l esp e O2)sur. Cette
approximation permet de calculer les constantes de vitesse (ki) par des mesures réalisées sur une
électrode tournante à disque et anneau.
Les méthodes de mesure sur une électrode tournante à disque et anneau permettent en effet d o te i la p opo tio de pe o de d h d og e p oduite pa appo t à la ua tit d eau fo e, ais gale e t, e faisa t a ie la itesse de otatio de l le t ode, les o sta tes de vitesse de chacune des étapes.24
Cependant, pour le calcul des constantes de vitesse des étapes de la réaction de réduction de l o g e, l h poth se si plifi at i e o sista t à ig o e la phase adso e est i dispe sa le. Or la cinétique de cette étape est t s d pe da te de la i ti ue d adso ptio de l o g e su le atal seu . C est pou uoi la du tio de l o g e est gale e t a a t is e pa es paramètres électrochimiques qui peuvent être obtenus sur une électrode à disque tournant par
le tracé des d oites de Tafel ou l appli atio de l uatio de
Koutecky-Levich.
Les g a deu s o te ues pa l utilisatio de la thode de Koute k -Levich25, 27-29 sont les
de sit s de ou a t li es à la diffusio de l esp e et à leu adso ptio , les de sit s de ou a t i ti ue et de ou a t d ha ge de la a tio et le o e total d le t o s ha g s pe da t la a tio . Les pe tes de Tafel, ua t à elles, e seig e t su le a is e d adso ptio et la nature des étapes limitantes.30 Ces méthodes permettent de qualifier la cinétique de réaction sur
un catalyseur et de déterminer son activité électrocatalytique.
Selo les he i s a tio els de la du tio de l o g e, deu g oupes de atal seu s se distinguent : les atal seu s su les uels la du tio de l o g e est alis e via uniquement l i te diai e pe o de d h d og e o e l o 31, 32 et ceux comme le platine capables de
atal se la du tio di e te de l o g e e eau pa all le e t à sa du tio faisa t i te e i le pe o de d h d og e.
4.1.4 Aspects structuraux
Le platine est le catalyseur présentant la eilleu e a ti it pou la du tio de l o g e ta t e ilieu a ide u e ilieu asi ue. Tout d a o d, il appa tie t au deu i e g oupe de catalyseurs.33, 34Il atal se de a i e di e te la du tio de l o g e e eau et poss de des
p op i t s de su fa e fa ilita t l adso ptio des ol ules d o g e. Pa ailleu s, il p se te u e g a de sta ilit e ilieu a ide et e p se e d o g e.
Le mécanisme de réduction du dioxygène fait intervenir différentes caractéristiques du at iau atal ti ue ui so t sus epti les d e odifie l a ti it : les orbitales d du métal interviennent dans la réaction, or les effets électroniques induits par la structure du matériau (coordination des atomes de surface, densité de défauts, etc.) peuvent les modifier,35 un effet
g o t i ue pa a t es de aille et fa ettes e pos es peut t e i pli u et l adso ptio du dio g e peut t e i flue pa l e i o e e t p o he de la su fa e p se e d o des, charges de surfaces, etc.)
Ces caractéristiques peuvent être, certes, modifiées par la nature du matériau catalytique mais également par des structures et des morphologies différentes du même matériau (en termes de taille de particules, surfaces exposées, contraintes inte es, et . . U atal seu est do pas seulement défini par sa nature chimique. Sa mise en forme est un des paramètres importants à prendre en compte lors de son étude.
Co e a t l tude de la a tio de du tio de l o g e, il est i po ta t de souligner u il est possi le d o te i plusieu s sultats selo l histo i ue de l le t ode. Da ja o i et al.36
ont montré que la réaction de réduction du dioxygène à la surface du platine (chemin réactionnel emprunté) est fortement d pe da t de l histo i ue du atal seu et de la p op et de la solutio . La cellule électrochimique doit, par conséquent, être parfaitement propre et les catalyseurs doi e t a oi eu le e t aite e t p ala le si l o eut o pa e les diff e tes i tiques et les mécanismes de la réaction de réduction du dioxygène observés.
Compte tenu de la complexité de l tude de la du tio de l o g e, le a is e de du tio de l o g e su le plati e este à p ise . Pou ela, l i flue e des fa teu s is en jeu da s la du tio de l o g e tels ue le a is e d adso ptio de l o g e ou la structure du catalyseur doit être mieux déterminée.
Catalyse de la réduction de
l o g e dans une PEMFC
4.2.1 Le concept du point triple
Dans une électrode, la zone active se situe entre la membrane et la couche de diffusion. Elle d te i e les pe fo a es glo ales de l le t ode. Cette zo e, appel e poi t t iple (Triple-Phase Boundary, en anglais), est le lieu de coexistence au même point d un catalyseur, d un combustible (ou un comburant), d un élément conducteur protonique et d un élément o du teu le t o i ue. L le t ode est d auta t eilleu e ue le o e de poi ts t iples est élevé (Figure 17).
Figure 17-Schéma du point triple
Le o e de ol ules d o g e duites d pe d du o e de poi ts t iples fo s. La cinétique est alors intrinsèque à la réaction et présente une limitation significative sur les performances des PEMFC. La connaissance sur la nature, les propriétés et le nombre de points triples sont primordiales pour optimiser les points de contact entre les trois espèces.
4.2.2 Réalisation du point triple
La couche active de 500 nm à 20 est i opo euse pou pe ett e l a i e des gaz jus u au atal seu . Elle est fo e à pa ti d u e e e o te a t de la poud e atal ti ue (particules de platine supportées) dispersée dans une solution contenant un ionomère ayant pour fo tio d a lio e la o du tio p oto i ue et le o ta t e a e/ atal seu . L e e est ensuite déposée sur la couche de diffusion via différentes méthodes (spray, sérigraphie, étalement mécanique par rouleaux, imprégnation, etc.37, 38. L i o po atio de Nafio ®
directement dans la couche active a grandement contribué aux progrès des performances des PEMFC.39
La a tio de du tio de l o g e s effe tue à l i te fa e atal seu / lectrolyte. Le
design d u e i te fa e opti ale d pe d fo te e t de la st u tu e des po es de la ou he
Dans le cas où l’éle trolyte e ouille pas totale e t le atalyseur, on parle du modèle à « pore simple ». Il e iste u is ue à l i t ieu des po es à u e e tai e p ofo deu . La a tio de du tio de l o g e se a la plus effi a e à et e d oit, où oe iste t l le t ol te, le atal seu et le a tif gazeu : est la zo e de poi ts t iples Figure 18 . Cela o espo d au as où l e e atal ti ue e poss de pas dio o e.
Figure 18-Modèle à pore simple et zone de point triple
Dans le cas où l’éle trolyte ouille le atalyseur, on parle du modèle du « film mince ». Il peut e iste u fil i e d le t ol te autou des g ai s de atal seur dans toute la profondeur du pore (Figure 19 da s le as où l e e atal ti ue a t p pa e a e u io o e t pe Nafio ® . Il a pas à p op e e t pa le de poi t t iple. Si le fil d le t ol te est t op épais, la diffusion du gaz vers les sites atal ti ues se a t op le te et le ou a t se a li it . L le t ode est alo s p ati ue e t totale e t imprégnée ou « noyée » (electrode flooding).
Figure 19-Modèle du film mince
Le contrôle des zones de points triples est primordial au fonctionnement de la pile. Si l le t ol te p t e da s la p ofo deu de la ou he a ti e tout e laissa t des po es ou e ts pou l a i e des gaz, le o e et l effi a it des poi ts t iples se o t aug entés.
Taux de charge en platine et les limites du point triple
E aiso du oût le du plati e, l o je tif est de dui e au a i u les ua tit s utilis es sa s pe te de pe fo a es, d auta t plus u il a t d o t ue seule u e fai le
proportion du platine est réellement active dans les processus électrochimiques (20 - 40 %).42
Ainsi au cours des trente dernières années, les quantités de chargement en platine ont pu être divisées par vingt en maintenant ou en améliorant le niveau de performance de la pile. Pour la première génération de PEMFC introduite au début des années 1990, la puissance maximale obtenue était de 400 mW.cm-2 avec une charge en platine comprise entre 4 et 10 mg.cm-2. 43 Les
e he hes su l asse lage atal seu - e a e, e pa ti ulie su l i t odu tio de la poud e de a o e ui off e u e plus haute su fa e sp ifi ue et su l i p g atio du o du teu protonique dans la couche de diffusion garantissant un meilleur contact avec la membrane, dès 1997, ont permis de passer au-dessous de 1 mg.W-1.44 Pouss s pa l esso des appli atio s
o iles, les e ts effo ts de e he he o t pe is de di i ue les ha ges de plati e jus u à une valeur égale à 0,1 mg.W-1. Ce p og s a t e du possi le pa l utilisatio de deu te h i ues
de dépôts en couches minces : l le t o-dépôt et la pulvérisation par voie physique, qui permettent de déposer une faible concentration de platine tout en conservant une activité catalytique élevée.45-48 En deçà de cette valeur, la puissance maximale délivrée chute
considérablement, passant de 700 à 150 mW.cm-2.49
Mécanisme de dégradation des électrodes
50Le support utilisé pour les catalyseurs de pile à combustible doit impérativement présenter une bonne conductivité afin de permettre la conduction électrique vers le circuit électrique extérieur. De plus, les nanoparticules doivent être bien dispersées sur la surface de support. Pour cela, un support de grande surface spécifique avec des sites permettant une bonne accroche des particules a été utilisé. Les supports les plus couramment employés sont des carbones pul ule ts tels ue le Vul a XC do t la su fa e sp ifi ue est de l o d e de 50 m2.g-1 et les
tailles de g ai de a o e de l o d e de . Ce suppo t est tout à fait adapt pou dispe se les catalyseurs métalliques.
4.4.1 Phénomène de dissolution du platine
En pile, trois phénomènes entraînent la dissolution du platine51-53 :
Le très faible pH (inférieur à 1) ;
Les potentiels élevés de fonctionnement à la cathode (supérieur à 1,0 V vs ERH) ; Le iste e d u e phase a ueuse li uide au o ta t du plati e, ue l o peut
retrouver dans les eaux en sortie de pile.
Selon différents auteurs, les plus petites particules (1 à 3 nm) exposent une grande probabilité de présence de défauts de surface et se dissolvent donc plus facilement car les atomes sur les arêtes et les sommets sont plus faiblement liés que ceux présents sur des domaines istallog aphi ues plus te dus. La dissolutio est fa o is e pa l aug e tatio du pote tiel de fo tio e e t e t aî a t la fo atio d o des de plati e ui peu ent alors se dissoudre dans un milieu acide. Le mécanisme de dissolution diffère selon les sources51, 53, 54 mais, de manière
g ale, le plati e passe à l tat o d e fo a t des o des ou des h d o des de platine qui sont ensuite dissous par les protons présents à faible pH suivant les réactions (Figure 20, Figure 21) :
Figure 20-Formation des oxydes de platine
Figure 21-Dissolution du platine en milieu acide
La plus grande partie du platine dissous resso t de la pile e t aî e pa l eau. L aut e pa tie de es io s peut ig e à l i t ieu de la e a e pol e et t e duite pa l h d og e la traversant par crossover. Il se forme alors au sein de la membrane des nanocristaux de platine inactifs.54Il est aussi possi le ue les io s se duise t su d aut es pa ti ules de plati e.
4.4.2 Phénomène de re-dépôt
Un des phénomènes qui découle de la dissolution du platine est le phénomène de ( 17 )
( 18 ) ) ( 15 ) ( 16 )
taille des nanoparticules. La dissolution, ainsi que le re-d pôt du plati e et l agglo atio des nanoparticules induit par la diffusion des particules à la surface du support en sont les causes principales. Le phénomène de dissolution/re-dépôt du platine (Figure 22) est nommé
û isse e t d Ost ald ou e o e Ostwald ripening et se produit en trois étapes : La dissolution du platine suivant les équations précédentes ( 15 à 18 ) ; La migration des ions ;
La du tio d u e e tai e pa tie de eu -ci sur de plus grosses particules, à o ditio ue l io talli ue soit à p o i it d u e pa ticule de platine.
Ceci entraîne la diminution de la proportion de particules de petites tailles (inférieures à 3 et l aug e tatio de la taille des pa ti ules plus g osses sup ieu es à ).51, 52, 54 De plus,
le re-dépôt favorise la création de sites où le platine est plus faiblement lié et donc la dissolution de ces grosses particules, ce qui explique la continuité de la dissolution du platine dans le temps. En plus de diminuer la surface active du platine, le phénomène de re-dépôt entretient la dissolution.
Figure 22-Mécanisme du phénomène de la dissolution/re-dépôt du platine51
Cepe da t, l agglo atio des a opa ti ules se le t e la p i ipale ause de l aug e tatio de la taille des particules, entraînant la diminution de la surface active. Elle est due à la o ilit des a opa ti ules à la su fa e du suppo t ai si u à l e gie de su fa e de celle- i. Les a opa ti ules diffuse t à la su fa e du suppo t pou e suite s agglo e Figure 23 et fo e u e pa ti ule plus sta le. Le ph o e d agglo atio est uasi e t pas observé en phase gaz (gaz sec) mais devient important lorsque le catalyseur est mis au contact a e de l eau. D ap s ertains auteurs,52, 54, 55l eau p t e ait e t e les pa ti ules et le support,
pote tiel de fo tio e e t du atal seu . Il est do o se au deu le t odes d u e pile à combustible. Une fois les particules stabilisées (taille li ite attei te , le p o essus de f ittage est plus observé contrairement à la dissolution du platine qui est continue.
Figure 23-S h a de la diffusio de pa ti ules atal ti ues à la su fa e d u suppo t a o , ig atio et
coalescence51
Il est possi le d o se e l aug e tatio de la taille due à l agglo atio des pa ti ules par chauffage en atmosphère réductrice. Dans ce as, les pa ti ules fo e t d a o d des agglomérats avant de se « solidariser » par réarrangement de joints de g ai . L h d og e adso à la su fa e du plati e pe et e a a ge e t à pa ti de °C. L agglo at fo de nanoparticules très proches les unes des autres) se transforme alors en une particule avec des domaines cohérents plus étendus.56
4.4.3 Cross-over métallique
Ce phénomène de cross-over métallique est notamment observé par microscopie électronique à transmission (MET) et décrit par Guilminot et al.57-59L esp e io i ue p t e la
me a e sous l effet de deu a is es :
Pa effet d os ose, la diff e e de o e t atio s e t aî e la diffusio des espèces ioniques au sein de la membrane polymère
Sous l effet du ha p le t i ue, les esp es io i ues ha g es ig e t au sei de la membrane polymère.
Ces espèces sont alors réduites au contact de dihydrogène diffusant lui-même au sein de la e a e de l a ode e s la athode. Ce i do e aissa e à des e tit s talli ues o se a les, au sei de la e a e. L o se atio de es pa ticules métalliques traduit donc l e iste e d u flu d h d og e joua t le ôle de du teu .
Figure 24-Mécanisme de dissolution du platine et précipitation dans la membrane
4.4.4 Appauvrissement des électrodes en platine
L esp e talli ue io i ue peut ig e au sei de l eau e t aînée du fait du débit gazeux au sein du système. Ceci provoque une perte de matière catalytique progressive, qui entraîne une perte de performance définitive.
L e se le de es t ois ph o es induit une perte de surface active à la cathode qui peut se traduire par une perte importante de performance et donc limiter la durabilité du système.
4.4.5 Corrosion du support carboné
La de i e ause de pe te des a opa ti ules est li e à l o datio du suppo t ui se dégrade en CO2ou e CO, li a t les pa ti ules ui so t e t aî es pa le flu d eau da s la pile
à combustible.60-63 La dégradation du support peut être élect o hi i ue ou issue d u e a tio
hétérogène.64 Dans le cas de la combustion électrochimique du carbone, des mesures effectuées
montrent que, en présence de platine, du monoxyde de carbone de surface se forme pour un potentiel supérieur à 0,3 V vs ERH. Il est ensuite oxydé en CO2 entre 0,6 et 0,8 V vs ERH. La réaction
o pl te d o datio le t o hi i ue du a o e se d oule selo l uatio ( 19 ) suivante (Figure 25) :
Figure 25-‘ a tio d o datio du a o e