Extraction des nanoparticules PEGylées par
immunoprécipitation
Mémoire
Youcef Chakib Hacene
Maîtrise en sciences pharmaceutiques - avec mémoire
Maître ès sciences (M. Sc.)
Extraction des nanoparticules PEGylées par
immunoprécipitation
Mémoire de Maîtrise en sciences pharmaceutiques
Youcef Chakib Hacene
Sous la direction de :
Dr Nicolas Bertrand, directeur de recherche
Faculté de Pharmacie
Résumé
L’application des connaissances scientifiques fondamentales ainsi que les récents progrès technologiques en nanoscience ont permis l’émergence d’une nouvelle discipline dans les sciences médicales dénommée la nanomédecine. Cette discipline consiste à développer des objets, dénommés nanoparticules, dont le registre de taille est de l’ordre de 100 nanomètres et qui visent à améliorer l’efficacité des molécules pharmacologiquement actives en altérant favorablement leur pharmacocinétique. Le développement rationnel des nanomédicaments passe par une série d’étapes où les interactions des nanomédicaments avec l’organisme vivant sont caractérisées. Cette caractérisation nécessite, comme condition préalable, d’être apte à extraire les nanoparticules à partir de matrices biologiques complexes après leur administration in vivo. Dans ce travail de maîtrise, nous proposons une méthodologie alternative aux techniques d’extraction couramment utilisées. Celle-ci est basée sur l’immunopréCelle-cipitation par l’utilisation d’anticorps dirigés contre le polyéthylène glycol (PEG), le PEG étant un polymère hydrophile fréquemment utilisé dans la fabrication de nanomédicaments. La méthodologie est validée par l’exploitation de trois types de colloïdes PEGylés : les nanoparticules polymériques, les liposomes, ainsi que les protéines conjuguées. Nous proposons une caractérisation du processus d’extraction et démontrons son applicabilité pour l’extraction de nanoparticules PEGylées, à partir de solutions simples ainsi qu’à partir du plasma in vitro et après administration in vivo. Par ailleurs, nous proposons une application de cette méthode d’extraction en complément aux expérimentations de pharmacocinétique, où l’extraction des nanoparticules à partir du sang permet de déterminer la variation de taille de ces dernières in vivo. Nous pensons que cette méthodologie sera utile pour permettre une meilleure compréhension des interactions entre les nanoparticules et les organismes vivants et aidera par conséquent dans le développement des nanomédicaments.
Abstract
The application of fundamental science as well as the recent technological progress in nanoscience allowed for the emergence of a new field within the medical sciences, named nanomedicine. This discipline consists in the development of objects, with a size in the 100 nm range, called nanoparticles, which aims to favorably alter the pharmacokinetics of pharmacologically actives molecules. Rational development of nanomedicines requires a series of experimental steps during which the interactions of nanoparticles with living organisms are characterized. A requirement for this characterization is the ability to extract nanoparticles from complex biological media following their administration in vivo. In this master’s program work, we propose immunoprecipitation by using antibodies directed against polyethylene glycol (PEG) as an alternative methodology for nanoparticles extraction. PEG is a hydrophilic polymer often utilized for the fabrication of nanomedicines. Herein, we validate the methodology using three types of nanoparticles: polymeric, liposomes, and conjugated proteins. We provide a characterization of the extraction process and demonstrate its applicability for the extraction of PEGylated nanoparticles from simple solutions as well as from plasma in vitro and after in vivo administration. Furthermore, we provide a methodology utilizing the novel extraction technique for the determination of changes in nanoparticles size distribution during pharmacokinetics studies. We believe this methodology will help to better understand the interactions of nanoparticles with living organisms and facilitate the development of more efficient nanoparticles.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures, tableaux, illustrations ... vii
Liste des figures ... vii
Liste des tableaux ... viii
Liste des abréviations, sigles, acronymes ... ix
Remerciements ... xi
Avant-propos ... xii
Introduction... 1
Les nanomédicaments ... 1
Définition ... 1
Pertinence des nanomédicaments... 1
Applications des nanomédicaments ... 2
Les types de nanomédicaments ... 5
Les liposomes ... 5
Définition ... 5
Composition ... 6
Encapsulation de molécules cargo dans les liposomes ... 6
Facteurs influençant les propriétés des liposomes ... 7
La préparation des liposomes ... 9
Les nanoparticules polymériques ... 11
Définition ... 11
Les types de nanoparticules polymériques ... 11
Les types de polymères ... 12
Les techniques utilisées pour la préparation de nanoparticules polymériques ... 12
Les nanoparticules protéiques ... 14
Définition ... 14
La préparation de nanoparticules protéiques ... 14
Les protéines thérapeutiques conjuguées au PEG ... 15
La PEGylation des nanoparticules ... 16
Définition ... 18
Facteurs affectant potentiellement la couronne de protéines ... 19
Les effets potentiels de la couronne de protéines sur le comportement des NPs ... 21
Les limites de notre compréhension de la couronne de protéine ... 22
Techniques utilisées pour caractériser la couronne de protéines ... 23
L’immunoprécipitation ... 26
Chapitre 1 Problématique et objectifs ... 28
Chapitre 2 The extraction of nanoparticles by immunoprecipitation informs on their biological fate... 30
2.1 Résumé ... 30
2.2 Abstract ... 31
Introduction... 31
Materials and methods ... 33
PEG-PLGA nanoparticles preparation ... 33
Liposomes preparation and quantification ... 33
Immunoprecipitation procedure ... 33
Crosslinking of magnetic beads with antibodies ... 34
In vivo experiments ... 34
Results and discussion ... 35
Nanoparticles can be extracted from PBS using antiPEG antibodies. ... 35
Extraction of nanoparticles from plasma requires the covalent attachment of antibodies on the magnetic beads. ... 36
Immunoprecipitation using antiPEG antibodies is compatible with other PEGylated systems. ... 37
Immunoprecipitation can extract nanoparticles after their administration in vivo ... 38
The size distribution of nanoparticles found in the bloodstream is not affected by their route of administration. ... 38
Conclusion ... 39
Figures ... 40
Supplementary figures ... 44
Supplementary materials and methods ... 49
Synthesis of borondipyrromethene and cyanine terminated polymers. ... 49
Chapitre 3 Résultats additionnels ... 51
Introduction ... 51
Comparaison avec la quantité de protéines non spécifiques obtenue par centrifugation ... 54 Conclusion ... 56 Bibliographie ... 58
Liste des figures, tableaux, illustrations
Liste des figures
1. Figure 1 : Illustration de la taille des nanomédicaments relativement aux petites molécules (le glucose), aux macromolécules (les anticorps), aux virus et aux bactéries.
2. Figure 2 : Illustration de la vectorisation passive par EPR et de la vectorisation active par molécule ligand.
3. Figure 3 : La structure générale commune à tous les liposomes.
4. Figure 4 : Illustration schématisant la fabrication des liposomes selon la technique de l'hydratation du film lipidique.
5. Figure 5 : Illustration de la désorption des protéines de la couronne à mesure que les nanoparticules se déplacent le long de la colonne.
6. Figure 6 : Schéma descriptif de la technique du fractionnement d’écoulement de champ par écoulement asymétrique (AF4).
7. Figure 7 : In PBS, native magnetic beads can efficiently extract nanoparticles decorated with anti-PEG antibodies.
8. Figure 8 : In the presence of plasma, native magnetic beads lose their ability to extract nanoparticles decorated with antiPEG antibodies presumably due to competition with non-specific antibodies. 9. Figure 9 : Different PEGylated nanoparticles can be immunoprecipitated; the quantities that can be
extracted depend on their physicochemical characteristics.
10. Figure 10 : A. The immunoprecipitation method allows isolation of nanoparticles after injection in vivo. Extraction of nanoparticles in the plasma collected from live animals is comparable to that observed after incubation in vitro. Values represent means +/- SD (n = 3). B. PLGA-PEG nanoparticles administered via the intraperitoneal route or the intravenous route show different plasma concentration profiles (n=5). C. C. Size distribution analysis using NTA of circulating nanoparticles after their administration via either the intravenous or the intraperitoneal route show no change in nanoparticles average size (n=3).
11. Figure S1 : A. Efficiency of elution buffers for the elution of nanoparticles extracted by crosslinked magnetic beads. Tested elution buffers from left to right are: Sodium dodecyl sulfate (SDS) 1%, SDS 5%, Polysorbate 5%, Sodium Deoxycholate 1%, Urea 6 M, and citric acid 0.1 M. B. After the extraction of increasing quantities of low PEG density and high PEG density PLGA-PEG nanoparticles as well as PEGylated liposomes, SDS 1% is effective in the elution of approximately 100% of the extracted quantity.
12. Figure S2 : A. Nanoparticles are successfully extracted from PBS using non crosslinked magnetic beads, and magnetic beads do not lose their binding capacity after one extraction and elution cycle is completed. B. Contrarily to non-crosslinked magnetic beads, crosslinked ones lose approximately one third of their initial binding capacity after full cycles of extraction from plasma and elution using SDS 1%.
13. Figure S3 : Change in the extraction capacity after crosslinking and as a function of the dispersing medium (PBS or Plasma).
14. Figure S4 : A. Extraction kinetics of liposomes and PLGA-PEG nanoparticles with high and low PEG density show that magnetic beads are saturated after approximately 1.5 hours of incubation with nanoparticles in plasma. B. Eluted protein quantity from magnetic beads crosslinked to antiPEG antibodies or control antibodies after incubation with an excess of PEGylated asparaginase (Oncaspar®).
15. Figure S5 : A. Centrifugation at 15 000 RCF of PLGA-PEG nanoparticles allows for their precipitation at increasing levels with time. PEGylated liposomes cannot be precipitated regardless of centrifugation time. B. Measuring the size distribution of unprecipitated PLGA-PEG nanoparticles shows that smaller nanoparticles are less readily separated from plasma using centrifugation. D. When PLGA-PEG nanoparticles are incubated in SDS 1% their size does not vary compared to their original size in water. This shows that the extraction procedure itself has no effect on nanoparticles size.
16. Figure S6. The number of PLGA-PEG nanoparticles which are extracted by 25 µl of magnetic beads (equivalent to 750 µg of solid) plotted against their average diameter.
17. Figure 11 : Variation de la quantité de protéines plasmatiques éluées par SDS à partir de 25 µl de billes magnétiques (750 µg de solide) saturées à 24%, 48%, 71%, 95% et 100% en nanoparticules polymériques.
18. Figure 12 : Variation de la quantité de protéines plasmatiques éluée par SDS à partir de 25 µl de billes magnétiques (750 µg de solide) en fonction du type de surfactant utilisé pour le blocage des billes magnétiques.
19. Figure 13 : Variation de la quantité de protéines plasmatiques éluée par SDS à partir de 25 µl de billes magnétiques (750 µg de solide) lorsque les billes magnétiques sont incubées dans une solution contenant 30%, 60% ou bien 90% de plasma du volume total.
20. Figure 14 : Variation de la quantité de protéines précipitée après centrifugation de nanoparticules polymériques, de liposomes, ainsi que d’un plasma témoin à 15 000 RCF pendant 20, 60 ou bien 120 minutes.
Liste des tableaux
1. Tableau 1 : Liste des nanomédicaments commercialisés pour le traitement de divers types de cancers. Reproduite avec autorisation de la source.
Liste des abréviations, sigles, acronymes
1. US-FDA : United states food and drug administration2. PEG : Polyethylene glycol
3. EPR : Enhanced permeability and retention 4. DSPC : distearoylphosphatidylcholine 5. DPPC : dipalmitoyl phosphatidylcholine 6. DMPC : Dimyristoylphosphatidylcholine 7. SM : Sphingomyéline 8. DOTAP : 1,2-dioleoyl-3-trimethylammonium-propane 9. DCP : dicetylphosphate
10. CMC : Concentration micellaire critique 11. PLA : Acide polylactique
12. PGA : Acide polyglycolique
13. PLGA : Acide poly(lactique-co-glycolique) 14. PAC : Poly-alkyl-cyano-acrylates
15. EMA : European Medicines Agency 16. BPF : Bonnes pratiques de fabrication 17. ADN : Acide désoxyribonucléique 18. PVA : Alcool polyvinylique 19. HSA : Human Serum Albumin 20. PCL : Poly-ε-caprolactone
21. ABC : Accelerated blood clearance 22. PHEA : Poly(hydroxyethyl-l-asparagine) 23. PHEG : Poly(hydroxyethyl-l-glutamine)
24. PG : Polyglycerol
25. PMeoX : Poly(2-methyl-2-oxazoline) 26. PMMa : Polyacrylamide
27. PVP : Polyvinylpyrrolidone
28. PHPMA : Poly(N-(2-hydroxypropyl)methacrylamide) 29. LC-MS : Liquid Chromatography – Mass spectrometry 30. FBS : Fetal Bovine Serum
31. PEP : Polyéthylène phosphate 32. BCA : Bicinchoninic Acid Assay
33. SDS-PAGE :Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis 34. DCC : N,N′-Dicyclohexylcarbodiimide
35. EDC : N-Ethyl-N′-(3-dimethylaminopropyl)carbodiimide 36. BS3 : bis(sulfosuccinimidyl)suberate
37. DMP : Dimethyl pimelimidate 38. BSA : Bovine Serum Albumin 39. PBS : Phosphate Buffered Saline 40. SDS : Sodium Dodecyl Sulfate
Remerciements
Je tiens tout d’abord à remercier Dr Nicolas Bertrand pour son tutorat et son perpétuel soutien tout le long de mes études au sein de son laboratoire. Je tiens également à remercier les membres et ex-membres du groupe du Dr Nicolas Bertrand pour leur aide et leur accompagnement : Caroline Queant, Elodie Chotard, Philippe Grenier, Amrita Dikpati, Sabrina Roussel, Nicolas Gaudreault, Farzad Mohammadi, Neda Madadian Bozorg et Vanessa Maria Dos Passos Maio. Je remercie également Jean François Thériault, membre du groupe du Dr Sheng-Xiang Lin pour son précieux soutien.
Avant-propos
Ce mémoire de maîtrise en sciences pharmaceutiques porte sur le développement d’une méthodologie pour l’extraction de nanoparticules PEGylées à partir des organismes vivants. La première partie du mémoire est rédigée en français et consiste en une introduction où sont présentées les principales classes de nanomédicaments. Y sont également décrits les concepts de couronne de protéines, de PEGylation, ainsi que les principales méthodologies permettant de séparer les nanoparticules et de les caractériser. Le premier chapitre du mémoire présente la problématique à laquelle souhaite répondre ce travail de recherche, notre hypothèse de recherche, ainsi qu’une mise en contexte de la méthodologie que nous avons adoptée. Le deuxième chapitre du mémoire est rédigé en anglais et consiste en un article qui sera prochainement soumis pour publication dans une revue à comité de lecture. Dans l’article, nous retrouvons une brève introduction, une description de la méthodologie et des matériaux utilisés, suivies par une présentation des résultats et de leur discussion. Le troisième chapitre du mémoire fournit des données non incluses dans l’article scientifique (chapitre 2). Le mémoire se termine par une conclusion qui remet en perspective les résultats obtenus et présente de possibles travaux complémentaires pour la poursuite de ce projet de recherche. Dans le cadre de ce projet de maîtrise, j’ai réalisé moi-même la majeure partie des expérimentations, exception faite des expérimentations animales, qui ont été accomplies par Dr Nicolas Bertrand et Philippe Grenier – étudiant au doctorat au sein de notre laboratoire. Par ailleurs, j’ai rédigé une première version du mémoire et de l’article. Cette première version a été corrigée et par la suite modifiée par Dr Nicolas Bertrand. Dr Nicolas Bertrand m’a supervisé pendant toute la durée de ces études.
Introduction
Les nanomédicaments
Définition
Selon la US-FDA (Food and Drug administration) et l’EMA (European Medicines Agency) un médicament est toute formulation contenant une substance officiellement reconnue par une pharmacopée, dont l’usage est destiné au diagnostic, à l’atténuation, au traitement, à la prévention d’une maladie. Cette définition inclue également toute substance autre que la nourriture et ayant un effet sur une structure ou fonction de l’organisme1,2.
Un nanomédicament est un médicament multiparticulaire et dont la conception a trait à la nanotechnologie3. La
nanotechnologie est définie comme étant la discipline permettant de structurer et d’analyser la matière à l’échelle nanométrique. Selon l’IUPAC une nanoparticule est tout objet dont les dimensions sont comprises entre 1 et 100 nm, incluant les objets dont seulement deux dimensions sont comprises dans cet intervalle (par exemple les nanotubes). Selon la même définition de l’IUPAC, lorsque les particules ont une taille pouvant atteindre les 500 nm mais qu’elles démontrent des propriétés nouvelles du fait de leur taille, elles sont alors également considérées comme nanoparticules.4 Certains auteurs indiquent que lorsqu’il
s’agit de formulation pharmaceutique, une nanoparticule peut avoir un diamètre allant jusqu’à 1000 nm.5
Pertinence des nanomédicaments
Selon George Khushf et Ronald A. Siegel6 tout l’intérêt des
nanomédicaments est dû à leur situation dans le monde mésoscopique. La physique mésoscopique est une branche de la physique qui étudie les phénomènes ayant lieu à des échelles de grandeur intermédiaires entre le monde quantique et la physique classique. Nous savons en effet
Figure 1 Illustration de la taille des nanomédicament relativement aux petites molécules (le glucose), aux macromolécules (les anticorps), aux virus, et aux
et apparente complexité, ne sont que des systèmes résultant de l’interaction de molécules, de biomacromolécules, et d’organelles. Ces éléments sont tous compris dans l’intervalle de taille des nanoparticules (figure 1). Ceci signifie que les nanoparticules peuvent interagir avec la machine du vivant d’une façon qui leur est propre et qui est incomparable avec les constructions macroscopiques (tels que les dispositifs médicaux implantables) ou moléculaires (telles que des molécules dissoutes dans le fluide biologique). Selon ces auteurs, les nanomédicaments sont donc toute construction artificielle démontrant, du fait de sa taille nanométrique, une fonctionnalité biologique novatrice d’utilité thérapeutique ou diagnostique. Ce concept de machine nanométrique pouvant accomplir des tâches à l’échelle cellulaire et subcellulaire n’est d’ailleurs pas si récent et remonte aux années 60, tel que retrouvé dans le célèbre discours de Richard Feynman « There’s plenty of room at the bottom ».7
Applications des nanomédicaments
La recherche sur les nanomédicaments vise souvent à améliorer le profil thérapeutique et toxicologique d’une ou plusieurs substances actives. Le principe est d’inclure la ou les substances actives dans des nanoparticules (NPs), qui agiront comme vecteur pour guider le principe actif vers un site où son accumulation est désirée. La NP libérera ensuite le principe actif dans ce tissu de manière contrôlée. En principe, les nanomédicaments permettent aux substances actives un comportement in vivo qu’elles n’auraient jamais eu dans leur état natif (c’est-à-dire sous forme libre, non encapsulée dans des NPs). Ce point a été démontré pour la première fois par les chercheurs Matsumura Y. et Maeda H.8 Cette étude séminale a montré que la conjugaison de protéines à
un copolymère (formé de styrène et d’acide maléique) prolongeait leur temps de circulation et permettait d’augmenter leur accumulation dans les tumeurs, comparativement à des protéines non-conjuguées. Il s’agissait là de la première démonstration de vectorisation d’un principe actif par une fabrication nanométrique. Cette vectorisation, dite « passive », a été nommée « l’effet de perméabilité et de rétention améliorée », en anglais « enhanced permeability and retention effect », abrévié EPR. Bien que controversé, le mécanisme proposé pour expliquer ce phénomène, est que la petite taille des nanoparticules permet leur extravasation à travers les défauts/anomalies de l’endothélium des tumeurs. Cette publication a suscité un énorme engouement, si bien qu’aujourd’hui une recherche sur le moteur Google Scholar du mot clé « nanomedicine » renvoie pas moins de 830 000 résultats. Ces recherches ont abouti à la commercialisation de 29 nanomédicaments à ce jour, parmi ceux-ci 9 sont indiqués en oncologie et sont listés dans le tableau 1.9
Tableau 1 Liste des nanomédicaments commercialisés pour le traitement de divers types de cancers. Reproduite avec autorisation de la source.9
Nom commercial Nom du principe actif Type de nanoparticule Indication thérapeutique Date d’autorisation Doxil® Caelyx® Doxorubicune Liposomes PEGylés
Cancer des ovaires Sarcome de Kaposi lié au VIH
Myélomes multiples
FDA 1995 EMA 1996
DaunoXome® Daunorubicine Liposomes non
PEGylés
Diverses leucémies FDA 1996
Myocet® Doxorubicine Liposomes non
PEGylés
Cancer du sein métastatique
EMA 2000
Abraxane® Paclitaxel NPs protéiques
d’albumine
Cancer du poumon non à petites cellules avancé Cancer du sein métastatique Cancer du pancréas métastatique FDA 2005 EMA 2008
MEPACT® Mifamurtide Liposomes non
PEGylés
Oostéosarcome non métastatique de haut grade résécable après une exérèse chirurgicale
macroscopiquement complète
EMA 2009
Marqibo® Vincristine Liposomes non
PEGylés Leucémie lymphoblastique aiguë à chromosome Philadelphie négatif FDA 2012
Onivyde® Irinotecan Liposomes non
PEGylés
Cancer du pancréas métastatique
Vyxeos® Ratio de 5 pour 1 de cytarabine et de daunorubucine
Liposome Leucémie myéloïde aigue US-FDA 2017 EMA 2018 Hensify® NPs d’oxyde d'hafnium stimulé par irradiation externe
Oxyde d’hafnium Carcinomes épidermoïdes localement avancés
Marquage CE 2019
Il existe en plus du ciblage passif, un mode de ciblage « actif ». Celui-ci exploite d’autres anomalies retrouvées au niveau des cellules vers lesquelles le principe actif doit être ciblé. En effet, au niveau des tissus tumoraux, certaines molécules sont davantage exprimées en surface des cellules qu’au niveau des tissus sains. Ces molécules peuvent être reconnues spécifiquement par des molécules ligands. En décorant les NPs de ces molécules ligands, il est possible de vectoriser le principe actif par un mécanisme « actif » et spécifique.10,11
Cette vectorisation a pour effet de protéger le corps des effets indésirables dus au principe actif (les molécules cytotoxiques par exemple) et conséquemment de réduire la toxicité. Les deux types de vectorisation sont schématisés à la figure 2.
Figure 2Illustration de: A. La vectorisation passive par EPR. B. La vectorisation active par molécule ligand. Reproduite avec autorisation de la source.12
Les nanomédicaments permettent des applications autres que la vectorisation. Lorsque la drogue peut être dénaturée ou dégradée par les conditions physiologiques (les acides nucléiques par exemple), encapsuler le principe actif permet de le protéger contre le corps, et donc maintenir sa stabilité jusqu’à ce qu’elle atteigne sa cible moléculaire13,14. Les NPs peuvent également prolonger la libération du principe actif dans le temps,
réduisant ainsi le nombre d’administrations nécessaires et améliorant l’observance des patients. De plus, il est possible pour les NPs de libérer le principe actif par l’effet de stimuli exogènes (tels que le pH, la présence d’enzymes dégradant les NPs, l’augmentation de la température), permettant donc de libérer le principe actif uniquement lorsque ceci est requis.15–17 Une autre application majeure des nanomédicaments, est d’améliorer
la solubilité et la vitesse de dissolution des principes actifs peu solubles. Cela peut avoir pour conséquence d’augmenter leur biodisponibilité, notamment après une administration orale.18–20 Ceci est possible via deux
mécanismes : premièrement les NPs permettent une surface de contact avec l’eau supérieure aux formes pharmaceutiques usuelles (voir le modèle de Noyes-Whitney21,22), et deuxièmement elles permettent le maintien
du principe actif dans une forme amorphe ce qui permet d’augmenter sa solubilité apparente.23,24
Les types de nanomédicaments
Dans les paragraphes qui suivront seront décrits les principaux types de NPs pertinents pour leur usage médical. Nous décrirons leur composition, aborderons des exemples des aspects relatifs à leur structure et qui affectent le comportement de celles-ci, et décrirons les techniques utilisées pour leur fabrication. La sélection de ces catégories est faite sur la base des médicaments autorisés à la commercialisation par l’US-FDA,25 exception
faite des NPs polymériques où il n’existe qu’un seul exemple de médicament commercialisé en Corée du Sud. Ces catégories sont les suivantes : les liposomes, les nanoparticules polymériques et les nanoparticules protéiques.
Bien que les nanocristaux représentent la majeure partie des nanomédicaments commercialisés, ils ne seront pas abordés dans le reste de cette introduction. En effet, ces technologies ne sont pas des véhicules de principe actif, mais servent principalement à augmenter la vitesse de dissolution tel que discuté plus haut.
Les liposomes
Définition
Les liposomes sont des structures sphériques composées d’une ou de plusieurs bicouches de phospholipides amphiphiles enrobant un cœur aqueux. Alec D. Bangham26 les a découverts dans les années 60s en étudiant
multilaméllaires concentriques (sphérulites) ou longitudinales ont été observées, où la taille et l’apparence de ces vésicules dépendaient de la constitution des films lipidiques.
Composition
À ce jour, les liposomes investigués en recherche pharmaceutique sont composés majoritairement de glycérophospholipides, d’origine naturelle ou synthétique, formant une bicouche phospholipidique semblable à celle des membranes cellulaires. Les phospholipides sont des molécules amphiphiles, avec un groupe hydrophile à une extrémité, dérivé de l’acide phosphorique, et à l’autre extrémité deux chaines d’acides gras. La figure 3 est une illustration de la structure générale commune à tous les liposomes.
Encapsulation de molécules
cargo dans les liposomes
Du fait de leur structure, les phospholipides forment spontanément des membranes en milieu aqueux.27 Legroupe phosphate hydrophile s’oriente en direction du milieu aqueux étant donné son interaction favorable avec les molécules d’eau. Les chaines lipidiques s’orientent en minimisant leurs interactions avec l’eau car elles y
sont insolubles. Cette structure a pour premier avantage d’être naturellement stable en milieu biologique, en plus d’être biocompatible, car elle reprend le même principe que celui des membranes cellulaires. Le deuxième avantage conféré par le caractère amphiphile des phospholipides est la possibilité d’encapsulation de molécules, qu’elles soient hydrophiles ou hydrophobes. Les principes actifs vont être localisés dans le compartiment aqueux central, et les principes actifs hydrophobes se localisent dans la bicouche phospholipidique interagissant majoritairement avec les acides gras.28 Alternativement, les molécules cargo
hydrophobes peuvent être localisées au sein du compartiment aqueux plutôt que dans la membrane si elles sont stabilisées par complexation avec une cyclodextrine.29 Les cyclodextrines sont des molécules de forme
toroïdale ou annulaire ayant un intérieur hydrophobe, grâce auquel elles forment des complexes avec les molécules insolubles dans l’eau et permettent leur dissolution en milieu aqueux. Cette approche permet un meilleur taux d’encapsulation (quantité de cargo par quantité de véhicule) étant donné que le volume du compartiment aqueux est supérieur à celui de la région hydrophobe de la membrane dans les vésicules unilaméllaires. Afin de demeurer stable, ce type de formulation nécessite que la molécule cargo demeure dans
Figure 3La structure générale commune à tous les liposomes. Reproduite avec autorisation de la source.1
la cyclodextrine sans se distribuer vers les composants membranaires.30 Cette approche est également la seule
alternative viable pour l’encapsulation de molécules insolubles dans l’eau mais faiblement miscibles avec les phospholipides, tels que les stéroïdes et esters de stéroïdes31. De ce fait, les liposomes sont un véhicule
universel et permettent d’encapsuler divers types de cargos, tels que les enzymes32, les protéines33, les
hormones34, les oligonucléotides35, l’ADN36, et les agents de bio-imagerie37.
Facteurs influençant les propriétés des liposomes
La lamélarité
Les liposomes peuvent être unilaméllaires (i.e., composés d’une seule bicouche phospholipidique) ou multilaméllaires (i.e., composés de plusieurs bicouches concentriques). La lamélarité affecte premièrement l’efficacité d’encapsulation de molécules cargo, tel que démontré par Betageri et Parsons38. Dans cette étude,
les auteurs comparaient l’encapsulation et la cinétique de libération de l’aténolol et du propanolol dans des liposomes unilaméllaires et multilaméllaires. Il a été observé que dans le cas des vésicules multilaméllaires, l’efficacité d’encapsulation d’un cargo hydrophobe (le propanolol) est meilleure que celle d’un cargo hydrophile (l’aténolol). De plus, il a été observé que la cinétique de libération du cargo était retardée à partir des vésicules multilaméllaires. Ceci s’explique par la nécessité de diffusion sur une plus longue distance de la molécule cargo avant d’être libérée39. Une deuxième considération est que l’épaisseur de la couche phospholipidique affecte la
taille du liposome et possiblement son devenir in vivo. Il est en effet observé que la clairance du liposome augmente avec sa taille, tel que rapporté par Juliano et Stamp40 dans une étude sur la pharmacocinétique d’une
population hétérogène de liposomes contenant des petits liposomes unilaméllaires et des plus gros liposomes multilaméllaires. On y retrouve notamment l’observation d’une pharmacocinétique biphasique où les grosses vésicules sont rapidement éliminées de la circulation sanguine comparativement aux petites vésicules. Le contenu en cholestérol
Le cholestérol est une molécule qui est communément employée dans la préparation de liposomes. Il a pour effet de stabiliser la membrane phospholipidique. Il a été rapporté par Gregory Gregoriadis et Christine Davis41
que l’addition de cholestérol à une membrane phospholipidique composée de lécithine et d’acide phosphatidique améliore leur stabilité in vitro. Cette stabilité se traduit par une meilleure rétention du cargo et une perméabilité moindre aux molécules situées à l’extérieur du liposome. L’addition de cholestérol permet également une meilleure stabilité in vivo, et empêche la capture des phospholipides par les lipoprotéines plasmatiques de haute densité (HDL) tel que démontré par Senior et al.42 Le cholestérol est décrit comme étant un agent stabilisateur
de la bicouche phospholipidique43. Cet effet stabilisateur est observé lorsque la proportion molaire du cholestérol
avec les phospholipides, tel qu’analysé par calorimétrie à balayage différentiel. À contrario, à des valeurs inférieures, le cholestérol cause la séparation de la membrane en deux phases, affectant ainsi sa stabilité44.
La nature des phospholipides (chaines alkyles)
La stabilité de la membrane phospholipidique dépend également du type de phospholipide, notamment la longueur et la saturation des carbones des acides gras. La longueur de l’acide gras et sa saturation favorisent les interactions entre les chaines hydrophobes. Ceci se traduit par l’élévation du point de transition de phase, température seuil à partir de laquelle la bicouche phospholipidique passe de l’état de gel à l’état de fluide ordonné (ou cristal liquide). Le cholestérol affecte le comportement de la membrane autour de la température de transition, et permet un effet condensant des phospholipides à des températures supérieures à la transition vitreuse, réduisant leur mobilité45.
Il en résulte qu’en plus du ratio cholestérol:phospholipide, le type de molécule phospholipidique est un autre facteur à considérer dans la formulation d’un liposome. À titre d’exemple, Anderson et Omri46 se sont intéressés
à des formulations de DSPC, DPPC et DMPC. Ces phospholipides neutres se distinguent par la longueur de leur chaine alkyle (DSPC – 18 carbones, DPPC – 16 carbones, DMPC – 14 carbones). Les propriétés étudiées étaient le taux d’encapsulation ainsi que la cinétique de libération de la molécule cargo, l’inuline. Il a été constaté qu’à mesure que la température de transition du phospholipide augmentait, le liposome était plus stable. D’après les auteurs, cette stabilité est démontrée par une meilleure efficacité d’encapsulation et une plus lente libération du cargo.
Une autre exemple de l’effet des propriétés thermiques des phospholipides est rapporté dans une étude par MS Webb et al.47 dans un papier comparant des liposomes formés de DSPC ou de Sphingomyéline (SM) et du
cholestérol sur la base de leur stabilité in vitro et in vivo. La SM ayant une température de transition supérieure à celle du DSPC, la membrane formée est ainsi plus rigide. Comme dans l’étude précédente, il a été observé une libération plus prolongée de la molécule cargo ainsi qu’un temps de circulation plus prolongé pour les liposomes de SM. Cette différence de pharmacocinétique est expliquée par une meilleure rigidité de la membrane des liposomes de SM. En plus de la température de transition, la chimie du phospholipide affecte également son devenir. Dans cette même étude, il est observé que le liposome de SM est plus stable et circule plus longtemps car l’acide gras y est lié au glycérol par une liaison amide. Cette liaison est plus stable comparativement à la liaison ester de la phosphatidylcholine.
La charge de la tête polaire
En fonction des phospholipides les composant, les liposomes peuvent porter des charges positives, négatives ou neutres. La charge affecte premièrement la stabilité des liposomes du fait de la répulsion qui évite leur agrégation48 et précipitation49 in vitro. Le taux d’encapsulation des molécules chargées peut être augmenté en
dans laquelle l’effet de la charge du liposome sur le taux d’encapsulation de protéines négativement ou positivement chargées a été investigué. Des liposomes d’un diamètre autour de 200 nm ont été préparés avec 10 mol% de DOTAP (1,2-dioleoyl-3-trimethylammonium-propane) ou de DCP (dicetylphosphate). Ces liposomes portaient donc respectivement, des charges positives ou négatives. Quatre protéines cargos ont été encapsulées, trois d’entre elles portant une charge négative et une portant une charge positive. Pour toutes les molécules cargo, une augmentation significative du taux d’encapsulation lorsque le liposome portait une charge opposée à celle de la molécule cargo a été observée. Un autre exemple où la charge des liposomes joue un rôle pertinent est celui des lipoplexes, définis comme étant des complexes entre des liposomes chargés positivement et des polyélectrolytes chargés négativement (tel que l’ADN).
La charge des liposomes affecte également leur distribution dans l’organisme. Les liposomes portant une charge positive s’accumulent davantage au niveau du foie, de la rate, des poumons, et des cellules endothéliales des tissus tumoraux comparativement aux liposomes neutres, tandis que les liposomes anioniques augmentent l’accumulation des liposomes au niveau du foie et de la rate51. La charge des liposomes affecte également leur
temps de circulation comparativement aux liposomes neutres. Ceci dit d’après Drummond et al.52 et Bozzuto et
al.53 il n’existe pas de tendance globale décrivant le changement de la pharmacocinétique en fonction de la
charge du liposome. D’après Drummond, les liposomes ayant des charges différentes ont aussi des propriétés thermiques distinctes qui pourraient aussi influencer les différences rapportées.
La préparation des liposomes
Le choix de la méthode de préparation dépend de plusieurs facteurs parmi lesquels53,54 les propriétés
physicochimiques des liposomes et du milieu dispersant. D’autres facteurs comme la voie d’administration et la pharmacocinétique désirée peuvent aussi influencer les procédés de préparation.
La méthode de l’hydratation du film lipidique
La méthode la plus souvent utilisée est celle de l’hydratation d’un film lipidique. Il s’agit d’une technique simple et rapide, aussi appelée technique de Bangham55, qui consiste en la dissolution des lipides formant les
liposomes dans un solvant organique suivie par l’évaporation du solvant afin de former une fine couche de lipides. Le solvant organique doit avoir un point d’ébullition relativement bas, comme par exemple le méthanol et le chloroforme. Le film lipidique est hydraté par une phase aqueuse sous agitation constante, ce qui résulte en la formation de vésicules multilaméllaires. La molécule cargo est ajoutée à la solution organique dans laquelle sont dissouts les lipides si elle est lipophile ou bien à la phase aqueuse si elle est hydrophile.
La réduction et l’uniformisation de la taille des vésicules multilaméllaires se font par sonication et/ou par extrusion, tel qu’illustré à la figure 4. La sonication transmet une énergie mécanique aux vésicules causant leur
division en des vésicules de tailles inférieures. Plus la durée et l’intensité de la sonication sont élevées, plus les liposomes rétrécissent.56
L’extrusion consiste à forcer la suspension de liposomes à travers une membrane d’une taille de pores donnée par une différence de pression. Lorsque la taille du pore est inférieure à celle du liposome, la membrane phospholipidique se rompt et se réorganise en une vésicule d’une taille plus petite. Le diamètre des liposomes finaux dépend de la taille des pores de la membrane utilisée.57 Afin de faciliter le processus, des membranes
ayant des pores de taille décroissante peuvent être utilisées de manière séquentielle. Notons qu’en plus de réduire la taille des liposomes, ces traitements (la sonication et l’extrusion) diminuent également le taux d’encapsulation de la molécule cargo58,59.
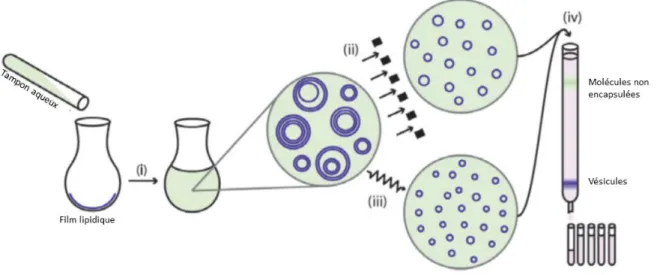
Figure 4 Illustration schématisant la fabrication des liposomes selon la technique de l'hydratation du film lipidique.60 (i) L’hydratation du film lipidique. (ii) Extrusion. (iii) Sonication. (iv) Purification par colonne d’exclusion de taille. Reproduite avec autorisation de la source.
La méthode de l’injection du solvant organique
Cette deuxième technique ne requiert pas la formation de film lipidique. Elle consiste d’abord en la dissolution des composants du liposomes dans une solution organique. La solution organique est par la suite injectée dans une phase aqueuse. Lorsque le solvant organique est miscible avec l’eau, dans le cas de l’éthanol par exemple, celui-ci diffuse dans l’eau et cause la précipitation spontanée des lipides sous formes de vésicules.61 Lorsque
le solvant organique est immiscible avec l’eau, tel que l’éther diéthylique, les phospholipides se placent alors à l’interface entre la phase organique et la phase aqueuse. La sonication permet de produire une émulsion, à partir de laquelle le solvant organique est évaporé formant ainsi des liposomes.62
La méthode de l’élimination du surfactant
Une troisième technique pour la préparation de liposomes consiste en la solubilisation des lipides par l’ajout de surfactants. Le surfactant est ensuite éliminé par dilution de la phase aqueuse, la chromatographie d’exclusion
stérique, et la dialyse54, et résulte en la formation de liposomes unilaméllaires. La taille des liposomes dépend
du type de détergent. Les détergents souvent utilisés sont le Triton X-100 et le Tween 20.
Les nanoparticules polymériques
Définition
Plusieurs polymères peuvent être utilisés pour permettre la fabrication de NPs aux propriétés physiques et chimiques variées. À titre d’exemple, l’utilisation de polymères dont les propriétés changent avec la chaleur15
ou le champ électrique16 ou un changement de pH17, permettent de préparer des NPs qui répondent à leur
environnement. Ceci permet en théorie une polyvalence structurelle et fonctionnelle infinie, s’adaptant à toutes les applications désirées en formulation pharmaceutique63, et a conséquemment suscité énormément d’intérêt
à un point tel qu’une recherche sur le moteur google scholar des deux mots clés « polymer » et « nanoparticle » retourne pas moins de 935 000 résultats.
Des NPs polymériques sont développées dans le but de vectoriser le principe actif, mais contrairement aux liposomes, il n’existe à ce jour aucun médicament exploitant cette approche qui soit commercialisé. La seule exception est le Genexol-PM, une formulation de micelles polymériques du principe actif paclitaxel, mis sur le marché uniquement en Corée du Sud.
Les types de nanoparticules polymériques
Il existe quatre types de NPs polymériques64 : les micelles polymériques, les polymersomes, les nanocapsules,
et les nanosphères. Les micelles ont typiquement une taille allant de 10 à 100 nm, et sont constituées de polymères amphiphiles dont le bloc hydrophobe forme le cœur de la NP tandis que le bloc hydrophile forme un enrobage hydraté en surface. Ces polymères forment spontanément des micelles lorsque leur concentration dépasse la concentration micellaire critique (CMC). Cette CMC est habituellement plus faible que celle des surfactants classiquement utilisés en formulation pharmaceutique tel que le Cremophor EL™ ou les polysorbates64, permettant aux micelles de maintenir leur structure après administration in vivo.
Les polymersomes sont des fabrications ressemblant essentiellement aux liposomes, et sont composés de polymères aux propriétés proches de celles des phospholipides et qui forment par autoassemblage une membrane ressemblant à la bicouche phospholipidique. Contrairement aux micelles, le cœur de ceux-ci est donc hydrophile, et peuvent servir à l’encapsulation et de molécules hydrophiles au sein du cœur aqueux et de molécules hydrophobes au sein de la membrane.
Les nanocapsules sont elles aussi des fabrications vésiculaires, à la différence que le cœur est constitué d’un volume lipidique dans lequel un cargo hydrophobe est dissout. Les nanosphères quant à elles sont essentiellement des particules solides dont le cœur est constitué d’une matrice de chaines polymériques
hydrophobes entrelacées. Il est également possible que ces chaines soient liées les unes aux autres par liaison covalente3.
Les types de polymères
Les exemple suivants sont des polymères biodégradables et fréquemment retrouvés dans la littérature65: l’acide
polylactique (PLA), l’acide polyglycolique (PGA), l’acide poly(lactique-co-glycolique) (PLGA), le chitosan, le Poly-ε-caprolactone (PCL), et les Poly-alkyl-cyano-acrylates (PAC). La sélection du polymère se fait selon les critères suivants : 1) La taille et les propriétés de surfaces désirées pour la NP, 2) les propriétés physiques et chimiques de la molécule cargo (sa solubilité et sa stabilité à titre d’exemple), 3) le degré et vitesse de biodégradation désirée des NPs, 4) la cinétique à laquelle le cargo doit être libéré. Parmi ces polymères, le PLGA est le plus utilisé et est considéré parmi les matériaux les plus adéquats pour la conception de nanomédicaments, car les produits de sa dégradation sont l’acide lactique et l’acide glycolique. Ces molécules sont des métabolites endogènes et sont métabolisées par le cycle de Krebs. Cela permet au PLGA d’être biocompatible. Le PLGA est par ailleurs utilisé comme excipient dans une variété de médicaments déjà approuvés par la FDA et l’EMA. De plus, du fait de sa fréquente utilisation, ce polymère est commercialement disponible dans une variété de ratios de monomères, de fonctionnalisations, et de poids moléculaires qui répondent aux normes BPF. Les BPF (ou bonnes pratiques de fabrication) sont un ensemble de directives édictées par les agences réglementaires (telles que la US-FDA ou l’EMA) et ayant pour but d’assurer la reproductivité des procédés de fabrication et la traçabilité du produit final.
Les molécules cargo encapsulées sont aussi variées que pour les liposomes. Elles vont des petites molécules hydrophiles ou hydrophobes jusqu’aux macromolécules tels que l’ADN ou les protéines. Dépendamment des propriétés du cargo et de la méthode de préparation des NPs ainsi que du type de NP polymérique, le cargo se situera soit au centre de la NP ou bien à sa surface, adsorbé ou couplé par liaison covalente.
Les techniques utilisées pour la préparation de nanoparticules polymériques
La préparation de NPs polymériques se fait selon trois catégories de méthodes : La dispersion de polymères préformés, la polymérisation de monomères, et la gélation ionique des polymères hydrophiles.La dispersion de polymères préformés est utilisée pour la formulation des NPs des polymères biodégradables tels que PLGA et PLA. Elle peut se faire par émulsion ou par déplacement de solvant (nanoprécipitation). La première consiste à dissoudre les polymères et la drogue à encapsuler dans un solvant organique non-miscible avec l’eau tel que le chloroforme ou l’acétate d’éthyle. Cette phase est émulsionnée dans l’eau par l’ajout d’un surfactant. Parmi les surfactants utilisés on retrouve le polyvinylalcool (PVA), le polysorbate-80, la gélatine, et le poloxamer 188. La taille des gouttelettes organiques stabilisées par le surfactant est réduite par homogénéisation ou par sonication. Par la suite, le solvant organique est éliminé par évaporation et les NPs
récupérées par centrifugation66. La taille obtenue dépend de l’intensité de la sonication ainsi que du type et de
la concentration des polymères et surfactants utilisés67.
Une deuxième technique pour la préparation de nanosphères ou nanocapsules à partir de polymères préformés est la technique du déplacement du solvant (aussi appelée nanoprécipitation). Cette technique ressemble à la précédente à la différence que le solvant utilisé est miscible avec l’eau. Lorsque la solution organique de drogue et de polymère est ajoutée à l’eau sous agitation constante, la diffusion du solvant organique dans l’eau amène les polymères à précipiter à l’interface des deux solvants et forment des nanoparticules en suspension. On peut également rajouter de l’huile dans la solution organique. Ceci aura pour effet de produire des nanocapsules au cœur huileux.68
Une troisième technique est la technique du « salting out ». Cette technique consiste premièrement en la préparation d’une solution organique d’un solvant miscible avec l’eau, tel que l’acétone. Une solution aqueuse est également préparée, celle-ci contient des sels insolubles dans la phase organique tels que le chlorure de magnésium ou l’acétate de magnésium ainsi qu’un surfactant. La concentration de sels doit être de 3 fois la concentration des polymères. La solution organique est rajoutée à la solution aqueuse et homogénéisée pour créer une émulsion. Contrairement à la nanoprécipitation, le solvant organique ne diffuse pas dans l’eau à cause de la concentration élevée de sels. Par la suite, la concentration des sels est réduite par le rajout d’eau pure à l’émulsion, permettant la diffusion du solvant organique et la précipitation du polymère sous forme de nanosphères. Les nanosphères sont par la suite purifiées par centrifugation ou par filtration.65
La technique de la gélation ionique des polymères hydrophiles est utilisée pour la préparation de NPs biodégradables à partir de polymères naturels tels que le chitosan, les alginates, la gélatine et l’agarose65
Cette technique se base sur la capacité des polyélectrolytes de former des nanoparticules en la présence de contre-ion. À titre d’exemple il est possible de préparer des NPs de chitosan sans l’utilisation de solvant organique par l’interaction des fonctions amine du chitosan chargées positivement avec les charges négatives du triphosphate de sodium.69 Le triphosphate de sodium agit comme agent de liaison, liant les chaines de
chitosan les unes avec les autres. Le chitosan est dissout dans une solution d’acide acétique, à cette solution est rajoutée le triphosphate de sodium goutte à goutte. Ceci permet l’obtention de NPs de chitosan par gélation ionique69.
La préparation de NPs par l’émulsion et la polymérisation consiste en la préparation d’une émulsion dans laquelle les gouttelettes dispersées dans la phase continue contiennent les monomères dissouts. L’émulsion peut être une émulsion H/E où l’initiateur est dissout dans l’eau si les monomères sont insolubles dans l’eau, ou bien E/H où l’initiateur est dissout dans la phase organique si les monomères sont hydrosolubles. L’émulsion est stabilisée par un surfactant ionique et/ou stérique car la taille des gouttelettes définit la taille des NPs, il est donc nécessaire de prévenir leur coagulation. Cette technique permet de préparer des NPs dont les chaines
polymériques sont liées les unes aux autres, une NP peut donc consister d’une seule molécule polymérique au très grand poids moléculaire. La taille des NPs fabriquées via cette technique peut varier de 50 à 500 nm.70
Les nanoparticules protéiques
Définition
Les NPs protéiques présentent l’avantage d’être biodégradables et faiblement immunogènes lorsqu’elles sont d’origine humaine et non dénaturées. Diverses protéines ont été exploitées pour la fabrication de NPs71, tels
que les protéines de lactosérum72, la gélatine73, le collagène74, la caséine75, et l’albumine76. Parmi ces protéines,
l’albumine est considérée comme une candidate idéale pour la fabrication de NPs véhiculant le principe actif en raison de sa capacité à lier les principes actifs, mais surtout de sa très grande abondance dans le plasma sanguin. Il existe divers types d’albumine en fonction de l’espèce dont elle est extraite. L’ovalbumine est une protéine de 47 kDa, extraite à partir des œufs, elle présente l’avantage d’être peu onéreuse du fait de son origine, mais elle est très immunogène. L’albumine bovine est une protéine de 69 kDa, d’origine bovine, elle est très largement utilisée comme protéine modèle en recherche pharmaceutique étant donné son faible coût. L’albumine humaine (abréviée HSA pour Human Serum Albumin) peut être préparée de manière recombinante et est une protéine de 66,5 kDa. Il s’agit de la protéine la plus abondante du plasma humain, et elle est particulièrement résistante aux altérations physiques tels que le changement de pH et l’augmentation de la température, la rendant adaptée aux techniques utilisées pour la préparation des NPs.
La préparation de nanoparticules protéiques
La préparation des NPs de protéines se fait selon 3 catégories de techniques, à savoir la désolvatation (ou la coacervation), l’émulsification, et la gélation thermique. La désolvatation consiste en l’addition à une solution aqueuse de protéines dans un solvant organique (tel que l’éthanol)77. Ceci réduit la solvatation des protéines et
cause leur précipitation, rendant la solution turbide. Afin que les protéines désolvatées forment des NPs stables, il est nécessaire qu’elles soient réticulées (signifiant liées les unes aux autres par liaisons covalentes). Ceci se fait par l’ajout de glutaraldéhyde qui va réagir avec les groupements amines primaires des protéines. La taille des NPs peut être ajustée en fonction des paramètres du procédé de fabrication tels que la quantité de l’agent désolvatant (l’éthanol) ainsi que le pH de la solution aqueuse. Les NPs sont par la suite purifiées par évaporation de l’éthanol et précipitation par centrifugation.
La technique de l’émulsification ressemble à celles décrites pour la synthèse de NPs polymériques. Elle consiste en la réduction de la taille par homogénéisation de gouttelettes aqueuses dans lesquelles est dissoute la protéine dispersée dans de l’huile ou dans un solvant non miscible à l’eau (tel que le cyclohexane). L’émulsion
est transformée par la suite en suspension colloïdale par dénaturation des protéines par la chaleur78,79 ou l’ajout
d’un agent de réticulation chimique comme le glutaraldéhyde80.
La fabrication par gélation thermique quant à elle consiste en l’application d’un traitement thermique (augmentation de la température) à une solution d’une ou de plusieurs protéines, sans émulsification ou précipitation par un antisolvant. Ceci cause le dépliement des protéines et favorise leurs interactions, les unes avec les autres, formant un gel81. Ce processus cause également la dénaturation des protéines, les rendant
potentiellement plus immunogènes.
Il est également possible de produire des NPs protéiques par l’atomisation d’une solution de protéines en des gouttelettes suffisamment petites pour être séchées et résulter en un précipité nanoparticulaire de taille avoisinant les 450 nm. Il existe une autre technique employée pour la fabrication de NPs protéiques nommée Nanoparticle Albumin Bound-technology ou nab-technology82. Celle-ci consiste en la dissolution de la drogue
dans une solution de chloroforme saturée d’eau et de la protéine dans une solution d’eau saturée de chloroforme. Le mélange des deux solutions est homogénéisé. Il en résulte une suspension colloïdale duquel le chloroforme est évaporé sans augmentation de la température, puis les NPs sont lyophilisées.
La drogue peut être incorporée aux NPs soit avant soit après leur formation par sa dissolution dans la solution aqueuse dans laquelle les NPs sont suspendues83–85. Cela aura pour effet de lier la drogue à la protéine par
interaction intermoléculaire non covalente jusqu’à saturation de tous les sites qui lient le principe actif au niveau des molécules de protéine. Lorsque la drogue est insoluble dans l’eau, elle est incorporée dans les NPs par sa dissolution dans la solution organique. Par exemple, lorsque les NPs sont fabriquées par désolvatation, la drogue est rajoutée à l’éthanol86.
Les NPs protéiques comprennent un nombre important de groupes réactifs (amines, acides carboxyliques et sulfhydriles des cystéines) qui permettent leur fonctionnalisation. Cette fonctionnalisation permet l’attachement du polyéthylène glycol (PEG), qui sera décrit dans la section suivante. Elle permet également le greffage de ligands pour le ciblage actif87, ou bien de polymères modifiant leurs propriétés de surface telles que la charge,88
ou la thermosensibilité.89
Les protéines thérapeutiques conjuguées au PEG
Il existe un autre type de système colloïdal basé sur les protéines : les conjugués protéines. Pour cette catégorie, les protéines ne sont pas une matrice véhiculant le principe actif mais plutôt le principe actif lui-même. Il s’agit des protéines conjuguées au polymère PEG. Cette catégorie de médicaments se situe à la limite entre les médicaments biologiques (tel que les anticorps monoclonaux) et les autres types de nanoparticules (tel que les nanoparticules polymériques ou les liposomes). La PEGylation, qui sera décrite dans la section suivante, améliore la stabilité enzymatique, prolonge la circulation plasmatique des protéines et amoindrit leur toxicité.
Da par protéine), le facteur de croissance granulocytaire humain recombinant PEGylé (dénommé Neulasta® et contient une seule chaine de PEG de poids moléculaire 20 kDa par protéine), et l’interféron alfa-2a PEGylé (dénommé Pegasys® et contient une seule chaine de PEG de poids moléculaire 40 kDa par protéine) sont des exemples de cette classe de nanomédicaments25.
La PEGylation des nanoparticules
La PEGylation désigne l’attachement du polymère hydrosoluble polyéthylène glycol aux NPs ou aux principes actifs. Le but de la PEGylation est de prolonger le temps de circulation des NP ou des principes actifs, de réduire leur immunogénicité et leur toxicité, d’éviter leur agglomération, et leur élimination par le système immunitaire. Le premier article ayant démontré l’intérêt de la PEGylation remonte à 1977 et a été publié par Abuchowski et al.90 Dans cette étude les auteurs ont couplé une enzyme au PEG de taille moléculaire égale à 1900 Da ou
5000 Da. Après leur administration in vivo, les enzymes PEGylées ont démontré, comparativement aux protéines non PEGylées, un pouvoir immunogène moindre et un temps de circulation plus élevé. Les enzymes PEGylées ont également retenu 95% de leur activité enzymatique. Celles couplées au PEG de taille moléculaire égale à 5000 Da étaient également insensibles à une digestion par la trypsine et la chymotrypsine. Le temps de circulation des protéines PEGylées est corrélé au poids moléculaire des chaines de PEG, car celles-ci augmentent le rayon hydrodynamique de la molécule et réduit conséquemment sa filtration glomérulaire.91
L’effet de la PEGylation sur le comportement des NPs in vitro et in vivo dépend du poids moléculaire des chaines de PEG, de leur nombre par unité de surface (densité), et de la nature du cœur hydrophobe des NPs.92 Dans
une étude par Mori et al.93 des liposomes contenant des phospholipides couplés à des PEG de poids
moléculaires de 5000 Da, 2000 Da et 750 Da ont été préparés. Il a été rapporté qu’en augmentant la longueur des chaines de PEG, le temps de circulation in vivo était rallongé et l’agrégation des liposomes in vitro était réduite. Dans une étude similaire par Perrault et al.94 des NPs d’or ont été utilisées, dont la taille varie de 10 à
100 nm et dont la taille moléculaire de PEG variait de 2 à 10 kDa. Dans cette étude, il a également été rapporté qu’à mesure que les chaines de PEG étaient plus longues, le temps de circulation des NPs était augmenté. Il a également été rapporté que la prolongation du temps de circulation par l’allongement des chaines de PEG était plus marquée pour les NPs les plus petites (10 nm) que pour les NPs les plus grandes (100 nm). Dans une autre étude, l’effet de la longueur de chaine de PEG sur l’interaction de NPs polymériques de PLA-PEG avec des macrophages in vitro a été étudié par Mosqueira et al.95 Il a été retrouvé que les NPs ayant une chaine de PEG
de 20 kDa étaient moins phagocytées que les NPs contenant un PEG de 5 kDa.
En plus de la longueur des chaines de PEG, leur nombre par unité de surface (déterminant la « densité de PEG ») est également un paramètre impactant le devenir des NPs PEGylées. À titre d’exemple, dans une étude par Paolo Zara et al.96 des NPs solide-lipide contenant des quantités croissantes d’acide stéarique couplé à un
PEG de 2 kDa ont été utilisées. Il a été rapporté, suite à leur administration chez le lapin, que le temps de circulation des NPs était corrélé au ratio molaire de phospholipide PEGylé, démontrant le rapport entre la densité de PEG et la pharmacocinétique des liposomes. Le contenu en PEG 2 kDa a également affecté la distribution des NPs dans les différents organes. Dans une étude par Qi Yang et al.97 l’effet de la densité de PEG sur
l’interaction des NPs PEGylées avec les macrophage a été étudié. Dans cette étude des NPs de polystyrène, rigides et non poreuses portant des fonctions carboxyliques à leur surface ont été utilisées. Les NPs ont été couplées par la réaction des fonctions carboxyliques avec des chaines de PEG portant des fonctions amines pour contrôler avec précision la quantité de PEG par unité de surface de chacun des lots de NPs. Il a été observé qu’à mesure que la densité de PEG augmente, le temps de circulation in vivo augmente et l’internalisation des NPs par les cellules immunitaires in vitro diminue. Selon les auteurs, le PEG en surface peut avoir une conformation en « champignon » (« mushroom conformation » en anglais) lorsque les chaines de PEG sont trop espacées ou en « brosse » (« brush conformation » en anglais) lorsque celles-ci sont assez rapprochées. La conformation en brosse dense est requise pour la prolongation de la circulation des NPs par la PEGylation. Dans une étude par Bertrand et al.98 l’importance de la densité de PEG sur la pharmacocinétique des NPs de
PLGA-PEG est démontrée. Dans cette étude, une série de NPs a été synthétisée de tailles égales à 55, 90 et 140 nm, et ayant une densité en PEG allant de 9 à 50 chaines de PEG par 100 nm². Il a été rapporté qu’à mesure que la densité de PEG augmente, le temps de circulation des NPs augmente jusqu’à ce qu’une valeur seuil égale à 20 PEG/100 nm² soit atteinte : au-delà de cette valeur, la demi-vie des NPs n’est plus prolongée davantage. Cette observation est inchangée pour les 3 catégories de taille des NPs (55, 90 et 140 nm) et chez 3 types de modèles animaux (souris Balb/c, souris C57Bl/6, et chez le rat). Il a également été rapporté que le seuil de 20 PEG/100 nm² est inférieur à celui décrit par l’étude précédemment citée de Qi Yang et al.97 et que
cette différence pourrait être due à l’hydrophobicité du cœur de polystyrène qui est supérieure à celle du PLGA. Tel que suggéré par la comparaison entre les deux précédentes études, le type de cœur hydrophobe enrobé par le PEG affecte le comportement des NPs qui ont une densité de PEG en surface égale. Dans une étude par Gref et al.99 des NPs polymériques ayant un cœur de PLGA, de PLA ou de PCL ont été synthétisées avec un
enrobage de PEG au poids moléculaire et de densité de PEG comparable. Il a été déterminé que la quantité et la nature des protéines s’adsorbant à ces NPs différaient, ce qui démontre l’effet des propriétés du cœur hydrophobe sur les NPs malgré une PEGylation égale.
Même s’il est considéré à ce jour comme le standard de choix des enrobage hydrophiles pour les nanomédicaments, compte tenu du succès clinique de plusieurs nanomédicaments exploitant ce matériau, le PEG présente des inconvénients. On remarque notamment que le temps de demi-vie des NPs PEGylées baisse après l’administration d’une première dose de liposomes PEGylés.100 Il s’agit du phénomène de clairance
production d’IgM dirigés contre le PEG.101 Ce phénomène pose problème car il affecte l’efficacité des
nanomédicaments PEGylés, À fortiori que des anticorps antiPEG ont été identifiés chez 25% de la population générale.102 De ce fait, plusieurs études ayant pour but de parvenir à une alternative au PEG ont été menées.103
Parmi ces molécules on cite le Poly(glutamic acid) (PGA), le Poly(hydroxyethyl-l-asparagine) (PHEA), le poly(hydroxyethyl-l-glutamine) (PHEG), qui sont des poly(acides aminés) biodégradables. Parmi les alternatives au PEG non biodégradables, on cite le polyglycerol (PG), le poly(2-methyl-2-oxazoline) (PMeOx), le polyacrylamide (PMMa), le Poly(vinylpyrrolidone) (PVP), et le Poly(N-(2-hydroxypropyl)methacrylamide) (PHPMA).
La couronne de protéines
Définition
Le corps humain est caractérisé par la présence d’une diversité de molécules dissoutes au sein des fluides biologiques, des protéines, des ions et d’autres solutés de faible poids moléculaire104. Lorsque les
nanoparticules sont administrées in vivo, les molécules du milieu s’y adsorbent et forment une « bio-couronne » ou « couronne » de protéines. Cette couronne de protéines affecte la façon avec laquelle les NPs interagissent avec le reste des constituants de l’organisme et leur confèrent une « identité biologique » qui contraste avec « l’identité synthétique » que les nanoparticules avaient avant la formation de la couronne de protéines105. Cette
couronne de protéines a été observée dans plusieurs types de nanoparticules, parmi lesquelles les liposomes106, les nanoparticules polymériques98,107, les nanoparticules d’or108, les points quantiques109, les
nanotubes de carbone110, les nanoparticules de silice111. On peut supposer que le même phénomène est
observable pour la quasi-totalité des types de nanoparticules lorsque celles-ci se retrouvent dans des solutions de protéines. Notons que bien que la majorité des papiers traitant de l’interaction des nanoparticules avec le milieu biologique fassent référence à la couronne de « protéines », cette couronne contient également des carbohydrates112 et des lipides113. Beaucoup de ces études utilisent des nanoparticules modèles comme des
particules de polystyrène, de silice ou de métal qui sont assez distinctes des nanomédicaments optimisés pour une utilisation in vivo. Les deux sections qui suivent abordent les facteurs pouvant influencer la composition de la couronne de protéines et l’influence potentielle de celle-ci sur le devenir des nanoparticules. En troisième partie, nous aborderons des études plus récentes analysant la couronne de protéines de nanoparticules ayant une pertinence clinique et qui remettent en question quelques conclusions des sections précédentes.