Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées
Institut de chimie des milieux et matériaux de Poitiers - IC2MP (Diplôme National - Arrêté du 7 août 2006)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Chimie des matériaux
Présentée par : Ludovic Potet
Synthèse, propriétés et utilisations d'hydrures métalliques (alane AlH3) comme additifs pour la propulsion spatiale
Directeur(s) de Thèse :
Laurence Pirault-Roy, Yann Batonneau Soutenue le 05 décembre 2014 devant le jury Jury :
Président Christophe Coutanceau Professeur des Universités, Université de Poitiers Rapporteur Denis Autissier Docteur ingénieur, CEA, Le Ripault
Rapporteur Jean-Louis Bobet Professeur des Universités, Université de Bordeaux Membre Laurence Pirault-Roy Professeur des Universités, Université de Poitiers Membre Yann Batonneau Maître de conférences, Université de Poitiers Membre Charles Kappenstein Professeur émérite, Université de Poitiers Membre Émilie Labarthe Docteur, CNES de Paris
Membre Guy Jacob Expert synthèse, Herakles, Vert-le-Petit
Pour citer cette thèse :
Ludovic Potet. Synthèse, propriétés et utilisations d'hydrures métalliques (alane AlH3) comme additifs pour la
propulsion spatiale [En ligne]. Thèse Chimie des matériaux. Poitiers : Université de Poitiers, 2014. Disponible sur
THESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
Faculté des Sciences Fondamentales et Appliquées
Diplôme National - Arrêté du 7 août 2006
École Doctorale :
Sciences pour l’Environnement Gay-Lussac
Secteur de Recherche : Chimie des Matériaux
Présentée par :
Ludovic POTET
Maître ès Sciences
*********************************
Synthèse, propriétés et utilisations d’hydrures métalliques
(alane AlH
3) comme additifs pour la propulsion spatiale
*********************************
Directrice de thèse : Laurence PIRAULT-ROY Codirecteur de thèse : Yann BATONNEAU
********************************* Soutenue le 5 décembre 2014 *********************************
JURY
Rapporteurs Jean-Louis BOBET Professeur, Université de Bordeaux Denis AUTISSIER Ingénieur/Chercheur, CEA Le Ripault Examinateurs Laurence PIRAULT-ROY Professeure, Université de Poitiers
Yann BATONNEAU Maître de Conférences, Université de Poitiers Charles KAPPENSTEIN Professeur émérite, Université de Poitiers Christophe COUTANCEAU Professeur, Université de Poitiers
Émilie LABARTHE Ingénieure/docteure, CNES, Direction des lanceurs
REMERCIEMENTS
Ce travail de thèse a été réalisé à l’Institut de Chimie des Milieux et Matériaux de Poitiers (IC2MP, UMR CNRS 7285) et plus précisément au sein de l’équipe « du Site Actif au Matériau Catalytique » (SAMCat). À cet égard, je remercie Sabine PETIT directrice de l’institut ainsi que Florence EPRON et Boniface KOKOH, responsables de l’équipe.
Je tiens tout d’abord à remercier Laurence PIRAULT-ROY, professeure de l’Université de Poitiers et Yann BATONNEAU, maître de conférences à l’université de Poitiers, pour avoir codirigé ces travaux et pour leurs nombreux conseils, leur disponibilité et la confiance qu’ils m’ont porté tout au long de cette thèse.
Je souhaite aussi remercier Jean-Louis BOBET, professeur à l’université de Bordeaux, ainsi que Denis AUTISSIER, ingénieur/chercheur au CEA du Ripault pour avoir accepté d’être les rapporteurs de ce manuscrit et Christophe COUTANCEAU, professeur à l’université de Poitiers de me faire l’honneur d’être membres de mon jury.
Mes remerciements s’adressent particulièrement à Émilie LABARTHE, ingénieure/docteure ainsi que Philippe SUPIE, chef de projet R&T, à la direction des lanceurs du CNES, et Guy JACOB, expert synthèse/docteur chez Herakles pour leur suivi et leurs nombreux conseils lors des réunions qui ont été d’une grande aide dans la réalisation de ces travaux.
J’exprime ma reconnaissance envers le CNES et Herakles pour avoir financé cette thèse et ainsi me permettre de réaliser un rêve d’enfant en travaillant pour le domaine de l’aérospatial.
Je remercie également Charles KAPPENSTEIN, professeur émérite à l’université de Poitiers, pour son aide précieuse et ses conseils avisés ainsi que Rachid BRAHMI, professeur, pour nos échanges scientifiques et sa sympathie.
Je remercie vivement Stève BARANTON, maître de conférences à l’université de Poitiers, pour son aide et ses conseils sur la réalisation du plan d’expériences.
Je souhaite remercier le pôle commun de mesures physiques pour leur aide et la réalisation des analyses physico-chimiques et plus particulièrement Sandrine pour son aide en DRX et pour toutes les analyses de mes échantillons.
Merci à Patrick pour nos nombreuses discussions et pour son aide sur les montages et autres pompes dans le laboratoire.
Je remercie également Michel et Claude pour la réalisation de ma presse ainsi que Jean-Jacques et Claude pour les réparations de verrerie.
J’adresse un grand merci à tous les enseignants que j’ai pu rencontrer pour les connaissances qu’ils m’ont transmises et pour le métier formidable qu’ils exercent.
Je tiens à remercier toute l’équipe SAMCat et bien sûr mes collègues doctorants qui ont rendu ces trois années inoubliables. Merci à Micka (entraîne toi un peu plus aux jeux je suis fatigué de te battre), Anna, Mélissandre, Mathias (coupe moi ces cheveux !), Soizic (idem), Saïd, Romain, Fatima, Vanessa, Davina, Carmen et Nelly avec qui j’ai partagé cette période intense de la rédaction. Je remercie également Eloi qui a partagé mon bureau pendant deux ans pour nos nombreuses discussions et son amitié. Merci à Maïté, ma stagiaire lors de ma première année qui m’a bien aidé dans l’avancement de ces travaux. Et pour ceux qui n’ont pas encore fini leur thèse je vous souhaite bon courage !
Je remercie mes amis K-fétard, Lionel, Maxou, Trigger, Guytan, Nico, Adri, BenH, Romain, Tommog, Branjon pour leur amitié et pour tous ces moments magiques que nous avons passés depuis toutes ces années. Merci à vous les gars !
Merci à tous mes amis poitevins, Benoit, Nadine, Romain, Angèle (x2), Titi, Julien, Vincent, Greg, Théo (nous aussi on sait ^^), Mélanie et Romain. Merci pour ces instants inoubliables qui me feront regretter de quitter le Poitou.
Bien sûr une grosse pensée à Sparky, ce chat qui me rend fou mais que j’adore !
Je remercie profondément toute ma famille pour m’avoir soutenu et permis d’en arriver là. Je remercie également ma belle-famille, Marco, Patrick et bien sûr belle maman, Florence, pour leur soutien pendant cette thèse, pour tous ces moments (tous les repas inoubliables ^^) et pour votre sympathie. Encore Merci !
Enfin je tiens à remercier celle qui est à mes côtés et m’a soutenu pendant ces moments difficiles. Merci de m’avoir supporté et de continuer à le faire, merci pour tous ces instants. Merci Maïté d’être là, tout simplement.
Table des matières
INTRODUCTION GÉNÉRALE ... 1
CHAPITRE 1 : ÉTAT DE L’ART... 5
1 Présentation ... 7
1.1 Propulsion solide ... 7
1.2 Propulsion hybride ... 9
2 Analyse théorique de la performance des hydrures en propulsion solide et hybride 10 2.1 Propulsion solide ... 11
2.2 Propulsion hybride ... 14
2.3 Conclusion ... 16
3 L’hydrure d’aluminium ... 17
3.1 Propriétés structurales et cristallographiques ... 17
3.1.1 Phase α ... 18 3.1.2 Phase α’ ... 23 3.1.3 Phase β ... 25 3.1.4 Phase γ ... 28 3.1.5 Autres phases ... 32 3.2 Propriétés physico-chimiques ... 33 3.2.1 Propriétés physiques ... 33 3.2.2 Propriétés thermodynamiques ... 34 3.3 Synthèse ... 36
3.3.1 Méthode classique avec deux solvants organiques ... 37
3.3.2 Processus continu ... 41
3.3.3 Synthèse mécano et thermochimique ... 42
3.3.4 Méthode électrochimique ... 44
3.3.5 Autres méthodes chimiques ... 46
3.3.7 Conclusion ... 53
4 Stabilité et stabilisation de l’alane ... 53
4.1 Couche d’oxyde ... 54
4.2 Stabilisation par lavage ... 54
4.3 Stabilisation à l’aide d’additif ... 55
4.4 Stabilisation par traitement de surface ... 57
4.5 Additif pour la cristallisation ... 58
4.6 Taille des particules ... 58
4.7 Conditions de stockage ... 59
4.8 Conclusion ... 60
5 Discussion ... 60
CHAPITRE 2 : PARTIE EXPÉRIMENTALE ... 67
1 Montage ... 69
1.1 Rampe double vide-argon ... 69
1.2 Verrerie ... 73
1.3 Distillation de l’éther ... 73
1.4 Presse pour synthèse thermochimique ... 76
2 Mode opératoire ... 78
2.1 Liste des réactifs ... 78
2.2 Synthèse avec toluène ... 79
2.2.1 Préparation des réactifs ... 79
2.2.2 Préparation du mélange réactionnel ... 80
2.2.3 Préparation du mélange éther-toluène et filtration ... 81
2.2.4 Distillation du mélange éther – toluène et cristallisation de l’alane α ... 83
2.2.5 Lavage ... 83
2.3 Synthèse sans toluène ... 84
2.3.1 Préparation des réactifs ... 84
2.3.3 Cristallisation de l’alane éthéré ... 86
2.3.4 Traitement thermique ... 86
2.3.5 Lavage ... 86
2.4 Synthèse sous presse ... 87
2.4.1 Préparation des réactifs ... 87
2.4.2 Mise sous presse et traitement thermique ... 87
2.4.3 Lavage ... 89
3 Techniques de caractérisation ... 90
3.1 Titrage par la méthode de Karl Fischer ... 90
3.1.1 Principe ... 90
3.1.2 Appareillage ... 92
3.1.3 Préparation des échantillons ... 92
3.2 Analyse élémentaire par spectrométrie d’émission optique couplée à un plasma inductif (ICP-OES) ... 93
3.2.1 Principe ... 93
3.2.2 Appareillage ... 93
3.2.3 Préparation des échantillons ... 94
3.3 Microscopie électronique à transmission (MET) ... 94
3.3.1 Principe ... 94
3.3.2 Appareillage ... 95
3.3.3 Préparation des échantillons ... 95
3.4 Microscopie électronique à balayage ... 96
3.4.1 Principe ... 96
3.4.2 Appareillage ... 96
3.4.3 Préparation des échantillons ... 96
3.5 Analyse thermogravimétrique (ATG) ... 96
3.5.1 Principe ... 96
3.5.2 Appareillage ... 97
3.5.3 Préparation des échantillons ... 97
3.6 Diffraction des rayons X ... 97
3.6.1 Principe ... 97
3.6.3 Préparation des échantillons ... 100
3.7 Stabilité volumétrique ... 101
3.7.1 Principe ... 101
3.7.2 Appareillage ... 102
3.7.3 Préparation des échantillons ... 102
CHAPITRE 3 : ÉTUDES PRÉLIMINAIRES ... 105
1 Pureté des réactifs et des solvants ... 107
1.1 Analyse par la méthode de Karl Fischer de l’éther diéthylique ... 107
1.2 Analyse cristallographique des réactifs LiAlH4 et AlCl3 ... 109
2 Mesure de solubilités ... 110
2.1 Solubilité du tétrahydruroaluminate de lithium LiAlH4 ... 111
2.2 Solubilité du chlorure d’aluminium AlCl3 ... 111
2.3 Solubilité du chlorure de lithium LiCl ... 111
2.4 Solubilité du borohydrure de lithium LiBH4 ... 112
2.5 Solubilité du chlorure de magnésium MgCl2 ... 112
2.6 Solubilité de l’alane éthéré AlH3∙nEt2O ... 112
2.7 Solubilité de l’alane α ... 112
2.8 Conclusion ... 113
3 Validation de la linéarité, limite de détection et de quantification du bore en solution aqueuse par ICP-OES ... 113
3.1 Préparation de la gamme d’étalonnage ... 113
3.2 Validation de la linéarité ... 114
3.3 Établissement de la fonction d’étalonnage linéaire ... 114
3.4 Évaluation de la linéarité ... 115
3.5 Interprétation ... 116
3.6 Résultats de la linéarité ... 116 3.7 Détermination de la limite de détection et de quantification à partir de la linéarité
4 Influence de la vitesse de montée en température en ATD-ATG ... 118
CHAPITRE 4 : SYNTHÈSE AVEC TOLUÈNE ... 123
1 Rappel des résultats de W. Cong [1] ... 125
1.1 Analyse par diffraction des rayons X ... 125
1.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 126
1.3 Analyse de la morphologie par microscopie à balayage ... 127
1.4 Conclusion ... 127
2 Reproductibilité de la synthèse avec toluène ... 128
2.1 Analyse par diffraction des rayons X sur poudre ... 128
2.2 Analyse thermogravimétrique sous argon ... 129
2.3 Conclusion ... 130
2.4 Synthèses réalisées au Centre de Recherche du Bouchet (CRB) ... 131
2.5 Caractérisation de l’échantillon n°1 ... 131
2.5.1 Analyse par diffraction des rayons X ... 131
2.5.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 132
2.6 Caractérisation de l’échantillon n°2 ... 134
2.6.1 Analyse par diffraction des rayons X ... 134
2.6.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 135
2.6.3 Conclusion ... 135
3 Étude de la nitruration de l’alane ... 136
3.1 Analyse thermogravimétrique (ATD-ATG) sous azote I de l’échantillon n°1 synthétisé au CRB ... 136
3.2 Analyse thermogravimétrique (ATD-ATG) sous azote I de l’échantillon n°2 synthétisé au CRB ... 138
3.3 Analyse thermogravimétrique (ATD-ATG) de phase α pure sous azote I ... 139
3.4 Analyse thermogravimétrique (ATD-ATG) sous azote alphagaz 2 d’alane α pur jusqu’à 900 °C ... 140
3.6 Analyse thermogravimétrique couplée à un spectromètre de masse (ATD-SM)
d’alane α sous azote alphagaz 2 ... 143
3.7 Conclusion ... 145
4 Discussion ... 145
CHAPITRE 5 : SYNTHÈSE SANS TOLUÈNE ... 149
1 Rappel des résultats obtenus par W. Cong [1] ... 151
1.1 Analyse par diffraction des rayons X ... 151
2 Synthèse en augmentant la température et la durée du traitement thermique ... 152
2.1 Analyse par diffraction des rayons X ... 153
2.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 154
2.3 Analyse par diffraction des rayons X de l’alane après analyse thermique jusqu’à 400 °C ... 155
2.4 Caractérisation par microscopie à balayage ... 156
2.5 Conclusion ... 157
3 Synthèse en réduisant la durée du traitement thermique ... 158
3.1 Analyse par diffraction des rayons X ... 158
3.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 160
3.3 Conclusion ... 162
4 Synthèse avec un rapport molaire LiAlH4/AlCl3/LiBH4 : 4/1/1 ... 162
4.1 Analyse par diffraction des rayons X ... 162
4.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 164
4.3 Conclusion ... 165
5 Synthèse en conservant le ballon utilisé pendant l’évaporation de l’éther pour le traitement thermique ... 165
5.1 Analyse par diffraction des rayons X ... 166
5.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 167
6 Synthèse avec prélèvement pendant le traitement thermique ... 169
6.1 Analyse par diffraction des rayons X ... 169
6.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 171
6.3 Conclusion ... 173
7 Synthèse avec mesure de la vitesse d’évaporation de l’éther dans un bain d’huile à 25 °C ... 174
7.1 Analyse par diffraction des rayons X ... 175
7.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 177
7.3 Conclusion ... 178
8 Synthèse avec un lavage avant le traitement thermique ... 179
8.1 Analyse par diffraction des rayons X ... 179
8.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 182
8.3 Conclusion ... 182
9 Synthèse avec une baisse accidentelle de la température pendant le traitement thermique ... 183
9.1 Analyse par diffraction des rayons X ... 183
9.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 185
9.3 Caractérisation par microscopie à balayage MEB ... 187
9.4 Bilan matière. Dosage du lithium et du bore ... 188
9.5 Conclusion ... 191
10 Stabilisation de l’alane ... 191
10.1 Stabilisation par lavage avec une solution acide ... 191
10.1.1 Analyse par diffraction des rayons X ... 192
10.1.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 193
10.1.3 Analyse par microscopie électronique à balayage ... 194
10.1.4 Conclusion ... 195
10.2 Stabilisation par lavage avec une solution contenant de l’aluminon ... 195
10.2.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 198
10.2.3 Conclusion ... 201
10.3 Stabilisation par ajout de chlorure de magnésium MgCl2 ... 201
10.3.1 Analyse par diffraction des rayons X ... 202
10.4 Analyse thermogravimétrique (ATD-ATG) sous argon ... 203
10.4.1 Analyse élémentaire par ICP-OES ... 204
10.4.2 Analyse par microscopie électronique à balayage ... 204
10.4.3 Conclusion ... 206
11 Ensemencement ... 207
11.1 Ensemencement avec de l’alane α ... 207
11.1.1 Analyse par diffraction des rayons X ... 207
11.1.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 208
11.1.3 Observation par microscopie électronique à balayage ... 209
11.1.4 Conclusion ... 210
11.2 Ensemencement avec du chlorure de magnésium, MgCl2 ... 211
11.2.1 Analyse par diffraction des rayons X ... 211
11.2.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 212
11.2.3 Analyse par microscopie électronique à balayage ... 213
11.2.4 Bilan matière ... 215
11.2.5 Test de stabilité réalisé au CRB (Herakles) ... 217
11.2.6 Conclusion ... 218
12 Synthèse avec un pied de cuve de dodécane ... 219
12.1 Analyse par diffraction des rayons X ... 219
12.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 220
12.3 Conclusion ... 222
13 Transfert technologique au CRB ... 222
13.1 Synthèse n° 1 ... 222
13.1.1 Analyse par diffraction des rayons X ... 222
13.1.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 223
13.1.3 Conclusion ... 224
13.2.1 Analyse par diffraction des rayons X ... 225
13.2.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 226
13.2.3 Conclusion ... 227
13.3 Synthèse n° 3 avec ajout des réactifs solides directement dans l’éther ... 228
13.3.1 Analyse par diffraction des rayons X ... 228
13.3.2 Analyse thermogravimétrique (ATD-ATG) sous argon ... 230
13.3.3 Conclusion ... 231
14 Discussion ... 232
CHAPITRE 6 : SYNTHÈSE SÈCHE DE L’ALANE ... 237
1 Principe d’un plan d’expériences... 239
2 Étude préliminaire ... 239
2.1 Détermination de la variation de température à l’issue d’une synthèse ... 240
2.2 Étude thermodynamique de la réaction de synthèse de l’alane sans solvant ... 242
3 Détermination de l’objectif du plan d’expériences ... 243
4 Choix des facteurs influents pendant la synthèse ... 243
5 Résultats du plan d’expériences ... 246
5.1 Présentation des analyses ... 246
5.1.1 Influence du rapport molaire ... 246
5.1.2 Influence de la durée de réaction ... 248
5.1.3 Influence de la pression exercée sur les réactifs ... 249
5.1.4 Influence de la température de réaction ... 250
5.1.5 Etude du plan d’expériences complet ... 252
5.1.6 Discussion sur les effets des facteurs ... 254
5.1.7 Discussion sur les interactions entre les facteurs ... 256
5.2 Vérification de la reproductibilité et de la linéarité des facteurs ... 257
5.3 Études complémentaires sur les réactifs et le produit de la réaction ... 259
5.3.1 Caractérisations par diffraction des rayons X des réactifs et produits de réaction 259 5.3.2 Caractérisation par microscopie électronique à transmission ... 264
5.3.3 Influence du lavage ... 267
CONCLUSION GÉNÉRALE ... 273 ANNEXES ... 281
1
3
La conquête spatiale est un rêve que l’Homme commence tout juste à réaliser. Pour cela, il utilise de gigantesques fusées qui lui permettent de s’échapper de l’attraction de la Terre. Cependant, les premières fusées n’étaient pas destinées à nous envoyer dans l’espace mais à assurer une suprématie en période de guerre. Leur histoire commence en 1232 lors de la bataille de Kai-Keng. Les Chinois utilisèrent des projectiles mus par propulsion à poudre contre les Mongols. Le vol spatial sera ensuite très largement amélioré et utilisé pendant la seconde guerre mondiale avec la mise au point des fusées V2 et le pilonnage de Londres. Toutefois, il aura fallu attendre la fin du XIXème siècle pour que le russe Tsiolkovsky suggère pour la première fois d’utiliser des ergols liquides, à savoir l’hydrogène liquide et l’oxygène liquide, pour des fusées dont le but serait la conquête spatiale. La course aux étoiles menées par les Soviétiques et les Américains durant la guerre froide a marqué une accélération nette des recherches et des découvertes dans ce domaine dont le premier homme dans l’espace (1961) et la conquête de la Lune (1969). L’utilisation massive de fusées et satellites a engendré de nombreux progrès en matière de propulsion notamment pour la mise au point des systèmes de propulsion mais aussi pour varier la nature des ergols. En effet, la société moderne s’appuie largement sur l’espace : explorations de la Lune, de Mars, du système solaire, des comètes mais aussi pour la communication, l’observation civile ou militaire, les prévisions météorologiques, le système de géolocalisation ou de navigation... Toutes ces technologies ayant recours aux satellites ont transformé ce rêve de conquête spatiale en réalité quotidienne. Il ne reste désormais plus que le développement du tourisme dans l’espace pour mettre les étoiles à la portée de chacun d’entre nous. La composition d’un ergol est un facteur clé dans les performances en propulsion. Un des moyens d’améliorer celles-ci est d’ajouter un additif énergétique dans la composition. Ainsi, l’énergie délivrée au cours de la réaction chimique sera augmentée et donc la quantité de gaz formés.
L’additif étudié dans ces travaux de thèse est l’hydrure d’aluminium AlH3 ou alane. Cet
additif peut être ajouté dans la composition de l’ergol en complément de l’aluminium ou pour le remplacer complètement.
La réaction 1 d’oxydation de l’hydrure d’aluminium est la suivante :
2 𝐴𝑙𝐻3(𝑠) + 3 𝑂2(𝑔) → 𝐴𝑙2𝑂3(𝑠) + 3 𝐻2𝑂(𝑔) (1)
Cette réaction possède une enthalpie de réaction égale à ΔrH° = -2378 kJ∙mol-1 contre
4
2 𝐴𝑙(𝑠) +32 𝑂2(𝑔) → 𝐴𝑙2𝑂3(𝑠) (2)
L’oxydation de l’hydrure d’aluminium est donc plus énergétique et permet de libérer de l’hydrogène qui vient s’ajouter aux autres gaz dans la chambre de combustion. Ces deux points permettent d’améliorer d’environ 10 % les performances en propulsion solide et d’environ 15 % en propulsion hybride. Ce qui rend l’alane particulièrement attractif pour ce type d’applications.
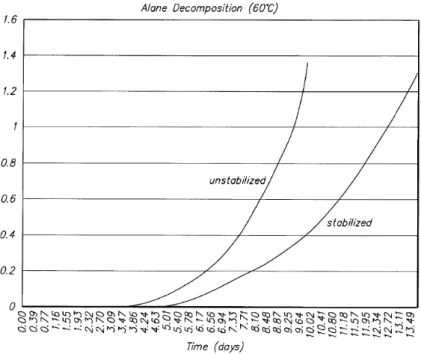
Malheureusement, la synthèse de l’hydrure d’aluminium est relativement complexe. De plus, elle nécessite d’importantes quantités de solvant et une grande pureté des réactifs ce qui la rend onéreuse. C’est pourquoi actuellement la production d’alane se limite à quelques grammes par synthèse. Enfin, un additif de propergol doit également pouvoir être stocké sur une longue période sans se dégrader. La stabilité de l’hydrure d’aluminium est un facteur essentiel qui conditionne son utilisation en propulsion.
Les travaux de cette thèse ont donc comme objectif de simplifier la synthèse de l’alane tout en préservant une qualité de produit acceptable pour son utilisation en propulsion spatiale, de réduire les coûts de production et enfin d’améliorer sa stabilité afin de limiter sa dégradation au cours du temps.
Le premier chapitre dressera l’état de l’art concernant les différents modes opératoires connus pour sa synthèse et les caractéristiques physico-chimiques de l’alane. Ensuite, les différentes voies de synthèses développées au cours de cette thèse ainsi que les techniques de caractérisations utilisées seront présentées dans une partie expérimentale. Les quatre chapitres suivant traiteront des résultats obtenus ainsi que du raisonnement mis en œuvre afin d’optimiser la synthèse et la stabilité de l’hydrure d’aluminium. Deux voies de synthèse seront principalement étudiées, une voie « humide » avec une réduction de 25 % de la quantité usuelle de solvant et une voie dite « sèche » réalisée à l’aide d’une presse et optimisée par la mise en place d’un plan d’expériences. L’ensemble des résultats obtenus sera résumé dans la conclusion générale.
5
7
1
Présentation
L’hydrure d’aluminium en tant qu’additif peut être utilisé pour les propulsions solide et hybride. La première partie de ce chapitre sera consacrée à une présentation de ces différentes technologies de propulsions ainsi qu’au gain théorique de la poussée apporté par l’utilisation de l’alane. Ensuite, les propriétés (cristallographique, thermodynamique, …) de l’alane seront présentées. Enfin, un bilan des différentes méthodes de synthèses connues sera réalisé.
1.1 Propulsion solide
La propulsion solide est un type de propulsion chimique utilisant un propergol. Un propergol
est un corps ou un ensemble de corps dont la réaction chimique, sans intervention de l’oxygène de l’air, donne naissance à la libération d’une grande quantité d’énergie, à un fort volume de gaz chauds et permet par exemple d’entretenir le mouvement d’un engin autopropulsé (Herakles). Ainsi, pour la fusée Ariane 5, le propergol est situé dans les deux
étages d’accélération à poudre (EAP) de part et d’autre de l’engin comme le montre la Figure 1. Les EAP fournissent 90 % de la poussée au décollage, sont haut de 27,3 m et pèsent chacun 270 t dont 238 t de propergol solide [1].
8
La Figure 2 représente le schéma d’un moteur de fusée ou moteur à propergol solide. Les gaz produits par la décomposition du propergol vont ensuite se détendre à travers la tuyère et ainsi créer la poussée qui va permettre la mise en mouvement de la fusée selon le principe de l’action et de la réaction défini par Newton.
La propulsion solide est utilisée dans le domaine du spatial mais également dans le domaine de la défense pour les missiles tactiques et stratégiques. En effet, le gros avantage de la propulsion solide est sa relative facilité de mise en œuvre mais également sa capacité de stockage sur le long terme ce qui est essentiel pour les missiles qui, lorsqu’ils sont utilisés, le sont parfois des années après leur fabrication.
Figure 2 : Architecture d’un moteur à propergol solide (Herakles)
Les performances d’un propulseur dépendent avant tout de la composition du propergol. Dans le cas d’Ariane 5, le propergol est un propergol composite constitué d’une matrice polymère servant de combustible, appelée liant, d’un oxydant solide sous forme de poudre et d’un métal réducteur également sous forme de poudre. Le liant polymère sert à assurer une bonne cohésion et une bonne tenue mécanique du mélange. L’espèce oxydante est généralement le perchlorate d’ammonium NH4ClO4 (68 %), le liant est un dérivé du polybutadiène, le PBHT
(14 %, polybutadiène hydroxytéléchélique) et le réducteur ou combustible est de l’aluminium (18 %).
Dans un premier temps, la réaction 3 d’oxydoréduction entre l’ion ammonium et l’ion perchlorate est observée.
9
Puis, le dioxygène formé lors de la réaction 3 réagit avec l’aluminium suivant la réaction 4.
4 𝐴𝑙(𝑠) + 3 𝑂2(𝑔) → 2𝐴𝑙2𝑂3(𝑠) (4)
La réaction 4 est très exothermique et permet d’augmenter la température des gaz formés et ainsi d’augmenter la poussée. Le PBHT va également réagir avec une partie de l’oxygène formé par la réaction 3 selon la réaction 5.
−[𝐶𝐻2− 𝐶𝐻 = 𝐶𝐻 − 𝐶𝐻2]−𝑛(𝑠) +112 𝑛𝑂2(𝑔) → 4𝑛𝐶𝑂2(𝑔) + 3𝐻2𝑂(𝑔) (5)
1.2 Propulsion hybride
La propulsion hybride utilise un moteur qui fonctionne avec des ergols à la fois liquide et solide contenus dans deux réservoirs distincts. Ce type de moteur présente ainsi les avantages des propulseurs liquides et solides. Il est en effet plus simple à mettre en œuvre et plus sûr qu’un moteur à ergol liquide. De plus, contrairement à un moteur à ergol solide, la poussée du moteur peut être régulée ou interrompue. La Figure 3 représente le schéma d’un propulseur hybride.
Figure 3 : Schéma d’un propulseur hybride [3]
Dans un propulseur hybride, l’oxydant, sous forme liquide de préférence, est stocké dans un réservoir pressurisé qui est séparé du propergol. Une vanne et un système d’injection permettent de mettre en contact le comburant liquide ou gazeux avec le propergol dans la chambre de combustion qui est, dans le cas le plus simple, un canal cylindrique percé. Ensuite, comme pour la propulsion solide, une tuyère permet la détente et augmente la vitesse d’éjection des gaz et donc augmente aussi la poussée.
10
2
Analyse théorique de la performance des hydrures en
propulsion solide et hybride
Maggi et al. ont étudié les performances de différents hydrures, dont l’alane, en propulsion hybride et en propulsion solide [4]. L’hydrogène est régulièrement choisi pour les systèmes propulsifs. Il est habituellement utilisé à l’état liquide en dessous de 21 K et à une pression de 1 bar. L’utilisation d’hydrures peut être une alternative comme méthode de stockage plus sécuritaire, plus dense et plus simple que le stockage cryogénique. La Figure 4 montre la densité de stockage de l’hydrogène de plusieurs hydrures en comparaison avec l’hydrogène liquide, LH2 [4]. L’hydrure ayant la plus haute densité en hydrogène est l’alane, AlH3, qui
possède une densité d’hydrogène deux fois plus élevée que l’hydrogène liquide LH2.
Figure 4 : Densité de stockage de l’hydrogène dans différents hydrures par rapport à l’hydrogène liquide LH2 [4]
Depuis les années 60, les hydrures ont été étudiés comme additifs pour la propulsion spatiale car ils permettent d’augmenter significativement l’impulsion spécifique et réduire l’agglomération métallique souvent observée avec l’aluminium. Malheureusement, certains hydrures sont incompatibles avec les réactifs usuels utilisés en propulsion spatiale (oxydant ou liant polymère) [4]. L’impulsion spécifique Is, définie selon l’équation 6, joue un rôle important dans la comparaison des performances d’un système propulsif.
11
𝐼𝑠 = 𝑞 × 𝑔𝐹 (6)
Avec Is = impulsion spécifique (s)
F = la poussée (N)
q = débit massique d’éjection des gaz (kg s-1)
g = accélération de la pesanteur (m s-2)
L’impulsion spécifique (Is) indique la durée pendant laquelle un kilogramme de propergol produit une poussée correspondant au poids exercé par une masse de 1 kg. Donc, plus l’Is est élevée, plus le système propulsif est performant. La masse volumique d’un ergol est un facteur aussi important que l’impulsion spécifique. L’impulsion volumique est définie comme le produit de ces deux grandeurs selon l’équation 7.
𝐼𝑣 = 𝐼𝑠 × 𝜌 (7)
Avec Iv = impulsion volumique (s g cm-3)
Is = impulsion spécifique (s)
ρ = masse volumique de l’ergol (g cm-3
)
2.1 Propulsion solide
Le Tableau 1 compare les impulsions spécifiques et volumiques des différents additifs par rapport à un mélange optimal de propergol uniquement constitué de perchlorate d’ammonium PA et de PBHT.
12
Tableau 1 : Comparaison des Is et Iv selon les différents additifs. Les compositions sont données en pourcentage massique. L’ergol de base pour la comparaison est uniquement constitué de PA
et de PBHT [4]
Additif Ratio massique
PA/Add/PBHT Is (s) Iv × 10 5 (s g cm-3) Base de l’ergol 89/0/11 274,3 4,76 Al 67/22/11 287,8 5,28 AlH3 62/28/10 310,7 5,05 LiAlH4 60/30/10 307,7 4,14 Li3AlH6 61/29/10 290,6 4,29 B10H14 75/15/10 287,7 4,42 MgH2 57/33/10 289,8 4,61 LiH 87/3/10 276,1 4,65 Mg(BH4)2 60/30/10 293,8 4,08 LiBH4 59/31/10 294,0 3,36
Le tableau 1 met en évidence que l’hydrure d’aluminium AlH3 permet d’obtenir les
meilleures performances en impulsion spécifique suivi de près par LiAlH4. Cependant,
l’impulsion volumique est plus faible qu’avec l’aluminium du fait de la faible masse volumique de seulement 1,49 g cm-3 pour AlH3 contre 2,70 g cm-3 pour l’aluminium. Malgré
la baisse de l’impulsion volumique, l’alane reste l’additif le plus intéressant car il améliore le plus l’impulsion spécifique tout en diminuant le moins l’impulsion volumique. L’augmentation des performances en propulsion solide en comparaison avec la base de l’ergol sans additif est présentée sur la Figure 5. En comparaison avec la base de l’ergol, l’ajout de AlH3permet d’augmenter les performances de plus de 10 %.
13
Figure 5 : Comparaison de l’amélioration de l’impulsion spécifique et de l’impulsion volumique entre les différents additifs normalisés par rapport à l’ergol de base uniquement constitué de PA
et de PBHT avec un ratio massique de 89/11 [4].
Le ratio massique de l’additif dans la formulation du propergol joue un rôle important dans le gain de performance. La Figure 6 représente le gain de performance obtenu pour des proportions massiques d’additif allant de 5 à 30 % dans le propergol. Les données sont normalisées par rapport à l’ergol de base constitué uniquement de PA et de PBHT [4].
14
Figure 6 : Gain de performance sur l’impulsion spécifique en fonction du rapport massique d’additif dans le propergol normalisé par rapport à un mélange constitué uniquement de PA et
PBHT [4]
Avec une proportion massique de 30 % en hydrure d’aluminium AlH3, le gain sur l’impulsion
spécifique est supérieur à 10 % par rapport au mélange de référence constitué de perchlorate d’ammonium et de PBHT. Cet hydrure permet aussi d’améliorer les performances quel que soit le rapport massique considéré en comparaison des autres hydrures.
2.2 Propulsion hybride
Dans la propulsion hybride, l’oxydant est sous forme liquide, par exemple l’oxygène liquide, et le réducteur sous forme solide mélangé avec un liant tel que le PBHT. La même comparaison que pour la propulsion solide peut être réalisée. Le Tableau 2 compare les impulsions spécifiques et volumiques des différents additifs par rapport à un mélange optimal de propergol uniquement constitué de PBHT. Le rapport massique entre l’oxydant et le réducteur (fuel) O/F est également indiqué [4].
15
Tableau 2 : Composition optimale pour l’ergol en propulsion hybride afin d’obtenir la meilleure impulsion spécifique. Les compositions sont données en fraction massique. L’ergol de base pour
comparaison est uniquement constitué de PBHT [4]
Additif % massique d’additif O/F Is (s) Iv × 10 5 (s g cm-3) Pur PBHT 0 2,2 323,6 3,43 AlH3 64 1,0 340,5 4,00 LiAlH4 77 0,9 333,4 3,38 B10H14 63 1,9 334,8 3,56 Mg(BH4)2 90 1,3 336,4 3,59 LiBH4 90 2,0 342,5 3,20
Les additifs LiH, MgH2, Al et Li3AlH6n’ont pas été retenus car ils réduisent trop l’impulsion
volumique. En outre, la composition optimale obtenue est proche d’une composition contenant seulement du PBHT [4]. En se focalisant uniquement sur l’impulsion spécifique, le gain est relativement faible, il n’est que de 5 % environ. Par contre, le gain sur l’impulsion volumique est de l’ordre de 15 % avec l’hydrure d’aluminium AlH3. Ces performances sont
présentées sur la Figure 7 normalisées par rapport à une formulation ne comprenant que du PBHT.
Figure 7 : Comparaison des performances optimales en impulsion spécifique Is et en impulsion volumique Iv de différents hydrures utilisés comme additif en propulsion hybride normalisées par rapport à une formulation ne contenant que du PBHT avec un rapport massique O/F = 2,2
16
Comme pour la propulsion solide, la proportion massique des additifs allant de 5 à 30 % est testée afin de comparer le gain en performance par rapport à un ergol constitué seulement de PBHT [4]. Les résultats de cette comparaison sont visibles sur la Figure 8.
Figure 8 : Gain de performance sur l’impulsion spécifique en fonction du pourcentage massique d’additif dans l’ergol normalisé par rapport à un mélange constitué uniquement de PBHT [4] Dans cette comparaison, l’alane permet d’obtenir le gain le plus élevé en impulsion spécifique parmi tous les hydrures testés. De plus, ce gain s’accroît avec la quantité d’alane utilisé.
2.3 Conclusion
Cette étude a permis de comparer les performances en impulsion spécifique Is et en impulsion volumique Iv de différents hydrures comme additif pour les propulsions solide et hybride. L’alane apparaît comme l’hydrure le plus intéressant pour augmenter l’impulsion spécifique, quel que soit le type de propulsion. La densité de l’additif étant un critère important pour obtenir une impulsion volumique élevée, seuls l’aluminium et l’hydrure d’aluminium augmentent les performances en propulsion solide. Il est important de noter que cette étude
17
est purement théorique et ne tient pas compte de la difficulté de mise en œuvre de la formulation de l’ergol ni des compatibilités entre les différents composés.
Cependant, ces résultats de performances expliquent pourquoi l’alane a été et est toujours étudié pour des applications en propulsion.
3
L’hydrure d’aluminium
L’hydrure d’aluminium (AlH3) ou alane est un matériau très important et une espèce
chimique fascinante qui a motivé une recherche scientifique et technologique considérable durant les cinquante dernières années. En raison de sa haute densité d’énergie, AlH3 est
devenu un composé prometteur pour différentes applications comme additifs énergétiques pour les ergols solides, comme agent réducteur ou comme source d’hydrogène pour les piles à combustibles basses températures [5].
L’alane est un matériau solide cristallin de couleur blanche, métastable à température ambiante. Il présente une capacité de stockage volumique d’hydrogène deux fois plus importante que l’hydrogène liquide (148 g L-1
contre 71 g L-1) et sa capacité de stockage massique est de 10 %. La recherche militaire sur l’hydrure d’aluminium date des années 60 avec la première synthèse de la phase α par les États-Unis, notamment par la société Dow Chemical, et aussi par l’U.R.S.S.
À ce jour, au moins sept phases d’alane sont connues, mais seule la structure des phases α et γ a été déterminée et affinée. La structure des autres phases n’est pas connue et nécessiterait des travaux de recherche plus fondamentaux. L’expérience montre que la stabilité thermique et la facilité de préparation de l’alane dépend fortement de sa pureté. La phase α hexagonale représente la phase la plus stable, mais la présence d’impuretés ou d’humidité affecte fortement sa stabilité. Cet état de l’art présente les recherches portant sur la synthèse de la phase α et des autres polymorphes, sur leurs structures cristallographiques et leurs propriétés physico-chimiques.
3.1 Propriétés structur ales et cristallographiques
L’hydrure d’aluminium non solvaté présente sept variétés cristallographiques différentes : α, α’, β, γ, δ, ε et ζ [6]. Chacune de ces phases a des propriétés physico-chimiques différentes et sera décrite ci-après. La phase β est produite conjointement avec la phase γ et les deux sont
18
métastables. Ensuite, au cours d’un traitement thermique, elles se transforment en phase α qui est la plus stable. Ce sont les conditions du traitement thermique, température et durée, qui permettront la formation de la phase α plutôt que de se limiter aux phases γ et β [7]. Les phases δ et ε sont formées lorsque des traces d’eau et d’impuretés sont présentes lors de la cristallisation. Enfin, le polymorphe ζ est préparé par cristallisation en présence du di-n-propylène [8].
Petrie et al. indiquent que les phases α’, δ, ε et ζ ne se convertissent pas en α-alane et sont moins stables que ce dernier [9]. Cependant, Lund et al., suggèrent malgré tout la possibilité que la phase α’ puisse se transformer en phase α par chauffage ou pendant la distillation de l’éther [10]. Sartori et al. confirment cette hypothèse en 2008 par des mesures de calorimétrie différentielle à balayage (DSC) en observant la transformation de α’ vers α à des températures supérieures à 80 °C [11].
3.1.1 Phase α
C’est en 1969 que Turley et al. déterminent par diffraction des neutrons et des rayons X sur poudre la structure de la phase α [12]. La fiche PDF (powder diffraction file) provenant de l’ICDD (International Centre For Diffraction Data) de la phase α porte le numéro suivant : 00-23-761. Dans la base de données ICSD (Inorganic Crystal Structure Database), sa fiche porte le numéro 98-001-5225. La structure de l’alane α est présentée sur les Figures 9 et 10.
19
a)
b)
Figure 9 : a) Structure de la phase α hexagonale en projection (100), les nombres entiers correspondent au douzième des coordonnées selon l’axe z [12] et b) en perspective [13]
H 12 8,8 8 6 7 5 4 4,4 0
20
Figure 10 : Structure de la phase α en projection (001). Les nombres entiers correspondent au douzième des coordonnées des atomes selon l’axe z [12]
0,6,12 1,5,9 3,7,11 3,7,11 2,8 1,5,9 1,5,9 3,7,11 3,7,11 3,7,11 4,10 4,10 1,5,9 0,6,12 0,6,12 0,6,12 1,5,9 1,5,9 3,7,11 3,7,11 2,8 2,8 0,6,12 1,5,9 3,7,11 1,5,9 3,7,11 3,7,11 3,7,11 3,7,11 1,5,9 4,10 1,5,9 0,6,12 1,5,9 0,6,12 1,5,9
21
Elle possède une symétrie hexagonale, son groupe d’espace est R3̅c (Z = 6) avec des paramètres de maille a = 4,449 Å et c = 11,804 Å. Le Tableau 3 présente les paramètres atomiques alors que le Tableau 4 présente les distances et les angles de liaisons de la structure de la phase α.
Tableau 3 : Coordonnées atomiques de α-AlH3 [12]
Atome x y z Biso sof Position de
Wyckoff
Al 0 0 0 1,000 1,000 6b
H 0,628 0 0,250 1,000 1,000 18e
Tableau 4 : Distances interatomiques (Å) et angles de liaison (°) pour α-AlH3 [12]
Atomes Distances Atomes Distances Atomes Angles
Al6-H7 1,715 H5-H7 2,418 Al6-H5-Al4 141,2 H7-Al8 1,715 H5-H7’ 2,418 H5-Al6-H7 89,6 Al6-Al8 3,236 H5-H7’’ 2,587 H3-H7-H11 172,5 Al6-Al4 3,236 H5-H3 2,418 H5-H7’-H5’ 60,4 Al6-Al6 4,449 H5-H3’ 2,418 H7’-H5’-H5 59,8 Al6-Al12 5,902 H5-H3’’ 2,587 H5’-H5-H7’ 59,8 H5-H5’ 2,434
Les noms des atomes sont précisés sur les Figure 9 et Figure 10.
La structure de la phase α présente un empilement de plan d’aluminium et d’hydrogène suivant l’axe Z. Chaque aluminium est coordonné à six hydrogènes : trois dans le plan supérieur et trois dans le plan inférieur comme le montre la Figure 9. Le volume de la maille AlH3 est de 202,34 Å3 et les plus petites distances sont 1,715 Å (Al-H), 2,418 Å (H-H) et
3,236 Å (Al-Al) [12, 14]. Il est intéressant de noter que la géométrie d’une couche d’aluminium est équivalente à celle de l’aluminium métallique Al (cubique faces centrées), mais l’hydrure d’aluminium est deux fois moins dense que l’aluminium (1,49 g cm-3
22
2,69 g cm-3). L’hydrogénation de l’aluminium métallique augmente la distance interatomique de 2,86 Å à 3,24 Å dans AlH3 augmentant ainsi le volume de la maille de plus de 100 %. Les
octaèdres de coordination s’enchaînent selon les sommets, formant une structure tridimensionnelle comme le montre la Figure 11.
a) b)
Figure 11 : Structure d’un cristal de α-AlH3. La maille est présentée à gauche a) et la connectivité des octaèdres est présentée à droite b) [14].
La Figure 12 présente deux clichés de microscopie électronique à balayage (MEB) de cristaux de la variété α de l’alane qui présente une morphologie hexagonale prismatique ou rhombohédrique.
23
Figure 12 : Morphologie de la phase α de l’hydrure d’aluminium a) [15], b) [16]
3.1.2 Phase α’
En 2006, Brinks et al. utilisent les rayons X et les neutrons pour déterminer la structure de la phase α’ [14]. Celle-ci est orthorhombique avec le groupe d’espace Cmcm (Z = 12) et de paramètres de maille : a = 6,470 Å, b = 11,117 Å et c = 6,562 Å. Le volume de la maille est de 471,98 Å3. La structure de la phase α’ est présentée en Figure 13. La fiche PDF de la phase α’-AlH3 a la numérotation 00-34-1436. La fiche ICSD pour α’-AlD3 porte le numéro
98-024-5325.
24
Le Tableau 5 présente les coordonnées atomiques de la phase α’ tirées de la fiche ICSD n° 98-024-5325 concernant la structure α’-AlD3d’après les travaux de Brinks et al. et le Tableau 6
référence les distances interatomiques ainsi que les angles des liaisons de la structure [14].
Tableau 5 : Coordonnées atomiques pour α’-AlD3 (fiche ICSD : 98-024-5325)
Atomes x y z Biso Sof Position de
Wickoff Al1 0 0 0 1,1000 1,0000 4a Al2 0,250 0,250 0 1,1000 1,0000 8d D1 0,298 0,223 0,250 2,5000 1,0000 8g D2 0 0,035 0,250 2,5000 1,0000 4c D3 0,312 0,400 0,047 2,5000 1,0000 16h D4 0 0,303 0,049 2,5000 1,0000 8f
Tableau 6 : Distances interatomiques (Å) et angles de liaisons (°) pour α’-AlD3 [14]
Atomes Distances
Al-D 1,68 1,73
D-D 2,31
Al-Al 3,216
Atomes Angles
Dans le plan ab Dans la direction c
Al-D-Al 134,93 140,3 150,50 153,31
La structure de la phase α’ est constituée d’octaèdres AlD6 où tous les atomes de deutérium
sont répartis entre deux octaèdres formant ainsi une structure comprenant des canaux de 3,9 Å de diamètre comme le montre la Figure 14 [14].
25
Figure 14 : Interconnexion des octaèdres dans la structure de la phase α’-AlH3 [14]
La Figure 15 représente un cliché MEB de cristaux de la phase α’ qui possède une morphologie radiée en « pelote d’épingles ».
Figure 15 : Morphologie de cristaux de la phase α’ de l’alane [16]
3.1.3 Phase β
La structure de la phase β a été résolue en 2007 par Brinks et al. par diffraction des rayons X et des neutrons [17]. La structure cristalline est cubique avec le groupe d’espace Fd3̅m (Z =
26
16) et un paramètre de maille a = 9,0037 Å. La structure est représentée sur la Figure 16. Le volume d’une maille est de 729,97 Å3
. La fiche PDF de la phase β-AlH3 a pour référence
00-38-756 et sa fiche ICSD porte le numéro 98-015-6310.
Figure 16 : Structure de la phase β-AlH3 [13]
Le Tableau 7 présente les coordonnées atomiques d’après la fiche ICSD 98-015-6310 et le Tableau 8 indique les distances interatomiques ainsi que les angles de la structure β-AlD3.
Tableau 7 : Coordonnées atomiques de la phase β-AlD3 (fiche ICSD 98-015-6310)
Atomes x y z Biso Sof Positions de
Wyckoff
Al 0 0 0 1,1900 1,0000 16c
27
Tableau 8 : Distances interatomiques (Å) et angles de liaison (°) de la structure cristalline β-AlD3 [17] Atomes Distances Al-D 1,712 D-D 2,358 2,482 Al-Al 3,183 Atomes Angles au sein de l’octaèdre AlD6 D-Al-D 87,07 92,93 179,99 180,00 Al-D-Al 136,83
La Figure 17 représente la structure de la phase β-AlD3 qui consiste en un enchaînement
d’octaèdres reliés par leur sommet et formant une structure avec des canaux de 3,9 Å de diamètre comme pour la phase α’.
Figure 17 : Enchaînement des octaèdres AlD6 dans la structure de la phase β-AlD3 [17] La phase β possède une morphologie difficilement identifiable par microscopie électronique (MEB) comme le montre la Figure 18.
28
Figure 18 : Morphologie de l a phase β de l’hydrure d’aluminium [16]
Il est intéressant de noter que Ke et al., par une étude théorique, ont identifié la structure de deux polymorphes (orthorhombique Cmcm et cubique Fd3̅m) possédant une enthalpie libre et une enthalpie de formation plus faible que la phase α et donc a priori plus stable thermodynamiquement que celle-ci [18]. Ces deux polymorphes ont les caractéristiques (groupe d’espace et paramètres de maille) identiques aux phases α’ et β mais la réalité montrent qu’elles sont moins stables que l’alane α.
3.1.4 Phase γ
La structure de la phase γ présentée sur la figure 19 a été déterminée par Yartys et al. en 2007 et également par Brinks et al. par diffraction des rayons X sur poudre [19], [20]. La structure cristalline est orthorhombique, de groupe d’espace Pnnm (Z = 6) avec les paramètres de maille suivants : a = 5,3806 Å, b = 7,3555 Å et c = 5,77509 Å [19]. Le volume de la maille est de 228,6 Å3. La fiche PDF de la phase γ-AlH3 est numérotée 00-38-757 et la fiche ICSD de
29
Figure 19 : Structure de γ-AlH3 [13]
Le Tableau 9 présente les coordonnées atomiques de la structure et le Tableau 10 donne les distances interatomiques et les angles de liaisons. Les numéros des atomes sont ceux portés sur la Figure 20.
Tableau 9 : Coordonnées atomiques de la phase γ [19]
Atomes x y z Biso Positions de Wyckoff Al1 0 0 0,5 1,27 2b Al2 0,7875 0,0849 0 0,40 4g H1 0 0,5 0,5 2,0 2d H2 0,626 0,278 0 2,0 4g H3 0,094(2) 0,130 0 2,0 4g H4 0,762 0,078 0,309 2,0 8h
30
Tableau 10 : Distances interatomiques (Å) et angles de liaison (°) dans la structure cristalline de la phase γ-AlH3 [19]
Atomes Distances Atomes Distances Atomes Angles
Al1-4Al2 3,1679 Al2-H1 1,668 Al1-H4-Al2 124,9
Al1-4H4 1,784 Al2-H2 1,664 Al1-H2-Al2 171,0
Al1-2H2 1,769 Al2-H3 1,68 Al2-H1-Al2 180,0
Al2-2Al1 3,1679 Al2-H3 1,70 Al2-H3-Al2 100,7
Al2-Al2 2,606 Al2-2H4 1,790
Figure 20 : Interconnexion des octaèdres dans la structure γ-AlH3 [16]
La Figure 20 met évidence deux types d’octaèdres AlH6, Al1H22H44 et Al2H1H2H32H42
ainsi que leur interconnexion dans la structure γ-AlH3 [19]. Un double pont, Al2-2H3-Al2, et
un pont Al1-H4-Al1 sont présents. Pour Al1, toutes les distances Al-H sont d’environ 1,78 Å. Pour Al2, la distance axiale Al-H est elle aussi de 1,78 Å. Les hydrogènes du double pont H-2Al-H forment des liaisons avec une distance plus courte 1,68 et 1,72 Å. Cette proximité résulte d’une interaction atomique entre les deux Al2 séparés par seulement 2,606 Å contre
31
3,1679 Å entre Al1 et Al2 et un angle de pont hydrogène plus faible de seulement 101 ° contre 125 ° pour les autres ponts.
Les octaèdres Al1D6 ne partagent qu’un sommet avec six octaèdres Al2D6. Les octaèdres Al2D6 sont connectés avec trois autres octaèdres Al1D6 (un par une arête et deux par un sommet) et avec deux Al2D6 (un par une arête et un par un sommet) comme le montre la Figure 21.
Figure 21 : a) Structure de la phase γ-AlD3 [16], détail de la coordination des octaèdres Al1D6 b) et des octaèdres Al2D6 c) [20]
Un cliché de microscopie électronique à balayage de cristaux de γ-AlH3 est présenté sur la
Figure 22 et met en évidence une morphologie en aiguille selon l’axe c.
Figure 22 : Morphologie de γ-AlH3 par image MEB [16]
Brower et al. indiquent que des images de la phase γ en lumière polarisée mettent en évidence une multitude de petites aiguilles poussant d’un centre et formant des « paquets flous »[6].
32
Une autre phase proche de la phase γ a été obtenue lors des travaux de thèse de W. Cong est nommée γ’ [15]. Le diffractogramme de cette phase possède des pics ayant les mêmes positions en 2 θ mais avec des intensités relatives différentes. La présence d’orientations préférentielles lors de l’enregistrement de diffractogrammes semble pourtant exclue.
3.1.5 Autres phases
Bien qu’il n’y ait aucune information sur les structures des phases δ, ε et ζ il existe des fiches PDF d’après les travaux de Brower et al. [6]. Les numéros de ces fiches sont : δ (00-38-758), ε (00-38-759) et ζ (00-38-760).
Récemment, Goncharenko et al. ont étudié par diffraction des rayons X, deux nouvelles phases de l’hydrure d’aluminium sous haute pression [21]. Pour une pression de 72 GPa [21] ou 64 GPa [13] la phase α se transforme en une première phase hp1 de groupe d’espace P63/m
et de paramètre de maille a = 5,3845 Å et c = 2,4840 Å [13]. Dans cette première phase, la coordination de l’aluminium passe de 6 à 9 [13]. Ensuite, vers 110 GPa selon Goncharenko [21] et vers 104 GPa selon Vajeeston [13], une deuxième phase hp2 cubique métallique de l’alane se forme caractérisée par un groupe d’espace Pm3̅n avec pour paramètre de maille a = 3,0768 Å [13]. Les distances H-H sont de 1,54 Å et sont les plus courtes de tous les hydrures métalliques connus. La plus courte distance connue auparavant était celle du NdNiInD1,19 de
valeur 1,56 Å [22], exception faite de la molécule H2 [21]. Chaque aluminium est ici
coordonné avec 12 atomes d’hydrogène. Cette phase est supposée supraconductrice. Les structures des phases hp1 et hp2 sont visibles sur la Figure 23.
a) b)
Figure 23 : a) Structure de la phase hp1, b) structure de la phase hp2 [13]
Un résumé des plus courtes distances Al-H et Al-Al dans les différents hydrures est présenté dans le Tableau 11 [16].
33
Tableau 11 : Distances Al-H et Al-Al dans les différents hydrures (Å)
Liaisons Al métallique
α-AlH3
α’- AlH3 β- AlH3 γ- AlH3 AlH4- AlH6-
Al-Al 2,86 3,24 3,22 3,183 2,61-3,17 - > 3 Al-H 1,75 (tétra) 2,02 (octa) 1,72 1,68 (Al-D) 1,712 (Al-D) 1,66-1,79 1,61-1,63 1,75-1,77
Les distances entre les atomes d’aluminium sont relativement identiques au sein des différentes phases de l’alane malgré des structures cristallines très différentes. Par contre, la distance Al-Al est plus importante dans l’alane que dans l’aluminium métallique. La distance Al-H est similaire dans les différentes phases de l’alane et dans l’aluminium métallique en considérant un site tétraédrique.
3.2 Propriétés physico-chimiques
3.2.1 Propriétés physiques
La masse molaire de l’hydrure d’aluminium AlH3 est de 30,005 g mol-1.
Les masses volumiques des différentes phases de l’alane d’après les fiches ICSD sont présentées dans le Tableau 12.
Tableau 12 : Masses volumiques des phases de l’alane calculées d’après les fiches ICSD
α-AlH3 (98-001-5225) α’-AlD3 (98-024-5325) β-AlD3 (98-015-6310) γ-AlH3 (98-024-9407) Masse volumique (g cm-3) 1,48 1,31 1,20 1,31
34
3.2.2 Propriétés thermodynamiques
La phase α de l’aluminium se décompose en aluminium et en dihydrogène selon la réaction endothermique 8 :
𝛼 − 𝐴𝑙𝐻3(𝑠) → 𝐴𝑙(𝑠) + 32 𝐻2(𝑔) (8)
Des études calorimétriques ont permis de déterminer l’enthalpie de formation de la phase α, celle-ci est d’environ ΔfH0 = -10 kJ mol-1 [23], [7], [24]. La variation d’entropie lors de
formation est estimée à ΔfS = 130,7 J mol-1 K-1 et celle de l’enthalpie libre à ΔfG298 K =
48,5 kJ mol-1 [7]. Les phases α’, β et γ sont moins stables que la phase α-AlH3 et se
transforment selon un processus exothermique en phase α à des températures proches de 100 °C [7], [25], [11]. Les enthalpies de transition de phase sont les suivantes : 1,6 kJ mol-1 AlH3
(α’ α) ; 1,5 kJ mol-1
AlH3 (β α) et 2,8 kJ mol-1 AlH3 (γ α) [7], [11]. Par contre, à des
températures plus basses, une décomposition suivant la réaction 9 due à l’instabilité de ces polymorphes a été observée.
𝛾 − 𝐴𝑙𝐻3(𝑠) → 𝐴𝑙(𝑠) + 32 𝐻2(𝑠) (9)
Un bilan de ces valeurs thermodynamiques est présenté dans le Tableau 13.
Tableau 13 : Enthalpie de transformation ΔtransfHavec leur température Ttransf pour les phases α’,β et γ vers la phase α. Enthalpie de formation ΔH1 pour la réaction Al + 3/2 H2 AlH3 avec sa
température T1. Enthalpie totale de formation ΔHtotale ainsi que l’enthalpie libre ΔG298 K = ΔHtotale - T ΔS avec ΔS = 130,7 J mol-1 K-1 [11], [7]
Phase de l’alane ΔHtransf / kJ mol-1 Ttransf / °C ΔH1 / kJ mol-1 T1 / °C ΔHtotale / kJ mol-1 ΔG298 K / kJ mol-1 α-AlH3 - - -9,9 162,1 -9,9 48,5 α’-AlH3 1,6 132,0 - 146,1 - - β-AlH3 1,5 91,0 -9,5 157,1 -8,0 50,5 γ-AlH3 2,8 100,7 -9,9 158,3 -7,1 51,4
Graetz et al. ont réalisé une étude calorimétrique différentielle à balayage (DSC) pour caractériser les phases α, β et γ [26]. La Figure 24 résume cette étude et met en évidence la
35
décomposition endothermique de la phase α à 170 °C ainsi que les transformations exothermiques des phases β et γ aux environs de 100 °C.
Figure 24 : DSC des phases α, β et γ [26]
Une étude de diffraction des rayons X in situ de Maehlen et al. met en évidence la transformation de la phase γ en phase α [27]. Ils montrent également que 60 % de la phase γ se décompose en aluminium selon la réaction 9 et les 40 % restant se transforment en phase α puis se décomposer aussi en aluminium comme le montre la Figure 25 [16], [27].
Figure 25 : a) DRX in situ de la phase γ pour une plage de température comprise entre 50 et 105 °C et b) le taux de transformation de la phase γ en phase α et de la phase γ en aluminium
36
Graetz et al. ont réalisé une étude cinétique sur la décomposition des phases α, β et γ [28]. Ils ont ainsi pu déterminer les énergies d’activation de ces trois polymorphes qui sont égales à 102 kJ mol-1(α-AlH3), 92 kJ mol-1(β-AlH3) et 79 kJ mol-1(γ-AlH3) [28].
Une étude de Young et al. montre que la diffusion de l’hydrogène dans l’aluminium métallique est relativement rapide [29]. Le coefficient de diffusion de l’hydrogène dans l’aluminium est calculé selon l’équation 10 [29]
𝐷 = 1,75 × 10−4exp [−𝐸
𝑅𝑇] (10)
où E = 16,2 ± 1,5 kJ mol-1. À 140 °C environ, le coefficient de diffusion est d’environ 1 × 10-6 cm2 s-1 [29], ce qui suggère un temps de diffusion de l’ordre de quelques secondes pour un cristal de l’ordre de 100 μm [16].
3.3 Synthèse
La première description de la synthèse de l’alane apparaît dès 1942 dans un article de Stecher et Wiberg, synthèse réalisée à partir de l’alane complexé par une amine AlH3·2N(CH3)3 [30].
En 1947, Finhold et al. préparent une solution éthérée d’hydrure d’aluminium à partir de tétrahydruroaluminate de lithium LiAlH4 et de chlorure d’aluminium AlCl3 dans du
diéthyléther, Et2O (réaction 11) [31].
3 𝐿𝑖𝐴𝑙𝐻4+ 𝐴𝑙𝐶𝑙3 Et2O
→ 4 𝐴𝑙𝐻3 ∙ 𝑛𝐸𝑡2𝑂 + 3 𝐿𝑖𝐶𝑙 (11)
Les publications, jusqu’en 1955, mentionnaient que l’éther ne pouvait pas être éliminé de l’alane éthéré sans perdre également de l’hydrogène. Or, en 1955, Chizinsky synthétise la forme non solvatée de AlH3en préparant dans un premier temps une solution d’alane éthéré
filtrée dans du pentane puis séchée pendant 12 h [32]. Selon Bulychev et al., l’alane éthéré obtenu par cette réaction présente une composition proche de AlH3∙0,25Et2O [33]. Le résultat
de cette synthèse n’a été identifié que bien plus tard, en 1976, par Brower et al. comme étant la phase γ de l’alane [6].
Après les années 50, il n’y a que très peu de publications relatant la synthèse ou l’étude de l’hydrure d’aluminium. Puis dans les années 70, l’alane connaît un regain d’intérêt et un grand nombre de brevets est déposé par les États-Unis, au travers d’une collaboration entre l’Air Force et la société Dow Chemical, mais aussi par l’U.R.S.S. En 1976, Brower et al., de
37
la société Dow Chemical, publient un rapport de leurs travaux traitant de la forme non solvatée de l’alane [6]. Au total et jusqu’à présent, sept phases cristallines ont été identifiées : α, α’, β, γ, δ, ε, ζ [6].
3.3.1 Méthode classique avec deux solvants organiques
La méthode employée, dite de Schlesinger [31], est similaire à celle développée par Finhold et Chizinsky. Elle consiste dans un premier temps, sous atmosphère contrôlée en l’absence d’eau et de dioxygène, à utiliser comme réactifs du LiAlH4 et du AlCl3 (avec un rapport molaire de
4:1) en solution dans l’éther pour former de l’alane éthéré (réaction 12).
4 𝐿𝑖𝐴𝑙𝐻4(𝑠𝑜𝑙) + 𝐴𝑙𝐶𝑙3(𝑠𝑜𝑙)Et→ 4 𝐴𝑙𝐻2O 3 ∙ 𝑛𝐸𝑡2𝑂(𝑠𝑜𝑙) + 3 𝐿𝑖𝐶𝑙(𝑠) + 𝐿𝑖𝐴𝑙𝐻4(𝑠𝑜𝑙) (12)
La solubilité de l’alane éthéré dans l’éther est comprise entre 0,2 et 0,22 mol L-1
à température ambiante [6]. Plusieurs températures sont données dans la littérature pour mettre la réaction en œuvre. Elles sont présentées dans le Tableau 14. Ce mélange réactionnel a ensuite besoin d’être filtré afin d’éliminer le chlorure de lithium et de ne conserver qu’une solution limpide d’alane éthéré.
Tableau 14 : Température du mélange réactionnel d’après la littérature
Température du mélange réactionnel Références
Température ambiante [34]
0 °C [19]
-10 °C [35], [36]
Inférieure à -10 °C [36]
Puis, une étape de désolvatation (réaction 13) est réalisée par l’ajout en excès de benzène ou de toluène suivi par la distillation du mélange réactionnel. L’ajout de LiBH4 peut avoir lieu
avant la filtration du chlorure de lithium [9], [15] ou après la filtration [28], [17].
4 𝐴𝑙𝐻3 ∙ 𝑛𝐸𝑡2𝑂(𝑠𝑜𝑙) + 𝐿𝑖𝐴𝑙𝐻4(𝑠𝑜𝑙)
𝑡𝑜𝑙𝑢è𝑛𝑒 ∆
38
La température de distillation du mélange éther/toluène est elle aussi très variable suivant les références bibliographiques. Le Tableau 15 regroupe ces différentes plages de température.
Tableau 15 : Températures de distillation du mélange éther/benzène selon les références bibliographiques
Température de distillation du mélange
réactionnel (°C) Référence 76-80 [36] 76,5-80 [6] 80-82 [37] 78,3 [38] 76-77 [34] 85-95 [8]
Enfin, l’alane cristallisé est lavé avec de l’éther pour éliminer l’excès de LiAlH4 et de LiBH4.
L’alane est alors séché sous vide à température ambiante ou pendant 1 h à 45 °C [35].
Dans un premier temps, le benzène a été utilisé puis, en raison de sa toxicité, il a été remplacé par le toluène. Le rapport volumique idéal éther : toluène est décrit par Scruggs comme étant compris entre 1 : 3 et 1 : 6 [37]. Si la quantité d’éther est trop importante, la formation de plusieurs formes cristallines de l’alane est alors observée. Si au contraire il n’y a pas assez d’éther, l’alane éthéré précipite avant que la température de désolvatation ne soit atteinte. Bulychev et al. indiquent que la concentration en alane dans une solution Et2O-ArH (1:1 v/v),
avec ArH = composé aromatique (benzène ou toluène), ne doit pas excéder 4 g L-1 afin que la cristallisation se produise [39]. Ils ajoutent également que la concentration peut être augmentée jusqu’à 5-6 g L-1 avec l’addition d’un large excès de LiAlH
4 et en présence de
LiBH4. Bulychev et al. démontrent ainsi l’importance de la présence de LiBH4 pour la
formation de la phase α de l’alane [39].
Les études menées par Graetz et al. montrent que la présence d’un excès de LiAlH4 permet de
39
d’un échantillon d’alane synthétisé par la méthode de Schlesinger sans ajout de LiBH4. La
Figure 27 représente ceux d’un échantillon d’alane après synthèse en présence de LiBH4.
Figure 26 : Échantillon d’alane obtenu après synthèse sans LiBH4 [39]
Figure 27 : Échantillon d’alane obtenu après synthèse en présence de LiBH4 [39]
La Figure 26 et la Figure 27 montrent qu’en l’absence de LiBH4 pendant la synthèse, les
cristaux de AlH3 sont moins agglomérés. Cependant, d’après les expériences menées par
Lund et al., l’ajout de LiBH4 n’aurait aucun impact sur la formation de l’alane α [10]. Les
concentrations et les rapports molaires LiAlH4/AlCl3/LiBH4 sont présentés dans le Tableau 16
ainsi que les différentes références bibliographiques. 10 μm
10 μm
40 μm
![Figure 4 : Densité de stockage de l’hydrogène dans différents hydrures par rapport à l’hydrogène liquide LH 2 [4]](https://thumb-eu.123doks.com/thumbv2/123doknet/7914786.265025/25.892.208.695.479.839/figure-densité-stockage-hydrogène-hydrures-rapport-hydrogène-liquide.webp)
![Figure 11 : S tructure d’un cristal de α -AlH 3 . La maille est présentée à gauche a) et la connectivité des octaèdres est présentée à droite b) [14]](https://thumb-eu.123doks.com/thumbv2/123doknet/7914786.265025/37.892.123.748.253.632/figure-tructure-cristal-maille-présentée-connectivité-octaèdres-présentée.webp)
![Figure 14 : Interconnexion des octaèdres dans la struc ture de la phase α’ -AlH 3 [14]](https://thumb-eu.123doks.com/thumbv2/123doknet/7914786.265025/40.892.109.769.111.464/figure-interconnexion-octaèdres-struc-ture-phase-α-alh.webp)
![Figure 17 : Enchaînement des octaèdres AlD 6 dan s la structure de la phase β -AlD 3 [17]](https://thumb-eu.123doks.com/thumbv2/123doknet/7914786.265025/42.892.108.780.697.952/figure-enchaînement-des-octaèdres-ald-structure-phase-ald.webp)
![Figure 28 : P rocessus continu pour la synthèse de la phase α de l’alane [41]](https://thumb-eu.123doks.com/thumbv2/123doknet/7914786.265025/56.892.251.642.287.837/figure-rocessus-continu-synthèse-phase-α-l-alane.webp)

![Figure 31 : Schéma de réactions à l’anode lors de la synthèse électrochimique de l’alane avec LiCl utilisé comme additif électro-catalytique [47]](https://thumb-eu.123doks.com/thumbv2/123doknet/7914786.265025/60.892.278.621.401.781/figure-schéma-réactions-synthèse-électrochimique-utilisé-électro-catalytique.webp)
![Figure 33 : ATD- ATG de l’alane synthétisé à partir de chlorure de benzyle [40]](https://thumb-eu.123doks.com/thumbv2/123doknet/7914786.265025/62.892.277.612.243.525/figure-atd-atg-alane-synthétisé-partir-chlorure-benzyle.webp)
![Figure 34 : I mage MEB d’un cristal d’alane α obtenu par la synthèse sans toluène [54]](https://thumb-eu.123doks.com/thumbv2/123doknet/7914786.265025/67.892.255.633.638.923/figure-mage-meb-cristal-alane-obtenu-synthèse-toluène.webp)