HAL Id: tel-02596948
https://hal.inrae.fr/tel-02596948
Submitted on 15 May 2020
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
de deux composantes biologiques d’un hydrosystème
natural biofilms diatomiques et bivalves filtreurs
-après remédiation d’un site industriel
A. Arini
To cite this version:
A. Arini. Décontamination métallique et capacités de récupération de deux composantes biologiques d’un hydrosystème natural - biofilms diatomiques et bivalves filtreurs - après remédiation d’un site industriel. Sciences de l’environnement. Doctorat Géochimie & Ecotoxicologie, Université Bordeaux 1, 2011. Français. �tel-02596948�
THESE
PRESENTEE A
L'UNIVERSITE BORDEAUX 1
ECOLE DOCTORALE « Sciences de l’Environnement »
par Adeline ARINI
POUR OBTENIR LE GRADE DE DOCTEUR
SPECIALITE : GEOCHIMIE ET ECOTOXICOLOGIE
D
ECONTAMINATION METALLIQUE ET CAPACITES DE RECUPERATION
DE DEUX COMPOSANTES BIOLOGIQUES D
’
UN HYDROSYSTEME NATUREL
-
BIOFILMS DIATOMIQUES ET BIVALVES FILTREURS
-
APRES REMEDIATION D
’
UN SITE INDUSTRIEL
THESE
PRESENTEE A
L'UNIVERSITE BORDEAUX 1
ECOLE DOCTORALE « Sciences de l’Environnement »
par Adeline ARINI
POUR OBTENIR LE GRADE DE DOCTEUR
SPECIALITE : GEOCHIMIE ET ECOTOXICOLOGIE
D
ECONTAMINATION METALLIQUE ET CAPACITES DE RECUPERATION DE DEUX COMPOSANTES BIOLOGIQUES D’
UN HYDROSYSTEME NATUREL-
BIOFILMS DIATOMIQUES ET BIVALVES FILTREURS-
APRES REMEDIATION D’
UN SITE INDUSTRIELNuméro d’ordre : 4438
Soutenue le 15 décembre 2011.
Après avis de :
Helena Guasch, Professeur, Université de Girona (Espagne) Rapporteur
Alain Geffard, Professeur, Université de Metz Rapporteur
Devant la commission d’examen formée de :
Frédéric Garabetian, Professeur, Université de Bordeaux 1 Président Helena Guasch Professeur, Université de Girona (Espagne) Rapporteur
Alain Geffard, Professeur, Université de Reims Rapporteur
Mr Jean Prygiel, Professeur, Université de Lille Examinateur
Agnès Feurtet-Mazel, Maître de Conférence, Université de Bordeaux 1 Directrice de thèse Michel Coste, Directeur de Recherche, Cemagref/ Irstea Directeur de thèse
« Nous n'héritons pas de la terre de nos ancêtres, nous l'empruntons à nos enfants. »
Antoine de Saint-Exupéry.
Remerciements
Cette page introduit ce manuscrit, pourtant pour moi elle signe la fin de sa rédaction. Et c’est avec beaucoup d’émotion que je tiens à remercier Antoine Gremare, directeur de l’UMR EPOC 5805, Frédéric Garabetian, directeur de la Station marine d’Arcachon, ainsi que Jean-Charles Massabuau, directeur de l’équipe Ecotoxicologie Aquatique, pour m’avoir accueillie dans ce laboratoire et m’avoir donné la chance d’accomplir ce travail.
Je souhaiterais également remercier l’Agence Nationale de la Recherche (ANR) à travers son programme Contamination Ecosystèmes Santé (CES) dont le projet Re-Syst a bénéficié.
Je tiens à remercier particulièrement Helena Guasch, Professeur à l’Université de Girona, et Alain Geffard, Professeur à l’Université de Reims, pour avoir accepté d’être les rapporteurs de cette thèse. Je remercie également Jean Prygiel, Professeur à l’Université de Lille, pour avoir accepté d’être examinateur, et enfin Frédéric Garabetian qui me fait l’honneur d’être le président du jury.
Je voudrais exprimer toute ma gratitude à Agnès Feurtet-Mazel ; merci de m’avoir donné ma chance, bien que personne ne me connaissait dans ce laboratoire. Merci également de m’avoir encadrée, accordé tant de temps et donné de si précieux conseils. Tu as toujours été juste et encourageante et si je sors aujourd’hui grandie de cette expérience c’est principalement grâce à toi. Merci également pour ton éternelle bonne humeur, même dans les moments difficiles. Cette thèse n’aurait pas été une si belle aventure sans toi.
Je tiens également à remercier tout particulièrement mon co-directeur de thèse, Michel Coste, pour sa gentillesse, et sa grande maitrise des diatomées. Merci de m’avoir fait partager un peu de votre immense savoir pour apprendre à identifier les espèces.
Je souhaiterais également remercier François Delmas, pour m’avoir accueillie au sein de son équipe au Cemagref/ Irstea, avec beaucoup de gentillesse et d’encouragements. J’en profite pour remercier l’ensemble de l’équipe REBx et le labo de chimie du Cemagref/ Irstea, avec une attention toute particulière pour Soizic Morin, qui m’a formée sur le terrain, au labo et qui a toujours su répondre présente pour moi tout au long de ces trois années. Merci également à Juliette, Vincent, Sébastien, Marius, Sandra et Sylvia pour leur gentillesse et leur aide.
Mes remerciements vont également à l’ensemble de l’équipe Ecotoxicologie Aquatique de la Station marine d’Arcachon, avec une attention particulière pour Magalie Baudrimont qui s’est beaucoup investie dans ce projet. Merci d’avoir soutenu ma candidature et de m’avoir donné la chance de mener à bien cette thèse. Merci également pour ton aide, tes conseils et pour ta gentillesse.
Je tiens également à remercier tout particulièrement Régine Maury-Brachet, pour sa joie, son rire communicatif et surtout sa grande maitrise des appareils de mesure, ces
et ton soutien tout au long de ces trois années.
Je garderai une pensée émue pour Patrice qui, dès le jour de mon arrivée, m’a tout de suite plongée dans le bain en m’aspergeant de pamplemousse (mais rassure-toi tu progresses !). Merci pour ta gentillesse, ta bonne humeur, et pour avoir initié le Beach volley de midi qui, en plus de nous offrir une pause détente, a su rapprocher bon nombre d’entre nous.
Merci également à Nathalie pour sa bonne humeur et les week-ends et autres sorties qu’elle nous propose toujours. C’est grâce à toi que nous avons eu le plaisir de partir au ski l’an dernier. C’est là que Dalia a découvert pour la première fois la neige (ses genoux s’en souviennent !) et que d’autres ont découvert le Jungle speed ! Ah quelle soirée ! N’est-ce pas Patrice ? (prends le !! prends le !!).
Je remercie également Alexia, non pas de m’avoir frappée à plusieurs reprises avec le totem, prise dans le feu de l’action, mais pour ta gentillesse et pour tes conseils.
Je voudrais également remercier Pierre, qui a rythmé nos fins de journées par sa musique en sourdine (mais les murs sont fins ici), qui a montré une extrême gentillesse et a sauvé plus d’un de mes appareils qui avaient plongé dans le sable.
Un grand merci à ma Cathy, la pro des bons de commande qui doivent partir en urgence ! Tu as toujours été présente pour moi et fait preuve d’une gentillesse inestimable, merci pour tout.
Je tiens également à remercier Flo. Je t’ai souvent entendu me râler dessus, parce que j’étais bordélique (ça s’appelle une manip Flo, pas du bordel !) ou parce que tu en avais marre de gratter mes lames. Bon d’accord, il y en a eu beaucoup… plus de 1000, d’après mes calculs. Mais au fond, tu as toujours été présente pour moi et pour l’ensemble des étudiants, et toujours prête à donner un coup de main. En cela, tu mérites bien ton surnom de « Maman Flo ». Merci pour tout ma Floflo.
En parlant de manip je tiens à dire un énorme merci à Henri qui a été d’une grande aide à la fois sur le terrain mais également au labo. Merci pour ta gentillesse et pour ton formidable travail sur l’étude et la réalisation des canaux qui représentent une grande partie de cette thèse.
Merci également à Bruno pour ton aide durant la préparation des manips.
J’ai également une pensée particulière pour ma Véro avec qui j’ai partagé beaucoup de bons moments au labo et lors de nos missions terrain. Merci pour ton aide, ta bonne humeur. Merci pour le travail remarquable que tu as effectué dans le cadre de ma thèse et pour tous les souvenirs que j’en garde.
Je remercie également Christelle Gramaglia et Delaine pour leurs précieux renseignements sur le contexte social du site de Viviez.
J’en profite pour remercier le site ABC, à Decazeville pour nous avoir accueillies de si nombreuses fois dans leurs locaux.
Enfin je remercie l’ensemble de la Station marine d’Arcachon, tous ceux qui m’ont suivie de près ou de loin.
Mais la Station marine, c’est aussi le Musée-Aquarium. Je voudrais donc remercier Christelle. Merci pour toutes les petites pauses entre deux bâtiments, devant la porte de ton atelier. Merci pour avoir fait office de garderie (malgré toi) pour mes anodontes. Merci également de m’avoir fait découvrir les coulisses de l’aquarium et d’avoir en vain tenter de me faire apprendre les noms de poissons. « Mais si celui-là je m’en rappelle, attends ça va me revenir… une sarcasse à tête noire ! Non je confonds avec la rascasse… donc c’est une … bref… j’abandonne… ».
Je remercie sincèrement Pierre-Jean Labourg et Claude Cazaux pour m’avoir donné la chance de travailler à leurs côtés et bénéficier de leur immense savoir, dans le cadre de mon monitorat d’entreprise en tant que doctorant-conseil pour la réalisation du projet scientifique et culturel du futur musée-aquarium du POA. Merci également à Philippe de m’avoir ouvert les portes de l’aquarium chaque fois que j’en avais besoin. Je tiens par ailleurs à remercier Bernard Favre, Philippe Monestier, Jean Dubourg, Antoine Grémare, Pierre Chardy et encore une fois Régine Maury-Brachet pour leur aide, leurs précieux conseils et leur volonté de faire avancer ce projet.
La réalisation de cette thèse n’aurait pas été la même sans la présence et le soutien de tous ceux qui ont accompagné mes journées, depuis le commencement et jusqu’à la fin de cette belle aventure. Merci à Sébastien, Mohamedou et Ika pour m’avoir accueillie dans le bureau des thésards. J’ai une pensée particulière pour Seb que j’ai souvent embêté, quand lui-même était en rédaction, pour savoir comment marchait tel appareil ou pour savoir où se cachait tel produit dans ce laboratoire alors inconnu, aux 1 000 couloirs et 10 000 placards ! Merci à Cerise pour avoir partagé ensemble le projet Re-Syst, avec toutes les journées dissections que cela a représenté, et pour avoir vécu ensemble l’aventure à Decazeville !
J’ai une pensée particulière pour celle qui a vraiment fait en sorte que cette thèse se passe dans la joie et la bonne humeur : Audrey. Tu es et tu resteras la plus belle découverte de ces trois années, même si ce n’a pas tout de suite été une évidence. Tu t’es montrée très intéressée par mon travail : « Adeline, tu sais que tes Corbis sont des marionnettes ? Parce que "un siphon - phon - phon les petites marionnettes ! " » et par sa valorisation : « Adeline, est-ce que tu vas à Cannes présenter ton prochain biofilm ? ». J’ai découvert en toi, au-delà de l’humour belge qui me laisse encore parfois perplexe, une amitié sincère qui durera, sois en sûre, au-delà de cette thèse.
Je tiens également à remercier Hugues, Yuguy le céleri, Huguette la paupiette, qui tu sais ! Merci pour ta gentillesse (oublié le temps où tu avais kidnappé Horace), pour tous les bons moments que nous avons passé ensemble et pour tes délicieux macarons (félicitations de nous avoir fait croire que tu continuerais à faire de délicieuses pâtisseries une fois en thèse !)
Une pensée particulière va également à ma Cécile, qui a partagé notre aventure pendant quelques mois (est-ce que tu as toi aussi découvert la diatom-attitude ? C’était plus fort que moi, il fallait que je la place…). Merci pour ta joie, ta gentillesse et pour ton amitié précieuse.
ou tout simplement notre quotidien et ont rendu ces trois années inoubliables.
Je tiens d’ailleurs à remercier Hubert pour avoir sauvé mon ordinateur d’un virus ultra-résistant, pour avoir récupéré mon disque dur HS un mois avant de déposer mon manuscrit et pour avoir finalement installé mon nouveau PC, un véritable bonheur lorsqu’on est en pleine rédaction.
Je tiens à remercier également tous ceux qui m’ont suivie malgré l’éloignement. Je pense bien sûr à Jérémy et Ondine, Irène, Rélie, Steph, Michaël, Sébastien, Alex, Aurélie G. et tous les autres.
Un merci tout particulier pour la plus chère de tous : Ilhem. Ma deuxième sœur, mon amie d’enfance, 24 ans qu’on se connait et jamais une dispute ! Merci à toi, ma confidente, ma thérapeute, merci pour ton soutien, ta bonne humeur, tes histoires à 8 000 épisodes et surtout pour être toujours présente pour moi.
Cette thèse n’aurait pas été la même sans le soutien de ma famille : Maï, Frédo, Gégé, Steph, Jorge, René, Mado, Aurélio, Chantal, Sèv et Cyril. Merci à vous tous qui vous êtes intéressés à mon travail et qui êtes venus me voir ici pour me faire retrouver un peu de mes racines.
Je tiens également à remercier très sincèrement mes parents. Comment pourrais-je trouver les mots justes pour vous témoigner ma reconnaissance et ma gratitude, vous qui m’avez montré un soutien inconditionnel, qui avez été présents à toutes les étapes de cette thèse (et de ma vie), et sans qui je n’en serai surement pas là aujourd’hui. Merci du fond du cœur, je vous aime.
Je souhaite également remercier tout particulièrement ma sœur, Céline. Plus qu’une sœur, tu es ma meilleure amie, ma deuxième mère. Tu m’as tellement donné et appris, sans toi je ne serai pas devenue celle que je suis.
Enfin, j’ai une pensée toute particulière pour mon Christophe. Merci de m’avoir suivie dans cette aventure, dans les bons comme dans les mauvais moments, et de l’avoir vécue avec moi au quotidien, plus que quiconque.
SOMMAIRE
INTRODUCTION ... 1
CHAPITREI :ETAT DES CONNAISSANCES ... 9
A. CARACTERISATION DES ELEMENTS TRACES METALLIQUES ... 10
1. Définition ... 10
2. Répartition et dispersion ... 10
3. Sources naturelles et apports anthropiques des métaux traces : zinc et cadmium ... 11
4. La spéciation chimique des métaux en milieu aquatique ... 13
B. MECANISMES D’INTERNALISATION DES METAUX CHEZ LES ORGANISMES AQUATIQUES ... 14
1. Le modèle de l’ion libre (Free Ion Activity Model – FIAM) ... 14
2. Le modèle du ligand biologique (Biotic ligand Model - BLM) ... 15
C. MECANISMES DE TOXICITE DES METAUX CHEZ LES ORGANISMES AQUATIQUES ... 18
1. Le caractère essentiel de certains métaux... 18
2. Mécanismes de toxicité chez les invertébrés aquatiques. ... 19
3. Mécanismes de toxicité chez les microalgues ... 24
4. Caractérisation de l’impact des métaux à l’échelle de l’écosystème ... 27
5. Définition d’un bioindicateur ... 30
D. LA CONTAMINATION DU SYSTEME HYDROGRAPHIQUE LOT -GARONNE -GIRONDE PAR LES METAUX LOURDS A L’ORIGINE DES TRAVAUX DE REMEDIATION ... 32
1. Présentation du continuum Lot- Garonne – Gironde ... 32
2. Le contexte de la pollution industrielle du bassin minier de Viviez ... 32
3. Constat des atteintes sanitaires ... 35
4. Initiation des travaux de remédiation ... 37
CHAPITREII :BASES METHODOLOGIQUES ... 39
A. LES BIVALVES CORBICULA FLUMINEA COMME BIOINDICATEURS DE CONTAMINATION METALLIQUE ... 40
1. Systématique ... 40
2. Origine et répartition géographique ... 41
3. Anatomie et biologie ... 42
4. Ecologie de Corbicula fluminea ... 45
1. Description d’un biofilm périphytique ... 48
2. Etapes de colonisation d’un biofilm périphytique ... 48
3. Systématique et répartition des diatomées ... 50
4. Morphologie et structures cellulaires ... 51
5. Cycle de développement ... 52
6. Habitats et modes de vie ... 54
7. Intérêt en tant que bioindicateurs ... 54
55 C. CARACTERISATION DES STATIONS D'ETUDE LE LONG DU GRADIENT DE POLLUTION METALLIQUE ... 57
1. Sites en amont de l’usine ... 58
2. Sites en aval de l’usine ... 60
D. METHODES D’ECHANTILLONNAGES ET D’ANALYSES ... 62
1. Détermination des paramètres physicochimiques des sites d’étude ... 62
2. Méthodes d’échantillonnage et d’analyse des bivalves Corbicula fluminea ... 63
3. Méthodes d’échantillonnage et d’analyse des biofilms périphytiques ... 67
4. Etude d’une monoculture de diatomées (Chapitre 6) ... 76
5. Analyses statistiques ... 77
CHAPITRE III :SUIVI DE L’ETAT DE CONTAMINATION DE L’HYDROSYSTEME A TRAVERS L’EXPOSITION DE DEUX MODELES BIOLOGIQUES (CORBICULA FLUMINEA ET BIOFILM PERIPHYTIQUE), AU COMMENCEMENT DES TRAVAUX DE REMEDIATION ... 79
A. COMPARISON OF PERIPHYTIC BIOFILM AND FILTER-FEEDING BIVALVE METAL BIOACCUMULATION (CD AND ZN) TO MONITOR HYDROSYSTEM RESTORATION AFTER INDUSTRIAL REMEDIATION : A YEAR OF BIOMONITORING ... 82
B. DEUX ANS DE BIOMONITORING POUR METTRE EN EVIDENCE LES PREMIERS IMPACTS DE LA REMEDIATION SUR LES BIOFILMS PERIPHYTIQUES. ... 96
C. SUIVI DE LA BIOACCUMULATIONS DE CORBICULA FLUMINEA LE LONG DU GRADIENT DE CONTAMINATION DURANT DEUX ANNEES CONSECUTIVES D’EXPOSITIONS IN SITU .... 126
1. Introduction ... 126
2. Résultats ... 126
3. Discussion ... 137
4. Conclusion ... 139
D. DIAGNOSTIC SUR LES POTENTIALITES DES 2 MODELES BIOLOGIQUES EN TANT QUE REVELATEURS DE L‘AMELIORATION DE L’ETAT CHIMIQUE DE L’HYDROSYSTEME : ELEMENTS DE REPONSE AUX QUESTIONS SOULEVEES DANS CE CHAPITRE. ... 141
1. En référence aux études antérieures, les suivis in situ permettent de mettre en évidence des prémices de décontamination en réponse aux travaux de remédiation ... 141
2. L’influence saisonnière sur les capacités de bioaccumulation est très marquée chez Corbicula fluminea et moins perceptible dans les biofilms périphytiques ... 142
3. Les Corbicula fluminea et les biofilms périphytiques présentent des réponses biologiques complémentaires et représentent en cela de bons bioindicateurs de
l’amélioration de l’état chimique de l’hydrosystème ... 142
CHAPITRE IV : CAPACITE DE RECUPERATION DES BIOFILMS PERIPHYTIQUES EN CONDITIONS NATURELLES APRES TRANSLOCATION...…………145
A. TRANSLOCATION DE BIOFILMS DIATOMIQUES COLONISES SUR SUBSTRATS ARTIFICIELS D’UN SITE IMPACTE PAR LES METAUX VERS UN SITE DE REFERENCE ... 149
B. INFLUENCE DE LA MATURITE DU BIOFILM SUR LES CAPACITES DE DECONTAMINATION METALLIQUE ET DE RESTRUCTURATION DIATOMIQUE ... 177
1. Introduction ... 177
2. Résultats ... 178
3. Discussion ... 186
4. Conclusion ... 189
C. DIAGNOSTIC SUR LES CAPACITES DE RECUPERATION DES BIOFILMS PERIPHYTIQUES EN CONDITIONS NATURELLES APRES TRANSLOCATION : ELEMENTS DE REPONSE AUX QUESTIONS SOULEVEES DANS CE CHAPITRE ………...……191
1. Les biofilms périphytiques collectés sur lames de verre en conditions naturelles ont montré des capacités de décontamination métallique et de restructuration des communautés diatomiques rapides, après la transplantation d’un site contaminé en Cd et Zn vers un site de référence. ... 191
2. L’état de maturité des biofilms joue un rôle majeur sur les capacités de décontamination métallique et de restructuration des communautés diatomiques en conditions naturelles ... 191
CHAPITRE V : CAPACITES DE DECONTAMINATION DE CORBICULA FLUMINEA ET DES BIOFILMS PERIPHYTIQUES EN CONDITIONS EXPERIMENTALES ... 195
A. INFLUENCE SAISONNIERE SUR LES CAPACITES DE DECONTAMINATION METALLIQUE DE CORBICULA FLUMINEA EN CONDITIONS CONTROLEES, APRES CONTAMINATION SUR UN SITE SOUMIS A DES REJETS METALLIQUES. ... 199
1. Introduction ... 199
2. Matériel et méthodes ... 200
3. Résultats ... 203
4. Discussion ... 209
5. Conclusion ... 212
B. INFLUENCE SAISONNIERE SUR LES CAPACITES DE DECONTAMINATION METALLIQUE DES BIOFILMS PERIPHYTIQUES EN CONDITIONS CONTROLEES, APRES CONTAMINATION SUR UN SITE SOUMIS A DES REJETS METALLIQUES. ... 214
1. Capacités de décontamination métallique des biofilms et restructuration des communautés diatomiques après exposition printanière sur un site contaminé ... 214
3. Influence de la variabilité saisonnière sur les capacités de décontamination métallique des biofilms périphytiques ... 262 4. Conclusion ... 271
C. COMPARAISON DES CINETIQUES DE DECONTAMINATION OBTENUES A PARTIR DES DEUX
MODELES BIOLOGIQUES ... 272 1. Représentativité des expériences en laboratoire utilisant les deux modèles ... 272 2. Comparaison des capacités de contamination et de l’influence saisonnière chez les
deux modèles ... 273 3. Comparaison des temps minima nécessaires pour obtenir une décontamination
complète chez les deux modèles ... 274
D. DIAGNOSTIC SUR LES CAPACITES DE DECONTAMINATION DE CORBICULA FLUMINEA ET
DES BIOFILMS PERIPHYTIQUES EN CONDITIONS EXPERIMENTALES ... 276 1. Les biofilms et Corbicula fluminea présentent de capacités de décontamination
différentes en conditions contrôlées, après l’arrêt total de la contamination ... 276 2. L’effet saisonnier influence fortement les capacités de décontamination métallique des
biofilms et en moindre mesure les Corbicula fluminea ... 276 3. Les capacités de restructuration des communautés diatomiques des biofilms après la
levée du stress métallique sont apparues limitées en laboratoire ... 277 4. Les biofilms et Corbicula fluminea représentent des bioindicateurs complémentaires en
phase de décontamination métallique en conditions contrôlées ... 277
CHAPITRE VI : CAPACITES DE DECONTAMINATION METALLIQUE ET EVOLUTION DES
FORMES TERATOGENES DE PLANOTHIDIUM FREQUENTISSIMUM APRES UNE
CONTAMINATION EXPERIMENTALE EN LABORATOIRE AU CADMIUM ... 279
A. CAPACITES DE DECONTAMINATION METALLIQUE ET EVOLUTION DES FORMES
TERATOGENES DE PLANOTHIDIUM FREQUENTISSIMUM APRES UNE CONTAMINATION
EXPERIMENTALE AU CADMIUM ... 282
B. DIAGNOSTIC DES CAPACITES DE DECONTAMINATION METALLIQUE ET DE L’EVOLUTION
DES FORMES TERATOGENES DE PLANOTHIDIUM FREQUENTISSIMUM APRES UNE
CONTAMINATION EXPERIMENTALE EN LABORATOIRE AU CADMIUM ... 304
1. La monoculture de Planothidium frequentissimum a montré de rapides capacités de décontamination métallique après une contamination au Cd ... 304 2. Les capacités de survie et de reproduction des formes tératogènes au sein de la
population de Planothidium frequentissimum après une contamination au Cd dépendent du type d’atteinte et de la sévérité de la déformation ... 304
CHAPITREVII :BILAN DES RESULTATS ET PERSPECTIVES DE
RECHERCHE……...………..307
1. La contamination de l’hydrosystème reste très marquée ... 308
2. Les capacités de récupération après la levée du stress métallique interviennent en quelques semaines chez les biofilms et quelques mois chez Corbicula fluminea ... 313
3. L’utilisation conjointe des biofilms périphytiques et de Corbicula fluminea, offre des approches complémentaires, appropriées pour le suivi de l’amélioration de l’état chimique de l’hydrosystème ... 315
B. PERSPECTIVES DE RECHERCHE ET CONCLUSION ... 318
REFERENCES BIBLIOGRAPHIQUES ... 323
ANNEXE A
:
PRINCIPALES ESPECES CITEES DANS CE MANUSCRIT...347ANNEXE B : COMPOSITION DU MILIEU DAUTA POUR DIATOMEES...351
1
INTRODUCTION
Les métaux traces, comme tout minerai, sont naturellement présents dans la croûte terrestre, et diffusés par érosion. S'il existe un fond géochimique, les principales sources de contamination proviennent en revanche des activités anthropiques.
Bien que les activités humaines n’aient en rien modifié les volumes de métaux lourds présents sur Terre, elles ont significativement modifié leur répartition et les formes chimiques sous lesquelles ils sont présents dans l’environnement. L’industrie a souvent privilégié les sites à proximité de cours d’eau pour faciliter le transport des matières premières, favorisant par là même les rejets des effluents industriels accidentels ou non. Pendant des dizaines d’années, les fleuves ont ainsi été soumis à des rejets industriels créant une pression de contamination croissante sur les écosystèmes aquatiques. Les contaminations par les métaux lourds ont été tout d'abord mises en évidence dans les pays industriellement avancés en raison de déversements industriels importants et spécialement à la suite de pollutions accidentelles par le mercure et le cadmium au Japon (Kurland et al., 1960; Nitta, 1972). Pour ces différentes raisons, l’industrie est aujourd’hui tenue responsable de la quasi-totalité des rejets de métaux traces dans l’eau, et la nécessité de réduire ces rejets n’est aujourd’hui plus discutée. Dans un contexte post-minier, les résidus métalliques continuent cependant à affecter de nombreux écosystèmes à l’échelle internationale (Cattaneo et al., 2004a; Chan et al., 1999; De Jonge et al., 2008; Dudka, 1997).
Lors de la révolution industrielle des XVIIIe et XIXe siècles, l'activité minière a progressé de façon considérable dans les pays d’Europe, dont la France, qui a connu plusieurs siècles d’exploitation minière. L’extraction a atteint son apogée entre 1945 et 1975, générant une grande quantité de déchets métalliques dont certains présentent encore actuellement des risques pour l’environnement. Une estimation récente a évalué à 130 millions de tonnes la quantité de résidus générés par les mines d’extraction métallique en France durant l’essor industriel (Miquel, 2001).
Sans intervention humaine, des processus naturels tendent à faire diminuer la contamination métallique des sédiments et des eaux de surface par des processus physico-chimiques mais également biologiques (microbiens par exemple) (Adriano et al., 2004). Cependant, la dynamique des contaminants dépend fortement des types de métaux impliqués et de leur état d'oxydation, mais également de la nature et des caractéristiques du milieu. Des auteurs ont ainsi rapporté que la contamination métallique engendrée en conséquence de l'exploitation minière pouvait persister pendant des centaines d'années après la cessation des activités d’extraction (Adriano et al., 2004; Peplow, 2000).
3 Si les effets délétères des métaux sur les organismes sont d’ores et déjà bien référencés (Apostoli and Catalani, 2011; Bal et al., 2011; Bertin and Averbeck, 2006; Calabrese and Nelson, 1974; Filipič et al., 2006; Hartwig, 2010; Kortenkamp, 2011; Mitchelmore and Chipman, 1998; Nagajyoti et al., 2010; Sunda and Huntsman, 2000), certaines études s’intéressent aujourd’hui aux capacités de décontamination métallique et de récupération des organismes aquatiques. Les réseaux trophiques sont les principaux vecteurs d’accumulation le long de la chaîne alimentaire. De ce fait, de nombreuses études écotoxicologiques portent sur les poissons carnivores, au sommet des chaînes alimentaires (Andres et al., 2000; Gale et al., 2004; Hinck et al., 2009; Southworth et al., 2011). D’autres s’intéressent aux macroinvertébrés (Clements, 2004; Santoro et al., 2009) pour leurs rôles de brouteurs ou de détritivores favorisant leur contamination. Mais les producteurs primaires sont tout particulièrement visés en écotoxicologie du fait de leur situation à la base des chaînes alimentaires, c’est-à-dire à la source de la contamination trophique. Il s’agit d’une part des microalgues benthiques, majoritairement constitutives des biofilms périphytiques. Ils assurent une part majeure dans la production primaire des eaux courantes dans leur tracé amont. De nombreuses études ont démontré leur fort potentiel accumulateur et leur intérêt en tant que modèle biologique (Bere and Tundisi, 2010; Duong et al., 2010; Gold et al., 2003a; Nunes et al., 2003; Prygiel and Coste, 1993). Mais il peut s’agir d’autre part des chlorophycées (Sekabira et al., 2011) qui participent majoritairement à l’alimentation des organismes filtreurs. Ces derniers sont également très étudiées, du fait de leur forte relation avec le milieu environnant dont dépendent leurs activités respiratoire et nutritionnelle (Baudrimont et al., 2003; Tran et al., 2002).
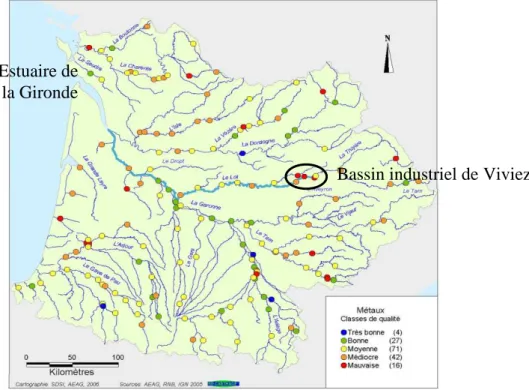
Situé en France dans l’Aveyron, le site atelier du bassin minier de Viviez-Decazeville, à proximité de la rivière Lot, représente un bon exemple de contamination métallique industrielle. Il est tenu pour responsable de la contamination du Lot qui a été mise en évidence dès le début des années 1970 par le Réseau National de la Contamination CHimique (ROCCH, anciennement appelé RNO). Des concentrations très élevées en cadmium ont été mesurées dans les bivalves collectés dans la zone aval de l’estuaire de la Gironde qui s’avérèrent être les plus contaminés du littoral européen. Différentes campagnes de collecte et d’analyse de sédiments au niveau des bassins versants de la Dordogne et de la Garonne furent entreprises pour remonter à la source de la contamination. Dans les années 80, des études démontrèrent que la principale source provenait d’un petit affluent du Lot, le Riou-Mort, subissant les rejets du site métallurgique de l’Union Minière (anciennement Société Vieille
Montagne et aujourd’hui racheté par UMICORE) à Viviez (Aveyron) (Boutier et al., 1989; Latouche, 1992).
L’usine de Viviez fut spécialisée dans le traitement du minerai de zinc de sa création en 1871 jusqu’en 1987. Depuis, l’usine maintient une production de zinc laminé. Bien que déjà connue, la contamination métallique n’a été prise en compte que dans les années 1999-2000 suite à un inventaire national des anciens sites d’activités industrielles potentiellement pollués. La rémanence de nombreux sites pollués dans l’Aveyron fut avérée à l’aube de la mise en place de la Directive Cadre européenne sur l’Eau (DCE, 2000/60/CE). L’intérêt grandissant de la part des politiques et des gestionnaires des pays européens plaça dès lors la contamination des écosystèmes aquatiques au centre de leurs préoccupations. S’ensuivirent d’importantes études visant à quantifier ces pollutions mais également à caractériser leurs impacts sur les organismes aquatiques.
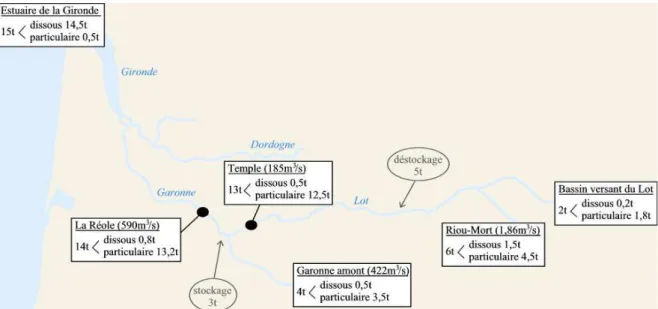
La forte contamination du bassin industriel de Viviez a suscité de nombreux travaux dans le cadre du groupement d’intérêt scientifique relatif à l’écologie du bassin Adour-Garonne (GIS ECOBAG). Dans ce cadre, deux modèles biologiques ont été choisis pour des suivis in situ : les bivalves filtreurs Corbicula fluminea et les biofilms périphytiques, principaux producteurs primaires de ce type de cours d’eau. L’objectif était d’établir l’état des lieux de la contamination du bassin industriel malgré l’arrêt de l’activité d’extraction en 1987. Ces diverses études ont ainsi permis de mettre en évidence la forte contamination en Zn et en Cd du milieu aquatique, estimée respectivement à 8180 et 145 mg/kg dans la phase particulaire en 2000 (Audry et al., 2004a), alors que les gammes de valeurs couramment observées dans les sols en France sont de l’ordre de 10 à 100 mg Zn/kget de 0,05 à 0,45 mg Cd/kg (Baize, 1997). Les répercussions sur les organismes aquatiques, à des niveaux communautaires, individuels et moléculaires ont été largement documentées (Achard et al., 2004; Baudrimont et al., 1999; Duong et al., 2008; Gold et al., 2003b; Marie et al., 2006; Morin et al., 2008c). L’identification des impacts de métaux sur ces deux modèles biologiques a permis de valider leur utilisation en tant que bioindicateurs de la contamination du milieu.
C’est dans ce contexte de pollution avérée que la société UMICORE entreprit dès 2007 d’importants travaux de remédiation des sols contaminés. Ces travaux visaient à traiter de manière pérenne la problématique de contamination des eaux par les métaux, et notamment par le cadmium, pour répondre aux attentes de la DCE visant à réduire l’émission de 33 substances prioritaires d’ici à 2015, dont le cadmium.
La poursuite des études in situ au cours de la phase de remédiation s’est concentrée sur ces deux mêmes modèles biologiques - biofilms périphytiques et bivalves filtreurs
5 Corbicula fluminea - afin de mettre en évidence cette fois-ci leur potentiel de récupération et de discuter de leur intérêt en tant qu’organismes modèles dans un contexte de gestion corrective. Pour répondre à cette problématique nous avons adopté une démarche suivant un schéma réductionniste croissant : des études de terrain, complexes par la multitude de facteurs environnementaux mis en jeu, aux études de laboratoires en conditions contrôlées, permettant d’appréhender les réponses diatomiques jusqu’au niveau monospécifique (Figure 1).
Une première série d’études a ainsi été consacrée aux suivis de terrain, menée durant deux années consécutives : d’octobre 2008 à novembre 2010. Ils offrent une bonne représentativité du milieu naturel en prenant en compte les facteurs environnementaux connus pour influencer les réponses biologiques, telles que la bioaccumulation (Tran et al., 2001). Un premier suivi à long terme réalisé conjointement sur Corbicula fluminea et les biofilms périphytiques a été dédié à la surveillance de l’état chimique du milieu en réponse à l’initiation des travaux de remédiation. L’utilisation conjointe des deux modèles biologiques a en outre permis de comparer leurs réponses biologiques en condition de stress métallique.
En prévision des effets à plus long terme de la remédiation, une seconde étude de terrain a consisté en la translocation de lames préalablement colonisées par du biofilm sur site contaminé vers un site non impacté. L’objectif était de simuler une décontamination rapide des biofilms et d’estimer les capacités de dépuration des métaux ainsi que le potentiel de restructuration des communautés de diatomées en conditions naturelles.
Par la suite, une série d’expérimentations a été réalisée en laboratoire en conditions contrôlées afin de s’affranchir des variations environnementales. Leurs objectifs étaient de confirmer ou d’infirmer les résultats obtenus en conditions naturelles, en appréhendant les réponses des organismes en relation avec uniquement la levée du stress métallique. Compte tenu de la diminution très progressive des contaminants in situ, ces conditions de laboratoire visaient également à estimer le temps nécessaire à une décontamination totale des organismes, en anticipation de celle encore non perceptible sur le terrain. Elles ont été réalisées sur deux saisons : au printemps et à l’automne 2010 et indépendamment pour les deux organismes modèles. D’une part, il s’agissait de collecter des biofilms colonisés sur deux sites naturels – l’un contaminé en métaux et l’autre non - puis de les ramener en laboratoire pour suivre une décontamination en canaux artificiels. Le suivi en parallèle de biofilms non impactés et de biofilms maintenus en contamination en laboratoire a servi de base pour comparer l’évolution
Suivi de l’amélioration chimique du milieu par l’exposition des Corbicula fluminea et la collecte de biofilms le long du gradient de contamination en 2009 et 2010 (Chapitre III).
Simulation d’une décontamination totale du milieu par la translocation de biofilms contaminés vers un site de référence en 2010 (Chapitre IV).
Décontamination expérimentale des biofilms et des Corbicula fluminea après exposition sur site contaminé au printemps et à l’automne 2010 (Chapitre V).
Induction de formes tératogènes dans une monoculture de Planothidium frequentissimum après contamination au Cd et capacités de retour à une population de forme normale en condition de décontamination (Chapitre VI).
.
Figure 1 : Schéma des différentes approches expérimentales abordées selon leur niveau de réductionnisme.
Etudes in situ
Etudes en
laboratoire
Etude
monospé
-cifique
7 des biofilms en décontamination et mettre en évidence une éventuelle restructuration des communautés diatomiques. D’autre part, des Corbicula fluminea ont été exposés à la contamination métallique in situ, puis ramenés en laboratoire en condition de décontamination. Ils ont été maintenus 15 mois afin de suivre les cinétiques décroissantes de bioaccumulations métalliques et les indices de condition.
Enfin, nous avons réalisé une dernière étude monospécifique sur la diatomée Planothidium frequentissimum. Cette volonté réductionniste a permis de se soustraire à l’influence des relations interspécifiques pouvant exister au sein des communautés diatomiques. Il est reconnu que des déformations au niveau des frustules des diatomées existent en milieu naturel non pollué, mais ces tératologies augmentent en condition de contamination métallique (Falasco et al., 2009a). Nous avons contaminé les monocultures au cadmium pendant 21 jours, auxquels ont succédé 28 jours de décontamination. L’objectif était de relier l’augmentation des formes tératogènes au sein de la population avec la bioaccumulation métallique. Il s’agissait in fine d’évaluer la viabilité et la capacité de reproduction des formes tératogènes en condition de décontamination pour prédire un retour vers une population de forme normale.
La complémentarité de ces approches avait pour but de répondre aux principales questions soulevées dans cette thèse :
- L’étude de la récupération des organismes exposés en conditions naturelles permet-elle de mettre en évidence une amélioration de l’état chimique du milieu ?
- Quel est le potentiel de récupération des organismes après transplantations in situ ou en laboratoire en condition de décontamination ?
- Quelles sont les réponses spécifiques à chacun des modèles biologiques étudiés en conditions de stress métallique ? Sont-elles complémentaires ?
Pour ce faire, la construction de ce mémoire suit le schéma conceptuel détaillé ci-dessus à travers 7 chapitres reliés entre eux par des transitions synthétisant les différents résultats obtenus et l’avancée des travaux de recherche.
Le chapitre I de ce manuscrit dresse un état des lieux des connaissances, au travers d’une synthèse bibliographique qui appuie le choix des modèles biologiques et des sites d’études.
Le chapitre II concerne la description des modèles biologiques - Corbicula fluminea et biofilms périphytiques - ainsi que des sites d’étude. De plus, il détaille les différentes méthodologies employées, concernant à la fois les travaux de terrain et de laboratoire. Les méthodes analytiques pour l’acquisition et le traitement des données y sont également explicitées.
Les chapitres suivants développent les résultats obtenus via les différentes approches expérimentales et font l’objet de chapitres distincts : suivi des organismes in situ (chapitre III), translocation de lames préalablement colonisées sur site contaminé vers un site non impacté (chapitre IV), expérimentations de laboratoire après contamination in situ (chapitre V), étude monospécifique sur la diatomée Planothidium frequentissimum (chapitre VI).
Le chapitre VII clôt ce mémoire par la discussion de l’ensemble des résultats obtenus. Il souligne la complémentarité des modèles biologiques choisis ainsi que des méthodes expérimentales employées. Enfin cette partie dresse un bilan prospectif des travaux de remédiation en s’appuyant sur les résultats exposés dans cette thèse qui serviront de base pour de futurs suivis.
9
CHAPITRE I
Ce chapitre dresse un état des connaissances général sur les mécanismes d’internalisation et de toxicité des éléments traces métalliques chez les organismes aquatiques. Les descriptions détaillées des modèles biologiques - Corbicula fluminea et biofilms - et des atteintes des métaux sur ces organismes seront réalisées dans le Chapitre 3.
1.
Définition
Les éléments-traces métalliques (ETM) sont conventionnellement définis comme les métaux dont la concentration naturelle moyenne dans la croûte continentale supérieure est inférieure à 1000 mg/kg. Longtemps appelés « métaux lourds », ils désignaient alors les éléments métalliques naturels, caractérisés par une masse volumique supérieure à 5 g/cm3. Quarante et un métaux correspondaient à cette définition générale auxquels s’ajoutaient cinq métalloïdes1. Bien que courante, l'appellation « métaux lourds » ne reposait cependant sur aucun fondement scientifique, ni sur aucune application juridique. Elle fut d'ailleurs souvent discutée car elle regroupait certains métaux aux propriétés toxiques, tels que le zinc, dont la masse volumique n’était pas supérieure à 5 g/cm3, ou encore des éléments toxiques qui ne sont pas définis comme étant des métaux (l'arsenic par exemple est un métalloïde). La notion d’ETM tend donc aujourd’hui à remplacer celle de « métaux lourds ».
2.
Répartition et dispersion
Les métaux sont présents dans tous les compartiments de l'environnement, généralement en quantités très faibles, justifiant leur appellation de métaux « traces ». Les ETM sont des éléments constitutifs de la croûte terrestre présents au sein des minerais et des
1
: Un métalloïde est un élément qui combine certaines caractéristiques du métal et d'autres caractéristiques
opposées, l'absence de conductivité électrique par exemple.
11 sédiments océaniques. Ils se retrouvent dans tous les compartiments de l’environnement du fait d’échanges permanents entre les réservoirs géochimiques.
Les principaux métaux traces sont le plomb, le cadmium, le mercure, l'arsenic et dans une moindre mesure, le chrome et le nickel. Parmi ces métaux le mercure, le plomb et le cadmium se distinguent des autres par le fait qu’ils peuvent changer de forme chimique, mais en aucune mesure être détruits. D’autre part, ils ont une conductivité électrique élevée, qui explique leur utilisation dans de nombreuses industries.
3.
Sources naturelles et apports anthropiques des métaux traces : zinc et
cadmium
3.1. Le zinc
Le zinc (Zn) est l'un des éléments les plus abondants dans la croûte terrestre, avec une moyenne de l’ordre de 80 mg/kg (INERIS, 2005b). Le Zn est naturellement présent sous forme de sulfure (blende). Il est assez uniformément distribué dans les roches magmatiques (40 à 120 mg/kg) où il est souvent associé à d’autres éléments métalliques tels que le plomb, le cuivre, le cadmium et le fer.
Les principales sources de Zn dans l’atmosphère proviennent de l’érosion éolienne des particules au sol, des éruptions volcaniques et des feux de forêts. Cependant, des causes anthropiques, telles que les activités minières et industrielles, le trafic routier ou les poussières émanant de l’incinération des ordures sont à l’origine de contaminations importantes de l’air. Les milieux aquatiques sont de surcroît soumis aux apports résultant des épandages agricoles mais également de l’érosion des matériaux fabriqués en Zn (toitures, gouttières, pneumatiques…) qui augmentent de façon non négligeable les concentrations en Zn dans l’eau.
Le Zn est le deuxième métal le plus abondant dans les organismes vivants (après le fer). Il constitue un élément essentiel pour tous les organismes vivants. A titre d’exemple, l'organisme humain contient de 2 à 3 g de zinc. Des protéines et des enzymes renfermant du Zn participent à divers processus du métabolisme, entre autres à la réplication et à la traduction du matériel génétique (Galdes, 1983). Chez l’ensemble des espèces, près de 200 enzymes ont été identifiées comme renfermant du zinc (O'Dell, 1984).
Il n’existe pas encore de consensus concernant l’établissement d’une PNEC
(Concentration sans effet prévisible ou "Predicted No Effect Concentration") pour le Zn du
fait que ce soit un métal essentiel. Cependant, compte tenu de la base de données existante, une PNEC correspondant à une concentration ajoutée à la concentration de fond naturelle a été déterminée à 8,6 µ g/L de Zn (INERIS, 2005b).
3.2. Le cadmium
Le cadmium (Cd) est un métal trace relativement rare qui n'existe pas à l'état natif. C’est un élément mineur constituant divers minerais de métaux non ferreux, s’associant souvent au Zn, au plomb ou au mercure. La concentration moyenne de Cd dans la lithosphère a été estimée à 0,098 mg/kg (Heinrichs, 1980).
Le Cd présent dans la croûte terrestre peut être dispersé dans l’atmosphère par entraînement de particules provenant du sol et par les éruptions volcaniques. Cependant, les activités industrielles telles que le raffinage des métaux non ferreux, la combustion du charbon et des produits pétroliers, les incinérateurs d'ordures ménagères et la métallurgie de l'acier constituent les principales sources de rejets atmosphériques.
Dans le milieu aquatique, le Cd provient de l'érosion naturelle, du lessivage des sols ainsi que des décharges industrielles. Le Cd est obtenu comme sous-produit de raffinage du plomb, du zinc et du cuivre. Une part non négligeable provient également du traitement des effluents industriels et des mines. Le Cd est considéré comme un métal non-essentiel puisqu’aucun rôle métabolique ne lui est connu et qu’il n’apparait pas biologiquement essentiel ou bénéfique au métabolisme des êtres vivants. En revanche, il est connu pour être rapidement toxique. En fonction de la dureté de l’eau, des PNEC de 0,21 µg/L (pour une dureté inférieure à 50mg de CaCO3/L) et de 0,75 µg/L (pour une dureté supérieure à 50mg de
CaCO3/L) ont été déterminées pour le Cd (INERIS, 2005a). En raison de sa toxicité, des
normes de qualité environnementales (NQE) fixent des valeurs seuils dans les eaux douces à 5
13
4.
La spéciation chimique des métaux en milieu aquatique
En milieu aquatique, les micropolluants existent sous deux formes : dissoute ou particulaire. Le métal dissous sous la forme ionique, dite libre, existe en général en faible proportion car il forme des complexes avec de nombreux ligands inorganiques en solution (e.g. OH-, Cl-, SO42-, HCO3-, PO43-) et organiques, ou s’adsorbe sur des surfaces immergées.
De plus, les métaux dissous sont en contact avec les sédiments ou matières en suspension, qui agissent comme des surfaces d’échange complexes.
En milieu aquatique, la toxicité des métaux dépend généralement de leur biodisponibilité, c’est à dire des formes chimiques sous lesquelles ils se trouvent dans le milieu, les rendant plus ou moins accessibles aux organismes.
Il existe trois types d’interactions contrôlant la spéciation des métaux en milieu aquatique :
- La précipitation : elle définit le passage d’une espèce de l’état dissous à l’état solide. En milieu aquatique naturel, les métaux précipitent principalement sous forme d’hydroxyde, de carbonates, de phosphates ou de sulfures.
- L’adsorption : c’est le phénomène par lequel des métaux se fixent sur la surface solide d’un substrat. Il s’agit d’un phénomène d’attraction électrostatique impliquant des liaisons de type Van der Waals. L’adsorption physique est généralement facilement réversible (Manceau, 2002) par le détachement des métaux adsorbés sur le substrat (désorption).
- La complexation : le métal adhère à la surface des particules par des liaisons ioniques spécifiques de types liaisons covalentes, difficilement réversibles. Les groupements anioniques (OH-, Cl-, SO42-, CO32-) ainsi que la matière organique, représentent une
source importante de ligands complexant pour la formation de métaux particulaires.
Le comportement d’un métal dans un écosystème aquatique dépend donc des conditions physico-chimiques du milieu, où il peut exister sous différentes formes, réparties entre la phase dissoute et la phase particulaire (Buffle, 1988; Turner, 1996).
1.
Le modèle de l’ion libre (Free Ion Activity Model - FIAM)
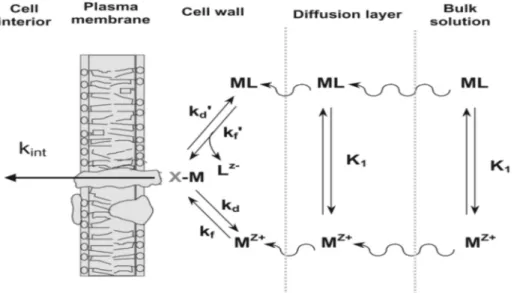
Le modèle FIAM (Figure 2) est basé sur l’existence, à la surface de l’organisme exposé au milieu contaminé, de sites spécifiques de fixation des métaux au travers desquels l’effet biologique s’exprime (Morel, 1983). L’effet biologique est proportionnel au nombre de sites membranaires occupés par le métal. Le modèle de l’ion libre décrit les interactions existant entre le métal et l’organisme selon trois étapes successives (Campbell, 1995) :
- La diffusion du métal de la solution vers la surface de l’organisme - La complexation (fixation) du métal sur les sites spécifiques - Le transport (internalisation) éventuel à travers la membrane.
Figure 2 : Modèle conceptuel des interactions entre les métaux et les organismes aquatiques (Campbell et al., 2002b). (MZ+ : ion métallique libre ; L : ligand ; ML : complexe métal-ligand (hydrophobe, labile) ; MX : complexe du métal à la surface membranaire ; K : constantes de réaction).
B.
M
ECANISMES D
’
INTERNALISATION DES METAUX CHEZ LES
ORGANISMES AQUATIQUES
15
2.
Le modèle du ligand biologique (Biotic ligand Model - BLM)
Le modèle du ligand biologique, repose sur les mêmes fondements conceptuels que le FIAM, schématisé en Figure 2. Cependant, il considère également comme des ligands les sites de fixation des espèces cationiques présents sur les membranes biologiques et susceptibles de liaison avec les métaux. Un « ligand biologique » est en effet par définition la cible biologique préférentielle d’un contaminant. Par assimilation, on appelle également « ligand biologique » les sites de fixation des métaux sur les organismes vivants pour aboutir à la formation d’un complexe métal / organisme.
D’après ce modèle le processus de transfert des métaux vers le milieu intérieur de la cellule suit trois étapes successives :
- Diffusion du métal à partir de l'eau vers la surface biologique. Cette première étape dépend de la chimie des équilibres qui existent à l’interface entre la cellule et le milieu extérieur.
- Adsorption (complexation) du métal à la surface de la membrane cellulaire. La complexation du métal au niveau de sites membranaires repose sur la forte électropositivité des métaux en solution. Ce processus de fixation est rapide et engendre la formation d’un complexe de surface noté M-X, selon l’équation suivante (Campbell et al., 2002b):
Mz+ + -X-cell ↔ M-X-cell où Mz+ : métal en solution et -X-cell ligand de la membrane cellulaire.
- Transfert du métal à travers la membrane plasmatique.
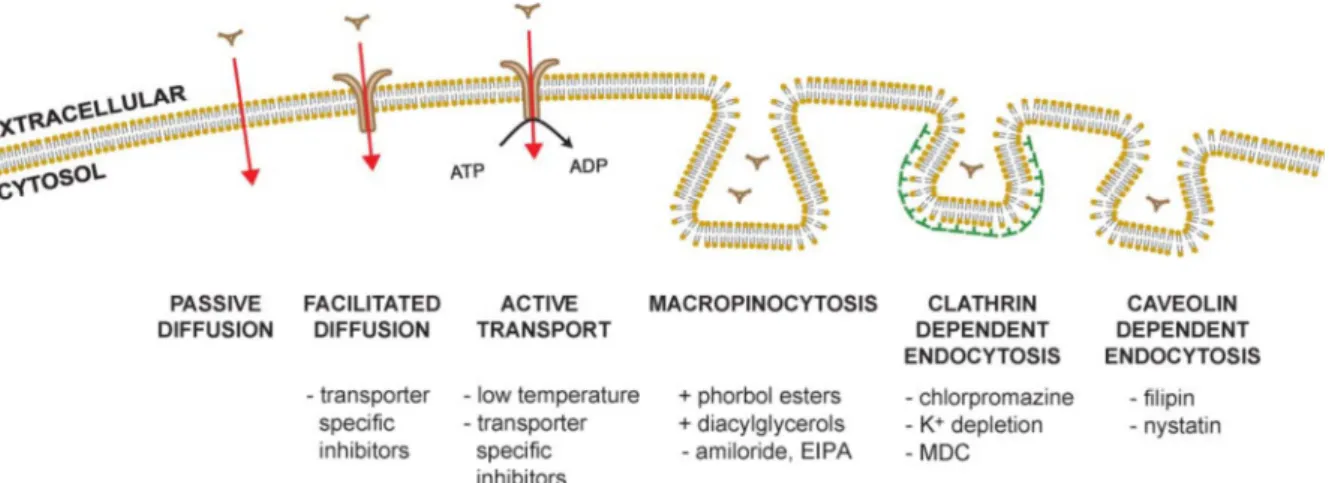
Il existe différentes voies d'entrée possibles dans la cellule faisant intervenir entre autres des protéines capables de traverser la double couche lipidique des cellules, des transporteurs de protéines ou encore des canaux à ions (Puckett et al., 2010; Simkiss, 1989). Le passage des formes dissoutes à travers la membrane apicale dépend des espèces chimiques métalliques, mais aussi de la salinité du milieu influant sur la physiologie des animaux et donc sur leurs capacités d’assimilation (Wang, 2001).
La Figure 3 résume l'ensemble des mécanismes susceptibles d'intervenir dans le transfert des métaux du milieu extérieur vers le milieu intracellulaire. En premier lieu, l’internalisation des métaux peut être réalisée par simple diffusion passive lorsqu’il s’agit d’un complexe métallique neutre lipophile (Puckett et al., 2010; Simkiss, 1989). Elle peut également faire intervenir des phénomènes de diffusion facilitée, dans le sens du gradient de
concentration par l'intermédiaire d'un transporteur ou par transport actif, contre le gradient de concentration, sollicitant de l'énergie (ATP).
Figure 3 : Mécanismes membranaires permettant l’entrée des complexes métalliques dans la cellule (Puckett et al., 2010).
Ces mécanismes sont bien référencés chez les cellules de mammifères (Zalups and Ahmad, 2003). Cependant, ils restent peu décrits chez les vertébrés et invertébrés aquatiques (Paquin et al., 2002; Simkiss, 1989; Worms et al., 2006). L'absorption du Zn, en relation avec le caractère essentiel à la vie de ce métal, fait généralement intervenir des protéines de transport ou des perméases (Roesijadi, 1994). Plusieurs études font par ailleurs état de l'utilisation par le Cd des canaux calciques voltage-dépendants (exemple de diffusion facilitée) du fait de l’homologie de l’encombrement moléculaire des ions Cd2+ et Ca2+ (rayon atomique respectivement de 0,97 et 0,99 Å) induisant une forte compétition (Roesijadi and Unger, 1993; Wang and Fisher, 1999b). L’endocytose joue cependant un rôle important dans le transfert des métaux chez les organismes aquatiques (mollusques filtreurs, organismes fouisseurs, déposivores) susceptibles d’ingérer des matières en suspension associées aux contaminants (Ke and Wang, 2001; Roesijadi, 1994). Elle a été décrite au niveau des branchies et du manteau des bivalves et semble être la voie majeure de transfert des métaux au niveau de la barrière intestinale (Depledge and Rainbow, 1990).
Initialement mis au point chez le poisson (Di Toro et al., 2001), le modèle du ligand biologique a plus récemment été étendu aux microcrustacés (De Schamphelaere and Janssen, 2004; Santore et al., 2001; Worms et al., 2006) et au phytoplancton (Campbell et al., 2002b; De Schamphelaere et al., 2005).
17
2.1. Les ligands biotiques chez les invertébrés aquatiques
Chez les invertébrés aquatiques, les branchies sont généralement considérées comme étant le principal ligand biotique. Elles constituent, de par leur fonction respiratoire, une importante surface de contact avec le milieu et représentent le premier point de contact et d’échanges entre l’organisme et le milieu environnant (Inza et al., 1997; Marigómez et al., 2002).
2.2. Les ligands biotiques chez les algues
Comme chez les autres organismes, on distingue chez les algues deux types d'accumulation : l'adsorption et l'absorption (internalisation). Le premier phénomène implique la fixation du métal sur les parois cellulaires (polysaccharides, peptidoglycanes, etc.) alors que le second fait intervenir des protéines facilitant le transport membranaire (Slaveykova and Wilkinson, 2002).
Crist et al. (1988) ont en effet montré que les membranes cellulaires des algues présentent une série continue de différents sites de fixation pour les métaux (ou les protons). Il a cependant été démontré que les capacités de liaison des métaux sur les parois cellulaires étaient spécifiques à chaque espèce d’algue (Gélabert et al., 2007) et qu’elles variaient en fonction des métaux (Klimmek et al., 2001).
Les membranes constituant les parois cellulaires sont donc considérées comme étant les ligands biotiques des microalgues.
Les critères d'effets biologiques pris en compte dans le cas de l'évaluation de la toxicité d'un métal vis-à-vis des organismes, sont généralement : l'accumulation (comprenant à la fois l'adsorption, l’absorption et l'assimilation) et la modification de la croissance, de la mobilité ou d’activités métaboliques telles que la photosynthèse.
1.
Le caractère essentiel de certains métaux
Les organismes vivants ont évolué en présence des éléments métalliques. Certains métaux sont essentiels aux processus biologiques comme le Zn, le cuivre ou le fer. En revanche, le Cd, tout comme le plomb, l’arsenic ou encore le mercure, ne présentent aucun intérêt biologique. Au contraire, leur accumulation perturbe le fonctionnement des cellules en empruntant les mêmes voies métaboliques que des ions métalliques essentiels de structure chimique apparentée.
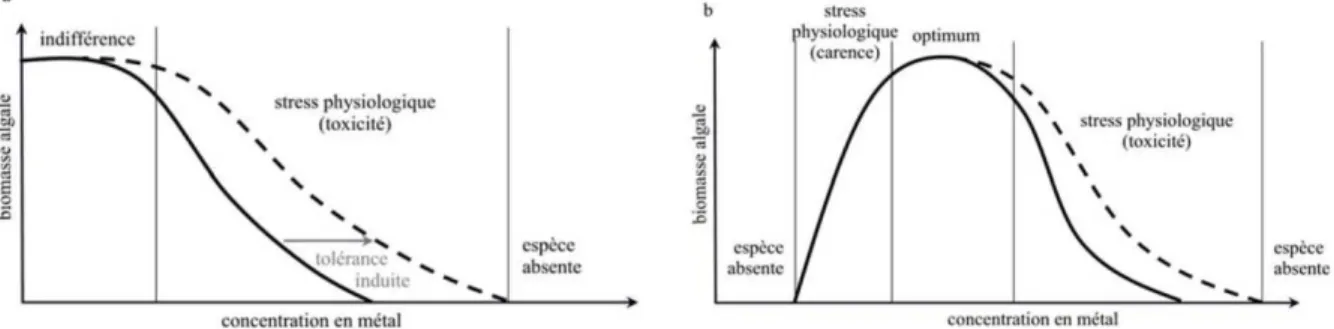
La Figure 4 illustre la régulation homéostatique qui entre en jeu chez les organismes vivants à la fois pour les métaux essentiels (a) et non essentiels (b). Pour ces deux groupes, des effets néfastes sur la croissance algale et plus généralement sur l'ensemble des activités métaboliques et physiologiques apparaissent lorsque ce processus de régulation sature. Pour les métaux essentiels, ces effets néfastes sont observés en condition de carence ou d’excès de métal dans l'environnement. Dans le cas des métaux non-essentiels, des concentrations environnementales très faibles suffisent à provoquer des effets délétères.
Figure 4 : Réponse des algues à une augmentation de la concentration métallique dans le milieu (a : métaux non essentiels, b : métaux essentiels) (d’après Simkiss et al. 1989).
C.
M
ECANISMES DE TOXICITE DES METAUX CHEZ LES
ORGANISMES AQUATIQUES
19
2.
Mécanismes de toxicité chez les invertébrés aquatiques.
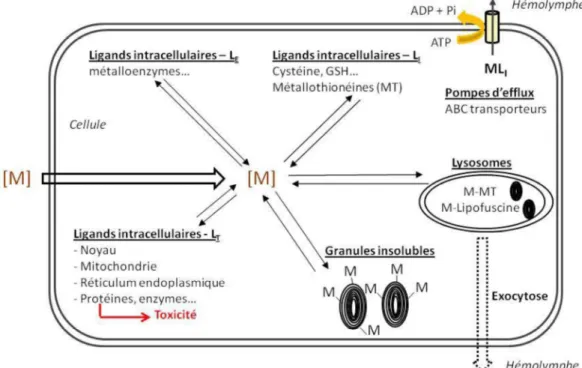
2.1. Internalisation et séquestration des métaux
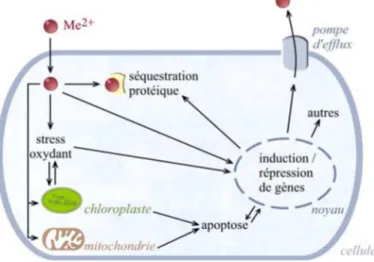
Comme évoqué plus haut, le ligand biotique des métaux sous forme dissoute chez les invertébrés est généralement situé au niveau des branchies. Ainsi, le Cd et le Zn dissous sont internalisés par les cellules épithéliales des branchies, tandis que les formes particulaires pénètrent par voie trophique dans l'intestin. Cette internalisation permet la libération des métaux dans le milieu circulant (sang ou hémolymphe) le plus souvent par des transporteurs de calcium. La fixation du Cd et Zn sur des protéines plasmatiques constitue une des formes de transport vers les différents organes. A titre d’exemple, différents transports ont été identifiés chez le crabe Carcinus maenas, impliquant la fixation du Cd ou du Zn sur l’hémocyanine, le pigment respiratoire, mais également sur des molécules de faible poids moléculaire ou encore sous forme d’ion libre dans les premiers temps d’exposition (Martin and Rainbow, 1998a, b). Au sein des cellules, en traversant l’enveloppe nucléaire, les métaux peuvent également se fixer sur les groupements amines des acides nucléiques et perturber la structure et le fonctionnement des chromosomes et de l’ADN (Viarengo, 1989).
Au niveau intracellulaire, des composants structuraux des membranes, des organites ou des composés cytosoliques sont capables de séquestrer les métaux (Figure 5). Leur contribution à la séquestration des métaux est fonction du niveau et du temps d’exposition, du type cellulaire, de l’espèce et du cycle de vie des organismes (Ahearn et al., 2004; Shi and Wang, 2004).
Les métallothionéines constituent les principaux ligands intracellulaires des métaux (Baudrimont et al., 2003; Kagi, 1991; Marie et al., 2006; Roesijadi, 1992). Ces protéines de faible poids moléculaire (6 à 7 kD) interviennent naturellement dans la détoxification des métaux essentiels revêtant un caractère toxique lorsqu'ils sont présents en excès (Zn, Cu). Leurs groupements thiols non spécifiques, permettent également la séquestration de métaux toxiques à caractère non-essentiel (Cd, Hg, Ag,…). Les métallothionéines assurent ainsi une tolérance aux métaux traces chez certaines populations soumises à un stress chronique. Ubiquistes à l'échelle du règne animal, les métallothionéines ont été identifiées chez les vertébrés, les invertébrés, mais également chez les végétaux, les champignons, les microorganismes eucaryotes et chez quelques procaryotes (Kagi, 1991; Roesijadi, 1992).
Figure 5: Représentation schématique des interactions entre les métaux et les structures cellulaires (Paul-Pont, 2010).
Figure 6 : Schéma illustrant les voies utilisées par le Cd et le Zn au travers des tissus des bivalves, avec l'indication des tissus impliqués dans l’entrée, le stockage et la filtration et l'excrétion des métaux.
21 La séquestration des métaux dans des structures compartimentées est également décrite chez les invertébrés aquatiques. Les lysosomes constituent une voie majeure de stockage et de détoxification non spécifique à l'égard des métaux. La fixation d’un métal par les métallothionéines représente un des mécanismes permettant l’accumulation des métaux dans les lysosomes (Viarengo, 1989).
Parallèlement à cette séquestration lysosomale, une partie des métaux présents dans le cytosol est précipitée sous forme de granules ou concrétions minérales insolubles, majoritairement composés de carbonates et phosphates de calcium (Viarengo and Nott, 1993b). Ces structures jouent un rôle important dans la séquestration du Cd, du Zn et du Cu chez les bivalves d’eau douce tels que Hydriella depressa ou Pyganodon grandis (Adams et al., 1997; Bonneris et al., 2005) et participent à la détoxification des métaux intracellulaires.
Chez les invertébrés, les hémocytes jouent également un rôle dans la séquestration et le transport des métaux (Robinson et al., 1997). Leur rôle de phagocytose des corps étrangers, des cellules mortes et des protéines dénaturées, aboutit à la concentration des métaux au sein de leurs lysosomes (Marigómez et al., 2002).
Enfin, les métaux peuvent être stockés dans la coquille des mollusques par des interactions entre les hémocytes et les cellules épithéliales du manteau ou par simple diapédèse2 des hémocytes vers la cavité palléale (Marigómez et al., 2002).
2.2. Voies d’élimination des métaux
L'élimination des métaux chez les invertébrés aquatiques se fait principalement par les voies rénales et digestives (Marigómez et al., 2002; Roesijadi, 1994). La Figure 6 résume l’ensemble des mécanismes impliqués dans l'absorption, les transferts, la séquestration et l'excrétion des métaux (Cd et Zn) chez le bivalve.
La majeure partie du métal particulaire associé à la nourriture passe par voie trophique vers l'intestin. Les métaux sont alors éliminés par migration depuis les tissus intestinaux, à travers la barrière épithéliale, vers la lumière du tube digestif ou vers l'eau de la cavité palléale (Marigómez et al., 2002; Roesijadi, 1994).
Les hémocytes constituent une des voies de transport des métaux. Stockés dans leurs lysosomes, les métaux migrent vers les organes de stockage et de détoxification tels que la glande digestive ou les reins. Ils sont ensuite éliminés selon trois voies complémentaires : 1)
2
dans les urines, parmi les concrétions excrétoires des néphrocytes; 2) dans les fécès par l’excrétion du contenu des lysosomes digestifs; et 3) à la fois dans l’urine et les fécès en raison de la diapédèse des hémocytes à travers l‘épithélium de la glande digestive, de l'intestin, et du rein (Marigómez et al., 2002). Chez de nombreuses espèces aquatiques, la glande digestive possède des fonctions intestinales et hépatiques et peut servir à la fois d’organe de transfert et de stockage. Les métaux peuvent également être relargués sous forme de pseudofèces, par exocytose au niveau des cellules de la glande digestive (Morton, 1983).
Les glandes péricardiques ont aussi été décrites comme sites potentiels d'ultrafiltration chez le bivalve Dreissena polymorpha (Giamberini and Pihan, 1996). Cependant, l’ultrafiltration intervient sur l’excrétion de molécules de taille supérieure à 45 kD, or la grande majorité des métaux est fixée à des protéines plasmatiques de plus petites tailles (Roesijadi, 1994). Enfin, les phénomènes de mues jouent un rôle non négligeable de détoxification chez certains invertébrés aquatiques par l’élimination des métaux accumulés au niveau de structures telles que l’exosquelette, l’exocuticule, la coquille, la dentition ou encore le byssus (Mason, 1995).
A l’heure actuelle peu d’études portent sur les capacités de détoxification des bivalves contaminés aux métaux lourds en conditions naturelles. Cependant, des études en laboratoire suggèrent que l’élimination du Cd chez les bivalves est longue (Mersch et al., 1993), estimant le temps de demi-vie à environ 2 ans (Baudrimont et al., 2003).
2.3. Atteintes toxiques des métaux
Les métaux toxiques sont reconnus pour avoir des effets tératogènes, mutagènes ou encore carcinogènes sur les organismes vivants (Bertin and Averbeck, 2006; Beyersmann and Hartwig, 2008; Leonard et al., 2004).
Au niveau cellulaire, le principal mode de toxicité des métaux réside dans la création d’un stress oxydatif (Figure 7). En temps normal, de nombreuses défenses antioxydantes maintiennent les taux d’espèces réactives à l’oxygène à de faibles concentrations (Hermes-Lima, 2005; Pinto et al., 2003). Cependant, les métaux en perturbant cet équilibre engendrent la création d’espèces réactives à l’oxygène telles que l’anion super-oxyde (O2·−), le peroxyde
d’hydrogène (H2O2) et le radical hydroxyle (HO·), qui provoquent d’importants effets
délétères au niveau cellulaire (dommages à l’ADN, oxydation de protéines, péroxydation lipidique) (Faria et al., 2010; Regoli et al., 2004).