© Sarah-Kim Bisson, 2020
Les inhibiteurs de la voie Wnt dans un modèle animal
d'insuffisance rénale chronique avec calcification
vasculaire
Mémoire
Sarah-Kim Bisson
Maîtrise en médecine expérimentale - avec mémoire
Maître ès sciences (M. Sc.)
Les inhibiteurs de la voie Wnt dans un modèle animal
d’insuffisance rénale chronique avec calcification
vasculaire
Mémoire
Sarah-Kim Bisson
Sous la direction de :
III
Résumé
En insuffisance rénale chronique (IRC), on observe un déséquilibre minéral qui est associé au développement d’un remodelage osseux anormal et de calcification vasculaire, un processus qui est semblable à la formation osseuse car il implique une trans-différenciation de cellules musculaires lisses vasculaires en cellules ostéoblastiques semblables à celles retrouvées dans l’os. Un lien a été rapporté entre le remodelage osseux ralenti et la calcification vasculaire en IRC mais la cause de ce lien demeure mal comprise. Nous avons étudié l’implication des inhibiteurs de la voie Wnt dans ce lien dans un modèle d’IRC chez le rat avec calcification vasculaire induite par un supplément de calcium, phosphore et vitamine D (Ca/P/vitD). Les animaux IRC+Ca/P/vitD présentaient de la calcification vasculaire, un remodelage osseux ralenti, un défaut de minéralisation et des niveaux sériques et vasculaires d’inhibiteurs de la voie Wnt élevés. La présence dans le vaisseau calcifié d’un inhibiteur de la voie Wnt de source ostéocytaire, la sclérostine, suggère que les cellules ostéoblastiques acquièrent un phénotype ostéocytaire. De plus, les inhibiteurs de la voie Wnt produits par le vaisseau pourraient avoir des conséquences sur l’os, ce qui cadrerait avec la formation ralentie et le défaut de minéralisation observés. Les inhibiteurs de la voie Wnt en circulation pourraient aussi avoir des effets vasculaires puisque les vaisseaux calcifiés présentaient des signes d’inhibition de la voie Wnt/β-caténine, les niveaux d’inhibiteurs de la voie Wnt ne semblant toutefois pas associés à un ralentissement de la calcification. Nos résultats mettent donc en lumière une implication potentielle des inhibiteurs de la voie Wnt dans le lien entre l’os et le vaisseau en IRC.
IV
Abstract
Chronic kidney disease (CKD) patients suffer from a dysregulation of minerals levels which is associated with abnormal bone remodeling and vascular calcification, a process similar to bone formation in that it implies the trans-differentiation of vascular smooth muscle cells into osteoblast-like cells. A link was reported between decreased bone formation and vascular calcification in CKD, but the cause of this link remains unclear. We have studied the involvement of Wnt pathway inhibitors in this process in a rat model of CKD with vascular calcification induced by a calcium, phosphorus and vitamin D supplement (Ca/P/vitD). CKD+Ca/P/vitD rats presented with vascular calcification, decreased bone turnover, defective mineralization and increased levels of circulating and vascular Wnt inhibitors. The expression by the calcified vessel of sclerostin, a Wnt inhibitor typically produced by osteocytes, suggests that vascular osteoblast-like cells could acquire an osteocytic phenotype as osteoblasts do in bone. Moreover, vascular Wnt inhibitors could have consequences on bone and contribute to the decrease in bone formation and the mineralization defect. The high circulating levels of Wnt inhibitors could also have vascular effects, which is supported by the fact that the Wnt/β-catenin pathway appears to be inhibited in the calcified vessels despite the fact that high levels of Wnt inhibitors were not correlated with a decrease in the severity of vascular calcification. Our results therefore suggest an implication of Wnt pathway inhibitors in the bone-vessels link that is frequently observed in CKD.
V
Table des matières
Résumé ... III Abstract ... IV Table des matières ... V Liste des figures ... IX Liste des tableaux ... X Liste des abréviations ... XI Remerciements ... XIII Avant-Propos ... XIV
Introduction ... 1
La régulation du métabolisme phosphocalcique ... 1
Le calcitriol ... 1
La parathormone ... 2
FGF23... 3
α-Klotho ... 4
Le métabolisme minéral osseux normal ... 4
L’ostéoclaste et la résorption osseuse ... 5
L’ostéoblaste et la formation osseuse ... 5
L’ostéoblaste et la minéralisation osseuse ... 6
Le ratio MEPE/PHEX et la minéralisation osseuse ... 7
L’ostéocyte et la régulation du remodelage osseux ... 7
La voie Wnt/β-caténine ... 8
La voie Wnt/β-caténine ... 8
Les ligands Wnt ... 9
L’activation de la voie ... 9
Le complexe de phosphorylation ... 9
L’inactivation du complexe de phosphorylation ... 9
VI
La régulation de la production d’inhibiteurs de la voie Wnt... 11
Régulation de la différentiation et de l’activité ostéoblastique par la voie Wnt/β-caténine ... 11
La voie Wnt/β-caténine ostéocytaire ... 12
Le rôle de la PTH dans le métabolisme minéral osseux ... 12
La PTH intermittente ... 12
La PTH continue ... 13
L’insuffisance rénale chronique ... 13
L’IRC ... 13
Le Ca et le P en IRC ... 14
La PTH en IRC ... 14
FGF23 en IRC ... 15
α-Klotho en IRC ... 16
Les inhibiteurs de la voie Wnt en IRC ... 16
L’os en IRC ... 16
Les anomalies osseuses en IRC ... 16
Le déséquilibre minéral et les anomalies osseuses... 17
Les inhibiteurs ... 17
L’os hyperparathyroïde ... 19
L’os adynamique ... 20
L’ostéomalacie ... 21
L’anomalie osseuse mixte ... 21
La calcification vasculaire en IRC ... 21
Mécanisme de la calcification vasculaire ... 21
Causes possibles de la calcification vasculaire ... 22
Les inhibiteurs ... 23
Le lien entre les anomalies osseuses et vasculaires ... 23
Les traitements disponibles pour l’IRC ... 24
La greffe rénale ... 24
La dialyse ... 24
Les chélateurs de phosphore ... 25
Les suppléments de vitamine D ... 26
Les calcimimétiques ... 26
VII
Cibler la voie Wnt/β-caténine ... 27
Comprendre le lien entre la voie Wnt et les anomalies osseuses et vasculaires ... 28
Chapitre 1 : Questions et hypothèses ... 29
Chapitre 2 : Une supplémentation haute en calcium, phosphate et calcitriol mène à un phénotype ostéocytaire dans les vaisseaux calcifiés et à un défaut de minéralisation osseuse chez le rat insuffisant rénal chronique. ... 30
2.1 Résumé ... 31
2.2 Abstract ... 32
2.3 Article ... 33
2.3.1 Introduction... 33
2.3.2 Material and methods ... 34
2.3.3 Results ... 36 2.3.4 Discussion ... 38 2.3.5 Acknowledgements ... 41 2.3.6 Author contributions ... 41 2.3.7 Conflict of interest ... 41 2.3.8 References ... 42 2.3.9 Figure legends ... 45 2.3.10 Figures ... 47 2.3.11 Tables ... 51 2.3.12 Supplementary materials ... 53
Chapitre 3 : Analyses supplémentaires ... 56
3.1 Transcription et expression de gènes ... 56
3.1.1 Dans le sérum ... 57
3.1.2 Dans l’os ... 58
3.1.3 Dans le vaisseau calcifié ... 60
3.2 Corrélations ... 61
3.2.1 Cause de l’excrétion accrue du phosphore ... 62
3.2.2 Causes de l’élévation d’inhibiteurs de la voie Wnt ... 63
3.2.3 Corrélations entre la structure et la biochimie dans l’os ... 66
Chapitre 4 : Discussion ... 67
VIII
4.2 Causes de l’élévation d’inhibiteurs de la voie Wnt ... 68
4.3 Liens os-vaisseau ... 70
4.4 Implication de la voie Wnt/β-caténine dans la calcification vasculaire ... 70
4.5 Causes du défaut de minéralisation ... 72
4.6 Causes de la formation osseuse ralentie... 73
4.7 Cause du défaut de résorption ... 74
Conclusion ... 75
Bibliographie ... 76
IX
Liste des figures
1.1 Métabolisme du calcium, du phosphore et du calcitriol………p.3 1.2 Effets de FGF23 et facteurs affectant sa production………...p.4 1.3 Facteurs affectant la formation et la résorption osseuse………..p.7 1.4 Activation et inactivation de la voie Wnt dans un ostéoblaste……….p.11 1.5 Effets de l’IRC sur le métabolisme phosphocalcique et le remodelage osseux……….p.15 1.6 Illustration des mécanismes par lesquels l’IRC et certains traitements induisent les anomalies osseuses………p.19 1.7 Marqueurs indiquant la présence de différentiation ostéoblastique, et possiblement ostéocytaire, dans le vaisseau calcifié………...p.22 2.1 Vascular calcification in the thoracic aorta p.47 2.2 Immunofluorescence analysis of osteocytes markers in the thoracic aorta p.47 2.3 Proteins expression of Wnt signalling pathway in thoracic aortas p.48 2.4 Cortical parameters of tibia bone in the different groups p.48 2.5 Bone histomorphometry results and representative histological images of tibia bone p.49 2.6 mRNA expression of osteocytes markers in the femur p.50 3.1 Niveaux sériques de RANKL p.57 3.2 Transcription de gènes dans l’os p.58 3.3 Transcription de gènes dans le vaisseau p.60 3.4 Transcription des SFRPs dans le vaisseau p.61
X
Liste des tableaux
2.1 Biochemical parameters between groups p.51 2.2 Bone dynamic parameters between groups p.52 2.3 Supplementary Table 1: Sequence of the primers used for qRT-PCR amplification p.53 2.4 Supplementary Table 2: Aorta and bone mRNA transcript expression between groups p.54 2.5 Supplementary Table 3: Correlations of cortical and trabecular bone parameters with vascular calcification p.55 3.1 Amorces utilisées pour le qRT-PCR p.56
3.2 Corrélations entre P et protéines phosphaturiques………....p.62 3.3 Corrélations entre sclérostine et Ca/P sériques p.63
3.4 Corrélations entre Dkk1 et ses activateurs potentiels p.63 3.5 Corrélation entre sclérostine et PTH p.64
3.6 Corrélations entre la calcification et les inhibiteurs de la voie Wnt circulants . p.64 3.7 Corrélation entre la sévérité de la calcification vasculaire et les inhibiteurs de la voie Wnt p.65
3.8 Corrélations entre les protéines ostéocytaires en circulation et leur production vasculaire p.65 3.9 Corrélation entre l’aire corticale et la transcription osseuse de Lrp4 p.66
XI
Liste des abréviations
APC: Adenomatous Polyposis Coli
ASBMR: American Society for Bone and Mineral Research BFR-BS: Bone Formation Rate-Bone Surface
BMP2: Bone Morphogenetic Protein 2 BV/TV: Bone Volume on Total Volume Ca: Calcium
CIHR: Canadian Institutes of Health Research CK1: Casein Kinase 1
CKD: Chronic Kidney Disease
CMLV: Cellules Musculaires Lisses Vasculaires CTL : Control
dL/BS : Double Label Surface/Bone Surface DMP1 : Dentin Matrix Acidic Phosphoprotein 1 Dvl: Dishevelled
ELISA: Enzyme-Linked Immunosorbent Assay FGF23: Fibroblast Growth Factor 23
FGFR1: Fibroblast Growth Factor Receptor 1 FRQ-S: Fonds de Recherche du Québec-Santé Fzd: Frizzled
GAPDH: Glyceraldehyde-3-Phosphate Dehydrogenase GSK3β: Glycogen Synthase Kinase 3
IRC: Insuffisance Rénale Chronique Lef: Lymphoid Enhancer-Binding Factor
Lrp5/6: Lipoprotein Receptor-Related Protein 5/6 MAR: Mineralization Apposition Rate
M-CSF: Macrophage Colony-Stimulating Factor MEPE: Matrix Extracellular Phosphoglycoprotein
MEPE-ASARM: Matrix Extracellular Phosphoglycoprotein-Acidic Serine Aspartate-Rich Motif MS/BS: Mineralization Surface/Bone Surface
MS/OS: Mineralization Surface/Osteoid Surface OcN/BV: Osteoclast Number per Bone Volume OPG: Ostéoprotégérine
XII
OV/BV: Osteoid Volume per Bone Volume P: Phosphore
PBS: Phosphate-Buffered Saline PKA: Protein Kinase A
PTH: Parathormone
PTHR1: Parathyroid Hormone Receptor 1
qRT-PCR: Quantitative Retrotranscription-Polymerase Chain Reaction RANK: Receptor Activator of Nuclear Factor
RANKL: Receptor Activator of Nuclear Factor kB Ligand RunX2: Runt Related Transcription Factor 2
SDS-PAGE: Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis SEM: Standard Error of the Mean
sL/BS: Single Label Surface/Bone Surface TbN: Trabecular Number
TbTh: Trabecular Thickness TCF: T-cell Factor
TNF: Tumor Necrosis Factor VDR: Vitamin D Receptor VitD: Vitamine D
XIII
Remerciements
J’aimerais tout d’abord remercier mon directeur de recherche, le Dr Fabrice Mac-Way, pour m’avoir accordé sa confiance lors de mon premier stage dans son laboratoire il y a quatre ans et pour m’avoir encouragé à me dépasser au cours des trois années suivantes.
Je remercie aussi mes collègues de laboratoire pour la belle ambiance de travail que j’ai eu la chance d’avoir chaque jour, et je remercie en particulier Visal Ung pour m’avoir appris tout ce que je devais savoir pour travailler en laboratoire, Sylvain Picard pour son enthousiasme contagieux pour l’histologie et la pathologie et Richard Larivière pour toujours avoir été présent pour répondre à mes questions.
Je tiens également à remercier les organismes qui m’ont offert un support financier au cours des dernières années : La fondation du CHU de Québec, le Fonds de Recherche Québec-Santé et les Instituts de Recherche en Santé du Canada.
Enfin, je ne peux terminer sans remercier mes proches pour avoir cru en moi, et en particulier mes parents Gilbert et Chantale qui ont toujours encouragé ma curiosité, m’ont inculqué de bonnes valeurs et m’ont toujours supportée.
XIV
Avant-Propos
Rédigé dans le cadre de ma maîtrise en médecine expérimentale, ce mémoire par insertion d’article contient deux publications récentes de notre laboratoire dont je suis l’auteure principale.
La première, High calcium, phosphate and calcitriol supplementation leads to an osteocyte‑like phenotype in calcified vessels and bone mineralisation defect in uremic rats, est présenté sous sa forme intégrale et en langue anglaise originale au chapitre 3. Elle a été publiée le 30 mars 2018 dans le Journal of Bone and Mineral Metabolism au terme de
quelques années de travail. En effet, avant d’entamer ma maîtrise dans le laboratoire du Dr Fabrice Mac-Way, j’avais déjà effectué 2 stages d’été dans ce même laboratoire au cours desquels j’ai eu l’occasion de débuter l’analyse de nos échantillons. J’ai ainsi participé à l’obtention des résultats pour l’article, à leur interprétation et à l’écriture de l’article. Les co-auteur Roth-Visal Ung, Sylvain Picard et Danika Valade ont aussi participé à l’obtention des résultats et à leur analyse alors que Roth-Visal Ung et Fabrice Mac-Way, mon directeur de maîtrise, ont aussi participé à l’écriture. Le protocole animal, qui est le résultat d’une collaboration entre plusieurs chercheurs, a été développé par Mohsen Agharazii, Richard Larivière et Fabrice Mac-Way avant mon arrivée au laboratoire.
Le second article, intitulé Role of the Wnt/β-Catenin Pathway in Renal Osteodystrophy, est inclus en annexe car il s’agit essentiellement d’un approfondissement de certains sujets abordés dans l’introduction. Il s’agit d’un article de revue en anglais disponible en libre accès que j’ai rédigé au cours de ma maîtrise et qui a été publié dans le International Journal of Endocrinology le 2 avril 2018. Roth-Visal Ung et le Dr Mac-Way m’ont guidé tout au long du processus de recherche et d’écriture et ont apporté des modifications avant la soumission au journal.
Pour finir, j’ai eu l’occasion de collaborer avec d’autres étudiants du Dr Fabrice Mac-Way sur d’autres projets de recherche, ce qui m’a amené à être co-auteure sur deux autres articles. Mon rôle dans l’écriture de ces articles a principalement consisté à obtenir et interpréter des résultats.
I. High calcium, phosphate and calcitriol supplementation leads to an osteocyte-like phenotype in calcified vessels and bone mineralisation defect in uremic rats.
Auteurs: Sarah-Kim Bisson, Roth-Visal Ung, Sylvain Picard, Danika Valade, Mohsen Agharazii, Richard Larivière, Fabrice Mac-Way.
Journal: Journal of Bone and Mineral Metabolism Statut de l’article: Publié en mars 2018
XV
II. Role of the Wnt/β-Catenin Pathway in Renal Osteodystrophy
Auteurs: Sarah-Kim Bisson, Roth-Visal Ung, Fabrice Mac-Way Journal: International Journal of Endocrinology
Statut de l’article: Publié en mai 2018
III. New bone biopsy sectioning approach for histomorphometry and molecular biology
Auteurs: Sylvain Picard, Roth-Visal Ung, Sarah-Kim Bisson, Fabrice Mac-Way. Journal: Journal of Bone and Mineral Research
Statut de l’article: Publié en décembre 2017
IV. FGF23-klotho axis, bone fractures and arterial stiffness in dialysis: a case-control study
Auteurs: Louis-Charles Desbiens, Aboubacar Sidibé,Roth-Visal Ung, Catherine Fortier, Michaël Munger, Yue-Pei Wang, Sarah-Kim Bisson, Mohsen Agharazii, Karine Marquis, Fabrice Mac-Way
Journal: Osteoporosis International Statut de l’article: Publié en juin 2018
1
Introduction
L’insuffisance rénale chronique (IRC), qui consiste en une perte de fonction rénale irréversible, affecte plusieurs systèmes du corps humain et cause de nombreuses pathologies secondaires. On peut penser entre autres aux problèmes osseux et à la calcification vasculaire, deux problèmes interreliés qui diminuent la qualité de vie des patients et augmentent leur risque de mortalité. Le lien entre l’IRC et ces deux problèmes étant mal compris, il existe peu de thérapies efficaces pour freiner le développement de problèmes osseux et vasculaires chez les patients. La présente introduction a pour but de présenter le fonctionnement normal du métabolisme minéral osseux, puis d’exposer comment l’IRC dérègle ce métabolisme et cause des problèmes osseux et vasculaires tout en mettant en lumière les mécanismes moins bien compris que nous avons tenté d’élucider dans nos recherches effectuées dans un modèle de rat IRC supplémenté en calcium, phosphore et vitamine D. Elle porte plus particulièrement sur le rôle que pourrait jouer la voie Wnt dans le développement des anomalies osseuses et de la calcification vasculaire et sur le lien entre l’os et le vaisseau en IRC, ainsi que sur la possibilité que des cellules ostéocytaires soient présentes dans le vaisseau calcifié.
La régulation du métabolisme phosphocalcique
De la matrice osseuse où on les retrouve ensemble sous forme de cristaux d’hydroxyapatite aux cellules musculaires où ils sont indispensables au processus de contraction, le calcium (Ca) et le phosphore (P) sont deux éléments qui jouent des rôles essentiels et dont les niveaux doivent être soigneusement régulés. Bien que ce soit l’intestin qui serve de porte d’entrée à ces deux minéraux, c’est plutôt le rein qui en est le principal régulateur, éliminant les surplus par l’urine et produisant des facteurs régulant directement ou indirectement leur absorption intestinale, leur excrétion et leur déposition dans l’os. Si une régulation inadéquate des niveaux de Ca et de P pourrait mener à de la calcification vasculaire en cas d’excès, une déficience pourrait quant à elle fragiliser l’os en nuisant à sa minéralisation. L’os, en plus de son rôle structurel crucial, est aussi la plus importante réserve de calcium et de phosphore de l’organisme. En cas de déséquilibre du métabolisme phosphocalcique qui requiert de puiser dans les réserves osseuses, une partie de la force structurelle de l’os peut être sacrifiée au profit du rétablissement de l’équilibre. On parle alors de résorption osseuse, soit une dégradation de l’os pour en libérer les minéraux. Plusieurs facteurs qui régulent l’absorption et l’excrétion du calcium et du phosphore régulent également la résorption osseuse.
Le calcitriol
L’un des facteurs produit par le rein et régulant les niveaux de Ca et de P est le calcitriol, ou 1,25-dihydroxycholécalciférol. Mieux connu comme étant la forme active de la vitamine D, le calcitriol est produit par le rein à partir du 25-hydroxycalciférol, un précurseur qui nécessite plusieurs étapes à produire. Le processus2
débute avec la forme retrouvée dans l’alimentation, le cholécalciférol, qui peut aussi être fabriqué par exposition de pré-vitamine D au soleil au niveau de la peau. Le cholécalciférol passe d’abord au foie, où une enzyme nommée 25-hydroxylase la convertit en 25-hydroxycalciférol. Ce dernier se rend ensuite aux reins pour être hydroxylé par la 1-α-hydroxylase, ce qui constitue l’étape d’activation finale de la vitamine D 1. Le calcitriol ainsi
formé peut ensuite se rendre à l’intestin pour stimuler l’absorption alimentaire du Ca, et dans une moindre mesure du P, ou encore stimuler la réabsorption rénale du calcium et sa libération de l’os 2. Outre sa régulation
du Ca et du P, le calcitriol semble nécessaire à un bon fonctionnement du métabolisme osseux puisque les souris sans 1-α-hydroxylase ni récepteur de la vitamine D (VDR) présentent des anomalies de la formation et de la résorption osseuse même si leurs niveaux de Ca et P sont maintenus normaux par d’autres moyens 3.
Comme le calcitriol est un élément central du métabolisme phosphocalcique, l’activité de la 1-α-hydroxylase est soigneusement régulée par plusieurs facteurs, à commencer par le calcitriol lui-même, qui l’inhibe pour former une boucle de rétrocontrôle négative 3. Si la concentration de calcitriol demeure trop élevée, une enzyme
nommée 24-hydroxylase peut l’hydroxyler une dernière fois pour entraîner sa dégradation en acide calcitroïque qui est par la suite éliminé dans la bile 1.
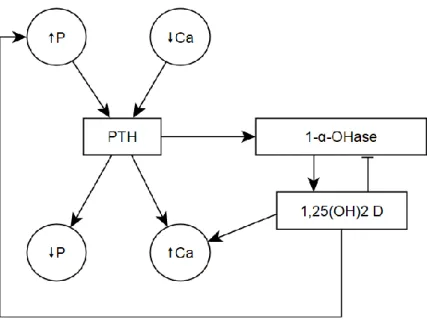
La parathormone
Une autre composante fondamentale du métabolisme phosphocalcique est la parathormone (PTH). Produite par les glandes parathyroïdes en réponse à une baisse des niveaux de Ca et de calcitriol ou à une hausse des niveaux de P et supprimée par les conditions inverses, son but est de rétablir l’équilibre en modulant à la fois l’absorption du Ca, l’excrétion du P et l’entreposage de ces deux minéraux dans l’os 4. Pouraugmenter les niveaux de Ca, elle en augmente l’absorption intestinale en stimulant la 1-a-hydroxylase dans le rein tout en supprimant l’activité de la 24-hydroxylase 3, 5 et elle augmente également la réabsorption rénale du
calcium 6. Le contraire est observé pour le phosphore, dont la réabsorption rénale est inhibée pour en stimuler
l’excrétion. C’est plus précisément la suppression de l’expression du transporteur de P NaPi-2a dans le tubule proximal qui permet à la PTH de réduire les niveaux de P 7. La PTH régule également la déposition et la
libération de Ca et de P dans l’os, ce qui permet d’utiliser les réserves osseuses de minéraux pour maintenir des niveaux circulants stables. Les mécanismes plus précis seront approfondis dans la section 1.4.
3
Fig. 1.1 Métabolisme du calcium, du phosphore et du calcitriol
FGF23
Une autre hormone systémique régulant les niveaux de Ca et de P est le Fibroblast Growth factor 23 (FGF23), une protéine de 32 kDa produite principalement par l’os 8. Comme la PTH, il stimule l’excrétion duP excédentaire en diminuant l’expression du transporteur NaPi-2a dans le tubule rénal proximal, mais son effet sur le calcitriol et le Ca est inversé 8, 9. En effet, contrairement à PTH, FGF23 a pour but de diminuer les niveaux
de Ca, but qu’il atteint en supprimant l’activité et la transcription de la 1-α-hydroxylase tout en augmentant celle de la 24-hydroxylase 8. Comme le calcitriol augmente aussi l’absorption du P en parallèle à celle du Ca, cette
action de FGF23 contribue à renforcer son rôle de suppression du P. FGF23 diminue également les niveaux de Ca et de calcitriol en supprimant la PTH, ce qu’il fait en se liant au récepteur Fibroblast Growth Factor Receptor 1 (FGFR1) des glandes parathyroïdes, tel que démontré in vitro et in vivo 10, 11. De plus, tout comme
la PTH, FGF23 agit sur le métabolisme minéral osseux par des mécanismes qui seront vus à la section 1.2. La production de FGF23 est principalement régulée par le calcitriol, la PTH et le Ca. Bien que FGF23 soit généralement augmenté en situation d’hyperphosphatémie, le P ne semble pas l’activer directement, ou du moins pas de façon marquée 12. À titre d’exemple, une élévation du P sanguin n’a que peu d’effet sur FGF23 si
les niveaux de PTH sont maintenus bas 13. On observe par contre un effet synergique lorsque le P et le calcitriol
sont tous deux élevés 14. Le calcitriol est quant à lui un activateur direct qui entraîne la transcription de FGF23
de façon dose-dépendante en se liant au VDR présent à la surface des ostéoblastes 12, 14, 15. L’hyperparathyroïdie,
qui est une situation de surproduction de PTH, semble aussi activer la production de FGF23. La PTH peut agir de façon directe en se liant au récepteur Parathyroid Hormone Receptor 1 (PTHR1) à la surface des ostéoblastes, ou encore indirectement en stimulant sur la production de calcitriol qui stimulera à son tour FGF23 16. Finalement, le Ca semble aussi activer la production de FGF23 indépendamment de la PTH et du
4
calcitriol puisque la délétion du VDR n’affecte pas son action stimulante et que l’hypocalcémie supprime FGF23 même si la PTH demeure élevée 13, 17. Toutefois, une brève élévation de Ca ne semble pas avoir d’effet sur
FGF23 chez l’humain 18.
Fig. 1.2 Effets de FGF23 et facteurs affectant sa production
α-Klotho
Pour exercer ses actions sur le Ca et le P, FGF23 doit se lier à la fois à son récepteur membranaire FGFR et à son co-récepteur, α-Klotho. Cette protéine est principalement produite par le rein et d’autres tissus-cibles de FGF23 comme les glandes parathyroïdes et il en existe deux formes principales, soit une forme transmembranaire et une forme circulante 19. Cette seconde forme, plus courte, peut résulter d’un clivage oud’une variation de transcription. Toutefois, c’est la forme transmembranaire qui semble la plus importante pour permettre la liaison de FGF23 à son récepteur 8. Il a été proposé que la forme circulante pourrait agir seule et
inhiber la réabsorption du phosphate dans le rein en agissant sur les transporteurs NaPi-2a, rendant son action comparable à celle de FGF23, mais cette affirmation est controversée 8, 20, 21. α-Klotho semble également agir
en collaboration avec FGF23 pour induire la production de ce dernier dans l’os 22. FGF23 est par ailleurs un
inhibiteur d’α-Klotho, ce qui pourrait avoir pour but d’atténuer les effets de FGF23 ou d’éviter une trop grande élimination du P si α-Klotho a bel et bien le même effet que FGF23 sur l’excrétion du P 8. Au contraire,
α-Klotho est activé par le calcitriol comme l’était FGF23, et aussi par le P, ce qui est compréhensible considérant qu’il doit être produit lorsque l’action de FGF23 est requise 19, 23.
5
Les os constituent une réserve importante de Ca et de P qui peut être utilisée pour réguler les niveaux sanguins en parallèle à la modulation de l’absorption et de l’excrétion. Comme mentionné précédemment, la résorption osseuse permet de libérer les minéraux, alors que la formation osseuse permet de déposer le Ca et le P dans les cristaux d’hydroxyapatite qui confèrent sa dureté à l’os. L’alternance entre la résorption et la formation osseuse constitue le remodelage osseux et permet à l’os d’augmenter sa solidité ou de fournir du Ca et du P. Le taux de remodelage dépend de l’activité des différentes cellules osseuses, dont les 3 types principaux sont les ostéoclastes, les ostéoblastes et les ostéocytes.
L’ostéoclaste et la résorption osseuse
Les cellules responsables de dégrader l’os pour en changer l’architecture ou en libérer le Ca et le P sont les ostéoclastes, de grosses cellules multinucléées issues de la lignée des macrophages et retrouvées à la surface de l’os. La différenciation de cellules pré-ostéoclastiques mononucléées et leur fusion subséquente pour former les ostéoclastes a lieu en réponse à deux facteurs. Le premier est le niveau du facteur de croissance Macrophage Colony Stimulating Factor (M-CSF) dans leur environnement alors que le deuxième est le ratio RANKL/OPG 24. RANKL, ou Receptor Activator of Nuclear Factor kB Ligand, est une protéine de lasuperfamille des Tumor Necrosis Factors (TNF) qui se lie aux récepteurs Receptor Activator of Nuclear Factor (RANK) à la surface des ostéoclastes, alors qu’OPG, ou ostéoprotégérine, est une protéine qui capte le RANKL pour empêcher son action. RANKL peut être trouvé sous forme membranaire ou sécrétée, les deux formes ayant pour effet de stimuler la différenciation et l’activité ostéoclastique 25. Le ratio entre RANKL et OPG est
régulé principalement par la PTH, qui agit sur les ostéoblastes et les ostéocytes pour stimuler leur production de RANKL et inhiber celle d’OPG 26, 27. Le calcitriol augmente également le remodelage en se liant au VDR à
la surface des ostéoblastes, ce qui augmente la production de RANKL 3. Le calcitriol semble même
indispensable à la formation d’ostéoclastes puisque l’absence de calcitriol ou de son récepteur empêche la différenciation ostéoclastique 3, 28. Une partie de l’effet stimulant qu’a la PTH sur RANKL pourrait d’ailleurs
passer par son effet positif sur le calcitriol 3. Par contre, une partie des effets du calcitriol sur l’activité
ostéoclastique pourrait être due à l’hypocalcémie puisqu’une supplémentation en Ca rétablit un taux de résorption normale dans une autre étude 29. Le stress mécanique, induit par exemple par l’activité physique,
semble plutôt inhiber l’activité des ostéoclastes en augmentant la production ostéoblastique d’OPG 30.
L’ostéoblaste et la formation osseuse
Les ostéoblastes sont des cellules dérivées de pré-ostéoblastes eux-mêmes issus de cellules souches mésenchymateuses. Une fois différenciés, ils se consacrent à la formation de matrice osseuse et à sa minéralisation 31. Comme les ostéoclastes, ils se trouvent à la surface de l’os. Ces deux typescellulaires sont d’ailleurs souvent regroupés à l’intérieur d’unités de remodelage, qui sont des emplacements de la surface osseuse où la résorption ostéoclastique est rapidement suivie par la formation de nouveau matériel
6
osseux 32. Les ostéoblastes produisent plusieurs molécules régulatrices du métabolisme minéral osseux telles
que FGF23, α-Klotho, RANKL et OPG 19, 25. Plusieurs facteurs régulent le nombre d’ostéoblastes et leur
sécrétion de matrice osseuse, à commencer par Runt Related Transcription Factor 2 (RunX2) et osterix, dont l’expression est régulée par la voie Wnt/β-caténine 33. Cette voie essentielle à la différenciation ostéoblastique
sera vue plus en détails sous peu. Le calcitriol semble également augmenter le nombre et l’activité des ostéoblastes chez le rat, sans pour autant que la minéralisation ne soit pareillement augmentée 34.
L’ostéoblaste et la minéralisation osseuse
Une fois la matrice osseuse sécrétée, l’ostéoblaste débute sa minéralisation, un processus sensible facilement inhibé par différentes conditions. L’inhibition de la minéralisation mène à l’accumulation de matériel ostéoïde, qui est de l’os non minéralisé et donc moins résistant. Parmi les activateurs de la minéralisation, on compte le facteur de transcription Bone Morphogenetic Protein 2 (BMP2), qui était aussi impliqué dans la formation osseuse 35. Quant aux inhibiteurs, FGF23 et sonco-récepteur α-Klotho semblent en faire partie. En effet, l’élévation de l’un ou de l’autre est associée à l’ostéomalacie, une pathologie caractérisée par l’accumulation de matériel ostéoïde. Il en résulte une diminution de densité osseuse indépendante des niveaux de Ca et de P 36-39. Si FGF23 est clairement associé à une
minéralisation réduite, l’association du calcitriol avec la minéralisation est plus variable. S’il est trop élevé dans l’environnement ostéoblastique, le calcitriol inhibe la minéralisation et mène à l’accumulation de matériel ostéoïde 29, 34, 40, mais l’absence totale de calcitriol mène aussi à l’accumulation d’ostéoïde en raison d’une
déficience en Ca et P 28, 41. La suppression de la production de calcitriol par FGF23 pourrait d’ailleurs contribuer
à son effet sur la minéralisation, mais FGF23 inhibe tout de même la minéralisation in vitro indépendamment du calcitriol 8, 36, 37. À des niveaux plus modérés, le calcitriol peut au contraire stimuler la minéralisation, agissant
7
Fig. 1.3 Facteurs affectant la formation et la résorption osseuse
Le ratio MEPE/PHEX et la minéralisation osseuse
Le ratio entre deux protéines osseuses retrouvées dans les ostéoblastes et les ostéocytes, Matrix Extracellular Phosphoglycoprotein (MEPE) et Phosphate Regulating Endopeptidase Homolog X-linked (PHEX), est aussi connu pour affecter la minéralisation 8. La protéine MEPE peut être clivée pour produire un peptide
comportant un motif ASARM (MEPE-ASARM) qui est ensuite libéré dans l’environnement osseux, où sa forme phosphorylée se lie à l’hydroxyapatite et nuit ainsi à la minéralisation 43. Quant à PHEX, il s’agit d’une
protéine membranaire retrouvée dans les cellules de la lignée ostéoblastique qui peut se lier à MEPE pour éviter son clivage, mais qui est en retour inhibée par MEPE-ASARM 43, 44. Un ratio MEPE/PHEX élevé peut donc
nuire à la minéralisation mais il influence également la production de FGF23 dans l’ostéoblaste mature. En effet, PHEX est un inhibiteur local de FGF23, ce qui fait de MEPE-ASARM un activateur indirect de FGF23
43. Les niveaux de MEPE ont d’ailleurs été associés positivement à ceux de FGF23 44, 45.
L’ostéocyte et la régulation du remodelage osseux
L’ostéoblaste atteint le stade terminal de sa différenciation lorsqu’il se retrouve entouré de la matrice osseuse qu’il a sécrétée et minéralisée. Ce n’est qu’une faible proportion des ostéoblastes qui connaissent ce destin, la majorité entrant en apoptose avant d’être entourés de matrice ou8
demeurant à la surface de l’os pour y devenir des cellules bordantes 31, 44, 46. Devenu un ostéocyte, l’ostéoblaste
cesse de former de l’os, tel qu’illustré par sa faible production de phosphatase alcaline, et produit plutôt des régulateurs du remodelage osseux 47. Comme 90% des cellules osseuses sont des ostéocytes, cette population
cellulaire est une source importante de molécules régulatrices 47. Les ostéocytes ont aussi de plus gros noyaux
que les ostéoblastes et ils communiquent entre eux par des prolongements cytoplasmiques qui se terminent en jonctions communicantes, ce qui leur permet de coordonner la production de protéines régulatrices 44. Outre
leurs différences morphologiques et leur activité, les ostéocytes se distinguent aussi des ostéoblastes par le type de molécules qu’ils produisent. Bien que certains composés soient communs aux deux types cellulaires, comme RANKL, OPG ou FGF23, d’autres comme la sclérostine, un inhibiteur de formation osseuse, ou la podoplanine, une protéine impliquée dans la formation de dendrites, sont plus spécifiques aux ostéocytes 44. Le
fait qu’ils soient confinés à des espaces restreints et relié entre eux par des dendrites fait des ostéocytes des cellules idéales pour détecter les changements de pression ou de tension dans l’os et ensuite signaler aux autres types cellulaires moins sensibles au stress mécanique qu’ils doivent former ou dégrader l’os 48. Bien que certains
ostéocytes puissent possiblement contacter directement les ostéoclastes par leurs prolongements cytoplasmiques, il est plus probable qu’ils communiquent en sécrétant du RANKL soluble 49. Par exemple, un
abaissement de la pression sur les ostéocytes augmente la production de RANKL dans les ostéocytes eux-mêmes, mais aussi dans les ostéoblastes via les jonctions communicantes, ce qui stimule l’ostéoclastogénèse 47, 50. Il a aussi été suggéré que RANKL stimule la production ostéocytaire de M-CSF, le deuxième facteur
nécessaire à la différenciation ostéoclastique, et que le calcitriol supprime la production d’OPG dans l’ostéocyte, facilitant l’action de RANKL 46, 47, 51. Enfin, l’apoptose ostéocytaire semble aussi stimuler la résorption en faisant
augmenter les niveaux de RANKL 46. Pour ce qui est de leur régulation de la formation osseuse, les ostéocytes
produisent des inhibiteurs de la voie Wnt/β-caténine comme la sclérostine et Dickkopf-1 (Dkk1), deux molécules qui inhibent la différentiation ostéoblastique.
La voie Wnt/β-caténine
La voie Wnt/β-caténine
L’activation de la voie Wnt/β-caténine dans les pré-ostéoblastes est une étape essentielle de la différentiation ostéoblastique. L’activation de cette voie mène à la stabilisation de la β-caténine, un facteur de transcription qui stimule la transcription de gènes ostéoblastiques comme RunX2 et osterix 33. Lorsquel’activation a lieu à grande échelle, il en résulte une hausse de la différentiation ostéoblastique et donc une augmentation de la masse osseuse 52. Au contraire, l’inhibition généralisée de cette voie mène à la
phosphorylation de la β-caténine par un complexe de phosphorylation, ce qui entraîne sa dégradation par le protéasome, freinant la différenciation ostéoblastique et la formation osseuse 53. L’article de revue présenté en
annexe contient une description plus détaillée des rôles de la voie Wnt dans le métabolisme minéral osseux et de son implication dans les anomalies osseuses en IRC.
9
Les ligands Wnt
L’activation de cette voie dans le pré-ostéoblaste se fait généralement par l’un des ligands Wnt, qui sont des protéines de 350 à 400 acides aminés 54. Ce ne sont pas tous les Wnt qui jouent un rôle prédominantdans la différentiation ostéoblastique et la formation osseuse, mais ce semble être le cas de Wnt1, Wnt3A, Wnt5A, Wnt7B et Wnt10B 33, 55.
L’activation de la voie
Les ligands Wnt en circulation activent la voie Wnt/β-caténine en se liant à la fois au récepteur Frizzled (Fzd), un récepteur couplé aux protéines G, et au co-récepteur Lipoprotein receptor-related protein 5 ou 6 (Lrp5/6) 56. Cela a pour effet de rapprocher les deux protéines transmembranaires, entraînant laphosphorylation de Fzd, ce qui permet le recrutement d’une protéine nommée Dishevelled (Dvl) 57. Lrp5/6 est
ensuite phosphorylé par un mécanisme inconnu qui pourrait impliquer Dvl, permettant d’y recruter le complexe de phosphorylation responsable d’initier la dégradation de la β-caténine 58. C’est plus précisément l’axine
contenue dans ce complexe qui se lie au récepteur 56, 57. Lrp6 semble plus facilement phosphorylé que Lrp5, ce
qui pourrait expliquer le fait qu’il a une plus grande capacité à activer la voie Wnt/β-caténine 58.
Le complexe de phosphorylation
Le complexe de phosphorylation recruté au niveau du co-récepteur Lrp5/6 est formé de 4 protéines et a normalement pour fonction de phosphoryler la β-caténine pour qu’elle soit ensuite dégradée 56, 59. Les 4 protéines sont la Glycogène synthase kinase 3 (GSK3β), la Caséine kinase 1 (CK1),l’Adenomatous Polyposis Coli (APC) et l’axine, ces deux dernières ayant principalement une fonction structurelle 54. Lorsque la voie est inactive, le complexe est libre dans le cytoplasme du pré-ostéoblaste. GSK3β
phosphoryle l’axine afin de la stabiliser, une étape nécessaire à la phosphorylation subséquente de la β-caténine
60. GSK3β, conjointement avec CK1, phosphoryle aussi la β-caténine au niveau des sérines 33, 37 et 45 et de la
thréonine 41 54, 61. Ces groupements phosphate permettent à une ubiquitine ligase E3 d’ubiquitinyler la
β-caténine, qui est ensuite dégradée par le protéasome 59.
L’inactivation du complexe de phosphorylation
Si le complexe est lié à Lrp5/6 plutôt que libre, il devient inactif et la voie est activée. Le complexe se lie également à Dvl, ce qui a pour effet d’empêcher la phosphorylation de l’axine par GSK3β 54, 60. Le complexe inactif contient toujours une molécule de β-caténine phosphorylée, mais10
Il en résulte une saturation des complexes de phosphorylation alors que la β-caténine, produite de façon constitutive, continue de s’accumuler dans le cytoplasme avant d’être transportée au noyau cellulaire 62. Sur
l’ADN, elle se lie au T-cell factor (TCF) et au Lymphoid enhancer-binding factor (Lef) pour activer la transcription de gènes nécessaires à la différenciation ostéoblastique comme RunX2 56, 63. Un autre gène notable
induit pas l’activation de la voie Wnt/β-caténine est l’axine2, une variante de l’axine moins efficace pour la phosphorylation de la β-caténine mais également sensible à la régulation par Dvl 64. Cela pourrait permettre de
garder la voie activée à long terme tout en modérant l’intensité de l’activation.
Les inhibiteurs de la voie Wnt/β-caténine
Il existe deux grandes catégories de molécules qui inhibent l’activité de la voie Wnt/β-caténine: Les protéines qui se lient à Lrp5/6 pour l’empêcher de se complexer à Fzd, dont font partie la sclérostine et Dkk1, et celles qui imitent le récepteur Fzd pour capter les ligands Wnt circulants, comme les Secreted Frizzled-Related Proteins (SFRPs) 46, 65-67. Si les premières sont principalement ostéocytaires, lessecondes sont produites plus globalement. La sclérostine est plus spécifique à l’os que Dkk1, tel qu’illustré par le fait que la délétion de ce dernier chez la souris mène à la mort puisqu’il est nécessaire au développement alors que la délétion de sclérostine affecte surtout l’os 68. Elle a tout de même quelques effets extrasquelettiques,
comme une élévation des niveaux de vitamine D et de phosphore en circulation et des niveaux plus bas de FGF23, cette dernière observation pouvant expliquer les deux autres 69. Elle régule aussi le ratio MEPE/PHEX
en stimulant le premier tout en inhibant le second, ce qui fait d’elle un inhibiteur de minéralisation potentiel 43, 70. Lrp4, une protéine apparentée à Lrp5/6, pourrait faire partie d’une troisième catégorie d’inhibiteurs de la
voie Wnt. Cette protéine, sans être un inhibiteur de la voie Wnt par elle-même, facilite l’action de la sclérostine et de Dkk1 sur leurs cellules-cibles 71, 72. Si elle est mutée chez l’humain, on observe une formation osseuse
exagérée semblable à celle qui est observée quand la sclérostine est inactivée 73. Principalement exprimée par
les ostéoblastes, cette protéine transmembranaire est structurellement similaire à Lrp5/6 en ce qu’elle peut lier sclérostine et Dkk1, mais elle en diffère de par le fait qu’elle ne peut pas activer la voie Wnt/β-caténine 71, 72.
Considérant son affinité pour les inhibiteurs de la voie Wnt, sa fonction proposée est de retenir la sclérostine et Dkk1 près du site où ils doivent agir 72, 74.
11
Fig. 1.4 : Activation et inactivation de la voie Wnt dans un ostéoblaste Lorsque la voie est inactive (gauche) la β-caténine est dégradée alors que si la voie est active, la β-caténine n’est pas dégradée et peut activer la transcription de gènes
La régulation de la production d’inhibiteurs de la voie Wnt
Les ostéocytes sont une source importante de Dkk1 et la source principale de sclérostine. Leur sécrétion peut être activée ou inhibée par plusieurs facteurs. La production de sclérostine est généralement augmentée par une diminution de la pression mécanique exercée sur le réseau ostéocytaire, ce qui permet de réduire la formation osseuse lorsqu’elle n’est pas nécessaire 75. Lecalcitriol, que l’ostéocyte peut détecter grâce aux VDR présents dans son cytoplasme et son noyau, augmente également la transcription de sclérostine 76-78. Le calcitriol pourrait aussi augmenter la transcription de
sclérostine en supprimant la PTH, l’un de ses inhibiteurs connus 76. En effet, la PTH supprime la production
de sclérostine et de Dkk1 dans l’os, possiblement pour que la résorption accrue soit compensée par plus de formation osseuse 16, 27, 79, 80. Comme la PTH est également produite en réponse à l’hyperphosphatémie, cette
suppression pourrait aussi viser à augmenter la déposition de P dans l’os. Le phosphate est d’ailleurs lui-même associé à la suppression de la sclérostine et de Dkk1 in vitro 81. Finalement, à l’inverse d’un relâchement, une
augmentation de la pression ressentie par les ostéocytes supprime la production et de Dkk1 de sclérostine pour que l’os soit solidifié par une formation accrue 50, 82.
Régulation de la différentiation et de l’activité ostéoblastique par la voie Wnt/β-caténine
Tel que mentionné précédemment, des niveaux élevés de β-caténine dans les tissus osseux sont associés à une augmentation de la différentiation et de la survie ostéoblastique qui se traduit par un gain de masse osseuse 46, 52. Outre les gènes12
impliqués dans la différentiation comme RunX2 et osterix, la β-caténine semble aussi activer la production de FGF23 et d’OPG, alors qu’elle supprime celle de RANKL 83, 84. La diminution du ratio RANKL/OPG causée
par l’accumulation de β-caténine est associée à une suppression de la différenciation ostéoclastique et donc de la résorption, ce qui contribue au gain net de masse osseuse 51, 53, 83, 85, 86. On observe l’inverse si les niveaux de
β-caténine sont bas, et ce de façon plus prononcée dans l’os trabéculaire que dans l’os cortical 31, 83. Enfin,
l’activation de la voie Wnt/β-caténine stimule la minéralisation de la matrice par les ostéoblastes 33. Bien que
l’activité de la voie Wnt/β-caténine soit un déterminant important de la différenciation ostéoblastique, d’autres facteurs l’influencent, comme le facteur de croissance BMP-2 87.
La voie Wnt/β-caténine ostéocytaire
En plus d’inhiber la formation osseuse et d’augmenter la résorption, la sclérostine semble freiner la maturation des ostéoblastes en ostéocytes, sans compter que l’inhibition de la voie Wnt/β-caténine semble nuire à la survie de ces derniers 46, 70. Même dans les ostéocytes matures, la voieWnt/β-caténine est présente et elle influence le métabolisme osseux. À preuve, l’activation de Lrp5 ou β-caténine spécifiquement dans l’ostéocyte augmente la formation osseuse même si ces cellules ne sécrètent plus de matrice osseuse, alors que la délétion de Lrp5 dans ces mêmes cellules diminue le gain osseux en réponse à un stress mécanique 46, 51, 88. On observe aussi dans l’ostéocyte le même effet stimulant de la β-caténine sur
OPG que dans l’ostéoblaste, mais contrairement à ce qu’on observait dans ce dernier, RANKL est aussi augmenté et fait en sorte que le ratio RANKL/OPG est en faveur de la résorption 51, 89.
Le rôle de la PTH dans le métabolisme minéral osseux
La PTH intermittente
Il a déjà été mentionné que la PTH a des effets pro-résorptifs sur l’os, mais elle peut aussi avoir d’autres effets sur l’os selon qu’elle soit élevée à court ou à long terme. Si l’augmentation de PTH est brève, soit environ 1 heure par jour, on observe une augmentation de la formation et de la densité osseuse, ce qui est principalement dû à une augmentation du nombre, de la densité et de la survie ostéoblastique 47, 90, 91.Ces effets anaboliques de la PTH sur l’os semblent impliquer l’activation de la voie Wnt/β-caténine puisqu’ils ne sont plus observés si Lrp6 est systématiquement supprimé 92. En effet, il a été montré que la PTH peut se
lier à la fois à Lrp6 et à son récepteur PTHR1 sur les cellules ostéoblastiques et qu’il en résulte une activation de la Protéine Kinase A (PKA), une enzyme qui a la capacité de phosphoryler Lrp6 et d’ainsi activer la voie Wnt/β-caténine de façon non-canonique 93. Ce mécanisme ne semble activé que si la PTH est élevée de façon
intermittente et il ne semble pas permettre la phosphorylation de Lrp5 malgré la similarité de ce dernier avec Lrp6 93, 94.
13
La PTH continue
Au contraire, une élévation continue de quatre heures ou plus par jour mène plutôt à une perte nette d’os malgré la formation accrue en raison d’une augmentation de la résorption 91, 95. En effet, la PTHfait augmenter le ratio RANKL/OPG dans les ostéoblastes et les ostéocytes à plus long terme 26, 80. La
résorption, qui affecte particulièrement l’os cortical, est intensive mais localisée et elle mène à la formation de tunnels osseux 90, 96. L’élévation maintenue de la PTH mène également à une différenciation incomplète des
pré-ostéoblastes, qui se comportent alors comme des fibroblastes tant que les niveaux de PTH demeurent élevés 96.
L’insuffisance rénale chronique
L’IRC
Comme mentionné plus tôt, le rein joue un rôle central dans la gestion des niveaux de Ca et de P. Il n’est donc pas étonnant qu’une perte de fonction rénale se traduise par des conséquences sérieuses sur le métabolisme minéral et l’os. C’est ce qu’on observe en insuffisance rénale chronique (IRC), une maladie caractérisée par une perte de fonction rénale irréversible qui mène à de la fragilité osseuse. On observe également de la calcification vasculaire chez les patients souffrant d’IRC, ce qui représente une autre conséquence du déséquilibre phosphocalcique. On parle plus précisément d’IRC lorsque le taux de filtration rénale, qui est normalement plus haut que 90 mL/min/1.73 m2, passe sous 60 ml/min/1.73 m2. Un diagnosticd’IRC peut aussi être appliqué lorsque le taux de filtration est plus haut que 60 ml/min/1.73 m2 mais que des
dommages rénaux sont observables 97. La sévérité de la maladie rénale est classifiée en 5 stades : Le stade 1, où
la fonction rénale est maintenue mais où l’on peut observer de l’albuminurie et des dommages rénaux, le stade 2, où la fonction rénale est légèrement réduite sans qu’il y ait de conséquences sérieuses, le stade 3, où le taux de filtration passe sous 60 ml/min/1.73m2 et où l’on commence à observer des effets plus sérieux qui doivent
être traités, le stade 4, où la fonction rénale est drastiquement réduite et où la dialyse est pratiquée dans 20% des cas et enfin le stade 5, où le taux de filtration est si bas que la dialyse est généralement inévitable 97, 98. La
plupart des patients vont décéder avant d’atteindre ce dernier stade, le risque de mortalité augmentant exponentiellement alors que la fonction rénale diminue 98, 99. La principale cause de mortalité en IRC est la
maladie cardiovasculaire, incluant la calcification vasculaire 100. La proportion de la population souffrant d’IRC
est en constante augmentation en raison de l’obésité, du diabète et des mauvaises habitudes de vie comme le manque d’exercice, si bien qu’on prévoit qu’elle sera de 16.7% chez les américains de plus de 30 ans en 2030 97,
101, 102. Au Canada en 2013, il a été estimé que c’est 3 000 000 de personnes qui souffraient d’IRC consciemment
ou non, ce qui correspond à 12.5% de la population, soit à peu près la même proportion que dans la population mondiale en général 103, 104. Par contre, des 3 millions de personnes souffrant d’IRC au Canada, seulement 730
14
Le Ca et le P en IRC
Parmi les anomalies du métabolisme minéral osseux souvent retrouvées en IRC, on note une élévation du phosphore, une surexpression de la sclérostine et de FGF23, de l’hyperparathyroïdie et une déficience en Ca et en calcitriol. La perte de masse rénale fonctionnelle en IRC entraîne une diminution de la production de calcitriol, si bien qu’environ 35% des patients souffrent d’une déficience avant même l’élévation de la PTH et du phosphore et s’ajoute à cela l’effet suppresseur de FGF23 et du P sur la 1-α-hydroxylase 1, 105-108. L’IRC est aussi associée à une diminution de l’expression du VDR dans les tissus-cibles du calcitriol,amplifiant les effets de la déficience 107. La déficience en calcitriol en IRC est associée à plus de mortalité et à
une progression plus rapide de la maladie, alors que les patients avec de plus hauts niveaux voient au contraire leurs chances de survie améliorées et la progression de leur IRC ralentie 1, 109-111. La déficience en calcitriol
affecte aussi négativement l’absorption du Ca, ce qui peut mener à de l’hypocalcémie dans certains cas, particulièrement aux stades plus avancés de la maladie 112. La déficience en Ca et en calcitriol a pour effet de
stimuler la production de PTH, mais cela n’est pas toujours suffisant pour rétablir les niveaux de Ca et de calcitriol, d’abord en raison de la perte de masse rénale et des autres facteurs qui limite la production de calcitriol mais aussi en raison d’une diminution globale de l’expression du récepteur PTHR1 qui mène à une résistance à la PTH 113. Il n’est donc pas étonnant que de la vitamine D ou des molécules semblables soient souvent
prescrites aux patients IRC. Dans ce cas précis, on peut éventuellement observer de l’hypercalcémie puisque les reins excrètent moins bien le Ca à partir du stade 3 de l’IRC 112. Le P est aussi moins excrété, faisant en sorte
qu’il s’accumule progressivement dans la circulation malgré une légère diminution initiale causée par la déficience en calcitriol 4, 108. De plus, une fois l’hyperphosphatémie établie, elle intensifie la suppression de la
1-α-hydroxylase et stimule la production de PTH 114. Elle est de plus associée à un plus fort taux de mortalité
spontanée et cardiovasculaire, à la calcification vasculaire et à la progression de l’IRC, l’effort supplémentaire déployé par les reins pour éliminer le phosphore contribuant à les endommager 22, 115-119. À l’inverse, une
restriction de l’apport en phosphore semble suffisante pour rétablir une partie de la fonction rénale chez le rat
115.
La PTH en IRC
Au cours de la progression de l’IRC, l’hyperphosphatémie, la déficience en calcitriol et l’hypocalcémie qui en découle mène au développement d’hyperparathyroïdie secondaire 108, 120. Dans cettepathologie, les glandes parathyroïdes deviennent hyperplasiques et moins sensibles à la régulation par le calcium et le calcitriol 114, 120. Si 17% des patients en souffrent aux stades plus précoces, c’est jusqu’à 85% des patients
qui en sont atteints au stade terminal 119. À ce stade, même l’hyperparathyroïdie ne permet plus de maintenir
des niveaux convenables de P car les reins endommagés n’arrivent plus à en excréter l’excès 121.
L’hyperparathyroïdie peut même contribuer à l’hyperphosphatémie en stimulant la libération de P osseux par les ostéoclastes, ce qui a aussi pour effet d’affaiblir l’os 122. Ainsi, bien que la PTH ait pour but de rétablir
15
calcification vasculaire et l’accélération du remodelage osseux. Son association avec la mortalité et le risque de fractures suit ainsi une courbe en U, les risques étant augmentés lorsque la concentration s’éloigne de la valeur normale 110, 123, 124. Des traitements visant à augmenter la concentration de calcitriol et de calcium ou à diminuer
celle de phosphore peuvent être administrés pour maintenir des niveaux de PTH sécuritaires. Dans notre étude, du calcium, du phosphore et de la vitamine D seront administrés aux animaux IRC, ce qui devrait diminuer les niveaux de PTH.
FGF23 en IRC
Les niveaux de FGF23 sont particulièrement élevés aux stades avancés de l’IRC mais sont tout de mêmes augmentés dès le début de la maladie, principalement en réaction à l’hyperphosphatémie et l’hyperparathyroïdie mais peut-être aussi en raison de la diminution d’α-Klotho, de l’élévation de sclérostine, de l’inflammation et de la déficience en fer qui sont souvent observées en IRC 125-127. L’élévation de FGF23 semblepar contre avoir lieu avant toute élévation importante de P ou de PTH, ce qui pourrait suggérer que FGF23 contribue à maintenir leurs niveaux normaux pendant un certain temps 22, 106, 126, 128. Il n’est par contre pas
certain que FGF23 soit très efficace à supprimer la PTH en IRC, d’une part parce que son co-récepteur α-Klotho est moins exprimé et d’autre part parce que les glandes parathyroïdes expriment moins le récepteur de FGF23 FGFR1 pour une raison inconnue 8, 129, 130. FGF23 semble même contribuer à l’hyperparathyroïdie
en IRC en raison de sa suppression de la production de calcitriol 128, 131, 132. Une fois l’hyperparathyroïdie établie,
elle a un effet stimulant clair sur la production de FGF23, tel qu’illustré par le fait qu’une parathyroïdectomie permet de l’éviter ou de la renverser 16, 133. FGF23 a parfois été associé à la mortalité en IRC, mais d’autres
sources ne rapportent aucun lien 110. Pour expliquer cela, il a été suggéré que l’effet de FGF23 sur la survie
pourrait dépendre de la sévérité de l’IRC. En effet, l’inhibition hâtive de FGF23 est dommageable car elle fait augmenter les niveaux de calcitriol, calcium et phosphore et stimule du coup le développement de calcification vasculaire. Au contraire, l’inhibition plus tardive de FGF23 est bénéfique car elle réduit les risques de mortalité et de fractures qui sont généralement associés à FGF23 au stade terminal, sans compter que l’inhibition de FGF23 ne mène pas à une élévation de la calcification vasculaire à ce stade car les reins produisent plus difficilement le calcitriol 126, 132.
16
α-Klotho en IRC
Au contraire de FGF23, α-Klotho voit sa production diminuée dans le rein et les glandes parathyroïdes dès le début de l’IRC, ce qui pourrait contribuer à l’élévation hâtive de FGF23 130, 134-136. La raisonde cette diminution demeure inconnue, mais elle semble associée à la sévérité de l’atteinte rénale 137. Ce pourrait
être FGF23 lui-même qui inhibe son co-récepteur, ou encore la déficience en calcitriol qui diminuerait son expression 8, 138. L’observation que l’administration d’un analogue de vitamine D permet d’augmenter
l’expression de α-Klotho dans les reins et les glandes parathyroïdes de rats IRC supporte cette seconde hypothèse 139.
Les inhibiteurs de la voie Wnt en IRC
Il a été rapporté dans de nombreuses études que les niveaux sanguins de sclérostine sont augmentés en IRC. Élevés dès le stade 3, ils continuent d’augmenter alors que la fonction rénale se détériore et pourraient donc jouer un rôle dans la fragilité osseuse dont souffrent les patients IRC 82, 140, 141.Bien que la cause de l’élévation soit encore inconnue, une corrélation positive avec les niveaux de phosphore circulants a été observée dans un certain nombre d’études 140, 142-145. Cette corrélation positive a aussi été
observée avec FGF23 dans certains cas 143, 145. De façon générale, la PTH corrèle plutôt inversement avec la
sclérostine puisqu’elle en inhibe la production 144, 146-149, mais ce lien n’est pas présent dans toutes les études 150, 151. De plus, les niveaux de sclérostine continuent à augmenter malgré l’hyperparathyroïdie 140, 152, 153. Dans
certaines études, les niveaux de sclérostine semblent positivement liés à une diminution de mortalité toute-cause et cardiovasculaire 149, 150, 154, alors qu’ils sont plutôt associés positivement à la mortalité 155 et aux événements
cardiovasculaires dans d’autres 156. Une méta-analyse récente a quant à elle pour conclusion qu’il n’y a aucun
lien entre la mortalité et les niveaux de sclérostine 157. L’implication d’autres inhibiteurs de la voie
Wnt/β-caténine comme Dkk1 a aussi été étudiée mais les résultats sont plus variables 142, 148. Comme la
sclérostine, Dkk1 a été rapporté comme étant augmenté par l’hyperphosphatémie en IRC, et ses niveaux semblent aussi corréler avec FGF23 142, 148. Une étude récente montre d’ailleurs la stimulation directe de la
production de Dkk1 par FGF23 en culture et in vivo 158. Il y a par contre peu d’études rapportant qu’il soit
augmenté en IRC de façon générale 82, 148, 159. Dans notre modèle de rat IRC, nous nous attendons à observer
une élévation de sclérostine dans la circulation des animaux, et possiblement de Dkk1 également.
L’os en IRC
Les anomalies osseuses en IRC
En IRC, les désordres du métabolisme minéral mènent à des anomalies osseuses qui peuvent mener à leur tour à une fragilité osseuse accrue. Le risque de fractures est augmenté dès les premiers stades de la maladie et peut être 4.4 fois plus élevé que dans la population générale au stade le plus avancé 160-163. À ce stade, 5 à 10% des patients subiront au moins une fracture par période de 3 ans et devront faire face17
ont effectivement 2 fois plus de risques de décéder des suites de ladite fracture qu’une personne ne souffrant pas d’IRC et ont aussi de moins bonnes chances de survie à long terme, 64% des patients subissant une fracture au stade terminal de l’IRC décédant dans l’année suivante 123, 161, 165.
Le déséquilibre minéral et les anomalies osseuses
Les anomalies osseuses en IRC sont le fruit de multiples facteurs. D’abord, la perte de capacité de filtration rénale fait en sorte que le P s’accumule en circulation, et des niveaux élevés de P ont été associés à des caractéristiques osseuses négatives comme un volume trabéculaire réduit et une perte de connectivité au niveau de l’os trabéculaire, ce qui semble être réversible si les niveaux de P sont maintenus sous contrôle 117, 166. L’hyperphosphatémie pourrait aussi détériorer l’architecture osseuse enentraînant l’apoptose des ostéoblastes et des ostéocytes, ce qui freine la formation osseuse 142. Ensuite, des
niveaux bas de calcitriol sont aussi associés à un plus grand risque de fracture de la hanche, en partie car ils entraînent une diminution de l’expression du VDR, ce qui est associé à une diminution de la formation osseuse
167, 168. La déficience en calcitriol, et par extension en Ca, stimule de plus la production de PTH, qui a des effets
considérables sur l’os en stimulant la résorption osseuse et en causant une pathologie osseuse nommée os hyperparathyroïde qui sera vue plus en détails plus tard. Toute tentative de rétablir des niveaux de PTH normaux, que ce soit par l’administration de calcitriol ou de calcium ou par l’administration de chélateurs de phosphore, peut avoir un trop grand effet suppresseur et mener à un ralentissement du remodelage osseux, ce qui est tout aussi délétère pour la structure osseuse qu’un remodelage accéléré 107. FGF23 a aussi des effets
osseux en IRC. Alors que certaines sources rapportent que c’est seulement aux stades plus avancés qu’on observe une hausse de la transcription de FGF23 dans l’os chez la souris, une augmentation a été observée dès les premiers stades de la maladie dans les os de patients et elle se poursuit au cours de la progression de l’IRC
152, 169. Des niveaux élevés en circulation sont associés à un plus grand risque de fractures chez les patients. Une
étude animale nous renseigne sur le mécanisme possible en rapportant que FGF23 et associé à une perte de volume et à un amincissement de l’os 170. Néanmoins, d’autres études chez l’humain rapportent une moins
grande quantité d’os non minéralisé chez les patients au stade terminal de la maladie, indiquant que FGF23 encouragerait la minéralisation en IRC 171, 172.
Les inhibiteurs
de la voieWnt et les anomalies osseuses
La voie Wnt/β-caténine a tendance à être inhibée dans l’os en IRC, ce qui pourrait contribuer à ralentir le remodelage osseux 173. Il a en effet été observé que la voieWnt/β-caténine est inhibée dans les ostéocytes de souris IRC et que les niveaux de β-caténine phosphorylée, et donc destinée à être dégradée pour prévenir l’activation de la voie Wnt/β-caténine, ont tendance à être augmentés dans les os de patients IRC 152, 174. Dans le modèle de souris IRC, des niveaux plus élevés de
18
de la voie Wnt pourraient être responsables de cette dernière 174. En induisant la production de sclérostine chez
des rats IRC parathyroïdectomisés par l’administration d’une diète haute en phosphore, Ferreira et al. ont observé une réduction du remodelage et du volume osseux, ce qui met en lumière le fait que l’hyperphosphatémie peut avoir un effet délétère sur l’os sans passer par la PTH 142. Dans un autre modèle
d’IRC avec hypoparathyroïdie, la suppression de la sclérostine semble augmenter le volume et la minéralisation trabéculaire, suggérant que ces deux processus sont perturbés par la sclérostine 175. Des observations semblables
ont été faites chez l’humain, des patients ayant plus de sclérostine en circulation exprimant moins de phosphatase alcaline dans une étude, ce qui est indicateur d’une formation osseuse ralentie 150. La sclérostine
corrélait aussi inversement avec le remodelage osseux dans d’autres études, et elle serait même un prédicteur de perte osseuse 146, 176, 177. Étonnamment, un lien positif a été découvert entre la sclérostine et la densité minérale
osseuse en IRC, ce qui semble à première vue en désaccord avec les effets négatifs précédemment mentionnés mais qui pourrait dériver du fait qu’une masse osseuse plus grande contient plus d’ostéocytes sécrétant la sclérostine 150, 151, 176, 178. Ce lien positif a aussi été observé en dehors du contexte de l’IRC chez la femme
ménopausée et la même explication a été avancée 179. Pour ce qui est de Dkk1, quelques études n’ont observé
aucun lien entre Dkk1 et les paramètres osseux en IRC, et le même constat a été fait chez la femme ménopausée
146, 178, 179. Une étude rapporte toutefois un lien inverse avec la densité osseuse chez les patients pré-dialysés 151.
Pour ce qui est de notre modèle animal, nous émettons l’hypothèse que l’expression de sclérostine et de Dkk1 sera élevée dans l’os, ce qui pourrait contribuer à ralentir le remodelage osseux.
Selon la combinaison de facteurs influençant le remodelage osseux qui sont présents, différentes anomalies osseuses peuvent être observées. Elles sont classifiées en quatre catégories : l’os hyperparathyroïde, l’os adynamique, l’ostéomalacie et l’anomalie osseuse mixte.