HAL Id: tel-03141287
https://tel.archives-ouvertes.fr/tel-03141287
Submitted on 15 Feb 2021HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
et le diagnostic
Lucie Jamgotchian
To cite this version:
Lucie Jamgotchian. Micelles fluorées et polydiacétyléniques pour la thérapie et le diagnostic. Chimie organique. Université Paris-Saclay, 2020. Français. �NNT : 2020UPASF037�. �tel-03141287�
Micelles fluorées et
polydiacétyléniques pour la
thérapie et le diagnostic
Thèse de doctorat de l'université Paris-Saclay
École doctorale n° 571, Sciences chimiques : molécules, matériaux, instrumentation et biosystèmes (2MIB) Spécialité : Chimie Unité de recherche : Université Paris-Saclay, CEA, INRAE, Médicaments et Technologies pour la Santé, 91191 Gif-sur-Yvette, FranceRéférent : Faculté des sciences d’Orsay
Thèse présentée et soutenue en visio-conférence totale,
le 17 décembre 2020, par
Lucie JAMGOTCHIAN
Composition du Jury
Elias FATTAL
Professeur des Universités, Université Paris-Saclay Président du jury
Patrick SAULNIER
Professeur des Universités, Université d’Angers Rapporteur & Examinateur
Cécilia MENARD-MOYON
Chargée de recherche CNRS, HDR, Université de Strasbourg Rapporteur & Examinatrice
Cyrille RICHARD
Directeur de recherche CNRS, Université Paris Descartes Examinateur
Edmond GRAVEL
Chercheur CEA, Université Paris-Saclay Examinateur
Eric DORIS
Chercheur CEA, Université Paris-Saclay Directeur de thèse
Thès
e de
doctorat
NNT : 2 02 0U PA SF 03 7À Monsieur Elias Fattal, professeur à l’Université Paris-Sud, à Monsieur Patrick Saulnier, professeur à l’Université d’Angers, à Madame Cécilia Ménard-Moyon, chargée de recherche au CNRS à l’Université de Strasbourg, à Monsieur Cyrille Richard, directeur de recherche au CNRS à l’Université Paris-Descartes, à Monsieur Edmond Gravel, chercheur au CEA de Saclay ainsi qu’à Monsieur Eric Doris, chercheur au CEA de Saclay, qui me font l’honneur de juger mon travail et que je remercie profondément.
Je voudrais remercier le Dr. Frédéric Taran, chef du Service de Chimie Bioorganique et de Marquage, pour m’avoir permis d’effectuer ces quatre années dans les meilleures conditions possibles.
Mes remerciements s’adressent ensuite à mon directeur de thèse, Monsieur Eric Doris et mon encadrant, Monsieur Edmond Gravel pour m’avoir permis de travailler à vos côtés pendant toutes ces années. Je vous remercie pour votre confiance, pour votre soutien et votre aide surtout durant les dernières semaines, pour nos discussions autour des différents projets sur lesquels j’ai pu travailler et sur lesquels je me suis sentie épanouie. Merci à tous les deux pour le temps que vous avez consacré à la relecture de mon manuscrit et pour vos encouragements de fin de thèse que j’ai particulièrement apprécié.
Mes pensées vont également au Dr. Laurent Devel. J’ai pu découvrir la vie des métallo-protéases mais j’ai surtout été initiée à ces projets « à l’interface » avant de m’engager sur cette thèse. Tu as toujours été de bons conseils et je n’oublierai jamais ta disponibilité. Je te remercie pour le temps que tu as consacré à la relecture du manuscrit. Je souhaite également remercier Madame Mylène Bernès pour son aide précieuse durant mes premières années au CEA et au fil de mes projets. Ça a toujours été un plaisir pour moi de travailler avec vous ainsi que tous les membres du SIMOS que je n’oublie pas ! Bien que Mylène ne fasse plus partie de l’équipe, je vous souhaite à tous le meilleur pour la suite.
Je voudrais maintenant remercier mes nombreux collaborateurs en commençant par le Dr. Sébastien Meriaux, le Dr. Solenne Vaillant, Monsieur Erwan Selingue, Madame Françoise Geffroy et toute l’équipe de Neurospin. Merci pour l’aide que vous m’avez apporté mais surtout pour votre confiance. Votre implication dans les études in vitro puis in vivo par IRM a été d’une grande importance dans la réalisation de ma thèse. Vous avez été d’un grand soutien et d’une grande aide. Vous m’avez notamment fait confiance pour la manipulation des IRM et à l’aide de vos enseignements, j’ai pu effectuer une partie des manips vivo en parfaite autonomie. J’ai été très heureuse de travailler avec vous, j’en garderai un très bon souvenir.
Je souhaite également remercier le Dr. Charles Truillet, le Dr. Vu-Long Tran ainsi que toute l’équipe du Service Hospitalier Frédéric Joliot à Orsay. Nous avons commencé une collaboration sur l’imagerie CT-scan puis PET-scan. Merci de m’avoir initiée à ces systèmes d’imagerie. J’espère que la suite du projet sur la radio-sensibilisation sera fructueuse !
Je souhaiterais remercier Madame Elodie Barruet, pour toutes les analyses ICP-MS ainsi que Madame Fabienne Testard pour les analyses SAXS. Merci pour votre aide et pour tous ces
Guillaume Pinna pour les tests de cytotoxicité. Merci pour votre disponibilité, votre réactivité et pour les différentes discussions que nous avons pu avoir autour des projets.
Mes remerciements les plus profonds s’adressent à toute l’équipe d’analyse du SCBM qui a joué un rôle important dans la réalisation de mon travail de thèse. Merci à David-Alexandre Buisson, Amélie Goudet et Sabrina Lebrequier, mais également à Céline Chollet et Elodie Marcon. Je vous remercie pour toutes les analyses RMN du fluor et toutes les masses intro-directes que vous avez pu effectuer. Je vous remercie pour vos conseils et votre disponibilité. Vous avez été pour moi une source de bonne humeur, alors ne changez pas. Je vous souhaite plein de belles choses pour la suite.
Merci à toutes les personnes du SCBM que j’ai pu côtoyer tous les jours pendant 4 ans ! Merci aux permanents : Karen, Antoine, Davide, Dominique, Olivier, Jean-Christophe, Marie-Pierre, Cristelle, Christophe Dugave, Christophe Créminion, Chantal et Bernard avec qui je n’ai pas travaillé directement. Merci pour votre présence, pour nos échanges et vos encouragements surtout en fin de thèse.
Merci aux doctorants et post-doctorants du Carbone-14 et de la recherche qui ont marqué mon expérience doctorale. En particulier merci à Margaux, Karine, Antonio, Gianluca, Robin, Alex, Maxime, Hugo et aux posts-docs Mathilde, Audrey, Serena, Victor (couroucoucou roploplo), Expédite. Merci pour tous ces apéros, pour ces sorties dans Paris, les running le midi, pour nos larmes de joie et de tristesse ! C’était une aventure humaine extraordinaire ! Avec vous, l’expérience de la thèse semble être un long fleuve tranquille ! J’en garderai que de bons souvenirs. J’ai vraiment fait de belles rencontres et j’espère que nous garderons contacts.
Finalement, je souhaiterais remercier toutes les personnes qui ont partagé mon quotidien au laboratoire ! Les nouveaux, les anciens, merci à tous pour votre présence, vos encouragements, vos sourires, vos blagues et vos pains aux chocolats que j’ai particulièrement appréciés ! Je pense particulièrement à Martina, Marion, Arun, Gopi, Danaji, Minh-Duc, Emilie, Timothée, Alaric, Viktor, Anaëlle, Alberto, Mickaël, Emmanuel, Joseph, Sophie, Florence, Sébastien, Grégory. J’espère que nous garderons contacts à l’avenir. Merci pour votre soutien, pour tous nos échanges et pour tous ces moments de partage.
Je souhaiterais remercier plus particulièrement Sophia. Tu es devenue une personne très importante pour moi. Je te remercie profondément pour tout le soutien que tu m’as apporté dans les périodes les plus difficiles de ma vie. Je te remercie pour ta bonne humeur au quotidien, tes encouragements, ta disponibilité. Je te remercie pour nos discussions, nos délires et nos galères… que nous sommes seules à comprendre et à partager… MERCI pour ça ! Je sais que j’ai été d’un grand soutien pour toi aussi, sache que je serai toujours là. Je te souhaite beaucoup de courage pour la suite de la thèse. Je suis sûre que tout se passera bien !!
Merci à Jérémy et Lucas avec qui j’ai partagé le laboratoire pendant 3 ans. Vous êtes devenus des personnes très importantes pour moi et je suis très heureuse de vous avoir connue. Nous avons réussi à surmonter pas mal d’épreuves ensemble (nos premières galères scientifiques, administratives, nos galères personnelles, nos premiers doutes) mais sur une chanson de Rita
dans les périodes les plus difficiles (il ne faut pas grand-chose…). Je vous souhaite plein de belles choses pour la suite ! Cette ambiance va terriblement me manquer.
Merci à mes amies Elodie, Marine, Séverine, Cathy et Coralie. Vous m’avez permis de garder un pied sur terre mais aussi de m’évader un peu lorsque cela était nécessaire. Merci pour toutes ces soirées électro à Paris, Lyon ou Barcelone, pour tous ces fous-rires, pour nos virées et nos vacances en bord de mer ou à la montagne, dans notre région natale adorée (avant l’arrivée du Covid…). Malgré la distance, nous avons continué à nous voir régulièrement, à nous appeler et je vous remercie pour vos messages d’encouragements pendant les périodes les plus difficiles. J’espère qu’on aura encore plein de beaux moments à partager.
Merci à mes colocataires : Linh, Arnaud, Virginie, Bérangère, Pascal, Sid-Ahmed, Victor, Oliver, Solène, Guillaume, Corentin, Anh, Elodie. Vous êtes des personnes incroyables. Vous avez été les premiers à me supporter au quotidien, le soir après une journée de travail intense… Merci pour votre patience, merci pour tous nos délires, merci pour votre écoute, merci pour tous ces moments de partage… Merci pour ces petites escapades à Conches-en-Ouche ou à Chateauneuf-sur-Cher ! Je n’oublierai jamais cette expérience de colocation à vos côtés (sans oublier le confinement, que j’ai particulièrement apprécié…). Pour certains, vous êtes devenus de très bons amis, j’espère que nous garderons contact… !
Mes derniers remerciements s’adressent à mes parents et ma sœur. Vivre en région parisienne, pour une fille du sud, ce n’est vraiment pas facile tous les jours…Malgré les quelques 900 km qui nous séparent, vous avez toujours été présents et disponibles, avec toujours de bonnes paroles pour m’encourager. Cette thèse marque la fin d’un long parcours, qui, sans vous, sans votre aide n’aurait pu s’achever. Ces 3 dernières années ont été particulièrement difficiles et nous avons traversé des épreuves assez douloureuses. Merci de m’avoir donné la force de continuer à me battre et à travailler sur cette thèse. Je vous remercie pour tout ce que vous avez fait pour moi et pour tout ce que vous m’avez transmis et appris.
Merci à mes grands-parents, Odette et Grégoire, qui m’ont vu grandir et devenir une adulte, qui m’ont soutenue et encouragée tout au long de ma thèse. À ma grand-mère Adrigue, qui croyait en moi dès mon jeune âge. Mon seul regret est que vous ne puissiez partager cette réussite avec moi. Vous me manquez énormément. À mon grand-père Vrege qui, par sa force, me permet de penser que rien n’est impossible !
1
Abréviations --- 7
Avant-propos --- 11
Introduction générale : utilisation de micelles en nanomédecine --- 10
I – Les systèmes nanométriques pour le diagnostic et la thérapie --- 15
1- Nanomédecine et vectorisation--- 15
2- La vectorisation : définitions et optimisation du concept --- 15
2.1- Vecteurs furtifs : Effet EPR et ciblage passif --- 16
2.2- Ligands de surface : reconnaissance cellulaire et ciblage actif --- 18
II- Etat de l’art sur le développement de vecteurs nanoparticulaires --- 20
1- Composition des nanoparticules organiques --- 21
2- Nanoparticules : outils de vectorisation --- 22
2.1- Les liposomes --- 22
2.2- Les nanocapsules et les nanosphères --- 24
2.3- Les nanoparticules de carbone --- 25
2.4- Les systèmes mono-macromoléculaires --- 26
2.5- Les micelles --- 28
III- Auto-assemblage d’amphiphiles et formation de micelles --- 29
1- Interactions entre auto-assemblages --- 29
2- Structures des auto-assemblages : concepts historiques --- 30
3- Concentration micellaire critique --- 32
4- Stabilisation de la micelle --- 33
4.1- Stabilisation par réticulation --- 33
4.2- Stabilisation par des composés perfluorocarbonés --- 34
V – Conclusion et objectifs de la thèse --- 35
Chapitre 1 : Micelles polydiacétyléniques pour le diagnostic et le traitement de l’athérosclérose --- 31
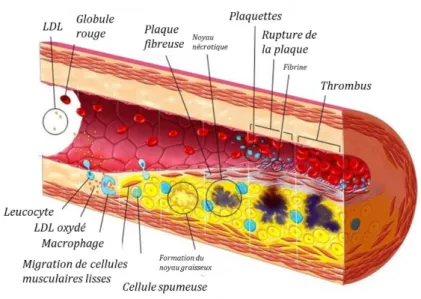
I- Plaque d’athérome et micelles PDA-PEG : état de l’art --- 39
1- L’athérosclérose et la découverte du GW3965 --- 39
1.1- Développement de la plaque d’athérome --- 39
1.2- Identification du GW3965 comme agoniste partiel des LXR --- 41
2- Micelles PDA-PEG : développement et études préliminaires--- 45
2.1- Historique sur le développement des micelles PDA-PEG --- 45
2
3- Objectifs --- 51
II- Formulation d’un composé agoniste des LXR --- 53
1- Synthèse des amphiphiles --- 53
2- Assemblage des micelles et caractérisations --- 55
3- Étude de toxicité --- 57 3.1 – Effet de la polymérisation --- 57 3.2- Distribution intracellulaire --- 59 4- Synthèse du GW3965 --- 59 5- Formulation du GW3965 --- 60 5.1- Encapsulation du GW3965 --- 60 5.2- Caractérisations de la formulation --- 62
5.2.1- Détermination de la taille des particules --- 62
5.2.2- Cinétique de libération du GW3965 --- 62
5.2.3- Stabilité au stockage --- 63
5.2.4- Efficacité in vitro --- 64
III- Études de pharmacocinétique et de biodistribution --- 65
1- Principes généraux sur la pharmacocinétique --- 65
2- Choix du modèle animal --- 66
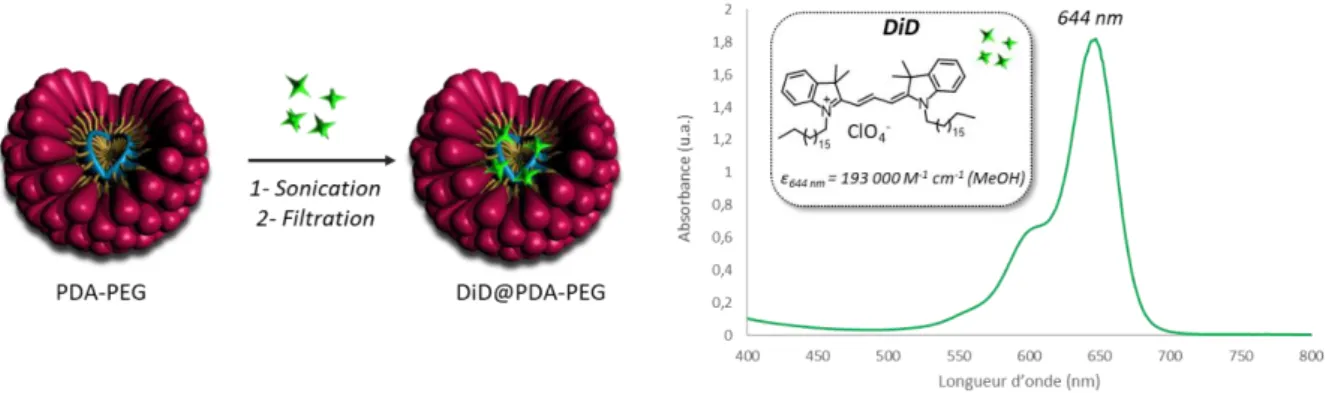
3- Étude de pharmacocinétique et de biodistribution des micelles --- 67
3.1- Formulation des micelles encapsulant un fluorophore --- 67
3.2- Étude de pharmacocinétique après administration par voie intraveineuse --- 68
3.4- Étude de biodistribution après injection par voie intra-veineuse --- 69
4- Étude pharmacocinétique de la formulation du GW3965 --- 70
IV- Formulation de deuxième génération --- 71
1- Optimisation structurale et formulation --- 71
1.1- Synthèse des dérivés du GW3965 --- 72
1.2- Formulation dans les micelles PDA-PEG et caractérisations --- 73
1.3- Études in vitro sur l’efficacité de la formulation --- 74
2- Études in vivo des formulations des dérivés du GW --- 75
2.1- Étude de pharmacocinétique --- 75
2.2- Étude de l’activité transcriptionnelle in vivo --- 77
V- Fonctionnalisation pour du ciblage actif --- 79
3
2- Étude in vivo avec le RXP470.1 --- 82
VI- Conclusions et perspectives --- 83
Chapitre 2 : Micelles fluorées pour l’imagerie par résonance magnétique du fluor --- 85
I- L’IRM 19F en tant qu’outil diagnostique de tumeurs solides --- 87
1- Principe de l’IRM --- 87
1.1- Principe physique --- 87
1.2- Agents de contraste développés pour l’IRM --- 89
2- IRM du fluor-19 --- 89
2.1- Avantages du fluor-19 --- 89
2.2- Développement de sondes fluorées --- 90
3- Applications à l’imagerie de tissus tumoraux --- 93
4- Vers la conception de micelles fluorées --- 93
5- Objectifs --- 94
II- Formulation du PERFECTA à l’aide de micelles fluorées --- 94
1- Synthèse des amphiphiles PFTD-PEG --- 94
2- Assemblage des micelles et caractérisations --- 95
2.1- Détermination de la CMC --- 95
2.2- Assemblage --- 96
3- Formulation de la molécule de PERFECTA --- 96
3.1- Synthèse du PERFECTA --- 96
3.2- Formulation dans les micelles PFTD-PEG --- 97
3.3- Détermination du taux de chargement par RMN 19F --- 97
4- Caractérisations --- 99
4.1- Détermination de la taille et de la structure des nanoparticules --- 99
4.2- Étude de stabilité de la formulation --- 101
III- Études de toxicité et imagerie cellulaire --- 102
1- Tests de cytotoxicité --- 102
2- Imagerie cellulaire --- 103
IV- Évaluation du potentiel diagnostique des micelles de PERFECTA par IRM --- 105
1- Mise au point du protocole IRM --- 105
1.1- Préparation des échantillons et gamme de concentration --- 105
1.2- Optimisation de la séquence IRM --- 105
4
3.2 – Optimisation du protocole in vivo --- 108
3.3- Acquisition des données IRM --- 109
3.4- Résultats --- 110
3.5- Analyses ex vivo --- 111
3.5.1 Expérience IRM --- 112
3.5.2 Expérience RMN 19F --- 112
VI- Conclusion et perspectives --- 113
Chapitre 3 : Nanoparticules d’or pour l’imagerie et la radiothérapie --- 115
I – Applications des nanoparticules d’or en nanomédecine --- 117
1- Propriétés optiques des nanoparticules d’or --- 117
2- Préparation de nanoparticules d’or --- 119
2.1- Synthèses de nanoparticules sphériques par voie chimique --- 119
2.1.1- Synthèse de Turkevich, --- 120
2.1.2- Synthèse de Brust --- 120
2.2- Stratégies de fonctionnalisation --- 120
2.2.1- La fonctionnalisation directe --- 121
2.2.2- La fonctionnalisation indirecte --- 121
3- Nanoparticules d’or en imagerie et thérapie --- 122
3.1- Nanoparticules d’or pour l’imagerie par tomodensitométrie --- 122
3.1.1- Principe de fonctionnement du contraste aux rayons X --- 122
3.1.2- Intérêt diagnostique des nanoparticules d’or --- 123
3.2- Utilisation de nanoparticules d’or pour la radiothérapie --- 125
3.2.1- Principe de la radiothérapie --- 125
3.2.2- Intérêt thérapeutique des nanoparticules d’or --- 126
4- Objectifs --- 128
II – Préparation des micelles encapsulant les nanoparticules d’or--- 128
1- Stratégie mise en œuvre --- 128
2- Préparation des micelles encapsulant les nanoparticules d’or --- 129
2.1- Synthèse des nanoparticules d’or --- 129
2.2- Échange du ligand --- 130
2.3- Encapsulation des nanoparticules d’or dans les micelles --- 132
3- Quantification de l’or --- 133
5
III – Imagerie par tomodensitométrie --- 137
1- Mise au point par tomodensitométrie --- 137
2- Expériences de tomodensitométrie in vivo --- 138
IV – Conception de micelles pour la radiothérapie --- 140
1- Imagerie TEP-scan et choix du radionucléide--- 140
2- Synthèse des amphiphiles --- 141
3- Essais de chélation du zirconium --- 143
4- Assemblage des micelles et caractérisations --- 144
5- Encapsulation des nanoparticules d’or--- 144
6- Solubilisation du dioxygène --- 144
V – Conclusion et perspectives --- 145
Conclusion Générale --- 147
Experimental section --- 151
General informations --- 153
Experimental part: “Chapitre 1” --- 155
Experimental part: “Chapitre 2” --- 176
7
Abréviations
ABCA1 ATP-binding cassette A1
ABCG1 ATP-binding cassette G1
ACN Acétonitrile
AcOEt Acétate d’éthyle
AcOH Acide acétique
ADN Acide désoxyribonucléique
AFM Microscopie à force atomique
APOA1 Alipoprotéine A1
ARN Acide ribonucléique
ATP Adénosine triphosphate
AuNP Nanoparticules d'or
AVC Accident vasculaire cérébral
CBA Cytometric Bead Array
Cl-HOBt 6-Chloro-1-Hydroxybenzotriazole di-hydrate
CM Chargement massique
CMC Concentration micellaire Critique
CT-scan Computed Tomography
Cyclo Cyclohexane
DA-NTA Diacetylenic NitrilotriAcetic amphiphile DA-PEG Diacetylenic Poly(ethylene glycol) amphiphile
DCM Dichlorométhane
DCs Dendritic cells
DFO Deferroxamine
DI Dose injectée
DIAD Diisopropyl azodicarboxylate
DIC N,N'Diisopropylcarbodiimide
DLS Dynamic light scattering
Dm Diamètre moyen
DMF Diméthylformamide
DMSO Dimethylsulfoxide
DOPC dioleoylphosphatidylcholine
DOPE dioleoylphosphatidylethanolamine
DOTA 1,4,7,10-Tetraazacyclododecane-1,4,7,10-tetraacetic acid DPTA Acide diéthylènetriaminepentaacétique
DSPC diastearoylphosphatidylcholine DSPE diastearoylphosphatidylethanolamine DSPG diastearoylphosphatidylglycerol
EC50 Concentration efficace
EDCI N-(3-Diméthylaminopropyl)-N’-ethylcarbodiimide
EE Efficacité d'encapsulation
8
EtOH Ethanol
FDA Food and Drug Administration
FID Free Induction Decay
FP730 FluoroProbes 730
GSH Glutathion
h heure
HATU Hexafluorophosphate de (diméthylamino)-N,N-diméthyl(3H-[1,2,3]triazolo[4,5-b]pyridin-3-yloxy)méthaniminium
HBL Balance Hydrophile-Lipophile
HDL Lipoprotéines de hautes densité
HFIP Hexafluoroisopopanol
HOBt Hydroxybenzotriazole
HPLC-MS Chromatographie liquide haute performance couplée à la specctrométrie de masse HSPC hydrogenated soy phosphatidylcholine
i.p. intrapéritonéale
i.v. intraveineuse
ICP-MS Inductively coupled plasma mass spectrometry
IRM Imagerie par résonance magnétique
KO Knockout
LC-MSMS Chromatographie liquide couplée à la spectrométrie de masse en tandem
LDH Lactates déshydrogénases
LDL Lipoprotéines de basses densité
LXR Liver X receptor
MeOH méthanol
MET Microscopie Electronique à Transmission
MLV Liposomes multi-lamellaires MMP Métalloprotase de la matrice Mn Masse moyenne MSME Multi-Slice-Multi-Echoes MTT 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide NIR Near-InfraRed NMP N-méthyl-2-pyrrolidone PAMAM Polyamidoamine
PBS Phophate buffer saline
PC Phosphatidyl Choline
PCL Poly-caprolactone
PDA Polydiacétylénique
9
PEG Polyethylène glycol
PERFECTA SuPER FluorinatEd ContrasT Agent
PFCE Perfluoro crown ether
PFCs Perfluorocarbones
PFDT Perfluorodecanethiol
PFMC Perfluoromethylcyclohexane
PFOB Perfluorooctyl bromide
PFPE Perfluoropolyether
PFTD-PEG Perfluoro-tetradecanol Poly(ethylene glycol) amphiphile
PGA Polyglycolide
PI Propidium iodide
PK Pharmacocinétique
PLA Poly acide lactique
PLGA Poly[lactide-co-glycolide]
PVP Poly vinylpyrrolidone
RARE Rapid Acquisition with Refocused Echoes
RES Système réticulo-endothélial
RF Radio Fréquence
RGD peptide Aginine-Glycine-Acide aspartique peptide
RMN Résonance magnétique nucléaire
ROS Reactive Oxygen Species
RTC Reverse transport cholesterol
RXR Récepteur X des rétinoïdes
SAR Relation structure-activité SAXS Small angle X-rays scattering
SNR Signal over noise ratio
SPIO Ion super paramagnétique
SPR Surface Plasmon Resonance
SRB1 Récepteur scavenger de classe B, type 1
SVF Sérum de veau fœtal
t.a. température ambiante
TEP-scan Tomographie à émission de positons
TFA Acide trifluoroacétique
THF Tétrahydrofurane
TOAB Bromure de tétraoctylammonium
u.a. unité arbitraire
UH Unité Hounsfield
UV Ultra-Violet
11
Avant-propos
Ces travaux de thèse ont été financés par le Commissariat à l’énergie atomique et aux énergies alternatives et réalisés à Saclay au sein du Service de Chimie Bioorganique et de Marquage sous la direction du Dr. Eric Doris.
Depuis plusieurs années, les activités de recherche du laboratoire s’orientent vers la conception de nanoparticules, plus particulièrement des micelles, dans un but diagnostique et thérapeutique.
Ce manuscrit se divise en quatre parties.
Dans une première section, un état de l’art sur le développement de nanoparticules pour des applications en nanomédecine sera présenté.
Une seconde partie sera dédiée à l’évaluation in vitro et in vivo de micelles polymérisées pour le ciblage passif et actif des acteurs du processus inflammatoire à l’origine de la formation de plaques d’athérome.
Dans une troisième partie, des micelles fluorées seront assemblées et valorisées pour le diagnostic in vivo de tumeurs par IRM 19F.
La dernière partie sera dédiée au développement de micelles fluorées encapsulant des nanoparticules d’or pour de l’imagerie par tomodensitométrie et pour de la radio-sensibilisation.
Les travaux réalisés au cours de cette thèse ont été valorisés par trois publications, une publiée dans Nanoscale, une soumise à Nanoscale et une en préparation.
Introduction générale : utilisation de micelles en
nanomédecine
15
C’est en 1959 que Richard P. Feynman1, évoque l’existence d’un « nanomonde ». Dans son
discours There’s plenty of room at the bottom2, il invite la communauté scientifique à explorer
l’univers de l’infiniment petit et à manipuler la matière atome par atome. Ce n’est cependant que quelques années plus tard que les recherches se sont intensifiées afin de faire émerger le potentiel des nanotechnologies, notamment en médecine. Cette nouvelle discipline qu’est la nanomédecine, offre de nombreuses perspectives pour le traitement et le diagnostic de certaines pathologies.
I – Les systèmes nanométriques pour le diagnostic et la
thérapie
1- Nanomédecine et vectorisation
Malgré les progrès réalisés dans le domaine de la recherche médicale et la conception de molécules actives, certaines limitations demeurent. En effet, les molécules actives qui sont administrées aux patients, sont le plus souvent peu spécifiques d’une cible donnée ce qui limite leur efficacité vis-à-vis de la pathologie visée et induit des effets secondaires indésirables. La conséquence directe de ce manque de spécificité est l’administration de doses plus fortes à des fréquences plus importantes ce qui conduit à des effets indésirables. Outre le manque de spécificité d’action, l’hydrophobicité des principes actifs pharmaceutiques constitue également une limitation. Se pose alors le problème de la formulation de ces principes actifs afin d’en améliorer la compatibilité (solubilité/stabilité) en milieux biologiques.
Le recours aux nanotechnologies va permettre de contourner certaines de ces problématiques. Par exemple, l’utilisation de nanoparticules « transporteuses » (vecteurs) constitue une stratégie qui peut se révéler efficace. En effet, le vecteur de par ses propriétés physico-chimiques (taille, charges électrostatiques de surface, hydrophilie…) adaptées, doit permettre une prise en charge, une distribution et une élimination optimales de la molécule active. Le devenir de cette dernière est alors régi par le devenir du vecteur lui-même et ses interactions avec le milieu biologique. L’un des défis de la nanomédecine est également de comprendre la nature de ces interactions.
2- La vectorisation : définitions et optimisation du concept
Ce concept a été évoqué et introduit pour la première fois au début du XXème siècle par Paul Ehrlich (Prix Nobel de Médecine en 1908). En effet, il rêvait déjà d’une « solution miracle » afin de transporter un médicament de manière spécifique vers son site d’action.
1Prix Nobel de physique 1965
16
Ce rêve est devenu réalité il y a plus de 40 ans, grâce au développement de liposomes par Bangham, initialement développés pour l’étude de la dynamique des membranes biologiques. Si la « nanomédecine » n’existait pas à cette période-là, c’est par cette découverte que Bangham introduisit la notion de vectorisation.3 Ces liposomes sont les premiers vecteurs, avec les
nanocapsules et les nanosphères, à avoir été développés. Cependant, une fois injectés dans l’organisme, ces vecteurs sont reconnus comme corps étrangers et vont activer les mécanismes de défense de l’organisme. Ce système de défense fait intervenir une famille de protéines appelées opsonines, qui vont s’adsorber à la surface des vecteurs, facilitant leur reconnaissance et leur prise en charge par les macrophages (Figure 1). Une fois capturés par les macrophages, les vecteurs sont éliminés par le système réticulo-endothélial (RES) et se retrouvent, ainsi que leur contenu, dans des organes de dépuration tels que le foie ou la rate.
Ce phénomène d’accumulation hépatique est particulièrement intéressant lorsque l’on souhaite améliorer l’efficacité de certains anticancéreux en ciblant le foie (cas des métastases hépatiques) et réduire leur toxicité pour d’autres organes.4
Cette première génération de vecteurs est donc caractérisée par : 1- Une opsonisation puis une reconnaissance par des macrophages 2- Une accumulation dans la rate et le foie
Cependant, l’élimination rapide des vecteurs par les macrophages peut diminuer l’effet pharmacologique du principe actif surtout si les foyers ciblés sont situés hors du RES. C’est la raison pour laquelle, plusieurs méthodes permettant de « masquer » les nanoparticules ont été développées. Parmi ces systèmes, certains bénéficient d’une modification au niveau de leur surface qui va empêcher la fixation des opsonines. C’est ce que nous allons développer dans la partie qui suit.
2.1- Vecteurs furtifs : Effet EPR et ciblage passif
De manière générale, l’architecture du vecteur peut être divisée en deux niveaux : le cœur et la surface du vecteur. Le cœur est utilisé pour la prise en charge de la molécule active, alors que la couronne périphérique est en interaction avec le milieu biologique environnant.
3Bangham, A. D.; Standish, M. M.; Watkins, J. C. Journal of Molecular Biology 1965, 13, 238-52. 4Owens, D. E.; Peppas, N. A. International Journal of Pharmaceutics 2006, 307, 93-102.
17
Bien qu’il n’y ait pas de méthodes génériques permettant de bloquer totalement le phénomène d’opsonisation, une chimie de surface adaptée peut néanmoins influer de manière significative sur ce processus et accroître le temps de demi-vie plasmatique du vecteur. En effet, certaines observations montrent que l’opsonisation de nanoparticules hydrophobes est plus rapide que celle de particules hydrophiles.5 Un rapport entre la charge à la surface de la particule et
l’opsonisation a également été démontré in vitro. En effet, des particules neutres ont un taux d’opsonisation beaucoup plus faible que des particules chargées.
Une méthode pour ralentir le phénomène d’opsonisation consiste donc à utiliser des groupements à la surface des particules afin de bloquer les interactions hydrophobes et électrostatiques qui aident les opsonines à se lier aux particules.4 Ces groupements sont
généralement des polymères hydrophiles et flexibles, en particulier du poly(éthylène glycol) (PEG), qui vont donc agir comme des boucliers en bloquant la fixation des opsonines par des forces de répulsion stériques.6,7 D’autres polymères tels que les polysaccharides, le
polyacrylamide ou le polysorbate ont également été décrits dans la littérature.
Avec une surface « optimisée », les vecteurs de petite taille vont pouvoir circuler de manière prolongée et diffuser vers des zones inflammatoires ou au niveau des tumeurs grâce à la perméabilité de l’endothélium vasculaire de ces tissus. En effet, dans le cas de tumeurs solides, c’est l’hyper-vascularisation des tumeurs et leur croissance rapide qui engendrent la formation d’espaces interstitiels entre les cellules endothéliales des vaisseaux sanguins, permettant la diffusion des nanoparticules des vaisseaux vers les tissus tumoraux. Ce phénomène d’extravasation est également associé à un drainage lymphatique défaillant, ce qui favorise l’accumulation des vecteurs dans les tissus tumoraux (Figure 3). Cet effet de perméabilité accrue et de rétention appelé EPR (Enhanced Permeability and Retention) permet l’accumulation par voie passive des nanoparticules et à conduit à l’émergence de systèmes nanoparticulaires pour la délivrance ciblée de principes actifs mais aussi pour le diagnostic de tumeurs solides.
5Carrstensen, H.; Muller, R. H.; Muller, B. W. Clinical Nutrition 1992, 11, 289-297. 6Otsuka, H.; Nagasaki, Y.; Kataoka, K. Advanced Drug Delivery Reviews 2003, 55, 403-419.
7Jeon, S. I.; Lee, J. H.; Andrade, J. D.; De Gennes, P. G. Journal of Colloid and Interface Science 1991, 142, 149-158.
18
Cette nouvelle génération de vecteur est donc caractérisée par : 1- Des vecteurs furtifs non reconnus par les macrophages 2- Une circulation prolongée dans le sang
3- Une accumulation dans les tissus tumoraux et inflammatoires
Du fait de sa variabilité inter-espèces, l’effet EPR est controversé au sein de la communauté scientifique.8 Par ailleurs, ce type de ciblage ne permet pas une internalisation sélective au niveau
des cellules atteintes mais une simple accumulation au niveau de la zone tissulaire ayant une forte perméabilité vasculaire. C’est pourquoi de nouveaux vecteurs bénéficiant d’un ciblage amélioré ont été développés.
2.2- Ligands de surface : reconnaissance cellulaire et ciblage actif
Le ciblage actif doit permettre aux vecteurs d’interagir spécifiquement avec les cellules malades. Pour ce faire, la couronne périphérique des vecteurs est fonctionnalisée à l’aide de ligands capables de reconnaître spécifiquement les récepteurs exprimés à la surface des cellules ciblées. Ce type de reconnaissance permet au vecteur (et donc au principe actif) d’être guidé jusqu’à sa cible cellulaire et d’être internalisé par endocytose. Lorsque le vecteur se trouve dans l’endosome, le ligand va se dissocier du récepteur qui sera recyclé pour retrouver sa fonction principale à la surface de la membrane cellulaire (Figure 4). Certains récepteurs membranaires sont parfaitement identifiés et la structure des ligands associés a été déterminée. Par exemple, l’acide folique est le ligand du récepteur qui porte le même nom et qui est surexprimé de manière très sélective à la surface de certaines lignées cellulaires cancéreuses (cellules Hela du col de l’utérus ou cellules Ov-3 de l’ovaire, par exemple).
8Danhier, F. Journal of Controlled Release 2016, 244, 108-121.
19
Outre l’acide folique, il existe une multitude ligands pour le ciblage de cellules tumorales, 9:
- La biotine ou vitamine B8, peut être utilisée comme agent de ciblage. En effet, les cellules
cancéreuses consomment beaucoup plus de biotine que des cellules saines, du fait de leur prolifération rapide. Elles surexpriment donc plus de récepteurs à la vitamine B8 que des
cellules saines.10
- L’acide hyaluronique est un polysaccharide naturel capable de reconnaitre spécifiquement les récepteurs à la glycoprotéine CD44 (surexprimés au niveau de cellules cancéreuses). Ce ligand peut donc être utilisé pour fonctionnaliser des vecteurs pour du ciblage actif.11
- Le peptide RGD est un peptide de 3 acides aminés (Arginine-Glycine-Acide aspartique). Des récepteurs transmembranaires appelés intégrines, et plus particulièrement les intégrines αV3, sont surexprimés au niveau des cellules cancéreuses et sont impliqués
dans l’angiogenèse. Le peptide RGD est capable de reconnaître spécifiquement ces intégrines c’est la raison pour laquelle il a été fréquemment utilisé pour du ciblage actif.12
- Les anticorps monoclonaux peuvent être utilisés comme agents de ciblage car ils sont capables d’interagir avec des antigènes ou avec des récepteurs bien spécifiques qui sont surexprimés au niveau de cellules cancéreuses. Par exemple, les récepteurs R-EGF, récepteurs de facteur de croissance épidermique, sont surexprimés dans les cancers de la prostate, des ovaires ou des poumons.13
Même si le ciblage actif (des nanovecteurs) est principalement exploité en oncologie, ces systèmes peuvent être appliqués à d’autres types de pathologies. Il a par exemple été possible de fonctionnaliser des liposomes chargés en amphotéricine B à l’aide d’anticorps monoclonaux
9Pérez-Herrero, E.; Fernandez-Medarde, A. European Journal of Pharmaceutics and Biopharmaceutics 2015, 93,
52-79.
10Na, K.; Bum Lee, T.; Park, K.-H.; Shin, E.-K.; Lee, Y.-B.; Choi, H.-K. European Journal of Pharmaceutical Sciences
2003, 18, 165-173.
11Choi, K. Y.; Saravanakumar, G.; Park, J. H.; Park, K. Colloids and Surfaces 2012, 99, 82-94.
12Brooks, P. C.; Montgomery, A. M. P.; Rosenfeld, M.; Reisfeld, R. A.; Hu, T.; Klier, G.; Cheresh, D. A. Cell 1994, 79,
1157-1164.
13Weiner, L. M.; Dhodapkar, M. V.; Ferrone, S. The Lancet 2009, 373, 1033-1040.
Figure 4 : Représentation schématique du ciblage actif d’un vecteur fonctionnalisé par de l’acide folique et de son internalisation au niveau cellulaire : 1) reconnaissance de l’acide folique par son récepteur, 2) invagination de la membrane, 3) endocytose, 4) libération du principe actif
20
(anticorps 34A) capables de reconnaître des glycoprotéines exprimées au niveau de l’endothélium pulmonaire, cela dans le but de traiter des aspergilloses pulmonaires.14
Les vecteurs doivent donc répondre à la fois aux contraintes apportées par la vectorisation et le ciblage tout en conservant leurs propriétés de furtivité (Figure 5).
Pour résumer, un vecteur, du fait de ses nombreuses interactions avec le milieu biologique, doit respecter un certain nombre de critères et doit :
1) être biocompatible et/ou biodégradable
2) posséder des propriétés de furtivité, afin d’échapper au système immunitaire et éviter sa capture par les macrophages
3) faciliter le transport de la molécule active, la protéger dans des conditions physiologiques et faciliter son adressage vers sa cible
4) libérer la molécule active au niveau de sa cible de manière efficace.
II- Etat de l’art sur le développement de vecteurs
nanoparticulaires
En s’appuyant sur les différents critères qu’impose la vectorisation, une multitude de nanoparticules a été envisagée et développée. Ces nanoparticules peuvent être catégorisées en deux grandes familles en fonction de leur nature chimique. On retrouve les nanoparticules organiques (lipides, polymères, macromolécules, nanotubes de carbone) et les nanoparticules inorganiques (quantum dots, nanoparticules magnétiques, silice). Pour la suite de ce rapport, nous nous intéresserons plus particulièrement aux nanoparticules organiques.
14Otsubo, T.; Maruyama, K.; Maesaki, S.; Miyazaki, Y.; Tanaka, E.; Takizawa, T.; Moribe, K.; Tomono, K.; Tashiro, T.;
Kohno, S. Antimicrobial agents and chemotherapy 1998, 42, 40-44.
Figure 5 : Représentation schématique des différentes générations de vecteurs utilisés en nanomédecine.
21
1- Composition des nanoparticules organiques
Les nanoparticules organiques doivent posséder des propriétés de biodégradabilité et/ou de biocompatibilité pour pouvoir être administrées chez l’Homme ou l’animal. En effet, elles ne doivent pas persister sur le long terme dans l’organisme et induire des réactions toxiques ou inflammatoires. C’est la raison pour laquelle un nombre limité de composants organiques ont été utilisés jusqu’à présent pour l’assemblage de vecteurs nanoparticulaires, les lipides et les polymères étant les constituants majoritaires.
Les composés lipidiques sont particulièrement intéressants puisqu’ils font partie intégrante des membranes cellulaires. Les lipides sont par ailleurs les premières molécules à avoir été utilisées sous forme de liposomes pour la vectorisation. Les lipides dont les acides gras, glycérolipides, glycérophospholipides, sphingolipides, stérols, sont généralement utilisés comme excipients dans la formulation de principe actif. Un exemple de formulation utilisant l’huile d’arachide, principalement composée d’acide oléique et d’acide linoléique, a par exemple été utilisée pour l’administration par voie intra-péritonéale et sous-cutanée de Tamoxifène.15
Outre leur utilisation en tant qu’excipients, les lipides peuvent également être utilisés en tant que constituants de vecteurs, sous forme de liposomes, nanosphères ou nanocapsules et parfois en association avec des polymères afin d’améliorer leur stabilité. En effet, certains polymères, qu’ils soient naturels ou synthétiques, entrent dans la composition de vecteurs organiques ce qui permet d’accéder à une grande diversité structurale. Les polymères naturels (protéines, polysaccharides…) ont d’abord été utilisés en nanomédecine comme par exemple pour le cas de l’Abraxane® qui a été commercialisé aux USA en 2005 pour le traitement du cancer du sein. Cette
formulation est basée sur des nanosphères d’albumine (polymères d’acides aminés) et prend en charge un anticancéreux, le paclitaxel.16 Des polymères de synthèses ont par la suite été utilisés,
mais ne répondent pas forcément aux critères de biocompatibilité ou de biodégradabilité d’un vecteur. En effet, certains polymères ne sont que partiellement dégradables voire non dégradés, comme le poly(éthylèneglycol) mais vont cependant fournir des fragments solubles en milieu biologique pour être facilement excrétés.17
Aujourd’hui, la plupart des nanoparticules sont à base de copolymères et sont composés de polymères dits « structurels » et de polymères dits « fonctionnels » de manière à améliorer la stabilité de la formulation. Les polymères structurels, tels que le poly(acide lactique) (PLA) ou le
15Suarez-Martinez, A. D.; Peirce, S. M.; Isakson, B. E.; Nice, M.; Wang, J.; Lounsbury, K. M.; Scallan, J. P.; Murfee, W.
L. Microcirculation 2018, 25, e12502.
16Henderson, I. C.; Bhatia, V. Expert Review of Anticancer Therapy 2007, 7, 919-943. 17Torchilin, V. P. Pharmaceutical Research 2006, 24, 1.
Acide oléique Acide linoléique
Figure 6 : Structures chimiques des composés qui entrent dans la composition de l’huile d’arachide.
22
poly(acide glycolique) (PGA), et les copolymères poly[lactide-co-glycolide] (PLGA), vont définir la morphologie du vecteur alors que les polymères fonctionnels, sont utilisés pour contrôler les interactions avec le milieu environnant. En effet, en fonctionnalisant un polymère hydrophobe avec du PEG, on va chercher à améliorer le temps de circulation des vecteurs afin de minimiser les interactions avec les protéines plasmatiques.
Les recherches s’orientent de plus en plus vers le développement de polymères biodégradables qui sont sensibles à des stimulus environnementaux : variation de pH, température, concentrations en ions… Par exemple le poly(acrylamide-n-isopropyle) est connu pour être sensible à des modifications de températures. Le polymère sera alors dégradé sous l’effet d’une variation de température, permettant ainsi la libération du principe actif.
Selon leur nature et le type d’interactions entre polymères, il est également possible d’obtenir des auto-assemblages aux morphologies différentes : des nanocapsules, des nanosphères, des micelles de polymères. L’obtention de telles structures est détaillée ci-après.
2- Nanoparticules : outils de vectorisation
Compte tenu des contraintes liés à la vectorisation, un certain nombre de vecteurs ont été conçus afin d’améliorer les propriétés in vivo d’actifs thérapeutiques. Parmi ces vecteurs, nous pouvons citer les liposomes, les nanocapsules, les nanosphères, les nanoparticules de carbone (nanotubes, graphène, fullerène…), les dendrimères et les micelles. Chacun de ces systèmes possède des avantages et des inconvénients qui seront détaillés dans les paragraphes qui suivent.
2.1- Les liposomes
Les liposomes sont généralement constitués d’un auto-assemblage de lipides (phospholipides), parfois associés à des polymères. Les phospholipides possèdent un caractère amphiphile avec une partie lipophile (longue chaînes grasses) et une partie hydrophile. Ils vont former une bicouche lipidique pour finalement s’auto-assembler sous forme de vésicule (Figure 8). C’est sous l’effet de forces d’attraction/répulsion des parties hydrophiles/hydrophobes que s’auto-assemblent les phospholipides. Le cœur du liposome renferme donc un cœur aqueux permettant l’encapsulation de principes actifs hydrophiles. Des molécules hydrophobes peuvent également être transportées en se logeant dans la partie hydrophobe que forme la bicouche de phospholipides. L’introduction de PEG ou de chitosane en surface des liposomes, permet d’améliorer le temps de résidence in vivo des vecteurs.
23
Le Doxil® est la première formulation liposomale à avoir été approuvée par la FDA en 1995.
Composé du phospholipide PEG-DSPE ((poly ethylèneglycol)
distearoylphophatidylethanolamine), mais aussi de phosphatidylcholine et de cholestérol (dans un ratio molaire 5 :55 :40) ce liposome permet de prendre en charge la doxorubicine qui est un anti-cancéreux utilisé pour le traitement du sarcome de Kaposi.18 D’autres exemples de liposomes
actuellement sur le marché sont présentés dans le Tableau 1.
Tableau 1 : Exemples de liposomes utilisés comme vecteurs de médicaments actuellement sur le marché.
Nom Commercial
Composition Lipidique Principe actif véhiculé
Indications thérapeutiques
Myocet® EPC et cholesterol Doxorubicine Métastases du
cancer du sein
DaunoXome® DSPC et Cholesterol Daunorubicin Tumeurs du
sang Ambisome® HSPC, DSPG, cholesterol et amphoteracin B Amphotericin B Infections fongiques EPC : egg phosphatidylcholine, DSPC : distearoylphosphatidylcholine, DOPC : dioleoylphosphatidylcholine, DOPE : dioleoylphosphatidylethanolamine, HSPC : hydrogenated soy phosphatidylcholine, DSPG : disteraoylphosphatidylglycerol.
L’obtention de liposomes se fait selon différents protocoles en fonction de la taille souhaitée. Par exemple, les liposomes multi-lamellaires (MLV) sont constitués de plusieurs bicouches lipidiques. Ils possèdent des tailles variables (entre 500 et 5000 nm) et la méthode traditionnelle
18Abraham, S. A.; Waterhouse, D. N.; Mayer, L. D.; Cullis, P. R.; Madden, T. D.; Bally, M. B. In Liposomes; 391 ed.;
Academic Press, 2005.
Figure 8 : Représentation schématique d’un liposome.
PEG-DSPE Phosphatidylcholine
Figure 9 : Structures du PEG-DSPE et de la phosphatidylcholine qui entrent dans la composition du liposome utilisé pour le traitement du sarcome de Kaposi.
24
permettant de les obtenir consiste à hydrater un film lipidique, préalablement formé par évaporation d’une solution organique. Cette séquence doit s’effectuer dans des conditions de températures particulières, dépendantes des lipides utilisés (température de transition de phase). Afin d’obtenir des liposomes uni-lamellaires, des traitements physiques supplémentaires sont nécessaires (passage aux ultrasons d’une solution de MLV).19 Sous certaines conditions, les lipides
peuvent également conduire à la formation de nanosphères et de nanocapsules.
2.2- Les nanocapsules et les nanosphères
Les nanosphères et les nanocapsules peuvent être composées de lipides mais le plus souvent de polymères et sont obtenues sous contrôle précis de la température et de la pression (systèmes non auto-assemblés).
Les nanocapsules sont des systèmes réservoirs : elles sont caractérisées par l’existence d’un cœur huileux ou aqueux (Figure 10). Les nanosphères, à la différence des nanocapsules, ne possèdent pas de cœur liquide et vont contenir la matière active sous forme dispersée au sein d’une matrice polymères.20
Plusieurs procédés de fabrication existent (mécaniques, chimiques, physico-chimiques) et le choix de la méthode dépend de l’application visée, des constituants qui les composent ou encore de la molécule à encapsuler. Parmi ces méthodes, une technique de formation de nanocapsules de polymères repose sur une réaction de polymérisation interfaciale mettant en jeu deux monomères, l’un étant hydrosoluble. La réaction de polycondensation à lieu à l’interface eau/huile et permet finalement l’encapsulation de composés actifs. L’inconvénient de cette méthode est qu’elle nécessite des étapes de purifications lourdes. C’est pourquoi d’autres méthodes peuvent être utilisées, comme la nanoprécipitation, utilisant des polymères préformés.
L’obtention de nanocapsules lipidiques repose quant à elle sur la stabilisation de gouttelettes issues de la dispersion d’une phase huileuse dans une phase aqueuse (nanoémulsion) par l’intermédiaire de lipides jouant le rôle de tensio-actifs. Après mélange des différents constituants, l’émulsion est chauffée à une certaine température (température de transition de phase) pour être ensuite refroidie très brutalement par ajout d’eau froide.21
19Cullis, P. R.; Mayer, L. D.; Bally, M. B.; Madden, T. D.; Hope, M. J. Advanced Drug Delivery Reviews 1989, 3, 267-282. 20Muller, R. H.; Mader, K.; Gohla, S. European Journal of Pharmaceutics and Biopharmaceutics 2000, 50, 161-177. 21Couvreur, P.; Barratt, G.; Fattal, E.; Legrand, P.; Vauthier, C. Crit. Rev. Ther. Drug Carrier Syst. 2002, 19, 99-134.
25
De tels vecteurs ont par exemple été utilisés pour de l’imagerie in vivo par IRM (Imagerie par résonance magnétique) du fluor. Des nanocapsules de 120 nm à base de copolymères PLGA-PEG renfermant un cœur liquide d’une molécule de bromure de perfluorooctyle, ont permis de mettre en évidence une accumulation des nanoparticules au niveau des tissus tumoraux par effet EPR, 7 h post-injection. Cela a été possible à l’aide de la molécule perfluorée utilisée comme sonde IRM du fluor mais aussi grâce à la présence de PEG permettant d’améliorer significativement le temps de résidence des nanoparticules dans le sang tout en favorisant l’effet EPR.22
2.3- Les nanoparticules de carbone
Les fullerènes, le graphène et les nanotubes de carbone sont les principales catégories de nanoparticules à base de carbone que l’on retrouve en nanomédecine notamment parce qu’elles possèdent des morphologies et propriétés physico-chimiques uniques. Avec une très grande surface spécifique, ces objets sont capables de prendre en charge une quantité importante de molécules actives.23 Par ailleurs, il est possible de fonctionnaliser la surface de ces matériaux ce
qui permet d’accéder à des plateformes multivalentes pour des applications biomédicales.24
Du fait de leur composition entièrement carbonée, ces objets sont difficilement dispersables dans l’eau. Pour contourner cette limitation, une modification de leur surface est nécessaire par adsorption, interactions électrostatiques ou en introduisant des groupements carboxyliques de surface par oxydation. La forme oxydée du graphène, permet par exemple d’obtenir une forme hydrosoluble, facilement fonctionnalisable et biocompatible.25
La surface des nanoparticules carbonées peut être également fonctionnalisée par des transformations chimiques comme la réaction de cycloadddition 1,3-dipolaire. Des nanotubes de carbone ont été ainsi fonctionnalisés pour y accrocher un anti-cancéreux (taxoïde) et la biotine, permettant un ciblage des cellules cancéreuses (Figure 11). Ces nanotubes incorporent également un lien clivable qui permettra le relargage du principe actif après internalisation cellulaire et interaction avec du glutathion (GSH - tri-peptide réducteur présent dans le réticulum endoplasmique qui a la particularité de cliver les ponts disulfures).26
22 Diou, O.; Tsapis, N.; Giraudeau, C. l.; Valette, J.; Gueutin, C.; Bourasset, F.; Zanna, S.; Vauthier, C.; Fattal, E.
Biomaterials 2012, 33, 5593-5602.
23Vashist, S. K.; Zheng, D.; Pastorin, G.; Al-Rubeaan, K.; Luong, J. H. T.; Sheu, F.-S. Carbon 2011, 49, 4077-4097. 24Karousis, N.; Tagmatarchis, N.; Tasis, D. Chemical Reviews 2010, 110, 5366-5397.
25 Kurapati, R.; Bonachera, F.; Russier, J.; Sureshbabu, A. R.; Ménard-Moyon, C.; Kostarelos, K.; Bianco, A. 2D
Materials 2017, 5, 015020.
26Chen, J.; Chen, S.; Zhao, X.; Kuznetsova, L. V.; Wong, S. S.; Ojima, I. Journal of the American Chemical Society 2008,
26
A l’heure actuelle, de nombreuses recherches s’orientent sur la biocompatibilité et la toxicité
in vivo et in vitro des nanomatériaux à base de carbone. Ces nanoparticules exercent des degrés
de toxicité différents en fonction de leur voie d’administration, des modèles utilisés, et du type de fonctionnalisation de surface. Par ailleurs, il est difficile de contrôler la taille des nanoparticules ce qui complique l’interprétation des données de toxicité. Cependant, ces matériaux peuvent être dégradés par des systèmes biologiques. Il a par exemple été montré en 2008 que la peroxidase du raifort (HRP pour horseradish peroxidase) pouvait dégrader les nanotube de carbone en 12 semaines, en présence de peroxyde d’hydrogène.27 Une équipe s’est par la suite inspirée de ces
travaux pour modifier chimiquement la structure du graphène en y incorporant des molécules spécifiques en surface permettant d’activer leur dégradation enzymatique.25 Il est donc possible
que d’autres peroxydases (comme la myéloperoxidase) puisse agir de cette manière in vivo.
2.4- Les systèmes mono-macromoléculaires
Les dendrimères sont des macromolécules composées d’unités organiques hyperbranchées. Ces systèmes de vecteurs sont particuliers puisqu’ils sont composés d’une seule macromolécule à la différence des liposomes, nanocapsules ou micelles. Ils sont synthétisés de manière séquentielle, par addition de monomères dans les trois dimensions de l’espace. En fonction de la nature des monomères ajoutés, le dendrimère possédera un caractère plutôt hydrophobe ou hydrophile. Il est donc possible d’envisager la synthèse d’un dendrimère possédant un cœur hydrophobe favorisant les interactions avec des principes actifs hydrophobes. La surface peut être, par ailleurs, très facilement fonctionnalisée avec des ligands pour du ciblage actif (Figure 12).
Deux stratégies de synthèse peuvent être envisagée : une stratégie divergente qui consiste à élaborer la synthèse à partir du cœur du dendrimère et une stratégie convergente qui permet de former le dendrimère depuis la périphérie vers le cœur. La synthèse divergente permet d’obtenir des dendrimères de grandes tailles mais la fonctionnalisation des branches peut être difficile et incomplète.
27Allen, B. L.; Kichambare, P. D.; Gou, P.; Vlasova, I. I.; Kapralov, A. A.; Konduru, N.; Kagan, V. E.; Star, A. Nano Letters
2008, 8, 3899-3903.
Figure 11 : Exemple de fonctionnalisation d’un nanotube de carbone avant
internalisation cellulaire pour la libération contrôlée d’un anticancéreux.26
27
La toxicité in vitro et in vivo des dendrimères dépend de leur composition de surface. Des dendrimères chargés négativement ou neutres semblent avoir des toxicités moindres par rapport à des dendrimères cationiques.28 Une fonctionnalisation des dendrimères par du PEG, de la
pyrrolidone ou d’autres composés biocompatibles, permet également de réduire significativement la cytotoxicité.29
Les capacités de chargement sont généralement forte avec, par exemple, 78 molécules d’ibuprofène qui ont pu être associées à un dendrimère de Poly(amidoamine) (PAMAM) par interactions ioniques.30
Une autre étude a démontré l’efficacité de la prise en charge et de la délivrance contrôlée, au niveau de cellules cancéreuses, du cis-platine par des dendrimères de PAMAM. Le dendrimère chargé a permis de réduire la toxicité parasite du cis-platine tout en maintenant une activité antiproliférative des cellules cancéreuses in vitro et in vivo.31
28Malik, N.; Wiwattanapatapee, R.; Klopsch, R.; Lorenz, K.; Frey, H.; Weener, J. W.; Meijer, E. W.; Paulus, W.; Duncan,
R. Journal of Controlled Release 2000, 65, 133-148.
29Ciolkowski, M.; Petersen, J. F.; Ficker, M.; Janaszewska, A.; Christensen, J. r. B.; Klajnert, B.; Bryszewska, M.
Nanomedicine: Nanotechnology, Biology and Medicine 2012, 8, 815-817.
30Kolhe, P.; Misra, E.; Kannan, R. M.; Kannan, S.; Lieh-Lai, M. International Journal of Pharmaceutics 2003, 259,
143-160.
31Tran, N. Q.; Nguyen, C. K.; Nguyen, T. P. Advances in Natural Sciences: Nanoscience and Nanotechnology 2013, 4,
045013.
Figure 13 : Structure de l’ibuprofène et d’une partie du dendrimère PAMAM. Figure 12 : Représentation schématique d’un dendrimère.
28
2.5- Les micelles
Les micelles constituent une autre catégorie de vecteurs potentiels. Découvertes en 1910, les micelles sont des auto-assemblages d’amphiphiles, constitués d’une partie hydrophile et d’une partie hydrophobe. Alors qu’en milieu aqueux, la partie hydrophile est en contact avec le milieu environnant, en milieu organique, c’est la composante hydrophobe qui est en contact avec le milieu extérieur, il s’agit alors de micelles dites inverses. En nanomédecine, seules les micelles «conventionnelles » sont exploitées.
Les micelles peuvent être composées de polymères (micelles polymériques) mais également de lipides, plus particulièrement de phospholipides. Dans ce cas, la stabilité de l’auto-assemblage est améliorée par la présence de deux chaînes d’acides gras permettant d’augmenter les interactions hydrophobes du cœur de la micelle. Les phospholipides sont associés, le plus souvent, à des polymères hydrophiles qui vont permettre d’améliorer la solubilité et la stabilité de l’auto-assemblage.
Les micelles polymériques sont assemblées à partir de copolymères à blocs. Un bloc est un enchaînement d’unités monomériques et chaque bloc va présenter une affinité différente pour le milieu environnant : en général les amphiphiles de copolymères contiennent un bloc A hydrophobe et un bloc B hydrophile. Les blocs peuvent s’enchaîner de manière très variables, généralement de types A-B ou A-B-A. Les micelles de polymères ont l’avantage d’avoir des tailles modulables et des surfaces facilement modifiables. En général, les blocs hydrophiles sont composés de PEG avec des poids moléculaires qui peuvent varier de 1 à 15 kDa ou encore d’alcool polyvinylique et de poly(N-vinylpyrrolidone) (PVP). Les blocs hydrophobes sont plus nombreux et variés. On retrouve principalement de l’acide polylactique (PLA) et la caprolactone.
De nombreuses combinaisons sont possibles pour la préparation de micelles polymériques. Des polymères Poly(styrène)-b-PEG ou encore Poly(ε-caprolactone)-b-PEG-b-poly(ε-caprolactone) peuvent être utilisés pour former des micelles de copolymères et sont obtenues suite à la solubilisation des blocs dans un solvant approprié et à une concentration supérieure à la CMC (concentration micellaire critique). Un échange de solvant par dialyse est ensuite nécessaire afin d’obtenir des micelles sphériques de tailles bien définies en phase aqueuse.32 Des
exemples de micelles de copolymères fonctionnalisées à l’aide de ligands et utilisées dans des études précliniques de thérapie anticancéreuse sont donnés dans le Tableau 2.
32O'Reilly, R. K.; Hawker, C. J.; Wooley, K. L. Chemical Society Reviews 2006, 35, 1068-1083.
Figure 14 : Structures chimiques de différents polymères utilisés pour former des amphiphiles de copolymères
29
Tableau 2 : Micelles de copolymères actuellement en étude pré-clinique. PG : poly(L-Acide glutamique), PCL : poly(ε-caprolactone), PLGA : poly(lactide-co-glycolide).
Copolymères Principe
actif
Ligand Cible
PEG-b-PG33 Doxorubicine mAb C225 Récepteur
EGF PEG-b-PCL34 Doxorubicine Ligand αVβ3 Intégrine
αVβ3
PLGA-b-PEG35 Doxorubicine Folate Récepteur
folate
mPEG-b-PCL36
Paclitaxel Folate Récepteur
folate
Les micelles de copolymères sont donc particulièrement utilisées de nos jours pour la formulation de principes actifs. Elles offrent certains avantages clés, notamment une taille réduite (pour une diffusion plus profonde dans les tissus cibles), la modularité, un assemblage simple et une capacité de charge élevée. Nous allons maintenant voir quelles sont les règles et propriétés physico-chimiques qui sont à l’origine de ces morphologies ordonnées et variées afin d’appréhender la problématique du projet de recherche.
III- Auto-assemblage d’amphiphiles et formation de
micelles
Les amphiphiles sont des molécules synthétiques ou naturelles qui ont la capacité de s’auto-assembler en une grande variété de structures : des micelles, des liposomes, des vésicules… C’est l’incompatibilité thermodynamique entre les différents blocs (hydrophile/lipophile) qui est à l’origine d’une organisation spatiale ordonnée à l’échelle nanométrique.
1- Interactions entre auto-assemblages
Les amphiphiles sont des composés qui possèdent à la fois un bloc hydrophile et un bloc lipophile. De manière générale, le bloc lipophile, que l’on nomme également « queue », est composé d’une longue chaîne hydrocarbonée (saturée ou insaturée), alors que la « tête » hydrophile peut être ionique ou neutre. On retrouve par exemple des amphiphiles non ioniques composés d’une chaine oxyde de PEG en tant que tête hydrophile et d’une longue chaîne alkyle comme queue hydrophobe. Les amphiphiles ioniques sont souvent utilisés comme détergents ou savons et sont généralement anioniques avec des têtes polaires chargées négativement (carboxylate, sulfate, sulfonate…) et des contre-ions chargés positivement (ions sodium, potassium, ammonium…). Les structures des amphiphiles les plus communs sont représentées dans la Figure 15. On retrouve également des amphiphiles zwitterioniques où la tête polaire
33Vega, J.; Ke, S.; Fan, Z.; Wallace, S.; Charsangavej, C.; Li, C. Pharmaceutical Research 2003, 20, 826-832.
34 Nasongkla, N.; Shuai, X.; Ai, H.; Weinberg, B. D.; Pink, J.; Boothman, D. A.; Gao, J. Angewandte Chemie
International Edition 2004, 43, 6323-6327.
35Yoo, H. S.; Park, T. G. Journal of Controlled Release 2004, 96, 273-283. 36Park, E. K.; Lee, S. B.; Lee, Y. M. Biomaterials 2005, 26, 1053-1061.
30
possède à la fois une charge positive et négative. C’est par exemple le cas du phospholipide phosphatidyl choline.37
La tête polaire permet d’interagir avec l’eau et donc de solubiliser la molécule amphiphile. Le bloc lipophile va quant à lui se mettre à l’interface : soit dans l’air soit dans un liquide non polaire ou simplement être replié sur lui-même. Cela va donc modifier la tension de surface existante, c’est notamment pour cela que l’on appelle ces composés des tensio-actifs.
Les amphiphiles sont soumis à un certain nombre de forces et d’interactions faibles. Cependant la multitude d’interactions faibles va produire un effet coopératif permettant de stabiliser les auto-assemblages et de maintenir les amphiphiles ensemble en solution. Les principales interactions faibles (non covalentes) qui sont impliquées dans le phénomène d’auto-assemblage d’amphiphiles sont :
- Les liaisons hydrogène : suffisamment fortes pour lier certaines molécules entre elles mais faibles pour être cassés dans les cellules vivantes lorsque cela est nécessaire
- Les effets hydrophobes : vont réguler la tendance qu’ont les molécules hydrophobes à s’auto-agréger
- Les interactions électrostatiques - Les forces de van der Waals
Ces forces, qui sont largement moins intenses que des liaisons covalentes (400 kJ mol-1)
lorsqu’elles sont considérées individuellement, peuvent varier de 5 kJ mol-1, pour les forces de van
der Waals, à 120 kJ mol-1 pour certaines liaisons hydrogènes. Cela rend les structures des
auto-assemblages plus flexibles et mobiles leur permettant d’une part, de résister à des perturbations mineures mais aussi, de préserver la réversibilité de la structure.
2- Structures des auto-assemblages : concepts historiques
La morphologie des auto-assemblages dépend d’un certain nombre de paramètres comme la forme et la nature chimique des amphiphiles qui les constituent.
37Lombardo, D.; Kiselev, M. A.; Magazu, S.; Calandra, P. Advances in Condensed Matter Physics 2015.
31
C’est en 1954 que Griffin suggère une méthode afin de connaître le caractère plutôt hydrophile ou lipophile d’un amphiphile : c’est ce que l’on appelle la balance hydrophile-lipophile (HBL). C’est à l’aide d’une équation mathématique qui prend en compte la masse molaire de la partie hydrophobe ainsi que la masse molaire totale du tensio-actif, que cette méthode nous permet de connaître la solubilité globale du complexe ou encore l’affinité du tensio-actif pour certains solvants.38
Ce concept a évolué dans les années 60. En effet le HBL ne permettait pas de relier directement la structure chimique des tensio-actifs avec la structure des auto-assemblages. C’est Israelachvili qui définit, plus tard, une équation mathématique selon laquelle il serait possible de prédire la structure de la nanoparticule à partir d’un paramètre d’assemblage (P)39. Cette équation fait
intervenir V le volume occupé par la chaîne hydrophobe, A la surface de la tête polaire et l la longueur de la chaîne.
En fonction de la valeur de P, les nanoparticules peuvent être sphériques, cylindriques ou lamellaires. Quelques paramètres peuvent néanmoins avoir une influence sur la valeur de P comme la température, le nombre de chaînes hydrophobes ou la salinité de la phase aqueuse. Un résumé des structures des agrégats qui peuvent être prédits sont présentés en Figure 16. Ces concepts restent très théoriques et ne sont que très rarement utilisés en formulation.
Outre le paramètre P, d’autres facteurs sont déterminants dans la formation d’auto-assemblages. Dans le cadre de cette thèse, nous allons plus particulièrement nous intéresser à la formation de micelles qui sont des assemblages sphériques d’amphiphiles présentant une surface
38Griffin, W. C. Journal of Cosmetic Science 1949, 1, 311-326.
39Israelachvili, J. N.; Mitchell, D. J.; Ninham, B. W. J. Chem. Soc. 1976, 72, 1525-1568.
Figure 16 : Résumé des structures obtenues en fonction du P calculé.
𝑃 = 𝑉 𝐴. 𝑙