Investigations phytochimiques de lichens soumis au stress
de la nordicité
Mémoire
Claudia Carpentier
Maîtrise en chimie
Maître ès sciences (M. Sc.)
Québec, Canada
© Claudia Carpentier, 2016
Investigations phytochimiques de lichens soumis au stress
de la nordicité
Mémoire
Claudia Carpentier
Sous la direction de :
III
Résumé du mémoire
Les lichens produisent une variété de métabolites secondaires de défense en réponse à un stimulus externe (intensité lumineuse, prédation, pathogène, conditions climatiques, etc.) afin de protéger les partenaires symbiotiques. Plusieurs activités biologiques sont associées à ces métabolites de défense : antitumorale, antipyrétique, anti-inflammatoire, antioxydante, antimycobactérienne, antimicrobienne et analgésique. Les décoctions de lichens étaient d’ailleurs utilisées en médecine traditionnelle pour traiter les maladies respiratoires (irritation de la gorge, toux, asthme et tuberculose), le diabète et les infections intestinales.
L’objectif du projet consiste à isoler et identifier de nouveaux produits naturels bioactifs issus des lichens du grand du nord du Québec qui vivent des stress uniques au monde.La diversité moléculaire des lichens Stereocaulon paschale et Cladonia stellaris provenant de la région d’Umiujaq a été étudiée.
Pour ce faire, des tests in vitro indicatifs de l’inhibition des étapes majeures de la carcinogenèse (initiation, promotion et progression) et anti-inflammatoires ont été réalisés lors du criblage biologique des extraits bruts pour identifier de nouveaux agents chimiopréventifs du cancer. Afin de localiser les composés actifs directement sur le chromatogramme, les extraits bruts ont été microfractionnés par chromatographie liquide à haute performance (HPLC), puis les fractions ont été soumises aux tests biologiques. Parallèlement, un premier criblage chimique des extraits bruts a été fait par HPLC-UV-TOF-HRMS. L’isolation à l’échelle du milligramme des produits naturels a ensuite été effectuée par chromatographie liquide à moyenne pression (MPLC).Puis, la structure des composés purs a été élucidée par une variété de méthodes spectroscopiques telles que la RMN, HRMS, IR, etc.
IV
Table des matières
Résumé du mémoire ... III Table des matières ... IV Liste des figures ... VIII Liste des schémas ... X Liste des tableaux ... XI Liste des annexes ... XII Liste des abréviations ... XIII Remerciements ... XVI
Chapitre 1 : Introduction ... 1
1. Que sont les lichens ? ... 1
1.1 Association symbiotique ... 1
1.2 Morphologie ... 2
1.3 Adaptation au stress environnemental ... 3
2. Métabolites lichéniques ... 5
2.1 Métabolites secondaires appartenant aux voies principales de biogenèse ... 5
2.1.1 Voie de l’acide shikimique ... 9
2.1.2 Voie des mévalonates ... 11
2.1.3 Voie des acétates polymalonates ... 12
2.2 Rôles biologiques et écologiques des métabolites secondaires ... 16
2.3 Applications potentielles des métabolites lichéniques ... 18
3. Objectifs et portée des travaux de recherche ... 20
Chapitre 2 : Études des métabolites lichéniques ... 22
1. Historique de la phytochimie des lichens ... 22
2. Méthodologie ... 24
2.1 Choix des lichens à étudier ... 25
2.2 Échantillonnage ... 27
2.3 Extraction des lichens ... 27
2.3.1 Broyage ... 28
2.3.2 Extraction par macération ... 28
V
2.5 Analyse par HPLC-PDA-ELSD-MS ... 30
2.6 Fractionnement et purification ... 33
2.7 Caractérisation et détermination de structure ... 35
2.7.1 Spectroscopie l’UV-visible ... 36
2.7.2 Spectroscopie infrarouge ... 36
2.7.3 Spectrométrie de masse ... 37
2.7.4 Spectroscopie résonance magnétique nucléaire ... 38
2.7.5 Chiralité ... 39
2.8 Transposition géométrique ... 40
2.8.1 Utilités ... 40
2.8.2 Fonctionnement ... 42
Chapitre 3 : Investigation phytochimique de lichen du genre Cladonia ... 46
1. Généralités sur le genre Cladonia ... 46
1.1 Classification et morphologie ... 46
1.2 Distribution, habitats et climat ... 46
1.3 Précédents de la littérature : métabolites isolés et activités biologiques ... 48
2. Résultats et discussion : étude du lichen Cladonia stellaris ... 50
2.1 Échantillonnage et identification ... 50
2.2 Préparation des extraits ... 50
2.3 Criblage biologique ... 51
2.4 Choix de l’extrait à étudier ... 53
2.5 Analyse par HPLC-PDA-ELSD-MS ... 54
2.6 Micro-fractionnement bioguidé ... 58
2.7 Fractionnement et purification ... 59
2.8 Caractérisation et identification ... 66
2.9 Biosynthèse des métabolites isolés ... 70
3. Travaux en cours et perspectives ... 72
3.1 Activité biologique des métabolites isolés ... 72
3.2 Investigations phytochimiques préliminaires des extraits de C. mitis et des extraits hexane et méthanol de C. stellaris ... 72
VI
3.2.2 Criblage biologique des extraits bruts de C. mitis ... 73
3.2.3 Comparaison de la composition chimique des extraits bruts ... 73
3.3 Conclusion ... 76
Chapitre 4 : Investigation phytochimique du lichen Stereocaulon paschale ... 77
1. Avant-propos ... 77
1.1 Généralités sur le genre Stereocaulon... 77
1.2 Précédents de la littérature : métabolites isolés et activité biologique ... 78
2. Résultats et discussion: étude du lichen Stereocaulon paschale ... 80
2.1 Préparation des extraits bruts ... 80
2.2 Criblage biologique des extraits brut ... 80
2.3 Analyse de l’extrait brut par HPLC-PDA-ESI-TOF-HRMS ... 81
2.4 Isolation et identification des métabolites ... 83
2.5 Élucidation de la structure des composés inédits ... 85
2.6 Considérations biosynthétiques ... 89
2.7 Activité antimicrobienne des métabolites isolés ... 94
3. Travaux en cours et perspectives ... 98
3.1 Analyses préliminaires des extraits Hex et DCM de S. paschale par HPLC-PDA 98 3.2 Études des propriétés anti-inflammatoires des métabolites isolés ... 99
3.3 Conclusion ... 102
Chapitre 5 : Synthèse de produits naturels issus du lichen C. stellaris et de ses dérivés ... 103
1. Objectifs ... 105
2. Précédents dans la littérature ... 106
3. Méthodologie pour la synthèse de l’acide 4-O-méthylolivetolcarboxylique ... 110
3.1 Formation du diéthylamide ... 112
3.2 Introduction de la chaîne alkyle par ortho-lithiation ... 113
3.3 Formation de l’ester méthylique ... 115
3.4 Formation de l’acide carboxylique ... 115
4. Travaux à compléter : synthèse de l’acide olivetolique et de l’acide perlatolique ... 117
Conclusion ... 119
Partie expérimentale ... 121
VII
Chapitre 4 : ... 128
Chapitre 5 ... 133
Annexes ... 139
VIII
Liste des figures
Figure 1. Représentation de l’association symbiotique ... 1
Figure 2. Types de thalles lichéniques ... 2
Figure 3. Cristaux d’acide usnique à la surface de l’hyphe du champignon ... 4
Figure 4. Processus fondamentaux menant aux voies biosynthétiques des PNs lichéniques . 7 Figure 5. Types de composés appartenant à la voie de l’acide shikimique ... 10
Figure 6. Types de composés appartenant à la voie des mévalonates ... 11
Figure 7. Types de composés appartenant à la voie des acétates polymalonates ... 13
Figure 8. Spectre d’absorption des rayons UV pour les types de métabolites photoprotecteurs ... 17
Figure 9. Évolution de l’étude des métabolites lichéniques ... 23
Figure 10. Méthodologie pour l’isolation et l’identification de métabolites bioactifs ... 25
Figure 11. Exemple fictif d’optimisation des conditions d’élution ... 32
Figure 12. Système de fractionnement modèle ... 34
Figure 13. Exemple de transposition géométrique ... 41
Figure 14. Exemple de la détermination du nouveau débit ... 42
Figure 15. Exemple de la détermination du temps des étapes ... 44
Figure 16. Lichen Cladonia stellaris (A) formation d’un tapis de lichen ... 47
Figure 17. Profilage des métabolites de l’extrait DCM de C. stellaris par HPLC-PDA-ELSD ... 55
Figure 18. Profilage des métabolites de l’extrait DCM de C. stellaris par HPLC-PDA-HRMS ... 57
Figure 19. Micro-fractionnement de l’extrait DCM de C. stellaris par HPLC semi-préparative ... 59
Figure 20. Optimisation du gradient d’élution pour augmenter la résolution ... 60
Figure 21. Fractionnement de l’extrait brut par MPLC (A) Montage utilisé pour l’injection solide du mélange brut (B) Composition du mélange brut (C) Chromatogramme obtenu pour le fractionnement de l’extrait dichlorométhane de C. stellaris ... 62
Figure 22. Purification de la fraction 67 par HPLC semi-préparative ... 65
Figure 23. Identification des composés isolés de l’extrait C. stellaris ... 66
Figure 24. Ions moléculaires obtenus lors de l’analyse du composé 0 par HRMS ... 67
Figure 25. Ions moléculaires obtenus lors de l’analyse du composé 5 par HRMS ... 67
Figure 26. Ions moléculaires obtenus lors de l’analyse du composé 8 par HRMS ... 68
Figure 27. Ions moléculaires obtenus lors de l’analyse du composé 11 par HRMS ... 69
Figure 28. Thalle du lichen S. paschale... 77
Figure 29. (A) Analyse de l’extrait MeOH de S. paschale par HPLC-PDA. (B) Analyse de l’extait brut par HPLC-TOF-HRMS en mode négative. (C) Analyse de l’extait brut par HPLC-TOF-HRMS en mode positive. ... 82
Figure 30. Composés isolés de l’extrait MeOH de S. paschale ... 84
IX
Figure 32. Chromatogrammes obtenus lors de l’analyse par HPLC des extraits bruts de S.
paschale ... 98 Figure 33. Banque de produits naturels et de dérivés synthétiques ... 105 Figure 34. Exemple de métabolites incorporant une unité de type acide orsellinique ... 106
X
Liste des schémas
Schéma 1. Voie métabolique de la glycolyse ... 7
Schéma 2. A : Formation de l’acétyl-CoA par décarboxylation oxydative, B : Formation du malonyl-CoA ... 8
Schéma 3. Biosynthèse de l’acide mévalonique ... 8
Schéma 4. Biosynthèse des précurseurs des acides aminés aromatiques ... 9
Schéma 5. Biosynthèse des métabolites lichéniques de la voie de l’acide shikimique ... 11
Schéma 6. Biosynthèse des métabolites de la voie des mévalonates ... 12
Schéma 7. Biosynthèse des unités monoaromatiques phénoliques ... 14
Schéma 8. Biosynthèse des depsides, diphényléthers et biphényles ... 15
Schéma 9. Formation des depsidones, diphényléthers et depsones ... 16
Schéma 10. Biosynthèse des composés 0, 5 et 11 ... 70
Schéma 11. Biosynthèse de l’acide usnique ... 71
Schéma 12. Biosynthèse des composés monoaromatiques 4 et 5 issus de l’extrait méthanol du lichen S. paschale ... 89
Schéma 13. Biosynthèse de l’acide lobarique ... 90
Schéma 14. Relation biosynthétique entre les pseudodepsidones 6 à 11 et l’acide lobarique ... 91
Schéma 15. Biosynthèse des dibenzofuranes 1 et 3 et de l’acide isostrepsilique ... 93
Schéma 16. Exemple d’une voie de synthèse menant à l’acide olivetolique à partir de l’olivetol ... 107
Schéma 17. Exemple d’une voie de synthèse permettant d’incorporer une chaîne alkyle . 107 Schéma 18. Voie de synthèse menant à une lactone d’acide resorcylique à partir du méthyle orsellinate ... 108
Schéma 19. Exemple de voie de synthèse menant à l’acide olivetolique suite à une alkylation ... 108
Schéma 20. Réaction d’ortho-lithiation dirigée et de substitution aromatique électrophile ... 109
Schéma 21. Plan de rétrosynthèse de l’acide 4-O-méthylolivetolcarboxylique ... 110
Schéma 22. Mécanisme d’ortho-lithiation, force des groupements ortho-directeurs et stabilité des lithiens ... 111
Schéma 23. Synthèse d’un amide à partir d’un chlorure d’acyle ... 112
Schéma 24. Synthèse du benzamide à partir de la diéthylamine et du triméthylaluminium ... 113
Schéma 25. Réaction d’ortho-lithiation et d’alkylation à partir de la diéthylbenzamide et de l’iodopentane ... 114
Schéma 26. Synthèse de l’ester méthylique à partir du benzamide alkylé ... 115
Schéma 27. Voie de synthèse proposée pour l’obtention de l’acide 4-O-méthylolivetolcarboxylique ... 116
XI
Liste des tableaux
Tableau 1. Classes de métabolites secondaires ... 6
Tableau 2. Classification scientifique des lichens C. mitis et C. stellaris ... 46
Tableau 3. Préparation des extraits bruts du lichen C. stellaris ... 50
Tableau 4. Criblage biologique des extraits bruts du lichen C. stellaris ... 51
Tableau 5. Transposition géométrique des conditions d’élution ... 61
Tableau 6. Analyse des fractions et location des composés par UPLC-PDA-ELSD ... 63
Tableau 7. Préparation des extraits bruts du lichen C. mitis... 73
Tableau 8. Criblage biologique des extraits bruts de C. mitis ... 73
Tableau 9. Ions moléculaires obtenus lors de l’analyse des extraits bruts par HPLC-MS ... 75
Tableau 10. Classification scientifique des lichens Stereocaulon ... 77
Tableau 11. Préparation des extraits bruts du lichen S. paschale ... 80
Tableau 12. Criblage biologique des extraits bruts du lichen S. paschale ... 81
Tableau 13. RMN 1H et RMN 13C des composés 1 à 3 et des acides hypostrepsilalique et norascomatique ... 86
Tableau 14. Activité antimicrobienne des composés isolés de S. paschale ... 95
XII
Liste des annexes
Annexe 1 : Démonstrations mathématiques menant à l’équation 1 ... 139
Annexe 2 : Démonstrations mathématiques menant à l’équation 5 ... 140
Annexe 3 : Revue de littérature des composés isolés du genre Cladonia ... 142
Annexe 4 : Optimisation du gradient d’élution de l’extrait CS DCM par HPLC-PDA ... 153
Annexe 5 : Analyse de la dégradation de l’extrait DCM de C. stellaris par HPLC-PDA . 153 Annexe 6 : Optimisation de la séparation des fractions 45-48 et 67 de l’extrait DCM de C. stellaris ... 154
Annexe 7 : Analyse des extraits bruts de C. stellaris et C. mitis par HPLC-PDA-HRMS 155 Annexe 8. Revue de littérature des composés isolés du genre Stereocaulon ... 157
Annexe 9. Résultats aux tests anti-inflammatoires pour les métabolites isolés de S. paschale ... 158
Annexe 10 : Spectres 1H et 13C RMN des métabolites isolés de l’extrait MeOH de S. paschale ... 167
Annexe 11 : Spectres UV des composés 6 à 13 isolés de l’extrait MeOH de S. paschale . 180 Annexe 12 : Spectre HRESIMS du composé 1 (mode ionisation négative) ... 181
Annexe 13 : Spectre HRESIMS du composé 3 (mode ionisation négative) ... 181
Annexe 14 : Chromatogrammes HPLC des composés 1, 2 et 3 ... 181
Annexe 15 : Analyse cristallographique du composé 4 ... 182
Annexe 16 : Analyse cristallographique du composé 13 ... 182
Annexe 17 : Comparaison des spectres RMN et HRMS des benzamides alkylé et dialkylé ... 183
Annexe 18 : Suivie de l’essai de saponification par 1H RMN (CHCl 3-d) ... 183
Annexe 19 : Suivi de la réaction de déméthylation menant à l’acide olivetolique par 1H RMN (CHCl3-d) ... 184
XIII
Liste des abréviations
ACN Acétonitrile
APPI Photo-ionisation à pression atmosphérique ATP Adénosine-5′-triphosphate
C. Cladonia (genre du lichen)
C18 Phase stationnaire octadécylsilane CCM Chromatographie sur couche mince
CD Dichroïsme circulaire
CM Extrait du lichen Cladonia mitis
CoA Coenzyme A
Col. Colonne
Conc. Concentration
COX-1 et COX-2 Cyclooxygénase-1 et -2
CS Extrait du lichen Cladonia stellaris
CV Nombre de volume de colonne
DAHP Acide-3-désoxy-D-arabino-heptulosonique-7-phosphate
DCM Dichlorométhane
DEPT Distortionless Enhanced Polarization Transfer
DIEA Diisopropyléthylamine DMAP 4-Diméthylaminopyridine DMAPP Diméthylallyl-pyrophosphate DME 1,2-Diméthoxyéthane DMF Diméthylformamide DMG Groupement ortho-directeur DMPU 1,3-Diméthyl-3,4,5,6-tétrahydro-2(1H)-pyrimidinone DMSO Diméthylsulfoxyde
DNP Dictionary of Natural Products
ɛ Absorptivité molaire
E+ Électrophile
ELSD Détecteur évaporatif à diffusion de la lumière ESI Mode ionisation par électronébulisation
eq. Équivalent FA Acide formique FR Fraction GPP Géranyl-pyrophosphate hν Symbole du photon 1H-1H Couplage proton-proton 1H-13C Couplage proton-carbone Hex Hexane
XIV
I Nombre quantique de spin nucléaire IC50 Concentration inhibitrice médiane
IL-6, -8 et -1β Interleucine-6, -8, 1β
% inhb. % inhibition
Inj. Injection
IPP Isopentényl-pyrophosphate
IR Spectroscopie infrarouge
IT-MS Spectrométrie de masse à trappe à ions (Ion trap mass spectrometry)
J Constante de couplage en hertz
LDA Diisopropylamidure de lithium
5-LO 5-Lipoxygenase
5- et 12- LOX Lipoxygénases-5 et -12
LPS Lipopolysaccharide bactérien
m/z Rapport masse sur charge
Max. Maximum
MIC Concentration minimale inhibitrice MOM Méthyle chlorométhyle éther mPGES-1 Prostaglandine E synthase-1
MPLC Chromatographie liquide à moyenne pression
MS Spectrométrie de masse
MTT Bromure de 3-(4,5-diméthylthiazol-2-yl)-2,5-diphényl tétrazolium NAD Nicotinamide adénine dinucléotide
NADPH Nicotinamide adénine dinucléotide phosphate
NF-κB Facteur de transcription nucléaire (nuclear factor-kappa B)
Nu- Nucléophile
[O] Réaction d’oxydation
ORD Dispersion rotatoire optique
PDA Détecteur à barrette de diodes (absorption UV)
PEP Phosphoénolpyruvate
PGAL Glycéraldéhyde-3-phosphate
Pi Phosphate inorganique
PLP Phosphate de pyridoxal
PNs Produits naturels
PTP1B Tyrosine-protein phosphatase non-receptor type 1
Q-MS Spectromètre de masse à quadridole QR Hepa 1c1c7 NADPH quinone réductase de type 2 RCM Métathèse de fermeture de cycle
Rf Coefficient de migration
RMN Spectroscopie de résonance magnétique nucléaire RMN 1H Étude RMN 1D du proton
XV
RMN COSY Étude RMN de type COrrelation SpectrocopY
RNM HMBC Étude RMN de type Heteronuclear Multiple Bond Coherence RMN HSQC Étude RMN de type Heteronuclear Single-Quantum Correlation RMN NOESY Étude RMN de type Nuclear Overhauser Effect SpectroscopY ROS Dérivés réactifs de l’oxygène
Rubisco Ribulose 1,5 bisphosphate carboxylase/oxygénase
S. Stereocaulon (genre du lichen)
SAR Étude de relation structure activité
sec Solvant anhydre
S-Enz Liaison souffre-enzyme
SP Extrait du lichen Stereocaulon paschale
Syst. Système
t.a. Température ambiante
TBDMS tert-Butyldiméthylsilyle
TDDFT Théorie de la fonctionnelle de la densité dépendante du temps
THF Tétrahydrofurane
TMEDA Tétraméthyléthylènediamine
TNF-α Facteur de nécrose tumorale alpha TOF Spectrométrie de masse à temps de vol TR Temps de rétention
UPLC Chromatographie liquide ultra performance
UV Détecteur UV-visible
XVI
Remerciements
Je tiens d’abord à remercier mon directeur de recherche Normand Voyer de m’avoir fait confiance en m’impliquant dans des projets d’envergure depuis mon tout premier stage et en m’ayant laissé commencer un nouvel axe de recherche sur l’étude des produits naturels au sein de son laboratoire de recherche.
Il ne fait aucun doute que le groupe du professeur Jean-Luc Wolfender de l’Université de Genève a été d’une aide très précieuse pour le commencement et la continuité de mes travaux de recherche à la maîtrise. C’est pourquoi j’aimerais également remercier Jean-Luc Wolfender et son associé de recherche Emerson Ferreira Queiroz de m’avoir accueillie dans leurs laboratoires pour m’apprendre les rudiments de l’isolation et l’identification de produits naturels bioactifs. Je leur suis aussi très reconnaissante de m’avoir transmis leur passion pour l’étude des produits naturels. J’aimerais aussi faire une mention spéciale au post-doctorant Marcos Marçal Ferreira Queiroz et aux autres membres de l’équipe brésilienne Cláudia Rocha et Leonardo Saldanha, pour avoir pris le temps de me former.
Je tiens aussi à remercier le Pr Stéphane Boudreau et à son groupe de recherche qui ont effectué la collecte des lichens, sans quoi le projet n’aurait pas vu le jour. J’ai aussi eu la chance de travailler avec des collègues de travail qui sont devenus de très bons amis au cours des dernières années. Merci pour l’ambiance dans le laboratoire et toutes nos soirées festives.
Je voudrais également remercier ma famille de m’avoir appuyée et encouragée à poursuivre une carrière scientifique. Ils ont aussi toujours été présents pour m’aider ce qui m’a permis de me concentrer pleinement sur mes études. Finalement, je voudrais remercier mon copain Étienne avec qui j’ai pu entretenir un nombre incalculable de discussions sur mes travaux de recherche. Merci aussi d’avoir fait comme si de rien n’était lorsque tu me demandais « tu finis quand ? » et que je te répondais « bientôt ».
1
Chapitre 1 : Introduction 1. Que sont les lichens ?
1.1 Association symbiotique 1,2,3,4,5
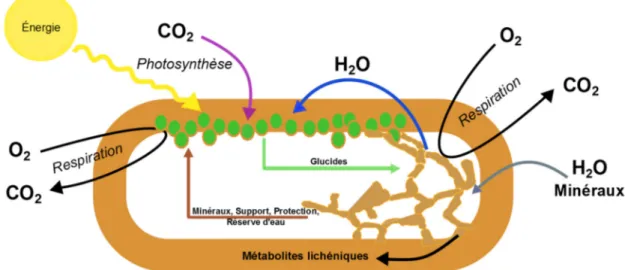
Les lichens sont des organismes symbiotiques composés d’un champignon (mycobionte) et d’une algue ou d’une cyanobactérie (photobionte). L’algue représente seulement 3,1% de la masse sèche du lichen. Le lichen dépend d’un échange mutuel d’éléments entre les partenaires fongique et photosynthétique (figure 1). Le champignon agit premièrement comme une source de support et de protection pour les cellules d’algue qui sont enchevêtrées dans les filaments du mycobionte. En dictant la structure et la morphologie des thalles, le champignon s’assure que le photobionte ait accès à une luminosité adéquate et puisse respirer (échange de gaz). Le mycobionte est aussi responsable d’acheminer de l’eau, des minéraux et de la vitamine C aux cellules d’algues pour qu’elles puissent produire de la matière organique par photosynthèse à partir du CO2 et de l’eau en utilisant
la lumière du soleil comme source d’énergie. Les glucides produits par le photobionte sont nécessaires au champignon pour sa croissance et à partir de ceux-ci, il pourra produire des métabolites lichéniques.
Figure 1. Représentation de l’association symbiotique
Le mycobionte des lichens peut appartenir à deux classes du règne des champignons, soit les ascomycètes ou les basidiomycètes. Environ 98% des mycobiontes lichéniques sont des ascomycètes et se distinguent des basidiomycètes par les cellules reproductrices qui
2
contiennent les spores, respectivement les asques et les basides. On dénombre jusqu’à maintenant 18 500 espèces de champignons lichénisants alors que seulement 40 genres de photobionte sont associés aux différentes espèces de mycobionte. Le photobionte est habituellement une algue verte (Chlorophycées ou Trébouxiophycées) unicellulaire (Trebouxia) ou filamenteuse (Trentepohlia). Le mycobionte peut aussi être associé à une cyanobactérie du genre Nostoc ou Scytonema.
1.2 Morphologie 1,3,4
La morphologie des lichens est assez simple comme les lichens se présentent sous la forme d’un thalle qui ne possède pas de feuilles, de racines et de tiges. La forme du thalle est principalement dictée par le champignon, mais elle est aussi influencée par le photobionte. Les lichens sont des organismes qui poussent lentement, soit d’environ 5 à 10 mm/année et qui peuvent vivre pendant plus de 100 ans. Les lichens vont habituellement croître en hauteur pendant environ une dizaine d’années, puis lorsqu’ils ont atteint leur hauteur maximale, le bas du thalle commence à mourir alors que le podétion continue de pousser. Les lichens sont présents sous sept formes de thalles : gélatineux, foliacés, lépreux, crustacés, fructiculeux, squamuleux et complexe (figure 2).
3
- Les gélatineux : lorsqu’hydratés, ils sont gélatineux tandis qu’à l’état déshydraté, ils sont cassants. Ils sont habituellement composés de cyanobactéries et sont de couleur vert foncé à noir.
- Les foliacés : sont sous la forme de lamelles lobées. Le thalle ressemble à une feuille qui se détache de son substrat.
- Les lépreux : sont sous la forme de granules qui se détachent du substrat. - Les crustacés : forment une croûte intégrée au substrat.
- Les fructiculeux : ressemble à un buisson, souvent ramifié dans toutes les directions. Ils ont habituellement un point de contact avec le substrat très restreint et le thalle se dresse à partir de cette surface de contact.
- Les squamuleux : constitués de petites écailles, ils forment une surface plane ou concave similaire aux crustacés et aux foliacés qui comporte des compartiments (squamules).
- Les complexes : sont formés de deux parties; d’un thalle primaire (crustacé, foliacé ou squamuleux) qui est rattaché au substrat et d’un thalle secondaire de type fructiculeux qui se forme sur le thalle primaire.
1.3 Adaptation au stress environnemental 1,2,3,4
Des fossiles anciens de 400-600 millions d’années ont démontré que les lichens sont probablement les tout premiers colonisateurs de nombreux habitats terrestres. On retrouve ces champignons lichénisants dans les tropiques, les sommets arctiques alpins, dans les déserts rocheux et en Antarctique, en raison de leur capacité d’adaptation aux stress environnementaux, qui est en partie due à l’association symbiotique. La preuve que cette symbiose est des plus efficaces est que l’algue et le champignon ne pourraient vivre séparément dans des conditions aussi extrêmes. Les lichens sont des organismes qui peuvent supporter de très grandes variations de température et d’humidité ce qui fait d’eux des pionniers qui dominent les habitats et les substrats qui sont inhabitables pour les autres végétaux.6
Leur habileté à tolérer des environnements aussi extrêmes doit être principalement due à leur habileté à passer d’une forme active à une forme de dormance.7 Les lichens sont des
4
sont hydratés. Lors d’une période sécheresse, ils peuvent ainsi se mettre en dormance pour survivre et dès que l’eau est à nouveau disponible, leur métabolite redevient actif. Un autre moyen de défense est la production de métabolites secondaires actifs à la surface de l’hyphe du champignon pour se protéger des herbivores, des insectes et des pathogènes. À la figure 3, on voit à la surface d’une culture de champignons des cristaux d’acide usnique, un métabolite lichénique antimicrobien et antifongique bien connu.8 Finalement, les lichens
peuvent accumuler de grandes quantités de métabolites ayant des propriétés physicochimiques bien spécifiques (filtration des radiations UVA-UVB, hydrophiles) qui les aident à survivre.6
5
2. Métabolites lichéniques 1,2,3,8,9
Les produits lichéniques peuvent être divisés en deux groupes, soit les métabolites primaires et secondaires. Les substances naturelles primaires sont communes à plusieurs organismes et par définition, elles sont essentielles à la survie et la reproduction. Parmi les composés primaires, on retrouve les acides aminés, les acides gras, les sucres, les protéines, les polyols, les caroténoïdes, les vitamines, etc., qui sont biosynthétisés par l’algue et le partenaire fongique. Ces composés sont dits intracellulaires, étant donné qu’ils se retrouvent dans la paroi cellulaire et dans les protoplastes, alors que les métabolites secondaires sont dits extracellulaires, comme ils se retrouvent à la surface de l’hyphe du champignon. Les composés secondaires ne sont pas essentiels à la survie de l’organisme, mais ils y jouent des rôles spécifiques. L’étude phytochimique des lichens se concentre particulièrement aux métabolites secondaires puisque, contrairement aux métabolites primaires, ils sont caractéristiques de l’organisme à l’étude. On dénombre actuellement plus de 1050 métabolites qui ont été isolés des lichens. La grande majorité de ces métabolites sont uniquement d’origine fongique, toutefois l’algue peut participer aux étapes finales de la biosynthèse d’un métabolite.10 L’algue représente environ 3 % de la masse sèche du
lichen, c’est pourquoi les métabolites uniquement produits par l’algue ne sont pratiquement jamais isolés étant donné qu’ils sont en très petite quantité dans l’organisme. Parmi les métabolites isolés, il y a environ seulement 5 à 10 % de ces composés qui sont aussi synthétisés par d’autres organismes comme les champignons. Les métabolites issus des lichens sont classés selon leur voie biosynthétique, cette classification a été proposée par Asahina et Shibata en 1971,11 puis a été améliorée par Culberson et Elix en 1996.12
2.1 Métabolites secondaires appartenant aux voies principales de biogenèse 5
Les lichens produisent une grande variété de métabolites secondaires de type phénolique qui proviennent pour la très grande majorité de la voie biosynthétique de l’acétate polymalonate. Les voies de l’acide shikimique et de l’acide mévalonique sont aussi des voies biosynthétiques par lesquelles les grands groupes de produits lichéniques sont produits.
6
Tableau 1. Classes de métabolites secondaires 4
Les différents types de composés lichéniques qui dérivent ces trois voies métaboliques sont présentés au tableau 1, en plus du nombre approximatif de composés rapportés pour chaque type. 82 % des métabolites connus font partie de la voie des acétates polymalonates qui englobent la majorité des types de composés lichéniques. En effet, dix des quatorze types rapportés sont associés à cette voie. Parmi ces types, les depsides, depsidones et diphényléthers sont les principaux produits naturels caractéristiques des lichens avec plus de la moitié du nombre de métabolites connus. Les terpènes et les stéroïdes qui tirent leur origine biosynthétique de la voie des mévalonates et les composés associés à la voie de l’acide shikimique représentent respectivement seulement 16 % et 2 % des métabolites connus.
Les blocs de construction nécessaires à la biosynthèse des métabolites secondaires sont issus de divers processus fondamentaux soit la photosynthèse, la glycolyse et la voie du pentose phosphate. Des milliers de métabolites lichéniques diversifiés et complexes sont formés par une série de réactions enzymatiques à partir de seulement quelques blocs de construction. Ces blocs de construction sont formés via trois substrats de base, l’acétyl-coenzyme A, l’acide shikimique, et le mévalonate qui sont impliqués respectivement dans les voies biosynthétiques des acétates polymalonates, des mévalonates et de l’acide shikimique.
Voie de biosynthèse Type de composé Nombre de
composés
Voie des acétates polymalonates
Acides aliphatiques, esters et dérivés 56
Monoaromatique phénoliques 32
Depsides, tridepsides et esters benzyliques 207
Depsidones et diphényléthers 131
Depsones 8
Dibenzofuranes, acide usnique et dérivés 29
Anthraquinones et dérivés 52
Chromones et chromanes 13
Naphtoquinones et bis-naphtoquinones 10
Xanthones et bis-xanthones 78
Voie des mévalonates Di-, sesquiter-, et tri-terpènes Stéroïdes 33 88 Voie de l’acide
7
Figure 4. Processus fondamentaux menant aux voies biosynthétiques des PNs lichéniques
Les processus fondamentaux qui mènent à la formation des substrats de base nécessaires pour la biosynthèse des métabolites secondaires sont présentés à la figure 4. Lors du processus de photosynthèse, les pigments photosynthétiques de l’algue captent la lumière du soleil et la convertie en énergie chimique (ATP et NADPH). Suite à ces réactions photochimiques, dans le cycle de Calvin, l’énergie chimique contenue dans l’ATP et le NADPH est utilisée pour transformer le CO2 en molécule organique composée de trois
carbones, le glycéraldéhyde-3-phosphate (PGAL). Cette étape de fixation du CO2 est
catalysée par l’enzyme Rubisco (Ribulose 1,5 bisphosphate carboxylase/oxygénase). Finalement, du glucose est formé à partir de deux molécules de PGAL. La glycolyse est la principale voie qui métabolise le glucose, lors de ce processus le glucose est oxydé en pyruvate par des réactions d’oxydoréduction à l’aide des coenzymes NAD+ et NADH
(schéma 1).
8
Le pyruvate, qui est la base conjuguée de l’acide pyruvique, est un métabolite primaire très important qui, suite à une décarboxylation oxydative, forme l’acétyl-coenzyme A (CoA). Grâce à l’acétyl-coenzyme A carboxylase, l’acétyl-CoA peut être convertie en malonyl-CoA par l’addition d’un groupement carboxylate (schéma 2).
Schéma 2. A : Formation de l’acétyl-CoA par décarboxylation oxydative, B : Formation du malonyl-CoA
C’est à partir de ces unités acétates et malonates et des enzymes polycétides-synthases (PKs) que les polycétides impliquées dans la voie des acétates polymalonates sont formées par condensation. En effet, l’acétyl-CoA est un substrat de base est très utile puisqu’il permet la formation de liens C-C par des réactions d’aldol et de Claisen. L’acide mévalonique est lui aussi formé par la condensation d’unités acétyl-CoA (schéma 3). Dans ce cas-ci, trois unités acétate sont nécessaires en plus de deux enzymes soit l’hydroxy-méthyl glutarate-CoA synthétase et réductase (HMG-CoA synthétase / réductase).
9
Finalement, l’acide shikimique est synthétisé à partir du phosphoénolpyruvate et de l’érythrose 4-phosphate (schéma 4), deux métabolites primaires qui sont respectivement formés par la voie de la glycolyse et du pentose phosphate.
2.1.1 Voie de l’acide shikimique
La voie de l’acide shikimique permet la synthèse des acides aminés aromatiques (L-phénylalanine, L-tyrosine et L-tryptophane) qui servent d’intermédiaires dans la voie de l’acide shikimique pour former des métabolites lichéniques très diversifiés.
Schéma 4. Biosynthèse des précurseurs des acides aminés aromatiques
L’acide chorismique est un intermédiaire clé dans la voie du shikimate, il sert à la fois de précurseur pour la synthèse de la tyrosine, de la phénylalanine, mais aussi pour le tryptophane et les dérivés de type indole (schéma 4). Il est obtenu suite à l’attaque nucléophile de l’acide shikimique 3-phosphate sur la double liaison protonée d’une molécule de PEP. Finalement, deux étapes successives d’élimination d’acide phosphorique permettent d’obtenir l’acide chorismique. Ce dernier peut être transformé en acide préphénique par un réarrangement de Claisen qui permet le transfert de la chaîne latérale dérivée du PEP sur le cycle carboné. Une étape d’aromatisation par décarboxylation mène au 4-hydroxyphénylpyruvate et au phénylpyruvate qui sont respectivement les
10
intermédiaires de la tyrosine et de la phénylalanine qui sont obtenus par une étape finale de transamination avec le glutamate et le phosphate de pyridoxal (PLP). Dans le cas du tryptophane, l’intermédiaire clé menant à sa biosynthèse est l’acide anthranilique au lieu de l’acide préphénique.
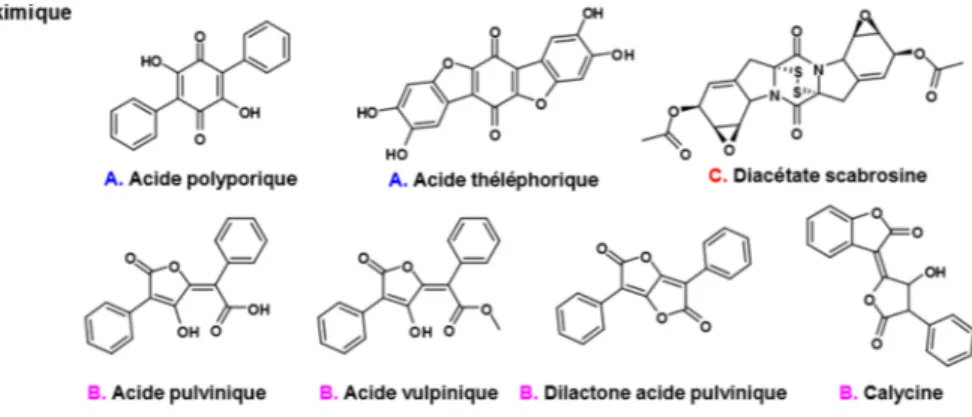
Les différents métaboliques lichéniques qui sont biosynthétisé par la voie de biogenèse de l’acide shikimique appartiennent à trois types de composés, soient les terphénylquinones, les dérivés de l’acide pulvinique et les épidithiodioxopipérazine (figure 5). Ils ont été isolés dans différents de lichens : la famille des Stictaceae,13 le lichen Letharia vulpina (acide
vulpinique et calycine) et le lichen Pseudocyphellaria crocata (acide vulpinique, calycine et acide polyporique).8
Figure 5. Types de composés appartenant à la voie de l’acide shikimique
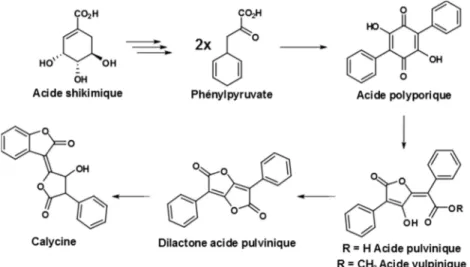
Ces composés sont obtenus par condensation de deux unités de phénylpyruvate qui mène à l’acide polyporique (schéma 5).13 Ce dernier est l’intermédiaire pour la biosynthèse de
l’acide théléphorique, mais aussi pour les dérivés de l’acide pulvinique. Il a été proposé que l’acide pulvinique soit obtenu suite à l’ouverture du cycle de l’acide polyporique par oxydation. L’acide vulpinique est simplement l’ester méthylique de l’acide pulvinique, ces deux derniers métabolites peuvent mener à la dilactone par l’attaque nucléophile du groupement hydroxyle sur la fonction carbonyle de l’acide ou de l’ester. Il a été aussi démontré que la dilactone de l’acide pulvinique peut être hydroxylé pour former la calycine par lactonisation.8
11
Schéma 5. Biosynthèse des métabolites lichéniques de la voie de l’acide shikimique
2.1.2 Voie des mévalonates
La voie biosynthétique de l’acide mévalonique produit différents types de terpènes qui sont présents dans les lichens, soit des di-, secter- et tri-terpènes, des stéroïdes et des caroténoïdes. Ces composés ne sont toutefois pas spécifiques aux lichens, ils sont aussi présents dans de nombreux organismes végétaux et animaux (figure 6).
Figure 6. Types de composés appartenant à la voie des mévalonates
Des unités isoprènes, isopentényl-pyrophosphate (IPP) et diméthylallyl-pyrophosphate (DMAPP) servent de précurseurs pour la biosynthèse des terpénoïdes, stéroïdes et caroténoïdes. L’IPP (unité C5) est obtenu à partir de l’acide mévalonique suite à des réactions de décarboxylation et de déshydratation. Le DMAPP (unité C5) est alors formé par l’isomérisation de l’IPP. Ces deux unités à cinq carbones peuvent ensuite se combiner pour former des monoterpènes (unité C10). C’est l’addition électrophile entre le cation
12
allylique du DMAPP et la double liaison de l’IPP suive de la perte d’un proton qui conduit au géranyl-pyrophosphate (GPP, unité C10). Par la suite, l’incorporation successive d’unités IPP au mono-, sesqui- et di-terpènes de façon tête-à-queue conduit aux différents terpénoïdes, stéroïdes et caroténoïdes tel que démontré au schéma 6.
Schéma 6. Biosynthèse des métabolites de la voie des mévalonates
2.1.3 Voie des acétates polymalonates 10
La voie de biogenèse des acétates polymalonates produit aux polycétides à partir de la condensation d’unité acétyl-CoA et malonyl-CoA. Ces longues chaînes β-carbonylées sont les précurseurs des acides aliphatiques (γ-lactones, di- et tri- acides gras) et des polyacétates aromatiques. Cette dernière classe est divisée en trois sous-classes de types de composés, soit les unités monoaromatiques phénoliques, les dérivés di- et tri- aryle d’unités phénoliques et les anthraquinones/xanthones (figure 7).
13
Figure 7. Types de composés appartenant à la voie des acétates polymalonates
Une attention particulière concernant la biosynthèse sera portée à la classe des polycétides aromatiques, plus particulièrement aux unités monoaromatiques, aux depsides, aux tridepsides, aux depsidones, aux diphényléthers et aux dibenzofuranes, qui sont des métabolites caractéristiques aux lichens. Les polycétides formés par condensation de type Claisen des unités acétyl-CoA et malonyl-CoA sont très réactifs et peuvent ainsi mener à divers types composés suite à des réactions intramoléculaires de Claisen ou des condensations aldoliques qui sont dictées par des enzymes. Les unités monoaromatiques phénoliques de base sont issues d’une chaîne carbonylée de huit carbones qui est formée par la condensation d’une unité acétyl-CoA avec trois unités malonyl-CoA. Cette tétracétide peut alors être cyclisée par deux différentes réactions ce qui mène à l’acide orsellinique et au phloroacétophénone (schéma 7). Dans le premier cas, l’énolate formé
14
permet une addition de type aldol sur le carbonyle ce qui mène à la formation d’un alcool tertiaire qui est ensuite déshydraté pour conduire à l’alcène. Par la suite, l’énolisation est favorisée puisqu’elle mène à l’aromatisation du cycle, un processus favorable. Finalement, l’acide orsellinique est obtenu par l’hydrolyse du thioester (S-Enz = CoA). Dans le deuxième cas, l’énolate formé permet une condensation intramoléculaire de type Claisen sur le carbonyle du thioester (C=O-SEnz). Cette étape de cyclisation est suivie de la reformation du carbonyle qui est possible en raison de l’expulsion du thiol qui agit comme groupe partant. Pour terminer, l’énolisation est favorisée par l’aromatisation du cycle. L’acide orsellinique et le phloroacétophénone sont les unités monoaromatiques les plus simples. Des dérivés de ces unités monoaromatiques de base peuvent être obtenus par les deux précédentes voies de cyclisation (aldolique et Claisen). Une des modifications possibles est la longueur de la chaîne alkyle (R) qui varie selon le nombre d’unités malonates qui forment le polycétide.14 Des étapes subséquentes de réduction et de
déshydratation sont nécessaires pour former ces chaînes alcanes.
Schéma 7. Biosynthèse des unités monoaromatiques phénoliques
L’union de deux unités monoaromatiques de type orsellinique par la formation d’un lien ester, d’un lien éther et d’un lien carbone-carbone conduit respectivement à la biosynthèse des depsides, des diphényléthers et les biphényles. C’est la combinaison de ces trois différents types de couplage qui mène à la formation des depsidones, des dibenzofuranes et des depsones. Les depsides sont obtenus par une réaction d’estérification entre les phénols et les acides carboxyliques de deux noyaux de type orsellinique. Un troisième noyau orcinol peut ensuite réagir selon une réaction d’estérification avec le depside pour former un tridepside. Dans le cas des depsidones, il a été suggéré que le lien éther est issu d’un
15
couplage oxydatif entre les radicaux des phénols d’un depside (schéma 8). Une deuxième théorie a été proposée pour la biosynthèse des depsidones, elle implique la formation d’un
meta-depside qui subit un réarrangement de Smiles pour mener à un intermédiaire
diphényléther qui conduit à la depsidone suite à une réaction d’estérification (schéma 8). La biosynthèse des depsidones par des réarrangements intramoléculaires sera traitée au chapitre 5.
Schéma 8. Biosynthèse des depsides, diphényléthers et biphényles
Les depsones ont aussi comme précurseur un depside, la formation du lien C-C entre les deux unités phénoliques est réalisée par un couplage oxydatif phénolique (schéma 8). Les diphényléthers sont produits suite à une réaction d’éthérification entre deux unités phénoliques. Trois biosynthèses menant à leur formation ont toutefois été rapportées dans la littérature. Pour le premier cas, le diphényléther peut être directement obtenu par un couplage oxydatif entre deux unités monoaromatiques (schéma 8). Dans le deuxième cas, il peut être formé par un réarrangement de Smiles d’un meta-depside. Finalement, les diphényléthers peuvent provenir de l’hydrolyse de la fonction ester d’une depsidone (schéma 9).
16
Schéma 9. Formation des depsidones, diphényléthers et depsones
2.2 Rôles biologiques et écologiques des métabolites secondaires 2,14,15,16
Les lichens produisent une variété de métabolites secondaires selon un procédé très énergivore où les partenaires fongique et photosynthétique travaillent en étroite collaboration (symbiose) pour fournir les éléments essentiels à la biosynthèse (voir section 1.1, chapitre 1). Il est évident que les métabolites secondaires produits par les lichens doivent avoir un ou plusieurs rôles biologiques et/ou écologiques dans l’organisme vu la complexité et la dépense énergétique élevée du processus biosynthétique. Les rôles des métabolites ne sont pas encore tous connus, mais leurs principales fonctions sont de :
- Fournir des minéraux importants à l’organisme en agissant comme des agents chélateurs.
- Promouvoir l’équilibre symbiotique en affectant la perméabilité des cellules membranaires de l’algue (photobionte).
- Prévenir la saturation du thalle en eau (propriétés hydrophobiques) et permettre l’échange gazeux avec l’atmosphère.
- Protéger l’organisme contre les microorganismes grâce à leurs propriétés antimicrobiennes.
- Protéger le lichen contre les insectes et les herbivores (propriétés insecticides et anti-herbivores).
17
Les métabolites secondaires sont ainsi aussi communément appelés des métabolites de défenses puisqu’ils sont synthétisés par l’organisme pour le protéger. Il a aussi été démontré qu’ils sont des métabolites de stress, c’est-à-dire que le lichen sécrète des métabolites lorsqu’il est soumis à des stress intenses tels des conditions extrêmes de croissance très variantes en termes de température, d’humidité et d’intensité lumineuse.
Figure 8. Spectre d’absorption des rayons UV pour les types de métabolites photoprotecteurs
En ce qui concerne les composés photoprotecteurs, la biosynthèse de ce type de métabolites est l’un des mécanismes de défense les plus importants pour les lichens puisque le partenaire photosynthétique (algue) des lichens peut subir d’importants dommages par les radiations UVB et UVA.17 Les métabolites photoprotecteurs appartenant à diverses classes
de composés (monoaromatiques, dibenzofuranes, depsidones, depsides, diphényléthers, anthraquinones, xanthones et dérivés de la voie shikimate) sont ainsi sécrétés souvent sous forme cristalline à la surface de l’hyphe du thalle pour filtrer les radiations. Chacune des classes de composés a un spectre d’absorption des rayons UV très caractéristique d’où l’importance de produire plus d’un type de composés photoprotecteurs afin d’assurer une protection sur une large gamme de radiation. Les spectres d’absorption des métabolites lichéniques sont présentés à la figure 8.
18
Parmi les métabolites de défenses et de stress qui sont sécrétés, certains sont toxiques ce qui permet de protéger les lichens contre les microorganismes, les insectes et les herbivores qui tenteraient de les attaquer. Les lichens sont des organismes très peu compétitifs, par exemple, lorsque le couvert végétatif est trop dense, ils ne peuvent survivre. Ils sont toutefois en mesure de contrôler la croissance des végétaux qui les entourent et sur lesquels ils poussent en produisant des composés toxiques. La biosynthèse de métabolites toxiques est ainsi l’autre mécanisme de défense principal qui a été développé par les lichens pour assurer leur survie face aux différents stress environnementaux auxquels ils sont soumis.
2.3 Applications potentielles des métabolites lichéniques 2,9,18
Les applications des métabolites lichéniques sont de plus en plus nombreuses grâce à l’étude de leur rôle biologique et écologique. Par exemple, ils pourraient être utilisés en agriculture pour protéger les cultures des pathogènes, des insectes et des herbivores grâce aux propriétés antimicrobiennes, insecticides et cytotoxiques. Par exemple, l’acide capératique issu du lichen Flavoparmelia baltimorensis permet de repousser les serpents de type Pallifera varia.19 Les composés monoaromatiques haematommate d’éthyle et le
β-orcinolméthylcarboxylate ont un effet antiparasitaire sur les larves Toxocara canis. Huneck et Schreiber ont aussi rapporté en 1972 qu’environ 33 composés lichéniques étaient en mesure de réguler la croissance de différentes plantes.20
Avant même l’étude chimique des lichens, les décoctions de lichens ont été couramment utilisées par différentes civilisations en médecine traditionnelle pour traiter, en autres, les maladies du sang, les problèmes cardiaques, les bronchites, l’asthme, la gale, la lèpre, les splénomégalies, les sensations de brulement, les vomissements, les inflammations et les problèmes de foie.13,21 Il est rapporté que plus de 52 genres de lichens ont été utilisés en
médecine traditionnelle et que les lichens appartenant aux familles des Parmeliaceae, Usneaceae et Cladoniaceae étaient les plus courants pour la médecine traditionnelle chinoise.8,22 Plusieurs activités biologiques sont associées aux métabolites de défense :
antitumorale, antipyrétique, anti-inflammatoire, antioxydante, antimycobactérienne, antimicrobienne et analgésique.13,23,24,25,26 Les composés lichéniques constituent ainsi de
19
futurs médicaments pour le traitement de diverses maladies ou dans d’autres cas ils peuvent servir de point de départ pour le développement de nouvelles molécules plus actives.
Certains des métabolites de défense qui ont des propriétés photoprotectives,16 antioxydantes
et propigmentantes sont aussi susceptibles d’être utilisés comme ingrédients actifs en cosmétique.27 Leur ajout dans les crèmes pourrait servir à comme soin de beauté anti-âge
ou stimulateur de la mélanine et à protéger la peau en filtrant les rayons UV nocifs. L’activité antioxydante des composés permet de protéger la peau en piégeant les dérivés réactifs de l’oxygène, mais est aussi une propriété très recherchée en cosmétique étant donné qu’elle aide à limiter le photoviellissement de la peau, soit l’apparition de rides.28
L’apparition de tache brune de vieillesse sur la peau est associée à une surproduction de la mélanine due à l’exposition au soleil. Les composés qui sont en mesure d’inhiber la voie de la mélanogénèse pourraient ainsi agir comme traitement anti-âge (dépigmentant) en réduisant la production de mélanine.29,30 À l’opposé, les métabolites qui stimulent la
synthèse de la mélanine (propigmentant), sont aussi utilisés comme soin de beauté pour activer et prolonger le bronzage.31
20
3. Objectifs et portée des travaux de recherche
Dans le cadre de ma maîtrise, mon directeur de recherche et moi-même avons décidé d’implanter, au sein du laboratoire de chimie bioorganique et supramoléculaire, un nouvel axe de recherche sur l’isolation et l’identification de produits naturels bioactifs issus de plantes nordiques du Québec.
Afin de réaliser cet ambitieux projet, à l’été 2014, nous avons établi une collaboration à long terme avec les laboratoires de Jean-Luc Wolfender (phytochemistry and bioactive natural products) et de Muriel Cuendet qui sont spécialisés respectivement en phytochimie et pharmacognosie. À l’automne 2014, j’ai ainsi eu la chance d’effectuer un stage international dans le laboratoire de Phytochimie et de Pharmacognosie de l’Université de Genève pour acquérir une formation complète au sujet de l’extraction, l’isolation, la purification et l’élucidation de la structure de produits naturels. Lors de ce séjour, j’ai pu bénéficier de l’encadrement de chercheurs aux expertises complémentaires en phytochimie, pharmacognosie et ethnobotanique pour amorcer mes travaux de recherche. En plus, j’ai pu utiliser des appareils et des technologies de pointe telles que la RMN microflow Probe, des HPLC couplés avec des détecteurs UV et ESLD, des UPLC couplés à des spectromètres de masse (IT-MS, Q-MS, TOF-MS) et des tests in vitro indicatifs de l'inhibition des étapes majeures de la carcinogenèse (initiation, promotion et progression).
Suite à ce séjour d’apprentissage, l’objectif était d’utiliser mes connaissances nouvellement acquises pour mettre en place une plateforme d’isolation de produits naturels en développant des méthodes efficaces d’extraction, d’isolation, de purification et de caractérisation pour l’identification de produits naturels.
Finalement, nous voulions en réalisant ce projet donner une valeur ajoutée au Grand Nord québécois, en démontrant que la flore nordique du Québec produit des substances naturelles inédites. Pour ce faire, parallèlement, à l’été 2014, nous avons fait appel au Centre d’études nordiques (CEN), qui dispose de plusieurs stations de recherche de Whapmagoostui-Kuujjuarapik jusqu’à l'île Ward Hunt, pour l’identification et la récolte de végétaux très peu étudiés du Grand Nord québécois. Deux lichens appartenant à la famille
21
des Cladoniaceae, soit Cladonia Mitis et Cladonia Stellaris, et le lichen Stereocaulon
paschale ont été récoltés dans la région d’Umiujaq par les botanistes Esther Lévesque et
Stéphane Boudreau.
Afin d’apprendre les rudiments de l’isolation de substances naturelles et mettre en place la plateforme d’isolation dans notre laboratoire à Québec, les lichens C. stellaris, C.
mitis et S. paschale ont été investigués phytochimiquement. Les objectifs spécifiques de ces
investigations étaient en premier lieu d’isoler et identifier de nouveaux produits naturels (PNs) bioactifs issus des lichens nordiques du Québec qui vivent des stress uniques au monde. En deuxième lieu, l’analyse des métabolites présents dans ces lichens pourra permettre de mieux comprendre l’adaptation moléculaire des lichens aux conditions extrêmes du Grand Nord du Québec. Finalement, les produits naturels ayant des propriétés inédites et des dérivés seront synthétisés pour effectuer des études mécanistiques détaillées. Les résultats obtenus durant ces travaux sont présentés dans le mémoire.
22
Chapitre 2 : Études des métabolites lichéniques 1. Historique de la phytochimie des lichens 2,3,8,15,32,33
L’étude chimique des lichens, qui regroupe l’isolation, la purification de produits naturels et l’identification suite à l’élucidation de la structure et la détermination de configuration absolue, ne date pas d’hier. En 1831, Bebert a été le premier chimiste organicien à isoler un composé lichénique, l’acide vulpinique. Peu de temps après, en 1832, l’acide picrolichénique a été trouvé par Alms, puis Knop a isolé en 1844 l’acide usnique qui est l’un des métabolites lichéniques les plus connus et les plus étudiés. Le premier compte rendu sur les substances lichéniques a été publié en 1858 par Gmelin. C’est la multitude de molécules organiques appartenant à diverses classes de composés, tels les dérivés d’acides aminés, les sucres, les acides gras, les terpènes, les stéroïdes, les caroténoïdes, les composés monoaromatiques, les depsides, les depsidones, les depsones, les dibenzofuranes, les quinones, les chromones, les xanthones et les macrocycles, qui a attirée les chimistes organiciens à étudier la chimie des lichens. Les travaux de Wilhelm Zopf, dans lesquels plus de 150 substances lichéniques sont classifiées selon leur propriété chimiques, ont marqué le début de cette nouvelle ère de recherche en 1907. Au début du 20e siècle, le test
colorimétrique de Nylander (1866) était la principale méthode utilisée pour l’identification de métabolites. Cette technique permettait d’identifier la présence des métabolites et le type de composé par des réactions colorées (ou réaction thallines) en appliquant des réactifs tels l’hydroxyde de potassium et l’hypochlorite de calcium sur le thalle du lichen. Plus précisément, le composé majoritaire pouvait être déterminé selon l’apparition de la couleur suite à l’ajout d’un réactif et les règles préétablies par Nylander.
L’étude de la chimie des composés lichéniques a battu son plein durant la deuxième moitié du 20e siècle. Les Japonais Asahina at Shibata furent les premiers à élucider la structure
d’un grand nombre de composés, en plus de décrire leur synthèse et de développer la technique de microcristallisation (1941) qui permit l’identification rapide des composés majoritaires de centaines d’espèces par l’analyse des cristaux des composés à l’aide d’un microscope. En 1954, ils publièrent ainsi leur célèbre livre, Chemistry of Lichen
Substances. L’augmentation fulgurante du nombre de métabolites isolés et de l’élucidation
23
1996, le review de Huneck et Yoshimura rapportait la structure de plus de 850 composés. L’augmentation drastique du nombre de métabolites identifiés peut être attribuée au développement de nouvelles techniques d’isolation, d’identification et de détermination de structure (figure 9). Plus précisément, à partir des années 1960, le développement des techniques de chromatographie sur papier et sur couche mince (1966-1972) et la chromatographie liquide à haute performance (1976-1993) a permis de séparer et ainsi d’identifier de nombreux composés. Dans les débuts, l’identification était principalement basée sur le facteur de rétention et la couleur des composés qui étaient révélés à l’aide de réactifs chimiques par la technique de CCM. C’est principalement le développement de techniques analytiques modernes telle la spectroscopie UV-visible et infrarouge (IR), la spectroscopie de résonance magnétique nucléaire (RMN), la spectrométrie de masse, le dichroïsme circulaire et l’analyse par rayons X, qui ont mené à l’augmentation impressionnante du nombre de composés isolés en facilitant l’élucidation de la structure des métabolites. À ce jour, la structure de plus de 1050 métabolites lichéniques aurait été rapportée.
24
2. Méthodologie
Dans le but d’étudier les produits naturels des lichens nordiques du Québec, nous avons développé une méthodologie de recherche qui englobe les quatre grands domaines de recherche en produits naturels : l’ethnobotanique, la pharmacognosie, la phytochimie et la synthèse totale. Les organismes à l’étude sont d’abord choisis selon les connaissances ancestrales des peuples qui les utilisaient. Puis, les substances naturelles issues de l’organisme sont isolées, purifiées et caractérisées. Les propriétés biologiques des produits naturels purs peuvent ensuite être étudiées. Finalement, la synthèse totale des nouvelles molécules ou celles ayant des propriétés inédites est effectuée afin d’avoir des quantités suffisantes des produits naturels pour poursuivre la caractérisation chimique et biologique des composés et pour faire des dérivés synthétiques.
Notre approche pour l’isolation et l’identification de produits naturels bioactifs est présentée à la figure 10. Cette méthodologie, qui est principalement basée sur la chromatographie d’adsorption, a été développée par le groupe de Jean-Luc Wolfender. Nous avons choisi cette méthode étant donné qu’elle est simple, efficace, logique, reproductible, universelle et elle permet l’isolement bioguidé des composés bioactifs.34,35,36,37 Le principal avantage de cette technique est que tout au long du processus
d’isolation, il est possible de localiser les composés qui ont identifiés lors du profilage initial des métabolites de l’extrait brut étant donné qu’un seul type de chromatographie (adsorption, C18) est utilisé pour tout le processus. Les différentes étapes de la méthodologie menant à l’isolation et l’identification de produits naturels bioactifs sont détaillées aux sous-sections du chapitre 2.
Il ne fait aucun doute que cette méthodologie a fait ses preuves, car les travaux du professeur Wolfender sont reconnus à travers le monde. Jusqu’à ce jour, son groupe de recherche a publié plus de 200 articles qui ont été cités près de 5000 fois.38 Jean-Luc
Wolfender est principalement reconnu pour ses travaux novateurs dans le domaine de la métabolomique des plantes. Il a plus précisément contribué au développement de méthodes pour l’identification de produits naturels (HPLC-MS et HPLC-RMN).39,40,41,42 Depuis 2012,
25
son groupe de recherche est sur une lancée avec plus d’une centaine d’articles, dont 30 pour l’année 2014.
Figure 10. Méthodologie pour l’isolation et l’identification de métabolites bioactifs
2.1 Choix des lichens à étudier
Le choix des lichens à investiguer est une étape très importante à ne pas négliger étant donné qu’elle est déterminante pour l’obtention de nouvelles substances ayant des propriétés inédites. En d’autres mots, même si les méthodes d’isolation, de purification et de caractérisation utilisées sont les plus efficaces et les plus performantes, aucun produit naturel nouveau ne va être isolé si l’organisme n’en contient pas. Dans le but de choisir des lichens qui sont susceptibles de contenir de nouvelles substances ayant des propriétés inédites, plusieurs paramètres sont à considérer. Pour orienter notre choix, deux approches sont possibles :
La première est une approche plus logique qui est basée sur des connaissances. En premier, il est primordial d’effectuer une revue de littérature sur la flore nordique du Québec. Ces recherches ont comme objectifs de connaître la biodiversité des lichens. Parallèlement, il est important de rencontrer les spécialistes qui vont s’occuper d’identifier et de récolter les organismes. Ces collaborateurs sont en mesure de proposer des choix de lichens qui sont
26
disponibles dans grand Nord. Par la suite, la prochaine étape est d’approfondir la revue de littérature en s’attardant sur les propriétés biologiques des lichens qui sont disponibles. Les connaissances ancestrales des peuples sur les lichens, par exemple, s’ils étaient ou sont encore utilisés en médecine traditionnelle pour soigner diverses maladies, sont aussi des informations très pertinentes qui permettront de choisir un lichen en particulier. Pour terminer, le lichen choisi devrait premièrement avoir une ou plusieurs activités biologiques (ex : anti-inflammatoire, antibactérienne, antivirale). Deuxièmement, il est préférable que le genre du lichen soit très peu étudié, que peu de molécules aient été isolées et qu’aucune molécule ayant les activités biologiques qu’on recherche n’ait été isolée dans d’autres lichens du même genre. Dans le même ordre d’idée, l’espèce à l’étude devrait n’avoir jamais été investiguée phytochimiquement pour avoir le plus de chance d’isoler de nouveaux produits naturels bioactifs. Finalement, la biodisponibilité du lichen choisi devrait être élevée pour préserver la biodiversité. Ce paramètre est aussi très important puisqu’une très faible proportion de la masse sèche du lichen contient des métabolites minoritaires qui sont souvent les plus intéressants. Il faut ainsi une grande quantité de matériel de départ pour les isoler en assez grande quantité pour les caractériser.
La deuxième approche est plus novatrice et a comme objectif de « sortir des sentiers battus ». Ici, le choix n’est plus basé sur des connaissances, mais les deux premières étapes sont toutefois les mêmes que pour l’approche logique soit : d’effectuer une revue de littérature sur la flore nordique et d’avoir une discussion avec les botanistes pour déterminer sur quels lichens sont disponible dans le Grand Nord. Par la suite, une revue de littérature est de nouveau effectuée, mais, cette fois-ci, spécifiquement sur les lichens qui ont été identifiés pour déterminer :
- quel genre a été très peu ou jamais investigué;
- quelle espèce du genre choisi n’a jamais été investiguée phytochimiquement; - quelle espèce n’est pas très répandue ailleurs dans le monde.
En respectant ces trois paramètres, les chances d’isoler et d’identifier de nouveaux métabolites sont plus élevées. De plus, si le lichen n’est pas répertorié ailleurs que dans le nord du Québec, il y a moins de chance qu’il ait déjà été investigué ou que d’autres groupes soient en train eux aussi de les étudier étant donné que la phytochimie est un domaine de
27
recherche très peu étudié en Amérique du Nord. Même si la deuxième approche n’est pas basée sur les connaissances ancestrales, elle vise tout de même à isoler de nouvelles substances bioactives issues des lichens nordiques en isolant tous les métabolites et en étudiant leurs propriétés biologiques. L’idée de cette approche est que les lichens du Grand Nord québécois sont une source immense de métabolites inédits étant donné que le métabolisme des lichens est fortement influencé par les stress environnementaux.
2.2 Échantillonnage
Pour l’échantillonnage des spécimens lichéniques, il est suggéré de faire appel à des spécialistes en lichénologie ou en botanique vu que l’identification des espèces d’un même genre peut être très complexe. Une petite quantité du lichen est préalablement collectée pour effectuer des observations macroscopiques et microscopiques, qui sont souvent nécessaires pour identifier correctement une espèce.3
Une fois que le spécimen est identifié, il faut d’abord s’assurer que la collecte est autorisée dans ce site et que l’espèce ne sera pas en danger suite à la collecte. Il est suggéré de prendre des photos du site d’échantillonnage pour connaître les stress environnementaux auxquels l’espèce est soumise. Il est aussi très important de noter la date et le géopositionnement du site. Certains types de lichens tels les crustacés peuvent être difficile à séparer de leur substrat rocheux, il est alors nécessaire d’utiliser un marteau et un ciseau à froid. Pour les autres types de lichens, un couteau coupant devrait permettre de récupérer facilement le spécimen. Finalement, il est préférable de stocker séparément les organismes et de les faire sécher à l’air libre et à température ambiante.
2.3 Extraction des lichens 15,43,44
L’étape d’extraction est primordiale étant donné qu’elle a une grande influence sur la quantité d’extrait brut, mais aussi sur le nombre et la variété de produits naturels qui se trouvent dans l’extrait brut. Cette première étape de l’isolement peut aussi permettre une première séparation des composés selon la technique et les conditions utilisées. Une variété de technique existe et chacune d’elle possède des avantages. Le choix d’une technique est basé sur le type de biomasse et des produits naturels que l’on recherche.
28
2.3.1 Broyage
Lors de l’extraction de produits non volatils, il est primordial de broyer les spécimens avant de les extraire. Cette étape supplémentaire affecte grandement le pourcentage d’extraction étant donné qu’elle permet de briser les cellules végétales ce qui rend plus accessible les molécules à extraire. Divers équipements peuvent être utilisés pour le broyage tels les mortiers, les malaxeurs, les moulins, les broyeurs. Lors du broyage, il faut toutefois éviter de former une poudre trop fine comme elle engendre des difficultés lors des étapes de filtration. Les lichens sont des organismes assez friables, il est donc plus approprié d’utiliser un mortier et un pilon pour éviter d’obtenir une poudre. Lors de ce processus, il peut y avoir des risques de dégradation thermique due au chauffage créé lors du broyage. Il est ainsi plus sécuritaire d’effectuer un cryobroyage, c’est-à-dire que de l’azote liquide est ajouté à la matrice lors du broyage pour limiter la dégradation. De plus, cette méthode augmente généralement les pourcentages d’extraction comme l’azote liquide brise les cellules en les gelant. Le processus de broyage est aussi facilité par l’utilisation d’azote liquide, car les spécimens lichéniques sont plus friables lorsque gelés.
2.3.2 Extraction par macération
L’extraction par macération consiste à faire tremper la biomasse dans un solvant pendant 24 h ou plusieurs jours sous agitation mécanique et à température pièce. La biomasse est ensuite filtrée pour récupérer le solvant qui contient les produits naturels. Ce mélange est alors évaporé sous vide pour obtenir un extrait brut de produits naturels. Une petite variante est l’extraction par macération avec gradient de solvant ce qui permet d’effectuer une première séparation des composés à extraire selon leur polarité. Lors de cette variante, la matrice est d’abord agitée dans un solvant peu polaire, puis dans des solvants organiques de polarité intermédiaire et de polarité élevée pour finir par une macération dans l’eau. Habituellement, la biomasse cryobroyée est mise dans un erlenmeyer et de l’hexane est ajouté jusqu’à l’obtention d’une suspension. Elle va ainsi macérer sous agitation pendant 24 h, puis la biomasse est filtrée pour récupérer l’hexane qui contient les composés peu polaires (terpènes, lipides, pigments, etc.). Une nouvelle portion d’hexane est ensuite ajoutée à la biomasse pour macérer de nouveau pendant 24 h. Le processus de filtration pour récupérer le solvant et de macération avec de nouvelles portions de solvant est répété