iii
Résumé
Cette étude porte sur la caractérisation de la matière organique dans les eaux naturelles et traitées avec la technique de spectroscopie de fluorescence 3D. Au total, deux usines ont été étudiées entre 2009 et 2011:
• Usine du Secteur-centre de la ville de Québec
• Usine de traitement des eaux potables de Victoriaville
Les paramètres de qualité d’eau mesurés sont la turbidité à l’eau brute, l’absorptivité UV, le carbone organique dissous, le carbone organique dissous biodégradable et la fluorescence. Cette étude utilise la fluorescence afin de démontrer son potentiel pour suivre les variations de la nature de la MON dans une source d’eau de surface et en cours de traitement. Les données de fluorescence ont été analysées par deux méthodes: par pic (maximums locaux) et par déconvolution 3D en fluorophores unitaires (Parallel factor analysis – PARAFAC). La fluorescence s’avère un outil utile pour évaluer l’efficacité du traitement.
v
Abstract
This study focuses on the characterization with fluorescence spectroscopy of the organic matter in natural and treated waters. In this study, two Drinking Water Treament Plants (DWTP) were studied between 2009 and 2011:
• DWTP of Quebec City • DWTP of Victoriaville
The main parameters to monitor water quality are raw water turbidity, UV absorbance, dissolved organic carbon, biodegradable dissolved organic carbon and fluorescence. Fluorescence spectroscopy is a simple and rapid technique that requires very little sample preparation and that can help in monitoring the organic matter through treatment, specifically some fractions such as humic acids, fulvic acids and amino acids associated with proteins as tryptophan and tyrosine. Fluorescence could also be used to monitor continuously in DWTP and be a good indicator of the effectiveness of treatment.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des figures ... ix
Liste des tableaux ... xi
Liste des sigles et abréviations ... xiii
Remerciements ... xv
1. Introduction ... 1
2. Hypothèse et objectifs ... 5
3. Revue de littérature ... 7
3.1 Matière organique naturelle ... 7
3.2 Enlèvement de la MON dans les filières conventionnelles de traitement d’eau ... 8
3.2.1 Coagulation-floculation ... 8 3.2.2 Ozonation ... 10 3.2.3 Biofiltration ... 12 3.3 Spectroscopie UV ... 13 3.4 Spectroscopie de fluorescence ... 14 3.4.1 Théorie ... 14 3.4.2 Analyse spectral 3D ... 17
3.4.3 Déconvolution 3D en fluorophores unitaires - PARAFAC ... 18
3.5 Fluorescence et MON ... 19
3.5.1 Application de la méthode PARAFAC à l’analyse de la MON dans l’eau ... 26
4. Méthodologie ... 33
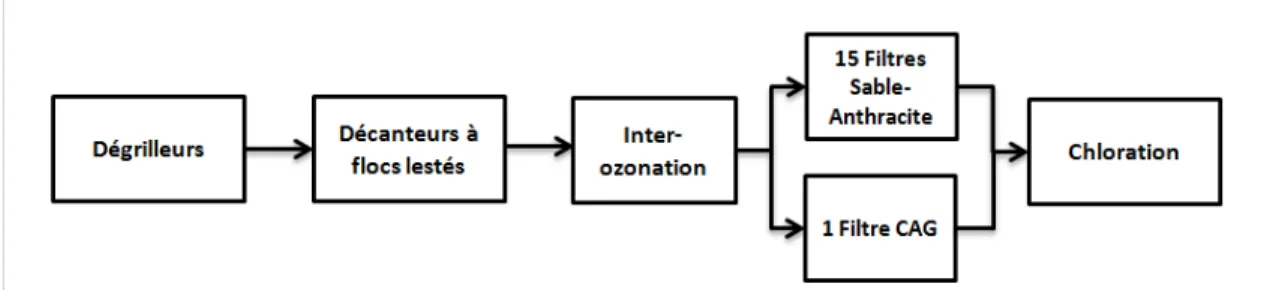
4.1 Description des filières des UTE ... 34
4.1.1 UTE du Secteur-centre de Québec ... 34
4.1.2 UTE de Victoriaville ... 35
4.2 Description des analyses physico-chimiques et microbiologiques ... 36
4.3 Campagne de suivi de la qualité de l’eau dans les UTE ... 38
4.4 Ozonation d’eau décantée en laboratoire ... 41
4.5 Fluorescence ... 41
4.5.1 Appareil et conditions d’analyse ... 41
4.5.2 Analyse des spectres 3D ... 42
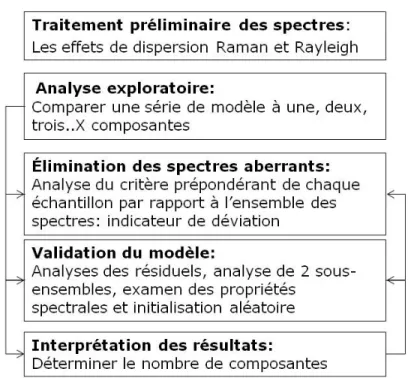
4.5.3 Traitement préliminaire des données ... 43
4.5.4 Méthode par pic ... 44
viii
5. Résultats et discussion ... 51
5.1 Suivis des paramètres conventionnels ... 51
5.1.1 Eau brute de l’UTE de Québec et de Victoriaville... 55
5.1.2 Eau traitée pour l’UTE de Québec et de Victoriaville ... 62
5.2 Fluorescence – Par pic ... 65
5.2.1 Coordonnées des pics ... 67
5.2.2 Intensité de fluorescence maximale des pics ... 70
5.2.3 Relation entre l’intensité maximale des pics et les autres paramètres conventionnels .. 76
5.3 Fluorescence - Modélisation PARAFAC ... 78
5.3.1 Base de données de fluorescence ... 78
5.3.2 Détermination du nombre de composantes ... 78
5.3.3 Analyse des modèles PARAFAC ... 83
5.3.4 La fluorescence et les autres paramètres ... 91
5.4 Discussion générale ... 92 6. Conclusion ... 95 Bibliographie ... 99 Annexe A ... 109 Annexe B ... 111 Annexe C ... 115 Annexe D ... 117 Annexe E ... 121 Annexe F ... 129 Annexe G ... 135 Annexe H ... 145
ix
Liste des figures
Figure 3-1: Classification de la matière organique adapté de Crittenden et al., 2005 ... 7
Figure 3-2: Mécanismes de coagulation de la MON (traduit de Matilainen et al.,2010) ... 9
Figure 3-3: CODB en fonction de la dose d’ozone appliquée, traduit de Carlson & Amy (2001) ... 11
Figure 3-4: Exemple de MEE obtenue en fluorescence (adapté de Peiris et al., 2010a) ... 15
Figure 3-5: Diffusion de la lumière ... 16
Figure 3-6: Le spectre excitation-émission d’une composante (Z = B·C) (Stedmon et Bro, 2008) ... 19
Figure 3-7: Résultats de COT, acides fulviques et tryptophane (traduit de Baker, 2002) ... 21
Figure 3-8: Corrélation entre l’intensité de fluorescence du pic A (à gauche) et du pic C (à droite), et le COT d’échantillons de rivières. Cumberland & Baker, 2007 ... 22
Figure 3-9: Corrélation entre l’intensité de fluorescence du pic A (à gauche) et du pic C (à droite), et le COT d’échantillons standards SISH. Cumberland & Baker (2007)... 22
Figure 3-10: Portrait de la fluorescence sur la rivière Bourn Brook, à Birmingham (Angleterre) traduit de Carstea et al. (2009 ... 24
Figure 3-11: Variation de l’intensité de fluorescence de chaque composante en fonction des caractéristiques environnementales des sites, traduit de Stedmon & Markager (2005) ... 28
Figure 3-12: Variation saisonnière de l’intensité de fluorescence maximale de huit composantes (Stedmon & Markager, 2005) ... 29
Figure 4-1: Filière de l’UTE du Secteur-centre de Québec avant réfection ... 34
Figure 4-2: Filière de l’UTE du Secteur-centre de Québec après réfection ... 35
Figure 4-3: Filière de l’UTE de Victoriaville ... 35
Figure 4-4: Zone plancher d’un spectre ... 44
Figure 4-5: Enlèvement des pics de dispersion de Rayleigh et de Raman avec Cleanscan (Zepp et al., 2004) ... 44
Figure 4-6: Sommaire des étapes de l’analyse PARAFAC adapté de Stedmon & Bro, 2008 ... 46
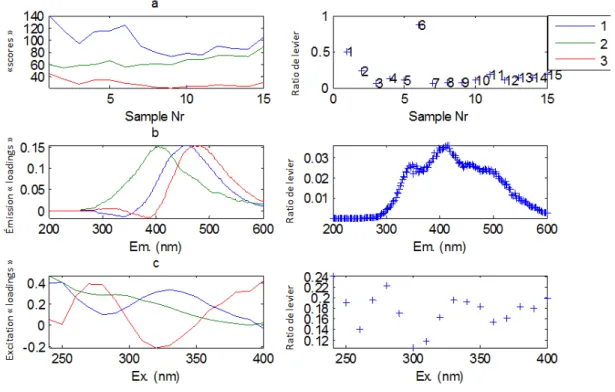
Figure 4-7: Exemple de ratio de levier – analyse PARAFAC adapté de Stedmon & Bro (2008) ... 47
Figure 4-8: Exemple de résidus d’un spectre de Stedmon & Bro (2008) ... 48
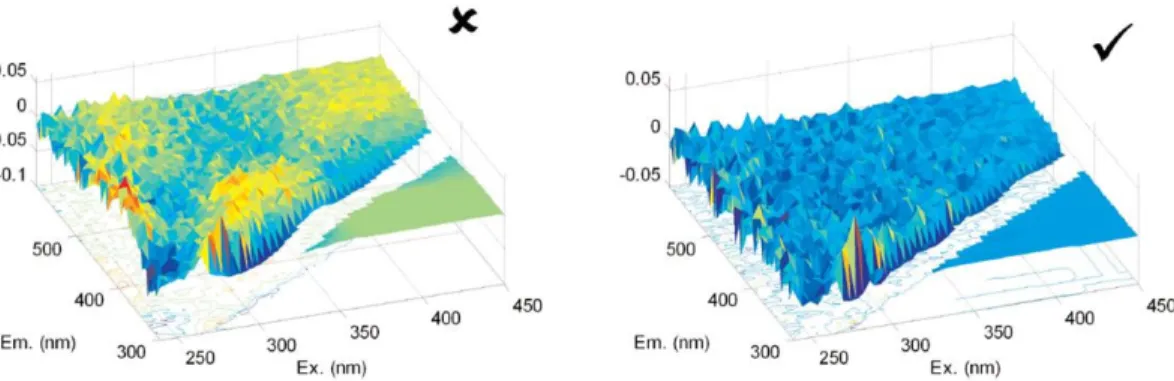
Figure 4-9: Exemple et contre-exemple de l’apparence de spectres de Stedmon & Bro (2008) ... 48
Figure 4-10: Exemple de l’initialisation aléatoire, traduit de Stedmon & Bro (2008) ... 49
Figure 5-1: Turbidité, pH et température de l’eau brute de l’UTE de Québec (2009-2010) et de l’UTE de Victoriaville (2010) ... 56
Figure 5-2: COD et SUVA de l’eau brute de l’UTE de Québec (2009-2010) et de l’UTE de Victoriaville (2010) ... 58
Figure 5-3: COD et CODB de l’eau brute de l’UTE de Québec (2009-2010) et de l’UTE de Victoriaville (2010) ... 60
Figure 5-4: Relation entre le COD et l’absorbance UV à 254 nm – Eau brute de l’UTE de Québec (2010-2011) ... 61
Figure 5-5: COD en cours de traitement pour UTE de Québec et de Victoriaville ... 63
Figure 5-6: SUVA en cours de traitement pour UTE de Québec et de Victoriaville ... 63
Figure 5-7: CODB en cours de traitement pour UTE de Québec ... 64
Figure 5-8: CODB en cours de traitement pour UTE de Victoriaville ... 65
Figure 5-9: Spectre de fluorescence typique de l’UTE de Québec (échantillons du 9 mai 2011) ... 66
Figure 5-10: Spectre 2D et 3D de l’échantillon d’eau brute du 21 mai 2010 ... 67
Figure 5-11: Coordonnées du pic A pour les échantillons de l’UTE de Québec et de Victoriaville .. 68
Figure 5-12: Coordonnées du pic C pour les échantillons de l’UTE de Québec et de Victoriaville .. 68
Figure 5-13: Coordonnées du pic T pour l’eau brute de l’UTE de Québec et de Victoriaville ... 69
Figure 5-14: Coordonnées des pics A et C pour l’UTE de Québec ... 70
Figure 5-15: Variation de la fluorescence de l’eau brute pour l’UTE de Québec et de Victoriaville . 72 Figure 5-16 : Variation du COD et de la fluorescence (Pic A) de l’eau brute de l’UTE de Québec et de Victoriaville pour la période de mai à juillet 2010 ... 74
x
Figure 5-18: Corrélation entre le COD et les pics A, C et T – Eau brute et traitée de l’UTE de Québec
... 77
Figure 5-19: Spectre 2D individuel d’eau brute ... 79
Figure 5-20: PARAFAC: Recherche des valeurs aberrantes ... 80
Figure 5-21: Somme des carrés des résidus pour les modèles de 2 à 7 composantes – Eau brute ... 81
Figure 5-22: Spectres 1D des émissions et excitations pour les modèles à 5 composantes (à gauche) et à 3 composantes (à droite) – Eau brute ... 81
Figure 5-23: Modèle à trois (C3) et à quatre composantes (C3 et C4) – Eau brute ... 82
Figure 5-24: Modèle à cinq composantes (C5) – Eau brute ... 83
Figure 5-25: Modèle à trois composantes pour l’eau brute de l’UTE de Québec ... 84
Figure 5-26: PARAFAC - Composante 1 pour les différents types d’eau de l’UTE de Québec ... 85
Figure 5-27: PARAFAC - Composante 2 pour les différents types d’eau de l’UTE de Québec ... 85
Figure 5-28: PARAFAC - Composante 3 pour les différents types d’eau de l’UTE de Québec ... 85
Figure 5-29: Fmax des composantes C1 des différents types d’eau– Analyse PARAFAC ... 87
Figure 5-30: Fmax des composantes C2 des différents types d’eau – Analyse PARAFAC ... 88
Figure 5-31: Fmax des composantes C3 des différents types d’eau– Analyse PARAFAC ... 88
Figure 5-32: Moyennes des Fmax pour toutes les composantes... 89
xi
Liste des tableaux
Tableau 3-1: Longueur d’onde excitation-émission des où se trouvent les principaux pics de
fluorescence (Hudson et al., 2007) ... 20
Tableau 3-2: Coordonnées des pics de la MON avec PARAFAC ... 30
Tableau 4-1: Analyses physico-chimiques et microbiologiques ... 37
Tableau 4-2: Campagne d’échantillonnage de 2010 et 2011. ... 40
Tableau 5-1: Caractéristiques de l'eau de l'UTE de Québec (2009-2010) ... 53
Tableau 5-2: Caractéristiques de l'eau de l'UTE de Québec (2011) ... 53
Tableau 5-3: Caractéristiques de l'eau de l'UTE de Victoriaville (2010) ... 54
Tableau 5-4: Coordonnées des pics de fluorescence ... 69
Tableau 5-5: Variation de l’intensité de fluorescence des pics A, C et T pour l’UTE de Québec et de Victoriaville – Eau brute ... 71
Tableau 5-6: Corrélation entre les différents paramètres de fluorescence et conventionnels pour l’UTE de Québec (eaux brutes et eaux traitées) ... 77
Tableau 5-7: Base de données pour la modélisation de fluorescence – UTE de Québec ... 78
Tableau 5-8: Caractéristiques des pics des spectres 2D des composantes 1, 2 et 3 pour les différents types d’eau ... 86
xiii
Liste des sigles et abréviations
Abs UV Absorbance ultraviolette à 254 nm
AF Acides fulviques
AH Acides humiques
CAG Charbon activé en grains
CI Carbone inorganique
COA Carbone organique assimilable
COD Carbone organique dissous
COD Carbone organique dissous biodégradable
COP Carbone organique particulaire
COT Carbone organique total
MEE Matrice excitation-émission
MO Matière organique
MOB Matière organique biodégradable
MOD Matière organique dissoute
MON Matière organique naturelle
PARAFAC «Parallel factor analysis» (déconvolution 3D en fluorophores unitaires)
UTE Usine de traitement de l’eau
UV Ultraviolet
SOM Décomposition des algorithmes (self-organizing map)
SBA Sable biologiquement actif
TE Température d’échantillonnage
xv
Remerciements
Je tiens tout d’abord à remercier M. Christian Bouchard, mon directeur de recherche et professeur au département de génie civil et de génie des eaux pour m’avoir soutenu tout au long de cette maîtrise et son aide dans la réalisation de ce projet. Merci également pour tout votre savoir transmis aux cours des dernières années et vos précieux conseils. Je remercie également Sabrina Simard (associée de recherche) et Michel Bisping (technicien de laboratoire) pour leur précieux soutien au laboratoire et dans le cadre de cette étude. J’aimerais aussi remercier Alexandre Déry pour ces résultats de fluorescence obtenus dans le cadre de la campagne 2011 à l’usine de traitement des eaux potables du Secteur-centre de Québec et pour sa grande contribution au développement de programme et son aide avec le logiciel Matlab. Je remercie Rodica Neagu Plesu pour son aide aux laboratoires de chimie.
Je remercie la ville de Québec pour sa collaboration et son aide de financement aux programmes de recherche de l’Université Laval. Merci aussi à la ville de Victoriaville pour sa collaboration à cette étude. Merci à la Chaire de recherche en eau potable de l’Université Laval pour leur collaboration financière. Merci aux trois organismes suivants pour m’avoir accordé une bourse d’étude :
• Association des ingénieurs municipaux du Québec (AIMQ) • Hydro-Québec
• Marthe et Robert Ménard
Finalement un gros merci à ma famille et à mon conjoint pour leur soutien et leurs encouragements.
1
1.
Introduction
Les enjeux et problèmes environnementaux occupent actuellement une place croissante dans les préoccupations des sociétés occidentales. L’environnement fait maintenant partie des enjeux économiques et politiques. Il est même capitalisé, il n’y a qu’à penser à la bourse du carbone, aux diverses taxations, au resserrement de la réglementation et aux besoins en matière d’énergie. L’eau fait partie de ces enjeux environnementaux, cette ressource considérée comme abondante et sans fin il y a quelques années, se fait maintenant de plus en plus rare et est actuellement convoitée comme l’or bleu de demain. Bien que l’eau recouvre 71% de la surface de la terre, seulement 2,5% est de l’eau douce et 0,001% serait accessible à l’homme (Taithe, 2006). Le Canada, bien nanti, possède 9% des ressources en eau renouvelables de la planète, alors qu’il compte moins de 1% de la population mondiale. Les Grands Lacs sont un bon exemple de cette richesse, ils représentent à eux seuls la plus grande superficie d'eau douce à l'échelle mondiale.
La règlementation et les normes en matière de traitement, de distribution et de rejets des eaux sont de plus en plus sévères. Au Québec, le Règlement sur la qualité de l’eau potable (RQEP) est entré en vigueur le 28 juin 2001 et a été modifié par la suite plusieurs fois, la dernière modification datant de 2014. Dans sa version actuelle, le RQEP comprend 80 normes liées à qualité de l’eau potable. Il inclut aussi entre autres :
• Des contrôles de qualité obligatoire (microbiologiques, contaminants organiques et inorganiques) pour plusieurs milliers d’installations de distribution (municipalités et autres) desservant plus de 20 personnes;
• Des exigences de traitement (traitements obligatoires, efficacités minimales d’élimination de pathogènes, etc.) et mise en place d’équipements de suivi;
• Des exigences pour la qualification des opérateurs;
• Des mesures de gestion des non-respects du règlement (avis d’ébullition, affichage eau non-potable, etc.);
• Une obligation de production d’un bilan annuel de qualité de l’eau.
L’entrée en vigueur du RQEP a entrainé depuis une dizaine d’années des changements importants dans bon nombre des usines de traitement d’eau (UTE) au Québec, incluant celles des grandes villes.
Le risque d’infection est encore un des principaux risques que l’on cherche à minimiser. Pour ce faire des agents désinfectants comme le chlore ou l’ozone sont utilisés couramment dans les UTE au Québec. Des systèmes de désinfection aux ultraviolets sont eux aussi utilisés en
2
complément des désinfectants chimiques en particulier quand l’eau brute est fortement contaminée du point de vue microbiologique. Rappelons que l’ozone est non seulement un désinfectant mais qu’il permet aussi de diminuer les goûts et odeurs, et d’oxyder des contaminants comme les toxines algales. L’utilisation de chlore ou d’ozone peut cependant avoir certaines répercussions négatives sur la santé quand il est mal utilisé. En effet, lorsque le chlore réagit avec la matière organique naturelle (MON) contenue dans l’eau, il y a formation de sous-produits de désinfection (SPD). En trop grande concentration, ces sous-sous-produits peuvent avoir un effet néfaste sur la santé, certains étant possiblement ou probablement cancérigènes. L’enlèvement de la MON, précurseur des SPD, constitue donc un des objectifs de traitement (Cipparone et al., 1997).
En plus de former des SPD, la MON qui se retrouve dans le réseau de distribution favorise la reviviscence microbienne puisqu’elle est une source de carbone organique. En fait, c’est la fraction dite biodégradable de la MON qui est une source de nutriments pour les bactéries. La formation de biofilms dans les réseaux peut être à l’origine de goût et odeurs ou favoriser la corrosion des conduites (LeChevalier et al., 1993). La distribution de l’eau influence aussi la qualité de l’eau distribuée au citoyen.
Lorsqu’une filière de traitement inclut une étape d’ozonation, la MON est dégradée par l’ozone et sa biodégradabilité est augmentée. Autrement dit, la fraction de carbone organique dissous biodégradable (CODB) augmente. Afin d’enlever une partie de ce CODB, l’inter-ozonation est généralement suivi d’une biofiltration ou filtration biologique. Voici comment le Guide de
conception des installations de production d’eau potable émis par le Ministère du Développement
Durable, de la Faune et des Parcs (MDDEFP) définit la filtration biologique:
« La filtration biologique comprend deux étapes de traitement, soit l’ozonation et la filtration sur un lit de charbon actif en grains. Cette chaîne de traitement, habituellement appliquée sur une eau de surface, doit suivre une filière de traitement conventionnelle ou s’y intégrer (ozone à l’eau décantée et remplacement de l’anthracite des filtres bi-couches par du charbon actif). Ce procédé profite de l’ozonation qui favorise le fractionnement de la matière organique et augmente la partie biodégradable de la matière organique dissoute. »
La matière organique est donc un enjeu en traitement des eaux potables. La présence de MON dans l’eau varie d’une source d’eau à une autre et varie selon les saisons pour une source d’eau donnée, et ce, tant en quantité qu’en qualité. Sa caractérisation et sa quantification sont donc un enjeu important pour bien contrôler le traitement de l’eau.
Les informations sur la nature de la MON fournies par les analyses classiques telles que la couleur, l’absorbance dans le domaine ultraviolet (UV) ou le carbone organique dissous (COD) sont limitées. Les analyses détaillées (chromatographie, fractionnements sur résine échangeuse
3 d’ions ou sur membrane, etc.) sont longues ou complexes, et coûteuses. La spectroscopie par fluorescence 3D (balayage en émission et en excitation) permet aussi d’analyser la MON. Cette méthode requiert un faible volume d’échantillon et demande très peu de préparation de l’échantillon ce qui la rend très intéressante du point de vue pratique. De plus il s’agit d’une technique sensible et rapide. La fluorescence 3D donne de l’information essentiellement sur la nature de la matière organique. Le potentiel de la spectroscopie par fluorescence 3D pour caractériser la MON dans l’eau et sa biodégradabilité est exploré dans ce projet dans le contexte du Québec (Peris et al., 2010a; Stedmon & Bro, 2008).
5
2.
Hypothèse et objectifs
Dans le cadre de ce projet, des hypothèses ont été posées entourant la MON dans les eaux de surface, l’influence des saisons et son évolution en cours de traitement. Ensuite, des objectifs expérimentaux ont été établis afin de valider ces hypothèses. Les hypothèses avancées dans ce projet sont les suivantes:
• Les eaux de surface sont différentiables et caractérisables par spectroscopie de fluorescence 3D;
• La spectroscopie de fluorescence 3D permet de suivre l’évolution de la nature de la MON tout au long d’une filière de traitement d’eau;
• La spectroscopie de fluorescence 3D permet de distinguer des sources d’eau et de suivre les variations saisonnières de la MON.
Le principal objectif de la présente étude est de montrer le potentiel de la spectroscopie de fluorescence 3D pour suivre les variations de la nature de la MON dans une source d’eau de surface et en cours de traitement, et ce, dans le contexte du Québec. L‘objectif secondaire est de mettre en relation la mesure de la fluorescence 3D avec les analyses conventionnelles de la MON comme le COD ou la mesure UV à 254 nm.
Cette étude expérimentale a été principalement réalisée par des suivis sur les eaux brutes, décantées, ozonées et filtrées de l’usine de traitement d’eau potable de la ville de Québec. Des échantillonnages ont également été faits à l’usine d’eau potable de la ville de Victoriaville. Ceci a permis la caractérisation de la MON selon la source, les saisons et l’effet du traitement sur la MON. L’étude permet de dresser des portraits de la nature de la MON à divers stades de traitement dans les deux usines étudiées. Dans une moindre mesure, ceci permet également de vérifier expérimentalement jusqu’à quel point la fluorescence peut permettre de suivre la biodégradabilité de la MON dans une filière de traitement.
7
3.
Revue de littérature
Cette section rappelle ce qu’est la MON et son devenir dans les chaines de traitement conventionnelles. Les principes des méthodes spectroscopiques d’analyse de la matière organique, qui est présente dans les eaux douces naturelles, sont aussi présentés en mettant l’accent sur la spectroscopie de fluorescence qui fait l’objet de la présente étude. Finalement, les applications de cette dernière méthode d’analyse au domaine de l’eau potable (source et traitement) sont présentées.
3.1
Matière organique naturelle
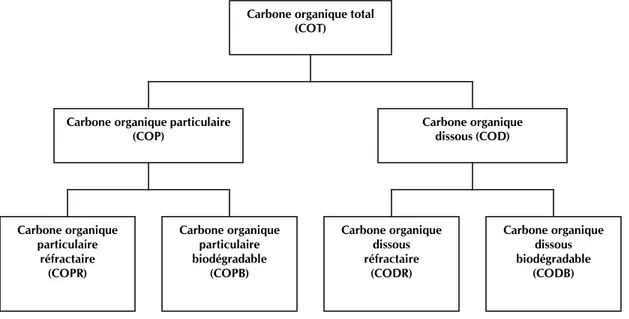
Les principaux éléments de la MON sont le carbone, l’oxygène, l’azote, le soufre et l’hydrogène. Le carbone est l’élément dominant en termes de masse puisqu’il représente 40 à 50% de la masse de la MON. C’est pourquoi la MON peut être quantifiée indirectement par l’analyse du carbone organique total (COT) (Servais et al., 2005). Étant donné que la MON peut être dissoute ou particulaire, deux analyses de COT peuvent être faites : le carbone organique particulaire (COP) et le carbone organique dissous (COD). Le COD est le COT qui est inclus dans la MON qui passe à travers un filtre ayant une porosité de 0,2 µm à 1,2 µm, la porosité de 0,45 µm étant la plus courante (Servais et al., 2005). De plus, on peut aussi mesurer les fractions biodégradables et réfractaires à la biodégradation du COD et du COP. Une classification générale du COT est illustrée à la Figure 3-1.
Figure 3-1: Classification de la matière organique adapté de Crittenden et al., 2005
Carbone organique total (COT)
Carbone organique particulaire (COP) Carbone organique dissous (COD) Carbone organique dissous réfractaire (CODR) Carbone organique dissous biodégradable (CODB) Carbone organique particulaire réfractaire (COPR) Carbone organique particulaire biodégradable (COPB)
8
En ce qui concerne le CODB, on peut le fractionner en deux sous-catégories : rapidement et lentement biodégradable. Le COD rapidement biodégradable est celui qui est disponible comme source de carbone et d’énergie pour les microorganismes dans un environnement aérobie et qui peut être rapidement et complètement métabolisé (Servais et al., 2005). Il est utilisé par la biomasse acclimatée d’un biofiltre par exemple. Quant au COD lentement biodégradable, il se retrouve plutôt dans le réseau de distribution parce peu dégradé à l’UTE. Le terme carbone organique assimilable (COA) est aussi utilisé en traitement des eaux pour désigner la fraction du carbone organique disponible pour les microorganismes. Les méthodes de COA évaluent la biodégradation par rapport à la croissance des microorganismes alors que les méthodes basées sur le CODB mesurent la minéralisation du carbone sous des conditions spécifiques. Le COA mesure la biomasse formée suite à la biodégradation du carbone assimilable (Huck, 1990). Le CODB et le COA sont différents, le CODB représentant la fraction du COD qui peut être minéralisée par les microorganismes hétérotrophes, alors que le COA est une portion du COD qui peut être convertie en en biomasse et exprimé en concentration de carbone (Huck, 1990). Théoriquement, la densité de microorganismes pouvant croître est proportionnelle à la concentration de COA contenue dans l’eau (van der Kooij et al., 1982). Le COA peut être mesuré par différentes méthodes dont les principales sont le compte de bactéries hétérotrophes (Standard Methods) et la concentration de l’ATP intracellulaire (Jago & Stanfield, 1984).
Plus globalement, la MON est principalement composée d'acides humiques, d’acides fulviques, d’acides hydrophiles, d’acides carboxyliques et d’acides aminés, de glucides, de polysaccharides. Les substances humiques sont des produits de la dégradation chimique et biologique des végétaux et organismes présents dans les écosystèmes. Les substances humiques (acides humiques et acides fulviques) constituent environ 50% (w/w) de la MON et peuvent même représenter jusqu’à 50 à 90% (w/w) de la MON dans les eaux naturellement très colorées (Nishijima & Speitel, 2004). Les acides humiques sont plus aromatiques et de plus haut poids moléculaire que les acides fulviques, et l'ozone a tendance à réagir plus facilement avec les acides humiques. Les acides fulviques sont légèrement plus biodégradables que les acides humiques. Les matières organiques biodégradables sont plus hydrophiles que celles non-biodégradables.
3.2
Enlèvement de la MON dans les filières conventionnelles de traitement
d’eau
3.2.1
Coagulation-floculation
La coagulation-floculation, combinée avec la décantation, est un procédé physico-chimique qui permet d’enlever des particules en suspension, incluant des microorganismes pathogènes et des particules organiques, et qui permet aussi d’enlever la MON. La coagulation correspond à une
9 déstabilisation des particules en suspension, ou des colloïdes, pour les rendre aptes à s’agglomérer lors de la floculation où on favorise les contacts entre particules déstabilisées. La déstabilisation des particules fait référence à l’utilisation d’un coagulant pour réduire les charges négatives à la surface des colloïdes pour former un précipité. Ces agglomérats de particules, appelés flocs, sont par la suite séparés de l’eau par sédimentation dans un décanteur. Il existe différents mécanismes de coagulation et ceux-ci sont différents pour les particules et pour la MON. Dans tous les cas, la coagulation est réalisée par ajout d’un coagulant dans l’eau qui est généralement un sel d’aluminium ou un sel de fer. Après ajout d’un coagulant métallique, l’aluminium ou le fer s’hydrolyse et forme différents espèces solubles (métal hydrolysé de plus ou moins grande masse molaire) ou solide (hydroxyde métallique) qui vont interagir avec les particules ou la MON pour les faire coaguler puis floculer. Les différents mécanismes de coagulation de la MON sont schématisés à la Figure 3-2. Ces mécanismes sont la neutralisation de charge ou la complexation avec des espèces hydrolysées solubles, ou l’adsorption ou l’emprisonnement avec des particules d’hydroxydes métalliques (Matilainen et al., 2010),
Figure 3-2: Mécanismes de coagulation de la MON (traduit de Matilainen et al.,2010) L’efficacité de la coagulation est fortement liée au type de coagulant, à la dose de coagulant, au pH et à la température de coagulation. Les conditions optimales de coagulation pour la réduction de la turbidité ne sont en général pas les mêmes que celles pour l’enlèvement de la MOD (Crittenden et al., 2005) ce qui complique le choix des conditions de coagulation quand on veut
10
enlever en même temps les particules et la MOD. La coagulation à un pH bas et avec une dose de coagulant relativement forte favorise l’enlèvement de la MOD. Quand une eau est turbide et colorée, c’est généralement la MOD qui détermine les conditions de coagulation en raison de la stœchiométrie qui existe entre la MOD et la dose de coagulant (Crittenden et al., 2005).
L’efficacité de la coagulation de la MOD dépend aussi beaucoup de la nature de la MOD. La fraction hydrophile de la MOD est constituée de carbone aliphatiques et de composés azotés, les protéines étant un bon exemple. La fraction hydrophobique de la MON est faite d’acides humiques et fulviques (Swietlik et al, 2004a). La fraction hydrophobe de la MON, qui contient plus de charges négatives à sa surface (groupements fonctionnels ionisés) et dont la masse molaire est plus élevée, est enlevée beaucoup plus efficacement par la coagulation que la fraction hydrophile (Sharpe et al. 2006). Une autre façon d’exprimer cela est que plus l’absorbance UV spécifique (voir définition dans la section 3.3) est élevée et plus l’enlèvement de la MOD est élevée.
L’enlèvement du COT par la coagulation varie entre 15 et 45 % dans les études faites par USEPA (1998). Une réduction du COD par coagulation jusqu’à 50% est rapporté par Wang et al. (2002) lors d’essais en laboratoire. Des valeurs allant jusqu’à 76% par coagulation-floculation-décantation d’enlèvement du COD sont rapportées par Volk et al. (2000).
3.2.2
Ozonation
L’ozone est un gaz instable qui est produit par décharge électrique (décharge corona) dans un mélange gazeux sec contenant de l’oxygène ou dans de l’oxygène pur. C’est un électron qui permet de séparer une molécule de O2 en deux molécules de O qui à leur tour s’associeront avec une molécule de O2 pour former une molécule d’ozone (O3). L’ozone est partiellement soluble dans l’eau. Il peut agir par voie directe, c’est-à-dire sous forme moléculaire O3. Dans ce cas l’oxydation est sélective et seulement certains composés organiques ou inorganiques sont oxydés. L’oxydation peut aussi se faire par voie indirecte, sous la forme d’hydroxyle radicalaire (OH•). Cette oxydation n’est pas sélective, les composés organiques ou inorganiques sont oxydés (Crittenden et al., 2005). C’est la forme radicalaire de l’ozone qui permet d’oxyder des composés comme les pesticides, la géosmine ou encore le perchloroéthylène. La formation d’hydroxyles radicalaires se fait par des mécanismes complexes dont la réaction globale est :
3O3 + OH- + H+ → 4O2 + 2OH• (1)
L’ozonation a également un effet sur la biodégradabilité de la MO et sur la production de sous-produits de la désinfection (SPD). Lorsque l’ozone réagit avec la MO par voie directe (O3) ou par
11 voie indirecte (OH•) cela a pour conséquence de convertir une fraction du COD réfractaire en COD biodégradable (Servais et al., 2005). Toutefois la diversité, la complexité et la variabilité des structures moléculaires de la MO dans les eaux naturelles limitent la compréhension des mécanismes d’oxydation. La structure de la MO ne varie pas seulement d’une eau à l’autre mais aussi dans le temps pour une même source. En ce qui concerne les substances humiques, qu’elles soient d’origine terrestre, aquatique ou commerciale, l’ozone augmente significativement leur biodégradabilité (Servais et al., 2005). Les études portant sur l’impact de la dose d’ozone sur le CODB ont démontré une augmentation significative de la biodégradabilité du COD. Le CO hydrophobe est converti en CO hydrophile sans diminution significative de COD. Ces composés biodégradables peuvent ensuite être enlevés par biofiltration. En effet, les produits de l’ozonation sont des composés de faible poids moléculaire qui sont plus facilement transportés à travers les membranes cellulaires et qui sont métabolisés plus facilement par les bactéries présentes dans un biofiltre. Globalement, l’ozonation fractionne la MON, augmente sa polarité et donc sa biodégradabilité Carlson & Amy, 2001 ; Volk et al., 1993 ; Espinoza & Frimmel, 2009; Medeiros et al., 2008; Yavich et al., 2004; Wang et al., 2006; Bijan & Mohseni, 2005; Uyguner & Bekbölet, 2005).
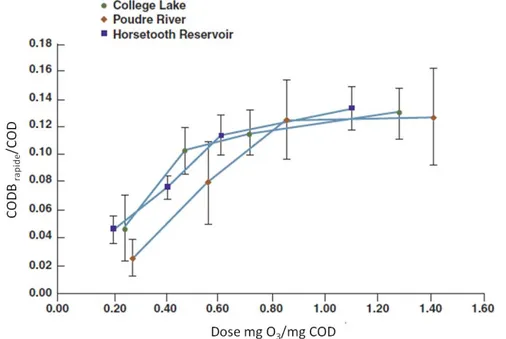
D’après les résultats de l’étude de Carlson & Amy (2001), l’accroissement de la concentration de
CODB se produit principalement pour des doses d’ozone égales ou inférieures à 0,5 mgO3/mg
COD. Toujours d’après la même étude, une dose supérieure à 1,0 mgO3/mg COD n’induirait pas
d’augmentation significative du COD (voir Figure 3-3).
12
Les sous-produits de l'ozonation du COD comprennent typiquement des aldéhydes aliphatiques, des acides organiques de faible poids moléculaire, les peroxydes d'hydrogène, et les peroxydes organiques et sont des composés biodégradables. D'une part, l'augmentation de sous-produits hydrophiles, dont la quantité augmente avec la dose d'ozone, réduit le degré d'adsorption physique, mais d'autre part, il accroît l’enlèvement par la biofiltration (Kozyatnik et al., 2010). La littérature n'est pas unanime quant à l'influence du pH sur la formation du CODB. Certains auteurs indiquent que le pH d’ozonation n'a pas d'effet significatif sur la formation CODB (Siddiqui et al., 1997) alors que d’auteurs ont constaté qu’à pH plus élevé, des quantités moindres d’aldéhydes sont produites (Schechter and Singer, 1995). Les aldéhydes constituent une importante fraction du CODB après ozonation (Paode et al., 1997).
3.2.3
Biofiltration
Dans le domaine de l’eau potable, la biofiltration est un procédé de filtration sur lit granulaire où a lieu une activité biologique qui permet d’enlever des composés indésirables comme l’ammoniaque, la MON ou des composés organiques toxiques biodégradables. Les microorganismes qui dégradent certains contaminants sont fixés à un matériau granulaire, dont le plus utilisé est le charbon actif en grains (CAG). Certains biofiltres sont aussi faits de sable et d’anthracite. Suite à l’ozonation, l’eau passe à travers le biofiltre par gravité. Le biofiltre est avant tout un filtre qui permet la rétention des particules comme le font les filtres conventionnels. À la mise en service d’un biofiltre, il y a d’abord adsorption de la MOD sur le CAG. Ensuite, quand la capacité d’adsorption est pratiquement épuisée, une biomasse se développe et les microorganismes utilisent alors la MOB et d’autres composés comme nutriments. Les microorganismes colonisant le média filtrant sont surtout des bactéries aérobies étant donné que le filtre est aéré. Des organismes supérieurs peuvent s’y développer (petits vers par exemple). Il peut aussi y avoir nitrification (transformation de l’ammoniaque en nitrates). L’enlèvement du COD dans un filtre biologique est variable et dépendant de la température de l’eau et du temps de contact du filtre. Les taux d’enlèvement du COD observés pour des filtres CAG dans des usines vont jusqu’à 30% (Merlet et al., 1992; Najm et al., 2005; Wang et al., 1995). Une étude de Wang et al. (1995) a démontré que les biofiltres utilisant le CAG comme média filtrant contenaient 3 à 8 fois plus de biomasse qu’un filtre à sable ou anthracite. La biofiltration permet non seulement une diminution de la MO mais permet aussi indirectement une réduction des SPD puisque la dose de chlore utilisé pour la post-désinfection est réduite, ce qui réduit la formation de THM ou des acides haloacétiques (AHA) (Déry, 2012). En réduisant la MON dans la filière de traitement, avant la post-chloration, les SPD diminuent également dans l’eau distribuée aux consommateurs.
13
3.3
Spectroscopie UV
Dans le domaine de l’eau, la spectroscopie ultraviolet est une technique de spectroscopie qui permet de mesurer la lumière absorbée par des composés en solution dans l’eau, et ce, dans le domaine de l'ultraviolet qui se situe dans la gamme de longueur d’onde entre 200 à 400 nm. Quand les molécules en solution dans l’eau sont soumises à un rayonnement dans cette gamme de longueurs d'onde, elles subissent une ou des transitions électroniques. Le spectre électronique est fonction de l'intensité lumineuse absorbée par l'échantillon analysé en fonction d’une longueur d'onde donnée, appelé absorbance UV.
L’absorbance UV spécifique (SUVA, «specific UV absorbance») est définie comme étant l’absorptivité à 254 nm, exprimée en m-1, divisée par la concentration en COD en mg/L :
[
]
[
]
[
]
1254
/
100
/
/
UVà
nm cm
SUVA L mg m
cm m
COD mg L
−
⋅
=
×
(2)L’absorbance UV à 254 nm est représentative de l’existence des liens insaturés du carbone, incluant les composés aromatiques, lesquels sont généralement récalcitrant à la biodégradation. Pour une même quantité de COD, Une diminution de l’absorbance UV à 254nm résulte donc habituellement en une augmentation de la biodégradabilité de la MON.
Le SUVA est un indicateur de la fraction aromatique de la MO qui contient des chromophores (groupement d'atomes comportant une ou plusieurs doubles liaisons carbone). Généralement, les composés organiques avec des valeurs élevées de SUVA ont une faible biodégradabilité, en raison de la présence accrue de groupements aromatiques et d'autres configurations insaturés. La règle générale veut que la MOD d’une eau ayant un SUVA inférieur à 2 L/(mg·m) soit composée principalement de substances non-humiques (et d’une hydrophobicité plus faible), alors que pour un SUVA supérieur à 4 L/(mg m), la MOD est constituée majoritairement de substances humiques avec des masses molaires élevées (Nkambule et al., 2011; Kiwa, 2006). Un SUVA qui se situe entre 2 et 4 L/(mg m) indique une MOD constituée d’un mélange de substances humiques aquatiques et d’autres composés organiques naturels.
Le SUVA permet de mesurer quantitativement les liens insaturés et/ou l’aromaticité de la MON. Globalement, une augmentation du SUVA reflète une plus grande humification, aromaticité et hydrophobicité de la MOD, ce qui induit une biodégradabilité plus faible. Comme mentionné plutôt, l’ozone induit des changements structuraux de la MON, et par conséquent pour les acides humiques, ce qui provoque une diminution de la couleur de l’eau et une diminution de l’absorbance UV à 254 nm due à une perte de l’aromaticité et dépolymérization (Camel et Bermond, 1998).
14
3.4
Spectroscopie de fluorescence
Les molécules organiques de la MOD contiennent des composés chromophoriques qui absorbent la lumière et des composés fluorophoriques qui émettent de la lumière. Il est donc possible d’obtenir de l’information sur la MOD à l’aide de la spectroscopie de fluorescence, et ce, en exploitant l’information contenue dans une matrice en 3D émission-excitation-intensité appelée communément MEE. La spectroscopie de fluorescence est une technique simple et rapide qui ne requiert par une préparation des échantillons susceptible de modifier la MO. Dans ce qui suit, la théorie entourant la fluorométrie sera brièvement abordée dans un premier temps. Puis, un résumé de la littérature englobant la caractérisation de la MON par la fluorescence sera fait. Les pics des MEE qui sont rapportés dans la littérature pour caractériser différentes composantes de la MON seront ensuite résumés et finalement un bref survol du matériel et de la méthodologie utilisée pour le traitement MEE sera fait.
3.4.1
Théorie
La spectroscopie de fluorescence est une technique analytique électromagnétique qui mesure la fluorescence d’un échantillon. Les termes fluorométrie et spectrofluorométrie sont aussi employés. La fluorescence se situe dans le domaine de l’UV (200 à 400 nm) et du visible (400 à 750 nm). La fluorescence se produit suite à l’absorption d’un photon par une molécule, celle-ci est alors excitée passant de son état fondamental à un niveau vibrationnel. Elle acquiert alors une énergie et il y a changement du nombre quantique de vibration. La molécule retourne ensuite à son état fondamental en émettant à son tour un photon lors de ce processus: il y a fluorescence. Généralement, ceci se produit à une longueur d’onde supérieure à celle absorbée précédemment.
Il y a deux types de fréquences caractéristiques en fluorométrie: celle de l’émission et celle de l’excitation. Le spectre d’émission est constitué des différentes longueurs d’onde émises par la molécule ayant absorbé un photon. Ces fréquences sont mesurées suite à une excitation qui peut se faire à une longueur d’onde particulière ou sur une gamme de longueur d’onde (spectre d’excitation). En excitant les composés organiques sur une gamme de longueur d’onde et en mesurant leurs émissions fluorescentes sur une autre gamme de longueur d’onde, un spectre ou une MEE est obtenue, ce qui permet de détecter en une seule fois l’ensemble des fluorophores contenus dans l’eau. L’unité de mesure de la troisième dimension des MEE est en intensité de fluorescence. La Figure 3-4 représente un graphique typique obtenue en fluorescence pour une eau naturelle. Le temps d’analyse est beaucoup plus grand que pour une analyse spectroscopique simple (ex. mesure de l’UV à 254 nm) puisqu’il faut balayer plusieurs longueurs
15 d’onde aussi bien en excitation qu’en émission. L’augmentation de la vitesse de balayage permet de réduire ce temps d’analyse mais cela se fait au prix d’une perte de sensibilité.
Figure 3-4: Exemple de MEE obtenue en fluorescence (adapté de Peiris et al., 2010a)
Un spectre 3D se présente comme une surface avec des sommets (voir l’exemple de la Figure 3-4). En ce qui concerne son interprétation, plusieurs facteurs doivent être pris en compte. Généralement, les intensités des pics de fluorescence sont proportionnelles à la concentration des fluorophores dans le cas de concentrations faibles. La diffusion de Rayleigh et la diffusion Raman peuvent gêner fortement la lecture des spectres (voir l’exemple de la Figure 3-4). La diffusion Raman est définie comme étant la diffusion inélastique d’un photon par un milieu donné. Il y a échange d’énergie entre le photon incident et la molécule. La lumière diffusée subit un changement de longueur d’onde. Lorsqu’il n’y a pas d’énergie échangée entre le photon et la molécule, la diffusion est élastique et on parle de diffusion de Rayleigh. La diffusion de Rayleigh cause une variation de l'indice de réfraction, ce qui a pour effet de diffuser la lumière visible. L’intensité des raies de Raman sont inférieures à celles de Rayleigh. La diffusion de Rayleigh se fait à la même longueur d’onde que celle de la lumière incidente alors que la diffusion de Raman vient modifier la longueur d’onde de la lumière diffusée. La Figure 3-5 illustre ces phénomènes.
16
Figure 3-5: Diffusion de la lumière
Sur la Figure 3-4 les trois pics de fluorescence sont identifiés δ, β et α. Le pic α correspond aux acides fulviques alors que les pics δ et β sont liés aux acides humiques. Quant aux deux régions encerclées, « First/Second order Raleigh scattering », elles sont dues à la lumière diffuse de Rayleigh et seraient reliées à la matière colloïdale/particulaire présente dans l’eau. L’intensité de ces régions parasites augmenterait avec l’accroissement de la fraction de particules/ colloïdes contenus dans l’eau (Wyatt, 1993; Stramski & Wozniak, 2005; Peiris et al., 2010a). Les détails de la caractérisation et de l’interprétation concernant la MON dans l’eau sera discutée dans la section suivante.
Il est également important de noter qu’à des concentrations élevées des fluorophores, l’intensité ne sera pas forcément proportionnelle à celle-ci, ce phénomène étant appelé « inner filtering effect ». Ceci est en fait dû à une distorsion ou une diminution du rendement quantique d’émission. Il y a alors absorption de la radiation émise ou excitée de la molécule. Une façon simple de remédier à ce problème est de diluer les échantillons trop concentrés. Il est possible de vérifier à partir de l’absorbance si un échantillon doit être dilué, i.e. que pour une longueur d’onde de 300nm avec une cuvette de 10cm, une absorbance inférieure à 0,02 assure l’absence d’interférence due au « inner filtering effect » (Green and Blough, 1994).
17
3.4.2
Analyse spectral 3D
L’analyse la plus simple des spectres 3D de fluorescence consiste à identifier les composés organiques par les maximums locaux, c’est-à-dire par les pics de fluorescence dont il a été question dans la section précédente. Cela peut être fait de façon manuelle (chaque pic est repéré par un analyste) ou automatiquement à l’aide d’un programme. Récemment, des techniques d'analyse de données multi-variées ont été développées pour étudier les spectres de fluorescence de manière plus approfondie:
• analyse des composantes principales (Marhaba et al., 2000);
• analyse partielle des moindres carrés (Marhaba et al., 2003; Hall et al., 2005);
• analyse par déconvolution 3D des fluorophores unitaires (PARAFAC) (Stedmon & Bro, 2008);
• régression linéaire multiple, résolution des courbes multi-variés (Saurina et al., 2000); • réseaux de neurones artificiels (SOM) (Bieroza et al., 2010).
Par rapport à l’identification et à la mesure des pics, ces méthodes peuvent améliorer la vitesse d'analyse des spectres et fournir plus d‘informations quantitatives sur la fluorescence. À noter que ces méthodes exigent la préparation des données, incluant l'élimination des diffusions de Raman et de Rayleigh (voir section 4.5.3).
Bieroza et al. (2010) ont comparé plusieurs méthodes d’analyses multi-variées et les réseaux de neurones artificiels (RNA) pour l’extraction des données et/ou l’analyse des MEE dans le domaine de l’eau potable (eaux brutes et eaux traitées). L’analyse par déconvolution 3D en fluorophores unitaires (PARAFAC) a été incluse dans leur étude. En ce qui concerne l’analyse par réseaux de neurones artificiels, la méthode utilisée a été celle par décomposition des algorithmes (self-organizing map – SOM). Cette méthode est un modèle mathématique ayant une structure spécifique qui est constitué d’éléments individuels (neurones) et interconnectés de façon parallèle et définies par une fonction algébrique non linéaire. Un neurone dit actif multiplie chaque vecteur d'entrée par son poids et la somme du produit passe par une fonction de transfert pour produire un extrant. Ce réseau non supervisé s’auto-organise de façon à rechercher les structures présentent dans un ensemble de données (SOM ou aussi connu sous le nom de Kohonen). Cette approche permet la conversion de relations statistiques non-linéaires des données en des relations plus simples, qui fournit une image plus facilement interprétable avec les caractéristiques essentielles (Demeusy, 2007).
Bieroza et al. (2010) concluent que les deux approches, PARAFAC et SOM, sont des outils performants pour décomposer les données de fluorescence. Le modèle PARAFAC nécessite une
18
analyse qui demande l’intervention de l’analyste dans le choix des composantes obtenues, alors que SOM ne requiert aucune supervision, les données étant sélectionnées automatiquement. Le fait que l’analyse se fasse automatiquement rend la démarche plus neutre mais l’utilisateur n’a que le résultat et l’analyse devient une boite noire. Avec SOM, l’analyse est purement mathématique alors que la méthode PARAFAC permet d’intervenir durant la modélisation. Ceci permet d’éviter d’avoir un modèle qui est mathématiquement viable mais dépourvu de sens physique. Comme la méthode PARAFAC a été utilisée dans le cadre de la présente étude, elle est présentée plus en détails dans la section suivante.
3.4.3
Déconvolution 3D en fluorophores unitaires - PARAFAC
La méthode PARAFAC permet de décomposer un spectre de fluorescence d’un mélange de substances en composantes individuelles et distinctes, ce qui permet de caractériser et de quantifier diverses fractions de la MOD dans les eaux de surface ou dans les eaux traitées. En supposant qu’une eau contienne x fluorophores/composantes, qui n’interagissent pas les uns avec les autres et que chaque fluorophore/composante se comporte conformément à la loi Beer-Lamberts, alors le spectre global du mélange est la somme des spectres de chaque composante. La méthode PARAFAC est appliquée à un ensemble de spectres qui correspondent à un ensemble d’échantillons d’eau. Pour un ensemble d’échantillons, on suppose, dans la méthode PARAFAC, que la forme du spectre de chaque fluorophore/composant ne change pas d’un échantillon à un autre, mais que seule son intensité peut changer. Les altérations au spectre de fluorescence dues par exemple à la température de l’eau sont ainsi négligées (Stedmon et Bro, 2008). La méthode PARAFAC s’avère utile pour caractériser la MON, en autant qu’une validation du modèle obtenu est faite de façon rigoureuse et transparente. La Figure 3-6 présente la déconvolution du spectre 3D (Z) d’une composante faite par PARAFAC. Le résultat de cette modélisation se traduit par l’obtention de trois paramètres Fmax, B et C qui sont respectivement
l’intensité maximale de fluorescence, le spectre 2D d’émission et le spectre 2D d’excitation de chaque composante (fluorophores).
Figure 3-6: Le spectre excitation
La fluorescence d’une composante ne peut pas se traduire directement en une concentration. Le fait que l’intensité d’une composante X soit plus grande que celle d’une composante Y ne signifie pas que X est en plus grande concentration que Y. Cela signifie
est plus importante. La fluorescence d’une substance dépend de son
rendement quantique du changement d’état. Toutefois, les changements dans les spectres et le ratio entre les composantes peuvent re
3.5
Fluorescence et MON
Les avancées dans le domaine de la fluorescence permet facilement caractériser la MON
caractérisation de la MON dans les eaux de mer, les eaux de surface et les sols. fractions de la MOD ont démontré une intensité de pic proportionnel
longueurs d’ondes spécifiques. Hudson et al., 2007; Baker, 2002; MON par spectroscopie de fluorescence d’identifier des composantes comme
humiques, les acides nucléiques et les composés phénoliques.
de MON dite fluorescente ont été trouvés dans les eaux naturelles (Coble, 1996): • De type humique à une longueur d’onde
• De type acide aminé à une longueur d’onde Coble (1996) a fait une première étude qui port mer et qui répertorie quatre principale
acides humiques et fulviques, le pic B qui
: Le spectre excitation-émission d’une composante (Z = B·C) (Stedmon et Bro, 2008)
La fluorescence d’une composante ne peut pas se traduire directement en une concentration. Le fait que l’intensité d’une composante X soit plus grande que celle d’une composante Y ne signifie pas que X est en plus grande concentration que Y. Cela signifie seulement que sa fluorescence est plus importante. La fluorescence d’une substance dépend de son absorptivité molaire et
du changement d’état. Toutefois, les changements dans les spectres et le ratio entre les composantes peuvent refléter des différences entre les échantillons.
et MON
dans le domaine de la fluorescence permettent maintenant de mieux et plus facilement caractériser la MON. Ainsi, la spectroscopie de fluorescence a été utilis
dans les eaux de mer, les eaux de surface et les sols.
ont démontré une intensité de pic proportionnelle à la concentration pour des Plusieurs études (Baker et al., 2008; Cumberland &
Baker, 2002; Kalbitz et al., 2000; Coble, 1996) sur la caractérisation de la fluorescence, qui ont été réalisées jusqu’à maintenant,
composantes comme les carbohydrates, les lipides, les protéines, les
humiques, les acides nucléiques et les composés phénoliques. Toutefois, deux principaux types dite fluorescente ont été trouvés dans les eaux naturelles (Coble, 1996):
De type humique à une longueur d’onde en émission de 420 à 450 nm ; De type acide aminé à une longueur d’onde en émission de 310 à 350 nm.
a fait une première étude qui porte sur les eaux douces de rivière et
quatre principales régions en fluorescence : pic A et C où se retrouve , le pic B qui est associé aux protéines, plus précisément à l’acide
19 C) (Stedmon et Bro, 2008)
La fluorescence d’une composante ne peut pas se traduire directement en une concentration. Le fait que l’intensité d’une composante X soit plus grande que celle d’une composante Y ne signifie seulement que sa fluorescence absorptivité molaire et du du changement d’état. Toutefois, les changements dans les spectres et le
fléter des différences entre les échantillons.
de mieux et plus utilisée pour la dans les eaux de mer, les eaux de surface et les sols. Certaines à la concentration pour des Cumberland & Baker, 2007; sur la caractérisation de la qui ont été réalisées jusqu’à maintenant, ont permis carbohydrates, les lipides, les protéines, les substances Toutefois, deux principaux types
de rivière et les eaux de se retrouve les plus précisément à l’acide
20
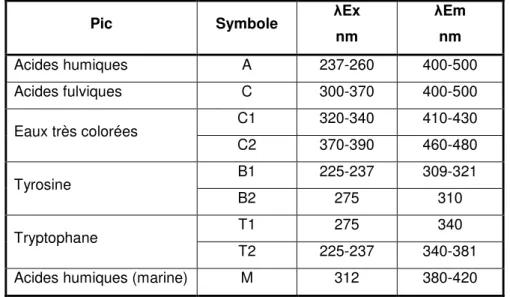
aminé tyrosine, et le pic T au tryptophane. La tyrosine et le tryptophane sont deux des 22 acides aminés qui participent à la synthèse des protéines. Hudson et al. (2007) ont fait une revue de la caractérisation de la MO par la fluorescence dans les eaux naturelles, usées et polluées. Le Tableau 3-1 présente les différentes régions de fluorescence, en termes de gammes de longueurs d’onde d’excitation et d’émission, où se trouvent les principaux pics.
Tableau 3-1: Longueur d’onde excitation-émission des où se trouvent les principaux pics de fluorescence (Hudson et al., 2007)
Pic Symbole λEx
nm λEm nm Acides humiques A 237-260 400-500 Acides fulviques C 300-370 400-500 Eaux très colorées C1 320-340 410-430 C2 370-390 460-480 Tyrosine B1 225-237 309-321 B2 275 310 Tryptophane T1 275 340 T2 225-237 340-381
Acides humiques (marine) M 312 380-420
Baker (2002) a étudié la possibilité d’établir une discrimination de la MO en combinant les techniques de spectrophotométrie de fluorescence et d'absorption UV, et ce pour un bassin versant d’une rivière ayant des affluents s’écoulant dans des zones urbaines et agricoles. Plus spécifiquement, l’étude a permis de caractériser, à l’aide de la spectroscopie de fluorescence, la MON dans l’eau du bassin versant d’Ouseburn en Angleterre où des échantillons ont été prélevés entre juin 2000 et novembre 2001. La concentration de COT dans l’eau des sites échantillonnés est très variable, le COT variant entre 5 à 20 mg/L. Il n’est pas étonnant d’obtenir une tel variabilité du COT puisque l’environnement des sites était diversifié; certains sites étaient en milieu urbain alors que d’autres étaient en milieu agricole, deux des sites étaient près d’un aéroport. Les fluorophores suivants ont été identifiés : les acides humiques (Ex = 377 à 381 nm, Em = 465 à 470 nm), les acides fulviques (Ex = 324 à 333 nm, Em = 416 à 429 nm) et le tryptophane (coordonnées non répertoriées dans l’article). La fluorescence a permis de caractériser les sites de façon distincte et en fonction de leur environnement. La Figure 3-7 présente les résultats obtenus. À noter que les sites 6 et 8 sont situés près de l’aéroport international de Newcastle.
21 Figure 3-7: Résultats de COT, acides fulviques et tryptophane (traduit de Baker, 2002) Dans le cadre de cette étude, l’étude statistique sur l’ensemble des échantillons révèle une relation significative (r2=0,68) entre le COT et les acides fulviques (pic C) contrairement au pic T et au COT pour lesquels la corrélation est mauvaise (r2=0,20).
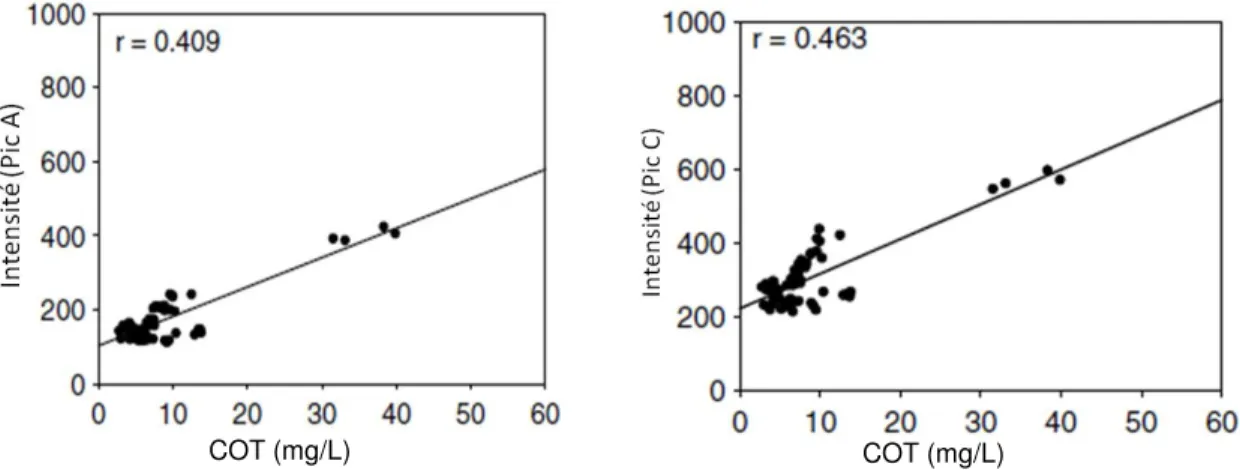
Les corrélations entre la concentration de COT et la fluorescence du pic A et C ont été étudiées par Cumberland & Baker (2007) sur des sources d’eau naturelle mais également avec des échantillons standards de substances humiques de la Société International des Substances
Humiques (SISH). Les corrélations entre le COT et les pics A et C des échantillons provenant
d’eau de rivière sont montrées à la Figure 3-8. On peut voir que la relation avec le COT est sensiblement la même pour le pic A ou le pic C. La Figure 3-9 présente les mêmes relations mais pour des échantillons standards de substances humiques.
22
COT (mg/L) COT (mg/L)
Figure 3-8: Corrélation entre l’intensité de fluorescence du pic A (à gauche) et du pic C (à droite), et le COT d’échantillons de rivières. Cumberland & Baker, 2007
COT (mg/L) COT (mg/L)
Légende :
NORDIC (Nordic fulvic acid) Acides fulviques nordique
SRFA (Suwanee River fulvic acid) Acides fulviques de la rivière Suwanee
SRHA (Suwanee River humic acid) Acides humiques de la rivière Suwanee
SRNOM (Suwanee River natural organic matter) MON de la rivière Suwanee
Figure 3-9: Corrélation entre l’intensité de fluorescence du pic A (à gauche) et du pic C (à droite), et le COT d’échantillons standards SISH. Cumberland & Baker (2007)
La corrélation entre la concentration de COD et les intensités des pics des acides humiques et fulviques est plus faible pour les eaux naturelles que pour les échantillons standards provenant du SISH. Une meilleure relation a été observée pour les eaux souterraines (pic A r2=0,631 et pic C r2=0,630) et les milieux humides (pic A r2=0,657 et pic C r2=0,609) (résultats non montrés).
23 La fluorescence 3D a été utilisée par Bieroza et al. (2009) pour caractériser des échantillons d’eau brute et décantée de 16 UTE alimentées par des eaux de surface en Angleterre. La concentration en COT de l’eau brute de ces usines variait de 2,7 à 7,0 mg/L en moyenne. Le pic C (reflétant le degré d'hydrophobicité) s’est avéré un bon indicateur de l’enlèvement du COT par le procédé de décantation (r2=0,90). Dans un autre article Bieroza et al. (2011) ont utilisé la spectroscopie de fluorescence pour caractériser les propriétés de la matière organique et son enlèvement par coagulation et décantation pour une gamme de pH donné afin d’optimiser le procédé de coagulation. En effet, pour des conditions optimales de coagulation une plus grande réduction de l’intensité de fluorescence entre l’eau brute et l’eau clarifiée a été observée. Ainsi, lorsque le pH de coagulation est passé de 7,5 (pH de coagulation de l’UTE) à 5,5 (pH optimisé), la réduction de l’intensité du pic C après coagulation et décantation est passée de 30% à 60%. Il a aussi été observé que la réduction du pic C avait une très forte corrélation (r2=0,91) avec l’enlèvement du COT.
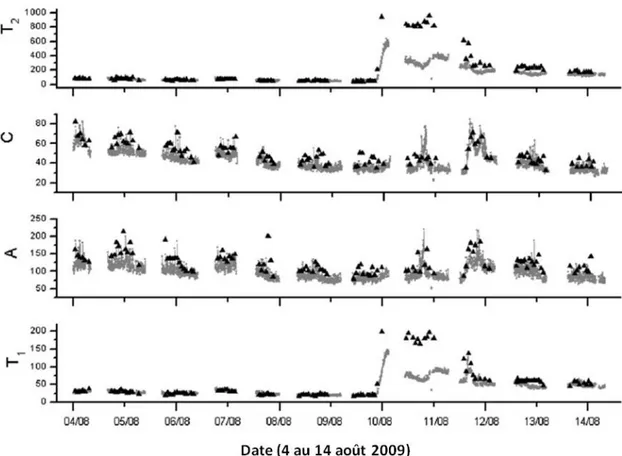
La fluorescence s’est avérée un outil intéressant pour suivre les variations de qualité de l’eau brute dues aux précipitations (Carstea et al., 2010). L’expérience a été faite sur la petite rivière Bourn Brook située en milieu urbain, à Birmingham en Angleterre. Par temps de pluie, cette rivière reçoit des débordements d’égouts. La fluorescence a été mesurée toutes les trois minutes du 4 au 14 août 2009. Au cours de cette période, il y a eu trois averses (breves averses le 4 et 7 août, fortes pluies le 12 août) et un évènement significatif de pollution au diesel (10 août). Sur la Figure 3-10, les pics T1 et T2, qui sont associées au tryptophane (un des 22 acides aminés qui constituent les protéines) puis les pic A et C aux matières humiques sont présentés. L’évènement de diesel a fait varier l’intensité et la position des pics T1 et T2. L’influence des pluies peut être observée à la Figure 3-10 à partir des pics A et C. Les intensités des pics A et C diminuent du 4 au 9 août mais une augmentation est observée le 12 août. Dans une étude précédente, Carstea et al. (2009) ont aussi rapporté une augmentation de la MON lors de précipitations, plus particulièrement une augmentation des pics associés aux composés humiques. Carstea et al. (2010) ont aussi observé une hausse des pics A et C le 1 août bien qu’il n’y ait eu aucune précipitation avant cela (résultats non montrés). Par contre cette hausse coïncide avec une inspection en amont de la rivière suite au déversement de diesel, ce qui a probablement agité les sédiments de la rivière et libéré des matières humiques.
24
Figure 3-10: Portrait de la fluorescence sur la rivière Bourn Brook, à Birmingham (Angleterre) traduit de Carstea et al. (2009
Dans leur étude précédente, faite sur la même rivière, Carstea et al. (2009) ont également observé une augmentation de l’intensité de fluorescence des acides humiques (pic A), des acides fulviques (pic C) et de la concentration de COT durant des épisodes de pluies et de neige à l’automne dans les eaux de la rivière de Bournbrook en Angleterre (du 6 au 20 novembre 2007). Une corrélation (r2=0,84) entre le pic C et la concentration de COT a été obtenus durant cette période. La relation entre l’absorbance UV à 254nm et la concentration de COT avait un r2 de 0,84.
L’étude de Muller et al. (2008) avait pour but d’étudier la nature de la MON dans les pluies, et ce, en fonction de la source, de sa géographie, du climat et de l’environnement. L’intensité et les coordonnées de chaque pic de fluorescence ont été examinées en fonction des variations des conditions météorologiques. L’étude a été faite au Royaume-Uni à Birmingham et les pluies ont été échantillonnées entre avril 2005 et mai 2007. Au total, trois types de fluorophores ont été identifiés: substances humiques, la tyrosine et le tryptophane. Les résultats montrent une hausse de l’intensité de fluorescence des acides humiques pour les pluies d’origine continentale, ce qui suggère une MON d’origine terrestre ou anthropique. Il en est de même lorsque les vents sont de
25 faible intensité. L’intensité de fluorescence de la tyrosine et le tryptophane n’a pu être reliée aux variations des conditions météorologiques.
Dans l’étude de McKnight et al. (2001), les acides fulviques ont été plus particulièrement étudiés dans des eaux naturelles. Les principaux paramètres mesurés ont été le pH, le COD et la fluorescence. Un indice de fluorescence a été défini. Cet indice est le rapport des intensités de fluorescence à 450nmet à 500nm pour une même longueur d’excitation de 370 nm. Il s’agit d’un indicateur du degré d’aromaticité. Les indices déterminés à partir de 13 sources d’eau différentes révèlent une valeur avoisinant 1,9 pour les acides fulviques d’origine microbienne et de 1,4 pour des acides fulviques d’origine terrestre. Il est également rapporté que les acides fulviques d’origine microbiologique ont une émission à plus faible longueur d’onde (λ = 442 à 448 nm) que ceux d’origine terrestre (λ = 457 à 461 nm). Ceci s’explique par le fait que la fraction dérivée de la flore microbienne est moins aromatique que la fraction terrestre dérivée de végétaux et du sol (McKnight et al., 2001).
L’enlèvement de la MO lors du traitement est accompagné de changements structuraux et chimiques, cela peut avoir un effet sur les pics observés, soit une diminution de l’intensité du pic. La désinfection a aussi un effet sur la fluorescence. Suite à l’utilisation d’un oxydant, il a été observé que les pics de fluorescence ont des longueurs d’onde en émission plus faibles. (Swietlik and Sikorska, 2004b; Korshin et al., 1999). Bieroza et al. (2010) observe aussi une diminution de l’intensité du pic C ce qui signifie qu’il y a réduction du degré aromatique de la fraction résiduel de MO. La portion aromatique est majoritairement enlevée lors de la désinfection dans le traitement. En fait, la chloration change la structure de la MO, elle détruit les sites halogènes aromatiques et segmente les molécules humiques en de plus petites particules (Korshin et al.,1999). Pour l’ozonation, l’effet serait l’inverse; les pics de fluorescence se déplacent vers des longueurs d’onde en émission plus élevées. L’ozonation aurait pour effet de changer la structure des fluorophores en favorisant la présence de composés carbonyl-, hydroxyl- et alkoxyl- et de groupes aminés. De plus, l’ozonation augmente l’intensité des pics reliés aux protéines (B et T). L’ozonation fractionne la MON en de plus petites fractions chromophoriques ce qui augmente la fluorescence. Par contre l’oxydation avancée, qui favorise l’oxydation par les radicaux libres hydroxyles (OH•) plutôt que par l’ozone (O3), produit un changement de structure qui diminue la fluorescence (Henderson et al., 2009) probablement parce que l’oxydation est beaucoup plus poussée. La désinfection a donc un effet sur les coordonnées en émission des pics de fluorescence mais également sur l’intensité mesurée qui peut varier d’un désinfectant à un autre.