Réfractométrie des liquides in situ, locale et résolue
temporellement pour l'imagerie cellulaire en
microscopie holographique numérique
Mémoire
Bertrand De Dorlodot
Maîtrise en biophotonique - avec mémoire
Maître ès sciences (M. Sc.)
Réfractométrie des liquides in situ, locale et résolue
temporellement pour l’imagerie cellulaire en
microscopie holographique numérique
Mémoire de maitrise
Bertrand de Dorlodot
Sous la direction de :
Pierre Marquet, directeur de recherche
Paul De Koninck, codirecteur de recherche
Résumé
La microscopie de phase quantitative, en particulier la microscopie holographique numérique (MHN), est une approche d’imagerie cellulaire très prometteuse, notamment dans le domaine émergent des cellules souches pluripotentes induites humaines, en raison de sa complémentarité avec l’imagerie de fluorescence, sa grande sensibilité, son caractère non invasif et la richesse du signal quantitatif de phase mesuré. Ce signal quantitatif, très riche, est également compliqué à interpréter. Notamment, il dépend de l’indice de réfraction de la solution physiologique dans laquelle baignent les cellules étudiées. Pour être en mesure d’interpréter correctement le signal quantitatif de phase produit par les cellules, cet indice de réfraction extracellulaire (IRE) doit donc être précisément mesuré. Ce mémoire présente la conception, le développement et la caractérisation d’une méthode de réfractométrie de l’IRE directement dans la chambre d’imagerie, à partir du signal quantitatif de phase mesurée avec un MHN. La capacité du MHN à mesurer précisément un indice de réfraction est d’abord démontrée. Ensuite, son utilisation pour la réfractométrie des liquides dans une chambre d’imagerie est analysée, en remplaçant une des lamelles fermant cette chambre par une lamelle rainurée dont les rainures sont très bien caractérisées. Une précision moyenne de 0.0003 sur l’indice de réfraction est démontrée, ce qui correspond à la précision d’un réfractomètre des liquides commercial typique. Enfin, une preuve de concept faite en utilisant ces lamelles dans un contexte d’imagerie cellulaire sous le MHN. Les données obtenues sont discutées et caractérisées en détail, et la pertinence de ces lamelles dans ce contexte est démontrée.
Abstract
Quantitative phase microscopy, in particular digital holographic microscopy, is a promising imaging technique for the study of living cells, notably the emerging field of human induced pluripotent stem cells, because of its great sensitivity and resolution, its strict non-invasiveness and its complementarity with fluorescence imaging. This technique allows for the retrieval of the quantitative phase signal (QPS) produced by cells, which is very rich but also complicated to interpret. In particular, the QPS depends on the refractive index (RI) of the medium surrounding the cells in an imaging chamber; therefore, this RI needs to be well monitored in order to correctly and precisely analyse the QPS. In this master’s thesis, the design, development and characterization of a method to measure this extracellular RI directly inside the imaging chamber using the QPS measured by a DHM are described. First, the DHM capability to measure precisely and accurately a RI is demonstrated. Then, its use for liquid refractometry in an imaging chamber is analysed, using a grooved coverslip with well characterized grooves in place of one of the coverslip closing the imaging chamber. An average accuracy on RI measurement of 0.0003 is demonstrated, which is similar to the one of a typical commercial liquid refractometer. Finally, a proof of concept using these grooved coverslips in a biological experiment involving cell imaging under the DHM is completed. The results are thoroughly analysed and discussed, and the relevance of these grooved coverslip for liquid refractometry in a biological context is demonstrated.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des figures ... vii
Liste des sigles ... viii
Remerciements ... ix
Avant-propos ... x
Introduction ... 1
Le dépistage et les stratégies de prévention primaires des grandes maladies psychiatriques... 1
Les biomarqueurs cellulaires pour les grandes maladies psychiatriques ... 2
La reprogrammation cellulaire ... 4
L’holographie numérique comme technique d’imagerie cellulaire adaptée à l’étude des troubles psychiatriques ... 6
Interprétation du signal quantitatif de phase ... 8
Découplage indice de réfraction – épaisseur et morphologie tridimensionnelle ... 10
Mesure de l’indice de réfraction extracellulaire ... 11
Chapitre 1 : Comparative study of quantitative phase imaging techniques for refractometry of optical waveguides ... 13 1.1 Résumé ... 13 1.2 Abstract ... 13 1.3 Introduction ... 13 1.4 Experimental Methods ... 15 1.4.1 Samples ... 15 1.4.2 QPI methods ... 16 1.4.3 RNF (Refracted near-field) ... 18
1.4.4 SEM (Scanning electron microscopy) ... 18
1.4.5 Image processing for quantification ... 18
1.5 Results and discussion ... 20
1.6 Conclusion ... 26
Funding ... 26
Disclosure ... 27
Chapitre 2 : Timely and spatially resolved in situ liquid refractometry using quantitative-phase digital holographic microscopy ... 28
2.1 Résumé ... 28
2.2 Abstract ... 28
2.3 Introduction ... 29
2.4 Experimental methods ... 30
2.5 Results and discussion ... 33
2.6 Conclusion ... 38
Funding ... 39
Acknowledgments ... 39
Disclosure ... 39
Chapitre 3 : Applications en biologie cellulaire du réfractomètre des liquides in situ ... 40
3.1 Approche expérimentale et méthodes ... 40
3.1.1 Chambre d’imagerie, lamelle rainurée et microscope ... 40
3.1.2 Découplage épaisseur – indice de réfraction cellulaire ... 42
3.1.3 Déroulement de l’expérience et paramètres expérimentaux ... 43
3.1.4 Analyse des images de phase et du SQP ... 44
3.2 Résultats et discussion ... 45
3.2.1 Analyse des mesures d’indice de réfraction in situ ... 46
3.2.2 Comparaison entre l’évolution dans le temps du SQP de la cellule et de la mesure in situ de l’IRE47 3.2.3 Interprétation des valeurs obtenues d’épaisseur, de volume et d’indice de réfraction de la cellule 48 3.2.4 Incertitude sur les mesures des paramètres cellulaires pour l’ensemble des cellules analysées ... 50
3.2.5 Amélioration de la précision sur les mesures d’IRE ... 54
3.3 Conclusion ... 54
Conclusion ... 55
Liste des figures
Fig. 0.1. Obtention de neurones humains à partir de cellules souches pluripotentes induites. ... 5 Fig. 0.2. Schéma optique du MHN et reconstruction des images d’intensité et de phase à partir de
l’hologramme. ... 8 Fig. 0.3. Schéma d'une chambre d'imagerie utilisée en MHN. ... 9 Fig. 1.1. Quantitative phase images and profile analysis of a segment of a Corning SMF-28 optical fiber
obtained with TIE, QWLSI and DHM. ... 19 Fig. 1.2. SEM images of the end-face of a Corning SMF-28 optical fiber and the obtained 𝛥𝑛𝑟 with TIE,
QWLSI, DHM, PSI and RNF ... 22 Fig. 1.3. Quantitative phase images and profile analysis of a representative waveguide photo-induced in
Corning Eagle2000 glass obtained with TIE, QWLSI and DHM. ... 23 Fig. 1.4. Photo-induced refractive index for series of waveguides inscribed with increasing power and number
of passes.. ... 24 Fig. 2.1. Schematic representation of the grooved coverslip mounted in a closed chamber and typical
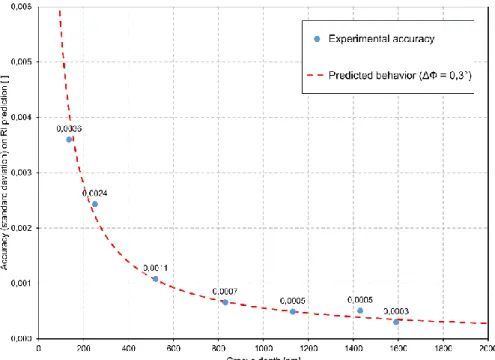
hologram, phase image, Dektak profile and phase profile of one of the grooves from the coverslip…31 Fig. 2.2. Absolute and absolute referenced refractometry results for various liquids. ... 34 Fig. 2.3. RI change during the dynamic refractometry experiment... 36 Fig. 2.4. Evolution of the experimental RI measurement accuracy with grooved coverslip of increasingly deep
grooves ... 38 Fig.3.1. Chambre d'imagerie utilisée et image de phase typique pour les expériences sur des cellules NIH/3T3 déposée sur des lamelles rainurées……….... 42 Fig.3.2. Images de phase quantitative d’une cellule et évolution de son QPS et de l’IRE lors d’une expérience
de découplage à deux liquide et de choc hypotonique. ... 45 Fig.3.3. Morphologie, épaisseur et indice de réfraction obtenus de la cellule sous différentes conditions
osmotiques. ... 48 Fig.3.4. Comparaison des mesures d'indice de réfraction et d'épaisseur de la cellule et de la variation de ces
Liste des sigles
CERC Canada Excellence Research Chairs CFI Canadian Foundation for Innovation COPL Centre d’optique, photonique et laser CSPI Cellules souches pluripotentes induites DHM Digital holographic microscope(y) GMP Grandes maladies psychiatriques
IRE Indice de réfraction (du milieu) extracellulaire
LRNP Laboratoire de recherche en neurophotonique et psychiatrie MCVD Modified chemical vapor deposition
MHN Microscop(i)e holographique numérique MQP Microscopie quantitative de phase
NSERC Natural Science and Engineering Research Council of Canada PSI Phase-shifting interferometry
QP-DHM Quantitative phase digital holographic microscopy QPI Quantitative phase imaging
QPS Quantitative phase signal
QWLSI Quadriwave lateral shearing interferometry RI Refractive index
RIE Reactive ion etching RNF Refracted near field
SEM Scanning electron microscopy SQP Signal quantitatif de phase TIE Transport of intensity equations
Remerciements
Un texte de cette ampleur ne se rédige évidemment pas seul, et la recherche qu’il présente est le fruit du travail d’une équipe dont je ne suis que le messager le temps d’un écrit. Premièrement, je dois remercier Erik Bélanger, le directeur scientifique du laboratoire du Dr Pierre Marquet qui, en plus de m’avoir assisté dans l’écriture de ce mémoire et des articles scientifiques qu’il contient, a été mon superviseur au quotidien pour toute la durée de ma maitrise. Sa rigueur, son esprit scientifique et son dévouement à la recherche m’ont impressionné tout au long de mon parcours et m’ont encouragé à développer mes propres aptitudes dans ces domaines, et dans bien d’autres. Pour l’écriture de mon mémoire, je dois aussi remercier Martin Roy, le coordonnateur clinique du laboratoire, ainsi qu’Ana Sofia Correia, notre spécialiste des cellules souches, dont les expertises respectives ont été bien utiles pour la rédaction des parties qui traitaient de ces sujets, avec lesquels j’étais moins à l’aise. Je tiens aussi à remercier Réal Vallée, son équipe et celle du COPL avec lesquels ça a été un plaisir de travailler et de discuter dans le cadre de mon mémoire, dans un contexte différent de celui auquel le LRNP nous habitue, ce qui est toujours rafraichissant. Dans le même ordre d’idée, Paul de Koninck, le premier à m’avoir initié aux mystères de la neurophotonique, mérite également sa part de remerciement, notamment pour avoir accepté de co-superviser mon travail de maitrise. Les discussions que j’ai pu avoir avec lui, sur la science, mais également sur tout le reste, m’ont été très précieuses.
Un merci très spécial également à mon directeur de maitrise, Pierre Marquet, qui m’a offert cette opportunité unique de découvrir dans son laboratoire un monde dont je ne soupçonnais pas l’existence, à l’interface de la microscopie, de la microbiologie et de la psychiatrie. Cette opportunité m’a permis de grandir en tant que scientifique, mais également en tant que personne, et je lui en suis grandement reconnaissant. Malgré son horaire extrêmement chargé, il m’a toujours accordé le temps nécessaire quand j’en avais besoin et son soutien a toujours été d’une grande aide.
Enfin, je ne peux pas passer sous silence le soutien de mes parents et amis, mais particulièrement de ma conjointe Rébecca Tardif, qui a toujours été à mes côtés. C’est elle qui, pendant ces deux années, m’a toujours insufflé le courage et la volonté de continuer à avancer, à expérimenter, à persévérer et, éventuellement, à écrire, même dans les moments les plus difficiles. Sa lucidité et son sens pratique exceptionnels m’ont été d’une grande aide dans mes moments d’incompréhension ou d’égarement, qui sont inévitables dans le cadre du travail de recherche et de la tranche de vie que constitue une maitrise.
Avant-propos
Ce mémoire est divisé en quatre chapitres, dont les deux chapitres centraux sont constitués d’articles scientifiques.
Le premier de ces deux articles a été soumis à la revue anglophone Optics Express le 13 mars 2018 et une version révisée a été acceptée pour publication le 18 avril de la même année. Finalement, l’article a été publié le 21 juin 2018 sous la référence :
E. Bélanger, J. Bérubé, B. de Dorlodot, P. Marquet, and R. Vallée, “Comparative study of quantitative phase imaging techniques for refractometry of optical waveguides,” Opt. Express. 26 (13), 17498–17510 (2018).
Pour conserver le ton et le langage des différents auteurs, le chapitre 2 de ce mémoire, constitué de l’article en question, est donc en anglais. Le contenu de ce chapitre 2 est rigoureusement identique à celui de l’article associé, seule la forme a été adaptée pour s’intégrer harmonieusement avec le reste de ce document. J’y partage le statut de premier auteur avec Erik Bélanger, le gestionnaire scientifique de mon laboratoire, et Jean-Philippe Bérubé, un professionnel de recherche de l’équipe du Pr. Réal Vallée avec laquelle ce travail de recherche a été réalisé en collaboration. Dans cet article, la théorie en arrière des guides d’onde optique, notamment dans l’introduction et la discussion, a été rédigée majoritairement par Réal Vallée et Jean-Philippe Bérubé, le reste a été rédigé en collaboration entre Erik Bélanger et moi, avec une supervision finale de la part de Pierre Marquet. La prise de données brutes de RNF, QWLSI, SEM et TIE a été faite par Jean-Philippe Bérubé. La prise d’images au MHN, le traitement de l’ensemble des données (y compris celles acquises par Jean-Philippe Bérubé), l’analyse et la présentation des données finales ainsi que la construction des figures ont été faits par moi.
Le second article, constituant le chapitre 3 de ce mémoire, a été écrit selon les standards de publication du journal Optics Letters. À ce jour, la décision finale quant à sa soumission à la revue en question n’a pas encore été prise. Si tel était le cas, nous serions trois auteurs, soit Erik Bélanger, Pierre Marquet et moi-même, et j’aurais le statut de premier auteur, peut-être partagé avec Erik Bélanger. Pour cet article, l’intégralité des manipulations a été effectuée par moi, sous la supervision de Erik Bélanger et de Pierre Marquet. La gravure des lamelles rainurées et leur caractérisation ont été faites avec l’aide précieuse de plusieurs techniciens du COPL, comme mentionné dans les remerciements (aknowledgments) de l’article en question. L’écriture a été faite en collaboration directe avec Erik Bélanger, avec une supervision finale de la part de Pierre Marquet.
Introduction
Le dépistage et les stratégies de prévention primaires des
grandes maladies psychiatriques
Bien que la biophotonique ait permis à l’aide de la lumière une meilleure compréhension du vivant en général, c’est certainement le domaine des neurosciences qui en a le plus bénéficié. En effet, les processus neurologiques sont généralement dynamiques et complexes, ce qui limite fortement leur étude sans outils non invasifs, précis et fiables, ce qu’offre la biophotonique. Cependant, bien que la biophotonique ait permis des avancées importantes dans notre compréhension de la physiologie du système nerveux, il y a eu peu de retombées dans le dépistage et la prévention des grandes maladies psychiatriques (GMP) avec une composante neurodeveloppementale, que sont notamment la schizophrénie, la maladie bipolaire, et la dépression majeure récurrente. Ces maladies touchent pourtant une part importante de la population (prévalence à vie d’environ 10% de la population) et constituent un enjeu de santé publique majeur pour les sociétés occidentales. La pathophysiologie obscure de ces maladies qui provient d’une interaction complexe entre des facteurs génétiques et environnementaux menant à des anomalies subtiles durant le développement du cerveau dans son ensemble, de la conception jusqu’à l’éclosion de ces maladies vers l’âge adulte, pose des défis techniques importants, même pour la biophotonique. De façon similaire, les GMP ont des présentations cliniques très hétérogènes qui traduiraient différents phénotypes d’une même susceptibilité générale, mais qui présentent des pathophysiologies différentes. Enfin, le dépistage et la prévention de ces maladies sont compliqués par leur composante neurodéveloppementale forte, qui fait en sorte que les altérations du système nerveux conduisant à l’apparition des GMP ont souvent lieu plusieurs années avant qu’un diagnostic sur la base de symptômes cliniques puisse être posé. Il est donc difficile d’étudier ces maladies sans études longitudinales exhaustives permettant de caractériser la trajectoire développementale des enfants les plus à risque, par exemple ceux qui ont un parent qui est atteint. Ces limitations font que les principaux symptômes des GMP sont traités de façon palliative, avec des antipsychotiques et des antidépresseurs, ce qui améliore le fonctionnement et la qualité de vie des patients, mais sans guérir ou traiter tous les symptômes de ces maladies. La mise en place de stratégies de prévention primaire qui seraient déployées durant l’enfance et qui viseraient à normaliser la trajectoire développementale des enfants les plus à risque constitue le meilleur espoir d’éviter ou du moins de retarder l’apparition des GMP. Des thérapies ou des interventions psychosociales chez les jeunes les plus à risque ont toujours de meilleures chances de succès que des interventions tardives, une fois la maladie installée [1].
Le Laboratoire de recherche en neurophotonique et psychiatrie (LRNP), au sein duquel la recherche présentée dans ce mémoire a été réalisée, s’est donc donné pour objectif d’identifier de nouveaux biomarqueurs de risque
pour les GMP, qui vont paver la voie vers la mise en place de stratégies de prévention primaire. Cet objectif repose sur la collaboration avec l’équipe du Dr Michel Maziade qui caractérise des familles, soit des patients et leurs enfants, largement affectées par les GMP depuis plus de trois décennies, de manière longitudinale à l’aide de mesures cliniques, de neuropsychologie, de neuroimagerie, d’électrophysiologie et de génétique. En ce qui concerne les études longitudinales des GMP, il n’a pas été possible jusqu’ici d’identifier de biomarqueurs uniques, mais lorsqu’un ensemble complet de biomarqueurs est analysé, plusieurs études ont été en mesure de distinguer efficacement les patients des contrôles, notamment dans le cadre de la dépression majeure récurrente [2] et du trouble bipolaire [3]. Similairement, les recherches du Dr Maziade ont permis de contribuer à identifier un ensemble d’anomalies cliniques, neuropsychologiques et électrophysiologiques partagées entre les patients et leurs proches appelées endophénotypes, lesquels révèlent déjà une susceptibilité héréditaire chez les jeunes à risque et peuvent être combinés pour aider à prédire leur risque de développer une GMP à l’âge adulte.
Dans cette optique, par son expertise de pointe en biophotonique, le LRNP se concentre sur plusieurs approches d’imagerie pour étudier le système nerveux et identifier de nouveaux biomarqueurs ou endophénotypes de risque pertinents pour les GMP, pour parvenir à mettre en place une caractérisation efficace des trajectoires de risque chez les jeunes à risque. Ces objectifs ambitieux passent par l’analyse d’échantillons biologiques de patients et d’enfants à risque à l’aide d’une plateforme linéaire comprenant la microscopie holographique numérique (MHN), et une plateforme non linéaire comprenant par exemple la génération de seconde harmonique, deux approches qui se basent sur un agent de contraste intrinsèque. Ce mémoire se concentre sur l’utilisation plus spécifique de la MHN pour l’identification de biomarqueurs cellulaires des GMP.
Les biomarqueurs cellulaires pour les grandes maladies
psychiatriques
Rappelons que les GMP qu’étudient le LRNP, soit notamment la schizophrénie, la maladie bipolaire, et la dépression majeure récurrente, ont toutes une pathophysiologie encore largement incomprise. Cependant, certaines anomalies morphologiques du système nerveux ont pu être associées à la présence de ces maladies, notamment à l’aide d’échantillons post mortem de patients et de modèles animaux. Parmi ceux-ci, plusieurs de ces anomalies concernent la morphologie cellulaire, ce qui motive l’étude des cellules sous cet angle dans une optique de dépistage précoce ou de meilleure compréhension de ces maladies.
Pour la schizophrénie, par exemple, il a été montré avec des études de résonnance magnétique que le volume total du cerveau, ainsi que celui de plusieurs régions spécifiques telles l’amygdale et l’hippocampe, était réduit [4], et que cette réduction continuait pendant longtemps après l’apparition des premiers symptômes [5]. Des autopsies de patients atteints de schizophrénie ont démontré que cette baisse de volume était associée à une
réduction de la taille du soma des neurones ainsi qu’à une réduction de l’arborisation dendritique[6,7], alors que le nombre de cellules semblait être similaire entre les patients et les contrôles. Dans le cas de la maladie bipolaire, une réduction dans le volume du cerveau complet et dans certaines régions spécifiques a également été observée, dont certaines similitudes avec les altérations observées pour la schizophrénie [8,9], mais majoritairement associées à une diminution du nombre de cellules plutôt qu’à une réduction du volume cellulaire [10]. Des différences dans la densité synaptique ont également été observées avec des études post mortem, notamment pour les neurones corticaux et hippocampaux des patients atteints de schizophrénie, chez qui la densité synaptique semble diminuée [11,12]. Cela est cohérent avec le fait que plusieurs gènes couramment associés aux GMP sont associés au fonctionnement et à la maturation des synapses [13].
Ces anomalies neuronales retrouvées chez certains patients atteints d’une GMP sont également supportées par les modèles animaux, développés principalement chez la souris pour mimer ces maladies. Ainsi, différents modèles de souris transgéniques conçus pour répliquer la schizophrénie, souvent en altérant des gènes associés à la maladie chez l’humain, présentent une réduction dans la proéminence des neurites et plus spécifiquement dans l’arborisation dendritique [14,15]. Ces modèles présentent également des dysfonctionnements synaptiques. Par exemple, dans le modèle DISC1, une réduction dans la transmission synaptique des neurones hippocampaux a notamment été observée [15]. Dans un second modèle où la signalisation basée sur Nrg1 est altérée, c’est le fonctionnement et la maturation des synapses qui ont été observés comme anormaux [16]. Enfin, un troisième modèle de souris présentant une délétion 22q11.2 présente des synapses plus petites ainsi qu’un nombre réduit de neurones corticaux [17]. Dans le cas de la maladie bipolaire, des modifications dans la morphologie des dendrites des souris ont également été observées [18], ainsi qu’une diminution dans la densité synaptique probablement associée à une plasticité et une maturation anormales [19]. Bien entendu, les résultats obtenus à partir de modèles animaux des GMP restent controversés puisqu’ils sont souvent basés sur la désactivation de certains gènes qui n’expliquent chacun qu’un petit nombre de cas chez l’humain, ce qui est loin d’assurer l’obtention d’un modèle représentatif et fiable d’une GMP. De plus, peu d’outils existent pour caractériser la fiabilité des modèles mis à part quelques observations comportementales qui ont elles aussi une validité restreinte lorsqu’il s’agit de faire des parallèles entre les comportements de l’humain et de la souris. Bref, malgré les réserves qu’on peut avoir sur les modèles animaux et sur les résultats qui en découlent, ceux-ci n’en demeurent pas moins un outil intéressant pour guider les futures recherches chez l’humain.
Enfin, des altérations significatives dans le contenu en protéine des cellules ont été observées dans différents contextes, notamment des études post mortem et des analyses de sang [20], mais également directement avec des globules rouges de malades, où des altérations dans la composition en acide gras polyinsaturé des membranes cellulaires chez des patients atteints de schizophrénie ont été identifiées [21]. Ces altérations
pourraient se refléter notamment sur les propriétés biophysiques des neurones et interférer avec la communication neuronale normale, puisque nombre des gènes dont l’expression a été identifiée comme altérée dans les GMP sont entre autres impliqués dans la neurotransmission synaptique [22] ou, tel que mentionné auparavant, dans le fonctionnement et la maturation des synapses [23].
Ainsi, l’ensemble de ces anomalies suggèrent que les GMP pourraient être mieux comprises à l’aide d’études d’imagerie cellulaire. Dans une optique de dépistage précoce et d’étude de la trajectoire développementale, l’étude des cellules doit pouvoir se faire chez l’enfant, avant l’apparition des premiers symptômes cliniques. C’est bien entendu possible pour des cellules périphériques ou faciles d’accès, notamment les globules rouges, qui peuvent être facilement prélevées à partir d’une simple prise de sang et qui sont prometteuses pour l’étude des GMP et l’identification de biomarqueurs, en regard de l’hypothèse membranaire de la schizophrénie [24] et des altérations déjà observées des acides gras polyinsaturés dans cette maladie [21]. Cependant, comme démontré ci-dessus, les études post-mortem, avec des modèles animaux ou sur différents phénotypes chez les patients suggèrent que les cellules nerveuses sont directement impliquées dans les anomalies cellulaires associées aux GMP. L’étude de ces dernières serait donc très pertinente pour l’identification de nouveaux biomarqueurs potentiels. Cependant, ces cellules sont bien entendu très difficiles d’accès, et leur étude directement à l’intérieur du système nerveux des patients avec les outils de la neurophotonique cellulaire serait très invasive et n’est pas envisageable. Heureusement, la mise au point de techniques de reprogrammation cellulaire en 2006 a permis de contourner le problème d’accessibilité et de mettre à profit ces outils précis et fiables pour l’étude des GMP, sans aucun risque pour les patients.
La reprogrammation cellulaire
Comme démontré par Takahashi et Yamanaka en 2006 [25], il est possible en surexprimant quatre facteurs de transcriptions reliés aux caractéristiques souches et pluripotentes de certaines cellules somatiques de les reprogrammer et de les induire en cellules souches pluripotentes. C’est ce qu’on a appelé la pluripotence induite. Ces cellules souches pluripotentes induites (CSPi) peuvent alors être différenciées en virtuellement n’importe quel type cellulaire de l’organisme vivant dont elles sont issues, tout en conservant le même matériel génétique que la cellule somatique d’origine. Dans le cas des CSPi, ce sont les conditions de culture et différents facteurs de différentiation qui vont déterminer en quels types cellulaires elles vont se différencier.
Dans la quête de nouveaux biomarqueurs de risque pour les GMP, ces CSPi sont très prometteuses, puisqu’elles permettent d’obtenir in vitro des cellules nerveuses spécifiques, sans nécessiter de biopsie ou d’autres opérations invasives chez le sujet. Comme ces CSPi peuvent être obtenues à partir de différents types de cellules somatiques, l’approche couramment utilisée est de prendre un échantillon de peau ou, plus simple encore, de récupérer les cellules urothéliales naturellement présentes dans un échantillon d’urine. De cette
manière, il est possible d’obtenir des cellules neuronales à l’aide de protocoles déjà existants [26,27] à partir de CSPi issues de cellules urothéliales provenant de patients atteints d’une GMP et d’enfants à risque faisant partie de grandes cohortes familiales. Les différentes étapes visant à obtenir ces cellules neuronales sont résumées en Fig. 0.1. Ces modèles cellulaires in vitro des GMP peuvent être étudiés avec les outils de la biophotonique cellulaire, notamment la MHN, pour identifier de nouveaux biomarqueurs de risque.
Fig.0.1. Obtention de neurones humains à partir de cellules souches pluripotentes induites. Adapté de Brennand et.al. (2012) [28].
L’intérêt de la méthode ne s’arrête pas là. En effet, comme on reproduit in vitro les principales étapes du développement des cellules souches neurales en cellules nerveuses matures, les mécanismes biologiques qui sous-tendent ces processus neurodéveloppementaux peuvent également être étudiés, ce qui ne serait pas possible à partir du système nerveux des patients, déjà mature, même si celui-ci était accessible. Les GMP présentant une composante neurodéveloppementale forte, étudier ce développement est non seulement pertinent pour améliorer notre compréhension de la maladie, mais également pour l’identification d’autres biomarqueurs de risque lié à des anomalies neurodéveloppementales, en plus de ceux qui seraient associés à une altération des propriétés des cellules matures.
Enfin, comme les CSPi ont la capacité de proliférer et se différencier en différents sous-types de cellules neuronales, cette technologie est également prometteuse dans le cadre d’expériences sur des cellules à l’aide de techniques de criblage à haut débit, où plusieurs dizaines de cultures cellulaires aux propriétés légèrement différentes sont imagées et analysées en rapide succession. Ces expériences visent à mesurer rapidement certaines propriétés clés dans une grande variété de populations neuronales différentes, pour identifier les conditions spécifiques dans lesquelles certaines anomalies neurodéveloppementales se déclarent, ou à identifier des cibles thérapeutiques pertinentes pour l’élaboration de nouveaux médicaments. En soumettant ces cultures neuronales variées provenant de malades à différents environnements chimiques et pharmacologiques et en étudiant leur développement et leur réponse sous ces conditions, il sera possible d’identifier des composés pouvant influencer ce développement et le normaliser. C’est une approche qui
nécessite un grand nombre de cellules et présente encore plusieurs défis techniques [29], mais qui a le potentiel de fournir de nombreux nouveaux outils pharmacologiques pour traiter les GMP ou prévenir leur développement. Une limitation potentielle de la méthode est le fait que, bien que les cellules nerveuses obtenues à partir de CSPi conservent le matériel génétique du sujet, les cellules obtenues ne reflètent pas nécessairement les facteurs environnementaux qui peuvent influencer son développement, tels que les complications durant la grossesse ou à la naissance, les expériences traumatiques durant l’enfance, la consommation de drogue, l’environnement social, etc. [30]. Il est généralement assumé qu’en retournant à l’état de cellules embryonnaires, les CSPi subissent « un lavage épigénétique » qui efface les effets qu’ont eus les expériences environnementales sur l’expression des gènes. Par contre, ce « lavage » est sujet à controverse surtout avec des maladies qui ont une composante environnementale aussi importante que les GMP [31]. Il y a tout de même une forte possibilité que les cellules nerveuses obtenues ne permettent pas de reproduire les effets de ces facteurs environnementaux sur le neurodéveloppement, ce qui peut limiter la portée des observations quant à l’état de vulnérabilité des enfants à risque à la part génétique de cet état de vulnérabilité. Cependant, si une évaluation précoce de cette sensibilité génétique peut être faite à l’aide de biomarqueurs de risques issus de CSPi chez les jeunes à risque, elle pourra guider les interventions pour s’assurer d’offrir un environnement sain au sujet et retarder ou prévenir le développement d’une GMP.
En somme, la technologie de reprogrammation cellulaire pour obtenir des cellules souches offre de nouvelles possibilités très prometteuses pour l’étude des GMP, tant au niveau de l’identification de trajectoires développementales de risque infantile, notamment avec l’appui de biomarqueurs de risque, que de la mise en place de méthodes d’interventions précoces et de l’amélioration de notre compréhension de ces grandes psychoses. Comme la technologie des CSPi est encore récente, les outils neurophotoniques doivent maintenant s’adapter pour permettre l’étude de ces cellules qui sont à la fois fragiles, couteuses et difficiles à obtenir. Il faut donc s’assurer de les utiliser à leur plein potentiel et d’aller chercher le maximum d’information de chacune de ces cellules. Le développement et l’adaptation de ces outils neurophotonique, qui sont au cœur du programme du LRNP, joueront un rôle déterminant dans la quête de nouveaux biomarqueurs de risque pour les GMP.
L’holographie numérique comme technique d’imagerie cellulaire
adaptée à l’étude des troubles psychiatriques
La neurophotonique s’est dotée, ces trente dernières années, d’une grande variété d’outils pour étudier divers aspects du système nerveux, chacun ayant ses particularités et ses limitations. Au niveau cellulaire, la microscopie à fluorescence s’est démarquée par une grande spécificité et un montage optique simple, pouvant être complexifié de bien des façons pour améliorer ou diversifier les propriétés de l’acquisition : sectionnement optique, super-résolution, tomographie, etc. Comme les cellules nerveuses ne sont en pratique pas
fluorescentes à l’état naturel, la microscopie à fluorescence a été tributaire des avancées en biochimie et en génétique pour le développement d’outils permettant de générer de la fluorescence de façon spécifique chez les cellules, soit par modification génétique ou par insertion de marqueurs. Dans les deux cas, ce sont des approches qui sont invasives, ce qui est particulièrement problématique dans les expériences à long terme, pourtant nécessaires pour l’étude du neurodéveloppement des GMP à travers les modèles in vitro issus des CSPi. Par ailleurs, la plupart des marqueurs fluorescents deviennent toxiques pour la cellule s’ils sont imagés trop longtemps, ce qui est encore une fois problématique pour les études à long terme. La microscopie quantitative de phase (MQP) est un outil de la biophotonique complémentaire à l’imagerie par fluorescence. Cette méthode d’imagerie permet d’investiguer de nombreux paramètres biophysiques des cellules, tels que le volume, la morphologie tridimensionnelle, la masse sèche, le contenu en protéines, les mouvements d’eau transmembranaires et les fluctuations membranaires nanoscopiques [32]. Ces paramètres étant pour la plupart difficiles à étudier avec la microscopie à fluorescence, ces deux techniques peuvent être utilisées en conjonction [33,34] pour effectuer un profilage plus complet et obtenir un maximum d’information des cellules différenciées de CSPi, couteuses et complexes à obtenir. Par ailleurs, comme la MQP se base sur un agent de contraste intrinsèque et nécessite une puissance d’illumination très faible, elle est particulièrement adaptée pour l’étude de cellules neurales à long terme.
La microscopie de phase a d’abord fait son apparition comme outil qualitatif, à partir des années 1940 [35]. De nombreuses approches quantitatives ont depuis été développées et appliquées à la biologie, permettant alors de quantifier précisément le décalage de phase produit par un tissu vivant, en particulier des cellules [36–39]. Parmi les différentes approches en MQP, la MHN possède plusieurs avantages clés qui en font un outil de choix pour l’imagerie cellulaire. Comme son nom l’indique, cette méthode consiste à enregistrer sur une caméra l’hologramme produit par un front d’onde perturbé par l’échantillon étudié interférant avec un front d’onde similaire non perturbé. Cet hologramme est ensuite reconstruit pour obtenir non seulement l’image de phase, mais également la distribution d’intensité produite par l’échantillon [40]. Une représentation du montage optique d’un MHN typique et un exemple des images obtenues sont présentés en Fig. 0.2. Parmi les éléments faisant de la MHN un outil adapté à la biologie cellulaire, on notera notamment sa conception optique relativement simple pouvant facilement s’intégrer à de l’équipement biologique [38], et être couplés à de la microscopie à fluorescence [33]. De plus, son algorithme de reconstruction est suffisamment léger pour obtenir les images de phase et d’intensité en temps réel avec la puissance de calcul d’un ordinateur de bureau typique, ce qui permet à l’expérimentateur d’avoir de l’information en temps réel sur l’état de l’échantillon biologique étudié et la qualité de l’acquisition. Si toutefois une plus grande vitesse d’acquisition est nécessaire, l’acquisition des hologrammes n’est limitée que par la vitesse d’acquisition de la caméra, et la reconstruction des images d’intensité et de phase peut se faire en marge de l’expérience. Par ailleurs, comme la phase et l’intensité sont connues, un focus numérique peut être fait [41,42], ce qui permet de travailler avec plusieurs cellules à des plans différents ou de
corriger pour une dérive du focus, un problème courant lors de longues périodes d’imagerie. L’algorithme de reconstruction peut également compenser les aberrations optiques du système [43], ce qui permet d’obtenir une résolution latérale limitée par la diffraction [40].
Fig.0.2. Schéma optique du MHN et reconstruction des images d’intensité et de phase à partir de l’hologramme, dans ce cas-ci des neurones corticaux de rat. Le logiciel de reconstruction utilisé est un logiciel commercial développé par Lyncée Tec, une compagnie qui commercialise aussi des MHN.
En outre, la nature interférométrique du MHN la rend sensible à des variations très fines sur l’axe vertical [38], suffisante pour détecter l’activité neuronale lors de stimulations pharmacologiques, à travers les changements dans le signal de phase induits par les mouvements d’eau transmembranaires [33,44]. Enfin, la microscopie à holographie numérique est également appropriée pour le criblage à haut débit [34], une des approches qui sera utilisée au sein du LRNP dans le cadre de son exploration des GMP, tel que mentionné plus tôt. En effet, la possibilité d’un autofocus numérique des images de phase en MHN est très utile pour les expériences de criblage à haut débit, où plusieurs dizaines de puits sont analysés en rapide succession, sans pour autant que le plan focal soit identique dans tous les cas. De plus, l’absence de limitation imposée par la MHN sur la vitesse d’acquisition des hologrammes est un atout supplémentaire pour des expériences de criblage à haut débit, où la vitesse d’acquisition est un paramètre crucial [45]. Pour sa grande sensibilité, son caractère quantitatif et ses caractéristiques avantageuses en imagerie cellulaire à long terme et en criblage à haut débit, la MHN est au cœur des différentes plateformes d’imagerie cellulaire du LRNP.
Interprétation du signal quantitatif de phase
Le signal quantitatif de phase (SQP) se définit comme le retard de phase que la cellule induit sur le front d’onde la traversant et est illustré à la Fig. 0.3. Ce retard de phase Δ𝜑 est causé par la différence d’indice de réfraction entre le milieu extracellulaire et le milieu intracellulaire. Plus précisément, il est régi par la relation
Δ𝜑 =2𝜋
𝜆 (𝑛𝑐− 𝑛𝑚)𝑑, (0.1)
où 𝜆 est la longueur d’onde de la lumière utilisée, 𝑑 est l’épaisseur de la cellule, 𝑛𝑐 son indice de réfraction et 𝑛𝑚 l’indice de réfraction du milieu extracellulaire. Ainsi, le SQP provient de deux paramètres intrinsèques de la cellule, soit son épaisseur et la différence entre son indice de réfraction, qui est une mesure de sa densité, et l’indice de réfraction du milieu extracellulaire. De ces deux paramètres cellulaires, de nombreux paramètres biophysiques peuvent être investigués quantitativement, notamment la masse sèche, la morphologie tridimensionnelle, les vibrations de la membrane et les mouvements d’eau transmembranaires. À noter que, tel que mentionné auparavant, ces mouvements d’eau transmembranaires ont notamment lieu lorsqu’il y a transfert d’ions à travers la membrane de la cellule, il s’agit donc d’un moyen de sonder l’activité neuronale lors de stimulations pharmacologiques de façon strictement non invasive.
Fig.0.3. Schéma d'une chambre d'imagerie utilisée en MHN. Les paramètres sont décrits dans l'Éq. 0.1.
Ainsi, le SQP est un signal très riche qui permet de sonder simultanément de nombreux paramètres cellulaires qui vont permettre l’élaboration d’un profil cellulaire complet pour étudier les multiples facettes du processus de maturation de neurones issus des SCPi de patients atteints d’une GMP. Cependant, c’est également un signal qui est complexe à interpréter. Premièrement, le SQP dépend de l’indice de réfraction extracellulaire. Or, cet indice de réfraction est sujet à changement suivant les paramètres expérimentaux utilisés : température, osmolarité, composés pharmacologiques, évaporation, gazage ou dégazage, etc. Donc, s’il n’est pas précisément mesuré et contrôlé, cela peut induire des artéfacts dans le signal de phase mesuré et affecter sa nature quantitative. En particulier, dans un contexte d’étude à long terme, cet indice de réfraction extracellulaire doit être connu pour pouvoir comparer quantitativement les données entre elles au fil du temps. Deuxièmement, les informations d’épaisseur et d’indice de réfraction cellulaires sont couplées dans le signal de phase, et ne peuvent donc pas être directement mesurées individuellement. Plusieurs approches ont été développées pour découpler ces paramètres, lesquelles sont explorées dans la section ci-dessous.
Découplage indice de réfraction – épaisseur et morphologie tridimensionnelle
L’indice de réfraction et l’épaisseur de la cellule, deux paramètres influençant directement le SQP, sont d’excellents candidats pour l’identification de biomarqueurs ou d’endophénotypes dans les recherches sur les GMP du LRNP. En effet, en ce qui concerne l’épaisseur, si celle-ci est connue à partir du signal de phase à chaque pixel, le volume peut très facilement être déduit. La morphologie tridimensionnelle est également accessible, information qui n’est généralement récupérable qu’avec des approches tomographiques, nécessitant un montage d’imagerie nettement plus complexe et des approximations sur la reconstruction des images de phase qui peuvent induire des artéfacts. Par ailleurs, tel que mentionné auparavant, plusieurs observations dans les études post mortem de patients et avec les modèles animaux suggèrent que la morphologie des cellules est affectée par les GMP, notamment la taille du soma et la densité synaptique dans le cas de la schizophrénie[6], ce qui en fait un biomarqueur potentiellement pertinent. Similairement, l’indice de réfraction des cellules est également un paramètre d’importance, il s’agit d’une mesure de la densité de la cellule, qui est directement liée au contenu intracellulaire [46]. On sait notamment que la composition des membranes est affectée par les GMP [24,47] et que de nombreuses autres différences dans le degré d’expression de diverses protéines ont également été observées [20,48], deux éléments qui peuvent avoir un impact sur l’indice de réfraction cellulaire. Mettre en place une stratégie de découplage de l’épaisseur et de l’indice de réfraction dans le SQP est donc cruciale pour tirer un maximum d’information des neurones dérivés des CSPi de patients.
Une première approche consiste à forcer la cellule à prendre une épaisseur connue pour obtenir un signal qui ne dépend alors plus que de l’indice de réfraction de la cellule, ce qui peut se faire en forçant les cellules à passer dans un étroit capillaire [49]. Cependant, bien que cette approche soit relativement simple, elle est invasive et ne peut s’appliquer qu’à des cellules uniques et indépendantes. Dans le cas des neurones, ceux-ci forment des réseaux et ne peuvent donc pas être étudiés avec une telle approche.
Une seconde approche consiste à tirer avantage de la dépendance du signal de phase à l’indice de réfraction du milieu extracellulaire. En modifiant cet indice de réfraction extracellulaire et en étudiant l’impact sur le SQP, l’indice de réfraction et l’épaisseur de la cellule peuvent être déduits. Plusieurs méthodes ont été utilisées pour changer l’indice de réfraction extracellulaire, notamment l’exploitation de la forte dispersion de certaines molécules sous des conditions spécifiques [50] ou l’ajout dans la solution perfusée d’un composé ayant un indice de réfraction élevé [51]. Cette seconde approche, non invasive, est utilisée par le LRNP pour obtenir l’indice de réfraction et l’épaisseur, donc le volume, des neurones dérivés de patients étudiés, deux paramètres potentiellement intéressants pour l’identification de biomarqueurs de risque liés aux GMP. Elle nécessite toutefois que l’indice de réfraction, et en particulier le changement d’indice de réfraction, de la solution physiologique dans la chambre d’imagerie soit précisément connu.
Mesure de l’indice de réfraction extracellulaire
Comme on l’a vu ci-dessus, l’indice de réfraction extracellulaire influence le SQP et doit à ce titre être contrôlé pour conserver la nature quantitative du signal de phase et permettre des comparaisons entre différentes expériences. De plus, cet indice de réfraction extracellulaire joue également un rôle central dans plusieurs expériences typiques de la MQP, notamment le découplage à deux liquides présenté ci-dessus. Il est donc essentiel de pouvoir mesurer précisément ce paramètre pour chaque expérience.
De nombreux outils existent pour mesurer l’indice de réfraction des liquides, le plus courant étant le réfractomètre d’Abbe en raison de sa grande précision, sa facilité d’utilisation et sa robustesse. Cependant, son utilisation implique que la mesure de l’indice de réfraction doive se faire en marge de l’expérience d’imagerie au MHN, pour chaque liquide différent utilisé. En plus d’ajouter des manipulations et d’augmenter le risque d’erreur en cas de mauvaise gestion des solutions, la précision de la mesure n’est pas garantie, puisque plusieurs paramètres peuvent influencer l’indice de réfraction du milieu extracellulaire directement pendant l’expérience : température, mélange des solutions lors d’un changement de liquide, évaporation, etc. En particulier, dans un contexte de criblage à haut débit, plusieurs dizaines, voire plusieurs centaines de puits différents sont analysés en parallèle, chacun contenant des solutions physiologiques différentes puisqu’on cherche dans chacun de ses puits à tester différentes molécules ou différentes concentrations. Mesurer systématiquement pour chacun d’eux l’indice de réfraction des solutions utilisées devient rapidement inapplicable.
C’est pourquoi le LRNP a travaillé sur une méthode pour mesurer l’indice de réfraction du milieu extracellulaire
in situ, directement dans la chambre d’imagerie au MHN. L’idée est de microstructurer les lamelles sur lesquelles
sont déposés les neurones dérivés de SCPi. Ces microstructures aux caractéristiques connues produisent un signal de phase sous le MHN qui ne dépend plus que de l’indice de réfraction du milieu extracellulaire si leur épaisseur et leur indice de réfraction sont connus (voir Éq. 0.1). Plus précisément, dans notre cas, ce sont des rainures qui sont gravées dans les lamelles de microscopie, qui permettent de sonder l’indice de réfraction du liquide qu’elles contiennent. Ainsi, lorsque des cellules sont déposées sur ces lamelles rainurées et qu’elles sont imagées sous le MHN, le SQP des cellules peut être obtenu et traité de façon habituelle et celui des rainures permet d’obtenir en temps réel, in situ et localement l’indice de réfraction du milieu extracellulaire. Ainsi, en plus d’éviter les biais possibles sur cet indice de réfraction lors de l’expérience (changement de température, mélange incomplet, etc.), ces lamelles rainurées permettent de s’affranchir des mesures au réfractomètre d’Abbe tout en conservant la nature quantitative du SQP, ce qui simplifie les expériences et rend les approches de criblage à haut débit envisageables.
Ce mémoire décrit donc la conception et la caractérisation d’un réfractomètre des liquides in situ, résolu temporellement et spatialement, basé sur l’utilisation de ces lamelles rainurées en MHN, ainsi que son
application à la biologie cellulaire. De nombreuses expériences de calibration et de caractérisation ont été réalisées avec un degré croissant de complexité, menant finalement à l’application cellulaire.
Dans un premier temps, les performances du MHN pour des mesures d’indice de réfraction dans un contexte simple ont été évaluées, soit dans une approche de réfractométrie d’échantillons solides, plus précisément des guides d’ondes optiques. Cette étude a permis de quantifier la sensibilité et la précision du MHN utilisé, de le comparer à d’autres approches similaires en MQP et de développer différentes méthodes d’analyse d’images qui ont directement pu être utilisées pour la réfractométrie des liquides. Ces différents résultats ont été publiés dans la revue Optics Express en juin 2018 [52] et sont présentés, en anglais, dans le deuxième chapitre de ce mémoire.
Le troisième chapitre de ce mémoire est constitué d’un second article scientifique, également en anglais, portant spécifiquement sur la précision et la fiabilité en réfractométrie des liquides, avec les lamelles rainurées introduites ci-dessus, sous différentes conditions. Le prototype final y est présenté et des performances remarquables, similaires à celles d’un réfractomètre commercial typique, y sont démontrées.
Finalement, le dernier chapitre présente une preuve de concept de l’utilisation du réfractomètre des liquides en biologie cellulaire. Concrètement, des expériences réalisées avec des cellules NIH/3T3 déposées sur ces lamelles rainurées et observées au MHN y sont présentées. Ces expériences impliquent des liquides d’indice de réfraction différents, notamment dans le cadre de l’expérience de découplage à deux liquides présentée ci-dessus, permettant d’obtenir simultanément l’indice de réfraction et l’épaisseur des cellules étudiées [51]. Ces différents indices de réfraction sont mesurés in situ avec notre réfractomètre et comparés aux mesures ex situ faites avec un réfractomètre d’Abbe commercial.
Chapitre 1
Comparative study of quantitative phase imaging
techniques for refractometry of optical waveguides
1.1 Résumé
Une étude comparative de techniques d’imagerie de phase quantitative pour la réfractométrie de guides d’ondes optiques est présentée. Trois techniques sont étudiées : une méthode basée sur l’équation du transport radiatif, l’interférométrie à décalage quadrilatéral et la microscopie holographique numérique. Le profil d’indice de réfraction d’une fibre optique SMF-28 a été précisément caractérisé et a servi d’état de l’art pour confirmer l’exactitude et la précision des méthodes d’imagerie de phase quantitative. Ensuite, des guides d’ondes inscrits dans une lame de verre avec un laser femtoseconde ont été utilisés pour évaluer la limite de sensibilité des méthodes susmentionnées. Nous montrons que les trois techniques produisent des mesures d’indice de réfraction exactes, précises et reproductibles. Enfin, à partir de ces données obtenues avec les différentes approches d’imagerie de phase quantitative, nous rapportons une carte complète de la photosensibilité du verre Eagle2000 aux impulsions femtosecondes. Ainsi, les données suggèrent que ces techniques d’imagerie de phase quantitative constituent un outil approprié pour la mesure précise et non destructive de changement d’indice de réfraction, pour l’étude et le contrôle des procédés d’inscription de guides d’ondes optiques.
1.2 Abstract
A comparative study of quantitative phase imaging techniques for refractometry of optical waveguides is presented. Three techniques were examined: a method based on the transport-of-intensity equation, quadri-wave lateral shearing interferometry and digital holographic microscopy. The refractive index profile of a SMF-28 optical fiber was thoroughly characterized and served as a gold standard to assess the accuracy and precision of the phase imaging methods. Optical waveguides were inscribed in an Eagle2000 glass chip using a femtosecond laser and used to evaluate the sensitivity limit of these phase imaging approaches. It is shown that all three techniques provide accurate, repeatable and sensitive refractive index measurements. Using these phase imaging methods, we report a comprehensive map of the photosensitivity to femtosecond pulses of Eagle2000 glass. Finally, the reported data suggests that the phase imaging techniques are suited to be used as precise and non-destructive refractive index shift measuring tools to study and control the inscription process of optical waveguides.
1.3 Introduction
From micrometer-scale integrated silicon-on-insulator optical circuits to long-distance optical fiber network spanning hundreds of kilometers, most photonic devices and systems rely on low-loss optical waveguides. As
such, the refractive index profile of optical waveguides is the key design parameter of integrated photonic devices because it determines, among other properties, the insertion losses and propagating modes. Therefore, an accurate refractive index profiling method is of paramount importance to the development, optimization and eventually quality monitoring of mass-produced photonic devices.
The measurement of the refractive index profile of optical waveguides, generally relies either on refracted near-field (RNF) [53,54] or quantitative phase imaging (QPI) [55]. RNF is the state-of-the-art in the optical fiber industry because of its relatively low-cost and ability to resolve abrupt changes in the refractive index profile [53]. However, this method presents a few practical drawbacks. The index profile cannot be obtained unless one of the end-face of the volumetric optical material is accessible. Moreover, if the index profile has to be measured at different points along the same optical waveguide, it must be broken repeatedly. On the other hand, QPI makes it possible to quantify the phase shift that light experiences when passing through a transparent object. As long as the refractive index of the phase object remains close to the one of the surrounding medium, in the present case the optical waveguide and the host material, the phase shift is proportional to optical path length. As such, it is only possible to get a precise measurement of either the thickness or the refractive index assuming the other is known. Fortunately, it is generally possible to measure accurately the thickness of the object with a complementary technique, for example with scanning electron microscopy (SEM). Therefore, QPI is well suited to identify, from optical path length measurements, refractive index alterations of optical waveguides and has the advantage of being non-destructive. However, the provided measurement corresponds to an integrated refractive index difference over the optical path [38,51,56] and hence, the measurement is not suited for 3D refractive index distribution of optical waveguides.
Among a few others, a non-interferometric QPI technique developed by Barty et al. [55] based on the transport-of-intensity equation (TIE) proved to be the most employed to date in the field of optical fibers [57–59]and photo-induced waveguides [60–62]. Over the past 10 years, a significant number of novel interferometric QPI methods have been developed [38,39,63–67]. Among those, the quadri-wave lateral shearing interferometry (QWLSI) and digital holographic microscopy (DHM) techniques have proven records of accomplishment in materials science [68–73]. However, to our knowledge none was transposed to the measurement of the refractive index difference of optical waveguides up to now. In fact, there has been a single report of DHM for strain-induced birefringence measurements in optical fibers, but based on a polarimetric approach [74].
Recently, femtosecond laser direct inscription emerged as an efficient method for the fabrication of integrated photonic devices. This technique allows 3D micro-structuring inside the volume of transparent optical materials by translating a focused fs laser beam below the surface, inducing a permanent alteration of the refractive index along the trajectory of the beam [75]. As such, refractive index modifications can be shaped with submicron
precision and the index contrast with the surrounding medium can be precisely adjusted which provides an ideal testbed for the evaluation of refractive index measurements methods.
In this paper, we present a thorough investigation of refractive index measurements of optical waveguides using three different QPI methods, namely TIE, QWLSI and DHM. First, the accuracy and the precision of the different QPI approaches were assessed by measuring the refractive index profile of a standard telecommunication fiber (Corning, SMF-28). Then, the three QPI techniques were used to characterize the refractive index contrast of photo-induced optical waveguides. Precise control over the photo-induced index contrast enabled for the formation of weak modifications, which allowed to determine the sensitivity of the QPI approaches. Finally, the QPI methods were used to produce a comprehensive map of the photosensitivity of a glassy optical material to fs laser direct inscription. Specifically, the effect of the laser power and the number of successive passes of the beam on the induced index contrast in Eagle2000 glass was studied.
1.4 Experimental Methods
1.4.1 Samples
Two different samples were selected for this study. The first one is a widespread telecommunication optical fiber (SMF-28, Corning), chosen because of its standardized geometry and refractive index profile. The second sample is a borosilicate glass chip (Eagle2000, Corning) containing multiple photo-induced optical waveguides.
1.4.1.1 Optical fiber
The Corning SMF-28 fiber is produced via the modified chemical vapor deposition (MCVD) process and is composed of a 125 µm diameter fused silica cladding with an 8.2 µm diameter germanium doped core. The core is known to exhibit a step-index profile and a refractive index difference of 5.2 × 10-3 with respect to the
cladding [76,77]. Two segments of about 1 cm long optical fiber stripped of the polymer coating were immersed in a refractive index matching liquid (n = 1.458 at 589.3 nm, Cargille Laboratories). The assembly was mounted between two coverslips and separated by a 120 µm thick imaging spacer (SecureSeal™SS1X20, Grace Bio-Labs). Three images of the fiber segments have been acquired along their length from a top-view perspective for each QPI technique.
1.4.1.2 Photo-induced waveguides
Owing to its strong photosensitivity, mechanical resistance and thermal stability, Corning Eagle2000 is a proven host for photonic devices fabricated using femtosecond laser inscription and operating in the visible and near infrared spectra. Recently, low-loss high-index waveguides as well as photonic circuits were formed in this boro-aluminosilicate glass [78–80]. For this work, waveguides were inscribed in the bulk of a 1.1 mm thick Eagle2000 sample using a femtosecond laser system (RegA, Coherent). The system was operated at a wavelength of 790
nm and a repetition rate of 250 kHz. The temporal FWHM of the pulses was measured to be 60 fs at the laser output and estimated at 85 fs on the sample. The beam was focused 100 µm beneath the surface of a glass sample using a 50X-microscope objective (f=4 mm, 0.55 NA, Edmunds Optics). The sample was translated at a speed varying between 5 and 20 mm/s, across the focal point, perpendicular to the laser beam using motorized mechanical stages (XML210, GTS30V, Newport). A cylindrical lens telescope was used to produce an astigmatic beam and shape the focal volume as to form waveguides with nearly circular cross-sections [81].
Overall, 61 waveguides were photo-inscribed in the sample. Waveguides were divided between 12 series, inscribed using increasing laser power and number of passes. Series were separated by a distance of around 100 µm and waveguides were set apart by a distance of about 50 µm. The complete set of experimental parameters for every waveguide is detailed in Fig. 1.4. For each series and waveguide, a phase image has been acquired using the three QPI methods. All images were taken from a top-view perspective.
1.4.2 QPI methods
1.4.2.1 TIE (Transport-of-intensity equation)
The TIE method yield a quantitative phase image of a transparent object using a pair of defocused bright-field images taken on both sides of a single focus image. The intensity distribution is directly obtained from the in-focus image while the phase information is inferred by the pair of images obtained by dein-focusing the microscope slightly in both positive and negative directions [55]. The phase is then retrieved by a Taylor series expansion of the difference between the defocused images. This expansion is usually valid up to the 3rd order [82].
Bright-field intensity images were obtained using an inverted microscope (IX71, Olympus) and two different microscope objectives. An oil-immersed 100X-objective (LMPLFLN, Olympus) with a working distance of 0.17 mm and a NA of 1.3 was used to retrieve the refractive index profile of the optical fiber. For the measurement of the refractive index contrast of the photo-induced waveguides, a 50X-objective (UPLANFL LWD, Olympus) with a working distance of 2.1 mm and a NA of 0.5 was used. Samples were illuminated in a Köhler illumination scheme by an incoherent white-light source (U LH100L 3, Olympus). Series of defocused images were obtained by moving the sample along the vertical axis with a piezoelectric translation stage (C Focus, Mad City Labs). A band-pass filter (FL514.5 10, Thorlabs) centered at 514.5 nm with a FWHM of 10 nm was inserted in the light path for all the measurements. Intensity images were captured with a 12 bit CCD camera (QICAM Fast, QImaging) recording at 10 frames per second. Each intensity image is an average of 10 single-shot images and the corresponding phase image was retrieved using a proprietary software (QPm, Iatia). The camera resolution is 1392 × 1080 pixels and the sensor has a pixel size of 4.65 × 4.65 µm. An intensity image of the object at the focus along with 3 pairs of defocused images at ±0.5, ±1 and ±2 µm and 2 pairs of defocused images at ±4 and ±8 µm were taken for the case of the optical fiber and the photo-induced waveguides respectively. Phase images were
retrieved for each pair using the above-mentioned software. The best image in terms of contrast and noise was chosen and used for refractive index determination of both samples.
1.4.2.2 QWLSI (Quadri-wave lateral shearing interferometry)
To realize quantitative phase images, QWLSI uses a wave-front sensor placed in the image plane of a microscope. QWLSI is based on the interference of four replicas of an incident wave front that is distorted by the observed sample. The replicas are created by a modified Hartmann mask which is a bi-dimensional diffraction grating [83,84]. The superposition of those four replicas creates, after a small propagation, an interferogram that is recorded by a CCD camera. A thorough explanation of the working principle of QWLSI can be found in [39]. The imaging setup was constituted of the same microscope, objectives and light source described in Section 1.4.2.1. The QWLSI sensor (SID4Bio, Phasics) was mounted on the camera port of the microscope with a C mount adapter. The 12 bit CCD camera recording at four frames per second gives 400 × 300 phase and intensity measurement points with a mask of a lateral pitch of 29.6 µm. Each phase image is an average of five single-shot images of the object at the focus, each being the result of the reconstruction from an interferogram performed by the proprietary software (SID4Bio, Phasics). At the beginning of each imaging session, a reference image in a clean and homogenous region of the sample has been recorded. A band-pass filter (FB550 10, Thorlabs) centered at 550 nm with a FWHM of 10 nm was inserted in the light path for all the measurements.
1.4.2.3 DHM (Digital holographic microscopy)
A digital holographic microscope (T 1003, Lyncée Tec) based on a Mach-Zehnder interferometer was used. Within the microscope, the beam produced by a 666 nm laser diode is separated in two, forming an object wave and a reference wave. The object wave, diffracted by the sample, interferes with the reference wave producing an off-axis hologram recorded by a digital camera. The microscope objectives magnification is 63X and 40X with free working distances of 160 and 400 µm and NA of 1.3 and 0.80 (HC PL FLUOTAR, Leica) for the measurements of the optical fiber and photo-induced waveguides respectively. The camera is equipped with a monochrome 2.3 megapixels Sony IMX174 CMOS sensor with a pixel size of 5.86 µm and recording at 162 frames per second (Grasshopper3, FLIR). The off-axis geometry, meaning that holograms are recorded with the object and reference waves having a small angle between their directions of propagation allows reconstructing quantitative phase image from a single recorded hologram. A more detailed description of the experimental setup can be found in [38]. The reconstruction of the original image from the hologram is computed numerically using a proprietary software (Koala, Lyncée Tec). The reconstruction algorithm consists in a simulation of the illumination of the recorded hologram by a digital reference wave followed by a numerical correction of the wave-front modifications induced by the optical components, the microscope objective, and the off-axis geometry as well as background flattening [40].
1.4.3 RNF (Refracted near-field)
An optical fiber analyzer (NR 9200, EXFO) based on the RNF technique [53] was used to recover the refractive index profile of the core of the SMF-28 optical fiber. Raster scanning of the fiber end-face yielded such profiles with a resolution of 0.2 µm at a wavelength of 657.6 nm.
1.4.4 SEM (Scanning electron microscopy)
The end-faces of the SMF-28 optical fiber and photo-induced waveguides were observed using SEM (Quanta 3D FEG, FEI). The fiber was cleaved and the end-faces of the glass chip were cut and polished. The cross-sections of the fiber core and waveguides were examined with a SEM using a 1000X-magnification or higher.
1.4.5 Image processing for quantification
Image processing was performed using an in-house software implemented in Matlab (R2016a, MathWorks). The purpose of the image processing procedure is to obtain leveled phase profiles, which can be readily quantified and interpreted. A procedure similar to the one demonstrated by Kouskousis et al. [76] has been applied to all QPI techniques and both samples. The image processing procedure of an optical fiber core is depicted in Fig. 1.1.
Fig. 1.1. (a)-(c) Quantitative phase images of a segment of a Corning SMF-28 optical fiber obtained with TIE, QWLSI and DHM respectively. All scale bars are 10 µm. (d)-(f) Single-line phase profiles corresponding to the white lines in (a)-(c). (g)-(i) Leveled phase profiles of the region of the core obtained with TIE, QWLSI and DHM respectively.
For the sake of clarity, the following explanation refers to the case of an optical fiber, but remains valid for the case of a waveguide. Typical quantitative phase images of the optical fiber for TIE, QWLSI and DHM are shown in Fig. 1.1(a)-(c) respectively. Representative single-line profiles, corresponding to the white lines in Fig. 1.1(a)-(c), are shown in Fig. 1.1(d)-(f). Phase images were averaged line-by-line along the axis of the fiber to obtain a one-dimensional mean phase profile. Next, the beginning position and the end location of the fiber core inside the mean profile were found using a 2nd order derivative treatment. The data points corresponding to the
fiber core were then temporarily removed from the mean profile and the remaining was considered as the baseline. Afterward, the baseline was fitted using a 7th order polynomial and subtracted in order to level the
mean phase profile. The portion of the profile corresponding to the core was repositioned on the baseline by applying the same correction, leading to the leveled phase profiles shown in Fig. 1.1(g)-(i). Within this new framework, the relative phase shift corresponds directly to the value of the y-axis.