Impact d’un procédé industriel de brassage et de
refroidissement sur les propriétés texturales et
rhéologiques de yogourts brassés
Rôle de la teneur en matières grasses et du temps de
fermentation
Mémoire
Noémie Lussier
Maîtrise en Sciences et technologie des aliments
Maître ès sciences (M. Sc.)
Québec, Canada
Impact d’un procédé industriel de brassage et de
refroidissement sur les propriétés texturales et
rhéologiques de yogourts brassés
Rôle de la teneur en matières grasses et du temps de
fermentation
Mémoire
Noémie Lussier
Sous la direction de :
Sylvie Turgeon, directrice de recherche
Daniel St-Gelais, codirecteur de recherche
Résumé
De plus en plus de travaux de recherches portent sur le yogourt brassé mais, très peu ont su étudier les impacts combinées des étapes de productions à l’échelle pilote.Le but de ce projet était de déterminer les effets combinés de la teneur en matières grasses (MG), du temps de fermentation (TF), du type de refroidissement durant le brassage et de l’entreposage du yogourt sur leurs propriétés physico-chimiques, texturales et rhéologiques. Les yogourts ont été standardisés à 4,2% de protéines et 16,5% de solides totaux (ST) et la teneur en MG a été ajustée entre 0,0 et 3,9%. Un yogourt sans gras à 14% de ST a servi de témoin. Les TF étaient de 3, 4 et 5 heures. Après fermentation, le yogourt (25 kg) de chaque cuvea été brassé à l’aide d’un système pilote simulant les conditions de production industrielle (brassage en cuve, pompage, lissage, refroidissement) et refroidi avec un système tubulaire, imposant un faible cisaillement, ou un système à plaques, provoquant un cisaillement élevé. La synérèse, la fermeté, l’hystérèse et la viscosité apparente ont été mesurées pendant les 34 jours d’entreposage à 4°C. Les résultats ont démontré que le TF et la teneur en ST ont eu peu d’impact sur les propriétés physico-chimiques, texturales et rhéologiques des yogourts brassés. L’augmentation de la teneur en MG a permis de réduire la synérèse et d’augmenter la fermeté, les aires des courbes d’hystérèse et la viscosité des yogourts brassés. L’utilisation d’un système de refroidissement à plaques a contribué à réduire la synérèse et à augmenter la fermeté sans modifier la viscosité. L’entreposage a permis d’augmenter la fermeté et la viscosité mais, l’indice de synérèse est resté constant. Les résultats obtenus permettent d’établir que le type de refroidissement a un impact important sur les propriétés rhéologiques mais que la présence de MG, à partir de 2,6%, permet au yogourt de mieux résister à une déstructuration du réseau protéique provoqué par un cisaillement élevé lors du brassage et ainsi de réduire la synérèse et d’augmenter la fermeté et la viscosité.
Abstract
More and more research subjects are about stirred yogurt but, only few have worked on combined impacts of yogurt production at a pilot scale. The purpose of this project was to determine the combined effects of milk fat (MF) content, fermentation time (FT), type of cooling during stirring, and storage time on the physico-chemical, textural and rheological properties of stirred yogurt. The yogurts were standardized at 4.2% protein and 16.5% total solids (TS), and the MF content was adjusted to values between 0.0% and 3.9%. A fat-free yogurt with 14% TS was used as a control. The FT was set at 3, 4 and 5 hours. After fermentation, yogurt (25 kg) of each tank was stirred using a pilot system that simulated industrial production conditions (tank stirring, pumping, smoothing, cooling) and cooled using a tubular heat exchanger, causing low shear, or a plate heat exchanger, which caused high shear. Syneresis, firmness, hysteresis and apparent viscosity were measured during 34 days of storage at 4 °C. The results showed that MF content and TS had little impact on the physico-chemical, textural and rheological properties of stirred yogurts. A higher MF content reduced syneresis and increased firmness, hysteresis loop areas, and viscosity in stirred yogurts. High shear of the plate heat exchanger led to a reduction in syneresis and an increase in firmness, but without changing the viscosity. Storage led to an increase of firmness and viscosity but, syneresis did not change. The results suggest that the type of cooling system used has an important impact on rheological properties but that the presence of MF at 2.6% and higher makes the yogurt more resistant to the disruption of the protein network caused by high shear during stirring, leading to lower syneresis and higher firmness and viscosity.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières... v
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations ... x
Remerciements ... xi
Avant-propos ... xiv
Introduction générale ... 1
Chapitre 1: Revue de littérature ... 3
1.1 Le lait et le yogourt ... 3
1.2 Fermentation et gélification du lait ... 3
1.3 Optimisation des étapes de production du yogourt ... 5
1.3.1 Ingrédients laitiers ... 6
1.3.2 Homogénéisation et traitement thermique ... 10
1.3.3 Culture lactique et paramètres de fermentation ... 12
1.4 Distinction entre yogourt ferme et yogourt brassé ... 14
1.4.1 Brassage ... 15
1.4.2 Entreposage ... 18
1.3 Problématique... 19
1.4 But, hypothèse, objectif général et objectifs spécifiques ... 20
1.4.1 But ... 20
1.4.2 Hypothèse ... 20
1.4.3 Objectif général ... 20
1.4.4 Objectifs spécifiques ... 20
Chapitre 2 : Impact de la teneur en solides totaux et en matières grasses ainsi que du type de refroidissement industriel sur les propriétés rhéologiques de yogourts brassés à l’aide d’un banc d’essai pilote ... 21
Résumé ... 22
2.1 Introduction ... 23
2.2 Matériel et méthodes ... 27
2.2.1 Ingrédients laitiers ... 27
2.2.2 Préparation du ferment lactique... 27
2.2.3 Mélange laitier ... 28
2.2.5 Banc d’essai pilote... 30 2.2.6 Analyses ... 31 2.3 Résultats ... 36 2.3.1 Mélanges laitiers ... 36 2.3.2 Populations bactériennes ... 36 2.3.3 Propriétés physico-chimiques... 37 2.3.4 Propriétés texturales ... 41 2.3.5 Propriétés rhéologiques ... 42 2.4 Discussion ... 46 2.5 Conclusion ... 54
Chapitre 3: Impact de la teneur en matières grasses, du temps de fermentation et du système de refroidissement sur les propriétés rhéologiques de yogourts brassés avec un banc d’essai pilote ... 56
Résumé ... 57
3.1 Introduction ... 58
3.2 Matériel et méthodes ... 61
3.2.1 Ingrédients laitiers et souches bactériennes ... 61
3.2.2 Préparation du ferment lactique et écrémage du lait entier cru ... 61
3.2.3 Production des yogourts ... 62
3.2.4 Banc d’essai pilote... 63
3.2.5 Analyses ... 64
3.3 Résultats ... 67
3.3.1 Composition des mélanges laitiers ... 67
3.3.2 Temps de fermentation... 67
3.3.3 Populations bactériennes ... 68
3.3.4 Propriétés physicochimiques ... 70
3.3.5 Propriétés texturales et rhéologiques ... 72
3.4 Discussion ... 75
3.5 Conclusion ... 81
Conclusion générale ... 83
Bibliographie ... 87
Annexe 1 : Composition des ingrédients laitiers et calcul matriciel des mélanges laitiers ... 96
Annexe 2: Courbes d’hystérèse et calcul de l’aire ... 99
Annexe 3: Valeurs de probabilité obtenues pour les facteurs étudiés au chapitre 2 et au chapitre 3 ... 101
Liste des tableaux
Tableau 2.1 : Composition des ingrédients laitiers. ... 27 Tableau A1.1 : Calcul matriciel de l’apport en protéines, en solides totaux et en matières
grasses de chaque ingrédient laitier. ... 97
Tableau A1.2 : Quantité d’ingrédients laitiers calculé selon les cibles. ... 97 Tableau A1.3 : Quantité d’ingrédients laitiers nécessaire pour la production de 25 kg de
yogourt. ... 98
Tableau A2.1 : Aire obtenue entre chaque valeur de la vitesse et de la contrainte de
cisaillement... 99
Tableau A3.1 : Valeurs de probabilité pour les facteurs individuels (YOG, REF, TE) et
de leurs interactions pour chacune des variables dépendantes mesurées au chapitre 2. ... 101
Tableau A3.2 : Effets significatifs individuels et combinés des différentes variables
indépendantes (YOG, REF, TF, TE) selon les variables dépendantes mesurées au cours du chapitre 3. ... 102
Liste des figures
Figure 1.1 : Schématisation des principales étapes de fabrication du yogourt de type
ferme et brassé. ... 15
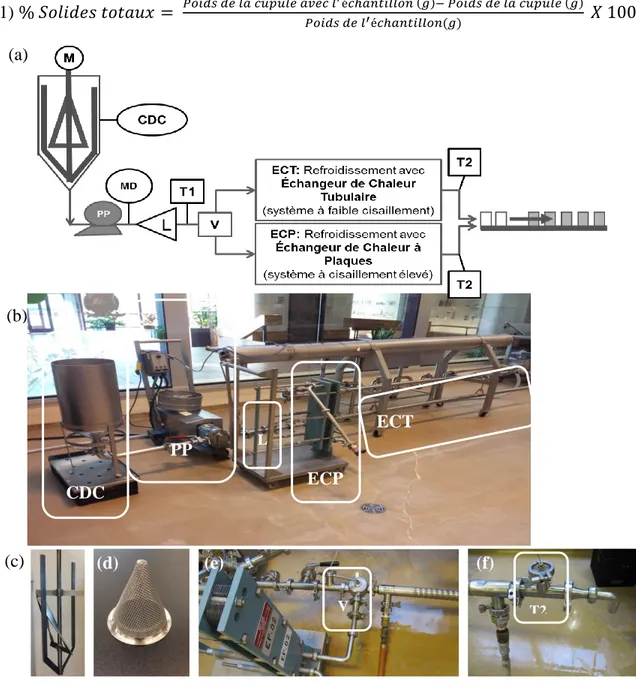
Figure 2.1 : (a) Schématisation du banc d’essai pilote : M, mélangeur à pales
hélicoïdales; CDC, cuve à déversoir conique; C, chicanes; PP, pompe à action positive; MD, manomètre digital; L, buse de lissage; T1, température à la sortie de la cuve; V, valve tri directionnelle; ECT, échangeur de chaleur tubulaire; ECP, échangeur de chaleur à plaques; T2, température à la sortie du refroidissement, (b) illustration du banc d’essai pilote complet et illustrations (c) du mélangeur à pales hélicoïdales (M), (d) de la buse de lissage (L), de la valve tri directionnelle (V) et (f) du thermocouple (T2) relié au coude à 90°C. ... 32
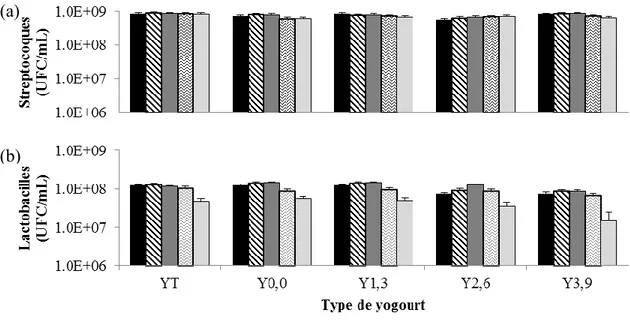
Figure 2.2 : Évolution de la population (a) des streptocoques et (b) des lactobacilles pour
les yogourts brassés à 14 (YT) et 16,5 % (Y0,0) de solides totaux sans gras et les yogourts brassés à 16,5 % de solides totaux contenant 1,3 (Y1,3), 2,6 (Y2,6) et 3,9 % (Y3,9) de matières grasses, pendant 34 jours d’entreposage à 4 °C. ... 37
Figure 2.3 : Évolution du pH pour les yogourts brassés à 14 (YT) et 16,5 % (Y0,0) de
solides totaux sans gras et les yogourts brassés à 16,5 % de solides totaux contenant 1,3 (Y1,3), 2,6 (Y2,6) et 3,9 % (Y3,9) de matières grasses, pendant 34 jours d’entreposage à 4 °C. ... 38
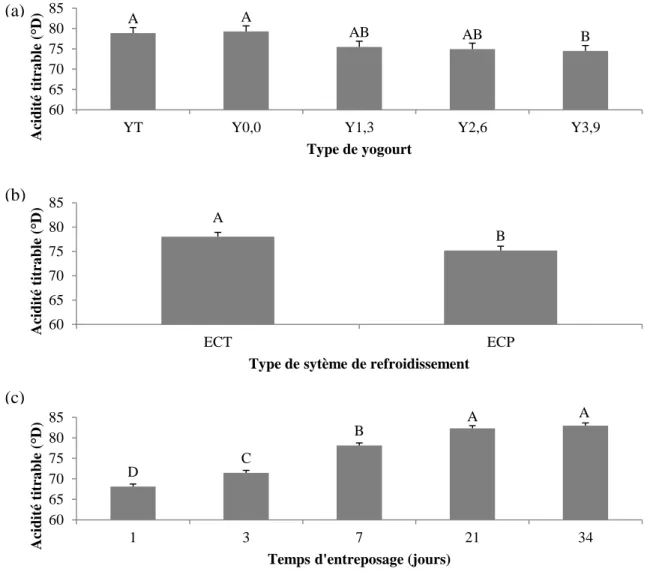
Figure 2.4 : Évolution de l’acidité titrable (a) pour les yogourts brassés à 14 (YT) et 16,5
% (Y0,0) de solides totaux sans gras et les yogourts brassés à 16,5 % de solides totaux contenant 1,3 (Y1,3), 2,6 (Y2,6) et 3,9 % (Y3,9) de matières grasses, (b) refroidis avec le système de refroidissement tubulaire (ECT) et à plaques (ECP) et (c) entreposés pendant 34 jours à 4 °C. ... 39
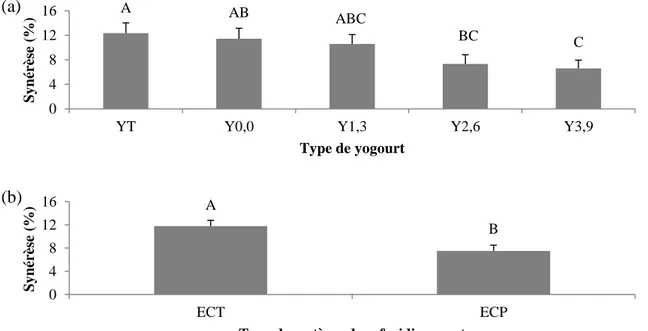
Figure 2.5 : Indice de synérèse (a) pour les yogourts brassés à 14 (YT) et 16,5 % (Y0,0)
de solides totaux sans gras et les yogourts brassés à 16,5 % de solides totaux contenant 1,3 (Y1,3), 2,6 (Y2,6) et 3,9 % (Y3,9) de matières grasses et (b) refroidis avec le système de refroidissement tubulaire (ECT) et à plaques (ECP). ... 40
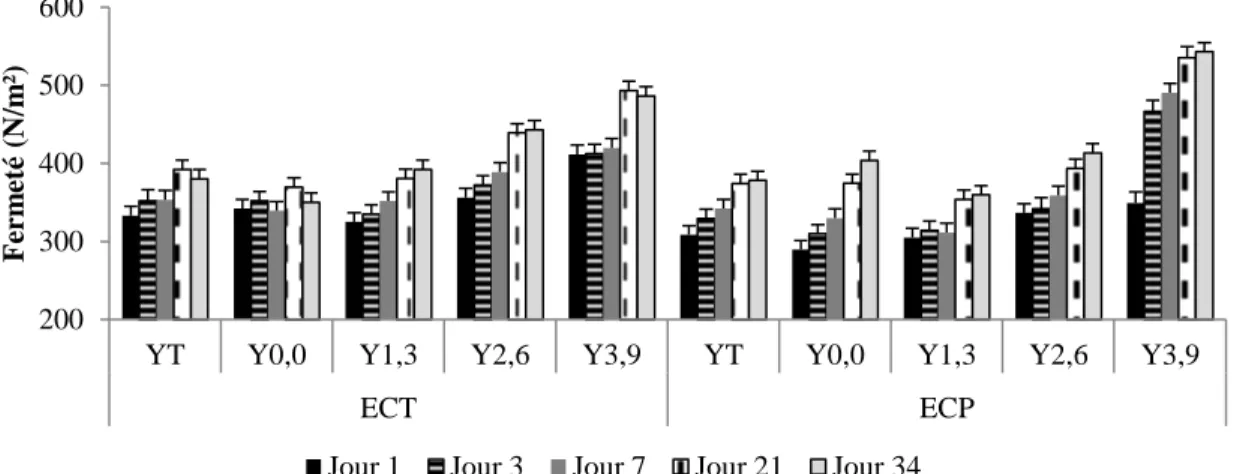
Figure 2.6 : Évolution de la fermeté pour les yogourts brassés à 14 (YT) et 16,5 % (Y0,0)
de solides totaux sans gras et les yogourts brassés à 16,5 % de solides totaux contenant 1,3 (Y1,3), 2,6 (Y2,6) et 3,9 % (Y3,9) de matières grasses, refroidis avec le système de refroidissement tubulaire (ECT) ou à plaques (ECP), pendant 34 jours d’entreposage à 4 °C. ... 42
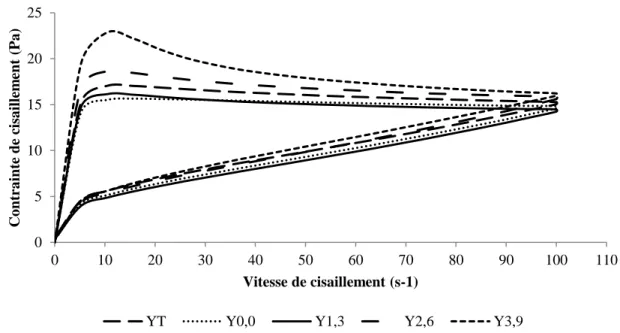
Figure 2.7 : Courbes d’hystérèse de 0 à 100 s-1 et de 100 à 0 s-1 obtenues pour les
yogourts brassés à 14 (YT) et 16,5 % (Y0,0) de solides totaux sans gras et les yogourts brassés à 16,5 % de solides totaux contenant 1,3 (Y1,3), 2,6 (Y2,6) et 3,9 % (Y3,9) de matières grasses. ... 43
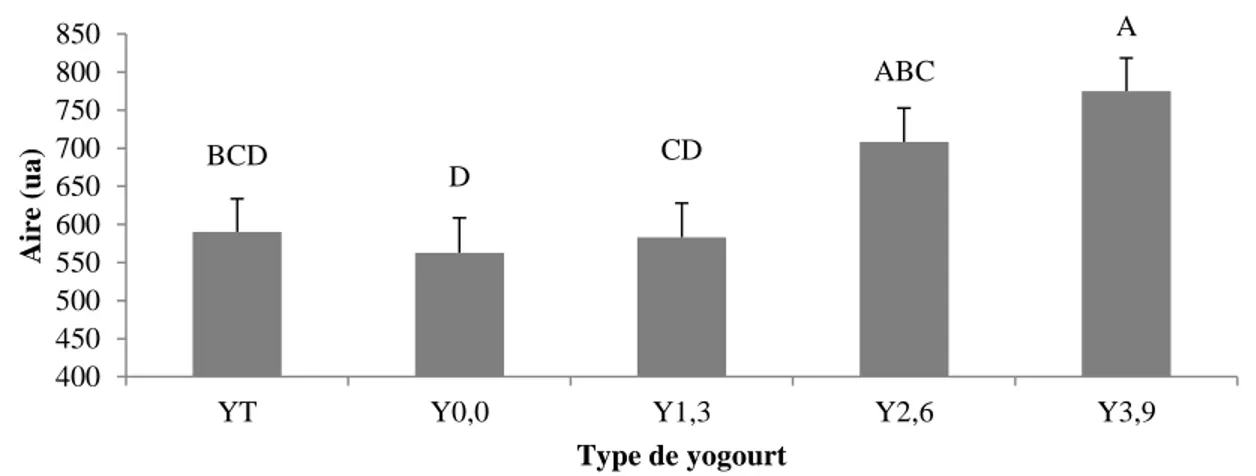
Figure 2.8 : Aire calculée des courbes d’hystérèse pour les yogourts brassés à 14 (YT) et
16,5 % (Y0,0) de solides totaux sans gras et les yogourts brassés à 16,5 % de solides totaux contenant 1,3 (Y1,3), 2,6 (Y2,6) et 3,9 % (Y3,9) de matières grasses... 44
Figure 2.9 : Évolution de la viscosité apparente à 10,5 s-1 (a) pour les yogourts brassés à 14 (YT) et 16,5 % (Y0,0) de solides totaux sans gras et les yogourts brassés à 16,5 % de solides totaux contenant 1,3 (Y1,3), 2,6 (Y2,6) et 3,9 % (Y3,9) de matières grasses et (b) durant 34 jours d’entreposage à 4 °C. ... 45
Figure 3.1 : (a) Schématisation du banc d’essai pilote : M, mélangeur à pales
hélicoïdales; C, chicanes; CDC, cuve à déversoir conique; PP, pompe à action positive; MD, manomètre digital; L, buse de lissage; T1, température à la sortie de la cuve; V, valve tri directionnelle; ECT, échangeur de chaleur tubulaire; ECP, échangeur de chaleur à plaques; T2, température à la sortie du refroidissement et (b) photogaphie du mélangeur à pales hélicoïdales jumelé aux chicanes à chaque extrémité. ... 64
Figure 3.2 : Courbes d’acidification des yogourts fermentés en quatre heures suite à une
inoculation à 2,05 % (ligne noire) et cinq heures suite à une inoculation à 1,35 % (ligne grise). ... 68
Figure 3.3 : Population des streptocoques dans les yogourts brassés (a) fermentés en 4 et
5h, (b) évolution de la population des lactobacilles durant l’entreposage à 4 °C des yogourts brassés à 0,0 (Y0,0) et 3,9% (Y3,9) de matières grasses et (c)refroidis par les systèmes de refroidissement tubulaires (ECT) et à plaques (ECP). ... 69
Figure 3.4 : Évolution du pH des yogourts brassés durant 34 jours d’entreposage à 4 °C.
... 70
Figure 3.5 : Évolution de l’acidité titrable durant 34 jours d’entreposage à 4 °C (a) des
yogourts brassés à 16,5 % de solides totaux contenant 0,0 (Y0,0) et 3,9 % (Y3,9) de matières grasses et (b) refroidis à l’aide des systèmes tubulaire (ECT) et à plaques (ECP). ... 71
Figure 3.6 : Indice de synérèse des yogourts brassés à 0,0 (Y0,0) et 3,9 % (Y3,9) de
matières refroidis avec les systèmes tubulaire (ECT) et à plaques (ECP). ... 72
Figure 3.7 : Évolution de la fermeté des yogourts brassés (a) refroidis avec les systèmes
de refroidissement tubulaire (ECT) et à plaques (ECP) à (b) 0,0 (Y0,0) et 3,9 % (Y3,9) de matières grasses pendant 34 jours à 4 °C. ... 73
Figure 3.8 : Évolution de la viscosité apparente à 10,5 s-1 des yogourts brassés à 0,0 (Y0,0) et 3,9 % (Y3,9) de matières grasses pendant 34 jours d’entreposage à 4 °C. ... 74
Liste des abréviations
CN : Caséines
CPL : Concentré de protéines de lactosérum ECP : Échangeur de chaleur à plaques ECT : .changeur de chaleur tubulaire EPS : Exopolysaccharides
GGH : Globules gras homogénéisés MG : Matières grasses (MF : milk fat) ML : Mélange laitier
PCC : Phosphate de calcium colloïdal PLÉ : Poudre de lait écrémé
PS : Protéines sériques
REF : Type de refroidissement SNG : Solides non gras
ST : Solides totaux (TS : total solids) TE : Temps d’entreposage
TF : Temps de fermentation (FT : fermentation time) YOG : Type de yogourt
Remerciements
J’aimerais d’abord remercier ma directrice Dre. Sylvie L. Turgeon pour avoir fait partie de son équipe durant ma maîtrise. Je remercie mon co-directeur Dr. Daniel St-Gelais pour ses précieux conseils et son support tout au long de mon projet. Je voudrais aussi remercier leur équipe respective pour leur soutien, pour avoir su me donner confiance et pour m’avoir supportée à travers ce périple qu’est la maîtrise.
Je tiens à remercier Annie Caron et Sophie Turcot pour m’avoir rapidement intégrée au sein de l’équipe. Elles m’ont été d’une grande aide et d’un grand support technique au laboratoire. À l’usine pilote, un chaleureux remerciement à Gaétan Bélanger qui a pris le temps de m’enseigner les premières étapes de production de yogourt. Sans l’équipe de Dr. Sébastien Villeneuve, le banc d’essai pilote n’aurait pas existé alors merci aussi à Dr. Sébastien Villeneuve, Dr. Stephan Grawboski, Dr. Mohammad Reza Zareifard et Louis-Philippe Des Marchais pour avoir participé à la réalisation de ce projet.
Merci aussi à tous les stagiaires et les étudiants aux études supérieures qui ont contribué à garder une ambiance de travail agréable et dynamique. Ma collègue et amie Valérie Guénard Lampron et moi-même avons évolué côte à côte durant nos maîtrises respectives. Je te remercie pour ces nombreux échanges de conseils et de réflexions et aussi pour avoir embarqué avec moi dans les moments plus cocasses mais surtout pour m’avoir soutenue dans les moments les plus durs. Merci à Marc-Olivier Leroux pour m’avoir donné des pistes de solutions et pour m’avoir encouragée à persévérer avec le sourire. Un merci tout spécial pour le travail assidu de ma stagiaire Mathilde Bentz. J’aimerais aussi remercier Joanie Côté pour m’avoir initiée aux différentes techniques d’analyses, pour tes précieux conseils et surtout, pour tes encouragements.
Je tiens également à souligner la générosité de Biena et Agropur pour nous avoir fait don des matières premières utilisées dans ce projet. Merci également la laiterie Chalifoux Inc. et Quadra Chemicals pour nous avoir approvisionné en lait et en ingrédients laitiers, respectivement. Merci aux partenaires financiers Novalait Inc., MAPAQ, FQRNT et AAC pour avoir permis de financer ce projet de recherche.
Finalement, un merci tout spécial à ma famille, mes ami(e)s, S. Jacqueline B., S. Jeanne-D’ Arc P. et S. Geneviève B. pour avoir gardé confiance en moi et m’avoir donné le courage et l’énergie pour réussir ce grand projet.
À mon filleul Avec de la volonté et de la persévérance
Avant-propos
Ce mémoire est composé de trois chapitres. Les chapitres deux et trois ont été entièrement écrits sous forme d’article scientifique, dont j’en suis la principale auteure. La totalité du projet a été effectuée au centre de recherche et de développement de St-Hyacinthe (AAC, St-St-Hyacinthe, QC, Canada) sous la supervision de Dre. Sylvie L. Turgeon, directrice et Dr. Daniel St-Gelais, co-directeur. Ils m’ont été d’une grande aide de par leur expertise et leurs conseils. J’ai effectué toutes les analyses, généré tous les résultats et fait la rédaction complète de ces articles.
Le premier chapitre, intitulé «Revue de littérature», fait l’état des connaissances actuelles sur la fabrication du yogourt brassé. La formation et la gélification du réseau protéique durant la fermentation lactique y est décrite. Les étapes pouvant modifier les propriétés physico-chimiques, texturales et rhéologiques du réseau protéique (standardisation et enrichissement du lait, homogénéisation, traitement thermique, temps de fermentation et conditionnement (brassage, refroidissement)) y sont aussi présentées. Ce chapitre se termine par la présentation de la problématique, du but, de l’hypothèse, de l’objectif général et des objectifs spécifiques.
Le deuxième chapitre présente l’impact de la teneur en matières grasses de yogourts qui ont été fermentés dans des cuves industrielles puis brassés, pompés, lissés et refroidis dans un banc d’essai pilote simulant les conditions de production en industrie. Le refroidissement a été effectué avec un échangeur de chaleur tubulaire ou à plaques pour créer un cisaillement faible et élevé, respectivement. Les résultats des analyses physico-chimiques, texturales et rhéologiques effectuées durant un entreposage à basse température ont permis de sélectionner le yogourt brassé qui formait le moins de synérèse et qui obtenait des valeurs de fermeté, d’hystérèse et de viscosité apparente les plus élevées pour étudier l’impact du temps de fermentation. Ce chapitre s’intitule «Impact de la teneur en solides totaux et en matières grasses ainsi que du type de refroidissement industriel sur les propriétés rhéologiques de yogourts brassés à l’aide d’un banc d’essai pilote».
Le troisième chapitre présente l’impact du temps de fermentation de yogourts avec et sans gras qui ont été brassés à l’aide du banc d’essai pilote utilisé au chapitre 2 et qui était
constitué de deux types de systèmes de refroidissement (tubulaire et à plaques). Les analyses de synérèse, de fermeté, d’hystérèse et de viscosité apparente ont été effectuées après le brassage et durant l’entreposage des différents yogourts brassés. Ce chapitre s’intitule «Impact de la teneur en matières grasses, du temps de fermentation et du système de refroidissement sur les propriétés rhéologiques de yogourts brassés avec un banc d’essai pilote».
Le mémoire se termine par une conclusion générale présentant l’avancement des connaissances générées suite à la réalisation de ce projet. Les perspectives sur de nouveaux questionnements et améliorations à apporter pour des projets futurs y sont aussi décrites.
Introduction générale
Le secteur de l’agriculture et de l’agroalimentaire occupe une place importante au Canada. Parmi les différentes catégories d’aliments ce sont surtout le porc et les produits laitiers qui sont à l’honneur au Québec (Agriculture et Agroalimentaire Canada (AAC) (2015b)). Parmi les produits laitiers, les dernières statistiques révèlent que plus de 30 000 tonnes de yogourt par année ont été produites au Canada, dont la majorité provenait du Québec (Statistique Canada (2016)). Le Guide alimentaire canadien recommande de consommer deux portions de produits laitiers et substituts. Un yogourt (175 g) par jour suffit à combler une portion sur deux chez les gens âgés entre 19 et 50 ans (Santé Canada (2008)). Depuis plusieurs années le yogourt a été l’aliment de choix pour y introduire des probiotiques et des acides gras oméga-3 et en faire un produit santé naturel (Agriculture et Agroalimentaire Canada (AAC) (2015a)). Un choix diversifié de saveurs est disponible et la teneur en matières grasses des yogourts peut varier entre 0 et 10% (Danone)).
La présence de synérèse ainsi qu’une fermeté et une viscosité faibles sont reconnues comme étant des défauts de qualité chez les consommateurs et les producteurs. Pour remédier à ces problèmes, les propriétés physico-chimiques, texturales et rhéologiques du yogourt ont fait l’objet de nombreuses études depuis plusieurs années (Driessen, F. M., Ubbels, J., et al. (1977), Ramaswamy, H. S.et Basak, S. (1992), Rohm, H.et Kovac, Alesa (1994)). La majorité de ces recherches a porté sur des yogourts de type ferme et sans gras (De Brabandere, Anne G.et De Baerdemaeker, Josse G. (1999), Hassan, A. N., Ipsen, R.,
et al. (2003), Lee, W. J.et Lucey, J. A. (2003)). Quelques études ont démontré que la
présence de matières grasses permettait d’augmenter la fermeté et la viscosité des yogourts (Brauss, M.S., Linforth, R.S.T., et al. (1999), Tamime, A. Y., Barrantes, E., et al. (1996)) tandis que d’autres études ont démontré que le temps de fermentation pouvait aussi modifier les propriétés rhéologiques du yogourt (De Brabandere, Anne G.et De Baerdemaeker, Josse G. (1999), Lee, W. J.et Lucey, J. A. (2004), Peng, Y., Horne, D. S.,
et al. (2009)).
Par contre, très peu d’études portent sur le yogourt de type brassé (Marafon, A. P., Sumi, A., et al. (2011), Serra, M., Trujillo, A. J., et al. (2009)). Contrairement aux yogourts
fermes où la fermentation se fait directement dans les pots de consommation, chez le producteur industriel de yogourts brassés, la fermentation se fait directement dans des cuves industrielles. Par la suite, le yogourt subi différentes étapes de brassage, de pompage, de lissage et de refroidissement avant sa mise en pots. Il est difficile de recréer en laboratoire les conditions de brassage industrielles. Les études sur le yogourt brassé rapportées dans la littérature sont souvent sans gras et brassés à l’aide de cuillères, de disques perforés ou de mélangeurs électriques. Si ces méthodes de brassage en laboratoire peuvent être standardisées et reproduites avec précision, elles ne représentent pas la complexité d’un brassage qui comporte des étapes successives de brassage et de cisaillement (brassage en cuve, pompage, lissage, refroidissement et écoulement dans les tuyaux) ayant un impact cumulatif important sur les propriétés des yogourts.
Le but de ce projet était de comprendre la relation qui existe entre des yogourts contenant différentes teneurs en solides totaux et en matières grasses, produits en différents temps de fermentations et qui ont été brassés avec un banc d’essai pilote simulant le procédé de fabrication industriel (brassage en cuve, pompage, lissage, refroidissement et entreposage à basse température) et refroidis par un échangeur de chaleur tubulaire ou à plaques causant un cisaillement faible ou élevé, respectivement.
Chapitre 1: Revue de littérature
1.1 Le lait et le yogourt
Le lait, dont le pH naturel se situe près de 6,7, a une composition qui peut varier, entre autres, avec les saisons et les races. Généralement, il est constitué de 87,5% d’eau, 2,7 % de caséines (CN), 0,6 % de protéines sériques (PS), 4,7 % de lactose, 0,7 % de minéraux (calcium, phosphore, magnésium et potassium), de traces de vitamines (riboflavine et B12) et de 3,3 % de matières grasses (MG) (Amiot, J., Fournier, S., et al. (2010), Brisson, J.et Roy, R. (2008), Lee, W. J.et Lucey, J. A. (2010)). Les CN κ, β et α sont associées sous forme micellaire et sont stabilisées par des interactions hydrophobes et des liaisons hydrogène, des répulsions électrostatiques et de la présence de phosphate de calcium colloïdal (PCC) (Dalgleish, D. G.et Corredig, M. (2012)). La taille moyenne des micelles de CN est de 150 nm mais, elle peut varier entre 100 et 500 nm de diamètre et son point isoélectrique est de pH 4,6. À l’état natif, les CN-κ retrouvées à la surface des micelles sont chargées négativement, ce qui cause des répulsions électrostatiques entre les micelles de CN dans le lait. Les PS, dont le point isoélectrique est de pH 5,3, constituées principalement de β-lactoglobulines et d’α-lactalbumines jouent un rôle important durant la formation du réseau protéique, qui sera détaillé dans la section suivante. Le lactose est utilisé par les bactéries lactiques thermophiles pour produire de l’acide lactique et ainsi réduire le pH du lait durant la fermentation.
Le lait entier peut être utilisé comme breuvage ou transformé en de nombreux produits laitiers (crème, beurre, ingrédients laitiers, yogourts). La transformation du lait par fermentation lactique permet, entre autres, de produire plusieurs types de yogourts (brassé et ferme, à boire, glacé, séché) mais, les yogourts les plus populaires qui sont produits et consommés au Canada sont de type ferme et brassé.
1.2 Fermentation et gélification du lait
La fermentation du lait débute avec l’inoculation des bactéries thermophiles
Streptococcus thermophilus et Lactobacillus delbrueckii ssp. bulgaricus spécifiquement
pour pouvoir obtenir l’appellation de yogourt (Institut canadien d'information juridique (2017), World Health Organization (WHO)et Food and Agriculture Organization of the
United Nations (FAO) (2011)). Ces deux bactéries sont normalement utilisées dans des ratios prédéterminés qui permettent d’obtenir des yogourts avec différentes acidités. Les consommateurs canadiens préfèrent normalement des yogourts peu acides. Il est important de considérer le pouvoir acidifiant plus élevé des lactobacilles et les températures optimales de chaque type de bactérie afin de bien contrôler le temps et la vitesse de fermentation ainsi que l’acidité finale désirée. Les valeurs de température et de pH optimales pour la croissance des streptocoques se situent entre 37 et 40 °C et entre 6,0 et 6,5 unités de pH, respectivement tandis que pour les lactobacilles la température se situe entre 47 et 48 °C et le pH entre 5,5 et 6,0 (Beal, Catherine, Louvet, Philippe, et al. (1989)). Les streptocoques peuvent réduire le pH jusqu’à 4,5 tandis que les lactobacilles peuvent diminuer le pH jusqu’à 3,6 (Beal, C., Skokanova, J., et al. (1999), Lamontagne, M., Champagne, C.P., et
al. (2010)). De ce fait, la majorité des producteurs de yogourt au Canada utilisera des
cultures lactiques mixtes avec un nombre plus élevé de streptocoques afin d’éviter une sur-acidification par les lactobacilles (Lamontagne, M. (2010)).
La formation et la gélification du réseau protéique ont été étudiées par plusieurs auteurs dont (Dalgleish, D. G.et Corredig, M. (2012)), Lee, W. J.et Lucey, J. A. (2010)), Phadungath, C. (2005)), Shaker, R. R., Jumah, R. Y., et al. (2000))). La formation de liens entre les PS et les micelles de CN débute durant le traitement thermique lorsque les groupements thiols des PS dénaturées sont exposés et se lient aux groupements thiols des CN-κ situés à la surface des micelles de CN, permettant la formation des ponts disulfures (complexe PS-CN-κ). Après l’inoculation des bactéries lactiques thermophiles dans le lait, il se produit une réduction graduelle du pH suite à la production d’acide lactique à partir de la dégradation du lactose. Entre un pH de 6,7 et 6,0, les répulsions électrostatiques sont réduites puisqu’il y a une diminution de la charge négative des CN-κ. Le PCC présent dans les micelles de CN commence à se solubiliser mais, pas suffisamment pour modifier l’intégrité des micelles. Entre un pH de 6,0 et 5,3, il y a une déstabilisation des micelles de CN causée par une diminution des répulsions électrostatiques, ce qui permet entre autres, aux micelles de se rapprocher et de se lier (CN-κ-CN-κ). Lorsque le pH atteint une valeur de 5,3, coïncidant avec le point isoélectrique des PS, l’agrégation des PS entre elles (PS-PS) et la formation de liens entre les complexes de CN-κ-PS (CN-κ-PS-PS-CN-κ) provoque le début de la gélification du réseau protéique. Entre un pH de 5,3 et 4,7, le PCC
lié aux CN-β et aux CN-α est complètement solubilisé, ce qui crée une expansion des micelles de CN. Lorsque le pH approche une valeur de 4,7, il y a une réorganisation des micelles de CN, une augmentation des interactions électrostatiques et des interactions hydrophobes entre les molécules de CN. À ce pH, les liens non covalents (hydrophobes, ioniques, hydrogènes et Van der Waal) entre les protéines forment un réseau protéique sous forme de gel.
Un réseau protéique dense aura une porosité moins élevée et une capacité de rétention d’eau supérieure à un réseau moins dense et plus poreux (Lee, W. J.et Lucey, J. A. (2010), Peng, Y., Horne, D. S., et al. (2009)). Körzendörfer, Adrian, Temme, Philipp,
et al. (2016) ont démontré que, suite à la formation du réseau protéique gélifié, la taille des
agrégats protéiques peut atteindre jusqu’à 5 mm de diamètre. Plus le réseau protéique formé est fort et résistant à la déformation, plus il sera apte à conserver le lactosérum à l’intérieur, ce qui diminue la synérèse spontanée à la surface des yogourts (Lee, W. J.et Lucey, J. A. (2003), Ramchandran, L.et Shah, N. P. (2009)). La stabilité du réseau protéique dépend du nombre et de la force des liens hydrophobes et des interactions électrostatiques créés entre les protéines durant la fermentation. Plus le nombre de liens augmente, plus le seuil d’écoulement est élevé, ce qui signifie qu’une plus grande force doit être appliquée pour initier l’écoulement du yogourt. Au contraire, un seuil d’écoulement faible démontre que le réseau protéique est instable (Lee, W. J.et Lucey, J. A. (2010), Lucey, John A., Teo, Cheng Tet, et al. (1997)). Pour réduire la synérèse et modifier les propriétés rhéologiques d’un yogourt, il est possible d’optimiser les paramètres de production de yogourt en modifiant la composition du mélange laitier, la pression et la température d’homogénéisation et de traitement thermique ou en modifiant le taux d’inoculation et la durée de la fermentation.
1.3 Optimisation des étapes de production du yogourt
Le lait, utilisé comme seul ingrédient pour la fabrication de yogourt, n’est pas suffisamment riche en protéines et en solides totaux pour obtenir un réseau protéique dense et stable (Le, Thien Trung, van Camp, John, et al. (2011)), permettant de bien retenir le lactosérum, et d’obtenir une fermeté et une viscosité qui répondent aux attentes des consommateurs canadiens. Au Québec, la loi stipule que le yogourt doit contenir un
minimum de 9,5% de solides non gras et 3,0% de protéines laitières (Ministère de l'Agriculture, des Pêcheries et de l'Alimentation du Québec (MAPAQ) (2016)). Les teneurs en CN, PS, MG, solides totaux (ST) et le ratio CN/PS sont déterminées par les transformateurs laitiers selon leur propres critères mais, ils doivent respecter les normes d’un minimum de 2,7% de protéines laitières et d’un maximum de 10% de MG pour utiliser l’appellation yogourt selon le Codex Alimentarius (World Health Organization (WHO)et Food and Agriculture Organization of the United Nations (FAO) (2011)). (Tamime, A.Y.et Robinson, R.K. (2007)) suggèrent qu’une teneur en ST entre 15 et 16% est optimale pour obtenir une fermeté et une viscosité élevées mais, qu’il est plus fréquent de retrouver des yogourts entre 14 et 15% de ST sur le marché. L’enrichissement du lait en ST tels des protéines et des MG est donc nécessaire pour atteindre ces cibles, et réduire la synérèse et augmenter la fermeté et la viscosité des yogourts. Cet enrichissement est fait avec des ingrédients laitiers qui sont présentés dans la section suivante.
1.3.1 Ingrédients laitiers
Le lait contient généralement 12,5% de ST, ce qui n’est pas suffisant pour obtenir des yogourts fermes et visqueux avec peu de synérèse. Plusieurs ingrédients laitiers concentrés existent pour enrichir le lait en protéines (CN, PS) et en ST. Parmi les différents ingrédients laitiers, les poudres de lait écrémé (PLÉ), les concentrés de protéines de lactosérum (CPL), le lactose et la crème sont les plus populaires chez les producteurs de yogourts. Une fois que les ingrédients laitiers ont été sélectionnés et que leurs proportions ont été déterminées, ils sont incorporés dans le lait afin d’être réhydratés avant les étapes d’homogénéisation et de traitement thermique qui jouent un rôle important sur la réduction de la taille des globules gras et la dénaturation des protéines du lait.
La PLÉ provenant de l’écrémage du lait entier, est une source principale de CN très utilisée par les producteurs de yogourts. Après l’écrémage du lait entre 50 et 60°C, le lait écrémé subit un traitement thermique à différentes températures (entre 70 et 135 °C) selon le degré de dénaturation des PS qui est recherché et il est séché par atomisation pour obtenir de la PLÉ (Canadian Dairy Commission (CDC) (2011), Michel, J.-C., Pouliot, M., et al. (2010)). La PLÉ a la même composition qu’un lait écrémé, excepté que l’eau a été presqu’entièrement retirée, ce qui permet de concentrer les constituants du lait écrémé. Par
contre, l’augmentation de la température du séchage a un impact sur la réduction de la solubilité des PS (Canadian Dairy Commission (CDC) (2011)). La fabrication de yogourt nécessite une bonne solubilisation des PS pour former un réseau protéique stable et permettre de retenir le lactosérum. De ce fait, il est préférable d’utiliser une PLÉ qui a subi un traitement thermique à basse température plutôt qu’à haute température pour enrichir le lait écrémé en CN.
Les CPL sont la source de PS privilégiée par les producteurs de yogourts. Les CPL sont généralement issus de l’ultrafiltration du lactosérum de fromage suivi d’une évaporation et d’un séchage. Il existe deux types de CPL selon l’origine du lactosérum. Lorsqu’il provient d’une coagulation par l’effet de la présure (cheddar, mozzarella), le lactosérum doux récupéré est relativement peu acide. Par contre, la fabrication de fromages de type cottage ou pâte molle génèrent un lactosérum acide (Britten, M. (2010)). Qu’il soit doux ou acide, les proportions de protéines sériques (α-lactalbumine et β-lactoglobuline) dans le CPL ne sont pas différentes de ce qui est retrouvé dans les deux types de lactosérum (Arunkumar, Abhiramet Etzel, Mark R. (2015), Michel, J.-C., Pouliot, M., et al. (2010)). Cependant, Turhan, K. N.et Etzel, M. R. (2004) mentionnent que comparativement au CPL doux, le CPL acide contient plus de minéraux le rendant moins intéressant pour la production de yogourt. Le CPL de type doux est donc normalement utilisé dans les mélanges laitiers (ML) à yogourt puisqu’il permet d’augmenter la teneur en PS dans le ML à yogourt sans augmenter la teneur en minéraux. Il existe deux catégories de CPL selon leur teneur en protéines : les concentrés (30-90%) et les isolats (> 90%). Delikanli, Berraket Ozcan, Tulay (2014) ont démontré que l’utilisation des concentrés de PS permettait d’obtenir un yogourt de type ferme ayant une bonne fermeté et peu de synérèse. L’utilisation d’un concentré CPL34 doux offre une bonne teneur en PS (34%) et contient généralement 46% de lactose et 8% de minéraux (Britten, M. (2010)) qui permettront d’augmenter la teneur en PS du lait et d’obtenir un yogourt ferme et visqueux. Ensemble, les CN et les PS jouent un rôle important durant la formation du réseau protéique et le nombre de liens créés entre ces protéines est tributaire de l’homogénéisation et surtout du traitement thermique subi.
Le lactose en poudre de grade alimentaire contient généralement 99% de ST. Ce sucre est utilisé pour ajuster la teneur en ST sans ajouter de protéines comme les concentrés laitiers en poudre. Le lactose a un pouvoir sucrant inférieur au glucose, ce qui évite un goût trop sucré et donne un caractère hygroscopique aux PS (Britten, M. (2010)). Meletharayil, Gopinathan H., Patel, Hasmukh A., et al. (2016) ont démontré que l’augmentation de la teneur en lactose de 5,6 à 11,2% dans un lait reconstitué et acidifié avec du glucono-delta-lactone permettait de former un réseau protéique plus dense et moins poreux. Leurs yogourts de type ferme contenant plus de lactose avait une capacité de rétention d’eau et un module élastique G’ supérieurs comparativement au yogourt sans ajout de lactose.
Les ingrédients laitiers en poudre permettent aussi d’augmenter la teneur en ST. Lee, W. J.et Lucey, J. A. (2010) rapportent qu’une augmentation des teneurs en ST par l’ajout de PLÉ favorise l’augmentation du module élastique G’ et de la viscosité des yogourts fermes. Généralement, les ingrédients laitiers en poudre sont combinés pour optimiser les avantages et limiter les défauts de chacun des ingrédients laitiers. Akalin, A. S., Unal, G., et al. (2012) et Remeuf, F., Mohammed, S., et al. (2003) rapportent que la PLÉ est le principal ingrédient laitier utilisé pour enrichir le lait en CN et PS. Par contre, ces auteurs ont démontré que les yogourts de type ferme enrichis avec de la PLÉ avaient des valeurs de synérèse plus élevées et des valeurs de fermeté et de viscosité apparente inférieures comparativement à un yogourt enrichi avec du CPL. L’utilisation combinée de la PLÉ et du CPL permettait donc d’enrichir le yogourt en CN et en PS, respectivement, ce qui réduirait la synérèse et augmenterait la fermeté et la viscosité des yogourts. Jorgensen, Camilla Elise, Abrahamsen, Roger K., et al. (2015) ont aussi démontré que la standardisation des ML à un ratio CN : PS de 55 : 45 créait un réseau protéique moins dense et plus granuleux comparativement à un yogourt dont le ratio était de 75 : 25. Amatayakul, T., Sherkat, F., et al. (2006b) ajoutent que des yogourts de type fermes à 14% de ST et avec un ratio CN : PS de 4 : 1 avaient une fermeté plus élevée comparativement à un yogourt à 9% de ST et avec un ratio de 1 : 1. Par contre, les auteurs rapportent que les yogourts ayant un ratio de 4 : 1 avaient des valeurs de synérèse plus élevées. La réduction du ratio CN : PS à 3 : 1 permettrait d’obtenir un juste milieu entre une fermeté élevée (ratio 4 : 1) et une synérèse moins élevée (ratio 1 : 1).
Sur le marché canadien, on retrouve surtout des yogourts contenant des teneurs en MG entre 0 et 2%, mais quelques yogourts se démarquent avec une teneur en MG allant jusqu’à 10%. De la crème, riche en MG, est normalement utilisée pour ajuster la teneur en MG dans ces yogourts. La présence de MG, après avoir été homogénéisée, permet généralement d’augmenter les propriétés texturales et rhéologiques des yogourts fermes et brassés tout en réduisant la formation de synérèse (Krzeminski, A., Tomaschunas, M., et
al. (2013), Sodini, I., Remeuf, F., et al. (2004), Sonne, Alina, Busch-Stockfisch, Mechthild, et al. (2014)). En présence de MG, le réseau protéique formé est plus dense et plus stable
comparativement à un yogourt faible ou sans gras. Dans le réseau protéique, les globules gras homogénéisés (GGH) sont uniformément répartis et agissent en tant qu’agent de liaison avec les CN et les PS, mais également en tant qu’agent de remplissage dans les cavités (pores) du réseau protéique (Xu, Z. M., Emmanouelidou, D. G., et al. (2008)).Par contre, il faut également tenir compte de la teneur en protéines. Velez-Ruiz, Jorge F., Hernandez-Carranza, Paola, et al. (2013) ont démontré qu’un yogourt à 3% MG et 3,34% de protéines peut démontrer plus de synérèse qu’un yogourt à 1% MG et 4,05% de protéines (40,6% vs 33,0%). L’augmentation de la teneur en MG contribuerait à augmenter les liaisons entre les CN, les PS et les GGH dans le gel qui serait donc plus dense et moins poreux. Brauss, M.S., Linforth, R.S.T., et al. (1999) ont démontré que la taille des agrégats protéiques diminuait dans le réseau gélifié en présence de MG, ce qui permettait d’augmenter la viscosité et de diminuer la synérèse. À 10% de solides non gras (SNG) et 0 et 4% de MG, la surface des agrégats augmentait de 10 à 500 µm² tandis que la surface des pores entre les agrégats protéiques diminuait de 100 à 10 µm². Par contre, à 20% de SNG, la surface des agrégats variait entre 650 et 500 µm² tandis que la surface des pores était stable à 100 µm². Cela signifie qu’à un taux de SNG élevé, l’effet de la teneur en MG est atténué par la présence des protéines (Pereira, Rogerio, Matia-Merino, Lara, et al. (2006)). Brauss, M.S., Linforth, R.S.T., et al. (1999) ont mesuré la taille des particules de gel dans des yogourts fermes à 0,2 et 10,0% de MG. Ils ont démontré qu’un yogourt à 0,2% de MG contenait des particules trois fois plus grosses comparativement à un yogourt à 10% de MG. Ces auteurs ont déterminé que la viscosité du yogourt riche en MG (10%) était supérieure au yogourt faible en MG (0,2%). Smoczyński, Michałet Baranowska, Maria (2014) ainsi que Yoon, Won B.et McCarthy, Kathryn L. (2002) rapportent que dans
un yogourt faible en gras, la majorité des protéines sera impliquée dans la formation du réseau protéique par des liaisons PS-PS, CN-CN et PS-CN. Dans un yogourt riche en gras, une fraction des protéines, surtout les CN, est répartie sur les membranes des GGH. Il resterait donc moins de CN disponibles pour former des agrégats protéiques comparativement au yogourt faible en gras.
1.3.2 Homogénéisation et traitement thermique
Les globules de gras natifs ont une densité inférieure comparativement aux autres composés du lait, ce qui cause une séparation des MG qui remontent à la surface du lait. L’homogénéisation permet de réduire la taille des globules gras et l’adsorption de protéines à leur surface (Velez-Ruiz, J. F.et Barbosa Canovas, G. V. (1997)). Cela évite une séparation des MG et confère aux GGH un rôle actif durant la formation du réseau protéique. L’homogénéisation peut se faire à différentes combinaisons de pression et de température. Nguyen, Hanh Thi Hong, Ong, Lydia, et al. (2015) ont démontré qu’une homogénéisation aussi faible que 8-16 MPa était suffisante pour réduire l’indice de synérèse dans des yogourts fermes comparativement à un contrôle non homogénéisé. À l’opposé, une haute pression d’homogénéisation (> 200 MPa) augmente aussi la fermeté et la viscosité des yogourts, mais l’indice de synérèse augmente également (Ciron, C. I. E., Gee, V. L., et al. (2010), Ciron, Chr Ian E., Gee, Vivian L., et al. (2011), Ferragut, V., Cruz, N. S., et al. (2009)). Cano-Ruiz, M. E.et Richter, R. L. (1997) ont démontré qu’en général, l’augmentation de la pression d’homogénéisation de 30 à 90 MPa de laits standardisés à 1,5 et 3,0% de MG entrainait une réduction de la taille des GGH (0,45 vs 0,19 µm) ce qui correspondait à une augmentation de la charge protéique (principalement des micelles de CN) adsorbée à la surface des GGH (6,12 vs 11,88 mg/m²). De plus, ces auteurs ont démontré qu’une température d’homogénéisation de 65 °C était plus favorable à l’augmentation de la charge protéique comparativement à une température de 85 °C. Cho, Y. H., Lucey, J. A., et al. (1999) ajoutent que, selon le type d’ingrédient laitier en poudre utilisé pour enrichir le yogourt, la charge protéique sur les GGH sera différente. Par exemple, ces auteurs ont démontré que dans un lait écrémé reconstitué avec de la PLÉ et ajusté à 10% de MG, l’enrichissement avec de la PLÉ permettait une adsorption des protéines sur les membranes des GGH pouvant aller jusqu’à 7 mg/m2 tandis que
L’augmentation du nombre de protéines adsorbées à la surface des GGH peut avoir un impact important durant la formation du réseau protéique à l’étape de fermentation. Une homogénéisation à 13,80 MPa et à 60 °C devrait permettre de réduire la taille des globules gras et un deuxième passage à 3,45 MPa devrait permettre de séparer les amas de GGH pouvant s’être formés après le premier passage du ML dans le système d’homogénéisation (Hardham, J.F., Imison, B.W., et al. (2000)). Une fois homogénéisé, le ML subit un traitement thermique.
L’objectif principal du traitement thermique est de détruire les microorganismes pathogènes et de réduire la microflore indésirable, ce qui, par le fait même, réduit la compétition des nutriments pour les bactéries lactiques utilisées dans la production du yogourt. Le chauffage du lait contribue aussi à diminuer la quantité d’oxygène dissout dans le lait, ce qui favorise la croissance des bactéries lactiques qui y sont sensibles durant l’étape de fermentation (Lee & Lucey, 2010).
Le traitement thermique permet aussi de dénaturer les PS afin qu’elles puissent contribuer à la formation du réseau protéique durant la fermentation (Küçükcetin, A. (2008), Lee, W. J.et Lucey, J. A. (2003)). Au pH naturel du lait, 6,7, le traitement thermique permet de dénaturer les β-lactoglobuline. Une grande partie de ces β-lactoglobuline vont se lier aux CN tandis qu’une minorité pourra former des agégats de PS. Par contre, seulement une faible proportion d’α-lactalbumine se lie aux CN suite au traitement thermique. La majorité conservera son état natif (Vasbinder, Astrid J.et de Kruif, Cornelis G. (2003)). La dénaturation des PS permet d’exposer leurs groupements hydrophobes et de former des ponts disulfures. Le PCC présent dans les micelles de CN se solubilise et va permettre de réduire les charges négatives des groupes phosphoryles des PS, ce qui réduit la répulsion entre les PS et les micelles de CN et favorise le début de la formation de liaisons entre les protéines (Horne, D. S. (1998), Peng, Y., Horne, D. S., et al. (2009)). Ces nouvelles interactions hydrophobes et la formation de ponts disulfures permettent de créer de nouveaux agrégats protéiques pouvant s’associer. Par exemple, des agrégats de PS se forment dès le chauffage du lait et se situent dans la phase soluble mais, également à la surface des CN suite à leur attachement aux CN-κ selon plusieurs voies décrites par Famelart, M. H., Guyomarc’h, F., et al. (2011). Le traitement thermique, généralement
effectué à 85 °C pendant 30 minutes ou à 90-95 °C pendant cinq minutes, permet d’augmenter la capacité de rétention d’eau, la fermeté et la viscosité des yogourts fermes comparativement à un yogourt dont le lait n’a pas subi de traitement thermique. Un traitement thermique de 90 °C pendant 10 minutes permet de former des amas de PS plutôt sphériques et ces derniers peuvent atteindre un diamètre de 70 nm (Guggisberg, D., Eberhard, P., et al. (2007), Jorgensen, Camilla Elise, Abrahamsen, Roger K., et al. (2015), Lee, W. J.et Lucey, J. A. (2010), Shaker, R. R., Jumah, R. Y., et al. (2000)). L’augmentation de la température du traitement thermique de 85 °C à 95 °C, pendant quatre minutes contribue aussi à augmenter la taille des particules formées, ce qui contribue à l’obtention d’un réseau plus poreux associé à une viscosité apparentedes yogourts brassés plus élevée (Cayot, Philippe, Schenker, Flore, et al. (2008)). Par contre, un traitement thermique à température trop basse conduit à la formation d’un réseau protéique avec une structure faible et fragile tandis qu’une température trop élevée causera une diminution de la fermeté du yogourt et sa texture sera plus granuleuse (Sodini, I., Remeuf, F., et al. (2004)). En présence de MG, le traitement thermique permet à une fraction des PS dénaturées de se lier à la fois aux micelles de CN présentes dans le ML et à la surface des GGH homogénéisés, ce qui permet à ces derniers de participer activement à la structure du réseau protéique. Le nombre d’interactions possibles entre les PS, les CN et les GGH est ainsi augmenté Lee, W. J.et Lucey, J. A. (2010). Un traitement thermique à 94,5 °C pendant cinq minutes devrait être suffisant pour éliminer les microorganismes indésirables et/ou pathogènes et pour dénaturer la majorité des PS avant de passer à l’étape de fermentation (Sodini, I., Remeuf, F., et al. (2004)).
1.3.3 Culture lactique et paramètres de fermentation
Plusieurs types de souches peuvent être ajoutées au ferment afin d’améliorer les propriétés texturales du yogourt. Par exemple, il est possible d’ajouter des souches bactériennes produisant des exopolysaccharides (EPS). Ces dernières peuvent avoir ou non un pouvoir filant qui affecte les propriétés rhéologiques du yogourt (Abbasi, Habib, Mousavi, Mohammad Ebrahimzadeh, et al. (2009), Amatayakul, T., Halmos, A. L., et al. (2006a), Mende, Susann, Mentner, Claudia, et al. (2012)). La présence d’EPS peut nuire à la formation du réseau protéique s’ils sont incompatibles avec les protéines ce qui peut mener à un yogourt de type ferme avec une fermeté plus faible (Ramchandran, L.et Shah,
N. P. (2009)). Les yogourts avec EPS ne se comportent pas comme les yogourts sans EPS. La présence d’EPS peut abaisser la viscosité apparente du yogourt ferme pendant l’entreposage (Smoczyński, Michałet Baranowska, Maria (2014)). Les EPS pourraient donc modifier les propriétés physico-chimiques, texturales et rhéologiques des yogourts et camoufler l’impact des MG dans les yogourts avec et sans gras. Il serait préférable d’utiliser une culture lactique mixte produisant le moins possible d’EPS possible, et non filant de préférence, pour être en mesure d’isoler le rôle de la teneur en MG dans les yogourts brassés qui font l’objet de cette recherche.
Après le traitement thermique, la température du ML est abaissée à la température de fermentation désirée. La température optimale de croissance des streptocoques se situe près de 40 °C et celle des lactobacilles près de 45 °C selon les souches utilisées (Beal, Catherine, Louvet, Philippe, et al. (1989)). La production du yogourt devrait donc se faire à une température variant entre 37 et 45 °C pour favoriser leur croissance. Une température de fermentation supérieure à 40 °C favorise les interactions hydrophobes entre les protéines, la croissance des lactobacilles et accélère la vitesse de fermentation. De plus, le réseau protéique créé à une température supérieure à 40 °C a un seuil de cisaillement plus élevée comparativement à un réseau protéique formé à plus basse température. Une température de fermentation élevée provoque un réarrangement protéique après la gélification des protéines, le rendant plus fragile, ce qui diminue la capacité de rétention d’eau et le module élastique G’ (Lee, W. J.et Lucey, J. A. (2004), Lee, W. J.et Lucey, J. A. (2010), Sodini, I., Remeuf, F., et al. (2004)). D’une autre côté, une température inférieure à 40 °C favorise plutôt la croissance des streptocoques et ralentit la vitesse de fermentation. Dans ces conditions, les CN forment davantage de liaisons, ce qui augmente la taille des agrégats de CN. Le réseau gélifié formé contient alors plus de liens protéiques le rendant plus dense et stable, ce qui permet d’obtenir des propriétés texturales et rhéologiques plus élevées (Lee, W. J.et Lucey, J. A. (2010)). En tenant compte des températures optimales de croissance des bactéries lactiques et de la formation du réseau protéique en fonction de la température, une fermentation à 40 °C semblerait être optimale pour obtenir un yogourt ayant des propriétés texturales et rhéologiques élevées. Par contre, ces propriétés peuvent changer selon le taux d’inoculation utilisé.
Il a été mentionné précédemment que le pH naturel du lait est de 6,7 et que la température optimale pour la fermentation devait se situer près de 40 °C. À l’étape de l’inoculation du ferment, les conditions initiales de température et de pH dans ML à yogourt favorisent la croissance des streptocoques. Ces derniers produisent de l’acide lactique, ce qui acidifie le ML et lorsque le pH optimal de croissance des lactobacilles est atteint (5,5), la croissance des lactobacilles peut alors prendre la relève pour continuer à diminuer le pH (Adams, M.R.et Moss, M.O. (2008), Sieuwerts, S, de Bock, A. M. Frank,
et al. (2008)). La variation du taux d’inoculation et du ratio streptocoques/lactobacilles sont
des outils technologiques permettant de contrôler le temps de fermentation. Lee, W. J.et Lucey, J. A. (2004) ainsi que Peng et al. (2009) ont démontré que l’inoculation d’un ferment mixte à un taux inférieur à 0,5% permettait de prolonger le temps de fermentation du yogourt ferme de 4 à plus de 6 heures comparativement à un taux d’inoculation supérieur à 3,5%. Au niveau microscopique, Peng, Y., Horne, D. S., et al. (2009) ont démontré que le réseau protéique produit en six heures ou plus était constitué de plus gros pores et qu’il était plus poreux comparativement à un yogourt produit en quatre heures, ce qui augmentait la synérèse et réduisait la contrainte de cisaillement ainsi que le module élastique G’.
1.4 Distinction entre yogourt ferme et yogourt brassé
Au Canada, les yogourts produits sont principalement de type brassé. La figure 1.1 illustre les principales étapes de fabrication du yogourt et différencie les types fermes et brassés. Lorsque la fermentation a lieu dans les pots de consommation, les yogourts sont de type ferme. Lorsqu’elle a lieu dans une cuve industrielle, ce sont des yogourts de type brassé. Pour la production des yogourts brassés, que ce soit avec ou sans gras, la fermentation est arrêtée en démarrant un brassage directement dans la cuve de fermentation lorsque le pH final de fermentation désiré des yogourts est atteint (généralement près du point isoélectrique des CN de 4,6) tout en le refroidissant graduellement pour atteindre 20 °C pour la mise en pots (Lee, W. J.et Lucey, J. A. (2010), Sodini, I., Remeuf, F., et al. (2004)). Finalement, les yogourts fermes et brassés sont entreposés à basse température (près de 4°C) avant d’être acheminé aux détaillants.
Figure 1.1 : Schématisation des principales étapes de fabrication des yogourts de types
ferme et brassé. Adapté de Lee, W. J.et Lucey, J. A. (2010).
Généralement, les producteurs cherchent à produire des yogourts fermes et brassés ayant le moins de synérèse possible puisque la présence de lactosérum à la surface du yogourt est considérée comme un défaut chez les consommateurs. De plus, certaines valeurs de fermeté et de viscosité sont nécessaire à atteindre pour répondre aux exigences des consommateurs. Dans le cas des yogourts brassés, ces propriétés texturales et rhéologiques sont diminuées suite au brassage.
1.4.1 Brassage
Après la fermentation, le ML dans la cuve industrielle forme un réseau protéique gélifié. Un bris du gel en cuve est amorcé par des pales rotatives et la température est graduellement abaissée. Ce brassage cause un cisaillement détruisant de façon importante le réseau protéique formé en cuve, ce qui crée des fragments de gel grossier. La résistance du réseau protéique gélifié au brassage est dépendante de la structure formée pendant la fermentation.
Pour étudier le yogourt de type brassé, plusieurs auteurs ont d’abord fabriqué des yogourts de type ferme, qu’ils ont ensuite laissé refroidir à basse température (4 °C) avant de les brasser pour effectuer leurs analyses (Beal, C., Skokanova, J., et al. (1999), Cayot, Philippe, Schenker, Flore, et al. (2008)). Serra, M., Trujillo, A. J., et al. (2009) ont étudié l’impact du brassage à la cuillère de yogourt fait à partir d’un lait ajusté à 3,5% de MG. Ils ont déterminé que la fermeté et le module élastique G’ étaient toujours plus élevés et la synérèse toujours plus faible dans les yogourts fermes comparativement aux yogourts brassés (Sandoval-Castilla, O., Lobato-Calleros, C., et al. (2004)). Par contre, en ajoutant des MG dans le yogourt brassé, ce dernier pourrait obtenir des propriétés rhéologiques et physicochimiques similaires à ceux du yogourt ferme. Il a été mentionné précédemment que la présence de MG augmente de façon importante la fermeté et la viscosité des ML gélifiés. De ce fait, ces gels protéiques seraient donc plus résistants au brassage grâce aux nombreuses interactions entre les protéines et les globules gras homogénisés. D’autre part, certains auteurs ont brassé le yogourt à la température de fermentation lorsqu’un pH de 4,5 était atteint et ensuite, ils les ont rapidement refroidis à 4-5 °C (Damin, M. R., Alcântara, M. R., et al. (2009), Haque, A., Richardson, R. K., et al. (2001)). Krzeminski, A., Tomaschunas, M., et al. (2013) et Krzeminski, Alina, Großhable, Katja, et al. (2011) ont démontré que l’augmentation de la teneur en MG de 0 à 12 %, dans les yogourts brassés à la température de fermentation, permettait d’augmenter la contrainte de cisaillement et la viscosité apparente des yogourts brassés avec un disque perforé et passé à travers une seringue. De plus, les valeurs d’hystérèse et du module élastique G’ augmentaient non seulement avec la teneur en MG mais aussi avec le ratio CN/PS. Ces auteurs ont aussi déterminé que la taille d3.2 des petits fragments de gel après brassage était dépendante d’une interaction entre le ratio CN/PS et la teneur en MG. Un ratio CN/PS et une teneur en MG plus élevés permettait de réduire la taille des fragments puisque les liens entre les CN et les GGH étaient favorisés au détriment des gros agrégats constitués de PS. Toutefois, les résultats obtenus par un brassage à la cuillère, une tige reliée à un disque perforé ou à l’aide d’un appareil électrique de laboratoire n’est pas représentatif d’une production industrielle. Cette dernière comprend un brassage dans une cuve industrielle, un premier refroidissement à 20 °C, un pompage, un lissage, un écoulement dans les tuyaux vers les buses de remplissage dans les pots de consommation et un deuxième refroidissement
durant l’entreposage à basse température (près de 4 °C) (Senge, B.et Blochwitz, R. (2009), Yoon, Won B.et McCarthy, Kathryn L. (2002)). Ces étapes supplémentaires, comparativement au brassage en laboratoire, peuvent aussi avoir un impact important sur les propriétés physico-chimiques, texturales et rhéologiques des yogourts brassés.
Quelques auteurs ont utilisé des équipements à l’échelle pilote pour simuler certaines étapes de la production de yogourt mais, pas dans une suite d’opération séquentielle complète. Le pompage, situé après l’étape du brassage en cuve industrielle, force l’écoulement du yogourt brassé dans les tuyaux du système de production industrielle. Zhang, H., Folkenberg, D. M., et al. (2016) ont démontré qu’un pompage combiné à un refroidissement à plaques augmentant la pression de 0,1 à 0,4 MPa dans les tuyaux causait une diminution de la viscosité apparente, du module élastique et de l’hystérèse ainsi qu’une augmentation de l’indice de synérèse. Il serait donc préférable d’utiliser un système de pompage fonctionnant à basse pression pour conserver la capacité de rétention d’eau, la fermeté et la viscosité des yogourts. Par contre un pompage à basse pression réduit la vitesse de l’écoulement du yogourt dans les tuyaux, ce qui nécessite plus de temps pour remplir les pots de yogourt. Weidendorfer, K., Bienias, Andrea, et al. (2008) ont démontré qu’une diminution du pompage et de la vitesse d’écoulement du yogourt à travers un réservoir conique permettait d’augmenter le module élastique G’ du yogourt brassé. Schmitt, L., Ghnassia, G., et al. (1998) ajoutent que la vitesse de cisaillement appliqué par le frottement du yogourt sur la paroi des tuyaux de 2 m entraine une déstructuration du réseau protéique et cause une diminution de la viscosité apparente du yogourt préalablement brassé dans la cuve (méthode de brassage non décrite). Senge, B.et Blochwitz, R. (2009) ont déterminé que la présence d’une étape de lissage, combiné à un pompage et un refroidissement à plaques à l’échelle pilote, contribuait à obtenir de petits fragments de gel plus uniforme. Rasmussen, M. A., Janhoj, T., et al. (2007) ajoutent que le brassage avec un mélangeur de laboratoire combiné à une étape de lissage dans un filtre tubulaire permet de réduire la granulosité des yogourts brassés. Après le lissage, le premier refroidissement à 20 °C peut être effectué dans un échangeur de chaleur tubulaire (ECT) ou à plaques (ECP). Tamime, A. Y.et Robinson, R. K. (2007) rapportent qu’une température de 20 °C permet de minimiser les dommages structuraux causés par l’écoulement du yogourt dans les tuyaux puisque le réseau protéique est moins visqueux à
20 °C qu’à 10 °C. Senge, B.et Blochwitz, R. (2009) rapportent que le système de refroidissement ECP est compact et offre une plus grande efficacité de refroidissement comparativement au système ECT. Par contre, le cisaillement subi dans le système ECP est environ deux fois supérieur au système ECT, ce qui peut nuire aux propriétés texturales et rhéologiques des yogourts brassés. Après ces étapes, le yogourt est transféré dans les pots de consommations et entreposé à basse température (4 °C). Cela permet, entre autres, de ralentir l’oxydation et la post-acidification (Tamime, A. Y.et Robinson, R. K. (2007)). 1.4.2 Entreposage
Durant l’entreposage, les bactéries lactiques, surtout les lactobacilles, continuent d’acidifier le yogourt, ce qui provoque une post-acidification causant un réarrangement du réseau protéique (Beal, C., Skokanova, J., et al. (1999)). Serra, M., Trujillo, A. J., et al. (2009) et Lee, W. J.et Lucey, J. A. (2010) ont démontré que la réduction du pH contribuait à augmenter les liens hydrophobes, de faible énergie à basse température, entre les CN. Comparativement au réseau protéique d’un yogourt ferme, celui d’un yogourt brassé contient de gros fragments dû à la collision des agrégats de CN durant l’étape de brassage (Lee, W. J.et Lucey, J. A. (2006), Lee, W. J.et Lucey, J. A. (2010)). La formation de liens entre les CN et PS durant l’entreposage permettait d’augmenter la fermeté et le module élastique G’. Marafon, A. P., Sumi, A., et al. (2011) ont démontré que le réseau protéique des yogourts brassés était modifié de façon importante durant les premiers jours d’entreposage. L’observation par microscopie à balayage électronique a démontré que le réseau protéique d’un yogourt non enrichi et brassé avec un disque perforé était plus poreux et moins dense après 24h d’entreposage comparativement à un yogourt enrichi avec des ingrédients laitiers (PLÉ et CPL). Cela concorde aussi avec les résultats obtenus par Remeuf, F., Mohammed, S., et al. (2003). Ces auteurs ont déterminé que l’utilisation de PLÉ et de CPL pour enrichir des yogourts brassés avec un disque perforé permettait d’obtenir des réseaux protéiques denses après une semaine d’entreposage. En présence de MG, Güler-Akin, Mutlu B., Serdar Akin, M., et al. (2009) ajoutent que la fermeté et la viscosité des yogourts brassés avec un mélangeur électrique augmentaient tandis que la synérèse diminuait.
Renan, M., Guyomarc'h, F., et al. (2009) rapportent que le pH au moment du brassage des yogourts influençait le pH final des yogourts durant leur entreposage. À un pH de brassage de 4,4; 4,7 et 5,0 les yogourts n’atteignaient pas le même pH final après 28 jours d’entreposage. En effet, la post-acidification abaissait les valeurs de pH à 4,20; 4,30 et 4,45, respectivement. Renan, M., Guyomarc'h, F., et al. (2009) ont aussi démontré que le pH final de fermentation du ML gélifié avant brassage avait un impact important sur le module élastique G’ et la viscosité du yogourt après brassage. À un pH final de fermentation plus acide (4,4 vs 4,7), le yogourt ferme avait une plus grande valeur de G’ avant d’être brassé. Après brassage avec un malaxeur maison et un entreposage de 28 jours, le ML gélifié qui a été brassé à un pH final de fermentation de 4,4 était plus visqueux et avait un G’ plus élevé que celui brassé à un pH final de fermentation de 4,7. La viscosité plus élevée pour les yogourts à pH de 4,4 peut être expliqué par la plus grande résistance de la matrice protéique au cisaillement à bas pH comparativement au yogourt à pH 4,7.
1.3 Problématique
La majorité des études rapportées dans la littérature ont été orientées sur le yogourt de type ferme sans gras. Quelques études portent sur le yogourt brassé avec une cuillère, un disque perforé ou un mélangeur électrique (Lee, W. J.et Lucey, J. A. (2006), Marafon, A. P., Sumi, A., et al. (2011), Renan, Marie, Arnoult-Delest, Véronique, et al. (2008), Serra, M., Trujillo, A. J., et al. (2009)). Ces études ne rapportent pas les relations entre la composition (solides totaux et matières grasses), le brassage et les propriétés rhéologiques des yogourts durant l’entreposage (Ciron, Chr Ian E., Gee, Vivian L., et al. (2011), Krzeminski, Alina, Großhable, Katja, et al. (2011), Renan, M., Guyomarc'h, F., et al. (2009)). De plus, ce type de brassage en laboratoire ne représente pas la complexité d’un système de brassage industriel. Même si certains auteurs ont utilisé des équipements à l’échelle pilote pour brasser du yogourt, aucun ne l’a fait dans une suite d’opération séquentielle complète à partir du brassage en cuve jusqu’à la mise en pot (Aguirre-Ezkauriatza, E. J., Galarza-Gonzalez, M. G., et al. (2008), Yoon, Won B.et McCarthy, Kathryn L. (2002)). Or, ces étapes successives pourraient causer un cisaillement cumulatif important et modifier les propriétés rhéologiques des yogourts brassés.