Caractérisation de l'endothélium cornéen pathologique
et de l'effet d'une pression intraoculaire à l'aide de
modèles in vitro
Thèse
Mathieu Thériault
Doctorat en biologie cellulaire et moléculaire
Philosophiæ doctor (Ph. D.)
Caractérisation de l'endothélium cornéen pathologique
et de l’effet d’une pression intraoculaire à l'aide de
modèles in vitro
Thèse
Mathieu Thériault
Sous la direction de :
Stéphanie Proulx, directrice de recherche
Isabelle Brunette, codirectrice de recherche
Résumé
L’endothélium cornéen est responsable de la déturgescence, un processus de déshydratation nécessaire à la transparence de la cornée. La dystrophie endothéliale cornéenne de Fuchs (FECD) est la principale cause de dysfonction endothéliale chez l’humain. C’est une maladie multifactorielle associée à (1) une plus grande apoptose dépendante du stress oxydatif des cellules endothéliales cornéennes, (2) un dépôt accru de protéine matricielle causant un épaississement de la membrane basale, et finalement (3) une perte de la capacité des cellules à assurer la déturgescence cornéenne. Actuellement, les modèles d’étude de la FECD montrent une capacité limitée à caractériser l’étiologie de la maladie, ce qui restreint notre capacité à développer des traitements pharmacologiques appropriés. Le seul traitement pour cette pathologie est la greffe de cornée. Afin d’étudier cette pathologie, mon laboratoire a développé des techniques de culture et de reconstruction par génie tissulaire d’endothélia FECD. Mes travaux ont utilisé ces modèles afin de comparer, par profilage génique, PCR quantitatif, immunofluorescence, résistance transendothéliale et essai de perméabilité, l’expression, la distribution et les capacités fonctionnelles des molécules impliquées dans la déturgescence et la sécrétion matricielle. Les résultats de mes études ont montré que les protéines associées à la fonction des cellules FECD (familles de transporteurs ioniques et de jonctions intercellulaires) n’avaient aucune différence d’expression suivant la mise en culture lorsque comparées à des équivalents non pathologiques. De plus, aucune différence fonctionnelle n’a été déterminée par résistance transendothéliale et essai de perméabilité. Toutefois, une plus grande quantité de fibronectine était déposée sous les cellules. Ce faisant, ces études suggèrent que la perte de fonction dans la FECD n’aurait pas un rôle primaire dans la pathologie et serait secondaire à un dépôt anormal de fibronectine.
Des recherches antérieures du laboratoire avaient démontré une amélioration dans l’expression des marqueurs de fonctionnalité suite à des greffes in vivo. Le 3e objectif présenté dans cette thèse était de déterminer si les conditions environnementales in vivo (telle que la pression intraoculaire) étaient impliquées dans cette amélioration. Pour ce faire, nous avons utilisé un système de chambre antérieure artificielle permettant d’exercer une pression sur l’endothélium dans un circuit fermé. Cette étude a montré une plus grande expression de ZO-1 à la périphérie des cellules endothéliales, une protéine associée aux jonctions serrées, par la pression. Ce résultat met en perspective l’importance de l’environnement sur la fonctionnalité de l’endothélium cornéen.
Abstract
The role of the corneal endothelium is to maintain the corneal transparency by a partial dehydration process named deturgescence. Fuchs endothelial corneal dystrophy (FECD) is the main cause of human endothelial dysfunction. It is a multifactorial disease associated with an increased oxidative-related cell death, a thickened basal lamina and a loss in the endothelial pump function resulting in a corneal opacification. Due to the lack of appropriate models, the exact cause of the pathology remains unknown, which restrains our ability to develop appropriate pharmacological treatments. As of now, the only cure is the transplantation of a healthy endothelium from a deceased donor. My laboratory has previoulsly developed in vitro cell and tissue models of FECD. My research projects used these models and analyzed, by gene profiling, quantitative PCR, immunofluorescence, trans-endothelial resistance and permeability assay, the expression, the distribution and the functional capacity of molecules engaged in deturgescence and extracellular matrix (ECM) deposition. Results show no difference between FECD and healthy cells for genes and proteins related to deturgescence (ion transporters and intercellular jonctions). However, an increased deposition of fibronectin was observed. These studies therefore suggest that the endothelial dysfunction would not be a primary aspect of the pathology and would rather be secondary to an aberrant deposition of fibronectin.
A previous in vivo study showed an amelioration of the endothelial phenotype upon transplantation in an animal model. It suggested a beneficial effect from the environment, such as the intraocular pressure (IOP). The effect of pressure on the endothelium was investigated by placing tissue-engineered endothelia in an artificial anterior chamber that mimicked the natural IOP. Increased ZO-1, a protein associated with tight junctions, was observed at the cell periphery. This result suggest that the in vivo environment influences the functionality of the corneal endothelium.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des figures ... ix
Liste des tableaux ... x
Liste des abréviations ... xi
Remerciements ... xvi Avant-propos ... xvii Introduction ... 1 1.1 Anatomie de la cornée ... 2 1.1.1 Généralité ... 2 1.1.2 Épithélium cornéen ... 2 1.1.3 Stroma cornéen ... 3
1.1.3.1 Collagènes du stroma cornéen ... 3
1.1.3.2 Les protéoglycanes ... 4
1.1.4 Kératocyte ... 5
1.1.5 Endothélium cornéen ... 5
1.1.6 Membrane de Descemet ... 9
1.1.6.1 Le collagène de type IV ... 10
1.1.6.2 Le collagène de type VIII ... 10
1.1.6.3 Les laminines ... 11 1.1.6.4 La fibronectine ... 11 1.1.6.5 Les intégrines ... 13 1.2 La déturgescence cornéenne ... 15 1.2.1 Pression de gonflement ... 16 1.2.2 Pression d’imbibition ... 16
1.2.3 Le rôle de la pression intraoculaire dans la déturgescence cornéenne ... 17
1.3 La barrière endothéliale ... 18
1.3.1 Jonctions serrées ... 19
1.3.1.1 Protéines zonula occludens. ... 20
1.3.1.2 Les claudines ... 20
1.3.1.3 L’occludine ... 21
1.3.2 Les jonctions adhérentes ... 22
1.3.2.1 Les cadhérines classiques ... 22
1.3.2.2 Les caténines ... 23
1.3.3 La polarisation apico-basale ... 25
1.3.4 Mécanisme/régulation de la barrière cellulaire ... 26
1.3.5 Famille des GTPases Rho ... 27
1.4 Le mécanisme de pompe endothélial ... 28
1.4.1 Le modèle de sécrétion anionique ... 29
1.4.1.1 Modèle électro-osmotique de l’endothélium cornéen ... 31
1.4.2 Protéines responsables du déplacement des ions ... 31
1.4.2.1 Pompes Na+/K+ ATPase ... 31
1.4.2.2 Co-transporteurs du bicarbonate ... 32
1.4.2.3 Transporteurs du monocarboxylate ... 33
1.4.2.5 Anhydrase carbonique ... 34
1.5 Dystrophie endothéliale cornéenne de Fuchs ... 35
1.5.1 Introduction ... 35 1.5.2 Épidémiologie (prévalence) ... 35 1.5.3 Physiopathologie ... 36 1.5.4 Définition ... 36 1.5.5 Classifications ... 36 1.5.6 Altérations génétiques ... 37
1.5.6.1 Le collagène de type VIII ... 38
1.5.6.2 La voie ZEB1/E2-2 ... 38
1.5.6.3 SLC4A11 ... 38
1.5.6.4 LOXHD1 ... 38
1.5.7 Effet de la pathologie sur les cellules endothéliales cornéennes ... 39
1.5.7.1 Diminution de la densité, pléiomorphisme et polymégatisme ... 39
1.5.7.2 Transition du phénotype endothélial ... 39
1.5.7.3 Stress oxydatif. ... 39
1.5.7.4 Apoptose ... 40
1.5.7.5 Fonctionnalité endothéliale ... 40
1.5.8 Effets de la pathologie sur la membrane de Descemet ... 41
1.5.8.1 Épaississement et modifications des couches de la membrane de Descemet 41 1.5.8.2 Altérations dans la composition de la matrice extracellulaire ... 42
1.6 Greffes de l’endothélium cornéen ... 43
1.7 Génie tissulaire de l’endothélium cornéen ... 45
1.7.1 Principes/avantages ... 45
1.7.2 Isolement ... 45
1.7.3 Culture ... 45
1.7.4 Supports ... 46
1.7.5 Injection de cellules dans la chambre antérieure ... 47
1.7.6 Modèles animaux ... 48
1.7.7 Modèles d’étude FECD par génie tissulaire ... 48
1.8 Hypothèses et objectifs de recherche ... 50
1.8.1 Chapitre 1 : Caractérisation de la fonctionnalité FECD sur modèles in vitro ... 50
1.8.2 Chapitre 2 : Caractérisation du dépôt de matrice des endothélia FECD sur modèles in vitro 50 1.8.3 Chapitre 3 : Effet de la pression intraoculaire sur la formation d’un endothélium cornéen fonctionnel ... 51
1.8.4 Annexe 1 : Évaluation du métabolisme énergétique des cellules endothéliales cornéennes ... 51
1.8.5 Annexe 2 : Injection de cellules endothéliales cornéennes dans la chambre antérieure. ... 51
Chapitre 1: Function-related protein expression in Fuchs endothelial corneal dystrophy .. 52
2.1 Résumé en français ... 53
2.2 Article: ... 54
2.3 Résumé en anglais ... 55
2.4 Introduction ... 56
2.5 Matériel et méthodes ... 58
2.5.1 FECD and healthy human corneal specimens ... 58
2.5.2 Isolation and culture of corneal endothelial cells from healthy and FECD corneas .. 58
2.5.3 Gene expression profiling ... 59
2.5.4 Quantitative PCR ... 60
2.5.5 Trans-endothelial resistance and 10 kDa FiTC-Dextran permeability analysis ... 60
2.5.6 Tissue engineering of the corneal endothelium ... 60
2.5.7 Tissue fixation and immunofluorescence analysis ... 61
2.6 Résultats ... 62
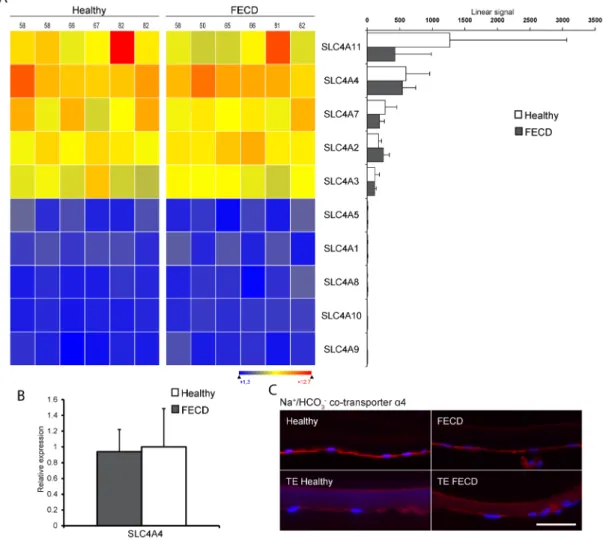
2.6.1 Assessment of the expression of the maily of sodium potassium pumps ... 62
2.6.2 Assessment of the epression of the SLC4 family of bicarbonate transporters ... 62
2.6.3 Assessment of the expression of the SLC16 family of monocarboxylate cotransporters ... 62
2.6.4 Assessment of the expression of aquaporins ... 63
2.6.5 Assessment of the barrier function ... 63
2.7 Discussion ... 64
2.8 Remerciement ... 66
2.9 Références ... 67
2.10 Figures ... 71
Chapitre 2: Extracellular matrix and integrin expression profiles in Fuchs endothelial corneal dystrophy cells and tissue models ... 76
3.1 Résumé en français ... 77 3.2 Article ... 78 3.3 Résumé en anglais ... 79 3.4 Introduction ... 80 3.5 Matériel et méthodes ... 82 3.5.1 Biological material ... 82
3.5.2 Isolation and culture of corneal endothelial cells from healthy and FECD corneas .. 82
3.5.3 Gene expression profiling ... 83
3.5.4 Tissue-engineered human corneal endothelium ... 83
3.5.5 Histology ... 84
3.5.6 Indirect immunofluorescence analysis ... 84
3.5.7 Statistical analyses ... 84
3.6 Résultats ... 85
3.6.1 Extracellular matrix- and integrin-related gene expression ... 85
3.6.2 Extracellular matrix- and integrin-related protein expression ... 85
3.7 Discussion ... 87
3.8 Remerciements ... 90
3.9 Références ... 91
3.10 Figures ... 94
3.11 Tableaux ... 99
Chapitre 3: Use of a corneal bioreactor to study the influence of pressure on the formation of corneal endothelial cell tight junctions ... 102
4.1 Résumé en français ... 103 4.2 Article ... 104 4.3 Résumé en Anglais ... 105 4.4 Introduction ... 106 4.5 Matériel et méthodes ... 107 4.5.1 Corneal specimens ... 107
4.5.2 Culture of human corneal endothelial cells ... 107
4.5.3 Engineered corneal endothelium ... 107
4.5.4 Mounting of corneas in the bioreactor (dynamic condition)... 108
4.5.5 Transparency assessments ... 109
4.5.6 Cell morphology, size and cell density analyses ... 109
4.5.7 Histology and electron microscopy ... 109
4.5.8 En face immunofluorescence assays ... 110
4.5.9 Statistical analyses ... 110
4.6 Résultats ... 111
4.6.1 Effect of dynamic culture conditions on the corneal endothelium ... 111
4.6.2 Effect of dynamic culture conditions on corneal transparency ... 111
4.7 Discussion ... 114
4.8 Conclusion ... 116
4.9 Remerciements ... 116
4.10 Références ... 117
4.11 Figures ... 120
Discussion et conclusion générale ... 127
5.1 Discussion ... 128
5.1.1 Expression des protéines liées à la fonctionnalité de l’endothélium dans notre modèle in vitro utilisant des cellules endothéliales FECD. ... 131
5.1.2 Expression des protéines liées à la matrice extracellulaire dans notre modèle in vitro utilisant des cellules endothéliales FECD. ... 133
5.1.3 Rôle de la pression dans la formation des jonctions serrées de l’endothélium cornéen 135 5.2 Conclusion générale ... 142
Références ... 144
6.1 Références ... 145
Annexe 1: Restoration of mitochondrial integrity, telomere length and sensitivity to oxidation by in vitro culture of Fuchs endothelial corneal dystrophy cells ... 185
A1.1 Résumé en français ... 186
A1.2 Article ... 187
A1.3 Résumé en anglais ... 188
Annexe 2: In vivo functionality of a corneal endothelium transplanted by cell-injection therapy in a feline model ... 189
A2.1 Résumé en français ... 190
A2.2 Article ... 191
Liste des figures
Figure 1.1 Coupe histologique de la cornée ... 2
Figure 1.2 Microscopie électronique à balayage de l’endothélium cornéen ... 6
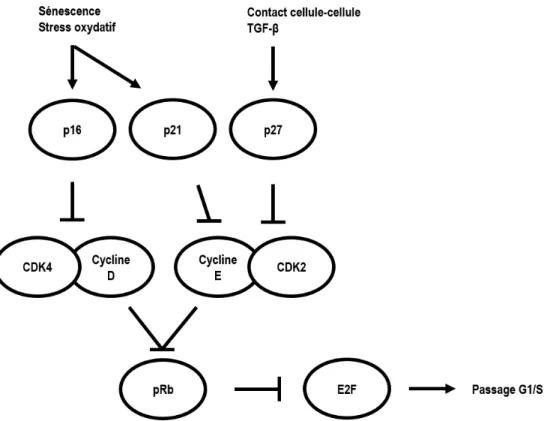
Figure 1.3 Régulation du passage G1/S du cycle cellulaire ... 8
Figure 1.4 Intégrines liant la matrice extracellulaire ... 14
Figure 1.5 Voies de signalisation des caténines. ... 24
Figure 1.6 Polarisation apico-basale. ... 26
Figure 1.7 Régulation du PAMR ... 27
Figure 1.8 Chambre Ussing de Hodson ... 29
Figure.1.9 Modèle du mécanisme de la pompe endothéliale. ... 30
Figure 2.1 Characterization of the family of sodium potassium pumps. ... 71
Figure 2.2 Characterization of the SLC4 family of bicarbonate transporters. ... 72
Figure 2.3 Characterization of the family of monocarboxylate co-transporters. ... 73
Figure 2.4 Characterization of the family of aquaporins. ... 74
Figure 2.5 Characterization of in vitro FECD endothelial barrier function. ... 75
Figure 3.1 Microarray analysis ... 94
Figure 3.2 Schematic representation of the tissue engineering of a corneal endothelium. 95 Figure 3.3 Extracellular matrix-related protein expression. ... 96
Figure 3.4 Integrin protein expression. ... 97
Figure 3.5 Clusterin and TGFβIp protein expression ... 98
Figure 4.1 Corneal bioreactor. ... 120
Figure 4.2 Corneal perfusion system. ... 121
Figure 4.3 Histology cross-sections of engineered and native corneas. ... 122
Figure 4.4 Corneal transparency and thickness following pressure experiment. ... 123
Figure 4.5 Assessment of cell morphology following pressure experiment. ... 124
Liste des tableaux
Tableau 3.1: Transcriptome analysis of extracellular matrix-related genes in FECD
cultured cells. ... 99 Tableau 3.2: Transcriptome analysis of integrin-related genes in FECD cultured cells. .. 100 Tableau 3.3: Summary of extracellular-matrix-related proteins and integrin subunits
detected by immunofluoescence. ... 101 Tableau 4.1: Corneal and endothelial measurements under pressure ... 126
Liste des abréviations
Aα : Alpha
AKT : Mice stock A inbred family k with transforming capability protein AJC : Apical junction complex ; complexe de jonction apical
AJ : Adherens junctions ; Jonction adhérente
aPKC : Atypical protein kinase C ; Protéine kinase C atypique AQP1 : Aquaporine 1
AE : Anion exchanger ; échangeur d’anion B
β : Beta ; Bêta
bFGF : Basic fibroblastic growth factor ; Facteur de croissance fibroblastique basique
C
CDS : Chondroitin sulfate ; Sulfate de chondroïtine
CEC : Corneal endothelial cell ; Cellule endothéliale cornéenne CDK : Cyclin-dependent kinase ; Kinase cycline-dépendante CDK2 : Cyclin-dependent kinase 2 ; Kinase 2 cycline-dépendante CDK4 : Cyclin-dependent kinase 4 ; Kinase 4 cycline-dépendante Cip1 : Cdk-interacting protein 1 ; p21
CDH1 : Cadhérine 1 (épithéliale) CDH2 : Cadhérine 2 (neuronale) CDH4 : Cadhérine 4 (rétinienne)
CKI : Cyclin-dependent kinase inhibitor; Inhibiteur de kinase cycline-dépendante Cdc42 : Cell division control protein 42 homolog; Protéine homologue 42 de contrôle
de la division cellulaire CTNNA1 : Caténine alpha 1
COL1A : Collagène de type I alpha COL8A1/2 : Collagène de type VIII alpha 1/2 CLU : Clusterine
CA : Carbonic anhydrase ; anhydrase carbonique D
DM : Descemet’s membrane ; Membrane de Descemet Dlg : Discs-large
DLEK : Deep lamellar endothelial keratoplasty
DSAEK : Descemet’s stripping automated endothelial keratoplasty DSEK : Descemet’s stripping endothelial keratoplasty
E
ECM : Extracellular matrix ; Matrice extracellulaire E-cadhérine Cadhérine épithéliale
EDTA : Ethylenediaminetetraacetic acid ; acide éthylène diamine tétraacétique ENaC : Epithelial sodium channel ; Canal sodique épithélial
E2-2 : Basic helix-loop-helix transcription factor (E protein) ; TCF4 F
FACIT: Fibril-Associated Collagens with Interrupted Triple helices ; Collagènes associés à des fibrilles avec des triples hélices interrompues
FAK : Focal adhesion kinase ; Kinase d’adhésion focale
FECD : Fuchs endothelial corneal dystrophy ; Dystrophie endothéliale cornéenne de Fuchs
FDA : Food and Drug Administration (of USA) G
GAG : Glycosaminoglycan ; Glycosaminoglycane GS : Heparan sulfate ; Sulfate d’héparane GTPase : GTP hydrolase
I
INK4 : Inhibitor of CDK4; p16 ; Inhibiteur de CDK4 J
JAM : Junctional adhesion molecule K
KS : Keratan sulfate ; Sulfate de kératane Kip1 : Kinase-inhibitors protein 1 ; p27 L
LgL : Lethal giant larvae
L450W : Mutation (substitution) de la leucine vers tryptophane du 450e acide aminé en partant du N-terminal du collagène de type VIII
L455K : Mutation (substitution) de la leucine vers lysine du 455e acide aminé en partant du N-terminal du collagène de type VIII
LOXHD1 : Lipoxygenase homology domains 1 M
MMP : Matrix metalloproteinase ; Métalloprotéinase matricielle MLC : Myosin light chain ; Chaîne légère de la myosine
MLCK : Myosin light chain kinase ; Kinase de la chaîne légère de la myosine MLCP : Myosin light chain phosphatase ; Phosphatase de la chaîne légère de la
myosine
MAGUK : Membrane-associated guanylate kinase ; Guanylate kinase associée à la membrane
MCT : Monocarboxylate transporter ; transporteur du monocarboxylate N
NBC : Sodium bicarbonate cotransporter ; Cotransporteur du sodium et du bicarbonate
NDCBE : Sodium-driven chloride/bicarbonate exchanger ; SLC4A8 ; Échangeur du chlore/bicarbonate sodium dépendant
NBCe1 : Electrogenic sodium bicarbonate cotransporter 1 ; SLC4A4 ; Cotransporteur électrogénique 1 du sodium et du bicarbonate
NBCe2 : Electrogenic sodium bicarbonate cotransporter 2 ; SLC4A5 ; Cotransporteur électrogénique 2 du sodium et du bicarbonate
NBCn1 : Electroneutral sodium bicarbonate cotransporter 1 ; SLC4A7 ; Cotransporteur électriquement neutre 1 du sodium et du bicarbonate NBCn2 : Electroneutral sodium bicarbonate cotransporter 2 ; SLC4A10 ;
Cotransporteur électriquement neutre 2 du sodium et du bicarbonate NLS : Nuclear localization sequence ; séquence de localisation nucléaire NES : Nuclear exportation sequence : séquence d’exportation nucléaire N-cadhérine Cadhérine neuronale
NFκB : Nuclear factor kappa B ; Facteur nucléaire kappa B
Nrf-2: Nuclear factor (erythroid-derived 2)-like 2; Facteur relié à l’érythroïde P
pRB : Retinoblastoma protein ; Protéine du rétinoblastome
PAMR : Perijunctional actomyosin ring ; Anneau d’actomyosine périjonctionnel PCNA : Proliferating cell nuclear antigen ; Antigène nucléaire de prolifération
cellulaire
Pals1 : Protein associated with Lin seven 1 ; Protéine associée avec Lin seven 1 Patj : PALS1-associated tight junction protein ; Protéine de jonction serrée
associée à PALS1
Par3 : Partitioning defective 3 ; Partitionnement défectif 3 Par6 : Partitioning defective 6 ; Partitionnement défectif 6 PK : Penetrating keratoplasty ; Kératoplastie pénétrante R
RHO : Ras homolog gene family ; Famille des homologues de ras
RGD : Arginin-Glycin-Aspartic acid peptidic motif ; Motif peptidique arginine-glycine-acide aspartique
R-cadhérine Cadhérine rétinienne
Rac1: Ras-related C3 botulinum toxin substrate 1 ; Substrat 1 de la toxine botulique C3 relié à Ras
S
Scrib : Scribble
SLC4A1-11 : Solute carrier 4 alpha 1 to 11 ; Transporteur de soluté 4 alpha 1 à 11 SLC16A1-14 : Solute carrier 16 alpha 1-14 ; Transporteur de soluté 16 alpha 1 à 14 SNP : Single-nucleotide polymorphism ; Polymorphisme nucléotidique simple T
TGF-β : Transforming growth factor beta ; Facteur de croissance transformant bêta TCF : Transcription factor ; Facteur de transcription
TCF8 : Transcription factor 8 ; ZEB1 ; Facteur de transcription 8 TEM : Transition épithélio-mésenchymateuse ou transition
endothélio-mésenchymateuse V
VLA : Very late antigen ; antigène très tardif VE-cadhérine Cadhérine endothéliale vasculaire W
Wnt : Wingless/integrated Z
ZO-1 : Zonula occludens 1 ZO-2 : Zonula occludens 2 ZO-3 : Zonula occludens 3
ZONAB : ZO-1 associated nucleic acid-binding protein ; Protéine liant les acides nucléiques associée à ZO-1
ZEB1 : Zinc finger E-box binding homeobox 1 ; TCF8 ; Boîte E doigt de zinc liant la séquence de boîte homéotique
“Heard melodies are sweet, but those unheard, are sweeter” John Keats
Remerciements
Je voudrais tout d’abord remercier les Dres Proulx et Brunette pour m’avoir offert l’opportunité de faire un doctorat dans le domaine du génie tissulaire de l’œil. Ce fut un réel privilège d’avoir deux mentors aussi dévouées et passionnées dans leur désir de transmettre et d’enseigner leurs sciences, leurs savoir-faire et leur passion pour cet Univers qui ne cesse de s’agrandir.
Les travaux présentés dans cette thèse sont le fruit du travail d’une quantité incroyable de collègues formidables qui ont su enrichir ces recherches en leur apportant une dimension multidisciplinaire. Ils ont de ce fait toute ma gratitude. J’aimerais plus particulièrement remercier Cristina Bostan, Karolyn Forget, Olivier Roy, Sébastien Gendron et Benjamin Goyer pour ces excellentes collaborations tout au long de mon doctorat.
J’aimerais finalement remercier ma famille pour tous les efforts qu’ils ont su déployer dans le seul intérêt de me permettre d’accomplir mes rêves et ambitions. Ils ont su me transmettre cette soif du savoir et du dépassement qui m’a permis de faire ce doctorat. À ce titre, je les remercie d’avoir été des exemples si formidables d’humanisme.
Avant-propos
Les recherches effectuées dans le cadre de mon doctorat sont présentées dans cette thèse sous la forme de trois articles scientifiques (chapitres 2, 3 et 4).
Le chapitre 1 présente le manuscrit « Function-related protein expression in Fuchs endothelial corneal dystrophy », qui est publié dans le journal « American Journal of Pathology ». Les auteurs sont Mathieu Thériault, Sébastien P. Gendron, Isabelle Brunette, Patrick J. Rochette et Stéphanie Proulx. L’étude correspond à une caractérisation des marqueurs de fonctionnalité endothéliale dans la dystrophie endothéliale cornéenne de Fuchs. J’ai participé à la conception du projet, la réalisation des expériences de qPCR et des immunomarquages, l’analyse et l’interprétation des résultats ainsi qu’à la rédaction du manuscrit. Dre Karine Zaniolo, de la plateforme de génétique moléculaire de l’Axe médecine régénératrice et Dr Gendron ont effectué les analyses de profilage génique. Les Drs Rochette et Brunette ont contribué de par leurs expertises dans le domaine en participant à l’interprétation des résultats et à la révision du manuscrit. La Dre Proulx, en tant que superviseur principal, a participé à la conception du projet, a produit les endothélia reconstruits par génie tissulaire, et a participé à l’interprétation des résultats, à la rédaction et à la révision du manuscrit.
Le chapitre 2 présente un deuxième manuscrit intitulé « Extracellular matrix and integrin expression profiles in Fuchs endothelial corneal dystrophy cells and tissue model », qui est publié dans le journal « Tissue Engineering ». Les auteurs sont Benjamin Goyer*, Mathieu Thériault* (co-premiers auteurs), Sébastien P. Gendron, Isabelle Brunette, Patrick J. Rochette et Stéphanie Proulx. Les travaux présentent la caractérisation des gènes et protéines liés à la matrice extracellulaire et les intégrines dans la dystrophie endothéliale cornéenne de Fuchs. Le Dr Goyer et moi avons eu une contribution complémentaire de par son expertise en matrice extracellulaire et mon expertise sur la dystrophie endothéliale cornéenne de Fuchs. Dr Goyer a effectué les immunofluorescences, l’analyse des résultats et la rédaction du manuscrit, incluant la conception et la revue de littérature qui en découle. En tant que co-premier auteur, j’ai préparé les cellules pour le profilage génique et j’ai participé à la conception du projet, à l’analyse des résultats (surtout en profilage génique) et à la rédaction du manuscrit. Les Drs Zaniolo et Gendron ont effectué les profilages géniques. Les Drs Brunette et Rochette ont contribué de par leurs expertises dans le domaine en participant à l’interprétation des résultats et à la révision du manuscrit. La Dre
Proulx, en tant que superviseure principale, a participé à la conception du projet, a produit les endothélia reconstruits par génie tissulaire et a participé à l’interprétation des résultats, la rédaction et la révision du manuscrit.
Le chapitre 3 présente un troisième manuscrit: « Use of a corneal bioreactor for the study of the influence of pressure on the formation of tight junctions of corneal endothelial cells» par Mathieu Thériault*, Olivier Roy* (co-premiers auteurs), Isabelle Brunette et Stéphanie Proulx. Une forme revisée du manuscrit est publié dans journal « Experimental Eye Research ». Le projet avait pour but d’utiliser un bioréacteur cornéen afin d‘évaluer l’effet de la pression sur la formation des jonctions serrées. Olivier Roy a participé à l’élaboration du protocole de recherche, a généré et analysé les résultats et a participé à l’écriture de l’introduction. En tant que co-premier auteur, j’ai participé à la conception, la réalisation, l’analyse et la rédaction de cette étude dans son ensemble en assistant Olivier dans les premières expériences et en menant à terme le projet après son départ. La Dre Brunette a contribué de par son expertise à l’interprétation des résultats et à la révision du manuscrit. Elle a aussi fourni une partie des chambres antérieures artificielles utilisées lors de la mise au point du protocole. La Dre Proulx, en tant que superviseure principale, a participé à la conception du projet, à l’interprétation des résultats, à la rédaction et à la révision du manuscrit.
L’annexe 1 présente l’article « Restoration of mitochondrial integrity, telomere length and sensitivity to oxidation by in vitro culture of Fuchs Endothelial Corneal Dystrophy cells » par Sébastien P. Gendron, Mathieu Thériault, Stéphanie Proulx, Isabelle Brunette et Patrick J. Rochette. Il a été publié dans le journal « Investigative Ophthalmology and Visual Sciences ». Le projet avait pour but d’étudier les mitochondries des cellules FECD. Le Dr Gendron a participé à la conception du projet, la réalisation des expériences, l’analyse et l’interprétation des résultats ainsi qu’à la rédaction du manuscrit. En tant que deuxième hauteur, j’ai fourni les populations endothéliales FECD et saines étudiées dans cette étude et j’ai techniquement assisté le Dr Gendron dans la gestion de ces cellules lors de ses expériences. Sans avoir pris part à la rédaction, mes connaissances sur la dystrophie endothéliale cornéenne de Fuchs ont été prises en compte dans les conclusions de l’étude. Les Drs Brunette et Proulx ont contribué de par leurs expertises à la révision du manuscrit. Le Dr Rochette, en tant que superviseur principal, a participé à la conception du projet, à l’interprétation des résultats, à la rédaction du manuscrit et à sa révision.
L’annexe 2 présente l’article « In vivo functionality of a corneal endothelium transplanted by Cell-injection therapy in a feline model » de Cristina Bostan, Mathieu Thériault, Karolyn J. Forget, Christelle Doyon, J. Douglas Cameron, Stéphanie Proulx et Isabelle Brunette. Il a été publié dans le journal « Investigative Ophthalmology and Visual Science ». L’étude correspond à une série d’expériences de transplantations expérimentales où des cellules endothéliales cornéennes étaient injectées dans la chambre antérieure d’un félin, suivi cliniquement pendant 7 à 30 jours et analysées en post-mortem par analyses histologiques et biomoléculaires afin de déterminer si elles étaient capables de produire un endothélium fonctionnel. La Dre Bostan a participé à la conception du projet et à la réalisation du volet clinique des expériences, incluant les transplantations. Elle a effectué le suivi clinique et une partie des analyses post-mortem. Elle a eu un rôle important dans l’interprétation des résultats et a rédigé la majeure partie du manuscrit. En tant que deuxième auteur, j’ai participé à la conception du projet, cultivé et caractérisé les cellules endothéliales qui ont servi pour les injections et j’ai effectué la majorité des analyses en post-mortem. J’ai participé à la rédaction du manuscrit en y apportant une expertise en biologie moléculaire. Mme Forget a assisté la Dre Bostan dans le volet clinique et joué le rôle d’intermédiaire dans la translation clinique/cellulaire du projet. Elle a participé à la rédaction du manuscrit et à sa révision. La Dre Doyon a participé au suivi clinique, à l’analyse des résultats et à la rédaction du manuscrit. Le Dr Cameron a fourni une expertise en pathologie qui a grandement contribué à l’analyse des résultats d’histologie et de microscopie électronique. La Dre Proulx a participé à la conception et au bon déroulement du projet en fournissant une expertise en génie tissulaire et a contribué à l’interprétation des résultats, à la rédaction du manuscrit et à sa révision. La Dre Brunette, en tant que superviseure principale, a participé à la conception et au bon déroulement du projet en fournissant une expertise en ophtalmologie. Elle a notamment effectué les transplantations. Elle a aussi participé à l’interprétation des résultats, à la rédaction et à la révision du manuscrit.
1.1 Anatomie de la cornée
1.1.1 Généralité
Située à la surface de l’œil, la cornée est une structure transparente et courbée. Du dioptre nécessaire pour obtenir le faisceau convergeant vers la rétine, deux tiers sont obtenus par la courbure de la cornée et un tiers par le cristallin. La cornée humaine adulte mesure de 11.5 mm à 12 mm à l’horizontale et de 10.5 mm à 11 mm à la verticale (Rufer et al. 2005). Son épaisseur varie de 500 µm au centre à environ 700 µm en périphérie (Mishima 1968, DelMonte et al. 2011). Elle est composée de 3 couches : l’épithélium, le stroma et l’endothélium (Fig. 1.1).
Figure 1.1 Coupe histologique de la cornée
La cornée comprend 5 couches : l’épithélium cornéen, la membrane de Bowman, le stroma cornéen dans lequel on retrouve les kératocytes, la membrane de Descemet et l’endothélium cornéen. Coloration au Trichrome de Masson. Barre de mesure = 20 µm. © Mathieu Thériault
1.1.2 Épithé
l
ium cornéen
pavimenteuses non kératinisées (Farjo et al. 2008). L’épithélium est recouvert d’un film lacrymal essentiel au polissage des irrégularités de sa surface antérieure. Les cellules épithéliales ont une durée de vie de 7 à 10 jours à partir duquel des processus d’involution, d’apoptose et de desquamation s’entreprennent (Hanna et al. 1961). Ces processus permettent un remplacement de l’épithélium à une fréquence hebdomadaire. Les couches antérieures de l’épithélium sont formées de cellules aplaties et polygonales. Ces cellules possèdent des microvilli et des microplaques recouvertes d’une couche de glycocalyx chargé favorisant l’interaction de l’épithélium avec le film lacrymal (Farjo et al. 2008). Ces cellules maintiennent des jonctions serrées empêchant les larmes de pénétrer dans la cornée. Cette barrière empêche aussi des toxines et des microbes d’entrer plus profondément dans la cornée.
1.1.3 Stroma cornéen
Le stroma cornéen est la couche principale de la cornée, occupant 90% de son épaisseur (Michelacci 2003). Le stroma diffère des autres structures de collagène de par sa transparence qui est le résultat d’une organisation précise des fibrilles de collagène et des autres composants de la matrice extracellulaire (Maurice 1970, Boote et al. 2003). Les kératocytes s’insèrent dans la matrice extracellulaire et assurent son intégrité en produisant les protéines matricielles, tels les collagènes et les protéoglycanes.
1.1.3.1 Collagènes du stroma cornéen
Les collagènes sont les protéines les plus abondantes du corps humain et sont essentiels à la cohésion des tissus (Wainsten 2012). Tous les collagènes sont des trimères polypeptidiques composés du produit d’un, deux ou trois groupes de gènes distincts. Il existe 28 types de collagène connus constituant une famille diverse de glycoprotéines regroupées en 3 catégories : fibrillaire, associé au collagène fibrillaire (FACIT; « Fibril Associated Collagens with Interrupted Triple helices ») et non fibrillaire (Shaw et al. 1991, Kadler et al. 1996, Sandberg-Lall et al. 2000, Snellman et al. 2000, Koch et al. 2001, Gordon et al. 2010). Tous les collagènes ont un domaine triple hélices. Ce domaine exige la présence des prolines pour la formation d’hélice alpha et de glycines à tous les trois résidus pour un assemblage en triple hélice. Les collagènes possèdent deux acides aminés uniques, (1) l’hydroxyproline importante pour maintenir la stabilité de la triple hélice et (2) l’hydroxylysine nécessaire pour la glycosylation de la protéine. Le collagène est synthétisé dans le réticulum endoplasmique sous la forme de procollagène ayant des domaines globulaires en N- et C-terminal. Ce procollagène est sécrété dans la matrice extracellulaire
où des protéases spécifiques, qui sont présentes à la surface des cellules, suppriment les domaines globulaires. Les molécules de collagène résultantes peuvent alors s’associer latéralement en un réseau de fibres de collagène de différentes longueurs et diamètres. La lysyl oxydase convertit ensuite les groupes amines sur certaines lysines en groupes aldéhydes qui réagissent aux groupes sur les lysines des autres chaînes, formant alors des liens covalents.
Au niveau du stroma, les fibres de collagène ont un espacement (55 nm) et un diamètre (25-30 nm) réguliers responsables de la transparence cornéenne, propriété unique à ce tissu (Maurice 1957, Benedek 1971, Farrell et al. 1973, Meek et al. 1993, Michelacci 2003, Meek et al. 2004). La matrice extracellulaire du stroma cornéen est principalement composée des collagènes fibrillaires de type I et V (Lee et al. 1984, Birk et al. 1986, Zimmermann et al. 1986, Birk et al. 1988, Michelacci 2003). Ces deux types de collagènes sont présents dans chacune des fibres de collagène. Le type V est impliqué dans l’initiation de l’assemblage des fibres et régule leur diamètre (Birk et al. 1990, Wenstrup et al. 2004, Wenstrup et al. 2006). Les fibres de collagène sont entourées de protéoglycanes spécialisés qui aident à la régulation de la structure et de l’hydratation cornéenne. Le stroma exprime aussi le collagène non fibrillaire de type VI (Cho et al. 1990) et les collagènes FACIT de type XII et XIV (Marchant et al. 2002, Young et al. 2002).
1.1.3.2 Les protéoglycanes
Les protéoglycanes sont des glycoprotéines ayant pour fonction d'emmagasiner l’eau dans un tissu conjonctif. Ils sont composés d’une protéine centrale sur laquelle est attachée par lien covalent au minimum une chaîne de glycosaminoglycane (GAG) (Iozzo 1998). Ces protéines sont divisées en trois familles basées sur l’homologie de leurs séquences d’acides aminés qui leurs confèrent des rôles particuliers, à savoir : 1) de s’intercaler dans la membrane plasmique, 2) de lier l’acide hyaluronique ou 3) de moduler la formation des fibres de collagène. Il existe une grande diversité de protéoglycanes, leurs tailles variant de 20 à 450 kDa. Les GAG sont des chaînes répétées de disaccharides composées d’esters de sulfate et ont une taille pouvant atteindre 70 kDa. Il existe trois types de GAG : 1) le dermatane/sulfate de chodroïtine (CDS; « chondroitin sulfate »), 2) le sulfate de kératane (KS; « keratan sulfate »), et 3) le sulfate d’héparane (HS; « heparan sulfate »). Les chaines CDS et HS sont attachées aux protéoglycanes via un résidu lysine suivi d’un résidu glycine. Les chaînes KS sont attachées à la protéine via les résidus asparagines liés à un résidu sérine ou thréonine. La protéine centrale est produite dans le réticulum endoplasmique et
les chaînes de GAG sont ajoutées dans l’appareil de Golgi. Les protéoglycanes sont ensuite sécrétés dans la matrice extracellulaire (Rada et al. 1993).
Le stroma cornéen contient quatre types de protéoglycanes : 1) le lumicane, 2) le kératocane 3) le mimécane et 4) la décorine (Blochberger et al. 1992, Li et al. 1992, Corpuz et al. 1996, Funderburgh et al. 1997, Liu et al. 1998). La décorine possède un seul GAG (CDS) de 55-60 kDa, alors que le lumicane, le kératocane et le mimécane possèdent entre deux et trois GAG (KS) de 10-15 kDa (Hassell et al. 1979, Midura et al. 1989, Dunlevy et al. 1998). La taille globale de ces protéoglycanes est alors de manière similaire, suffisamment petite pour s’insérer dans l’espace entre les fibres de collagène et ainsi réguler leur espacement (Cintron et al. 1978, Hassell et al. 1983, Chakravarti et al. 1998, Liu et al. 1998, Liu et al. 2003, Beecher et al. 2005). Cette régulation est principalement basée sur les groupes sulfates des chaînes de GAG qui lient l’eau. Cette eau peut ainsi avoir une influence sur l’espacement des fibres de collagène. En condition physiologique normale, les chaînes CDS sont totalement hydratées, alors que les chaînes KS sont déshydratées. Cela suggère que ces dernières agissent comme une réserve à l’hydratation (Bettelheim et al. 1975). Bref, la synthèse coordonnée de différents types de collagène et de protéoglycanes ainsi que leurs modifications post-traductionnelles respectives sont requises pour produire un réseau de fibres de collagène ayant une architecture compatible avec la transparence du stroma cornéen. Un désordre quelconque de ces mécanismes peut entraîner une opacification de la cornée, comme c’est le cas dans la dystrophie stromale cornéenne congénitale humaine associée à une mutation du gène de la décorine (Bredrup et al. 2005, Rodahl et al. 2006).
1.1.4 Kératocyte
Les kératocytes sont les cellules principales du stroma et sont impliqués dans le maintien de l’environnement matriciel. Ils produisent les molécules de collagène, de glycosaminoglycane (GAG), et des métalloprotéases matricielles (MMP; « Matrix metalloproteinase ») nécessaires à l’homéostasie stromale.
1.1.5 Endothélium cornéen
La face postérieure de la cornée est occupée par une monocouche de cellules portant le nom d’endothélium cornéen. Ces cellules dérivées de la crête neurale forment une importante barrière cellulaire entre la chambre antérieure et le stroma cornéen (Wulle et al. 1969, Wulle 1972, Hay 1980, Bahn et al. 1984). Elles ont l’apparence physiologique d’un épithélium monocellulaire perméable (« leaky ») avec une densité chez l’humain d’environ
2500 cellules/mm2 (Bahn et al. 1984, Edelhauser 2006, Srinivas 2010) (Fig. 1.2). Le rôle principal de l’endothélium cornéen est de générer une déshydratation partielle du stroma compatible avec la transparence du tissu tout en assurant un approvisionnement des nutriments nécessaires aux kératocytes et aux cellules épithéliales, et une élimination des déchets produits par ces derniers. Il y parvient via deux mécanismes, une barrière perméable régulant l’absorption de liquide et une pompe active retournant le liquide vers la chambre antérieure (Dikstein et al. 1972, Maurice 1972).
Figure 1.2 Microscopie électronique à balayage de l’endothélium
cornéen
Les cellules endothéliales forment une monocouche de cellules avec une morphologie hexagonale « honeycomb » d’une densité d’environ 2500 cellules/mm2. Elles forment ainsi une barrière imparfaite entre la chambre antérieure et le stroma cornéen. Barre d’échelle = 10 µm. ©Mathieu Thériault.
Pour maintenir la transparence, les cellules endothéliales cornéennes (CEC) doivent conserver une densité minimale critique d’environ 400-700 cellules/mm2 chez l’humain (Mishima 1982, Edelhauser 2006). Les analyses morphométriques des CEC chez le fœtus et l’humain montrent que suivant la formation de la monocouche endothéliale durant le développement cornéen, les CEC ne se divisent pas suffisamment rapidement pour compenser la perte des cellules. Ceci résulte en une attrition cellulaire annuelle d’environ 0.3-0.6% (Murphy et al. 1984, Bourne et al. 1997). La réponse de l’endothélium à cette perte graduelle de cellules, ainsi qu’à des blessures plus grandes, est la migration et
l’élargissement des cellules voisines pour couvrir la zone sans cellule (Laing et al. 1976, Honda et al. 1982, Matsuda et al. 1985b). Ceci cause une augmentation de la taille des cellules (polymégatisme) et une altération de la morphologie hexagonale des cellules (pléomorphisme).
Les cellules ne se divisant pas se retrouvent dans un état de repos (qualifié de phase G0) dans lequel l’ADN est présent sous une forme non dupliquée (2N). Une stimulation mitogénique induit une transition vers une phase de préparation (la phase G1) à la duplication de l’ADN (phase S). La transition de la phase G1 à la phase S est hautement régulée et se traduit par la régulation du facteur de transcription E2F qui active la transcription des gènes requis pour la synthèse de l’ADN (Fig. 1.3) (Leone et al. 1999).
Plusieurs études ont été effectuées pour caractériser l’état des protéines du passage G1/S du cycle cellulaire afin de mieux comprendre la nature non proliférative des CEC humaines (Fig. 1.3). Durant le développement, les CEC prolifèrent et migrent vers le centre de la cornée pour former la monocouche endothéliale (Nuttall 1976). L’analyse par microscopie électronique à transmission montre que la prolifération cesse suivant la formation des contacts cellule-cellule (Wulle et al. 1969, Wulle 1972). Ce mécanisme joue aussi un rôle dans l’inhibition de la prolifération des cellules endothéliales matures (voir section 1.2.2.2) (Joyce et al. 1998). L’inhibition de contact des cellules corrèle avec une augmentation de l’expression de p27Kip1. Des immunobuvardages de type Western ont montré qu’il y avait 20 fois plus de p27Kip1 dans les cellules à confluence comparativement aux cellules à sous-confluence (Joyce et al. 2002, Yoshida et al. 2004).
Dans des endothélia natifs ex vivo humains, le relâchement du contact cellule-cellule par des blessures mécaniques ou par l’ajout d’EDTA promeut la division des cellules suivant leur exposition à des mitogènes (Senoo et al. 2000a, Senoo et al. 2000b). Ainsi, le relâchement du contact cellule-cellule par l’EDTA combiné à l’ajout d’agents mitotiques est la stratégie utilisée pour l’amplification cellulaire in vitro, qui sera discutée à la section 1.6.3. In vivo toutefois, la perte de contact cellule-cellule ne suffit pas à entrainer la division cellulaire. Ceci suggère qu’il n’y a pas suffisamment de stimulations mitogéniques paracrines ou autocrines pour la permettre.
Figure 1.3 Régulation du passage G1/S du cycle cellulaire
En quiescence, E2F est séquestré par la protéine du rétinoblastome pRb, inhibant son activité transcriptionnelle. Pour inhiber E2F, pRb doit être dans un état d’hypophosphorylation. Des stimulations mitogéniques induisent la synthèse de la cycline D qui lie et active la kinase 4 cycline-dépendante (CdK4), et phosphoryle spécifiquement pRb (Sherr 1993). La phosphorylation de pRb entraine le relâchement de la séquestration d’E2F, permettant l’activation transcriptionnelle de ce dernier et l’entrée en phase S. La cycline E est exprimée en phase G1 suivant l’activation d’E2F. Cette cycline s’associe à la kinase 2 cycline-dépendante (CdK2) qui phosphoryle à son tour pRb. La régulation « négative » empêchant la transition G1 vers S est causée par des protéines inhibitrices des complexes cycline/CdK (CKI; « Cyclin-dependent kinase inhibitor »). Il existe deux familles de CKI. La famille INK4 (« Inhibitors of CDK4 ») compte p16INK4a qui lie spécifiquement CdK4 et prévient son association avec la cycline D, ce qui prévient l’initiation de la cascade d’hyperphosphorylation de pRb (Serrano et al. 1993). La famille Cip/Kip (« CDK interacting protein/Kinase inhibitory protein ») inclut p21Cip1 et p27Kip1 (Harper et al. 1993, Polyak et al. 1994). Ces deux inhibiteurs lient les complexes cycline/CdK de la phase G1. La synthèse de p21Cip1 est induite par le facteur de transcription p53, qui est activé par de nombreux processus, comme le stress oxydatif et les dommages à l’ADN (Helton et al. 2007). Le facteur de prolifération transformant (TGF-β) et la formation de contacts cellule-cellule augmentent l’expression de p27Kip (Polyak et al. 1994). Tirée de (Joyce 2012).
1.1.6 Membrane de Descemet
Les membranes basales furent caractérisées par microscopie électronique à transmission comme étant des structures de matrice extracellulaire homogènes, très minces (50-100 nm) et toujours associées à des cellules épithéliales ou endothéliales (Vracko et al. 1967, Vracko et al. 1970, Vracko 1972, Vracko et al. 1972, Vracko 1974, Ruben et al. 1994, Prockop et al. 1995). Leur fonction est de procurer un support structurel et de réguler le phénotype de ces cellules (Aumailley et al. 1986, Paulsson 1992). Elles sont composées de molécules hydrophobes qui s’assemblent à partir d’un processus d’auto-assemblage régulé par des protéines ancrées aux cellules (intégrines, récepteurs, etc.) (Yurchenco et al. 1984, Yurchenco et al. 1986, Yurchenco et al. 1987, Yurchenco et al. 1990, Barnard et al. 1992, Yurchenco et al. 1994a, Yurchenco et al. 1994b, Cheng et al. 1997, Yurchenco et al. 2002). Les principaux composants des membranes basales sont le collagène de type IV, la laminine, le protéoglycane, l’héparane sulfate et l’entactine (Smith et al. 1994, Kalluri 2003). On y retrouve aussi l’agrine, l’ostéopontine, la fibuline, la fibronectine et les collagènes de type XV et XVIII (Schittny et al. 1989, Yurchenco et al. 1990, Paulsson 1992, Ockleford et al. 1993). D’ordre général, les cellules produisent leur propre membrane basale.
L’endothélium cornéen repose sur une membrane basale particulière, appelée membrane de Descemet (DM; « Descemet’s membrane »). Elle est composée de deux couches, la couche antérieure striée (couche fœtale) et la couche postérieure non striée (couche postnatale). La couche fœtale possède une épaisseur de 2-4 µm (Bourne et al. 1982, Naumann et al. 2000, Yuen et al. 2005). Elle est composée de collagène de type VIII formant des fibrilles organisées de manière régulière avec des stries de 90-120 nm qui deviennent de moins en moins précises en approchant la couche postnatale (Kayes et al. 1964, Gottsch et al. 2005, Yuen et al. 2005). Ces fibrilles ont été identifiées comme étant du collagène de type VIII sécrété par l’endothélium (Kapoor et al. 1986, Levy et al. 1996, Kelliher et al. 2011). La couche fœtale conserve la même épaisseur avec l’âge (Kayes et al. 1964).
La couche postnatale apparait au niveau postérieur de la couche fœtale et ne possède pas de stries (Kayes et al. 1964, Naumann et al. 2000). Elle est composée de fibrilles de collagène disposées aléatoirement (Kayes et al. 1964). Puisque l’endothélium cornéen continue de déposer de la matrice extracellulaire tout au long de la vie de l’individu, son épaisseur augmente avec l’âge. Ainsi, à l’âge de 80 ans, elle peut atteindre 15 µm d’épaisseur (Johnson et al. 1982).
La DM ne présente pas une distribution homogène des protéines qui la composent. La partie antérieure renferme des collagènes de types IV α1/α2 et VIII, de fibronectine et de la vitronectine. La partie postérieure est composée des collagènes de types IV α3-α6 et XII, de laminine, d’entactine et de perlécane (héparane sulfate) (Kabosova et al. 2007).
Une étude in vitro a évalué l’effet de la matrice extracellulaire sur les cellules endothéliales. Il en ressort que des composants de la membrane de Descemet, tel le collagène de type IV et la fibronectine ont un effet bénéfique sur la morphologie de ces cellules (Choi et al. 2013). Puisque les composants matriciels de la DM et leurs récepteurs cellulaires (intégrines) sont étudiés au chapitre 2, ces protéines seront décrites dans les prochaines sous-sections.
1.1.6.1 Le collagène de type IV
Le collagène de type IV forme l’élément structural de base des membranes basales (Balleisen et al. 1980, Reddy et al. 1993, Noelken et al. 1994, Kuhn 1995, Morisaki et al. 1995). Il est produit par 6 gènes : COL4A1 à COL4A6, formant respectivement les formes α1 à α6 (Soininen et al. 1987, Hostikka et al. 1988, Hostikka et al. 1990, Leinonen et al. 1994, Mariyama et al. 1994, Oohashi et al. 1994, Zhou et al. 1994). Comme pour tous les collagènes, ces sous-unités s’assemblent en triple hélice. Elles ne forment toutefois que trois combinaisons possibles : α1α1α2, α3α4α5 et α5α5α6 (Timpl et al. 1981, Boutaud et al. 2000, Borza et al. 2001, Borza et al. 2002). Lorsque sécrétés dans la matrice extracellulaire, les brins triple hélice s’associent ensemble pour former un réseau irrégulier d’apparence polygonale dans lequel d’autres composants de la matrice peuvent interagir (Timpl et al. 1981, Yurchenco et al. 1987).
1.1.6.2 Le collagène de type VIII
Le collagène de type VIII est un collagène formant de courtes chaînes agencées en réseau (Sage et al. 1983). On le retrouve dans les membranes basales vasculaires (Sage et al. 1980, Sage et al. 1982, Kittelberger et al. 1989, Kittelberger et al. 1990, Iruela-Arispe et al. 1991, Plenz et al. 1999) et dans la membrane de Descemet (Sawada et al. 1990). Il est le produit de deux gènes : COL8A1 et COL8A2, produisant les collagènes de type VIII α1 ou α2 (Yamaguchi et al. 1989, Muragaki et al. 1991a, Muragaki et al. 1991b). Ces derniers s’associent ensemble de manières hétérogène et homogène pour former des brins triple hélice (Jander et al. 1990, Illidge et al. 1998a, Illidge et al. 1998b, Greenhill et al. 2000). Ces brins s’assemblent en un réseau d’apparence hexagonale (Sawada et al. 1990). Cette
conformation aurait pour rôle d’aider la membrane basale à résister à toute forme de compression sans affecter sa porosité (Shuttleworth 1997, Sutmuller et al. 1997).
Dans la membrane de Descemet saine, les collagènes de type VIII α1 et α2 sont colocalisés à un intervalle régulier et périodique, suggérant un co-assemblage des deux sous-unités où chacune occupe un rôle structurel défini et complémentaire (Gottsch et al. 2005). Dans des cas de mutations du COL8A2 comme la L450W, on observe une perte de cette colocalisation et l’apparition d’un phénotype similaire à la dystrophie endothéliale cornéenne de Fuchs (voir section 1.5.6.1).
1.1.6.3 Les laminines
Les laminines sont des glycoprotéines d’échafaudage extracellulaire responsables de l’organisation primaire de la structure et du développement de la membrane basale (Alberts 2008). Elles disposent d’une grande quantité de domaines de liaison, notamment pour les intégrines (Miner et al. 2004, Sasaki et al. 2004, Alberts 2008). Elles se forment à partir de l’association d’une des 5 sous-unités α, 4 sous-unités β et 3 sous-unités γ pour former 15 combinaisons connues de trimères (Miner et al. 2004, Aumailley et al. 2005, Durbeej 2010). L’identification des laminines suit une nomenclature correspondant aux numéros des sous-unités. Par exemple, la laminine formée des sous-unités α4β1γ1 porte le nom de laminine-411 (Aumailley et al. 2005). Dans la DM, seules les laminines laminine-411 et 511 sont rapportées (Ljubimov et al. 1995, Kabosova et al. 2007).
1.1.6.4 La fibronectine
La fibronectine est le produit d’un seul gène FN1 capable de produire plus de 20 variants d’épissage avec des fonctions distinctes (Kornblihtt et al. 1983, Tamkun et al. 1984, Hynes 1985). Elle prend la forme d’une glycoprotéine composée de deux sous-unités de 250 kDa associées ensemble par un pont disulfure en C-terminal (Hogg 1974). Chaque monomère est composé de 3 types de segments répétés. Le type I est composé de 40 acides aminés et contient 2 sites de ponts disulfures. Le type II est composé de 60 acides aminés et de deux sites de ponts disulfures. Le type III est composé d’environ 90 acides aminés sans pont disulfure. Généralement, un monomère de fibronectine contient 12 segments type I, 2 segments type II et 15-17 segments type III (Skorstengaard et al. 1982, Petersen et al. 1983, Skorstengaard et al. 1984). À cela peut s’ajouter les segments EDA, EDB et une série interchangeable de segments V (pour variable) (Kornblihtt et al. 1984, Kornblihtt et al. 1985, Norton et al. 1987, Schwarzbauer et al. 1987, George et al. 1993).
La fibronectine se divise généralement en deux catégories, la forme soluble et la forme insoluble (ou cellulaire). La forme soluble est un constituant du plasma (300 mg/mL) et peut s’associer à la matrice extracellulaire (Allard et al. 1986). La forme insoluble forme un groupe davantage hétérogène avec des isoformes spécifiques aux cellules qui la produisent avec des propriétés d’adhésions et de solubilité distinctes. La fibronectine insoluble participe directement aux processus de régulation cellulaire de la matrice extracellulaire en interagissant avec les intégrines (Akiyama et al. 1989, Wennerberg et al. 1996, Yang et al. 1996, Sechler et al. 2000).
La fibronectine régule une grande variété d’interactions cellulaires avec la matrice extracellulaire et joue un rôle important dans l’adhésion, la migration, la croissance et la différenciation cellulaire (Yamada et al. 1976, Ali et al. 1977, Grinnell 1978, Hynes et al. 1978, Grinnell et al. 1980, Kleinman et al. 1981, Pankov et al. 2002). Elle est exprimée dans plusieurs types cellulaires, incluant les cellules endothéliales (Birdwell et al. 1978, Jaffe et al. 1978, Macarak et al. 1978, Johansson et al. 1979, Voss et al. 1979, Alitalo et al. 1980, van de Water et al. 1981, Villiger et al. 1981). Elle est aussi essentielle au développement des vertébrés (George et al. 1993).
La fibronectine est un élément essentiel au processus de dépôt de collagène menant à la formation de matrice extracellulaire (Sottile et al. 2002). Par exemple, il a été démontré que l’inhibition du dépôt de fibronectine entraine une inhibition subséquente du dépôt des collagènes de type I et III, inhibition qui peut être renversée par l’ajout de fibronectine (McDonald et al. 1982, Velling et al. 2002). La fibronectine serait aussi essentielle à l’assemblage de plusieurs autres composants de la matrice extracellulaire, tels la fibuline, la fibrilline, la ténascine C, le fibrinogène et la « TGF-β binding protein » (Godyna et al. 1995, Pereira et al. 2002, Dallas et al. 2005, Sabatier et al. 2009).
Dans la cornée, elle a comme fonction principale de faciliter l’interaction cellule-matrice dans des processus de guérison des plaies épithéliales (Suda et al. 1981, Nishida et al. 1982, Tervo et al. 1991, van Setten et al. 1992, Latvala et al. 1995, Tervo et al. 1995, Pankov et al. 2002). La protéine est notamment administrée sous forme de gouttes oculaires dans le traitement de pathologies réparatoires épithéliales (Nishida et al. 1983b, Nishida et al. 1985). On la retrouve dans la membrane de Descemet, mais son rôle spécifique n’y est pas connu (Suda et al. 1981, Fujikawa et al. 1984, Kohno et al. 1987).
Il est probable que la fibronectine contribue au processus d’épaississement naturel de la membrane de Descemet en régulant le dépôt par les cellules des autres protéines de la matrice extracellulaire (McDonald et al. 1982, Sottile et al. 2007).
1.1.6.5 Les intégrines
Les intégrines sont des molécules d’adhésion. Elles régulent l’adhésion cellule-cellule, cellule-matrice et cellule-pathogène. Elles transmettent des signaux bidirectionnels à travers la membrane plasmique et régulent plusieurs fonctions biologiques telles la réparation tissulaire, la différenciation, la migration et évidemment l’adhésion des cellules (Luo et al. 2006, Alberts 2008).
Les intégrines forment des hétérodimères de sous-unités alpha et bêta qui possèdent chacune une grande quantité de membres : α1-α11, αv, αE, αIIb, αM, αL, αX et β1-β8. Jusqu’à 24 combinaisons rapportées d’intégrines assurent une grande diversité de liaisons à des ligands, tels les collagènes, les ténacines, la fibronectine, la vitronectine et les laminines (Fig. 1.4). Certains hétérodimères αβ lient un seul ligand alors que d’autres peuvent s’associer à plusieurs. Ces combinaisons d’hétérodimères αβ peuvent être classifiées en trois grandes familles, à savoir β1, β2 et αv.
La première famille est basée sur la sous-unité β1. Elle peut former des hétérodimères avec 12 sous-unités alpha (α1 à 11 et αv). La famille β1 est présente dans les cellules dérivées des trois types de tissus (endoderme, ectoderme et mésoderme). Des expériences de « knock-out » ont montré le rôle essentiel de cette famille dans le développement embryonnaire, l’organogénèse, hématopoïèse, ainsi que la formation des os, de la peau et des cheveux (Fassler et al. 1995, Stephens et al. 1995, Potocnik et al. 2000, Raghavan et al. 2000, Sheppard 2000, Bouvard et al. 2001, Globus et al. 2005, Stepp 2006).
Une autre famille est basée sous la sous-unité β2. Elle forme des hétérodimères avec 3 sous-unités alpha (αL, αM, αX). Elles sont impliquées dans la fonctionnalité des cellules immunitaires. Leurs ligands sont presque exclusivement des membres de la famille des IgG et non des protéines de la matrice extracellulaire (Mayadas et al. 2005).
L’intégrine αv porte son nom via sa capacité à lier la vitronectine et forme sa propre famille d’intégrines. Elle lie les sous-unités β1, β3, β5, β6 et β8. Tous les hétérodimères d’intégrines αv reconnaissent la séquence de trois acides aminés arginine-glycine-acide aspartique (RGD) de la fibronectine. L’intégrine αvβ3 est un important médiateur de
l’angiogenèse (Tucker 2003). Les intégrines αvβ5, αvβ6 et αvβ8 sont des médiateurs de l’activation du TGF-β (Sheppard 2004).
Il existe d’autres combinaisons d’intégrines qui ne font pas partie d’une famille. L’intégrine αIIbβ3 est retrouvée dans les plaquettes (Marcinkiewicz 2005), alors que αEβ7 est exprimée par les cellules immunitaires et favorise leur migration intra-épithéliale en se liant à la E-cadhérine (Strauch et al. 2001, Hadley 2004). L’intégrine α6β4 est une composante des hémidesmosomes (Stepp et al. 1990, Gipson et al. 1993, Van den Bergh et al. 2003).
Figure 1.4 Intégrines liant la matrice extracellulaire
Les intégrines s’associent à plusieurs molécules de la matrice extracellulaire. Ce diagramme montre les différentes associations possibles pouvant lier la fibronectine, la vitronectine, la laminine et les collagènes. Tirée de (Stepp 2006).
À l’intérieur des cellules, les intégrines s’associent au cytosquelette d’actine avec l’aide d’intermédiaires comme la taline, la vinculine, l’α-actinine et la filamine. Les intégrines font plus que seulement générer une adhésion à la matrice extracellulaire. Elles recrutent notamment des oncogènes comme la « focal adhesion kinase » (FAK) via des intermédiaires comme la taline et la paxilline. Les FAK sont des tyrosines kinases capables de s’autophosphoryler suivant leur dimérisation. Cette réaction forme un site de liaison phosphotyrosine capable d’activer la famille des kinases Src et ainsi influencer la prolifération des cellules (Hynes 2002, Luo et al. 2006, Alberts 2008). De manière similaire, les intégrines influencent aussi la voie AKT et la famille des RHO GTPases impliquées dans la survie et la motilité cellulaire (Hynes 2002).
L’endothélium produit plusieurs de ces hétérodimères, notamment α2β1, α3β1, α5β1, α6β1, αvβ3 et αvβ5 (Joyce et al. 1998, Ljubimov et al. 1998, Rayner et al. 1998, Collins et al. 2004).
1.2 La déturgescence cornéenne
La transparence cornéenne est le résultat d’un ingénieux processus de déshydratation stromale, nommé déturgescence cornéenne, permettant d’assurer un agencement optimal des fibres de collagène nécessaire afin d’éviter une diffusion aléatoire de la lumière nuisible à la vision. Cette déturgescence dépend des barrières physiques formées par l’épithélium et l’endothélium, de la pompe endothéliale et de la pression intraoculaire (PIO) (Costagliola et al. 2013). Tous ces éléments, ensemble, génèrent une pression sur le stroma qui fait opposition à la pression exercée par la force d’attraction des protéoglycanes pour l’eau et assure ainsi une hydratation du tissu avoisinant les 3.5mg d’H2O par mg de matière sèche (Turss et al. 1971). Ce processus est en grande partie régulé par l’endothélium cornéen via ses deux mécanismes de barrière et de pompe endothéliales qui seront décrits plus en détail dans les sections 1.3 et 1.4. Pour bien comprendre la contribution l’endothélium à la déturgescence cornéenne, il m’apparaît toutefois important d’introduire en premier lieu la relation des forces impliquées dans le phénomène.
La régulation de l’hydratation stromale doit se faire en considération avec la pression osmotique entre l’intérieur et l’extérieur du stroma (Hodson 1971, Elliott et al. 1980). L’attraction du stroma à l’égard de l’eau est attribuable aux GAGs du stroma. Les GAGs sont de longues molécules formées d’une répétition de disaccharides souvent sulfatés qui ont la capacité d’être chargés. Un stroma déshydraté présente moins d’espace entre les charges négatives. Cela attire l’eau parce ces charges cherchent à s’éloigner et utilise l’eau pour y arriver. Dans un stroma hydraté, l’eau a déjà éloigné les charges répulsives. Cela le rend donc moins enclin à attirer davantage d’eau. Puisque le stroma doit être déshydraté à un niveau compatible avec la transparence, l’endothélium doit trouver des méthodes afin de compenser l’attirance pour l’eau des protéoglycanes chargés. En théorie la déturgescence peut être établie via deux stratégies. La première est de manipuler la concentration des molécules chargées de manière à réduire, relativement à l’extérieur du stroma, la quantité de charges dans le stroma avec pour effet de générer une pression osmotique entrainant le liquide à l’extérieur. La deuxième stratégie est de forcer mécaniquement la sortie du liquide via, par exemple, un mécanisme de pompe. L’endothélium semble utiliser une combinaison de ces deux stratégies.
1.2.1 Pression de gonflement
Il fut très tôt démontré in vitro qu’il existait une relation linéaire entre l’épaisseur cornéenne et son niveau d’hydratation (Hedbys et al. 1962). Il fut aussi démontré très tôt qu’il était nécessaire d’exercer une pression sur le stroma excisé et désépithélialisé pour empêcher son hydratation et/ou le garder mince. Cette pression fut nommée pression de gonflement (PG), puisqu’elle correspond à la force nécessaire pour empêcher le gonflement du stroma. Elle fut mesurée chez le félin à 100 mmHg en déposant des poids sur un stroma immergé dans de l’eau distillée (Kinsey et al. 1942). Cette valeur fut aussi déterminée à l’aide d’un modèle mathématique chez le lapin (Leung et al. 2011, Cheng et al. 2015b). Il fut aussi démontré que cette PG pouvait être diminuée en immergeant la cornée dans des solutions salines. Par exemple, une solution NaCl 1% réduit la PG à 30 mmHg chez le félin (Kinsey et al. 1942). Plusieurs études ont estimé la PG physiologique à environ 55-75mmHg (Pau 1954, Dohlman et al. 1957, Hedbys et al. 1963a). Toutefois, la technique mesurant la PG n’étant pas utilisable in vivo, cette valeur restait approximative. Il a d’ailleurs été suggéré qu’en considérant l’importante fluctuation de la PG suivant la salinité in vitro, la déturgescence pourrait survenir en réduisant cette pression à 0 par un jeu d’osmolarité entre le stroma et son environnement (Dohlman et al. 1962, Stiemke et al. 1992).
1.2.2 Pression d’imbibition
Pour déterminer s’il existait une pression de gonflement dans le stroma in vivo, une nouvelle méthode a été développée qui consiste à mesurer l’attirance du stroma pour un liquide en introduisant dans le tissu une canule connectée à un détecteur. Cette attirance fut appelée pression d’imbibition (PI) puisqu’elle se définit par la capacité d’un tissu à s’imbiber de liquide (Langham 1962). Cette technique fut utilisée in vitro sur des cornées bovines excisées et donna des résultats similaires à la mesure de PG (Hedbys et al. 1963a). Normalement, si in vivo la PG était réduite à 0 par un jeu d’osmolarité, la PI elle aussi devrait être de 0. La PI mesurée in vivo chez le lapin montra toutefois une PI d’environ -30-40 mmHg, suggérant la présence d’une pression de gonflement résiduelle dans une cornée transparente (Hedbys et al. 1963b). La plus faible valeur obtenue in vivo de PI par rapport aux valeurs de PG de 55-75 mmHg in vitro fut attribuée à la pression intraoculaire (PIO) qui exercerait une pression sur le stroma comme lorsqu’on utilise un poids pour mesurer la PG (Dohlman et al. 1962). Cela suggérait que la déturgescence cornéenne était le résultat d’une combinaison de la PIO et d’un autre élément générant cette pression d’imbibition. Cet autre élément fut identifié comme étant les fonctions de pompe et de barrière de l’endothélium