T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul Sabatier Discipline ou spécialité : Immunologie
JURY
Dr MILON Geneviève, Directrice de recherche, Institut Pasteur Paris Dr LOCHT Camille, Directeur de recherche, Institut Pasteur Lille Pr SCHWARTZ Olivier, Professeur, Institut Pasteur Paris
Dr.CHARBIT Alain, Directeur de recherche, Faculté de Necker Paris Dr TAILLEUX Ludovic, Chargé de recherche, Institut Pasteur Paris Pr VAN MEERWIJK Joost, Professeur, Université Toulouse III Pr GICQUEL Brigitte, Professeur, Institut Pasteur Paris
Dr NEYROLLES Olivier, Chargé de recherche, IPBS Toulouse
Rapportrice Rapporteur Examinateur Examinateur Examinateur Examinateur Membre invité Directeur de thèse
Ecole doctorale : Biologie-Santé-Biotechnologies
Unité de recherche : Institut de Pharmacologie et de Biologie Structurale- CNRS UMR5089
Unité de Génétique Mycobactérienne- Institut Pasteur Paris
Directeur(s) de Thèse : NEYROLLES Olivier
Présentée et soutenue par TANNE Antoine Le 22 décembre 2009
Etude du rôle des homologues de DC-SIGN dans le modèle murin
d'infection par Mycobacterium tuberculosis
- 1 -
Remerciements
C’est aujourd’hui avec un réel pincement au cœur que j’en arrive à écrire ces remerciements car ils sont la conclusion finale de ces années de travail et d’épanouissement aux cotés de mes collègues et de mon directeur de thèse. Il est temps maintenant pour moi de me lancer dans le grand bain de la recherche.
Tout d’abord, je tiens à remercier l’ensemble des membres de mon jury d’avoir accepté d’évaluer mes travaux de thèse. Je remercie plus particulièrement Geneviève Milon et Camille Locht d’avoir accepté d’en être les rapporteurs. Un grand merci également à Alain Charbit d’avoir accepté d’examiner mes travaux. Merci Alain d’avoir nourri ma passion pour la recherche lors de mon court passage dans votre laboratoire. Je remercie les professeurs Joost Van Meerwijk et Olivier Schwartz d’avoir accepté de m’accorder un peu de leur précieux temps pour évaluer mes travaux. Je voudrais remercier Brigitte Gicquel pour sa présence au sein de mon jury, mais aussi, et surtout, pour m’avoir accueilli dans son unité à l’Institut Pasteur et pour m’avoir permis de travailler aux côtés d’Olivier Neyrolles. Merci beaucoup Brigitte pour toute la confiance que vous avez témoignée à mon égard, pour nous avoir permis et encouragé à effectuer ces travaux. Merci pour tous les moyens que vous avez mis à ma disposition pour que je puisse parvenir à mes fins. Bien entendu, ce fut aussi pour moi un grand plaisir d’être évalué par mon ancien collègue, Ludovic Tailleux. J’ai passé de bonnes années à tes cotés ; merci pour ton aide, tes conseils et pour nous avoir toujours mis au courant des derniers potins de Pasteur. Merci d’avoir apaisé l’atmosphère certains jours difficiles et surtout un grand merci pour ces crises de fous rires lorsque nous entreprenions de faire des blagues à notre très cher chef.
J’adresse la majorité de mes remerciements à mon directeur de thèse : Olivier Neyrolles. Je rigolais le jour où Ludovic m’a dit : « Antoine ; Olivier ce n’est pas ton chef ! C’est ton mentor ; tu dois le vénérer. » Je crois qu’aujourd’hui j’en suis presque venu à ce stade. Olivier, je te dois énormément, je te remercie pour ton dévouement, ton humanisme, ta patience et toute la volonté que tu as mise pour tirer de moi le meilleur et faire qu’aujourd’hui la recherche est vraiment pour moi une passion et une dévotion. Je te remercie pour toute la confiance que tu as eue en moi et tous les moyens et l’énergie que tu as dépensés pour que nous puissions parvenir à mener à bien notre projet. J’ai vraiment du mal à m’imaginer travailler avec d’autres chercheurs mais ma chance est qu’aujourd’hui, grâce aux méthodes et à la volonté de travailler que tu m’as inculquées je sais que chaque jours je m’épanouirai en faisant de la recherche. Lorsque je discute avec d’autres étudiants, je me rends vraiment
- 2 - compte de la chance que j’ai eue de t’avoir pour encadrer mon travail et diriger mes recherches. Je pense qu’il sera difficile de retrouver autant de complicité au travail et cela va vraiment me manquer. Tu m’as aidé à vraiment mûrir et m’épanouir dans mon travail et surtout tu m’as appris à persévérer et cela me servira chaque jour de ma future carrière. Encore merci Olivier pour tout.
La suite de mes remerciements s’adresse à l’ensemble de mes collègues et collaborateurs. Tout d’abord à mes collègues de Pasteur et plus particulièrement à Fred, sans qui mes travaux sur les souris n’auraient jamais été réalisables. Un grand merci à toi Fred et je vous félicite toi et Camille pour l’heureux évènement qui se profile. Je remercie aussi L.Barreiro pour m’avoir appris à maitriser les différentes facettes de la RT-PCR. Tous mes remerciements à Sandrine, Patricia et Marie Renée pour votre aide. Je remercie aussi mes collègues et amis, Helena, Tiago, Niaina et ceux que j’oublie pour les bons moments passés à vos cotés à Paris.
Suite à mes trois premières années à Paris je suis venu avec Olivier à Toulouse où j’ai pu concrétiser mes travaux de recherche en trouvant un réel second souffle grâce à la beauté de cette région et à l’ensemble des personnes travaillant à l’IPBS. Mes quelques années au sein de l’IPBS ont vraiment contribué à la réussite de mes travaux. Je tiens à remercier l’ensemble des gens avec qui j’ai interagi notamment à la gestion (merci Annie), et l’animalerie (Jean-Michel et Jean-Pierre) et plus particulièrement Laurence. Bien sûr je remercie mes collègues de l’ancienne équipe « Altare » (Yannick, Pascale et Florence). Je les remercie de m’avoir accepté à leurs cotés et de m’avoir permis de rapidement m’adapter à mes nouvelles conditions de travail. Je remercie particulièrement Florence pour l’aide qu’elle a pu me fournir. Je remercie Hélène qui fut ma première étudiante et qui m’a permis de réaliser que je ne suis peut être pas très bon pédagogue car peut-être trop exigent et impatient. Je te souhaite bonne continuation pour tes travaux de recherche et je te félicite pour le début de ta carrière rugbalistique. Je remercie mon petit Firmin (le p’tit homme pas drôle) pour m’avoir fait rigoler, je sens que tu as un très gros potentiel et qu’en canalisant ton énergie et tes idées tu feras une super thèse. Je remercie également Denis pour sa disponibilité et ses réponses à toutes mes questions, de même je tiens à remercier Geanncarlo pour ses précieux conseils et son aide dans mes démarches anglophones : « Enjoy your time in France… » Je tiens aussi à m’excuser auprès de mes collègues pour les « mauvais » jours mais certaines périodes de la vie et de la thèse sont parfois plus dures que d’autres et déteignent sur l’humeur.
Je remercie Germain Puzo et Jerome Nigou pour m’avoir fourni tous mes ligands mycobactériens. Je remercie Audrey, Fumky, Guillaume C, Guillaume T, Gaëlle, Nathalie,
- 3 - Caro, Christine, Julien pour les discussions scientifiques ou non, et l’aide que vous avez pu m’apporter.
Enfin les gens qui me connaissent, savent que l’une des clefs de ma réussite réside dans mon bien être que je dois à tout mes amis, ma famille et à Jess.
Tout d’abord je remercie ma « famille d’adoption », un grand merci à ma petite Constance et à mon petit Jon. Qui aurait pu prédire que les deux provinciaux du magistère de génétique deviendraient, binôme, meilleurs amis, témoins, et qu’ils soutiendraient leurs thèses à 4 jours d’écart. Franchement merci Jon, sans toi le cursus aurait été beaucoup plus pesant. Merci à toi Constance d’avoir supporté nos révisions un peu spéciales. Merci pour toutes les fois où je suis venu m’assoir à votre table. Jon tu seras et resteras le pote qui a survécu à la froideur des bancs de la fac.
Je remercie tout mes amis rencontrés à Toulouse et travaillant avec Jon tel que Ramy, ma petite Péco, le petit Alex « Rodrigo » et Sophie. Mon petit Rodrigo dépêche toi de finir ta thèse et viens nous rejoindre en post-doc pour que l’on puisse se faire des royales sessions de Wake et de Snow.
Je remercie Damien de m’avoir fait découvrir la vie toulousaine, merci pour tout mon « petit Daminou » tu m’as fait rencontrer des gens génialissimes. Tous d’abord ma petite Christelle tu es une fille géniale et je t’adore, encore merci pour tout à toi et Nico (le meilleur mari du monde) ; vous allez trop me manquer. Je remercie bien sur Hein, Tonton, et Ken pour leur présence hebdomadaire les week-ends à nos cotés. Merci à Naouf, Colin, Anais et bien sûr à mon future collègue de trekking j’ai nommé, « Kaiser Laurent ».
Je remercie également tout mes amis bas normands, avec une mention spéciale à mon Philou, et Kévin qui m’ont toujours permis de positiver et surtout de me motiver à bloc pour me donner les moyens de réussir.
Enfin je remercie bien entendu toute ma famille qui m’a toujours soutenu et qui m’a permis de réussir dans mes études. Je suis profondément reconnaissant envers la dévotion de mes parents et tout ce que vous avez fait, et faites encore, pour moi. Sans vous tout cela n’aurait jamais été possible. Je dédie en partie cette thèse à mes grands parents qui ont eu en cette année 2009 une année éprouvante et je souhaite profondément que les choses s’arrangent. Je dédie bien sure aussi cette thèse à Jessica. Merci de m’avoir soutenu et d’avoir tenu le coup malgré mon départ à Toulouse. Sans toi tout aurait été plus difficile. Je te remercie de m’avoir supporté pendant toutes mes périodes de stress et de doute et pour m’avoir épaulé pour l’écriture de ce manuscrit. Je te remercie aussi pour tout le bonheur que tu m’as apporté et qui a beaucoup contribué à ma réussite.
Abréviations :
ADN : Acide désoxyribonucléique Ag : Antigène
AP1 : Activating Protein 1 ARN : Acide ribonucléique ARNr : ARN ribosomique ATG : Autophagy Related Genes ATP : Adénosine triphosphate
BAL : Broncho-Alveolar Lavage
BALT : Bronchial Associated Lymphoid Tissue BCG : Bacille de Calmette et Guérin
BCL10 : B-Cell Lymphoma 10
BSSL : Bile Salt Stimulated Lipase
CARD : Caspase Recruitment Domain CCl2 : Chemokine Ligand 2
CEA :Carcino-Embryogenic Antigen
CEACAM : carcino-embryogenic antigen adhesion
molecule
CFP-10 : 10 kDa culture filtrate protein
CFU : Colony Forming Unit
CLEC9A: C-type Lectin domain family 9 member
A
CMH : Complexe majeur d’histocompatibilité
CNK : Cellules Natural Killer
CPA : Cellules Présentatrices d’Antigènes CR : Complement Receptor
CRD : Carbohydrate Recognition Domain CTL : C-Type Lectin
CXCL : Chemokine (C-X-C motif) ligand DAMPS : danger associated molecular patterns DC :Dendritic Cell
DC-SIGN : Dendritic Cell-Specific Intercellular
adhesion molecule-3-Grabbing Non-integrin
DEC205 : Dendritic and Epithelial Cells, 205 kDa
Dos : Dormancy survival
DOTS :Directly Observed Therapy, Short-course ERK : Extracellular signal-Regulated Kinase
ESAT-6 : 6kDa Early Secreted Antigenic Target
FN : Fibronectin
G-CSF : Granulocyte-Colony Stimulating Factor
GFP : Green Fluorescent Protein GPI : Glycosylphosphatidylinisotol
H1N1/H5N1 : Hémaglutinine de type 1/5,
Neuraminidase de type 1
HLA : human leukocyte antigen
ICAM : Inter-Cellular Adhesion Molecule
IFN : Interferon
IkB kinase : Inhibitor of NF-kB Kinase
IL12Rb1 : Interleukin 12 receptor b 1
IRAK1-4/M : Interleukin-1 Receptor-Associated
Kinase 1-4/M
IRF : Interferon Regulatory Factor
IRGM1 : Immunity-related GTPase Family, M-1 ITAM : Immunoreceptor Tyrosine-based
Activation Motif
JNK : Jun N-terminal Kinase
KD : Knock Down KO : Knock Out
KSR1 : Kinase Suppressor of RAS-1
LAM :Lipo-Arabino Mannan
LARG : Leukemia-associated Rho guanine
nucleotide exchange factor
LB :Lymphocytes B LCN :Lipocalin
LFA-1 : Lymphocyte function-associated antigen 1 LM : Lipo Mannan
LPS : Lipopolysaccharide
LSECTin :Liver and Lymph node Sinusoidal
Endothelial cell C-Type lectin
LT reg : LT régulateur LT : Lymphocyte thymiques
MALT1 : Mucosa-Associated Lymphoid Tissue
lymphoma translocation protein 1
MAMPS : Microbe Associated Molecular Patterns MAP-kinase : Mitogen-Activated Protein kinase MARCO : Macrophage Receptor with
Collagenous structure
MBL : Mannose Binding Lectin
MCP-1 : Monocyte Chemoattractant Protein-1
MCs : monocytes circulants MDR : multi drug resistant
MEP : Malnutrition Energétique Protéique MIP1 : Macrophage Inflammatory Proteins 1 MR : Mannose Receptor
MyD88 : Myeloid Differentiation primary response
gene (88)
NADH : Nicotinamide adénine dinucléotide NADPH : Nicotinamide Adénine Dinucléotide
Phosphate
NFAT : Nuclear Factor of Activated T-cells NF-kB : Nuclear Factor-kappa B
NK : Natural killer
NKG2D : Natural Killer Group 2D NKt :Natural Killer T cell
NLR : Nod Like Receptor / Nucleotide-binding
domain, Leucine-Rich repeat containing
NLRP3 :Nod Like Related Protein 3 NO : monoxyde d’azote
NOD : Nucleotide oligomerization domain NRAMP1 : Natural Resistance-Associated
Macrophage Protein
OMS : Organisation mondiale de la santé
PAK : p21 activated kinase
PGL : glycolipide phénoliques PIB : Produit Intérieur Brut PIM : Phosphoinositol Mannosides PIP : Phospho-Inositol monophosphate
PMA: Phorbol 12-myristate 13-acetate
PMN :Poly-Morpho Nuclear
PRR : Pathogen Recognition Receptor RAG : Recombination Aactivating Gene RANTES : Regulated on Activation, Normal T
Expressed and Secreted
RNAi : RNA interference
RNI: Reactive Nitrogen Intermediate RNS : Reactiv Nitrogen Species ROI : Reactive Oxygen Intermediate ROS : Reactiv Oxygen Species
Abréviations :
SIDA : Syndrome d’Immunodéficience Acquise SIGIRR : Single Immunoglobulin IL-1R-Related
Molecule
SIGNR : (DC)-SIGN Related Si-RNA : Small interfering RNA SNP : Single Nucleotid Polymorphism
SOCS : Suppressor Of Cytokine Signaling proteins
SPA/D : Surfactant Protein A/D
SPR210 : Surfactant Proteinreceptor 210 SRA : Scavenger Receptor A
SRAS : syndrome respiratoire aigu sévère
Src : Sarcoma kinase
SYK : Spleen tyrosine Kinnase TB : Tuberculose
TCR : T-Cell Receptor
TDB : Trehalose-6,6-dibehenate TDM : Trehalose-6,6-dimycolate TGF : Transforming growth factor Th1/Th2 /Th17: T helper 1/2/17 TIR : Toll-Interleukin-1 Receptor
TIRAP : Toll-Interleukin 1 Receptor (TIR) domain
Containing Adaptor Protein
TLR : Toll Like Receptor TNF : Tumor Necrosis Factor
TNF-R : Tumor Necrosis Factor Receptor TOLLIP : Toll Interacting Protein TRAF : TNF Receptor Associated Factor TRAM : Toll-like Receptor Adaptor Molecule TRIF : TIR-domain-containing adapter-inducing
interferon-β
TST :Tuberculin Skin Test VDR : Vitamin D Receptor
VIH : Virus d’immunodéficience humaine VPS34 : Vacuolar Protein Sorting 34 XDR : Extreme drug resitant
- 4 -
Sommaire
INTRODUCTION ... 6
-A. HISTOIRE ET EPIDEMIOLOGIE ... 7
-1. Epidémiologie ... 8
-a) Les facteurs sociaux de la tuberculose ... 8
-(1) L’impact de la coinfection VIH-tuberculose ... 9
-(2) Malnutrition et tuberculose ... 9
-b) Autres facteurs ... 11
-(1) L’effet néfaste des fumées ... 11
-(2) Alcool et autres drogues ... 12
-(3) Tuberculose et traitements anti-TNF (tumor necrosis factor) ... 13
-c) Les facteurs de risques endogènes : âge, sexe et génétique ... 13
-(1) L’âge ... 13
-(2) Le sexe ... 14
-(3) La génétique ... 14
-2. Etiologie de la tuberculose ... 16
-a) Les mycobactéries et le complexe « Tuberculosis » ... 16
-b) Mycobacterium tuberculosis ... 17
-3. La lutte contre la tuberculose ... 19
-a) Les politiques de lutte ... 19
-(1) La stratégie DOTS ... 19
-(2) Global Plan to Stop TB ... 19
-b) Les outils de lutte actuelle et les enjeux de la recherche ... 20
-(1) Le système de détection ... 20
-(2) Les antibiotiques ... 22
-(3) Vers de nouveaux antituberculeux ... 24
-(4) Les vaccins ... 26
-B. LE BACILLE ET LE SYSTEME IMMUNITAIRE DE L’HOTE ... 29
-1. La réponse immunitaire innée ... 29
-a) Les PRRs opsonisants ... 29
-(1) Le Récepteur du complément de type 3 (CR3) ... 29
-(2) Les collectines (SPA, SPD et fibronectine) ... 30
-(3) Le récepteur des fractions constantes des IgGs (FcγR) ... 32
-(4) La « mannose binding lectin » (MBL) ... 32
-b) Les récepteurs membranaires ... 33
-(1) Les Récepteurs Scavengers (SRs ; scavenger receptors) ... 33
-c) Les récepteurs senseurs de dangers ... 35
-(1) Les récepteurs Toll-like (TLRs) ... 35
-(2) Les récepteurs de type NOD (NLR (Nucleotide oligomerization domain (Nod) like receptors)) ... 41
-(3) Les lectine de type C transmembranaires ... 44
-2. Les mycobactéries et la réponse immunitaire innée ... 48
-a) Les macrophages et cellules dendritiques quiescentes ... 48
-- 5 --
(2) L’évasion cytoplasmique ... 51
-(3) L’auto-phagocytose ou autophagie (Figure 18) ... 52
-(4) L’apoptose ... 56
-b) Le macrophage activé ... 57
-(1) L’activation induit la maturation de la vacuole mycobactérienne et l’autophagie ... 58
-(2) L’acidification ... 58
-(3) Les ROS (reactiv oxygen species) et RNS (reactiv nitrogen species) ... 59
-(4) Les peptides antimicrobiens ... 60
-3. Dynamique de l’infection et mise en place de la réponse adaptative ... 63
-a) Régulations de l’équilibre immunitaire ... 63
-b) L’entré du bacille et sa multiplication ... 64
-(1) La mise en place d’un état inflammatoire local (Figure 20) ... 65
-(2) L’activation des DCs et la mise en place de la réponse adaptative (Figure 20) ... 68
-(3) La tuberculose chronique chez la souris et chez l’homme ... 70
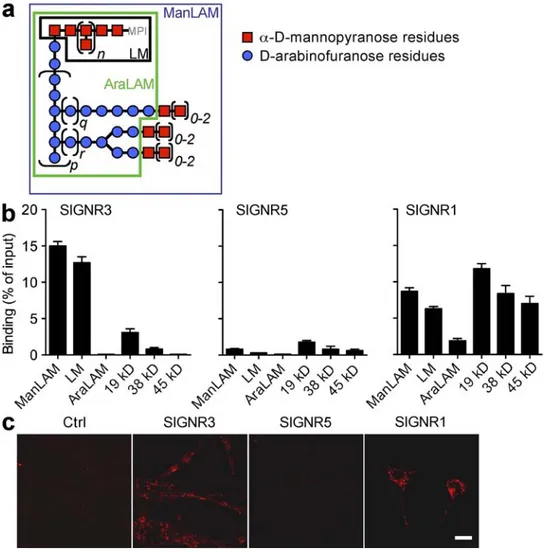
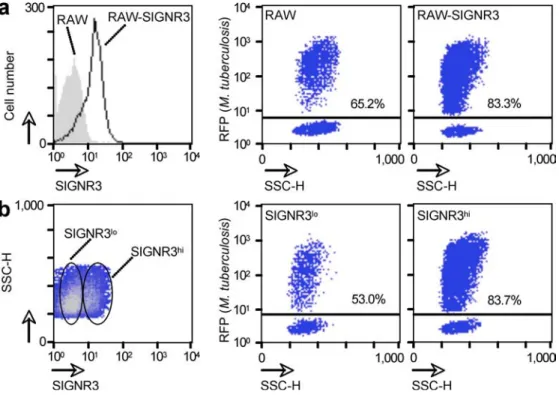
-C. DENDRITIC CELL-SPECIFIC (ICAM)-3 GRABBING NON-INTEGRIN (DC-SIGN, CD209) ... 75
-1. Etude structurale ... 75
-a) Le domaine intracellulaire ... 76
-b) La charnière extracellulaire ... 76
-c) Le domaine fonctionnel ... 77
-2. DC-SIGN peut interagir avec des motifs endogènes ... 78
-3. DC-SIGN peut interagir avec des motifs exogènes ... 79
-a) Le rôle de PRR de DC-SIGN (Tableau 4) ... 80
-b) DC-SIGN peut interagir avec M. tuberculosis (Tableau 4) ... 80
-4. Etude fonctionnelle de DC-SIGN ... 83
-a) DC-SIGN est un récepteur phagocytaire ... 83
-b) Le role immunomodulateur de DC-SIGN ... 84
-(1) Le signalosome DC-SIGN favorise la sécrérion d’IL10 par le TLR4 via la voie ERK (Figure25) ... 84
-(2) DC-SIGN module la réponse immunitaire de manière Raf-dépendante et ERK-indépendante ... 85
-RESULTATS ... 88
-A. GENERALITES SUR LE COMPLEXE SIGN MURIN ... 88
-1. Fonctions du complexe SIGN ... 88
-a) Interactions avec des motifs endogènes ... 90
-b) Leur rôle de PRRs ... 90
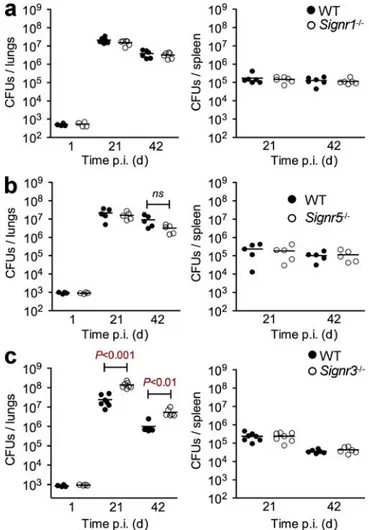
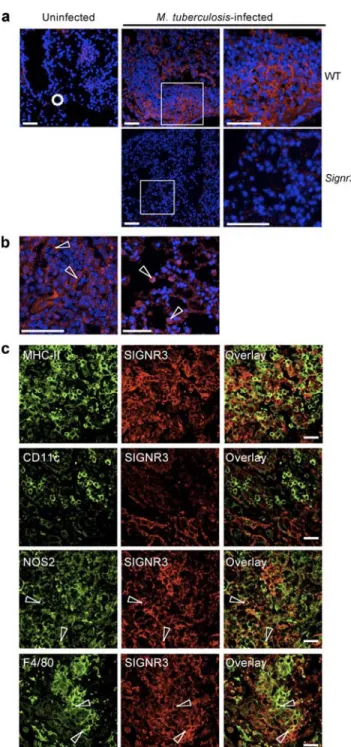
-c) Etude du rôle du complexe murin dans l’infection par M. tuberculosis. ... 92
-B. L’UN DES HOMOLOGUES MURINS DE DC-SIGN CONTRIBUE A LA PROTECTION CONTRE M. TUBERCULOSIS.. - 93 -1. Publication : ... 93
-2. Discussion et perspectives ... 114
-C. DE LA SOURIS A L’HOMME : ETUDE DU ROLE DE DC-SIGN AU COURS DE L’INFECTION ... 121
-CONCLUSION ... 124
-- 6 --
Introduction
Bien que les principales causes de morbidité et de mortalité dans les pays développés aient progressivement évolué vers les maladies non transmissibles et un ensemble de pathologies regroupées sous le terme de maladies chroniques (cancers, cardiopathies, obésité et syndromes euro-dégénératifs) (Figure 1A), les maladies infectieuses restent la principale cause de mortalité chez les enfants et les jeunes adultes dans le monde (Figure 1B ) et tuent chaque année entre 14 et 17 millions de personnes, principalement dans les pays en développement (Mathers and Loncar, 2006).
Six grandes pathologies sont à elles seules à l’origine de 90 % des décès liés à des agents infectieux (Figure 2): les pneumopathies aigües (pneumonies et grippes), la tuberculose, les diarrhées (choléra et dysenterie), les différentes formes de paludisme, les infections infantiles (rougeole) et le SIDA (Mathers and Loncar, 2006; OMS/WHO, 2009 ). De nos jours, des épidémies telles que la grippe porcine H1N1 en 2009-2010 ou la grippe aviaire H5N1 en 2007-2008 sont mises en avant par crainte d’une pandémie mondiale pouvant faire de nombreux morts (la grippe dite « espagnole » tua ainsi entre 30 et 100 millions de personnes entre 1918 et 1919). Cependant, d’autres pathologies telles que le SIDA, la tuberculose ou le paludisme, sévissent depuis des décennies et ont un impact dramatique sur les populations, en particulier dans les régions en développement telles que l’Afrique Subsaharienne et l’Asie où elles font chaque année plus de morts que les nombreux conflits armés qui s’y déroulent. Ainsi en 2007 l’Organisation Mondiale de la Santé (OMS) a recensé 13,7 millions de personnes malades de la tuberculose dont 9,3 millions de nouveaux cas. Chaque année cette maladie tue plus de 1,7 millions de personnes (OMS/WHO, 2009).
La tuberculose est une pathologie transmissible par voix aérienne depuis un malade vers un individu sain qui inhale des gouttelettes contenant quelques bacilles (Figure 3). Les bactéries pénètrent dans les voix aériennes jusqu’aux alvéoles où elles interagissent avec différents acteurs de la réponse immunitaire innée du compartiment alvéolaire. La réponse immunitaire adaptative qui s’en suit et l’accumulation de lymphocytes aux points d’infection dans des structures typiques appelées « granulomes » permet le contrôle de l’infection dans la grande majorité des cas (sans doute plus de 90%). Chez une minorité d’individus qu’on estime à environ 5%, l’infection et la maladie se développent, malgré la réponse immunitaire, dans les quelques mois qui suivent la primo-infection ; on l’appelle alors tuberculose primaire. Chez les autres individus, la tuberculose se développe plus tard au cours de la vie (avec un risque d’environ 1-2% par an), après une période asymptomatique dite de « latence » ; on l’appelle
Maladies infectieuses
Décés accidentels Complications périnatales, Maladies non transmissibles
Infections post-partum et malnutrition 2002 2015 2030 26% 23% 21% 59% 63% 66% 6% 5% 4% 9% 9% 9%
0-4 ans 5-14 ans 15-59 ans + 60 ans
Maladies infectieuses
Autres causes Maladies non transmissibles
Figure 1│ Les principales causes de mortalité dans le monde
Les maladies infectieuses sont la première cause de mortalité dans le monde après les maladies chroniques et non transmissibles. Les maladies infectieuses ont une forte incidence chez les jeunes enfants, celle-ci diminuant progressivement en fonction de l’âge au profit des pathologies non transmissibles. A- Projection des principales causes de mortalité dans le monde de 2002 à 2030. B- Evolution des principales causes de mortalité en fonction de l’âge. Adaptée de Mathers et Loncar, 2007.
A
B
- 1 000 2 000 3 000 4 000 Pneumopathies aigues MST Lèpres Dengue Encephalite japonaise Trachome Parasitoses intestinales Meningites Pathologies tropicales Hépathites B et C Infections infantiles Diahrées Paludisme VIH/SIDA Tuberculose 2,8 millions 1 million 1,6 millionsFigure 2│ Mortalité des principales pathologies infectieuses dans le monde en 2002 (x1000)
Parmi les pathologies infectieuses , les pneumopathies aigues, les infections infantiles, les diahrées, le paludisme, le VIH et la tuberculose représentent 90% des décès liés à des infections. La tuberculose est l’infection la plus mortelle étant associée à un pathogène unique et tuant environ 1.6 millions de personnes chaque année. Adaptée de Mathers et Loncar, 2007.
68% 53% 43% 10% 86% 4% 29% 28% 16% 31% 28% 8%
Figure 3│ Le cycle infectieux de la tuberculose
Des personnes saines sont contaminées par des personnes infectées via l’inhalation de gouttelettes contenant des bacilles. (i) Le bacille peut être spontanément éliminé. (ii) L’ infection peut induire le développement d’une tuberculose primaire parfois disséminatoire et fréquente lors des primo-infection d’individus immuno-déficients. (iii) L’infection ne conduit pas à la mise en place de la pathologie. L’infection est contenue par les acteurs de la réponse immunitaire (a) ce qui permet de mettre en place un équilibre entre le système immunitaire et le bacille afin de contenir l’infection dans une structure appelée granulome (b). Cette phase est appelée tuberculose latente, elle est asymptomatique et non infectieuse et peut perdurer pendant toute la vie sans que la personne soit malade; on estime qu’elle touche les 1/3 de la population mondiale. Cette forme latente peut conduire à la pathologie lors d’une phase de réactivation
(iii). Cela peut se caractériser par une dégradation progressive des granulomes (c) ce qui permet la
dissémination du bacille à l’ensemble de l’organisme. C’est ce que l’on appelle la tuberculose secondaire qui se manifeste généralement par la forme pulmonaire contagieuse de tuberculose qui consiste en une dégradation progressive des poumons. La réactivation résulte généralement d’un déplacement de l’équilibre entre le pathogène et le système immunitaire (ce qui est matérialisé par les balances) en faveur du bacille. Adaptée de Kaufmann et al, 2005.
Guérison spontanée
Tuberculose Primaire (5%)
Primo-infection Contrôle de l’infection(95%)
Tuberculose latente
Réactivation
Tuberculose
secondaire Immunodéficience (VIH)Facteurs génétiques Malnutrition Tabac … Pathologie asymptomatique non contagieuse Pathologie symptomatique contagieuse Tuberculose Disséminée (i) (ii) (iii) (iiii) (a) (b) (c)
- 7 - alors tuberculose secondaire ou réactivation tuberculeuse. Les risques de tuberculose primaires et secondaires sont accrus (d’environ 10 fois) chez les individus immunodéprimés comme les patients avec un SIDA (Kaufmann and McMichael, 2005). La dégradation tissulaire qui accompagne la maladie reflète l’exacerbation de la réponse immunitaire et inflammatoire anti-tuberculeuse, et on peut considérer la tuberculose comme une immuno-pathologie. On distingue les tuberculoses pulmonaires, celles qui sont transmissibles, des tuberculoses extra-pulmonaires suite à une dissémination du bacille, et qui peuvent atteindre tous les organes.
A.
Histoire et épidémiologie
Bien que le nombre de décès causés par la tuberculose ne soit pas le plus élevé lorsqu’on le compare au nombre de décès associés au SIDA et aux diarrhées (Figure 2), on considère la tuberculose comme la première cause de mortalité due à un agent étiologique unique. L’identification de Mycobacterium tuberculosis, comme agent de la tuberculose fut établie en 1882 par Robert Koch. A l’époque de cette découverte, l’incidence de la tuberculose était d’environ 500 cas pour 100000 habitants en Europe. Cette découverte ainsi qu’une meilleure connaissance du mode de transmission de la maladie ont permis d’améliorer les normes d’hygiène. En 1921, une souche vaccinale atténuée dérivée de Mycobacterium bovis (l’agent étiologique de la tuberculose bovine) fut isolée à l’Institut Pasteur par Albert Calmette et Camille Guérin (vaccin BCG pour « bacille de Calmette et Guérin »). Le BCG ne fut cependant utilisé à grande échelle qu’à partir de la seconde guerre mondiale. La découverte de ce vaccin ainsi que l’apparition des antibiotiques à partir des années 1940 contribua à une forte diminution de l’incidence de la maladie au cours de la seconde moitié du XXème siècle dans les pays industrialisés; ainsi dans les années 1950 on n’observait plus que 50 cas pour 100000 en Europe, et l’incidence actuelle en France par exemple et d’environ 10 pour 100000 (OMS/WHO, 2009).
Ces progrès ont pu donner l’impression trompeuse que la maladie était sous contrôle. Cependant des résurgences dans les pays développés, notamment aux Etats-Unis ou en Europe suite aux migrations Est-Ouest et au développement de la pandémie de SIDA, ont rappelé les autorités de santé à la réalité : la tuberculose n’a jamais disparue, en particulier dans les pays pauvres et dans les couches défavorisées des pays développés. L’émergence de souches de bacille tuberculeux résistantes et multi-résistantes aux antibiotiques concerne aujourd’hui directement l’ensemble de la population mondiale.
0-24 25-49 50-99 100-299 ≥ 300 ND Nombre de nouveaux cas de tuberculose par 100000 habitants
A
140 135 130 125 1990 1995 2000 2005 Nombre de cas annuels par 10000 0 habitant sB
Figure 4│ Estimation de l’incidence de la tuberculose dans le monde en 2007
La tuberculose est présente sur l’ensemble du globe. Les régions les plus touchées correspondent aux régions les plus pauvres, les plus instables d’un point de vue géopolitique mais aussi les plus touchées par d’autres épidémies (Afrique sub-saharienne, l’Europe de l’est et l’Asie du sud-est). L’incidence de la pathologie a augmentée sur l’ensemble de la planète entre les années 1990 et 2004. L’OMS en mettant en place de nouvelles politiques de lutte et de prévention dans les années 2000 a permis d’ amorcer une diminution de la morbidité de la tuberculose à partir de 2004. A- Nombre de nouveaux cas de tuberculose en 2007 par 100000 habitants sur l’ensemble de la planète. B- Evolution du nombre de nouveaux cas annuels par 100000 habitants entre les années 1990 et 2007. Source OMS 2009 Global report.
- 8 -
1.
Depuis 1997 la tuberculose fait l’objet d’un suivi épidémiologique annuel par OMS afin d’évaluer l’efficacité des différents programmes de lutte mis en place. On considère qu’un tiers de la population mondiale est infecté de façon latente (asymptomatique) par M. tuberculosis ; chez ces personnes, les bacilles présentent un métabolisme minimal dit de « dormance ». Même si seulement 5 à 10% des individus infectés développent une tuberculose, le réservoir est tel que le nombre de nouveaux cas annuels est élevé, environ 10 millions (OMS/WHO, 2009).
Epidémiologie
En 2007, les régions où l’incidence de la tuberculose était la plus élevée correspondent majoritairement aux pays en développement (Figures 4-5). A l’échelle mondiale, cette incidence n’a cessé d’augmenter entre les années 1990 et 2004 où le pic d’incidence globale de la maladie semble avoir été atteint : 150/100000 (Figure 4B). Depuis 2004 et suite à la mise en place de différents programmes de lutte, la proportion de personnes atteintes par cette pathologie tend à diminuer (139/100000 en 2007). Toutefois de nombreuses disparités existent entre les différentes régions du monde (Figure4A), ce qui est la conséquence de la complexité des différents facteurs pouvant influer sur le développement des maladies infectieuses. Effectivement, l’incidence dans les pays développés tels qu’en Europe occidentale et aux Etats-Unis tend à diminuer très nettement. Cependant, dans d’autres régions du globe, telles qu’en Afrique et en Europe de l’Est, le nombre de nouveaux cas annuels ne cesse d’augmenter (Figure 5).
a) Les facteurs sociaux de la tuberculose
La tuberculose touche principalement les pays en développement et est officiellement considérée comme une maladie « de la pauvreté ». Son incidence est étroitement associée à l’impact de l’infection par le VIH (virus d’immunodéficience humaine) et/ou au PIB (produit intérieur brut) par habitant et à la stabilité socio-économique des pays concernés (Figures 5-6). Dans les pays développés, la réapparition de cette pathologie est également associée à l’augmentation de la pauvreté et de la précarité, ainsi qu’à l’augmentation de l’indice démographique, à l’existence de flux migratoires en provenance de régions endémiques et à des problèmes de santé publique tels que la toxicomanie, le tabagisme, l’alcoolisme, l’obésité et l’interférence avec des traitements utilisés contre d’autres pathologies comme les maladies chroniques inflammatoires. La stabilité géopolitique des régions touchées est un élément essentiel du succès des stratégies de contrôle telle la stratégie dite « DOTS » (voir plus bas).
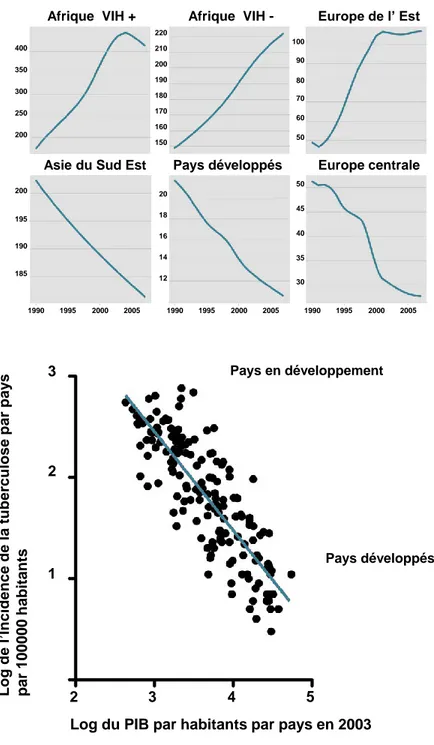
Afrique VIH +
Asie du Sud Est
400 200 250 300 350 200 185 190 195 1990 1995 2000 2005 Afrique VIH -Pays développés 220 180 190 200 210 170 150 160 20 12 14 16 18 1990 1995 2000 2005 Europe centrale Europe de l’ Est 50 35 40 45 30 100 60 70 80 90 50 1990 1995 2000 2005
A
B
Figure 5 │ La tuberculose est une maladie de la pauvreté
A- Evolution du nombre de nouveaux cas annuels de tuberculose par 100000 habitants dans différentes
régions du monde. Alors que cet indice tend à diminuer dans les régions développés; il n’a de cesse d’augmenter dans les régions pauvres, où d’autres pathologies telles que le SIDA ont aussi une forte incidence. B- Corrélation entre le PIB par habitant et le nombre de cas annuels de tuberculose. Source OMS
2009 Global report, Banque mondiale, 2003 et Mathers et Loncar, 2007. 1 2 3 3 4 5 2 Log de l’Inci denc e de la tuberc ulos e par pay s par 10000 0 habitant s
Log du PIB par habitants par pays en 2003
Pays développés Pays en développement
- 9 - (1) L’impact de la coinfection VIH-tuberculose
La tuberculose se développe très rapidement dans un contexte d’immunosuppression, ainsi les personnes atteintes par le VIH sont très sensibles à l’infection par M. tuberculosis (Figure 6). Depuis 1980 et la description des premiers cas de SIDA aux Etats-Unis, l’épidémie s’est répandue à l’ensemble de la planète et depuis les années 1990, elle est considérée comme pandémie. A la fin de l’année 2005, on comptait 40 millions de séropositifs dans le monde, soit 5 millions de plus que l'année précédente. Le VIH se réplique dans différents types cellulaires dont principalement les lymphocytes T CD4+, entraînant leur destruction et l’apparition d’un syndrome d’immunodéficience (SIDA). Les personnes atteintes du SIDA sont, de part leur immunodépression, très susceptibles à différentes pathologies opportunistes telles que des pneumonies induites par Pneumocystis carinii ou des cancers tels que le sarcome de Kaposi qui sont des pathologies à faible incidence dans les populations immunocompétentes.
Nombreux sont les séropositifs qui développent une tuberculose comme première expression du SIDA, dans la mesure où l'infection par le VIH constitue le plus fort facteur de risque de transformation d'une tuberculose latente en infection active, ou de rechute chez les patients ayant déjà subi un traitement. Par ailleurs, en cas de coinfection, chacune de ces maladies accélère le développement de l'autre, leur puissance destructrice cumulée étant supérieure à leur impact indépendant. Dans certaines régions d'Afrique — où le nombre de nouveaux cas de tuberculose a plus que quadruplé depuis 1990 — 75 % des tuberculeux sont séropositifs. Et si le taux mondial de prévalence de la coinfection est de 0,36 % seulement, dans huit pays africains, il dépasse les 5 % (Figure 6A).
(2) Malnutrition et tuberculose
L’un des facteurs aggravant de l’évolution de l’ensemble des pathologies infectieuses mais aussi chroniques dans le monde est la malnutrition. Dans une revue récente Schaible et Kaufmann évoquent l’impact majeur de la malnutrition sur l’évolution des épidémies dans le monde et leurs impacts économiques (Schaible and Kaufmann, 2007).
La dénutrition mais aussi la surnutrition ont aujourd’hui un impact dramatique sur la santé mondiale car toutes deux contribuent à un affaiblissement du système immunitaire, augmentant ainsi la susceptibilité aux infections. Lors d’une infection, l’organisme répond d’abord en activant la réponse immunitaire innée, puis lors d’une seconde phase plus tardive la réponse immunitaire adaptative se met en place. L’ensemble de ces processus requiert
0-5 5-20 20-49 ≥ 50 ND Prévalence du VIH dans les nouveaux cas de tuberculose
Prévalence du VIH chez les adultes
0.1-1 0.5-1 1-5 5-15 < 0.1 15-28 ND
A
B
Figure 6│ La tuberculose et le VIH dans le monde en 2007
La tuberculose et le VIH sont toutes deux des pathologies de la pauvreté qui sévissent dans les mêmes régions de la planète. La tuberculose est une pathologie qui se développe dans des conditions d’immunodéficience et les personnes contaminées par le VIH présentent un risque accru de développer des tuberculoses primaire ou secondaire. La tuberculose est dans le monde l’une des premières causes de mortalité des personnes séropositives. A- Prévalence du VIH en pourcentage du nombre de nouveaux cas en 2007. B- Prévalence du VIH chez les adultes en pourcentage en 2007. Source OMS 2009 Global report,
- 10 - l’activation et la multiplication de nombreux types cellulaires. Ces phénomènes nécessitent une activité métabolique cellulaire très élevée, supérieure à l’état basal. Ainsi, le stock énergétique de l’organisme est un facteur-clé permettant de contrôler une infection. Ce lien entre malnutrition et réponse immunitaire a été démontré par Moret et Schmid-Hempel (Moret and Schmid-Hempel, 2001) qui ont étudié l’effet du jeun sur des colonies d’abeilles soumises à des stimulations inflammatoires non létales et ont démontré que la dénutrition engage un pronostique vital. Ceci est associé à une incapacité à subvenir aux besoins énergétiques de l’organisme tant le coût énergétique de la réponse immunitaire est élevé. La Malnutrition Energétique et Protéique (MEP) a des effets importants sur le développement du système immunitaire et sur l’efficacité de la réponse immunitaire. De plus, un état infectieux peut contribuer à accentuer l’effet de la malnutrition. En effet, dans le cas des infections gastro-intestinales, les diarrhées empêchent l’absorption des aliments. Dans le cas du VIH et de la tuberculose, mais aussi d’infections par des parasites intestinaux, ces pathologies induisent des états de déficit tels que cachexie et anémie. Il a été démontré qu’il existe une forte corrélation entre l’impact des maladies infectieuses et la MEP chez l’homme et l’animal (Ambrus and Ambrus, 2004 ; Schaible and Kaufmann, 2007; Scrimshaw and SanGiovanni, 1997 ; Woodward, 1998 ). Ainsi, dans le cas de l’infection par le bacille tuberculeux, la MEP a été démontrée comme étant un facteur de risque dans le développement de tuberculose active (Cegielski and McMurray, 2004; Schaible and Kaufmann, 2007 ). Des études effectuées au cours de la seconde guerre mondiale ont pu montrer que l’incidence de la tuberculose dans les camps allemands chez les prisonniers de guerre alliés était moins élevée que chez les prisonniers russes. Une explication possible de cette différence est que les prisonniers anglais et américains recevaient une ration de complément alimentaire distribuée par la Croix Rouge (Schaible and Kaufmann, 2007). D’autres études plus récentes ont pu montrer une association entre l’impact de la maladie et le niveau de malnutrition au Sri Lanka et au Ghana (Liebeschuetz et al., 2004 ; Metcalfe, 2005; Singal, Pandhi, and Agrawal, 2005 ). Enfin ces observations furent aussi confirmées dans un modèle d’infection de souris et de cobayes malnutris qui sont plus susceptibles à l’infection et qui présentent de sévères altérations de leur système immunitaire ne leur permettant pas de contenir l’infection (Cegielski and McMurray, 2004; Chan et al., 1996). L’association entre tuberculose et dénutrition est très claire lorsque l’on regarde la répartition des régions où l’incidence est la plus élevée, en effet celles-ci correspondent aussi aux régions où le PIB est le plus faible et donc le niveau de MEP le plus élevé (Figures 4-5). Cette association entre la malnutrition et la tuberculose est aussi à l’origine de l’évolution de cette infection dans les pays développés. Le
- 11 - niveau de pauvreté ne cesse d’augmenter et notamment le nombre de personne vivant sous le seuil de pauvreté dans les grandes villes des pays développés est en pleine croissance, comme le nombre de tuberculeux.
Comme la malnutrition, la surnutrition peut avoir des effets néfastes sur la réponse immunitaire. Les pays développés et dans une moindre mesure les pays émergents, voient ainsi apparaître de nouvelles pathologies associées à des problèmes de comportements alimentaires qui entraînent de multiples complications et notamment une augmentation de la susceptibilité aux infections (Schaible and Kaufmann, 2007). En particulier, une des causes directes de la mauvaise alimentation est l’augmentation du risque de développer un diabète de type 2, ou diabète non insulino-dépendant, qui est une dérégulation hormonale du métabolisme et qui entraîne une immunodéficience augmentant ainsi la susceptibilité aux maladies infectieuses et notamment à la tuberculose (Jeon and Murray, 2008; Joshi et al., 1999).
b) Autres facteurs
Outre le SIDA, la malnutrition et la pauvreté, d’autres facteurs influent sur l’incidence de la maladie.
(1) L’effet néfaste des fumées
Il existe de nombreux facteurs de risques associés au développement de la pathologie, tels que la consommation de tabac, la consommation de drogues et d’alcool mais aussi l’augmentation de la pollution environnementale. « Où il y a de la fumée, il y a de la tuberculose » ; dans des publications récentes, Gordon et Rylance (Gordon and Rylance, 2009), Lin et Murray (Lin, Ezzati, and Murray, 2007) Koloppan et Subramani (Kolappan and Subramani, 2009) mettent en évidence l’existence d’un facteur de risque aggravé dû aux effets nocifs des fumés sur le poumon.
Une méta-analyse des facteurs associés à la pathologie à permis de démontrer que les fumeurs sont plus sujets au développement de la maladie et présentent un plus grand taux de positivité au test tuberculinique, que les non-fumeurs (Slama et al., 2007). Enfin la mortalité due à la tuberculose est significativement plus élevée chez les fumeurs et les anciens fumeurs que chez les non-fumeurs (Slama et al., 2007). La toxicité de la fumée de tabac associée à la tuberculose ne se limitent pas aux simples fumeurs et les fumeurs passifs et plus particulièrement les jeunes enfants sont aussi plus susceptibles de développer la pathologie (Alonso et al., 2007). Enfin, il apparaît que les fumées d’intérieurs dégagées notamment par
- 12 - les graisses végétales et animales sont à l’origine d’une augmentation de la susceptibilité à l’infection, avec une très forte incidence en Afrique et en Asie (Alonso et al., 2007). Les effets toxiques de la pollution de l’air et du tabac peuvent s’expliquer par le fait que l’atteinte des voix aériennes empêche le bon drainage des secrétions de mucus au niveau de la surface trachéo-bronchique. Ceci pourrait permettre au bacille d’échapper à la première barrière de défense mécanique des poumons, lui permettant ainsi de mieux atteindre le compartiment alvéolaire. Les fumées et les particules polluantes ont, au sein des alvéoles, un effet nocif sur les macrophages alvéolaires qui sont un des premiers types cellulaires impliqués dans la mise en place de la réponse immunitaire innée contre le bacille. Différentes études ont ainsi pu montrer que les macrophages alvéolaires de fumeurs présentent une activité phagocytaire altérée, que la nicotine influe sur le niveau intracellulaire de cytokines pro-inflammatoires telles que le TNF, et enfin que ces macrophages présentent une accumulation de fer dans le compartiment intracellulaire ce qui peut altérer la réponse immunitaire et favoriser le développement des pathogènes intracellulaires (Stampfli and Anderson, 2009).
(2) Alcool et autres drogues
Si la consommation d’alcool à faible dose ou modérément n’influence pas l’incidence de l’infection par M. tuberculosis, la synthèse de nombreuses études épidémiologiques (Lonnroth et al., 2008) montre cependant que le risque d’infection est significativement augmenté par une consommation quotidienne d’alcool supérieure à 40 g (soit 40 cl de vin ou 1 l de bière). Cet effet peut s’expliquer par l’effet toxique de l’alcool sur le système immunitaire, par exemple sur les cellules présentatrices d’antigène, qui sont la première barrière de défense contre l’infection par le bacille, en altérant leur développement, leur phénotype et leur fonction (Lau, Szabo, and Thomson, 2009). De plus, la consommation d’alcool peut aussi altérer la réponse immunitaire de façon indirecte en induisant des carences en micro- et macro-nutriments ou suite à des pathologies induites telles que des cancers de l’œsophage et du système digestif (Cegielski and McMurray, 2004; Rieder, 1999).
Concernant la consommation de drogues, il n’existe pas d’association stricte entre l’effet des molécules et l’augmentation de la prévalence de la tuberculose mais plutôt avec les modes d’administration et leurs conséquences, tels qu’une augmentation du risque de développer d’autres pathologies pouvant favoriser la réactivation de tuberculoses latentes (Deiss, Rodwell, and Garfein, 2009). Par ailleurs, la consommation d’alcool et de drogues ou de leurs substituts peut interférer avec les traitements antituberculeux de manière directe ou indirecte de part leur toxicité hépatique (Deiss, Rodwell, and Garfein, 2009). Enfin, un autre problème
- 13 - majeur influant sur l’incidence de la tuberculose dans ces populations à risque est lié à la difficulté d’éducation concernant les notions d’hygiène et d’observance du traitement.
(3) Tuberculose et traitements anti-TNF (tumor necrosis factor)
Depuis une dizaine d’année, des traitements antagonistes anti-TNF sont utilisés pour traiter diverses maladies chroniques inflammatoires telles que les polyarthrites rhumatoïdes, le psoriasis ou la maladie de Crohn. Ces traitements consistent, pour la plupart, en des anticorps monoclonaux recombinants ou des formes recombinantes du récepteur au TNF qui permettent d’induire la dégradation du TNF, celui-ci étant souvent à l’origine de ces syndromes d’inflammation chronique. Le TNF est un facteur essentiel pour le contrôle de nombreuses infections et joue un rôle majeur dans la mise en place d’une réponse immunitaire innée efficace puis dans l’induction et la régulation de la réponse adaptative. Notamment, dans le cadre de l’infection par M. tuberculosis, le TNF permet le développement du granulome, la structure immunitaire permettant de contrôler l’infection (Stenger, 2005). Les souris déficientes en TNF ou en son récepteur, le TNF-R, présentent une susceptibilité accrue à l’infection aussi bien dans des modèles de tuberculose active que dans des modèles dits de tuberculose latente (Adams et al., 1995; Bean et al., 1999; Botha and Ryffel, 2003; Flynn et al., 1995; Mohan et al., 2001). Dès lors, il n’est pas étonnant d’observer une augmentation de la prévalence de la tuberculose chez les personnes suivant un traitement anti-TNF (Wallis, 2008). Ces patients nécessitent donc un suivi comprenant un test systématique de présence ou non d’infection latente ainsi qu’un traitement préventif anti-tuberculeux en cas de doute. En effet, le traitement anti-TNF augmente non seulement le risque de développer une tuberculose fulgurante mais aussi très significativement le risque de réactivation de tuberculose latente (Wallis, 2008). Le problème majeur réside dans le fait que, dans certains cas, le traitement anti-TNF agit en synergie avec l’infection aggravant ainsi les symptômes en favorisant une dissémination rapide et ectopique.
c) Les facteurs de risques endogènes : âge, sexe et génétique
(1) L’âge
L’âge influence le risque de développement de la maladie et le type de tuberculose développée. En effet, les jeunes enfants de moins de 2 ans ont davantage de risque de développer une tuberculose suite à une primo-infection que des enfants plus âgés ou que des adultes ; les enfants (surtout ceux de moins de 1 an, mais également dans une moindre mesure ceux de 1 à 5 ans) ont aussi davantage de risque de développer des tuberculoses
extra-- 14 extra-- pulmonaires (Adams et al., 1995; Marais et al., 2006; Marais et al., 2004; Nelson and Wells, 2004). Une des hypothèses pour expliquer ces différences est liée à la maturité du système immunitaire. Des études comparatives effectuées chez la souris ont montré que les animaux âgés sont plus résistants à l’infection que des animaux jeunes, et ceci est associé à une meilleure réponse CD8 permettant d’endiguer l’infection au sein des granulomes (Orme, 1989).
(2) Le sexe
Il existe un dimorphisme sexuel globalement observé associé à la susceptibilité à développer la tuberculose. En effet on compte deux patients hommes pour une patiente dans presque tous les pays du monde. Cette différence est observée à tous les âges, sauf chez les jeunes enfants de moins de 14 ans, ce qui suggère une implication des hormones stéroïdes dans l’immunité anti-tuberculeuse. D’autres facteurs pourraient contribuer à la plus grande résistance des femmes contre l’infection, des facteurs génétiques et métabolique (Neyrolles and Quintana-Murci, 2009).
(3) La génétique
Nous avons vu qu’il existe de nombreux facteurs de risques sociologiques et environnementaux associés au développement de la tuberculose. Cependant, de nombreux individus développent cette pathologie sans aucun facteur de risque identifiable. Ceci suggère qu’il puisse exister des variations génétiques pouvant être associées à la maladie.
La tuberculose fut longtemps considérée comme une maladie héréditaire. Ainsi, au Moyen-Age, la concentration des cas au sein des familles laissait penser que cette pathologie pouvait avoir une origine congénitale. Cette concentration familiale est encore observée actuellement, et certaines études ont montré que la tuberculose est plus présente chez les jumeaux monozygotiques que chez les jumeaux dizygotes suggérant, parmi d’autres, une cause génétique au développement de la maladie suite à l’infection (Comstock, 1978; Diehl and Von Verschuer, 1933; Martin et al., 1978; Simonds, 1963). L’étude de paire de jumeaux dont au moins un individu présentait les signes pathologiques d’une tuberculose par Simonds et collaborateurs en 1963 puis par Comstock et collaborateurs en 1978 a permis de mettre en évidence que l’augmentation du risque que le second développe aussi la pathologie était associé au fait que ce soit des jumeaux monozygotiques (32%) alors que les paires di-zygotique avaient un risque moins élevé (14%) (Comstock, 1978; Simonds, 1963). Cependant les résultats de l’étude de Simonds et collaborateurs furent réanalysés récemment et bien
- 15 - qu’une étroite association ai put etre mise en evidence entre les jumeaux monozygotiques et le risque de développer la maladie, les auteurs ont conclu aussi a un effet non négligeable de l’environnement sur ces résultats et notamment sur le fait que les jumeaux monozygotiques de même sexe présentent un risque accru de développer la maladie de part leur promiscuité et leurs nombreux contacts favorables à une contamination (van der Eijk et al., 2007).
Une autre conséquence de l’influence génétique sur le devenir de la maladie se retrouve dans le caractère essentiellement endémique au continent européen de cette infection jusqu’au XIX ème siècle permettant ainsi de fixer les allèles de résistance. Depuis peu, cette maladie s’est propagée à l’Afrique (Bellamy, 2003; Budd, 1867; Cummins, 1908; Millar, 1908) et on observe que les seuls facteurs environnementaux ne peuvent expliquer l’incidence de l’infection sur le continent africain. En effet, des études aux Etats-Unis ont pu montrer que la population noire africaine présente une susceptibilité accrue à la maladie et que l’incidence de cette pathologie est soumise à une ségrégation ethnique (Bellamy, 2003; Stead et al., 1990). Actuellement d’autre facteurs d’association avec la susceptibilité à la maladie ou son devenir ont été décrits et montrent l’étroite relation qui existe entre le système immunitaire et le pathogène. Ainsi, des études de cas cliniques ont permis d’associer la susceptibilité à des infections par des mycobactéries non-pathogènes ou la susceptibilité à M. tuberculosis avec des mutations dans différents gènes de la réponse immunitaire. Cette origine mendélienne de la maladie a été mise en évidence par l’association entre des syndromes d’immunodéficience primaire et la susceptibilité à BCG ou à d’autres infections mycobactériennes (Alcais et al., 2005; Al-Muhsen and Casanova, 2008).
D’autres variant génétiques ont pu êtres associés à la pathologie grâce à des études de génétiques des populations et d’épidémiologie (individus malades versus individus sains), tels que HLA, NRAMP1, DC-SIGN, VDR, MBL, IFNγ , IL1b, IL12Rb1, IL10, CCL2, TLR8 ou encore TNF, tous ces gènes codant des médiateurs de la réponse immunitaire innée (Bellamy, 2003; Berrington and Hawn, 2007). Cependant les études de génétiques humaines sont difficiles à interpréter et conduisent parfois à des résultats contradictoires. Dans une étude épidémiologique effectuée au Vietnam (Caws et al., 2008), les auteurs ont mis en évidence l’association de variants génétiques de TLR2 avec la souche à l’origine de l’infection. Hors la majorité des études de génétique des populations n’intègre pas ce facteur qui peut expliquer que dans certaines régions et pas dans d’autres un variant génétique puisse être associé à la pathologie. De même beaucoup d’études ne tiennent pas compte de la structure interne, ou stratification, des populations, ce qui peut conduire à des résultats faussement positifs.
A
B
Figure 7│ Phylogénie du genre Mycobactérium
Le genre Mycobactérium peut être divisé en deux classes majeures, les mycobactéries à croissance rapide et à croissance lente. L’Etude de l’ARN ribosomal 16S permet de diviser les bactéries à croissance lentes en deux sous-groupes en fonction de certaines de leurs structures secondaires spécifiques, les mycobactéries à croissance lente à longue ou courte hélice 18. Le complexe Tuberculosis est une branche des mycobactéries à croissance lente à longue hélice 18 qui englobe un ensemble de bactérie pouvant induire des pathologies similaires à la tuberculose chez l’homme et l’animal. A- Phylogénie des mycobactéries à croissance rapide basée sur l’analyse comparative de la séquence de la petite sous unité de leur ARNr 16S avec celle de M. tuberculosis (un des membres des mycobactéries à croissance lente). B- Phylogénie des mycobactéries à croissance lente et à longue hélice 18 basée sur l’étude comparative des séquences des ARNr 16S avec celle d’une des bactéries à croissance rapide; M. fortuitum. Adapté de Tortoli et al, 2006.
- 16 -
2.
a) Les mycobactéries et le complexe « Tuberculosis »
Etiologie de la tuberculose
La tuberculose est une maladie pulmonaire chronique liée à l’infection par des mycobactéries et plus particulièrement par Mycobacterium tuberculosis, et certaines espèces proches appartenant au complexe « Tuberculosis ». Ces bactéries appartiennent à l’ordre des Actinomycetales et au sous-ordre des Corynebacterinaeae. Ces bactéries ont la particularité d’être acido-alcoolorésistantes, ce qui permet de les visualiser au microscope grâce à la coloration de Ziehl-Neelsen qui est à la base du test diagnostic le plus couramment utilisé pour mettre en évidence l’infection. Bien que présentant une structure d’enveloppe proche de celle des bactéries à Gram-négatif, avec en particulier une couche d’acides mycoliques externe incluant des porines, elles ont un phénotype Gram-positif. On les qualifie de bactéries à Gram-positif riches en G/C. A ce jour, plus de 120 espèces ont été identifiées (Tortoli, 2003; Tortoli, 2006). On peut les diviser en différents sous-groupes en fonctions de facteurs phénotypiques tels que leur vitesse de croissance et leur pigmentation. Ainsi, on distingue une branche dite ancestrale de bactéries à croissance rapide qui sont essentiellement des saprophytes non pathogènes (Figure 7A).
Le deuxième groupe comprend des mycobactéries majoritairement environnementales et à croissance lente (Figure 7B). Certaines sont responsables de pathologies dans le règne animal. Au cours de l’évolution, ces pathogènes opportunistes ont acquis une spécificité d’interaction avec leurs hôtes. Ainsi Mycobacterium avium induit des pathologies chez les oiseaux, les bovidés et les suidés mais aussi chez les individus immunodéprimés. Mycobacterium marinum est un pathogène de certaines espèces aquatiques pouvant avoir un impact sur l’aquaculture (Mansfield and Lackner, 1997; Primm, Lucero, and Falkinham, 2004). Ces mycobactéries peuvent induire des pathologies opportunistes chez l’homme contrairement à M. tuberculosis et Mycobacterium leprae, les agents étiologiques de la tuberculose et de la lèpre, qui sont des pathogènes strictes de l’espèce humaine.
Parmi les mycobactéries à croissance lente, un taxon est appelé « complexe M. tuberculosis » ou complexe « Tuberculosis » (Figures 7B, 8). Il est composé de 7 espèces et sous-espèces de mycobactéries : M. tuberculosis, Mycobacterium canettii (appartenant au groupe ancestral « Prototuberculosis » (Gutierrez et al., 2005) , Mycobacterium africanum, Mycobacterium pinnipedii, Mycobacterium microti, Mycobacterium caprae et Mycobacterium bovis. Ces bactéries sont des pathogènes humains et/ou de certains animaux (Tortoli, 2006). Ce complexe regroupe des espèces très proches présentant plus de 99.9% d’homologies de
Espèces de bacilles à l’origine de tuberculoses (M.prototuberculosis)
Mycobactéries lisses isolées le patients tuberculeux
Complexe Tuberculosis
0.001
M.canettii M.canettii
Figure 8│ Le complexe Tuberculosis et le complexe proto-tuberculosis.
Phylogénie basée sur l’analyse comparative des séquences de 6 gènes de ménages et de l’ARNr 16S de différentes souches de bacilles tuberculeux rugueuses (Carrés bleues) ou lisses (Carrés roses). Le complexe Tuberculosis est un des taxons qui a dérivé de manière clonale à partir d’un ancêtre commun appartenant au sous groupe des mycobactéries à croissance lente. Il regroupe un ensemble d’espèce mycobactériennes pouvant être à l’origine de tuberculose chez l’homme et chez les animaux. On distingue les « bacilles tuberculeux » rugueux qui représentent le complexe Tuberculosis des bacilles tuberculeux lisses qui sont des formes ancestrales représentées majoritairement par M. canettii et qui possèdent deux régions génomiques qui ont disparues dans certains cas au cours de l’évolution du complexe tuberculosis: RD9 et TbD1. De part le haut niveau de conservation de leur génome, ces deux sous-groupes peuvent être regroupés dans une branche commune de l’évolution des mycobactéries appelée M.prototuberculosis.
- 17 - séquences génomiques (Smith et al., 2009), ce qui est très élevé en comparaison à l’hétérogénéité qui peut exister entre certaines espèces procaryotes notamment entre diverses souches d’Escherichia coli qui peuvent présenter jusqu’à 1-2% de différences.
M. tuberculosis est l’espèce la plus étudiée du complexe « Tuberculosis ». Elle n’a jamais été isolée dans l’environnement et son seul réservoir écologique semble être l’homme avec pour seul vecteur de transmission la voie aérosole depuis des individus atteints de tuberculose active vers des personnes saines.
L’étude phylogénétique de ce complexe suggère qu’il a dérivé de manière clonale à partir d’un ancêtre commun, pathogène pour l’homme, et qui se serait différencié en colonisant d’autres niches écologiques (Smith et al., 2006; Smith et al., 2009). Il a été suggéré que cet ancêtre commun ait pu évoluer, entre autres, par acquisition de matériel génétique exogène depuis des espèces environnementales (Jang et al., 2008; Veyrier et al., 2009). L’ensemble de ces espèces bactériennes présente en effet des régions génomiques de composition nucléotidique différente de celle du reste du génome. Ces régions exogènes n’existent pas chez Mycobacterium ulcerans et M. marinum, et sont spécifiques du complexe « Tuberculosis » et de quelques espèces ancestrales de « Prototuberculosis » (Becq et al., 2007; Jang et al., 2008; Rosas-Magallanes et al., 2006). Des traces d’éléments mobiles (transposons, prophages) et des signatures nucléotidiques apparentées à divers organismes de l’environnement sont caractéristiques de ces vestiges de transferts horizontaux.
b) Mycobacterium tuberculosis
Des études récentes montrent que le génome de M. tuberculosis est très conservé entre les différentes souches épidémiques et qu’il n’y a pas d’événement majeur récent d’acquisition de matériel génétique exogène, ce qui peut s’expliquer par la spécificité de la niche occupée par ce pathogène et par sa faible efficacité de transformation. Les souches de M. tuberculosis différent essentiellement par des mutations ponctuelles synonymes et non-synonymes (Dos Vultos et al., 2008; Filliol et al., 2006; Supply et al., 2003) et des délétions de fragments génomiques (Tsolaki et al., 2004). Bien que ces différences génétiques soient faibles, elles sont facilement détectables par plusieurs techniques permettant de classer les souches épidémiques en génotypes (Figure 9) (Tsolaki et al., 2004). Certaines de ces différences génétiques confèrent des particularités phénotypiques, dans la virulence et l’évolution de la maladie (Dormans et al., 2004). Par exemple, des études ont pu montrer que l’interruption du gène plcD par insertion de l’élément mobile IS6110 (Talarico, Durmaz, and Yang, 2005) est plus fréquemment observée dans des souches responsables de tuberculoses extra-pulmonaires
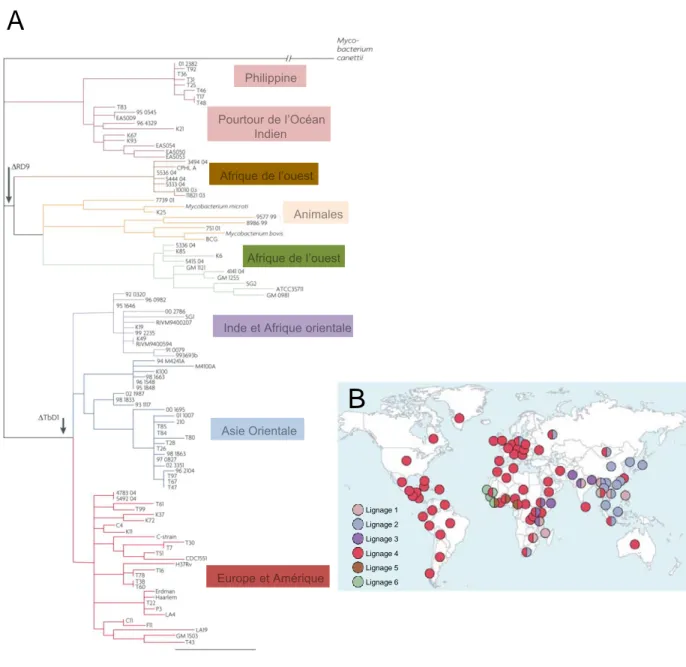
A
Lignage 1 Lignage 2 Lignage 3 Lignage 4 Lignage 5 Lignage 6B
Figure 9 │ L’organisation phylogéographique de M. tuberculosis
Plusieurs méthodes d’analyse ont permis de démontrer l’évolution clonale phylogéographique de M. tuberculosis à partir d’un ancêtre commun du complexe Tuberculosis présent sur l’ensemble de la planète. Au fur et a mesure du temps les pressions de sélection ont induit la fixation de mutations ponctuelles (SNPs) et la délétion de certaines régions génomiques qui ont permis au bactéries du complexe Tuberculosis d’évoluer en étroite relation avec leurs hôtes. Par exemple la délétion RD9 est caractéristique de l’embranchement M. africanum; Mycobactérie animales et M. tuberculosis. A- Phylogénie basée le séquençage systématique d’une région de 65 kb chez 108 souches couvrant l’ensemble du complexe (Méthode du maximum de parcimonie). B- Répartition phylogéographique des différents lignages de M. tuberculosis. Adapté de Hershberg et al. 2009, Gagneux et al. 2007 et Smith et al, 2009.
- 18 - (Kong et al., 2005). Un autre exemple est fourni par les souches du génotype dit « W-Beijing ». Ce génotype semble présenter une virulence accrue dans différents modèles expérimentaux (Manca et al., 2004; Manca et al., 2005). Les souches de la famille Beijing sont majoritaires dans les pays d’Asie et de l’ancienne Union Soviétique (Bifani et al., 2002; Gagneux and Small, 2007; Glynn et al., 2002; Nicol and Wilkinson, 2008). Il semble de plus qu’elles soient davantage susceptibles d’acquérir des phénotypes de résistance aux antibiotiques (Glynn et al., 2002). Ces souches ont la particularité de synthétiser la polykétide synthase Pks15/1 intacte, alors que les souches d’autres familles de M. tuberculosis ont une Pks15/1 inactive suite à une mutation (Constant et al., 2002). Cette enzyme permet la synthèse du glycolipide phénolique (PGL), une molécule anti-inflammatoire qui pourrait favoriser le développement de l’infection (Dormans et al., 2004; Kong et al., 2007; Reed et al., 2004). Des études plus récentes suggèrent que le PGL n’est pas à lui seul responsable de la virulence accrue des souches de la famille Beijing (Sinsimer et al., 2008).
La disparité des souches de M. tuberculosis et leur organisation phylo-géographique (Figure 9) en familles, semblent résulter de la coévolution entre l’hôte et le pathogène (Gagneux et al., 2006; Mokrousov et al., 2005). Ainsi certaines familles de M. tuberculosis semblent mieux adaptées à des populations humaines particulières (Gagneux et al., 2006). Récemment une étude épidémiologique réalisée au Vietnam, précédemment citée (Caws et al., 2008), a montré une association entre génotype de l’hôte, génotype de la souche et devenir de la pathologie. Il semble ainsi que les souches des génotypes Beijing et indo-océaniques (définis respectivement par les délétions RD105 et RD239) soient plus virulentes et induisent plus de tuberculoses extrapulmonaires que des souches euro-américaines. De plus les auteurs ont observé que certains polymorphismes de l’hôte étaient associés au génotype de la souche. Ainsi ils ont montré une association entre une infection par des souches du génotype Beijing, les formes extra-pulmonaires de la maladie et une mutation synonyme (T597C) dans la région promotrice du gène codant pour le récepteur Toll-like receptor 2 (TLR2), mutation déjà décrite comme associée avec les tuberculoses méningées (Caws et al., 2008; Thuong et al., 2007).
Il semble en conclusion difficile de considérer l’épidémie de tuberculose d’une manière globale et il sera sans doute important de tenir compte de l’influence des variations génétiques de l’hôte et du pathogène sur la maladie pour le développement de nouvelles stratégies de détection et de traitement, mieux adaptées aux populations de patients et de bacilles qui les infectent.