THESE
Présentée devant
L’UNIVERSITE DE TOULOUSE III- PAUL SABATIER,
U.F.R SVT
En vue de l’obtention du
DOCTORAT D’UNIVERSITE
Spécialité : Biologie structurale
Présentée et soutenue par
Bruno VINCENT
Le 18 février 2008
Investigation fonctionnelle et structurale des mécanismes
d’activation ou de régulation de RCPGs opiacés basée sur une
approche par fragment
Jury
Dr Isabelle Mus-veteau, Chargée de recherche, CNRS Nice Rapporteur Dr François Penin, Ingénieur de recherche (CE), CNRS Lyon Rapporteur Dr Frédéric Simonin, Chargé de recherche, CNRS Strasbourg Rapporteur Pr Peter Faller, Professeur d’université Toulouse III Examinateur Pr Alain Milon, Professeur d’université Toulouse III Examinateur Dr Pascal Demange, Chargé de recherche, CNRS Toulouse Co-directeur
Dr Lionel Mouledous, Chargé de recherche, CNRS Toulouse Co-directeur (membre invité)
I-1 LISTE DES FIGURES...I-6 LISTE DES ABREVIATIONS ...I-8 PARTIE 1 : ...I-15 PRESENTATION DES RCPGS ET DES RECEPTEURS OPIOIDES...I-15
I. LA FAMILLE DES RCPGS ...I-17
A. TOPOLOGIE DES RCPGS... I-17 B. MECANISMES MOLECULAIRES DE LA TRANSDUCTION DU SIGNAL... I-19 C. L’ACTIVATION DES PROTEINES G... I-21 D. LES MECANISMES DE REGULATION... I-23
II. LE SYSTEME OPIOÏDE ... II-29
A. L’ACTION OPIOÏDE DANS LE TRAJET DE LA DOULEUR...II-29 B. TOLERANCE ET DEPENDANCE : LES MECANISMES MOLECULAIRES...II-31 C. LES RECEPTEURS OPIOÏDES AU NIVEAU MOLECULAIRE...II-33
PARTIE 2 : ... II-35 STRATEGIE ET SUJETS D’ETUDES... II-35
III. DESCRIPTION ET INTERET DE L’APPROCHE PAR FRAGMENT ...III-37
IV. POURQUOI ETUDIER L’EXTREMITE C-TERMINALE ?...IV-41
A. LES FONCTIONS DE L’EXTREMITE C-TERMINALE AU SEIN DES RCPGS... IV-41 B. L’EXTREMITE C-TERMINALE DES RECEPTEURS OPIOÏDES... IV-42
V. POURQUOI ETUDIER LA BOUCLE EC2 ?... V-43
A. L’IMPORTANCE DU PONT DISULFURE DE LA BOUCLE EC2 DES RCPGS... V-43 B. LA CONFORMATION DE LA BOUCLE EC2, UN ELEMENT CLE... V-45
PARTIE 3 : ... V-49 LES PARTENAIRES PROTEIQUES INTRACELLULAIRES DU RECEPTEUR MOP ... V-49
VI. LES PARTENAIRES CONNUS DU RECEPTEUR MOP...VI-51
A. PARTENAIRES HISTORIQUES... VI-51 B. PARTENAIRES MODIFIANT LE TRAFIC... VI-53 C. PARTENAIRES MODIFIANT LE COUPLAGE AVEC LES PROTEINES G... VI-54 D. NOUVELLES VOIES DE SIGNALISATION... VI-57
VII. RECHERCHE DE PARTENAIRES PROTEIQUES D’UNE PROTEINE MEMBRANAIRE VII-58
A. À PARTIR DE RECEPTEUR ENTIER...VII-59 B. À PARTIR DE FRAGMENTS...VII-60
I-2 L’EXTREMITE C-TERMINALE ...VIII-65
A. VALIDATION DE LA CO-IMMUNOPRECIPITATION DE PARTENAIRES DU RECEPTEUR ENTIER... VIII-65 1. Immunoprécipitation du récepteur MOP sur cellules SHSY5Y... VIII-65 2. Co-immunoprécipitation du récepteur MOP avec la protéine Gβ... VIII-67 B. L’EXTREMITE C-TERMINALE DU RECEPTEUR MOP FUSIONNEE A L’ETIQUETTE 6 HISTIDINES... VIII-67 1. Production et purification ... VIII-67 2. Recherche de partenaire... VIII-69 C. UTILISATION DE LA THIOREDOXINE POUR AUGMENTER LA SOLUBILITE... VIII-71 D. PURIFICATION DE DEUX FRAGMENTS DE L’EXTREMITE C-TERMINALE PAR UNE CONSTRUCTION UTILISANT LA GST ETIQUETEE 6 HISTIDINES... VIII-73 E. RECHERCHE DE PARTENAIRES DE LA PARTIE DISTALE DU RECEPTEUR MOP ... VIII-75 1. Expérience de pull down ... VIII-75 2. Coupure enzymatique sur résine glutathione sépharose ... VIII-75 3. Pontage covalent ... VIII-79
IX. DISCUSSION SUR LA RECHERCHE DE PARTENAIRES PROTEIQUES...IX-80
A. LES INTERACTIONS PROTEINE-PROTEINE DANS LA SIGNALISATION... IX-80 B. DE NOUVELLES METHODES DE RECHERCHE DE PARTENAIRE A PARTIR DU RECEPTEUR ENTIER... IX-81 C. DE NOUVEAUX MOYENS D’ANALYSES... IX-83 D. CONCLUSION... IX-84
PARTIE 4 : ...IX-85 PHOSPHORYLATION DU RECEPTEUR MOP...IX-85
X. LES KINASES IMPORTANTES POUR LA REGULATION DU SIGNAL PAR LE RECEPTEUR
MOP ... X-87
A. LES EXPERIENCES « IN VIVO » ET « EX VIVO » DEMONTRANT UN LIEN ENTRE LA PHOSPHORYLATION ET LES PROCESSUS DE TOLERANCE OU DEPENDANCE... X-87 B. QUELLES CONSEQUENCES MOLECULAIRES POUR QUELLES KINASES ? ... X-89
XI. LOCALISATION DES PHOSPHORYLATIONS SUR LE RECEPTEUR MOP ...XI-91
A. ÉTUDES FONCTIONNELLES IMPLIQUANT DES SITES POTENTIELS DE PHOSPHORYLATION... XI-91 1. Au niveau de l’extrémité C-terminale ... XI-91 2. Au niveau des boucles intracellulaires ... XI-93 B. VISUALISATION DIRECTE DES PHOSPHORYLATIONS... XI-94
XII. CARACTERISATION DE LA PHOSPHORYLATION PAR LA PKA ET LE PKC DU
FRAGMENT C-TERMINAL (352-398) DU RECEPTEUR MOP (ARTICLE 1)... XII-96
XIII. CONCLUSION SUR LA PHOSPHORYLATION DU RECEPTEUR MOP ...XIII-97
PARTIE 5 : ...XIII-99 CARACTERISATION STRUCTURALE DE L’EXTREMITE C-TERMINALE DES RCPGS ...XIII-99
I-3
A. LES ETUDES STRUCTURALES D’INTERACTION AVEC LES PROTEINES PARTENAIRES... XIII-100 B. L’HELICE VIII DE LA RHODOPSINE RETROUVEE CHEZ D’AUTRES RCPGS... XIII-101 C. L’HELICE VIII EN DETAIL... XIII-102
XIV. RESULTATS : CARACTERISATION STRUCTURALE DE L’EXTREMITE C-TERMINALE
DU RECEPTEUR MOP ...XIV-107
A. UNE CONFORMATION DIFFERENTE SUIVANT LE PH ET LA TEMPERATURE... XIV-107 B. L’EXTREMITE C-TERMINALE POSSEDE DEUX PARTIES EN HELICE RELIEES PAR UNE BOUCLE... XIV-111
XV. DISCUSSION SUR LA CARACTERISATION STRUCTURALE DE L’EXTREMITE
C-TERMINALE DU RECEPTEUR MOP... XV-116
A. LES DOMAINES NON STRUCTURES DES PROTEINES... XV-116 1. La dynamique conformationnelle... XV-116 2. Le rôle des domaines non structurés ... XV-117 B. LES ELEMENTS DE REPONSES APPORTES PAR LA STRUCTURE DE L’EXTREMITE C-TERMINALE... XV-119 1. La dépendance au pH... XV-119 2. La phosphorylation par la PKA... XV-119
PARTIE 6 : ... XV-121 ACTIVATION DES RCPGS ... XV-121
XVI. ETUDE DES MECANISMES...XVI-123
A. METHODES DE BIO-INGENERIE, DE L’IDENTIFICATION DES RESIDUS IMPLIQUES A L’ENVIRONNEMENT 3D OFFERT PAR LE RECEPTEUR... XVI-123 B. METHODES BIOPHYSIQUES ET SPECTROSCOPIQUES, DES MODIFICATIONS SUBTILES DE CONFORMATIONS A L’ETABLISSEMENT DES COMPLEXES MULTIPROTEIQUES... XVI-124 C. APPORT DE LA RMN SUR L’ETUDE DE RECEPTEURS « ENTIERS »... XVI-126 D. APPORT DE LA RMN VIA L’APPROCHE PAR FRAGMENT... XVI-128
XVII. EXEMPLE DE L’INVESTIGATION MOLECULAIRE DES SPECIFICITES ENTRE LES
SYSTEMES NOCICEPTINE-NOP ET DYNORPHINE-KOP AU SEIN DE LA FAMILLE DES
RECEPTEURS OPIOÏDES ... XVII-129
A. AU NIVEAU DES RECEPTEURS...XVII-131 1. Le cœur hydrophobe ...XVII-131 2. Les boucles extracellulaires...XVII-132 B. AU NIVEAU DES LIGANDS...XVII-133
XVIII. BOUCLE EXTRACELLULAIRE DU RECEPTEUR NOP1 : CARACTERISATION PAR
SPECTROSCOPIE RMN D'UN SITE DE BASSE AFFINITE (ARTICLE 2) ...XVIII-135
XIX. CONCLUSION SUR LA CARACTERISATION DU SITE DE BASSE AFFINITE DU
RECEPTEUR NOP ...XIX-137 PARTIE 7 : ...XIX-139
I-4 CONCLUSIONS ET PERSPECTIVES ...XIX-139 MATERIELS ET METHODES ...XIX-143
XX. CONSTRUCTIONS GENETIQUES ... XX-145
1. Plasmides utilisés ... XX-145 2. Clonages réalisés... XX-145 3. Milieux de culture ... XX-146 4. Souches bactériennes ... XX-146 B. TRANSFORMATION DES BACTERIES ET SUREXPRESSION DES PROTEINES RECOMBINANTES... XX-146 1. Préparation des bactéries électrocompétentes ... XX-146 2. Préparation des bactéries chimiocompétentes... XX-146 3. Transformation des bactéries électrocompétentes ... XX-147 4. Transformation des bactéries chimiocompétentes ... XX-147 5. Culture bactérienne ... XX-147 C. PURIFICATION DU FRAGMENT HIS-MOP(ACIDES AMINES 322-398 DU RECEPTEUR MOP) ... XX-148 D. PURIFICATION DES PROTEINES DE FUSION (THIOREDOXINE-HIS-MOP, ... XX-148 HIS-GST-TEV-F47 ET HIS-GST-TEV-F31) PAR LEURS ETIQUETTES 6XHIS... XX-148 E. GEL FILTRATION... XX-149 F. PURIFICATION DU FRAGMENT F47(ACIDES AMINES 354-400 DU RECEPTEUR MOP) A PARTIR DE LA
PROTEINE DE FUSION... XX-149 G. PREPARATION D’EXTRAITS PROTEIQUES POUR LA RECHERCHE DE PARTENAIRES... XX-149 1. Culture des cellules SHSY5Y ... XX-149 2. Préparation des extraits protéiques de cellules SHSY5Y ... XX-150 3. Préparation d’extrait protéique de cerveau de souris ... XX-150 H. IMMUNOPRECIPITATION DU RECEPTEUR MOP EN FUSION A L’ETIQUETTE T7... XX-150 I. «PULL DOWN » SUR RESINE CHELATINE SEPHAROSE DE L’ECHANTILLON HIS-MOP ... XX-151 J. «PULL DOWN » SUR RESINE GLUTATHIONE SEPHAROSE AVEC LES PROTEINES DE FUSION HIS -GST-TEV-MOP(F31 OU F47) ET ELUTION PAR COUPURE ENZYMATIQUE... XX-151 K. «PULL DOWN » SUR RESINE CHELATINE SEPHAROSE AVEC UTILISATION D’AGENTS PONTANTS... XX-152 L. TECHNIQUES D’ANALYSES ELECTROPHORETIQUES... XX-152 1. Gel d’acrylamide 1D... XX-152 2. Gel d’acrylamide 2D... XX-152 3. Western blot ... XX-153 4. Coloration au nitrate d’Ag ... XX-153 5. Coloration au SYPRO ruby ... XX-154 M. ANALYSE PAR SPECTROMETRIE DE MASSE... XX-154 1. Préparation des échantillons ... XX-154
a) Lavage des spots ...XX-154 b) Réduction/Alkylation (seulement après gel 1D) ...XX-154 c) Digestion tripsyque ...XX-155
I-5 a) Analyse MALDI-TOF ...XX-155 b) Analyse nanoLC-ESI-Q-TOF...XX-155
N. ETUDES STRUCTURALES DE L’EXTREMITE C-TERMINALE DU RECEPTEUR MOP... XX-156 1. Analyse par dichroïsme circulaire ... XX-156
a) Préparation de l’échantillon...XX-156 b) Enregistrement et analyse ...XX-157
2. Analyse par RMN ... XX-157
a) Acquisition de spectres TOCSY, NOESY, COSYDQF ...XX-157 b) Traitement des données ...XX-158 c) Calcul de structure sous contrainte RMN...XX-158 ANNEXES ... XX-161 BIBLIOGRAPHIE ... XX-165
I-6
Liste des figures
Figure I-1 : Les familles de RCPGs
Figure I-2 : Passage de l’état inactif à l’état actif
Table I-3 : Les familles de protéines G et leurs effecteurs Figure I-4 : Le cycle « classique » d’activation des protéines G Figure I-5 : Rétrocontrôle et désensibilisation hétérologue
Figure I-6 : Schéma du complexe entre un RCPG, la protéine GRK et l’hétérotrimère de protéine G
Figure I-7 : Les phénomènes consécutifs à l’activation d’un RCPG
Figure II-1 : Régulation du message nocicepteur afférent au niveau de la corne dorsale Figure II-2 : Alignement de séquences entre les récepteurs MOP, DOP et KOP
Figure II-3 : Sélectivité de ligands endogènes
Figure II-4 : Action opiacée sur la transmission synaptique Figure III-1 : L’approche par fragment sur la rhodopsine
Table III-2 : Les études structurales de RCPG via l’approche par fragment
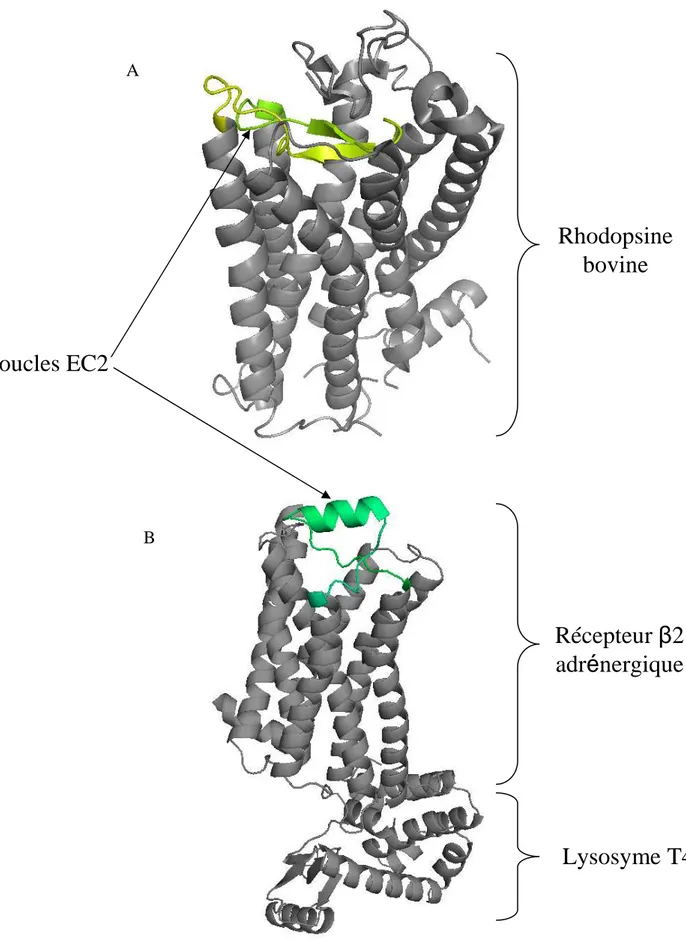
Figure IV-1 : Les variants d’épissage de l’extrémité C-terminale du récepteur MOP Figure V-1 : Le rôle de filtre joué par la boucle EC2 du récepteur muscarinique M2 Figure V-2 : Les boucles EC2 des deux structures connues de RCPGs
Figure VI-1 : Les partenaires de l’extrémité C-terminale du récepteur MOP à activité régulatrice Figure VI-2 : Séquences primaires de l’extrémité C-terminale du récepteur MOP
Figure VI-3 : Les partenaires de l’extrémité C-terminale du récepteur MOP entraînant de nouvelles voies de signalisation
Figure VIII-1 : Co-immunoprécipitation du récepteur MOP et de la sous unité Gβ Figure VIII-2 : La tubuline et l’actine partenaires de l’extrémité C-terminale Figure VIII-3 : La protéine de fusion thioredoxine est micro-agrégée
Figure VIII-4 : Expression et purification du fragment F47 Figure VIII-5 : « Pull down » et détection par gel 2D
I-7 Figure VIII-6 : Une élution plus spécifique, la coupure enzymatique sur colonne
Figure VIII-7 : L’utilisation d’agents pontants pour stabiliser les complexes protéiques Figure X-1 : Les kinases impliquées sont fonctions de l’agoniste
Figure X-2 : Exemple des processus conduisant à la désensibilisation des canaux GIRK Figure XI-1 : Les sites de phosphorylation de l’extrémité C-terminale du récepteur MOP Figure XI-2 : Les sites de phosphorylation des boucles IC2 et IC3 du récepteur MOP Figure XIII-1 : Interactions intramoléculaires de l’extrémité C-terminale de la rhodopsine Figure XIV-1 : L’extrémité C-terminale du récepteur MOP présente une conformation Figure XIV-2 : Le pH et la température sont les facteurs déterminant la conformation Figure XIV-3 : Histogramme des contraintes de distance
Figure XIV-4 : Connectivités
Figure XIV-5 : Analyse par le logiciel PROCHECK (Laskowski 1996)
Figure XIV-6 : Domaines structurés de l’extrémité C-terminale distale du récepteur MOP (352-398)
Figure XV-1 : Similarité d’environnement entre la Ser375 et la serine d’un peptide substrat cristallisé avec la PKA
Figure XVII-1 : Les acides aminés déterminants du cœur hydrophobe du récepteur NOP Figure XIX-1 : Modèle d’interaction établie entre la boucle EC2 et la nociceptine
I-8
Liste des abréviations
5-HTx Récepteur 5-hydroxytryptamine x
AP-2 Protéine Adaptatrice 2
BN-PAGE Gel d'Electrophorèse PolyAcrylamide Natif Bleu
CaMKII calmoduline kinase II
CBx Récepteur Cannabinoïde x
CCK CholeCystoKinine
CGRP Calcitonin Gene Related Peptide
CHAPS 3-[(3-cholamidopropyl)-dimethylammonio]-1-propanesulfonate
CHO Chinese Hamster Ovary
CN-PAGE gel d'electrophorèse polyacrylamide natif transparent COSYDQF Double-Quantum Filtration COrrelation SpectroscopY
CTX ToXine Cholérique
CV Volume de Colonne
DAMGO (D-Ala2, N-Me-Phe4,. Gly-01’) enkephaline
DMSO DiMethyl SulfOxyde
DO Densité Optique
DOP récepteur Delta OPioïde
DPC DodecylPhosphoCholine
DRG Ganglion de la Racine Dorsale
DTT DithioThréiTol
Dyn DYNorphine
EBP50 Ezrin-Radixin-Moesin(ERM)-binding phosphoprotein-50
ECx ExtraCellulaire x
EDC N-Ethyl-N?-(3-Dimethylaminopropyl)Carbodiimide
EDTA acide Ethylène Diamine Tétra-Acétique
EGF facteur de croissance épidermique
ESI Ionisation par ElectroSpray
I-9
GABA Acide Gamma Amino Butyrique
GASP GPCR associated sorting protein
GIRK G-protein activated Inwardly Rectifying K+ current
GRK G protein coupled Receptor Kinase
GST Glutathione S Transférase
HEK293 Human embrionic kidney 293
ICAT Isotope Coded Affinity Tag
ICx IntraCellulaire x
IPTG IsoPropyl- b-D- ThioGalactopyranoside
KOP récepteur Kappa OPioide
LB Luria broth
LC Chromatographie Liquide
LTB4 LeukoTriène B4
MALDI Matrix Assisted Laser Desorption Ionisation
MAPKs Mitogen activated protein kinase
mGluRx Récepteur Métabotropique du GLUtamate
MOP récepteur Mu OPioïde
MS Spectrométrie de Masse
MW Molecular Weight
NHS N-hydroxysuccinimide
NMDA récepteur ionotropique du glutamate
Noc NOCiceptine
NOE Effet Nucléaire Overhauser
NOESY Nuclear Overhauser Enhancement Spectroscopy
NonO Non-POU domain-containing Octamer-binding protein
NOP récepteur de la nociceptin
I-10
PDZ Post synaptic density protein (PSD95),
Drosophila disc large tumor suppressor (DlgA), and Zonula occludens-1 protein (zo-1)
PEG PolyEthylène Glycol
PKA Proteine Kinase A
PKC Proteine Kinase C
PLD2 PhosphoLipase D2
PMA 4beta-Phorbol 12-Myristate 13-Acetate
PMSF Phényl Méthyl Sulfonyl Fluoride
POPC 1-palmitoyl-2-oleyl-sn-phosphatidyl choline
POPS 1-palmitoyl-2-oleoyl phosphatidyl serine
PTX ToXine Pertussique
Q Quadripole
RCPG Récepteur Couplé aux Protéines G
RDC Couplage Dipolaire Residuel
RMN Résonance Magnétique Nucléaire
RMSD Root Mean Square Deviation
RVM Medulla Rostro Ventrale
SDS Sodium Dodécyl Sulfate
SDS-PAGE Sodium Dodécyl Sulfate-Gel d'Electrophorèse PolyAcrylamide
SFPQ splicing factor, Proline- and glutamine-rich
SHSY5Y lignée cellulaire de neuroblastome humain
SHx Homologue à Src x
SILAC Stable-Isotope Labelling by Amino acids in Cell culture
SN SurNageant
STATs Signal Transducer and Activator of Transcription
SUV Small Unilamelar Vesicle
TAP Tandem Affinity Purification
I-11
TCEP Tri-(2-CarboxyEthyl) Phosphine
TEV protéase du virus du tabac (Tobacco Etch Virus)
TFE TriFluoroEthanol
TMx TransMembranaire x
TOCSY TOtal Correlation SpectroscopY
TOF Time Of Flight
Tris TRIS (hydroxyméthyl) aminométhane
UV UltraViolet
I-12
Objectifs et plan de la thèse
Le travail de ma thèse consiste à étudier le système opioïde au niveau moléculaire. Il s’inscrit d’une manière plus générale, dans l’investigation des mécanismes mis en œuvre, aux niveaux de la reconnaissance de différents ligands et de la transduction du signal, dans la famille des récepteurs couplés aux protéines G (RCPG). L’approche par fragment nous a permis d’explorer plusieurs champs d’intérêts dans la pharmacologie des récepteurs opioïdes. Ces champs d’intérêts définissent l’organisation du manuscrit en sept parties. Plus particulièrement, quatre parties présentent les résultats de travaux effectués durant ma thèse, dont trois ont pour sujet d’étude le récepteur MOP et concernent des phénomènes intracellulaires primordiaux, et une concerne l’activation du récepteur NOP au niveau extracellulaire.
Partie 1 : Présentation des RCPGs et des récepteurs opiacés
Le contexte général de l’étude, à savoir les protéines membranaires de la famille des RCPGs, sera présenté. Les phénomènes liés plus particulièrement au système opioïde comme la tolérance et la dépendance seront développés.
Partie 2 : Stratégie et sujets d’études
La complexité et la diversité des mécanismes de transduction du signal ainsi que le caractère membranaire des RCPGs imposent l’utilisation d’une stratégie adaptée. La méthodologie utilisée, une approche par fragment, sera justifiée. Le choix des fragments étudiés, l’extrémité C-terminale du récepteur MOP, et la boucle EC2 du récepteur NOP, sera également expliqué.
Partie 3 : Partenaires protéiques intracellulaires du récepteur MOP (présentation de résultats)
Les protéines partenaires d’un RCPG sont des acteurs primordiaux dans la fonction du récepteur. Ceci sera mis en exemple par la description des partenaires intracellulaires et des fonctions de ces partenaires dans le cas du récepteur MOP. Les travaux conduisant à produire l’outil moléculaire qui sera utilisé par la suite seront décrits ainsi que les expériences de recherche de partenaire visant à découvrir de nouvelles interactions protéine-protéine impliquant l’extrémité C-terminale du récepteur MOP. Au vu des résultats une discussion proposera des méthodes envisageables pour continuer l’étude.
Partie 4 : Phosphorylation du récepteur MOP (présentation de résultats)
Les modifications post-traductionnelles et plus particulièrement les phosphorylations permettent la régulation des RCPGs. Les connaissances à l’heure actuelle sur le récepteur MOP seront
I-13 développées. Les travaux de phosphorylation in vitro de l’extrémité C-terminale du récepteur MOP qui seront présentés, constituent une validation directe de résultats de la littérature et apportent des précisions quant à la nature des kinases impliquées.
Partie 5 : Caractérisation structurale de l’extrémité C-terminale des RCPGs (présentation de
résultats)
Les travaux existants sur la caractérisation structurale de l’extrémité C-terminale d’un RCPG seront présentés. Les résultats obtenus ici permettent de définir des domaines structurés de l’extrémité C-terminale du récepteur MOP. Les sites de phosphorylations identifiés précédemment seront discutés par rapport aux nouvelles données apportées. Par ailleurs la dynamique conformationnelle et les zones non structurées de protéines seront évoquées.
Partie 6 : L’activation des RCPGs (présentation de résultats)
Des méthodes variées permettent de renseigner sur la liaison d’un ligand et l’activation d’un RCPG. Ces méthodes apportent différents niveaux de compréhension, et l’apport de la RMN dans ce contexte sera présenté. Le système opioïde permet d’illustrer les mécanismes de spécificité d’activation d’un RCPG au sein de sa famille. Les résultats obtenus sur l’interaction entre la boucle EC2 du récepteur NOP et la nociceptine, permettront de valider et compléter le schéma précédemment présenté.
I-15
PARTIE 1 :
PRESENTATION DES RCPGs ET DES
RECEPTEURS OPIOIDES
Famille 1
1a
Famille 3
Famille 2
1b
1c
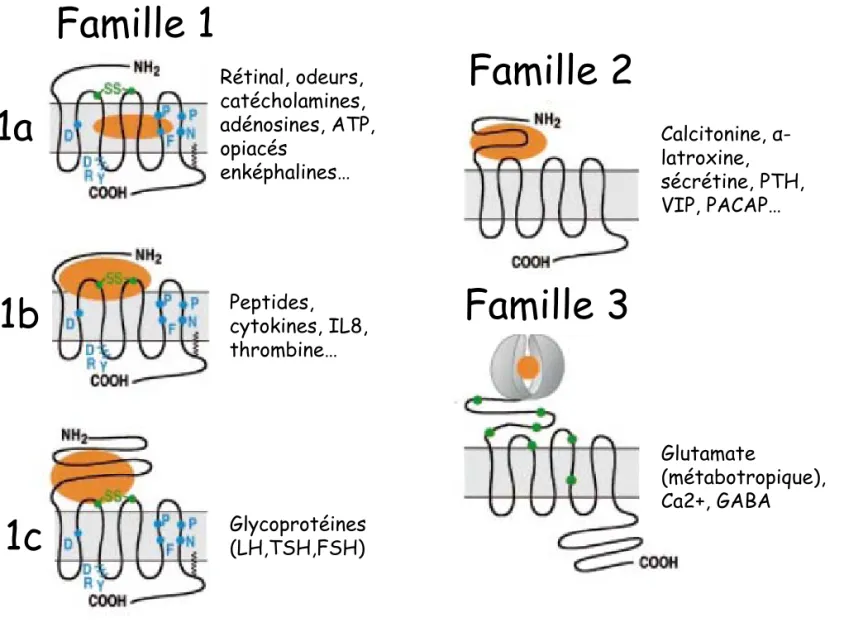
Rétinal, odeurs, catécholamines, adénosines, ATP, opiacés enképhalines… Peptides, cytokines, IL8, thrombine… Glycoprotéines (LH,TSH,FSH) Calcitonine, α-latroxine, sécrétine, PTH, VIP, PACAP… Glutamate (métabotropique), Ca2+, GABAFigure I-1 : Les familles de RCPGs (adaptée de Bockaert 1999)
Les RCPGs sont classés en 8 familles présentant au sein de chacune d’entre elles des particularités. Les 3 familles classiques sont représentées ici avec les acides aminés conservés (vert et bleus) et les zones d’interaction des ligands (orange), la palmitoylation de l’extrémité C-terminale est représentée par un trait noir. FSH (follicle stimulating hormone), GABA (acide
γ-amino-butiryque), IL8 (interleukine 8), LH (luteinizing hormone), PACAP (pituitary adenylyl cyclase activating peptide), PTH (parathyroid hormone), TSH (thyroid stimulating hormone), VIP (vasoactive intestinal peptide)
I-17 I. La famille des RCPGs
A. Topologie des RCPGs
Les récepteurs couplés aux protéines G appartiennent à une grande famille de protéines membranaires puisqu’ils sont codés par environ 1% du génome humain. Ils représentent une cible thérapeutique importante car ils sont impliqués dans de nombreux mécanismes et sont capables de se lier à des ligands très variés. On estime qu’environ 30 % des médicaments sur le marché ciblent la voie de transduction d’un RCPG (Overington et al., 2006). La topologie de ces récepteurs est commune. Ils sont formés de 7 segments transmembranaires reliés par 3 boucles intracellulaires et 3 boucles extracellulaires. L’extrémité N-terminale est extracellulaire et l’extrémité C-terminale intracellulaire. Les 7 segments transmembranaires forment une poche hydrophobe au sein du récepteur. La comparaison des séquences primaires permet d’établir une classification en plusieurs familles présentant des caractéristiques différentes (Bockaert and Pin, 1999), (Bockaert et al., 2002) Figure I-1). La famille 1 représente des récepteurs ayant entre autre un couple de cystéines conservé entre la boucle extracellulaire 2 (EC2) et le segment transmembranaire 3 (TM3) ainsi que la séquence DRY au niveau de la boucle intracellulaire 2 (IC2). Trois sous classes sont distinguées en fonction du site de liaison du ligand. Alors que de petites molécules peuvent se fixer au niveau de la poche hydrophobe de la famille 1A, les peptides vont plutôt interagir avec les parties extracellulaires ou les domaines proches des segments transmembranaires de la famille 1B. La famille 1C est caractérisée par une longue partie N-terminale qui permet de fixer par exemple des hormones de haut poids moléculaire. La famille 2 est proche morphologiquement de la famille 1C mais ne présente pas d’homologie de séquence avec celle ci. La famille 3 regroupe des récepteurs spécialisés dans la fixation de molécules à l’aide d’une extrémité N-terminale structurée en deux lobes. Ces lobes peuvent s’ouvrir et se refermer sur le ligand. Les 5 autres familles sont moins connues (la famille de récepteurs de phéromones de l’organe voméro-nasal, la famille des récepteurs « frizzled » et « smoothened », la famille des récepteurs de l’AMPc, les familles des récepteurs de gouts et des récepteurs olfactifs) mais illustrent la diversité employée au sein des RCPGs pour satisfaire aux nombreux messages extracellulaires. Ce classement n’est pas exhaustif d’autant plus que de nombreux récepteurs orphelins (dont le ligand n’est pas encore connu) existent et sont encore découverts (un lien internet utile permet d’accéder rapidement aux données récentes concernant les RCPGs : http://www.gpcr.org/7tm/).
Actif
Inactif
TM6
TM3
Glu 268
Asp 130
Arg 131
Figure I-2 : Passage de l’état inactif à l’état actif (adaptée de Ballesteros 2001)
Le récepteur β2-adrénergique est maintenu dans une conformation inactive par un jeu d’interaction ionique entre l’Asp130et l’Arg131du TM3 ainsi que le Glu268 du TM6. Les structures filaires bleues représentent l’espace
I-19 B. Mécanismes moléculaires de la transduction du signal
La transduction du signal permet de relayer une information « externe » à la cellule au milieu « interne » sans avoir à transférer de molécules à travers la membrane plasmique. On peut classer les ligands se fixant aux RCPGs en 3 grandes classes suivant leurs effets sur un récepteur donné. Les agonistes permettent une activation du récepteur, les antagonistes n’ont aucun effet malgré l’occupation du site de liaison, et les agonistes inverses réduisent l’activité basale du récepteur. Certains ligands agissent toutefois de manière originale comme par exemple dans le cas des récepteurs PAR (pour « protease activated receptor »). Le ligand effectue une protéolyse de la partie N-terminale du récepteur qui devient ainsi capable elle-même d’activer le récepteur ((Coughlin, 1999) pour une revue). D’une manière générale les différentes conséquences citées précédemment suite à la liaison d’un ligand, s’expliquent par la propension de chacun d’entre eux à modifier la conformation du récepteur. En effet l’activation s’opère par un changement conformationnel de la structure tridimensionnelle du RCPG qui est « ressentie » au niveau intracellulaire. La première preuve directe de ce phénomène a été obtenue sur le récepteur β2-adrénergique (Gether et al., 1995). Une sonde fluorescente sensible à la polarité de son environnement a été greffée sur les résidus cystéines et a permis d’observer une modification de fluorescence survenant en présence d’agoniste mais pas d’antagoniste. Les variations d’absorbtion UV des résidus tryptophanes du récepteur de la rhodopsine montrent que ce sont le TM3 et le TM6 qui sont principalement affectés lors de l’activation du récepteur (Lin and Sakmar, 1996). Le TM6 du récepteur de la rhodopsine subit une rotation dans le sens inverse des aiguilles d’une montre par rapport à une vue de l’extérieur de la cellule (Farrens et al., 1996). Ces observations concordent également avec les résultats obtenus sur le récepteur β2 adrénergique et le récepteur M3 muscarinique (Kobilka and Gether, 2002), (Ward et al., 2006). Un mécanisme similaire est pour l’instant proposé pour l'ensemble des RCPGs malgré la diversité de fonctions, de ligands, et de voies de signalisation adoptées (pour une revue (Karnik et al., 2003)). Certains RCPGs possèdent à l’état basal des interactions intramoléculaires stabilisant une conformation « inactive ». Cette conformation n’est effectivement pas totalement inerte puisqu’il subsiste généralement une activité basale qui peut être inhibée par les agonistes inverses. Ceux-ci stabilisent alors une forme vraiment inactive du récepteur là où un antagoniste n’influence pas la conformation adoptée par le récepteur. Certains antagonistes semblent toutefois prédisposés à adopter un caractère d’agoniste inverse si les récepteurs sont mutés pour devenir constitutivement actifs (Egan et al., 1998). Quoiqu’il en soit certains RCPGs ont probablement évolué de manière à préserver une stabilisation de leur conformation inactive.
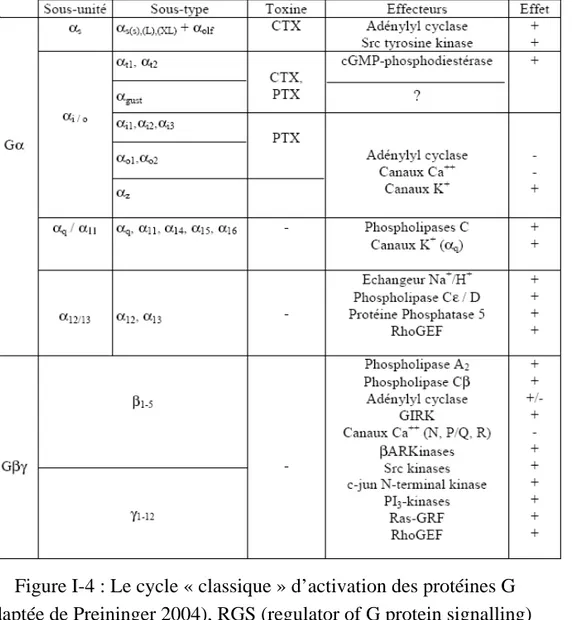
Table I-3 : Les familles de protéines G et leurs effecteurs
(adaptée de Milligan 2006 et Bockaert 1998) Les toxines pertussiques (PTX) ou cholériques (CTX) peuvent ADP ribosyler et ainsi inhiber les protéines Gα.
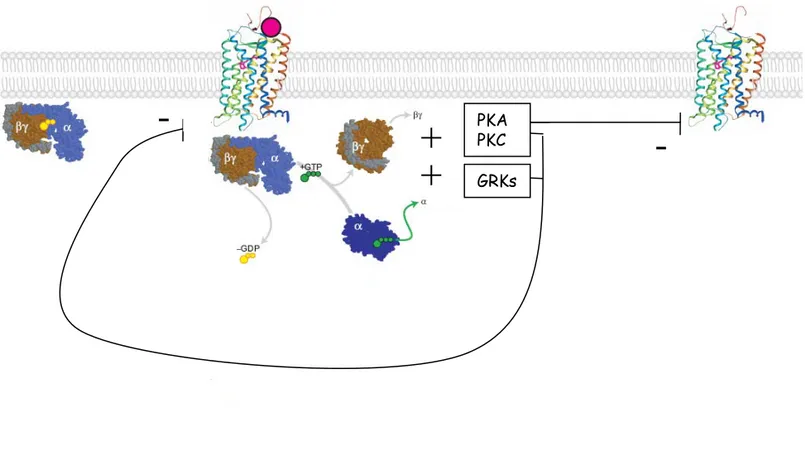
Figure I-4 : Le cycle « classique » d’activation des protéines G (adaptée de Preininger 2004), RGS (regulator of G protein signalling)
Effecteurs de Gα Effecteurs de Gβγ
L’activation du RCPG catalyse l’échange GDP-GTP au niveau de la sous unité α. Les protéines RGS favorisent l’hydrolyse du GTP et donc le retour à l’état initial.
I-21 Ceci est illustré par l’observation qu’une alanine de la boucle IC3 du récepteur α1B-adrénergique ne peut être remplacée par aucun autre acide aminé sans entraîner une activation constitutive du récepteur (Kjelsberg et al., 1992). L’un des éléments clés identifié dans la stabilisation de l’état inactif des RCPGs de la famille A est le motif D/E RY. Ce motif est situé au niveau cytoplasmique du TM3 et permet un contrôle de l’activation des récepteurs. La chaîne latérale de l’arginine du motif D/E RY interagit avec le groupement carboxylique de l’acide aminé voisin, et avec le groupement carboxylique d’un acide aminé situé au niveau cytoplasmique du TM6 (Figure I-2, (Ballesteros et al., 2001) sur le récepteur β2-adrénergique). Les structures des récepteurs de la rhodopsine et du β2-adrénergique confirment cette topologie ((Palczewski et al., 2000) et (Rasmussen et al., 2007) respectivement) bien que dans ce dernier l’interaction semble plus faible. La liaison du ligand, en induisant une rotation des TM3 et TM6 permet donc de rompre cette interaction au profit d’une nouvelle conformation. Pour induire une modification de la conformation des récepteurs certains ligands vont agir directement au cœur du récepteur. La liaison aux éléments plus externes des récepteurs joue également un rôle très important en permettant notamment à des messagers plus encombrants de transmettre un signal. Les boucles extracellulaires servent de modulateur pour favoriser une conformation par rapport à une autre (Klco et al., 2005). Le changement conformationnel induit par la formation du complexe ligand-récepteur va se traduire par des modifications d’interactions avec différents effecteurs et notamment avec les protéines G.
C. L’activation des protéines G
L’effecteur premier des RCPGs est le complexe hétérotrimérique (α, β et γ) de protéines G. Les boucles intracellulaires IC2 et IC3 des RCPGs jouent un rôle essentiel dans le couplage aux protéines G. Ces boucles sont respectivement les extensions cytoplasmiques des TM3 et 6 qui subissent des modifications conformationnelles lors de l’activation du récepteur (voir paragraphe I-B). Dans le cas du récepteur muscarinique m5, l’extension du TM3 serait hélicoïdale. Cette structuration confère à un coté de l’hélice les propriétés nécessaires au maintient de la forme inactive (grâce à la séquence DRY), et sur la face opposée les propriétés nécessaires au couplage avec les protéines G (Burstein et al., 1998). La boucle IC3 joue aussi un rôle dans le couplage et possède un caractère de sélectivité vis-à-vis des différentes protéines G comme il a été démontré par exemple pour le récepteur D2 de la dopamine ((Senogles et al., 2004), et pour une revue générale sur la sélectivité du couplage (Wess, 1998)). Cette sélectivité est un point essentiel de l’action des RCPGs sur leurs effecteurs.
+
+
-Figure I-5 : Rétrocontrôle et désensibilisation hétérologue (adaptée de Preininger 2004)
Les kinases activées par les protéines G peuvent phosphoryler le récepteur activé dans un schéma classique de rétrocontrôle ou alors phosphoryler un autre récepteur et conduire à une action hétérologue (cas des protéines kinases A et C seulement).
GRK, G protein-coupled receptor kinase; signalling; PKA et PKC, protein kinase A et C respectivement; RGS, regulator of G protein
GRKs PKA PKC
I-23 Elle n’est pas a priori évidente lorsqu’un millier de récepteurs « mécanistiquement » semblables doit induire une signalisation spécifique. Cependant tous les récepteurs ne sont pas exprimés simultanément au sein d’une même cellule et un panel d’isoformes de protéines G est disponible. Il existe 20 sous unités α, 5 β et 12 γ. Malgré le fait que toutes les combinaisons ne soient pas possibles cela engendre une variété non négligeable d’hétérotrimères. Les sous unités α sont classées en 4 familles différentes suivant leurs séquences primaires et leurs fonctions, Gαi/o, Gαs, Gαq/11 et Gα12/13 (Table I-3, (Bockaert and Pin, 1998)). Une sous unité Gα ayant fixé
une molécule de GDP peut s’associer à un hétérodimère Gβγ. En revanche une molécule de GTP fixée à la sous unité Gα empêche la liaison à Gβγ. Lorsque le RCPG est activé, il catalyse l’échange sur la sous unité Gα de la molécule de GDP pour une molécule de GTP (Figure I-4). Trois régions flexibles stabilisent cette nouvelle interaction. Le modèle classique décrit alors une séparation de l’hétérotrimère en deux parties, Gα-GTP d’un coté et l’hétérodimère Gβγ de l’autre. Cependant ce modèle est maintenant remis en question (pour une revue (Levitzki and Klein, 2002)) et certains résultats confirment effectivement un comportement pour certaines protéines G qui diffère du schéma classique initialement déduit de la transducine (protéine G du récepteur de la rhodopsine) (Frank et al., 2005). Après fixation du GTP les modifications conformationnelles des régions flexibles de la sous unité α autorisent la liaison/action sur les effecteurs. La pré-association d’une protéine G à son effecteur a été rapportée ce qui pourrait non seulement permettre une efficacité plus importante dans la réponse mais aussi une certaine spécificité (Dowal et al., 2006). Les effecteurs des protéines G sont des canaux ioniques et des enzymes (Table I-3, revue (Morris and Malbon, 1999)). Une des enzymes clés dont l’activité est modulée par les RCPGs est l’adénylate cyclase. Elle est régulée positivement par les protéines de types Gαs (« s » pour stimulant) et négativement par celles de type Gαi (« i » pour
inhibant).
D. Les mécanismes de régulation
Le premier mécanisme de régulation suite à l’activation des protéines G est une auto-hydrolyse du GTP grâce aux propriétés enzymatiques intrinsèques de la sous unité α. La structure cristallographique de Gα-GTP a permis de déterminer l’emplacement du GTP (GTPγS dans l’étude) qui est enfoui entre une hélice et le site GTPasique de la sous unité α (Noel et al., 1993). La liaison de AlF4- sur la protéine Gα-GDP a la propriété d’activer la protéine G. La structure cristalline du complexe Gα-GDP-AlF4- révèle que l’anion s’insère au niveau de l’emplacement normal du phosphate γ dans la forme liée avec le GTP (Sondek et al., 1994). Cette structure est proche d’un état où l’hydrolyse d’un groupement phosphate γ serait possible.
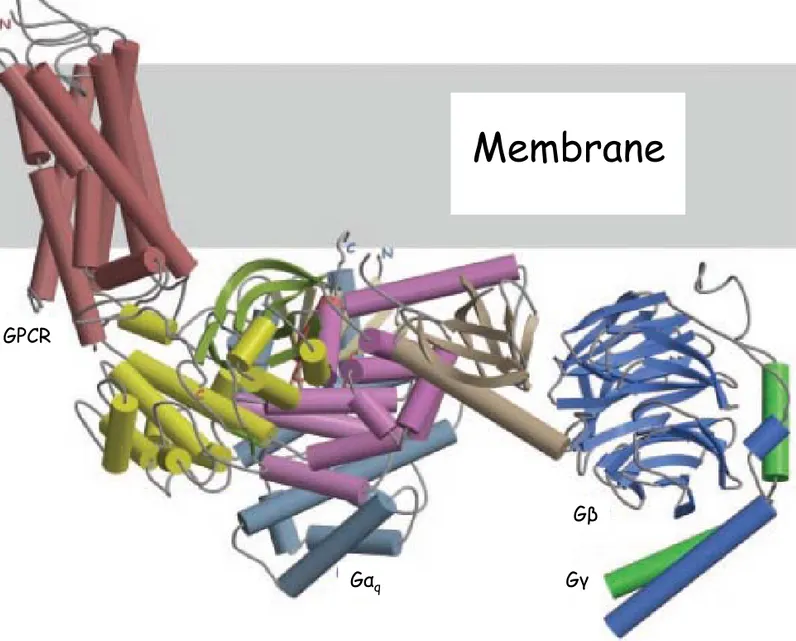
Figure I-6 : Schéma du complexe entre un RCPG, la protéine GRK et l’hétérotrimère de protéine G (adaptée de Lodowski 2003)
Le récepteur (rouge) interagit au niveau du domaine kinase de la GRK (jaune). Cette dernière interagit avec Gαq (bleu clair) par son domaine RH (« RGS homology domain » représenté en violet). La protéine GRK peut également interagir simultanément avec l’hétérodimère Gβγ (bleu foncé et vert) par le domaine PH (« pleckstrin homology domain » représenté en marron)
GPCR
Gαq
Gβ
Gγ
I-25 Ces deux complexes permettent ainsi d’émettre des hypothèses sur les mécanismes conduisant la sous unité α à auto-hydrolyser la molécule de GTP. Des protéines régulatrices sont également connues pour influer sur la vitesse d’hydrolyse du GTP. Ainsi les protéines RGS, pour « Regulator of G protein Signalling », interagissent avec le domaine entourant le GTP pour faciliter l’action GTPasique de la sous unité α (Tesmer et al., 1997). L’activation des RCPGs entraîne leur phosphorylation ((Stadel et al., 1983) pour ses travaux sur le récepteur β adrénergique). Ce mécanisme est une régulation négative et fait intervenir différentes kinases dont notamment les protéines kinases A et C. Ces kinases sont en fait elles-mêmes activées par les RCPGs (Figure I-5). L’activation du récepteur n’est cependant pas un pré-requis et ces kinases sont fortement suspectées d’être responsables des phénomènes de désensibilisation hétérologue. Dans ce cas de figure des kinases activées par un type de récepteur phosphorylent un deuxième type de récepteur non activé. Une deuxième famille de kinase phosphorylant cette fois spécifiquement les récepteurs activés a été découverte en 1986 ; ce sont les GRK (pour « G-protein coupled Receptor Kinase ») (Benovic et al., 1986). Au nombre de 7, leurs techniques de recrutement à la membrane suite à l’activation des récepteurs varient (pour une revue (Ribas et al., 2007)). Les GRK 1 et 7, sont impliquées spécifiquement dans la régulation de la rhodopsine et subissent une farnésylation. Les GRK 2 et 3 possèdent un domaine de liaison à l’hétérodimère Gβγ lui-même adressé à la membrane, les GRK 4 et 6 sont palmitoylées, et finalement les GRKs en général possèdent un domaine de liaison au phosphoinositide di-phosphate (PIP2). La cristallisation de la GRK2 complexée à un hétérodimère de Gβγ indique de manière intéressante comment les domaines importants de cette kinase s’organisent pour pouvoir fonctionner simultanément (Figure I-6, (Lodowski et al., 2003)). Le domaine homologue à la pleckstrine (PH) permet la liaison à Gβγ sur un site en partie identique à celui utilisé par cette dernière pour sa liaison à Gα ou à différents effecteurs. L’interaction serait donc compétitive. L’orientation de la protéine GRK par rapport à la membrane permettrait simultanément la liaison du récepteur au site prédit du domaine kinase et donc la phosphorylation de ce dernier, ainsi que la liaison à la protéine Gαq au niveau du domaine homologue aux régulateurs de signal des protéines G (domaine RH). Ainsi les GRKs peuvent inhiber le signal 1) simplement en se fixant aux protéines G (caractère inhibiteur du domaine RH et donc sans phosphorylation du récepteur) ou alors également via l’interaction avec le récepteur (là aussi la phosphorylation du récepteur n’est pas toujours nécessaire pour l’inactivation ex : (Dhami et al., 2004)). En dehors de leurs capacités à inhiber le signal des RCPGs, les GRKs apportent un jeu supplémentaire d’interactions avec différents partenaires pouvant être impliqués dans d’autres voies, qui commencent seulement à être appréhendées (Figure I-7A).
GRKP P α β γ α β γ GDP Arrestine MAPKs PI3K GITs P P Arrestine Src-TK Raf1 MEK ERK1/2 AP2 Clathrine Arrestine P P P P P P P P P P P P Recyclage Dégradation Arrestine Décroc hage Sig nalis ation
Figure I-7 : Les phénomènes consécutifs à l’activation d’un RCPG
A) La fixation de la GRK inhibe le signal transmis par le RCPG, phosphoryle le RCPG et apporte un nouveau panel de partenaires protéiques. B) La fixation de l’arrestine permet le recrutement d’AP2 et de clathrine pour permettre l’endocytose. C) Le récepteur internalisé peut continuer à former un complexe de signalisation avec l’arrestine (1) ou alors être déphosphorylé puis recyclé ou dégradé (2).
A B
C
1 2
I-27 En cela la calveoline ou les protéines GITs, (pour « GPCR kinase interacting protein ») sont des partenaires de GRKs et sont des protéines possédant de nombreux domaines d’interaction (revue (Ribas et al., 2007)). Par ailleurs l’action de la GRK2 sur la voie des « mitogen activated protein kinase » (MAPKs) révèle bien le spectre d’action étendu de cette famille (Jimenez-Sainz et al., 2006). L’activité de la phosphorylation des RCPGs est connue pour autoriser dans un deuxième temps la fixation des arrestines responsables du découplage entre les récepteurs et les protéines G (Lohse et al., 1990). Il faut cependant également nuancer ce schéma puisque la phosphorylation du récepteur n’est pas forcément requise dans tous les cas (exemple du récepteur au Leukotriène B4, (Jala et al., 2005)). Les arrestines sont au nombre de 4 : 2 sont localisées au niveau de la rétine, les arrestines des cellules en cônes et en bâtonnets, et 2 sont exprimées de manière ubiquitaire, les β-arrestines 1 et 2 (pour une revue (Luttrell and Lefkowitz, 2002)). La fixation de l’arrestine entraîne tout d’abord une gêne stérique pour la fixation des protéines G contribuant à la terminaison du signal. Des souris ko pour la β-arrestine 2 développent ainsi une signalisation opiacée plus soutenue dans le temps que les souris sauvages (Bohn et al., 1999). En deuxième lieu les β-arrestines possèdent des domaines de liaison à la clathrine et à l’AP2 (protéine adaptatrice 2) qui vont permettre une endocytose dépendante de la dynamine (Figure I-7B). Les processus d’ubiquitination de la β-arrestine rentrent également en compte dans le phénomène d’internalisation (Shenoy et al., 2001). Suite à l’endocytose des récepteurs plusieurs voies sont possibles (Figure I-7C). La séquestration dans les endosomes ou la dégradation dans les lysosomes entraîne une réponse courte suite à l’activation. Au contraire le recyclage à la membrane permet de resensibiliser les récepteurs et continuer l’activité (pour une revue (Ferguson, 2001)). Les récepteurs sont internalisés complexés ou non avec l’arrestine. Jusqu’à présent il a été montré que les récepteurs qui ne sont pas internalisés avec l’arrestine sont recyclés à la membrane. Ceux qui entraînent l’arrestine sont soit recyclés soit maintenus au niveau intracellulaire. Sans arrestine liée au récepteur ou après son décrochage la déphosphorylation des récepteurs pour retrouver leur état d’origine est plus facile. En plus de jouer un rôle important dans l’internalisation les β-arrestines sont des éléments supplémentaires permettant une fois encore d’augmenter le panel d’interaction protéine-protéine. Ainsi la fixation de la β-arrestine sur le récepteur β2-adrénergique permet par exemple la compléxation avec la tyrosine kinase c-Src et l’activation de la voie des MAPKs (Luttrell et al., 1999). Récemment une activité nucléaire a été rapportée (Kang et al., 2005). Après activation du récepteur DOP la β-arrestine 1 est dirigée vers le noyau où elle facilite l’activation de l’histone H4 au niveau de promoteurs spécifiques.
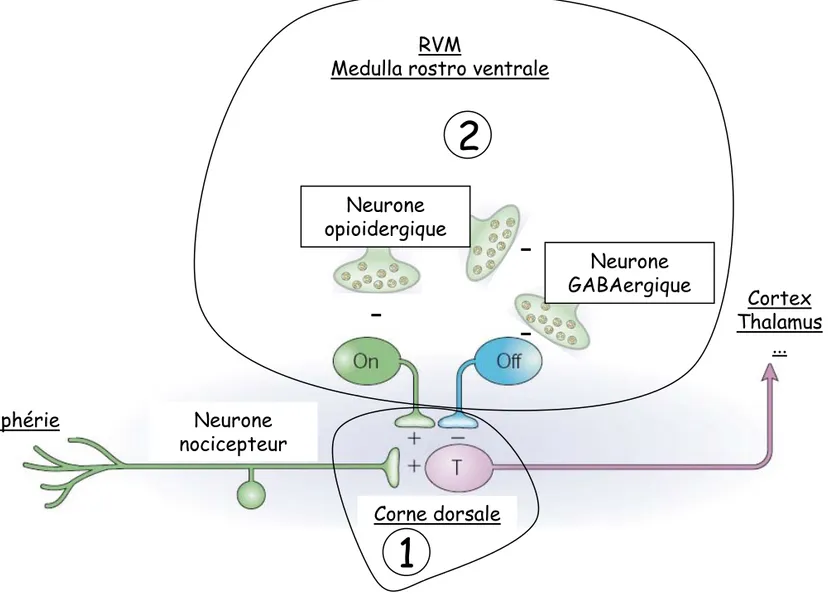
Neurone nocicepteur
Corne dorsale RVM
Medulla rostro ventrale
Périphérie Neurone GABAergique
-Neurone opioidergique-Figure II-1 : Régulation du message nocicepteur afférent au niveau de la corne dorsale (Adaptée de Fields 2004)
(1) Les opioïdes ont un effet direct au niveau du relais de la corne dorsale où les fibres afférentes transmettent le signal nocicepteur via le neurone T (neurone de transmission). (2) Dans la medulla rostro ventrale en conditions « normales », les cellules « Off » sont inhibées par les neurones GABAergiques. L’action opiacée inhibe les neurones GABAergiques (ce qui lève l’inhibition des cellules « Off ») et inhibe les cellules facilitatrices dites « On ». Ce schéma permet aux opiacés de réguler négativement la transmission du signal nocicepteur.
1
2
Cortex Thalamus
II-29
II. Le système opioïde
A. L’action opioïde dans le trajet de la douleur
Le système de perception de la douleur permet de transmettre une information sensorielle et émotionnelle associée à un dommage tissulaire (réel ou non). Ce système préservé lors de l’évolution apporte un avantage notable en permettant une réaction rapide face à différents stimuli potentiellement dangereux. La première étape est le transfert de l’information jusqu’à la moelle épinière. Les stimuli, qui peuvent être de nature chimique, mécanique, thermique, ou lumineuse entraînent une activité électrique des fibres de type Aδ (myélinisée) ou C (non myélinisée) des neurones afférents périphériques (revue (Scholz and Woolf, 2002)). Ce mécanisme est rendu possible par la présence de récepteurs ionotropiques spécifiques (ex : TRP8 pour le froid, TRPV1 pour le chaud et l’acide) qui, une fois activés, autorisent l’entrée des cations Ca2+ ou Na+ dans les terminaisons périphériques. Lorsque la dépolarisation engendrée a dépassé un seuil de tolérance, un potentiel d’action est émis par les canaux sodiques dépendant du voltage. Différents acteurs moléculaires sont trouvés dans les zones inflammées, comme des neurotransmetteurs (sérotonine), des peptides (bradikinine), des lipides (prostaglandines), ou des nucléotides (ATP). Ceux-ci peuvent faciliter l’entrée des ions Ca2+ ou Na+ par les récepteurs ionotropiques ou encore abaisser le seuil de génération du potentiel d’action. Une fois le potentiel d’action émis les neurones afférents, dont les corps cellulaires se trouvent dans les ganglions de la racine dorsale (DRG), alimentent à leur tour le processus inflammatoire en relâchant le CGRP (pour « calcitonin gene related peptide ») ou la substance P qui vont permettre la vasodilatation, l’extravasation plasmatique, et la stimulation de cellules non neuronales. La principale fonction des neurones afférents est de transmettre le signal jusqu’à la moelle épinière, où le relais va être effectué pour transmettre l’information jusqu’à diverses régions corticales. La sensation de douleur est produite. Les récepteurs opioïdes situés dans la corne dorsale de la moelle épinière permettent d’atténuer ce signal. Les opioïdes exercent aussi leur action analgésique aux niveaux des centres de régulation supraspinaux. Par exemple pour agir sur ce circuit les neurones de la medulla rostro-ventrale (RVM) projettent leurs axones au niveau de la corne dorsale de la moelle épinière où s’effectue le relais de l’information (revue (Fields, 2004)). Deux types de neurones s’y trouvent, les cellules « on » et les cellules « off ». Les premiers facilitent la transmission du relais et les deuxièmes l’inhibent. En condition normale les cellules « off » sont inactives car inhibées par les neurones GABAergiques (Figure II-1). L’action des opiacés sur un neurone est une action inhibitrice.
MOP1 DOP1 KOP1 MOP1 DOP1 KOP1 MOP1 DOP1 KOP1 MOP1 DOP1 KOP1 MOP1 DOP1 KOP1 MOP1 DOP1 KOP1 MOP1 DOP1 KOP1
Figure II-2 : Alignement de séquences entre les récepteurs MOP, DOP et KOP
Les fragments transmembranaires de la rhodopsine sont indiqués par des barres grises et ceux supposés pour les récepteurs opioïdes sont représentés par des barres bleues. Les lettres blanches sur fond rouge indiquent les acides aminés conservés, les lettres rouges sur fond blanc les acides aminés similaires pour au moins deux récepteurs. Les variations sont observées majoritairement pour les extrémités N et C terminales ainsi que pour les boucles EC2 et EC3.
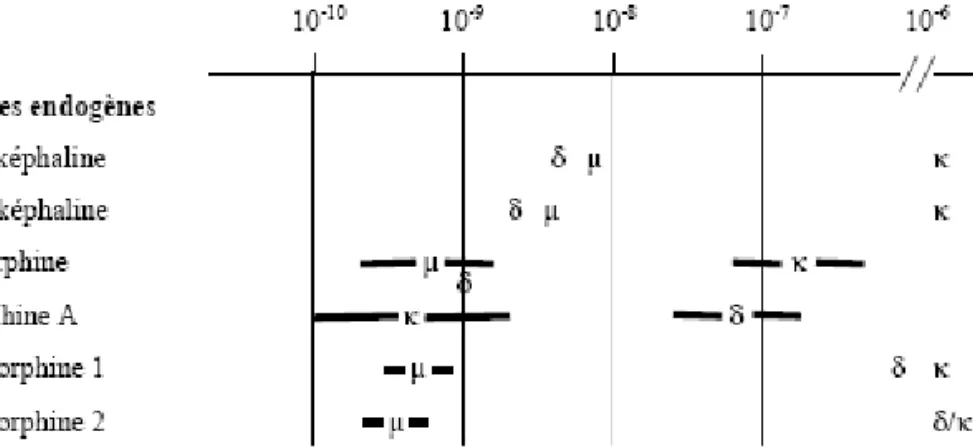
Figure II-3 : Sélectivité de ligands endogènes L’échelle d’affinité est représentée en haut de la figure et l’unité est le molaire.
II-31 Afin de diminuer l’influx nocicepteur les opiacés agissent donc en inhibant directement les cellules « on » et/ou en inhibant les neurones GABAergiques inhibiteurs des cellules «off ».
B. Tolérance et dépendance : les mécanismes moléculaires
Les problèmes rencontrés lors de l’utilisation chronique d’opiacés sont la tolérance et la dépendance. La tolérance est la diminution de l’effet de la drogue et donc la nécessité de progressivement augmenter les doses, cela au profit de certains effets secondaires. La dépendance décrit elle une nécessité psychique et physiologique imposant la consommation répétée de l’opiacé. Sur modèles animaux la dépendance et la tolérance sont créées en pré- administrant de façon répétée un agoniste du récepteur MOP. Dans un deuxième temps l’administration d’un antagoniste provoque le sevrage. La dépendance est observée en notifiant les modifications du comportement de l’animal (bonds de l’animal par exemple). Ce comportement serait dû principalement à un déséquilibre persistant engendré par la drogue et notamment à la plasticité des réseaux neuronaux. La tolérance est elle observée en ré-administrant un agoniste et en mesurant son efficacité soit à l’échelle de l’individu par des tests de sensibilité à la douleur, ou soit par mesure d’activité cellulaire. Elle provient d’une part d’une augmentation du pouvoir excitateur pro-nocicepteur, et d’autre part d’une diminution du pouvoir opioïdergique anti-nocicepteur. Les antagonistes de certains récepteurs impliqués dans la transmission pro-nociceptive (récepteur ionotropique du glutamate (NMDA), récepteur cholecystokinine (CCK) et récepteur du CGRP) permettent de réduire la tolérance. Au niveau du système opioïdergique plusieurs mécanismes moléculaires sont suspectés d’être impliqués dans le phénomène de tolérance. Il existe tout d’abord des évènements directement reliés au couplage du récepteur avec les protéines G et au trafic du récepteur tels que la désensibilisation et l’internalisation. La β arrestine 2 est impliquée dans la désensibilisation homologue du récepteur. Des souris « knock out » pour ce gène ne développent plus de tolérance à la morphine mais développent toujours une dépendance (Bohn et al., 2000). La capacité de l’agoniste à provoquer l’internalisation semble déterminante pour empêcher les phénomènes liés à la tolérance de s’installer. En provoquant l’internalisation et la dégradation du récepteur par la morphine en cellules HEK293 les phénomènes de tolérance sont diminués (Finn and Whistler, 2001). En inhibant l’internalisation dépendante de la dynamine une tolérance au DAMGO se développe chez la souris ((Ueda et al., 2001), pour une revue sur l’importance de l’internalisation (von Zastrow et al., 2003)). Ensuite plusieurs processus relèvent plus d’une adaptation cellulaire comme l’adaptation en aval du récepteur visant à compenser l’activité opioïde sur les voies de signalisation.
Ac
MO
P
PLC
Ca
2+
-
+
PKA
PKC
+
+
-MOP
K
+
+
+++++++
---
---GIRK
N et P/Q
Vésicule avec
neuro-transmetteurs
Potentiel
membranaire
Figure II-4 : Action opiacée sur la transmission synaptique
A) Actions au niveau présynaptique. Le récepteur MOP régule différentes enzymes comme la phospholipase C (PLC) ou l’adenylate cyclase (Ac) qui produisent des seconds messager ayant un large panel d’action (PKA et PKC pour protéine kinase A et C respectivement). L’inhibition des canaux calciques voltage dépendant de type N ou P/Q diminue le taux de calcium intracellulaire et empêche l’exocytose des vésicules synaptiques. B) Actions au niveau post-synaptique. Le récepteur MOP active les canaux potassique GIRK (pour « G-protein-coupled inwardly rectifying potassium ») pour induire une hyperpolarisation et inhiber la génération d’un potentiel d’action.
A
II-33 Ce dernier point traduit par exemple l’observation faite d’une super activation de l’adenylate cyclase normalement inhibée par le traitement opiacé et observable après suppression du traitement. Ce phénomène contribue à l’établissement de la « tolérance cellulaire » mais pourrait également révéler le type de modification à l’œuvre dans des organismes dépendants. Deux hypothèses sont proposées sur le rôle de l’internalisation.
- La première hypothèse suggère un rôle protecteur de l’internalisation face à une activation trop soutenue dans le temps. Ainsi la mesure de l’efficacité de l’agoniste par rapport à sa capacité à entraîner l’internalisation (RAVE) renseigne sur sa propension à générer les phénomènes de tolérance (He et al., 2002).
- La deuxième hypothèse suggère que l’internalisation du récepteur permet de resensibiliser les récepteurs découplés présents à la membrane (pour une revue (Bailey and Connor, 2005)). La part des choses pour tel ou tel mécanisme dans tel ou tel système n’est pas encore très claire.
C. Les récepteurs opioïdes au niveau moléculaire
Les récepteurs opioïdes sont au nombre de 4 (MOP, DOP, KOP et NOP) (présentés dans la revue traitant du récepteur NOP, (Meunier et al., 2000)). Ces récepteurs possèdent chacun un profil d’expression différent suivant le tissu considéré. Ils sont cependant localisés principalement au niveau du système nerveux central mais aussi au niveau de tissus périphériques comme dans le cœur, les reins, les intestins ((Mansour et al., 1995a) pour les récepteurs MOP, DOP et KOP, (Mollereau and Mouledous, 2000) pour le récepteur NOP). Leur spectre d’action est donc relativement large. Les récepteurs opioïdes présentent une forte homologie de séquence entre eux, environ 60 % (Figure II-2). Les disparités de séquence sont observées au niveau des extrémités N et C terminales ainsi qu’au niveau des boucles. Ces domaines contribuent à établir les différents profils pharmacologiques des récepteurs. Ainsi chaque ligand opioïde endogène ou exogène est plus ou moins spécifique d’un récepteur (Figure II-3). Par ailleurs les protéines en interaction avec les récepteurs au niveau intracellulaire sont différentes. Le récepteur MOP est par exemple responsable de l’action analgésique de la morphine comme le démontrent les expériences sur souris « knock out ». Les opiacés ont une action inhibitrice sur les neurones. Ils modulent l’activité des canaux ioniques responsables de l’activité électrique neuronale. Cette action se divise en deux processus localisés au niveau pré ou post synaptique (pour une revue (Ingram, 2000)). Au niveau pré-synaptique l’activation des récepteurs opioïdes réduit l’influx de cations calcium par les canaux
II-34 calciques voltage dépendants (Figure II-4). Les canaux calciques N et P/Q sont inhibés par les protéines Gαo ou Gβγ. L’augmentation du taux de calcium intracellulaire est normalement
nécessaire pour permettre l’exocytose des vésicules synaptiques dans l’espace interneuronal. Au niveau post-synaptique les canaux potassiques de type GIRK sont activés par les opiacés afin d’hyperpolariser la membrane. Cette hyperpolarisation contre la dépolarisation nécessaire à l’établissement d’un potentiel d’action. Il a été montré récemment que l’activation des canaux potassiques implique le réarrangement d’un complexe préformé entre le canal et la protéine G hétérotrimérique (Riven et al., 2006).
Les récepteurs opioïdes sont également couplés négativement à l’adenylate cyclase. En effet les récepteurs aux opiacés sont principalement couplés aux protéines Gαi et induisent donc une
inhibition de l’adenylate cyclase. Cependant plusieurs isoformes d’adenylate cyclase existent et certaines peuvent en fait être activées (Yoshimura et al., 1996). Cette enzyme a pour fonction de produire l’AMPc (« c » pour cyclique), or l’AMPc active la kinase PKA regulant elle-même de nombreux effecteurs. De même les opiacés peuvent activer la phospholipase C et par cette voie activer la kinase PKC connue pour activer les canaux calciques de type N.
II-35
PARTIE 2 :
Figure III-1 : L’approche par fragment sur la rhodopsine (code 1JP, Yeagle, 2001) Structure établie à partir de mesures isolées sur des fragments peptidiques de la rhodopsine, et de contraintes longues distances. La coloration va du bleu pour la partie N-terminale au rouge pour la partie C-terminale. Les peptides couvrant la séquence de la rhodopsine se structurent individuellement de la même manière que dans la protéine entière et sont capables de réaliser des interactions protéine-protéine. Ces fragments représentent pour la majorité des récepteurs, la seule approche techniquement réalisable pour obtenir des données structurales.
TM 1
TM 4
TM 7
TM 2
TM 6
TM 3
TM 5
III-37
III.Description et intérêt de l’approche par fragment
La seule structure connue de RCPG a été pendant des années celle de la rhodopsine, obtenue par cristallographie des rayons X avec une résolution de 2Å (Palczewski et al., 2000). L’un des avantages dans l’étude de la rhodopsine est que ce récepteur est présent de manière relativement « pur » et en quantité suffisante dans sa membrane naturelle (80% des protéines membranaires des cellules en bâtonnet de l’œil). L’expression des protéines membranaires est un problème majeur rencontré pour la cristallisation d’autres récepteurs, qui nécessite d’obtenir des quantités suffisantes de récepteurs correctement repliés. Récemment la structure du récepteur β2 adrénergique à 3,4 et 2,4 Å de résolution a également pu être obtenue ((Cherezov et al., 2007), (Rasmussen et al., 2007)). Ce récepteur a été produit dans des cellules d'insecte. Il a été exprimé sous forme de protéine de fusion avec différentes étiquettes qui permettent sa purification. Deux méthodes différentes ont été employées. Dans un cas la cristallisation a été réalisée en présence d’agoniste inverse et grâce à la présence de fragment d'anticorps FAB dirigés contre la boucle intracellulaire 3 du récepteur (Rasmussen et al., 2007). Dans la deuxième étude, la boucle IC3 du récepteur a été remplacée pour intégrer le lysosyme T4 et favoriser la stabilisation du cristal (Rosenbaum et al., 2007). Ces structures permettent d’établir des modèles très utiles pour les autres RCPGs mais peuvent poser des problèmes notamment à cause des divergences entre récepteurs au niveau des longueurs de boucles intra ou extra cellulaires. Par ailleurs, bien que très informative, la cristallographie peut être complétée par d’autres techniques. Les parties flexibles sont moins bien définies et les études dynamiques ne sont pas possibles. Pourtant ces données sont de première importance étant donné le mode de transduction employé par les RCPGs. Une alternative intéressante est l’approche par fragment. Il a été montré qu’il est possible d’obtenir des récepteurs actifs en produisant tous les « morceaux peptidiques » nécessaires de manière indépendante (exemples du récepteur du facteur α (Ste2p) de
Saccharomyces Cerevisiae, (Martin et al., 1999), et de la rhodopsine, (Ridge et al., 1995)). En
utilisant une série de peptides couvrant la séquence de la rhodopsine il est possible de reconstituer in silico une structure proche de celle établie par cristallographie des rayons X et surtout de déterminer la structure des parties initialement « mal définies » ((Yeagle et al., 2001), Figure III-1). La reconstruction de la protéine entière s’appuie sur des données supplémentaires pour pouvoir définir le repliement global de la protéine. Les domaines intracellulaires, notamment les boucles intracellulaires 1 et 2 ainsi que l’extrémité C-terminale, montrent des conformations particulières dans la structure obtenue. Les boucles sont des éléments souvent
Table III-2 : Les études structurales
de RCPG vi
a l’approche par fragme
nt D omai ne ét u d ié p ar R M N R é c e pte ur tous l e s T M s A d e nos ine A 2 a IC 2 α2A -adré n er g iq u e E C 1 , I C 3, C term A n gi oten s in II A T1A IC 3, C ter m β a d ré n o rec ep te u r av ian IC 3, C ter m β 2 -a d ré no rec ept e u r IC 2, C ter m B ra di k ini ne B 2 IC 3 ( s e ul emen t C B 1), T M 7 C te rm , C te rm C a n nab in oi de 1 e t 2 N te rm CCR3 N te rm, E C 3 C hol ec y s tok in in e ( C C K 1 ) E C 3 C hol ec y s tok in in e ( C C K 2 ) E C1 CRF ( fa m ill e B 1 d e s RCP G s ) EC 3 D O P E C 3 G o n ad o tr o pi ne ( G n R H ) E C 1 , IC 3 H o rmon e p arat hy roi d ien ne ( P T H 1) EC 2 KO P E C 2, N te rm, E C 3 N eur ok in ine -1 E C 1, IC 3 P a ra th y ro id e ho rm o n e E C 2, IC 1 P ro s tac y c li n e EC 1 S1 P4 E C 1 , E C 2 , IC 3, T M 6 , E 3 -T M 7 -C te rm S T E 2 p E C 1, E C 2, E C 3 , IC 1 T h rom b o x a n e A 2 IC 2 V a so p re s si n V 1A A rs h av a 1 9 98; N ai d er 2005 ; E s te ph an 2 0 0 5 R u an 20 0 1 ; S o 2 003 ; W u 20 03 ; G e n g 2 0 04 D e me ne 20 0 3 Mac D ona ld 2 0 01 ; U lfe rs 2 002 ; L e q u in 200 2 P e ll e g ri n i 19 9 6 ; P is e rc hi o 20 0 0 ; P la ti 2 0 0 7 Z h ang 20 02, 20 0 6 Ph a m 2 0 0 7 F adhi l 2 004 Pe tr y 2 0 0 2 P is e rc h io 2 0 0 0 , 2 0 05 Z h a n g 20 0 2 Ye 2 0 0 0 P e lleg ri ni 1 9 99 ; Gi ra g o s s ia n 2 0 0 1 Gi ra g os s ia n 20 0 2 20 0 4 G rac e 2 0 0 7 J u n g 19 9 5 , 1 9 96 K a rt ra g a dd a 20 04 P is e rc hi o 2002 U lf e rs 20 02; X ie 2 005 ; T ibur u 200 6 Ré fé re n c e s L a z a rov a 2004 C h ung 2 0 02 F ran z oni 199 7, 19 99; N ic as tro 200 3
III-39 mobiles qui pourtant contribuent de manière non négligeable à la stabilité structurale de la protéine, comme montré sur un récepteur proche des RCPGs, la bactériorhodopsine (Kahn et al., 1992). L’approche par fragment est basée sur le fait qu’une grande partie des interactions déterminant la structure du récepteur sont des contraintes locales au niveau de la séquence peptidique (Dyson et al., 1992). L’étude des fragments peptidiques de récepteurs a permis d’obtenir des informations structurales dans différents milieux et permis de constituer une librairie de domaines d’intérêts des RCPGs (Table III-2). En plus de posséder leurs structures originelles les fragments peptidiques sont biologiquement actifs puisqu’ils conservent leurs capacités à former des interactions protéine-protéine. C’est cette capacité qui est exploitée dans la recherche de nouvelles protéines partenaires et dont il sera question dans la partie III. Les fragments de récepteurs sont donc également capables d’inhiber les interactions protéine-protéine du récepteur entier. En surexprimant la boucle IC3 du récepteur DOP l’activité des récepteurs DOP, MOP et α2 adrénergique sur l’accumulation d’AMPc est altérée alors que celle du récepteur β2 adrénergique reste intacte (Morou and Georgoussi, 2005). Cette différence s’explique notamment par les différences de couplage avec les protéines G. Par ailleurs parmi les 3 récepteurs cités précédemment (MOP, DOP et α2 adrénergique) dont la voie de régulation de l’AMPc est modifiée par le peptide, seuls les récepteurs MOP et DOP ont une sensibilité pour leur activité sur les ERKs (pour « extracellular signal-regulated protein kinase »). L’approche par fragment avec la boucle IC3 du récepteur DOP permet de moduler la voie de signalisation empruntée par un type de récepteur. Comme il est montré dans cette étude, pour moduler un même effecteur, les voies de signalisation employées par deux récepteurs peuvent être différentes, et donc ciblées indépendamment l’une de l’autre. Le peptide IC3 issu du récepteur DOP, en possédant une activité biologique, constitue donc un outil pharmacologique. Bien que tous les fragments de RCPGs n’aient pas un rôle biologique aussi précis, la découverte de sites de liaison allostériques incite à ne négliger aucune piste pour moduler l’activité des RCPGs. Les éléments reliant les TMs sont une cible de choix pour moduler les modifications de conformations des récepteurs ((Espinoza-Fonseca and Trujillo-Ferrara, 2005) sur le récepteur muscarinique). Pour résumer, de part leurs propriétés structurales conservées, leurs capacités à lier les protéines partenaires ou les ligands, et de part l’intérêt pharmacologique que constituent certains des domaines mobiles de RCPGs, c’est une approche par fragment qui a été choisie pour l’ensemble des travaux réalisés durant cette thèse.
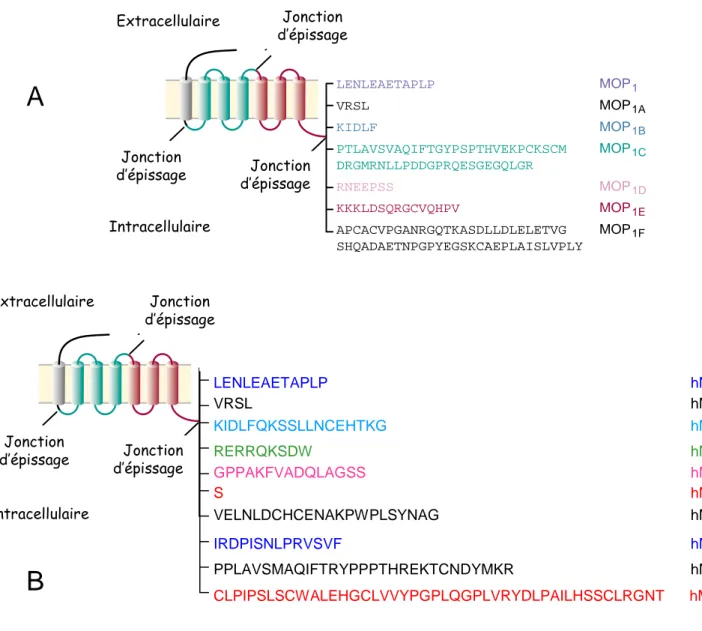
LENLEAETAPLP VRSL KIDLF PTLAVSVAQIFTGYPSPTHVEKPCKSCM DRGMRNLLPDDGPRQESGEGQLGR RNEEPSS KKKLDSQRGCVQHPV APCACVPGANRGQTKASDLLDLELETVG SHQADAETNPGPYEGSKCAEPLAISLVPLY MOP1 MOP1A MOP1B MOP1C MOP1D MOP1E MOP1F Extracellular Intracellular Splice junction Splice junction Splice junction
Figure IV-1 : Les variants d’épissage de l’extrémité C-terminale du récepteur MOP (issu de Pasternak 2001 et Pan 2005)
A) Le récepteur MOP est représenté avec des couleurs différentes pour chaque exon. Au niveau de l’extrémité C-terminale, 7 des 12 variants existants chez la souris sont représentés. B) Les 10 variants observés chez l’homme sont représentés.
Extracellulaire Intracellulaire Jonction d’épissage Jonction d’épissage Jonction d’épissage Extracellular Intracellular Splice junction Splice junction Splice junction Extracellulaire Intracellulaire Jonction d’épissage Jonction d’épissage Jonction d’épissage LENLEAETAPLP hMOR-1 VRSL hMOR-1A KIDLFQKSSLLNCEHTKG hMOR-1B1 RERRQKSDW hMOR-1B2 GPPAKFVADQLAGSS hMOR-1B3 S hMOR-1B4 VELNLDCHCENAKPWPLSYNAG hMOR-1B5 IRDPISNLPRVSVF hMOR-1Y PPLAVSMAQIFTRYPPPTHREKTCNDYMKR hMOR-1O CLPIPSLSCWALEHGCLVVYPGPLQGPLVRYDLPAILHSSCLRGNT hMOR-1X
A
B
IV-41
IV.Pourquoi étudier l’extrémité C-terminale ?
A. Les fonctions de l’extrémité C-terminale au sein des RCPGs
L’extrémité C-terminale d’un RCPG est un élément privilégié pour l’interaction avec des protéines partenaires. Même lors du trafic intracellulaire du récepteur elle se trouve en contact avec le milieu cytoplasmique. Les études récentes augmentent constamment le nombre d’interactions connues entre ces extrémités C-terminales et des partenaires protéiques (Bockaert et al., 2003). Certaines de ces protéines partenaires sont des protéines d’échafaudage possédant plusieurs motifs d’interaction protéine-protéine leur permettant d’établir un véritable réseau d’interaction. L’un des motifs d’interaction protéine-protéine connu est particulièrement bien adapté aux extrémités C-terminales protéiques. Ce motif est appelé PDZ (pour « Post synaptic density protein (PSD95), Drosophila disc large tumor suppressor (DlgA), and Zonula occludens-1 protein (zo-1) »), et son ligand, sauf cas de structure particulière, doit inclure le groupement carboxylique C-terminal (Sheng and Sala, 2001). Ce ligand est effectivement retrouvé chez plusieurs RCPGs. L’extrémité C-terminale est également un site idéal pour l’interaction entre deux RCPGs. C’est de cette manière que les récepteurs GABAB forment un
hétérodimère pleinement fonctionnel (Kuner et al., 1999). Les modifications post-traductionnelles apportées à l’extrémité C-terminale permettent d’influer sur l’activité du récepteur. Ainsi par exemple la structure cristallographique du récepteur β2-adrénergique montre un ancrage dans la membrane par le biais d’un acide palmitique greffé sur une cystéine conservée dans la famille 1 des RCPGs (Cherezov et al., 2007). La structure de la rhodopsine montre la présence de deux acides palmitiques cependant le rôle précis de cette modification reste à démontrer (Filipek et al., 2003). En revanche il est clairement établi que les phosphorylations jouent un rôle dans le trafic intracellulaire des récepteurs et à ce titre l’extrémité C-terminale est aussi prépondérante que les boucles intracellulaires. Récemment il a été montré que la phosphorylation des extrémités C-terminales des récepteurs CXCR1 et CXCR2 influe chacune sur la propre régulation de son récepteur mais, ce qui est nouveau, aussi sur celle de l’autre récepteur (Attal et al., 2008). L’hypothèse de la formation d’une plateforme de recrutement de partenaires protéiques modulant l’activité d’un autre récepteur a été émise. Cependant plusieurs points restent à éclaircir dont notamment la formation d’un hétérodimère entre CXCR1 et CXCR2, qui n’a pour l’instant ni été démontrée ni infirmée.